HAL Id: tel-01158923
https://tel.archives-ouvertes.fr/tel-01158923
Submitted on 2 Jun 2015HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Evaluation des dispositifs médicaux innovants dans les
CHU en vue de leur acquisition : état des lieux et
élaboration d’un outil d’aide à la décision
Nicolas Martelli
To cite this version:
Nicolas Martelli. Evaluation des dispositifs médicaux innovants dans les CHU en vue de leur acquisi-tion : état des lieux et élaboraacquisi-tion d’un outil d’aide à la décision. Santé. Université Paris Sud - Paris XI, 2015. Français. �NNT : 2015PA114802�. �tel-01158923�
1
UNIVERSITE PARIS-SUD
ÉCOLE DOCTORALE 425 :
INNOVATION THÉRAPEUTIQUE : DU FONDAMENTAL A L’APPLIQUÉ
Laboratoire de droit et économie pharmaceutiques
Année 2014/2015 Série doctorat n°1317
THÈSE DE DOCTORAT
DISCIPLINE : SANTE PUBLIQUE
par
Nicolas MARTELLI
Evaluation des dispositifs médicaux innovants dans les CHU en
vue de leur acquisition : état des lieux et élaboration d’un
outil d’aide à la décision
Date de soutenance : 23/01/2015
Composition du jury
Directeur de thèse : Pr Hélène VAN DEN BRINK Professeur, Université Paris-Sud Rapporteur : Pr François LOCHER PUPH, Université Claude Bernard Lyon 1
Rapporteur : Pr Marine AULOIS-GRIOT Professeur, Université Victor Segalen Bordeaux 2 Examinateur : Dr Isabelle BORGET MCU et PH, Université Paris-Sud
2
Evaluation des dispositifs médicaux innovants dans les CHU en vue de leur acquisition : état des lieux et élaboration d’un outil d’aide à la décision
Les dispositifs médicaux (DM) innovants offrent sans cesse de nouvelles options thérapeutiques et diagnostiques et contribuent à améliorer la prise en charge des malades à l’hôpital. Toutefois, ces innovations, potentiellement onéreuses, ne disposent pas toujours de données probantes garantissant leur efficience. Par conséquent, pour guider le choix des décideurs hospitaliers, une évaluation à l’échelle de l’hôpital est souvent nécessaire afin de lever le maximum d’incertitudes avant leur acquisition. Cette démarche, appelée évaluation des technologies de santé (ETS) en milieu hospitalier, s’est beaucoup développée à l’étranger, mais reste méconnue en France. A travers notre travail, nous avons montré que les CHU français proposaient des modèles d’organisation pour l’évaluation des DM innovants tout à fait comparables à ceux rencontrés dans d’autres pays. Parmi les modèles d’ETS en milieu hospitalier, la mini-ETS semble être le plus généralisable et pourrait concourir à l’harmonisation des pratiques entre CHU. Ce modèle en plein essor existe sous de multiples formes dans le monde. La confrontation des critères d’évaluation identifiés dans les modèles assimilables à la mini-ETS à ceux utilisés dans les CHU français nous a permis d’isoler 26 critères d’évaluation d’intérêt pour l’évaluation des DM innovants. Enfin, nous avons élaboré puis testé, en situation réelle, un outil d’aide multicritère à la décision dérivé des précédents critères identifiés.
Introduction of innovative medical devices at French university hospitals: an overview of hospital-based health technology assessment initiatives and development of a decision support tool
Innovative medical devices offer solutions to medical problems. However, medical devices arriving on the European market have generally little evidence about efficiency.To manage the uncertainty surrounding the introduction of innovative medical devices, hospitals and university hospitals have developed worldwide hospital-based health technology assessment (HTA) processes to guide the selection of expensive and innovative products. Nevertheless, little is known about hospital-based HTA activities in France. We demonstrated that French models of hospital-based HTA are comparable to those found elsewhere and presented sometimes a combination of several HTA models. We also underlined that a mini-HTA like model could easily be applied to French university hospitals. Mini-HTA has become widespread in many different forms across the world. We compared criteria of different mini-HTA forms to criteria used in French university hospitals and identified 26 relevant criteria to assess innovative medical devices. Finally, we developed and tested in real conditions a multiple-criteria decision tool derived from these 26 criteria.
Mots clés : dispositif médical ; innovation ; évaluation des technologies de santé ; outil d’aide
à la décision
3 « Ce qui est simple est toujours faux. Ce qui ne l'est pas est inutilisable. »
Paul Valéry (1871-1945)
4
Remerciements
A Monsieur le Professeur Gilles Aulagner
Je suis particulièrement honoré de l’expérience que vous apportez à ce jury de thèse. Je garde en mémoire notre entrevue de mai 2013, où nous avons échangé sur le sujet du DM innovant, comme un moment privilégié de ma carrière. Soyez assuré de mes sincères remerciements.
A Madame le Professeur Marine Aulois-Griot
Je vous remercie sincèrement d’avoir accepté de juger ce travail et d’en être rapporteur. Vos suggestions constructives lors du comité de thèse m’ont été d’une aide remarquable pour aborder la rédaction de ce travail. Soyez assurée de mon respect et de ma sincère gratitude.
A Madame le Docteur Isabelle Borget
Je te remercie profondément pour ton soutien au cours de ces années où ton écoute a toujours été pour moi un véritable réconfort. Tes précieux conseils ont beaucoup apporté à ce travail. Trouve ici les prémices de notre collaboration à venir que j’espère fructueuse.
A Monsieur le Professeur François Locher
Je suis très sensible à l’honneur que vous me faites en acceptant de juger ce travail et d’en être rapporteur. Veuillez recevoir mes sincères remerciements et l’assurance de mon profond respect.
A Madame le Professeur Hélène van den Brink
Je t’exprime toute ma gratitude pour la confiance que tu as su m’accorder tout au long de ces années. Je te remercie infiniment d’avoir dirigé ce travail que ta disponibilité, ta bienveillance et ta rigueur m’ont permis de mener dans les meilleures conditions qui soient. Je suis très heureux de l’opportunité qui m’est offerte de continuer à travailler à tes côtés. Trouve ici le témoignage de ma plus profonde reconnaissance.
A Monsieur le Professeur Eric Fouassier
Je vous exprime toute ma gratitude pour m’avoir accueilli dans votre laboratoire et vous remercie de votre bienveillance à mon égard. Le projet GRADES auquel vous avez bien voulu m’associer est une aventure tout à fait enthousiasmante et je suis très honoré de pouvoir y apporter ma contribution.
A Monsieur le Professeur Patrice Prognon
Je ne vous remercierai jamais assez pour votre indéfectible soutien dans ce projet et plus généralement pour tout ce que vous avez pu faire pour ma carrière professionnelle. C’est un immense honneur de travailler dans votre service. J’espère que ce travail sera à la hauteur des espérances que vous avez placées en moi.
A Madame le Docteur Judith Pineau
J’ai tellement de chance de travailler à tes côtés et j’en suis si fier. Tu m’as ouvert à ce monde fascinant du DM dans lequel tu es sûrement l’un des meilleurs guides qui soient. Merci ma chère Judith de me faire partager ta passion que j’espère avoir honorée par ce travail. Je te dédie cette thèse.
5
A Madame le Docteur Brigitte Bonan
Je n’oublierai jamais ce que tu as fait pour moi et profite de ces lignes pour te témoigner ma profonde gratitude. Je ne serai pas là sans toi.
A tous les pharmaciens hospitaliers ayant participé à l’enquête présentée dans ce travail
Je vous remercie d’avoir très aimablement accepté de participer à ce travail. J’ai reçu de votre part un accueil confraternel d’une qualité admirable qui m’a beaucoup touché.
To Dr Paul Hansen, University of Otago, New Zealand
I thank you very much for your help and for letting me use your great software. I hope to meet you one day, maybe in New Zealand.
A Anne-Sophie, Aurélie, Capucine et Mathilde
Merci infiniment pour vos contributions directes et indirectes à ce travail. Je garde de merveilleux souvenirs de vos stages respectifs et serai toujours là pour vous.
A tous mes collègues de l’HEGP
Merci pour votre soutien au fil des ans, les cafés et les éclats de rire.
A Paola
Qui sait.
A mes parents et ma grand-mère
« On ne peut pas exister sans être aimé » comme dirait Romain Gary.
A ma famille et ma belle-famille
Pour tout leur amour et leur soutien.
A Zoltan et Isabelle
De vrais citoyens du monde qui changent tout…c’est gourmand !
A Nicolas et Géraldine
Si peu par rapport à vos réalisations…merci de votre amitié indéfectible.
A mes amis parisiens et montpellierains (ou pas loin)
Qui trouveront ici une raison au peu de temps que j’ai pu leur consacrer depuis ces dernières années…pardon !
6
Table des matières
REMERCIEMENTS ... 4
TABLE DES MATIERES ... 6
LISTE DES ABREVIATIONS ... 9
LISTE DES ILLUSTRATIONS ... 13
LISTE DES TABLEAUX ... 15
INTRODUCTION ... 18
PARTIE 1 : LE DISPOSITIF MEDICAL INNOVANT ET L’EVALUATION DES TECHNOLOGIES DE SANTE EN MILIEU HOSPITALIER ... 20
Chapitre 1 : Définition du dispositif médical innovant et problématique de son évaluation en vue de son financement ... 20
1. Contexte réglementaire du dispositif médical en France : définition, mise sur le marché et remboursement pour les établissements de santé ... 20
2. Définition du dispositif médical innovant ... 35
3. Evaluation des dispositifs médicaux innovants en vue de leur financement : un défi pour la Haute Autorité de Santé... 44
4. Evaluation des dispositifs médicaux innovants dans les CHU : enjeux et objectifs de notre travail ... 64
Chapitre 2 : Evaluation des technologies de santé en milieu hospitalier appliquée aux dispositifs médicaux à l’étranger et en France ... 69
1. Introduction ... 69
2. Organisation de l’évaluation des technologies de santé en milieu hospitalier appliquée aux dispositifs médicaux à l’étranger ... 74
3. Organisation de l’évaluation des technologies de santé en milieu hospitalier en France .. 97
4. Conclusions ... 104
Chapitre 3 : Enquête sur l’organisation de l’évaluation des dispositifs médicaux innovants dans les CHU français ... 107
1. Introduction ... 107
2. Objectifs ... 107
7
4. Résultats ... 134
5. Discussion ... 173
6. Conclusions ... 193
CONCLUSION DE LA PARTIE 1 ... 195
PARTIE 2 : ELABORATION D’UN OUTIL D’AIDE A LA DECISION POUR LES DISPOSITIFS MEDICAUX INNOVANTS ... 198
Chapitre 4 : Revue systématique de la littérature sur les critères d’évaluation dans les outils d’aide à la décision assimilables à la mini-ETS ... 198
1. Introduction ... 198 2. Objectifs ... 199 3. Matériel et méthode ... 200 4. Résultats ... 206 5. Discussion ... 219 6. Conclusions ... 229
Chapitre 5 : Comparaison et proposition de synthèse des critères d’évaluation issus de la revue de la littérature sur la mini-ETS et de l’enquête parmi les 18 CHU français ... 231
1. Introduction ... 231 2. Objectifs ... 232 3. Matériel et Méthode ... 232 4. Résultats ... 235 5. Discussion ... 249 6. Conclusions ... 256
Chapitre 6 : Test préliminaire d’un outil d’aide multicritère à la décision dans un CHU français ... 258 1. Introduction ... 258 2. Objectifs ... 276 3. Matériel et méthode ... 277 4. Résultats ... 285 5. Discussion ... 293 6. Conclusions ... 299 CONCLUSIONS DE LA PARTIE 2 ... 301 CONCLUSION GENERALE ... 303
8
REFERENCES BIBLIOGRAPHIQUES ... 305
OUVRAGES CONSULTES ... 337
LISTE DES PUBLICATIONS ET DES COMMUNICATIONS EN RAPPORT AVEC LE SUJET DE THESE ... 339
ANNEXES ... 340
Annexe 1 : Publications retenues dans la revue systématique de la littérature sur l'ETS en milieu hospitalier ... 341
Annexe 2 : Version originale du guide d’entretien ... 348
Annexe 3 : Version du guide d’entretien retenue pour l’enquête... 353
Annexe 4 : Grille de codage pour l’analyse des entretiens ... 358
Annexe 5 : Analyses des correspondances multiples de l’enquête ... 359
Annexe 6 : Arbre décisionnel pour le classement selon les dimensions de la mini-ETS originale des critères regroupés ... 372
Annexe 7 : Caractéristiques des 23 outils d’aide à la décision identifiés ... 373
Annexe 8 : Codage des critères et leur définition - 173 critères ... 381
Annexe 9 : Taxonomie chronologique des 16 modèles assimilables à la mini-ETS identifiés ... 389
Annexe 10 : Dimensions et critères de la mini-ETS et de la mini-ETS augmentée ... 391
Annexe 11 : Capture d’écran présentant un exemple de choix pour la pondération avec le logiciel 1000minds® ... 394
9
Liste des abréviations
A4R : Accountability for Reasonableness
ACC : Analyse coût-conséquence
ACM : Analyse des correspondances multiples
AdHopHTA : Adopting hospital-based Health Technology Assessment
AETSA : Andalusian Agency for Health Technology Assessment
AFSSaPS : Agence Française de Sécurité Sanitaire des Produits de Santé
AHP : Analytic Hierarchy Process
AHRQ : Agency for Healthcare Research and Quality
AIB : Analyse d’impact budgétaire
ANSM : Agence Nationale de Sécurité du Médicament et des produits de santé
AP-HP : Assistance Publique – Hôpitaux de Paris
AP-HM : Assistance Publique – Hôpitaux de Marseille
ARS : Agence Régionale de Santé
ASA : Amélioration du service attendu
ASR : Amélioration du service rendu
ATIH : Agence Technique de l’Information sur l’Hospitalisation
CBU : Contrat de bon usage
CCAM : Classification commune des actes médicaux
CED : Coverage with evidence development
CEDIT : Comité d’Evaluation et de Diffusion des Innovations Technologiques
CEDM : Centre d’Evaluation du Dispositif Médical
CEE : Communauté Economique Européenne
CEESP : Commission d’Evaluation Economique et de Santé Publique
CEPS : Comité Economique des Produits de Santé
CHEERS : Consolidated Health Economic Evaluation Reporting Standards
CHRU : Centre hospitalier régional universitaire
CHU : Centre hospitalo-universitaire
CME : Comission médicale d’établissement
CNEDiMTS : Commission Nationale d’Evaluation des Dispositifs Médicaux et des Technologies
CNRC : Comité National de Recherche Clinique
10
CONSORT : Consolidated Standards of Reporting Trials
CRO : Contract Research Organization
CSP : Code de la santé publique
CSS : Code de la sécurité sociale
DACEHTA : Danish Centre for Evaluation and Health Technology Assessment
DAF : Dotation annuelle de financement
DGOS : Direction Générale de l'Offre de Soins
DHOS : Direction de l'Hospitalisation et de l'Organisation des Soins
DIM : Département d’information médicale
DM Dispositif médical
DMDIV : Dispositif médical de diagnostic in vitro
DMI : Dispositif médical implantable
DMIA : Dispositif médical implantable actif
DOM-TOM : Départements et Territoires d'Outre-Mer
DRC : Délégations à la Recherche Clinique
DRCI : Délégations à la Recherche Clinique et de l’Innovation
DRG : Diagnosis-related group
DRIRE : Direction Régionale de l'Industrie, de la Recherche et de l'Environnement
EBM : Evidence-based medicine
ECHTA : European Collaboration for Health Technology Assessment
ECAHI European Collaboration for Assessment of Health Interventions
ENCC : Etude nationale des coûts à méthodologie commune
ETS : Evaluation des technologies de santé
ETSAD : Evaluation des Technologies de Santé pour l'Aide à la Décision
EUnetHTA : European network for Health Technology Assessment
EVIDEM : Evidence and Value: Impact on Decision-Making
FDA : Food&Drug Administration
FHF : Fédération Hospitalière de France
FINOHTA : Finnish Office for Health Technology Assessment
GANT : Guide for the Acquisition of New Technologies
GHM : Groupe homogène de malade
GHS : Groupe homogène de séjour
11
HCL : Hospices Civils de Lyon
HEGP : Hôpital Européen Georges Pompidou
HTA : Health technology assessment
HTAi : Health Technology Assessment international
IDEAL : Idea, Development, Exploration, Assessment, Long-term study
IGAS : Inspection Générale des Affaires Sociales
IQWiG : Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen
INAHTA : International Network of Agencies for Health Technology Assessment
IRDES : Institut de Recherche et Documentation en Economie de la Santé
IRM : Imagerie par résonance magnétique
ISPOR : International Society For Pharmacoeconomics and Outcomes Research
JORF : Journal officiel de la République Française
JOUE : Journal officiel de l’Union Européenne
LFSS : Loi de financement de la sécurité sociale
LNE/GMED : Laboratoire National de Métrologie et d’Essais
LPPR : Liste des produits et prestations remboursables
MCDA : Multiple-criteria decision analysis
MCO : Médecine Chirurgie Obstétrique
MERRI : Missions d’Enseignement, de Recherche, de Référence et d’Innovation
MeSH : Medical Subject Headings
MIG : Missions d’intérêt général
MIGAC : Missions d’Intérêt Général et de l’Aide à la Contractualisation
NANDO : New Approach Notified and Designated Organisations Information System
NICE : National Institute for Health and Clinical Excellence
NOKC : Norwegian Knowledge Centre for the Health Services
NSCCAHS : Northern Sydney Central Coast Area Health Service
NWS : New South Wales
OCDE : Organisation de Coopération et de Développement Economiques
OHTAC : Ontario Health Technology Advisory Committee
OMEDIT : Oberservatoire des Médicaments, des Dispositifs Médicaux et des Innovations
PAPRIKA : Potentially All Pairwise RanKings of all possible Alternatives
PHRC : Programmes Hospitaliers de Recherche Clinique
12
PIVT : Pôle Innovation et Veille Technologique
PLM : Paris-Lyon-Marseille
PME : Petites et moyennes entreprises
PMSI : Programme de médicalisation des systèmes d'information
PRME : Programme de Recherche Médico-Economique
PUI : Pharmacie à usage intérieur
P-STIC : Programmes de Soutiens aux Techniques Innovantes et Coûteuses
QALY : Quality Adjusted Life Year
RCT : Randomized controlled study
SA : Service attendu
SAMU : Service d'aide médicale urgente
SMART : Simple Multi-Attribute Rating Technique
SMUR : Service mobile d'urgence et de réanimation
SROS : Schémas Régionaux d’Organisation des Soins
T2A : Tarification à l’activité
UNOCAM : Union Nationale des Organismes d'Assurance Maladie Complémentaire
USA : United States of America
VHA : Veterans Health Administration
13
Liste des illustrations
Figure 1 : Modes de prise en charge des dispositifs médicaux selon l'avis rendu par la HAS 33
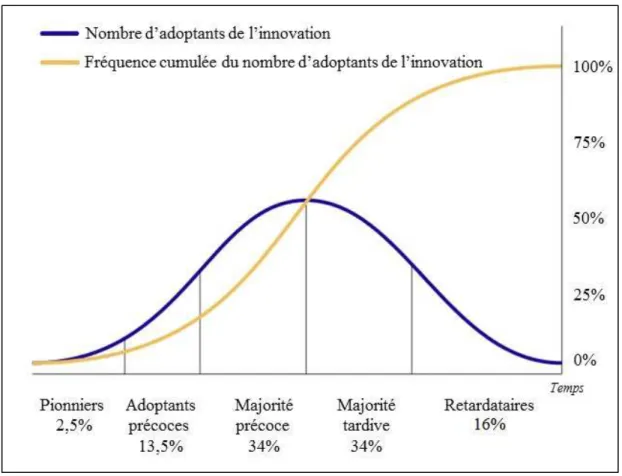
Figure 2 : Diffusion des innovations selon Rogers ... 37
Figure 3 : Cube de classification des innovations selon l'EUCOMED ... 40
Figure 4 : Stratégie de sélection des publications pour la revue de la littérature sur l’organisation de l’ETS en milieu hospitalier (janvier 1990-avril 2014) ... 80
Les données réactualisées en avril 2014 apparaissent en grisée. ... 80
Figure 5 : Répartition géographique des publications retenues sur l'ETS en milieu hospitalier (n = 45) ... 81
Figure 6 : Nombre de publications par année (n = 45) ... 82
Figure 7 : Répartition des modèles décrits dans les publications retenues (n = 56) ... 83
Figure 8 : Schéma de la stratification de l'échantillon de l'enquête ... 119
Figure 9 : Répartition des processus principaux par type de processus (n = 18) ... 139
Figure 10 : Répartition des processus secondaires par type de processus (n = 18) ... 139
Figure 11 : ACM représentant les modèles internationaux d'ETS et les processus identifiés dans l'enquête avec leurs modalités ... 159
Figure 12 : Types d'informations médicales utilisées dans les évaluations de DM innovants (n = 99) ... 160
Figure 13 : Types d'informations médico-économiques utilisées dans l’évaluation de dossier de DM innovants (n = 125) ... 163
Figure 14 : Sources des informations médico-économiques utilisées dans l’évaluation de dossier de DM innovants (n = 48) ... 164
Figure 15 : Stratégie de sélection des publications pour la revue de la littérature sur les outils d’aide à la décision assimilables à la mini-ETS ... 207
Figure 17 : Répartition générale des critères selon les 4 dimensions de la mini-ETS originale (n = 452) ... 215
Figure 18 : Processus intégrant une modélisation MCDA ... 261
Figure 19 : Etapes-clés du processus décisionnel en santé ... 266
Figure 20 : Schéma du processus d'aide à la décision EVIDEM ... 267
Figure 21 : Représentation graphique d'une analyse multicritère de la Matrix4Value® ... 275
14 Figure 23 : Répartition des avis en fonction des résultats obtenus avec l'outil d'aide
multicritère à la décision développé ... 283 Figure 24 : Médiane des pondérations des critères décisionnels par les 25 membres
permanents du CODIMS de l'AP-HP ... 289 Figure 25 : Médianes des pondérations des médecins et des pharmaciens constituant les membres permanents du CODIMS de l'AP-HP ... 289 Figure 26 : Représentation graphique des scores globaux obtenus pour les 10 dossiers de DM innovants sélectionnés ... 291
15
Liste des tableaux
Tableau 1 : Degrés de nouveauté selon l'ANSM ... 36
Tableau 2 : Les 9 domaines du HTA Core Model® ... 47
Tableau 3 : Spécificités des dispositifs médicaux et conséquences méthodoloiques à la réalisation d'essais cliniques ... 55
Tableau 4 : Thèmes et questions pour l’adoption d’une nouvelle technologie de santé en milieu hospitalier ... 70
Tableau 5 : Modèles d’ETS en milieu hospitalier ... 72
Tableau 6 : Algorithme de recherche utilisé pour la revue systématique de la littérature sur l’ETS en milieu hospitalier ... 75
Tableau 7 : Avantages et inconvénients des 4 modèles d'ETS en milieu hospitalier ... 90
Tableau 8 : Comparaison des approches en recherche qualitative et quantitative ... 108
Tableau 9 : Recommandations pour la réalisation d’entretiens semi-directifs téléphoniques 113 Tableau 10 : Villes de France métropolitaines possédant un CHU. ... 115
Tableau 11 : Répartition des entretiens selon la proportion du nombre de séjour MCO en 2011 par rapport à l’ensemble des CHU ... 118
Tableau 12 : Ecueils et biais potentiels des entretiens semi-directifs et mesures prises dans notre enquête pour les prévenir ... 125
Tableau 13 : Degré d’accord entre codeur selon le coefficient Kappa ... 129
Tableau 14 : Numéros d'identification attribués aux CHU enquêtés par catégorie ... 130
Tableau 15 : Répartition par catégorie de CHU du nombre de lits MCO ... 134
Tableau 16 : Nombres de citations par spécialités médicales et chirurgicales représentatives du CHU et pourvoyeuses de DM innovants ... 135
Tableau 17 : Proportion de DM innovants sur l'ensemble des DM référencés annuellement par catégorie de CHU ... 136
Tableau 18 : Fréquence des demandes de DM innovants par catégorie de CHU ... 137
Tableau 19 : Fréquence de réunion de la COMEDIMS par catégorie de CHU ... 140
Tableau 20 : Répartition par catégorie professionnelle des demandeurs de DM innovants selon le processus d'évaluation et d'acquisition des DM innovants ... 142
Tableau 21 : Répartition par catégorie professionnelle des évaluateurs de DM innovants selon le processus d'évaluation et d'acquisition des DM innovants ... 143
16 Tableau 22 : Répartition par catégorie professionnelle des décideurs de DM innovants selon le processus d'évaluation et d'acquisition des DM innovants ... 144 Tableau 23 : Etapes et caractéristiques des processus organisationnels pour l’évaluation et l’acquisition de DM innovants ... 149 Tableau 24 : Facteurs limitants des processus organisationnels d’évaluation et d’acquisition des DM innovants ... 152 Tableau 25 : Déroulement d’une évaluation d’une demande pour un DM innovant selon les processus organisationnels ... 156 Tableau 26 : Comparaison des modèles internationaux d'ETS en milieu hospitalier et des processus identifiés dans l'enquête ... 158 Tableau 27 : Fréquence d'utilisation des informations médico-économiques pour l'évaluation des dossiers de DM innovants ... 161 Tableau 28 : Freins à l’utilisation des données médico-économiques dans l'évaluation des dossiers de DM innovants (n = 35) ... 162 Tableau 29 : Connaissance des organismes et des modèles d'ETS par les enquêtés (n = 18) 165 Tableau 30 : Facteurs pouvant influencer la décision d'acquisition d'un DM innovant ... 167 Tableau 31 : Influence de l’évaluation menée sur le DM innovant ... 168 Tableau 32 : Suggestions d'amélioration du processus d'évaluation et d'acquisition des DM innovants dans les CHU ... 171 Tableau 33 : Suggestions pour une coordination des activités d'évaluation des DM innovants entre CHU ... 172 Tableau 34 : Algorithmes de recherche utilisés pour la revue systématique de la littérature sur la mini-ETS ... 201 Tableau 35 : Correspondance des 63 dimensions recensées dans les 23 outils d'aide à la décision avec les 4 dimensions de la mini-ETS originale ... 211 Tableau 36 : Coefficient de similarité entre des outils d'aide à la décision identifiés (n = 16) ... 214 Tableau 37 : Répartition des critères d’évaluation par dimension pour chaque modèle identifié (n = 16) ... 216 Tableau 38 : 50 critères d’évaluation les plus fréquemment rencontrés parmi les modèles identifiés (n = 16) ... 217 Tableau 39 : Nombre de critères totaux par dimension dans les groupes de modèles identifiés (n = 16) ... 218
17 Tableau 40 : Critères supplémentaires identifiés à travers l'enquête auprès des 18 CHU
français (s'ajoutant au 173 de la revue sur la mini-ETS) ... 236 Tableau 41 : Comparaison du nombre et du coefficient de similarité des critères cités par les enquêtés à ceux identifiés dans les formulaires/questionnaires recueillis (n = 12) ... 239 Tableau 42 : 30 premières occurrences des critères issus de l'enquête sur les 18 CHU français ... 240 Tableau 43 : Calculs des coefficients de similarité entre les critères issus de l'enquête et ceux des mini-ETS et mini-ETS augmentée ... 243 Tableau 44 : Critères communs entre les critères issus de l'enquête parmi les 18 CHU et les modèles de la mini-ETS ... 244 Tableau 45 : Nombre d’occurrences pour les 13 critères communs issus de la triangulation des données de l'enquête ... 245 Tableau 46 : Processus de suppression et d'intégration des critères issus de la triangulation des données de l'enquête aux critères de la mini-ETS augmentée ... 246 Tableau 47 : Comparaison des critères d’évaluation issus de l’enquête pour les CHU disposant d’un formulaire/questionnaire aux 26 critères obtenus ... 248 Tableau 48 : 15 critères de la Value Matrix du système EVIDEM ... 268 Tableau 49 : Critères retenus dans la Matrix4Value® ... 273 Tableau 50 : Sélection des critères d’évaluation pour constituer l’outil d’aide multicritère à la décision ... 286 Tableau 51 : Critères décisionnels retenus pour l’outil d’aide multicritère à la décision ... 288 Tableau 52 : Scores globaux obtenus pour les 10 dossiers de DM innovants sélectionnés ... 290 Tableau 53 : Avis rendus par le CODIMS de l'AP-HP et obtenus avec l'algorithme ... 292
18
Introduction
Les dispositifs médicaux (DM) désignent un ensemble hétérogène de produits de santé dont les contours exacts sont difficiles à cerner. Du défibrillateur implantable à l’aiguille hypodermique, 160 000 à 800 000 références seraient actuellement commercialisées sur le marché européen (1). Ce marché, estimé à près de 62 milliards d’euros en 2009, se caractérise par son dynamisme que souligne un rythme de croissance annuel de 5% (2). Omniprésents auprès des malades et indissociables des progrès majeurs de la médecine, l’innovation en matière de DM offre de nombreuses solutions thérapeutiques et diagnostiques (3). Toutefois, ce progrès a un coût, parfois élevé et sans cesse en augmentation. En France, où le marché du DM représente près de 19 milliards d’euros, les dépenses de l’assurance maladie pour ces produits de santé n’ont fait que croître depuis ces dernières années à l’hôpital. Ainsi, elles ont atteint en 2009 près de 1,5 milliard d’euros pour les DM implantables remboursés en sus de la tarification à l’activité (T2A) et 1,65 milliard pour les autres DM (4). Notre système de santé doit faire face à un défi complexe : les besoins thérapeutiques se multiplient avec en écho un élan d’innovation, mais dans un contexte de contrainte économique importante aggravée par la crise économique mondiale. Comment concilier la maîtrise des dépenses de santé à l’hôpital sans freiner l’innovation et son corollaire essentiel qu’est l’amélioration de la prise en charge des malades ?
Dans notre travail, nous nous intéresserons tout d’abord à la manière dont les DM innovants sont évalués en vue de leur introduction à l’hôpital, ce qui constituera notre première partie, puis développerons dans une seconde partie l’élaboration d’un outil d’aide à la décision issu de nos recherches. Ces deux parties sont chacunes divisées en 3 chapitres numérotés successivement afin de distinguer clairement leurs rappels. Dans la première partie, nous tâcherons au cours du Chapitre 1 de définir le DM innovant et la problématique de son évaluation. Nous présenterons ensuite une revue systématique de la littérature sur l’évaluation des technologies de santé en milieu hospitalier en France et à l’étranger dans le Chapitre 2. Enfin, nous compléterons, dans le Chapitre 3, cette revue de la littérature par une enquête réalisée dans 18 centres hospitalo-universitaires (CHU) français. Dans la seconde partie, nous présenterons au cours du Chapitre 4 une revue systématique de la littérature sur les outils d’aide à la décision consacrés à l’évaluation des technologies de santé en milieu hospitalier.
19 Dans le Chapitre 5, nous comparerons les éléments recueillis dans notre enquête à ceux de la revue systématique du Chapitre 4 et en proposerons une synthèse. Enfin, nous terminerons par la présentation, dans le Chapitre 6, des résultats d’un test préliminaire en situation réelle d’un outil d’aide multicritère à la décision issu de nos recherches.
En préambule à ce travail, nous tenons à en préciser le périmètre. En effet, il est possible de classer les DM en fonction de leur utilisation selon trois catégories : les DM à usage individuel, les équipements biomédicaux et les DM de diagnostic in vitro (2). Nous limiterons le périmètre de ce travail aux DM à usage individuel pour plusieurs raisons. Tout d’abord, les processus de remboursement, en particulier l’inscription sur la liste des produits et prestations remboursables (LPPR), ne concernent que cette catégorie de DM. Ensuite, l’introduction dans les établissements de santé d’équipements biomédicaux dits « lourds » (scanners, IRM…) est, selon l’article L. 6122-1 du Code de la santé publique, soumise à l’autorisation des agences régionales de santé (5). Par conséquent, l’intégration de ces DM au plan d’équipement des établissements relève d’une problématique très spécifique mettant en jeu l’organisation des soins au plan régional (6). Enfin, les équipements biomédicaux et les DM de diagnostic in vitro étant des dispositifs à usage multiple, ils impliquent des notions d’amortissement à moyen ou long termes assez éloignées sur le plan médico-économique de la problématique en lien avec les DM à usage individuel (souvent à usage unique et stériles) (7).
20
Partie 1 : Le dispositif médical innovant et
l’évaluation des technologies de santé en milieu
hospitalier
Chapitre 1 : Définition du dispositif médical innovant et
problématique de son évaluation en vue de son financement
1.
Contexte réglementaire du dispositif médical en France : définition, mise
sur le marché et remboursement pour les établissements de santé
1.1. Définition du dispositif médical
En France, d’après l’article L. 5211-1 du Code de la Santé Publique, on entend par dispositif médical tout instrument, appareil, équipement, matière, produit, à l'exception des produits d'origine humaine, ou autre article utilisé seul ou en association, y compris les accessoires et logiciels nécessaires au bon fonctionnement de celui-ci, destiné par le fabricant à être utilisé chez l'homme à des fins médicales et dont l'action principale voulue n'est pas obtenue par des moyens pharmacologiques ou immunologiques ni par métabolisme, mais dont la fonction peut être assistée par de tels moyens. Constitue également un dispositif médical le logiciel destiné par le fabricant à être utilisé spécifiquement à des fins diagnostiques ou thérapeutiques (8). Cette définition française du DM n’est autre que la transposition en droit français d’une définition européenne issue de la directive 93/42/CEE modifiée par la directive 2007/47/CE (9,10). Le législateur semble avoir conçu cette définition de façon complémentaire à celle du médicament. Cette construction n’est pas exclusive pour autant, car ce qui n’est pas un médicament n’est pas obligatoirement un DM non plus. En effet, d’autres produits de santé utilisés chez l’homme sont également exclus de la définition du DM comme les produits cosmétiques, les produits d’origine humaine1 (tissus, greffons, cellules, sang…) ou encore les équipements de protection individuelle (EPI). On le comprend, les DM recouvrent un
1 Concernant les produits d’origine humaine, certains DM peuvent en incorporer et sont réglementés par la directive 2000/70/CE relative aux DM incorporant des dérivés stables du sang ou du plasma humains (11).
21 ensemble très vaste et hétérogène de produits de santé, pouvant aller de l’aiguille hypodermique au scanner en passant par la prothèse articulaire de hanche.
1.2. Mise sur le marché du dispositif médical : le marquage CE
1.2.1. Généralités
Afin de garantir la sécurité des consommateurs et des utilisateurs de DM, des directives européennes dites de « nouvelle approche » ont fixé des « exigences essentielles » en matière de santé, de sécurité, de protection du consommateur et d’environnement. Le respect de ces exigences essentielles se traduit par l’apposition du marquage CE qui est le seul prérequis obligatoire2 pour permettre leur libre circulation et leur commercialisation sur le marché de l’Union Européenne. Son apposition est sous la responsabilité du fabricant, qui doit avoir préalablement vérifié que son produit répond aux exigences essentielles de la directive correspondante. Pour les DM, ces directives européennes sont les suivantes :
• 93/42/CEE modifiée par la 2007/47/CE pour les DM (9,10) ;
• 90/385/CEE modifiée par la 2007/47/CE pour les DM implantables actifs (DMIA) (12) ;
• 98/79/CEE pour les DM de diagnostic in vitro (DMDIV) (13) ;
• 2000/70/CE pour les DM incorporant des dérivés stables du sang ou du plasma humains (et modifiant la directive 93/42/CEE) (14) ;
• 2003/32/CE pour les DM fabriqués à partir de tissus d'origine animale (et modifiant la directive 93/42/CEE) (15).
1.2.2. Classification
D’après l’article R. 665-6 du Code de la santé publique, les DM sont répartis en quatre classes : classe I, classe IIa, classe IIb et classe III (16). Ces classes correspondent à un niveau de risque croissant établi selon des règles de classification3 évaluant le caractère invasif, le type d’invasivité, la durée d’utilisation ou encore la zone corporelle en contact avec le DM. Ces règles de classification sont au nombre de 18 et consignées dans l’annexe IX de la directive 93/42/CEE modifiée par la directive 2007/47/CE (10).
2 Seuls les DM destinés à des investigations cliniques, ceux élaborés « sur mesure » et ceux de diagnostic in vitro pour évaluation des performances sont exemptés de cette mesure.
3 A noter qu’un guide d’aide à la mise en œuvre de cette classification, le guide MEDDEV (version actuelle 2.4/1 Rev 9), est disponible et a été élaboré en partenariat avec les industriels du secteur (17).
22 1.2.1. Rôle du fabricant
Tout d’abord, le fabricant doit s’assurer que son produit répond bien à la définition du DM. La procédure de certification qu’il devra suivre est conditionnée par la classification à laquelle son dispositif correspond. En effet, pour les DM de classe I non stériles ou n’ayant pas de fonction de mesurage, le fabricant effectue une auto-certification de son DM et une simple déclaration à l’autorité sanitaire compétente du pays (10). Dans les autres cas, le fabricant doit obligatoirement s’adresser à un organisme notifié pour réaliser cette certification. Il doit avoir préalablement préparé une documentation technique démontrant la conformité de son DM aux exigences essentielles. Il peut pour cela se référer à des normes européennes harmonisées auxquelles renvoient les directives. Le fabricant n’a pas d’obligation de suivre ces normes, mais il devra apporter la preuve qu’il satisfait aux exigences essentielles de la directive. En fonction du niveau de risque du DM, plusieurs modalités de contrôle par l’organisme notifié existent dont certaines ne sont que purement documentaires (1).
1.2.2. Rôle des organismes notifiés
Les organismes notifiés sont désignés par les autorités sanitaires compétentes des états-membres après vérification de leur indépendance et de leur compétence en vue de mener des évaluations de conformité (18). Ces organismes notifiés4 sont placés sur un marché européen concurrentiel, ce qui signifie qu’un fabricant peut s’adresser à l’organisme de son choix comme spécifié à l’article R. 5211-25 du Code de la santé publique (19). Chaque organisme notifié travaille sous tutelle de l’autorité sanitaire compétente de son pays. Ainsi, en France, le seul organisme notifié est actuellement le Laboratoire National de Métrologie et d’Essais (LNE/GMED) sous tutelle de l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM).
Pour mener à bien ses missions, l’organisme notifié se fonde sur la documentation technique fournie par le fabricant, qui comprend notamment :
• Une description générale du produit ;
• Des informations sur la conception, les normes appliquées ou les solutions proposées pour satisfaire aux exigences essentielles dans le cas où les normes européennes
4 Il existe environ 80 organismes notifiés dont la liste est disponible sur le site Internet NANDO (New Approach
Notified and Designated Organisations Information System)
23 harmonisées ne seraient pas applicables, mais aussi les moyens de contrôle et de vérification de la conception ;
• Les spécificités choisies par le fabricant dans la conception et la fabrication du DM pour réduire les risques, les mesures de protection appropriées et les informations présentées aux utilisateurs sur les risques résiduels ;
• Les rapports des essais précliniques ;
• L'évaluation clinique s’il y a lieu et dont la mise en œuvre est précisée dans l’annexe X de la directive 93/42/CEE (10) ;
• L’étiquetage proposé.
L’organisme notifié peut compléter ces données par des investigations supplémentaires s’il les juge nécessaires. A la suite de cette analyse, il délivre un certificat de conformité valide pour une durée de cinq ans maximum et renouvelable. Pendant cette période, il peut mener des audits de suivi en particulier sur le système de management de la qualité mis en œuvre par le fabricant et un audit approfondi a théoriquement lieu au moment du renouvellement du marquage CE.
1.2.3. Rôle de l’Agence nationale de sécurité du médicament et des produits de santé En France, l’ANSM est donc l’autorité compétente en matière de sécurité sanitaire pour les DM (20). L’ANSM n’intervient pas directement dans la certification et la mise sur le marché du DM. Son rôle se situe soit en amont par l’évaluation et l’autorisation des recherches biomédicales menées en France sur le DM, soit en aval à travers la surveillance du marché français. Concernant la surveillance du marché, cette mission recouvre plusieurs actions comme le contrôle du respect des dispositions réglementaires en termes de performances annoncées des dispositifs. Ce contrôle passe par une évaluation ou réévaluation du rapport bénéfice/risque par rapport à l’état de l’art ou une technique de référence. Ceci peut se traduire soit par des évaluations ponctuelles portant sur un DM en particulier, ou sur la totalité d’une catégorie de DM mis sur le marché en France. Ces évaluations5 sont menées à travers des analyses sur dossier de la documentation technique ou bibliographique et/ou à travers des tests réalisés dans ses propres laboratoires ou dans des laboratoires experts. Le constat du non-respect des performances annoncées et/ou la mise en évidence d’un risque potentiel pour les
5 La loi du 29 décembre 2011 prévoit de renforcer les moyens de l’ANSM pour assurer la surveillance et l’évaluation des produits de santé. Ceci se traduirait notamment par une capacité d’incitation au développement de recherches indépendantes orientées sur la sécurité des produits de santé, de mener des études de suivi, de recueillir des données d’efficacité et de tolérance, de faire réaliser des essais cliniques par les industriels (13). A l’heure actuelle, le décret n°2012-597 du 27 avril 2012 relatif à l’ANSM n’apporte pas de précisions sur ces moyens (14).
24 utilisateurs peuvent conduire à des recommandations, des restrictions d'utilisation, voire à des arrêts de commercialisation du DM en question.
1.3. Modalités de prise en charge par l’assurance maladie
En ambulatoire, le remboursement aux assurés sociaux d’un DM à usage individuel par l’assurance maladie nécessite son inscription sur la LPPR définie à l’article L. 165-1 du Code de la sécurité sociale (21). Le DM doit appartenir à une des catégories définies à travers les 4 titres de la LPPR qui sont :
• Titre I : DM pour traitements et matériels d'aide à la vie, aliments diététiques et
articles pour pansements ;
• Titre II : Orthèses et prothèses externes (lunettes, montures, prothèses oculaires et
faciales) ;
• Titre III : Dispositifs médicaux implantables (DMI), implants issus de dérivés
d'origine humaine ou en comportant et greffons tissulaires d'origine humaine ;
• Titre IV : Véhicules pour handicapés physiques.
Pour les patients hospitalisés, les dépenses de DM ne leur sont pas directement facturables. Ainsi, ces dépenses sont soit incluses dans les forfaits des groupes homogènes de séjour (GHS) ou prises en charge par l'assurance maladie en sus de ces forfaits pour les activités médecine-chirurgie-obstétrique (MCO), soit couvertes par la dotation annuelle de financement (DAF) notamment pour les soins de suite et de réadaptation et les activités psychiatriques. Nous nous proposons de détailler ci-après les modalités de financement des DM dans les établissements de santé.
1.3.1. Financement au titre des tarifs des prestations d’hospitalisation
La T2A a été introduite en France suite à la loi de financement de la sécurité sociale pour 2004 (22,23). A ce jour, la T2A finance l’activité MCO. Cette activité est décrite à travers des groupes homogènes de malades (GHM) qui regroupent les patients selon un même profil afin d’y adjoindre un tarif de prise en charge, standardisé au plan national, le GHS. Cette expression tarifaire des GHM est fondée sur les données issues de l’étude nationale des coûts à méthodologie commune (ENCC) (24). Le tarif du GHS est un forfait facturable par les établissements de santé permettant notamment de couvrir les dépenses de DM et de médicaments. L’établissement de santé finance ses achats de DM sur la base des tarifs versés dans l’année, suite à la saisie des actes correspondant par les praticiens. Ceci implique qu’un
25 acte spécifique ait été préalablement défini dans la liste des actes de la classification commune des actes médicaux (CCAM) (25). Si cet acte n'est pas inscrit et correctement saisi6, l’établissement de santé ne pourra pas être remboursé du séjour correspondant puisque le paiement du GHS dépend du diagnostic principal, mais également du type d’actes effectués. La longueur des délais7 de création des actes est souvent décriée par les industriels du secteur et présentée comme un frein à la diffusion des DM les plus innovants (2,26,27).
Récemment, une nouvelle disposition est venue modifier la manière d’évaluer les DM financés à travers les GHS. Il s’agit du décret n°2012-1051 du 13 septembre 2012 définissant l'évaluation et la prise en charge de certains produits de santé financés dans les tarifs des prestations d'hospitalisation (28). Il devrait permettre l’évaluation de certaines catégories de DM qui échappaient jusqu’à présent à toute évaluation par les autorités sanitaires après obtention du marquage CE. Pour ces catégories de DM, en vue de l'inscription ou de la modification des conditions d'inscription de leur produit sur la liste prévue au I de l'article L. 165-11, les fabricants, ou leurs mandataires, ou les distributeurs, ou, le cas échéant, leurs représentants dans le cas d'une inscription sous forme de description générique déposent une demande auprès de la commission mentionnée à l'article L. 165-1, qui en accuse réception. La Commission en question est la Commission Nationale d’Evaluation des Dispositifs Médicaux et des Technologies de Santé (CNEDiMTS) de la Haute Autorité de Santé (HAS). Deux modalités d’inscription cohabitent, l’une sous « description générique » commune à une catégorie de produits comparables et l’une sous « nom commercial ». Cette inscription est valable pour une période de cinq ans, renouvelable, et est éventuellement subordonnée à des conditions de prescription et d’utilisation ou à la production par l’exploitant d’études complémentaires sur son produit. Le dernier arrêté publié fixant les catégories homogènes de produits de santé mentionnées aux articles L. 165-11 et R. 165-49 du code de la sécurité sociale est celui du 28 novembre 2013 (29).
Ainsi, les DM, et notamment les plus coûteux, ont vocation tôt ou tard à être comptabilisés dans le tarif des GHS8. Toutefois, les délais de revalorisation des GHS peuvent être longs et ont conduit, comme dans la plupart des pays européens ayant adopté ce mode de financement, à mettre en place un système de paiement en sus des prestations d’hospitalisation (30).
6
Depuis la décision du 18 juillet 2005 de l'Union nationale des caisses d'assurance maladie (UNCAM) relative à la liste des actes et prestations pris en charge ou remboursés par l'assurance maladie, le remboursement des actes professionnels par assimilation a été abrogé.
7 Ces délais ont été estimés entre 10 et 14 mois (26). 8
Par exemple, après plusieurs années de remboursement en sus, les défibrillateurs cardiaques implantables en mars 2011 ont vu leur prix inclus dans le montant d’un GHS redimensionné en conséquence et ont été radié de la LPPR.
26 1.3.2. Financement en sus des prestations d’hospitalisation
L’utilisation de certains DM coûteux, potentiellement innovants, est susceptible d’introduire une hétérogénéité dans les coûts de séjour. En attendant une éventuelle revalorisation du GHS, une prise en charge en sus des prestations d’hospitalisation est possible, mais nécessite l’inscription du DM sur la liste des produits et prestations pris en charge en sus des prestations d'hospitalisation mentionnée à l’article L. 162-22-7 du Code de la sécurité sociale (31,32). A l’hôpital, cette liste en sus correspond en fait aux DM définis au Titre III de la LPPR. Ces DM doivent aussi correspondre aux conditions générales fixées par l’assurance maladie pour leur remboursement et présenter les quatre caractéristiques suivantes9 (33):
- Etre implantés en totalité dans le corps humain ; - Etre implantables uniquement par un médecin ;
- Etre présents dans l’organisme pendant une durée supérieure à 30 jours ; - Etre l’objet principal d’une intervention chirurgicale.
Ces caractéristiques excluent de fait de nombreux DM : ceux qui ne sont implantés que partiellement, ceux qui ne sont amenés qu’à être utilisés pendant l’intervention chirurgicale, ceux présents dans l’organisme pendant moins de 30 jours (dispositifs rapidement résorbables) ou ceux ne faisant pas l’objet de l’intervention (dispositifs anti-adhérentiels par exemple).
L’inscription à la LPPR s’effectue selon deux modalités possibles d’après l’article R. 165-3 du Code de la sécurité sociale (34).
1.3.2.1. Inscription sous forme de description générique ou auto-inscription La formulation de l’article R. 165-3 du Code de la sécurité sociale pose l’inscription sous forme de description générique comme la règle générale (34). En effet, il y est stipulé que l'inscription sur la liste est effectuée, pour une durée maximale de cinq ans renouvelable par la description générique du produit ou de la prestation. Elle concerne les DM présentant une indication et des spécifications techniques identiques à celles d’une ligne générique déjà présente à la LPPR. Cette inscription peut se définir comme une auto-inscription, car si le fabricant estime que son DM répond aux spécifications d’une de ces lignes génériques, il n’aura qu’à étiqueter son produit selon la nomenclature LPPR correspondante. De plus,
9 A noter que certains DMI peuvent faire l’objet d’une inscription s’ils présentent un intérêt important de santé
27 aucune évaluation de la part de la CNEDiMTS n’est nécessaire lors de la première inscription10.
Le décret n°2004-1419 du 23 décembre 2004 précise également les dispositions liées à la révision de ces lignes génériques par la CNEDiMTS (35). Ces révisions concernent les indications cliniques, les spécificités techniques, les conditions d’emploi et de prescription de la ligne générique, qui aboutissent à la rédaction d’une nouvelle nomenclature. La CNEDiMTS doit par conséquent suivre un programme annuel de révision des descriptions génériques arrivant en fin de validité afin de pouvoir soumettre des recommandations aux ministres chargés de la santé et de la sécurité sociale qui pourront motiver une décision ou non de renouvellement de la ligne générique considérée voire d’éventuelles modifications tarifaires.
1.3.2.2. Inscription sous nom de marque ou de nom commercial
L’inscription sous forme de nom de marque ou de nom commercial constitue l’exception et est prévue par l’article R. 165-3 du Code de la sécurité sociale pour les produits qui présentent un caractère innovant ; ou lorsque l'impact sur les dépenses d'assurance maladie, les impératifs de santé publique ou le contrôle des spécifications techniques minimales nécessite un suivi particulier du produit (34). Cette inscription nécessite que le fabricant soumette son DM à une évaluation du Service Attendu (SA) et de l’Amélioration du Service Attendu (ASA) par la CNEDiMTS. Selon l’article R. 165-2 du Code de la sécurité sociale, le SA repose sur deux critères (36) :
- L'intérêt du produit ou de la prestation au regard, d'une part, de son effet thérapeutique, diagnostique ou de compensation du handicap ainsi que des effets indésirables ou des risques liés à son utilisation, d'autre part, de sa place dans la stratégie thérapeutique, diagnostique ou de compensation du handicap compte tenu des autres thérapies ou moyens de diagnostic ou de compensation disponibles ;
- Son intérêt de santé publique attendu, dont notamment son impact sur la santé de la population, en termes de mortalité, de morbidité et de qualité de vie, sa capacité à répondre à un besoin thérapeutique, diagnostique ou de compensation du handicap non couvert, eu égard à la gravité de la pathologie ou du handicap, son impact sur le système de soins et son impact sur les politiques et programmes de santé publique.
10
Depuis le décret n°2010-247 du 10 mars 2010 relatif à la déclaration des produits et prestations mentionnés à l'article L. 165-1 du code de la sécurité sociale, le fabricant a toutefois pour obligation de déclarer son produit à l’ANSM.
28 Si le SA11 est jugé suffisant, alors l’ASA est apprécié par rapport à un produit, un acte ou une prestation de référence (37). Cette inscription sous nom de marque n’a pas vocation à être permanente. En effet, il est prévu à l’article R. 165-3 du Code de la sécurité sociale qu’à tout moment, l'inscription sous forme d'une description générique peut être substituée à l'inscription d'un ou plusieurs produits sous forme de marque ou de nom commercial par arrêté du ministre chargé de la sécurité sociale et du ministre chargé de la santé après avis de la Commission nationale d'évaluation des dispositifs médicaux et des technologies de santé (34). Depuis le décret n° 2012-1116 du 2 octobre 2012 relatif aux missions médico-économiques de la HAS, une évaluation médico-économique est requise lorsqu'un DM présente une ASA (ou une amélioration du service rendu, ASR) élevée12 et lorsque ce dernier peut avoir un impact significatif sur les dépenses de l'assurance maladie (38). Le décret définit aussi le rôle et les objectifs de la Commission d’Evaluation Economique et de Santé Publique (CEESP) de la HAS chargée de rendre un avis sur l'efficience prévisible ou constatée de la prise en charge par l'assurance maladie du DM.
A l’issue de cette évaluation, une phase de négociation13 s’engage alors entre l’industriel et le Comité Economique des Produits de Santé (CEPS). Ce dernier doit aboutir, à l’issue d’un accord conventionnel, à la détermination d’un tarif de responsabilité (base de remboursement par l’assurance maladie), ainsi que du prix limite de vente (base de facturation à l’utilisateur) du DM à usage individuel qui seront ensuite définis par arrêtés ministériels (40). D’après l’article R. 165-14 du Code de la sécurité sociale, cette négociation tarifaire tient compte du SA, de l’ASA si elle existe, des tarifs des actes, des produits ou prestations comparables, mais aussi des volumes de vente prévus et des conditions prévisibles et réelles d'utilisation du DM (41). Dans le cadre d’une première inscription, l’avis rendu par le CEESP devrait intervenir dans la fixation du prix entre le CEPS dans ses négociations avec l’industriel (42).
1.3.2.3. Respect du contrat de bon usage
Quelle que soit la modalité d’inscription à la LPPR, l’utilisation d’un DM appartenant au Titre III est soumise au respect du contrat de bon usage pour faire l’objet d’un remboursement (CBU) (43). Ce CBU vise à garantir le bien fondé des prescriptions de médicaments onéreux et de l’utilisation des DM du Titre III dans les établissements de santé. Ainsi, pour obtenir un
11 Il existe deux catégories de SA : suffisant ou insuffisant. Par contre, il existe 5 catégories d’ASA/ASR : I (majeure), II (importante), III (modérée), IV (mineure) et V (absence d’amélioration).
12 On entend par ASA/ASR élevée, une ASA/ASR comprise entre I et III. 13
Le délai total moyen (CNEDiMTS + CEPS) pour une première inscription d’un DM à la LPPR est long, environ 9 mois (26). D’après l’article R. 165-8 du Code de la sécurité sociale, ce délai ne doit pourtant pas dépasser 180 jours (39).
29 remboursement intégral14, l’établissement s’engage à respecter les indications garantissant leur bon usage (indications de la LPPR, recommandations de la HAS…). La durée du contrat est de 3 à 5 ans et il est signé par le directeur de l’Agence Régionale de Santé (ARS), le directeur de l’établissement de santé et le médecin conseil régional de l’assurance maladie. En résumé, pour que l’établissement soit intégralement remboursé par l’assurance maladie d’un DM en sus des GHS, trois conditions doivent être réunies :
• Que le DM soit inscrit sur la LPPR au Titre III et sur la liste en sus ;
• Qu’il ait un acte CCAM associé ;
• Que l’établissement de santé respecte les indications d’utilisation dans le cadre du CBU.
1.3.3. Financements par dotation
Les Missions d’Intérêt Général et de l’Aide à la Contractualisation (MIGAC) sont issues de la loi de financement de la sécurité sociale pour 2004 (22,23). Les MIGAC sont des dotations de financement destinées à prendre en charge les activités non financées par la T2A. Ainsi, ces missions sont détaillées dans l’article L. 162-22-13 du Code de la sécurité sociale et concernent notamment les actions relevant du service public hospitalier, l’enseignement, la recherche, la médecine préventive, l’éducation pour la santé, la lutte contre l’exclusion sociale, l’amélioration de la qualité des soins, la mise en œuvre de la politique nationale en matière d’innovation médicale ou enfin des activités de soins dispensés à certaines populations spécifiques (44). Des dépenses de DM peuvent tout à fait être couvertes par ces dotations dans le cadre de ces missions. On distingue plusieurs catégories de missions financées par les MIGAC.
1.3.3.1. Les Missions d’Enseignement, de Recherche, de Référence et d’Innovation
Les Missions d’Enseignement, de Recherche, de Référence et d’Innovation (MERRI) couvrent les dépenses des établissements de santé liées aux activités de recherche et d’enseignement. Le montant et le mode de répartition de l’enveloppe MERRI sont définis au plan national par la Direction Générale de l'Offre de Soins (DGOS). Cette enveloppe est constituée de 3 parts :
14
Si l’établissement de santé respecte ces indications, le taux de remboursement des DMI en sus du GHS de l’année n+1 sera de 100%. En cas de non respect du contrat, le taux de remboursement de l’année n+1 se situera entre 70% et 100%.
30
• La part fixe garantissant aux établissements de santé des ressources stables pour le fonctionnement de leur activité de recherches et supportant les charges liées au personnel et l’équipement ;
• La part modulable qui est calculée sur la base d’indices d’activité de l’établissement de santé et qui prend notamment en compte les publications scientifiques, le nombre d’étudiants hospitaliers formés, etc. ;
• La part variable qui finance les structures de soins labellisées, les activités donnant lieu à des appels à projets et les activités de soins réalisées à titre expérimental ou non couvertes par les nomenclatures ou les tarifs dites de recours exceptionnel. Parmi les appels à projets, nous distinguerons en particulier les Programmes Hospitaliers de Recherche Clinique (PHRC) et les Programmes de Recherche Médico-Economique (PRME) à l’initiative des équipes de recherche des établissements de santé :
- Les PHRC sont destinés à financer des projets de recherche clinique pour des
technologies de santé à un stade précoce de leur développement (DM inclus). Ces appels à projets doivent correspondre à des thématiques de santé publique fixées par la DGOS. Le Comité National de Recherche Clinique (CNRC) est chargé d’examiner les projets soumis et propose au ministre chargé de la santé une liste de dossiers retenus pour financement. La circulaire n°DGOS/PF4/2013/105 du 18 mars 2013 rappelle ainsi que l’objectif des PHRC est de financer des projets de recherche visant à évaluer la sécurité, la tolérance, la faisabilité d’utilisation ou encore l’efficacité de technologies de santé chez l'Homme (45). Ces évaluations doivent prioritairement se faire au moyen de méthodes comparatives contrôlées, randomisées ou non, afin d’obtenir des données de haut niveau de preuve. Toutefois, ce type d’appel à projet concerne de manière assez marginale les DM puisqu’en 2012, seuls 9 (8%) projets sur 112 financés concernaient ces produits de santé (46).
- Les PRME, anciennement Programmes de Soutien aux Techniques Innovantes
et Coûteuses (P-STIC), ont été définis dans la circulaire DGOS du 18 mars 2013 comme des études médico-économiques devant respecter les standards méthodologiques définis par la HAS et visant à démontrer l’utilité médico-économique d’innovations15 à l’efficacité clinique préalablement validée (45,47). On comprend ainsi que ces projets s’adressent à des technologies de
15 Plus exactement, il existe deux axes pour les PRME : un axe innovation et un axe parcours de soins. Dans le cadre de ce travail, nous n’avons ici présenté que le premier axe.
31 santé à un stade plus avancé de leur développement que les PHRC. De plus, la circulaire souligne que les résultats des PRME seront pris en compte dans les décisions publiques, ce qui fait écho au décret n° 2012-1116 du 2 octobre 2012 relatif aux missions médico-économiques de la HAS. Toutefois, cette circulaire insiste aussi sur le fait que les PRME ne sont pas assimilables à des moyens de financement précoces d’une innovation et que toute technologie de santé innovante bénéficiant d’un PRME ne pourra faire l’objet, avant l’obtention des résultats finaux, d’une évaluation par la HAS dans le cadre d’une demande de remboursement. Sur 5 projets financés en 2013, deux concernaient des DM à usage individuel (48).
1.3.3.2. Autres missions d’intérêt général et aide à la contractualisation
Les autres missions d’intérêt général (MIG) couvrent, selon l’article D162-7 du Code de la sécurité sociale, les missions de veille et de vigilance, les dispositifs facilitant le maintien des soins de proximité, l’aide médicale d’urgence (SAMU/SMUR), les soins aux détenus, la prise en charge des patients en situation de précarité. Il existe aussi les dotations d’aide à la contractualisation (AC) qui permettent l’accompagnement des contrats pluriannuels d’objectifs et de moyens signés par les établissements de santé et la mise en œuvre des priorités de santé publique inscrites au sein des plans et des programmes nationaux.
1.3.4. Financements particuliers
1.3.4.1. Article L. 165-1-1 du Code de la sécurité sociale
Le législateur a proposé une solution dérogatoire et temporaire de prise en charge des produits de santé innovants dont les conditions de prise en charge sont définies à l’article L. 165-1-1 du Code de la sécurité sociale comme suit : tout produit, prestation ou acte innovant peut faire l'objet, à titre dérogatoire et pour une durée limitée, d'une prise en charge partielle ou totale relevant de l'objectif de dépenses mentionné à l'article L. 162-22-9. La prise en charge est décidée par arrêté des ministres chargés de la santé et de la sécurité sociale après avis de la Haute Autorité de santé. L'arrêté fixe le forfait de prise en charge par patient, le nombre de patients concernés, la durée de prise en charge, les conditions particulières d'utilisation, la liste des établissements de santé pour lesquels l'assurance maladie prend en charge ce forfait, et détermine les études auxquelles la mise en œuvre du traitement innovant doit donner lieu, ainsi que les modalités d'allocation du forfait aux établissements de santé. Cet arrêté peut préciser leurs modalités d'identification dans les systèmes d'information hospitaliers. Le