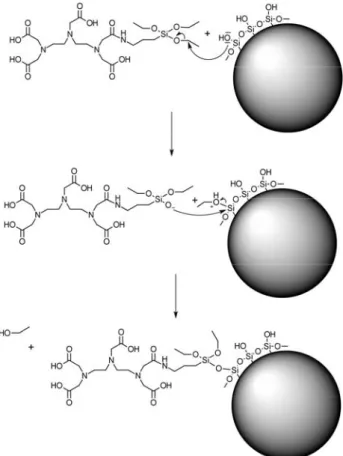
Hydrogels paramagnétiques pour applications
en imagerie par résonance magnétique
Thèse
Fanny Silencieux
Doctorat en génie des mines, de la métallurgie et des matériaux
Philosophiae Doctor (Ph. D.)
Québec, Canada
© Fanny Silencieux, 2017
Hydrogels paramagnétiques pour applications
en imagerie par résonance magnétique
Thèse
Fanny Silencieux
Sous la direction de :
Marc-André Fortin, directeur de recherche
Freddy Kleitz, codirecteur de recherche
Résumé
Les hydrogels sont des polymères de plus en plus utilisés dans le domaine des biomatériaux. À cause de leur faible différence de densité avec le milieu environnant, ils sont difficiles à visualiser en imagerie par résonnance magnétique (IRM). Des agents de contraste sont couramment utilisés pour faciliter la distinction entre les tissus pendant la visualisation en IRM. L'objectif de ce projet de thèse est donc de développer un agent de contraste paramagnétique et de l'encapsuler dans des hydrogels afin d'en permettre la visualisation en IRM. Des nanoparticules de silice mésoporeuses (MSN) ont été synthétisées et fonctionnalisées avec un agent de contraste cliniquement approuvé, le DTPA-Gd (acide diethylènetriamine pentaacetique complexé avec du gadolinium). Ces nanoparticules ont été caractérisées et leurs propriétés relaxométriques ont été mesurées. Le ratio r2/r1 = 1.46 démontre leur efficacité comme agent de contraste "positif". Ces nanoparticules sont ensuite encapsulées dans des hydrogels biocompatibles par différentes stratégies : dans un hydrogel de poly (éthylène glycol) (PEG) par agitation, ou dans un hydrogel d'alginate par émulsion dans un réacteur. Ces produits ont ensuite été mis en forme, respectivement pour des applications en chirurgie interventionnelle pour des aiguilles de biopsies et en microencapsulation pour le traitement du diabète de type 1.
Les performances relaxométriques de l'hydrogel de PEG ont été confirmées par NMRD (Nuclear Magnetic Relaxation Dispersion) à différents champs magnétiques. Cet hydrogel a ensuite été déposé par trempage-retrait sur des substrats de titane simulant des aiguilles de biopsie. Les substrats ont été préalablement lavés et fonctionnalisés avec du phosphate acrylate. En modulant la viscosité à l'aide d'un agent gélifiant, un hydrogel de PEG de 40 à 70 µm d’épaisseur a été obtenu en surface de tubes de titane. Les aiguilles recouvertes ont révélé un contour brillant en IRM. Des séquences d’acquisition en gradient d’écho de moins de 3 min ont permis d’obtenir un rehaussement de signal de 178% par rapport à l’eau.
Pour les hydrogels d'alginate, un rehaussement de contraste jusqu'à 113 % a été quantifié par rapport aux billes sans agent de contraste, avec une séquence d'écho de spin de 4 min. Un suivi par IRM sur plusieurs mois a aussi permis de confirmer que les deux hydrogels ne relarguent pas de gadolinium au cours du temps. Ces résultats confirment la possibilité de suivre ces hydrogels à long terme sans perte de signal, ce qui est essentiel à la poursuite de procédures in vivo.
Ce travail présente donc des hydrogels paramagnétiques à fort rehaussement de contraste en IRM grâce à l'insertion de nanoparticules de silice mésoporeuses fonctionnalisées avec un agent de contraste. Les résultats obtenus démontrent l'efficacité des MSN-DTPA-Gd encapsulées dans des hydrogels pour visualiser ces derniers par IRM. Ces travaux permettront une visualisation des hydrogels à long terme après implantation dans le corps humain.
Abstract
Hydrogels are polymers increasingly used in the field of biomaterials. Due to their low density difference with the surrounding middle, they are very difficult to visualize with magnetic resonance imaging (MRI). Contrasts agents are widely used in MRI to differentiate the different biological tissues during the imaging. The main objective of this project was the development of a paramagnetic contrast agent trapped in biocompatible hydrogels enabling their visualization in MRI.
Mesoporous silica nanoparticles (MSN) were synthesized and functionalized with a clinically-approved contrast agent, DTPA-Gd (gadolinium-diethylenetriamine pentaacetic acid). The nanoparticles were characterized and their relaxometric properties were evaluated. The r2/r1 relaxometric ratio of 1.46 revealed an efficient “positive” MRI contrast agent. Then, different entrapment strategies were performed in biocompatible polymers forming hydrogels: in a poly (ethylene glycol) (PEG) hydrogel (by stirring) or in an alginate hydrogel (by emulsion). These products were designed for applications in interventional surgery for biopsy needles and in microemulsion for type 1 diabetes treatment, respectively.
The relaxometric performances of the PEG hydrogel were assessed by NMRD (Nuclear Magnetic Relaxation Dispersion) at different magnetic field strengths. Then, the paramagnetic hydrogel was coated on titanium substrates as substitute of biopsy needles. The substrates were cleaned and functionalized with phosphate acrylate prior to dip-coating. With a thickening agent in the suspension, PEG hydrogels of 40 to 70 µm were deposited on titanium tubes. These samples showed bright outline in MRI. A signal enhancement of 178 %, in regard with water, was obtained with gradient echo sequences shorter than 3 min.
For the alginate hydrogels, beads with contrast agent showed a contrast 113 % enhanced, compared to beads without contrast agents, with a spin echo sequence of 4 min. MRI monitoring over months was done to confirm the persistence of the nanoparticles entrapment in both the PEG and alginate hydrogels. These results settled the possibility to use these hydrogels in the long term with no signal decrease, which is essential for in
vivo processes.
This work introduced paramagnetic hydrogels with a high contrast enhancement in MRI due to the entrapment of mesoporous silica nanoparticles functionalized with a contrast agent. Results confirmed the efficiency of the MSN-DTPA-Gd trapped in the hydrogels to visualize them in MRI. This work could lead to a long-term visualization of hydrogels after implantation in the body.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... viii
Liste des figures ... ix
Liste des abréviations ... xiii
Remerciements ... xvi
Avant-Propos ... xviii
Introduction ... 1
1. Présentation des concepts ... 18
1.1. Hydrogels pour applications biomédicales ... 18
1.1.1. Classes d'hydrogels pour applications biomédicales ... 18
1.1.2. Polymères biocompatibles pour hydrogels ... 19
1.1.3. L'alginate ... 20
1.1.4. Le poly (éthylène glycol) (PEG) ... 20
1.2. Les agents de contraste paramagnétiques pour l’IRM ... 23
1.2.1. Principe de l'imagerie par résonance magnétique ... 23
1.2.2. Les agents de contraste d’imagerie par résonance magnétique ... 29
1.3. Nanoparticules de silice mésoporeuses ... 33
1.3.1. Introduction aux nanoparticules de silice mésoporeuses ... 34
1.3.2. Principales voies de synthèse des nanoparticules de silice mésoporeuses pour applications biomédicales ... 35
1.3.3. Fonctionnalisation des nanoparticules de silice mésoporeuses avec des groupements paramagnétiques ... 36
1.3.4. Caractéristiques des nanoparticules de silice mésoporeuses appropriées pour un piégeage dans un hydrogel... 37
1.4. Mise en forme des hydrogels par dépôt trempage-retrait ... 37
1.4.1. Mécanisme de dépôt ... 37
1.4.2. Viscosité ... 41
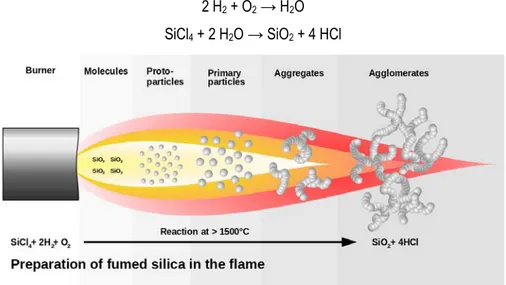
1.4.3. Silice fumée ... 43
2. Outils d’analyse utilisés pour le projet ... 46
2.1. Analyses des propriétés texturales et physico-chimiques des MSN-DTPA-Gd ... 46
2.1.2. Diffraction des rayons X (DRX) ... 47
2.1.3. Physisorption d'azote ... 47
2.1.4. Diffusion dynamique de la lumière (DLS) ... 49
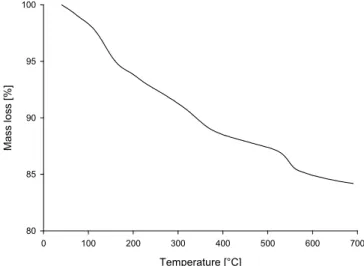
2.1.5. Analyse thermogravimétrique (ATG) ... 51
2.1.6. Relaxométrie ... 52
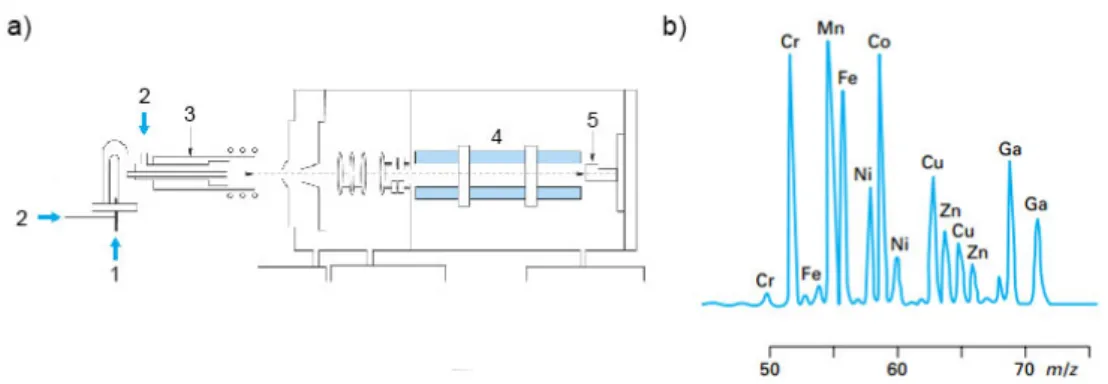
2.1.7. Spectroscopie de masse à plasma à couplage inductif (ICP-MS) ... 54
2.1.8. Activation neutronique (NAA) ... 55
2.2. Analyses de surface ... 56
2.2.1. Microscopie électronique à balayage (MEB) ... 56
2.2.2. Spectrométrie photoélectronique X (XPS) ... 56
2.2.3. Spectroscopie infrarouge à transformée de Fourier (FTIR) ... 57
3. Méthodologie de synthèse et de caractérisation des produits ... 58
3.1. Méthode de synthèse des MSN-DTPA-Gd ... 58
3.1.1. Synthèse des MSN ... 58
3.1.2. Fonctionnalisation des MSN ... 59
3.2. Couches minces de MSN ... 61
3.2.1. Dépôt par trempage-retrait et frittage des couches minces ... 61
3.2.2. Calcul de la densité ... 62
3.2.3. Distributions de taille... 62
3.3. Revêtements d'hydrogels de PEG encapsulant des MSN-DTPA-Gd ... 65
3.3.1. Synthèse du précurseur d'hydrogel ... 65
3.3.2. Caractérisation de l'hydrogel ... 67
3.3.3. Nettoyage du titane et greffage du phosphate acrylate ... 68
3.3.4. Dépôt de l'hydrogel sur les aiguilles ... 68
3.4. Billes d'alginate encapsulant des MSN-DTPA-Gd ... 70
3.4.1. Préparation des MSN-DTPA-Gd ... 70
3.4.2. Encapsulation des MSN-DTPA-Gd dans des billes d'alginate ... 71
3.5. Schéma des synthèses et caractérisation ... 74
4. Caractérisation des MSN-DTPA-Gd ... 76
4.1. Caractérisation des MSN-DTPA-Gd ... 76
4.1.1. Confirmation de la structure des MSN ... 76
4.1.2. Rendement et stabilité de la suspension de MSN ... 78
4.1.3. Propriétés des MSN-DTPA-Gd ... 79
4.2. Viabilité cellulaire des MSN-DTPA-Gd ... 82
4.2.1. Méthode expérimentale ... 82
4.2.2. Résultats de viabilité cellulaire ... 84
6. Revêtements paramagnétiques pour les dispositifs de chirurgie interventionnelle ... 95
6.1. Efficacité de l'hydrogel à piéger les nanoparticules ... 97
6.1.1. Performances relaxométriques de l'hydrogel ... 97
6.1.2. Piégeage des particules dans l'hydrogel ... 99
6.1.3. Détection de l'hydrogel à faibles volumes ... 100
6.1.4. Viscosité de l'hydrogel ... 101
6.2. Couches d’hydrogel paramagnétiques pour le rehaussement de signal des aiguilles de biopsie utilisées en IRM ... 103
6.2.1. Nettoyage des surfaces de titane ... 103
6.2.2. Greffage du phosphate acrylate ... 106
6.2.3. Dépôt de l'hydrogel sur les aiguilles ... 110
6.2.4. Visualisation des aiguilles en IRM ... 111
6.2.5. Conclusion ... 114
7. Hydrogels paramagnétiques pour l’encapsulation d’ilots de Langerhans et le suivi par IRM de la thérapie du diabète ... 116
7.1. Expérience sans cellules ... 117
7.1.1. Caractérisation de la suspension MSN-DTPA-Gd ... 117
7.1.2. Distribution de taille des billes d'alginate ... 117
7.1.3. Visualisation des billes en IRM ... 120
7.1.4. Étude du relargage du gadolinium dans le milieu environnant ... 122
7.2. Expérience avec cellules ... 124
7.2.1. Caractérisation de la suspension MSN-DTPA-Gd ... 124
7.2.2. Distribution de taille des billes d'alginate ... 125
7.2.3. Visualisation des billes en IRM ... 126
7.2.4. Discussion ... 129
7.3. Conclusion ... 130
Conclusion ... 131
Annexe A : Caractérisation des produits synthétisés dans cette thèse ... 136
Annexe B : Procédures de biopsie ... 143
Annexe C : Concepts des techniques d'analyse ... 146
Annexe D : Nettoyage des substrats de titane ... 151
Liste des tableaux
Tableau 1. Conversion entre le calibre d'une aiguille et son diamètre extérieur ... 9
Tableau 2. Valeur des susceptibilités magnétiques des principaux éléments ou alliages composant les aiguilles de biopsie compatibles pour IRM. ... 10
Tableau 3. Quantification des artéfacts causés par des aiguilles compatibles IRM ... 11
Tableau 4. Liste non exhaustive de polymères biocompatibles pouvant former des hydrogels... 19
Tableau 5. Nombre de spin en fonction de la parité de A et Z ... 24
Tableau 6. Moment magnétique de quelques éléments paramagnétiques ... 31
Tableau 7. Paramètres moléculaires pour le gadolinium. ... 32
Tableau 8. Température maximale pour l'analyse ATG en fonction de la nature du creuset. ... 51
Tableau 9. Principales études de biocompatibilité pour les produits composant l'hydrogel. ... 66
Tableau 10. Paramètres des séquences IRM utilisées pour les images de la Figure 86 ... 69
Tableau 11. Description des lots préparés pour l'expérience d'encapsulation des MSN-DTPA-Gd dans des billes d'alginate sans cellule ... 72
Tableau 12. Concentrations massiques avant et après remise en suspension ... 78
Tableau 13. Temps de relaxation et concentrations en gadolinium des différents lots utilisés dans ce document. ... 82
Tableau 14. Volume de milieu retiré et volume de nanoparticules ajouté par puits en fonction de la concentration souhaitée en nanoparticules au contact des cellules. ... 83
Tableau 15. Variation des propriétés des MSN après frittage à différentes températures ... 90
Tableau 16. Composition atomique relative des surfaces de titane nettoyées. ... 104
Tableau 17. Composition atomique de la surface des substrats de titane avec du phosphate acrylate greffé ... 106
Tableau 18. Composition du titane nettoyé, du phosphate acrylate en solution aqueuse et des substrats de titane greffés, déterminée par analyse en survol et en haute résolution en XPS. ... 107
Tableau 19. Augmentation du contraste des hydrogels à la surface des aiguilles ... 112
Tableau 20. Augmentation du contraste des billes contenant les MSN-DTPA-Gd ... 121
Tableau 21. Augmentation du contraste des billes contenant les MSN-DTPA-Gd ... 122
Tableau 22. Rapport entre le signal dans le haut et le bas au sein des puits contenant des billes d'alginate avec MSN-DTPA-Gd. ... 123
Tableau 23. Taux de relaxation pour les deux solutions du lot BAL. ... 142
Liste des figures
Certaines figures présentées dans ce document sont tirées de manuscrits et d'articles en préparation. Elles sont donc en anglais avec la légende rédigée en français.
Figure 1. Schéma d'un sein ... 7
Figure 2. Zones de la prostate ... 8
Figure 3. Aiguille à aspiration et aiguille coupante ... 10
Figure 4. Exemple d'artéfact créé par une aiguille de biopsie ... 10
Figure 5. Coupe histologique d'un cancer du sein multifocal et prostatectomie ... 12
Figure 6. Aiguille de biopsie compatible IRM dans la prostate d'un chien adulte... 12
Figure 7. Évolution du diabète dans le monde entre 2014 et 2035 ... 13
Figure 8. Schéma d'une cellule ... 14
Figure 9. Schéma de microencapsulation de cellules dans une bille d'alginate ... 16
Figure 10. Formule chimique des unités composant le polymère alginate. ... 20
Figure 11. 4A-PEG-TA (4arms–poly (ethylene glycol)-tetraacrylate) ... 21
Figure 12. Mécanisme de polymérisation radicalaire ... 22
Figure 13. Exemple de polymérisation radicalaire d'un polymère ... 23
Figure 14. Moment magnétique de spin ... 24
Figure 15. Mouvement en spirale du vecteur d'aimantation entre l'axe z et le plan xy ... 25
Figure 16. Graphique de la fonction de recouvrement longitudinal du vecteur d'aimantation ... 26
Figure 17. Graphique de la fonction de recouvrement transversal du vecteur d'aimantation ... 26
Figure 18. Relation entre le positionnement du champ magnétique dans le plan xy et le signal reçu au cours du temps. ... 27
Figure 19. Séquence d'écho de spin ... 29
Figure 20. Paramètres physiques du gadolinium ... 31
Figure 21. Les différentes mésostructures de la famille des M41S ... 34
Figure 22. Schéma d'un surfactant et de la formation d'une micelle ... 35
Figure 23. Liaisons oxo entre les atomes de silicium ... 35
Figure 24. Fonctionnalisation de MSN par co-condensation ou par greffage post-synthèse ... 36
Figure 25. Schéma du trempage-retrait ... 38
Figure 26. Visualisation d'un voxel d'IRM ... 38
Figure 27. Épaisseur d'un film après trempage-retrait, en fonction de la vitesse de retrait ... 39
Figure 28. Schéma d'un fluide newtonien entre deux plaques ... 41
Figure 30. Schéma d'un rhéomètre cône-plan ... 43
Figure 31. Schéma des étapes de la préparation de la silice fumée ... 44
Figure 32. Image MET de nanoparticules MSN ... 46
Figure 33. Exemple d'une courbe de l’intensité des rayons X diffractés pour des MCM-48. ... 47
Figure 34. Schéma simplifié d'un système de physisorption d'azote. ... 48
Figure 35. Exemple d'isothermes d'absorption et de désorption pour des MCM-48 ... 48
Figure 36. Schéma d'un appareil de DLS ... 50
Figure 37. Exemple d'un graphe en intensité de DLS ... 50
Figure 38. Évolution de la masse d'un échantillon de MSN-DTPA en fonction de la température. ... 52
Figure 39. Schéma simplifié d'un appareil de relaxométrie... 53
Figure 40. Valeurs de 1/T1 et 1/T2 en fonction de la concentration en gadolinium ... 54
Figure 41. Schéma simplifié d'un appareil d'ICP-MS ... 54
Figure 42. Schéma du principe de l'activation neutronique. ... 55
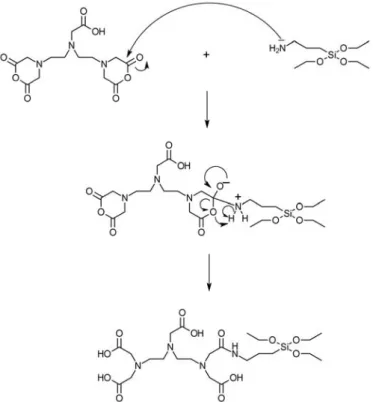
Figure 43. Ouverture du DTPA par le (3-aminopropyl)triéthoxysilane ... 59
Figure 44. Greffage du DTPA-silane sur les MSN ... 60
Figure 45. Représentation schématique des MSN-DTPA-Gd. ... 61
Figure 46. Molécule de l'Irgacure 184, de la triéthanolamine et du 1-vinyl-2-pyrrolidone. ... 65
Figure 47. Molécule d'alginate et gélification après ajout des ions Ca2+ et schéma des phases présentes après centrifugation du mélange dans le réacteur. ... 72
Figure 48. Exemple de ROI dans un puit contenant des billes d'alginate avec MSN-DTPA-Gd ... 73
Figure 49. Images MET des nanoparticules de silice mésoporeuses du lot CMF et distribution de taille des nanoparticules ... 76
Figure 50. Motif de diffraction des rayons X à bas angles pour les MSN du lot CMF ... 77
Figure 51. Isotherme de physisorption d'azote pour les MCM-48 du lot CMF ... 77
Figure 52. Distribution du diamètre hydrodynamique des MSN du lot CMF ... 78
Figure 53. Stabilité colloïdale des MSN en suspension aqueuse pour le lot CMF ... 79
Figure 54. Courbe d'analyse thermogravimétrique des MSN-DTPA du lot HYD ... 80
Figure 55. Isothermes de physisorption d'azote pour les MSN et pour les MSN-DTPA du lot HYD ... 80
Figure 56. Distribution du diamètre hydrodynamique des MSN-DTPA-Gd du lot HYD ... 81
Figure 57. Taux de relaxation longitudinale (1/T1) et transverse (1/T2) de la suspension de MSN-DTPA-Gd du lot HYD ... 81
Figure 58. Mécanisme de réduction de la résazurine en résorufine. ... 84
Figure 60. Représentation schématique du procédé de trempage-retrait et images prises par
microscopie électronique à balayage ... 86
Figure 61. Images MEB des substrats de silicium trempés dans une suspension de MSN... 87
Figure 62. Fréquence de sphéricité ... 88
Figure 63. Images MEB des couches minces de MSN ... 89
Figure 64. Évolution de la mésostructure des pores des MSN et évolution de la taille des pores ... 90
Figure 65. Représentation schématique de la création de cols entre les MSN ... 91
Figure 66. Spectres de RMN solide du 29Si des MSN non frittées et frittées à 600 °C ... 92
Figure 67. Profils ATG-DSC de MSN non frittées. ... 92
Figure 68. Images au microscope électronique à balayage d'une multicouche de MSN ... 95
Figure 69. Images MEB d'une multicouche de MSN sur des substrats d'acier inoxydable et de titane ... 96
Figure 70. Représentation schématique du réseau d'hydrogel piégeant les MSN-DTPA-Gd ... 96
Figure 71. Profils NMRD du précurseur d'hydrogel et de l'hydrogel réticulé ... 97
Figure 72. Profils NMRD d'une solution de gadolinium acétate sans silice fumée et avec 3 wt%, 5 wt% et 11.5 wt% de silice fumée. ... 98
Figure 73. Images IRM prouvant l'efficacité de la rétention des MSN-DTPA-Gd par l'hydrogel ... 99
Figure 74. Image IRM des gouttes d'hydrogel contenant des MSN-DTPA-Gd ... 100
Figure 75. Volume d'hydrogel quantifié en fonction du volume de la goutte initialement déposée ... 100
Figure 76. Mesures de viscosité des précurseurs d'hydrogel en fonction du taux de cisaillement ... 101
Figure 77. Courbe de la viscosité des précurseurs d'hydrogel ... 102
Figure 78. Schéma du processus de liaison entre le titane et l'hydrogel ... 103
Figure 79. Mécanisme de réaction d'un phosphate sur une surface métallique hydroxylée ... 104
Figure 80. Profils de rugosité réalisés avec une mesure AFM ... 105
Figure 81. Spectre en haute résolution en XPS de l'oxygène et du phosphore ... 108
Figure 82. Types de coordination du phosphate sur un substrat métallique ... 109
Figure 83. Spectre FTIR du phosphate acrylate libre en solution aqueuse et du phosphate acrylate greffé sur le titane. ... 109
Figure 84. Images de l'hydrogel à la surface des aiguilles de titane ... 110
Figure 85. Corrélation entre l'épaisseur et la viscosité de l'hydrogel ... 111
Figure 86. Images IRM d'aiguilles recouvertes d'hydrogel ... 112
Figure 87. Positionnement de la cavité péritonéale dans l'abdomen. ... 116
Figure 88. Diamètre hydrodynamique des MSN-DTPA-Gd mesuré en DLS ... 117
Figure 90. Distribution de taille des lots 2%-Ctrl-M, 2%-Ctrl-H, 2%-MSN-M et 2%-MSN-H ... 118
Figure 91. Distribution de taille des lots 7.5%-Ctrl-M, 7.5%-Ctrl-H, 7.5%-MSN-M et 7.5%-MSN-H ... 119
Figure 92. Images IRM des billes d'alginate avec et sans MSN-DTPA-Gd ... 121
Figure 93. Images IRM des billes d'alginate avec et sans MSN-DTPA-Gd ... 122
Figure 94. Images IRM des billes d'alginate avec et sans MSN-DTPA-Gd ... 123
Figure 95. Diamètre hydrodynamique des MSN-DTPA-Gd mesuré en DLS ... 124
Figure 96. Distribution de taille des billes d'alginate avec MSN-DTPA-Gd, avec cellules et avec cellules et MSN-DTPA-Gd ... 125
Figure 97. Image IRM des billes d’alginate ... 126
Figure 98. Évolution du contraste en fonction du temps ... 127
Figure 99. Évolution du rapport entre le bas et le haut des puits en fonction du temps ... 128
Figure 100. Diffractogramme DRX du lot CMF. ... 136
Figure 101. Images MET du lot CMF et distribution de taille des nanoparticules. ... 136
Figure 102. Isothermes de physisorption du lot CMF et distribution de taille de pore ... 137
Figure 103. Diffractogramme DRX du lot HYD. ... 137
Figure 104. Distribution de taille des nanoparticules et image MET du lot HYD ... 138
Figure 105. Isothermes de physisorption d’azote du lot HYD avant fonctionnalisation et après fonctionnalisation avec le DTPA ... 138
Figure 106. Graphe d'ATG du lot HYD après fonctionnalisation. ... 139
Figure 107. Taux de relaxation longitudinale et transverse du lot HYD et le signal relatif estimé ... 139
Figure 108. Diffractogramme DRX du lot BAL. ... 140
Figure 109. Image MET du lot HYD et distribution de taille des nanoparticules. ... 140
Figure 110. Isothermes de physisorption d’azote du lot BAL ... 141
Figure 111. Graphe d'ATG du lot BAL après fonctionnalisation. ... 141
Figure 112. Photo d'une patiente positionnée dans une bobine pour IRM avec une grille latérale; image IRM avec la grille de planification pour la biopsie et exemple d'une feuille de travail ... 144
Figure 113. Photos étape par étape d'une procédure de biopsie du sein ... 144
Figure 114. Exemple de système de bras articulé;image IRM de vérification de l'emplacement du manchon et schéma des emplacements de prélèvement pour les biopsies de la prostate ... 145
Figure 115. Schéma de la colonne d'un microscope électronique à transmission (MET) ... 146
Figure 116. Schéma simplifié de la colonne d'un microscope électronique à balayage ... 148
Figure 117. Schéma simplifié d'un appareil de XPS et spectre obtenu en survol ... 149
Liste des abréviations
Abréviation Nom completATG Analyse thermogravimétrique
Champ magnétique
DLS Diffusion de la lumière en mode dynamique DMEM Milieu Eagle modifié de Dulbecco
dpore Diamètre de pore
DRX Diffraction des rayons X
DTPA Acide diethylènetriamine pentaacetique
FBS Sérum de veau fœtal
FDA Food and drug administration
FTIR Spectroscopie infrarouge à transformée de Fourier HPK 1-Hydroxy-cyclohexyl-phenyl-ketone ICP-MS Spectroscopie de masse à plasma à couplage inductif IRM Imagerie par résonnance magnétique
Longueur d'onde
Vecteur d'aimantation
Masse moléculaire moyenne entre deux réticulations d'un hydrogel
MCM Mobile Corporation Material
MEB Microscopie électronique à balayage
MET Microscopie électronique à transmission Masse moléculaire moyenne d'un polymère MSN Nanoparticules de silice mésoporeuses MSN-DTPA MSN fonctionnalisées avec du DTPA
MSN-DTPA-Gd MSN fonctionnalisées avec un chélate de gadolinium
NAA Activation neutronique
NMRD Nuclear Magnetic Relaxation Dispersion NVP 1-vinyl-2-pyrrolidone
P-Acr 4-hydroxybutyl acrylate phosphate
PBS Tampon phosphate salin
PEG Poly (éthylène glycol)
PET Poly (éthylène terephtalate)
PLEA Acide poly (lactique-co-glycolique) PLLA Acide poly (L-lactique)
PS Pénicilline streptomycine
PTFE Poly (tétrafluoro éthylène)
PVA Alcool polyvinylique
r1 Relaxivité longitudinale
r2 Relaxivité transverse
RMN Résonnance magnétique nucléaire
T1 Temps de relaxation longitudinale
T2 Temps de relaxation transverse
TE Temps d'écho
TEA Triéthanolamine
TR Temps de répétition
UV Ultraviolet Distance entre deux réticulations XPS Spectrométrie des photoélectrons X
À mes parents, qui n'ont jamais cessé de croire en moi.
"Tout nous paraît impossible, jusqu'à ce qu'on le fasse…"
Remerciements
Au terme de ce doctorat effectué conjointement au laboratoire des Biomatériaux pour l'Imagerie Médicale et au laboratoire des Matériaux Fonctionnels Nanoporeux de l'Université Laval à Québec, j'adresse mes remerciements à mes superviseurs, le professeur Marc-André Fortin et le professeur Freddy Kleitz. Merci de m'avoir donné l'opportunité de faire un doctorat dans vos laboratoires, de m'avoir guidée dans mon projet et de m'avoir soutenue jusqu'à sa réalisation.
Je remercie aussi les professeurs Gaétan Laroche, Delphine Périé-Curnier, Houshang Alamdari et Frédéric Pouliot d'avoir accepté d'être membres de mon jury et d'évaluer mon travail. Je remercie le professeur Gaétan Laroche d'avoir accepté d'effectuer la prélecture de ma thèse et pour ses conseils avisés.
Ce travail de recherche a été rendu possible grâce au financement du FRQNT (Fonds de Recherche du Québec - Nature et Technologies) et je remercie le Québec de m'avoir offert cette chance de faire mes études dans un autre pays. L'expérience fut aussi enrichissante scientifiquement qu'humainement.
J'adresse un remerciement tout particulier au Dr Pascale Chevallier pour son soutien tout au long des années, pour sa patience incroyable et pour sa gentillesse au quotidien. Merci de m'avoir épaulée, d'avoir répondu à chacune de mes questions et d'avoir cru en moi. Rien de tout cela n'aurait été possible sans toi.
Je veux aussi remercier Meryem Bouchoucha pour m'avoir patiemment formée, et pour avoir ensuite été une amie si chère. Tu as su rendre ces trois années à la fois riches et amusantes. Tu as été une oreille attentive, toujours prête à me soutenir. Merci d'avoir égayé mon doctorat. Notre amitié hors du laboratoire m'a permis de passer à travers mon expérience avec le sourire.
Je remercie le Dr Teresa Simao pour ces moments ensemble, au laboratoire comme dans l'appartement. Je te suis reconnaissante pour ta patience et ta gentillesse qui ont fait de notre cohabitation des moments de plaisir. Pour ces longues soirées à travailler au salon et pour ces dimanches au laboratoire, merci. J'ai été contente d'avoir pu partager tant de moments avec toi.
Je voudrais aussi témoigner ma reconnaissance aux Dr Stéphane Turgeon, Dr Jean Lagueux et Dr Marie-France Coté pour avoir répondu à mes questions avec patience, même les plus basiques. Vous m'avez énormément appris et j'ai eu beaucoup de chance de faire mon doctorat entourée de professionnels de recherche toujours prêts à aider les étudiants.
Un remerciement spécial au Dr Diane Djoumessi, pour les fous rires et pour sa gentillesse au laboratoire. Tes conseils m'ont bien aidée. Merci pour ton grain de folie dans le laboratoire, pour m'avoir appris à parler à mes nanoparticules et pour m'avoir montré le meilleur dans chaque situation.
Je tiens à remercier Mathieu Bouchard pour sa bonne humeur au laboratoire et sa générosité. Tu as toujours été prêt à aider. Une pensée spéciale pour les réveils à trois heures du matin et les heures de route à m'entendre jacasser dans tes oreilles. N'oublie jamais qu'il n'y a qu'un seul remède pour tous les maux du monde : les fraises Tagada.
Je remercie aussi Myriam Laprise-Pelletier pour sa douceur et sa gentillesse. Même dans les moments difficiles, tu as gardé de l'optimisme. Je garderai en mémoire tes aventures rocambolesques et ta capacité à en rire.
Je suis reconnaissante à mes stagiaires Christopher Cirio, le Dr Esteban Vargas, Marc-Antoine Loranger et Jean-François Sauvageau d'avoir partagé un bout de mon aventure. Vous avez cru en mon projet et consacré vos journées à le faire avancer avec moi. Merci à vous quatre.
J'ai aussi une pensée pour mes collègues de bureau avec qui j'ai beaucoup partagé et qu'il me serait impossible de lister intégralement. De manière plus globale, je remercie tous les étudiants et professionnels de recherche du bloc E de l'hôpital de Saint-François d'Assise, pour ces trois années à vos côtés. J'ai énormément appris de chacun de vous.
Sur un volet plus personnel, je tiens à remercier mon fiancé pour sa patience. Il n'a pas hésité à m'encourager à partir, malgré le sacrifice que cela représentait, pour que je puisse vivre mon rêve. Merci pour ton indéfectible confiance, merci d'avoir veillé tard pour m'attendre sur Skype, merci d'avoir traversé l'Atlantique pour venir me voir.
En enfin, j'ai gardé le plus important pour la fin. Je veux remercier mes parents pour leur soutien. Je n'étais qu'une enfant lorsque j'ai décrété que je voulais faire de la recherche plus tard. Ce désir n'a fait que grandir parce que vous l'avez encouragé, vous avez nourri ma curiosité, m'avez montré le monde et m'avez communiqué l'envie d'apprendre encore et toujours. Sans vous, rien de tout ce que j'ai accompli n'aurait été possible. Vous n'avez pas hésité une seconde à m'épauler pour ce voyage fou de trois ans dans un autre pays. Je ne pourrais jamais suffisamment vous exprimer ma reconnaissance pour votre amour et votre soutien.
De manière globale, je remercie toutes les personnes qui m'ont aidée à vivre cette merveilleuse aventure et à traverser ces trois années en n'en gardant que de bons souvenirs.
Avant-Propos
Ce travail de thèse a été réalisé au sein de deux laboratoires : le Laboratoire des Biomatériaux pour l'Imagerie Médicale (groupe du Pr. Marc-André Fortin) et le Laboratoire des Matériaux Fonctionnels Nanoporeux (groupe du Pr. Freddy Kleitz). Ces deux laboratoires possèdent une expertise dans le domaine des agents de contraste, de l'imagerie médicale et des matériaux poreux. La synthèse de nanoparticules de silice mésoporeuses contenant du gadolinium complexé avec de l’acide diethylènetriamine pentaacetique (MSN-DTPA-Gd) a été développée au sein du laboratoire avant mon arrivée. L'optimisation du procédé pour obtenir un agent de contraste le plus performant possible a été réalisée par ma collègue Meryem Bouchoucha, travaux publiés dans Advanced Functional Materials (2014). Les résultats présentés dans ce document de thèse se découpent en trois chapitres principaux, chacun correspondant à un article publié ou en cours de rédaction. Dans le chapitre 5, une étude des propriétés de couches minces de MSN soumises à un traitement thermique a fait l'objet d'un article publié dans Langmuir en octobre 2015 : Mesoporous Silica Nanoparticles
under Sintering Conditions: A Quantitative Study. La participation des auteurs (Silencieux, F., Bouchoucha, M., Mercier, O., Turgeon, S., Chevallier, P., Kleitz, F. et Fortin, M.-A.) est décrite ci-après. La partie expérimentale
sur les dépôts de couches minces de MSN sur des substrats de silicium, afin d'obtenir des structures compactes et ordonnées de nanoparticules, a, quant à elle, été effectuée par un stagiaire au BIM, Olivier Mercier avec un produit synthétisé et caractérisé par Meryem Bouchoucha. Le début de mon projet de thèse a été de terminer cette étude en y ajoutant une caractérisation complète des couches avant et après frittage, pour observer le comportement de la porosité des nanoparticules lorsqu'elles sont soumises à un traitement thermique visant à les fixer sur le substrat. Le Dr Stéphane Turgeon a réalisé les distributions de taille et établi les modélisations physiques pour étudier l'évolution du diamètre en fonction de la température de frittage. Le Dr Pascale Chevallier a participé à la co-rédaction de l'article.
Cette étude a mené à la conclusion que pour déposer les MSN-DTPA-Gd sur des substrats, tout en conservant leur propriété porosimétrique, l'encapsulation dans un hydrogel était préférable. Le chapitre 6 a donc consisté à développer une méthode de synthèse d'un hydrogel à base de poly (éthylène glycol) (PEG) dans lequel les MSN-DTPA-Gd ont été encapsulées, puis déposées sur des substrats métalliques. Tout cela a été réalisé dans l’objectif de rehausser le signal des aiguilles pour des procédures de biopsies sous IRM. En ajustant les volumes des produits (initiateurs, polymères, agent gélifiant…), la durée des étapes et les paramètres de trempage-retrait, un hydrogel paramagnétique a pu être déposé sur des substrats de titane (préalablement activés par du phosphate); simulant des aiguilles de biopsie. Les résultats obtenus ont permis la rédaction d'un manuscrit, Paramagnetic hydrogels for high signal-enhancement of interventional biomedical devices in MRI, par Silencieux, F., Chevallier, P., Lagueux, J., Bouchoucha, M., Gossuin, Y., Kleitz, F. et Fortin, M.-A., qui est
actuellement en préparation et sera soumis à l'automne à Nanoscale. Dans ce travail, j’ai fortement contribué au développement et à l’optimisation de la méthode d'encapsulation de MSN-DTPA-Gd dans un hydrogel de PEG, à l’activation des surfaces de titane, ainsi qu’à la méthodologie et aux paramètres de déposition de cet hydrogel sur les surfaces activées. Le Dr Pascale Chevallier a participé à la rédaction de l'article et a effectué les caractérisations de surface sur les aiguilles afin de confirmer la méthode de lavage et le greffage du phosphate pour activation du substrat. Le Dr Jean Lagueux a réalisé les images IRM démontrant l'efficacité de l'hydrogel pour rehausser le signal des aiguilles. Il a par ailleurs, avec Meryem Bouchoucha, effectué les mesures de relaxométrie au sein du laboratoire du Pr Yves Gossuin, à l'Université de Mons en Belgique. Meryem Bouchoucha a aussi participé à la synthèse et la caractérisation des MSN-DTPA-Gd utilisées pour ce projet.
Le chapitre 7 regroupe un autre projet dans ma thèse qui a consisté à encapsuler des MSN-DTPA-Gd dans des billes d'alginate au cours d'une collaboration avec le laboratoire Stem Cell du Pr. Corinne Hoesli à l'Université McGill. Un article, en co-rédaction entre nos deux laboratoires, a été rédigé par Sarkis, S. et
Silencieux, F. (en copremiers auteurs), Markwick K., Fortin, M.-A. et Hoesli, C., Paramagnetic alginate hydrogels based on mesoporous silica nanoparticles, for pancreatic islet cells implantation and tracking in MRI, et est
actuellement en préparation pour une soumission à ACS Biomaterials Science & Engineering. Sary Sarkis et moi-même avons rédigé le manuscrit, moi pour la partie synthèse et caractérisation des MSN-DTPA-Gd et le suivi des billes d'alginate par IRM, lui pour la culture cellulaire et l'expression des gènes. Karen Markwick a réalisé les distributions de taille des billes d'alginate et le Dr Jean Lagueux a effectué les images IRM.
Au cours de mes trois années de doctorat, j'ai formé quatre stagiaires. Certaines analyses ont été effectuées par eux, mais j'ai toujours moi-même réalisé l'extraction et la mise en forme des données. Enfin, mes travaux ont été présentés à des conférences nationales et internationales sous forme de posters ou de présentations orales. Pour les conférences nationales, j'ai présenté mes travaux :
au congrès de l'Association Francophone pour le Savoir (posters), en 2013 et 2014, au colloque du Centre de Recherche sur les Matériaux Avancés (posters), en 2013 et 2014, à la 96e conférence du Canadian Society for Chemistry (poster), en 2013,
lors du Symposium Imaginez l'Imagerie à Sherbrooke (poster), en 2014,
au colloque annuel du Centre Québécois sur les Matériaux Fonctionnels (deux oraux et deux posters), en 2013, 2014 et 2015.
Pour les conférences internationales, mes travaux ont été présentés lors d'un oral au 2015 MRS Fall Meeting & Exhibit à Boston (USA). Ces différentes communications ont permis de diffuser les résultats obtenus au cours de ma thèse.
Introduction
Mise en contexte
Les biomatériaux se définissent comme des matériaux non vivants utilisés dans un dispositif médical et conçus pour interagir avec des systèmes biologiques (Conférences de consensus de Chester, 1986 et 1991). Ils sont de plus en plus présents dans la médecine moderne. En 2012, le marché global des biomatériaux était évalué entre 150 et 200 milliards de dollars américains.[1] Les biomatériaux doivent nécessairement être composés de matériaux biocompatibles qui peuvent être de nature très variée tels que des céramiques, des métaux et aussi des polymères. Dans le cas des polymères, ces derniers peuvent être sous forme solide et compacte, comme les prothèses en Téflon (polytétrafluoroéthylène (PTFE)) ou en Dacron (poly (éthylene terephthalate) (PET)), des cathéters en polyuréthane, etc. Ils peuvent aussi se retrouver sous forme d'hydrogel comme échafaudage pour l'ingénierie tissulaire,[2] comme barrière immuno-isolante pour la microencapsulation,[3] comme support pour la croissance cellulaire[4] ou encore comme système de contrôle pour la délivrance de médicaments.[5, 6] Les hydrogels peuvent être utilisés comme biomatériaux à court terme avec dégradation du polymère ou à long terme sans dégradation dans les milieux biologiques. Au cours des 30 dernières années, les méthodes de synthèse des hydrogels ont été grandement développées car les propriétés modulables de ces derniers présentaient un fort potentiel. Ces nombreux travaux ont permis d’avoir un meilleur contrôle de leur structure pour répondre aux besoins croissants et spécifiques dans le domaine biomédical.[7]
Cependant, lorsqu'ils sont introduits dans le corps humain, le suivi de ces biomatériaux ou leur localisation est devenu un vrai défi en termes d’imagerie non invasive. Cette dernière permet de visualiser l’intérieur du corps humain mais n’offre pas une image claire et précise de la plupart des biomatériaux.[8] Les techniques d'imagerie actuelles sont nombreuses (ultrasons, microscopie photoacoustique, imagerie par résonnance magnétique, imagerie optique, imagerie par rayons X, imagerie nucléaire…) mais leur utilisation avec les procédures standards développées actuellement ne permet pas toujours la quantification du volume d'un hydrogel après implantation ou le suivi de sa dégradation.[9] Parmi les techniques d'imagerie tridimensionnelles les plus utilisées se trouvent l'imagerie aux ultrasons, la tomographie et l'imagerie par résonance magnétique (IRM).
L'imagerie aux ultrasons est basée sur l'émission d'une onde acoustique qui fait vibrer les éléments du milieu qu'elle traverse. Ces éléments émettent alors des échos acoustiques secondaires dont une partie est détectée par la sonde de l'appareil à ultrasons pour être retranscrite en images. Le principal avantage de cette technique est la quasi-instantanéité des images et sa nature non-ionisante, c’est-à-dire que le patient comme le praticien ne sont pas soumis à des radiations pendant la procédure de biopsie. L'inconvénient majeur de
l'imagerie ultrasonore est le faible champ de vue dû à une mauvaise résolution en profondeur. La visualisation des structures denses est aussi difficile et ces-dernières laissent une trace fantôme en arrière-plan.
La tomographie de rayons X est une technique reposant sur l'atténuation des rayons X en fonction de la densité massique du tissu traversé. Un arceau de détecteurs permet de mesurer la transmission des rayons X à travers le corps et une image numérique est recalculée mathématiquement point par point en niveaux de gris d'après le coefficient d’atténuation du faisceau incident. La tomographie à rayon X a une excellente résolution spatiale. C'est une méthode d'imagerie qui permet une visualisation en profondeur, donc avantageuse pour effectuer des images à l’intérieur du corps ou sous des tissus denses tels que les os. Cependant, la tomographie à rayons X offre un contraste limité dans les tissus mous. Enfin, c'est une technique ionisante qui irradie le patient et le praticien et qui donc pose des risques radiobiologiques.
L'IRM est une méthode d'imagerie plus sensible dans la détection d'anomalies et dans la quantité de détails visualisables dans les tissus mous que les ultrasons ou la tomographie à rayons X.[10] C'est une technique basée sur l'alignement des moments magnétiques des spins des protons d’hydrogène dans un champ magnétique. Sous une impulsion radiofréquence, ces derniers basculent dans un autre plan. De manière très simplifiée, leur retour à l'équilibre après l'arrêt de l'impulsion permet d'obtenir une image basée sur le fait que le temps de retour des moments magnétiques des protons dépend de la nature du tissu et de son environnement. C'est une technique non-ionisante et multi-planaire, avec une résolution allant jusqu'au mm3 en clinique et au 0.01 mm3 en préclinique.[11] L'IRM fournit un excellent contraste dans les tissus mous, ce qui facilite la localisation et la quantification volumique des biomatériaux. L'inconvénient majeur de cette méthode est l'impossibilité d'imager des matériaux possédant une forte susceptibilité magnétique car cela cause une déformation de l'image. Par ailleurs, il est aussi difficile d'obtenir un contraste entre les hydrogels et le milieu environnant à cause de leur capacité à absorber les liquides biologiques.
L'IRM a été largement utilisée dans la recherche biomédicale, notamment pour tracer des microcapsules d'hydrogel,[12] pour étudier la vascularisation dans ces matériaux[13] ou encore pour suivre leur dégradation après implantation.[14] La qualité des images IRM (résolution, rapport signal sur bruit et contraste sur bruit) s'est améliorée au cours des 30 dernières années. Outre le fait que les appareils d’IRM sont équipés d'aimants produisant un champ magnétique toujours plus puissant, le développement d'agents de contraste efficaces et non toxiques a joué un rôle important dans cette évolution.
D'une manière simplifiée, l'IRM est basée sur l’énergie des spins des atomes d’hydrogène. Les protons sont alignés grâce à un champ magnétique . Les spins sont ensuite excités avec une impulsion radiofréquence à 90° par rapport à . Pour retourner à leur état d’équilibre, les spins qui sont à l’état excité
vont émettre de l’énergie qui sera convertie en signal. La relaxation correspond au transfert de ces spins excités vers leur état d’équilibre. Il y a deux temps de relaxation : la relaxation longitudinale T1, correspondant au
recouvrement selon l’axe du champ magnétique , et la relaxation transverse T2, correspondant à la diminution
des protons orientés à 90° par rapport au champ magnétique . Ces notions seront explicitées dans la présentation des concepts ensuite. Le signal produit par l’IRM dépend essentiellement de la densité en protons des tissus et de ces deux temps T1 et T2 qui sont des valeurs intrinsèques aux tissus. Chaque élément biologique
composant le corps (tissus, os, fluides, matières organiques) possède un T1 et un T2 uniques, tout comme la
densité de protons, ce qui permet un contraste naturel entre les éléments composant le corps. Les valeurs de
T1 et T2 dépendent de l'arrangement des protons d'hydrogène et de leur environnement dans un tissu donné,
par exemple dans les muscles, le T1 et le T2 seront respectivement d'environ 900 ms et 30 ms, tandis que dans
le foie, ils seront de 500 ms et 40 ms.[15] Lorsque nécessaire, le signal intrinsèque des tissus peut être amplifié par l'utilisation d'agents de contraste afin de faciliter la distinction entre deux tissus de nature et composition différentes. Ces éléments chimiques, tel que le gadolinium, permettent d'augmenter le signal dans une zone localisée en réduisant les temps de relaxation des protons environnants. Le produit est généralement injecté de façon intraveineuse au cours de l'examen et ensuite éliminé par voie rénale. Approuvé depuis 1988 par la FDA (Food and Drug Administration), le gadolinium complexé par du DTPA (acide diéthylène triamine penta acétique) est un des agents de contraste les plus utilisés lors des examens cliniques.[11]
L’augmentation de l’efficacité des complexes de gadolinium comme agent de contraste a fait l’objet de nombreux travaux.[16] L’efficacité dépend en effet de nombreux paramètres que l'on peut ajuster pour optimiser l'influence du gadolinium sur les protons d’hydrogène du milieu liquide. L'une des stratégies utilisées est de greffer ces complexes à des nanoparticules biocompatibles telles que celles à base d'or[17] ou de silice.[18] L’utilisation de nanoparticules de silice est déjà largement envisagée dans le domaine de la médecine.[19-21] Leur utilisation comme agent de contraste par le greffage de chélates de gadolinium s'est donc aussi développée au cours des 15 dernières années.[22-24]
La localisation des hydrogels in vivo en utilisant l'IRM est rendue complexe par la nature même de l'hydrogel. En effet, le réseau tridimensionnel poreux absorbe jusqu'à 90 % de l'eau du milieu environnant, ce qui le rend difficile à distinguer de ce dernier. Sans utilisation d’un agent de contraste pour augmenter le signal de l'hydrogel, il n'est pas pertinent d'utiliser l'IRM pour visualiser les hydrogels après implantation dans le corps. Cette technique offre pourtant un excellent contraste dans les tissus mous, pour le suivi des hydrogels dans le corps. Ce projet consiste donc à développer un agent de contraste efficace, sous la forme de nanoparticules paramagnétiques, afin d’augmenter le signal des hydrogels et de mieux les distinguer des tissus environnants dans les procédures de visualisation en IRM.
Pour ce faire, nous avons développé des particules de silice mésoporeuses fonctionnalisées avec un chélate de gadolinium (MSN-DTPA-Gd). Dans un premier temps, des couches minces de ces nanoparticules ont été déposées sur un substrat de silicium pour étudier leur comportement lors d'un traitement thermique. L'hypothèse était de pouvoir accrocher les nanoparticules directement sur un substrat par frittage. La forte diminution des propriétés porosimétriques des MSN après frittage a conduit à développer plutôt l'encapsulation des MSN-DTPA-Gd dans un hydrogel. Deux applications ont été développées : l'encapsulation dans un hydrogel de poly (éthylène glycol) pour la visualisation des aiguilles de biopsie en IRM et l'encapsulation dans un hydrogel d'alginate pour le suivi de billes d'alginate après implantation dans le corps.
Utilisation des couches minces de MSN
Dans une première étape, un dépôt direct des MSN sur un substrat a été envisagé pour la visualisation par IRM des aiguilles de biopsie. L’objectif était de déposer une couche d’une épaisseur d’une centaine de microns pour obtenir un bon rehaussement de signal en IRM. Il était donc important d’avoir, dès la première couche (couche mince), un dépôt structuré et solide. Pour consolider le dépôt, la méthode envisagée a été le frittage, c’est-à-dire un traitement thermique à une température suffisamment élevée pour faciliter la diffusion des atomes et créer ainsi des cols entre les nanoparticules et avec le substrat, ce qui renforce l’adhérence et la cohésion des MSN déposées.
Les MSN sont utilisées dans de plus en plus d'applications et technologies, allant de la catalyse à la délivrance de médicaments, en passant par l'optique, la chromatographie, la détection de gaz, les dépôts dans l'industrie des semi-conducteurs et les surfaces hydrophiles. Plusieurs articles de revue ont déjà été publiés, décrivant les synthèses, les fonctionnalisations, la caractérisation ainsi que les propriétés physico-chimiques et texturales des MSN.[25-27] Les MSN sont des matériaux qui présentent un volume poreux (> 60 %) et une surface spécifique exceptionnellement élevés, une bonne stabilité thermique et chimique ainsi qu'une large gamme de fonctionnalisations possibles.[28-30] Parmi les différentes catégories de MSN développées, les nanoparticules de type MCM, qui présentent un très grand volume poreux et une grande surface spécifique ainsi qu'un bon contrôle de leur taille,[31, 32] sont des candidates idéales pour la fabrication de films minces compacts pour la catalyse ou l'élution de médicament.
Un nombre croissant d'applications requiert que les MSN soient attachées sur des substrats pour former des structures bien ordonnées et compactes de nanoparticules. Les couches minces faites à partir de nanoparticules poreuses peuvent présenter des propriétés de diffusion améliorées et un système poreux plus accessible que pour des couches minces réalisées directement à partir d'un précurseur de silice.[33] Parmi les techniques de déposition utilisées pour disperser les nanoparticules de silice sur des substrats avec un bon contrôle sur l'épaisseur, on trouve l'auto-assemblage électrostatique,[34] la déposition de Langmuir-Blodgett,[35]
le dépôt par centrifugation,[36, 37] le dépôt par trempage-retrait[38] ou le dépôt couche-par-couche.[39, 40] Des suspensions de nanoparticules individualisées, plutôt que des agglomérats en solution, sont préférables pour ces procédés car les défauts (tels que les agglomérats) déposés sur une surface sont amplifiés à chaque étape supplémentaire de dépôt.[36] De ce fait, il est généralement admis que la formation de couches minces lisses et homogènes, présentant une très faible rugosité, nécessite l'utilisation de suspensions de MSN de bonne qualité, homogènes et non agglomérées.[36, 37, 40]
Jusqu'à présent il n'y a pas eu – ou très peu – de descriptions dans la littérature du comportement des MSN (taille des particules et propriétés texturales) lorsqu'elles sont frittées. Saito et al [41] a rapporté la fabrication de disques compacts millimétriques de MSN (diamètre 0.56 µm) qui ont ensuite été frittés à l'air entre 400 °C et 1200 °C. L'évolution de la densité, de la surface spécifique et des profils DRX des disques a été évaluée. Cependant, les propriétés texturales telles que le volume poreux et le diamètre des pores n'ont pas été mesurées. Il est intéressant de noter qu'aucune évidence de liaison entre les MSN n'est observée pour les échantillons frittés à 1050 °C ou moins, tandis qu'une forte densification des disques est constatée à 800 °C ou plus. Cela suggère une perte de la porosité pour un frittage au-delà de 800 °C, au détriment des propriétés poreuses de films minces hautement poreux réalisés à partir de MSN accrochées sur des substrats. Dans une autre étude, Tsai et al.[35] rapporte le frittage à 430 °C de recouvrements super hydrophobes de particules de silice de tailles micro/nano sur des substrats de verre. Bien que cette température puisse sembler très basse pour un frittage significatif, les dépôts, de 50 nm, 0.5 µm, 1 µm et 1.5 µm de nanoparticules denses, apparaissent stables aux mesures d'angle de contact. La visualisation des revêtements en MEB ne montre pas d'évidence de liaison entre les particules mais le résultat de cette étude révèle la possibilité de consolider des revêtements de nanoparticules de silice par un frittage à relativement basse température (< 500 °C).
Le comportement des nanoparticules de silice mésoporeuses après frittage soulève de nombreuses questions qui doivent être étudiées. Il y a une forte différence entre les performances du frittage sur le silicium et sur la silice. En effet, la présence de silice en surface de billes de silicium inhibe la diffusion de surface (et donc le grossissement des grains) par rapport au mécanisme de densification durant le frittage.[42] De telles constatations sont difficiles à extrapoler aux MSN de tailles similaires car :
les pores représentent 60 % du volume,
la mésostructure des MSN est organisée en motifs géométriques périodiques, ce qui peut causer une voie de diffusion moléculaire au sein des nanoparticules,
les murs de silice ne sont pratiquement pas cristallins.
De plus, les MSN ne sont pas composées uniquement de SiO2 : le rapport Si/O peut varier. Elles présentent de nombreux groupements silanols (Si-OH) en surface, qui peuvent influer sur la capacité à se lier
avec leurs voisins proches à de faibles températures de frittage. La quantité de groupements silanols en surface peut aller jusqu'à 5 Si-OH par nm² pour des surfaces non poreuses de silice.[43, 44] Le nombre de ces groupements est fortement réduit après un traitement à une température au-delà de 500°C et ils peuvent alors se condenser pour former des liaisons Si-O-Si.[45, 46] Une étude du comportement des MSN disposées en couches minces lorsqu'elles sont frittées à différentes températures apporterait donc des informations importantes sur les propriétés des MSN après traitement thermique.
Visualisation des aiguilles de biopsie sous IRM
L'imagerie médicale permet de détecter la présence de masses suspectes dans les seins ou la prostate, qui représentent environ 25 % des cancers chez la femme et chez l'homme.[47] Cependant il peut être difficile de déterminer si une anomalie est bénigne ou maligne avec seulement les signes cliniques et les résultats radiologiques. Pour pallier à ce problème, la biopsie percutanée1 est utilisée. C'est une intervention durant laquelle on effectue le prélèvement chirurgical de tissus qui forment une masse pour les examiner au microscope.
La grande majorité des biopsies du sein ou de la prostate sont effectuées sous imagerie ultrasonore[48, 49] ou sous tomographie à rayons X.[50, 51] Ces deux méthodes d'imagerie ont été décrites précédemment et les avantages de l'IRM ont été soulignés. En effet, l'IRM offre un excellent contraste dans les tissus mous, ce qui rend cette technique plus sensible que les ultrasons ou la tomographie à rayons X, à la fois dans la détection d'anomalies et dans la quantité de détails visualisables. C'est aussi une technique multiplanaire qui permet de changer de plan de coupe pendant la procédure, pour avoir une vision sous plusieurs angles pendant l'opération et donc un meilleur suivi de l'aiguille de biopsie (localisation et trajectoire). Enfin, l'IRM est une méthode non ionisante : ni le patient, ni le praticien, ne sont exposés à un rayonnement pendant la procédure. Un hématome peut parfois se former ou une infection peut se développer sur le site de l'incision, mais ces inconvénients sont rares (< 1 %)[52] et une procédure de biopsie sous IRM sera moins invasive et plus rapide qu'une biopsie chirurgicale.
Cancer du sein
Le cancer du sein est le cancer le plus diagnostiqué chez la femme (26 % des cas de cancer, 25 000 cas au Canada en 2015) et représente la deuxième cause principale de décès par cancer (14 % de tous les décès par cancer, 5000 cas au Canada en 2015).[53]
1 En médecine, le terme "percutané" désigne une procédure médicale permettant d'atteindre des tissus ou des organes
Le sein est une glande modifiée de la peau; enveloppée dans du fascia fibreux2. Le sein est composé de trois grandes structures : la peau, les tissus sous-cutanés et les tissus du sein (parenchyme3 et mésenchyme4).[54] Le parenchyme est divisé en lobes et canaux reliés entre eux tandis que le mésenchyme contient de la graisse, des tissus conjonctifs, des ligaments, des vaisseaux, des ganglions lymphatiques et des nerfs. La peau de la poitrine contient les follicules pileux et les glandes. Le cancer du sein peut se développer dans les cellules des canaux galactophores (carcinome canalaire) ou dans les lobules (carcinome lobulaire) (Figure 1). Le carcinome canalaire est le type de cancer du sein le plus fréquent.
Figure 1. Schéma d'un sein avec indication de l'emplacement des canaux galactophores et des lobules où se développe le cancer du sein (image : Larousse Médicale, édition 2006)
L'évaluation du grade du cancer se fait par classification histologique. Un échantillon prélevé par biopsie est observé au microscope et en fonction de son apparence et de son comportement, la probabilité et la rapidité de propagation sont estimées. On peut ainsi mieux planifier le traitement et établir un pronostic. Le système de classification histologique est basé sur les critères de Nottingham et se fait en fonction des caractéristiques des cellules de la tumeur.
Grade 1 → Tumeur de bas grade (bien différenciée) qui ne semble pas se développer rapidement et qui est peu susceptible de se propager.
Grade 2 → Tumeur de grade intermédiaire (modérément différenciée) dont les caractéristiques varient entre celles des tumeurs de grade 1 et de grade 3
Grade 3 → Tumeur de haut grade (peu différenciée) qui a tendance à se développer rapidement et qui est susceptible de se propager.
2 Un fascia est une membrane fibro-élastique composée de tissu conjonctif qui recouvre ou enveloppe une structure
anatomique.
3 Somme des tissus constituant les parties fonctionnelles d'un organe.
4 Tissus de remplissage qui donne la forme à l'organe et le maintien en place. Il joue aussi un rôle dans la nutrition des
Plus le cancer est pris tôt (grade 1 ou 2), plus les chances de survie sont élevées. Le diagnostic se pose en plusieurs étapes : un examen physique, une mammographie ou une échographie puis une biopsie si l'imagerie révèle la présence d'une masse suspecte. Cependant les mammographies conventionnelles peuvent ne pas détecter jusqu'à 25% des cancers à cause de la densité similaire entre les tissus du sein et les carcinomes, en particulier chez les femmes possédant des seins denses (≥ 50% de tissus fibreux et < 50% de tissus adipeux).[55] Les mammographies sont aussi moins sensibles chez les femmes ayant des implants ou qui ont eu une chirurgie ou une radiothérapie. En revanche, la sensibilité de l'IRM permet de détecter des cancers qui n'auraient pas été détectés par mammographie ou par examen clinique.[56, 57] Des études ont montré que le taux de sensibilité de l'IRM pour des cancers du sein de taille supérieure à 3 mm était de 100 %.[58] Une publication de Lehman et al. a rapporté que l'IRM du sein controlatéral peut détecter les tumeurs à un stade plus précoce que d'autres méthodes d'imagerie.[59] La possibilité d'effectuer ensuite une biopsie sur ces masses non détectées par les autres méthodes d'imagerie souligne l'importance de l'IRM du sein. Les procédures de biopsie du sein sont décrites plus en détail dans l'Annexe B.
Cancer de la prostate
Le cancer de la prostate est le cancer le plus répandu chez les hommes (24 % des cas de cancer, 24 000 cas au Canada en 2015) et représente la troisième cause de décès par cancer (10 % de tous les décès par cancer, 4100 cas au Canada en 2015). Étant donné que c'est un cancer à évolution lente, le taux de survie est de 96% après cinq ans.[53]
Chez un homme adulte, la glande de la prostate est un organe de la taille d'une noix et qui pèse 30 à 40 g. Elle est située dans le bassin, entre le col de la vessie et le diaphragme urogénital, en avant du rectum et de l'urètre qui traverse son centre. Anatomiquement, la prostate comprend trois zones (Figure 2) avec des volumes différents et des formes de cancer différentes. Environ 70 % des tumeurs se situent dans la zone périphérique (qui représente elle-même 70 % du volume total de la prostate), 20 % dans la zone transitionnelle (25 % du volume total de la prostate) et 10 % dans la zone centrale (5% du volume total de la prostate).[60]
Tout comme pour le cancer du sein, la classification histologique est primordiale pour l'évaluation du grade du cancer et donc la planification du traitement du cancer de la prostate. L'observation des cellules cancéreuses prélevées lors d'une biopsie permet de décrire l'état de la tumeur suivant une classification. Pour les cancers de la prostate les plus courants, c'est la classification de Gleason qui est utilisée.[62] Il s'agit d'une échelle de 1 à 5 qui reflète l'anomalie des tissus. Plus le nombre est bas (grade 1 ou 2), plus le tissu est normal. À partir du grade 3, on considère qu'il y a un début de tumeur.
En raison de sa grande sensibilité de contraste dans les tissus mous, l'IRM permet, comme pour le cancer du sein, de détecter des masses qui ne sont pas visibles en échographie transrectale, ce qui réduit le nombre de faux négatifs.[63-66] Dans ses travaux, Hambrock et al. rapporte des taux de détection de cancer de 59 % avec l'IRM contre seulement 15 % en utilisant l'échographie transrectale et sur ces 59 %, 93 % ont eu une biopsie positive.[65] Les procédures de biopsie de la prostate sont décrites plus en détail dans l'Annexe B.
Aiguilles de biopsie compatibles pour IRM
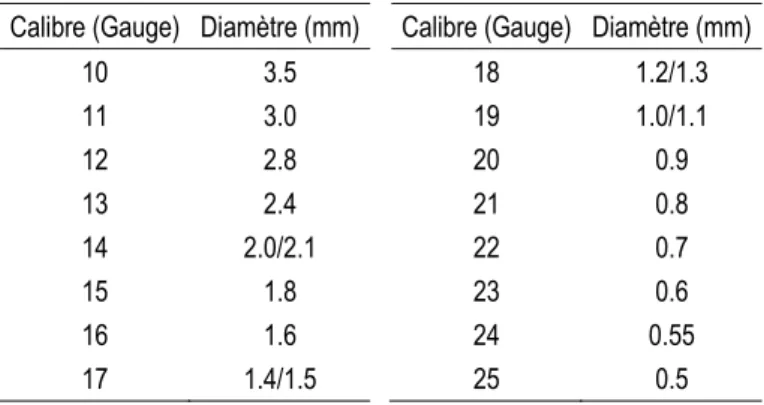
Les procédures de biopsie nécessitent un matériel adapté, en particulier des aiguilles spécifiquement conçues pour prélever des échantillons de tissu à l'intérieur du corps. Comme toutes les aiguilles, elles sont définies par leur calibre qui est mesuré en gauge. Le gauge est une unité de mesure basée sur le nombre d’aiguilles que l’on peut mettre dans un gabarit en forme de cylindre d’un diamètre de 1 pouce. Plus le calibre en gauge est faible, plus le diamètre de l’aiguille est gros. Le Tableau 1 donne les équivalences entre le calibre en gauge et le diamètre externe de l'aiguille pour les principaux calibres rencontrés parmi les aiguilles de biopsie.
Tableau 1. Conversion entre le calibre d'une aiguille et son diamètre extérieur
Calibre (Gauge) Diamètre (mm) Calibre (Gauge) Diamètre (mm)
10 3.5 18 1.2/1.3 11 3.0 19 1.0/1.1 12 2.8 20 0.9 13 2.4 21 0.8 14 2.0/2.1 22 0.7 15 1.8 23 0.6 16 1.6 24 0.55 17 1.4/1.5 25 0.5
Il existe deux catégories d'aiguilles de biopsie : les aiguilles à aspiration et les aiguilles coupantes.[67] Les premières sont généralement des aiguilles de petit calibre (20 à 25 G) utilisées pour prélever des échantillons de tumeur pour une analyse cytologique (Figure 3a). Elles permettent d'obtenir des cellules individuelles plutôt que des morceaux de tissus. Le faible calibre de ces aiguilles permet de traverser des
organes tels que l'intestin, l'estomac ou le foie.[68] Les aiguilles coupantes sont généralement utilisées pour faire des analyses histologiques. Ce sont des aiguilles dont le bout ou le bord est tranchant (Figure 3b).[69] Avec un mouvement vers l'avant et une rotation, l'aiguille coupe le tissu, collectant un petit échantillon pour la biopsie.
Figure 3. a) Aiguille à aspiration (Chiba®) et b) aiguille coupante (Cook®)[70]
Pour répondre à la contrainte mécanique de la perforation et de la découpe des tissus, les aiguilles sont constituées d'alliages métalliques, ce qui leur assure une grande rigidité. Malheureusement, ces alliages métalliques ont une susceptibilité magnétique souvent élevée (Tableau 2). La susceptibilité magnétique est la faculté d’un matériau à s’aimanter sous l’action d’un champ magnétique. C’est une propriété macroscopique intrinsèque à un matériau, qui décrit la réponse de ses éléments à un champ magnétique appliqué. En IRM, une trop forte susceptibilité magnétique peut causer des perturbations locales du champ magnétique, ce qui entraîne des artéfacts5 (Figure 4) et des distorsions dans les images.
Tableau 2. Valeur des susceptibilités magnétiques des principaux éléments ou alliages composant les aiguilles de biopsie compatibles pour IRM. [71, 72]
Élément / Alliage Susceptibilité magnétique Acier inoxydable 30 x 10-8 – 70 x 10-8 Nitinol6 2.4 x 10-8
Titane 1.5 x 10-8
Figure 4. Exemple d'artéfact créé par une aiguille de biopsie.[73]
5 Un artéfact est une visualisation inappropriée d’un objet, caractérisée par une augmentation ou une diminution du signal
qui ne reflète pas la présence des protons d’hydrogène dans cette zone.
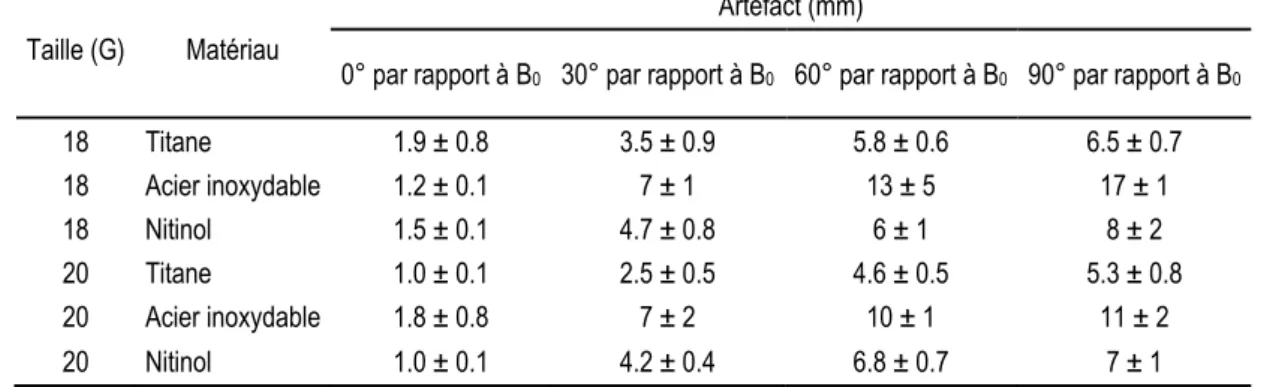
Quelques études ont été effectuées pour quantifier les artéfacts produits par les aiguilles de biopsie commercialisées.[74, 75] Des aiguilles compatibles pour IRM, en alliage non-ferromagnétique, ont été développées mais elles généraient toujours un artéfact.[76-79] Penzkofer a réalisé une étude assez complète des artéfacts causés par les aiguilles de biopsie dites "compatibles IRM" commercialisées.[80] Le diamètre des artéfacts causés par ces aiguilles a été quantifié à deux différents champs magnétiques (1.5 T et 3 T), en faisant varier l'angle entre l'aiguille et l'orientation du champ magnétique B0 pour deux séquences IRM (pondération T1 et
précession libre). Le type et la taille d'artéfact varient selon le matériau de l'aiguille, sa taille et son orientation. Le type de séquence et la puissance du champ influent moins. Les résultats pour quatre aiguilles imagées en séquence pondérée T1 à 1.5 T ont été reportés dans le Tableau 3.
Tableau 3. Quantification des artéfacts causés par quatre aiguilles compatibles IRM commercialisées.[80] Champ : 1.5 T,
séquence pondérée T1 (T1‐weighted‐spoiled‐gradient‐echo, TR = 8.48 ms, TE = 4.6 ms, angle = 12°, champ de
vue = 260x260 mm, matrice d'acquisition = 432x432, épaisseur de tranche : 2 mm, temps d'acquisition : 1 s).
Taille (G) Matériau
Artéfact (mm)
0° par rapport à B0 30° par rapport à B0 60° par rapport à B0 90° par rapport à B0
18 Titane 1.9 ± 0.8 3.5 ± 0.9 5.8 ± 0.6 6.5 ± 0.7 18 Acier inoxydable 1.2 ± 0.1 7 ± 1 13 ± 5 17 ± 1 18 Nitinol 1.5 ± 0.1 4.7 ± 0.8 6 ± 1 8 ± 2 20 Titane 1.0 ± 0.1 2.5 ± 0.5 4.6 ± 0.5 5.3 ± 0.8 20 Acier inoxydable 1.8 ± 0.8 7 ± 2 10 ± 1 11 ± 2 20 Nitinol 1.0 ± 0.1 4.2 ± 0.4 6.8 ± 0.7 7 ± 1
Les artéfacts causés par les aiguilles seront plus ou moins grands en fonction de la susceptibilité magnétique (Tableau 2 et Tableau 3). En effet, pour les aiguilles en acier inoxydable, lequel a une susceptibilité magnétique plus de 20 fois supérieure au titane, les artéfacts sont beaucoup plus importants que ceux provoqués par les aiguilles en titane. On observe la même tendance avec le nitinol dont la susceptibilité magnétique est 13 fois inférieure à celle de l'acier inoxydable mais 1.5 fois celle du titane. Les artéfacts causés par les aiguilles en nitinol sont de diamètre moindre que pour les aiguilles en acier inoxydable, mais supérieur ou égal à celles en titane. C'est donc les aiguilles en titane qui présentent le plus faible diamètre d'artéfact, puisque le titane a une susceptibilité magnétique de 1.5 x 10-8.
La présence d'artéfacts, même millimétriques, peut gêner le chirurgien pendant la procédure, en particulier dans le cas des cancers du sein ou de la prostate où les nodules composant la tumeur sont souvent de taille millimétrique (Figure 5). Il est essentiel pour le praticien d'avoir la plus grande précision possible afin d'éviter les faux négatifs en ponctionnant dans du tissu sain au lieu de la tumeur. Or, même avec l'adaptation
du matériel aux biopsies sous IRM,[78, 79] les aiguilles n'offrent qu'un faible contraste avec le tissu environnant (Figure 6). Ce faible contraste et les forts artéfacts peuvent compliquer les procédures de biopsie.
Figure 5. a) Coupe histologique d'un cancer du sein multifocal avec 8 foyers tumoraux de taille inférieure à 10 mm[81] et b)
prostatectomie révélant un foyer tumoral de taille inférieure à 10 mm.[82]
Figure 6. Aiguille de biopsie compatible IRM (flèche blanche) dans la prostate d'un chien adulte (source : bdml.stanford.edu/Main/ShapeSensingNeedle)
Afin d'avoir une précision optimale concernant la localisation de l'aiguille dans le corps du patient, le praticien a besoin d'un contraste entre l'aiguille et les tissus environnants. Le dépôt d'un hydrogel paramagnétique à la surface des aiguilles de biopsie permettrait le rehaussement de contraste du contour de l'aiguille et donc une localisation plus précise par le praticien. C’est l’approche qui a été retenue dans ce projet de recherche.
Localisation de billes d'alginate pour le traitement du diabète de type 1
Le diabète en quelques chiffres
Une autre application des nanoparticules synthétisées et du concept d’hydrogels paramagnétiques dans ce projet concerne le traitement du diabète de type 1. Le diabète est considéré aujourd'hui comme un problème de santé mondial sérieux et en croissance constante. Si, en 2014, le diabète touchait 387 millions de personnes dans le monde (dont 3.4 millions au Canada),[83] cette maladie touchera 592 millions de personnes en 2035, soit une augmentation de 53 % (Figure 7).[84] Une personne sur douze est diabétique dans le monde,
![Tableau 2. Valeur des susceptibilités magnétiques des principaux éléments ou alliages composant les aiguilles de biopsie compatibles pour IRM. [71, 72]](https://thumb-eu.123doks.com/thumbv2/123doknet/5595061.134498/29.892.303.584.676.1008/tableau-susceptibilités-magnétiques-principaux-éléments-composant-aiguilles-compatibles.webp)
![Figure 13. Exemple de polymérisation radicalaire d'un polymère se terminant par une fonction acrylate (adapté de Polymérisation sous rayonnements UV) [127]](https://thumb-eu.123doks.com/thumbv2/123doknet/5595061.134498/42.892.326.577.392.823/exemple-polymérisation-radicalaire-polymère-terminant-fonction-polymérisation-rayonnements.webp)