T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul SabatierDiscipline ou spécialité : Immunologie
JURY
Pr Roland LIBLAU Président Dr Maria Cristina CUTURI Rapporteur Pr Jean DAVOUST Rapporteur Pr Joost van MEERWIJK Directeur de Thèse
Ecole doctorale : Biologie - Santé - Biotechnologies Unité de recherche : U563 Inserm
Directeur(s) de Thèse : Joost van Meerwijk
Présentée et soutenue par Thibault SANTOLARIA Le 26 janvier 2009
Titre : INDUCTION DE TOLERANCE AUX ALLOGREFFES D'ORGANES SOLIDES PAR LES
REMERCIEMENTS
Aujourd’hui se tourne une page importante de ma vie, quatre années passées à l’Inserm U563 et pourtant, quand je regarde en arrière, j’ai l’impression d’être seulement arrivé hier. Cette page est émminamment importante puisque c’est elle qui m’a vu, pour rester dans l’immunologique, me différencier de cellule immature (étudiante) en cellule effectrice, apte à la dure loi de la sélection du travail… Même si une telle transformation demande une intégration personnelle du message (« La chimère hématopoïétique est à la réponse à toutes les questions » et autre « Les Tregs vont sauver le monde »), elle ne saurait s’opérer sans une éducation et un signal de survie de la part d’autres cellules spécialisées (la grande famille des Chefs, et la famille tout court).
Dans mon cas, ma cellule présentatrice d’antigènes est certainement mon directeur de thèse : Joost van Meerwijk. Merci à vous de m’avoir accepté au sein du DEA d’immunologie, puisque c’est ainsi que cela s’appelait encore, et de m’avoir associé à l’un des plus passionnants sujets qui soit : la tolérance aux autres. Merci également de m’avoir tout au long de ces quatre années enseigné l’art délicat de la chimère hématopoïétique, la passion des Tregs et le goût de former la génération suivante. Je garderai en mémoire, de nos « interactions », les longues semaines, pleines de doutes et de craintes, à patienter pour savoir si oui ou non, nos greffes de coeur allaient survivre jusqu’à terme ; les mois à attendre que nos coupes histologiques soient enfin prêtes ; les jours précédents l’envoi du papier à faire et refaire, encore et encore, des photos avec Talal ; et votre détermination sans faille pour défendre le papier devant l’Editorial Board de Nature Medicine. Peu y aurait cru, vous oui ! Encore moins aurait réussit un tel pari, vous si ! Le jeu en valait la chandelle… Merci encore pour ses intences émotions.
Si dans cette métaphore immunologique, Joost devait être la CPA, alors Paola serait certainement la mTEC. Parfait complément dans cette étape de sélection, vous avez su m’apporter la rigueur nécessaire à la réalisation d’un projet scientifique. Merci pour votre disponibilité, les nombreux rapports de congrès que vous nous avez fait (et les discussions qui s’ensuivaient) et votre enthousiasme au quotidien. Mon seul regret sera que vous ne m’ayez que partiellement communiqué votre passion pour la sélection thymique. Il faut dire que je partais avec un a priori assez fort vis-à-vis de cette partie de l’immunologie.
Merci à Geneviève pour sa gentillesse et son aide précieuse dans le phénotypage des nombreuses souris transgéniques utilisées au laboratoire.
Bien sûr, le thymocyte n’est pas seul dans l’immensité du thymus. De très nombreux autres lymphocytes en devenir l’accompagnent dans cette longue transformation. Sans eux, le pauvre thymocyte ne serait plus le même. Parmi eux, il y a d’abord mes collègues de l’équipe Tolérance et Auto-immunité, à commencer par
REMERCIEMENTS
les anciens, qui par leur sagesse ont contribué à ma formation. Un grand merci donc à toi, Olive, pour m’avoir appris les bases techniques du sujet et donné tous les conseils dont j’avais besoin : de l’étude comparative entre les pansements Carrefour et Hansaplast pour les greffes de peau, à la technique secrète de l’ACK ou les chemins détournés pour traverser Toulouse en pleine heure de pointe pour rentrer chez mes parents. Merci enfin, pour ta patience, devant mon style parfois si particulièrement particulier (« Lors du dysfonctionnement d’un organe, celui-ci n’assure plus sa fonction »). Ingrid, pendant les trois ans que je t’ai cottoyée, tu as été un tel soleil, de par ta fougue, ta gentillesse, et ton caractère si trempé, qu’il est difficile de t’oublier. Tantôt souriante, tantôt attendrissante quand tu parlais de Tristan et parfois si effrayante quand tu t’enflammais contre quelqu’un, tes rires resonneront encore longtemps contre les murs du labo. Mille mercis pour ce que tu es ! Surtout ne change pas… Julie, tu es la seule à m’avoir accompagné tout au long de ces quatre ans. D’abord intimidé par tes « Allo » si engageant, j’ai rapidement découvert derrière le masque, une fille extrêmement attachante et toujours prête à aider. Nos discussions, tant sur le Stade Toulousain que sur les derniers exploits d’un Ministre appelé à devenir Président à la place du Président, me manqueront. Merci également pour tes idées débordantes pour fêter le départ d’un des notres… idées qui m’ont tour à tour, mis dans la peau de Mitch, Travolta ou Charlie et ses drôles de dames. Enfin, comment oublier la petite Julie Ribot, mascotte de l’équipe et ambassadrice des pauses cafés-clopes. Même dans les moments difficiles, tu m’as toujours soutenu, écouté et je t’en remercie.
Place maintenant aux jeunes, à la relève du labo. Honneur à la première arrivée : Céline ! C’est maintenant toi la doyenne du labo, le pillier sur lequel compteront les futurs étudiants. Merci pour ton écoute, tes discussions souvent enflammées et ton entrain quotidien. A Lise, je t’ai refilé le bébé et espère qu’il t’e donnera autant de bonheur et de réussite qu’il m’en a apporté. Bon courage pour la suite et profite bien de ces quelques années de thèse : elles ont une saveur toute particulière. Clémence, nos chemins ne se sont malheureusement pas croisés très longtemps mais cela m’a suffit pour comprendre qu’un peu à l’image d’Ingrid, tu allais rapidement devenir la coqueluche de l’U563, grâce à ta sympathie et à ta bonne humeur quotidienne. Mais, j’ai également découvert que, comme elle, tu n’étais pas genre à te faire marcher sur les pieds. Entre toi, Lise et Céline, Joost a donc du souci à se faire. Peut-être en fait, devrais-je lui souhaiter à lui « Bon Courage ». Enfin, il est temps de boucler la boucle, celle-là même qui avait commencé quand Olive m’avait cédé sa place comme seul coq de la basse-cour et qui se termine aujourd’hui puisque je laisse Svet au milieu de ces filles. Cela peut faire peur de prime abord, mais tu verras : on y prend goût très vite. En tout cas, courage pour la suite de ton M2R !
REMERCIEMENTS
Je remercie également tous les membres de l’unité, les anciens comme les nouveaux, pour avoir partagé avec moi tant de bons moments pendant ces 4 longues années : Florie, Camille, Sabina, Loïc, Nico, Yovan, Delphine, Lucile, Audrey et Patrick de l’animalerie, Fatima, Dominique, notre super secrétaire, et Aline, notre deuxième mère. Une mention spéciale à Nicolas, mon talentueux partenaire de dance, à Sophie, la gentillesse incarnée, à Aurelie, la « people » de l’U563, à Julie Tabiasco, la pile électrique toujours prête à aider, et Michaël, l’animateur de nos repas de midi, qui, chacun dans son style, m’a beaucoup apporté.
Pour terminer, je remercie mes parents sans qui, je ne serais pas celui que je suis aujourd’hui et qui m’ont toujours soutenu ; mes amis qui depuis déjà 13 ans pour certains, me supportent et me permettent d’oublier les petits tracas de la vie. Enfin, si je devais une dernière fois utilisée la comparaison avec l’immunologie, je dirais qu’une cellule effectrice ne saurait exister sans sa contrepartie régulatrice, chacune étant le versant opposé de l’autre, unies en un tout... N’est-ce pas la définition de l’âme sœur ? Merci à toi Karine d’être ma cellule régulatrice, celle qui fait mon bonheur et mes peines et qui, comme moi, a subit la parfois difficile sélection thymique.
SOMMAIRE
Résumé……… 8
Liste des illustrations……… 10
Liste des abréviations………... 11
Introduction………...12
1ère Partie : Transplantation……… 13
A. Historique
B. Limites non immunologiques 1) Le manque de donneur 2) La mort cérébrale 3) Ischémie et reperfusion C. Limites immunologiques
1) Les alloantigènes
• Les antigènes majeurs d’histocompatibilité • Les antigènes mineurs d’histocompatibilité • Le système ABO
2) Les voies d’alloreconnaissance
• Voie d’alloreconnaissance directe • Voie d’alloreconnaissance indirecte • Voie d’alloreconnaissance semi-directe
3) Les mécanismes de rejet • Le rejet hyperaigu • Le rejet aigu • Le rejet chronique
D. Protocole d’inhibition du rejet
1) Drogues immunosuppressives • Inhibition de la prolifération • Glucocorticoïdes
• Déplétion/modulation des lymphocytes • Inhibition de la synthèse des cytokines • Blocage de la migration des cellules activées
2) Nouvelles stratégies thérapeutiques
• Induction de chimérisme hématopoïétique • Cellules dendritiques tolérogènes
SOMMAIRE
• Blocage des molécules de co-stimulation
2ème Partie : Tolérance………53
A. Tolérance centrale 1) La sélection positive 2) La sélection négative B. Tolérance périphérique 1) La tolérance passive • L’ignorance • L’anergie • La délétion • La déviation phénotypique 2) La tolérance active
• Les cellules dendritiques tolérogènes • Les lymphocytes NKT
• Les lymphocytes T CD8 régulateurs • Les lymphocytes Tr1
3ème Partie : Les lymphocytes T régulateurs……….67
A. Mise en évidence et caractérisation des Tregs 1) Mise en évidence des Tregs
2) Les premiers marqueurs 3) La découverte de Foxp3 4) Les nouveaux marqueurs
B. Origine, développement et homeostasie des Tregs 1) Origine thymique
2) Développement des Tregs 3) Homéostasie des Tregs C. Mécanismes de suppression
1) Déprivation cytokines 2) CTLA-4
3) Cytotoxicité directe
4) Cytokines immunsuppressives
D. Fonctions physiologiques et pathologiques 1) Prévention de l’auto-immunité
SOMMAIRE
2) Modulation des réponses anti-infectieuses 3) Inhibition de la réponse anti-tumorale 4) Tolérance foeto-maternelle
E. Potentiel clinique des Tregs
1) Pathologies auto-immunes et immuno-inflammatoires 2) Maladie du greffon contre l’hôte
3) Aide à la thérapie génique
Résultats………91 1) Article 2) Resultats préliminaires Discussions et perspectives………..106 Annexes………...122 Références bibliographiques………126
RESUME
Thibault Santolaria
INDUCTION DE TOLERANCE AUX ALLOGREFFES D’ORGANES SOLIDES PAR LES LYMPHOCYTES T REGULATEURS CD4+CD25+FOXP3+
Directeur de Thèse : Joost van Meerwijk Thèse soutenue à Toulouse, le 26 janvier 2009
La principale limite à la transplantation d’organe réside dans l’initiation d’une forte réponse immune dirigée contre le greffon. Si l’utilisation de drogues immunosuppressives a largement permis de contrôler l’apparition du rejet aigu, de nombreux patients souffrent d’un rejet chronique qui conduit inévitablement à la destruction de l’organe transplanté. L’induction d’une tolérance immunologique vis-à-vis des antigènes du greffon pourrait permettre de s’affranchir du rejet ainsi que de la nécessité d’un traitement à vie avec des drogues immunosuppressives. Une tolérance similaire existe déjà à l’état physiologique vis-à-vis des antigènes du soi. Elle est médiée en périphérie par une sous population lymphocytaire douée de propriétés immunosuppressives : les lymphocytes T régulateurs CD4+ CD25+.
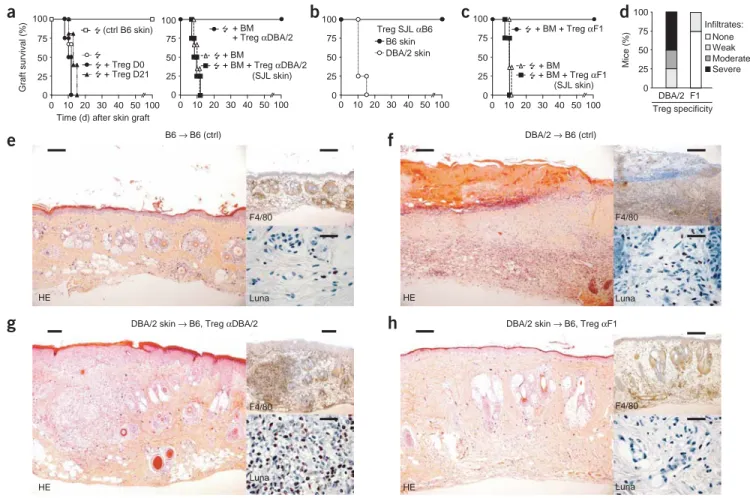
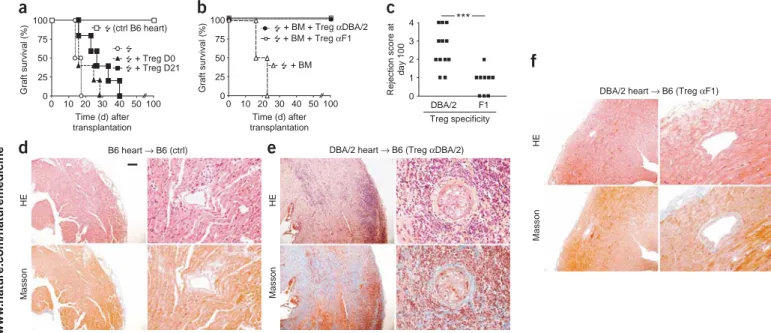
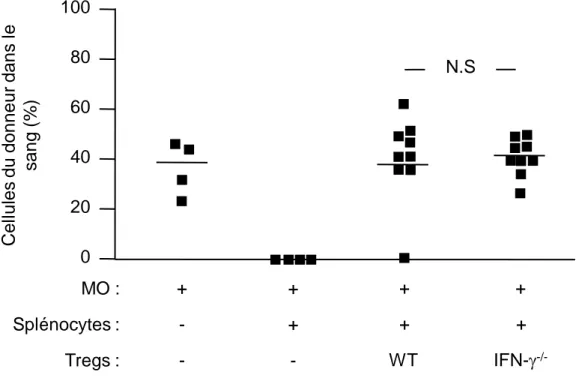
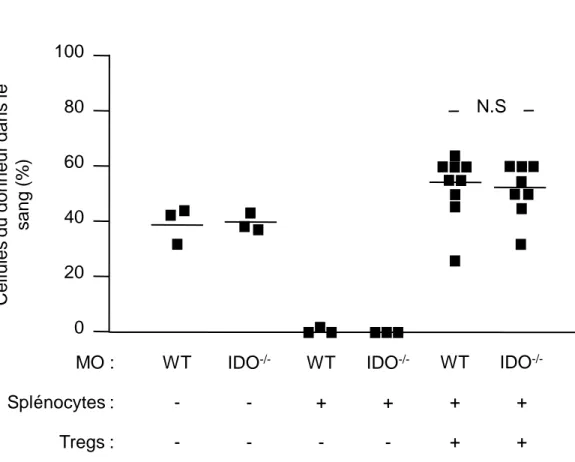
Lors de ce travail de thèse, j’ai pu montrer que, chez des souris irradiées à des doses cliniquement applicables, l’injection de cellules régulatrices CD4+CD25+Foxp3+ stimulées in vitro avec des alloantigens, induit une tolérance durable et spécifique vis-à-vis d’une greffe de moelle osseuse et, par la suite, de cœur ou de peau. Les Tregs spécifiques pour les antigènes présentés par la voie directe d’alloreconnaissance inhibent uniquement le développement du rejet aigu, en dépit de l’état de chimérisme induit. En revanche, des Tregs spécifiques pour les antigènes présentés par les voies directe et indirecte de reconnaissance préviennent l’apparition des phases de rejet aigu et chronique. Nos résultats démontrent ainsi le fort potentiel des Tregs, activés de manière appropriée, pour de futures approches de thérapie cellulaire, dans le but d’induire une tolérance durable aux greffes allogéniques.
Mots clés : lymphocytes T régulateurs, transplantation, mécanismes d’action
Discipline : Immunologie
Equipe Tolerance et Autoimmunité INSERM U563, Hôpital Purpan 31024 Toulouse cedex 3
ABSTRACT
Thibault Santolaria
INDUCTION OF TOLERANCE TO SOLID ALLOGRAFTS BY REGULATORY T CELLS CD4+CD25+FOXP3+
Thesis supervisor : Joost van Meerwijk Toulouse, Purpan Hospital, January 26th 2009
A major challenge in transplantation medicine is controlling the very strong immune responses to foreign antigens that are responsible for graft rejection. Although immunosuppressive drugs efficiently inhibit acute graft rejection, a substantial proportion of patients suffer chronic rejection that ultimately leads to functional loss of the graft. Induction of immunological tolerance to transplants would avoid rejection and the need for lifelong treatment with immunosuppressive drugs. Tolerance to self-antigens is ensured naturally by several mechanisms ; one major mechanism depends on the activity of regulatory T lymphocytes.
We showed that in mice treated with clinically acceptable levels of irradiation, regulatory CD4+CD25+Foxp3+ T cells stimulated in vitro with alloantigens induced long-term tolerance to bone marrow and subsequent skin and cardiac allografts. Regulatory T cells specific for directly presented donor antigens prevented only acute rejection, despite hematopoietic chimerism. By contrast, regulatory T cells specific for both directly and indirectly presented alloantigens prevented both acute and chronic rejection. Our findings demonstrate the potential of appropriately stimulated regulatory T cells for future cell-based therapeutic approaches to induce lifelong mmunological tolerance to allogeneic transplants.
Keywords : regulatory T cells, transplantation, mechanisms
Discipline : Immunology
Tolerance and Autoimmunity team INSERM U563, Hôpital Purpan 31024 Toulouse cedex 3
LISTE DES ILLUSTRATIONS
Figure 1 : Deux modèles permettent d’expliquer la forte fréquence de cellules alloréactives
Figure 2 : Les trois voies d’alloreconnaissance dans la transplantation
Figure 3 : La découverte des agents immunosuppresseurs en transplantation Figure 4 : Les cibles moléculaires des différentes drogues
immuno-suppressives
Figure 5 : Démonstration par Billingham en 1953 de « l’acquisition active de tolérance » vis-à-vis d’alloantigènes
Figure 6 : Génération de cellules dendritiques tolérogènes in vitro Figure 7 : Les mécanismes de tolérance centrale
Figure 8 : Les mécanismes passifs de tolérance périphériques Figure 9 : Les différents marqueurs des Tregs et leur découverte Figure 10 : Les mécanismes effecteurs des Tregs
LISTE DES ABREVIATIONS
AIRE : autoimmune regulator
APECED : autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy B6 : C57BL/6
CD : cellule dendritique
CMH : complexe majeur d’Histocompatibilité CPA : cellule présentatrice d’antigène cTEC : cortical thymic epithelial cell
CTLA-4 : cytotoxic T-lymphocyte antigen 4 DN : double négatif
DP : double positif
EAE : encéphalite autoimmune expérimentale Foxp3 : forkhead box p3
GITR : glucocorticoid-induced TNF receptor family-related gene IDO : indoléamine 2,3-dioxygénése
IFN : interferon Ig : immunoglobuline IL : interleukine
iNKT : invariant natural killer T cell
IPEX : immune dysregulation polyendocrinopathy enteropathy and X-linked
syndrome
LT : lymphocyte T
mTEC : medullary thymic epithelial cell mTOR : mammalian target of rapamycin NFκκκκB : nuclear factor-kappa B
NK : natural killer
NOD : non-obese diabetic PD-L1 : program death ligand 1 RAG : recombination activation gene Scid : severe combined immunodeficiency SP : simple positif
STAT : signal transducer and activator of transcription TCR : T cell receptor
TGF : transforming growth factor Th : T helper
TNF : tumor necrosis factor Treg : lymphocyte T régulateur
INTRODUCTION
INTRODUCTION
INTRODUCTION
INTRODUCTION
TRANSPLANTATION
A. HISTORIQUE
« Simple curiosité opératoire aujourd'hui, la transplantation d'un organe pourra peut-être un jour avoir un certain intérêt pratique » Alexis Carrel, Prix Nobel de Médecine 1912.
• Les premières expériences
L’Histoire de la Transplantation est particulièrement riche en témoignages écrits, remontants pour certains aussi loin que l’Empire Romain et rapportant diverses tentatives de greffe de tissu. La Bible en est ainsi largement pourvoyeuse : le Christ remet en place l'oreille du soldat mutilé par Saint Pierre, Saint Antoine de Padoue procède à la réimplantation d'un pied, Saint Pierre fait de même avec les Seins de Sainte Agathe, tranchés par un romain. Quoique sans aucun fondement scientifique, ces récits illustrent parfaitement la fascination de l’Homme pour la transplantation.
Au fil des âges, cette fascination va s’affirmer et, profitant des premières dissections aux XVème et XVIème siècles, connaît un nouvel essor. Gaspare Tagliacozzi, un des pères de la chirurgie plastique, utilise ainsi la peau du bras d’un homme pour réparer son nez arraché par un chien, réalisant ainsi la première autogreffe avérée. Un siècle plus tard, en 1668, Job van Meeneren décrit minutieusement comment il a consolidé le crâne d’un soldat blessé en utilisant les os d’un chien. Malheureusement, ces différentes tentatives n’ont pour fonction que de soigner un cas isolé et ne font en rien progresser la discipline. Ce n’est qu’en 1744 avec les débuts des expériences de greffes chez l’animal, réalisées par Abraham Trembley que la transplantation, jusqu’alors simple curiosité chirurgicale, passe par une démarche scientifique. Grâce à elles, de nouvelles techniques sont découvertes et permettent à Berger de les appliquer en retour chez l’Homme lors d’autogreffes de peau. Enfin, en 1869, Jacques-Louis Reverdin s’illustre à son tour en réalisant la première allogreffe de peau et donne ainsi son nom à une procédure chirurgicale.
• Amélioration des techniques
Néanmoins, si les tentatives de greffes d’organes, autres que la peau, sur des animaux se multiplient, leurs résultats ne permettent toujours pas d’envisager de les étendre à l’homme. Une des difficultés majeures concerne en effet l’incapacité des chirurgiens de l’époque à suturer de façon durable les vaisseaux sanguins des
organes transplantés à ceux des receveurs. Il faut attendre 1906 pour que Mathieu Jaloubay, un médecin lyonnais spécialisé en chirurgie vasculaire, mette au point une telle technique. Il l'applique dès lors à la transplantation, en greffant un rein de porc au pli du coude d’une femme atteinte d'insuffisance. Pourtant, cela ne suffit pas à empêcher le rejet rapide de l’organe. Ce n’est finalement qu’après la mise au point des techniques de suture vasculaire (1), qui vaudront le Prix Nobel de Médecine en 1912 à Alexis Carrel, que la transplantation d’organe entre enfin dans l’ère moderne.
• Découvertes des antigènes HLA
Pourtant, si de part le monde, de nombreux investigateurs parviennent à reproduire et à simplifier l’allotransplantation des deux reins réussie par le Docteur Carrel, aucune avancée majeure ne parvient à prolonger la survie des organes greffés. Il devient donc rapidement évident que d’autres phénomènes entrent en jeu et sont responsables des échecs systématiques des différentes tentatives de transplantation. En 1933, le Russe Serguey Voronoy est le premier à proposer une autre cause que l’imperfection des techniques chirurgicales : le rejet est un événement immunologique. Pour le prouver, il décide de réaliser la première homotransplantation, en greffant un rein provenant d’un homme de 60 ans décédé chez une jeune femme de 26 ans : il espère ainsi s’affranchir du rejet de greffe. Quatre jours après l’intervention, la patiente décède mais l’idée de Voronoy va révolutionner l’approche de la communauté scientifique.
S'ensuit une longue période de latence ; le contexte mondial n'est guère propice aux recherches. Il faut attendre l'après-guerre pour que les travaux reprennent. En 1952, l’équipe de Jean Hamburger réalise une avancée sans précédent : un jeune patient, Marius Renard, reçoit dans l’urgence le rein de sa mère. Contre toute attente, le patient survit 21 jours (2). Deux ans plus tard, la totale réussite d’une transplantation rénale entre deux jumeaux identiques, sous la direction de Merrill et Murray à Boston (3), vient corroborer ces résultats. Le rôle de certains facteurs génétiques est alors supposé. En 1958, les travaux de Jean Dausset et de son équipe mettent à jour l’existence d’une « empreinte génétique » sous formes de marqueurs cellulaires, qui, à l’image des empreintes digitales, sont propres à chaque individu. Il s’agit des groupes d’antigènes HLA (« Human Leucocyte Antigen »). Quelques années plus tôt, leurs homologues murins (système H-2) avaient déjà été mis en évidence par Peter Gorer et George Snell. Toutefois, si ces découvertes majeures jettent les bases de l’histocompatibilité, elles confirment que l’application en clinique humaine de la transplantation ne sera possible que si la composante immunologique est contournée.
• L’immunosuppression
Les recherches se concentrent donc sur l'immunosuppression. Plusieurs méthodes sont expérimentées, à commencer par l'irradiation totale. En 1959, des équipes à Boston et Paris réussissent les premières greffes rénales entre faux jumeaux. Des séances d'irradiation totale et un traitement par corticoïdes ont permis d'affaiblir suffisamment le système immunitaire du patient pour qu'il n'y ait pas de rejet. Parallèlement, à Richmond, l'Américain David Hume réalise la première greffe avec immunosuppression à partir d'un rein de donneur décédé.
Les réussites s'enchaînent alors, principalement sur la greffe rénale. Après avoir mis au point les premières techniques d’immunosuppression, ils cherchent désormais à élargir la greffe à d’autres organes que le rein. Mais si ce dernier, organe pair, permet la greffe à partir d’un donneur vivant et a une durée de vie plus longue hors du corps, ce n’est pas le cas des autres organes. De plus, après quelques expérimentations, les équipes médicales constatent rapidement qu’un organe prélevé chez un donneur décédé après arrêt circulatoire, s’altère très rapidement, limitant grandement son intérêt en transplantation.
• La mort cérébrale
En 1959, l'école neurologique parisienne décrit l'état de mort cérébrale ouvrant ainsi de nouveaux horizons en termes de prélèvement à cœur battant. Les travaux de Mollaret et Goulon (4) sont publiés. C’est à eux que l’on doit l’expression de « coma dépassé » qui sera remplacé plus tard par la notion plus juste de mort cérébrale. Cependant la question se pose : « A quel moment, ces patients en mort encéphalique peuvent-ils être considérés comme décédés? » La lecture du tracé des encéphalogrammes apporte une réponse claire et ouvre désormais la voie au prélèvement d’organes sur un cadavre : le rein en 1963 par les équipes de Guy Alexandre en Belgique et Jean Hamburger en 1964 ; le foie en 1963 puis 1967 à Denver par Thomas Starzl ; les poumons en 1963 sous la direction de James Hardy ; le pancréas dès 1966. Si aucune de ces « premières » n’a été médiatisée à l’époque, il en va différemment de la première greffe cardiaque. Bénéficiant des travaux de Norman Shumway à San Francisco, le 3 décembre 1967, le professeur Christian Barnard, au Cap, en Afrique du Sud, étonne le monde par la première greffe de l'organe le plus symbolique : le cœur (5). Son second opéré, un blanc, survivra grâce au cœur d’un métis. Dans l’Afrique du Sud des années 60, le symbole est fort.
• La découverte de la Cyclosporine
Pourtant, malgré toutes ses « premières », la transplantation humaine connait une période de transition durant les années 70 : les nombreuses contraintes techniques, la lourdeur des traitements immunosuppresseurs et les échecs fréquents ont eu raison de l’enthousiasme des précédentes décennies. Il faut attendre le 9 mars 1980 pour que l’utilisation d’une nouvelle molécule révolutionnaire, la Cyclosporine, utilisée comme immunosuppresseur lors d’une greffe de foie par le Dr Starzl, éveille de nouveaux espoirs (6). En quelques années, le taux de survie des greffons à cinq ans passe de 40 à 75%. L’avenir de la transplantation est dès lors assuré.
Depuis, d’autres traitements immunosuppresseurs, plus efficaces encore, ont été découverts, permettant l’amélioration constante des chances de survie des patients. Cependant, la transplantation souffre encore de nombreuses limites.
B. LIMITES NON IMMUNOLOGIQUES
Pendant plusieurs siècles, la recherche s’est donc focalisée sur l’amélioration des techniques chirurgicales puis sur la compréhension de la physiopathologie des mécanismes de rejet et sur les moyens à mettre en œuvre afin de les contrôler. Les différentes avancées majeures ont ainsi occulté l’existence de nombreuses restrictions, non immunologiques, qui limitent encore aujourd’hui le recours et/ou le succès de cette solution thérapeutique. Elles sont notamment liées à l’appréhension du don d’organe dans nos sociétés, à l’origine des greffons et aux altérations subies par les organes avant même leur implantation chez le receveur.
1. LE MANQUE DE DONNEUR
En 2007, 13081 patients nécessitaient une greffe en France. Parmi eux, seuls 4666 organes étaient greffés. 360 d’entre eux trouvèrent la mort cette année-là (Source EFG). Ainsi, le nombre de receveurs potentiels et de donneur n’ont cessé de progressivement diverger, provoquant un allongement constant des listes d’attentes (6348 patients en attente au 1er janvier 2002 ; 7307 en 2007). La raison en est le sentiment ambivalent qui nait du don d’organe : plaisir d’assurer la vie d’autrui et crainte pour le non-respect de sa propre mort. Au début des années 90, cette dernière perception a pris le pas sur la générosité. Entre 1991 et 1996, le nombre de greffes réalisées a chuté de 23% ! Ceci a conduit la communauté scientifique à développer des méthodes adéquates de prélèvement afin d’optimaliser et d’augmenter le nombre d’organes mis à disposition pour la transplantation. Depuis, de nombreuses campagnes de sensibilisation ainsi qu’un cadre légal favorable ont permis d’inverser cette tendance.
En effet, quand en 1952, Jean Hamburger réalise la première transplantation rénale française à partir d’un donneur vivant, aucune législation ne prévoyait les prélèvements in vivo. Les chirurgiens se trouvaient alors menacés par une autre loi qui les faisait tomber sous le coup de « l’atteinte au corps de la personne ». De même quand, en 1959, la mort cérébrale est décrite, elle n’a aucune valeur légale, obligeant les médecins et scientifiques de l’époque à opérer dans l’illégalité jusqu’à sa reconnaissance officielle en 1968 par une circulaire parue au journal officiel. Dès lors, la « tradition » veut que l’avis de la famille soit consulté avant tout prélèvement mais ceci entraine de très nombreux refus, en particulier quand il s’agit du cœur.
Pour remédier à cela, la Loi Caillavet est promulguée le 2 décembre 1976. Elle y autorise le prélèvement d’organe à partir d’un donneur vivant ou en mort cérébrale « confirmée » et instaure pour la première fois, le concept de consentement présumé. Elle sera ensuite reprise par la loi n°94-654 du 29 juillet 1994 relative au don et à l’utilisation des éléments et produits du corps humain, elle-même complétée par les Lois de Bioéthique du 6 aout 2004. Quatre principes éthiques sont ainsi établis : le consentement, la gratuité du don, l’anonymat entre le donneur et le receveur et l’interdiction de publicité en faveur d’une personne ou d’un organisme déterminé. La notion de consentement présumé prévoit que « des prélèvements peuvent être effectués à des fins thérapeutiques ou scientifiques sur le cadavre d’une personne n’ayant pas fait connaître de son vivant son refus d’un tel prélèvement ». Pour recueillir les éventuels désaccords, un Registre National des Refus est créé en 1997 et est placé sous la responsabilité de l’Etablissement Français des Greffes. Toutefois, la consultation de la famille est fortement encouragée dans les cas où le défunt n’aurait pas clairement exprimé son opinion de son vivant. La loi de 1994 interdit toute rémunération du don d’organes ou de tissus qu’elle définit comme « un acte de générosité entièrement gratuit ». Elle affirme également le principe de l’anonymat : l’identité du donneur ne peut être révélée à la famille du défunt, et inversement afin d’éviter une relation délicate entre la famille du donneur et celle du receveur, de faciliter le deuil de la famille du donneur ainsi que la convalescence du malade vivant avec l’organe ou le tissus d’un autre. La famille du donneur peut toutefois être informée des résultats des greffes par les équipes médicales. Enfin, la publicité en faveur d’un don d’éléments ou de produits du corps humain est interdite tandis que l’information du public est encouragée. La sensibilisation de la population par des campagnes d’information a ainsi permis une augmentation du nombre de donneurs pendant les années 2000. Pourtant, si aujourd’hui 82% des français se disent favorables au don de leurs propres organes, seuls 40% ont fait part de leur position à leurs proches…
2. LA MORT CEREBRALE
La mort fut traditionnellement définie par l'arrêt de toutes les fonctions organiques et plus particulièrement de la respiration et de l'automatisme cardiaque.
Depuis l'avènement des méthodes médicales de réanimation permettant de faire reprendre ces activités après leur suspension, ainsi que le maintien artificiel de la ventilation et de la circulation sanguine par l'appareillage médical, une définition, médicale et juridique, plus précise devint nécessaire.
Décrit dès 1959, le concept de « mort cérébrale » implique une destruction totale du tronc cérébral et donc, à court terme, de l’organisme entier. Extrêmement rare (2.000 décès sur 500.000 chaque année en France), cet état ne doit pas être confondu avec certains comas profonds n’entrainant pas la mort et au cours duquel le cerveau n’est que partiellement endommagé. Selon la Loi, le diagnostic ne peut être réalisé que par deux médecins qualifiés, non impliqués dans une activité de transplantation et indépendant du donneur et/ou du receveur. Il requiert un examen clinique complet mettant en évidence trois critères indispensables à la déclaration de mort cérébrale : l’absence de conscience, de reflexes du tronc cérébral et de ventilation spontanée. En complément, la destruction totale et définitive du cerveau doit être confirmée par deux encéphalogrammes nuls et aréactifs effectués à un intervalle minimal de quatre heures ou par artériographie objectivant l'arrêt complet de la circulation encéphalique.
Les activités cardiaque et respiratoire pouvant être maintenues artificiellement, la mort encéphalique a permis aux médecins et scientifiques d’obtenir des greffons d’excellente qualité. Cependant, malgré un cadre juridique favorable et de nombreuses campagnes d’informations, la moitié des cas en France n’est pas prélevée (dont 2/3 sont liés à un refus). De plus, il a été suggéré, dès les années 90, que l’état de mort cérébrale pouvait avoir un impact sur la qualité des organes périphériques. Ainsi, diverses données expérimentales et cliniques ont montré que la fonctionnalité et la survie des organes prélevés chez des individus vivants sont supérieures à celles observées avec des donneurs cadavériques (7, 8).
Une des explications vient de l’origine même du décès. En effet, la mort cérébrale est généralement provoquée par un violent traumatisme, une hémorragie ou une tumeur, provoquant ainsi une hypoxie et/ou une augmentation sévère de la pression intracrânienne. En réponse, l’organisme diminue le débit et la fréquence cardiaque. Le cerveau, sous-alimenté et sous-oxygéné, active alors des mécanismes compensatoires. Cette réaction, appelée « reflexe de Cushing », se traduit par une libération massive et systématique de catécholamines par la médullosurrénale (9) et une sécrétion locale de noradrénaline et neuropeptide Y, par les terminaisons nerveuses sympathiques intramyocardiques (10). Sous l’effet de ces médiateurs, la fréquence et le débit cardiaque augmentent fortement. Cet emballement, conjugué aux propriétés vasoconstrictrices de la noradrénaline et du Neuropeptide Y, aboutit à une dérégulation de la balance entre apport et consommation en oxygène du cœur. Celui-ci entre alors en situation d’ischémie et modifie en conséquence son métabolisme en passant en anaérobie (11). La pression artérielle s’élève inexorablement avant d’atteindre un plateau et de se stabiliser. La déplétion des catécholamines et des substances vasoactives ainsi que la production d’espèces actives d’oxygène (ROS) par les cellules tuées ou stressées (12, 13), entraine alors la diminution de la résistance vasculaire systémique et l’hypotension. Le cœur diminue sa force et sa fréquence de contraction à des valeurs proches de la normale.
L’effet délétère de cet emballement sur la qualité du tissu cardiaque a été établi par différents groupes. Dans des cœurs de babouins, prélevés 12 heures après la mort, ils ont observé des lésions au niveau des tissus conducteurs, des cellules musculaires lisses des artères coronaires et des cardiomyocytes. Il a été suggéré que les catécholamines pourraient jouer un rôle majeur dans cette dégradation, notamment en induisant des spasmes microvasculaires (13, 14).
Le tissu cardiaque n’est cependant pas le seul à être altéré lors d’une mort encéphalique. Les reins ou les poumons sont également affectés par la vasoconstriction, l’ischémie et par une dérégulation de la balance hormonale. De plus, l’équipe de Tilney a montré dans le cœur, les reins et le sang périphérique de donneurs cadavériques, des niveaux anormalement élevés de médiateurs pro-inflammatoires (8, 15).
3. L’ISCHEMIE ET LA REPERFUSION
Une fois l’organe prélevé, il est maintenu stérile dans un environnement à basse température, en présence d’un milieu isotonique, puis est transporté jusqu’au receveur. Tout au long de cette étape pouvant durer jusqu’à plusieurs heures, les tissus sont privés d’oxygène et de nutriment tandis que les déchets cellulaires ne sont plus éliminés : c’est l’ischémie. Cette situation particulièrement stressante provoque au niveau de l’organe une accumulation de métabolites toxiques (16) ainsi que des altérations biochimiques au niveau cellulaire.
L’absence d’oxygène limite le métabolisme oxydatif et accentue la glycolyse anaérobie. Ceci conduit à la production de ROS et d’acide urique, à l’accumulation rapide d’acide lactique, qui diminue le pH intracellulaire, et donc à l’activation d’enzymes lytiques. De plus, cette voie métabolique n’est que peu productrice d’énergie, entraînant à court terme une diminution des stocks d’ATP et l’arrêt de nombreuses fonctions cellulaires. Le dysfonctionnement de la pompe Na/K ATPase, notamment, perturbe l’homéostasie des électrolytes (K, Ca, Fe) et ainsi exacerbe l’activité des phospholipases et des protéases. Enfin, la fixation des métaux sur leur protéine de transport (transferrine, ferritine) est également inhibée. L’augmentation de la concentration intracellulaire en fer libre qui en résulte catalyse la génération de radicaux oxygénés (17) qui permettront à leur tour la production d’autres espèces actives d’oxygène telles que l’oxyde nitrique. L’équipe de Nori a ainsi mis en évidence l’implication de cette molécule dans l’altération des organes greffés, en montrant que l’inhibition in vivo de l’enzyme responsable de sa production (NO synthase) protège les reins des effets néfastes de l’ischémie (18).
Une fois l’organe réimplanté, l’étape de reperfusion va permettre son réchauffement, sa réoxygénation, un retour à un métabolisme aérobie et donc à la production massive d’ATP. Cependant, des quantités importantes de ROS vont aussi être produites (17, 19). La réaction entre l’anion superoxyde et le peroxyde d’hydrogène va permettre la génération du radical hydroxyle. Cette molécule, hautement réactive et cytotoxique, va induire la peroxydation des membranes
lipidiques (17). L’intensité du stress oxydatif va largement dépasser les mécanismes de régulation et permettre une accumulation de ROS qui induiront la mort par apoptose des cellules présentes dans l’environnement (20).
L’ischémie et la reperfusion de l’organe entrainent donc une destruction tissulaire plus ou moins importante. Celle-ci, même limitée, permet le relargage de nombreuses molécules toxiques et de facteurs de stress, à même d’entrainer un état inflammatoire important.
Ainsi, des études réalisées sur le foie, le cerveau, le myocarde ou les reins ont montré que l’expression d’ICAM1 et VCAM est augmentée à la surface des cellules endothéliales. Ces deux molécules jouent un rôle crucial dans le recrutement des leucocytes dans les tissus. Au moment de la transplantation, l’entrée des cellules du système immunitaire du receveur au sein du greffon n’en sera que favorisée. De plus, l’altération tissulaire liée à la production de ROS conduit à la production de molécules chimioattractantes, telles l’IL-8 ou ELR-CXC, qui favorisent le recrutement rapide et massif des neutrophiles qui entretiendront à leur tour le processus inflammatoire. Enfin, les protéines de choc thermique, telles HSP60, libérées dans le tissu lésé, pourraient aussi avoir un rôle majeur sur les fibroblastes et les cellules musculaires lisses contenus dans la paroi des vaisseaux. En induisant leur prolifération et leur sécrétion de matrice extracellulaire, ces molécules pourraient notamment participer au développement de vasculopathies caractéristiques des épisodes de rejet chronique.
Toutefois, grâce à la mise en lumière de ces mécanismes, de nombreuses cibles thérapeutiques ont ainsi pu être identifiées et la recherche a permis d’améliorer la qualité des liquides de conservation. Ainsi, de nombreux composés actifs sont ajoutés afin d’inhiber l’hypertrophie cellulaire, de contrôler l’homéostasie du calcium, de diminuer la génération des ROS et de fournir à l’organe des substrats hautement énergétiques. Il a également été montré que le conditionnement du receveur pouvait prévenir certaines complications. L’ajout de mannitol ou d’autres molécules anti-oxydantes, permet ainsi de prévenir au maximum la destruction cellulaire liée à la production des ROS. D’autres molécules visant à augmenter la vasodilatation ou à réduire la peroxydation lipidique (inhibiteurs des canaux calciques) sont aussi utilisées, notamment dans le cas d’allogreffes rénales. Enfin, l’utilisation de traitements anti-inflammatoires puissants a été associée à une augmentation de la survie et de la fonctionnalité des organes greffés.
C. LIMITES IMMUNOLOGIQUES
Les siècles précédents ont ainsi permis à la transplantation de progresser tant du point de vue des techniques chirurgicales que de la compréhension des mécanismes responsables de l’altération des organes avant la greffe. Pourtant, malgré des progrès évidents, il a fallut attendre la fin des années 50 et l’utilisation de
protocoles immunosuppresseurs expérimentaux pour que les premières greffes entre deux individus génétiquement différents fonctionnent. Par la suite, l’amélioration de ces traitements n’a toutefois pas réussi à vaincre la dernière limite à cette stratégie thérapeutique ambitieuse : l’activation du système immunitaire du receveur, conduisant à l’élimination plus ou moins rapide des tissus greffés.
1. LES ALLOANTIGENES
De nombreuses molécules, exprimées par les cellules du greffon, sont susceptibles de conduire à l’activation du système immunitaire du receveur : les alloantigènes. Ceux-ci peuvent varier par leur distribution tissulaire, leur structure ou leurs fonctions physiologiques. Toutefois, trois types d’antigènes sont particulièrement impliqués : les antigènes majeurs d’histocompatibilité, les antigènes mineurs d’histocompatibilité et le système antigénique ABO
• Les antigènes majeurs d’Histocompatibilité
Les molécules du complexe majeur d’histocompatibilité (CMH) constituent la principale cible du système immunitaire lors du rejet de greffe. Mises en évidence dès 1936 à la suite de nombreuses études à partir de souris congéniques, elles sont codées par un ensemble de gênes situés sur le chromosome 6 chez l’homme et 17 chez la souris. Cette région comprend ainsi différents loci, classés en gènes de classe I (HLA- A, B et C chez l’Homme ; H-2K, D et L chez la souris) et de classe II (HLA-DP, DQ et DR chez l’Homme ; I-A et I-E chez la souris).
Les molécules de CMH de classe I sont exprimées de manière constitutive à la surface de toutes les cellules nucléées. Ces glycoprotéines sont composées d’une chaîne α polymorphe à trois domaines, associée de façon non covalente à la β 2-microglobuline. Leur fonction consiste à présenter à la surface des cellules des fragments peptidiques dérivés de protéines endogènes. Ainsi en reflétant en permanence une image du contenu intracellulaire, elles permettent au système immunitaire de détecter des situations pathologiques, telles une infection virale ou les processus de cancérisation. Une exception à cette définition est apportée par les cellules dendritiques qui possèdent la capacité de présenter des peptides exogènes dans le contexte du CMH de classe I, ceci afin de permettre l’activation des lymphocytes T CD8+ vis-à-vis d’antigènes viraux non portés par la CPA : c’est la présentation croisée (21).
Ces molécules associées à leur peptide peuvent être reconnues et permettre l’activation des lymphocytes T CD8+ via leur TCR. Mais elles peuvent également réguler l’activation des cellules NK. Ainsi, une expression anormale des molécules de CMH de classe I, due par exemple à une infection virale ou à un stress important, conduira à l’activation des cellules NK et in fine à la destruction de la cible.
Les molécules de CMH de classe II sont, elles, formées par l’assemblage de deux chaines polymorphes α et β. Elles sont impliquées dans la présentation des antigènes exogènes ou membranaires et permettent l’activation des lymphocytes T CD4+. Leur expression est, contrairement aux molécules de CMH de classe I, bien plus restreinte, limitée principalement aux cellules présentatrices d’antigènes (cellules dendritiques, macrophages, lymphocytes B) et aux cellules épithéliales thymiques. Toutefois, sous l’influence de certaines cytokines comme l’IFN-γ, elles peuvent également être retrouvées à la surface des cellules endothéliales vasculaires.
Ainsi, si les molécules de CMH de classe I et II diffèrent par leur profil d’expression et leur structure, elles partagent une origine polygénique complexe, sont hautement polymorphes et répondent à une expression co-dominante de leurs gènes. Ceci leur permet ainsi d’augmenter les chances de survie de chaque individu face aux agressions extérieures mais posent à contrario un problème majeur en transplantation puisqu’elles réduisent fortement les probabilités d’histocompatibilité entre donneur et receveur.
• Les antigènes mineurs d’Histocompatibilité
Les antigènes mineurs d’histocompatibilité regroupent l’ensemble des molécules, différentes des antigènes du CMH de classe I et II, susceptibles d’induire l’activation de lymphocytes T allospécifiques et ainsi, d’amener au rejet d’une greffe. Le plus souvent de nature peptidique, il a été montré qu’ils pouvaient provenir non seulement de glycoprotéines membranaires, comme cela avait été initialement suggéré, mais également de protéines intracellulaires, telles que des facteurs de transcription ou la myosine. Ils trouvent leur origine dans les nombreuses variations géniques propres à chaque espèce et se traduisent par des peptides différents présentés aux cellules T par le biais des molécules de CMH (22, 23).
Ils peuvent être codés par des chromosomes autosomaux comme c’est le cas pour la myosine ou la β2-microglobuline, par le chromosome Y ou l’ADN mitochondrial (24). Les antigènes mâles HY constituent ainsi l’un des exemples d’antigènes mineurs les mieux caractérisés. Ils n’ont une relevance que lorsqu’un tissu mâle est greffé chez une femelle histocompatible. Les femelles ne possédant pas le chromosome Y, leur système immunitaire voit les peptides, dérivés de gènes codés par l’Y (Hya, Sry, Uty, Smcy, Ube1y) et présentés naturellement par le CMH, comme étrangers (25). Néanmoins, cette immunogénicité des antigènes de mâles
n’est pas due à une simple présence/absence. En effet, tous les gènes, présents sur le chromosome Y et susceptibles de coder pour un antigène mineur, possèdent leur paralogue sur le chromosome X. Cependant, il a souvent des divergences importantes dans les séquences des paralogues et ce sont ces nombreuses différences qui sont vues par le système immunitaire femelle comme étranger (26). Ces antigènes sont donc capable d’induire l’activation des lymphocytes T CD4 et CD8 alloréactifs et ainsi d’entrainer le rejet d’un tissu greffé entre individu mâle et femelle histocompatible (27). En revanche, ils ne déclenchent pas de réponse humorale détectable. Ces différences mâle/femelle sont d’autant plus importantes chez la souris, où les lignées consanguines ont permis d’en étudier longuement les implications.
Chez la souris, environ 720 loci codent ainsi pour des antigènes mineurs potentiels (28). Cependant, lorsque des greffes sont réalisées entre souris partageant les mêmes haplotypes du CMH mais génétiquement différentes, par exemple entre des souris de même haplotype, la réponse semble se limiter à un petit nombre de peptides dits immunodominants, en dépit d’une multitude de différence d’antigènes mineurs (29, 30). Des évidences suggèrent que ces peptides sont associés aux molécules de CMH avec une affinité supérieure et que ces complexes CMH/peptide sont exprimés à des niveaux élevés à la surface cellulaire. L’interaction CMH-peptide-TCR n’en est qu’optimisée et les réponses à leur encontre sont alors plus fortes.
• Le système ABO
Ce système d’antigènes, découvert en 1900 par Karl Landsteiner, n’entre pas dans la définition des antigènes mineurs, étant incapable d’activer les lymphocytes T. Son importance ne doit toutefois pas être sous-estimée.
Les déterminants antigéniques du système ABO sont des oligosaccharides présents à la surface de différents types cellulaires et notamment par les érythrocytes et par l’endothélium vasculaire, interface importante entre le greffon et l’hôte. Le gène « ABO », situé sur le chromosome 9 chez l’Homme, code pour une glycotransférase de type A ou B, ces deux formes ne différant que par quatre substitutions d’acides aminés. Dans le cas de l’allèle O, une délétion d’un acide aminé dans l’exon 6 est à l’origine d’un codon stop et conduit à la synthèse d’une protéine tronquée inactive (31, 32). Ces glycosylations différentielles modifient la substance H et définissent ainsi les quatre groupes sanguins connus (A, B, AB, O).
Durant les premières années de leur vie, les individus immunocompétents du groupe O produisent des anticorps contre les antigènes des groupes sanguins manquants : anti-A et anti-B (33). Il a été supposé que ces anticorps préformés, en majorité des IgM, sont produits par sensibilisation à des substances environnementales comme la nourriture, des bactéries ou des virus. Ces anticorps
constituent une barrière immunologique très efficace contre la transfusion et la transplantation d’organe entre individus de groupes sanguins différents. Ainsi, lors d’une greffe d’organe solide d’un donneur de type A et/ou B chez un receveur de type O, l’endothélium du greffon sera le premier, la cible des anticorps préformés (34) et nouvellement synthétisés, entrainant un rejet hyperaigu. Cependant, depuis de nombreuses années, afin de faire face à la raréfaction des organes disponibles, de nombreuses équipes ont, avec succès, réalisé des transplantations rénales de donneur ABO-incompatible en utilisant des protocoles visant à diminuer les anticorps anti-donneur A/B chez le receveur (plasmaphérèse, élimination des cellules B, ex
vivo immunoadsorption) (35). Chez ces patients, la survie du greffon est alors
comparable à celle obtenue lors d’une greffe entre personne de même groupe sanguin (36).
2. LES VOIES D’ALLORECONNAISSANCE
L’activation du système immunitaire du receveur à lieu au niveau des nœuds lymphatiques drainants la greffe. Là, les lymphocytes T alloréactifs naïfs pourront être activés selon deux voies principales d’activation.
• Voie de reconnaissance directe
La voie de reconnaissance directe implique une interaction entre le TCR des lymphocytes T et les molécules de CMH allogéniques intactes à la surface des CPAs (Cellules dendritiques, cellules endothéliales, etc.) du donneur.
La mise en évidence de cette voie s’appuie sur différentes observations. Ainsi,
in vitro, une prolifération intense des lymphocytes T peut être observée lorsqu’ils sont
mis en contact avec des cellules présentatrices d’antigènes (CPAs) irradiées. Cette réponse rapide et forte correspond à celle observée in vivo lors du rejet aigu d’un organe.
Diverses stratégies de déplétion des CPAs de l’organe greffé sont venues conforter cette observation. Lafferty a ainsi montré que la survie d’une greffe allogénique de thyroïde, dont les CPAs ont été éliminées avant transplantation, est prolongée de façon significative par rapport à celle d’un greffon non manipulé (37). De même, lors d’une greffe de moelle osseuse, la maladie du greffon contre l’hôte (Graft versus Host Disease, GvHD) peut être prévenue par l’inactivation des CPAs de l’hôte (38). Lechler, pour sa part, a observé, dans un modèle de rat, qu’en pré-transplantant un rein semi-allogénique dans un hôte intermédiaire, sous traitement immunosuppresseur, avant de le greffer à son hôte final quatre semaines plus tard, le greffon était durablement accepté (>100 jours). Dans ces conditions, l’injection de quelques milliers de cellules dendritiques du donneur chez le receveur final suffit à
restaurer l’immunogénicité de l’allogreffe, provoquant ainsi un rejet aigu (39). Cependant, si dans ces mêmes expériences, les combinaisons sont changées et que le greffon utilisé provient cette fois d’un hôte totalement allogénique, la greffe « retransplantée » est inévitablement rejetée, avec cependant une cinétique plus lente que si elle n’a pas été pré-transplantée chez un hôte intermédiaire. Ceci laissait à penser qu’une autre voie de présentation des alloantigènes pouvait prendre le relais.
Enfin, dans de nombreux modèles expérimentaux, ainsi qu’en clinique humaine, il a été montré que plus l’histocompatibilité entre le receveur et le donneur était importante, meilleures étaient les chances de survie du greffon. Dans le cas d’une parfaite identité pour les molécules de CMH de classe II, une allogreffe de rein peut même être acceptée à long terme (40).
La démonstration formelle que des cellules T, ne reconnaissant les alloantigènes que directement, pouvaient induire à elles seules le rejet de greffe, n’a été apportée que récemment par l’équipe de Gill. Ainsi, le transfert de lymphocytes T CD4+ syngéniques B6 chez un hôte Rag1-/- entraine le rejet d’un cœur allogénique BLAB/c exprimant les molécules de CMH de classe II mais pas le rejet d’un cœur provenant de souris déficientes pour ces mêmes molécules. En outre, dans ces mêmes combinaisons, l’expression des molécules de CMH II par l’hôte n’est pas nécessaire au rejet. La voie de reconnaissance directe médiée par les lymphocytes T CD4+ est ainsi nécessaire et suffisante pour induire le rejet de greffe (41).
L’existence d’un tel mécanisme direct de stimulation des lymphocytes T par une molécule de CMH autre semble transgresser le dogme de la restriction du TCR au CMH du soi. L’analyse structurale d’un TCR allogénique a indiqué que ce mode de reconnaissance trouvait son origine dans la cross-réactivité de lymphocytes spécifiques de complexe peptide/CMH du soi pour les molécules de CMH allogéniques (42). Cette hypothèse est en accord avec des travaux plus anciens qui avaient montré qu’une large proportion des lymphocytes T participant à l’alloréactivité ont un phénotype mémoire (43).
La réponse immunitaire dépendante d’une activation par la voie directe a été décrite comme particulièrement rapide et de grande amplitude. Ceci s’explique par la fréquence élevée (environ 7%) des cellules T susceptibles de reconnaître des molécules de CMH allogéniques, une fréquence 100 à 1000 fois plus grande que celle estimée des précurseurs T spécifiques d’un antigène exogène (44). Diverses hypothèses ont été proposées afin d’expliquer ce constat.
La première repose sur les travaux de Jerne dans les années 70. Il a ainsi été suggéré que le répertoire de gènes qui codent pour le TCR a évolué en fonction de sa capacité à conférer une réactivité avec les antigènes du CMH de l’espèce (45). Cette hypothèse a été par la suite confirmée et démontrée par Zerrahn et al. en 1997. Lors d’expérience de maturation de thymocytes en absence de molécule de CMH, ils ont en effet observé une alloréactivité similaire à des populations de thymocytes ayant subis les différentes étapes de sélection thymique (46).
La deuxième propose que le ligand du TCR alloréactif est la molécule du CMH elle-même, indépendamment du peptide présenté. Ainsi, à la surface des CPAs du donneur, toutes les molécules de CMH allogéniques peuvent agir comme un ligand pour le TCR, augmentant ainsi fortement l’avidité de l’interaction. La forte fréquence de lymphocytes mobilisés lors d’une allogreffe serait donc liée au fait que même les cellules qui expriment un TCR de faible affinité sont susceptibles de s’activer.
Enfin, la dernière hypothèse, à l’inverse de la précédente, propose que chaque TCR est spécifique d’un complexe CMH/peptide bien défini. Ainsi, en supposant qu’un peptide dérivé d’une protéine non polymorphe, mais présenté dans le contexte du CMH allogénique, soit reconnu comme du non-soi, le fort pourcentage de cellules T allospécifiques serait lié à l’existence d’un nombre immense de complexes immunogènes à la surface des CPAs. Ce modèle, proposée par Polly Matzinger, est appelée « modèle du complexe binaire simplifié » (47).
En réalité, il est supposé que ces deux derniers modèles représentent deux cas extrêmes qui encadrent un large spectre de situations dans lesquelles le peptide contribue, à différents degrés, à l’interaction entre le TCR et le ligand. Obst et al. ont en effet pu montrer que le peptide a d’autan plus d’importance que les molécules de CMH du donneur et du receveur sont proches. A l’inverse, plus les molécules du CMH sont structurellement éloignées, plus l’interaction entre le TCR et son ligand est à dominance CMH (48).
Enfin, la voie d’alloreconnaissance directe a essentiellement été associée aux épisodes de rejet aigus. En effet, les cellules dendritiques allogéniques sont présentes en nombre limité dans l’organe transplanté et sont incapables de se renouveler. Ainsi, leur capacité à soutenir une activation continue du compartiment T du receveur va décroitre avec le temps post-greffe. Ceci est en adéquation avec des études cliniques qui ont montré que le nombre de cellules T activées par cette voie diminue inexorablement, même en l’absence de rejet total du greffon (49, 50).
• Voie de reconnaissance indirecte
Suite à l’inflammation crée par l’acte chirurgical, les cellules dendritiques du receveur et leurs précurseurs hématopoïétiques sont attirés vers le greffon où ils vont pouvoir acquérir des alloantigènes par l’internalisation de molécules de CMH
solubles, par la phagocytose de corps apoptotiques/nécrotiques ou par échange de vésicules. Cette acquisition peut également avoir lieu directement au niveau des nœuds lymphatiques drainant grâce notamment à la présence de nombreuses CPAs du donneur à leur niveau.
Ces alloantigènes sont alors présentés par les molécules du CMH de classe II endogènes présentés à la surface des CPAs du receveur. Les peptides présentés dérivent de l’action protéolytique de différentes enzymes lysosomales à l’égard des molécules du CMH allogéniques ou des antigènes mineurs d’histocompatibilité. La fréquence des lymphocytes T alloréactifs s’activant par la voie indirecte de présentation est extrêmement faible comparée à celle de la voie directe, puisqu’équivalente à la fréquence des cellules T reconnaissant des antigènes exogènes.
L’existence de cette voie d’alloreconnaissance a été démontrée au cours de différentes études. Ainsi, Lechler, dans les mêmes expériences qui ont mises en évidence la voie directe, a observé que la déplétion des cellules dendritiques contenues dans le greffon permet de retarder, mais pas de totalement inhiber, le rejet (39). De même, dans un modèle murin, une greffe allogénique de peau provenant d’un donneur déficient pour les molécules de CMH de classe II peut être rejetée par le système immunitaire d’un animal receveur CMH I-/- (51). Dans ce système, la souris hôte n’a pas de cellules T CD8+ et ses cellules T CD4+ ne peuvent pas être directement activées par les CPAs contenues dans le greffon puisqu’elles n’expriment pas les antigènes de classe II. Enfin, Dalchau et al ont montré que des rats préalablement injectés avec des molécules solubles et allogéniques de CMH I ou II rejettent plus rapidement une allogreffe de peau que des animaux non manipulés (52).
Si la portée de cette voie n’est que faible lors du rejet aigu, il semble qu’elle soit la voie prédominante lors du rejet chronique. En effet, l’influence de la voie directe diminue avec le temps, alors que la voie indirecte se maintient à des niveaux élevés chez des patients présentant un rejet cardiaque chronique en comparaison à des patients ayant acceptés le cœur transplanté (53).
• Voie de reconnaissance semi-directe
Pendant très longtemps, les voies directes et indirectes ont été considérées comme les seuls mécanismes de stimulation des cellules T allospécifiques du receveur. Pourtant, de nombreuses observations laissaient à penser que d’autres mécanismes étaient impliqués. Ainsi, il avait été décrit que des cellules T CD4+ activées par la voie indirecte étaient capables de délivrer une aide efficace aux lymphocytes T CD8+ stimulés directement par les molécules allognéiques de CMH de classe I (54).
Une nouvelle voie intermédiaire, qualifiée de « semi-directe » a récemment été décrite par l’équipe de Robert Lechler (55, 56). Elle a pu mettre en évidence in
vitro que des cellules dendritiques pouvaient acquérir et présenter, par un
mécanisme actif, des molécules intactes de CMH de classe I et de classe II présentes à la surface de cellules dendritiques ou endothéliales allogéniques. De plus, elle a montré que ce transfert d’antigène se déroule également in vivo et que les molécules de CMH ainsi captées sont capables d’activer par une voie directe, et spécifique de l’antigène, des cellules T syngéniques. Cette voie permettrait ainsi d’assurer, une fois les CPAs du donneur disparues, une activation continue des lymphocytes T CD8+, obligé de reconnaître le CMH de classe I du donneur pour présenter leurs fonctions cytotoxiques, et de recevoir une aide efficace des CD4+, activés eux par la voix d’alloreconnaissance indirecte. Toutefois, l’importance relative de ces mécanismes dans l’activation du répertoire alloréactif et son implication dans le rejet de greffe ne sont pas actuellement connues.
3. LES MECANISMES DE REJET
Trois formes de rejet ont été initialement décrites. Elles se caractérisent par leur cinétique plus ou moins précoce après la greffe, par les mécanismes moléculaires et cellulaires mis en jeu et par les types de lésions constituées au niveau du greffon.
• Le rejet hyperaigu
Le rejet hyperaigu survient dans les heures qui suivent la reperfusion de l’organe. Il est l’exemple le plus classique et le plus spectaculaire d’un rejet dépendant des anticorps. Macroscopiquement, l’organe présente des signes évidents de thrombose vasculaire, d’hémorragies et une infiltration légère de cellules mononucléées.
Il est la conséquence de la présence d’alloanticorps préformés dans le sang du patient suite à une transfusion, une greffe ou une grossesse. Ces anticorps sont majoritairement dirigés contre les antigènes ABO ou les molécules du CMH présents à la surface des cellules endothéliales du greffon. Leur fixation va entrainer l’activation intense de la cascade du complément qui aboutit à la destruction des cellules cibles par le complexe d’attaque membranaire ainsi qu’à la libération de médiateurs inflammatoires comme l’IL-8, MCP-1 ou le facteur de Von Willebrand (57). Les cellules de l’endothélium vont alors se rétracter, ce qui va augmenter la perméabilité des vaisseaux et provoquer des hémorragies, et perdre l’expression de molécules anticoagulantes ce qui conduira à une thrombose, à l’ischémie et à la mort rapide de l’organe (58).