BENOÎT M.-LABBÉ
ÉVALUATION DE L’IMPACT DE NOUVEAUX
PANSEMENTS BIOLOGIQUES SUR LA GUÉRISON
DE PLAIES CUTANÉES IN VITRO
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l’Université Laval dans le cadre du programme de maîtrise en médecine expérimentale
pour l’obtention du grade de Maître ès sciences (M. Sc.)
FACULTÉ DE MÉDECINE UNIVERSITÉ LAVAL
QUÉBEC
2013
Résumé
Le traitement des ulcères cutanés constitue un défi majeur et les options thérapeutiques efficaces demeurent limitées. Le but du présent projet était de concevoir et d’évaluer le potentiel de pansements biologiques fabriqués à partir de cellules souches extraites du tissu adipeux (CSTA) à favoriser la guérison de plaies cutanées. Des pansements faits de CSTA ou de CSTA différenciées en adipocytes ont été mis au point en utilisant la technique d’auto-assemblage développée au LOEX et évalués sur un modèle d’étude in vitro adapté pour l’étude de pansements. L’effet de ces pansements a été évalué en mesurant la progression de la réépithélialisation des plaies in vitro, en caractérisant leur sécrétome et en réalisant des analyses histologiques et immunohistochimiques. Cette recherche suggère que les CSTA différenciées en adipocytes pourraient être utilisées en complément ou alternativement aux fibroblastes dermiques pour la production de recouvrements autologues utiles dans le traitement des plaies cutanées.
Abstract
Treatment of chronic wounds remains a major challenge in clinic and efficient treatment options are still limited. The goal of this project was to create and evaluate the potential of bioengineered cellular wound dressings made of adipose-derived stem/stromal cells (ASCs) for cutaneous wound healing. Dressings made of ASCs differentiated or not towards the adipogenic lineage were produced using the self-assembly approach and were evaluated using an adapted in vitro wound healing model. The effect of these dressings was assessed by measuring the progression of reepithelialisation on in vitro wounds, by characterizing dressing’s secreted products and by histological and immunohistochemical analyses. This research suggests that ASCs could be used as an alternative or a complement to dermal fibroblasts for the production of autologous dressings useful for healing of chronic wounds.
Remerciements
Ce mémoire est d’abord le résultat d’une collaboration solide avec ma directrice de recherche Julie Fradette Ph.D. Je tiens à la remercier chaleureusement pour sa disponibilité, sa rigueur scientifique et son support constant tout au long de mes études graduées. Dre Fradette est définitivement un bel exemple d’une chercheure ayant à cœur le succès de ces étudiants et la production de recherches de qualité.
Je tiens également à remercier les membres de l’équipe LOETA qui ont été présents au cours de mon projet pour discuter de science et relaxer de temps à autre! Un merci particulier à Valérie Trottier, assistante de recherche de l’équipe, qui a travaillé les débuts du présent projet et qui m’a offert une aide précieuse tout au long de l’expérimentation. Merci à Maryse Proulx, Caroline Vincent, Guillaume Marceau-Fortier et Dominique Mayrand pour leur support et leur aide. Merci également à Todd Galbraith pour son soutien lors de mes premiers contacts avec le génie tissulaire, à Olivier Rochette-Drouin pour son aide avec les microscopes ainsi qu’à Francis Charrette et à Annie Boisvert pour leur aide avec les prises de mesures. De plus, je remercie l’ensemble des chercheurs du LOEX pour leur contribution à la création de ce centre de recherche d’envergure.
Je veux souligner le support que m’ont offert les membres de ma famille et mon amoureuse au cours de ce projet de maitrise. Ils ont su être présents pour moi lors des moments plus difficiles et m’ont encouragé constamment. Merci pour votre soutien précieux.
Finalement, je remercie la faculté de médecine de l’Université Laval et les organismes subventionnaires de m’avoir permis de réaliser ce projet conjointement à mes études au doctorat en médecine.
À ma famille pour leur support inconditionnel
Table des matières
Résumé ... i
Abstract ... iii
Remerciements ... v
Table des matières ... ix
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations ... xv
1. Chapitre 1 - Introduction générale... 1
1.1 Peau normale humaine et ses composantes ... 2
1.1.1 Épiderme ... 2 1.1.1.1 Couche basale ... 3 1.1.1.2 Couche épineuse ... 4 1.1.1.3 Couche granuleuse ... 4 1.1.1.4 Couche cornée ... 5 1.1.2 Jonction dermo-épidermique ... 5
1.1.3 Derme et annexes cutanées ... 6
1.1.4 Hypoderme (tissu adipeux humain) ... 7
1.1.4.1 Composition cellulaire ... 8
1.1.4.1.1 Adipocytes... 8
1.1.4.1.2 Cellules souches extraites du tissu adipeux (CSTA)... 8
1.2 La guérison des plaies cutanées ... 9
1.2.1 Physiologie de la guérison ... 9
1.2.1.1 La phase inflammatoire ... 9
1.2.1.2 La phase proliférative ... 10
1.2.1.2.1 La réépithélialisation ... 11
1.2.1.2.2 La formation du tissu de granulation ... 12
1.2.1.2.3 La néovascularisation ... 13
1.2.1.3 La phase de maturation et de remodelage ... 13
1.2.2 La pathogénie des plaies chroniques ... 14
1.2.2.1 Le diabète ... 14
1.2.2.2 L’insuffisance veineuse ... 16
1.2.3 Traitements des plaies cutanées ... 17
1.2.3.1 Méthodes de base ... 17
1.2.3.2 Pansements synthétiques ... 17
1.2.3.3 Pansements cellulaires ... 18
1.3 Étude de la guérison des plaies cutanées et potentiel des cellules souches extraites du tissu adipeux (CSTA) ... 23
1.3.1 Modèles animaux de la guérison des plaies cutanées ... 23
1.3.2 Potentiel des cellules du tissu adipeux en guérison des plaies cutanées ... 25
1.3.2.1 Sécrétion de molécules bioactives ... 27
1.3.2.1.1 Leptine ... 27
1.3.2.1.2 VEGF ... 28
1.3.3 Peaux reconstruites et contribution du génie tissulaire (méthode
d’auto-assemblage) ... 29
1.4 Problématique, hypothèse et objectifs ... 31
2 Chapitre 2 - Matériel et méthode ... 33
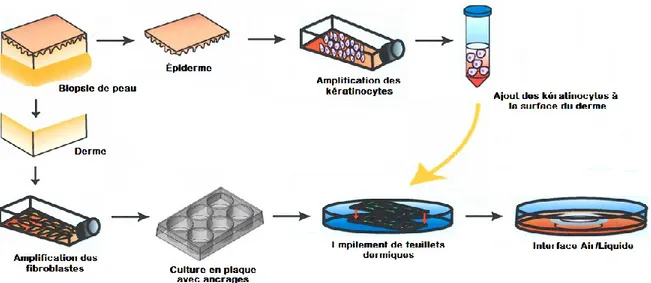
2.1 Production de peaux bilamellaires humaines reconstruites in vitro par auto-assemblage ... 34
2.1.1 Production du derme des peaux reconstruites ... 34
2.1.2 Production de l’épiderme des peaux reconstruites ... 36
2.2 Production de feuillets migratoires dermiques ... 38
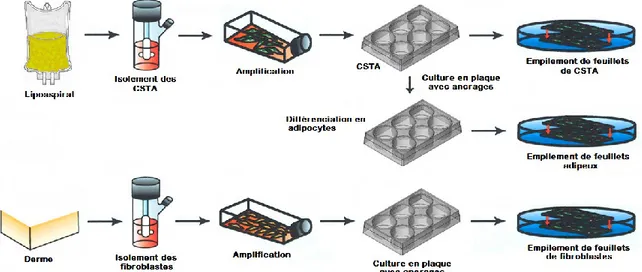
2.3 Production de pansements biologiques ... 38
2.4 Réalisation du modèle d’étude ... 41
2.5 Devis expérimentaux ... 43
2.6 Prise de photos macroscopiques des peaux et des plaies ... 44
2.7 Suivi de la progression de la réépithélialisation dans le temps ... 45
2.7.1 Méthode 1 ... 45
2.7.2 Méthode 2 ... 45
2.8 Mesure de l’aire réépithélialisée de la plaie ... 46
2.9 Analyse des peaux, des plaies et des pansements ... 47
2.9.1 Analyse des peaux ... 47
2.9.2 Analyse des plaies ... 47
2.9.3 Analyse des pansements ... 49
2.10 Dosage par ELISA des molécules sécrétées ... 49
2.11 Analyses statistiques ... 50
3 Chapitre 3 – Résultats ... 51
3.1 Conception du modèle de guérison des plaies in vitro adapté à l’étude de pansements biologiques ... 52
3.2 Progression de la réépithélialisation de plaies recouvertes de pansements biologiques ... 61
3.3 Caractérisation de l’impact des pansements biologiques sur la réépithélialisation 68 4 Chapitre 4 – Discussion... 75
4.1 Adaptation du modèle d’étude in vitro et conception des pansements biologiques 76 4.1.1 Modèle d’étude de la guérison des plaies in vitro ... 76
4.1.2 Conception des pansements biologiques ... 80
4.2 Évaluation de l’efficacité des pansements biologiques ... 81
4.3 Poursuite du projet sur un modèle animal ... 87
6 Chapitre 5 - Conclusion ... 89
Liste des tableaux
Tableau 1.1 : Principaux recouvrements biologiques disponibles en clinique pour le
traitement de plaies chroniques. ... 21 Tableau 2.1 : Populations cellulaires de fibroblastes utilisés pour la production de dermes
reconstruits et de feuillets migratoires. ... 34 Tableau 2.2 : Composition du milieu de culture pour kératinocytes. ... 37 Tableau 2.3 : Populations cellulaires de CSTA et de fibroblastes utilisées pour la
production de pansements biologiques. ... 39 Tableau 2.4 : Composition du milieu d’induction adipogénique. ... 40 Tableau 2.5 : Résumé des devis expérimentaux réalisés et des principaux paramètres de
chacun. ... 44 Tableau 2.6 : Anticorps utilisés pour les marquages immunohistochimiques de plaies. .... 48
Liste des figures
Figure 1.1 : Multiples couches cellulaires résultant du processus de différenciation des kératinocytes. ... 3 Figure 1.2 : Schématisation de la jonction dermo-épidermique. ... 6 Figure 1.3 : Schématisation des principales étapes de la guérison des plaies de la peau. ... 10 Figure 1.4 : Patient de 60 ans amputé de deux orteils et souffrant d’un ulcère diabétique
classiquement situé à la pointe du deuxième métatarse. ... 15 Figure 1.5 : Apparence générale des principaux pansements cellulaires disponibles
commercialement. ... 20 Figure 2.1 : Étapes de production de peaux bilamellaires reconstruites in vitro. ... 36 Figure 2.2 : Étapes de production de pansements biologiques en fonction du type cellulaire utilisé. ... 39 Figure 2.3 : Étapes de réalisation du modèle d’étude de guérison des plaies selon la
condition expérimentale à l’étude.. ... 42 Figure 2.4 : Aspect général du modèle d’étude réalisé. ... 43 Figure 2.5 : Exemple des photos ayant servies à générer les résultats de mesure d’aire
non-réépithélialisée et d’aire totale de la plaie originale. ... 46 Figure 3.1 : Aspect macroscopique d’une peau reconstruite. ... 52 Figure 3.2 : Apparence macroscopique et microscopique des pansements biologiques
produits par auto-assemblage. ... 54 Figure 3.3 : Résumé des résultats de l’étude pilote. ... 57 Figure 3.4 : Profil de sécrétion des pansements biologiques sur une période de 48 heures en
milieu sans sérum et sans phénol. ... 58 Figure 3.5 : Aspect au stéréomicroscope du phénomène de réépithélialisation d’une plaie
reconstruite in vitro après l’adaptation de la méthode de suivi de la
réépithélialisation. ... 60 Figure 3.6 : Comparaison de l’aire ouverte des plaies en fonction du nombre de jour de
guérison et selon le pansement utilisé (première étude). ... 61 Figure 3.7 : Profil de sécrétion des pansements biologiques sur une période de 24 heures en
milieu sans sérum et sans phénol. ... 63 Figure 3.8 : Progression de la réépithélialisation en fonction du groupe expérimental à
l’étude (deuxième étude). ... 65 Figure 3.9 : Profil de sécrétion des pansements biologiques sur une période de 48 heures en
milieu de culture pour adipocytes. ... 67 Figure 3.10 : Aspect histologique d’une coupe transversale de la marge d’une plaie colorée au trichrome de Masson. ... 69 Figure 3.11 : Aspect histologique de la réépithélialisation six jours après la création des
plaies suite à une coloration au trichrome de Masson sur coupes transversales. ... 71 Figure 3.12 : Analyses immunohistochimiques du phénomène de réépithélialisation en
présence de pansements biologiques après six jours de guérison. ... 72 Figure 3.13 : Aspect histologique au trichrome de Masson des pansements adipeux utilisés comme recouvrement d’une plaie au fil du temps. ... 73 Figure 3.14 : Exemple d’une plaie où le feuillet migratoire n’a pas été réépithélialisé. ... 74
Liste des abréviations
(Termes en anglais inscrits en italique)Ac Anticorps monoclonaux ou polyclonaux (M ou P) ASCs Adipose-derived stem/stromal cells
bFGF Basic fibroblast growth factor
CHA Centre Hospitalier Affilié
CSTA Cellules souches extraites du tissu adipeux DME Dulbecco’s modified Eagle’s medium EGF Epidermal growth factor
ELISA Enzyme-linked immunosorbent assay
IBMX 3-isobutyl-1-méthylxanthine KGF Keratinocyte growth factor
LOEX Laboratoire d’Organogénèse Expérimentale
NO Oxyde nitrique
PAI-1 Plasminogen activator inhibitor-1
PDGF Platelet-derived growth factor
PGA Polyglycolic acid
PLA Polylactic acid
SVF Sérum de veau fœtal
T3 Triiodothyronine
TGF Transforming growth factor (α et β)
VEGF Vascular endothelial growth factor
1.1 Peau normale humaine et ses composantes
La peau humaine est un organe important ayant pour rôle principal d’être une barrière entre l’environnement interne et externe du corps. Elle est principalement composée de trois types cellulaires organisés en trois couches. La couche la plus superficielle est l’épiderme, érigée par les kératinocytes, suivi du derme, essentiellement constitué de fibroblastes, et de l’hypoderme, contenant surtout des adipocytes. La peau joue plusieurs rôles importants en plus d’être une barrière efficace. Elle est impliquée dans la thermorégulation du corps, dans la transmission des sensations en plus d’avoir un rôle immunitaire. Elle possède aussi diverses fonctions endocrines, dont l’activation de la vitamine D ainsi que la production de leptine dans son tissu adipeux (Kierszenbaum et al., 2006).
1.1.1 Épiderme
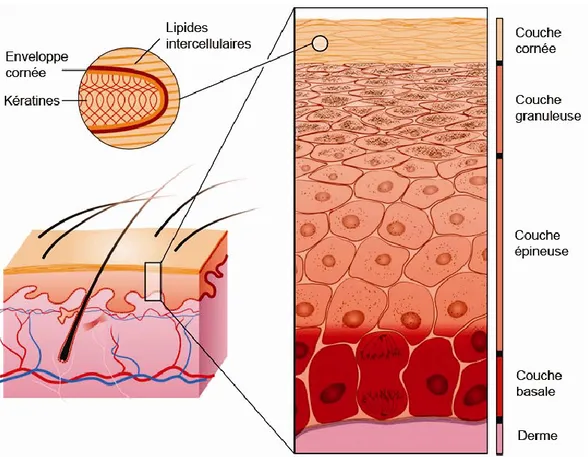
L’épiderme est la partie la plus superficielle de la peau. Sa structure est celle d’un épithélium pavimenteux stratifié, tout comme la majorité des épithéliums du corps humain subissant de la friction. Il est toutefois un des seuls à être kératinisé et à contenir des mélanocytes, assurant une protection solaire en pigmentant la peau et les poils. Il contient aussi des cellules de Merkel servant de récepteurs sensoriels ainsi que des cellules de Langerhans impliquées dans l’immunité cellulaire (Kierszenbaum et al., 2006). Les kératinocytes prolifèrent et maturent de la couche basale jusqu’à la couche cornée, en passant par les couches épineuses et granuleuse où leur morphologie et leur composition se transforment (Fig 1.1). Les kératines, principales protéines structurales composant les kératinocytes, possèdent des profils particuliers selon la couche et constituent près de 85% de la masse d’un seul kératinocyte une fois la différenciation complétée (Fuchs, 1995). Elles constituent donc des marqueurs de choix dans l’étude de la formation de l’épiderme.
Figure 1.1 : Multiples couches cellulaires résultant du processus de différenciation des kératinocytes. [Figure modifiée de (Segre, 2008)]
1.1.1.1 Couche basale
La couche basale de la peau est la seule couche cellulaire où les kératinocytes prolifèrent (Fuchs et al., 1980). Ils sont solidement attachés à la membrane basale par des hémidesmosomes, des protéines complexes qui guident la polarisation et l’organisation spatiale de l’épiderme en formation (Borradori et al., 1999). Cette couche contient des cellules souches épidermiques qui expriment entre autres la kératine 19. Elles sont situées dans la couche basale des crêtes épidermiques profondes de la peau sans poils ou dans le renflement des follicules pileux de la peau avec poils (Michel et al., 1996, Fradette et al., 1998). Les kératines 5 et 14 sont fortement exprimées au niveau de la couche basale. Elles se retrouvent seulement dans les kératinocytes ayant des capacités prolifératives, leur expression est donc régulée à la baisse dès que les kératinocytes passent à la couche épineuse (Fuchs, 1995, Fuchs et al., 1980). La kératine 15 est également exprimée dans les
cellules de la couche basale, quoique de moins grande importance quantitative (Lloyd et al., 1995). L’antigène Ki-67 est aussi un marqueur cellulaire particulier à la couche basale au sein de l’épiderme puisqu’il est présent dans les cellules prolifératives (Gerdes et al., 1983, Gerdes et al., 1984).
1.1.1.2 Couche épineuse
En quittant la couche basale, le profil des kératines synthétisées au sein des kératinocytes se modifie. La présence des kératines 5 et 14 diminue et le taux de synthèse des kératines 1 et 10 prend de plus en plus d’ampleur (Fuchs, 1995). À ce stade de différenciation, les kératinocytes sont toujours métaboliquement actifs et demeurent liés entre eux par des desmosomes comme dans la couche basale(Franke et al., 1987). Les 4 à 8 couches cellulaires qui composent l’épineuse prennent graduellement une forme plus plane jusqu’à leur passage à la couche granuleuse (Fuchs, 1990).
1.1.1.3 Couche granuleuse
Dans leur transition vers la couche granuleuse, les kératinocytes stoppent leur production massive de kératines entreprise dans les couches basale et épineuses. Les kératinocytes acquièrent alors des granules de kératohyalines à l’intérieur de leur cytoplasme. Celles-ci contiennent entre autres de la loricrine servant à former l’enveloppe cornée des cornéocytes (Mehrel et al., 1990). Elles renferment également des précurseurs de la filaggrine qui servent à l’agrégation des filaments de kératine en macrofibrilles (Dale et al., 1978, Watt, 1989). Ces granules ont aussi un rôle à jouer dans la déshydratation et l’aplatissement de la cellule avant son passage à la couche cornée (Dale et al., 1994). Parallèlement à la production de ces granules, il y a formation de corps lamellaires riches en lipides qui sont sécrétés dans l’espace intercellulaire (Kierszenbaum et al., 2006). Les transglutaminases sont également des enzymes actifs dans la couche granuleuse qui entreprennent la formation de l’enveloppe cornée (Buxman et al., 1975, Eckert et al., 2005).
1.1.1.4 Couche cornée
Une fois la couche cornée atteinte, les kératinocytes aplatis maintenant devenus des cornéocytes ne possèdent plus de noyau et sont dépourvus d’organelles. Ils perdent le peu de cytoplasme restant. À ce stade, ils sont remplis de filaments de kératine et entourés d’une couche de protéines insolubles apposée sur la face interne de leur membrane plasmatique (Watt, 1989). Les cornéocytes ont ainsi pour rôle de protéger les strates vivantes de l’épiderme contre les forces mécaniques exercées sur la peau. Ils servent également à l’imperméabiliser grâce aux lipides intercellulaires produits par les corps lamellaires (Menon et al., 1997, Kierszenbaum et al., 2006). Graduellement, la desquamation a lieu et les strates superficielles de cornéocytes se détachent de la peau. Le délai séparant la présence d’une cellule à la couche basale et sa différenciation terminale en cornéocyte est de deux à quatre semaines, selon le degré de renouvellement nécessaire à un site donné de la peau (Fuchs, 1995).
1.1.2 Jonction dermo-épidermique
La membrane basale séparant le derme de l’épiderme, aussi appelée jonction dermo-épidermique, se divise en quatre structures distinctes lorsque visualisée par microscopie électronique (Fig 1.2). La première structure de la jonction dermo-épidermique est constituée de la membrane plasmatique des kératinocytes basaux de l’épiderme. Ces kératinocytes sont soutenus par des filaments intermédiaires de kératine 5 et 14 contenus dans leur cytoplasme (Fuchs et al., 1994). Leur membrane plasmatique s’attache aux autres structures de la jonction dermo-épidermique grâce à des hémidesmosomes (Borradori et al., 1999). Ces hémidesmosomes utilisent des intégrines spécialisées dans la liaison des laminines (α6β4 et α3β1) (Watt, 2002) afin de se lier aux filaments d’ancrage des deux structures suivantes, la lumina lucida et la lumina densa. La laminine 5 est l’un des principaux constituants de ces ancrages, accompagnée des laminines 6 et 10 qui s’y retrouvent de façon moins abondante (Aumailley et al., 1996, Aumailley et al., 1999). La laminine 5 est d’ailleurs un marqueur spécifique de la membrane basale des épithéliums pavimenteux (Nishiyama et al., 2000). La troisième structure de la jonction
dermo-épidermique, la lumina densa, est principalement constituée de collagène de type IV. Enfin, la lamina reticularis, dernière structure de la membrane basale, est surtout formée des collagènes de types I et III. Des fibres de collagène de type VII servent à ce niveau de filaments d’ancrage entre la lumina densa et la lumina reticularis et assurent la stabilité de la cohésion entre la membrane basale et le derme.
Figure 1.2 : Schématisation de la jonction dermo-épidermique. [Figure modifiée de (Karp, 2004)]
1.1.3 Derme et annexes cutanées
Le derme est principalement constitué de cellules mésenchymateuses nommées fibroblastes qui sont reliées entre elles par une solide matrice extracellulaire. Il se divise en deux couches plus ou moins bien définies où la composition de sa matrice varie. La couche la plus proximale à l’épiderme est la couche papillaire, constituée de fibroblastes, de fibres de collagène fines et de fibres élastiques. Elle contient les capillaires sanguins qui fournissent les nutriments nécessaires à la formation de l’épiderme ainsi que des terminaisons nerveuses. La couche réticulaire est quant à elle composée de fibres de collagène organisées en faisceaux épais ainsi que de fibres élastiques grossières en plus des fibroblastes. Elle contient un réseau sanguin, lymphatique et nerveux de plus gros calibre que la couche papillaire (Kierszenbaum et al., 2006).
Le derme est le siège d’annexes cutanées telles que les poils, les glandes sébacées et les glandes sudoripares. La tige des poils traverse l’épiderme et est solidement ancrée dans le derme par le follicule pileux. Les poils ont différentes fonctions selon leur emplacement, que ce soit de filtrer l’air passant par le nez ou d’isoler le cuir chevelu. Une glande sébacée s’associe à chaque follicule pileux au niveau de la peau pour produire du sébum, une substance grasse possédant des propriétés antimicrobiennes. Les glandes sudoripares contribuent pour leur part à la régulation de la température corporelle en laissant échapper la sueur dans de petits pores jusqu’à la surface de la peau (Kierszenbaum et al., 2006).
Le derme a pour rôle d’offrir à la peau à la fois une résistance mécanique contre les traumatismes ainsi qu’une souplesse qui permet l’amplitude des mouvements. Il aurait aussi un rôle important à jouer dans la régulation de l’épithélialisation par le remodelage du collagène et la production de facteurs de croissance (Coulomb et al., 1989). Dans des études in vitro, la co-culture de fibroblastes et de kératinocytes accentue la prolifération des kératinocytes et la morphologie de l’épiderme qui en résulte se rapproche davantage à celle de la peau normale humaine que lorsque les kératinocytes prolifèrent en absence de fibroblastes (El-Ghalbzouri et al., 2002, El Ghalbzouri et al., 2003). La prolifération des kératinocytes serait même doublée lorsqu’en co-culture avec des fibroblastes (Goulet et al., 1996).
1.1.4 Hypoderme (tissu adipeux humain)
L’hypoderme est la troisième et dernière couche de la peau. Sa distinction avec le derme est graduelle, aucune membrane définie ne les sépare. Aussi appelé tissu adipeux sous-cutané, il joue plusieurs rôles physiologiques importants en plus d’être un soutien indispensable pour le derme et l’épiderme qui le recouvre. L’hypoderme est un coussin précieux pour amortir les chocs et joue un rôle de thermorégulation. Il constitue une réserve énergétique importante. Sa distribution varie selon le sexe et l’indice de masse corporelle.
1.1.4.1 Composition cellulaire
Les constituants principaux du tissu adipeux sont les adipocytes et les cellules stromales/souches adultes qui résident dans le tissu adipeux.
1.1.4.1.1 Adipocytes
Les adipocytes blancs sont les principaux constituants du tissu adipeux humain. Ils servent notamment à stocker de l’énergie sous forme de triglycérides. Ils sont également responsables de la production de leptine, une hormone responsable du contrôle de la satiété (Voir section 1.3.2.1.1 Leptine). La large gouttelette lipidique contenue dans leur cytoplasme occupe près de 95% de l’espace cellulaire; le reste du volume cellulaire est occupé par le noyau aplati contre la membrane cytoplasmique ainsi que d’une fine couche de cytoplasme au pourtour (Kierszenbaum et al., 2006).
Le tissu adipeux présente un profil de sécrétion intéressant, notamment de molécules actives dans les processus liés à la guérison des plaies. Campbell et al. ont d’ailleurs tenté de cultiver des kératinocytes directement sur une couche de cellules adipeuses afin de vérifier l’impact des adipocytes sur la prolifération des kératinocytes. Ils ont constaté que la prolifération des kératinocytes était accélérée lorsque les deux types cellulaires étaient en contact direct, de même que lorsque les kératinocytes étaient cultivés dans un milieu conditionné préalablement par des adipocytes (Campbell et al., 2010). De telles observations avaient d’ailleurs été décrites précédemment en utilisant des techniques de co-culture (Aoki et al., 2004, Misago et al., 1998, Sugihara et al., 2001).
1.1.4.1.2 Cellules souches extraites du tissu adipeux (CSTA)
Plusieurs tissus humains sont connus pour contenir une sous-population cellulaire décrite comme étant des cellules souches. Trois conditions définissent ce qu’est une population de cellules souches; elle doit être capable de s’auto-régénérer, elle doit présenter une fonctionnalité et une viabilité à long terme et doit pouvoir se différencier en plusieurs types de cellules spécialisées (Zuk et al., 2002, Verfaillie, 2002). Plusieurs populations de
cellules mésenchymateuses contiennent des cellules souches multipotentes, dont la moelle osseuse (Prockop, 1997, Pittenger et al., 1999, Jiang et al., 2002), le derme (Toma et al., 2001, Toma et al., 2005) et le cordon ombilical (Wang et al., 2004).
Les CSTA, ou cellules souches/stromales extraites du tissu adipeux, résident dans le tissu adipeux humain. Ces cellules souches multipotentes décrites pour la première fois en 2001 ont la capacité de se différencier en différents types cellulaires tels que les chondrocytes, les ostéoblastes, les adipocytes, les cellules neuronales et les cellules musculaires lisses (Zuk et al., 2001, Safford et al., 2002, Zuk et al., 2002). Près de 2% des cellules contenues dans le tissu adipeux auraient d’ailleurs des propriétés de cellules souches (Strem et al., 2005). Les propriétés des CSTA en regard de la guérison des plaies sont abordées à la section 1.3.2.
1.2 La guérison des plaies cutanées
La peau est un organe volumineux qui est susceptible de subir divers traumatismes tels que des brûlures, des coupures et des ulcères. Pour être en mesure de réparer et de résister à ce risque éminent de lésions, elle est munie d’un processus de guérison efficace et rapide qui lui permet de recouvrir partiellement ou totalement ses fonctions initiales. Ce processus continu de guérison se divise classiquement en trois phases qui s’entrecroisent, soit la phase inflammatoire, la phase proliférative et la phase de remodelage.
1.2.1 Physiologie de la guérison
1.2.1.1 La phase inflammatoire
Une lésion traumatique de la peau provoque le bris localisé de l’épiderme et du derme à un degré variable. Une lésion qui atteint le tissu conjonctif brise également des capillaires et des vaisseaux de petit calibre. Le sang qui s’échappe et qui entre en contact avec les tissus lésés forme en quelques minutes seulement un « bouchon plaquettaire » permettant de stopper le saignement. Au cours des heures suivantes, ce bouchon est remplacé par une structure de fibrine plus résistante et plus durable. La dégranulation des
plaquettes de ce bouchon temporaire ainsi que les cellules du tissu conjonctif local stimulent alors le recrutement de cellules immunitaires telles que les monocytes et les polynucléaires neutrophiles vers le site de la plaie (Singer et al., 1999). Ces cellules débarrassent le site des débris cellulaires, des pathogènes et des corps étrangers s’étant infiltrés par la plaie (Stadelmann et al., 1998). Les monocytes et les macrophages jouent également un rôle chimiotactique sur les cellules endothéliales et sécrètent des facteurs de croissance stimulant la prolifération des fibroblastes du derme (Hunt, 1988, Adamson, 2009). Ces mécanismes d’attraction et de nettoyage initient la guérison et préparent la plaie aux étapes de guérison subséquentes.
1.2.1.2 La phase proliférative
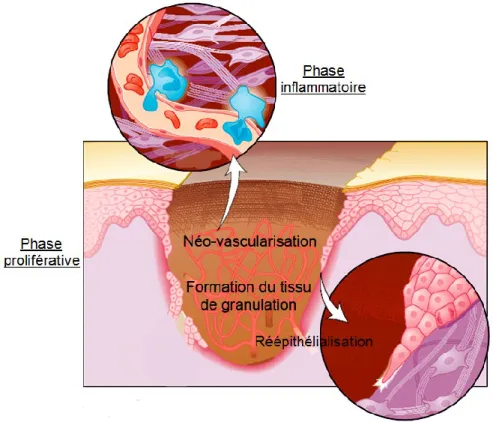
La phase proliférative comprend trois étapes coordonnées assurant la réparation de tous les compartiments initiaux de la peau. Ces trois processus sont la réépithélialisation, la formation d’un tissu de granulation et la néo-vascularisation (Fig 1.3).
Figure 1.3 : Schématisation des principales étapes de la guérison des plaies de la peau. [Figure modifiée de (Martin, 1997)]
1.2.1.2.1 La réépithélialisation
La réépithélialisation d’une plaie est le phénomène par lequel les kératinocytes reconstruisent une nouvelle couche épithéliale par des processus de migration, de prolifération et de différenciation cellulaires. Le but premier de ce processus est de rendre à la peau ses fonctions de protection contre l’environnement extérieur et d’imperméabilisation du corps. Elle débute quelques heures seulement après l’apparition de la plaie (Singer et al., 1999). La production de plasmine par les cellules épithéliales en marge de la plaie permet une dissolution locale du caillot de fibrine et libère l’espace nécessaire à la migration des kératinocytes. Simultanément, le taux de mitose des kératinocytes augmente (Stadelmann et al., 1998). De plus, la désorganisation des desmosomes et des hémidesmosomes retenant habituellement les kératinocytes en place permet aux cellules de la marge d’effectuer librement un mouvement latéral dirigé vers la zone lésée (Singer et al., 1999, Hackam et al., 2002). Les kératinocytes utilisent diverses intégrines nouvellement synthétisées pour parvenir à s’accrocher au derme et à se déplacer vers le site de la plaie (Martin, 1997). Ce sont les kératinocytes de la couche basale qui ont la capacité de migrer. Une étude sur un modèle de culture organotypique montrerait toutefois un phénomène complémentaire de « saute-mouton » qui permettrait aux kératinocytes suprabasaux de participer à la migration. Ils passeraient par-dessus les cellules basales et s’apposeraient à leur tour à la jonction dermo-épidermique (Garlick et al., 1994, Laplante et al., 2001).
Différentes explications ont été avancées pour comprendre cette capacité des kératinocytes à reconnaitre le besoin de migrer et de proliférer de manière organisée pour recouvrir une plaie. La présence d’une zone non recouverte de kératinocytes entrainant un bris du contact cellule-cellule pourrait suffire à initier la migration et la prolifération cellulaire (Singer et al., 1999). Des molécules produites localement telles que l’EGF, le PDGF, le TGFα et β et le KGF pourraient aussi contribuer à activer les processus de guérison de l’épithélium (Singer et al., 1999, Barrandon et al., 1987, Moulin, 1995). D’autres molécules telles que la leptine, le VEGF et l’angiopoïétine-1 seraient impliquées dans le processus de réépithélialisation (tel que revu à la section 1.3.2.1 Sécrétion de molécules bioactives), mais leur rôle spécifique dans l’initiation de la réépithélialisation
reste à préciser. Un autre mécanisme suggéré est la modification du potentiel transépithélial. La création d’une plaie modifie ce potentiel et crée un champ électrique qui s’aligne vers le centre de la plaie, ce qui pourrait diriger le phénomène de réépithélialisation (Dube et al., 2010). Enfin, les variations de la concentration d’oxyde nitrique (NO) produit par les kératinocytes au site de plaie pourraient aussi être un facteur important. Une faible concentration serait liée à une stimulation de la prolifération tandis qu’une forte présence réduirait la prolifération et activerait la différenciation (Hackam et al., 2002).
Les zones réépithélialisées reforment progressivement de nouveaux desmosomes et hémidesmosomes qui serviront d’assise à la formation d’un nouvel épiderme fonctionnel. Une nouvelle membrane basale se forme par le dépôt de collagène de type IV et de laminine 5 à la jonction dermo-épidermique (Laplante et al., 2001, Kirfel et al., 2004, Aumailley et al., 1996). D’abord près des marges et ensuite au centre, la différenciation des kératinocytes s’active pour former un nouvel épiderme possédant toutes les couches fonctionnelles initiales (Martin, 1997). Il y a également un déplacement passif des couches supérieures de la marge de la plaie vers le centre (Laplante et al., 2001).
1.2.1.2.2 La formation du tissu de granulation
La formation d’un tissu de granulation se traduit par le développement d’un nouveau tissu conjonctif remplaçant celui lésé. Les fibroblastes et les cellules endothéliales prolifèrent et s’organisent pour progressivement recréer un compartiment dermique fonctionnel. Les macrophages jouent aussi un rôle important en fournissant plusieurs facteurs de croissance stimulant l’action des fibroblastes et des cellules endothéliales. Les fibroblastes synthétisent et organisent alors une nouvelle matrice extracellulaire formée entre autres de fibres de collagène, de fibres élastiques et de glycosaminoglycanes tels que l’acide hyaluronique (Singer et al., 1999, Stadelmann et al., 1998).
1.2.1.2.3 La néovascularisation
Pour soutenir la formation du tissu de granulation, un réseau de capillaires sanguins est formé par la migration et la prolifération de cellules endothéliales. Des molécules importantes telles que le bFGF et le VEGF sont liées à l’initiation de cette néovascularisation (Singer et al., 1999, Stadelmann et al., 1998). Le bFGF est le principal médiateur de l’angiogenèse durant les premiers jours de guérison tandis que le VEGF produit par les fibroblastes et les kératinocytes environnants exerce un effet prédominant en phase de guérison plus avancée (Nissen et al., 1998). D’une manière analogue au kératinocytes en migration qui dissolvent localement à l’aide de plasmine le caillot de fibrine lors de la réépithélialisation, les cellules endothéliales stimulent une protéolyse dirigée du tissu de granulation pour parvenir à créer un nouveau réseau de capillaires (Martin, 1997).
1.2.1.3 La phase de maturation et de remodelage
Le remodelage du tissu de granulation vers un tissu sain et fonctionnel s’effectue par un phénomène lent de synthèse et de dégradation des collagènes au sein du derme (Stadelmann et al., 1998, Singer et al., 1999). Diverses métalloprotéinases caractérisent les étapes de réorganisation du collagène (Singer et al., 1999). Certains fibroblastes adoptent un phénotype de myofibroblastes et se contractent pour réduire la superficie de la plaie dès la deuxième semaine de guérison (Stadelmann et al., 1998, Larochelle et al., 2004, Tomasek et al., 2002). La solidité de la cicatrice en formation s’accroît au fil des semaines au rythme de l’accumulation du collagène. Une fois le remodelage terminé, la peau retrouve environ 70% de sa résistance initiale (Singer et al., 1999).
Dans un contexte physiologique, la guérison d’une plaie est un processus constant et fiable. Toutefois, plusieurs maladies peuvent influer son déroulement. De fait, le dérèglement d’un ou plusieurs mécanismes de guérison d’une plaie peut entraîner un retard et même une chronicisation de la lésion cutanée. Des maladies bien connues, telles que le diabète et l’insuffisance veineuse, sont à l’origine de problèmes importants de guérison.
1.2.2 La pathogénie des plaies chroniques
Les plaies chroniques sont causées par différents types de pathologies, tels que des maladies vasculaires, métaboliques ou neurologiques (Fauci et al., 2008). Malgré des écarts marqués dans les étiologies pouvant expliquer leur apparition, les conséquences individuelles et collectives des ulcères qui résultent de ces problématiques de santé se ressemblent. Les traitements ont aussi beaucoup de points en commun. Ce sont surtout les personnes âgées qui sont atteintes de plaies chroniques, car l’efficacité de leurs mécanismes intrinsèques de guérison des plaies est réduite (Mustoe, 2004). Les principales causes d’ulcération chronique sont les plaies de pression, l’insuffisance artérielle, le diabète et l’insuffisance veineuse (Brunicardi et al., 2006, Mustoe, 2004). Ces deux dernières seront abordées plus en détail.
1.2.2.1 Le diabète
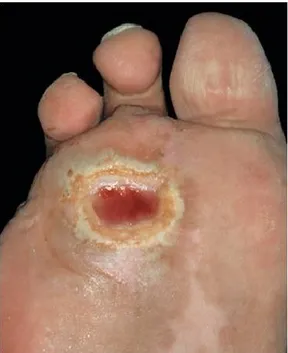
Il y avait 1,84 million de personnes atteintes du diabète de type 1 ou 2 dans la population âgée de plus de 12 ans au Canada en 2010, soit 6,4% de la population générale (StatCan, 2011). Il est prédit que ce nombre bondira au cours des 15 prochaines années avec l’augmentation de l’incidence de l’obésité. Au Québec, la proportion de diabétiques est moindre que dans l’ensemble du pays, mais demeure tout de même alarmante (Aras, 2011). Parmi les patients atteints du diabète, 15% auront un ou plusieurs ulcères au cours de leur vie (Jeffcoate et al., 2003). Ces lésions sont très majoritairement localisées au niveau des membres inférieurs (Fig 1.4). Quinze à 27% des ulcères diabétiques conduiront à une amputation au niveau de l’articulation métatarsophalangienne, de la cheville ou même du genou (Jeffcoate et al., 2003). Près de 50% des personnes amputées à la suite d’un ulcère diabétique compliqué décèderont dans les trois années suivant la procédure (Jeffcoate et al., 2003, Fauci et al., 2008).
Figure 1.4 : Patient de 60 ans amputé de deux orteils et souffrant d’un ulcère diabétique classiquement situé à la pointe du deuxième métatarse. [Figure tirée de (Wolff et al., 2005)]
L’une des principales complications du diabète expliquant la formation d’ulcères est l’apparition progressive d’une neuropathie périphérique. Les pieds sont la première zone corporelle atteinte par cette destruction des fines fibres nerveuses sensitives. Les personnes atteintes subissent une réduction de la sensibilité à la douleur ainsi qu’une détérioration de leur capacité à se situer dans l’espace (proprioception). Elles sont donc davantage sujettes à subir un traumatisme à leur insu ou à exercer une pression excessive au niveau de leurs pieds (Fauci et al., 2008). Cette déficience à reconnaitre la douleur augmente le risque de lésions aiguës au niveau des pieds et augmente par le fait même le risque qu’une plaie banale devienne un ulcère chronique.
Le diabète provoque également une dégradation de la microvascularisation corporelle, particulièrement en périphérie. Ce réseau vasculaire endommagé nuit à l’oxygénation et au transport des substances essentielles au maintien d’une peau intacte (Jeffcoate et al., 2003). Le diabète amène aussi un dérèglement dans la sécrétion de facteurs importants dans la guérison des plaies normales. Les personnes diabétiques ont entre autres des taux de KGF diminués, ce qui pourrait expliquer partiellement les problèmes de réépithélialisation (Hackam et al., 2002).
Enfin, le diabète provoque des changements dans l’efficacité et la stabilité du système immuno-inflammatoire. L’hyperglycémie réduit entre autres la fonctionnalité et la prolifération des leucocytes (Jeffcoate et al., 2003) et favorise une présence accrue de substances pro-inflammatoires telles que TNF-α, IL-1 et IL-6 dans le sérum et au site des plaies des patients diabétiques (Tellechea et al., 2010). Les leucocytes de patients diabétiques ont également une capacité de chimiotactisme réduite ainsi qu’un défaut à s’autoactiver (Delamaire et al., 1997). Les plaies chroniques deviennent donc des portes d’entrée facilement accessibles à des bactéries telles que Staphylococcus aureus à l’origine de cellulites et d’ostéomyélites ou Clostridium perfringens à l’origine de la gangrène gazeuse (Fauci et al., 2008, Jeffcoate et al., 2003).
1.2.2.2 L’insuffisance veineuse
L’insuffisance veineuse est un problème du retour sanguin vers le cœur qui se manifeste principalement au niveau des membres inférieurs. D’ailleurs, plus de la moitié des cas d’ulcères au niveau des membres inférieurs sont partiellement ou totalement causés par un problème associé à la circulation veineuse (Gillespie et al., 2010). Elle est rencontrée plus fréquemment chez les femmes dans un ratio de 2,8 femmes pour 1 homme (Bevis et al., 2011). Plus de 600000 personnes aux États-Unis souffrent d’un ou de plusieurs ulcères veineux (Cherubino et al., 2011).
L’accumulation de sang veineux entraine la formation d’œdème chronique au niveau des pieds, des chevilles et des jambes atteintes. La pression exercée sur les petits capillaires des tissus par l’œdème diminue la perfusion et favorise la nécrose de la peau (Loots et al., 1998, Fauci et al., 2008). Les différents facteurs responsables de maintenir une guérison des plaies normale qui sont transmis par le sang sont alors moins accessibles localement (Fauci et al., 2008). Cette pression chronique modifie aussi la morphologie des capillaires et augmente leur perméabilité, les rendant parfois incapables de retenir les protéines plasmatiques et la fibrine (Loots et al., 1998). L’apparition d’ulcères est souvent précédée d’une dermatite progressive et ces ulcères sont généralement localisés au niveau des malléoles externes (Fauci et al., 2008).
1.2.3 Traitements des plaies cutanées
1.2.3.1 Méthodes de base
Les infections doivent être prises en charge rapidement par un antibiotique approprié. Un antibiotique topique peut être suffisant, mais le recours à un traitement systémique est souvent nécessaire (Fauci et al., 2008, Jeffcoate et al., 2003). L’utilisation systématique d’antibiotiques en présence d’ulcères n’est toutefois pas recommandée, l’amélioration globale de la guérison étant minime ou nulle en absence d’infection sévère (O'Meara et al., 2000, Game et al., 2012). Le débridage grossier des tissus nécrosés et la diminution de la charge exercée sur la plaie font couramment partie du traitement des ulcères (Bennett et al., 2003, Brunicardi et al., 2006). L’utilisation de bas-pression est une méthode efficace de favoriser la guérison de plaies causées par l’insuffisance veineuse (Fauci et al., 2008).
La prévention joue également un rôle de premier plan dans le traitement et la prise en charge des ulcères chroniques chez les patients à risque. Les principales mesures recommandées pour réduire le risque de chronicisation des plaies sont de choisir avec soin des chaussures appropriées, d’effectuer quotidiennement des mesures d’hygiène et une inspection des pieds, de réduire les comportements à risque de blessures (Ex. marcher pieds nus) et de consulter rapidement un professionnel en présence d’une blessure (Fauci et al., 2008). Dans le cas du diabète, un contrôle strict de la glycémie ainsi qu’une réduction des facteurs de risque cardiovasculaire contribuent à réduire l’incidence des plaies chroniques (DCCT_Research_Group, 1993, UKPDS_Group, 1998). Globalement, les traitements de base devraient toujours être employés avant d’avoir recours à des technologies plus complexes et souvent plus coûteuses (Harding et al., 2002).
1.2.3.2 Pansements synthétiques
Il existe de nombreux types de pansements ou de techniques de traitement des ulcères diabétiques et veineux. Parmi les technologies disponibles, il est difficile de statuer sur celles qui devraient être mise de l’avant en premier dans le traitement des ulcères
diabétiques, tel que conclu par une revue récente et exhaustive des méthodes disponibles (Game et al., 2012). L’utilisation d’un recouvrement d’hydrocholloïde, combiné ou non à un antiseptique topique, ou l’utilisation d’un recouvrement dit « sans adhérence » (pansement muni d’une substance grasse lubrifiante) semble présenter le même profil d’avantages dans le traitement (Game et al., 2012, Jeffcoate et al., 2009). Notons que l’utilisation d’une chambre hyperbare semble avoir une efficacité notable et prévient plusieurs complications graves (Londahl et al., 2010), malgré le fait que cette alternative coûteuse ne soit pas disponible dans tous les milieux. De plus, les pansements à pression négative pourraient présenter des avantages dans les délais de guérison, mais principalement lorsqu’utilisés dans le traitement de plaies postopératoires (Game et al., 2012, Blume et al., 2008).
1.2.3.3 Pansements cellulaires
Lorsque les options de traitement s’épuisent pour les patients atteints d’ulcères chroniques, il est possible d’avoir recourt à des alternatives dites cellulaires ou biologiques. Ces technologies en développement depuis les années 80 commencent à entrer sur le marché et à faire leurs preuves comme étant cliniquement efficaces et sécuritaires. Une méta-analyse des différents recouvrements cellulaires commercialement disponibles montre d’ailleurs une supériorité globale de ces technologies par rapport au traitement conventionnel et une réduction notable du taux d’infection des plaies chroniques traitées (Teng et al., 2010).
Le premier tissu reconstruit approuvé et utilisé pour le traitement d’ulcères chroniques a été Apligraf®. Il a été approuvé pour le traitement des ulcères veineux en 1998 et pour le traitement des ulcères diabétiques en 2000 en démontrant qu’il augmente le nombre de fermeture complète des plaies (47% versus 19% des contrôles sur 6 mois pour les ulcères veineux) en plus d’augmenter la vitesse de guérison complète (Zaulyanov et al., 2007, Falanga et al., 1999). Ces premières utilisations remontent à 1995 comme un recouvrement potentiel de plaies post-chirurgicales (Eaglstein et al., 1995). Ce recouvrement bilamellaire est composé de fibroblastes néonataux ensemencés dans une matrice de collagène bovin de type I recouvert de kératinocytes néonataux. Il s’agit donc
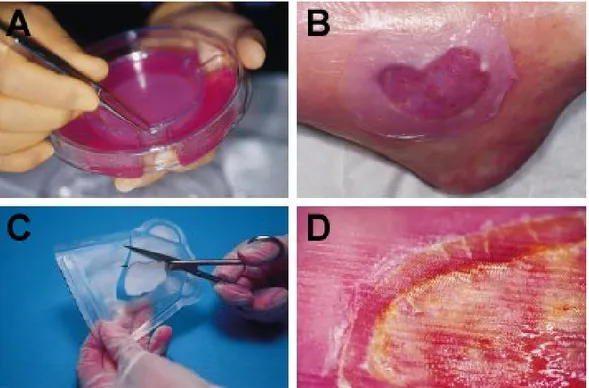
d’un recouvrement allogénique contenant des cellules vivantes. Son mécanisme d’action est imprécis, mais il est avancé que l’action de cytokines sécrétées par le pansement telles que les interférons α et β, le PDGF et certaines interleukines ainsi que la sécrétion de composantes servant à la formation de matrice extracellulaire seraient à l’origine des effets bénéfiques d’Apligraf® [revu dans (Zaulyanov et al., 2007, Shevchenko et al., 2010)]. Il est actuellement le pansement biologique le plus couramment utilisé dans les cliniques spécialisées de traitement des plaies chroniques et constitue depuis l’étalon de comparaison dans l’étude d’autres types de pansements cellulaires. La Figure 1.5 A-B illustre l’utilisation d’Apligraf® pour recouvrir un ulcère chronique.
D’autres pansements cellulaires sont composés d’un seul type cellulaire, dont Dermagraft®, qui contient uniquement des fibroblastes néonataux. Ces fibroblastes sont ensemencés dans une matrice de polyglactine dégradable. Ce pansement est actuellement reconnu efficace pour recouvrir des ulcères veineux et diabétiques (Marston et al., 2003, Omar et al., 2004). Il agirait favorablement sur la néovascularisation et favoriserait également la migration des kératinocytes de la marge d’une plaie (Shevchenko et al., 2010). La manière d’utiliser Dermagraft® en clinique est illustrée à la Figure 1.5 C-D.
Figure 1.5 : Apparence générale des principaux pansements cellulaires disponibles commercialement. Apligraf® est commercialisé dans un contenant rigide (A) et doit être appliqué au-delà des marges de la plaie (B), tandis que Dermagraft® est disponible dans une enveloppe souple et doit être ajusté à la forme de la plaie (D). [Figure modifiée de (Harding et al., 2002)]
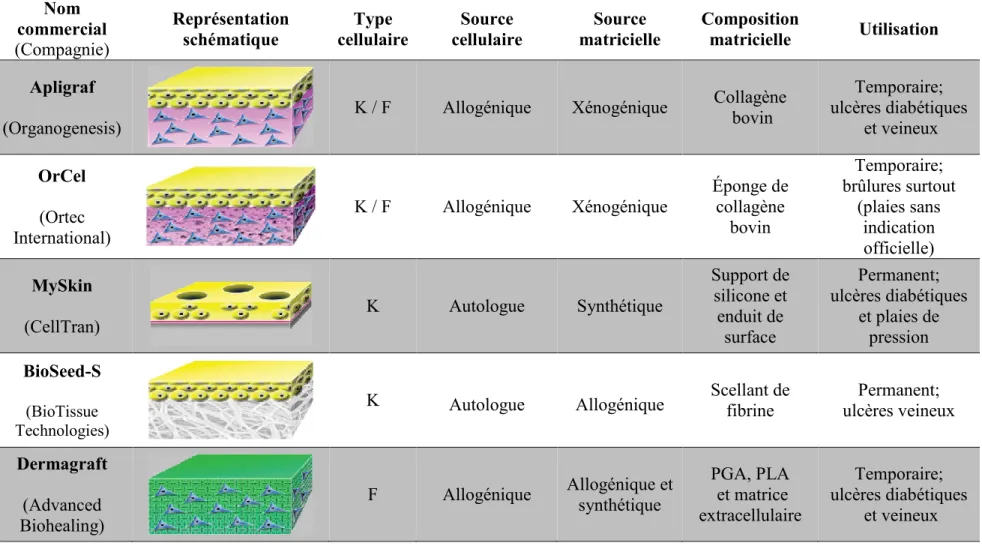
Il existe aussi quelques types de recouvrements cellulaires constitués seulement de kératinocytes. Les principales caractéristiques de ces pansements, ainsi que celles des pansements composés de fibroblastes seulement ou d’une combinaison (incluant Apligraf® et Dermagraft®), sont résumées dans le Tableau 1.1.
Tableau 1.1 : Principaux recouvrements biologiques disponibles en clinique pour le traitement de plaies chroniques. [Tableau traduit et adapté de(Shevchenko et al., 2010)]
Nom commercial (Compagnie) Représentation schématique Type cellulaire Source cellulaire Source matricielle Composition matricielle Utilisation Apligraf
(Organogenesis) K / F Allogénique Xénogénique
Collagène bovin Temporaire; ulcères diabétiques et veineux OrCel (Ortec International) K / F Allogénique Xénogénique Éponge de collagène bovin Temporaire; brûlures surtout (plaies sans indication officielle) MySkin (CellTran) K Autologue Synthétique Support de silicone et enduit de surface Permanent; ulcères diabétiques et plaies de pression BioSeed-S (BioTissue Technologies)
K Autologue Allogénique Scellant de fibrine Permanent; ulcères veineux Dermagraft (Advanced Biohealing)
F Allogénique Allogénique et synthétique
PGA, PLA et matrice extracellulaire Temporaire; ulcères diabétiques et veineux Abréviations : K, kératinocytes; F, fibroblastes; PGA, acide polyglycolique; PLA, acide polylactique.
Le coût de production de pansements partiellement ou entièrement composés de cellules est élevé et le bénéfice coût-efficacité d’utiliser de telles technologies a été remis en question par plusieurs auteurs (Dinh et al., 2006, Langer et al., 2009). Des pansements comme Apligraf® ont un coût unitaire de 28$/cm2 de pansement, ce qui surpasse grandement le coût d’un pansement plus traditionnel (Shevchenko et al., 2010). Il est donc important que les sommes sauvées par la réduction de la morbidité et de la durée du traitement surpassent ces coûts supplémentaires (Dinh et al., 2006). Une revue systématique récente des deux principaux pansements cellulaires commercialisés (Apligraf® et Dermagraft®) conclut que ces deux types de pansement ont un ratio coût-efficacité favorable lorsqu’utilisés chez des patients correctement sélectionnés (Langer et al., 2009), c’est-à-dire des patients pour qui une démarche de recouvrement de plaie traditionnelle prolonge notablement la durée du traitement. Le marketing, la disponibilité et la facilité d’utilisation (souvent décrit en anglais comme étant le « off-the-shelf use ») et la capacité de production de masse sont également des facteurs importants du succès commercial de ces pansements (Mansbridge, 2006).
Il existe d’autres types de recouvrement ne contenant pas de cellules vivantes, mais plutôt une matrice biologique servant à aider les mécanismes de guérison du corps à rebâtir le site d’une plaie. Une étude récente comparant les bénéfices d’utiliser une matrice de collagène nommée PriMatrix® en comparaison à l’utilisation d’Apligraf® conclut que la matrice appliquée de manière permanente au site de la plaie a permis de favoriser la guérison plus rapidement qu’Apligraf®, quoique les deux méthodes se soient avérées efficaces (Karr, 2011). Les différentes matrices à l’étude en guérison des plaies sont revues de manière extensive par Shevchenko et al (Shevchenko et al., 2010).
Certaines équipes de recherche envisagent de combiner les stratégies ayant un potentiel de promouvoir la guérison des plaies. En plus de concevoir un recouvrement ou une matrice contenant des cellules, ils proposent de modifier génétiquement ces cellules afin de les rendre productrices de molécules pro-angiogéniques ou de molécules favorables à la réépithélialisation. Ces stratégies de thérapie génique ont été revues par Branski et plus récemment par Gauglitz (Branski et al., 2009, Gauglitz et al., 2011).
1.3 Étude de la guérison des plaies cutanées et potentiel des
cellules souches extraites du tissu adipeux (CSTA)
Afin de décrire les mécanismes de guérison de la peau et d’étudier des pistes de solution en ce qui a trait au traitement des ulcères chroniques, des études in vitro et in vivo sont nécessaires avant d’envisager une transition clinique. Divers modèles ont été mis au point pour permettre des recherches fondamentales représentatives de la guérison humaine. Les cellules souches extraites du tissu adipeux ont d’ailleurs été l’objet de plusieurs études visant à caractériser leur potentiel à favoriser la guérison d’une plaie, entre autres par l’utilisation de tels modèles. Les propriétés sécrétoires des CSTA et des adipocytes présentent également un potentiel prometteur afin de favoriser la guérison des plaies. Ces cellules constituent une avenue intéressante dans la création de technologies servant à guérir des plaies chroniques.
1.3.1 Modèles animaux de la guérison des plaies cutanées
L’utilisation de modèles animaux est largement répandue dans l’évaluation de méthodes de traitement des plaies ainsi que dans l’étude des différentes phases de la guérison. Il existe plusieurs techniques afin de recréer un environnement se rapprochant au maximum de la guérison physiologique des plaies humaines. Il est possible de recréer des conditions pathologiques par des interventions locales ou systémiques chez des animaux, tels que l’induction d’un diabète insulinorésistant ou l’ischémie locale.
La souris demeure l’animal le plus fréquemment utilisé en raison de son accessibilité et de la variété des types disponibles commercialement. Afin d’évaluer l’impact de différentes interventions voulant favoriser la guérison des plaies, plusieurs types de souris ont été utilisés jusqu’à ce jour. Plus spécifiquement pour l’étude du potentiel de guérison des CSTA, certaines études ont utilisé des souris athymiques (Kim et al., 2007) et d’autres des souris diabétiques db/db (Nambu et al., 2009, Amos et al., 2010). Ces dernières ont une mutation génétique rendant le récepteur de la leptine inefficace, ce
qui provoque une prise de poids rapide, l’induction d’un diabète insulinorésistant dès les premières semaines de vie et une diminution de leurs capacités de guérison.
D’autres stratégies afin d’altérer la guérison normale des souris ont été explorées au cours des dernières années. L’irradiation est une méthode permettant d’atténuer les mécanismes de régénération locaux et systémiques par une destruction importante de la moelle osseuse, méthode déjà utilisée pour l’évaluation d’injections intraveineuses de CSTA (Ebrahimian et al., 2009). Une autre technique consiste à provoquer l’ischémie locale du tissu cutané. Elle consiste à implanter chirurgicalement un aimant circulaire sous la peau d’une souris et d’ajouter en surface un second aimant de force variable. Selon la durée de la présence de l’aimant et la pression créée sur le tissu, une plaie se forme graduellement au centre secondairement au manque de perfusion (Reid et al., 2004, Fang et al., 2008). Des souris athymiques sont également utilisées pour évaluer certains recouvrements de CSTA (Altman et al., 2009), malgré que ce type de souris ne présente pas d’anomalie franche dans les mécanismes de guérison. Elles sont utiles pour l’évaluation de xénogreffes humaines et permettent l’étude détaillée de certains mécanismes de guérison tels que l’angiogenèse à l’aide de cellules marquées (Davidson, 1998).
Peu importe le type de souris utilisé, il faut tenir compte des mécanismes particuliers de la guérison cutanée des rongeurs afin que les plaies produites s’apparentent à celle de l’humain. Les rongeurs possèdent globalement les mêmes phases de guérison décrites précédemment, mais le phénomène de contraction de la plaie est prédominant parmi les divers mécanismes (Davidson, 1998, Hayward et al., 1991, Fang et al., 2008). Près de 90% de la fermeture d’une lésion cutanée chez les rongeurs serait attribuable à la contraction (Hayward et al., 1991). Il est donc primordial de contrôler cette variable pour préserver la validité du modèle. L’une des techniques les plus répandues dans la littérature récente consiste à fixer à la peau une « attelle » faite de silicone ayant une forme de beigne. Une fois la plaie faite, le dispositif est centré autour de la plaie, collé à la peau et fixé par des sutures afin de supporter les marges de la plaie et retenir la force de contraction. Cette technique simple permet l’étude plus juste du phénomène de réépithélialisation autant chez les souris saines que diabétiques d’après une étude détaillée de la technique (Galiano et al., 2004). Contrairement aux chambres de Fusenig utilisées dans l’évaluation de greffe cutanée
chez le rongeur (Worst et al., 1974), cette méthode assure le support des tissus environnants tout en permettant à l’épiderme au pourtour de la plaie de refermer la plaie avec un minimum de contraction.
Le porc est également un modèle intéressant pour l’étude de la guérison des plaies. Le porc Yorkshire est probablement le modèle d’étude se rapprochant le plus des mécanismes de guérison de la peau humaine, particulièrement dans l’étude de la réépithélialisation (Vardaxis et al., 1997, Wang et al., 2000, Fang et al., 2008). La contraction est peu présente et les phénomènes de granulation et de réépithélialisation s’approchent de ceux chez l’humain. La principale limite de ce modèle est technique; les coûts d’hébergement et d’achat des animaux ainsi que le nombre limité d’animaux pouvant être utilisés rendent la validité statistique des études limitée (Davidson, 1998). Malgré ces limites, le porc permet de produire de multiples plaies par animal et constitue un modèle de choix dans l’étude de la réépithélialisation. Le porc a d’ailleurs déjà été utilisé pour l’étude des CSTA dans le traitement de plaies cutanées (Fu et al., 2007, Forcheron et al., 2012, Hadad et al., 2010)
Un autre modèle utilisé est l’oreille de lapin ischémique. En procédant à la ligature de deux des trois principales artères d’une oreille, il est par la suite possible de créer des plaies se comportant comme des ulcères chroniques (Steinberg et al., 2012, Ahn et al., 1990). Certains auteurs choisissent d’effectuer des plaies sur le lapin normal plutôt que la souris normale puisque la contraction y serait moins importante (Stoff et al., 2009).
1.3.2 Potentiel des cellules du tissu adipeux en guérison des plaies
cutanées
Les cellules souches extraites du tissu adipeux sont actuellement utilisées dans plusieurs domaines liés à la médecine régénératrice. Elles présentent l’avantage technique d’être une source abondante de cellules souches et facilement accessible. Elles sont entre autres utilisées expérimentalement dans la reconstruction orthopédique (Rada et al., 2009) et urologique (Jack et al., 2009). Elles font également l’objet d’études cliniques dans le traitement des fistules anales (Garcia-Olmo et al., 2009).
Les CSTA font également l’objet de beaucoup d’attention dans le traitement des plaies cutanées, dont les ulcères diabétiques et veineux. Différentes techniques d’administration des CSTA sont actuellement à l’essai, tel que revu récemment par Cherubino (Cherubino et al., 2011) et par notre propre équipe (Labbé et al., 2011b). La voie d’administration la plus fréquemment utilisée dans la littérature est l’application locale d’une suspension contenant des CSTA ou l’injection locale de celles-ci (Nie et al., 2011, Stoff et al., 2009, Lim et al., 2010, Lu et al., 2008, Park et al., 2008, Steinberg et al., 2012, Amos et al., 2010, Maharlooei et al., 2011). D’autres équipes ont plutôt misé sur la possibilité de manipuler le véhicule servant à administrer les CSTA. Notons entre autres l’utilisation de matrices de collagène (Nambu et al., 2009, Nambu et al., 2007), de matrices faites d’une combinaison collagène-élastine (de Vries et al., 1995) ou de matrices de fibroïne-chitosane (Altman et al., 2009). Jusqu’à ce jour, très peu d’études proposent une matrice manipulable et exempte de biomatériau exogène pour mettre une plaie en contact avec des CSTA ou des adipocytes.
De nombreux auteurs concluent qu’il existe un effet bénéfique notable d’appliquer des CSTA à une plaie. Parmi ceux-ci, Nie et al. conclut que les cellules souches extraites du tissu adipeux auraient des effets bénéfiques sur les phénomènes de réépithélialisation ainsi que sur la formation d’un tissu de granulation, lorsqu’injectées au site d’une plaie. Les effets ont été observés sur des plaies de rats diabétiques, mais aussi de rats non-diabétiques (Nie et al., 2011). Cette même étude montre également que les cellules souches sécrètent des cytokines qui favoriseraient la néovascularisation au site d’une plaie tel que le VEGF (Nie et al., 2011). Maharlooei et al. a également obtenu des résultats similaires, mais sans conclure que cet effet bénéfique à la guérison est médié par une vascularisation accrue. L’effet bénéfique serait attribuable à un autre mécanisme pour le moment inconnu.
Les cellules souches extraites du tissu adipeux agiraient également sur la prolifération des fibroblastes du derme. Le contact direct entre ces deux types cellulaires ainsi que les effets paracrines des CSTA favoriseraient le rétablissement du compartiment dermique dans un contexte de guérison de plaie (Kim et al., 2007). Ces résultats ne sont toutefois pas confirmés par Maharlooei qui observe une légère baisse du taux de prolifération des fibroblastes du derme (Maharlooei et al., 2011).
La plupart des études comparant l’effet des CSTA en guérison des plaies utilisent le véhicule seul ou un placebo comme comparatif afin de conclure de l’efficacité. Deux études récentes ont utilisé des fibroblastes dermiques à titre de comparatif, jugeant qu’il s’agit probablement du contrôle se rapprochant le plus de l’utilisation actuelle de thérapies cellulaires (décrites dans la section Pansements cellulaires 1.2.3.3) (Steinberg et al., 2012, Nie et al., 2011). Dans ces deux études, Nie démontre la supériorité des CSTA par rapport aux fibroblastes pour favoriser la fermeture de plaies chroniques tandis que Steinberg conclut que leurs effets s’équivalent (Nie et al., 2011, Steinberg et al., 2012).
1.3.2.1 Sécrétion de molécules bioactives
Les cellules souches extraites du tissu adipeux présentent un potentiel important pour favoriser la guérison de plaies chroniques. Ces cellules se caractérisent par leur capacité à produire une quantité notable de substances favorisant la réépithélialisation, la prolifération des cellules du derme ainsi que l’angiogenèse (Cherubino et al., 2011). Des molécules produites par les adipocytes ont également un potentiel notable pour favoriser la fermeture de plaies. Parmi ces substances, la leptine, le VEGF et l’angiopoïétine-1 présentent un intérêt particulier pour leurs effets multiples dans le processus de guérison.
1.3.2.1.1 Leptine
La leptine occupe une place importante dans la physiologie adipeuse et constitue une molécule d’intérêt dans la compréhension de l’obésité et de ses effets depuis sa découverte en 1994 (Friedman et al., 1998, Auwerx et al., 1998, Zhang et al., 1994). La leptine agit sur le contrôle de la satiété au niveau de l’hypothalamus. Lorsque sécrétée, elle diminue la faim et augmente la lipolyse ayant lieu dans les réserves adipeuses. Elle majore aussi à la hausse la sensibilité des cellules à l’insuline. Une mutation de son récepteur entraine chez la souris comme chez l’homme une obésité importante (Mantzoros et al., 2011). Cette observation a d’ailleurs donné lieu à divers modèles pour l’étude de l’obésité, du métabolisme des lipides et de la guérison des plaies (tel que revu dans la section 1.3.1).
La leptine a aussi fait l’objet d’études sur son rôle dans la guérison des plaies de la peau. Elle serait un facteur important dans la réépithélialisation des plaies chez les souris diabétiques. L’administration topique et systémique de leptine chez ces animaux réduirait entre autres l’atrophie des langues de migration aux marges de la plaie, favorisant ainsi une fermeture plus rapide des lésions (Frank et al., 2000, Ring et al., 2000). Les kératinocytes en marge d’une plaie seraient d’ailleurs particulièrement sensibles à la leptine grâce à un sous-type de récepteur (ObRb) exprimé durant la guérison d’une plaie (Frank et al., 2000). L’application topique de leptine aurait également un effet favorable sur les plaies non diabétiques (Frank et al., 2000).
La sécrétion locale de leptine est augmentée durant la guérison, suggérant que la leptine aurait potentiellement un effet de régulateur dans les mécanismes physiologiques (Murad et al., 2003, Poeggeler et al., 2010). La leptine agirait sur l’épithélium en guérison en favorisant entre autres la production de VEGF (Stallmeyer et al., 2001). Les cellules endothéliales seraient également influencées par la présence de leptine, favorisant ainsi positivement l’angiogenèse associée à la guérison cutanée (Poeggeler et al., 2010, Liapakis et al., 2008).
1.3.2.1.2 VEGF
Le facteur de croissance de l’endothélium vasculaire, ou VEGF, est une protéine principalement impliquée dans la migration et la prolifération endothéliale lors de la genèse de nouveaux vaisseaux sanguins (Ferrara et al., 2003). Elle est surtout produite par les cellules endothéliales, mais elle est également retrouvée dans le sécrétome des cellules stromales (Rehman et al., 2004) et des adipocytes du tissu adipeux (Rega et al., 2007).
En plus de l’effet angiogénique du VEGF qui contribue à la guérison des plaies, la molécule aurait un effet direct sur les kératinocytes en guérison. Les kératinocytes seraient munis de récepteurs VEGFR-1 et VEGFR-2 sur leur membrane cytoplasmique. En exposant les kératinocytes en monocouche à du VEGF, il y aurait augmentation du taux de prolifération et de la vitesse de migration (Man et al., 2006). L’effet du VEGF en guérison
![Figure 1.2 : Schématisation de la jonction dermo-épidermique. [Figure modifiée de (Karp, 2004)]](https://thumb-eu.123doks.com/thumbv2/123doknet/6644701.181513/24.918.214.660.281.571/figure-schématisation-jonction-dermo-épidermique-figure-modifiée-karp.webp)