Étude comparative de combinaisons de peptides pour la
livraison de protéines dans les cellules de mammifères
Thèse
Jean-Pascal Lepetit-Stoffaes
Doctorat en génie chimique
Philosophiae doctor (Ph.D.)
Québec, Canada
Étude comparative de combinaisons de peptides pour la
livraison de protéines dans les cellules de mammifères
Thèse
Jean-Pascal Lepetit-Stoffaes
Sous la direction de :
Alain Garnier, directeur de recherche
Bruno Gaillet, codirecteur de recherche
Résumé
Encore aujourd'hui, l’expression de protéines recombinantes dans les cellules de mammifères se fait principalement par transfection d’acides nucléiques codant pour cette protéine. Or, une alternative, la livraison directe de protéines, suscite un intérêt grandissant depuis près de trente ans, avec la découverte de séquences peptidiques ayant la capacité de pénétrer les cellules et de déstabiliser les membranes. Ainsi, des stratégies de livraison de protéines employant ces peptides se sont détachées des systèmes synthétiques tels que les polymères et les lipides cationiques. Parmi ces peptides, on retrouve notamment, d’une part, les peptides de pénétration cellulaire (Cell Penetrating Peptides - CPP) qui sont capables d’amener une protéine liée dans la cellule par endocytose, mais peinent à franchir la barrière endosomale ; d'autre part, des peptides de fuite des endosomes (Endosomal Leakage Domains - ELD), permettant de déjouer ce goulot d’étranglement de la livraison. Cette thèse s'intéresse principalement à l’étude de la livraison de protéines via la combinaison de CPP et d’ELD. Une avenue d'intérêt qui a été identifiée consiste à co-incuber les cellules avec différentes combinaisons d'un mélange de ces peptides avec la protéine à livrer, sans liaison covalente. Ainsi, les peptides CPP-ELDs ont permis de livrer la protéine fluorescente GFP seule, mais aussi la GFP fusionnée à un domaine d’importation nucléaire qui a pu rejoindre le noyau de divers types cellulaires. En particulier, le peptide 6His-CM18-PTD4 a été particulièrement investigué pour la livraison de diverses protéines d’intérêt. 6His-CM18-PTD4 a permis la livraison du facteur de transcription HoxB4 ainsi que des nucléases Cas9 et Cpf1 pour réaliser leur fonction d’édition génomique. Les propriétés et mécanismes de livraison des CPP-ELDs ont été étudiés. Ainsi, des mécanismes d’endocytose et de translocation directe vers le cytoplasme ont été identifiés et étudiés. La répartition entre ces voies d’entrée cellulaire peut varier suivant la nature du peptide CPP-ELD ou de divers facteurs de livraison tels que sa concentration. Globalement, les mécanismes de livraison ont été étudiés par l’emploi de la protéine GFP et d’autres sondes fluorescentes (calcéine, FITC-dextranes). Les CPP-ELDs sont capables de livrer des molécules de petite taille (600 Da) jusqu’à des poids moléculaires importants (250 kDa). Cette capacité à livrer de grandes protéines a été validée par l’entrée cellulaire des nucléases Cas9 et Cpf1, ainsi que d’anticorps. L’analyse de la composition ainsi que des structures secondaires supposées a permis d’identifier des critères nécessaires pour l’efficacité de livraison dans les cellules de mammifères pour des applications de recherche et thérapeutiques.
Abstract
The expression of proteins in mammalian cells is still today mostly done by transfection of nucleic acids coding for the protein. An alternative, the direct delivery of proteins, has roused a growing interest for the past thirty years, since the discovery of peptide sequences with the capacity to penetrate the cells and destabilize the membranes. Thereby, strategies of protein delivery associating these peptides to the cargo protein differentiate from synthetic systems like cationic polymers and lipids. Among these peptides are found Cell Penetrating Peptides (CPP), which are able to bring a linked protein to the cell by endocytosis, but lack to cross the endosomal barrier. We also find peptides, which permit the endosomal escape of a cargo, the Endosomal Leakage Domains (ELD), in order to evade this bottleneck. This thesis is interested in the study of protein delivery, by means of the combination of CPP and ELD. An identified way of interest consists in co-incubating the mammalian cells with different combinations of a mix of these peptides with the protein to be delivered, without covalent link. Thereby, the CPP-ELDs permitted the delivery of the GFP fluorescent protein alone, as well as the GFP in fusion with a nuclear localization domain, which was found in the nuclei of several cellular types. In particular, the 6His-CM18-PTD4 peptide has been notably investigated for the delivery of various proteins. It enabled the delivery of the HoxB4 transcription factor, as well as the Cas9 and Cpf1 nucleases to realize their genome editing function. The properties and mechanisms of CPP-ELDs have been studied. Therefore, the endocytosis mechanism and the direct translocation to the cytoplasm have been identified and studied. The balance between these cellular pathways can vary depending on the nature of the CPP and the ELD, and on the delivery factors such as the peptide concentration. Overall, the delivery mechanisms have been studied by using GFP protein, and other fluorescent probes (calcein and FITC-Dextrans). The CPP-ELDs are able to deliver small size molecules (600 Da) to molecules with high molecular weight (250 kDa). The capacity to deliver big proteins has been confirmed by the cellular entry of the Cas9 and Cpf1 nucleases, but also with antibodies. The analysis of the biochemical properties and assumed secondary structures allowed identifying several criteria required for the efficient delivery in mammalian cells, for discovery and therapeutic applications.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... viii
Liste des figures ... ix
Liste des abréviations ... xi
Remerciements ... xiv
Avant-propos ... xvi
1 Introduction et objectifs de la thèse ... 1
1.1 Introduction ... 2
1.2 Objectif général ... 3
1.3 Objectifs spécifiques ... 3
2 Synthèse de la littérature ... 5
2.1 Introduction ... 6
2.2 Étapes du transport cellulaire d’une protéine ... 7
2.2.1 Milieu extracellulaire... 8
2.2.2 Membrane plasmique... 8
2.2.3 Endocytose et endosomes ... 8
2.2.4 Cytoplasme ... 9
2.2.5 Importation vers un organite spécifique ... 10
2.3 Moyens peptidiques de livraison inspirés de mécanismes naturels ... 10
2.3.1 Livraison de protéines cargo par peptide de pénétration cellulaire ... 10
2.3.1.1 TAT, premier peptide de pénétration cellulaire... 12
2.3.1.2 CPPs amphiphiles primaires ... 13
2.3.1.3 CPPs amphiphiles secondaires ... 14
2.3.1.4 CPPs non-amphiphiles ... 14
2.3.1.5 Fusion des CPPs aux protéines ... 15
2.3.1.6 Mécanismes d’entrée des CPPs dans les cellules de mammifères ... 15
2.3.1.7 Études comparatives de différents CPPs ... 16
2.3.1.8 Limites d’utilisation des CPPs ... 17
2.3.2 Domaines de fuite des endosomes ... 19
2.3.2.1 ELDs dépendants du pH ... 20
2.3.2.2 ELDs indépendants du pH ... 21
2.3.2.3 Différents emplois des ELDs ... 22
2.4 Voies de livraison ... 22
2.4.1 Voies de livraison envisagées ... 22
2.4.1.1 Translocation directe ... 23
2.4.1.2 Endocytose ... 24
2.4.1.3 Facteurs influençant les voies de livraison des protéines ... 25
2.4.1.4 Endosomes, barrière critique de la livraison protéique ... 26
2.4.2 Stratégies pour la fuite des endosomes ... 29
2.4.2.1 ELDs en fusion avec les protéines ... 29
2.4.2.2 Stratégie de fusion des ELDs avec des CPPs ... 29
2.4.2.3 Autres stratégies de livraison de protéines avec des peptides ... 42
2.4.3.1 Propriétés biochimiques des peptides impliquées dans la livraison des protéines ... 44
2.4.3.2 Propriétés structurales des peptides nécessaires à la livraison de protéines ... 45
2.4.3.3 Criblage de CPP-ELDs ... 48
2.4.3.4 Différents types de protéines livrées ... 49
2.4.3.5 Études de toxicité des peptides de livraison de protéines ... 51
2.5 Méthodes analytiques de suivi de la pénétration cellulaire et de la fuite des endosomes ... 51
2.5.1 Méthodes d’identification des voies de livraison ... 51
2.5.2 Détection de la fuite des endosomes et étude de ses mécanismes ... 52
2.6 Synthèse et conclusions ... 54
3 Combinaison de peptides de fusion incluant un CPP et un ELD pour la livraison de protéines en cellules de mammifères ... 57
3.1 Introduction ... 58
3.2 Livraison de la protéine fluorescente GFP ... 58
3.2.1 CPPs fusionnés avec la protéine GFP ... 58
3.2.2 CPP et ELD fusionnés avec la protéine GFP ... 62
3.2.3 Bilan de la livraison de la protéine GFP fusionnée avec des peptides de livraison ... 63
3.3 Livraison de la protéine GFP avec des peptides de livraison par co-incubation ... 64
3.3.1 Emploi de CPP et ELD indépendants ... 64
3.3.2 Fusion de CPP et ELD en co-incubation avec la protéine GFP ... 66
3.4 Sélection et combinaison de domaines CPPs et ELDs pour la conception de peptides de livraison par co-incubation ... 68
3.4.1 Choix des ELD et CPP, et génération des peptides CPP-ELD ... 69
3.4.2 Choix du protocole de livraison avec les peptides CPP-ELDs ... 71
3.4.3 Sélection de peptides CPP-ELDs efficaces pour la livraison de protéines... 72
3.4.3.1 Sélection des meilleurs CPPs ... 75
3.4.3.2 Sélection des meilleurs ELDs ... 75
3.4.3.3 Influence de la position des domaines ELD et CPP dans le peptide ... 76
3.4.3.4 Optimisation de l’efficacité de livraison de CPP-ELD par l’ajout d’histidines ... 76
3.4.3.5 Optimisation de l’efficacité de livraison de peptide CPP-ELD par l’ajout de cystéines ... 79
3.4.3.6 Optimisation de l’efficacité de livraison de peptide CPP-ELD par l’ajout de résidus glycine et sérine ... 79
3.4.4 Efficacité des CPP-ELDs et disponibilité de la protéine livrée ... 80
3.5 Conclusion ... 83
3.6 Méthodes ... 84
4 Membrane permeabilizing amphiphilic peptide delivers recombinant transcription factor and CRISPR-Cas9/Cpf1 ribonucleoproteins in hard-to-modify cells ... 88
4.1 Résumé ... 89
4.2 Abstract ... 90
4.3 Introduction ... 91
4.4 Results and Discussion ... 92
4.4.1 6His-CM18-PTD4 safely and efficiently delivers GFP-NLS to multiple mammalian cell types. ... 92
4.4.2 6His-CM18-PTD4 enables repeated HoxB4 transcription factor delivery to maintain gene regulation ... 94
4.4.3 6His-CM18-PTD4 delivers functional CRISPR Cas9/Cpf1 RNP complexes in hard-to-modify NK cells ... 97
4.4.4 6His-CM18-PTD4 co-delivers multiple CRISPR RNP systems in the same cells and promote directed homologous recombination ... 100
4.4.5 6His-CM18-PTD4 activates translocation and endocytosis in a concentration-dependent manner ... 102
4.4.7 6His-CM18-PTD4 owns relevant features for cell therapy manufacturing... 107
4.5 Supporting information ... 109
4.6 Acknowledgements ... 110
4.7 Authors contribution ... 110
4.8 Materials and Methods ... 110
5 Autres études des peptides de livraison CPP-ELDs ... 118
5.1 Introduction ... 119
5.2 Diverses propriétés de pénétration cellulaire des CPP-ELDs ... 119
5.2.1 Co-livraison de deux protéines par les CPP-ELDs ... 119
5.2.1.1 Co-livraison des protéines fluorescentes GFP et mCherry ... 119
5.2.1.2 Co-livraison des protéines GFP et HoxB4, de Cas9 et Cpf1 ... 121
5.2.2 Distinction entre protéine livrée intracellulaire ou membranaire ... 121
5.2.3 Comparaison avec le peptide Chariot ... 122
5.2.4 Cinétique rapide du peptide 6His-CM18-PTD4 pour la livraison de protéines ... 123
5.2.5 Livraison de protéine fluorescente GFP dans des cellules primaires et lignées cellulaires ... 125
5.3 Étude des mécanismes cellulaires impliqués dans la livraison de protéines ... 127
5.3.1 Utilisation d’agents fluorescents pour l’étude des mécanismes de livraison ... 127
5.3.2 Étude de la livraison de GFP-NLS ... 128
5.3.3 Étude de la livraison de calcéine ... 130
5.3.4 Voies d’entrée cellulaire, translocation directe et fuite des endosomes ... 135
5.3.4.1 Fuite de calcéine et inhibiteurs des voies endocytaires ... 136
5.3.4.2 Répartition entre translocation et endocytose des peptides CPP-ELDs... 139
5.3.4.3 Étude de la fuite de calcéine dans d’autres types cellulaires ... 143
5.3.4.4 Influence de la taille de la molécule à livrer par les CPP-ELDs ... 144
5.4 Applications de livraisons de protéines par les peptides CPP-ELDs ... 147
5.4.1 Livraison du facteur de transcription HoxB4... 147
5.4.2 Livraison des nucléases Cas9 et Cpf1 pour l’édition génomique dans les cellules de mammifères ... 148
5.4.3 Livraison d’anticorps ... 151
5.5 Analyse des séquences protéiques des CPP-ELDs ... 154
5.5.1 Analyse de la composition en acides aminés ... 155
5.5.2 Analyse des structures prédites ... 158
5.6 Conclusion ... 161 5.7 Méthodes ... 163 Conclusion ... 168 Perspectives ... 176 Bibliographie ... 178 Annexes ... 200
Liste des tableaux
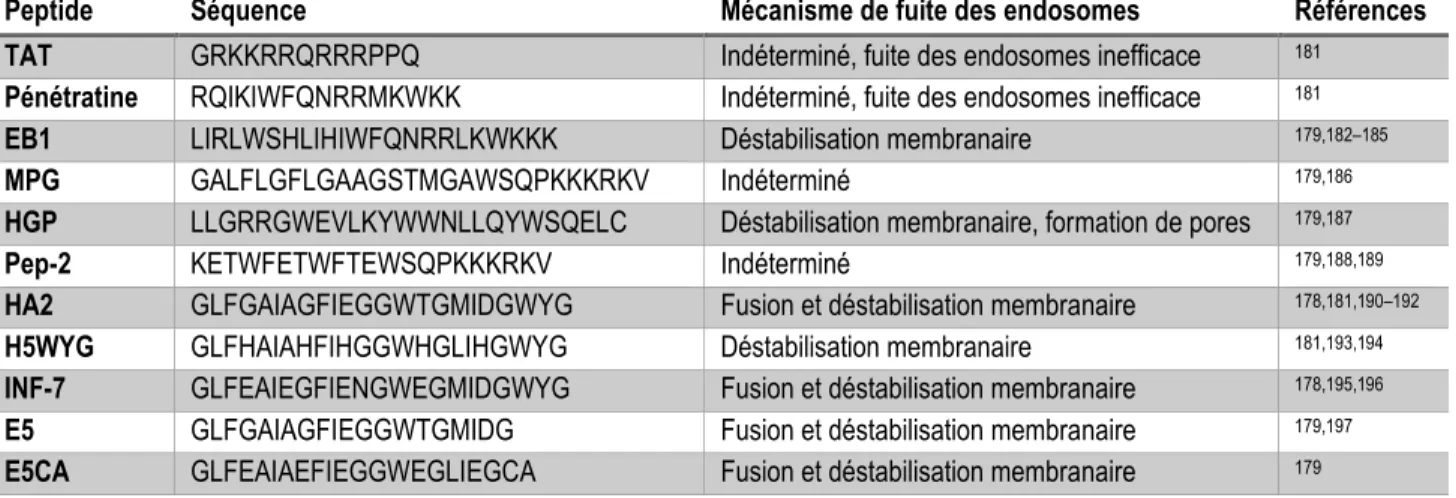
Tableau 1 - Peptides de pénétration cellulaire couramment retrouvés dans la littérature ... 11
Tableau 2 - Peptides de fuite des endosomes couramment rapportés dans la littérature ... 19
Tableau 3 - CPP-ELDs retrouvés dans la littérature ... 41
Tableau 4 - Protéines recombinantes de fusion GFP, GFP-NS et CPP-GFP ... 59
Tableau 5 - Résultats de cytométrie de flux de livraison de GFP fusionnée à des CPPs ... 60
Tableau 6 - Protéines recombinantes de fusion CPP-ELD-GFP ... 62
Tableau 7 - Livraison de GFP-NLS en co-incubation avec CPP et/ou ELD en cellules HeLa ... 65
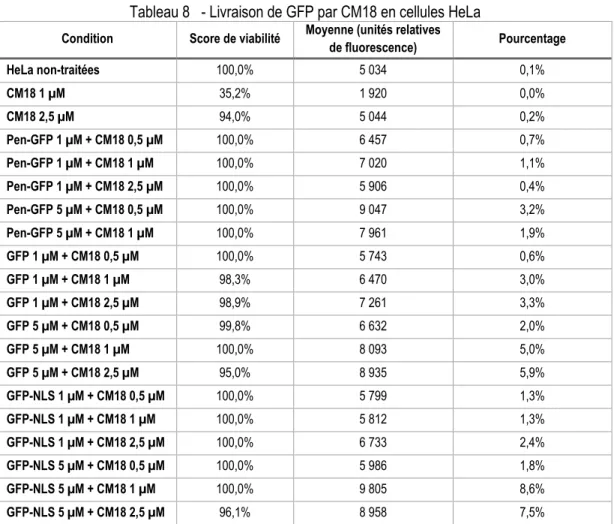
Tableau 8 - Livraison de GFP par CM18 en cellules HeLa ... 65
Tableau 9 - Domaines CPPs et ELDs ... 69
Tableau 10 - Peptides contrôles CPP et ELD ... 70
Tableau 11 - Peptides CPP-ELD ... 70
Tableau 12 - Séquence primaire des protéines GFP-NLS et mCherry-NLS ... 120
Tableau 13 - Types cellulaires employés ... 125
Liste des figures
Figure 1 - Les voies d’entrée cellulaire, incluant l’endocytose et le devenir des biomolécules livrées
(Chou et al., 2011) ... 9
Figure 2 - Pénétration de quatre CPPs (Sugita et al. 2008) ... 17
Figure 3 - Les voies de livraison d’endocytose et de translocation directe (Poillot et De Waard, 2011) ... 23
Figure 4 - Les mécanismes de la fuite des endosomes (Martens et al., 2014) ... 27
Figure 5 - Mécanisme de fuite des endosomes dit "tapis" (Mudhakir et Harashima, 2009) ... 28
Figure 6 - Stratégie d'un agent protéique multidomaines (Glover et al. 2009) ... 30
Figure 7 - Livraison de CPP-ELD-NLS-protéine (Liou et al. 2012)... 31
Figure 8 - CPP-ELD pour la livraison de TAT-Cre (Wadia et al. 2004) ... 32
Figure 9 - Fuite des endosomes d'un cargo endocyté provoquée par HA2-TAT (Sugita et al. 2007) ... 33
Figure 10 - Livraison d'un CPP-cargo en co-incubation avec HA2-TAT (Sugita et al. 2007) ... 34
Figure 11 - Rendements de livraison de mCherry par E5-TAT (Lee et al. 2010) ... 36
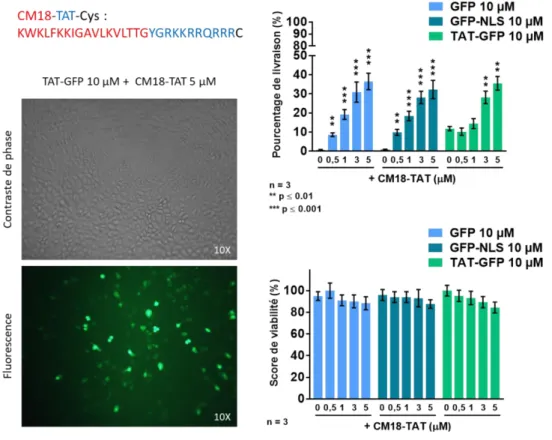
Figure 12 - Stratégie des CPP-ELDs (Lee et al. 2010) ... 37
Figure 13 - Structure tridimensionnelle de CM18-TAT (Salomone et al. 2012) ... 38
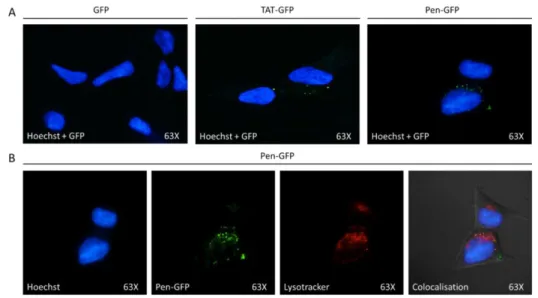
Figure 14 - Livraison de TAT-GFP par CM18-TAT (Salomone et al. 2012) ... 39
Figure 15 - Mécanisme de fuite des endosomes de CM18-TAT (Fasoli et al. 2014) ... 40
Figure 16 - Images de microscopie à fluorescence de la livraison de P21-mR-8R en cellules NIH3T3 (Dixon et al. 2016) ... 42
Figure 17 - Catégorisation du mode de livraison recherché (Kauffman et al. 2015) ... 45
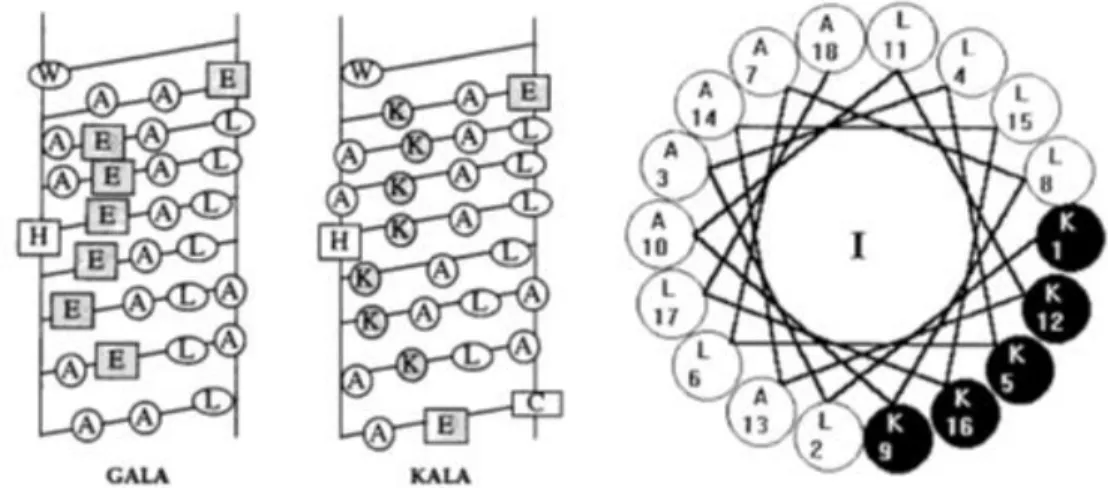
Figure 18 - Vue latérale d'hélice alpha des peptides GALA et KALA (Wyman et al. 1997) et projection d'hélice alpha du peptide KLA1 (Scheller et al. 1999) ... 46
Figure 19 – Modèle d’entrée de CPPs dans les cellules de mammifères selon la température (Jones, 2007) ... 52
Figure 20 - Résultats de microscopie à fluorescence de livraison de GFP fusionnée à des CPPs ... 60
Figure 21 - Microscopie confocale de livraison de CPP-GFP en cellules HeLa ... 61
Figure 22 - Microscopie à fluorescence de livraison de ELD-CPP-GFP en cellules HeLa ... 62
Figure 23 - Livraison de protéines GFP par CM18-TAT en cellules HeLa ... 66
Figure 24 - Temps d’incubation pour la livraison de protéines GFP par CM18-TAT en cellules HeLa ... 67
Figure 25 - Livraison de protéines GFP-NLS par CM18-TAT dans cellules en suspension THP1 ... 68
Figure 26 - Temps d'incubation et dose-réponse de livraison de GFP-NLS en cellules HeLa ... 71
Figure 27 - Criblage des variants CPP-ELD (20 µM) pour la livraison de GFP-NLS (5 µM) en cellules HeLa (cytométrie de flux) ... 73
Figure 28 - Criblage des variants CPP-ELD pour la livraison de GFP-NLS en cellules HeLa (microscopie à fluorescence) ... 74
Figure 29 - Influence d'une séquence riche en histidines sur la livraison de protéines en cellules HeLa ... 76
Figure 30 - Influence de séquences riches en histidines dans le peptide CM18-PTD4 ... 78
Figure 31 - Influence de séquences riches en cystéines dans le peptide CM18-PTD4 ... 79
Figure 32 - Influence de séquences de liaison entre CM18 et PTD4 ... 80
Figure 33 - Localisation intracellulaire de GFP-NLS par microscopie à fluorescence ... 81
Figure 34 - Localisation intracellulaire de GFP-NLS par microscopie confocale à fluorescence ... 82
Figure 35 - 6His-CM18-PTD4 efficiently and safely delivers GFP-NLS into the cytosol after one-minute co-incubation with various mammalian cells. ... 93
Figure 36 - Successful repeated deliveries of the HoxB4 transcription factor with 6His-CM18-PTD4 maintain gene regulation in human monocytes THP1. ... 96
Figure 37 - Robust genome editing after 6His-CM18-PTD4-mediated delivery of CRISPR/Cas9 and
CRISPR/Cpf1 RNP complexes in HeLa, Jurkat and NK cells. ... 99
Figure 38 - Successful directed recombination and multiple gene editing after co-incubating 6His-CM18-PTD4 and CRISPR RNPs ... 101
Figure 39 - 6His-CM18-PTD4 activates both translocation and endocytosis mechanisms ... 104
Figure 40 - 6His-CM18-PTD4 efficiently deliver proteins into the cytosol of mammalian cells... 109
Figure 41 - Co-livraison de GFP-NLS et mCherry-NLS par 6His-CM18-PTD4 dans les cellules HeLa .... 120
Figure 42 - Livraison de protéine GFP-NLS dans les cellules en suspension ... 122
Figure 43 - Comparaison de livraison de GFP-NLS avec le peptide commercial Chariot ... 123
Figure 44 - Suivi de l'importation nucléaire de GFP-NLS... 124
Figure 45 - Livraison de GFP-NLS dans divers types cellulaires ... 126
Figure 46 - Suivi des voies d'entrée cellulaire ... 128
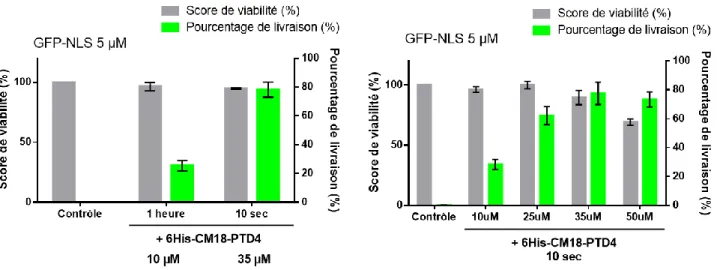
Figure 47 - Mécanismes de livraison de GFP-NLS par 6His-CM18-PTD4 ... 130
Figure 48 - Test de fuite de calcéine en cellules HeLa ... 131
Figure 49 - Fuite de calcéine par CPP, ELD et CPP-ELD ... 132
Figure 50 - Criblage et dose-réponse des CPP-ELDs ... 133
Figure 51 - Fuite de calcéine des variants de 6His-CM18-PTD4 ... 134
Figure 52 - Microscopie de la fuite de calcine en cellules HeLa ... 136
Figure 53 - Fuite de calcéine 6His-CM18-PTD4 - Drogues et basse température ... 137
Figure 54 - Fuite de calcéine 6His-CM18-PTD4 - Inhibition de la macropinocytose par l’amiloride... 138
Figure 55 - Dépendance de la température pour la fuite de calcéine ... 139
Figure 56 - Voies de fuite de calcéine de 6His-CM18-PTD4 ... 140
Figure 57 - Voies de fuite de calcéine de TAT-KALA ... 141
Figure 58 - Voies de fuite de calcéine de 6His-LAH4-TAT-6His ... 141
Figure 59 - Evaluation de la fuite de calcéine par CM18-TAT dans les myoblastes ... 143
Figure 60 - Fuite de dextrane-FITC de 10 kDa par 6His-CM18-PTD4 ... 145
Figure 61 - Cytométrie de flux de différentes tailles de dextrane-FITC en cellules HeLa ... 146
Figure 62 - Détection qPCR après livraison de HoxB4 par des peptides CPP-ELDs ... 148
Figure 63 - Immunofluorescence de Cas9 ... 149
Figure 64 - Criblage de livraison de Cas9 en cellules HeLa ... 150
Figure 65 - Livraison d'anticorps anti-tubuline par CPP-ELD ... 152
Figure 66 - Livraison d'anticorps par CPP-ELD ... 153
Figure 67 - Livraison d'anticorps anti-actine à dose croissante de 6His-CM18-PTD4 ... 154
Figure 68 - Analyse PEP-FOLD3 et projection d'hélice alpha de 6His-CM18-PTD4 ... 159
Figure 69 - Caractère amphiphile des CPP-ELDs ... 160
Liste des abréviations
AAV Virus adéno-associés (Adeno-Associated Virus, AAV)
ADN Acide désoxyribonucléique
ANP Acides nucléiques peptidiques, ANP (Peptide Nucleic Acid, PNA)
ARN Acide ribonucléique
BSA Albumine de sérum bovin (Bovin Serum Albumin)
CHO Cellules d’ovaires de hamster de Chine (Chinese Hamster Ovary cells) CPP Peptide de pénétration cellulaire (Cell Penetrating Peptide)
CRISPR Courtes répétitions palindromiques groupées et régulièrement espacées (Clustered Regularly Interspaced Short Palindromic Repeats)
crRNA ARN CRISPR (CRISPR RNA)
CTP Peptide de ciblage cellulaire (Cell-Targeting Peptide)
DMEM Milieu minimum essentiel de Eagle modifié Dulbecco (Dulbecco's Modified Eagle's Medium)
DMSO Diméthylsulfoxyde
DO Densité optique
DT Toxine diphtérique (Diphteria Toxin)
EDTA Acide éthylène diamine tétra-acétique (ethylenediaminetetraacetic acid) ELD Domaine de fuite des endosomes (Endosomal Leakage Domain) FITC Isothiocyanate de fluorescéine (Fluorescein isothiocyanate)
FPLC Chromatographie liquide rapide de protéines (Fast Protein Liquid Chromatography) FSC Dispersion frontale (forward scatter)
GAG Glycosaminoglycane
GFP Protéine fluorescente verte (Green Fluorescent Protein)
HB EGF Facteur de croissance épidermique se liant à l’héparine (Heparin-Binding Epidermal Growth Factor)
HPLC Chromatographie en phase liquide à haute performance (High-Performance Liquid Chromatography)
HSPG Héparanes sulfates protéoglycanes
iPSC Cellules souches pluripotentes induites (Induced Pluripotent Stem Cells) MAP Peptide membranaire actif (Membrane Active Peptide)
MTS Séquence de ciblage mitochondrial (Mitochondrial Targeting Sequence)
NK Cellules « Natural Killer »
NLS Signal d’importation nucléaire (Nuclear Localisation Signal)
PAGE Électrophorèse en gel de polyacrylamide (Polyacrylamide Gel Electrophoresis) PBS Tampon phosphate (Phosphate-Buffered Saline)
PCI Internalisation photochimique (Photochemical internalization)
PCR Amplification en chaîne par polymérase (Polymerase Chain Reaction)
PEI Polyéthylèneimine
pH Potentiel hydrogène
pI Point isoélectrique
PMAP Peptide d’interaction membranaire dépendant du pH (pH-Dependent Membrane Active Peptide)
PTD Domaine peptidique de transduction (Protein Transduction Domain)
qPCR Amplification en chaîne par polymérase quantitative (quantitative Polymerase Chain Reaction)
RFP Protéine fluorescente rouge (Red Fluorescent Protein)
RNP Complexe ribonucléoprotéique
ROS Dérivé réactif de l'oxygène (Reactive Oxygen Species)
RPM Rotation Par Minute
SCARA Récepteur « scavenger » de classe A (class-A scavenger receptors)
scFv Anticorps de type Fragment variable simple chaîne (single-chain variable Fragment)
SDS Dodécylsulfate de sodium
siRNA Petit ARN interférent (Small interfering RNA)
SMTP Peptide de translocation membranaire (Spontaneous Membrane-Translocating Peptide)
SSC Dispersion latérale (side scatter)
TALENs Nucléases effectrices de type activateur de transcription (Transcription Activator-Like Effector Nucleases)
TFA Acide trifluoroacétique (Trifluoroacetic acid)
tracrRNA ARN CRISPR trans-activateur (trans-activating crRNA)
VC Volume de colonne
Remerciements
J’aimerais remercier toutes les personnes qui ont permis le succès de mes études de doctorat, qui ont été une expérience extrêmement enrichissante, aussi bien sur le plan professionnel qu’humain.
Je remercie chaleureusement mon directeur de recherche, le professeur Alain Garnier, pour son soutien et sa confiance dans ce projet tout au long de ce doctorat. Je vous remercie d’avoir cru en moi et de m’avoir aidé à me surpasser. Merci de m’avoir offert l’opportunité de mener des études graduées poussées vers l’excellence.
Merci à mon co-directeur de recherche, le professeur Bruno Gaillet, pour m’avoir intégré dans ce projet de recherche. Merci pour tous vos conseils durant ces années qui m’ont aidé à mieux mener mon projet.
Merci au professeur Jacques P. Tremblay, ainsi qu’à Mme Chantale Maltais et M. Daniel Agudelo, pour leur expertise et leur aide dans les projets auxquels j’ai participé avec grand plaisir.
Un grand merci à mon superviseur industriel, le docteur David Guay, qui m’a accompagné et aidé durant ce doctorat. Je te remercie de m’avoir intégré dans les activités de recherche menées à Feldan Therapeutics.
Merci au docteur François-Thomas Michaud, Président Directeur Général et Co-fondateur de Feldan Therapeutics, pour sa confiance. Mon projet professionnel sur les biotechnologies industrielles est devenu concret grâce à toi. J’ai également pu bénéficier d’une bourse industrielle par ton soutien. J’ai beaucoup appris en tant que scientifique industriel et en tant que personne.
Un remerciement particulier au docteur Thomas Del’Guidice, avec qui j’ai énormément travaillé ces dernières années. J’ai apprécié ton investissement dans ce projet pour l’amener à une technologie pleine de promesses. J’ai eu beaucoup de plaisir à travailler avec toi.
Mes remerciements à mes collègues du génie chimique : Thierry, Mathias, Karl, Juliette, Alexandre, Simon, Igor, Julien, Luc, Pierre-Marc, Massoud, Amélie, Corinne, Mariève, Alexandre, Hanan, Moez, Shahab, Marc-Olivier, Wilinthon. Merci pour le soutien mutuel au quotidien, les belles discussions, j’ai vécu de bons moments en votre présence. Merci aux collègues de l’association des étudiants gradués du département UCGCB, avec qui j’ai pu contribuer à la vie du département.
Merci à tous les employés de Feldan Therapeutics et ceux qui l’ont été : David, Thomas, Louis-Jean, Guillaume, Joannie, Vanessa, Coraline, Anne-Marie, François-Thomas, Vincent, Meriem, Christine, Victor, François, Joëlle, Nancy, Mario, Karine, Hélène, Benjamin, Anne-Marie, Valérie, Pierre-Alain, Gina, Rex, Isabelle, Marjorie, Gabrielle, Marie-Astrid, Jean-François, Xavier. C’est grâce à vous tous que j’ai pu mener mon projet de manière épanouie et passionnée.
Merci aux membres l’équipe de soccer des Mad Scientists, qui m’ont permis de rythmer mes semaines de manière sportive ! Guillaume, Jonathan, Jacques, Hélori, Yannick, Simon, Julie, Samer, Simon, Kévin et encore bien d’autres.
Merci à ma famille, particulièrement mes grand-mères Jeanine et Andréa, ma belle-famille, et à mes amis, pour leur soutien malgré la distance. Merci également aux nouveaux amis qui font de Québec mon nouveau chez moi.
Enfin, un merci infini à ma femme Céline, à qui je dédie cette thèse. Merci pour ton soutien aussi bien dans les moments de doute que dans les meilleurs. Ce doctorat n’aurait pas été possible sans toi, merci d’avoir foi en moi.
Avant-propos
Les travaux de cette thèse ont été initiés dans le cadre d’un projet regroupant une équipe de chercheurs de l’Université Laval et du partenaire industriel Feldan Therapeutics, supportés par une subvention de recherche et développement coopérative (RDC) du Conseil de recherche en sciences naturelles et en génie (CRSNG). La thèse s’est poursuivie avec une bourse en milieu de pratique BMP Innovation, offerte par le Fonds de recherche du Québec - Nature et technologies (FRQNT), le CRSNG et Feldan Therapeutics.
Après avoir effectué des études en génie biologique en France (École de Biologie industrielle, EBI), j’ai intégré l’équipe du professeur Alain Garnier au département de génie chimique de l’Université Laval pour réaliser le projet de doctorat décrit dans cette thèse.
Les travaux présentés dans cette thèse ont été réalisés au département de génie chimique de l’Université Laval, et dans les laboratoires de Feldan Therapeutics.
Le chapitre 4 consiste en l’insertion d’un article soumis au journal PLOS ONE. Cet article a été soumis le 15 décembre 2017, avec pour titre « Membrane permeabilizing amphiphilic peptide delivers recombinant transcription factor and CRISPR-Cas9/Cpf1 ribonucleoproteins in hard-to-modify cells ». Le manuscrit a été jugé par des pairs et accepté le 26 mars 2018. Ce chapitre ne contient pas de modifications par rapport à la version soumise au journal. Mon statut pour cette publication est co-premier auteur avec le docteur Thomas Del’Guidice. Ma contribution à ces travaux a consisté en la conception, la préparation et la réalisation d’une grande part des expériences au laboratoire, pour les tests de peptides pour la livraison de la protéine fluorescente GFP, et pour les expériences d’études des mécanismes impliqués. J’ai également rédigé une partie de l’article et contribué à sa révision avant sa soumission. Le docteur Thomas Del’Guidice a conçu, préparé et réalisé une partie des expériences pour les tests de livraison de diverses protéines dans les cellules de mammifères (GFP, HoxB4, Ca9, Cpf1), et a également rédigé une partie de l’article et effectué les corrections suite aux relectures. Le docteur Louis-Jean Bordeleau, Mme Vanessa Théberge et Mme Coraline Lauvaux ont élaboré et réalisé des expériences concernant les livraisons de nucléases Ca9 et Cpf1 et leurs tests de détection (clivage T7). Mme Joannie Roberge a réalisé l’entretien et la préparation des tâches de culture cellulaire, et participé aux tâches de biologie moléculaire pour la production des protéines testées (protéines GFP, HoxB4, Cas9, Cpf1). M. Xavier Barbeau a analysé les données, a contribué à
l’écriture du manuscrit et révisé les corrections. Mme Jessica Trottier a réalisé les expériences sur les cellules hématopoïétiques (HSC-CD34+). Les professeurs Vibhuti Dave et Denis-Claude Roy sont les
superviseurs de Mme Jessica Trottier, et ont contribué à cette publication par cette supervision et l’apport de leur expertise pour les cellules hématopoïétiques. Les professeurs Bruno Gaillet et Alain Garnier ont supervisé mes travaux et ont révisé et approuvé le manuscrit avant soumission. Le docteur David Guay a contribué à l’élaboration des expériences, à la révision et l’approbation finale du manuscrit avant soumission.
Ces travaux ont contribué à une meilleure compréhension de l’implication de peptides de pénétration cellulaire pour la livraison de protéines fonctionnelles dans les cellules de mammifères. Cette nouvelle voie d’entrée cellulaire ouvre la porte à de nouvelles pistes de recherche qui, je l’espère, mèneront à de nouvelles thérapies cliniques.
1.1 Introduction
Ces dernières décennies ont vu l’avènement et le développement de thérapies dirigées vers des maladies graves telles que les cancers et les maladies génétiques. De nombreuses biomolécules ont été mises au point pour corriger des fonctions cellulaires défaillantes. Ces biomolécules peuvent être de différentes natures, comme des acides nucléiques, des peptides ou des protéines. Les cibles à atteindre pouvant être situées à l’intérieur des cellules, de multiples barrières existent pour ces biomolécules, entre autres les membranes. L’emploi de virus recombinants a permis la livraison d’éléments nucléiques pouvant coder pour les protéines thérapeutiques, et différents types viraux et d’autres systèmes de transfection sont à présent couramment retrouvés dans des stratégies de thérapies. La livraison d’une protéine thérapeutique présente aujourd’hui un fort intérêt afin d’éviter les risques associés à l’utilisation d’ADN (intégration aléatoire dans le génome). Des stratégies de livraison ont vu le jour, en s’inspirant notamment de mécanismes naturels. Ainsi, des séquences peptidiques spécialisées dans le passage à travers les membranes cellulaires ont été identifiées. Des peptides de pénétration cellulaire ont permis d’amener des protéines associées jusqu’au système endosomal de cellules de mammifères. Cependant, les molécules livrées n’ont que rarement pu rejoindre leur cible intracellulaire, en raison de leur séquestration et de leur dégradation dans les endosomes. La fuite des endosomes est considérée comme un élément critique des stratégies protéiques de livraison, et des séquences spécialisées ont été développées, encore une fois inspirées de mécanismes naturels.
Les peptides de pénétration cellulaire (CPP) et les domaines de fuite des endosomes (ELD) ont largement été utilisés dans des stratégies diverses, aussi bien pour la livraison d’acides nucléiques (ADN, ARNm, siRNA) que de protéines. Ces stratégies peuvent associer des virus ou des systèmes synthétiques, comme les lipides cationiques et polymères cationiques, pour des applications ex vivo ou in vivo. Des systèmes intégralement protéiques existent, n’associant que des séquences peptidiques, dont les CPPs et ELDs, pour la livraison de protéines dans les cellules de mammifères. Ces séquences peuvent être liées de manière covalente avec la protéine à livrer, comme dans le cas d’une protéine de fusion produite par génie génétique (protéine recombinante). D’autres stratégies dissocient les séquences de livraison de la protéine d’intérêt, en privilégiant des liaisons non-covalentes pour amener la protéine jusqu’à sa cible.
L’emploi des séquences de livraison CPPs et ELDs offre la possibilité d’étudier comment des protéines d’intérêts thérapeutiques peuvent accéder à l’environnement intracellulaire. Les mécanismes de livraison, incluant les interactions avec les membranes cellulaires et les voies empruntées (translocation directe à travers la membrane plasmique, voies endocytaires), sont encore aujourd’hui mal connus, et l’étude de ces mécanismes pour des systèmes intégralement protéiques et leurs véritables rendements présente un grand intérêt.
1.2 Objectif général
L’objectif de cette thèse est d'étudier systématiquement la dynamique des différentes étapes du transport cellulaire de protéines (le cargo), en association (covalente ou non) avec des peptides de pénétration cellulaire (CPP) et des peptides de fuite des endosomes (ELD). Ces CPP et ELD seront issus de la littérature ainsi que nouvellement créés par la compagnie Feldan Therapeutics, un partenaire de ce projet. Idéalement, ces informations devraient permettre de dégager une meilleure compréhension du phénomène de transport cellulaire de cargos de grande taille et ultimement contribuer à l'optimisation de complexes CPP/ELD novateurs.
1.3 Objectifs spécifiques
Les objectifs spécifiques de cette thèse étaient les suivants :
La comparaison de systèmes de livraison des protéines dans des cellules de mammifères, par l’emploi de peptides CPPs et ELDs sélectionnés à partir de la littérature et des constructions offertes par Feldan Therapeutics.
Ce premier objectif a été atteint en associant des peptides de pénétration cellulaire CPPs et des peptides de fuite des endosomes ELDs pour former un peptide non lié à une protéine d’étude (protéine fluorescente verte, GFP). L’étude de la littérature a permis de sélectionner plusieurs stratégies de livraison, soit par la fusion de CPPs et/ou ELDs avec la GFP, soit par la co-incubation de peptides CPP-ELDs avec la GFP. Le choix de cette dernière approche a été fait, et par la suite plusieurs CPPs et ELDs sélectionnés à partir de la littérature ont été étudiés. Le CPP-ELD le plus efficace pour la livraison de GFP a ensuite été étudié de manière plus poussée afin de mieux comprendre son mécanisme de livraison.
L’étude des mécanismes en jeu pour la livraison de protéines par les CPPs et ELDs.
Les peptides CPPs étant étudiés pour leur capacité de pénétration cellulaire et les ELDs pour leur capacité de fuite des endosomes, les peptides CPP-ELDs ont été étudiés pour l’ensemble des étapes de livraison de protéines en co-incubation. Plusieurs outils qualitatifs et quantitatifs ont permis de déterminer les voies impliquées. L’étude de différentes séquences de CPP-ELDs a permis d’identifier des caractéristiques communes aux peptides les plus performants pour ce type de livraison par co-incubation.
La vérification de l’efficacité des complexes CPP-ELD pour la livraison de diverses protéines d’intérêts thérapeutiques.
Cet objectif a été complété par la livraison de plusieurs protéines d’intérêts thérapeutiques, que sont les nucléases Cas9 et Cpf1, le facteur de transcription HoxB4, ainsi que des anticorps. Des livraisons de protéines dans plusieurs types cellulaires (lignées et cellules primaires) ont été effectuées.
2.1 Introduction
Au cours des dernières décennies, la recherche de nouvelles thérapies pour des pathologies telles que le cancer et les maladies génétiques a notamment reposé sur l’utilisation de virus recombinants pour la livraison de biomolécules vers les cellules des organismes atteints. Les différents types de virus (adénovirus, rétrovirus et virus adéno-associé, AAV) ont tous comme point commun l’objectif de livrer un acide nucléique, ADN ou ARN, pour que ce dernier réalise son rôle thérapeutique. Mimer le mode d’entrée des virus est très efficace pour la livraison d’acides nucléiques, mais les risques immunologiques et de modifications permanentes du génome peuvent être importants. Ces risques ont conduit à la recherche d’alternatives moins dangereuses1,2.
La livraison d’acides nucléiques peut se faire via l’emploi de méthodes physiques3. La micro-injection permet
de livrer directement un acide nucléique dans le cytoplasme cellulaire. Cette stratégie est cependant laborieuse puisqu’elle nécessite des traitements cellule par cellule. L’électroporation consiste en la perturbation momentanée de la membrane plasmique des cellules via des impulsions électriques. La biomolécule alors chargée négativement (acides nucléiques ou autres complexes chargés négativement) peut alors être livrée dans la cellule via sa charge, ou alors simplement par diffusion pour des molécules de petite taille. Cette technique est cependant limitée à certains types cellulaires (comme les lymphocytes T), et à certains types de biomolécules à livrer. L’électroporation induit aussi généralement une forte mortalité cellulaire, et son application clinique reste exceptionnelle.
Les méthodes chimiques offrent également des solutions efficaces de livraison d’acides nucléiques4. Des
lipides ou des polymères chargés positivement interagissent avec l’acide nucléique chargé négativement, et les complexes formés sont internalisés dans les cellules-cibles par endocytose5. Les lipides cationiques
peuvent se lier à l’acide nucléique par leur tête polaire cationique pour former un lipoplexe. Il existe différents types de lipides cationiques, dépendamment de leur niveau d’hydrophobicité et de la nature des lipides qui les composent6. Les lipides cationiques ont pour avantage de protéger les acides nucléiques de l’activité
enzymatiques des nucléases présentes dans le cytoplasme. De plus, cette méthode est efficace dans de nombreux types cellulaires. Cependant, les lipides cationiques peuvent être toxiques et déclencher une forte réponse inflammatoire in vivo. Les polymères cationiques, comme la poly-L-lysine ou le polyéthylèneimine (PEI), forment un polyplexe avec l’acide nucléique. Ce dernier est endocyté pour ensuite rejoindre le cytoplasme cellulaire. Les propriétés des polymères cationiques sont très variables mais présentent dans l’ensemble une forte cytotoxicité. Un inconvénient commun aux lipides et polymères cationiques est aussi l’absence de spécificité cellulaire, même si des solutions de couplage avec des ligands sont possibles. D’autres stratégies existent encore, telles que les nanoparticules (dont les liposomes), les particules
pseudo-virales7–9 (VLPs, virus-like particles), des petites molécules organiques ou encore des méthodes physiques
particulières (comme la déstabilisation temporaire des membranes par déformation cellulaire).
L’ensemble des stratégies énumérées ci-dessus présente donc des avantages et inconvénients variables. Cependant, elles cherchent toutes à livrer un acide nucléique dans les cellules. Un ADN étranger aura toujours le risque d’être incorporé dans le génome d’un patient conduisant à un risque élevé de cancers.
Pour ces raisons, l’utilisation à risque d’acides nucléiques avec des méthodes de livraison présentant des problèmes d’efficacité et de toxicité, doit être repensée et changée (si on exclut les siRNA). Puisque les acides nucléiques livrés en cellule codent pour la synthèse de protéines, la fabrication de ces protéines par ingénierie biomoléculaire et leur livraison directe est rapidement devenue une stratégie de choix. En effet, la livraison de protéines thérapeutiques s’est imposée dans la communauté scientifique comme une alternative sérieuse, au point de représenter un marché croissant avec des d’importants investissements en recherche10.
Il existe aujourd’hui plusieurs méthodes de livraison de protéines thérapeutiques11. Elles restent cependant
limitées et peu font l’objet d’études cliniques. Des techniques citées ci-dessus, peu peuvent être employées pour ce type de livraison. Plusieurs stratégies de livraison portent sur l’emploi de peptides ou protéines naturels, afin de mimer des mécanismes d’entrée des virus ou des toxines bactériennes. Le traitement ex vivo des cellules à corriger, par l’apport d’un facteur de transcription, d’une nucléase ou encore d’autres protéines et peptides, n’a parfois besoin que d’être transitoire. L’emploi de systèmes intégralement protéiques, aussi bien pour la biomolécule à livrer que pour la navette de livraison, présente l’intérêt qu’ils seront dégradés après un certain temps dans la cellule.
Cette synthèse critique de la littérature couvre les stratégies de livraison de protéines thérapeutiques ex vivo. Après avoir présenté les difficultés liées à la livraison de protéines, cette synthèse de la littérature abordera des solutions sur les peptides et protéines activant des mécanismes de pénétration cellulaire tels que la translocation et l’endocytose. Enfin, la présentation des mécanismes de livraison sera suivie par l’utilisation de peptides capables de transporter des protéines à l’intérieur des cellules en activant lesdits mécanismes.
2.2
Étapes du transport cellulaire d’une protéine
Une protéine à livrer dans un compartiment cellulaire spécifique, comme le noyau ou le cytoplasme ou encore les mitochondries, fait face à de multiples barrières depuis le milieu extracellulaire12–18.
2.2.1 Milieu extracellulaire
La protéine thérapeutique à livrer dans les cellules est tout d’abord située dans le milieu extracellulaire. Même dans un milieu in vitro il est nécessaire que la protéine reste intègre durant un temps suffisant avant de se lier à la membrane plasmique d’une cellule-cible (cinétique limitée par la diffusion). Un cargo (une molécule à livrer dans la cellule) doit conserver son interaction avec sa navette de livraison pour pouvoir entrer dans les cellules (s’il ne possède pas lui-même une affinité pour la membrane plasmique). La navette protéique joue également un rôle de protection, comme par exemple un polymère cationique protège un ADN des nucléases. Dans le cas de navettes chargées, ce qui est le cas pour de nombreux peptides de livraison, le complexe cargo-navette peut également interagir avec l’albumine ou encore d’autres protéines, aboutissant à une agrégation du complexe et empêchant sa bonne livraison cellulaire19,20.
2.2.2 Membrane plasmique
La membrane plasmique est la barrière extérieure de la cellule que la protéine cargo doit franchir. Le passage libre vers le cytoplasme ne peut se faire que pour de très petites molécules, ou en faisant intervenir un transport actif par des canaux spécifiques. En plus de ces voies, la membrane plasmique est le premier lieu de la voie endocytaire, permettant l’entrée via des récepteurs ou par simple affinité pour la membrane21.
Le problème à cette étape est donc double. Tout d’abord il est nécessaire que la protéine ait une affinité pour la membrane plasmique, que ce soit par la liaison avec un récepteur ou par l’affinité pour la bicouche lipidique. Cela permet ainsi de limiter les pertes dues à la diffusion de la protéine dans le milieu extracellulaire22. Ensuite
il est nécessaire de provoquer un mécanisme d’entrée, comme l’induction de l’endocytose pour utiliser la voie naturelle, ou alors créer une voie d’entrée temporaire directe vers le cytoplasme. Dans le cas de l’endocytose plusieurs modes d’entrée existent, dépendant de récepteurs ou non23.
2.2.3 Endocytose et endosomes
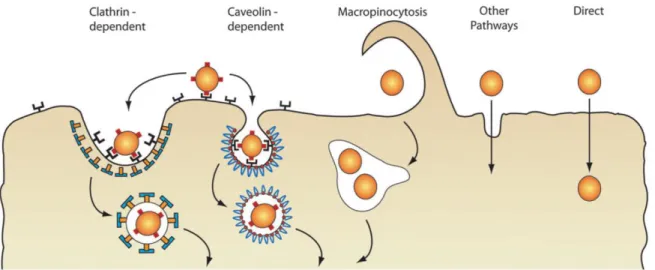
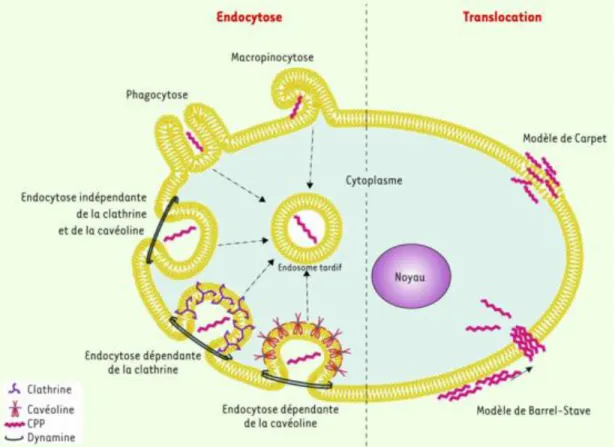
Comme indiqué dans la partie précédente, le passage de biomolécules à travers la membrane peut se faire selon deux principales voies, la translocation directe et l’endocytose. L’endocytose est un phénomène énergie-dépendant qui regroupe différentes voies (présentées dans la Figure 1)24. La macropinocytose consiste en
l’invagination de la membrane plasmique (dépendante de l’actine) permettant de former des vésicules de grande taille (0.2 à 5 µm)25,26. Ces vésicules non-pourvues de manteau protéique permettent l’entrée de
molécules solubles sans interaction avec des récepteurs. La macropinocytose constitue donc une voie d’entrée possible pour les protéines extérieures à la cellule27. Les autres voies endocytaires forment des
endocytaire qui dépend de la clathrine, protéine qui constitue le manteau protéique de la vésicule formée28. De
même il existe une voie endocytaire dépendant de la protéine cavéoline. Enfin, d’autres voies existent aussi et qui ne dépendent pas de ces deux protéines. Ainsi l’ensemble des voies citées peut être regroupé sous le terme de pinocytose (l’endocytose étant composée de la phagocytose et la pinocytose)29.
Figure 1 - Les voies d’entrée cellulaire, incluant l’endocytose et le devenir des biomolécules livrées (Chou et al., 2011)
Toutes ces vésicules endocytaires vont alors suivre une maturation vers des vésicules dénommées endosomes. Les endosomes constituent une barrière supplémentaire pour les protéines qui ont été internalisées par endocytose. Les endosomes précoces vont évoluer selon la composition des éléments transmembranaires présents, et selon la diminution progressive du pH, pour alors devenir des endosomes tardifs. Au final ces endosomes vont fusionner avec les lysosomes pour atteindre un pH acide (environ 4,5). C’est dans ces endolysosomes qu’aura lieu la dégradation des protéines via des protéases de type cathepsine30.
La barrière endosomale est similaire à la membrane plasmique car c’est une bicouche lipidique que la protéine doit franchir, cependant les mécanismes possibles peuvent différer, notamment avec la diminution du pH. Il est donc primordial pour le cargo protéique de sortir des endosomes le plus tôt possible pour rejoindre le cytoplasme et éviter la dégradation.
2.2.4 Cytoplasme
Le cytoplasme peut être la cible finale de la protéine à livrer, cependant il constitue également une barrière de livraison en raison du protéasome, le système de dégradation protéique. Le cytoplasme étant constitué d’un
grand nombre de macromolécules qui font obstacle à l’interaction du cargo avec sa cible, la cinétique de diffusion de la protéine peut donc avoir un impact sur la quantité de protéines atteignant la cible intracellulaire.
2.2.5 Importation vers un organite spécifique
L’importation vers un organite spécifique, lieu d’action de la protéine cargo, constitue la dernière barrière de livraison. En effet, une protéine donnée ne sera pas nécessairement capable de rejoindre l’organite où se trouve sa cible. Dans le cas de l’importation nucléaire, des protéines comme les facteurs de transcription sont naturellement reconnues par le système d’importines pour être internalisées dans le noyau31,32. De plus, des
protéines de moins de 60 kDa ou des peptides peuvent diffuser librement à travers la membrane nucléaire33.
Enfin, il est possible de rejoindre le noyau dans le cas de cellules en division puisque la membrane nucléaire se dégrade puis se reforme par la suite. En conséquence, pour beaucoup de protéines, il sera nécessaire de les fusionner à des domaines d’importation nucléaire, dénommés NLS (Nuclear Localisation Signal)34. Le NLS
le plus employé est le peptide SV40 (KKKRKV), et d’autres en sont dérivés. Le passage d’une protéine cargo peut alors se faire via le système de protéines importines. L’importation vers les mitochondries peut aussi être envisagée35–37. Des séquences d’importation vers ces organites existent également, dénommées MTS
(Mitochondrial Targeting Sequences – Séquences de ciblage mitochondrial)38–40. Les MTS peuvent être
fusionnées avec la protéine d’intérêt afin de rejoindre les mitochondries. Enfin, il est aussi possible de cibler le réticulum endoplasmique ou l’appareil de Golgi par d’autres séquences spécifiques41.
2.3 Moyens peptidiques de livraison inspirés de mécanismes
naturels
Dans l’objectif d’employer un système de livraison entièrement protéique, de nombreux travaux ont été menés en s’inspirant des systèmes naturels pour concevoir des protéines de transport associées au cargo protéique. Le modèle viral (nu ou enveloppé) a permis de créer de nouvelles méthodes de livraison de biomolécules42,
par la détermination des protéines responsables de la transfection dans la cellule de mammifère. Ces protéines présentent un fort intérêt pour surmonter les barrières de la voie endocytaire, les virus utilisant cette voie dans la plupart des cas.
2.3.1 Livraison de protéines cargo par peptide de pénétration cellulaire
WB. Kauffman et al. définissent les peptides de pénétration cellulaire (Cell Penetrating Peptides - CPPs) comme des peptides exogènes ou peptides associés à un cargo qui peuvent être internalisés de manière significative dans les cellules, peu importe le mécanisme43. Ces cargos peuvent être de natures différentes,
pénétration cellulaire dans les cellules de mammifères, mais aussi potentiellement dans les cellules végétales50–52.
Les CPPs ont souvent été associés à des molécules cargos de type protéique afin d’aider à leur internalisation dans les cellules-cibles (souvent des cellules de mammifères) et ainsi éviter l’emploi de matériel génétique53,54.
En 1988 deux études ont démontré la capacité du peptide TAT, issu du trans-activateur de transcription (trans-activating transcriptional activator, TAT), HIV-1, de pénétrer les cellules de mammifères sans l’emploi de récepteurs membranaires55,56. Le CPP TAT a depuis été très étudié dans de nombreuses applications57.
D’autres CPPs ont depuis été découverts, dont certains sont présentés dans le Tableau 1, et de nombreuses synthèses de la littérature traitent de ces peptides pour la livraison de différents types de cargos12,58–79. Les
CPPs ont à présent plusieurs origines, naturelles ou synthétiques. De plus, le nombre de peptides à potentiel de pénétration cellulaire est élevé et il est difficile de déterminer le nombre des peptides étudiés à ce jour.
Tableau 1 - Peptides de pénétration cellulaire couramment retrouvés dans la littérature
Peptide Origine Séquence Références
TAT Protéine TAT du HIV PGRKKRRQRRPPQ 55
Pénétratine Homéodomaine d’Antennapedia RQIKIWFQNRRMKWKK 80
Transportane Construction chimérique des peptides galanine et mastoparane GWTLNSAGYLLGKINLKALAALAKKIL 81
9Arg Synthétique (9 acides aminés arginine) RRRRRRRRR 82
PTD4 Analogue du CPP TAT YARAAARQARA 83
Pep1
Construction chimérique d’une séquence riche en tryptophane et du NLS SV40
KETWWETWWTEWSQPKKKRKV 84,85
SynB3 Dérivé de protégrine RRLSYSRRRF 86
Xentry Dérivé de la protéine X du virus de l’hépatite B LCLRPVG 87
MPG
Construction chimérique d’un dérivé de la protéine gp41 du HIV et du NLS SV40
GALFLGFLGAAGSTMGAWSQPKKKRKV 88
Des résultats sont présentés comme prometteurs pour la livraison de cargos à haute valeur ajoutée comme des facteurs de transcription, à l’instar de la livraison effective de HoxB4 en fusion avec le CPP usuel TAT89,90.
De nombreux articles font état de résultats de livraison positifs pour différents cargos protéiques, parmi lesquels les TALENs (Transcription activator-like effector nuclease, nucléases effectrices de type activateur de transcription) dans le domaine de l’édition génomique, ou des facteurs de reprogrammation cellulaire (Oct4, Klf4, etc.)59,91–95.
Il existe plusieurs classements de CPPs, selon leur origine et selon leur structure notamment.96 Ces peptides
peuvent dériver de protéines retrouvées dans la nature, tels que TAT ou la pénétratine.80 On retrouve
également des peptides chimériques issus de différentes séquences protéiques, comme Pep-1 qui est issu d’une séquence hydrophobe riche en tryptophane, du domaine d’importation nucléaire SV40, ainsi que d’une séquence séparatrice. Le dernier sous-groupe selon l’origine du CPP est celui des peptides synthétiques, comprenant notamment le peptide 9Arg.
L’intérêt de classer ces peptides de pénétration réside cependant plus dans le fait de distinguer leurs structures respectives, qui auront une influence sur la voie d’entrée cellulaire et l’interaction avec la biomolécule à livrer. La première catégorie regroupe les peptides présentant une amphipathicité primaire (comme transportane81), c’est-à-dire une succession d’acides aminés hydrophobes et hydrophiles le long de la
séquence primaire de la molécule, et non pas due à une conformation particulière. Le second groupe présente une amphipathicité secondaire (comme pénétratine), c’est-à-dire due à la prise d’une conformation du peptide, comme une hélice alpha.97 Le troisième groupe comprend les peptides non-amphipathiques, et fortement
cationiques (comme TAT).98
2.3.1.1 TAT, premier peptide de pénétration cellulaire
Bien que des études se soient penchées sur des peptides permettant de faciliter la pénétration cellulaire99,
c’est le peptide de pénétration cellulaire TAT (PGRKKRRQRRPPQ) qui est un véritable pionnier dans la venue des moyens protéiques pour réaliser la livraison de biomolécules dans les cellules de mammifères. Comme décrit précédemment, le peptide TAT est dérivé du virus HIV-1, et a été identifié par Frankel et Pabo comme étant capable de franchir les membranes biologiques55. La portion TAT du HIV, d’un poids moléculaire de 14
kDa, est une séquence reconnaissant une portion de l’ARN viral62. Elle est composée d’un domaine
d’activation de la transcription, ainsi que d’un domaine riche en arginines. Ce dernier domaine constitue la portion minimale (de neuf acides aminés) pouvant pénétrer les membranes cellulaires (RKKRRQRRR). La détermination de la séquence responsable de la transduction de la protéine a donc amené au premier peptide de pénétration cellulaire identifié, nommé CPP ou PTD (Protein Transduction Domain). Depuis cette découverte, de nombreux CPPs ont alors été identifiés, avec des origines diverses. Les mécanismes de pénétration de TAT ont d’abord été identifiés comme étant énergie-indépendants, écartant les voies endocytaires. Après des études de livraison de nombreuses molécules, Richard et al. ont démontré que l’entrée de TAT dépendait également de mécanismes endocytaires et que son efficacité de pénétration était surestimée100.
Depuis les nombreuses études impliquant d’autres CPPs, le peptide TAT est resté présent dans les stratégies de livraison, jusqu’à encore aujourd’hui. Sa liaison à des molécules à livrer, souvent de grande taille, a permis de diriger le complexe vers les membranes plasmiques pour pénétrer les cellules par endocytose. Ainsi, des molécules telles que protéines, peptides, acides nucléiques et fluorophores ont été livrées par TAT, et ce CPP a également été associé à d’autres systèmes de livraison comme des liposomes, nanoparticules et polymères62.
2.3.1.2 CPPs amphiphiles primaires
Plusieurs CPPs retrouvés dans la littérature présentent une amphiphilicité primaire, c’est-à-dire qu’ils consistent en une succession d’acides aminés essentiellement hydrophiles puis essentiellement hydrophobes101. Cette amphiphilicité permet à ces peptides de pouvoir pénétrer des membranes eucaryotes
ou procaryotes, et ce sans nécessairement dépendre d’une structure secondaire97,102,103.
Transportane (GWTLNSAGYLLGKINLKALAALAKKIL) est un CPP dont la construction chimérique assemble la portion N-terminale du neuropeptide galanine et le peptide mastoparane, les deux portions liées par une lysine81. Transportane interagit avec les bicouches lipidiques pour les perturber de manière transitoire en
s’insérant dans sa zone hydrophobe104. La voie d’entrée de transportane, ainsi que de son dérivé plus court
transportane 10 (Tp10), est principalement endocytaire dans les cellules de mammifères (voie dépendante de la cavéoline)105. Cependant, la voie d’entrée semble dépendre de la biomolécule à livrer avec ce CPP, et il a
également été montré par des dérivés de transportane que l’hydrophobicité et la structure chimique du CPP influe sur son efficacité à sortir par la suite du système endosomal pour rejoindre le cytoplasme106.
Pep-1 (KETWWETWWTEWSQPKKKRKV) consiste en deux domaines, l’un hydrophobe, et l’autre hydrophile riche en lysine, acide aminé cationique84. Ce peptide a été décrit comme étant capable de pénétrer la
membrane plasmique des cellules de mammifères107, et d’emmener avec lui des peptides d’intérêt, ces
derniers n’étant pas liés de manière covalente mais interagissant via des charges. Le complexe Pep-1-peptide interagit alors avec la tête des phospholipides de la membrane plasmique, et s’insère ensuite dans la bicouche lipidique pour la déstabiliser. Le peptide se détache alors de Pep-1 pour rejoindre le cytoplasme, le CPP restant lié à la membrane.
D’autres CPPs amphiphiles primaires existent, comme SynB3 (RRLSYSRRRF). Ce peptide est dérivé du peptide antimicrobien Protegrine 1108, et a été développé dans l’objectif de franchir la barrière
hémato-encéphalique pour des applications in vivo, où l’hydrophobicité du CPP semble jouer un rôle important109.
de se lier aux protéines membranaires syndécanes qui porte des héparanes sulfates, et ainsi pénétrer les cellules possédant cette protéine (cellules adhérentes)87,110. Xentry est donc incapable de pénétrer les cellules
du sang, offrant un intérêt d’application in vivo par injection intraveineuse. Une version activable de Xentry par une protéase a été développée par la suite, et des substitutions de la cystéine ont permis de révéler l’importance de cet acide aminé dans la livraison111. MPG (GALFLGFLGAAGSTMGAWSQPKKKRKV) est le
premier CPP à avoir été employé de manière non-covalente pour la livraison d’acides nucléiques78,85,112.
Comme Pep-1, il consiste en une section hydrophobe et une section hydrophile riche en lysines, séparées par un courte séquence (WSQP). Cette dernière séquence est présentée comme pouvant favoriser la flexibilité et l’intégrité des deux sections88.
2.3.1.3 CPPs amphiphiles secondaires
Le CPP amphiphile secondaire le plus retrouvé est la pénétratine (RQIKIWFQNRRMKWKK)80, qui est issu de
l’homéoprotéine Antennapedia. Ce CPP est en effet amphiphile lorsqu’il se structure en hélice alpha, avec un côté de l’hélice hydrophobe (porté par des tryptophanes et une phénylalanine) et l’autre hydrophile (porté notamment par des acides aminés cationiques lysines et arginines). La pénétratine interagit avec la membrane plasmique via ses charges cationiques113–116, pour alors être endocytée117–119. Ce CPP a largement
été employé dans la communauté scientifique, le plus souvent par fusion avec la biomolécule à livrer.
PTD4 (YARAAARQARA) est dérivé du CPP TAT, auquel a été ajoutée une propriété amphiphile120. Ce CPP
est uniquement capable de pénétrer les cellules de mammifères par endocytose. La pénétration de PTD4 est dépendante de la dose appliquée sur les cellules, et requiert une plus grande quantité que TAT pour être efficace, avec l’hypothèse que le nombre d’arginines portées par ces deux CPPs jouent un rôle dans cette dose-dépendance. Néanmoins, PTD4 est capable de pénétrer un grand nombre de cellules, validant sont intérêt vers des applications thérapeutiques78,121,122.
2.3.1.4 CPPs non-amphiphiles
Les CPPs non-amphiphiles consistent essentiellement en une succession d’acides aminés chargés positivement, surtout des arginines, afin d’interagir avec la membrane plasmique et provoquer l’endocytose du CPP et de la biomolécule associée. Le CPP le plus rencontré est TAT, décrit précédemment, qui possède de nombreuses arginines et lysines (PGRKKRRQRRPPQ). Un autre CPP très rencontré dans la littérature est la polyarginine, le plus souvent 9Arg (RRRRRRRRR)82. Les arginines interagissent avec la membrane plasmique
récepteurs spécifiques123. Des séquences sont aussi dérivées des polyarginines, avec une augmentation de
l’hydrophobicité qui aiderait à réaliser une structure hélicale avec de meilleures capacité de pénétration124.
2.3.1.5 Fusion des CPPs aux protéines
Les CPPs sont pour la plupart retrouvés en fusion avec un cargo protéique, à l’extrémité N- ou C-terminale, afin de provoquer l’internalisation de ce dernier dans de nombreux types cellulaires. Cependant, on retrouve également d’autres types de liaisons possibles125. Les stratégies de liaison sont présentées dans la figure
fournie en Annexe 1. Pour l’emploi des CPPs en fusion avec le cargo protéique à internaliser dans les cellules, on retrouve de nombreuses études et applications126. La fusion par clonage du CPP à la protéine d’intérêt
permet la production en cellules bactériennes (si la protéine ne nécessite pas de modifications post-traductionnelles). Ainsi des protéines de reprogrammation cellulaire (Oct4, Sox2, Klf4 et c-Myc) ont permis la génération de cellules induites pluripotentes (iPSCs)127–129.
2.3.1.6 Mécanismes d’entrée des CPPs dans les cellules de mammifères
L’activité de pénétration cellulaire des CPPs résulte essentiellement de la forte charge positive du peptide. En effet, on retrouve dans de nombreux CPPs tels que TAT, polyarginine ou pénétratine des acides aminés arginines ou lysines, chargés positivement que ce soit dans le milieu extracellulaire que dans les différents compartiments cellulaires. Les CPPs avaient d’abord été considérés comme indépendant du système endosomal, c’est-à-dire qu’ils provoqueraient une translocation directe du peptide et de son cargo à travers la membrane plasmique. Depuis, les livraisons via les CPPs ont été démontrées comme dépendantes de la température ou de drogues spécifiques, signifiant une entrée considérable (mais non-exclusive) par endocytose. Les CPPs ne dépendent pas d’un récepteur pour être internalisés par la cellule, mais agissent via une interaction non-spécifique entre le CPP et la membrane.
La mise en contact de CPP avec la membrane plasmique est facilitée par les protéoglycanes présents sur la membrane, comme pour les virus130–133. Cette interaction va affecter la fluidité de la membrane, touchant alors
le réseau d’actine de la cellule et activant des mécanismes d’endocytose de types macropinocytoses et dépendants de la clathrine. Ces voies endocytaires ont été validées pour TAT, polyarginine et pénétratine, qui sont des CPPs cationiques134–138. Ces mécanismes n’ont pas été validés pour des CPPs ne possédant pas
d’arginines, tels que transportane139.
Différentes voies de pénétration cellulaire peuvent avoir lieu simultanément, spécialement dans le cas de peptides de pénétration cellulaire amphipathiques, car ils peuvent, en plus d’interagir via ses charges