Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées
Institut de chimie des milieux et matériaux de Poitiers - IC2MP (Diplôme National - Arrêté du 7 août 2006)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Chimie organique, minérale, industrielle
Présentée par : Fatima El Bahhaj
Nanosondes épigénétiques Directeur(s) de Thèse :
Philippe Bertrand
Soutenue le 30 octobre 2014 devant le jury Jury :
Président Gérard Simonneaux Directeur de recherche CNRS, Université de Rennes Rapporteur Jean-Claude Florent Directeur de recherche CNRS, Institut Curie de Paris Rapporteur Paola Barbara Arimondo Directrice de recherche CNRS, ETAC de Toulouse Membre Philippe Bertrand Maître de conférences, Université de Poitiers Membre Yves Blériot Professeur des Universités, Université de Poitiers Membre Didier Desmaële Directeur de recherche CNRS, Université de Paris Sud
Pour citer cette thèse :
Fatima El Bahhaj. Nanosondes épigénétiques [En ligne]. Thèse Chimie organique, minérale, industrielle. Poitiers : Université de Poitiers, 2014. Disponible sur l'Intranet de l'Université de Poitiers <http://theses.univ-poitiers.fr>
THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS (Faculté des Sciences Fondamentales et Appliquées)
(Diplôme National – Arrêté du 7 Août 2006)
Ecole Doctorale : Sciences pour l’environnement – Gay-Lussac Secteur de recherche : Chimie Organique, Minérale et Industrielle
Présentée par :
Fatima EL BAHHAJ
******************************Nanosondes épigénétiques
****************************** Directeur de Thèse :Dr. Philippe BERTRAND, Maitre de conférences, Université de Poitiers ******************************
Soutenue le 30 Octobre 2014 Devant la Commission d’Examen ******************************
JURY
Dr. Paola ARIMONDO Directrice de Recherche CNRS ETaC, Toulouse
Rapporteur
Dr. Jean-Claude FLORENT Directeur de Recherche CNRS Institut Curie, Paris
Rapporteur
Pr. Yves BLERIOT Professeur, Université de Poitiers Examinateur Dr. Didier DESMAËLE Directeur de Recherche CNRS
Université Paris-Sud
Examinateur
Dr. Gérard SIMONNEAUX Directeur de Recherche CNRS Université de Rennes
Examinateur
Dr. Philippe BERTRAND Maitre de conférences Université de Poitiers
Directeur de thèse
Avant de présenter les travaux qui ont conduit à la réalisation de ce manuscrit je tiens à remercier toutes les personnes qui ont contribué à l’aboutissement de ce travail.
J’exprime ma profonde gratitude au Dr. Philippe BERTRAND, maitre de conférences à l’université de Poitiers qui m’a permis de réaliser et de mener à bien ce projet de thèse. J’ai beaucoup appris à ses cotés durant ces trois dernières années.
Je tiens à remercier le Pr. Yves BLERIOT de m’avoir permis d’effectuer cette thèse au sein du laboratoire de chimie organique de l’IC2MP et d’avoir bien voulu juger ce travail.
J’adresse également mes sincères remerciements au Dr. Paola ARIMONDO, directrice de recherche CNRS à l’ETaC de Toulouse, et au Dr. Jean-Claude FLORENT, directeur de recherche CNRS à l’institut Curie à Paris, pour avoir accepté d’être rapporteurs de ce manuscrit et de juger ce travail.
Je tiens également à remercier le Dr. Didier DESMAËLE, directeur de recherche CNRS à l’université de Paris-Sud et le Dr. Gérard SIMONNEAUX, directeur de recherche CNRS à l’université de Rennes, de m’avoir fait l’honneur de participer au jury de thèse et de l’intérêt qu’ils ont porté à ce travail.
Je remercie tous ceux qui ont collaboré à la réalisation de ce projet de thèse : le Dr. Valérie HEROGUEZ, directrice de recherche CNRS au laboratoire de chimie des polymères organiques à Bordeaux et son équipe, pour la synthèse des nanoparticules polymériques ; l’équipe du Dr. Marc GREGOIRE à l’INSERM de Nantes, et plus particulièrement, le Dr. Christophe BLANQUART, chargé de recherche INSERM et Iza DENIS, étudiante en thèse, pour l’ensemble des tests biologiques.
Un grand merci à tous mes collègues et amis pour la convivialité et la bonne humeur qu’ils ont apporté à mon quotidien ; à mes copines Virginie et Amélie pour tous les bons moments qu’on a passé ensemble (sans oublier nos séances sportives) ; à mes amis de promo : Benoit et Alex pour leur humour, Romain, Nelly et Soizic pour leur amitié ; à mes camarades : Anne-Ju, Alexandra, Eric et Thibault pour la bonne ambiance qu’ils ont amené au labo ; à Naima et Jaufret pour leur gentilesse et services rendus ; à Marielle pour sa sympathie.
Sans oublier Isa, Martine, Patrick et Joëlle pour l’aide précieuse qu’ils ont pu m’apporter durant ces trois années ; Jérôme D., Jérôme G., Agnès, Brigitte, Séb P., Fréd, Séb T. et Hélène pour la sympathie qu’ils ont pu me témoigner.
Je ne saurais trop remercier mes parents, mes héros, qui n’ont pas cessé de croire en moi. Merci pour votre soutien et votre amour. Grâce à vous j’ai pu franchir les obstacles et devenir la personne que je suis aujourd’hui. Un énorme merci à ma sœur et mes frères.
A toi, Yan, ma moitié. Merci pour ton soutien durant les moments difficiles, pour ton amour et ta présence quotidienne à mes côtés.
1
Abréviations ... 4
Introduction générale ... 7
1 Le cancer ... 8
1.1 Généralités ... 8
1.2 Les traitements anticancéreux ... 9
1.3 Les traitements médicaux ... 9
1.3.1 L’hormonothérapie ... 9
1.3.2 L’immunothérapie ... 10
1.3.3 La chimiothérapie ... 11
1.3.4 Les thérapies ciblées ... 13
2 Les inhibiteurs de HDAC, une nouvelle classe d’agents anticancéreux ... 14
2.1 Le complexe nucléaire ADN-histones ... 14
2.2 Les modifications épigénétiques ... 16
2.2.1 La méthylation de l’ADN ... 16
2.2.2 Les modifications post-traductionnelles des histones ... 18
2.3 Les modifications épigénétiques et les pathologies ... 19
2.4 Acétylation/désacétylation des histones et régulation de la transcription des gènes . 21 2.4.1 Les histones désacétylases (HDAC) ... 22
2.4.2 Les inhibiteurs d’histones désacétylases ... 24
2.5 La vectorisation thérapeutique ... 28
3 Utilisation des nanoparticules comme vecteur thérapeutique ... 30
3.1 Importance des nanoparticules en médecine ... 30
3.1.1 Les barrières biologiques aux nanoparticules ... 31
3.1.2 L’effet EPR : ... 33
3.2 Principales catégories de nanovecteurs ... 34
3.2.1 Les liposomes ... 35
3.2.2 Les nanoparticules polymériques ... 36
3.2.3 Les nanoparticules inorganiques ... 41
3.3 Les applications en nanomédecine ... 43
3.3.1 Applications de nanoparticules pour l’imagerie médicale ... 43
3.3.2 Applications des nanoparticules en thérapie ... 46
3.4 Le développement des nanovecteurs pour les thérapies anticancéreuses ... 49
3.4.1 Nanovecteurs de 1ère génération : les nanovecteurs hépato-spléniques ... 50
3.4.2 Nanovecteurs de 2e génération : le ciblage passif ... 51
3.4.3 Nanovecteurs de 3e génération : le ciblage actif ... 52
4 Les systèmes de délivrance des médicaments ... 55
4.1 L’activation de la délivrance de médicaments par signal externe ... 55
4.1.1 Les systèmes thermosensibles ... 55
4.1.2 Les systèmes magnéto-sensibles ... 56
4.1.3 Les systèmes sensibles aux ultrasons ... 56
4.1.4 Les systèmes photosensibles ... 57
4.2 L’activation de la délivrance du médicament par signal biologique ... 58
2
5 Présentation du sujet de thèse ... 64
Chapitre I : Synthèse de prodrogues de iHDAC acido-sensibles ... 67
1 Généralités ... 69
2 Nouveaux systèmes triazoles acido-labiles ... 72
2.1 Première étude modèle ... 72
2.2 Deuxième étude : Nanoparticules thérapeutiques acido-sensibles ... 74
3 Préparation des prodrogues acido-labiles de iHDAC... 76
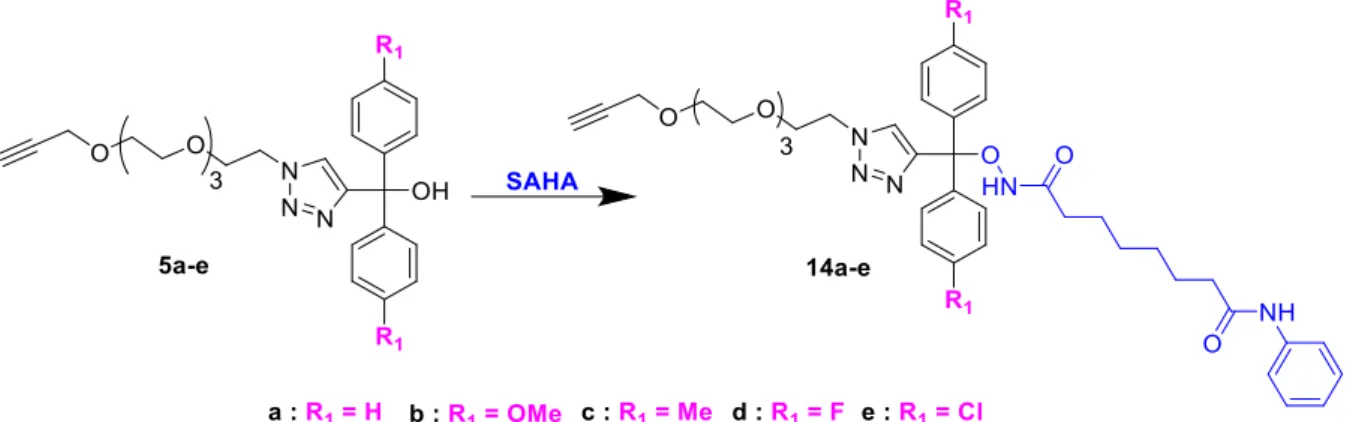
3.1 Synthèse des précurseurs diaryltriazoles disubstitués 5 ... 76
3.2 Ligation des iHDAC aux précurseurs acido-labiles 5a-e ... 79
3.2.1 Ligation du SAHA et évaluation de l’hydrolyse acide des prodrogues ... 79
3.2.2 Ligation du CI-994 et évaluation de l’hydrolyse acide des prodrogues ... 84
3.2.3 Ligation du NODH et évaluation de l’hydrolyse acide des prodrogues ... 87
3.2.4 Ligation du iHDAC organosulfuré NHC-31 ... 90
4 Evaluation biologiques des prodrogues ... 93
5 Fonctionnalisation des nanoparticules avec les prodrogues ... 96
5.1 Nanoparticules fonctionnalisées par le SAHA ... 99
5.1.1 Préparation des polymères et des nanoparticules ... 99
5.1.2 Inhibition de HDAC par les nanoparticules acido-labiles 45 ... 101
5.1.3 Toxicité cellulaire des nanoparticules ... 102
5.1.4 Evaluation in vivo des nanoparticules 45, 46 et 48 ... 104
5.2 Nanoparticules fonctionnalisées avec CI-994 ... 107
5.2.1 Préparation des nanoparticules ... 107
5.2.2 Inhibition des HDAC par les nanoparticules 52 ... 108
5.2.3 Toxicité cellulaire des nanoparticules 52 ... 109
5.3 Nanoparticules fonctionnalisées avec le NODH ... 111
5.3.1 Inhibition des HDAC par les nanoparticules 56 ... 112
5.3.2 Toxicité cellulaire des nanoparticules 56 ... 113
5.3.3 Effet in vivo des nanoparticules 57 ... 114
6 Conclusion ... 117
Chapitre II : Synthèse de prodrogues de iHDAC fluorescentes acido-sensibles 119 1 Généralités ... 121
2 La fluorescence ... 123
3 Synthèse des précurseurs fluorescents acido-labiles ... 126
4 Préparation des prodrogues fluorescentes pH sensibles de iHDAC ... 131
4.1 Synthèse des prodrogues ... 131
4.2 Evaluation de la fluorescence en fonction du pH ... 136
5 Conclusion ... 139
Chapitre III : Nouvelle voie de synthèse de benzofuranones et résolution chirale141 1 Généralités ... 143
2 Préparation de benzofuranones par acylation intramoléculaire de Friedel-Crafts………... ... 150
3
3.1 Première étude : Synthèse énantiosélective de benzofuranones 2-monosubstituées 156 3.1.1 Préparation d’éthers de phénols à partir de lactates de méthyles optiquement actifs
... 156
3.1.2 Préparation d’éthers de phénols optiquement actifs par purification chromatographique de mélange racémique sur une colonne chirale ... 157
3.1.3 Cyclisation des éthers de phénols énantiopures et validation de la pureté énantiomérique des benzofuranones ... 158
3.2 Deuxième étude : Synthèse énantiosélective de benzofuranones 2,2-disubstituées 162 4 Conclusion ... 168 Conclusions ... 170 Partie expérimentale ... 178 1 Matériels et méthodes ... 178 2 Modes opératoires ... 183 Références bibliographiques... 252
4
Abréviations
Dans ce manuscrit, plusieurs abréviations seront utilisées dont les significations sont présentées ci-dessous : (Pour des raisons pratiques certains termes anglais n’ont pas été traduits en français)
Aβ Β-amyloïde
Ac Acétyle
AcCl Chlorure d’acétyle
ACN Acétonitrile
AcOEt/AE Acétate d’éthyle
ADCA Adénocarcinome
ADN Acide désoxyribonucléique
ARN Acide ribonucléique
ARN m Acide ribonucléique messager AMM Autorisation de mise sur le marché
AuNPs Nanoparticules d’or
BCECF (2ʹ,7ʹ-Bis-(2-carboxyéthyl)-5-(et-6-)carboxyfluorescéine) BF3.Et2O Diéthyléthérate de trifluorure de bore
BHE Barrière hémato-encéphalique
BRET Bioluminescence resonance energy transfer
CCM Chromatographie à couche mince
CMC Concentration micellaire critique ClCO2Et Chloroformiate d’éthyle
DBU 1,8-diazabicyclo[5.4.0]undéc-7-ène
DCM Dichlorométhane
DIAD Diisopropyle azodicarboxylate
DIPEA N,N-diisopropyléthylamine
DLS Dynamic light scattering
DMF Diméthylformamide DMAP 4-diméthylaminopyridine DMSO Diméthylsulfoxyde DNMt ADN méthyltransférase EDC 1-Ethyl-(3-dimethylaminopropyl)carbodiimide EP Ether de pétrole
EPR Enhanced permeability and retention
éq. Equivalent
Et Ethyle
EtOH Ethanol
Eu(hfc)3 tris [3-(heptafluoropropylhydroxymethylene)-camphorato] europium
FDA Food and drug administration
FITC Isothiocyanate de fluorescéine
GFLG GlycylPhenylalanylLeucylGlycine
5
HDA1 Histone désacétylase –A1
HDAC Histone désacétylase
HDLP Histone deacetylase like protein
HER2 Récepteur 2 du facteur de croissance épidermique humain HPLC High performance liquid chromatography
HPMA N-(2-Hydroxypropyl)methacrylamide
ICF Immunodéficience instabilité centromérique dysmorphie faciale iHAT Inhibiteur d’histones acétyles transférases
iHDAC Inhibiteur d’histones désacétylases
IL2 Interleukine 2
kDa Kilodalton
LAMP-1 Lysosomal associated membrane protein 1 LHRH Hormone de libération de la lutéinostimuline
Me Méthyle
MeOH Méthanol
MBP Methyl-CpG binding protein
MPM Mésothéliome pleural malin
MPS Système phagocytaire mononucléaire
MsCl Chlorure de mésyle
MTX Méthotrexate
NAD+ Nicotinamide adénine nucléotide
n-BuLi n-butyllithium
OBn O-benzyle
OMe Méthoxy
OMS Organisation mondiale de la santé
OTf O-triflate
PACA Poly(cyanoacrylate d’alkyle)
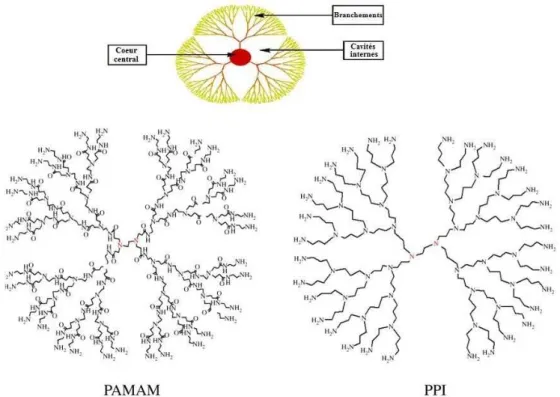
PAMAM Poly(amidoamine)
pb Paire de base
PBCA Poly(butylcyanoacrylate)
PEG Polyéthylène glycol
PEG Poly(oxyde d’éthylène)
PEPE Polyether-copolyester
PhH Benzène
PGA Poly(acide glycolique)
PgP P-glycoprotéine
PLA Poly(acide lactique)
PMDETA Pentamethyldiethylenetriamine PLGA Poly(acide lactique-co-glucolide)
PNB Polynorbornène
PNIPAM Poly(N-isopropylacrylamide)
PPA Acide polyphosphorique
PPI Poly(propylène imine)
PSMA Antigène prostatique membranaire spécifique
PVA Alcool polyvinylique
QDs Quantum dots
Rf Facteur de rétention
6
RMN Résonance magnétique nucléaire
ROMP Ring opening metathesis polymerization
RpD3 Reduced potassium dependency 3
SAHA Suberoylanilide acid hydroxamic SIR2 Silent information regulator 2
SIRT Sirtuine
SMHR Spectrométrie de masse à haute résolution
SNAFR Seminaphtofluorone
SPION Superparamagnetic iron oxide nanoparticles
ta Température ambiante
THF Tétrahydrofurane
TfOH Acide triflique
TMEDA Tétraméthyléthylènediamine
TNFα Tumor necrosis factor α
TPP Triphénylphosphine
TSA Trichostatine A
TsCl Chlorure de tosyle
TEBA Chlorure de triéthylbenzylammonium
Ub Ubiquitine
USPION Utrasmall superparamagnetic iron oxide nanoparticles
VPA Acide valproïque
7
Introduction générale
8
1 Le cancer
1.1 Généralités
Le cancer est un terme général qui regroupe plus d’une centaine de maladies différentes, ayant en point commun la présence de cellules cancéreuses au niveau des tissus de l’organisme. Le déclenchement de cette prolifération de cellules anormales est causé par des mutations génétiques survenues lors de la division cellulaire et cela sous l’influence de divers facteurs comme l’hérédité, le tabac, les agents chimiques, les radiations, etc… En effet, les tissus et les organes du corps humain sont constitués de milliards de cellules, la régulation du rythme de division cellulaire étant inscrite dans le patrimoine génétique héréditaire, mais il arrive toutefois que des cellules continuent à se diviser sans que l’organisme en ait besoin. Ces cellules en excès forment alors une masse appelée tumeur qui peut être bénigne et inoffensive, qui ne se propage pas dans d’autres parties du corps humain et qui ne représente aucune menace pour la santé, contrairement à la tumeur maligne qui quant à elle est cancéreuse. Ce type de tumeur est constitué de cellules qui se divisent de manière anarchique. Elles peuvent endommager les tissus et les organes aux alentours mais elles peuvent aussi traverser les vaisseaux du système sanguin et du système lymphatique pour migrer vers d’autres organes pour former des métastases.
Selon l’organisation mondiale de la santé (OMS)1
, le cancer est la première cause de mortalité chez l’homme et la deuxième chez la femme après les maladies cardiovasculaires. A l’échelle mondiale, on estime l’incidence du cancer à 14,1 millions de nouveaux cas et à 8,2 millions le nombre de décès liés au cancer survenus en 2012, par rapport à 12,7 millions et 7,6 millions en 2008, respectivement. Cette incidence est en augmentation régulière du fait de la conjonction de facteurs tels que le vieillissement de la population et l’amélioration des méthodes de détection et de diagnostic. On distingue parmi les cancers les plus fréquemment diagnostiqués le cancer du poumon (avec 1,8 million de cas, soit 13,0 % du total), le cancer du sein (1,7 million de cas, ou 11,9% du total) et le cancer colorectal (1,4 million de cas, ou 9,7% du total). Ces statistiques montrent bien que le fléau du cancer représente un problème majeur de santé publique ainsi qu’un enjeu très important pour les organismes de recherches publiques et privés.
9 A l’heure actuelle certaines formes de cancers peuvent être guéries alors que d’autres peuvent être stabilisées sur plusieurs années. Il est également possible de ralentir l’évolution de la maladie et d’en réduire les symptômes.
1.2 Les traitements anticancéreux
Différents traitements ont été développés pour chaque type de cancers, dans le but de déclencher la destruction des cellules cancéreuses et l’arrêt de leur prolifération incontrôlée. Les principales méthodes thérapeutiques sont les suivantes :
La chirurgie, qui permet l’ablation définitive de la tumeur, elle impose souvent d’enlever également une partie du tissu sain ce qui rend cette technique assez dévastatrice.
La radiothérapie, qui consiste à exposer une zone tumorale à des radiations afin de détruire les cellules cancéreuses. C’est une technique plus ciblée que la chirurgie et moins destructrice des cellules saines voisines.
Les traitements qui permettent la destruction des tumeurs grâce à l’administration de substances médicamenteuses. Ces dernières agissent selon différents mécansmes blocage de la prolifération des cellules cancéreuses, stimulation du système immunitaire de l’organisme (immunothérapie), détruction des cellules cancéreuses. La chimiothérapie englobe les différents traitements à base de molécules organiques.
Notre intérêt s’est porté sur l’étude des traitements médicamenteux. Les deux autres méthodes thérapeutiques ne seront donc pas détaillées dans ce manuscrit.
1.3 Les traitements médicaux
1.3.1
L’hormonothérapie
Cette thérapie concerne des cancers dits hormono-dépendants. En effet, la croissance cellulaire de certains tissus de l’organisme dépend de la sécrétion de certaines hormones (tels que les œstrogènes pour les cellules de la glande mammaire). Les cancers dérivés de ces tissus peuvent garder cette hormono-dépendance, par conséquent la prolifération des cellules cancéreuses sera stimulée sous l’effet de l’hormone à laquelle elles sont sensibles et la
10 privation de cette influence hormonale peut entrainer l’arrêt de la prolifération et/ou la mort des cellules tumorales.
Dans le cas du cancer de la prostate chez l’homme, l’inhibition de la sécrétion de l’hormone de libération de la lutéinostimuline (LHRH), responsable de la production de la testostérone, est nécessaire pour la régression de la tumeur. Cette inhibition va se faire par l’administration d’analogues de la LHRH qui vont entrainer tout d’abord une augmentation de la production de la testostérone pendant une très courte durée, suivie d’une diminution de cette production, ce qui va empêcher la croissance des cellules cancéreuses. Parmi les analogues de la LHRH les plus couramment utilisés pour traiter le cancer de la prostate2 on trouve la leuproréline (Enantone®), la triptoréline (Decapeptyl®), la goséréline (Zoladex®) et la buséréline (Bigonist®).
1.3.2
L’immunothérapie
L'immunothérapie a pour but de stimuler les défenses immunitaires d’un organisme pour bloquer des maladies comme les cancers ou les maladies dégénératives et pour la désensibilisation allergique. Cela désigne en général toute thérapie utilisant des protéines produites par les cellules du système immunitaire (mmunoglobulines) même si l’objectif n’est pas de stimuler l’immunité. Les premiers essais d'immunothérapie remontent aux années 1970 et utilisaient des anticorps polyclonaux. Actuellement différentes molécules sont utilisées : en premier lieu les immunoglobulines monoclonales, les interférons et les interleukines.
L'interféron alpha et gamma, l'interleukine 2 (IL2) sont les cytokines les plus souvent utilisées et indiquée dans le traitement du cancer du rein métastatique et dans le mélanome métastatique. Les anticorps monoclonaux visent à empêcher la prolifération cellulaire en bloquant l'activité de certains récepteurs codés par des oncogènes. Le rituximab, indiqué pour le traitement de lymphomes folliculaires de stade III-IV chimiorésistants ou après rechute après chimiothérapie, se lie spécifiquement à la protéine transmembranaire antigène CD20, une située sur les lymphocytes B et s'exprimant dans plus de 95 % des cellules B des lymphomes non hodgkiniens. Le trastuzumab est administré aux femmes ayant un cancer du sein résistant en raison de la présence en surabondance d'un récepteur spécifique HER-2 qui induit la prolifération cellulaire.3
11 L’immunothérapeie a conduit au développement de stratégie de vaccination anticancéreuse comme le sipuleucel-T (Provenge) pour le traitement du cancer de la prostate. Sa mise sur le marché a été approuvée le 29 avril 2010 par la FDA et en juin 2013 en Europe. Il est fabriqué par le laboratoire pharmaceutique Dendreon. Il repose sur l'utilisation des cellules dendritiques, qui sont des cellules présentatrices d'antigènes issues de la moelle osseuse.Souvent associée à d’autres types de traitements, l'immunothérapie n'est jamais le traitement dominant, mais peut aider à éradiquer la tumeur.
1.3.3 La chimiothérapie
Dans le cas d’un cancer métastatique, les traitements locaux comme la radiothérapie ou la chirurgie ne sont plus adaptés, seule la chimiothérapie est capable d’atteindre toutes les cellules malignes et d’assurer leur destruction. En effet, c’est une thérapie qui consiste en l’administration de substances chimiques qui vont reduire la croissance des cellules tumorales ou induire leur destruction. Il existe actuellement plus d’une centaine de médicaments pour lutter contre le cancer et chaque année plusieurs nouvelles molécules apparaissent ayant pour cible différents éléments cellulaires.
On distingue des médicaments dont l’action est centrée sur l’ADN et l’ARN (en empêchant leur synthèse ou leur lecture ou en induisant la coupure de l’ADN) et ceux qui agissent sur des protéines. Ils sont classés selon leur mode d’action tout en ayant le même but : Interrompre le cycle de réplication de la cellule, ce qui va conduire à la mort de cette dernière. Parmi ces agents anticancéreux on retrouve, par exemple, la gemcitabine (Gemcitabine®) qui appartient à la famille des antimétabolites. Son rôle consiste à s’incorporer dans l’ADN à la place des bases pyrimidiques (thymine, cytosine, uracile). Il existe aussi des substances capables d’agir sur des protéines qui interviennent pendant la mitose comme la tubuline empêchant la construction du fuseau cellulaire. Les poisons du fuseau mitotique vont créer une forte affinité avec cette protéine bloquant ainsi la division cellulaire. Parmi ces agents on peut citer le paclitaxel (Taxol®) ainsi que la vinflunine (Javlor®). Cette dernière molécule a été développée au sein de notre laboratoire4 et a été commercialisée par Les laboratoires Pierre Fabre (AMM en 2009). La vinflunine est notamment utilisée dans le cas du cancer de la vessie.
12 Plusieurs agents anticancéreux sont souvent associés pour obtenir une synergie des effets thérapeutiques. Malheureusement leur efficacité peut être limitée à cause des phénomènes de résistance. En effet, certaines cellules cancéreuses peuvent être d’emblée résistantes lors de l’administration des premières cures de chimiothérapie comme dans le cas du mélanome, du cancer du rein et de nombreux sarcomes, ou bien, elles peuvent être chimio-sensibles au début du traitement, mais développent par la suite des capacités de résistance au cours de ce traitement.
La plupart des médicaments administrés en chimiothérapie agissent sur les cellules cancéreuses en bloquant les mécanismes de division cellulaire. Cependant, l’agent cytotoxique utilisé peut ne pas être actif et cela à cause de la multiplication très lente de certaines cellules cancéreuses. Cet agent peut rencontrer aussi le problème d’inaccessibilité au niveau des cellules dans le cas d’une tumeur peu vascularisée. Les mécanismes de métabolisation peuvent aussi conduire à l’élimination du médicament par l’organisme et donc à la réduction de son activité anticancéreuse. Les phénomènes de résistance peuvent aussi être expliqués par des mécanismes moléculaires qui apparaissent lors des premières administrations d’un traitement. Les plus importants sont5 :
La concentration intracellulaire du composé anticancéreux insuffisante et cela à cause de la réduction de l’activité des transporteurs membranaires d’influx nécessaires à l’entrée du médicament, ou bien, à cause de la surexpression des transporteurs membranaires d’efflux, responsables de la sortie du médicament. Citons à titre d’exemple la surexpression de la P-glycoprotéine (PgP) dans certaines tumeurs telles que les cancers du côlon, du sein et de l’estomac.
La mise en place des mécanismes de réparation de l’ADN des cellules cancéreuses conduisant à la réduction de la cytotoxicité du médicament.
La répression des gènes proapoptotiques, comme l’inactivation du gène suppresseur de tumeur p53.
La modification de la cible de l’agent cytotoxique, soit par surexpression de la cible, dans ce cas, la quantité du médicament est insuffisante pour entrainer une cytotoxicité significative, soit par mutation du site de fixation de l’anticancéreux, dans ce cas ce dernier ne reconnait plus sa cible et devient inactif. On peut citer l’exemple de la résistance de certains cancers au paclitaxel (Taxol®) par mutation de la tubuline.
13 Il est important de mentionner également que l’effet cytotoxique de la plupart des médicaments anticancéreux peut aussi toucher les cellules saines. Tout comme les cellules cancéreuses, les cellules saines en division peuvent être facilement endommagées à cause du manque de sélectivité des médicaments. Ce phénomène va conduire à l’apparition d’effets secondaires liés au traitement, comme les nausées, les vomissements, l’alopécie aiguë, et l’anémie, etc….
1.3.4 Les thérapies ciblées
A l’heure actuelle, le challenge de la recherche contre le cancer est de pouvoir élaborer des agents anticancéreux capables de lutter contre les phénomènes de résistance tout en entrainant le moins d’effets secondaires possibles. Afin d’épargner la destruction des cellules saines, il faut cibler plus spécifiquement les cellules cancéreuses et développer des médicaments présentant une meilleure sélectivité.
Les thérapies ciblées répondent à ce challenge et consistent à rendre des molécules anticancéreuses plus sélectives soit en développant des composés très sélectifs soit par le ciblage des récepteurs ou des antigènes membranaires des cellules cancéreuses. Si le ciblage basé sur des mutations est possible mais sans doute plus difficile à obtenir, les récepteurs membranaires surexprimés à la surface des cellules tumorales est plus couramment utilisé. Les ligands de ces récepteurs s’y lient avec une très grande affinité et peuvent donc être ainsi utilisés comme agents de ciblage. Ces derniers peuvent être de nature saccharidique comme l’acide hyaluronique,6
protéique comme les transferrines7 ou des petites molécules comme l’acide folique.8
Le crizotinib developpé par Pfizer cible spécifiquement les cancers du poumon avancés à non-petites cellules présentant la mutation ALK. L’Adcetris® (Seattle Genetics ; AMM 2011), un conjugué drogue-anticorps, est constitué de l’auristatine monométhyle E (MMAE) comme agent anticancéreux et d’un anticorps destiné au ciblage de l’antigène CD30 surexprimé à la surface des cellules cancéreuses.9 Ce conjugué est utilisé pour le traitement du lymphome anaplastique à grandes cellules et du lymphome hodgkinien. L’acide folique a été associé au désacétylvinblastine monohydrazide (DAVLBH), un agent anticancéreux analogue de la vinblastine pour donner le composé EC145 (développé par Endocytes). Ce composé est en phase II d’étude clinique pour le traitement du cancer du poumon non à petites cellules.10
14 La surexpression des intégrines 53 participate au processus d’angiogénèse utilisé par les cellules tumorales pour leur croissance. Le blocage du site de liaison des intégrines est une autre stratégie de ciblage pouvant induire l’opotose des celules endothéliales et prévenir l’angiogénèse. Le peptide cyclique RGD est un ligand de ces intégrines utilize pour le ciblage. Dans ce travail, nous nous sommes intéressés à une nouvelle classe d’anticancéreux apparue depuis une vingtaine d’années : les inhibiteurs d’histones désacétylases ayant pour cible des entités épigénétiques. La méthode de ciblage développée dans ce travail utilise uniquement le concept de ciblage passif sans recours à l’utilisation de ligands de récepteurs membranaires decellules cancéreuses.
La partie qui suit débutera par une présentation générale des phénomènes épigénétiques et de leurs influences sur la transcription génétique. Cette partie sera suivie d’une description des différents types d’inhibiteurs d’histones désacétylases développés ainsi que de leur mode d’action comme agents anticancéreux.
2 Les inhibiteurs de HDAC, une nouvelle classe
d’agents anticancéreux
2.1 Le complexe nucléaire ADN-histones
Le génome humain se présente sous la forme d’une double hélice d’ADN11
contenant environ 30000 gènes et dont la taille à l’état déroulé est de deux mètres. L’ADN des celulles eucaryotes est stocké dans le noyau dasn une forme compacte afin d’occuper le plus petit volume possible et de n’être transcrit que lorsque cela est nécessaire. Il subit ainsi différents niveaux de compactage pour former la structure de la chromatine. Lors du premier niveau de compaction, 147 paires de base (pb) d’ADN s’enroulent 1,67 fois autour d’un octamère de protéines appelées histones pour former le nucléosome. Cette structure, formée par le complexe ADN-histones, est répétée sous forme d’un nucléo-filament qui peut adopter des niveaux d’organisation plus compacts et plus complexes (Figure 1).12
15
Figure 1 : Le complexe ADN-histones 13
Les histones sont les protéines les plus abondantes de la chromatine avec une masse moléculaire comprise entre 10 et 24 kDa.14 L’octamère protéique qui forme la partie centrale du nucléosome est constitué de deux exemplaires de chacune des histones H2A, H2B, H3 (dont les variantes H3.1, H3.2 et H3.3)15 et H4 (Figure 2). On retrouve aussi l’histone H1 qui est internucléosomique.16
Les histones H2A, H2B, H3 et H4 présentent un caractère basique grâce à leur richesse en résidus lysine et arginine. Les extrémités N-terminales des histones H3 et H4 en particulier subissent différentes modifications post traductionnelles reversibles permettant la régulation de l’expression génétique. Dans le cas particulier de l’acétylation des lysines des histones, celle-ci conduit à un relachement de l’ADN permettant l’accès aux facteurs de transcription. Leur désacétylation conduit à des lysines dont le groupe -amino chargé positivement assure les interactions avec les charges négatives des groupements phosphates de l’ADN17
participant à la forme condensée de la chromatine et ainsi à la répression de l’expression des gènes.
16
Figure 2 : Représentation schématique de la partie centrale du nucléosome 18
2.2 Les modifications épigénétiques
Le terme épigénétique, du grec « épi » qui signifie « au-dessus », désigne, à l’heure actuelle, l’étude des changements héritables et réversibles de l’expression des gènes qui n’impliquent pas de modifications de la séquence nucléotidique de l’ADN.19
Ces changements au niveau de l’épigénéome sont controlés par différentes familles d’enzymes induisant des réactions chimiques réversibles au niveau de la chromatine, ces réactions se produisant soit sur des positions spécifiques de certaines bases de l’ADN, soit sur les histones.
2.2.1
La méthylation de l’ADN
La méthylation de l’ADN correspond à l’addition d’un groupement méthyle en position 5 d’une cytosine (Figure 3). Cette réaction est catalysée par des enzymes spécifiques : les ADN méthyltransférases (DNMT1, 3a, 3b et 3L). La modification chimique
17 se fait plus exactement au niveau des doublets CG (Cytosine-Guanine) de l’ADN appelés également CpG.20
Figure 3 : Schéma réactionnel de la méthylation des cytosines par la DNMT
Figure 4 : Effets de la méthylation des îlots CpG de l'ADN sur l’expression des gènes
Chez l’espèce humaine, jusqu’à 10% des CpG sont méthylés et peuvent être inégalement distribués le long du génome humain. En revanche, on retrouve des régions riches en CpG appelées îlots CpG, qui sont non méthylés et qui se trouvent au niveau des régions promotrices de gènes.21 L’hyperméthylation de ces régions conduit à une inactivation de la transcription des gènes, notamment dans le cas de cellules cancéreuses, l’inactivation de gènes suppresseurs de tumeurs (Figure 4)22. Les modifications post traductionnelles des extrémités N-terminales des histones détaillées ci-parès participent également à cette régulation de l’expression génétique.
18
2.2.2 Les modifications post-traductionnelles des histones
Les extrémités N-terminales non structurées des histones pointent à l’extérieur de la partie centrale du nucléosome et si elles sont la cible majoritaire de différentes enzymes capables de les modifier chimiquement, des modifications sont aussi connues pour les ppartiesdes histones internes au nucléosome. Parmi les modifications post-traductionnelles les plus étudiées sur les histones on trouve l’acétylation, la méthylation, la phosphorylation, l’ubiquination qui correspondent respectivement à l’insertion d’un groupement acétyle (Ac), méthyle (Me), phosphate (P) et la protéine ubiquitine (Ub)23 (Figure 5). On retrouve aussi d’autres types de modifications, mais moins étudiées, telles que la glycosylation, l’ADP-ribosylation, la biotinylation et la Sumoylation.
Figure 5 : Les principales modifications post-traductionnelles des histones 24
L’ensemble de ses modifications va permettre la création ou la stabilisation de liaisons entre certains sites de la chromatine et des protéines régulatrices, comme les facteurs de transcription, les protéines impliquées dans la condensation de la chromatine ou la réparation de l’ADN.25 En revanche, ces modifications peuvent aussi avoir l’effet inverse en interrompant ou en bloquant cette liaison chromatine-protéines. La combinaison qui résulte de l’ensemble de ces différentes modifications conduit aux « marques épigénétiques » qui définnissent ce que l’on appelle le code histone.26 Ce code est obtenu par l’action de trois
19 groupes d’enzymes épigénétiques qui « écrivent », « effacent » et « lisent » les marques épigénétiques (writers, erasers, readers). Ainsi l’acétylation des histones est une marque « écrite » par les histone acétyle transférases (HAT) et effacée par les histone désacétylases (HDAC). Cette marque est « lue » par des protéines contenant un domaine BROMO. DE la même manière la méthylation des histones implique des histone méthyl transférases, déméthylases et des protéines contenant des domaines CHROMO ou TUDOR. Cette reconnaissance des marques épigénétiques par les facteurs de transcription permet d’amorcer les voies de signalisation dans le but de réparer l’ADN ou activer la transcription de certains gènes. La dérégulation de la lecture du code des histones peut conduire à l’arrêt des mécanismes de réparations de l’ADN ou à la répression de la transcription de gènes menant ainsi à l’apparition de certaines pathologies.
2.3 Les modifications épigénétiques et les pathologies
Il est certain qu’un dysfonctionnement des mécanismes de méthylation de l’ADN ou des modifications des histones joue un rôle très important dans l’apparition ou l’évolution de certaines maladies. Cependant, il existe une corrélation entre l’acétylation des histones et la méthylation de l’ADN. En effet, l’ADN méthylé peut fixer des protéines appelées les MBP (Methyl-CpG-binding domain proteins) qui elles-mêmes peuvent fixer d’autres protéines comme les histones désacétylases27. Ces dernières vont alors provoquer la compaction de la chromatine et donc la répression de l’expression de gènes.
Ces anomalies épigénétiques peuvent conduire à l’apparition de pathologies dégénératives comme dans le cas du syndrome de Rett caractérisé par un développement précoce normal suivi d’une détérioration progressive des capacités locomotrices et cognitives. Ce syndrome est causé par la mutation du gène MeCP2 lié au recrutement des histones désacétylases et à la compaction de la chromatine.28
Parmi les maladies d’origine épigénétique, on retrouve aussi le syndrome ICF (Immunodéficience instabilité Centromérique dysmorphie Faciale) qui présente des infections respiratoires récurrentes commençant dès l’enfance. Cette maladie est causée par une hypométhylation de l’ADN due à une mutation de l’enzyme méthyltransférase DNMT3b.29
20 Cependant, la catégorie de maladies la plus connue causée par les aberrations des phénomènes épigénétiques est le cancer. Bien que cette pathologie soit causée en grande partie par des mutations génétiques irréversibles, les données bibliographiques montrent que les anomalies épigénétiques, et surtout celles qui conduisent au silence des gènes, participent à l’activation de l’oncogenèse ou à l’inactivation de la transcription des gènes suppresseurs de tumeurs.30,31
De ce fait, la modification d’expression de gènes suites à des variations épigénétiques (méthylation de l’ADN et modifications chimiques des histones) a ouvert une nouvelle voie sur l’étude, l’induction et le traitement des cancers.
Le développement de modulateurs épigénétiques capables de bloquer les dysfonctionnements responsables de l’apparition ou du développement des cancers a vivement suscité l’intérêt de la communauté scientifique. Parmi ces modulateurs, on peut citer l’exemple de la décitabine et l’azacitidine (Figure 6). Ces molécules ont été utilisées dans un premier temp, comme antimétabolites et agents cytotoxiques pour le traitement de leucémies avant d’être caractérisées comme inhibiteurs de DNMT.32
Ces composés appartiennent à la famille des analogues nucléosidiques et sont les seuls inhibiteurs de DNMT aujourd’hui commercialisés.
Figure 6 : Structures chimiques des inhibiteurs de DNMT commercialisés : la décidabine et l'azacitidine
A l’heure actuelle, en dehors de la méthylation de l’ADN, la régulation de l’acétylation des histones est très étudiée pour son implication dans les processus de cancérisation puisque l’hypoacétylation des histones est associée dans les cellules tumorales à une répression de l’expression des gènes suppresseurs de tumeur.33 Pour mieux comprendre ce phénomène, la suite de ce chapitre présentera plus particulièrement les mécanismes
21 d’acétylation et de désacétylation des histones, leur association aux maladies du cancer ainsi que les thérapies anticancéreuses ciblant ce type de modifications épigénétiques.
2.4 Acétylation/désacétylation des histones et régulation de
la transcription des gènes
L’acétylation correspond au greffage d’un groupement acétyle (Ac) sur les lysines aux l’extrémité N-terminale des histones. Cette modification chimique est catalysée par les transférases d’acétyle des histones (Histone acetyl transferase, HAT), dont l’activité est en équilibre avec celle des désacétylases d’histones (Histone deacetylases, HDAC).34 Une fois les lysines N-terminales des histones acétylées sur la position ε, les charges positives des groupements NH3+ sont neutralisées. Les interactions avec les groupements phosphates de l’ADN (PO4
3-) sont alors diminuées donnant ainsi une structure relâchée de la chromatine (Figure 7), avec un ADN plus accessible pour les facteurs de transcriptions des gènes.35 L’équilibre entre acétylation et désacétylation des histones est donc un élément clé dans la régulation des gènes, l’acétylation favorisant l’activité transcriptionnelle et la désacétylation participant à la répression.
Figure 7 : Acétylation/ désacétylation des histones et leur effet sur la structure de la chromatine
Ainsi une inactivation des HAT ou une surexpression des HDAC conduisant à un niveau d’acétylation des histones trop faible participent à la répression de gènes régulateurs et cette hypoacétylation peut participer à la cancérogénèse.36,37 Des stratégies thérapeutiques
22 peuvent être déduites de ce mécanisme d’acétylation des histones pour permettre la renormalisation de l’expression des gènes : soit favoriser l’acétylation et donc activer les HAT, soit empêcher la désacétylation en inhibiant les HDAC. Des travaux récents montrent également que l’activité anormale de ces enzymes peut résulter de mutations. Notament le gène de la protéine p300 (famille des HAT) est muté dans le cas du cancer du côlon38 et d’autres mutations sont connues pour les sirtuines39
et les proteines contenant des bromodomaines40. Quant à la liaison entre la surexpression des HDAC et le développement des cancers elle a été démontrée pour la leucémie promyélocitaire41, le cancer du côlon42 et dans le cas du cancer du sein.43 Cependant, dans le cas de l’acétylation de la chromatine, c’est la surexpression des HDAC qui fait l’object de l’essentiel des travaux en oncologie.
2.4.1 Les histones désacétylases (HDAC)
Ces enzymes sont classées en fonction de leur homologie avec les HDAC de la levure
Saccharomyces cerevisiae.44 Chez l’Homme, on distingue 18 HDAC se répartissant en
quatres grandes familles distinctes45 :
Les HDAC de classe I : ce sont les HDAC 1, 2, 3 et 8. Ces enzymes sont des homologues du répresseur transcriptionnel RPD3 (Reduced Potassium Dependency 3) de la levure. Elles prédominent dans le noyau et sont exprimées dans la plupart des tissus.
Les HDAC de classe II : ce sont les HDAC 4, 5, 6, 7, 9 et 10. Ces enzymes sont des homologues de la protéine HDA1 (Histone Deacetylase-A1) de la levure. Elles peuvent passer du noyau au cytoplasme et vice-versa en réponse à divers signaux cellulaires, de plus, elles peuvent être impliquées dans la différenciation et le développement cellulaires.
Les HDAC de classe III (Sirtuines) : constitués de SIRT 1, 2, 3, 4, 5, 6 et 7. Ces enzymes sont homologues à la protéine SIR2 (Silent Information Regulator 2) de la levure et leur activité dépend de NAD+ (Nicotinamide Adénine Dinucléotide), l’agent d’oxydation présent dans les cellules.
L’HDAC de classe IV : on y retrouve l’HDAC 11, c’est la dernière enzyme isolée et caractérisée qui présente une homologie à la fois avec les HDAC de classes I et II. Par conséquent, elle n’est classée dans aucune des autres classes.46
23 Il est nécessaire d’ajouter que les HDAC de classe I, II et IV font partie des métallo-enzymes dites zinc dépendantes.
En 1999, le groupe de Finnin avait déterminé la structure cristalline d’une HDAC47 par analyse cristallographique effectuée sur un homologue de HDAC de la bactérie Aquifex
aeolicus : la HDLP (Histone Deacetylase Like Protein). Cette enzyme partage une homologie
de séquence sur une région de 375 acides aminés avec la HDAC1 humaine. La structure fondamentale des HDAC de classe I et II est constituée d’une poche tubulaire, formée d’acides aminés hydrophobes et menant à une cavité interne où se trouve le site actif de l’enzyme. Cette région interne est capable de coordiner un atome de zinc à travers des résidus polaires d’histidines et d’asparagines. De plus, cette analyse structurale a permis de mettre en évidence le mécanisme moléculaire du mode d’action des HDAC zinc dépendantes. Plusieurs mécanismes de désacétylation des histones ont été proposés,48,49 comme celui de Finnin et al. présenté dans la Figure 8.
N O H N+ N H -O O H -O O H N N O H H H O -O O H N+ N H N N H-O O N+ H H H H O N O -H O H H O N+ N H -O O H -O O H N+ N H O -O Lysine Tyr297 His132 Asp173 His131 Tyr297 His132 His131 Asp166 Lysine Asp166 Asp173 Lysine Tyr297 His132 Asp173 His131 Asp166 Zn2+ Zn2+ Zn2+
Figure 8 : Mécanisme de désacétylation des histones proposé par Finnin 50
La désacétylation de la lysine commence par la coordination de l’atome de zinc avec l’atome d’oxygène d’une molécule d’eau, ainsi que l’atome d’oxygène du carbonyle du groupement acétyle de la lysine. La déprotonation de la molécule d’eau par l’histidine 132 va
24 permettre la formation d’un ion hydroxylium. Ce dernier va alors réagir sur le carbonyle par une attaque nucléophile pour former un intermédiaire acyloxanion, celui-ci est alors stabilisé par ses interactions avec l’atome d’hydrogène provenant du groupement hydroxyle de la tyrosine 297. Le réarrangement de cet intermédiaire tétraédrique permet la formation d’un ion acétate et une lysine désacétylée portant une fonction ammonium NH3+ à l’extrémité terminale de la chaine.
Il apparait qu’une surexpression de HDAC peut mener à la présence excessive d’extrémités terminales NH3+qui vont se lier fortement à l’ADN créant ainsi une chromatine compactée et inaccessible aux machineries de transcription. Ce rôle de répresseur transcriptionnel des HDAC peut être supprimé grâce à des molécules qui peuvent bloquer l’activité de ces enzymes, c’est le rôle des inhibiteurs d’histones désacétylases (iHDAC). Depuis que la surexpression des HDAC a été associée à l’apparition de cancers et à la progression des cellules tumorales, le développement des iHDAC comme agent anticancéreux a suscité un grand intérêt pour la recherche contre le cancer. En effet, il a été démontré que ces composés pouvaient entrainer l’arrêt du cycle cellulaire et de la prolifération, l’activation des programmes de différenciation et l’apoptose dans différents types de cancers.51
2.4.2
Les inhibiteurs d’histones désacétylases
La désacétylation des histones est un mécanisme réversible qui a ouvert des perspectives prometteuses pour l’utilisation des iHDAC dans le cadre d’une thérapie antitumorale. Cependant, ce n’est qu’après leur découverte et leur utilisation que leur effet inhibiteur de HDAC a été mis en évidence. Ces molécules ont contribué à une meilleure connaissance de ces enzymes et à leur utilisation comme cible thérapeutique.
Il existe une très grande diversité des iHDAC, d’origine naturelle ou synthétique, divisée en quatre grandes classes structurales :
Les acides hydroxamiques : la Figure 9 présente quelques exemples de molécules appartenant à cette famille. Les acides hydroxamiques se lient au niveau du site actif de l’enzyme en se chélatant à l’atome de zinc qui se trouve à l’intérieur de la poche catalytique
25 des HDAC zinc dépendantes. C’est pour cette raison que la plupart des iHDAC appartenant à cette famille inhibent les HDAC de classe I et II et sont inefficaces sur les enzymes de classe III qui ne sont pas zinc dépendantes. Dans cette catégorie on retrouve les iHDAC les plus connus : la trichostatine A (TSA) et le suberoylanilide hydroxamic acid (SAHA, Zolinza®). Des études in vitro ont montré que la TSA inhibe la croissance de cellules pulmonaires cancéreuses en stoppant le cycle cellulaire et en provoquant leur apoptose.52 Malheureusement son activité antitumorale in vivo est limitée à cause de son instabilité, de sa toxicité et de sa faible rétention dans l’organisme.53 Par ailleurs le SAHA, approuvé par la FDA (Food and Drug Administration), a montré une très bonne activité in vivo dans plusieurs types de cancers, comme dans le cas du cancer de la prostate en induisant une réduction du volume tumoral de 97% après 20 jours de traitement.54 L’activité anticancéreuse de cet agent a été également démontrée sur des patients atteints de leucémies cutanées et périphériques à cellules T.55 Le SAHA a également été étudié pour le traitement des patients atteints de mésothéliome (cancer de la plèvre),56 mais malheureusement, l’essai clinique a connu un échec en phase III.
Figure 9 : Quelques iHDAC de la famille des acides hydroxamiques
Les benzamides : dont les chefs de file sont le MS-275 et le CI-994 (Figure 10). Le MS-275 a montré des résultats in vitro très encourageants sur des lignées cellulaires de différents types de cancers et notamment le cancer du sein, du colon, de la prostate et la leucémie.57, 58, 59 Quant au CI-994, il a montré une activité anticancéreuse sur des tumeurs pulmonaires, de plus, il a présenté une activité cytotoxique sur 100% des modèles xénogreffes
26 humaines ou murines, quelle que soit l’origine de la tumeur.60 Leur mode d’action serait également basé sur la chélation à l’atome de zinc, démontrée récemment, mais pourrait aussi être allostérique.
Figure 10 : Quelques iHDAC de la famille des benzamides
Les tetrapeptides cycliques : Citons à titre d’exemple l’apicidine et la romidepsine (FK228, Istodax®) (Figure 11). La romidepsin a démontré une bonne activité anticancéreuse
in vivo sur des lignées de carcinomes pulmonaires transplanté chez la souris61 en induisant un arrêt du cycle cellulaire et de l’apoptose associé à une hyperacétylation de l’histone H3.62
Cet agent a été approuvé par la FDA pour le traitement des leucémies cutanées et périphériques à cellules T. Il est considéré comme ne prodrogue naturelle, le pont dissulfure étant ouvert in vivo et le butène-thiol libéré étant responsable de l’inhibition par chélation à l’atome de zinc du site.
Figure 11 : Quelques iHDAC de la famille des tetrapeptides cycliques
Les molécules d’acide carboxylique à courte chaine : les principaux inhibiteurs de cette classe sont l’acide valproïque (VPA), le butyrate de sodium et l’acide phénylbutyrique (Figure 12). L’acide phénylbutyrique a montré un effet inhibiteur de HDAC intéressant lors de son développement clinique en phase I sur des patients atteints de tumeurs solides.
27 Cependant des effets toxiques ont été remarqués comme la fatigue, les nausées et les vomissements.63 Si le VPA est bien connu comme antiépileptique (Dékapine®), sont efficacité sur certaines leucémies a été démontrée.64,65 Cependant ces différents composés ont une activité millimolaire peu propice à leur développement.
Figure 12 : Quelques iHDAC acides carboxyliques à courtes chaines
Malgré le nombre de iHDAC cité précédemment, l’utilisation de la plupart d’entre eux comme agent anticancéreux reste limitée à cause de leur effet toxique, leur rapide élimination par l’organisme et l’apparition de résistance.
En effet, dans le cas du traitement au VPA, on observe une apparition de thrombocytopénie (affection caractérisée par un nombre de plaquettes sanguines au-dessous de la normale) ainsi qu’une cardiotoxicité due aux doses de VPA administrées.66 Les iHDAC peuvent subir aussi des réactions métaboliques au sein de l’organisme conduisant ainsi à leur élimination. Citons par exemple la métabolisation du SAHA, en moins d’une heure, par la réaction de glucuronidation de la fonction acide hydroxamique,67 ainsi que la béta-oxydation du VPA. Des effets de résistance peuvent également être observés lors de certains traitements avec les iHDAC. Une surexpression de la P-glycoprotéine, un transporteur membranaire d’efflux, a été observée chez des patients traités au FK228.68
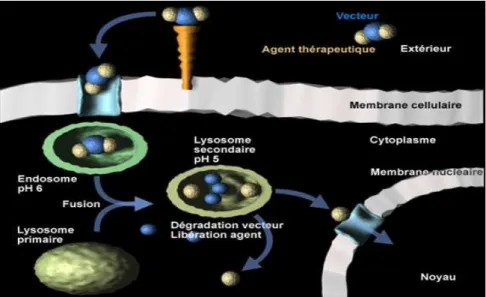
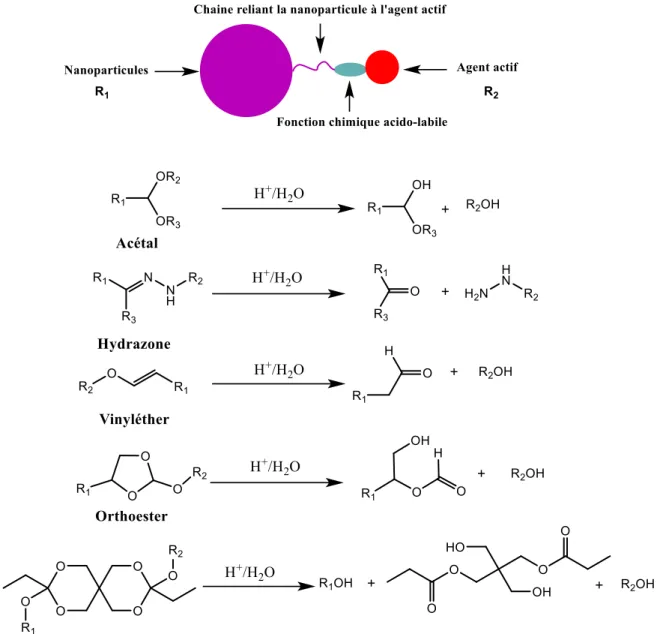
Ainsi, à cause de toutes ces limitations, certains iHDAC administrés se voient éliminés bien avant d’atteindre leur cible qui se trouve au niveau du noyau cellulaire. Leur activité anticancéreuse est alors atténuée. Afin de permettre à ces agents d’atteindre plus spécifiquement leur cible, il faut qu’ils puissent éviter les barrières enzymatiques menant à leur métabolisation rapide et à leur élimination, mais aussi, qu’ils puissent s’introduire dans la cellule en passant plus facilement les barrières biologiques. Ceci peut être réalisé grâce à la vectorisation des iHDAC.
28
2.5 La vectorisation thérapeutique
Le concept de la vectorisation thérapeutique constitue l’ensemble des approches permettant de transporter une molécule active jusqu’à sa cible biologique. En effet, le vecteur doit masquer et protéger la molécule transportée pour ne la libérer qu’une fois la cible atteinte. Pour ce faire, ce vecteur doit être biocompatible pour être toléré par l’organisme et doit posséder des propriétés de surface lui permettant d’être internalisé par les tissus ciblés. Sa biodistribution doit être maitrisée en tenant compte de l’état physiologique et du rythme biologique de l’organisme. Enfin, une fois la molécule libérée sur son site d’action, le vecteur doit être biodégradable, c’est-à-dire facilement éliminé par l’organisme. Ce concept a été tout d’abord proposé à la fin du XIXème siècle par l’immunologiste Paul Ehrlich, qui énonça la théorie du ‘’Magic Bullet’’69
et depuis, la recherche en vectorisation thérapeutique a fait des progrès considérables donnant naissance à plusieurs formes de vecteurs pour le traitement de différentes pathologies comme le cancer et les maladies infectieuses. Ainsi, de nombreux vecteurs de nature diverse sont étudiés en recherche. Cependant notre intérêt s’est porté vers les vecteurs utilisés dans les thérapies anticancéreuses. On peut en citer quelques exemples :
Les vecteurs viraux : ce sont des vecteurs naturels non pathogènes, leur patrimoine génétique est modifié afin de transporter le gène ‘’médicament’’ à l’intérieur des cellules.70
Les vecteurs peptidiques et protéines de translocation : leurs séquences d’acides aminés peuvent être d’origine naturelle (comme les protéines de surface de virus ou de bactéries) ou synthétique. Ils ont la particularité de traverser la membrane cytoplasmique des cellules eucaryotes et ont été ainsi utilisés pour la vectorisation de macromolécules.71
Les vecteurs nanoparticulaires : ce sont des colloïdes synthétiques adoptant différentes structures et possédant plusieurs propriétés uniques. Les nanoparticules organiques sont connues pour être biocompatibles et leur utilisation dans le domaine médical et plus particulièrement en vectorisation thérapeutique, a connu un essor considérable au cours de ces dernières années.
Parmi les vecteurs thérapeutiques cités précédemment, notre attention s’est portée plus particulièrement sur l’étude des nanoparticules. L’application de ces derniers à des agents anticancéreux, comme les iHDAC, pourrait en effet améliorer l’activité cytotoxique de ces modulateurs épigénétiques.
29 Ainsi, la partie qui suit s’intéressera aux nanoparticules et à leurs différentes applications dans le domaine médical et plus particulièrement à leur utilisation comme vecteurs de molécules anticancéreuses.
30
3 Utilisation des nanoparticules comme vecteur
thérapeutique
Le terme nanoparticule désigne un assemblage d’atomes formant un objet dont la taille est comprise entre 1 et 100 nm sur au moins une de ses dimensions.72 C’est une taille qui correspond à la gamme de taille des molécules biologiques, comme les protéines. Cependant, la définition trouvée dans les ouvrages de pharmacopée donne une taille pouvant aller jusqu’au micromètre. Pour les applications anti-cancéreuses, la taille maximum usuelle est 200 nm. On désigne par nanotechnologie, la conception, l’ingénierie et l’application de nano-objets dans plusieurs secteurs d’activités comme la médecine, l’automobile, l’aéronautique, l’électronique, l’énergie et l’environnement. Ces applications diverses et variées ont vu le jour grâce au développement de nanoparticules ayant différentes caractéristiques physicochimiques, comme la taille, la charge de surface, la forme, l’hydrophobicité et la porosité. Ainsi, chacune de ces caractéristiques confère des propriétés uniques à chaque nanoparticule et notamment la réactivité, la résistance, la biocompatibité et les propriétés optiques.
Au cours de cette dernière décennie, la médecine a connu une nouvelle expansion grâce à la nanotechnologie en raison de la facilité avec laquelle les nanoparticules interagissent avec le vivant à l’échelle moléculaire. Les nouvelles thérapies pour le cancer ou autres pathologies ont donc fait appel aux nano-objets afin d’améliorer l’efficacité des médicaments avec le minimum d’effets indésirables. Mais encore, les nanotechnologies constituent des outils très intéressants pour d’autres applications tels que la vaccination, le diagnostic et l’imagerie médicale.73
3.1 Importance des nanoparticules en médecine
La faible taille des nanoparticules est une de leurs particularités qui leur permet d’avoir une surface spécifique très importante ainsi qu’une grande stabilité. Par ailleurs, les nanoparticules peuvent être constituées de différents matériaux, tels que les polymères, les
31 particules inorganiques ou les lipides, chaque type ayant des propriétés électroniques, optiques, thermiques et aussi magnétiques applicables à la vectorisation de médicaments destinés à la thérapie ou au transport d’agents de contraste destinés au diagnostic.
Ces systèmes offrent un excellent moyen d’administration d’agents thérapeutiques présentant un effet toxique important et une faible solubilité in vivo. En effet, les nanoparticules vont protéger les agents actifs des mécanismes de métabolisation et les véhiculer jusqu’à l’environnement pathologique ciblé où ils vont être délivrés.74 Cependant, le développement de ces nanovecteurs reste complexe car il fait appel à la maitrise de différentes disciplines, comme la chimie, la physico-chimie et la pharmacologie. Par ailleurs, les nanoparticules développées doivent répondre à deux critères très importants : le premier concerne la biodégradabilité et la biocompatibilité des matériaux utilisés. En effet, après l’administration des nanoparticules, ces dernières ne doivent induire ni toxicité ni effets inflammatoires. De plus, l’organisme doit être capable de les éliminer. Le deuxième critère concerne le transport de l’agent actif. Ce dernier doit être encapsulé par les nanovecteurs qui doivent assurer sa circulation dans l’organisme vers le milieu tissulaire ou cellulaire ciblé.75
Une fois que les nanoparticules sont administrées dans l’organisme, elles peuvent faire face à différentes barrières biologiques et leur biodistribution est influencée par leurs propriétés structurales (type, taille et forme des matériaux). Ainsi, le challenge est de pouvoir élaborer des nanovecteurs capables de traverser ces barrières tout en transportant le médicament vers sa cible.
3.1.1 Les barrières biologiques aux nanoparticules
La voie intraveineuse reste le moyen le plus pratique pour l’administration des nanoparticules mais elles peuvent rencontrer certaines contraintes in vivo. En effet, les nanovecteurs de taille inférieure à 10 nm peuvent subir une élimination par le système rénal et hépatique.76 De plus, elles peuvent se heurter aux phénomènes d’opsonisation, c’est à dire être fixées à leur surface des protéines appelées opsonines qui permettent leur reconnaissance et élimination par le système phagocytaire mononucléaire (MPS).77 Elles sont alors éliminées bien avant d’atteindre leur site d’action. Ce phénomène d’opsonisation est observé pour les nanoparticules d’une taille supérieure à 200 nm, dont la surface plus grande permet de fixer plus d’opsonines.78
32 optimale pour des nanoparticules thérapeutiques se situe entre 20 et 100 nm. Elles présentent un nouvel espoir pour leur application en tant que vecteurs in vivo, et cela grâce à leur habilité à circuler d’une manière prolongée dans l’organisme. Elles peuvent échapper facilement aux systèmes rénal et hépatique car leur taille est assez grande, et aussi, d’éviter l’opsonisation car leur taille est assez petite. Par ailleurs, il apparait que les nanoparticules ayant cette gamme de taille peuvent être s’accumuler préférentiellement dans les tissus tumoraux pour ensuite être internalisées par les cellules cancéreuses.79 Ceci est dû à la forte perméabilité vasculaire de certains tissus tels que les tumeurs ou les sites d’inflammations. Cette accumulation est très importante pour le maintien de l’agent thérapeutique à de fortes concentrations sur son site d’action, et cet effet est augmenté par le faible drainage lymphatique au niveau de ces tissus. Ce phénomène est appelé l’effet EPR (Enhanced Permeability and Retention).
La biodistribution des nanovecteurs peut être aussi affectée par la nature chimique de la surface des nanoparticules. En modifiant chimiquement cette surface, il est possible de moduler l’effet de charge ainsi que le caractère hydrophile/hydrophobe des nanoparticules.80
La charge de surface des nanoparticules a un effet très important sur leur circulation dans le sang, sur leurs interactions avec la matrice extracellulaire ainsi que sur leur capture cellulaire. En effet, les nanovecteurs ayant un excès de charge positive à leur surface sont rapidement éliminées par les cellules du MPS et cela en favorisant leurs interactions avec les opsonines.81 Il a aussi été démontré que l’opsonisation des nanoparticules hydrophobes se fait plus rapidement que l’opsonisation des nanoparticules hydrophiles et cela à cause des interactions hydrophobes qui favorisent l’adsorption des protéines d’opsonines à la surface des nanoparticules.82
Ainsi, afin de ralentir le processus d’opsonisation, des modifications chimiques peuvent être appliquées à la surface des nanoparticules dans le but de minimiser les interactions électrostatiques et hydrophobes responsables de la fixation des protéines d’opsonines sur les nanoparticules. Les meilleurs candidats à ces modifications doivent apporter un caractère neutre et hydrophile à la surface des nanoparticules, c’est le cas de certains polymères, comme les polysaccharides, les polyéthylènes glycol (PEG)83 et les poloxamers (copolymères bloc avec séquence ethylèneoxyde et propylèneoxyde). Les PEG sont les plus utilisés pour la modification de la surface des nanoparticules. Les chaines PEG
33 sont des polymères hydrophiles neutres qui vont servir de bouclier aux nanoparticules hydrophobes chargées positivement en leur conférant un effet de furtivité envers les macrophages du MPS.84
3.1.2
L’effet EPR :
L’utilisation de nanoparticules ayant une taille comprise entre 20 et 100 nm et présentant des caractères hydrophiles et neutres va permettre la circulation prolongée des nanovecteurs dans l’organisme. Cette circulation prolongée va permettre leur passage dans certains sites altérés où ils peuvent s’accumuler. Ce phénomène décrit il y’a une trentaine d’années par Maeda et Matsumura85
est observé principalement dans le cas de tumeurs ou d’inflammations, c’est l’effet EPR cité précedemment (Enhanced Permeability and Retention, Figure 13).
Figure 13 : Schéma représentatif de l'effet EPR et du ciblage passif 86
Ce phénomène se produit lors de l’apparition de conditions inflammatoires où on observe la présence de fenestrations aux niveaux des vaisseaux sanguins. L’apparition de ces fenestrations est due à l’action de différentes molécules agissant sur les cellules endothéliales et ouvrant les jonctions serrées intercellulaires. Parmi ces molécules on trouve : la bradykinine, l’histamine, les prostaglandines, et le facteur de nécrose tumorale. Cet effet est également observé dans le cas d’infections microbiennes, où la sécrétion de bradykinine cause la formation d’œdème.87 Dans le cas d’un tissu tumoral, au moins deux substances vont être