HAL Id: tel-01808989
https://tel.archives-ouvertes.fr/tel-01808989
Submitted on 6 Jun 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Impact de la cristallisation sur la structure et la
durabilité chimique de verres borosilicatés
Elodie Nicoleau
To cite this version:
Elodie Nicoleau. Impact de la cristallisation sur la structure et la durabilité chimique de verres borosilicatés. Autre. Université Montpellier, 2016. Français. �NNT : 2016MONTT274�. �tel-01808989�
Délivré par l’Université de Montpellier
Préparée au sein de l’école doctorale 166
Informations, Structures, Systèmes
Et de l’unité de recherche CEA Marcoule LCLT
Spécialité : Physique
Présentée par Elodie Nicoleau
Soutenue le 02 février 2016 devant le jury composé de
Mme. Claudine FOLLET, Professeur, Univ. Valenciennes Rapporteur Mme. Nadia PELLERIN, Maitre de conférences, Univ. Orléans Rapporteur Mme. Annie PRADEL, Professeur, Univ. Montpellier Président du jury M. Frédéric ANGELI, Ingénieur-chercheur, CEA Directeur de thèse Mme. Nolwenn CHOUARD, Ingénieur, AREVA Invité Mme. Sophie SCHULLER, Ingénieur-chercheur, CEA Invité Mme. Aurélie VERNEY-CARRON, Maitre de conférences,
Univ. Paris-Est Créteil
Invité
IMPACT DE LA CRISTALLISATION SUR LA
STRUCTURE ET LA DURABILITE
“Sometimes glass glitters more than diamonds
because it has more to prove.”
R
EMERCIEMENTS
Si je me suis lancée dans cette grande aventure qu’est la thèse, c’est en grande partie grâce à deux personnes de mon entourage. Tout d’abord, mon amie, Céline, qui un jour en évoquant son travail m’a transmis sa passion pour le verre ; puis Monique Comte qui, en plus d’avoir confirmé cet intérêt pour ce matériau passionnant, m’a permis d’assister aux journées GDR-USTV de Rennes et ainsi de rencontrer Etienne Vernaz qui m’a appris l’existence de ce sujet.
Cette thèse a été réalisée au sein du Commissariat à l’Energie Atomique et aux Energies Alternatives de Marcoule. Les travaux présentés sont le fruit d’une collaboration entre deux laboratoires du Service d’Etude et Comportement des Matériaux de conditionnement (SECM) : le Laboratoire d’étude du Comportement à Long Terme des matériaux de conditionnement (LCLT) et le Laboratoire d’étude et Développement de Matrices de Conditionnement (LDMC). Je tiens donc à remercier Bruno Lorrain, Frédéric Angeli et Olivier Pinet de m’avoir accueillie au sein de leur unité de recherche et de m’avoir permis de réaliser mes trois années de thèse dans les meilleures conditions. Cette étude a été cofinancée par Areva et je souhaite remercier Sophie Bétremieux et Nolwenn Chouard qui ont successivement suivi l’avancée de ces travaux.
Merci également aux membres du jury : Claudine Follet et Nadia Pellerin qui ont accepté de rapporter ce travail, Annie Pradel qui a présidé le jury et Aurélie Verney-Carron qui a accepté d’examiner cette thèse malgré les contraintes administratives.
Un grand merci à ceux qui ont suivi mes travaux au quotidien. Tout d’abord, à Frédéric Angeli qui a dirigé cette thèse. Merci d’avoir toujours été disponible, de m’avoir fait découvrir la RMN dont je n’ai pas encore percé tous les mystères… et bien évidemment de m’avoir accueillie dans le grand club sportif qu’est le « Tennis Club de Chusclan » au sein duquel j’ai pu passer d’excellents moments et partager avec toi un match mémorable ! (Je me souviens encore : « Ben Elodie, tu ne t’échauffes pas… ! »). A Sophie Schuller, qui a su apporter le dynamisme et l’énergie nécessaires à l’avancement de cette étude. Merci de ne rien avoir laché et de m’avoir épaulée jusqu’au bout que ce soit pour l’écriture du manuscrit ou, quelques mois plus tard, pour la préparation de l’oral. Et puis, même si ton nom n’apparaît nulle part dans l’équipe encadrante, merci à Patrick Jollivet d’avoir toujours été présent malgré les difficultés du sujet et notamment de ces verres au molybdène qui se dissolvaient trop vite et dont les résultats ont fait l’objet de nombreux débats !
Merci à tous les membres du LCLT qui ont rendu ces trois années exceptionnelles et qui, par leur bonne humeur et leur gentillesse, ont permis de toujours passer des bons moments. Merci : à Emmanuelle Garcès qui a su m’apporter son aide et poursuivre mes expériences pendant mon congé maternité ; aux blagueurs, Pierre Frugier et Jean-Pierre Mestre, sans qui les pauses ne seraient pas aussi sympathiques ; à Loïc Marchetti pour m’avoir permis, à travers le récit de ses expériences, de dédramatiser la rédaction ; à Nicole Godon pour sa gentillesse, son oreille attentive et sa présence dans les moments difficiles ; à Jean-Louis Chouchan sur qui j’ai toujours pu compter ; à Florence Bruguier et Céline Marcou pour leur bonne humeur et leurs talents de cuisinières (d’ailleurs Céline, à présent que je ne suis plus dans l’équipe, tu me la donnes ta recette de tarte au fromage blanc ???) ; à Yves Minet dont la culture n’a pas d’égal ; à Stéphane Gin pour ses conseils ; à Chantal Sanchez pour les papotages en paillasse ; à l’équipe de l’ICP, Géraldine Parisot, Sandra Contat, Mylène Aragon et Frédéric Bouyer pour avoir analysé mes
Remerciements
iv
solutions puis pour m’avoir fait confiance et laissé prendre en main l’instrument et enfin à Valérie Sivera pour les missions et autres services qu’elle a pu me rendre.
Merci également à l’ensemble des personnels du LDMC qui m’ont toujours accueillie chaleureusement et avec qui ça a été un plaisir de travailler et d’échanger de bons moments. Un grand merci en particulier à : Myriam Chartier pour son aide et nos papotages, Lionel Campayo pour sa formation MEB indispensable pour mener à bien cette étude, Fabienne Delabaudière pour avoir été disponible notamment quand il a été nécessaire de faire la démarche compliquée de la prolongation de contrat, Isabelle Giboire pour ses précieux conseils sur l’élaboration des matériaux, Nicolas Massoni pour les affinements Rietveld et Bruno Pénelon pour les mesures ATD, la distribution des creusets, le café… Merci aussi aux filles, Virginie Ansault et Charlène Vallat, avec qui j’ai pu partager des moments de détente ! Je remercie également Magaly Tribet
du LMPA. Ces travaux m’ont également amenée à travailler en collaboration avec de nombreux
laboratoires et je tiens à remercier les personnes qui ont apporté leur contribution à ce sujet. Thibault Charpentier et Mélanie Moskura du CEA Saclay, qui ont acquis et traité les données RMN. Merci Thibault pour ton intérêt pour mon travail qui aura nécessité de nombreuses acquisitions et parfois même certaines dans l’urgence ! Jacques Rogez et Pierre Benigni de l’IMN2P de l’université d’Aix-Marseille qui m’ont fait découvrir l’intérêt de la calorimétrie dans le domaine verrier. De l’ICSM, je tiens à remercier : Renaud Podor et Johann Ravaux pour les expériences en MEBE et les jolis films qui en ont découlé, Adel Mesbah pour les affinements Rietveld et Stéphanie Szenknect et Diane Rebiscoul pour nos échanges autour des posters des journées scientifiques de Marcoule. Pascale Colombel et Laurent Duffours de l’entreprise PrimeVerre qui ont fait un travail remarquable de préparation des poudres de verre.
Un grand merci également à Bernadette Lacan de l’école doctorale I2S que j’ai sollicitée à de nombreuses reprises et qui a, toujours dans la bonne humeur, tout fait pour me faciliter cette fin de thèse riche en administratif.
Merci à tous mes collègues thésards, stagiaires, post-docs avec qui j’ai pu partager des moments géniaux, inoubliables, que je ne pourrai malheureusement pas tous citer. Tout d’abord, il y a eu notre épopée à Cherbourg où le moral a été soumis à rude épreuve mais ce voyage a surtout conduit à la naissance de jolies amitiés et à mon apprentissage de la coinche. Ensuite, il y a eu un sacré challenge avec le défi Monté Cristo et ses 2 km en mer puis les différentes sorties canoë, barbecues, baignades aux cascades du Sautadet, festival d’Avignon… Et enfin tous les bons moments passés dans les laboratoires. Pour tout ça, merci à Elodie, Clémentine, Marie, Tom, Marc, Aurélien, Mélanie, Romain, Mathieu, Hélène P, Judith, Caroline, Jean, Pierrick, Sarah, Sara, Benjamin(s), Lindsey, Victor, Joris, Morgane. Merci à Jessica Vincent-Balandier, Alexandre Le Gac et Gaëtan Annaloro pour leur aide qui a permis l’acquisition de nombreuses données et à qui je souhaite le meilleur pour la suite.
Une grosse pensée pour ma cobureau Hélène Arena avec qui j’ai pu partager d’intenses moments de réflexion (ou juste discussion), ma passion pour le thé et ma joie de devenir maman !
Bien évidemment, un IMMENSE merci à Maxime Fournier sans qui cette thèse n’aurait pas été la même ! Merci pour : sa gentillesse, son aide au laboratoire, nos moments de craquage quand tard le soir il ne restait plus que nous au 438, nos covoiturages malgré mes retards le matin dans les
Remerciements
débuts, ses croque-monsieur améliorés… (et tant d’autres choses encore) ! Je n’aurais jamais imaginé qu’un sac à dos jaune pourrait conduire à une si belle amitié !
Pour terminer cette longue liste, je tiens à remercier infiniment mes parents et ma sœur qui ont toujours cru en moi. Merci pour vos encouragements et votre soutien sans faille qui ont su me motiver et m’emmener là où j’en suis aujourd’hui.
Enfin, je remercie du fond de mon cœur, celui avec qui je partage ma vie depuis près de 7 ans maintenant : Thomas. Au cours de ces trois années, nous nous sommes mutuellement soutenus et encouragés pour réussir nos thèses, et tout ça, malgré la distance. Cette période terminée, une nouvelle vie commence, ensemble auprès de notre petit Quentin qui, par sa gentillesse et ses nuits bien rodées pour son jeune âge, pourra se vanter de ne même pas avoir pertubé ni sa maman ni son papa dans la préparation de leurs oraux respectifs ! Je vous aime.
S
OMMAIRE
Remerciements ... iii
Sommaire…… ... vii
Introduction générale ... 1
CHAPITRE 1.
Etat de l’art ... 5
1.1. Origine et gestion des déchets radioactifs... 5
1.1.1. Les différents types de déchets radioactifs ... 5
1.1.2. Vitrification et stockage géologique pour confiner les déchets de haute activité ... 6
1.2. Les verres : structures et hétérogénéités ... 8
1.2.1. Description générale de la structure des verres ... 8
1.2.2. Mécanismes de formation des hétérogénéités dans les verres ... 14
1.2.3. Les éléments à l’origine de la cristallisation dans les verres nucléaires ... 18
1.3. Altération des verres homogènes et hétérogènes en milieu aqueux ... 30
1.3.1. Altération d’un verre homogène ... 31
1.3.2. Influence des hétérogénéités sur la durabilité chimique des verres ... 35
1.4. Conclusions du chapitre 1 ... 41
CHAPITRE 2.
Approche
expérimentale
développée
pour
l’étude
de
l’altération de verres partiellement cristallisés ... 43
2.1. Nature des hétérogénéités dans les verres nucléaires ... 43
2.2. Choix des systèmes modèles ... 44
2.2.1. Sélection des hétérogénéités étudiées... 44
2.2.2. Compositions des systèmes modèles ... 44
2.2.3. Compositions des systèmes complexes ... 49
2.3. Détermination des paramètres influençant l’altération de verres hétérogènes . 50 2.3.1. Expérience préliminaire d’altération de verres hétérogènes ... 50
2.3.2. Discussion ... 53
2.4. Techniques de caractérisation et protocoles d’altération... 56
2.4.1. Techniques de caractérisation des matériaux ... 56
2.4.2. Protocoles d’altération ... 61
Sommaire
viii
CHAPITRE 3.
Influence d’une séparation de phase de type molybdates sur la
durabilité chimique du verre ... 65
3.1. Préparation des verres ... 65
3.2. Impact de la teneur en oxyde de molybdène – Etude de la série xMo ... 66
3.2.1. Influence de la démixtion sur la morphologie et la structure du verre borosilicate de sodium ………. ... 66
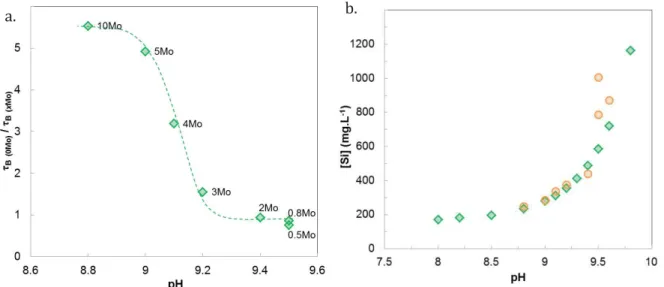
3.2.2. Etude de l’altération ... 76
3.2.3. Discussion ... 83
3.2.4. Conclusions sur l’impact de la teneur en oxyde de molybdène ... 88
3.3. Impact de la nature des molybdates – Etude de la série 3Mo3Y ... 88
3.3.1. Influence de la cristallisation de molybdates d’alcalino-terreux sur la morphologie et la structure du verre borosilicate ... 89
3.3.2. Etude de l’altération ... 95
3.3.3. Discussion ... 99
3.4. Conclusions du chapitre 3 ... 100
CHAPITRE 4.
Influence de la cristallisation de Ca
2TR
8(SiO
4)
6O
2sur la
structure et la durabilité chimique des verres ... 103
4.1. Préparation des matériaux modèles ... 103
4.1.1. Conditions de synthèse des verres homogènes ... 103
4.1.2. Conditions de synthèse des céramiques ... 104
4.1.3. Conditions optimales de cristallisation des verres par traitement thermique ... 104
4.1.4. Etude de la cristallisation ... 106
4.2. Caractérisations microstructurales des verres cristallisés ... 109
4.2.1. Observations microscopiques des verres ... 109
4.2.2. Détermination de la microstructure des phases cristallines ... 110
4.2.3. Détermination des compositions des verres englobants... 115
4.3. Etude de la structure des verres au lanthane... 115
4.3.1. RMN MAS 11B ... 116
4.3.2. RMN MAS 29Si ... 118
4.3.3. RMN MAS 23Na ... 119
4.3.4. RMN MQMAS 17O ... 120
4.3.5. Discussion ... 121
4.3.6. Conclusions sur l’impact de la cristallisation sur la composition chimique et la structure de la partie vitreuse englobante ... 122
4.4. Etude de la durabilité chimique des matériaux ... 123
Sommaire
4.4.2. Altération en régimes de chute de vitesse et de vitesse résiduelle ... 126
4.4.3. Etude de la pellicule d’altération ... 131
4.4.4. Discussion ... 134
4.5. Conclusions du chapitre 4 ... 140
CHAPITRE 5.
Application des systèmes simples à l’étude de systèmes
complexes……….. ... 141
5.1. Influence de la répartition hétérogène de cristaux de RuO2 sur la durabilité chimique du verre... 142
5.1.1. Caractérisation et altération des verres ... 143
5.1.2. Application de la méthodologie développée sur les systèmes modèles ... 146
5.2. Influence de la présence de gradients de composition sur la durabilité chimique du verre ... 147
5.2.1. Caractérisation des verres ... 148
5.2.2. Altération des verres ... 152
5.3. Conclusions du chapitre 5 ... 154
Conclusion générale ... 155
Références bibliographiques ... 159
Annexes………….. ... 177
Annexe 1 : Données expérimentales – tests d’altération en régime de vitesse initiale... 177
I
NTRODUCTION GENERALE
Si la stratégie énergétique de la France aspire à évoluer vers la transition énergétique et écologique avec le développement des énergies vertes, la production actuelle d’électricité est majoritairement d’origine nucléaire (75 à 80 %). Cette énergie génère des déchets radioactifs dont la gestion est un enjeu crucial.
Le combustible nucléaire usé est traité afin d’en extraire les matières valorisables, plutonium et uranium, qui sont réutilisées dans de nouveaux combustibles mixtes. Les autres éléments, produits de fission et actinides mineurs (PFA), constituent les déchets « ultimes ». Parce qu’il garantit un bon confinement des radionucléides ainsi qu’une réduction du volume des déchets, le verre borosilicaté est choisi comme matériau de conditionnement. Après élaboration par fusion du déchet calciné et d’un précurseur vitreux (fritte de verre), les verres sont coulés dans des conteneurs métalliques puis entreposés avant leur stockage définitif.
Suite aux différentes lois concernant la gestion des déchets radioactifs, loi Bataille de 1991 et loi de 2006, l’Agence Nationale pour la gestion des Déchets Radioactifs (ANDRA) a étudié un projet de stockage géologique profond réversible (projet CIGÉO) reposant sur un concept multi-barrières assurant une protection de la biosphère vis-à-vis de la dispersion des radionucléides. Trois barrières sont proposées dans ce concept : la matrice de verre, un surconteneur métallique et la roche hôte du site de stockage (argiles du Callovo-Oxfordien situées à la limite de la Meuse et de la Haute-Marne entre 400 m et 600 m de profondeur). Dans ces conditions, les colis de verre se trouvent en contact avec l’eau souterraine après corrosion du conteneur métallique. Les nombreuses études menées sur le comportement du verre en conditions de stockage (altération de la matrice de verre par l’eau souterraine, effet des matériaux d’environnement, influence de l’auto-irradiation…) ont conduit à la demande d’autorisation de création du centre de stockage visant un début de construction en 2017 et une mise en exploitation du centre en 2025.
Au cours de sa fabrication, le verre peut subir des phénomènes de séparation de phase et/ou de cristallisation pouvant conduire à la présence d’hétérogénéités microscopiques (cristaux, phases séparées, gradients de composition) et à la modification des propriétés macroscopiques et physico-chimiques du verre (viscosité, conductivité thermique, altération aqueuse). Ces hétérogénéités peuvent notamment se former suite à des surconcentrations locales d’éléments du déchet calciné au sein de la fritte de verre et sont redissoutes dans le verre lors d’une élévation de température. L’homogénéité du verre est ainsi contrôlée par le choix d’un taux d’incorporation et l’utilisation de conditions de vitrification optimales (temps, température, agitation).
Dans l’objectif d’augmenter le taux d’incorporation en déchet ou de conditionner de nouveaux types de déchets, des verres partiellement cristallisés pourraient être élaborés. Il s’avère alors nécessaire d’évaluer les effets de la présence de phases cristallines ou de phases séparées dans les verres vis-à-vis du comportement à long terme du verre et en particulier vis-à-vis de sa durabilité chimique. Deux effets sont notamment à considérer :
Introduction générale
2
(i) les modifications de la composition du verre qui englobe les hétérogénéités de par la mobilisation de certains éléments au sein des cristaux,
(ii) la présence d’hétérogénéités ayant une durabilité chimique différente de la matrice de verre initiale.
L’objectif de ce travail de thèse est de définir une méthodologie d’étude des matrices partiellement cristallisées afin d’être en mesure de décrire précisément l’impact de la présence de cristaux au sein d’une matrice vitreuse sur son comportement vis-à-vis de l’altération par l’eau. Menée sur des verres inactifs, cette étude se focalise sur l’effet de la nature de la phase cristalline, le taux de cristaux ainsi que le mécanisme dont est issu la cristallisation (séparation de phase ou cristallisation par nucléation-croissance) en omettant la problématique de la fracturation du colis de verre.
Dans ce contexte, trois phases susceptibles de se former lors d’une augmentation du taux d’incorporation en déchet au sein des verres de conditionnement de type Uranium Oxyde ont été retenues : les molybdates d’alcalins et d’alcalino-terreux (Na2MoO4, Na2Mo2O7, CaMoO4, SrMoO4,
BaMoO4), les silicates de terres rares de structure apatitique Ca2TR8(SiO4)6O2 et l’oxyde de
ruthénium (RuO2). En considérant des phases de différentes natures, l’influence de la durabilité
chimique de la phase cristalline sur la durabilité globale de la matrice de conditionnement est également étudiée.
Cette étude se décompose en trois parties. La première consiste à déterminer une méthodologie pour décrire le comportement à l’altération de verres partiellement cristallisés. Dans la seconde partie qui constitue l’axe majeur de ce travail, l’influence de la présence de phases cristallines sur l’altération de systèmes modèles contenant une phase cristalline unique est évaluée. Le dernier axe développe une réflexion sur l’adaptation de la méthodologie proposée à l’étude de l’altération de systèmes plus complexes, qui présentent des phases cristallines et des hétérogénéités chimiques réparties de manière non homogène au sein de la matrice vitreuse. Ce manuscrit s’organise en cinq chapitres.
Le premier chapitre introduit le contexte de l’étude, en présentant la vitrification des déchets de haute activité à vie longue et le concept de stockage envisagé pour ces déchets. Dans la suite de ce chapitre introductif est proposée une synthèse des connaissances. Elle décrit les notions utiles à la compréhension de ce travail de thèse avec, d’une part, des généralités sur la structure vitreuse, les mécanismes de formation des hétérogénéités dans les verres ainsi que sur les principaux éléments responsables de la cristallisation au sein des verres nucléaires et, d’autre part, la description des mécanismes et des paramètres pilotant l’altération des verres homogènes et cristallisés.
Le deuxième chapitre est consacré à la description de l’approche retenue dans cette étude pour déterminer les paramètres influençant la durabilité chimique d’un verre cristallisé. Après avoir défini les systèmes modèles (nature des phases cristallines et composition des verres), les résultats d’une étude préliminaire d’altération de verres cristallisés sont présentés. Ce travail met en évidence les paramètres d’étude essentiels à la compréhension du comportement vis-à-vis de l’altération de verres contenant des phases cristallines. La dernière partie de ce chapitre détaille les techniques d’analyse et de caractérisations ainsi que les protocoles d’altération utilisés.
Introduction générale
Les trois chapitres suivants traitent de l’impact de la présence de phases cristallines de nature variable sur les différents régimes d’altération d’un verre cristallisé. Par l’utilisation de plusieurs techniques de caractérisation (RMN, DRX-Rietveld, MEB-analyse d’images), des liens sont établis entre les propriétés des verres cristallisés (structure vitreuse, nature et taux de la phase cristalline) et les cinétiques d’altération.
Ainsi, le chapitre trois concerne l’influence d’une séparation de phase conduisant à la cristallisation de molybdates sur la durabilité chimique d’un verre borosilicaté. Les effets de l’addition d’oxyde de molybdène et de la nature du molybdate cristallisé (Na2MoO4, BaMoO4,
CaMoO4 ou SrMoO4) sont discutés.
Le quatrième chapitre se focalise sur l’influence d’une cristallisation de silicates de terres rares de composition Ca2TR8(SiO4)6O2 avec TR = La ou Nd. L’influence sur l’altération des différents
paramètres liés à la cristallisation (taux de cristaux, interface verre-cristal et caractéristiques de la phase vitreuse) ainsi que celle de l’effet de la nature de la terre rare sont discutées dans ce chapitre.
Enfin, le cinquième chapitre s’attache à étudier des systèmes complexes présentant différentes hétérogénéités réparties de manière hétérogène dans la matrice vitreuse. Les effets de la
présence de cristaux de RuO2 et de gradients chimiques sont étudiés dans une première partie
puis les apports et limites de la méthode développée dans les chapitres 2, 3 et 4 sont discutés en vue d’une application aux systèmes complexes.
CHAPITRE 1. E
TAT DE L
’
ART
Ce premier chapitre développe le contexte général de cette thèse. Dans une première partie, l’origine des différents types de déchets radioactifs sera décrite, puis la gestion particulière des déchets de haute activité (dits « déchets ultimes ») sera présentée avec la description du procédé de calcination-vitrification et du concept de stockage géologique des colis de verre. Des généralités sur la structure des verres et les mécanismes de formation des hétérogénéités au sein des verres seront ensuite exposées dans une seconde partie, avant de présenter l’impact du molybdène et des terres rares sur la structure et la cristallisation des verres nucléaires. Pour terminer, un état de l’art sera dressé sur la phénoménologie de l’altération aqueuse de verres homogènes et de verres contenant des hétérogénéités (séparation de phase et cristallisation).
1.1. Origine et gestion des déchets radioactifs
1.1.1. Les différents types de déchets radioactifs
Selon l’Agence Internationale de l’Energie Atomique, « toute matière pour laquelle aucune utilisation n’est prévue et qui contient des radionucléides en concentration supérieure aux valeurs que les autorités compétentes considèrent comme admissibles dans des matériaux propres à une utilisation sans contrôle » est considérée comme un déchet radioactif.
Les déchets radioactifs proviennent de nombreux secteurs d’activité : électronucléaire, défense, recherche, industrie et médical. Pour trouver des solutions de gestion adaptées, ils sont classifiés selon deux paramètres : l’activité de leur radioactivité initiale et la durée pendant laquelle ils présentent un risque radiologique. Cinq catégories de déchets sont ainsi distinguées (tableau 1.1).
Période Durée de vie
Activité Vie Courte (VC, période < 30 ans) Vie Longue (VL, période > 30 ans)
Très Faible Activité (TFA) Stockés en surface au centre de stockage TFA de l’Aube Déchets TFA
Faible Activité (FA) Déchets FMA-VC Stockés en surface au centre de stockage TFA de l’Aube qui a succédé
au centre de stockage de la Manche
Déchets FA-VL
Stockage en subsurface à l’étude Moyenne activité (MA) Centre de stockage profond à l’étude Déchets MA-VL
Haute activité (HA) Déchets HA
Centre de stockage profond à l’étude
Tableau 1.1 : Catégories de déchets nucléaires en France et mode de gestion retenu ou envisagé.
L’étude réalisée dans le cadre de cette thèse portant sur des déchets de haute activité (HA), seul ce type de déchet est considéré dans la suite. Les déchets HA représentent seulement 0,2 % du volume total de déchets mais concentrent 96 % de la radioactivité totale des déchets radioactifs français (ANDRA, 2012). Ils correspondent essentiellement aux résidus hautement radioactifs issus du traitement des combustibles usés (procédé PUREX) (Madic, 1999). L’ensemble des déchets est isolé sous forme de solutions contenant des actinides mineurs (Np, Am, Cm) et des
Chapitre 1 : Etat de l’art
6
produits de fission, principalement constitués d’alcalins (Cs, Rb), d’alcalino-terreux (Sr), de chalcogènes (Se, Te), de métaux de transition (Mo, Tc, Zr), de platinoïdes (Ru, Pd, Rh) et de lanthanides (La, Ce, Pr, Nd…) (Advocat et al., 2008).
1.1.2. Vitrification et stockage géologique pour confiner les déchets de
haute activité
Afin de réduire le volume de déchets et de satisfaire aux normes de manutention, transport et entreposage, le confinement de ces déchets sous une forme solide s’est imposé.
Dès les années 1950, des programmes de recherche ont été engagés sur le confinement des déchets liquides de haute activité à vie longue. De nombreuses matrices de confinement ont été envisagées : des ciments (Glasser, 1985) ; des céramiques (McCarthy, 1977 ; Morgan et al., 1981 ; Jantzen et al., 1982) ; une roche synthétique, le Synroc, mélange de phases minérales naturelles inventé par Ringwood et al. (1979) ; des verres de type borosilicate, aluminosilicate ou phosphate (Jantzen, 1986 ; Sales et Boatner, 1986 ; Plodinec, 1986) et des vitrocéramiques silicatées avec des compositions basées sur la sphène, le celsian, la fresnoite ou encore la perovskite (Hayward, 1988).
De par son caractère amorphe, le verre présente un certain nombre d’avantages qui en font un matériau de référence pour le conditionnement des déchets radioactifs. Parmi les propriétés que lui confère sa structure désordonnée, on note sa capacité à incorporer l’ensemble des éléments chimiques présents dans les déchets, sa bonne résistance à l’altération par l’eau et sa bonne tenue face à l’auto-irradiation. Ainsi, après de nombreuses études, la décision de vitrifier les solutions de déchets hautement radioactives a été prise en France en 1957 (Vernaz et Bruezière, 2014).
La formulation d’une matrice vitreuse résulte d’un compromis entre les propriétés du verre et sa faisabilité technologique. La France a ainsi retenu les verres aluminoborosilicatés comme matrice de confinement. Le verre « R7T7 », nom issu des deux ateliers de vitrification de l’usine de La Hague R7 et T7, renferme une trentaine d’éléments et peut contenir jusqu’à 18,5 %mass de Produits de Fission et Actinides mineurs (PFA) (Poinssot et Gin, 2012).
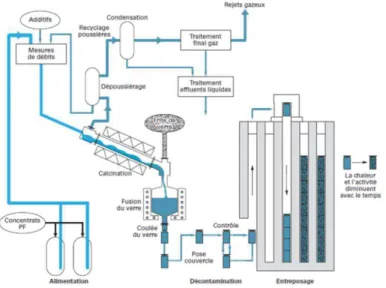
Le procédé continu de vitrification actuellement mis en œuvre industriellement sur le site nucléaire de La Hague comporte deux étapes séparées : l’évaporation-calcination des solutions de déchets puis la vitrification (figure 1.1). Au cours de la première étape, la solution de PFA est introduite dans le calcinateur, tube métallique rotatif chauffé, qui permet d’évaporer l’eau, de décomposer une partie des nitrates et de les transformer en oxydes. Le composé ainsi obtenu, appelé déchet calciné ou calcinat, tombe ensuite en continu par gravité dans un four de fusion en inconel chauffé par induction à des températures entre 1 000 °C et 1 150 °C. Par ailleurs, ce four est alimenté par une fritte de verre qui apporte les éléments chimiques indispensables à la
formation d’un verre (formateurs de réseau SiO2 notamment). Une fois en contact, les oxydes de
la fritte de verre et du calcinat réagissent entre eux pour former le verre. Le but de l’élaboration à haute température est d’obtenir un liquide homogène qui est ensuite coulé dans un conteneur en acier inoxydable. Après fermeture par soudage et décontamination, ces conteneurs sont entreposés en puits ventilés.
1.1. Origine et gestion des déchets radioactifs
Figure 1.1 : Principe du procédé français de vitrification en usage à La Hague (Advocat et al., 2008).
Cet entreposage est une étape provisoire avant celle du stockage. Dans le cadre de la loi Bataille de 1991 (JORF, 1991) puis de la loi de 2006 (JORF, 2006) portant sur la gestion des déchets radioactifs, un projet de stockage géologique profond multi-barrières appliqué à la couche d’argilite du Callovo-Oxfordien est étudié. Les barrières de confinement sont successivement le verre, un conteneur en inox et l’argile (ANDRA, 2006). Ces multiples barrières ont pour but de s’opposer au relâchement et à la migration des radionucléides en retardant l’arrivée de l’eau au contact du colis. Une fois en contact avec l’eau souterraine, le verre sera soumis à une altération aqueuse.
Ces colis de verre présentent une forte résistance à l’altération. Cependant, des hétérogénéités appelées « cristaux réactionnels intermédiaires » pourraient se former à la suite d’un défaut de réactivité entre la fritte de verre et le calcinat dans des conditions dégradées de fonctionnement ou lors d'une augmentation du taux de déchet (Advocat et al., 2008).
La présence de ces phases cristallines peut induire des modifications des propriétés macroscopiques du verre telles que :
§ une modification de la durabilité chimique du colis de verre (Mitamura et al., 1986 ; Bickford et Jantzen, 1986 ; Spilman et al., 1986), induite par des variations de composition du verre englobant1 et notamment par un appauvrissement de la matrice
vitreuse en éléments constitutifs de la phase cristalline,
§ la possible formation de phases très solubles incluant des radionucléides, dont le relâchement serait rapide au contact de l’eau,
§ des fissurations, qui peuvent être entrainées par les différences de coefficients de dilatation entre le verre et la phase cristalline (Rose et al., 2011) ou par le gonflement sous l’effet de l’auto-irradiation α des éléments radioactifs incorporés dans les cristaux (Weber, 1993 ; Devanathan et al., 1998 ; Zinkle et al., 2002) et qui conduisent à une augmentation de la surface réactive du verre.
Chapitre 1 : Etat de l’art
8
Ces modifications justifient l’intérêt de l’étude de l’impact de la présence de cristaux sur la durabilité chimique du colis de verre.
En résumé, de par sa souplesse structurale, le verre permet d’incorporer un large spectre d’éléments chimiques. Sa haute résistance à l’altération et à l’auto-irradiation, fait du verre une matrice de conditionnement de choix pour les déchets de haute activité issus du traitement des combustibles usés. Un concept de stockage géologique profond multi-barrières est actuellement à l’étude pour stocker ces verres, qui dans ces conditions, ne pourront relâcher les radionucléides que par altération de la matrice vitreuse par l’eau souterraine. La formation de phases cristallines susceptibles de se produire au cours de l’élaboration ou du refroidissement du colis peut conduire à des modifications du comportement à long terme du verre, et notamment à l’altération, qu’il convient de décrire.
1.2. Les verres : structures et hétérogénéités
1.2.1. Description générale de la structure des verres
Le verre est défini comme un solide amorphe qui présente le phénomène de transition vitreuse2
(Zarzycki, 1982). Obtenu après refroidissement rapide (trempe), le verre conserve le désordre structural du liquide dont il est issu : sa structure est donc caractérisée par l’absence d’ordre à moyenne et grande distance. Il apparait cependant qu’à courte distance (de l’ordre de 5 Å), les éléments constituants le verre sont organisés sous la forme de polyèdres bien définis.
Parmi la grande diversité de verres qui existent (métalliques, oxydes, halogénures, chalcogénures, organiques), les verres de type borosilicate de sodium ont été choisis pour conditionner les déchets nucléaires de haute activité. Ces verres sont majoritairement constitués d’oxydes dits « formateurs de réseau» (ex : SiO2, B2O3). Ces oxydes ont la particularité de pouvoir former à eux seuls un verre s’ils respectent les 4 règles énoncées par Zachariasen (1932 ; 1935) qui portent sur la coordinence du cation et sur la répartition et l’organisation spatiale des atomes d’oxygène, à savoir : (i) aucun oxygène ne doit être lié à plus de deux cations, (ii) le nombre d’atomes d’oxygène entourant le cation doit être petit (3 ou 4), (iii) les polyèdres constitutifs ne doivent avoir que des sommets en commun et (iv) au minimum trois sommets de chaque tétraèdre doivent être mis en commun. Après une présentation des verres de silice et de bore, les systèmes borosilicatés seront décrits.
2 Température de transition vitreuse : température en dessous de laquelle la viscosité est trop faible pour permettre un réarrangement structural.
1.2. Les verres : structures et hétérogénéités
1.2.1.1. Les verres silicatés
Le verre de silice est l’un des verres les plus réfractaires et les plus durables. Il est composé de
tétraèdres de SiO4 formant un réseau tridimensionnel désordonné. La forte rigidité de ce réseau,
engendrée par le fort caractère covalent de ses liaisons, lui confère une température d’élaboration très élevée (2 000 °C3).
Pour faciliter son élaboration et modifier ses propriétés physiques, d’autres oxydes dits
« modificateurs de réseau » (ex : Na2O) sont ajoutés. Aussi appelés fondants, ceux-ci permettent
de modifier les propriétés du verre (température de transition vitreuse, viscosité, conductivité électrique…) et conduisent à une grande diversité de compositions possibles.
Ces modifications sont engendrées par la rupture des liaisons pontantes Si–O–Si créant des oxygènes non pontants (NBO, pour non-bridging oxygen) à raison d’un NBO par ion alcalin ajouté et deux par ion alcalino-terreux.
L’introduction de ces liaisons ioniques non pontantes crée des discontinuités du réseau vitreux : le réseau est dépolymérisé. Afin de dissocier les différents tétraèdres de SiO4 en fonction du
nombre d’oxygènes pontants (BO) qu’ils possèdent, la terminologie des Qn est utilisée (tableau
1.2), avec n le nombre d’atomes d’oxygène pontants sur un tétraèdre de SiO4.
Qn Q4 Q3 Q2 Q1 BO 4 3 2 1 Si Si Si Si –O– ––O Si– O– – O– – – – – Si Si Si Si –O– ––O Si– O– – O– -– – – – Si Si Si Si –O– ––O Si– O– -– O– -– – – – Si Si Si Si –-O– ––O Si– O– -– O– -– – – –
Tableau 1.2 : Présentation des différentes espèces Qn pouvant exister au sein des verres.
Différents modèles structuraux ont été avancés pour décrire la répartition des ions modificateurs au sein du réseau silicaté.
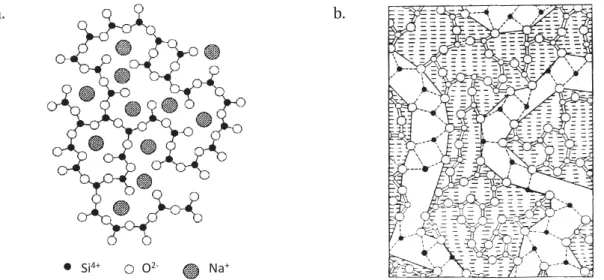
De façon empirique, Zachariasen (1932) a avancé le modèle du « réseau aléatoire continu » représenté en figure 1.2–a dans lequel les cations modificateurs sont répartis de manière aléatoire au sein du réseau vitreux. Appuyé par Warren (1941) à partir de données obtenues par
diffraction des rayons X, ce modèle propose une distribution aléatoire des différentes espèces Qn.
Avec l’apparition de nouvelles techniques de caractérisation – l’EXAFS (Extended X-Ray Absorption Fine Structure) (Greaves et al., 1981 ; 1985) et la dynamique moléculaire (Huang et Cormack, 2015) – l’environnement des ions sodium a pu être mieux détaillé et il a ainsi été suggéré qu’ils ne soient pas répartis aléatoirement dans le réseau. Greaves (1985) a donc proposé le modèle du « réseau aléatoire modifié » représenté en figure 1.2–b dans lequel un
3 La silice a une température de fusion autour de 1 720 °C (Handbook, 2010), mais à cette température le verre fondu obtenu est encore très visqueux et il est nécessaire de monter la température autour de 2 000 °C pour le couler.
Chapitre 1 : Etat de l’art
10
réseau constitué de formateurs et une région « inter-réseau » constituée de modificateurs et d’atomes d’oxygène non pontants sont interconnectés.
Si4+ O2- Na+
Figure 1.2 : Représentation de la structure des verres SiO2–Na2O selon les modèles (a) aléatoire continu proposé par
Zachariasen et Warren (1932 ; 1941) et (b) aléatoire modifié proposé par Greaves (1985) (les atomes noirs représentent les ions sodium).
Ces modèles sont encore discutés aujourd’hui et de nombreuses études ont été menées pour affiner la connaissance de la structure locale autour des formateurs et modificateurs. Citons par exemple des études sur :
§ la distribution des Qn. Si certains auteurs suggèrent que seulement deux espèces avec un
n différent coexistent au sein d’un verre (Dupree et al., 1984), d’autres montrent une
distribution avec plus de deux espèces Qn qui coexistent (Maekawa et al., 1991),
§ la connectivité entre les espèces Qn. Des études par RMN MAS double quanta (Olivier et
al., 2001) démontrent la faisabilité d’obtenir des informations sur la connexion entre les espèces Qn,
§ la distribution des alcalins au sein du réseau vitreux. En montrant que les atomes d’oxygène pontants et non pontants interagissent fortement avec le sodium, Lee et Stebbins (2009) et Angeli et al. (2011) suggèrent une répartition plus homogène du sodium dans le réseau silicaté que celle proposée dans le modèle du « réseau aléatoire modifié ».
Par ailleurs, chaque cation modificateur présente une force de champ4 différente qui influence
fortement la distribution des espèces Qn. Ainsi, il a été montré que pour les alcalins (Maekawa et
al., 1991) comme pour les alcalino-terreux (Maehara et al., 2007), plus la force de champ du cation est élevée, plus elle conduit à un déplacement de l’équilibre 2Qn 1 Qn-1 + Qn+1 (avec n = 3, 2
ou 1) vers la dismutation de l’espèce Qn (exemple pour les alcalins sur la figure 1.3).
4 La force de champ traduit la capacité d’un cation à déformer le nuage électronique de ses premiers voisins. Elle s’exprime par F = Z/a2, avec Z la charge du cation et a la distance moyenne cation–oxygène.
1.2. Les verres : structures et hétérogénéités 100 80 60 40 20 0 20 30 40 50
Alkali oxide [mol%]
Q n[% ] Q2 Q3 Q1 Q4
Figure 1.3 : Distribution des entités Qn dans les verres de silicates de ¡ potassium, ¨ sodium, r lithium (Maekawa et al.,
1991) (avec FK < FNa < FLi).
Enfin, dans le cas de verres silicatés contenant un mélange de cations modificateurs, il a été observé la création de sites de mélange (Lee et Stebbins, 2003b). Dans ce cas, l’oxygène non pontant est entouré de paires de cations, préférentiellement dissemblables (Na-Ca par exemple).
1.2.1.2. Verres boratés
De par son fort caractère hygroscopique, le verre de borate a une faible durabilité chimique. Il
est composé de triangles de BO3 formant des anneaux plans boroxols [B3O6]3- comme décrit sur
la figure 1.4. Dans cette structure bidimensionnelle, tous les atomes d’oxygène sont pontants.
Figure 1.4 : Structure d’anneaux boroxols
L’effet structural de l’addition d’ions modificateurs est décrit par le modèle de Krogh-Moe (1969). L’addition de quelques pourcents d’oxydes modificateurs de réseau conduit à la transformation progressive du bore trigonal en bore tétragonal (figure 1.5–a), ce qui a pour conséquence l’augmentation de la rigidité du réseau vitreux avec le passage d’un réseau bidimensionnel à tridimensionnel. Ce phénomène, appelé anomalie du bore, se traduit par une augmentation de la viscosité. Au-delà de 25 %mol d’alcalins, la formation d’atomes d’oxygène non pontants est observée avec l’apparition de nouvelles unités structurales constituées de
triangles BO3 contenant un ou plusieurs atomes d’oxygène non pontants (figure 1.5–b).
+M2O +M2O
Figure 1.5 : (a) Formation des atomes de bore tétraédriques et (b) formation des atomes d’oxygène non pontants dans le réseau boraté (M = alcalin).
Yun et Bray (1978) définissent le paramètre N4 qui correspond à la proportion d’atomes de bore
en coordinence 4 tel que N4 = [BIV]/B(total) et montrent qu’il évolue en fonction de la nature de
l’ion alcalin ajouté : plus la force de champ de l’alcalin est importante, plus N4 est grand. Cette
quantité atteint un maximum autour de 30 à 40 %mol d’alcalin.
Chapitre 1 : Etat de l’art
12
1.2.1.3. Verres borosilicatés
Pour des problèmes d’immiscibilité, l’ajout d’un fondant est obligatoire pour synthétiser un verre borosilicaté.
Intéressons-nous au système ternaire SiO2–B2O3–Na2O. Comme présenté sur la figure 1.6, pour
une température inférieure à 750 °C, les verres contenant des teneurs inférieures à 20 %mol en oxyde de sodium présentent un domaine d’immiscibilité qui se caractérise par une démixtion entre deux domaines vitreux distincts : l’un riche en silicium et l’autre riche en sodium et en bore. Au-dessus de 750 °C et lorsque la concentration en Na2O est supérieure à 20 %mol, les
verres sont homogènes.
Figure 1.6 : Zone d’immiscibilité (hachurée) dans le système ternaire SiO2–B2O3–Na2O (Haller et al., 1970).
A l’aide de mesures par RMN du 11B, un modèle structural pour décrire les verres de ce système
ternaire a été développé, le modèle de Dell et al. (Yun et Bray, 1978 ; Xiao, 1981 ; Dell et al., 1983). Ce modèle considère les rapports molaires d’oxydes entre Na2O, SiO2 et B2O3 tels que
R = [Na2O]/[B2O3] et K = [SiO2]/[B2O3]. Il est valable pour les verres riches en silice tels que K ≤ 8.
Plusieurs cas sont distingués :
§ R < 0,5 : la composition contient peu d’ions sodium qui sont tous supposés convertir les atomes de bore trigonaux en bore tétragonaux compensés par les ions alcalins. Le verre est hétérogène et constituée d’une phase alcalino-boratée englobée dans une phase de silice pure,
§ R = 0,5 : le réseau borate alcalin est essentiellement constitué de groupements diborates formés de deux trièdres BO3 pour deux tétraèdres BO4- (figure 1.7–a),
§ 0,5 < R < Rmax = 0,5+K/16 : dans ces conditions, les atomes de sodium en excès détruisent
progressivement les unités diborates en transformant les triangles BO3 en tétraèdres
BO4. Ces unités peuvent alors s’intégrer au réseau silicaté et former les groupes
reedmergnerites [BSi4O10]- compensés par les ions sodium en excès (figure 1.7–b). Ce
processus s’achève lorsque tous les tétraèdres SiO4 ont pris part aux unités
reedmergnerites. Ainsi, pour Rmax, le verre est constitué d’unités reedmergnerites et
d’unités diborates et dans le cas particulier où K = 8 et R = 1, le verre n’est composé que
d’unités reedmergnerites. Les seules espèces Qn observées dans ce domaine de
composition sont les Q4 reliées à 4Si ou 3Si–1B,
§ Rmax < R < RD1 = 0,5+K/4 : dans ce domaine, la proportion de bore en coordinence 4 (N4)
est constante. Les ions modificateurs supplémentaires créent des NBO dans les tétraèdres de SiO4. A la limite RD1, le verre est constitué de groupements diborates et
1.2. Les verres : structures et hétérogénéités
§ RD1 < R < 2+ K : la fraction de Na2O supplémentaire détruit les groupes reedmergnerites
pour former des entités Q2 et des unités pyroborates constituées d’unités BO3 avec 2
NBO par BO3. Ainsi, le pourcentage de BO4 diminue fortement jusqu’à atteindre zéro
pour R = 2 + K. Dans ce domaine de composition, le verre est constitué d’unités BO3
contenant des NBO et d’espèces Q2. Il est donc fortement dépolymérisé.
L’utilisation de techniques supplémentaires (spectroscopie Raman et RMN du29Si, 11B, 23Na et
17O) a permis d’apporter des améliorations à ce modèle, notamment au niveau des bornes des
domaines :
§ la spectroscopie Raman a mis en évidence la présence d’unités de type danburite (Bunker et al., 1990) (figure 1.7–c). Omises par le modèle de Dell et Bray, ces unités se caractérisent par une mixité des réseaux silicaté et alcalino-boraté pour un ratio R de l’ordre de 0,33 (et non 0,5 comme annoncé par Dell et Bray). Ce résultat est confirmé par les mesures RMN du 17O et 11B (Du et Stebbins, 2003b) qui montrent la présence
d’espèces BO4 avec 1 voisin B et 3 voisins Si (notés (1B, 3Si)) caractéristiques de la
danburite.
§ Pour les compositions telles que 0,5 < R < Rmax, contrairement à ce qui est prévu par le
modèle de Bray, des atomes d’oxygène non pontants au sein des tétraèdres de SiO4
peuvent être présents (Q3) (Bunker et al., 1990).
§ Dans le domaine Rmax < R < RD1, les résultats de RMN de 29Si montrent que la proportion
d’espèces SiO4 Q3 contenant des atomes de bore serait négligeable. Ainsi, contrairement à
ce qui est proposé par le modèle de Dell et Bray, les atomes d’oxygène non pontants se formeraient plutôt sur les tétraèdres de silicium non liés à des atomes de bore (Bunker et al., 1990). B -O– ––O O – +Na B O– B -O– ––O O O– O B– +Na B -O– ––O O – +Na Si–O Si O– ––O O O– O–Si Si – – O – O –O – – – O O– – O O– B -O– ––O O – +Na Si–O Si O– ––O O O– O–B -Si – – O – O –O – – – O O– – O O– Na+
Figure 1.7 : Unités (a) diborate, (b) reedmergnerite et (c) danburite
Des oxydes dits « formateurs de réseau » (ex : SiO2, B2O3) peuvent former à eux seuls un verre dont les propriétés physico-chimiques et la structure peuvent être modifiées par l’ajout d’ions dits « modificateurs » (ex : Na2O, CaO). Différents modèles ont été proposés pour décrire la structure de ces verres et notamment la répartition des ions modificateurs au sein des réseaux silicatés ou borosilicatés. Avec l’apport de techniques expérimentales et de modélisations toujours plus performantes, le type d’organisation à courte distance ainsi que les différents modèles proposés sont encore aujourd’hui très discutés.
Chapitre 1 : Etat de l’art
14
1.2.2. Mécanismes de formation des hétérogénéités dans les verres
Les verres peuvent également présenter des hétérogénéités induites par les mécanismes de séparation de phase et de cristallisation par nucléation-croissance. Les considérations thermodynamiques liées à ces deux processus seront abordées dans cette partie.
1.2.2.1. Les processus de séparation de phase dans les verres
Pour décrire le processus de séparation de phase (ou démixtion) qui trouve son origine dans la démixtion des liquides, l’approche thermodynamique – avec notamment les lacunes d’immiscibilité et les domaines de stabilité des phases séparées en fonction de la température – est particulièrement bien adaptée.
Le comportement d’un mélange binaire (deux composants A et B) à température et pression constantes peut être évalué par l’étude de la variation de l’enthalpie libre du mélange ΔGm
(équation (1.1)) avec ΔHm la variation d’enthalpie du mélange et ΔSm la variation d’entropie du
mélange à une température T donnée.
ΔGm = ΔHm - TΔSm (1.1)
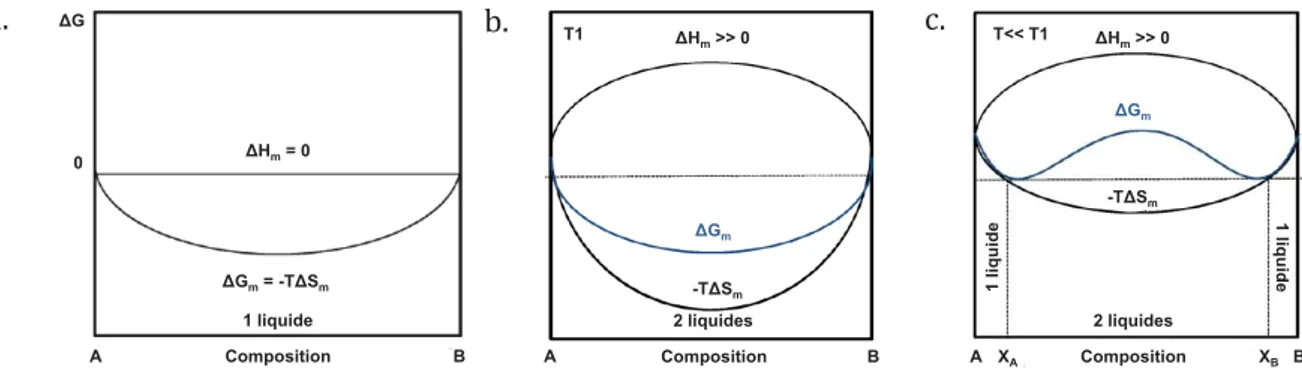
Dans le cas d’une solution dite idéale (miscibilité parfaite des deux liquides), les variations
d’enthalpie du mélange des deux composés à une température donnée sont nulles (ΔHm = 0) et la
courbe d’enthalpie libre en fonction de la composition ne présente qu’un seul minimum (figure 1.8–a).
La tendance à la démixtion correspond à une déviation à l’idéalité traduite par une enthalpie de mélange positive. Cette élévation de ΔHm s’oppose à la miscibilité des constituants A et B,
conduisant à l’obtention d’une solution instable et donc à un mélange dans lequel les rapprochements entre atomes de même espèce sont favorisés (AA et BB). En raison de la
dépendance au terme entropique, la forme de la courbe ΔHm = f(composition) varie avec la
température (figures 1.8–b et –c). Ainsi, dans le cas d’une température très élevée, le terme TΔSm
est prépondérant et l’enthalpie libre ne présente qu’un seul minimum : deux liquides non miscibles seront obtenus sur l’ensemble du domaine de composition (A, B) (figure 1.8–b). En revanche, pour des températures plus faibles, le terme ΔHm devient prépondérant, ce qui se
traduit par une courbe présentant deux minima (figure 1.8–c) dont les positions délimitent un domaine de composition dans lequel coexistent deux liquides à la température donnée. Autour de ce domaine, une miscibilité parfaite est obtenue entre les constituants A et B.
1.2. Les verres : structures et hétérogénéités (a) (b) (c) ΔHm= 0 ΔGm= -TΔSm ΔG Composition 0 B A 1 liquide T1 ΔH m>> 0 -TΔSm ΔGm Composition B 2 liquides A T<< T1 ΔGm -TΔSm Composition B XA XB 1 li qu id e 1 li qu id e A ΔHm>> 0 2 liquides
Figure 1.8 : Evolution de l’enthalpie libre de mélange, (a) d’une solution idéale, (b) et (c) d’une solution instable en fonction de la variation de l’entropie du système. En (b), l’entropie maximale avec T1 une température très élevée et en
(c), une entropie plus faible avec une température T < T1 (Schuller, 2013).
En fonction de la composition initiale du verre et de la zone du dôme d’immiscibilité dans laquelle il se trouve, des comportements à la séparation de phase distincts peuvent se produire. En effet, l’étude de la variation de l’enthalpie libre au cours du processus de séparation de phase permet de discerner deux régions dans lesquelles les mécanismes de séparation de phase sont différents (figure 1.9).
Figure 1.9 : Evolution de la fonction ΔG(T) lors d’une faible fluctuation de composition pour des compositions E1 et E2 respectivement présentes dans des zones de démixtion par nucléation croissance I (stable) et décomposition spinodale II
(instable) (Schuller, 2013).
Considérons les compositions E1 et E2 respectivement comprises dans la partie concave de la courbe d’enthalpie libre entre les points A et C et dans la partie convexe de la courbe entre les points C et D, avec C et D les points dits spinodaux pour lesquels la dérivée seconde de l’enthalpie libre en fonction de la composition ∂2G/∂X2 est nulle.
Considérons maintenant une fluctuation de composition autour des points E1 et E2. Sous l’effet de cette faible variation, l’enthalpie libre G(E1) au point E1 augmente pour atteindre
G’(E1) > G(E1) alors qu’au point E2, G(E2) diminue pour atteindre G’(E2) < G(E2). Or, selon les
conditions de stabilité des phases établies par Gibbs (1948), une variation positive de ∂2G/∂X2
est associée à une région stable en opposition à une variation négative qui est associée à une région métastable.
b.
Chapitre 1 : Etat de l’art
16
Par conséquent, au point E1 le système est stable vis-à-vis de la fluctuation de composition et il faut fournir une énergie pour obtenir la séparation de phase (création des premiers germes de A et de B) ce qui impose un mode de démixtion par nucléation croissance (domaine I). A l’inverse, au point E2, le système est instable vis-à-vis de la fluctuation de composition et évolue donc spontanément vers son état d’équilibre selon un mécanisme de décomposition spinodale (domaine II).
En fonction de la nature du processus de démixtion dont résultent les phases séparées, des morphologies très différentes sont obtenues.
Dans le cas d’une démixtion par nucléation-croissance, des particules sphériques dispersées dans une matrice résiduelle sont observées (figure 1.10–a). Les phases sont déconnectées les unes des autres, séparées de la matrice résiduelle par une interface nette et leur composition ne varie pas au cours du temps.
A l’issue d’une démixtion par décomposition spinodale, des phases interconnectées sont observées (figure 1.10–b). L’interface entre les phases initialement diffuse évolue au cours du temps jusqu’à devenir nette une fois l’équilibre atteint.
Figure 1.10 : Clichés MEB de phases séparées formées (a) par nucléation-croissance dans un verre borosilicaté enrichi en MoO3, P2O5, ZrO2 et CaO (Schuller et al., 2008), (b) par décomposition spinodale dans un verre poreux Shirasu (sur le
cliché, on distingue en gris la phase la plus durable et en noir le vide laissé par la dissolution de la phase la moins durable) (Kukizaki, 2010).
Notons qu’en fonction de la composition de la phase séparée, il arrive qu’elle cristallise au refroidissement du matériau (Jantzen et al., 2001 ; Magnin, 2009).
1.2.2.2. Cristallisation par nucléation-croissance
La cristallisation dans les verres implique deux étapes dépendantes de la température : la nucléation, qui entraine la formation de germes (nuclei), puis la croissance de ces germes. Ces mécanismes peuvent se comprendre par la théorie classique de nucléation (Cormier et Neuville, 2013).
La nucléation
Deux types de nucléation peuvent être distingués : la nucléation homogène qui intervient dans l’ensemble du système considéré et la nucléation hétérogène qui intervient sur des sites préférentiels (impuretés, bulles ou hétérogénéités chimiques).
1.2. Les verres : structures et hétérogénéités
De façon succincte, le processus de nucléation homogène peut se résumer de la façon suivante : pour des températures où la mobilité atomique est suffisante, les atomes diffusent et se rencontrent de manière aléatoire ce qui conduit à la formation d’agrégats. Par additions successives des atomes, les agrégats sont qualifiés de germes cristallins (ou nuclei) lorsqu’ils parviennent à un rayon dit critique (rcrit). Ce rayon est atteint quand l’enthalpie libre de
formation du nucleus, somme des énergies libre de la transition liquide-cristal et de la création d’une interface solide-liquide, est maximale (figure 1.11).
Figure 1.11 : Enthalpie libre de formation d’un nucleus ΔG en fonction de son rayon.
Dans le cas où le nucleus se forme sur un substrat, la nucléation est facilitée par la réduction de l’énergie d’interface entre le liquide et le solide, elle est dite hétérogène. Ainsi, la présence d’hétérogénéités favorise la nucléation dans les matrices vitreuses.
Croissance cristalline
Les germes stables formés par le processus de nucléation accroissent leur taille pendant l’étape de croissance cristalline. Celle-ci peut être contrôlée par différents mécanismes qui conduisent à des morphologies variables de cristaux (Kirkpatrick, 1975 ; Uhlmann, 1982a ; Faure et al., 2007). Trois modes de croissance sont distingués en fonction du degré de surfusion :
§ les réactions à l’interface liquide-solide qui génèrent des cristaux automorphes (surface plane) dont la taille est proportionnelle au temps de traitement thermique. Le temps caractéristique de rupture des liaisons du liquide est le paramètre qui contrôle cette croissance puisqu’il contrôle la vitesse d’adjonction des atomes à la surface du cristal en formation (Turnbull et Cohen, 1960),
§ la diffusion qui conduit à des cristaux de morphologie squelettiques avec des arêtes et des sommets mais des faces incomplètes. Le processus de diffusion à longue distance se met en place si l’environnement proche du cristal s’appauvri en éléments formateurs. Ce mode de croissance est limité par la diffusion des atomes dans le liquide et l’apparition de gradients de composition aux interfaces liquide-cristal (Donaldson, 1975). La vitesse de croissance est donc proportionnelle à √(D/t) avec D le coefficient de diffusion de l’espèce la plus lente et t le temps (Kirkpatrick, 1975).
§ la dissipation de la chaleur latente de cristallisation qui entraine la formation de cristaux de type sphérolites et dendritiques qui sont caractérisés par une vitesse de croissance beaucoup plus rapide pour les arêtes que pour les faces, ce qui conduit à des cristaux en forme d’aiguilles.
Chapitre 1 : Etat de l’art
18
Taux de nucléation et de croissance cristalline
L’évolution typique des taux de nucléation et de croissance en fonction de la température est
illustrée sur la figure 1.12. Des germes sont créés dans la gamme de température T1 à T3 mais ils
ne peuvent pas croître. Entre les températures T2 et Tf, la croissance est possible, mais aucun
germe ne peut être créé, donc la cristallisation est inexistante. Enfin, entre T3 et T2, des germes
cristallins peuvent se former et croître. En fonction des systèmes, les courbes de nucléation et croissance sont plus ou moins superposées.
Taux de nu cl éa ti on N Taux de c roi ss ance cr is tal line C Nmax Cmax C(t) N(t) T1 T3 T2 Tf T Tg
Figure 1.12 : Evolution typique des taux de nucléation (N) et de croissance (C) en fonction de la température. Tf
correspond à la température de fusion des cristaux.
Les hétérogénéités dans les verres peuvent être issues de deux mécanismes : la séparation de phase et la cristallisation par nucléation-croissance. Les matériaux obtenus, verres démixés et/ou cristallisés, présentent des morphologies variables dépendantes des compositions des verres et des processus de formation.
1.2.3. Les éléments à l’origine de la cristallisation dans les verres
nucléaires
Plusieurs études portent sur la cristallisation des différents verres nucléaires (Larkin, 1986 ; Loiseau et al., 2003 ; Henry et al., 2004 ; Rose et al., 2011). Les principales études référencées concernant la cristallisation de verre de type R7T7 ont été menées par Orlhac (1999) et Delattre (2013).
L’étude d’Orlhac (1999) a permis de déterminer le taux maximum de cristaux susceptibles de se former au sein du verre R7T7 après un traitement thermique (5h à 550 °C suivies de 100h à 780 °C), soit 4,24 %mass, ainsi que la nature des phases cristallines susceptibles de se former :
powellite (CaMoO4), cerianite et oxyde mixte cérium-zirconium (CeO2 et (Ce, Zr)O2) et
zincochromite (ZnCr2O4) ainsi que deux phases minoritaires : l’albite (NaAlSi3O8) et les silicates
1.2. Les verres : structures et hétérogénéités
Dans le cadre d’étude sur la cristallisation au sein de l’auto-creuset5, Delattre (2013) a évalué
l’impact de l’application de gradients thermiques sur la cristallisation de deux verres d’intérêt nucléaire et a ainsi mis en évidence la cristallisation de powellite (630 °C – 900 °C) et de silicates de terres rares de structure apatitique Ca2TR8(SiO4)6O2 (660 °C – 900 °C). La cristallisation de
silicates de terres rares a également été mise en évidence au cours des recherches menées sur l’optimisation de nouvelles compositions permettant d’incorporer un taux de déchet supérieur à 18,5 %mass (verres à Haut Taux de Charge, HTC) (Bardez, 2004 ; Quintas, 2007 ; Chouard, 2011 ; Taurines, 2012).
Cette thèse portant principalement sur l’influence de la cristallisation de molybdates et de silicates de terres rares sur la durabilité chimique, dans cette partie des explications seront données concernant l’influence des oxydes de molybdène et terres rares sur la structure du réseau vitreux et leur tendance à promouvoir les processus de séparation de phase et de cristallisation dans les verres de conditionnement.
1.2.3.1. Comportement de l’oxyde de molybdène dans les verres borosilicates de sodium
Le molybdène est un élément qui ne peut s’incorporer de manière homogène qu’à très faible teneur dans des verres borosilicatés (typiquement autour du pourcent molaire) (Horneber et al., 1982 ; Lutze et Ewing, 1988 ; Short et al., 2003 ; Rose et al., 2011 ; O.V.Mazurin et al., 1987 ; Do Quang et al., 2003). Différentes formulations de verre sont développées en fonction du déchet à traiter (Uranium Oxyde ou Uranium Molybdène) et donc de la concentration en oxyde de molybdène qu’il contient. Après avoir décrit les caractéristiques de ces verres, nous donnerons des explications concernant les modifications structurales ainsi que les phénomènes de séparation de phase et cristallisation induits par l’ajout de molybdène dans les verres de compositions simplifiées.
Les verres de conditionnement de déchets nucléaires enrichis en oxyde de molybdène Dans cette partie, nous donnerons les caractéristiques microstructurales des verres de type Uranium Oxyde (UOx) et Uranium Molybdène (UMo) contenant de l’oxyde de molybdène.
Cas des verres de type Uranium Oxyde
Les déchets issus du combustible de type UOx sont confinés dans le verre de type Uranium Oxyde (R7T7) dont le taux de charge en produits de fission et actinides mineurs est de l’ordre de 18,5 %mass (Poinssot et Gin, 2012), soit 2,2 %mass d’oxyde de molybdène issu uniquement des réactions de fission nucléaire. Dans des conditions nominales de fonctionnement, le verre obtenu ne présente aucune séparation de phase.
5 En 2010, le procédé de vitrification par creuset froid a été mis en service à l’usine de La Hague. Le principe consiste à induire directement des courants électriques au sein du bain de verre ce qui permet de vitrifier à des températures supérieures à celles utilisées avec la technologie du pot de fusion ou creuset chaud (présentée en partie 1.1.1.1.2). Au contact de la paroi refroidie par un circuit d’eau, le verre forme une couche solide, appelée auto-creuset.