HAL Id: tel-01659925
https://tel.archives-ouvertes.fr/tel-01659925
Submitted on 9 Dec 2017HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Stimulations du cervelet pour le traitement des
dyskinésies induites par la lévodopa dans la maladie de
Parkinson
Adèle Bousquet Combes
To cite this version:
Adèle Bousquet Combes. Stimulations du cervelet pour le traitement des dyskinésies induites par la lévodopa dans la maladie de Parkinson. Neurosciences [qbio.NC]. Université Pierre et Marie Curie -Paris VI, 2017. Français. �NNT : 2017PA066134�. �tel-01659925�
THÈSE DE DOCTORAT
UNIVERSITÉ PIERRE ET MARIE CURIE – PARIS VI
École Doctorale : Cerveau Cognition Comportement
Spécialité Biologie - Mention Neurosciences
Présentée par Adèle Bousquet Combes
pour obtenir le grade de Docteur
STIMULATIONS DU CERVELET POUR LE TRAITEMENT DES
DYSKINÉSIES INDUITES PAR LA LÉVODOPA DANS LA
MALADIE DE PARKINSON
Soutenue le 7 juin 2017, devant la commission d’examen composée de :
M. Jean MARIANI PU-PH Université Pierre et Marie Curie Président
M. Philippe ISOPE DR Université de Strasbourg Rapporteur
M. Mohamed JABER PU-PH Université de Poitiers Rapporteur
Mme Sabine MEUNIER DR Université Pierre et Marie Curie Examinatrice
Mme Nicole EL MASSIOUI CR-HDR Université Paris Sud Examinatrice
2
3
4
Ce manuscrit est l’œuvre de quatre années de vie qui m’ont grandie tant sur le plan scientifique qu’humain.
Je tiens à remercier Messieurs Philippe Isope et Mohamed Jaber pour avoir accepté d’être rapporteurs de ces travaux ainsi que pour leurs conseils et remarques qui ont contribué à la maturation de ce projet. J’adresse également mes remerciements à Mesdames Sabine Meunier et Nicole Massioui pour leur participation en leur qualité d’examinatrices, ainsi qu’à Monsieur Jean Mariani, président du jury.
Daniela, je te remercie pour la confiance que tu m’as accordée en m’offrant le privilège d’être ta première étudiante en thèse. Tes compétences, ton exigence et ta disponibilité m’ont beaucoup appris et ont contribué à construire la scientifique que je suis aujourd’hui. Tu as également parfaitement su mettre en pratique le principe de renforcement positif grâce à tes ravitaillements réguliers en halva, brownies et autres barres énergétiques inconnues du grand public. Ces quatre années furent quelque peu rock’n’roll et il fut un temps où nous aurions pu être « The Popa’s & the not-so-well-recovering mice », « Rage Against The recording Machine » ou tout simplement « The L-Popa & D-Dopa dyslexic team ».
Une page se tourne et dans l’espoir d’un avenir heureux, nous deviendrons, prochainement je l’espère, « The Popa’s & the published papers ».
Merci à toi aussi, Clément, pour ton soutien m’ayant permis d’intégrer l’équipe, ainsi que pour tes conseils et ta patience. Accordéon is not dead.
Mon cher Fabien, Docteur M., Fabiano del pastaga, MC Yellow Submarine, compatriote du sud et fervent défenseur du houblon, cette thèse n’aurait pas eu les mêmes accents sans toi. Combien de week-ends aux fragrances de souris ? Combien de soirées analyse-party ? Tu as été un collègue en or, dont la compétence et la pédagogie n’ont eu d’égales que la bienveillance et l’énergie, et pour tout cela je te remercie. Nos routes professionnelles se sont séparées et je suis heureuse d’avoir travaillé à tes côtés.
Chères cavalières, votre arrivée dans l’équipe a marqué un chapitre bruyant nouveau dans ma vie au laboratoire. Sponsors officiels de la lutte contre la dénutrition, fournisseuses de soutien moral, public résigné de la blague nulle, toutes trois, Hind, Aurélie et Riham, avez contribué à mon avancée. Merci.
5
Guillaume, tes conseils, ton humanisme et ta pédagogie sont à la hauteur de leur réputation et je suis heureuse d’avoir croisé ton chemin. Matthieu, expert ès débogage d’accéléromètre, ton aide a plus d’une fois été salvatrice. Et si j’en viens à parler des plus anciens, je me dois de te citer, Antonin, car si chaque histoire a un commencement, la mienne au 9ème étage de l’IBENS a commencé par mail avec toi. J’ai également une pensée pour Michel Volovitch, qui ne se souvient certainement pas de la jeune étudiante que j’étais, visitant l’ENS sans préavis plusieurs années avant mon arrivée à la capitale, et qui m’a dit « à bientôt ».
Sébastien, ta passion pour la médecine et ta culture ont été particulièrement enrichissantes et j’espère recroiser ta route dans un futur proche. Zohra et Anaëlle, vous avez été mes premières stagiaires et avez contribué à mon évolution scientifique et pédagogique de par votre soif de comprendre et votre implication. Gwenaëlle, Amé, Séda, votre passage furtif restera également un très bon souvenir.
Mon arrivée en 2013 n’est déjà presque qu’un lointain souvenir et l’équipe s’est peu à peu métamorphosée. Dernière étudiante de l’équipe Cervelet 2.0, la vue sur le Panthéon sera bientôt elle aussi reléguée au rang de l’Histoire. De nouveaux visages, de nouveaux accents tout aussi accueillants emplissent désormais le bureau, Julie (The Ayatollah of the Statistics), Jimena et Andrès (Los Argentinos), Thibault, Jean, Kévin et Bérénice (The new new ones).
J’adresse également mes remerciements à Gérard, Caroline, Sonia, Simon, Laurent et Jeff, mais aussi à Alain, qui m’ont, chacun à leur manière, apporté une aide précieuse. Je tiens également à remercier particulièrement les animaliers, dont Christophe et Guillaume, experts de la portée de plus de 100 souris en un temps record, à qui je n’ai pas facilité la tâche et qui ont été un maillon essentiel de mes travaux.
Outre les collègues et amis du laboratoire, j’ai eu la chance de rencontrer les intellectuels les plus rock’n’roll de la capitale. Olivier, Marc-Antoine et Robin, la musique à vos côtés a été une formidable source de décompression, d’élévation culturelle et de bonheur tout simplement. Deux biologistes et deux philosophes, répétant dans les locaux historiques de l’ENS, tout ça pour parler de Hegel en minivan ou des pratiques douteuses en Alabama, c’est aussi ça le rock et j’espère que cela se poursuivra encore longtemps.
Chaque rencontre nous construit, nous forge et il en est certaines qui défient l’espace et le temps. Sophie, Marion, Barbara, depuis plus de dix ans vous êtes à mes côtés et m’offrez une amitié
6
inconditionnelle. Nounous de l’extrême, soutiens moraux et confidentes de toute heure, vous avez contribué à ma réussite. Merci pour tout.
Je tiens également à remercier ma famille, qui a toujours cru en moi quels que soient les obstacles. Merci à vous papa, maman et Charles pour tout l’amour et le soutien inconditionnels que vous m’avez toujours offerts. Merci également à vous Jacques et Martine d’avoir toujours répondu présents. Parrain et Guilhem, Mémé et Mamé, vous me manquez, j’espère que de là où vous êtes, vous êtes fiers de ce que je suis devenue.
Enfin, à toi Charles, dont le soutien et l’amour indéfectibles malgré mon absence chronique ont sublimé ces quatre années de dur labeur. Tu es le véritable héros de cette thèse, l’époux parfait qui, pour le meilleur et pour le pire, est resté à mes côtés. Merci d’avoir toujours été là, même lorsque moi je ne l’étais pas.
Alexandre ton arrivée a transformé ma vie. Tu m’as donné l’énergie et le courage d’avancer, tu as fait de moi une scientifique et une personne meilleure. Tu ne te souviendras certainement pas de cette période mais saches, mon fils, que tu restes ma plus belle réussite.
7
8
Table des illustrations
... 12Préambule
... 15Introduction
... 18Première partie : Rappels anatomiques
... 191. Le cervelet ... 20
1.1. Anatomie du cervelet ... 20
1.1.1. Organisation régionale ... 20
1.1.2. Les noyaux cérébelleux profonds ... 22
1.1.3. Le cortex cérébelleux ... 23
1.1.3.1. La couche granulaire ... 23
1.1.3.2. La couche moléculaire ... 24
1.1.3.3. La couche des cellules de Purkinje ... 24
1.1.4. La région Crus II ... 25
1.1.4.1. Crus II chez le rongeur ... 25
1.1.4.1.1. Intégration sensorimotrice de la zone périorale ... 25
1.1.4.1.2. Voie ascendante entre crus II et le cortex moteur oral ... 27
1.1.4.2. Crus II chez les hominidés ... 27
1.2. Communication bidirectionnelle entre le cervelet et les ganglions de la base ... 28
2. Les ganglions de la base ... 30
2.1. Voies directe, indirecte et hyperdirecte dans les ganglions de la base ... 30
2.2. Le striatum ... 31
2.3. Le segment interne du globus pallidus et la substance noire pars reticulata ... 32
2.4. Le segment externe du globus pallidus ... 32
2.5. Le noyau sous-thalamique ... 32
2.6. La substance noire pars compacta ... 33
3. Le thalamus ... 34
3.1. Les noyaux thalamiques intralaminaires ... 34
3.2. Le thalamus ventral antérieur et ventral latéral ... 35
4. Le cortex moteur primaire ... 36
5. Mouvement volontaire, involontaire et coordination motrice ... 39
Deuxième partie : La maladie de Parkinson
... 419
2. Sémiologie de la maladie de Parkinson ... 44
2.1. Symptômes moteurs de la maladie de Parkinson ... 44
2.1.1. La rigidité ... 44
2.1.2. L’akinésie / bradykinésie ... 44
2.1.3. Les tremblements de repos ... 45
2.2. Symptômes non-moteurs de la maladie de Parkinson ... 45
Troisième partie : Les dyskinésies induites par la lévodopa dans la maladie de
Parkinson
... 471. Lévodopa et effets secondaires ... 48
1.1. Histoire et caractéristiques de la lévodopa ... 48
1.2. Effets secondaires non-moteurs de la lévodopa ... 49
1.3. Effets secondaires moteurs de la lévodopa ... 49
1.3.1. Les fluctuations motrices ... 50
1.3.2. Les dyskinésies ... 50
2. Pathophysiologie et caractéristiques électrophysiologiques des dyskinésies induites par la lévodopa ... 53
2.1. Ganglions de la base et dyskinésies ... 53
2.1.1. Striatum et dyskinésies... 53
2.1.1.1. Altérations pré-synaptiques du striatum ... 53
2.1.1.2. Altérations post-synaptiques du striatum ... 54
2.1.2. Pallidum, noyau sous-thalamique et dyskinésies ... 55
2.2. Thalamus et dyskinésies... 56
2.2.1. Le thalamus ventral antérieur et ventral latéral ... 56
2.2.2. Le complexe centromédian / parafasciculaire ... 57
2.3. Cortex moteur et dyskinésies ... 58
2.4. Cervelet et dyskinésies ... 59
3. Traitements contre les dyskinésies ... 63
3.1. Réduction des fluctuations plasmatiques de la lévodopa ... 63
3.1.1. Formulations orales à libération lente ... 63
3.1.2. Administration continue ... 63
3.2. Réduction des taux de lévodopa et traitements alternatifs ... 64
3.2.1. Les agonistes dopaminergiques ... 64
3.2.2. Les inhibiteurs de la monoamine oxydase-B (I MAO-B) ... 65
3.2.3. Les inhibiteurs de la catécholamine-O-méthyltransférase (ICOMT) ... 65
3.3. Traitements anti-dyskinétiques actuels ... 66
10
3.3.2. La stimulation cérébrale profonde ... 66
3.4. Traitements anti-parkinsoniens et anti-dyskinétiques en cours d’évaluation ... 69
3.4.1. Traitements pharmacologiques potentiels ... 69
3.4.2. Traitements non pharmacologiques invasifs potentiels ... 70
3.4.2.1. La stimulation NIR ... 70
3.4.2.2. La stimulation médullaire ... 70
3.4.2.3. La transplantation cellulaire ... 70
3.4.2.4. La thérapie génique ... 71
3.4.3. Traitements non pharmacologiques non invasifs potentiels ... 72
3.4.3.1. Immunothérapies ciblant l’α-synucléine ... 72
3.4.3.2. La radiochirurgie par Gamma Knife ... 72
3.4.3.3. Les stimulations transcrâniennes ... 73
3.4.3.3.1. La stimulation en courant direct (tDCS) ... 73
3.4.3.3.2. La stimulation magnétique transcrânienne (TMS) ... 73
4. Modèles animaux des dyskinésies induites par la lévodopa ... 76
4.1. Modèles génétiques et α-synucléine ... 76
4.2. Administration de toxines ... 76
4.2.1. Le MPTP ... 77
4.2.2. La 6-OHDA... 77
4.3. Induction des dyskinésies... 78
4.4. Echelles d’évaluations des dyskinésies chez le rongeur ... 79
5. Stimulation optogénétique des cellules de Purkinje ... 81
5.1. L’optogénétique ... 81
5.2. L’optogénétique appliquée aux cellules de Purkinje et la lignée de souris L7-ChR2 ... 82
6. Axes de recherche ... 85
Matériel & Méthodes
... 861. Sujets ... 87
2. Protocole longitudinal général ... 87
3. Protocoles péri-chirurgicaux ... 89
3.1. Anesthésie et lésion ... 89
3.2. Protocole de soin ... 90
4. Enregistrements électrophysiologiques ... 91
4.2. Conception des électrodes d’enregistrement cellulaire ... 91
4.3. Système d’enregistrements électrophysiologiques ... 91
5. Stimulation optogénétique ... 93
11
5.3. Système de stimulation optique ... 93
6. Acquisition des mouvements de l’animal ... 95
6.1. Protocole en openfield et enregistrements électrophysiologiques ... 95
6.2. Protocole d’évaluation des mouvements involontaires anormaux oro-linguaux ... 97
6.3. Asymétrie d’utilisation des pattes avant ... 98
7. Euthanasie et extraction cérébrale ... 99
8. Immunohistochimie ... 99
9. Imagerie ... 100
10. PCR ... 100
11. Tests statistiques ... 101
Résultats
... 1021. Stimulations du cervelet pour le traitement des dyskinésies oro-linguales ... 103
2. Modulation électrophysiologique du cortex moteur et du thalamus ... 107
3. Modulation de l’expression de FosB/ΔFosB dans le striatum ... 114
4. Modulation du nombre de cellules de Purkinje ... 116
5. Contrôle : lésion de la voie nigro-striée ... 119
6. Résultats supplémentaires ... 120
Discussion
... 1251. Choix du modèle utilisé et limitations ... 126
2. Les cellules de Purkinje sont impliquées dans l’effet anti-dyskinétique des stimulations cérébelleuses ... 129
3. Le cortex moteur et le thalamus parafasciculaire sont impliqués dans les pathologies parkinsoniennes et dyskinétiques ... 130
4. Stimulations cérébelleuses anti-dyskinétiques et altérations des voies cérébello-thalamo-cortico-striatale et cérébello-thalamo-striatale ... 132
Conclusion et perspectives
... 13612
13
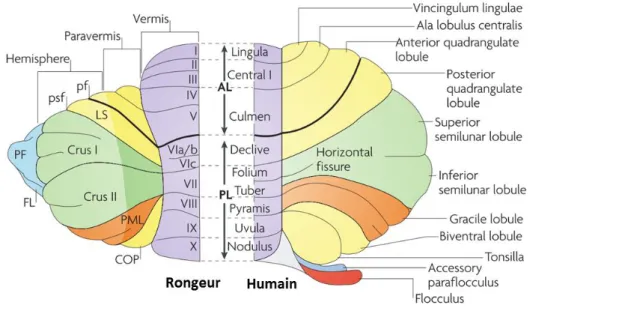
Figure 1 Régions cérébelleuses équivalentes entre le rongeur et l’être humain. ... 21
Figure 2 Organisation du cervelet ... 21
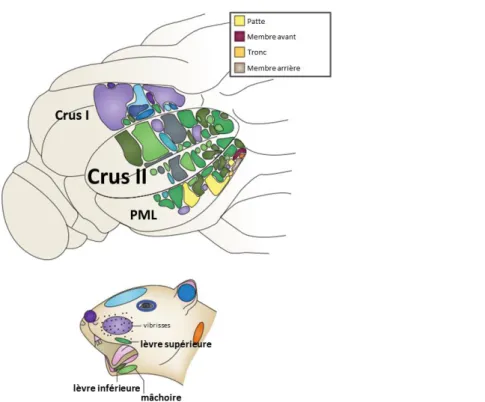
Figure 3 Distribution spatiale des champs récepteurs des régions Crus II, Crus I et du lobule paramédian (PML) en réponse à un stimulus sensoriel. ... 26
Figure 4 Cervelet et ganglions de la base ... 29
Figure 5 Afférences et efférences des noyaux thalamiques ... 35
Figure 6 Projections et couches corticales ... 37
Figure 7 Voies ascendantes et descendantes reliant le cervelet au cortex moteur. ... 38
Figure 8 Dyskinésies induites par la lévodopa : types et facteurs de risques différents. ... 52
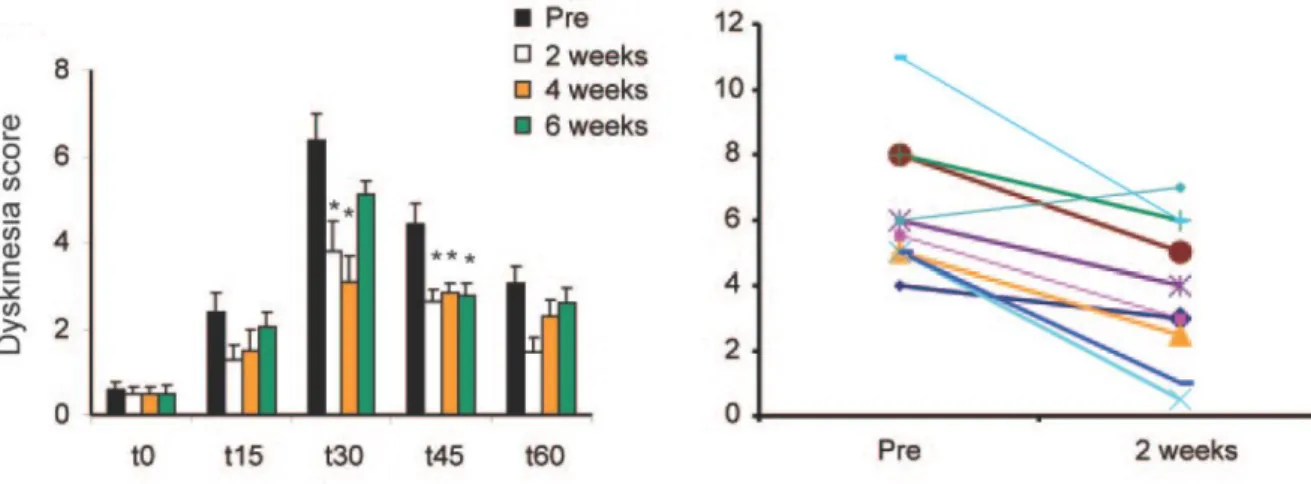
Figure 9 Effet anti-dyskinétique des stimulations cTBS des hémisphères cérébelleux chez le patient parkinsonien. ... 62
Figure 10 Chirurgie implantatoire d’électrodes de stimulation cérébrale profonde au niveau du noyau sous-thalamique chez un patient atteint de la maladie de Parkinson. ... 68
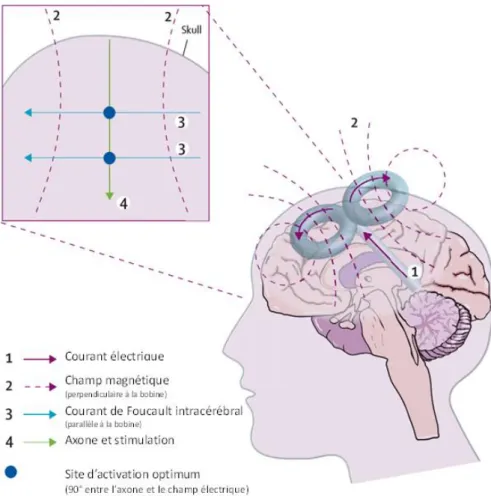
Figure 11 Activation neuronale par la stimulation magnétique transcrânienne. ... 75
Figure 12 Expression spécifique la ChR2-EYFP dans les cellules de Purkinje de souris L7-ChR2. ... 84
Figure 13 Séquence d’inhibition-excitation rebond dans la voie ascendante cérébello-thalamo-corticale suite à l’activation optogénétique des cellules de Purkinje. ... 84
Figure 14 Protocole longitudinal. ... 88
Figure 15 Stimulation optogénétique. ... 94
Figure 16 Exemples de mouvements involontaires anormaux de faible, moyenne et grande amplitude. ... 98
Figure 17 Développement des AIMs oro-linguaux. ... 105
Figure 18 Evolution individuelle des AIMs oro-linguaux entre la semaine 1 et la semaine 4. ... 106
Figure 19 Anatomie de l’implantation des électrodes d’enregistrement cellulaire. ... 109
Figure 20 Exemples de lésions électrolytiques dans les régions d’intérêt. ... 110
Figure 21 Réduction de la fréquence de décharge des neurones du cortex moteur oral M1 en condition parkinsonienne comparée aux contrôles. ... 111
Figure 22 Modulation de la fréquence de décharge des neurones du cortex moteur oral M1 et du thalamus Pf par la lévodopa chez des animaux parkinsoniens non stimulés. ... 111
Figure 23 Modulation de la fréquence de décharge des neurones du cortex moteur oral M1 et du thalamus Pf par la lévodopa et les stimulations cérébelleuses correctives chez des animaux parkinsoniens... 112
Figure 24 Modulation de la fréquence de décharge des neurones du cortex moteur oral M1 et du thalamus Pf par la lévodopa et les stimulations cérébelleuses préventives chez des animaux parkinsoniens. ... 113
Figure 25 Modulation de l’expression de FosB/ΔFosB dans le striatum lésé comparé au striatum contrôle... 115
Figure 26 Exemples de marquages de FosB/ΔFosB dans le striatum dorsolatéral. ... 115
Figure 27 Modulation du nombre de cellules de Purkinje en fonction de la lésion du MFB et des stimulations cérébelleuses. ... 117
Figure 28 Exemples de cellules de Purkinje chez un animal non-parkinsonien. ... 117
Figure 29 Exemples de cellules de Purkinje chez un animal parkinsonien traité à la lévodopa et recevant des stimulations préventives. ... 118
Figure 30 Lésion dopaminergique striatale. ... 119
Figure 31 Exemples de réponse du cortex moteur suite à la stimulation des cellules de Purkinje. ... 134
Figure 32 Altérations des voies cérébello-thalamo-cortico-striatale et cérébello-thalamo-striatale en condition parkinsonienne, dyskinétique et suite aux stimulations cérébelleuses thérapeutiques. ... 135
14
Figure S2 Cohérence cortico-corticale dans la bande de fréquence β. ... 121
Figure S3 Asymétrie d'utilisation des pattes avant. ... 123
Figure S4 Effet de la stimulation préventive de crus I et crus II sur les AIMs oro-linguaux. ... 124
Figure S5 Fréquence de décharge des neurones du thalamus VAL. ... 124
Tableau 1 Nombre d’animaux opérés avec succès, par groupe. ... 88
Tableau 2 Coordonnées d’injection et de placement des électrodes et de la LED... 92
Tableau 3 Décours temporel des protocoles en openfield. ... 96
15
16
La lévodopa est actuellement le traitement de référence pour les patients atteints de la maladie de Parkinson. Cependant, ce précurseur de la dopamine est associé à l’émergence d’effets secondaires très handicapants affectant jusqu’à 80% des patients après 5 ans de thérapie : les dyskinésies. Des traitements complémentaires visant à réduire les dyskinésies sont donc indispensables à cette étape de la maladie. A cet effet, la stimulation cérébrale profonde du noyau sous-thalamique et du pallidum interne est la technique actuellement la plus efficiente. Toutefois, invasive, onéreuse et pouvant s’avérer inefficace, elle n’est effectuée que chez un nombre restreint de patients.
Le modèle classique de la maladie de Parkinson propose une dégénérescence des ganglions de la base dont la modulation dopaminergique aberrante suite à l’administration de lévodopa sous-tend l’émergence des dyskinésies. Pour autant, l’existence d’une interconnexion cérébello-basale via le pons et le thalamus, ainsi que d’une modulation de l’activité du striatum par le cervelet, suggèrent une possible implication du cervelet dans les dyskinésies induites par la lévodopa dans la maladie de Parkinson.
Qui plus est, deux études majeures ont démontré l’effet anti-dyskinétique durable de la stimulation magnétique transcrânienne du cervelet. Non invasive et présentant très peu de contre-indications, cette technique prometteuse argumente donc en faveur de l’implication des voies cérébello-corticales dans la réduction des dyskinésies dopa-induites chez le patient.
Les travaux présentés dans cette thèse s’intéressent à l’implication des cellules de Purkinje cérébelleuses via les voies cérébello-thalamo-cortico-striatale et cérébello-thalamo-striatale dans l’émergence et le traitement des dyskinésies induites par la lévodopa dans un modèle murin de la maladie de Parkinson. Après quelques rappels anatomiques, nous aborderons brièvement la sémiologie de la maladie de Parkinson afin de contextualiser par la suite la pathophysiologie des dyskinésies dopa-induites. Nous aborderons ainsi les modulations des structures encéphaliques en condition pathologique et mettrons en exergue l’implication du cervelet dans l’émergence et le traitement des dyskinésies induites par la lévodopa dans la maladie de Parkinson. Nous décrirons également les diverses thérapies actuelles ou en cours d’évaluation visant à corriger les dyskinésies dopa-induites. Enfin, nous traiterons du modèle animal et argumenterons en faveur de l’utilisation de la lignée de souris L7-ChR2 dans l’optique d’aborder la question du rôle des cellules de Purkinje et des voies cérébello-thalamo-cortico-striatale et cérébello-thalamo-striatale dans l’émergence et le traitement des dyskinésies induites par la lévodopa.
Les résultats obtenus au cours de cette thèse et présentés dans cet ouvrage mettent en évidence l’implication des cellules de Purkinje de la région crus II dans le traitement des
17
dyskinésies oro-linguales dopa-induites. Effectivement, la modulation chronique spécifique des cellules de Purkinje par une technique d’optogénétique semble à même de corriger et de prévenir l’émergence du phénotype dyskinétique et ce en association avec une modulation de l’activité de relais thalamiques (en particulier le thalamus parafasciculaire), du cortex moteur primaire oral et du striatum dorsal.
Ces résultats argumentent ainsi en faveur de l’implication des voies cérébello-thalamo-cortico-striatale et cérébello-thalamo-cérébello-thalamo-cortico-striatale dans le traitement correctif et préventif des dyskinésies induites par la lévodopa dans la maladie de Parkinson.
18
19
Première partie
20
1. Le cervelet
1.1. Anatomie du cervelet
1.1.1. Organisation régionale
Le cervelet est une structure majeure de l’encéphale qui influence les multiples aspects du comportement moteur et cognitif principalement via le circuit cérébello-thalamo-cortical (Middleton & Strick, 2001).
Le cervelet humain pèse 154 g et contient 69 milliards de neurones. En comparaison, le cortex cérébral humain, qui représente 80 % de la masse du cerveau, a un poids moyen de 1233 g et est constitué de 16 milliards de neurones. Ainsi, le cervelet concentre plus de neurones que l’ensemble du reste du système nerveux central (Herculano-Houzel, 2009).
Il est organisé en trois régions longitudinales qui s'étendent le long du plan rostro-caudal : le vermis (cervelet médial), le paravermis (cervelet intermédiaire ou pars intermedia) et les hémisphères (cervelet latéral) (voir figure 1).
Selon le plan dorso-ventral, le cervelet est agencé en deux parties distinctes à savoir le cortex, constitué de trois couches, et les noyaux cérébelleux (voir figure 2).
Deux fissures profondes divisent le cortex cérébelleux en trois lobes : les lobes antérieurs et postérieurs, divisés par la fissure primaire, et le lobe flocculonodulaire, séparé du lobe postérieur par la fissure postérolatérale. Ces régions sont encore subdivisées en lobules par des fissures peu profondes et, selon les espèces, certains lobules peuvent être repliés en sous-lobules ou folia (Cerminara et al., 2015). Enfin, il existe également des variations régionales dans l’expression de certains marqueurs moléculaires, dont le plus étudié est la zébrine-II une enzyme glycolytique exprimée de façon hétérogène dans les cellules de Purkinje. Le cortex cérébelleux peut ainsi être subdivisé en bandes alternantes positives ou négatives, orientées de façon rostro-caudales (Hawkes & Leclerc, 1987; Cerminara et al., 2015).
21
Figure 1 Régions cérébelleuses équivalentes entre le rongeur et l’être humain.
Crus I & Crus II : lobule ansiforme
pf : fissure primaire ; psf : fissure postérieure supérieure ; LS : lobulus simplex ; PF : paraflocculus ; FL : flocculus ; PML : lobule paramédian ; COP : copula pyramidis
D’après Apps & Hawkes, 2009.
Figure 2 Organisation du cervelet
Panneau de gauche : cytoarchitecture du cervelet
D’après Cerminara et al 2015.
Panneau de droite : projections cortico-nucléaires.
DENT = Noyaux Denté (rostral et caudal) ; EMB = Noyau Emboliforme (interposé) ; GLOB = Noyaux Globuleux (interposé) ; FAST = Noyau fastigial ; INT = cellules interstitielles ; ANS = Lobule ansiforme ; PFL = Paraflocculus ; FLO = Flocculus.
22
1.1.2. Les noyaux cérébelleux profonds
Les noyaux profonds (ou noyaux cérébelleux profonds, DCN) sont situés dans la partie la plus ventrale du cervelet (voir figure 2). Ils sont l'unité finale de traitement de l’information des circuits cérébelleux qu’ils intègrent et transmettent aux cibles extra-cérébelleuses (De Camilli et al., 1984 ; Uusisaari & Knöpfel, 2013). Bien que recevant des collatérales excitatrices en provenance des fibres grimpantes et des fibres moussues, leur afférence principale est inhibitrice et provient des cellules de Purkinje GABAergiques. Ainsi, au cours du contrôle sensorimoteur, les noyaux profonds intègrent les entrées excitatrices, médiées par les fibres moussues et les fibres grimpantes, avec les entrées inhibitrices provenant des cellules de Purkinje.
La projection des cellules de Purkinje sur les noyaux profonds semble topographiquement organisée (De Camilli et al., 1984 ; Jansen & Brodal, 1940) et ces derniers sont divisés en trois régions principales : le noyau fastigial (médial), le noyau interposé (composé des noyaux globuleux et emboliforme chez le primate) et le noyau denté (latéral).
Le noyau fastigial (ou noyau du faîte) reçoit principalement les projections des cellules de Purkinje situées au niveau du vermis. Il se projette majoritairement contra-latéralement sur les noyaux vestibulaires et réticulés d’une part et ipsi-latéralement sur les noyaux pontiques et réticulés et la médulla d’autre part. Il est ainsi impliqué dans le contrôle de la posture, du tonus musculaire et du mouvement oculaire de même que dans les activités viscérales et émotionnelles (Zhang, Wang, et al., 2016).
Le noyau interposé (ou interpositus) est divisé en noyaux globuleux (globulus) et emboliforme (embulus) chez le primate. Il reçoit principalement les afférences des régions paravermales et il se projette essentiellement sur les régions contra-latérales comme le noyau rouge, la zona incerta, le thalamus ventral antéro-latéral et les noyaux thalamiques intralaminaires (parafasciculaire, centromédian et centrolatéral). Il semble jouer un rôle modulateur dans la dynamique du contrôle et de l’apprentissage de de la réponse motrice (Teune et al., 2000) ainsi que dans l’adaptation comportementale (Callu et al., 2013).
Enfin, le noyau denté (ou dentelé, dentate) est la principale structure de réception des régions hémisphériques. Adjacent au toit du quatrième ventricule et au vermis, il s’agit du plus volumineux des noyaux de sortie du cervelet. Ses axones décussent au niveau du pédoncule cérébelleux supérieur dans le mésencéphale caudal, passent à travers le noyau rouge (dans lequel un faible pourcentage fait synapse) et se projettent sur plusieurs régions thalamiques telles que les noyaux thalamiques ventrolatéral et postérieur, les noyaux intralaminaires (parafasciculaire et centrolatéral), ainsi que les noyaux médioventral et mediodorsal latéral du thalamus (Harolan et al., 1981; Pelzer et al., 2017).
23
En outre, les noyaux profonds envoient tous trois des projections inhibitrices vers l’olive inférieure contra-latérale (Martin et al., 1976; Voogd et al., 2013). Elle-même projetant vers les cellules de Purkinje et formant ainsi une boucle de rétrocontrôle.
Les projections efférentes des noyaux profonds impliquent en outre trois classes principales de neurotransmetteurs : le glutamate, le GABA et la glycine.
Les neurones glutamatergiques des noyaux profonds projettent vers différentes structures du mésencéphale telles que le noyau rouge, la formation réticulée ou le thalamus (Canto et al., 2016). Ils peuvent également moduler la décharge du cortex cérébelleux en excitant les cellules en grain excitatrices projetant sur les cellules de Purkinje (Gao et al., 2016).
D’autre part, la plupart des neurones GABAergiques des noyaux profonds inhibent l’olive inférieure pour réguler l'activité de la fibre grimpante et d'autres pourraient fonctionner comme interneurones locaux (Canto et al., 2016; Uusisaari & Knöpfel, 2008).
Enfin, les noyaux profonds possèdent également des interneurones glycinergiques pouvant inhiber la plus part des cellules principales (Husson et al., 2014). Ils sont également composés de neurones à GABA/glycine capables de moduler le cortex cérébelleux via les cellules de Golgi (Ankri et al., 2015).
1.1.3. Le cortex cérébelleux
Le cortex cérébelleux est organisé en trois couches : la couche granulaire, la couche moléculaire et la couche des cellules de Purkinje.
1.1.3.1. La couche granulaire
La couche granulaire est située dans la partie la plus profonde du cortex cérébelleux et constituée de cellules en grain ainsi que de trois types d’interneurones : les cellules de Golgi et les cellules de Lugaro (interneurones inhibiteurs) et les cellules unipolaires en brosse (UBC, interneurones excitateurs).
Les cellules en grain sont les neurones les plus simples et les plus petits de l’encéphale, mais aussi les plus nombreux. Ils reçoivent des projections excitatrices glutamatergiques des fibres moussues et des cellules en brosse, et sont inhibés par les cellules de Golgi et de Lugaro (Geurts et al., 2003). Les axones des cellules en grain remontent à travers la couche granulaire et atteignent la couche moléculaire où ils bifurquent pour former les fibres parallèles qui activent en retour les cellules de Golgi, mais aussi les cellules de Purkinje et les interneurones de la couche moléculaire (Eccles et al., 1967). Les cellules en brosse, avec les cellules en grain, sont les seuls neurones excitateurs du
24
cortex cérébelleux. En particulier, ils permettent d’amplifier le signal des fibres moussues (Englund et al., 2006).
Enfin, les cellules de Lugaro sont des interneurones activés de façon sélective par la sérotonine et inhibés par les cellules de Purkinje (Dieudonné & Dumoulin, 2000). Situés juste en dessous des cellules de Purkinje, les cellules de Lugaro forment des contacts inhibiteurs axosomatiques et axodendritiques avec l’ensemble des neurones corticaux et interconnectent ainsi les trois couches du cortex cérébelleux (Geurts et al., 2003).
1.1.3.2. La couche moléculaire
La couche moléculaire forme la partie la plus superficielle du cortex cérébelleux. Elle est constituée des cellules en panier et des cellules étoilées. Ces neurones inhibiteurs activés par les fibres parallèles et les fibres grimpantes glutamatergiques ont pour fonction principale de moduler l'activité des cellules de Purkinje (Szapiro & Barbour, 2007).
D’un point de vue topographique, les cellules étoilées sont situées dans les deux tiers supérieurs de la couche moléculaire, celles du premier tiers constituant ses seuls neurones superficiels (Palay & Chan-Palay, 1974). Elles forment des synapses inhibitrices sur les dendrites des cellules de Purkinje, sur d’autres cellules étoilées ainsi que sur elles-mêmes formant ainsi des synapses autaptiques (Liu, 2013). Les cellules en panier quant à elles, plus larges et arrondies, sont situées plus en profondeur, à proximité des cellules de Purkinje (Palay & Chan-Palay, 1974).
1.1.3.3. La couche des cellules de Purkinje
Les cellules de Purkinje du cervelet ont été identifiées en 1837 par l'anatomiste tchèque Jan Evangelista Purkyně. Elles se projettent sur les noyaux profonds (et le complexe vestibulo-nucléaire) et constituent ainsi la structure de sortie du cortex cérébelleux. Situées entre la couche granulaire et la couche moléculaire, les cellules de Purkinje possèdent un soma mesurant environ 20 microns dont l’apex donne naissance à un arbre dendritique étendu dans le plan parasagital de la couche moléculaire. Les cellules de Purkinje sont disposées en une couche monocellulaire et influencées par deux types d'entrées principales : les fibres grimpantes en provenance de l’olive inférieure et les fibres parallèles issues des cellules en grain et relayant les informations des fibres moussues venant du tronc cérébral et de la moelle épinière. Leurs connexions synaptiques se font au niveau de l’arbre dendritique des cellules de Purkinje situé dans la couche moléculaire. Les fibres parallèles, agencées le long de l’axe antéro-postérieur, sont situées dans un plan orthogonal aux arbres dendritiques des cellules de Purkinje et des neurones de la couche moléculaire. Cet
25
agencement permet ainsi à une seule fibre parallèle de traverser plus de 300 cellules de Purkinje
(Eccles et al., 1967) et à une seule cellule de Purkinje de faire synapse avec environ 175.000 fibres parallèles (Napper & Harvey, 1988). Remarquablement, les cellules de Purkinje enregistrées in
vitro présentent une activité spontanée en l’absence d’entrées synaptiques (Haüsser & Clark, 1997; Llinás & Sugimori, 1980). En outre, chez le rongeur éveillé ou anesthésié, elles présentent également une activité spontanée, non liée au mouvement (Lang et al., 1999). Ainsi, la sortie cérébelleuse dépend de la façon dont les informations entrantes sont intégrées dans l’activité spontanée des cellules de Purkinje (Haüsser & Clark, 1997 ; Zucca et al., 2016).
D’autre part, les cellules de Purkinje présentent la particularité de générer deux types de potentiels d’actions. Alors que l'activation des fibres parallèles via les moussues entraîne la génération de potentiels d’actions simples (simple spikes), de 44 Hertz (Hz) en moyenne, par les cellules de Purkinje, l'activation des fibres grimpantes en provenance de l’olive inférieure entraîne la génération de potentiels d’action complexes (complex spikes) plus lents, dont le taux de décharge moyen est de 1,5 Hz (Armstrong & Rawson, 1979). Cet équilibre entre simple et complex spikes dans les cellules de Purkinje permet la modulation de la sortie cérébelleuse (Zucca et al., 2016). En
particulier, l’afférence de la fibre grimpante sur les cellules de Purkinje pourrait jouer un rôle dans l’apprentissage moteur et la plasticité synaptique via l’activation de récepteurs glutamatergiques AMPA (Ito, 2001). Toutefois, il semble également exister une plasticité de la synapse fibre parallèle – Purkinje impliquant les récepteurs glutamatergiques NMDA et modulée par l’afférence de la fibre grimpante (Coesman et al., 2004 ; Piochon et al., 2007).
1.1.4. La région Crus II
Le lobule ansiforme (ou lobule semi-lunaire) constitue le lobule VII du cervelet postérieur. Il est composé des régions hémisphériques crus I située dans la partie supérieure et crus II située dans la partie inférieure et subdivisée en crus IIa et crus IIb. Ainsi, crus II est la région hémisphérique cérébelleuse située entre crus I et le lobule paramédian sous-jacent.
1.1.4.1. Crus II chez le rongeur
1.1.4.1.1. Intégration sensorimotrice de la zone périorale
Chez le rongeur, des expériences de stimulations tactiles couplées à des enregistrements électrophysiologiques dans la couche granulaire du cortex cérébelleux ont permis de mettre en évidence l’existence de champs récepteurs. Il existe ainsi une carte somatotopique fracturée traduisant les afférences des fibres moussues en mosaïque suite à la stimulation tactile de diverses
26
parties du corps (Shambes et al., 1978). En particulier, la région crus II reçoit les informations somatosensorielles provenant principalement de la zone périorale ipsi-latérale (Bower & Kassel, 1990; Pijpers & Ruigrok, 2006; Haüsser & Clark, 1997) (voir figure 3) et est impliquée dans la coordination des mouvements oro-linguaux (Bryant et al., 2010). Les informations sensorimotrices reçues par le cortex cérébelleux passent par trois voies distinctes, issues du nerf trigéminal. Il s’agit de deux projections à latences courtes et d’une projection à latence longue.
- Les projections à latences courtes sont, d’une part, l’afférence directe du nerf trigéminal vers les fibres moussues et, d’autre part, l’afférence indirecte passant par le colliculus supérieur et l’olive inférieure (Huerta et al., 1983). En particulier, les cellules en grain et les cellules de Golgi avoisinantes peuvent recevoir des entrées de fibres moussues séparées et fonctionnellement distinctes, permettant aux cellules de Golgi de réguler la taille et la reproductibilité des réponses sensorielles (Duguid et al., 2015).
- La projection à latence longue issue du nerf trigéminal passe par le thalamus et rejoint le cortex (ainsi que d’autres structures telles que le striatum). En retour, le cortex cérébral est fonctionnellement lié à crus II grâce à une connexion di-synaptique passant par le pons. Il s’agit de la voie cérébro-ponto-cérébelleuse (Brodal, 1979). En particulier, le cortex moteur oral et la zone crus II du cervelet sont fonctionnellement liés via une voie descendante. En effet, la stimulation du cortex moteur oral induit l’apparition d’une réponse métabolique et cellulaire au niveau de la zone crus II (Proville et al., 2014; Schwarz & Welsh, 2001).
Figure 3 Distribution spatiale des champs récepteurs des régions Crus II, Crus I et du lobule paramédian (PML) en réponse à un stimulus sensoriel.
Notons la prépondérance de la représentation de la zone orale au niveau de Crus II.
27
1.1.4.1.2. Voie ascendante entre crus II et le cortex moteur oral
Les cellules de Purkinje de la zone crus II projettent, entre autres, sur une région située entre les noyaux interposé et denté, nommée bosse dorsolatérale (DLH, dorsolateral hump) ( Buisseret-Delmas & Angaut, 1989; Ding et al., 2016; Goodman et al., 1963). Cette région est particulièrement impliquée dans l’activité motrice orale et dans une moindre mesure dans l’activité des pattes avant, sa stimulation induisant des mouvements oro-linguaux chez le rongeur (Cicirata et al., 1992). Cela suppose l’existence d’une interaction fonctionnelle entre crus II et le cortex moteur oral passant par la DLH, cependant ce lien n’a pas encore été démontré.
En revanche, il a été démontré chez le rongeur que la région ventrolatérale du thalamus, qui reçoit principalement des afférences du cervelet, est fonctionnellement reliée cortex moteur orofacial (Polack & Charpier, 2006). De plus, il existe une interaction fonctionnelle entre crus I et le cortex moteur des vibrisses, la stimulation de crus I induisant une réponse neuronale forte au niveau du cortex moteur vibrissal. De même, il existe une faible réponse cellulaire au niveau du cortex moteur vibrissal faisant suite à la stimulation de la région crus IIa (Proville et al., 2014). Le cortex moteur des vibrisses étant situé à proximité directe du cortex moteur oral, cela suggère par analogie l’éventuelle existence d’une connexion fonctionnelle entre crus II et le cortex moteur oral chez le rongeur.
1.1.4.2. Crus II chez les hominidés
Chez les hominidés, les afférences de crus II proviennent principalement du cortex préfrontal dorsolatéral et du cortex pariétal (Habas et al., 2009; Kelly & Strick, 2003; O’Reilly et al., 2010). En retour, crus II se projette sur le cortex préfrontal dorsolatéral (Kelly & Strick, 2003) en passant par le territoire associatif du noyau sous-thalamique (Bostan et al., 2010).
La région dorsolatérale du cortex préfrontal est impliquée dans la gestion des fonctions exécutives qui incluent l’organisation des entrées sensorielles, le maintien de l’attention, la mémoire de travail et la coordination du comportement orienté. En outre, bien qu'il ne soit pas directement impliqué dans le contrôle du mouvement, le cortex préfrontal projette sur le cortex prémoteur et encode probablement ainsi des informations liées à l'action. Par conséquent, les projections entre le cortex préfrontal dorsal et la région corticale cérébelleuse Crus II pourraient également être impliquées dans les fonctions motrices chez le primate (Ramnani, 2006).
Par rapport aux autres espèces, les hominidés présentent une expansion du lobule ansiforme en comparaison au reste du cervelet. Cette observation reflète l’hypothèse de la pression évolutionnaire selon laquelle les systèmes interconnectés évoluent de concert les uns avec les autres (Baumann et
28
al., 2015). Ainsi, chez l’humain, l’importance de crus II dans l’aisance verbale, l’activation du langage et la perception sociale a été démontrée (Jack et al., 2017).
1.2. Communication bidirectionnelle entre le cervelet et les ganglions de la base
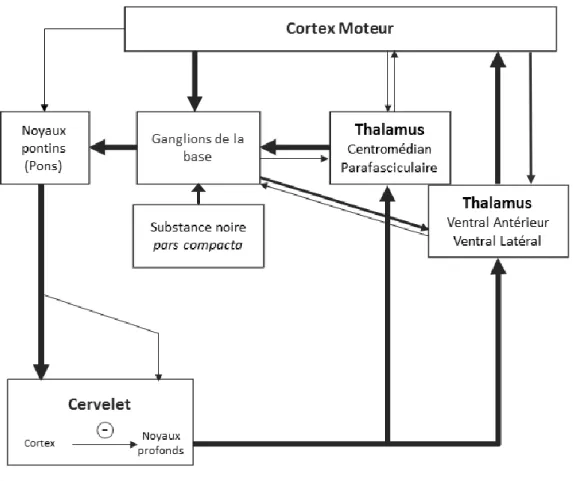
Les ganglions de la base sont un ensemble de régions sous-corticales du cerveau impliquées le contrôle du mouvement volontaire et l’apprentissage comportemental. Ils sont composés du striatum, du globus pallidus interne (GPi) et externe (GPe), de la substance noire pars compacta (SNpc) et reticulata (SNr), et du noyau sous-thalamique (STN) (voir figure 4). Le cervelet et les ganglions de la base forment deux boucles synaptiques distinctes se chevauchant au niveau des zones corticales qu’elles relient (Middleton & Strick, 2000). Toutefois, ils sont également reliés par des connexions anatomiques. En effet, Bostan et Strick ont démontré en 2010 l’existence d’une connexion di-synaptique réciproque entre le cervelet et les ganglions de la base chez le primate non-humain (Bostan et al., 2010) (voir figure 4).
Ainsi, le noyau sous-thalamique (STN) se projette sur le cortex cérébelleux via les noyaux pontiques. Cette connexion di-synaptique est topographiquement organisée, la zone crus II postérieure du cervelet recevant des innervations principalement en provenance de la partie rostrale ventro-médiale du STN, alors que l’expansion hémisphérique du lobule VIIB du cervelet est
majoritairement innervée par la partie caudale dorso-latérale du STN. A l’inverse, les aires motrices et non motrices du noyau denté, appartenant à la sortie cérébelleuse, projettent vers le striatum en une connexion di-synaptique passant par le thalamus ventral latéral (VL) et ventral antérieur (VA) et les noyaux intralaminaires thalamiques centrolatéral (CL), centromédian et parafasciculaire (CM/Pf) (Bostan et al., 2010; Hoshi et al., 2005).
De plus, au niveau du thalamus, les projections pallidales (issues des ganglions de la base) et cérébelleuses forment une organisation spécifique avec des zones ségrégées mais également de larges régions qui se chevauchent, en particulier au niveau des noyaux intralaminaires et du noyau ventral latéral (Pelzer et al., 2017). Il existe ainsi un substrat anatomique en faveur d’une communication bidirectionnelle entre les ganglions de la base et le cervelet.
En particulier, chez le rongeur, il semble donc exister deux boucles cérébello-thalamo-corticales principales reliant le cervelet (dont crus II) au cortex moteur oral (M1oral).
Une boucle courte passant par le complexe VA/VL thalamique : (Purkinje – DCN) – VA/VL – M1oral.
Une boucle longue passant par les noyaux thalamiques intralaminaires : Via la voie directe :
29 Via la voie indirecte :
(Purkinje – DCN) – CL/Pf – Striatum - GPe – STN – GPi/SNr – VA/VL - M1oral
Outre ces voies anatomiques, l’existence d’une connexion fonctionnelle excitatrice entre les noyaux cérébelleux profonds et le striatum passant par les noyaux thalamiques intralaminaires centro-latéraux a également été démontrée (Chen et al., 2014).
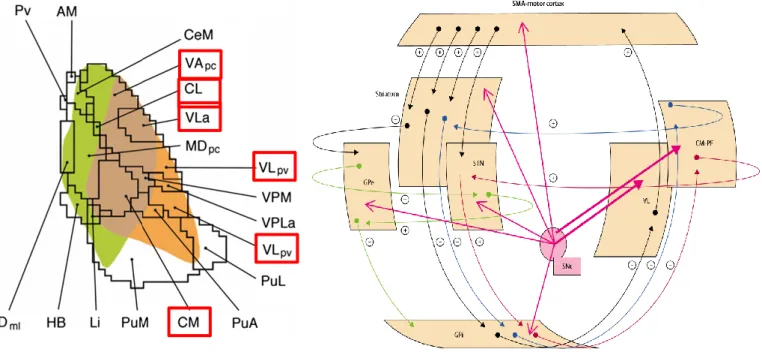
Figure 4 Cervelet et ganglions de la base
Panneau du bas : Organisation des ganglions de la base : voies directe, indirecte et hyperdirecte.
D’après Jahanshahi, 2015.
Panneau du haut : Interconnexions di-synaptiques entre le cervelet et les ganglions de la base.
L’injection de virus rétrogrades dans le striatum ou le cortex cérébelleux respectivement révèle l’existence d’une connexion di-synaptique reliant le noyau denté du cervelet au striatum via un relais thalamique. De même, le noyau sous-thalamique (STN) projette vers le cortex cérébelleux via les noyaux pontins (PN).
30
2. Les ganglions de la base
2.1. Voies directe, indirecte et hyperdirecte dans les ganglions de la base
Dans le modèle classique d'organisation des ganglions de la base (ou noyaux gris centraux)
(Albin et al., 1989), le cortex cérébral envoie des projections glutamatergiques excitatrices vers le striatum selon une topographie rostro-caudale (Verstynen et al., 2012) directement depuis les couches V et VI corticales (Alexander et al., 1986). La dopamine, via la voie nigrostriée, module ces apports, soit par un effet excitateur sur une sous-population de neurones striataux exprimant des récepteurs dopaminergiques de type D1 (voie directe), soit par un effet inhibiteur sur une sous-population de neurones exprimant des récepteurs dopaminergiques de type D2 (voie indirecte). Dans la voie directe, les neurones striataux envoient directement des afférences inhibitrices GABAergiques aux noyaux de sortie des ganglions de la base, le globus pallidus interne (GPi) et la substantia nigra pars reticulata (SNr), qui envoient ensuite des fibres GABAergiques aux noyaux thalamiques. En revanche, les axones des neurones striatofuges de la voie indirecte forment des synapses GABAergiques avec des cellules du globus pallidus externe, qui envoient ensuite des projections GABAergiques au noyau sous-thalamique (STN). Le noyau sous-thalamique utilise ensuite le glutamate pour moduler l’activité de la région GPi / SNr.
Ainsi, le modèle prédominant de la fonction des ganglions de la base propose l’existence de deux types de projections provenant de populations distinctes de neurones épineux dans le striatum, les voies dites directes et indirectes, ayant des effets opposés sur le mouvement. L'activité de la voie directe faciliterait le mouvement alors que l'activité de la voie indirecte l’inhiberait (DeLong, 1990). Ce modèle classique suggère que la dopamine régule l'activité des ganglions de la base en équilibrant les effets opposés sur les voies directes et indirectes. Ainsi, la perte de l’afférence dopaminergique striatale dans la maladie de Parkinson perturbe cet équilibre, induisant un état hypokinétique. Cependant, suite à l’observation chez la souris d’augmentations transitoires de l'activité neuronale striatale des voies à la fois directe et indirecte lors de l’initiation du mouvement, Cui et collaborateurs suggèrent que l’activation coordonnée des deux voies pourrait être importante pour la sélection de l’action ou pour le timing de la sortie cérébelleuse, la voie directe promouvant le programme moteur désiré alors que la voie indirecte inhiberait les programmes entrant en compétition (Cui et al., 2013).
Il existe en outre une voie dite hyperdirecte, qui est une projection excitatrice monosynaptique depuis le cortex jusqu’au noyau sous-thalamique entraînant une excitation de substance la noire réticulée (Kita et al., 1983).
31
2.2. Le striatum
Composé presque exclusivement de neurones GABAergiques, le striatum est le principal noyau d'entrée des ganglions de la base. Il reçoit des afférences glutamatergiques excitatrices provenant de diverses régions dont le néocortex et le complexe centromédian/parafasciculaire (CM/Pf) du thalamus intralaminaire. Il reçoit également des innervations dopaminergiques modulatrices provenant de la substance noire compacte et de l’aire tegmentale ventrale (Bolam et al., 2000). Anatomiquement, le striatum est composé d’une partie dorsale comprenant le noyau caudé et le putamen séparés par les fibres de la capsule interne chez le primate, ainsi que d’une partie ventrale dont la structure principale est le noyau accumbens. En particulier, le striatum dorsal est impliqué dans le comportement moteur (Haber, 2016).
Au niveau de sa composition cellulaire, les neurones épineux moyens (MSNs) GABAergiques représentent environ 95 % du striatum (Kemp & Powell, 1971). Comme détaillé précédemment, il existe deux sous-populations, partiellement ségrégées (Calabresi et al., 2014), qui se distinguent par leurs projections et leurs motifs d'expression protéique. D’une part les MSNs exprimant les récepteurs dopaminergiques de type D1 envoient des projections inhibitrices directement aux noyaux de sortie des ganglions de la base : la substantia nigra pars reticulata et le globus pallidus interne (ou noyau entopédonculaire chez rongeur). Ce circuit, nommé «voie directe» ou «voie D1», provoque une excitation du thalamus résultant en une boucle de rétroaction corticale positive qui contribue à la réalisation du mouvement. D’autre part les MSNs exprimant les récepteurs dopaminergiques de type D2 envoient quant à eux des projections inhibitrices au globus pallidus externe (GPe). Ce circuit est nommé «voie indirecte» ou «voie D2» et provoque une inhibition de l'activité thalamique résultant en une boucle de rétroaction corticale qui contribue à inhiber le comportement.
Les 5 % de neurones restants sont constitués d'interneurones lisses capables de moduler les neurones principaux. D’une part les interneurones cholinergiques, d’autre part plusieurs sous-types d'interneurones GABAergiques (à décharge rapide exprimant la parvalbumine, à calrétinie, à tyrsosine hydroxylase et à décharge de bas seuil coexprimant le neuropeptide Y, la somatostatine et la synthase d’oxyde nitrique) (Ibáñez-Sandoval et al., 2011).
Par ailleurs, les terminaisons dopaminergiques en provenance de la substance noire compacte sont riches en tyrosine hydroxylase (TH). La TH est l’enzyme limitante permettant de convertir la tyrosine en lévodopa, elle-même précurseur de la dopamine. Ainsi, une réduction des taux de TH au niveau du striatum est associée à une perte de l’afférence dopaminergique en provenance de la substance noire compacte (Daubner et al., 2011).
32
2.3. Le segment interne du globus pallidus et la substance noire pars reticulata
Les neurones épineux moyens du putamen et du noyau caudé sont à l’origine de projections GABAergiques qui se terminent sur deux autres noyaux des ganglions de la base : le segment interne du globus pallidus et la région pars reticulata de la substance noire. Tous deux ont des fonctions efférentes identiques, la pars reticulata faisant en réalité partie du globus pallidus dont elle a été séparée au cours du développement par les fibres de la capsule interne (Purves et al., 2003). Il semble en outre exister une connexion monosynaptique cortico-nigrale, la pars reticulata recevant probablement des afférences depuis les cortex moteur et prémoteur (Cacciola et al., 2016). Les neurones efférents du globus pallidus interne et de la substance noire réticulée sont GABAergiques et constituent les structures de sortie des ganglions de la base.
Le pallidum interne inhibe ainsi le thalamus (qui projette principalement vers les aires motrices du cortex cérébral), en particulier les noyaux thalamiques intralaminaires et le thalamus ventral antérieur, et dans une moindre mesure le thalamus ventral latéral, ventromédian et ventropostéromédian (Pelzer et al., 2017). La substance noire réticulée quant à elle inhibe principalement le colliculus supérieur, impliqué dans le mouvement oculaire.
2.4. Le segment externe du globus pallidus
Le globus pallidus externe reçoit divers types d’afférences. Les projections principales sont GABAergiques venant majoritairement des neurones épineux moyens de la voie directe du striatum, glutamatergiques en provenance du thalamus et du noyau sous-thalamique, dopaminergiques depuis la substance noire pars compacta et sérotoninergiques depuis le raphé (Eid & Parent, 2015; Rav-Acha et al., 2008). Les populations neuronales des deux segments pallidaux sont similaires. Ainsi, comme le pallidum interne, presque tous les neurones du pallidum externe sont constitués de larges neurones GABAergiques à parvalbumine. Déchargeant majoritairement après le mouvement, les neurones du globus pallidus externe sont principalement impliqués dans la régulation motrice (DeLong, 1971) et régulent les ganglions de la base (Nelson & Kreitzer, 2014).
2.5. Le noyau sous-thalamique
Avec le striatum, le noyau sous-thalamique (STN) ou corps de Luys représente la principale entrée dans les ganglions de la base. Sortie majeure du pallidum externe, il reçoit également des afférences excitatrices du complexe CM/Pf, ainsi que des afférences corticales formant la boucle hyperdirecte (Nelson & Kreitzer, 2014). Composé principalement de neurones glutamatergiques, le
33
STN envoie des projections excitatrices vers les noyaux de sortie des ganglions de la base et en retour vers le pallidum externe, le striatum et la substance noire compacte (Cragg et al., 2004; Plenz & Kital, 1999).
2.6. La substance noire pars compacta
Découverte en 1784 par Félix Vicq-d’Azyr, la substance noire est une structure située dans la partie ventrale du mésencéphale et composée de deux aires distinctes : la pars reticulata et la
pars compacta. La pars compacta, située dans la région postéro-médiale, est l'un des quatre noyaux
dopaminergiques principaux du cerveau, avec la région tegmentale ventrale, la région rétrorubrale et le noyau arqué de l'hypothalamus (Kwon & Jang, 2014). 70 % des afférences reçues par la substance noire compacte sont inhibitrices GABAergiques et issues principalement du globus pallidus externe et de la substance noire réticulée (Smith & Bolam, 1990).
La substance noire compacte innerve principalement sur le striatum via la voie nigrostriée ainsi que le cortex. Ses axones font synapse avec les deux types de neurones épineux moyens du striatum. Ainsi, il semble que l'entrée dopaminergique exerce un effet facilitateur sur les MSNs de la voie directe via les récepteurs D1 et un effet inhibiteur sur les MSNs de la voie indirecte via les récepteurs D2. Une caractéristique morphologique importante de la projection nigrostriée est le très grand nombre d'arborisations axonales qu'elle exprime. En effet, un neurone dopaminergique pourrait faire jusqu'à 1 million de contacts synaptiques sur les neurones du striatum. Cette connectivité dopaminergique conséquente implique un large effet modulateur de la dopamine sur le striatum et les ganglions de la base (Lanciego et al., 2012).
34
3. Le thalamus
3.1. Les noyaux thalamiques intralaminaires
Les noyaux intralaminaires sont la principale afférence thalamique du striatum chez le primate et les autres espèces (Macchi et al., 1984) (voir figure 5). Ils sont divisés en deux ensembles, le noyau centrolatéral (CL) rostral d’une part, et le noyau parafasciculaire caudal d’autre part qui, chez le primate, constitue le complexe centromédian-parafasciculaire (CM/Pf).
En particulier, le noyau thalamique parafasciculaire envoie des projections excitatrices vers l’ensemble du striatum de manière topographiquement organisée. Ainsi la partie latérale du noyau parafasciculaire (analogue au CM chez le primate) projette vers la partie latérale sensorimotrice du caudé-putamen, tandis que les projections de la partie médiane de ce noyau (analogue au Pf chez le primate) se terminent dans les régions associatives et limbiques du striatum c’est à dire la partie médiane du caudé-putamen et dans la partie dorsolatérale du noyau accumbens (Berendse & Groenewegen, 1990).
Ces projections thalamiques excitatrices établissent des contacts synaptiques directs avec les neurones épineux moyens GABAergiques ainsi qu’avec les interneurones striataux cholinergiques et GABAergiques à parvalbumine (Brown et al., 2010; Smith et al., 2014) et sont ainsi en mesure de moduler l’activité des ganglions de la base. Dans une moindre mesure, le noyau parafasciculaire du rongeur (CM du primate) envoie également des projections excitatrices vers le noyau sous-thalamique, le pallidum et le cortex (Sadikot & Rymar, 2009; Smith et al., 2014).
Le noyau parafasciculaire reçoit également des projections directes excitatrices des noyaux profonds du cervelet (Aumann et al., 1994; Cornwall & Phillipson, 1988; Hoshi et al., 2005; Ichinohe et al., 2000), du cortex moteur et du noyau pédonculopontin. Il reçoit aussi des projections inhibitrices depuis le pallidum interne, la substance noire réticulée (Sadikot & Rymar, 2009) ainsi que la zona incerta (Barthó et al., 2002).
D’autre part, l’équipe de Kamran Khodakhah a montré en 2010 que les réponses du striatum dorsolatéral induites par le cervelet nécessitent le relais du noyau intralaminaire centrolatéral (Chen et al., 2014). Le cervelet est donc en mesure d’influencer l’activité des ganglions de la base via les noyaux intralaminaires thalamiques.
Enfin, il semble que les afférences excitatrices comme celles du cervelet et des neurones pyramidaux de la couche V du cortex aient un rôle critique dans la transmission de l’information aux noyaux thalamiques, alors que les afférences inhibitrices telles que celles de la sortie des ganglions de la base semblent avoir un rôle de modulateur (Parr-brownlie et al., 2009).
35
3.2. Le thalamus ventral antérieur et ventral latéral
La délimitation entre thalamus ventral antérieur (VA) et latéral (VL) n’étant pas claire chez le rongeur, cette région est nommée complexe VA/VL (VAL). Ce complexe reçoit des afférences en provenance du cervelet et des ganglions de la base. En particulier, la région caudolatérale de VA/VL reçoit préférentiellement des projections glutamatergiques en provenance du cervelet. La région rostromédiale du VA/VL quant à elle reçoit préférentiellement des projections GABAergiques en provenance de la substance noire réticulée et du noyau entopédonculaire (pallidum interne chez les primates) (Garcia-Munoz & Arbuthnott, 2015).
En outre, la région VA/VL projette vers les cortex moteurs, tels que le cortex moteur primaire (M1), le cortex prémoteur ou l’aire motrice supplémentaire (voir figure 5).
En particulier, il a été démontré chez le primate (Fang et al., 2006; Gharbawie et al., 2016) et chez le rongeur (Polack & Charpier, 2006) que la région VL (et VA dans une moindre mesure) reçoit principalement des afférences du cervelet et projette en particulier vers le cortex moteur orofacial.
Figure 5 Afférences et efférences des noyaux thalamiques
Schéma de gauche : Vue schématique de l’organisation du thalamus et des afférences pallidales (vert) et dentées (orange) sur les noyaux thalamiques chez l’humain.
AM = Antéromédial ; CeM = Centromédial ; CL = Centrolatéral ; CM = Centromédian-Parafasciculaire ; HB = Habenula ; Li = Limitans ; MD = Médiodorsal (parvo- et magno-cellulaire) ; Pu = Pulvinar (antérieur, latéral et médial) ; Pv = Parvalbumine ; VA = Ventral Antérieur (parvo-cellulaire) ; VL = Ventro Latéral (antérieur et postéroventral) ; VPL = Ventropostérolatéral (antérieur) ; VPM = Ventropostéromédian. D’après Pelzer et al., 2017.
Schéma de droite : Noyaux thalamiques et circuits moteurs.
En noir : boucle cortico-baso-corticale ; En bleu : feedback positif thalamo-baso-thalamique ; En rouge : feedback négatif thalamo-baso-thalamique ; En vert : voie indirecte ; En rose : projections dopaminergiques. D’après Obeso et al., 2000.
36
4. Le cortex moteur primaire
Le cortex moteur joue un rôle essentiel dans la génération et le contrôle du mouvement de par ses projections en provenance ou en direction du reste du cortex et d'autres zones sous-corticales telles que le striatum et le thalamus, ainsi que vers le cervelet via les noyaux pontins (Jeong et al., 2016). Le cortex cérébral, constitué de plus de 70% de neurones excitateurs (Markram et al., 2004), est organisé de façon laminaire et composé de 6 couches (I – VI).
Ainsi, la couche I est constituée de dendrites des neurones des couches inférieures et quasi dénuée de corps cellulaires. Elle reçoit des afférences en provenance du thalamus, en particulier la région ventrale antérieure recevant des projections inhibitrices des ganglions de la base (Kuramoto et al., 2009).
La couche II/III est principalement constituée de neurones dont les dendrites situées dans la couche I reçoivent des afférences thalamiques. Ces neurones excitateurs se projetant vers les neurones de la couche V, vers le cortex contra-latéral et dans une moindre mesure vers le striatum sont dits intra-télencéphaliques (Reiner et al., 2003; Shepherd, 2014) (voir figure 6).
La couche IV étant quasi-inexistante dans le cortex moteur M1, ce dernier est considéré comme étant pseudo-agranulaire (Yamawaki et al., 2014).
La couche V est la couche la plus épaisse du cortex moteur primaire. Elle est principalement composée de neurones excitateurs de deux types. D’une part les neurones intra-télencéphaliques projetant en particulier vers le striatum ipsi et contra-latéral, ainsi que vers le cortex contra-latéral, la couche II/III et les neurones du tractus pyramidal de la couche V. D’autre part les neurones du tractus pyramidal projetant en particulier vers le striatum, le noyau sous-thalamique et le thalamus ipsi-latéraux, ainsi que la moelle épinière et les noyaux pontins reliant le cervelet (Shepherd, 2014) (voir figure 6). En particulier, le thalamus ventrolatéral (VL) recevant des projections cérébelleuses projette abondamment vers la couche V (et II/III dans une moindre mesure), où il excite les neurones du tractus pyramidal, formant ainsi une boucle fermée cérébro-ponto-cérébello-thalamo-cérébrale (Léna & Popa, 2016).
Enfin, la couche VI, composée de divers types neuronaux reçoit et projette en particulier depuis et vers le thalamus (Briggs, 2010).
En outre, environ 30% des neurones corticaux sont des interneurones inhibiteurs capables de moduler l’activité des neurones principaux (Markram et al., 2004). De types divers, ils présentent des schémas de décharges pouvant être simples ou en bouffée (burst), lents ou rapides (Kawaguchi & Kubota, 1997).
37
Le cortex moteur est également topographiquement organisé. En particulier, la stimulation de la zone périorale chez la souris induit une augmentation de l’activité neuronale localisée (Pronichev & Lenkov, 1998). Plus précisément, en prenant pour origine le bregma, le cortex moteur oral de la souris s’étend latéralement de ± 4mm à ± 0,5mm et antérieurement de + 0,5mm à + 3mm. En particulier, il existe une zone commune à la mâchoire et aux lèvres centrée autour de ± 2,2mm ; 2,2mm.
Inversement, la stimulation chez la souris de cette même région induit des mouvements oro-linguaux (Proville et al., 2014). Ainsi, la zone de prédilection d’enregistrement du cortex moteur oral chez la souris est située au niveau des coordonnées ± 2,2mm en médiolatéral et + 2,2mm en antéropostérieur par rapport au bregma.
Il existe ainsi un ensemble de voies ascendantes et descendantes reliant le cervelet au cortex moteur et impliquant des relais thalamiques et pontiques ainsi que les ganglions de la base (voir figure 7).
Figure 6 Projections et couches corticales
IT = Neurone intra-télencéphalique ; CCor = Cortico-cortical ; CStr = Cortico-striatal ; PT = Tractus pyramidal ; CT = Neurone cortico-thalamique ; RTN = Noyau thalamique réticulé ; Cal = Corps calleux.