HAL Id: tel-02195581
https://tel.archives-ouvertes.fr/tel-02195581
Submitted on 26 Jul 2019
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
verres nucléaires
Marie Collin
To cite this version:
Marie Collin. Géochimie en milieu nanoporeux : Application aux verres nucléaires. Chimie inor-ganique. Université de Montpellier; Ecole Doctorale Information Structures Systèmes, 2018. Français. �tel-02195581�
Rapport de gestion
2015
THÈSE POUR OBTENIR LE GRADE DE DOCTEURE
DE L’UNIVERSITÉ DE MONTPELLIER
En Physique École doctorale I2S
Unité de recherche CEA, DEN, DE2D, SEVT, LCLT
Présentée par Marie COLLIN
Le 26 juin 2018
Sous la direction de Stéphane GIN
Devant le jury composé de
André AYRAL, Professeur des universités, Université de Montpellier Laurence GALOISY, Maître de conférences, Université Pierre et Marie Curie Agnès GRANDJEAN, Directeur de recherche, CEA Marcoule
Thibault CHARPENTIER, Directeur de recherche, CEA Saclay Damien DAVAL, Chargé de recherche, CNRS
Alex FERNANDEZ-MARTINEZ, Chargé de recherche, CNRS
Aurélie VERNEY-CARRON, Maître de conférences, Université Paris-est Créteil Stéphane GIN, Directeur de recherche, CEA Marcoule
Maxime FOURNIER, Ingénieur Chercheur, CEA Marcoule
Président du jury Rapporteure Rapporteure Examinateur Examinateur Examinateur Examinatrice Directeur de thèse Invité
Géo ch imie en milieu na nopo reu x :
App lica tion au x ve rres n ucléaires
5
Remerciements
L’obtention d’une thèse nécessite bien du travail personnel, mais également un environnement d’accueil apte à épanouir le ou la doctorante qui, trois longues années durant, évolue au sein d’un laboratoire. Le LCLT fut le terreau fertile à mon travail, et je le dois à Frédéric Angeli, Bruno Lorrain et Florence Bart que je remercie chaleureusement.
Après trois ans de labeur, j’ai eu la joie de présenter les fruits de mes travaux devant un jury dont je remercie vivement chacun des membres. Merci à vous tous pour votre lecture avisée (et parfois en un temps record !) de mon manuscrit, et merci de vous être déplacés dans des conditions parfois difficiles (vive les grèves SNCF1) pour assister à la soutenance. J’ai vécu cette dernière comme une très belle discussion scientifique, et je vous en suis reconnaissante. Cette thèse, aujourd’hui bien fournie, provient d’une toute petite bouture, proposée en 2015 par Stéphane Gin dans le terreau fertile du LCLT. Stéphane, malgré mon incertitude de départ (est-ce la bonne espè(est-ce de bouture ? Vais-je savoir m’en occuper ?? A quelle fréquen(est-ce ça s’arrose une thèse ???), tu m’as fait confiance et m’as fourni moultes tuteurs et autres engrais pour que le résultat final fleurisse enfin. Milles mercis pour m’avoir appris le métier de jardinière chercheuse (apprentissage par mimétisme s’il se doit). Je pense que nous pouvons être fiers du travail accompli (même si on n’a pas encore tout compris). J’espère que ce n’est pas la fin de notre pépinière, et que nous planterons encore suffisamment d’arbres dans le futur pour produire pleins de papiers !
Parlons maintenant d’un de ces fameux tuteurs (je continue ma métaph(l)ore douteuse). Sur la couverture de la thèse, rien d’officiel, mais Maxime. Tu as beau dire, je t’assure que sans toi ma dernière Josiane (la plus belle, celle qui fleur(e) bon l’encre et le papier) ne serait vraiment pas ce qu’elle est aujourd’hui, de même que ma vie à Marcoule et à Bagnols-sur-Cèze, petit village du sud (à dire avec l’accent). Et puisque je pars, je te souhaite pour la suite pleins de superbes encadrements de thèse, une carrière du tonnerre (je ne me fais pas trop de soucis à ce niveau-là) et tout le bonheur du monde (pour aujourd’hui comme pour demain).
Mais revenons au terreau. Je l’ai évoqué plus haut, mais quelle qualité ! quelle fertilité ! Que de nutriments (apportés généralement sous formes de gâteaux au café du matin) ! J’adresse ici
1 Ceci n’est pas un placement de produit.
Sur le verre sain, il y a du gel. Plus il y a de gel, plus il y a de trous. Plus il y a de trous, moins il y a de gel. Donc plus il y a de gel, moins il y a de gel.
6
quelques améliorations sur la forme). Merci à Jean-Louis et Jean-Pierre pour les blagues plus ou moins douteuses que j’ai subies trois années durant (j’ai jeté mes bergamotes et le jumelage de Longwy et Cournon restera gravé dans ma tête). Merci à Pierre, Nicole, Patrick et Loïc pour leurs conseils scientifiques plus ou moins compréhensibles (désolée Pierrot). Merci à Frédéric, Olivier, Manu, Géraldine, Chantal, Yves et Manon pour leur présence au quotidien, et plus particulièrement au moment des questions. Merci aussi à la meilleure des secrétaires, Fabienne, que j’ai réussi à coller du début à la fin grâce à un subtil changement de laboratoire en cours de thèse ! Vous avez tous été formidables et vous allez énormément me manquer (sauf un ou une2). J’ai quand même une complainte : ça va pas de mettre la barre si haute ? Je fais comment pour retrouver un labo comme ça maintenant ???
Assez parler feuillage (et je commence à manquer d’idées), parlons plutôt des membres des labos d’à côté (littéralement pour le LDMC ou le LDPV, de l’autre côté de la rue pour le LMPA). Merci à Bruno, Lionel, Muriel, Myriam, et Jennifer pour m’avoir aidée dans mes analyses, et à Christophe, Magaly et Sylvain pour les discussions toujours enrichissantes que nous avons pu échanger. Merci aussi à Laurent Dupuy, sans qui ce manuscrit serait bien plus léger puisque vide de tous profils ToF-SIMS ! Merci également à tous les autres car même si nous n’avons pas forcement interagi professionnellement, c’était toujours un plaisir de pouvoir discuter avec vous !
Cette thèse n’aurait pas eu la même dimension sans tous les chercheurs passionnés qui y ont contribué. Un grand merci à l’équipe RMN de Saclay, Thibault et Mélanie, pour m’avoir aidée dans mes analyses et interprétations de résultats, et pour m’avoir fait découvrir quelques très bons restaurants dans les coins de Gif-sur-Yvette. Thibault, j’espère avoir le plaisir de retravailler avec toi un jours ! Même espoir de futures collaborations incluant tous les membres de l’EFRC WastePD avec qui j’ai eu le privilège de travailler et d’échanger. Je pense notamment à Jincheng Du et Thiruvillamalai Mahadevan de NTU et aux équipes de PNNL et Penn State. Un grand merci aussi à Ian Bourg, qui a eu la gentillesse de m’accueillir trois mois durant à Princeton pour me former à la dynamique moléculaire. Ian, ta bonne humeur et ta pédagogie sont une force extraordinaire, et j’espère pouvoir collaborer une nouvelle fois avec toi dans le futur!
De Princeton, j’en suis revenue riche de connaissances certes, mais également riche de quelques amis en plus, et particulièrement Baptiste, Victor et Isabel. Merci à vous trois de m’avoir offert
7 trois mois de souvenirs inoubliables (au point que je ne voulais plus repartir, mais ça c’est un classique) !
Des amis, j’en ai aussi rencontrés quelques-uns à Marcoule. Thomas et Mathieu par exemple ! Deux ans et demi à se supporter (dur !), mais surtout à se soutenir les uns les autres (belle !), ça forge les caractères. Merci à vous deux, je retiens de ce temps partagé : des gobelets à café touchant le plafond, une saga d’enfer pour un fauteuil, quelques photos « particulières » accrochées partout dans mon bureau, etc etc. Rendez-vous dans 10 ans dans une ambassade quelconque où le Sir Ducasse aura élu domicile, ou bien au fameux consulat de Laudun !
Et puis il y a tous les amis du 438 (encore et toujours debout malgré les annonces constantes de son imminente destruction). Leila, Mathilde, Nicolas, Sathya, Thibault et Trilce, je ne dirais qu’une chose : ughyougueugou, et cœur sur vous. Valentine, dite Val la brutale, tu as été ma première stagiaire et tu as assuré ! Dylan (comment qu’c’est gros ?), Hélène (dont la proximité de bureau t’a valu de supporter mes nombreuses exclamations parfois peu polies…), Judith et Seb (arrêtez de lécher des cailloux svp), mes plus vieux compagnons du LDMC : merci et courage pour la suite. Et puis merci à vous tous :
- les doctorant·e·s : Amreen, Anne, Anne-Lise, Boris, Cloé, Luiz, Maria, Pierrick, Valou, Victor (encore merci pour le post-doc !!!)…
- Le post-doc : Nicolas.
- Les stagiaires : Alexandre (dit Raton), Alexis, Baptiste, Benjamin (dit l’insolent), Brian, Laura, Marion…
- Les alternant·e·s et CDD : Alexandra la brune et Alexandra la rousse, Bastien, Carine, Lena, Marine, Victoria…
Marcoule, c’est aussi Aisther, la meilleure des assos qui m’a permis de rencontrer énormément de gens formidables. Un gros bisous à tous, vous allez me manquer, mais on se reverra (et pour certains même plus tôt que prévu : Céline et Claire, on se voit sur Orléans !)
Un gros bisous aussi à mes amis qui m’ont soutenue pendant la thèse, je pense notamment à la licence Kinder, à la team C2RMF 2014 et à mes amis de Manaa et du lycée. Où que vous soyez, je vous embrasse !
Enfin, je termine ces quelques pages sur les classiques remerciements à ma famille. Merci à mes parents pour leur soutien sans faille lors de cette aventure à l’autre bout de la France (et par moment à l’autre bout de l’Atlantique). Promis maman, je vais essayer de donner plus de nouvelles ! Merci à ma sœur que j’aime, je ne vais pas écrire toutes les bêtises auxquelles je pense sous peine de décrédibiliser totalement l’intégralité de ce manuscrit, mais quand même : slurp. Gros bisous à ma nièce qui reste plus belle et plus classe que nous tous (en toute objectivité). Merci enfin aux grands-parents, aux oncles et tantes et aux cousins-cousines qui n’ont pas forcement compris ce que je faisais mais c’est pas grave. Je passerai le bonjour à Tofsims et Borosilicate de votre part en faisant couler de l’eau sur des vitres.
9
Résumé
Ce travail de thèse s’intéresse aux interactions entre la solution et la pellicule d’altération, appelée gel, qui se forme lors de la lixiviation des verres borosilicatés d’intérêt nucléaire, et plus spécifiquement dans ce travail, sur le verre à six oxydes International Simple Glass. Afin de mieux comprendre les mécanismes de formation du gel, ainsi que ses propriétés de passivation, une étude combinant analyses expérimentales et simulations de dynamique moléculaire (DM) est réalisée.
Dans un premier temps, l’étude se focalise sur la structure du verre sain dans le but de mieux appréhender les processus de lixiviation. Pour ce faire, des analyses par spectroscopie RMN sont réalisées. Les résultats sont comparés à ceux obtenus par DM afin de valider la simulation. Cette dernière permet alors une exploration complète de l’ordre à courte et moyenne distances. Elle montre en outre une distribution homogène des formateurs de réseau et l’absence de zones enrichies en bore. Ce dernier, que l’on sait fortement soluble, a tendance à fragmenter le réseau silicaté, affectant de ce fait sa réactivité.
Les processus de formation du gel sont ensuite étudiés expérimentalement, dans des conditions favorisant la passivation (90 °C, pH 7, solution saturée en silice). Nous mettons en évidence un fort effet des éléments exogènes en solution, notamment les alcalins faiblement hydratés tels que le potassium et le césium. Ces derniers entrainent ainsi une chute marquée de l’altération du verre. Afin de comprendre cet effet, les gels formés en présence de différents alcalins sont caractérisés. Les analyses montrent un départ congruent du bore et du sodium, et une incorporation du potassium et du césium de la solution qui prennent le rôle de compensateur de charge des unités [AlO4]- assuré par le calcium dans les gels formés en milieux sans alcalin ou contenant des alcalins fortement hydraté comme le lithium ou le sodium. Les différents gels présentent des degrés d’hydratation variés, en accord avec les résultats de simulation de DM de la diffusion de l’eau dans une silice nanoporeuse en milieu alcalin. Ces simulations montrent que la combinaison d’effets stériques (taille des alcalins) et physico-chimiques (énergie d’hydratation) entraine une diminution de la quantité d’eau dans les porosités contenant des ions potassium ou césium.
Par ailleurs, les différents gels obtenus dans les conditions d’altération précitées sont fortement polymérisés, indiquant une réorganisation du réseau silicaté à la suite du départ des éléments facilement hydrolysables comme le bore. Cette réorganisation a lieu sans hydrolyse complète des tétraèdres de silicium, ce qui invalide dans ce cas le modèle de formation des gels par dissolution congruente/précipitation. La spéciation de l’eau au sein du gel, obtenue en combinant ATG et RMN du proton, permet de plus de déterminer quantitativement la répartition des atomes d’oxygène au sein du gel (atomes d’oxygène pontants, non pontants ou H2O).
Ces données sont alors utilisées pour l’interprétation d’expériences de traçage en milieu enrichi en eau marquée en 18O d’échantillons pré-altérés. Ces expériences, menées à différentes températures, mettent en évidence pour la première fois une réorganisation continue du réseau du gel, avec une diminution au cours du temps de l’accessibilité des espèces mobiles (H2O et hydroxyles) au verre sain du fait de la maturation de la porosité au sein du gel. Nous déterminons différentes diffusivités pour l’eau en fonction de la topologie du gel et proposons l’hypothèse que cette atténuation progressive de la réactivité du réseau soit à l’origine du caractère passivant du gel.
11
Abstract
This work aims at understanding water interactions with the altered layer, called gel, formed during borosilicate nuclear glass corrosion. Specifically, we focus on the corrosion of the six oxides ISG. To better understand gel formation mechanisms, as well as gel passivating properties, experimental studies are combined to molecular dynamics simulations.
First, this study focuses on the characterization of the pristine glass structure. Experimental analysis (NMR) provides some information to validate the simulated structure. As a result, an improved understanding of the pristine glass short- and medium-range orders is obtained. We also observe that network formers are homogeneously distributed, with no area enriched in boron for instance. Boron is known to be highly soluble, and tends to divide the silicate network, which would affect its reactivity.
The gel formation is then studied experimentally in conditions favoring the passivating effect of the glass (90 °C, pH 7, silica-saturated solution). A strong effect of exogenous elements in solution, particularly weakly hydrated alkalis such as potassium and cesium, is observed, with a notable decrease of glass corrosion. To better understand this effect, all gels are characterized. A congruent release of boron and sodium is observed, while potassium and cesium are incorporated. They then act as charge compensator for [AlO4]- units. Calcium usually plays this role in gels formed in solutions with no alkali or containing strongly hydrated alkali such as lithium and sodium. The hydration degree differs for the various gels present, as confirmed by MD simulation of water diffusion in nanoporous amorphous silica in presence of alkali. These simulations highlight a combined impact of sterical effects (alkali size) and physicochemical effects (hydration energy) leading to a decrease of water quantity in the nanopores containing potassium and cesium.
Moreover, all the gels formed in the above mentioned leaching conditions are highly polymerized, which indicates a reorganization of the network following the leaching of hydrolysable species such as boron. This reorganization happens without complete hydrolysis of silicon atoms, which invalidate the congruent dissolution/precipitation model in this case. Water speciation inside the gel is determined combining TGA and NMR, giving access to quantitative oxygen repartition in the gel (bridging oxygen, non-bridging oxygen or H2O).
This data are then used for the interpretation of tracing experiments carried out in H218O rich solution on prealtered samples. The results demonstrate for the first time that the network reorganizes continuously over time, with a decrease of mobile species (H2O and hydroxyls) accessibility due to the maturation of the porosity within the gel. We determine various water diffusivities as a function of the gel topology and propose the hypothesis that this decreasing reactivity of the network is the source of the passivating nature of the gel.
13
Table des matières
Remerciements ... 5
Résumé ... 9
Abstract ... 11
Table des matières ... 13
Préambule... 17
Introduction ... 20
Références ... 24
Chapitre 1 ... 28
Synthèse bibliographique ... 28
1. Structure des verres silicatés d’intérêt nucléaire ... 29
1.1. Généralités ... 29
1.1. Structure des verres simulée par dynamique moléculaire ... 30
2. Altération des verres et formation de la pellicule d’altération ... 32
2.1. Phénoménologie de l’altération des verres nucléaires ... 32
2.2. Impact de la structure des verres sur leur comportement à long terme... 34
2.3. Rappels sur les caractéristiques de la pellicule d’altération ... 36
3. Réactivité et mobilité : étude de la dynamique de l’eau au sein d’un milieu poreux 39 3.1. Spéciation de l’eau ... 39
3.1.1. Spéciation de l’eau : études par Spectroscopie infrarouge et Raman ... 40
3.1.2. Spéciation de l’eau : études par Résonance Magnétique Nucléaire... 43
3.2. Géochimie en milieu nanoporeux : étude de la dynamique de l’eau confinée ... 46
3.2.1. Etudes des fluides nanoconfinés : analyse de matériaux nanoporeux hydratés ... 46
3.2.2. Apports de la simulation de dynamique moléculaire ... 48
Conclusion du chapitre ... 52
Références ... 53
Chapitre 2 ... 62
Plan d’actions ... 62
1. Choix du verre à étudier ... 63
2. Expériences de lixiviation ... 65
3. Etude chimique et structurale du verre et du gel ... 68
14
5. Etude de la mobilité de l’eau ... 72
6. Etude de la réactivité de l’eau ... 73
Références ... 75
Chapitre 3 ... 78
Structure et propriétés de la couche passivante formée en conditions proches de la neutralité ... 78
1. Résumé de l’article “Structure of International Simple Glass and properties of passivating layer formed in circumneutral pH conditions” ... 79
2. Article: Structure of International Simple Glass and properties of passivating layer formed in circumneutral pH conditions ... 79
Graphical Abstract ... 80
Abstract ... 80
Introduction ... 81
1. Methods ... 82
a. Molecular dynamic simulations ... 82
b. Leaching Experiments ... 83
c. Solid analysis ... 85
2. Results ... 87
a. Molecular dynamics simulations ... 87
b. Alteration kinetics ... 91
c. Solid analysis ... 91
d. Water Speciation analysis ... 96
3. Discussion ... 98
a. Pristine glass and gel structures ... 98
b. Water speciation and porosity analysis ... 100
Concluding remarks ... 104
References ... 106
Chapitre 4 ... 112
Effets des alcalins sur la passivation du verre ... 112
1. Résumé de l’article “Do alkalis affect the passivation of silicate glass?” ... 113
2. Article : Do alkalis affect the passivation of silicate glass? ... 113
Abstract ... 113
Introduction ... 114
1. Methods ... 115
15
b. Solid analysis ... 116
2. Results ... 119
a. Alteration kinetics ... 119
b. Gel composition ... 121
c. Structural analysis of the pristine glass and gels... 122
d. Free volume calculation ... 124
e. Water Speciation analysis ... 125
3. Discussion ... 128
a. Effect of alkalis on glass alteration ... 128
b. Aging effect on gel structure ... 130
Concluding remarks ... 132
References ... 134
Chapitre 5 ... 140
Mobilité de l’eau nanoconfinée : traçages isotopiques et dynamique moléculaire... 140
1. Mobilité de l’eau : traçages isotopiques à température ambiante ... 141
1.1. Matériels et méthodes ... 141
1.2. Résultats ... 143
1.3. Discussion ... 146
2. Mobilité de l’eau : simulations de dynamique moléculaire ... 149
2.1. Résumé de l’article “Molecular Dynamics Simulations of Water Structure and Diffusion in a 1-nm-diameter Silica Nanopore as a Function of Surface Charge and Alkali Metal Counterion Identity” ... 149
2.2. Article “Molecular Dynamics Simulations of Water Structure and Diffusion in a 1-nm-diameter Silica Nanopore as a Function of Surface Charge and Alkali Metal Counterion Identity” ... 150
Graphical Abstract ... 150
Abstract ... 150
Introduction ... 151
1. Methodology ... 153
2. Results and discussion ... 159
3. Conclusion ... 170
Références ... 174
Chapitre 6 ... 182
Réactivité de l’eau nanoconfinée : étude expérimentale ... 182
1. Matériels et méthodes ... 183
16
2.1. Réactivité d’un gel néoformé ... 185
2.2. Réactivité d’un gel mature ... 187
3. Discussion ... 190
Références ... 194
Conclusion ... 198
Liste des figures ... 205
Annexes ... 213 Annexe I ... 214 Annexe II... 216 Annexe III ... 228 Annexe IV ... 239 Annexe V ... 245
17
Préambule
Cette thèse a bénéficié d’un financement de l’US Department of Energy (DOE) dans le cadre de l’Energy Frontier Research Center (EFRC) Center for Performance and Design of Nuclear Waste Forms and Containers (WastePD) en collaboration avec 8 Universités et Centres de recherches américains.iii
20
Introduction
Imaginons deux découvertes scientifiques majeures, ayant pour point commun d’être accidentelles : le verre et la radioactivité. Séparées de plusieurs millénaires, ces deux découvertes ont très certainement marqué l’histoire de l’humanité, et restent actuellement très usitées.
Prenons le verre : il existe naturellement sur terre, mais les vitesses rapides de refroidissement nécessitant sa formation font qu’on ne le trouve qu’en petites quantités à proximité, notamment, des volcans. Les verres de ce type les plus courants sont les verres basaltiques. D’autres verres naturels, comme les obsidiennes, se forment à la suite d’éruptions volcaniques d’un magma riche en silice. Les obsidiennes sont utilisées dès la préhistoire, pour se défendre et chasser du fait de leur dureté et de leur tranchant, mais également pour se parer, le brillant du matériau attirant l’œil. La production humaine de verre, fortuite si l’on en croit les écrits de Pline l’Ancien, débute bien plus tard dans le bassin méditerranéen, vers le Vesiècle avant notre ère :
« On raconte que des marchands de nitre y ayant relâché, préparaient, dispersés sur le rivage, leur repas; ne trouvant pas de pierres pour exhausser leurs marmites, ils employèrent à cet effet des pains de nitre de leur cargaison : ce nitre soumis à l’action du feu avec le sable répandu sur le sol, ils virent couler des ruisseaux transparents d’une liqueur inconnue, et telle fut l’origine de verre. » Pline l’Ancien, Histoire naturelle, XXXVI, 65.
La production de verre se perfectionne rapidement, et l’emploi à la fois fonctionnel et décoratif du verre se répand et perdure au fil des siècles : l’utilisation d’objets du quotidien à l’époque romaine est ainsi suivie, au moyen âge, par la production de somptueux vitraux ornant églises ou cathédrales et dont la Sainte Chapelle, située sur l’île de la Cité à Paris, est un exemple magistral. L’histoire du verre connait ensuite de nombreuses périodes de déclin, les secrets de fabrication transmis oralement se perdant facilement, et de renouveau. La fin du XIXe siècle est une période d’essor pour la production verrière, la révolution industrielle apportant avec elle de nouvelles techniques de fabrication et des outils de production à grande échelle. Aujourd’hui, les champs d’utilisation du verre sont aussi vastes que variés. Une des applications du verre, peu connue du grand public, est la stabilisation des déchets radioactifs à vie longue par incorporation dans le réseau vitreux. Le comportement à long terme de ces matrices de stockage est l’objet de cette étude.
Mais parlons d’abord de la provenance de ces déchets. La radioactivité, découverte et étudiée par Henri Becquerel puis Marie et Pierre Curie à la fin du XIXe siècle, est d’abord utilisée à des fins militaires. A partir des années 1950, une autre de ses applications se développe : la production d’énergie. Son utilisation en France est intensive : le nucléaire représente actuellement plus de 70 % de la production d’électricité. Si cette énergie est relativement neutre
21 en termes de rejets de CO2, elle produit en revanche des déchets radioactifs dont les plus dangereux proviennent du combustible nucléaire usé. Bien que la France ait choisi de recycler ce dernier afin de réutiliser l’uranium et le plutonium qu’il contient encore, il résulte de ce recyclage environ 4 % de déchets dits « ultimes », hautement radioactifs et contenant des isotopes de demi-vie très longue comme 129I, 36Cl, 79Se, ou encore 135Cs. Ces déchets sont incorporés dans une matrice de verre borosilicaté devant, à terme, être stockée en milieu géologique profond afin de limiter au maximum la dispersion des radionucléides dans la biosphère. La France a choisi les argilites du Callovo-Oxfordien situées au nord-est du bassin parisien pour ce projet de stockage géologique. Cette couche, d’environ 100 mètres d’épaisseur, est située à près de 500 mètres de profondeur. Elle a fait l’objet d’études approfondies depuis 20 ans notamment par le biais du laboratoire souterrain de Meuse-Haute Marne. 1 Ce projet, appelé Cigéo (Centre industriel de stockage géologique), repose sur un concept multi-barrières de confinement des radionucléides. Les barrières envisagées incluent ainsi :
- Les enveloppes métalliques (conteneur en acier inoxydable et surconteneur en acier non allié) entourant la matrice de verre qui doivent protéger cette dernière de l’arrivée d’eau souterraine.
- La matrice de verre qui, une fois les différentes enveloppes métalliques corrodées, doit limiter la diffusion des radionucléides de par sa résistance à l’altération.
- La couche argileuse elle-même qui doit servir de dernier rempart de par ses propriétés de rétention des radionucléides, ainsi que sa faible perméabilité.
Dans ces conditions, sachant que l’eau souterraine saturant la couche d’argile devrait entrer en contact avec le verre après plusieurs milliers d’années, il apparait nécessaire de pouvoir développer des modèles de prédiction de l’altération du verre fiables pour asseoir la démonstration de sûreté du site.
Le développement de tels modèles passe notamment par une bonne compréhension des mécanismes d’altération du verre en milieu aqueux. Les études réalisées jusqu’à présent ont permis de mettre en évidence plusieurs phénomènes, détaillés dans le premier chapitre de cette thèse. Ce chapitre s’attache à retracer l’état de l’art actuel sur l’altération du verre et sur la formation de la couche d’altération, appelé gel dans la suite de ce manuscrit. Nous verrons que les caractéristiques physico-chimiques de ce gel vont en effet dépendre de la structure du verre sain et des conditions d’altération. Le gel présente des propriétés passivantes et, dans certaines conditions, des pores de très petite taille, soulevant la question de la dynamique de l’eau nanoconfinée, dernier point abordé dans ce chapitre bibliographique.
Ce gel reste encore mystérieux à l’heure actuelle, malgré son étude par différentes communautés. En effet, ce type de couche passivante se forme sur les verres de différentes compositions, mais également sur des minéraux d’intérêt pour les géologues. Ces couches interrogent donc les scientifiques dans de nombreux champs disciplinaires. Les mécanismes
22
régissant leur formation ne sont pas encore totalement explicités, bien qu’ils répondent à des contraintes thermodynamiques (règles d’Ostwald par exemple dans le cas des minéraux). De plus, malgré leur appellation de couche « passivante », seules des preuves indirectes de ce caractère protecteur ont été observées, ne permettant pas une modélisation détaillée des mécanismes en jeu.
Dans le cas des verres nucléaires, afin de mieux appréhender la formation du gel et ses interactions avec l’eau, une approche pluridisciplinaire a été envisagée, combinant études expérimentales et numériques. Cette approche est détaillée dans le deuxième chapitre. Le choix du verre étudié, un verre borosilicaté à six oxydes (verre ISG pour international simple glass), y est explicité. La structure du verre sain est étudiée en profondeur, en combinant étude expérimentale et des simulations de dynamique moléculaire. Les conditions de lixiviation (milieu saturé en silice amorphe, 90 °C et pH proche de la neutralité, présence ou non d’alcalins en solution), choisies afin de limiter les paramètres impactant les mécanismes de formation du gel, sont ensuite détaillées. Les gels ainsi formés sont caractérisés au plan structural, mais également par des études de la spéciation et la dynamique de l’eau en leur sein. Ces caractérisations combinent de nombreuses méthodes d’analyses expérimentales, telles que la résonance magnétique nucléaire, l’analyse thermogravimétrique, la spectroscopie infrarouge, etc., mais également des simulations de dynamique moléculaire de la diffusion de l’eau en milieu nanoconfiné. Toutes les méthodes utilisées au cours de la thèse sont donc détaillées dans le deuxième chapitre en fonction de leurs avantages et limites, considérant l’objectif visé.
Les résultats acquis sont présentés et discutés dans les chapitres suivants. L’étude se scinde alors en deux grands axes : résultats acquis au cours de la caractérisation du gel, puis de ceux obtenus lors de l’étude de la dynamique de l’eau en son sein.
Afin de simplifier leur compréhension, les observations et conclusions sur la formation du gel, ainsi que sur la caractérisation de ses propriétés physico-chimiques et structurales, ont été séparées en deux chapitres. Le chapitre 3 résume ainsi les résultats obtenus dans un milieu d’altération simple, avec une emphase sur les études structurales comparant verre sain et gel. Le chapitre 4 présente les résultats obtenus en milieux plus complexes, et compare entre eux les différents gels formés. Ces deux chapitres suivent une démarche similaire, avec l’étude des cinétiques d’altération dans un premier temps, puis une caractérisation complète des matériaux formés et une détermination de la spéciation de l’eau au sein des gels.
Les deux derniers chapitres décrivent le caractère passivant de ce gel. La détermination de la spéciation de l’eau permet en effet de réaliser un suivi quantitatif des échanges pouvant intervenir entre le gel et la solution. Ces échanges, selon la température, apportent des informations sur la diffusion (Chapitre 5) et/ou la réactivité de l’eau (Chapitre 6) au sein du gel.
23 Les résultats obtenus dans le cadre de cette thèse valident la démarche suivie pour mieux appréhender les mécanismes de passivation du verre. Ainsi, en combinant des méthodes expérimentales et numériques, une compréhension structurale approfondie d’un verre contenant six oxydes est atteinte. Le développement de nouveaux potentiels de calcul présage d’une possibilité de complexifier encore les compositions de verre par la suite. Ce travail apporte également de nombreuses conclusions sur les mécanismes de formation, dans les conditions considérées, du gel, ainsi que sur ses propriétés physico-chimiques. Enfin, l’utilisation novatrice de traceurs isotopiques permet de proposer de nouvelles hypothèses sur l’origine de son caractère passivant. Il est alors possible d’envisager une application généralisée d’une telle démarche expérimentale pour, à terme, expliciter les mécanismes de l’altération des verres sur une vaste gamme de compositions et de conditions d’altération.
La plupart des travaux présentés dans ce manuscrit ont fait l’objet de publications dans des revues à comité de lecture. De ce fait, certains chapitres de ce manuscrit de thèse adoptent la structure proposée dans les différents articles publiés en premier auteure.
24
Références
1 ANDRA. Recherche de l'ANDRA sur le stockage géologique des déchets radoactifs à
Chapitre 1
28
Chapitre 1
Synthèse bibliographique
Les travaux de thèse présentés dans ce manuscrit s’attachent à décrire les interactions entre l’eau et la couche amorphe appelée gel, formée au cours de l’altération des verres silicatés d’intérêt nucléaire. Ce premier chapitre dresse un état de l’art des différents points développés dans la suite de ce manuscrit afin d’en faciliter la compréhension.
Nous présentons dans un premier temps la structure des verres, puis la phénoménologie de l’altération de ces derniers. Les mécanismes de formation de la couche d’altération passivante sont ensuite explicités, avec un focus particulier sur la formation de la partie amorphe appelée gel que nous étudierons par la suite. Les caractéristiques physico-chimiques de ce gel sont également présentées.
Dans un second temps, l’intérêt se porte sur l’eau confinée au sein du gel. Les méthodes analytiques donnant accès à la spéciation de l’eau sont présentées, puis les méthodes d’étude de la dynamique et la réactivité de l’eau nanoconfinée, et plus particulièrement la simulation de dynamique moléculaire.
29
1. Structure des verres silicatés d’intérêt nucléaire 1.1. Généralités
Le verre est un solide amorphe : l’agencement des atomes le constituant ne présente pas d’ordre particulier à grande distance, bien que sa structure à l’échelle subnanométrique fasse apparaitre un ordre. Différents types de verres existent, allant du verre de silice simple à des verres de compositions beaucoup plus complexes. Les verres d’intérêt nucléaire sont des borosilicates pouvant contenir jusqu’à une trentaine d’oxydes. Les éléments composant ce type de verre peuvent être répartis en trois grandes catégories 1 :
- les oxydes formateurs de réseau composant la matrice vitreuse (SiO2, B2O3, etc.), - les oxydes modificateurs de réseau (alcalins et alcalino-terreux, terres rares entre
autres),
- les oxydes intermédiaires qui peuvent assurer le rôle de formateur ou modificateur de réseau selon la composition du verre (ZrO2, Al2O3, ZnO etc.) Dans les verres nucléaires, Al et Zr sont des formateurs de réseau. 2
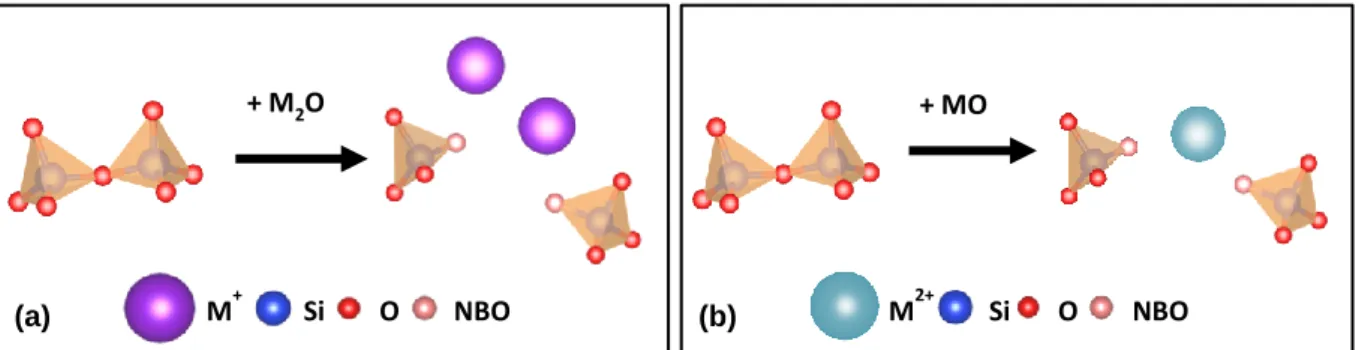
Les oxydes formateurs se présentent sous forme de polyèdres MOn(ou M = Si, Zr, Al…), n définissant la coordinence de l’élément formateur. On trouve ainsi la silice sous forme de tétraèdres [SiO4]. 3 Le bore coexiste dans les verres sous forme de trièdres (appelés par la suite B[3]) et de tétraèdres (B[4]). 4,5 Le réseau vitreux borosilicaté est constitué de ces entités de base qui sont liées entre elles par les atomes d’oxygène. On parle alors d’oxygène pontant (ou BO pour bridging oxygen). La répartition B[3]/B[4] peut par ailleurs être déterminée à partir de modèles simples basés sur la composition du verre 4-6, ou par spectroscopie RMN du 11B. 7 Les unités [BO4]- présentent une charge négative, tout comme les unités [AlO4]- et [ZrO6]2-, et sont compensées par les cations alcalins ou alcalino-terreux. 5,8 Si ces derniers sont introduits en excès par rapport aux unités structurales à compenser, ils entrainent alors une dépolymérisation du réseau avec rupture de liaison siloxane et formation d’oxygènes non-pontants (aussi appelé NBO pour non-bridging oxygen), comme montré sur la figure ci-dessous.
La terminologie Qn permet de préciser le nombre n d’oxygène pontant entourant un formateur de réseau. Ainsi, dans le cas d’un tétraèdre de silicium [SiO4], Q1 désigne un Si entouré de 1 BO et 3 NBO, alors qu’un Q4 désigne un Si entouré de 4 BO. Dans le cas de compositions simples, la répartition des Qn du silicium peut-être déterminée par spectroscopie RMN du 29Si 9,10 ou par spectroscopie Raman 7,11,12. Dans le cas de compositions plus complexes, la quantification des espèces n’est généralement pas possible car les signaux obtenus sont fortement dépendants des seconds voisins. 9
30
Figure 1 | Représentation de la dépolymérisation du réseau silicaté résultant de la présence (a) d’alcalins M+ et
(b) d’alcalino-terreux M2+, entrainant la formation d’oxygènes non-pontants (NBO).
En compilant les données expérimentales disponibles, différents modèles structuraux ont été présentés, évoluant avec le temps et le développement de nouvelles techniques analytiques. Le réseau, autrefois considéré comme totalement aléatoire et homogène, 1 est aujourd’hui considéré comme présentant des hétérogénéités mésoscopiques. Le consensus actuel établi par Greaves 13 est que, dans le cas où les cations sont essentiellement modificateurs de réseau et non compensateurs de charge, alors la structure du verre est constituée de deux sous-réseaux interconnectés :
- un réseau riche en formateur de réseau et en BO. - un « réseau » riche en NBO et en cations.
Cette ségrégation entrainerait la formation de canaux dits de « percolation » facilement hydrolysables. Nous verrons par la suite que l’altération d’un verre est fortement dépendante de sa structure.
1.1. Structure des verres simulée par dynamique moléculaire
Les méthodes analytiques actuelles ne permettent pas d’expliciter la structure des verres complexes et notamment de préciser le degré d’ordre à moyenne et longue distance. Le développement de méthodes de simulation numérique ainsi que l’accroissement exponentiel des capacités de calculs ont permis la simulation de structures vitreuses. Trois méthodes permettent actuellement ce type de simulations : la dynamique moléculaire ab initio, la dynamique moléculaire classique, et la méthode Monte-Carlo Hydride. 14
La dynamique moléculaire (DM) permet la simulation de structures en calculant les trajectoires des atomes d’un système de petite taille (de quelques centaines à quelques milliers d’atomes suivant les méthodes) au cours du temps. Pour ce faire, les équations classiques du mouvement sont appliquées à chaque atome 15, considéré comme une masse ponctuelle :
𝑓1 ⃗⃗⃗ = 𝑚𝑖𝑎⃗⃗⃗ 𝑖 (1) (b) + MO M2+ Si O NBO + M2O M+ Si O NBO (a)
31 Où 𝑓⃗⃗⃗ est la somme des forces s’exerçant sur un atome i, mi est la masse de l’atome i et 𝑎1 ⃗⃗⃗ est 𝑖 son accélération. Dans le cas de la DM ab initio, les premiers principes de la mécanique quantique sont utilisés pour calculer les forces d’interaction. Dans le cas de la DM classique, les forces dérivent de potentiels d’interactions atomiques simplifiés. 16
La DM ab initio est contraignante car elle requiert des capacités de calcul importantes pour des systèmes de très petite taille (quelques centaines d’atomes). Elle s’attache en effet à décrire le cortège électronique des atomes avec l’approximation de Born-Oppenheimer. Actuellement, cette méthode permet de simuler des verres simples binaires (Si-B) 17 à ternaires (Si-B-Na/Li/K). 18,19 Aucun système vitreux plus complexe n’a été étudié jusqu’à présent.
La DM classique nécessite moins de temps de calcul et peut être appliquée à des systèmes plus importants (jusqu’à plusieurs dizaines de milliers d’atomes) selon le type de potentiels utilisés. Au contraire de la DM ab initio, la DM classique considère les atomes comme des charges ponctuelles, ce qui simplifie les calculs. Ces potentiels semi-empiriques sont préalablement obtenus en ajustant les paramètres de simulations sur des propriétés physiques connues telles que les constantes élastiques. 20 De nombreux potentiels existent pour la simulation de structures silicatées 21,22, et borosilicatées tels que les potentiels Born-Mayer-Higgins (BMH) 23. La configuration de ces potentiels n’est cependant pas dépendante de la composition, ce qui entraine des écarts entre les propriétés physico-chimiques des structures simulées et les résultats expérimentaux. De nouveaux potentiels ont récemment été développés pour pallier cette limitation. 24,25 Ces potentiels sont dotés de charges atomiques dépendantes de la composition et d’interactions de paires à courte distance assurant un temps de calcul efficient. Ces nouveaux potentiels permettent de reproduire correctement des structures de verres boroaluminosilicatés, et notamment les évolutions de la coordinence du bore en fonction de la composition. 24-26
La méthode Monte-Carlo Hybride diffère des deux méthodes précédentes car elle ne résout pas d’équation du mouvement. Elle utilise des procédés de tirages au sort aléatoires qui permettent l’exploration stochastique de différentes configurations d’un système, configurations qui sont ensuite validées selon des critères d’acceptation liés aux potentiels de DM classique. 16 Cette méthode a permis la simulation récente d’un verre nucléaire à six oxydes (Si-B-Na-Al-Ca-Zr) appelé ISG, qui sera étudié par la suite dans ce travail de thèse. 27
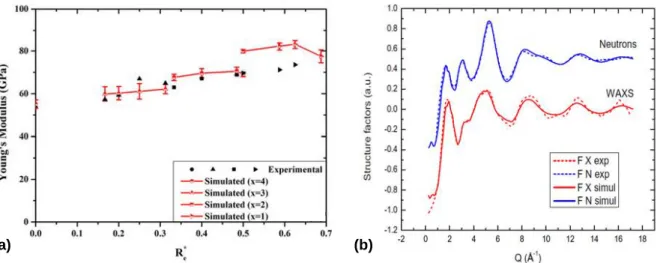
Les structures résultant de ces différentes méthodes de simulation sont validées par comparaison avec des propriétés physiques obtenues expérimentalement. 25,27,28 Il est ainsi possible de calculer des propriétés mécaniques (Figure 2 a), des longueurs et angles de liaisons, des facteurs de structures (Figure 2 b), des coordinences d’éléments, etc.
32
Figure 2 | Comparaison entre résultats expérimentaux et résultats de simulation : (a) propriétés physiques telles
que le module de Young 25, (b) facteurs de structures obtenus expérimentalement par diffraction des neutrons ou
par diffusion des rayons X aux grands angles (WAXS). 27 La bonne cohérence entre les résultats expérimentaux et
les résultats simulés indique que les potentiels choisis permettent de reproduire correctement la structure vitreuse étudiée.
Les structures simulées validées peuvent ensuite apporter des informations complémentaires aux techniques analytiques 29-31 : distribution des Qn, fonction de distribution de paires, taille des anneaux, compensation de charge, etc.
2. Altération des verres et formation de la pellicule d’altération 2.1. Phénoménologie de l’altération des verres nucléaires
La plupart des verres silicatés d’intérêt nucléaire, indépendamment de leur composition, présentent au contact de l’eau des processus d’altération communs, représentés schématiquement sur la Figure 3.
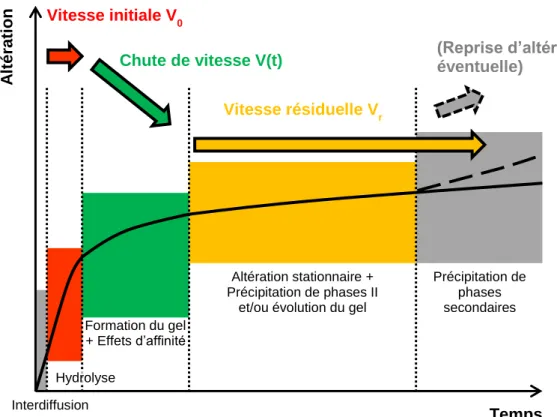
Dans un premier temps, l’eau pénètre dans la structure du verre. Ce phénomène d’hydratation entraine le départ préférentiel, appelé interdiffusion, d’espèces telles que les modificateurs de réseau (alcalins ou alcalino-terreux par exemple) ou de certains formateurs de réseau facilement hydrolysables comme le bore. A la suite de cette étape généralement très rapide, le passage en solution des différents constituants du verre devient congruent, ce qui signifie que tous les éléments présents dans le verre passent en solution à une vitesse identique. Ce régime est contrôlé par l’hydrolyse du réseau silicaté qui se fait à une vitesse maximale, aussiappelée
vitesse initiale et notée V0. 32,33
33 Figure 3 | Description de l’évolution de la vitesse d’altération d’un verre silicaté d’intérêt nucléaire au cours du
temps, et des phénomènes prépondérants expliquant le changement de régime de vitesse. 38
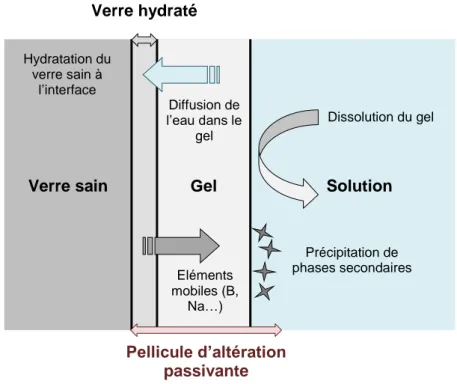
Dans les cas où la solution n’est pas renouvelée (on parle alors de milieu statique), l’hydrolyse est suivie d’une chute de vitesse s’expliquant par deux phénomènes : d’une part une diminution de l’énergie libre de Gibbs de la réaction de dissolution du verre que l’on traduit par l’approche d’un équilibre thermodynamique entre la solution et le réseau silicaté, réduisant le passage en solution de certaines espèces (en particulier le silicium), et d’autre part la formation à la surface du verre d’une pellicule d’altération passivante qui freine le transport diffusif des espèces aqueuses (Figure 4). 32 Cette pellicule peut être composée, selon les compositions du milieu altérant et du verre, d’une couche de verre hydraté, d’un gel obtenu par des réactions de condensation et/ou de précipitation des composants du verre (Si, Al, Zr…) et de la solution, et de phases secondaires néoformées (Figure 4). Elle permet le plafonnement de la vitesse d’altération à une valeur quasi constante ou faiblement décroissante appelée vitesse
résiduelle. 32,33 Le pouvoir passivant du gel dépend de la formation de phases secondaires
thermodynamiquement plus stables.
Enfin, il arrive parfois que des phases secondaires de type zéolithes précipitent massivement au détriment du gel, entrainant une reprise d’altération. Ceci n’est généralement observé que pour des pH très alcalins ou des températures élevées, et n’intervient donc pas dans les conditions étudiées par la suite. 33-36
A lt éra ti o n Temps Vitesse initiale V0 Chute de vitesse V(t) Vitesse résiduelle Vr (Reprise d’altération éventuelle) Interdiffusion Hydrolyse Formation du gel + Effets d’affinité Altération stationnaire + Précipitation de phases II
et/ou évolution du gel
Précipitation de phases secondaires
34
Figure 4 | Représentation schématique des mécanismes de formation de la pellicule d’altération (verre hydraté +
gel + phases secondaires) à la surface d’un verre en contact avec une solution. 38
2.2. Impact de la structure des verres sur leur comportement à long terme
Nous avons vu précédemment que les mécanismes d’altération des verres silicatés d’intérêt nucléaire sont similaires quelle que soit la composition du verre étudié. Leurs durées sont en revanche fortement dépendantes de la structure des verres. Cette dernière est conditionnée par la composition du verre et son mode de refroidissement.
Le verre étudié dans le cadre de ces travaux étant composé de six oxydes (SiO2, B2O3, Na2O, Al2O3, CaO et ZrO2), cette partie ne se concentrera que sur l’effet de ces oxydes en particulier sur l’altération du verre. Tous les oxydes ne présentent pas la même résistance à la corrosion. Certaines liaisons, comme les liaisons B–O–B et B–O–Si, présentent des énergies d’hydrolyse plus faibles que celles des liaisons Si–O–Si ou Si–O–Zr/Al. 37 De fait, le bore est un élément facilement hydrolysable indépendamment de la composition du verre étudié. 32,38,39 On parle d’ailleurs de percolation des unités boratées, le départ de ces dernières étant irréversible et laissant derrière elles une porosité plus ou moins importante en fonction de la quantité de bore présente dans le verre sain. 40 Le Vycor, verre de silice poreux, est élaboré à partir d’un verre borosilicaté composé à ~96% de SiO4 et 4% de BO3-Na2O, dont le sous-réseau boraté est lixivié. 41
Les modificateurs de réseaux sont plus ou moins hydrolysables en fonction de leur rôle. Ainsi, le calcium et le sodium en position de compensateur de charge sont peu solubles. Le calcium est même connu pour augmenter la résistance des verres à la dissolution. 9,40 Introduits en excès,
Hydratation du verre sain à l’interface Diffusion de l’eau dans le gel Dissolution du gel Précipitation de phases secondaires
Verre sain Gel Solution
Eléments mobiles (B, Na…) Verre hydraté Pellicule d’altération passivante
35 ces éléments dépolymérisent le réseau. Ils sont alors facilement hydrolysables 42 (par des phénomènes d’interdiffusion) et, passé un seuil, entrainent la formation de canaux de percolation facilitant l’accès des molécules d’eau au réseau vitreux. Des simulations Monte-Carlo de borosilicates de sodium viennent corroborer ces observations : les verres fortement polymérisés sont plus résistants que ceux contenant de nombreux NBO. 43
Cela ne signifie pas, pour autant, qu’un verre contenant beaucoup d’espèces difficilement hydrolysables est forcément plus résistant à la corrosion. En effet, si le zirconium peut réduire la vitesse de corrosion d’un verre d’un facteur 5 à 25 (Figure 5 a), 9 les travaux de Cailleteau 44 montrent aussi que l’augmentation de la quantité de zirconium dans la structure des verres borosilicatés au-delà d’une certaine teneur empêche la formation d’un gel passivant ce qui conduit à une moindre résistance sur le long terme (Figure 5 b). 45,46
Figure 5 | Simulation (méthode Monte-Carlo cinétique) de la formation du gel d’altération en fonction de la
quantité de zirconium. (a) Les liaisons Si–O–Zr sont résistantes à la corrosion, les verres riches en Zr sont moins hydrolysés en V0 (t = 104 pas de temps). (b) La présence de Zr empêche cependant la formation du gel passivant à plus long termes (t = 3 × 105 pas de temps) ce qui rend le verre moins résistant à long terme. (Le silicium est représenté en rouge, le bore en jaune, l’eau en bleu, d’après Cailleteau, et al. 45.)
Le rôle de l’aluminium est ambivalent : s’il contribue à augmenter la résistance du réseau silicaté à l’hydrolyse, 47,48 il participe également à la formation de phases secondaires (de type argile ou zéolithe) au détriment du gel passivant, entrainant une vitesse résiduelle élevée, voire une reprise d’altération. 34,49,50
Un autre paramètre de structure pouvant modifier la durabilité chimique d’un verre est indépendant de la composition, mais dépendant des conditions d’élaboration du verre. Par exemple, la trempe thermique (refroidissement rapide) d’un verre crée des contraintes de tension dans sa structure, ce qui le rend mécaniquement plus résistant 51, alors que la trempe chimique (plongé du verre dans une solution de sels d’alcalin) permet le remplacement de modificateurs de réseaux dans la partie externe de la structure du verre, avec un effet non négligeable sur sa résistance physico-chimique. 52,53 L’effet d’une trempe très rapide sur un verre nucléaire a été étudié expérimentalement (300 à 0,5 K·min-1) et par simulation de dynamique moléculaire classique (1010 à 1015 K·s-1). 54-56 L’intérêt de ce type d’étude est de
36
comparer des verres de composition similaire mais dont la structure diffère en fonction du mode de refroidissement. La structure d’un verre refroidi rapidement est plus désordonnée, une partie des cations compensateurs de charge passe en position de modificateurs de réseau et la répartition B[3]/B[4] est modifiée. Ces études démontrent également que ce désordre structural influe sur la résistance à l’hydrolyse du verre : 57 les verres trempés présentant des V0 plus élevés que celui du verre recuit, ce qui est en partie imputé à l’augmentation du nombre d’unités B[3] plus hydrolysables que les unités B[4]. 58
Ces effets de trempe peuvent être comparés aux dégâts d’irradiation produits par les radionucléides dans les verres nucléaires. A faible dose, l’impact sur le verre sain reste faible : un légère repolymérisation du réseau est observée. Ceci n’a pas de réel effet sur le comportement à long terme du verre puisque des cinétiques d’altération similaires sont observées pour un verre sain et un verre irradié. Les gels d’altération sont semblables, les processus de lixiviation éliminant un certains nombres de défauts paramagnétiques créés par l’irradiation. 59 A plus forte dose, l’irradiation entraine une dépolymérisation du réseau et une augmentation du nombre de B[3], à l’image de ce qui est observé lors des trempes.
En conclusion, le verre sain et le gel vont présenter des structures différentes de par leurs compositions et leurs voies de formation. Les caractéristiques structurales de ces deux matériaux doivent être connues pour mieux appréhender leurs interactions avec l’eau. Nous avons vu précédemment quel était l’état des connaissances sur la structure des verres sains, voyons ce qu’il en est de la structure du gel.
2.3. Rappels sur les caractéristiques de la pellicule d’altération
Le gel qui se forme lors de l’altération du verre est le siège de phénomènes complexes et encore incomplètement décrits à l’origine de la chute de vitesse. Il est admis que ce gel se forme, selon les conditions d’altération, par des mécanismes d’hydrolyse/condensation in situ (c’est-à-dire sans passage des formateurs de réseau dans la solution) 39,60, et/ou des mécanismes de dissolution/précipitation. 61-63 Ces deux mécanismes impliquent la rupture de toutes ou une partie des liaisons Si–O–Si par l’eau 64 :
Si–O–Si + H2O → Si–OH + HO–Si
Dans le cas de la dissolution complète, une succession de réactions d’hydrolyse mène à la formation d’acide orthosilicique Si(OH4) :
Q3Si–O–Si≡ + H2O → Q2Si–OH + HO–Si≡
Q2Si–O–Si≡ + H2O → Q1Si–OH + HO–Si≡
37 La présence en solution de nombreux éléments à la suite de la dissolution du verre peut entrainer, lorsqu’il y a sursaturation, la précipitation de phases cristallines et/ou amorphes à la surface du verre. Leur signature isotopique est alors identique à celle de la solution 44,65.
Dans le cas de l’hydrolyse/condensation, il n’y a pas formation d’espèces aqueuses puisque la rupture des liaisons est directement suivie d’une réaction de condensation des espèces partiellement hydrolysées :
≡Si–O–Si≡ + H2O → ≡Si–O–H + ≡Si–O–H ≡Si–O–H + ≡Si–O–H → ≡Si–O–Si≡ + H2O
La prédominance d’un mécanisme sur l’autre va dépendre de la composition du verre et des conditions d’altération (température, pH, concentration en silice dissoute…) Dans le cas du verre SON68, l’analogue non-radioactif du verre nucléaire français R7T7, il y a bien dissolution du réseau silicaté jusqu’à l’atteinte d’un état stationnaire (il n’est pas démontré qu’il s’agit d’un équilibre thermodynamique). Les expériences en solution enrichie en 18O et 29Si démontrent que les mécanismes d’hydrolyse/condensation prévalent lorsque cet état stationnaire est atteint, puisque la signature isotopique du gel formé est intermédiaire entre celle du verre sain et celle de la solution. 66 La formation du gel est alors isovolumique, c’est-à-dire que le gel occupe le même volume que le verre sain avant lui. 63,67,68
Ce gel a été étudié par de nombreuses techniques analytiques afin de caractériser certaines de ses propriétés (composition, morphologie, porosité, diffusivité…). Classiquement, lorsque le gel se forme à partir de l’altération du verre dans une eau initialement pure qui se sature progressivement en silice, on distingue à l’interface avec la solution une couche appauvrie en formateurs (Si, Al) et présentant un important volume de porosité (jusqu’à 70% en eau pure). 69-71 Plus en profondeur se trouve une seconde couche plus riche en éléments formateurs (Si, Al, Zr…), et dans une moindre mesure en calcium qui assure seul le rôle de compensateur de charges (rôle combiné avec le sodium dans le verre sain). 72 De par son caractère poreux, le gel présente une surface spécifique très importante (de ~70 à plus de 200 m2·g-1). 73 Les études par réflectométrie X et diffusion des rayons X aux petits angles démontrent la densification de ce matériau au cours du temps. 74,75
Afin de mieux comprendre l’évolution de cette pellicule d’altération, des échantillons pré-altérés 1 et 86 jours ont été immergés dans une solution enrichie en 29Si. 76 Les analyses ToF-SIMS révèlent que le traceur peut pénétrer au sein du gel qui se forme dans les premiers jours de l’altération. En revanche, cela n’est plus le cas pour le gel obtenu au bout de 86 jours. Cette étude prouve donc la transformation morphologique du gel au cours du temps, avec une densification et un frein au transport des espèces entre le verre sain et la solution. 76 Cette évolution de la structure du gel est également mise en évidence par RMN qui confirme la repolymérisation du réseau silicaté à la suite du départ des éléments mobiles. 9,77 Cette
38
recondensation du réseau silicaté est également observée par modélisation Monte-Carlo simulant la formation de la pellicule d’altération sur des verres ternaires (Si-B-Na) 20 et plus complexes (Si-B-Na-Ca-Zr) 46. Dans ce cas, elle est observée dans la zone externe du gel (Figure 6), et non pas à l’interface entre le gel appauvri et le verre sain. Cette fermeture de porosité pourrait être à l’origine du rôle passivant de la couche d’altération en contrôlant l’accessibilité de l’eau à l’interface réactionnelle. 44,46
Figure 6 | Évolution de la morphologie de la couche d’altération au cours du temps (verre sans Zr) : le gel se
densifie progressivement à l’interface avec la solution, jusqu’à bloquer les échanges entre le solide et la solution. (La silice est représentée en rouges, le bore en jaune et l’eau en bleu, d’après Ledieu 20.)
La couche d’altération tendrait donc à évoluer vers un matériau thermodynamiquement stable. En revanche, cette évolution est cinétiquement limitée. 33,78 Afin de s’affranchir des premiers stades d’altération et de former rapidement un gel stable, le choix a été fait par Gin, et al. 39 de travailler dans une solution d’altération pré-saturée en silice amorphe (29SiO2), cet oxyde étant le principal formateur du gel. Dans ces conditions, il n’y a pas de dissolution du réseau silicaté, et les mécanismes de départ des espèces mobiles (B, Na et Ca) sont prépondérants. La caractérisation du gel formé montre d’une part la repolymérisation du réseau silicaté (RMN du 29Si), et d’autre part la formation d’un matériau nanoporeux où seules les molécules de taille inférieure à 1 nm peuvent diffuser (ToF-SIMS). Le coefficient de diffusion des espèces mobiles en son sein diminue au cours du temps, ce qui illustre une nouvelle fois le caractère passivant du matériau. Plusieurs hypothèses vont être avancées pour expliquer ces observations :
- il y aurait atteinte d’un équilibre thermodynamique entre la solution et le solide,
- la pellicule d’altération pourrait avoir un impact sur la mobilité et la réactivité de l’eau, qui seraient plus faibles dans le gel que dans la solution.
Notons par ailleurs que l’hélium, qui est une espèce chimiquement inerte présentant un rayon de Van der Waals équivalent à celui de l’oxygène dans une molécule d’eau, a un coefficient de diffusion qui est de 4 à 9 ordres de grandeur supérieur à celui de l’eau dans le verre sain et dans le gel. Cette observation supporte l’idée que la mobilité de l’eau pourrait être affectée par sa réactivité avec le solide. 39,79
39
Conclusion : Si la phénoménologie de l’altération du verre est aujourd’hui bien connue, un certain nombre d’interrogations demeurent sur l’origine des propriétés de passivation du gel, et plus particulièrement sur le comportement de l’eau nanoconfinée en son sein et son rôle sur la dynamique de réorganisation du gel. En effet, il a été démontré que le coefficient de diffusion de l’eau différait grandement de celui d’une espèce inerte, ce qui semble prouver l’importance des interactions chimiques entre les espèces aqueuses et la structure du gel. Il est donc nécessaire d’étudier la structure du verre sain et du gel, avant de s’intéresser à la spéciation de l’eau en son sein, puis à sa réactivité et sa mobilité.
3. Réactivité et mobilité : étude de la dynamique de l’eau au sein d’un milieu poreux 3.1. Spéciation de l’eau
Figure 7 | Présentation des différentes espèces de l’eau au sein d’un matériau : eau moléculaire H2O et hydroxyles –X–OH (X = Si, Al, Zr…) formant ou non des liaisons hydrogène.
L’eau liquide existe principalement sous forme d’eau moléculaire formant des liaisons hydrogène. En contact avec un solide, l’eau peut réagir avec la surface et se dissocier en plusieurs espèces (Figure 7). On trouve ainsi de l’eau moléculaire libre ou en interaction avec les sites de surface, ainsi que des groupements hydroxyles –X–OH. Les hydroxyles peuvent être liés à différents éléments X formant le réseau du milieu étudié, notamment le silicium. On parlera alors de groupements silanols. 80 Toutes ces espèces peuvent former des liaisons hydrogène entre elles ou avec n’importe quel atome d’oxygène voisin. Il est nécessaire, afin de mieux comprendre les mécanismes de dissociation de l’eau, de pouvoir déterminer et quantifier les espèces existantes.
H H O H H O H H O H H O O H H H H O H X O X O H H X O H X O O Liaisons hydrogène
40
3.1.1. Spéciation de l’eau : études par Spectroscopie infrarouge et Raman
Les spectroscopies infrarouge (IR) et Raman permettent d’étudier les modes vibrationnels des molécules et des structures. Elles donnent des résultats de même nature : des spectres présentant un certain nombre de bandes de vibrations. Ces bandes, ou modes, sont situées à des nombres d’ondes qui leur sont caractéristiques. Elles sont dues aux mouvements des liaisons chimiques des molécules, ou témoignent d’un réseau plus ou moins organisé. Le spectre obtenu est donc représentatif du matériau étudié ; il permet de connaitre sa structure et, dans certains cas, la quantification de diverses espèces aqueuses en son sein. Seule la spectroscopie IR a été utilisée au cours de cette thèse, cette partie bibliographie se concentrera donc sur cette technique uniquement.
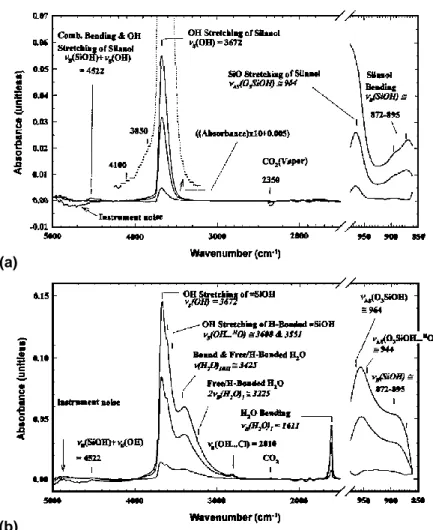
La littérature présente une abondance de travaux sur la spéciation de l’eau dans des milieux confinés tel que les zéolithes 81,82 ou la silice amorphe. 83-85 Ces milieux présentent des compositions simplifiées mais proches de celle du gel, et peuvent éventuellement servir de référence pour des travaux en IR. 86 De nombreux travaux existent cependant sur les verres naturels 87-89 ou synthétiques 90-92 et peuvent servir de base pour référencer les différents modes de vibration existants. Ainsi, les verres peu hydratés ne contiennent que des silanols et présentent donc essentiellement trois contributions vers 900, 3700 et 4500 cm-1, comme le démontre la Figure 8 a. 92,93 Les verres fortement hydratés contiennent à la fois des silanols et de l’eau sous forme moléculaire : en plus des contributions dues aux silanols, de nouveaux massifs attribués aux molécules apparaissent vers 1650, 3000 à 3700 et 7090 cm-1 (Figure 8
b). 94,95 Notons que toutes ces espèces tendent à former des liaisons hydrogène. En conséquence,
les signaux obtenus s’élargissent significativement. 92 Les différentes contributions observées dans ce type de verres et leur attribution sont compilées dans la Table 1.
Ces études restent généralement qualitatives, et ne se risquent à la quantification que lorsqu’elles combinent leurs analyses spectroscopiques à d’autres méthodes destructives comme les analyses thermogravimétriques (ATG) ou la méthode Karl-Fischer pour le dosage de l’eau. Ce couplage de techniques permet l’établissement de courbes de calibration en corrélant quantité totale d’eau et évolution des bandes dans le proche 89,96 et moyen-IR (Figure
41 Figure 8 | Evolution du Spectre IR d’un verre Suprasil W2 d’après Davis and Tomozawa 92. (a) Verre faiblement hydraté ne contenant que des silanols. (b) Verre fortement hydraté contenant des silanols et de l’eau moléculaire formant ou non des liaisons hydrogène.
Figure 9 | Corrélation entre la quantité totale d’eau dans l’échantillon de verre et la hauteur de la bande
fondamentale de déformation des liaisons OH à 3500 cm-1 d’après Stolper 97. Cette calibration permet ensuite de
quantifier les teneurs en eau dans des échantillons similaires sans avoir recours aux méthodes destructives habituelles (analyses thermogravimétriques ou méthode Karl-Fischer).
(a)