Criblage pharmacologique de nouvelles
molécules à caractère antipsoriasique
Mémoire
Audrey Bélanger
Maîtrise en sciences pharmaceutiques
Maître ès sciences (M. Sc.)
Québec, Canada
Criblage pharmacologique de nouvelles
molécules à caractère antipsoriasique
Mémoire
Audrey Bélanger
Sous la direction de :
III
Résumé
Le psoriasis est une dermatose érythémato-squameuse d’évolution chronique. Les patients atteints par la pathologie ont à leur disposition de nombreux traitements qui permettent de contrôler la maladie sans toutefois la guérir. Néanmoins, plusieurs de ces traitements présentent des propriétés toxicologiques et des effets indésirables à court ou long terme. Il devient donc impératif de découvrir de nouvelles molécules thérapeutiques afin d’améliorer considérablement la qualité de vie des patients psoriasiques. Or, l’ingénierie tissulaire permet d’approfondir les connaissances en dermatologie et d’investiguer sur de nouveaux agents thérapeutiques topiques, que ce soit dans le domaine cosméceutique ou pharmaceutique. La culture cellulaire tridimensionnelle (3D) est un modèle pertinent afin d’étudier l’architecture d’un tissu sain ou pathologique. La méthode d’auto-assemblage développée au Laboratoire d’Organogénèse Expérimentale (LOEX) permet l’obtention, entre autre, de substituts cutanés bilamellaires autologues sains ou psoriasiques. L’objectif général de ce projet a été de démontrer, via criblage pharmacologique, le potentiel antipsoriasique d’une gamme de molécules dérivées de la biomasse végétale de la forêt boréale en vue d’une possible utilisation dans le traitement du psoriasis. Des tests de toxicité effectués avec 39 molécules à différentes concentrations ont permis d’identifier 9 molécules inhibitrices de la croissance kératinocytaire et ce, à de faibles concentrations. Parmi ces 9 molécules, toutes testées sur des substituts cutanés 3D sains et psoriasiques, 4 ont démontré des propriétés thérapeutiques prometteuses au niveau de la normalisation de la prolifération et de la différenciation kératinocytaire; il y a une diminution significative de l’épaisseur de l’épiderme vivant des substituts psoriasiques traités avec ces 4 molécules comparativement au contrôle. De plus, ces quatre molécules régulent positivement l’expression de plusieurs protéines impliquées dans la différenciation cellulaire (involucrine, filaggrine, loricrine) ou la prolifération cellulaire (Ki-67). Ainsi, ces molécules novatrices de structure polyphénolique pourraient éventuellement être utilisées en tant que traitement efficace du psoriasis.
V
Abstract
Psoriasis is a chronic skin disease characterized by erythematous plaques with loosely adherent silvery-white scales. Psoriatic patients have at their disposal several treatments that control the disease however, no cure has been found yet., Current treatments for psoriasis are associated with toxicological problems and short- and long-term adverse effects. Hence, it is imperative to discover new therapeutic molecules in order to significantly improve the quality of life of psoriatic patients. Tissue engineering of skin is used to deepen our knowledge in dermatology and to investigate on new topical therapeutics for the cosmeceutical or pharmaceutical fields. Three-dimensional (3D) cell culture recapitulates normal and pathological tissue architectures that provide physiologically relevant models to study normal development or diseases of the tissue. The self-assembly method developed at LOEX allows to produce healthy or psoriatic bilamellar skin substitutes. The aim of this project was to demonstrate, using pharmacological screening, the antipsoriatic potential of a range of compounds derived from the plant biomass of the boreal forest. Toxicity assays were used to screen 39 molecules at different concentrations, and a choice of 9 molecules inhibiting the keratinocyte growth at low concentrations was made to pursue this project. Among these 9 molecules, all tested on healthy and psoriatic 3D skin substitutes, 4 of them have shown promising therapeutic properties for the normalization of keratinocyte proliferation and differentiation; these 4 molecules upregulate the expression of several proteins involved in cellular differentiation (involucrin, filaggrin, loricrin) or cellular proliferation (Ki-67). Histological analyses of psoriatic skin substitutes treated with these 4 molecules showed a significant decrease of the epidermis thickness. Thereby, these innovative molecules with a polyphenolic structure could possibly be used as an effective treatment of psoriasis.
VII
Table des matières
Résumé ... III Abstract ... V Table des matières ... VII Liste des tableaux ... XI Liste des figures ... XIII Liste des abréviations ... XV Remerciements ... XVII Chapitre 1 – Introduction ... 1 1.1 Le système tégumentaire ... 3 1.1.1 L’épiderme ... 4 1.1.2 Fonctions de la peau ... 11 1.2 Le psoriasis ... 16
1.2.1 Différents types cliniques du psoriasis ... 17
1.2.2 Caractéristiques histologiques ... 21
1.2.3 Traitements symptomatiques ... 25
1.3 Molécules de source naturelle à potentiel thérapeutique ... 35
1.3.1 Produits naturels ... 36
1.3.2 Les polyphénols ... 37
1.3.3 Molécules novatrices potentiellement antipsoriasiques ... 39
1.4 Développement de produits pharmaceutiques ... 41
1.5 Génie tissulaire ... 44
1.5.1 Modèles tridimensionnels in vitro ... 45
1.6 Problématique ... 47
1.6.1 Hypothèse ... 48
1.6.2 Objectifs ... 48
Chapitre 2 – Matériels et méthodes ... 49
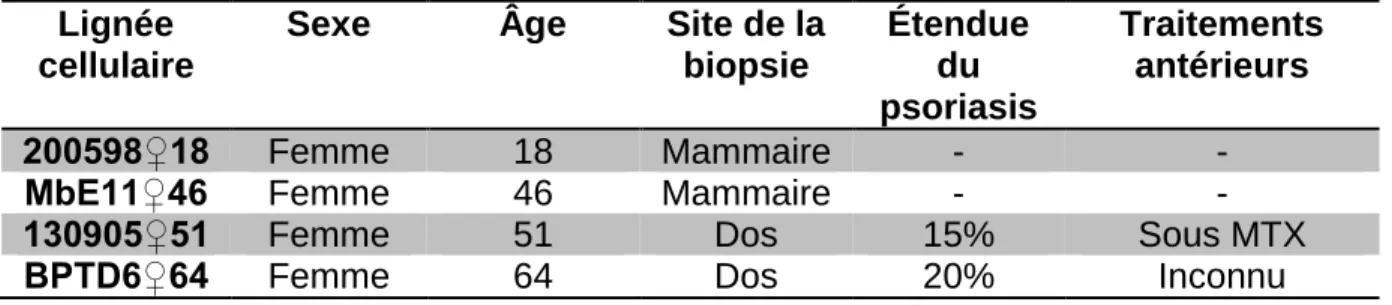
2.1 Patients ... 51
2.2 Milieux de culture ... 51
VIII
2.2.2 Kératinocytes ... 52
2.3 Extraction cellulaire ... 52
2.3.1 Isolation des cellules épithéliales ... 53
2.3.2 Isolation des fibroblastes ... 53
2.4 Production de substituts cutanés ... 54
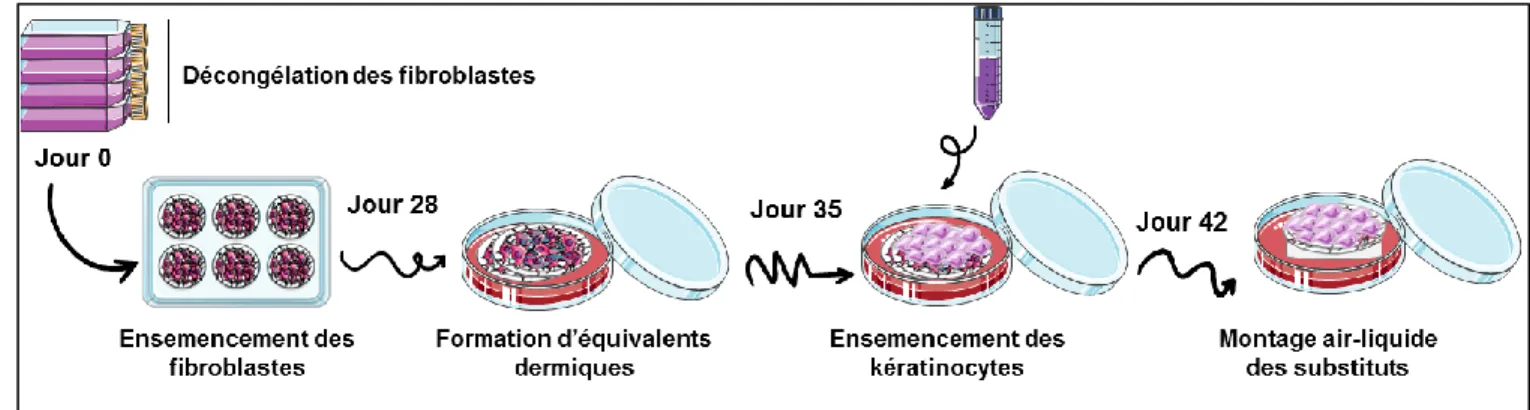
2.4.1 Culture de fibroblastes ... 54 2.4.2 Culture de kératinocytes ... 54 2.4.3 La méthode d’auto-assemblage ... 54 2.5 Molécules à l’étude ... 56 2.6 Études toxicologiques ... 57 2.7 Analyses histologiques ... 58 2.8 Analyses immunohistochimiques ... 58 2.9 Analyses statistiques ... 60 2.10 Code éthique ... 60
Chapitre 3 – Résultats des analyses de toxicité, macroscopiques, histologiques et immunohistochimiques ... 61
3.1 Dosage SRB ... 63
3.2 Analyses macroscopiques ... 64
3.3 Analyses histologiques ... 67
3.3.1 Mesures de l’épiderme vivant ... 69
3.4 Analyses immunohistochimiques ... 71
3.5 Validation du potentiel antipsoriasique des molécules novatrices ... 75
3.5.1 Analyses macroscopiques ... 75
3.5.2 Analyses histologiques ... 77
3.5.3 Mesures de l’épiderme vivant ... 77
3.5.4 Analyses immunohistochimiques ... 79
Chapitre 4 – Discussion des analyses toxicologiques, histologiques et immunohistochimiques ... 83
4.1 Analyses toxicologiques ... 85
4.2 Analyses histologiques ... 86
IX
4.3 Analyses immunohistochimiques ... 89
4.3.1 Involucrine ... 90
4.3.2 Filaggrine & loricrine ... 91
4.3.3 Ki-67 ... 92
4.4 Molécules novatrices de source naturelle ... 92
4.4.1 Les études antérieures dans l’équipe de la Dre Pouliot ... 93
4.4.2 L’usage des plantes médicinales ... 94
4.4.3 Mécanismes d’action potentiels des polyphénols sur l’épiderme ... 97
Chapitre 5 – Conclusions et perspectives ... 99
5.1 Conclusions ... 101
5.2 Perspectives... 101
5.2.1 Cellules de Franz ... 103
Chapitre 6 – Bibliographie ... 105
XI
Liste des tableaux
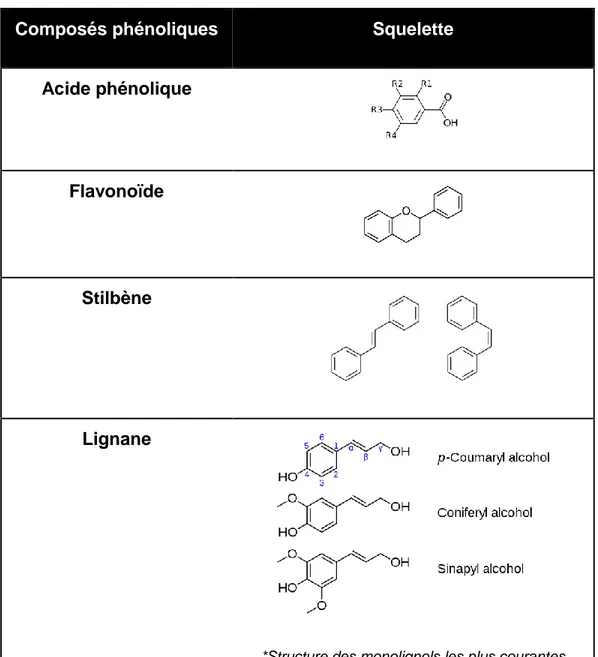
Tableau 1.1 Différents groupes de composés phénoliques associés à leur
structure moléculaire de base ... 38
Tableau 2.1 Informations supplémentaires sur les populations cellulaires saines et
psoriasiques utilisées lors de ce projet. ... 51
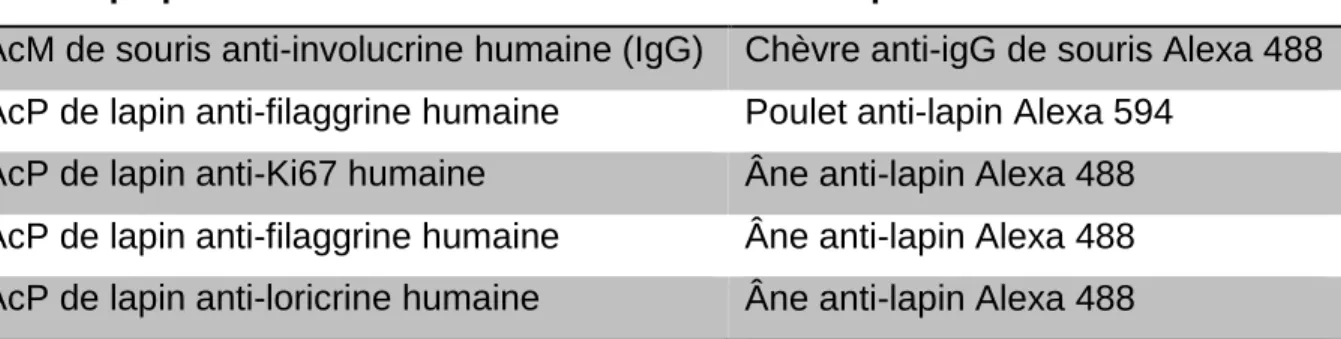
Tableau 2.2 Liste des différents anticorps primaires et secondaires utilisés ... 59 Tableau 3.1 Concentration inhibitrice de la croissance kératinocytaire à 50% des
XIII
Liste des figures
Figure 1.1 Structure de la peau. ... 10
Figure 1.2 La kératinisation et l’évolution des cellules de l’épiderme. ... 11
Figure 1.3 Les différentes routes de pénétration cutanée. ... 16
Figure 1.4 Phénotypes cliniques du psoriasis ... 18
Figure 1.5 Les quatre types d’anticorps monoclonaux selon leur nature animale ou humaine... 31
Figure 1.6 Les grandes étapes pour le développement de nouveaux produits pharmaceutiques. ... 44
Figure 2.1 Représentation schématique de la méthode d’auto-assemblage. Adaptée du mémoire d’Isabelle Gendreau. ... 56
Figure 3.1 Pourcentage de l’inhibition de la croissance des kératinocytes psoriasiques traités avec différentes molécules à différentes concentrations. ... 64
Figure 3.2 Résultats macroscopiques des substituts bilamellaires autologues sains (A-E) et psoriasiques (F-J) pour les molécules #3, #34 et #36. ... 65
Figure 3.3 Résultats macroscopiques des substituts bilamellaires autologues sains (A-E) et psoriasiques (F-J) pour les molécules #4, #5 et #24. ... 66
Figure 3.4 Résultats macroscopiques des substituts bilamellaires autologues sains (A-E) et psoriasiques (F-J) pour les molécules #2, #10 et #21. ... 66
Figure 3.5 Analyses histologiques des substituts bilamellaires autologues sains (A-E) et psoriasiques (F-J) pour les molécules #3, #34 et #36. ... 67
Figure 3.6 Analyses histologiques des substituts bilamellaires autologues sains (A-E) et psoriasiques (F-J) pour les molécules #4, #5 et #24. ... 68
Figure 3.7 Analyses histologiques des substituts bilamellaires autologues sains (A-E) et psoriasiques (F-J) pour les molécules #2, #10 et #21. ... 68
Figure 3.8 Boîtes à moustaches présentant les différentes mesures de l’épaisseur de l’épiderme vivant des substituts sains et psoriasiques. ... 70
Figure 3.9 Immunofluorescence indirecte sur des substituts cutanés avec un anticorps dirigé contre la filaggrine, l’involucrine ou Ki-67. ... 73
Figure 3.10 Expression de la filaggrine (rouge) dans les substituts psoriasiques traités avec les différentes molécules (A-H). ... 74
Figure 3.11 Expression de l’involucrine (vert) dans les substituts psoriasiques traités avec les différentes molécules (A-H). ... 74
Figure 3.12 Expression de Ki-67 (vert) dans les substituts psoriasiques traités avec les différentes molécules (A-H). ... 75
Figure 3.13 Résultats macroscopiques des substituts bilamellaires autologues sains (A-F) et psoriasiques (G-L) pour les molécules #3, #4, #10 et #21. ... 76
XIV
Figure 3.14 Analyses histologiques des substituts bilamellaires autologues sains
(A-F) et psoriasiques (G-L) pour les molécules #3, #4, #10 et #21. ... 77
Figure 3.15 Boîtes à moustaches présentant les différentes mesures de
l’épaisseur de l’épiderme vivant des substituts sains et psoriasiques non traités et traités avec le méthotrexate et les molécules #3, #4, #10 et #21. ... 79
Figure 3.16 Immunofluorescence indirecte sur des substituts cutanés avec un
anticorps dirigé contre la filaggrine (vert, A-C) ou la loricrine (vert, D-F). ... 80
Figure 3.17 Expression de la filaggrine (vert, A-D) et de la loricrine (vert, E-H)
dans les substituts psoriasiques traités avec les différentes molécules. ... 81
Figure 5.1 Représentation schématique de la cellule de Franz de type statique (A)
XV
Liste des abréviations
Sigle Définition du sigle
18♀ Population cellulaire saine obtenue d’une femme âgée de 18 ans 46♀ Population cellulaire saine obtenue d’une femme âgée de 46 ans L51♀ Population cellulaire psoriasique obtenue d’une femme âgée de 51
ans
L64♀ Population cellulaire psoriasique obtenue d’une femme âgée de 64 ans
3D Tridimensionnel
3T3 «3-day transfer, inoculum 3x105 cells»
AFPSN Aliments fonctionnels et de produits de santé naturel AcM Anticorps monoclonal
AcP Anticorps polyclonal
ADME Absorption, Distribution, Métabolisation, Élimination AL Air-liquide
AMPC Adénosine monophosphate cyclique
AMPS Peptides antimicrobiens
ANOVA Analyse de la variance AP-1 Protéines activatrices 1
CB Couche Basale
CC Couche Cornée
CE Couche Épineuse
CG Couche Granuleuse
COX-2 Cyclooxygénase-2
CSEs Cellules Souches Épidermiques DME «Dulbecco’s Modified Eagle’s» DMSO Diméthylsulfoxyde
DO Densité optique
EDTA «Ethylenediaminetetraacetic acid»
EGCG Épigallocatéchine-3-gallate EGF «Epidermal Growth Factor»
ELISA «Enzyme-linked immunosorbent assay»
EMA «European Medicines Agency»
FDA «Food and Drug Administration»
IFN-γ Interféron gamma IL Interleukine
JDE Jonction Dermo-Épidermique
K Kératine
LcT Lymphocyte T
LOEX Laboratoire d’Organogénèse Expérimentale MEC Matrice ExtraCellulaire
MTX Méthotrexate
NF-κB Facteur nucléaire kappa B
XVI OCT «Optimal Cutting Temperature» P Passage cellulaire
PASI Indice de surface et de gravité du psoriasis («Psoriasis Area Severity
Index»)
PBS « Phosphate buffered saline »
PSN Produit de santé naturel PSORS «Psoriasis Susceptibility» PUVA Psoralène-UVA
RAR Récepteur nucléique de l’acide rétinoïque («Retinoic Acid Receptor») RPM Révolution par minute
SRB Sulforhodamine B SVF Sérum de Veau Fœtal
Th Lymphocyte T auxiliaire («T Helper») TIG «Tazarotene-Induced Gene»
TNF Facteur de nécrose tumorale («Tumor Necrosis Factor») UV Ultraviolet
UVA Ultraviolet de type A UVB Utraviolet de type B
VEGF Facteur de croissance de l’endothélium vasculaire («Vascular
XVII
Remerciements
Je tiens d’abord à remercier ma directrice de recherche, la Dre Roxane Pouliot, pour m’avoir donné la chance de faire partie de cette belle équipe. Merci de m’avoir fait confiance et ce, avec autant de liberté. Cette expérience m’a permis de m’accomplir dans ma carrière scientifique et ce, grâce aux belles opportunités que tu m’as offertes. Je tiens aussi à remercier les Drs André Pichette et Jean Legault pour leur précieuse collaboration, ainsi que François Simard pour l’extraction et la purification des molécules. Je me sens privilégiée d’avoir partagé cette expérience avec vous et j’en suis reconnaissante. Merci pour tout!
Je remercie également le dermatologue Dr Jacques Soucy, de la clinique de dermatologie du CHU de Québec, ainsi que tous les donneurs anonymes pour leur collaboration dans la création de notre banque cellulaire.
Au laboratoire, il m'est impossible de ne pas mentionner l'aide inestimable que m'a apportée Sergio Cortez Ghio pour ses connaissances en statistique et sa précieuse aide pour mes analyses. À tous les membres de l’équipe de la Dre Pouliot, je tiens à vous remercier pour votre support et vos mots d’encouragement. Un merci spécial à ma collègue et amie, Mélissa Simard, pour sa générosité, son attention et son écoute. Tu as toujours été présente pour moi, tant au laboratoire qu’en dehors; je t’en remercie grandement.
Enfin, je veux remercier profondément mes parents, André Bélanger et Lyne Moisan, qui m’ont supportée de tout leur cœur. Merci d’avoir été patients en m’apportant le soutien et les encouragements à la réussite de mon parcours; vous m’avez appris à aller toujours plus loin et à ne jamais abandonner malgré les difficultés. Je suis redevable d’une éducation dont je suis fière. Vous êtes mes modèles; je vous aime.
1
Chapitre 1 – Introduction
3
1.1 Le système tégumentaire
Également appelée tégument, la peau est l’organe le plus lourd et le plus étendu de l’organisme, pesant 4 kg et représentant une surface d’environ 2 m2 [1]. Selon Katz et Poulsen, chaque centimètre carré de peau renferme environ 3 vaisseaux sanguins, 10 poils, 12 nerfs, 15 glandes sébacées et 100 glandes sudoripares [2]. La peau associe différentes structures tissulaires (épithéliales, conjonctives, vasculaires, musculaires et nerveuses) qui assurent de nombreuses fonctions indispensables à la vie terrestre (sensitives, protectrices, thermorégulatrices, immunitaires et métaboliques) [3, 4].
La peau comporte deux feuillets contigus, soit l’épiderme en surface et le derme sous-jacent, qui reposent sur un tissu adipeux, l’hypoderme. L’épiderme, d’origine ectodermique, est un épithélium pluristratifié kératinisé en contact direct avec l’environnement, et dont la fonction fondamentale est d’assurer une barrière de protection semi-perméable entre l’extérieur et l’intérieur de l’organisme [5]. L’épiderme comprend également des annexes épidermiques logées en grande partie dans le derme: les follicules pileux, associés étroitement aux glandes sébacées, et les glandes sudoripares. Le derme est un tissu conjonctif innervé et vascularisé plus épais que l’épiderme [6]. Les cellules résidentes du derme sont essentiellement des fibroblastes dont le rôle est la synthèse de fibres de collagène et d’élastine responsables de la résistance mécanique et de l’élasticité de la peau [3]. Le derme est également composé de cellules immunitaires telles que les macrophages, les mastocytes et les lymphocytes [7]. Grâce à une communication moléculaire, le derme joue un rôle important dans l’homéostasie épidermique de par sa participation à la thermorégulation cutanée et à l’apport d’éléments nutritifs à l’épiderme par diffusion [8].
L’hypoderme, quant à lui, est caractérisé par la présence d’adipocytes, des cellules spécialisées dans le stockage des lipides sous forme de triglycérides [8]. Ce tissu joue ainsi un rôle de réserve énergétique et d’isolant thermique
4
[9]. Cette enveloppe corporelle qu’est la peau est essentielle à la survie, car sans elle, l’humain serait rapidement la proie des bactéries et périrait de la déperdition d’eau et de chaleur.
Or, considérant ses nombreuses fonctions, on s’aperçoit que la peau représente bien davantage qu’un grand sac opaque pour le contenu du corps et qu’elle n’exerce son rôle parfaitement que si son intégrité physique et fonctionnelle est conservée.
1.1.1 L’épiderme
L’homéostasie épidermique repose sur la balance entre la prolifération et la différenciation kératinocytaire. Lorsqu’il y a diminution de la prolifération des kératinocytes, cela entraîne l’amincissement de l’épiderme et, par le fait même, une perte de fonction protectrice. À l’inverse, lorsqu’il y a une augmentation de la prolifération kératinocytaire, ceci peut conduire à des états pathologiques comme le psoriasis [10] ou le cancer [11].
Stratification épidermique
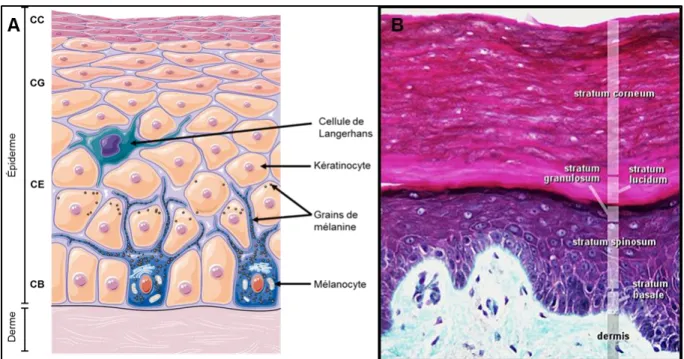
L’épiderme est un épithélium de revêtement pavimenteux (car les cellules de sa couche superficielle sont plates), stratifié (constitué de plusieurs assises cellulaires) et kératinisé (qui synthétise des protéines spécifiques, les kératines (K)) où différents types cellulaires coexistent, les kératinocytes étant largement majoritaires (90% à 95%) [12]. Parmi les autres types cellulaires qui constituent l’épiderme, on distingue les mélanocytes et les leucocytes tels que les lymphocytes T, les cellules de Langerhans et les cellules de Merkel [12]. Comme leur nom l’indique, les kératinocytes sont spécialisés dans la synthèse des kératines, qui sont des protéines fibreuses de la famille des filaments intermédiaires. Au cours de la différenciation de l’épiderme, les kératinocytes migrent de la profondeur vers la surface, au sein des quatre assises cellulaires distinctes que sont la couche basale (Stratum
5
granuleuse (Stratum granulosum) et la couche cornée (Stratum corneum) (Figure 1.1) [13]. Chacune des stratifications de l’épithélium exprime un hétéropolymère de kératines, composé d’une kératine acide et d’une kératine basique [14] et ainsi, différents types sont exprimés dans les différents stades de différenciation [15]. Les kératines K5 et K14 sont retrouvées dans la membrane basale, tandis que les kératines K1 et K10 sont plutôt exprimées au niveau suprabasal [15]. Les kératines sont donc de bons marqueurs pour déceler des anomalies dans la stratification et la différenciation du tégument. Lors de leur migration (entre 21 et 28 jours), les propriétés structurales et fonctionnelles des kératinocytes se modifient et mènent à la formation de la couche cornée, et ce, selon le processus de cornification [16].
La couche basale (CB)
Représentant la couche la plus profonde de l’épiderme, elle est composée d’une seule assise de kératinocytes basaux et de cellules germinatives cuboïdales, permettant le renouvellement constant de l’épiderme [17]. En effet, la régénération de l’épiderme commence par l’activation de ces cellules souches, suivie par la prolifération et la différenciation de leur descendance. Ainsi, la CB est composée à la fois de kératinocytes basaux prolifératifs et non prolifératifs [18, 19]. Les kératinocytes prolifératifs (cellules souches épidermiques (CSEs) et cellules d’amplification transitoires) assurent le renouvellement constant et la réparation de l’épiderme, alors que les kératinocytes non prolifératifs assurent l’ancrage de l’épiderme à la matrice extracellulaire (MEC) sous-jacente au niveau de la jonction dermo-épidermique (JDE). L’adhésion des cellules de la CB à la MEC est assurée par les intégrines et des hémidesmosomes tels que les desmogléines 2 et 3 et les desmocollines 2 et 3, tandis que les cellules adjacentes sont reliées entre elles par les desmosomes, qui sont des jonctions d’adhésion intercellulaires. Les cellules basales qui composent cette assise ont la capacité de synthétiser des filaments de kératines, spécifiquement les K5 et K14, qui sont des marqueurs protéiques de la CB de l’épiderme [20].
6
Selon l’aspect chronologique, il y a d’abord mitose des cellules basales germinatives, suivie de la migration et de la différenciation de la moitié des cellules filles dans la couche supérieure de l’épiderme, la couche épineuse (CE). La division des cellules basales, plus précisément celle des CSEs, s’appuie sur la capacité des cellules à se diviser asymétriquement, en orientant leur fuseau mitotique de manière à ce qu’une des cellules filles se localise dans le compartiment supérieur épineux, alors que l’autre est maintenue dans la CB en conservant son pouvoir prolifératif. La division des cellules d’amplification transitoire, des kératinocytes basaux prolifératifs situés en périphérie des CSEs, a également lieu, et implique une division symétrique des cellules, puisque les deux cellules filles se retrouvent adjacentes sur un plan horizontal dans la CB après division. Ces cellules d’amplification transitoire, après quelques cycles de différenciation, génèrent un « pool » de kératinocytes qui vont sortir irréversiblement du cycle cellulaire (et donc quitter la couche basale) et se différencier. Ainsi, l’une des deux cellules filles serait capable de se détacher de la membrane basale sous-jacente pour rejoindre le compartiment supérieur, entrant ainsi en différenciation, alors que l’autre resterait dans la CB en assurant le renouvellement constant de l’épiderme. La CB est également composée de mélanocytes, qui assurent via la synthèse de mélanines une photoprotection partielle de la peau [21, 22] et de cellules de Merkel, où ces dernières sont associées, pour la plupart, à une terminaison nerveuse et exercent ainsi une fonction de mécanorécepteur [23].
La couche épineuse (CE)
Cette couche est également appelée corps muqueux de Malpighi et est constituée de cinq à six assises de kératinocytes entrés en différenciation [2]. De ce fait, les kératinocytes cessent de se diviser dès leur entrée dans la CE de l’épiderme. Les cellules qui composent cette couche sont très actives, de par leur capacité à synthétiser des protéines, notamment les kératines. Les kératinocytes épineux sont caractérisés par la synthèse des kératines K1 et
7
K10, qui remplacent les kératines basales K5 et K14 [20]. À cette étape de la stratification épidermique, les kératines synthétisées par la CE s’associent en tonofilaments. L’abondance et l’organisation des tonofilaments, ainsi que leur association aux nombreux desmosomes confèrent aux cellules une structure épineuse. Une telle cohésion des kératines envers les desmosomes est en partie responsable de la très grande résistance mécanique de l’épiderme et, sans équivoque, de la résistance contre les agressions physiques [24]. D’autres types de jonctions, i.e. les jonctions adhérentes, renforcent davantage cette cohésion cellulaire. Les kératinocytes de cette couche synthétisent une protéine appelée involucrine, utile à la formation des couches épidermiques suivantes [24]. Plus précisément, l’involucrine exerce un rôle lors de la fixation des autres molécules de l’enveloppe cornée, notamment la loricrine, en servant d’amorce. De plus, la présence de l’involucrine est essentielle pour la formation d’une enveloppe cornée, car cette protéine agit comme un accepteur d’amines dans la réaction enzymatique des transglutaminases 1, 3 et 5, où ces dernières forment des polymères de protéines insolubles indispensables à l'organisme pour créer des barrières et structures stables [25].
La couche granuleuse (CG)
Cette assise cellulaire est composée de trois à cinq couches de cellules et forme la dernière couche de cellules nucléées de l’épiderme. Ces cellules, aplaties et fusiformes, s’orientent parallèlement à la surface de la peau et possèdent un noyau oval et dense dans lequel la chromatine et les organites se raréfient. Le nom de la CG est dû à la présence de deux nouvelles structures cytoplasmiques, soit les nombreux corps d’Odland (corps lamellaires) et les granules de kératohyaline. Les corps d’Odland sont des vésicules d’origine golgienne et de forme ovoïde qui occupent une grande partie du cytoplasme des kératinocytes granuleux. Ces corps lamellaires, synthétisés dans la partie supérieure de la CE, contiennent un ensemble de lipides, tels que les phospholipides, le cholestérol, les céramides et les acides
8
gras libres, lesquels participent à l’élaboration du ciment intercellulaire des cellules cornées qui composent la couche la plus superficielle de l’épiderme, soit la couche cornée (CC). Les grains de kératohyaline se trouvent également dans le cytoplasme des kératinocytes granuleux et apparaissent en microscopie électronique comme des amas de forme étoilée. Étroitement associés aux tonofilaments, il existe deux types de granules cytoplasmiques, soit les granules de type F et les granules de type L [20]. Les grains de kératohyaline de type F ont une forme irrégulière et contiennent la profilaggrine, un précurseur de la filaggrine. Ce type de granules a pour rôle d’agréger les filaments de kératine qui forment alors des macrofibrilles, composante principale des cellules cornifiées qui composent la CC. Les granules de type L ont plutôt une forme ronde et contiennent la loricrine, protéine basique riche en cystéine. Ce type de granules participe à la formation de l’enveloppe cornée. Ainsi, en ce qui concerne l’aspect biochimique au niveau de la CG, diverses réactions se produisent dans le cytoplasme des kératinocytes granuleux pour assurer la formation des structures essentielles à la CC, plus précisément l’enveloppe cornée et les lamelles lipidiques extracellulaires. En effet, lors du processus de différenciation épidermique au niveau de la CG, les corps d’Odland déversent leur contenu par exocytose dans les espaces intercellulaires (à l’interface entre la couche granuleuse et la couche cornée) sous forme de lamelles lipidiques participant ainsi à la cohésion des cellules cornifiées. De plus, la formation d’une enveloppe cornée rigide et résistante repose sur l’expression de précurseurs protéiques, tels que la loricrine et la profilaggrine, tous synthétisés dans le cytoplasme des kératinocytes de la CG de l’épiderme. Or, à partir de ces composantes protéiques, il est possible de déterminer si la peau est bien différenciée puisque ces dernières caractérisent la différenciation cellulaire. Afin de savoir si la CG assure tous ces rôles, d’autres marqueurs protéiques peuvent être étudiés, tels que les K1 et K10 et les grains de kératohyaline. Parmi les marqueurs lipidiques, les
9
phospholipides ainsi que les corps d’Odland peuvent être utilisés pour étudier l’aspect biochimique de la CG.
La couche cornée (CC)
Cette assise cellulaire est la couche la plus superficielle de l’épiderme et s’organise en plusieurs couches de cellules, dont le nombre varie selon la région du corps observée. En moyenne, la CC est composée de quatre à huit couches de cellules complètement aplaties. Les kératinocytes appartenant à la couche cornée ont atteint leur stade final de différenciation cellulaire : ce sont les cornéocytes. Les cornéocytes sont anucléés et il y a absence des organites cytoplasmiques. Les cornéocytes présents dans la partie inférieure de la CC, le stratum compactum, sont près les uns des autres, et au fur et à mesure que les cellules cornifiées approchent la partie supérieure, le stratum
disjonctum, celles-ci se disposent de façon lâche. En fait, les cornéocytes les
plus superficiels, en perdant leurs liaisons intercellulaires, soient les cornéodesmosomes, se détachent progressivement du tissu, donnant lieu au phénomène de desquamation, un processus protéolytique permettant le maintien d’une épaisseur épidermique constante [26]. Plus précisément, cette exfoliation épidermique est caractérisée par la dégradation progressive des constituants externes des cornéodesmosomes, soient la desmogléine-1, la desmocolline-1 et la cornéodesmosine [26]. La dégradation de ces constituants résulte de l’action de protéases, des enzymes protéolytiques déversées dans l’espace intercornéocytaire par les corps lamellaires, puisqu’elles ont la capacité de cliver les protéines constitutives des cornéodesmosomes reliant entre eux les cornéocytes. Ainsi, le processus de cornification repose sur l’activité de plusieurs protéases, où ces dernières sont également impliquées dans la maturation de différentes protéines essentielles pour la différenciation terminale de l’épiderme. Au niveau cellulaire, le cytoplasme des cellules cornées est remplacé par la forme finale des kératines (macrofibrilles) résultant d’une hydrolyse des kératines qui s’associent à la filaggrine. Il y a également formation d’une enveloppe cornée
10
correspondant à un dépôt au niveau de la face interne de la membrane plasmique de protéines solubles (involucrine et cornifine) et insolubles (loricrine) liées entre elles essentiellement par une enzyme, soit la transglutaminase I. Afin d’étudier la différenciation terminale des cellules de l’épiderme, des marqueurs protéiques tels que la filaggrine, la loricrine, la transglutaminase I et l’involucrine peuvent être utilisés. En ce qui a trait aux marqueurs lipidiques, ils sont plus nombreux au niveau de la CC étant donné que les corps lamellaires sont extrudés dans cette couche. Parmi les marqueurs lipidiques, il y a les sphingolipides (céramides), le cholestérol, le lanostérol et les acides gras libres.
Figure 1.1 Structure de la peau.
A. Schématisation des couches cellulaires épidermiques de la peau humaine B. Coloration au trichrome de Masson d’une coupe transversale de
11
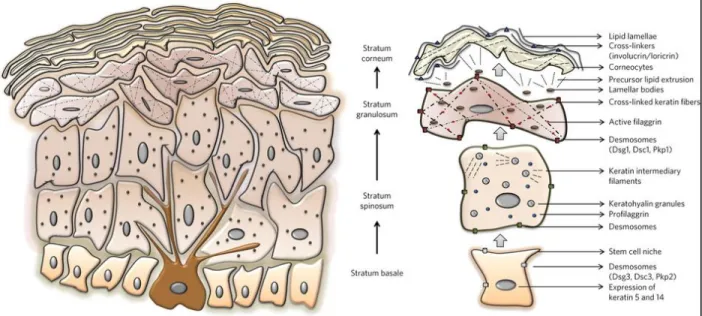
Figure 1.2 La kératinisation et l’évolution des cellules de l’épiderme.
Les marqueurs pour chaque strate cellulaire sont présentés à droite sur la figure, tirée de Vivek T Natarajan (2014) [28].
1.1.2 Fonctions de la peau
Les différentes structures de la peau permettent à celle-ci d’assurer des fonctions protectrices, sensitives et thermorégulatrices [3, 4].
Fonction de protection
Recouvrant l’ensemble du corps humain, la peau est considérée comme étant un des organes les plus importants [29], puisqu’elle confronte en permanence les constantes attaques des substances exogènes, qu’elles soient physiques, chimiques, biologiques ou thermiques [10, 30]. Ainsi, cette barrière biologique active et résistante qu’est la peau sert de système de défense primaire et protège le corps humain contre tous les dangers externes potentiels [1, 5]. Cette ultime frontière entre le milieu biologique et l’environnement vis-à-vis de la perméation de substances exogènes est assurée plus particulièrement par le stratum corneum [1]. La présence d’une enveloppe cornée, de même que d’une matrice lipidique qui s’intercale entre
12
les cornéocytes, confère à la CC sa grande résistance et son imperméabilité. Dans les années 80, Elias a comparé ce plan architectural de la CC à un mur de briques (cornéocytes) et mortier (matrice de lipides) [31, 32]. En effet, la matrice lipidique solidifie l’ensemble et empêche les infiltrations indésirables provenant de l’environnement externe ainsi que les pertes d’eau transépidermiques, propriété essentielle pour lutter contre la déshydratation de l’organisme [33]. Parmi les composants du mortier, les céramides sont les principaux constituants lipidiques et contribuent grandement à la perméabilité de la peau [11].
Par ailleurs, la peau offre une protection antimicrobienne, non seulement par sa protection physique, mais également grâce à son pH et à sa synthèse de peptides antimicrobiens (AMPs) [34, 35]. Mise à part les principaux constituants de la matrice lipidique de la CC (les acides gras libres, les glucosylcéramides et les sphingosines) qui fournissent une barrière antimicrobienne à la peau, cette dernière est un manteau acide qui joue un rôle primordial dans la défense antimicrobienne de l’organisme. En plus d’inhiber la croissance de certaines bactéries pathogènes qui se divisent mieux à pH neutre, un faible pH favorise le développement d’une microflore naturelle, créant ainsi un environnement moins propice à la croissance des microbes à la surface cutanée. De même, la peau produit un certain nombre de peptides et de protéines antimicrobiennes tels que les défensines 1 à 3 et les cathélicidines, jouant un rôle important dans les défenses innées de l'hôte.
En plus des activités antimicrobiennes directes contre diverses bactéries, virus et champignons, les AMPs activent les réponses immunitaires cellulaires et adaptatives. Les AMPs ont la capacité de moduler les réponses inflammatoires locales, qui influent sur la prolifération cellulaire, la cicatrisation des plaies et la production de chimiokines.
Tel qu’indiqué ci-dessus, la peau offre aussi une protection mécanique envers les diverses agressions externes que peut subir le corps humain,
13
telles qu’une coupure ou un écrasement, de par sa résistance, son extensibilité et sa compressibilité.
La peau, essentiellement la couche cornée, assure également une protection chimique où les kératines, de par leur structure, offrent la plus grande résistance envers les agents chimiques.
Principalement assurée par l’épiderme, la peau permet également une protection contre les rayonnements solaires. En effet, lors de la sudation, l’acide urocanique assure la formation d’un film hydrolipidique qui filtre les rayons ultraviolets de type B (UVB). De plus, la barrière cornéenne joue un rôle prépondérant en réfléchissant, diffractant et absorbant les rayonnements. Finalement, il existe une barrière mélanique qui a comme fonction principale la photoprotection de l’organisme. L’épiderme est composé de mélanocytes qui synthétisent un pigment appelé mélanine, jouant un rôle de filtre chimique, puisque ce pigment a la capacité d’absorber et de réfléchir les rayons UVB (90%), protégeant ainsi l’ADN des cellules qui réagit facilement à ce type de rayonnement [8, 21, 22, 36]. En fait, la mélanine est accumulée à l’intérieur d’organites, les mélanosomes, et ces derniers sont distribués au-dessus des noyaux kératinocytaires.
Grâce à la présence de structures particulières au niveau du derme, telles que les muscles pilo-moteurs et le réseau vasculaire, la peau sert également de protection thermique à l’organisme.
Thermorégulation
La thermorégulation est un mécanisme physiologique qui repose sur un équilibre constant entre les apports et les pertes de chaleur permettant à l’homme de maintenir sa température interne relativement constante. Il existe quatre modalités d’échange de chaleur entre la peau et l’environnement : la radiation, la convection, la conduction et l’évaporation. Or, la thermorégulation représente l’ensemble de ces processus permettant à l’être
14
humain de maintenir sa température interne. Afin de maintenir cette température centrale constante chez l’être humain, la température de la peau peut varier de façon importante, soit entre 20°C et 40°C, et ce, sans conséquence néfaste pour l’organisme. En fait, l’existence de ce gradient permet une perte de chaleur de la profondeur à la surface du corps, puis de celle-ci vers le milieu externe. Bref, la thermorégulation se traduit par la thermolyse, qui est la déperdition de chaleur, ou encore, par la thermogenèse, qui est la production de chaleur.
Un des rôles de la peau est alors la thermorégulation, puisqu’elle permet de maintenir la température du corps humain aux alentours de 37°C [37] et ce, grâce aux poils, aux glandes sudoripares et à la dilatation des vaisseaux sanguins [38]. En effet, la température du corps est régulée, entre autres, grâce à la variation du calibre des vaisseaux sanguins. Lorsque l’organisme est exposé à un milieu froid, cela entraîne une vasoconstriction afin de diminuer le flux sanguin et garder la chaleur du corps. Au contraire, lorsque la température du corps est augmentée, une vasodilatation s’observe afin de dissiper la chaleur. Une perte de chaleur se traduit également par la sudation (évaporation). Lorsque la température ambiante dépasse la température corporelle, la sudation reste le seul mécanisme permettant une perte de chaleur de l’organisme. Le phénomène de transpiration cutanée met en jeu les glandes sudoripares, qui se divisent en deux types différents : les glandes eccrines, localisées sur tout le revêtement cutané, et les glandes apocrines, localisées dans des zones précises et annexées aux follicules pilo-sébacés. Fonction d’échange : Absorption percutanée
L’absorption percutanée est la pénétration d’une molécule déposée à la surface de la peau au travers du Stratum corneum et des couches sous-jacentes et ce, jusqu’à la circulation sanguine. La fonction barrière de l’épiderme s’exerce dans les deux sens, c’est-à-dire qu’elle empêche la pénétration d’agents exogènes indésirables et évite la perte d’eau transépidermique vers le milieu externe. Cependant, l’imperméabilité de
15
l’épiderme est dite relative, puisqu’elle est mise à profit pour le passage d’un médicament ou d’un produit actif susceptible d’effectuer une action thérapeutique au sein de la peau elle-même ou au niveau systémique. En effet, bien que la couche cornée empêche le passage de différentes substances exogènes, plusieurs autres molécules peuvent y circuler. Différentes voies de pénétration peuvent être empruntées par les molécules à travers la peau. Il existe 3 différentes routes de pénétration : sudoripare, folliculaire et transépidermique (Figure 1.3 A). Le passage transépidermique est prédominant et est divisé en deux autres voies (Figure 1.3 B). Premièrement, il y a la voie intercellulaire, où les molécules traversent la couche cornée par les lipides intercellulaires et contournent les cornéocytes. La seconde voie est la voie transcellulaire, où les molécules pénètrent directement à travers les cornéocytes pour se rendre au derme [39]. Puisque l’intérieur de la bicouche lipidique est apolaire et hydrophobe, la voie intercellulaire est empruntée par les molécules hydrophobes, alors que la voie transcellulaire est empruntée plutôt par les molécules hydrophiles, étant donné que les têtes lipidiques sont polaires et hydrophiles. Ces différentes voies de pénétration se retrouvent impliquées dans l’administration transcutanée de médicaments. Il s’agit d’une technique non invasive qui permet d’évaluer l’activité de médicaments topiques ou encore l’innocuité de médicaments, de cosmétiques et d’autres agents susceptibles d’entrer en contact avec l’épiderme autant au niveau local que systémique [40].
Lorsqu'un médicament cible seulement une couche de la peau (par exemple la couche cornée), on parle de pénétration, alors que si le traitement cible plus d’une couche sans se rendre dans la circulation sanguine, on parle de perméation. Finalement, si le médicament traverse complètement la peau pour se retrouver dans la circulation sanguine et agir de façon systémique, on parle d’absorption percutanée. Lors du développement de produits dermopharmacologiques transdermiques, le principal défi se situe au niveau de la diffusion des substances dans le corps, due à la résistance de la barrière épidermique. L’information sur l’organisation moléculaire du Stratum
16
corneum est alors très importante pour la libération percutanée de
médicaments ou encore, pour le traitement des maladies de la peau.
Figure 1.3 Les différentes routes de pénétration cutanée.
A. Schématisation des 3 différentes voies de passage : la voie folliculaire (1);
la voie transépidermique (2); la voie sudoripare (3) B. Représentation des deux routes de pénétration cutanée qui caractérisent la voie transépidermique, tirées de El Maghraby, G.M et al (2008) [41].
Synthèse de la vitamine D
L’épiderme, plus précisément la couche cornée, joue un rôle essentiel dans la synthèse de la vitamine D. Cette vitamine, particulièrement nécessaire pour l’assimilation du calcium et la robustesse du squelette humain, est synthétisée dans l’organisme à partir d’un dérivé du cholestérol (7-déhydrocholestérol) sous l’action des UVB [42, 43]. L’apport en vitamine D chez l’être humain provient principalement de la synthèse cutanée (90%), alors qu’une faible quantité provient de l’apport nutritionnel [43].
1.2 Le psoriasis
Bien que le tégument assure la protection des tissus et des organes contre les agressions extérieures, il peut toutefois être déséquilibré par l’apparition de diverses maladies cutanées, telles que le psoriasis. Le psoriasis est une
17
dermatose érythémato-squameuse d’évolution chronique caractérisée par un prurit et une hyperréactivité exacerbée face à des stimuli allergiques, irritants ou encore microbiens. Cette pathologie inflammatoire affecte environ 3% de la population mondiale [44, 45]. Cependant, la prévalence de cette maladie cutanée varie considérablement dans les différents groupes ethniques. En effet, elle est plus fréquente chez les Caucasiens [45]. De plus, les différences génétiques, démographiques et environnementales [46] semblent jouer un rôle important sur la prévalence du psoriasis, bien que l’étiologie de cette dermatose reste incomprise à ce jour.
1.2.1 Différents types cliniques du psoriasis
La gravité de la maladie, de même que le phénotype, varient d’un patient à l’autre. En ce qui concerne la sévérité de la pathologie, elle est classée en trois catégories : légère, modérée et sévère. La plupart des personnes développent une forme légère avec quelques lésions, affectant moins de 2% de la peau. D’autres ont un psoriasis modéré qui touche 2% à 10% de la peau. La forme sévère affecte des régions cutanées plus grandes, voire même le corps entier. Cependant, cette dermatose peut être classifiée de type sévère même si l’atteinte corporelle par les lésions psoriasiques représente un faible pourcentage, car plusieurs autres paramètres que la superficie corporelle entrent en jeu lors d’un diagnostic dermatologique. En effet, cette classification de la gravité du psoriasis dépend de plusieurs signes cliniques, tels que les sites anatomiques atteints par les lésions psoriasiques, la taille, l’étendue et l’épaisseur de ces lésions, et, sans équivoque, le type de lésions, qui est le paramètre de première importance lors de l’examen du patient. En effet, il existe plusieurs variétés de cette maladie cutanée, soit le psoriasis en plaques, inversé, en gouttes et pustuleux, décrit ci-dessous (Figure 1.3) [47, 48]. Cependant, ces formes de psoriasis ne constituent pas des entités distinctes, ce sont des symptômes différents de la même maladie. Dans certains cas, une personne présentera plus d'une forme de psoriasis. Étant donné qu'il n'existe toujours pas de critères diagnostiques officiels pour
18
le psoriasis, l’Area Severity Index Psoriasis (PASI) est un outil largement employé afin de classifier la pathologie, puisqu’il prend en considération les diverses caractéristiques du psoriasis, nommées ci-dessus, en combinant la gravité des signes locaux (érythème, desquamation et épaisseur des plaques) et le pourcentage de la zone affectée. En bref, à partir de ce test, le corps est divisé en quatre sections (tête, bras, tronc et jambes), afin de mesurer le pourcentage de la superficie de la peau impliquée et la gravité des trois signes cliniques sur une échelle allant de 0 (aucune) à 4 (très sévère). Les quatre scores sont combinés entre eux afin d’obtenir un PASI final. Ce score sert essentiellement pour l’évaluation thérapeutique des différents traitements abordés à la section 1.2.3.
Figure 1.4 Phénotypes cliniques du psoriasis
Psoriasis en plaques (A-B) ; inversé (C) ; en gouttes (D) et pustuleux palmo-plantaire (E), tirée de Bélanger, A et al (2016) [49].
Le psoriasis en plaques
Le psoriasis en plaques, aussi connu sous le nom de psoriasis vulgaris, est la forme clinique la plus prédominante, affectant 90% des patients atteints par le psoriasis (Figure 1.4 A-B) [50]. Par conséquent, la majorité des études portant sur cette maladie de la peau sont basées sur ce type de psoriasis.
19
Cette pathologie cutanée se caractérise principalement par l’apparition de lésions érythémateuses aux contours bien définis, couvertes d’écailles argentées et sèches [51]. Les lésions psoriasiques précoces peuvent apparaître sous forme de petites papules et peuvent devenir plus enflammées. Les régions atteintes par ces plaques lésionnelles sont généralement les coudes, les genoux et la région lombaire (Figure 1.4 A). Les lésions psoriasiques peuvent parfois dominer les régions séborrhéiques et affecter les zones du cuir chevelu, de même que le visage comme les joues, le nez et les oreilles (Figure 1.4 B) [52]. Bien souvent, la dermite séborrhéique provoque une inflammation et un prurit qui favorisent l’apparition du psoriasis par un phénomène de Koebner, défini par l’apparition de nouvelles lésions sur une zone cutanée qui vient de subir un traumatisme, tel qu’une irritation, une égratignure ou de nouveaux éléments d’une dermatose (dermite séborrhéique). Cette distribution anatomique du psoriasis en plaques est appelée psoriasis séborrhéique ou sébopsoriasis [53].
Les lésions psoriasiques peuvent également être situées dans les zones de flexions, telles que les aisselles, la fente interfessier, l’aine et la région sous-mammaire (Figure 1.4 C) [50]. Lorsque les lésions psoriasiques touchent la peau qui entoure les articulations, le terme psoriasis "inversé" est davantage utilisé. Ce type de psoriasis se distingue des autres de par ses lésions rougeâtres, brillantes et humides sans squame, en raison de l’humidité plus importante des régions atteintes.
Le psoriasis en gouttes
Le psoriasis en gouttes est caractérisé par la présence de petites lésions en forme de gouttes sur le corps entier ; aucune plaque n’est observée (Figure 1.4 D). Ces lésions psoriasiques sont principalement situées dans les endroits où le frottement des vêtements est impliqué, comme le bas-ventre et le bas du dos, les avant-bras, la poitrine, de même que le cuir chevelu. Cette forme clinique de psoriasis survient généralement chez l’enfant, à la suite d’une infection par un streptocoque β-hémolytique, telle que l’amygdalite ou
20
la pharyngite. La plupart du temps, ce type de psoriasis se résorbe de lui-même suite à la prise d’antibiotiques, bien que dans certains cas, cette poussée puisse être le mode d’entrée dans la maladie psoriasique [54].
Le psoriasis pustuleux
Le psoriasis pustuleux est une forme sévère du psoriasis, dans laquelle les patients touchés souffrent de sensations de brûlures et de douleur intense. Bien souvent, cette variante du psoriasis progresse avec le psoriasis en plaques lorsque les plaques lésionnelles deviennent très enflammées et irritantes. Ce type de psoriasis se caractérise par la formation de pustules à l’intérieur desquelles se trouve un liquide jaunâtre composé principalement de globules blancs. Dans le psoriasis pustuleux, il existe deux formes : le psoriasis pustuleux généralisé et le psoriasis pustuleux palmo-plantaire [54, 55]. Le psoriasis pustuleux généralisé est une affection très sévère, où l’hospitalisation du patient est souvent nécessaire. Les lésions psoriasiques ont un aspect d’œdème et le corps entier est touché par ces lésions. À l’inverse, le psoriasis palmo-plantaire est très localisé puisqu’il ne touche que les mains et les pieds (Figure 1.4 E). Les lésions se présentent sous la forme de petites pustules translucides (diamètre moyen compris entre deux millimètres et un centimètre).
Le psoriasis érythrodermique
Contrairement aux autres types de psoriasis énumérés ci-dessus, le psoriasis érythrodermique ne produit pas de lésions individuelles ; toute la zone touchée est érythémateuse et enflammée. Dans les cas très graves, tout le corps est couvert de lésions.
Ce sont là les formes de psoriasis cutanés les plus courantes, bien qu’il existe d’autres types de psoriasis, tels que l’arthrite psoriasique (qui touche 5% des patients) et le psoriasis « unguéale », qui est l’atteinte de l’ongle.
21
1.2.2 Caractéristiques histologiques
Bien que la cause exacte du psoriasis ne soit toujours pas connue, les analyses histologiques mettent en évidence plusieurs caractéristiques importantes de la pathologie. Ces caractéristiques histologiques comprennent : 1) l’acanthose, 2) l’hyperkératose, 3) la parakératose, 4) une agranulose, 5) une papillomatose, 6) l’infiltration leucocytaire et 7) une augmentation de l’angiogenèse [56-58].
Analyses histologiques de la peau psoriasique
Essentiellement, les anomalies histologiques siègent au niveau de l’épiderme, étant donné que le dysfonctionnement le plus évident concerne l’activité du kératinocyte. Dans une plaque de psoriasis, il est possible d’observer une hyperplasie épidermique, causée par une hyperprolifération et une différenciation anormale des kératinocytes. L’hyperprolifération des kératinocytes psoriasiques provoque un épaississement de la peau, plus particulièrement une augmentation de l’épaisseur de la couche basale et de la couche épineuse de l’épiderme, augmentant ainsi le nombre de couches de cellules (acanthose). Cette hyperactivité kératinocytaire engendre également une accentuation des crêtes épidermiques, où celles-ci s’invaginent profondément dans le derme (papillomatose). Par ailleurs, l’hyperprolifération des kératinocytes s’accompagne d’anomalies dans la cornification du stratum corneum, qui est incomplète due à la persistance anormale des noyaux dans les cornéocytes (parakératose), ainsi que dans la fabrication de la kératine, avec notamment l’apparition de kératines de prolifération (hyperkératose).
Ainsi, le renouvellement accéléré des kératinocytes compromet leur différenciation et leur maturation normales au fur et à mesure de leur ascension dans l’épiderme, puisque les kératinocytes psoriasiques atteignent la surface cutanée en quelques jours seulement, comparativement aux kératinocytes normaux, où leur processus de différenciation cellulaire se
22
déroule entre quatre à six semaines [59]. La mauvaise différenciation des kératinocytes entraîne la réduction ou l’absence de la couche granuleuse (agranulose) ce qui affecte la barrière de la peau lésionnelle en augmentant par conséquent, sa perméabilité [60, 61]. Ces anomalies histologiques sont observables macroscopiquement sur une peau de patient atteint par le psoriasis. En effet, au niveau de la peau saine, l’intégrité de l’épiderme est conservée car la croissance kératinocytaire est régulée par la balance entre la survie cellulaire et la mort cellulaire. L’hyperprolifération et la différenciation hâtive des cellules épidermiques pathologiques influent le mécanisme de desquamation, les cellules cornifiées s’accumulent alors à la surface cutanée et une couche de pellicules blanches appelée squames est ainsi formée, ce qui est caractéristique des lésions psoriasiques.
La pathogénèse du psoriasis est également caractérisée par une infiltration excessive du derme et de l’épiderme par des cellules du système immunitaire, telles que les macrophages, les cellules dendritiques, les lymphocytes et les neutrophiles [62]. Les lymphocytes T jouent un rôle prépondérant dans l’initiation et le maintien de l’inflammation dans le psoriasis, ce qui mène à définir cette maladie comme une maladie auto-immune. En effet, les kératinocytes sont stimulés par des cytokines pro-inflammatoires provenant de ces cellules immunitaires, ce qui déclenche le processus inflammatoire. Cet afflux de leucocytes, plus particulièrement l’exocytose de neutrophiles, entraîne la formation de micro-abcès de Munro-Sabouraud caractéristiques du psoriasis dans la couche cornée [63, 64]. Finalement, au niveau du derme papillaire, le psoriasis se caractérise par l’augmentation de l’angiogenèse et la manifestation d’œdème. En fait, au sein de la plaque de psoriasis, les kératinocytes subissent une activation et sécrètent des cytokines qui augmentent l’angiogenèse, un phénomène qui se caractérise par la formation de nouveaux capillaires à partir de vaisseaux sanguins préexistants, ce qui accélère le processus inflammatoire et ainsi, la formation de plaques lésionnelles très rouges [64].
23 Analyses structurales de la peau psoriasique
Le dysfonctionnement kératinocytaire dans le psoriasis trouble le plan architectural de la peau. Dans une peau saine, la CG témoigne de la bonne différenciation et s’avère être incomplète, voire même absente dans une peau psoriasique. Ceci est caractérisé, entre autres, par la réduction en nombre, de même qu’en taille, des grains de kératohyaline et des filaments de kératines qu’elle contient. Ce phénomène résulte en effet de l’hyperprolifération kératinocytaire qui engendre une différenciation anormale de ces cellules de l’épiderme. Étant donné que les grains de kératohyaline jouent un rôle important au niveau de la formation de l’enveloppe cornée, de par leur synthèse de diverses protéines (profilaggrine et loricrine), et que les filaments de kératines assurent l’imperméabilité et la protection vis-à-vis les agressions externes, il est aisé de concevoir que cette modification physicochimique de la peau altère l’homéostasie du tissu et, par conséquent, ses fonctions.
Tout d’abord, il est connu de la littérature que la perméabilité d’une peau psoriasique est augmentée, comparativement à la peau saine. Dans la CG d’une peau pathologique, les corps lamellaires sont réduits en nombre et leur contenu est prématurément déversé par exocytose (jusqu’à la 4ème
couche antérieure à l’interface CG-CC) [65]. De ce fait, la transformation des bicouches lipidiques en lamelles lipidiques matures reste incomplète dans la partie inférieure de la CC. Par conséquent, les bicouches lipidiques restent dans une configuration globulaire, agrandissant les espaces intercornéocytaires. Par le fait même, le nombre insuffisant de corps lamellaires entraîne, à l’occasion, une absence complète de lipides dans les espaces intercornéocytaires, ce qui provoque inévitablement la perte de barrière de l’épiderme.
Cette barrière protectrice naturelle qu’est la peau est notamment altérée, tel qu’indiqué ci-haut, par des anomalies protéiques. En effet, les marqueurs de différenciation précoces, tels que l'involucrine et la transglutaminase l, sont
24
surexprimés dans la peau de patients atteints par le psoriasis, tandis que les marqueurs de différenciation tardifs, tels que la filaggrine et la loricrine normalement détectées dans la couche granuleuse de l’épiderme, sont sous-exprimé [66, 67]. La faible expression de la loricrine et de la filaggrine concorde avec les analyses biochimiques et structurales, puisque la maturation de la filaggrine et la synthèse de la loricrine dépendent des grains de kératohyaline, en moindre quantité dans la peau psoriasique. La faible expression de ces protéines dans la peau psoriasique contribue donc négativement à la fonction barrière cutanée, puisque la filaggrine est impliquée dans le façonnement de la couche cornée, conférant à cette dernière la capacité de retenir l’eau, alors que la loricrine est un des précurseurs protéiques permettant de produire l’enveloppe cornée.
La kératinisation est un processus continu qui se produit depuis les cellules souches et ce, tout au long de la maturation cellulaire (Figure 1.2). Dans une peau atteinte par le psoriasis, il existe un trouble au niveau de la kératinisation. Normalement, la localisation des kératines synthétisées par les kératinocytes diffère entre les couches épidermiques. Habituellement, dans la peau saine, les cellules de la CB synthétisent les cytokératines 5 et 14 (K5/K14), et les cellules suprabasales expriment les cytokératines 1 et 10 (K1/K10) qui remplacent les K5/K14 [15]. Toutefois, dans le psoriasis, l’hyperactivité des kératinocytes entraîne une modification dans le processus de kératinisation. L’expression des K5/K14 est augmentée et elles se trouvent partout dans l’épiderme, alors que l’expression des K1/K10 est diminuée dans les couches suprabasales de l’épiderme. Cette diminution de l’expression de K1 et K10 est justifiée par la formation d’une nouvelle paire de kératine nommée K6 et K16, également exprimée dans d'autres maladies hyperprolifératives [68]. Il est également possible de détecter dans les couches suprabasales la présence de la K17, également impliquée dans la pathogenèse de nombreuses maladies auto-immunes, y compris le psoriasis [47, 48]. En fait, l’interleukine 17 (IL-17) induit la production de cytokines
pro-25
inflammatoires dans divers types cellulaires, telles que l’IL-6 dans des fibroblastes [49].
Cependant, nombreuses sont les questions qui restent encore à élucider autour du dysfonctionnement de la barrière cutanée dans le psoriasis.
1.2.3 Traitements symptomatiques
Il existe de nos jours divers traitements symptomatiques afin d’atténuer les symptômes que provoque le psoriasis. Cependant, aucun de ces traitements ne permet une guérison complète de la pathologie. Étant donné qu’il existe plusieurs types de psoriasis et que la taille et l’étendue des lésions diffèrent d’un individu à l’autre, plusieurs traitements différents sont disponibles. Il existe quatre grandes classes de traitements actuellement sur le marché afin de maîtriser les différents symptômes que provoque le psoriasis : les traitements locaux, les traitements systémiques, la photothérapie et les agents biologiques. Pour choisir la meilleure approche thérapeutique pour le patient psoriasique, plusieurs facteurs doivent être considérés. Parmi ces facteurs, il y a non seulement le type de psoriasis, la surface corporelle impliquée et la localisation des lésions, mais également l’âge du patient et son état général, le sexe (à savoir s’il y a planification d’une grossesse), les traitements antérieurs et les attentes du patient vis-à-vis du traitement. En outre, comme le psoriasis est une maladie douloureuse et inconfortable, cette dermatose affecte l’état psychique du malade. Or, il est important de tenir compte du comportement psychosocial du patient lors d’un diagnostic afin de maximiser l'efficacité du traitement et d’améliorer, par le fait même, la qualité de vie de ce dernier. Ainsi, la prise en charge du patient atteint par le psoriasis est souvent complexe, puisque ceux-ci tolèrent de façon très variable la pathologie ; certains la supportent remarquablement bien, alors que d’autres ne s’y habituent jamais. Toutefois, la plupart des patients se situent entre ces deux extrêmes.
26 Thérapies locales
Les traitements topiques se présentent sous différentes formes galéniques, telles que les pommades, les crèmes ou les gels, que l'on applique directement sur les plaques psoriasiques. En règle générale, les traitements locaux sont utilisés pour soulager les formes de psoriasis légères à modérées. Parmi les traitements topiques en dermatologie, il y a les corticostéroïdes et les dérivés de cortisone, les dérivés de la vitamine D3, les rétinoïdes ainsi que les dérivés de la vitamine A. L’hydrocortisone d’acétate est le premier corticostéroïde développé pour le traitement de maladies inflammatoires, telles que le psoriasis. Les corticostéroïdes et les dérivés de la cortisone exercent plusieurs actions dans l’organisme et ciblent principalement l’inflammation. Au niveau cellulaire, il y a formation du complexe récepteur-stéroïde où ce dernier, grâce à sa liaison au glucocorticoïde à l’intérieur du noyau des cellules, stimule ou inhibe la transcription et la synthèse de protéines. En effet, les corticostéroïdes ont la capacité de réguler négativement l’expression de cytokines pro-inflammatoires, telles que les ILs 1, 2 et 6 et de stimuler la transcription de gènes codant pour des cytokines anti-inflammatoires, comme l’IL-10 [69]. Bien que le mécanisme demeure toujours incompris, les médicaments dérivés de la vitamine D3 [70], tels que le calcitriol et le calcipotriol (un dérivé
synthétique du calcitriol), sont efficaces au niveau du psoriasis. Selon un mécanisme faisant intervenir les récepteurs de la vitamine D, cette catégorie de traitements topiques permet d’éviter l’hyperprolifération et la migration anormales des cellules de l’épiderme psoriasique, notamment grâce à la capacité de ces médicaments à augmenter la concentration de calcium intracellulaire des kératinocytes, ce qui favorise la différenciation kératinocytaire.
Les rétinoïdes et les dérivés de synthèse de la vitamine A, comme le tazarotène, sont également approuvés par la Food and Drug Administration (FDA) afin de traiter le psoriasis en plaques. Le tazarotène joue un rôle au
27
niveau de la régulation de la prolifération kératinocytaire et de la normalisation de leur diférenciation via l’action de son métabolite, l’acide tazaroténique. Ce dernier interagit avec le récepteur de l’acide rétinoïque de type gamma (RAR-γ), qui est une protéine de la superfamille des récepteurs nucléaires liant la vitamine A [71-73]. Ce complexe récepteur-stéroïde réduit ainsi la quantité de protéines activatrices 1 (AP-1), une protéine présente de façon importante dans les peaux hyperprolifératives comme le psoriasis [74, 75]. D’un point de vue génétique, l’action du métabolite affecte de façon directe la transcription de gènes (Tazarotene-induced genes: TIG1, TIG2 et TIG3), ce qui a pour effet de réduire la prolifération cellulaire, entre autres, via la production d’un inhibiteur de la prolifération des kératinocytes (TIG3) [73, 76]. Par ailleurs, le tazarotène permet de réguler plusieurs marqueurs de différenciation cellulaire qui sont surexprimés (transglutaminase I, involucrine, K6/K16) ou sous-exprimés (filaggrine, K10).
Bien que ces traitements topiques soient efficaces pour atténuer les symptômes provoqués par le psoriasis, ceux-ci présentent des propriétés toxicologiques et des effets indésirables lorsqu’ils sont utilisés sur une période prolongée ou en grande quantité. Parmi les effets indésirables, il y a l’atrophie et l’irritation cutanées, l’apparition de télangiectasie, la tachyphylaxie et l’hypercalcémie.
Thérapies systémiques
Les traitements systémiques se présentent sous forme de comprimés ou de solutions. Habituellement, ce type de thérapie est réservé aux formes modérées à sévères de la pathologie. Cependant, les thérapies systémiques seules ou en association avec les traitements topiques peuvent être utilisées dans les formes légères de psoriasis dans les cas d’échec de la thérapie locale, ou encore, lorsque la maladie provoque une diminution de la qualité de vie justifiant ainsi l’intervention de thérapies systémiques. Sinon, les traitements systémiques sont prescrits dans les cas de psoriasis touchant