Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées (SFA) Institut de physiologie et biologie cellulaires - IPBC (Poitiers)
(Diplôme National - Arrêté du 7 août 2006)
École doctorale : Biologie-santé - Bio-santé (Limoges)
Secteur de recherche : Aspects moléculaires et cellulaires de la biologie
Présentée par :
Aurélie Mercier-François
Adressage et expression fonctionnelle des canaux sodiques cardiaques Nav1.5 : rôle majeur de la sous-unité régulatrice 1
Directeur(s) de Thèse : Patrick Bois, Aurélien Chatelier
Soutenue le 13 septembre 2013 devant le jury
Jury :
Président Marc Mesnil Professeur des Universités, Université de Poitiers Rapporteur Pierre Charnet Directeur de recherche CNRS, Université de Montpellier Rapporteur Flavien Charpentier Directeur de recherche INSERM, Université de Nantes Membre Patrick Bois Professeur des Universités, Université de Poitiers Membre Aurélien Chatelier Maître de conférences, Université de Poitiers Membre Mohamed Chahine Professeur des Universités, Université de Laval
Pour citer cette thèse :
Aurélie Mercier-François. Adressage et expression fonctionnelle des canaux sodiques cardiaques Nav1.5 : rôle majeur de la sous-unité régulatrice 1 [En ligne]. Thèse Aspects moléculaires et cellulaires de la biologie. Poitiers : Université de Poitiers, 2013. Disponible sur Internet <http://theses.univ-poitiers.fr>
Pour l obtention du grade de
DOCTE†R DE L †N)‡ERS)TE DE PO)T)ERS
(Faculté des Sciences Fondamentales et Appliquées)(Diplôme National – Arrêté du 7 août 2006) Ecole Doctorale Bio-Santé
Secteur de Recherche : Aspects Moléculaires et Cellulaires de la Biologie
Présentée par :
Aurélie MERCIER-FRANÇOIS
*****************************Adressage et expression fonctionnelle
des canaux sodiques cardiaques Nav1.5 :
rôle majeur de la sous-
unité régulatrice .
***************************** Directeur de Thèse : Pr. Patrick BOIS Co-directeur de Thèse : Dr. Aurélien CHATELIER
***************************** Soutenue le 13 Septembre 2013 Devant la Commission d Examen
*****************************
JURY
Dr. Flavien CHARPENTIER Directeur de Recherche INSERM, Université de Nantes Rapporteur Dr. Pierre CHARNET Directeur de Recherche CNRS, Université de Montpellier Rapporteur Pr. Mohamed CHAHINE Professeur, Université Laval Examinateur Pr. Marc MESNIL Professeur, Université de Poitiers Examinateur Dr. Aurélien CHATELIER Maître de Conférences, Université de Poitiers Examinateur Pr. Patrick BOIS Professeur, Université de Poitiers Examinateur
SOMMAIRE
TABLE DES ILLUSTRATIONS ________________________________________________________________________________ 6
ABREVIATIONS ________________________________________________________________________________________________ 8
INTRODUCTION ______________________________________________________________________________________________ 13 Chapitre I – Les canaux sodiques dépendants du potentiel _________________________________________ 13
I – La famille des VGSC _____________________________________________________________________________ 13 A) Historique ____________________________________________________________________________________ 13 B) Les VGSC au sein de la superfamille des canaux ioniques dépendants du potentiel ______ 14 C) Membres des VGSC et leurs particularités _________________________________________________ 16 D) Cœur et VGSC ________________________________________________________________________________ 20
II – Nav1.5 ____________________________________________________________________________________________ 21
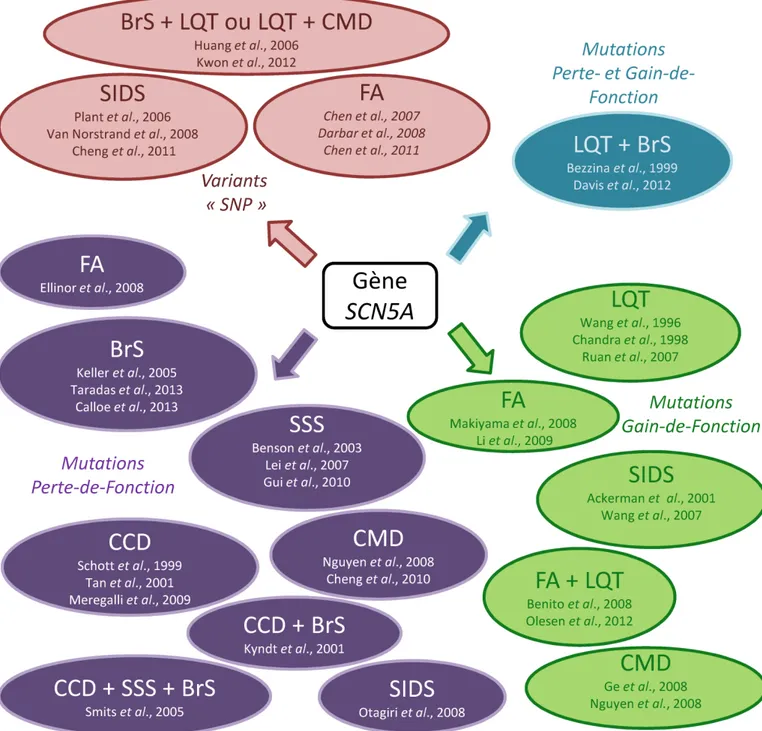
A) Structure protéique _________________________________________________________________________ 21 B) Propriétés biophysiques _____________________________________________________________________ 22 C) Fonctions et rôles physiologiques___________________________________________________________ 24 III – Modulation du canal Nav1.5 _________________________________________________________________ 27 A) Modulation de l’expression _________________________________________________________________ 27 B) Protéines partenaires _______________________________________________________________________ 35 C) Pharmacologie ______________________________________________________________________________ 38 IV – Canalopathies cardiaques liées à Nav1.5 __________________________________________________ 40 A) Syndrome de Brugada ______________________________________________________________________ 42 B) Syndrome du Long QT3 _____________________________________________________________________ 50 C) Syndrome de la mort subite du nourrisson _________________________________________________ 51 D) Troubles de la conduction : Maladie de Lev-Lenègre ______________________________________ 52 E) Dysfonction sinusale ________________________________________________________________________ 53 F) Cardiomyopathie Dilatée ___________________________________________________________________ 53
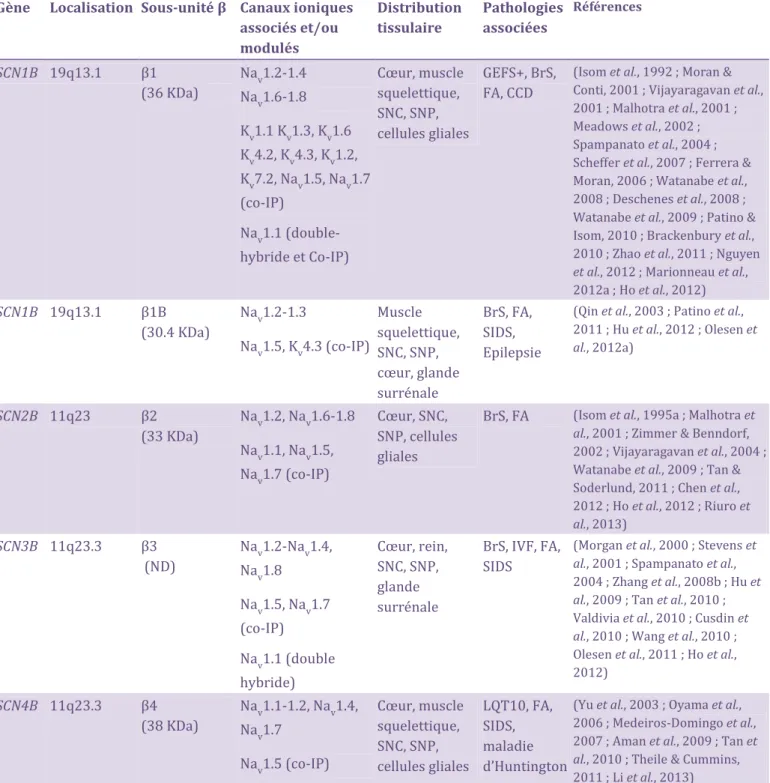
G) Fibrillation Atriale __________________________________________________________________________ 54 H) Syndromes mixtes et phénomène « overlap syndromes »__________________________________ 55 IV – Les sous-unités auxiliaires Nav ____________________________________________________________ 56 A) Structure protéique et expression tissulaire _______________________________________________ 56 B) Fonctions, modulation et interactions _____________________________________________________ 58 C) Physiopathologies associées aux sous-unités ____________________________________________ 66
Chapitre II – L’adressage protéique _____________________________________________________________________ 67
I – Points de contrôle & maturations protéiques _____________________________________________ 67 A) Maturation et rôle des N-glycanes__________________________________________________________ 67 B) Contrôle Qualité du RE et rôles des chaperonnes __________________________________________ 71 C) Réponse au stress réticulaire _______________________________________________________________ 73 D) Défauts d’adressage des mutants Nav1 : stratégies de correction ________________________ 75
II – Transport et ciblage membranaires ________________________________________________________ 76 A) Rôle du cytosquelette ________________________________________________________________________ 76 B) Distribution subcellulaire : modèle du « two-pool » _______________________________________ 77
MATERIELS ET METHODES ________________________________________________________________________________ 83
I – Matériels cellulaires ___________________________________________________________________________ 84 A) Les cellules HEK293T _______________________________________________________________________ 84 B) Conditions de culture ________________________________________________________________________ 85 C) Entretien et conservation ___________________________________________________________________ 85 D) La lignée stable Nav1.5 ______________________________________________________________________ 87 II – Matériels plasmidiques _______________________________________________________________________ 87 A) Vecteurs ______________________________________________________________________________________ 87 B) Transformations bactériennes ______________________________________________________________ 89 C) Amplification et extraction plasmidiques __________________________________________________ 89 D) Dosage et vérification des ADN _____________________________________________________________ 90 III – Transfection transitoire : méthode du phosphate de calcium _________________________ 90 A) Principe ______________________________________________________________________________________ 90 B) Protocole _____________________________________________________________________________________ 91 IV – Conditions de culture et traitements pharmacologiques _______________________________ 92 A) Agents restaurateurs de Nav1.5_____________________________________________________________ 92
B) Modulateurs de l’adressage et de la dégradation protéiques _____________________________ 93 V– Approches biochimiques ______________________________________________________________________ 94 A) Extractions protéiques ______________________________________________________________________ 94 B) Western blot _________________________________________________________________________________ 96 C) Biotinylation de surface _____________________________________________________________________ 98 D) Co-immunoprécipitation __________________________________________________________________ 100 E) Digestions des N-glycanes _________________________________________________________________ 101 VI – Techniques de biologie cellulaire ________________________________________________________ 103 A) Immunofluorescence ______________________________________________________________________ 103 B) Technique de luminométrie ELISA de surface ___________________________________________ 105 VII – Techniques d’électrophysiologie cellulaire : le patch clamp ________________________ 107 A) Histoire et principe ________________________________________________________________________ 107 B) La configuration cellule entière __________________________________________________________ 108 C) Matériel et dispositif expérimental _______________________________________________________ 111 D) Protocoles de stimulation et méthodes d’analyse ________________________________________ 113 VIII – Traitements des données et analyses statistiques __________________________________ 115
RESULTATS _________________________________________________________________________________________________ 117 Chapitre I – Caractérisation de deux « mutants Brugada » du canal Nav1.5 : mise en évidence
d’un effet dominant négatif dépendant de la sous-unité . _____________________________________ 117
I – Etude comparative des mutants d’adressage R G et L R du canal sodique cardiaque __________________________________________________________________________________________ 118 II – Impact de la co-expression des mutants avec les canaux sauvages _________________ 120 A) Approche électrophysiologique ___________________________________________________________ 122 B) Approche biochimique ____________________________________________________________________ 127 III – Mise en évidence de l’implication de la sous-unité auxiliaire dans l’interaction des sous-unités _________________________________________________________________________________ 129 A) Cadre d’étude ______________________________________________________________________________ 129 B) Résumé _____________________________________________________________________________________ 131 C) Article : The 1-subunit of Nav1.5 cardiac sodium channel is required for a dominant
Chapitre II – Caractérisation des états de maturation et du devenir des canaux Nav1.5 ___ 143
I – Validation des modèles de surexpression transitoire et stable : les cellules HEK293T ______________________________________________________________________________________________________ 143 II – Mise en évidence des états de N-glycosylations de Nav1.5 ____________________________ 145 III – Etude des voies protéolytiques impliquées dans la dégradation de Nav1.5 _______ 149 IV – Etude préliminaire : Implication de la réponse UPR et de la voie autophagique _ 153
Chapitre III – Caractérisation du mutant S9 L et de son effet dominant négatif -dépendant __________________________________________________________________________________________________ 156
I – Cadre d’étude __________________________________________________________________________________ 156 II – Résumé ________________________________________________________________________________________ 157 III – Reproduction du manuscrit : Myotonic dystrophy type mimics and exacerbates Brugada phenotype induced by Nav . sodium channel loss of function mutation __ 158 IV – Résultats complémentaires _______________________________________________________________ 177 DISCUSSION _________________________________________________________________________________________________ 183 CONCLUSION GENERALE _________________________________________________________________________________ 194 REFERENCES BIBLIOGRAPHIQUES _____________________________________________________________________ 198 RESUME _____________________________________________________________________________________________________ 231 ABSTRACT __________________________________________________________________________________________________ 232 ANNEXES ____________________________________________________________________________________________________ 234
TABLE DES ILLUSTRATIONS
Liste des Figures
Figure 1 : Illustration de la superfamille des canaux ioniques dépendants du potentiel chez les mammifères. ____________________________________________________________________ 15 Figure 2 : Représentation schématique de la topologie membranaire des canaux sodiques dépendants du potentiel. __________________________________________________________ 18 Figure 3 : Représentation schématique des états conformationnels du canal Nav1.5. _________ 23
Figure 4 : Représentation schématique de l activité électrique cardiaque humaine. __________ 25 Figure 5 : Représentation schématique de la structure des variants d épissage du canal Nav1.5. 28
Figure 6 : Illustration des protéines régulatrices partenaires des canaux Nav1.5 et de leurs sites
d interaction sur la sous-unité . ___________________________________________________ 31 Figure 7 : )llustration de la localisation des sites d action et de liaison des neurotoxines et des anti-arythmiques de classe 1b sur les canaux VGSC. ___________________________________ 39 Figure 8 : Illustration des différentes physiopathologies cardiaques associées à des mutations ou à des polymorphismes du gène SCN5A. ______________________________________________ 41 Figure 9 : Aspects électrocardiographiques typiques du syndrome de Brugada observés dans les dérivations précordiales droites. ___________________________________________________ 43 Figure 10 : )llustration de l hypothèse de la repolarisation associée au BrS. ________________ 47 Figure 11 : )llustration de l hypothèse de la dépolarisation associée au BrS. ________________ 49 Figure 12 : Les sous-unités sodiques et leurs sites d interaction avec les protéines partenaires. _______________________________________________________________________________ 60 Figure 13 : Illustration simplifiée de la voie de sécrétion protéique intracellulaire. __________ 68 Figure 14 : Illustration du processus de N-glycosylation. ________________________________ 70 Figure 15 : )llustration du devenir d une glycoprotéine néosynthétisée dans la lumière du réticulum endoplasmique : Cycle Calnexine / Calréticuline et voie ERAD. __________________ 72 Figure 16 : )llustration de la voie adaptative activée lors d un stress réticulaire chez les mammifères. ____________________________________________________________________ 74 Figure 17 : Représentation schématique de la localisation sarcolemmique des deux sous-populations cardiaques de canaux Nav1.5. ___________________________________________ 78
Figure 18 : Bilan schématique récapitulant les modèles cellulaires utilisés et les trois axes principaux d étude développés durant ce projet. ______________________________________ 83 Figure 19 : Représentation schématique de la structure du réactif de biotinylation EZ-Link® Sulfo-NHS-SS-Biotin (Thermo Scientific). ____________________________________________ 99 Figure 20 : Représentation schématique de la locasition des sites de clivage des enzymes de déglycosylation. ________________________________________________________________ 102 Figure 21 : Représentation schématique du protocole simplifié de la technique de luminométrie ELISA (Enzyme-Linked ImmunoSorbent Assay) de surface. ____________________________ 105 Figure 22 : Représentation schématique du circuit électrique équivalent en configuration cellule entière. _______________________________________________________________________ 109 Figure 23 : Traces représentatives du potentiel de membrane et du courant capacitif résultant lors de l application d une stimulation en configuration cellule entière. __________________ 110 Figure 24 : Les mutants R1432G et L325R Nav . présentent un défaut d adressage par rétention
dans des compartiments intracellulaires. ___________________________________________ 119 Figure 25 : Les mutations R1432G et L325R du canal Nav1.5 abolissent totalement ou
partiellement le courant sodique INa. _______________________________________________ 121
Figure 26 : La co-expression des mutants R1432G et L325R avec les canaux Nav1.5 sauvages
Figure 27 : L effet dominant négatif exercé par les mutants R G et L R ne résulte pas de l altération des propriétés biophysiques des canaux sauvages. _________________________ 125 Figure 28 : Les mutants R G et L R altèrent l adressage membranaire des canaux Nav1.5
sauvages. ______________________________________________________________________ 128 Figure 29 : L expression du mutant R G ainsi que sa co-expression avec les canaux sauvages Nav . n influencent pas leur dégradation liée au protéasome. _________________________ 141
Figure 30 : La sous-unité 1module l interaction entre les sous-unités sauvages Nav1.5. ___ 142
Figure 31 : Les canaux Nav1.5 présentent différents états de maturation et/ou de dégradation. 144
Figure 32 : Les canaux Nav1.5 présentent différents états de N-glycosylation. ______________ 146
Figure 33 : Les canaux Nav1.5 sont adressés à la membrane via les voies de sécrétion classique et
non conventionnelle. ____________________________________________________________ 148 Figure 34 : Les canaux Nav1.5 sont dégradés via la voie lysosomale. ______________________ 151
Figure 35 : Effet de la déprivation en acides aminés sur l expression des canaux Nav1.5. _____ 154
Figure 36 : Le mutant S910L exerce un effet dominant négatif sur la localisation membranaire des canaux Nav1.5 sauvages. _________________________________________________________ 178
Figure 37 : L effet dominant négatif exercé par le mutant S910L sur les canaux sauvages est aboli en absence de la sous-unité 1. ____________________________________________________ 180
Figure 38 : Modèle illustrant l adressage, la maturation et la dégradation des canaux Nav1.5 dans
le modèle cellulaire HEK293T. ____________________________________________________ 196
Liste des Tableaux
Tableau 1 : Récapitulatif des caractéristiques des membres composant la famille des sous-unités des ‡GSC chez l (omme. ________________________________________________________ 17 Tableau 2 : Gènes associés au syndrome de Brugada. ___________________________________ 44 Tableau 3 : Récapitulatif des caractéristiques des isoformes composant la famille des sous-unités des ‡GSC chez l (omme. ________________________________________________________ 57 Tableau 4 : Récapitulatif des plasmides utilisés détaillant le type de vecteur, l insert cloné ainsi que le type et la position des tags pour les ADNc codant la protéine étiquetée. _____________ 88 Tableau 5 : Récapitulatif des conditions de transfections réalisées en fonction des expériences menées. ________________________________________________________________________ 91 Tableau 6 : Récapitulatif des anticorps primaires utilisés pour la détection protéique en western-blot. ___________________________________________________________________________ 97 Tableau 7 : Récapitulatif des anticorps primaires utilisés pour l immunofluorescence. ______ 104 Tableau 8 : Tableau récapitulatif des paramètres biophysiques des canaux sauvages (WT) et mutants co-exprimés dans les cellules HEK293T avec la sous-unité 1. ___________________ 126
Tableau 9 : Tableau récapitulatif des paramètres biophysiques des canaux sauvages (WT) et mutant S910L co-exprimés dans les cellules HEK293T avec ou sans la sous-unité 1. _______ 181
ABREVIATIONS
ABC ATP Binding Cassette
ADAM-10 A Disintegrin And Metalloproteinase-10
ADN Acide DésoxyriboNucléique ARF1 ADP Ribosylation Factor 1
ATF6 Activating Transcription Factor 6
BACE-1 -site Amyloid precursor protein-Cleaving Enzyme 1
BiP Binding immunoglobulin Protein
BrS Syndrome de Brugada CAM Cell Adhesion Molecules
CaP Phosphate de Calcium
Cav Voltage-Gated Calcium Channel
CCD Cardiac Conduction Disease
CHU Centre Hospitalier Universitaire
CFTR Cystic Fibrosis Transmembrane conductance Regulator
CHO Chinese Hamster Ovary
CHOP C/EBP Homologous protein
CMD Cardiomyopathie dilatée CNG Cyclic Nucleotide-Gated channel
CNX Calnexine
Co-IP Co-immunoprécipitation COPII/COPII Coat protein complex I/II CRT Calréticuline
DM1 Dystrophie Myotonique de type 1 DMEM Dulbecco’s Modified Eagle Medium DMPK Dystrophia Myotonica Protein Kinase
DMSO Diméthyl Sulfoxide DO Densité Optique ECG Electrocardiogramme
EDEM Endoplasmic reticulum Degradation-Enhancing 1,2 mannosidase-like protein
EDTA acide éthylène diamine tétraacétique ELISA Enzyme-Linked ImmunoSorbent Assay
e)F eukaryotic translation Initiation Factor 2
Endo H endoglycosidase H
ERAD Endoplasmic Reticulum Associated Degradation
ERGIC Endoplasmic Reticulum/Golgi Intermediate Compartment
ERMan1 -mannosidase 1 FA Fibrillation Atriale
FHF Facteur de croissance des fibroblastes Foxo1 Forkhead box protein O1
FRET Fluorescence Resonance Energy Transfert
GBF1 Golgi-specific Brefeldin A-resistance guanine nucleotide exchange factor 1
G3PD1-L Glycerol-3-Phosphate Dehydrogenase 1-Like
GEFS+ Generalized Epilepsy Febrile Seizure +
GRP Glucose Related Protein
HCN Hyperpolarization-activated cyclic Nucleotide-gated channel
HEBS HEPES-Buffered Saline
HEK293T Human Embryonic Kidney 293T
HEPES acide 4(-2-HydroxyEthyl)-1-Pipérazine Ethane Sulfonique hERG human ether-a-go-go related gene
hH1 human Heart 1
HRP Horse-Radish Peroxydase
HSP Heat Shock Protein
Ig-like Immunoglobulin-like
IRE1 Inositol-REquiring kinase 1
IVF Idiopathic Ventricular Fibrillation
IC50 concentration causant % d inhibition KChIP2 Kv Channel Interacting Protein 2
KI Knock-In
KO Knock-Out
LC3 microtubule-associated protein 1 Light Chain 3
LQT Syndrome du Long QT
MAGUK Membrane Associated GUanylate Kinase
MOG-1 multicopy suppressor of gsp1
NAD(H) Nicotinamide Adénine Dinucléotide
Nedd4-2 Neuronal precursor cell expressed developmentally downregulated protein 4-2
NB-DNJ N-butyldeoxynojirimycin
NF-κB Nuclear Factor-kappa B
NrCAM NgCAM related cell adhesion
PBS Phosphate Buffered Saline
PCCD Progressive Cardiac Conduction Defect
PDZ acronyme de PSD-95 (Post-Synaptic Density-95), de Dlg (Drosophila disc-
large tumor suppressor) et Z0-1 (Zona Occludens-1)
PERK PKR (double-stranded RNA-activated protein kinase)-like Endoplasmic Reticulum Kinase
PFA ParaFormAldéhyde PKA Protéine Kinase A PKC Protéine Kinase C PNGase Peptide N-glycosidase F PTPH1 Protein Tyrosin PHosphatase 1 Ran Ras-related nuclear GTPase RE (ou ER) Réticulum Endoplasmique
RIPA Radio-ImmunoPrecipitation Assay RLU Relative Light Unit
ROS Espèce réactive à l oxygène
RPTP Receptor Protein Tyrosine Phosphatase RVOT Right Ventricular Outflow Tract
SAP97 Synapse Associated Protein 97
SERCA1 Sarcoplasmic/Endoplasmic Reticulum Calcium-ATPase1
SIDS Suddent Infant Death Syndrome
SLMAP SarcoLemmal Membrane-Associated Protein
SNC Système Nerveux Central SNP Système Nerveux Périphérique
SDS-PAGE Sodium Dodecyl Sulfate PolyAcrylamide Gel Electrophoresis
SSS Sick Sinus Syndrome
ST3Gal4 beta-galactoside alpha-2,3-sialyltransferase 4
TBS Tris-Buffered Saline
TBX5 T-box transcription factor
TGN Trans Golgi Network
TPC Two-Pore Channel
TRP Transient Receptor Channel
TTX Tétrodotoxine Tubule T Tubule transverse
UPR Unfolded Protein Response
UPS Ubiquitin Proteasome System
VGSC ou Nav Voltage-Gated Sodium Channel
WB Western Blot
INTRODUCTION
La famille des canaux ioniques dépendants du potentiel est considérée comme étant à l origine de l excitabilité électrique chez les êtres vivants. Parmi ses membres, figurent les canaux sodiques dépendants du potentiel (VGSC, Voltage-Gated Sodium
Channels) qui jouent un rôle primordial dans la genèse et la propagation rapide des
influx électriques dans les cellules excitables. Ces vecteurs sodiques sont considérés comme étant les plus récents dans la phylogénèse générale des canaux ioniques.
Chapitre I – Les canaux sodiques dépendants du potentiel
I – La famille des VGSC
A) HistoriqueA partir des années 1950, les travaux initiés et menés par Hodgkin et Huxley sur l axone géant de calmar, ont mis en évidence l existence d une perméabilité sodique générant une dépolarisation membranaire ainsi qu une inversion du potentiel de membrane lors des potentiels d actions dans les cellules excitables (Hodgkin & Huxley, 1952 ; Hodgkin et al., 1952). Bien qu ait rapidement émergé l idée que cette perméabilité résulterait d un courant transitant par une protéine canalaire membranaire, son identité resta inconnue jusqu en . En effet, une trentaine d années furent nécessaires pour cloner le premier membre de la famille des VGSC à partir de l organe électrique du Gymnote Electrophorus electricus (Noda et al., 1984). Il faut tout de même noter que dans les années 70- , l utilisation d approches biochimiques avait avant cela permis d identifier puis de purifier les sous-unités protéiques et associées à partir de cellules de neuroblastome, de muscles squelettiques et de cerveaux de rats (Beneski & Catterall, 1980 ; Hartshorne et al., 1982 ; Barchi, 1983).
B) Les VGSC au sein de la superfamille des canaux ioniques dépendants du potentiel
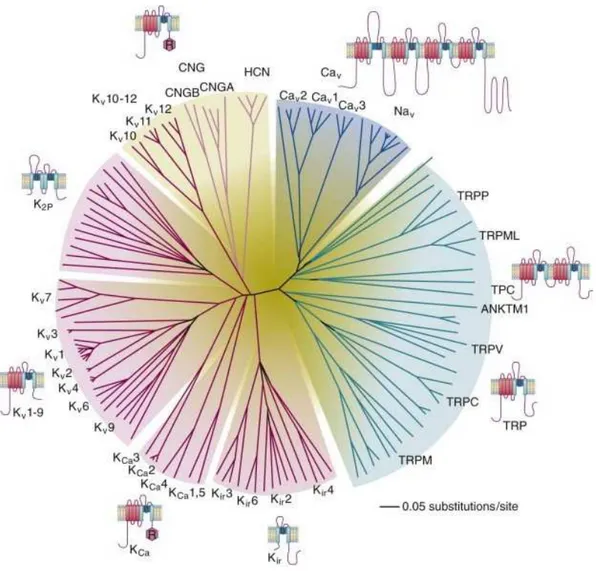
De par la découverte de leur fonction dans les cellules excitables et le clonage de la sous-unité , les VGSC ou Nav furent les membres fondateurs de la superfamille des canaux ioniques dépendants du potentiel (Figure 1). Cette famille comprendrait 143 protéines canalaires réparties en plusieurs sous-groupes dont les protéines à quatre domaines de six segments transmembranaires (Nav et Cav), les canaux à deux domaines de six segments transmembranaires (TPC pour Two-Pore Channel), les canaux à un domaine dont font partie les canaux potassiques à deux (Kir), à quatre (K2P) ou à six segments transmembranaires (Kv, KCa), les canaux sensibles directement aux nucléotides cycliques (HCN pour Hyperpolarization-activated cyclic Nucleotide-gated channel et CNG pour Cyclic Nucleotide-Gated channel) et enfin les canaux cationiques non sélectifs (TRP pour Transient Receptor Channel) (Yu et al., 2005).
Du point de vue de l évolution génique, les canaux potassiques dépendants du potentiel Kv ont été les premiers à apparaître chez les bactéries (Anderson & Greenberg, 2001). La structure de ces protéines comprend six segments transmembranaires capables de se tétramériser afin de former un canal fonctionnel. Bien que des canaux sodiques dépendants du potentiel à six segments transmembranaires (NavBac) existent chez les bactéries, l apparition des canaux Nav chez les eucaryotes semble avoir une autre origine (Koishi et al., 2004). En effet, au cours de l évolution des eucaryotes, des duplications successives d un gène codant pour une protéine de type Kv auraient abouti à la naissance d une protéine canalaire formée de quatre domaines à six segments transmembranaires, structure partagée par les canaux Cav et Nav (Zakon, 2012). Une étude phylogénétique a d autre part récemment corroboré l hypothèse selon laquelle les canaux sodiques Nav auraient évolué à partir des canaux calciques Cav (Liebeskind et al., 2011).
Figure 1 : Illustration de la superfamille des canaux ioniques dépendants du potentiel chez les mammifères.
La relation entre les différents membres est établie par les similarités entre les séquences en acides aminés correspondant à la région du pore de chaque canal D après Yu et al., 2005).
C) Membres des VGSC et leurs particularités
Chez les mammifères, la famille des VGSC est composée de dix isoformes différenciables de par leur distribution tissulaire, leur résistance relative à la tétrodotoxine (TTX), leurs séquences protéiques notamment dans les parties intracellulaires, et principalement leurs propriétés biophysiques. Certaines de ces caractéristiques sont résumées dans le Tableau 1, la sensibilité à la TTX étant définie par une IC50 (concentration causant % d inhibition de l ordre du nanomolaire.
Un système de nomenclature, similaire à celle utilisée pour les canaux Kv, a permis d uniformiser le nom de chaque membre de la famille des ‡GSC (Goldin et al., 2000). Le symbole chimique de la principale espèce ionique perméante (Na) est suivi en indice par le principal régulateur physiologique, ici le voltage (Nav). Sont ensuite accolés un chiffre précisant la sous-famille du gène séparé par un point d un deuxième chiffre qui correspond à l isoforme, comme par exemple Nav1.5. Dans certains cas et pour chaque isoforme, une lettre supplémentaire en minuscule permet d identifier les variants d épissage Nav1.5a).
Ainsi, à ce jour, dix gènes paralogues (SCN1A-SCN11A, Sodium ChaNnel) ont été identifiés et codent pour les dix sous-unités que sont Nav1.1-Nav1.9 et Nax.
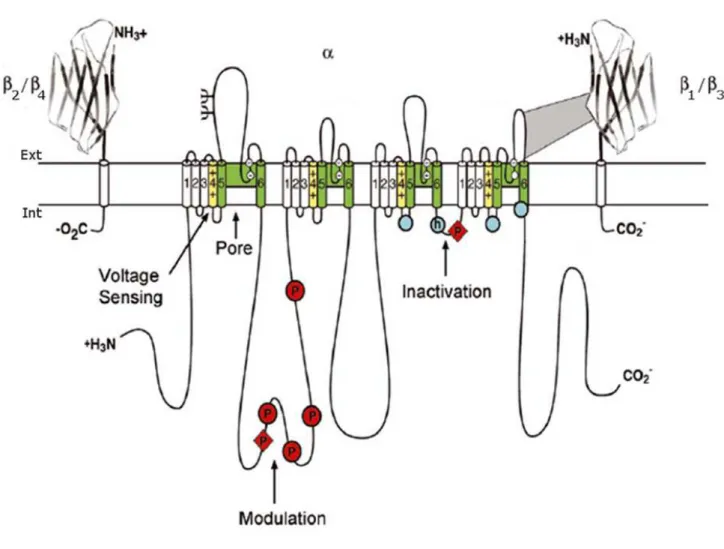
Chaque canal Nav est constitué d un complexe multimérique constitué d une sous-unité ~ KDa et d une ou plusieurs petites sous-unités auxiliaires (~35 KDa) (Figure 2) (Catterall, 2000). La sous-unité comprend un pore conducteur caractérisé par une perméabilité sélective sodique ainsi que tous les éléments essentiels conditionnant notamment l ouverture, la fermeture et l inactivation du canal. Les sous-unités régulatrices sont au nombre de quatre 1- 4) et sont codées par les gènes
SCN1B-SCN4B. Bien que les sous-unités seules soient nécessaires et suffisantes pour
former un canal fonctionnel, les sous-unités sont connues pour moduler leurs cinétiques et la dépendance au potentiel de leurs activation et inactivation d une part, et de participer à leur adressage et à leur ancrage membranaire d autre part (Patino & Isom, 2010). Leurs caractéristiques structurales, fonctionnelles ainsi que leur rôle modulateur sur la fonction des sous-unités seront détaillés plus loin dans ce chapitre.
Gène Localisation chromosomique
Protéine Distribution tissulaire Sensibilité à la TTX (IC50)
Références
SCN1A 2q24 Na
v1.1 Corps cellulaires des
neurones du SNC, cœur
TTX-S (6 nM)
(Westenbroek et al., 1989)
SCN2A 2q23-24 Nav1.2 Axones des neurones non
myélinisés du SNC, cœur
TTX-S (12 nM)
(Boiko et al., 2001)
SCN3A 2q24 Nav1.3 Corps cellulaires des
neurones du SNC, cœur
TTX-S (4 nM)
(Chen et al., 2000)
SCN4A 17q23-25 Nav1.4 Myocytes squelettiques
matures et innervés, cœur
TTX-S (25 nM) (Trimmer et al., 1989) SCN5A 3p21 Na v1.5 Cardiomyocytes, myocytes squelettiques immatures, cellules musculaires lisses intestinales, cellules de Cajal, régions limbiques
TTX-R (2 µM)
(Rogart et al., 1989 ; Kallen et al., 1990 ; Donahue et al., 2000 ; Ou
et al., 2002 ; Strege et al.,
2003)
SCN8A 12q13 Na
v1.6 Nœuds de Ranvier des
neurones des SNC et SNP, neurones des ganglions des racines dorsales, astrocytes
TTX-S (1 nM)
(Schaller et al., 1995 ; Kaplan et al., 2001)
SCN9A 2q24 Nav1.7 Neurones des ganglions des
racines dorsales, cellules de Schwann, neurones sympatiques TTX-S (4 nM) (Sangameswaran et al., 1997 ; Felts et al., 1997)
SCN10A 3p22-24 Nav1.8 Neurones sensoriels des
ganglions des racines dorsales, cardiomyocytes
TTX-R (60 µM)
(Akopian et al., 1996 ; Facer et al., 2011 ; Yang
et al., 2012)
SCN11A 3p21-24 Na
v1.9 Neurones sensoriels des
ganglions des racines dorsales
TTX-R (40 µM)
(Dib-Hajj et al., 1998)
SCN7A 2q21-23 Nax Organes
circum-ventriculaires, cœur, utérus
Non connue (Hiyama et al., 2004 ; Gaborit et al., 2007 ; George, Jr. et al., 1992)
Tableau 1 : Récapitulatif des caractéristiques des membres composant la famille des sous-unités des VGSC chez l’(omme.
TTX-S et TTX-R indiquent respectivement la sensibilité et la résistance des canaux à la tétrodotoxine. Abréviations : SNC, Système Nerveux Central ; SNP, Système Nerveux Périphérique (Adapté d'après Savio-Galimberti et al., 2012).
Figure 2 : Représentation schématique de la topologie membranaire des canaux sodiques dépendants du potentiel.
Les structures primaires communes à tous les VGSC sont représentées ici. Les segments transmembranaires formés d hélices sont représentés sous forme de cylindres alors que les boucles et les extrémités protéiques localisées sur les faces externes et cytoplasmiques sont illustrées par un simple trait. Les sous-unités 1-4 présentent un domaine extracellulaire avec une structure de type immunoglobuline. Les motifs correspondent aux sites potentiels de N-glycosylation, les P en rouge, aux sites avérés de phosphorylation de la PKA (cercle) ou de la PKC (losange). Les segments transmembranaires jaunes sont les segments S4 senseurs de potentiel alors que ceux en vert correspondent aux segments S5-S6 et aux boucles P formant le pore du canal. Les cercles blancs des boucles P représentent les résidus formant le filtre de sélectivité. Enfin, le h encerclé en bleu annote la particule d inactivation rapide comprenant le motif )FMT alors que les autres cercles bleus correspondent aux « docking sites » (D'après Catterall, 2012).
Parmi les neuf isoformes Nav1.1-Nav1.9 présentant un degré d homologie supérieur à 50%, il est possible de distinguer des canaux dits neuronaux (Nav1.1-Nav1.3 ; Nav1.6-Nav1.9) et les isoformes « musculaires » squelettiques (Nav1.4) et cardiaques (Nav1.5). Par ailleurs, en considérant les loci où se trouvent les gènes SCN, les canaux Nav1.1-1.3 et Nav1.7 présentent une forte homologie de séquence, des propriétés biophysiques similaires, une haute sensibilité à la TTX et une large distribution au niveau des systèmes nerveux central et périphérique (Goldin et al., 2000). Ces caractéristiques ainsi que la localisation de leurs gènes respectifs (Homme : 2q23-24) laissent suggérer une origine évolutive commune. D autre part, l isoforme cardiaque Nav1.5, et les canaux Nav1.8-Nav1.9 exprimés dans les ganglions dorsaux, semblent également être étroitement liés. En effet, le groupe de gènes SCN5A, SCN10A et SCN11A se trouvent sur le chromosome humain 3, et chacune de ces isoformes présente une substitution d un acide aminé dans le domaine ) leur conférant un degré de résistance élevé à la TTX. Quant aux isoformes Nav1.4 et Nav1.6, leur sensibilité à la TTX ainsi que leur homologie de séquence les rapprochent des canaux encodés par les gènes du chromosome 2. Cependant, la localisation de leurs gènes codants sur deux loci bien distincts indique des relations évolutives éloignées (Goldin, 2002).
L isoforme Nax, bien que présentant une structure primaire et un degré d homologie de séquence de l ordre de % avec les autres ‡GSC, fait figure d exception. En effet, au niveau de sa séquence en acides aminés, des différences ont été rapportées dans le segment S4 senseur de voltage, ainsi que dans la région du pore et la porte d inactivation (George, Jr. et al., 1992). Ainsi, ce canal ne présenterait pas ou peu de dépendance au potentiel, et serait alors préférentiellement régulé par la concentration en sodium extracellulaire (Grob et al., 2004). Une autre de ses particularités réside dans l incapacité d exprimer cette isoforme dans un modèle d expression hétérologue, limitant ainsi la caractérisation de ses propriétés biophysiques et pharmacologiques.
D) Cœur et VGSC
Bien que le Nav1.5 soit considéré comme l isoforme Nav cardiaque prédominant, il est avéré que des conductances présentant une sensibilité à la TTX existent également dans le cœur.
Dès , Corabœuf a montré que des courants TTX-sensibles contribuaient à la durée du potentiel d action des fibres de Purkinje de chien (Coraboeuf et al., 1979). De multiples études ont mis en évidence par des approches d immunocytochimie et de quantification de transcrits, qu il s agissait des isoformes Nav1.1-1.4 et Nav1.6, et ce à partir de plusieurs types de préparations que ce soient des cardiomyocytes néonataux de rat (Kaufmann et al., 2010), des cardiomyocytes ventriculaires de souris et de chien (Haufe et al., 2005a ; Haufe et al., 2005b ; Maier et al., 2002) et des cardiomyocytes auriculaires et ventriculaires humains (Gaborit et al., 2007 ; Kaufmann et al., 2013). Curieusement, bien que toutes ces isoformes soient exprimées dans le cœur de ces différentes espèces, il existe de grandes disparités au niveau de leurs taux de transcription, et ce principalement entre souris et humain (Blechschmidt et al., 2008). En effet, chez la souris, seulement 60% des transcrits coderaient pour Nav1.5 et ses variants d épissage contre % chez l (omme. Il faut noter que les différences d expression des canaux TTX-sensibles semblent dépendre du stade du développement cardiaque ainsi que du genre des sujets étudiés. Récemment, il a été montré que l isoforme Nav1.8 contribuait au courant INa persistant dans les cardiomyocytes ventriculaires de souris et pourrait être responsable du développement d arythmies (Yang et al., 2012). Or il a été montré que ce canal, en plus d être exprimé au niveau des neurones sensitifs intracardiaques humains, serait également présent au niveau myocardique (Facer et al., 2011).
Concernant les travaux de Kaufmann en 2013, il semble que les myocytes humains auriculaires présentent une distribution membranaire distincte et localisée en fonction des isoformes ou considérées. En fonction des études et des modèles, le taux d expression des canaux dits TTX-sensibles est estimé à 8- % de l ensemble des canaux Nav, laissant suggérer une fonction physiologique cardiaque importante de cette population (Kaufmann et al., 2013 ; Haufe et al., 2005a). D une manière intéressante, l équipe de Gaborit a montré que le taux d expression des transcrits codant les canaux
Nax est très abondant, bien que moindre par rapport aux canaux Nav1.5, dans les tissus humains sains auriculaires et ventriculaires droits ainsi que dans les fibres de Purkinje (Gaborit et al., 2007).
Enfin, concernant les sous-unités modulatrices, les quatre sous-unités 1- 4, ainsi que le variant d épissage 1B, sont exprimés au niveau cardiaque chez l Homme, la souris et le rat. Ils sont retrouvés dans les cardiomyocytes auriculaires et ventriculaires ainsi que dans les tissus conducteurs (Watanabe et al., 2008 ; Dominguez et al., 2005 ; Malhotra et al., 2001 ; Kaufmann et al., 2010 ; Maier et al., 2004). La sous-unité 1 semble être l isoforme la plus largement exprimée dans tous ces tissus chez l Homme (Gaborit et al., 2007).
II – Na
v1.5
A) Structure protéique
La sous-unité Nav1.5 est l isoforme prédominante au niveau cardiaque. )l s agit d une glycoprotéine de 2016 acides aminés constituée de quatre domaines homologues D), D)), D))) et D)‡, chacun d entre eux étant formé de six segments transmembranaires S1 à S6 (Figure 2). Une fois insérés dans la bicouche lipidique, les domaines s organisent et se replient de façon à former un canal fonctionnel autour d une cavité centrale. Les extrémités amino- et carboxy-terminales ainsi que les boucles liant chaque domaine sont localisées au niveau cytoplasmique et comprennent de nombreux sites de modulations qui seront largement décrits dans la suite de ce chapitre.
Les séquences protéiques connectant les segments S5 et S6, les boucles P (P-loop), forment la partie externe étroite du pore et comprennent le filtre de sélectivité aux ions sodium (Catterall, 2000).
Le segment S4 confère la caractéristique fondamentale de la famille des VGSC qu est la sensibilité au potentiel. En effet, les segments S4 de chaque domaine homologue comprennent une succession de motifs comportant un résidu chargé positivement (Lys ou Arg) suivi de deux résidus hydrophobes.
Enfin, la particule d inactivation localisée dans la boucle reliant D))) et D)‡ comprend le motif « IFMT » (pour Nav1.5, Ile1485–Phe1486-Met1487-Thr1488) et intervient dans l inactivation rapide des canaux sodiques (West et al., 1992).
B) Propriétés biophysiques
1- Etats conformationnels
Les canaux sodiques peuvent adopter quatre états conformationnels, illustrés dans la Figure 3. Lors d une dépolarisation membranaire, les segments S des quatre domaines homologues vont subir un changement de position aboutissant à l activation et donc à l ouverture des canaux Nav. Cet état ouvert est transitoire du fait d une inactivation rapide qui se met en place dans les millisecondes suivant l activation des canaux. Ce mécanisme ne ferme pas le canal mais obture le pore du côté cytoplasmique, et ce tant que la dépolarisation membranaire est maintenue. Une fois la membrane cellulaire repolarisée, les canaux inactivés reviennent à un état fermé mais toujours inactivé, leurs segments S4 ayant retrouvé leur position initiale. Un laps de temps (~100 ms) est toutefois nécessaire pour permettre aux canaux de récupérer de leur inactivation et d être à nouveau disponibles et activables (Huang et al., 2009 ; Huang et
al., 2011 ; Marangoni et al., 2011 ; Calloe et al., 2013).
2- Perméabilité et mécanisme d’activation
La perméabilité du canal aux ions sodium dépend du filtre de sélectivité se trouvant au niveau de la face externe du pore du canal. Il se compose de deux anneaux de quatre résidus hautement conservés : l anneau le plus externe et le plus large comprend deux acides aminés chargés négativement formant le motif EEDD, alors que l anneau interne particulièrement étroit est constitué du motif DEKA. Ces deux anneaux formeraient ainsi dans le pore, un vestibule externe attirant les charges positives, puis assurant le passage sélectif des ions sodium vers le milieu intracellulaire (Favre et al., 1996 ; Khan et al., 2002).
Etat Ouvert
Etat Fermé
Etat inactivé
Etat Fermé & Inactivé
Figure 3 : Représentation schématique des états conformationnels du canal Nav1.5.
Les domaines senseurs de voltage colorés en vert, portent des charges positives (billes rouges) au niveau des résidus arginine et lysine. Les ions sodium hydratés sont entourés de molécules d eau dans les milieux extra- et intracellulaires (Modifiée d'après Eijkelkamp et al., 2012).
3- Mécanismes d’activation et d’inactivation
La capacité qu ont les canaux sodiques à s ouvrir dépend uniquement de la mobilité des quatre senseurs de voltage qui les composent. En effet, les charges positives des segments S4 leur confèrent une sensibilité aux variations du potentiel transmembranaire. Bien qu il existe différents modèles de localisation et de mobilisation des S4 lors d une dépolarisation, tous s accordent sur la direction de leurs mouvements effectués vers la face membranaire externe (Yang et al., 1997 ; Jiang et al., 2003).
L inactivation des canaux sodiques ne résulte pas d un mécanisme unique et peut être séparée essentiellement en deux classes d inactivation présentant des cinétiques distinctes, appelées communément inactivations rapide et lente. Ces processus confèrent aux canaux une propriété fondamentale qu est la période réfractaire. En empêchant leur réactivation précoce pendant une dépolarisation prolongée, l état inactivé des canaux limite la fréquence de décharges des cellules excitables (Goldin, 2003).
L inactivation rapide est médiée par un mécanisme de boule et de chaîne « ball
and chain » qui consiste en l occlusion du pore par une région cytoplasmique du canal,
et ce au cours des premières millisecondes de dépolarisation (Figure 3). En effet, la particule d inactivation contenant le motif hydrophobe IFMT se fixe au niveau de sites récepteurs voisins (« docking sites ») localisés dans les boucles S4-S5 de DIII et DIV ainsi qu à l extrémité intracellulaire du S6 de DIV (West et al., 1992 ; Rohl et al., 1999).
Linactivation lente des canaux sodiques intervient lors d une dépolarisation prolongée, et présente des constantes de temps de l ordre de , à seconde. Son mécanisme s appuierait sur des réarrangements structuraux du pore, et impliquerait les boucles P et la boucle intracellulaire DIII-DIV (Vilin & Ruben, 2001 ; Goldin, 2003).
C) Fonctions et rôles physiologiques
Les canaux Nav . jouent un rôle majeur dans l excitabilité et la conduction cardiaques. Ils portent le courant entrant rapide INa qui induit une dépolarisation à l origine de la phase ascendante des potentiels d action (Phase 0) (Figure 4A).
Nav1.5, Navβ1 KChIP2, Cav1.2
A
C
Courant dépolarisant Courant repolarisantB
Figure 4 : Représentation schématique de l’activité électrique cardiaque humaine.
(A) Potentiel d action ventriculaire et des courants majoritairement impliqués. Les différentes phases sont numérotées : 0, pour la dépolarisation rapide, 1 pour la repolarisation rapide précoce, 2 pour la repolarisation lente, 3 pour la repolarisation rapide et 4 pour le potentiel de repos. Les courants sont INa,
courant sodique rapide, ICaL, courant calcique de type lent, Ito, courant potassique transitoire sortant, IKs et IKr,
courants potassiques rectifiants retardés lent et rapide, IK1, courant potassique rectifiant entrant. (B)
(étérogénéité transmurale de l expression cardiaque humaine des canaux sodiques Nav1.5 et Nav 1, des
canaux calciques Cav1.2 et de la sous-unité auxiliaire des canaux Kv, KChIP2. Les gradients présentés
prennent en compte les profils d expression variant entre l épicarde et l endocarde. (C) Système de conduction cardiaque et des potentiels d action générés dans les différents tissus spécialisés. Les chiffres indiquent les temps de parcours en ms de l influx électrique depuis le nœud sinusal jusqu aux différentes régions du cœur. Les lignes pointillées rouge correspondent aux voies de conduction internodales. Le schéma en bas à droite illustre la résultante de l activité électrique de l ensemble des cellules cardiaques, l onde P correspondant à la dépolarisation auriculaire, le complexe QRS, à la dépolarisation ventriculaire et l onde T à la repolarisation ventriculaire. Abréviation : AV, pour atrio-ventriculaire (Modifiée d'après Laske
L activité de ces canaux est ainsi à l origine de l initiation des potentiels d actions myocytaires, et intervient dans la régulation de la durée des potentiels d action. Le courant INa est retrouvé dans les cardiomyocytes ventriculaires et auriculaires ainsi que dans les tissus conducteurs du réseau de Purkinje (Remme et al., 2009 ; Boukens et al., 2009). Sa large distribution dans le système conducteur cardiaque fait de Nav1.5, un acteur majeur dans la propagation de l influx électrique depuis le tissu nodal sinoatrial jusqu'au réseau de Purkinje et aux ventricules (Figure 4C).
Il est important de préciser que la distribution tissulaire des canaux ioniques est hétérogène en fonction du type cellulaire cardiaque considéré. C est notamment le cas pour Nav1.5 au niveau du tissu ventriculaire qui est constitué de trois tuniques que sont l endocarde, le myocarde et l épicarde. L équipe de Gaborit en 2007 a mis en évidence chez l Homme l existence d un gradient transmural de la distribution de Nav1.5 et de sa sous-unité 1, leur expression étant plus faible dans le myocarde sous-épicardique que dans celui sous-endocardique (Figure 4B). Cette hétérogénéité d expression touche également d autres canaux dont les canaux calciques Cav1.2 et, via leur sous-unité régulatrice KChIP2, les canaux potassiques Kv4.3 portant le courant Ito potassique transitoire (Boukens et al., 2009 ; Gaborit et al., 2007). Ces différences d expression entraînent dans les myocytes sous-endocardiques des durées de potentiel d action plus longues que dans ceux sous-épicardiques.
Bien que le canal Nav . soit considéré comme l isoforme cardiaque des ‡GSC, il est également retrouvé dans d autres organes au sein par exemple des cellules de Cajal et des cellules musculaires lisses du jéjunum où il contrôlerait la motricité intestinale (Strege et al., 2003 ; Ou et al., 2002). En effet, ces études suggèrent un rôle potentiel de ces canaux dans la régulation de l excitabilité et de la contraction musculaire lisse, et ce notamment en contribuant au potentiel de membrane.
Ce canal serait exprimé dans les macrophages mais uniquement au niveau des membranes des endosomes tardifs (Carrithers et al., 2007). Nav1.5 régulerait positivement l activité phagocytaire de ces cellules issues du système immunitaire en modulant l acidification intra-endosomale.
III – Modulation du canal Na
v1.5
A) Modulation de l’expression1- Transcriptionnelle
Des études récentes ont montré que l expression du gène SCN5A était régulée par différents facteurs de transcription, que ce soit au cours du développement ou en réponse à une situation de stress. Il a notamment été observé qu un stress oxydatif, pouvait diminuer le taux d ARNm codant Nav . , et ce par l action de facteurs de transcription tels que NF-κB (Nuclear Factor-kappa B) et Foxo1 (Forkhead box protein
O1) sur le promoteur du gène SCN5A (Shang et al., 2008 ; Mao et al., 2012). Le facteur
TBX5 (T-box transcription factor), dont le rôle est important dans le développement du système conducteur cardiaque, contrôlerait également l expression du gène SCN5A (Arnolds et al., 2012). Dautre part, l existence de plusieurs variants de promoteur du gène SCN5A a récemment été mise en évidence (van Stuijvenberg et al., 2010 ; Yang et al., 2008). L usage alternatif de ces promoteurs octroierait ainsi une variabilité d expression interindividuelle de ce gène ainsi qu une spécificité d expression tissulaire principalement au niveau cardiaque. Cela est d autant plus intéressant qu une équipe a récemment corrélé la présence de ces variants de promoteur spécifiques à un risque accru de développer un phénotype sévère chez les patients porteurs de mutations pertes-de-fonction du gène SCN5A (Park et al., 2012).
2- Post-transcriptionnelle
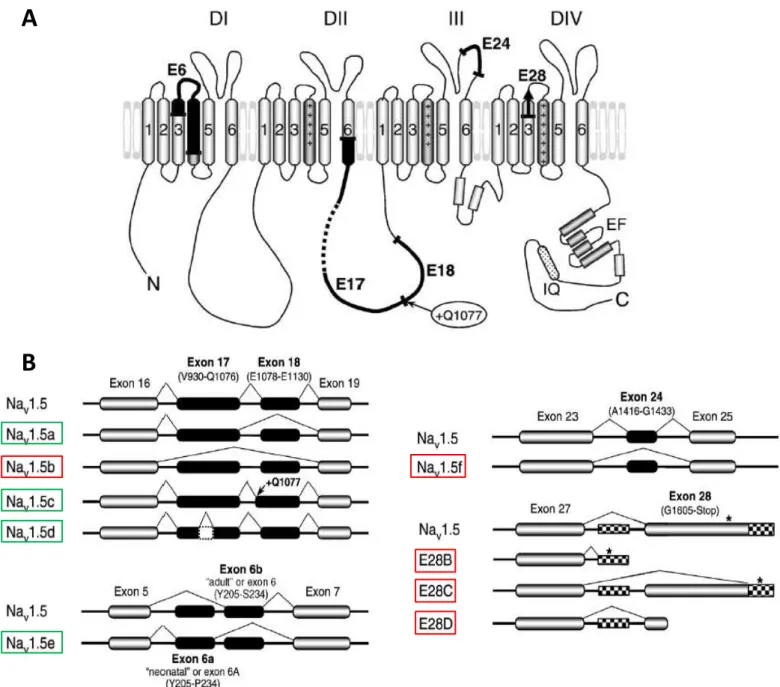
Le gène SCN5A codant les canaux Nav . comprend exons s étendant approximativement sur 80 Kb. Des études récentes indiquent que les pré-ARN messagers issus de sa transcription subissaient un épissage alternatif générant ainsi une grande diversité de variants de protéines Nav1.5 (voir pour revue Schroeter et al., 2010). L ensemble des neuf variants d épissage découverts jusqu à ce jour, sont présentés dans la Figure 5.
A
B
Figure 5 : Représentation schématique de la structure des variants d’épissage du canal Nav1.5. (A) Topologie membranaire du canal Nav . illustrant les régions protéiques affectées par l épissage alternatif. Les segments transmembranaires noircis ainsi que les traits épaissis montrent ces régions en fonction du ou des exons touchés. (B) )llustration des séquences exoniques d épissage propres à chaque variant. Les noms de ces variants sont encadrés en vert s il s agit d une protéine fonctionnelle, et en rouge si non fonctionnelle. Les séquences exoniques alternatives sont indiquées en noir, celles se retrouvant hors du cadre de lecture, en damier, et les codons stop avec un astérisque (D'après Schroeter et al., 2010).
Les régions affectées sont restreintes à quatre zones correspondant aux segments S3-S4 du domaine I (Nav1.5e), à la boucle intracellulaire reliant DII et DIII (Nav1.5a,b,c,d), à la partie distale de la boucle P de DIII (Nav1.5f) et à toute la partie amino-terminale après le segment S3 du DIV (E28B-D). Parmi ces variants, seulement quatre correspondent à des protéines fonctionnelles et seront détaillés dans cette partie.
Le variant Nav . a, caractérisé par la délétion de l exon , est largement exprimé dans les cœurs de souris et de rat (Zimmer et al., 2002c ; Gersdorff Korsgaard et al., 2001). En effet, il représente respectivement 33% et 25% de la totalité des ARNm codant les canaux Nav . chez ces espèces. Mais curieusement, ce variant n est pas présent dans le cœur humain, suggérant que l exon est essentiel pour la fonction des canaux Nav . chez l Homme (Blechschmidt et al., 2008). Deux études suggèrent que ce variant induirait un décalage de la courbe dinactivation à l état stable vers des potentiels plus hyperpolarisés (Kerr et al., 2007 ; Ou et al., 2005).
Au contraire, Nav1.5c se présente comme le variant majoritairement exprimé dans le cœur humain, alors qu il est retrouvé à de faibles taux chez les rongeurs. Sa particularité réside en l insertion d une glutamine en position . )l faut noter que ce variant correspond à la première séquence hH1 (pour human Heart 1) publiée lors du clonage et du séquençage de l isoforme cardiaque humaine (Gellens et al., 1992). Globalement dans tous les tissus cardiaques, la proportion de transcrits codant ce variant Q correspond à % de l ensemble des ARNm codant les canaux Nav1.5 (Makielski et al., 2003). Les propriétés biophysiques des canaux sauvages Q1077 ou ΔQ sont semblables, bien que dans le cas de canaux mutés ponctuellement ou présentant un polymorphisme, des différences aient pu être observées notamment au niveau de la densité de courant (Tan et al., 2005 ; Tan et al., 2006).
Nav . d constitue un variant spécifique à l Homme et est retrouvé dans les tissus cardiaques (Blechschmidt et al., 2008). L isoforme résultante présente une délétion de 39 résidus entre les positions 961 et 1000 dans la boucle reliant DII à DIII. Des altérations significatives des propriétés biophysiques ont été mises en évidence, dont une réduction de la probabilité d ouverture de ces canaux et un déplacement des courbes d activation et d inactivation vers des potentiels plus dépolarisés (Camacho et
Nav . e constitue le variant d épissage dit « néonatal » car présent en grande quantité dans le cœur de souris nouveau-né mais absent dans les tissus de souris adultes (Chioni et al., 2005). Ce variant néonatal résulte de l usage alternatif de deux exons a et 6b, aboutissant à la substitution de sept résidus entre S3 et S4 de DI. Comparé aux canaux Nav1.5, ce variant présente un décalage de la courbe dactivation à l état stable vers des potentiels plus dépolarisés ainsi que des cinétiques et une récupération de l inactivation ralenties (Onkal et al., 2008). )l faut noter que l expression de ce variant n a pas été mise en évidence dans le cœur humain néonatal à ce jour.
Les autres variants (Nav1.5b, Nav1.5f, E28B, E28C et E28D) dont la fonctionnalité n a pas pu être validée dans des modèles d expression hétérologue, ne semblent pas avoir de rôle physiologique, notamment sur l excitabilité cardiaque (Schroeter et al., 2010).
3- Post-traductionnelle
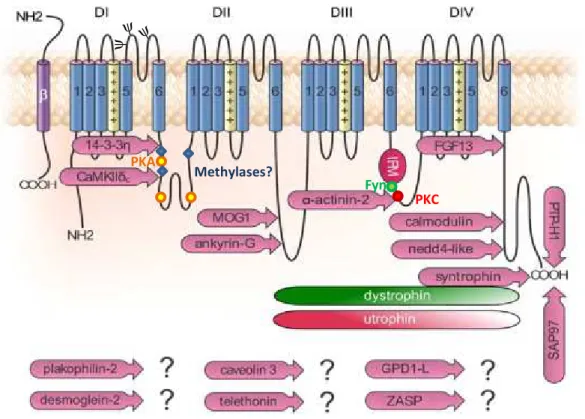
Pendant tout le processus d adressage des canaux Nav1.5, depuis leur traduction jusqu à leur dégradation, ces protéines sont modulées par différents acteurs moléculaires via des glycosylations, des méthylations ou encore des phosphorylations. La Figure 6 illustre les différentes protéines partenaires et régulatrices identifiées comme interagissant avec les canaux Nav1.5.
Glycosylations et méthylations
Des modifications post-traductionnelles de Nav1.5 ont été identifiées notamment concernant leurs N-glycosylations et méthylations.
Récemment, une équipe a identifié trois sites de méthylation, les arginines R513, R526 et R680, qui sont localisées dans la boucle liant DI et DII (Beltran-Alvarez et al., 2011). Bien que l effet fonctionnel de ces modifications ne soit pas encore connu, l existence de mutations de ces sites retrouvées chez des patients atteints du syndrome de Brugada et du Syndrome du QT long 3 suggère un rôle essentiel dans la régulation des canaux Nav1.5.
PKA
PKC Fyn
Methylases?
ψ
Figure 6 : Illustration des protéines régulatrices partenaires des canaux Nav1.5 et de leurs sites d’interaction sur la sous-unité .
Certains sites putatifs de phosphorylation (PKA, PKC, Fyn kinase), de méthylation et de glycosylation sont indiqués respectivement par des cercles, des losanges ou des arbres de glycosylation (Adaptée d'après Shy et al., 2013).
Bien que l identité exacte des N-glycanes ainsi que leurs sites d attachement à Nav1.5 restent à déterminer, plusieurs études ont mis en évidence la régulation des propriétés biophysiques de ce canal par les N-glycosylations (Zhang et al., 1999 ; Stocker & Bennett, 2006). Contrairement aux autres VGSC qui sont considérés comme étant lourdement glycosylés, le canal Nav1.5 est une sialoglycoprotéine contenant environ 5% de carbohydrates (Cohen & Levitt, 1993). Le rôle des acides sialiques a été particulièrement étudié dans des systèmes d expression hétérologue ou des cardiomyocytes de rats adultes et ce après traitement en présence de sialidase. Ces équipes ont ainsi montré un déplacement des courbes d activation et d inactivation à l état stable des canaux Nav . vers des potentiels plus dépolarisés. L hypothèse avancée serait que les acides sialiques attachés sur des résidus asparagine de la boucle DI S5-S6, sont chargés négativement à pH physiologique. Ces charges négatives influenceraient alors localement le potentiel de surface et entraineraient une activation des canaux Nav1.5 à des potentiels moins dépolarisés (Stocker & Bennett, 2006). Il faut noter toutefois que ces effets observés sur Nav . n ont pas été retrouvés dans un autre système d expression, la lignée C(O Chinese Hamster Ovary). En étudiant une lignée déficiente pour la sialylation, aucun effet significatif sur les propriétés biophysiques de Nav . n a pu être rapporté (Bennett, 2002). Cependant, ces résultats sont à contraster avec une étude récente menée dans des cardiomyocytes de souris déficientes pour la sialyltransférase ST3Gal4 (beta-galactoside alpha-2,3-sialyltransferase 4) où des effets majeurs sur l activité des canaux sodiques cardiaques ont été observés (Ednie et al., 2013). En effet, la dépendance au potentiel de l activation et de l inactivation à l état stable est décalée vers des potentiels plus dépolarisés alors que les cinétiques d inactivation de ces canaux ainsi que leur récupération de l inactivation rapide sont sensiblement altérées.
Phosphorylations
Dans les myocytes cardiaques, lors d une stimulation de la voie -adrénergique, l élévation du taux d AMPc intracellulaire active la protéine kinase A PKA dont l effet drastique sur les canaux Nav1.5 est une augmentation du courant INa (Frohnwieser et al., 1997 ; Lu et al., 1999 ; Zhou et al., 2002). Les sites de phosphorylation de la PKA ont été localisés dans la boucle cytoplasmique reliant DI et DII où se trouveraient des motifs putatifs de rétention réticulaires RXR adjacents à ces sites (Zhou et al., 2002). Des
travaux suggèrent l existence de deux sous-populations de canaux, l une réticulaire et l autre sous-membranaire qui serait rapidement mobilisable via l action directe de la PKA (Zimmer et al., 2002b ; Hallaq et al., 2006).
L activation de la protéine kinase C (PKC) entraîne également une modulation de la densité de courant INa associée aux canaux Nav1.5, et cela de manière négative (Qu et
al., 1996 ; Murray et al., 1997). Un site de phosphorylation de la PKC, la sérine S1503,
ainsi que l implication de la G3PD1-L (Glycerol-3-Phosphate Dehydrogenase 1-Like) dans la régulation PKC-dépendante des canaux Nav1.5 ont été mis en évidence (Liu et al., 2009 ; Hallaq et al., 2012). En effet, il semble que la phosphorylation du résidu 1503 et la production mitochondriale d espèces réactives à l oxygène ROS médiées par la PKC induisent l effet inverse de la PKA sur la mobilisation, l adressage et l activité des canaux Nav . . Bien que la fonction de l enzyme G3PD1-L reste encore incertaine, il a été montré que la phosphorylation de S était dépendante de l activité de cet enzyme notamment via la modulation du taux de NAD(H) (Nicotinamide Adénine Dinucléotide) intracellulaire (Valdivia et al., 2009 ; Liu et al., 2013b).
L activité des canaux Nav . est également régulée par la phosphorylation d un résidu tyrosine T1495, proche du motif IMFT dans la boucle DIII-DIV, via l activité de la protéine tyrosine kinase Fyn. Celle-ci induit un déplacement de la courbe d inactivation vers des potentiels plus dépolarisés (Ahern et al., 2005 ; Hartmann et al., 1994). Il faut noter ici que la protéine tyrosine phosphatase PTPH1 en interagissant au niveau du domaine PDZ (acronyme de PSD-95 (Post-Synaptic Density-95), Dlg (Drosophila
Disc-large tumor suppressor) et de ZO-1(Zona occludens-1)) induit l effet inverse de la Fyn
kinase (Jespersen et al., 2006). L état de phosphorylation des tyrosines de Nav1.5 semble donc moduler l état inactivé de ce canal.
Il faut noter que très récemment, huit nouveaux sites de phosphorylation ont pu être identifiés in situ au niveau de la boucle cytoplasmique DI-DII de canaux Nav1.5 ventriculaires murins (Marionneau et al., 2012b).
Homéostasie calcique
De nombreuses études ont mis en avant le rôle prépondérant du calcium intracellulaire dans la régulation de l expression des ‡GSC (Kim et al., 2004 ; Duff et al., 1992 ; Casini et al., 2009). C est au niveau de l extrémité carboxy-terminale présentant un domaine « EF-hand » fonctionnel que le calcium peut se fixer directement aux canaux
Nav1.5 (Wingo et al., 2004). Le calcium régule également ces canaux via une voie dépendante de la calmoduline capable de se fixer sur un motif )Q au niveau d une région adjacente au domaine « EF-hand » (Mori et al., 2003). D autre part, il faut savoir que ce domaine et le motif )Q peuvent interagir directement, ce qui a pour effet d augmenter l affinité du domaine « EF-hand » pour le calcium (Shah et al., 2006). Quant aux effets directs du calcium et de la calmoduline sur les canaux Nav1.5, de nombreuses études ont rapporté des résultats contradictoires concernant leurs cinétiques d inactivation (Tan et
al., 2002 ; Deschenes et al., 2002 ; Potet et al., 2009).
D autre part, l élévation de calcium intracellulaire entraîne l activation d une sérine/thréonine protéine kinase bien spécifique, la CamKII. Celle-ci a été montrée comme interagissant et phosphorylant la boucle intracellulaire reliant DI et DII sur les résidus S516, S571 et T594 (Hund et al., 2010 ; Koval et al., 2012 ; Ashpole et al., 2012). Ces modifications post-traductionnelles en modifiant les propriétés biophysiques du canal Nav . , moduleraient l excitabilité des cardiomyocytes, notamment via une augmentation d un courant persistant )Na et un déplacement de l inactivation vers des potentiels plus hyperpolarisés (Wagner et al., 2006). Très récemment, l équipe de King a montré qu une élévation du calcium intracellulaire induisait une diminution du courant INa qui serait associée à une réduction de l expression des canaux Nav1.5 plutôt quà une altération de leurs caractéristiques biophysiques (King et al., 2013).
Ubiquitinylation
Les canaux Nav1.5 sont également régulés par un membre de la famille des protéines E3 ubiquitine-ligases, la protéine Nedd4-2 (Neuronal precursor cell Expressed
Developmentally Downregulated protein 4-2) (van Bemmelen et al., 2004). Un domaine
consensus, le motif PY xPPxY , localisé au niveau de l extrémité carboxy-terminale des Nav1.5, constitue un site de fixation directe pour Nedd4- . L étiquetage des canaux par les molécules d ubiquitine via l action de Nedd -2 aboutirait alors à une augmentation du taux d internalisation des canaux et donc régulerait leur densité à la membrane (Rougier et al., 2005).