Université de Montréal
Innocuité d’un nouvel agent spermicide (FTDBA) pour
l’ADN des spermatozoïdes humains
par
Geneviève Laforest
Sciences biomédicales faculté de médecine
Mémoire présenté à la faculté des études supérieures en vue de l’obtention du grade de maîtrise
en sciences biomédicales
avril, 2003
C
q
/F
Q
/7
Direction des bibliothèques
AVIS
L’auteur a autorisé l’Université de Montréal à reproduire et diffuser, en totalité ou en partie, par quelque moyen que ce soit et sur quelque support que ce soit, et exclusivement à des fins non lucratives d’enseignement et de recherche, des copies de ce mémoire ou de celle thèse.
L’auteur et les coauteurs le cas échéant conservent la propriété du droit d’auteur et des droits moraux qui protègent ce document. Ni la thèse ou le mémoire, ni des extraits substantiels de ce document, ne doivent être imprimés ou autrement reproduits sans l’autorisation de l’auteur.
Afin de se conformer à la Loi canadienne sur la protection des renseignements personnels, quelques formulaires secondaires, coordonnées ou signatures intégrées au texte ont pu être enlevés de ce document. Bien que cela ait pu affecter la pagination, il n’y a aucun contenu manquant.
NOTICE
The author of this thesis or dissertation has granted a nonexclusive license allowing Université de Montréal to reproduce and publish the document, in part or in whole, and in any format, solely for noncommercial educational and research purposes.
The author and co-authors if applicable retain copyright ownership and moral rights in this document. Neither the whole thesis or dissertation, nor substantial extracts from it, may be printed or otherwise reproduced without the author’s permission.
In compliance with the Canadian Privacy Act some supporting forms, contact information or signatures may have been removed from the document. While this may affect the document page count, it does not represent any loss of content from the document.
Faculté des études supérieures
Ce mémoire intitulé:
Innocuité d’un nouvel agent spermicide (FTDBA) pour l’ADN des spermatozoïdes humains
présenté par: Geneviève Laforest
a été évalué par un jury composé des personnes suivantes:
Michèle Brochu, président-rapporteur Gilles Bleau, directeur de recherche Eve De Lamirande, membre du jury
Résumé
Le fluorure de tétradécyl-diméthyl-benzyl ammonium (FTDBA) est un nouvel agent spermicide très puissant. Cet ammonium quaternaire cause une perte irréversible de la mobilité des spermatozoïdes en induisant la nécrose cellulaire et l’inhibition enzymatique.
En cas d’échec de la contraception locale, il y a un risque théorique que l’agent spermicide cause une fragmentation de l’ADN des spermatozoïdes et cela pourrait être associé à une transmission d’ADN endommagé à l’ovocyte. La présente étude a pour but d’observer l’innocuité du FTDBA pour l’ADN des spermatozoïdes.
Pour y parvenir, les spermatozoïdes de 32 hommes ayant une fertilité démontrée ont été exposés à des doses sublétales de FTDBA établies par la technique Sander-Cramer. La fragmentation de l’ADN a été mesurée par cytométrie en flux, après marquage des extrémités 3’OH de l’ADN via la transférase terminale (« Terminal uridine nick end labeling» ou TUNEL). L’intégrité de l’ADN a également été évaluée par électrophorèse sous champs pulsés et par une nouvelle technique de marquage radioactif (ATP35$) sur des extraits d’ADN.
Par la technique TUNEL, une hausse significative du marquage de l’ADN des spermatozoïdes est observée après exposition au FTDBA (p < 0,001). Les substances oxygénées réactives ne seraient pas impliqués dans ce phénomène. Cependant, cette augmentation n’est pas observée par électrophorèse, ni par le marquage radioactif sur des extraits d’ADN.
Le FTDBA n’induit pas de dommages à l’ADN des spermatozoïdes; il permettrait plutôt de détecter des brisures inaccessibles par la technique TUNEL. Il est donc sécuritaire à ce niveau en cas d’échec contraceptif et pourrait servir à rendre la technique TUNEL plus sensible. Mots-clés : Fragmentation d’ADN, spermatozoïdes, TUNEL, spermicide.
Abstract
Tetradecyl-dimethyl-benzyl-ammonium fluoride (TDBAF) is a powerful new spermicide. This fluoride sait of a quaternary ammonium causes irreversibie loss of sperm motility by inducing ceil necrosis and enzyme inhibition.
In cases of faiiure of local contraception, there is a theoretical risk that a spermicidal agent might cause sperm DNA strand breaks and be associated with transmission of damaged DNA to the oocyte by a spermatozoon exposed to a sublethal dose. The present study aims to ascertain innocuity in the case of TDBAF.
$permatozoa from 32 fertile men were exposed to a subiethai concentration of TDBAF, as establishes by $ander-Cramer assay. The degree of DNA fragmentation was measured by the TUNEL assay where 3’OH termini are labeled using terminal transferase, followed by flow cytometry. DNA integrity was also assessed by pulsed field electrophoresis and by a new enzymatic assay measuring radioactively iabeled (35S-ATP) purified DNA extracted from TDBAf-exposed spermatozoa.
Using the TUNEL assay, a significantly increase in percent labeled spermatozoa was observed afier TDBAF treatment compared to controls (p < 0.001). The same resuit
was observed in the presence of antioxidant so reactive oxygen species are not implicated in this phenomenon. However, this increase was not observed upon electrophoresis and radioactive labeling of extracted DNA.
The increase in percent labeled sperm observed by the TUNEL assay most likely resuits from increased access of the enzyme to its DNA substrate in treated sperm. TDBAF at sublethal concentrations does not induce DNA strand breaks in spermatozoa; in this regard, it can be considered safe for the embryo in cases of failure of local contraception.
Table des matières
RÉSUMÉ III
ABSTRACT IV
LISTE DES TABLEAUX VIII
LISTE DES FIGURES IX
LISTE DES SIGNES ET ABRÉVIATIONS xl
REMERCIEMENTS XV 1. INTRODUCTION 1 1.1 Introduction générale 1 1.2 Les spermatozoïdes 2 1.2.1 La spermatogenèse 2 1.2.2 La spermiogenèse 6
1.2.3 Maturation des spermatozoïdes 9
1.2.4 Les spermatozoïdes matures 11
1.3 Les spermicides 14
1.3.1 Historique et généralités 14
1.3.2 Types et modes d’action des spermicides 17
1.3.3 Tests pour évaluer l’activité des spermicides 18 1.4 La fragmentation de l’ADN des spermatozoïdes éjaculés 23 1.4.1 Défauts lors de la transition des histones aux protamines 23
1.4.2 Processus apoptotique inachevé 24 1.4.3 Présence de substances oxygénées réactives (SOR) 26
1.5 Techniques de détection des dommages à l’ADN 28
1.5.1 Dosage de la $-hydroxy-2’-désoxyguanidine 2$
1.5.2 Traduction de brèche (« Nick translation ») 2$
1.5.3 Le test comète
(
Cornet assay ») 291.5.4 « Sperm chromatin structure assay» (SCSA) 30
1.5.5 Technique TUNEL 32
2. OBJECTIFS DE L’ÉTUDE 33
3. ARTICLE SOUMIS
À
« CONTRACEPTION » 35Abstract 37
Introduction 39
Materials and Methods 42
Study participants 42
Sample collection 42
Determination ofthe sublethal concentration 42
Measurement of sperm DNA fragmentation by the TUNEL assay 43
Extraction and isolation of sperm DNA 45
Detection of DNA fragmentation by a35S ATP incorporation in extracted DNA... 45 DNA analysis by regular and pulsed field electrophoresis 46
Antioxidant treatment and measurement of ROS production 47
Statistical analyses 48
Resuits 49
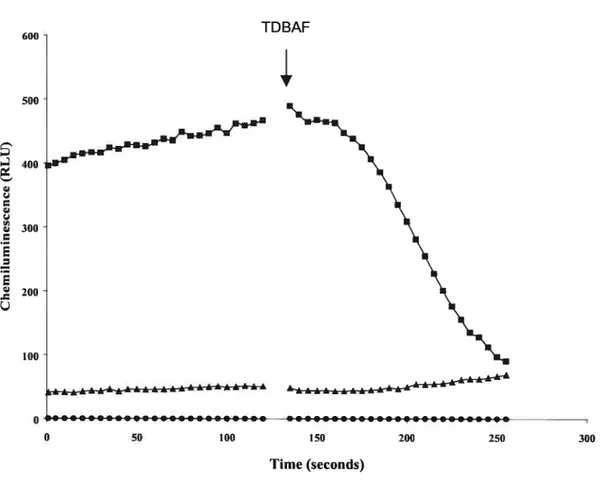
Effect ofTDBAf on the resuits ofthe TUNEL assay 49 Effect of TDBAF on ROS production by sperm and other ceils in semen 50 Assessment of DNA fragmentation by electrophoresis pulsed field 51 Measurement of 3’OH termini in isolated DNA from spennatozoa 51
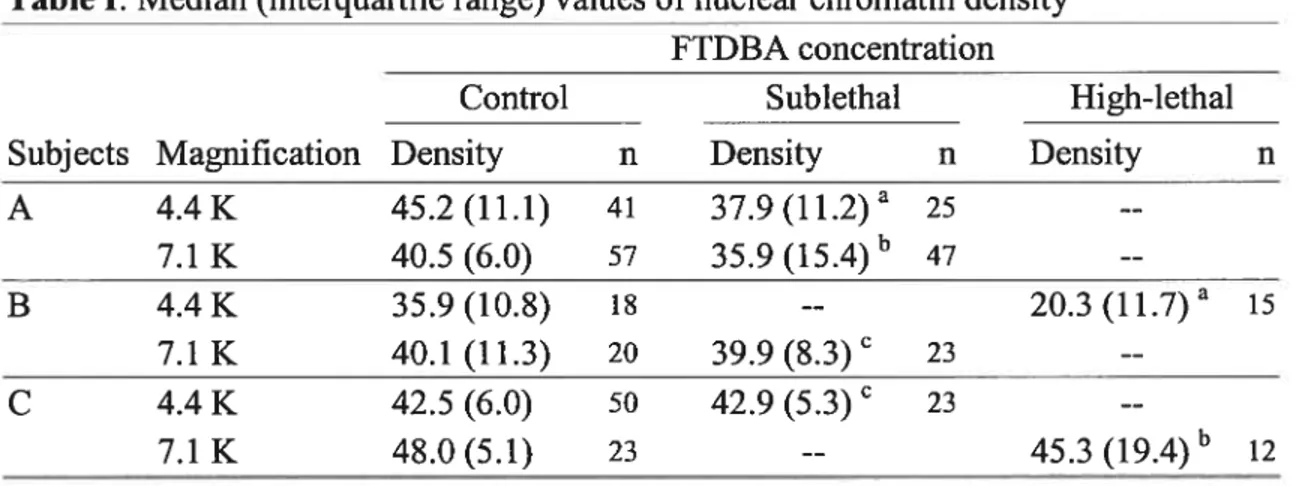
Evaluation ofsperm chromatin density 52
Discussion 53
References 58
4. DISCUSSION GÉNÉRALE 68
4.1 La technique TUNEL dans l’évaluation d’un agent spermicide 68
4.2 Évaluation de la production de substances oxygénées réactives 70
4.3 Faiblesses de la technique TUNEL 73
4.3.1 Inaccessibilité, in situ, de certaines cassures par la TdT 73 4.3.2 Le manque d’uniformité dans la technique TUNEL 75
4.4 Preuve de l’innocuité du FTDBA pour l’ADN des spermatozoïdes 77
5. CONCLUSION ET PERSPECTIVES 79
Liste des tableaux
Chapitre 1 : Introduction
Tableau I: Les différents types de spermicides et leurs modes d’action 20
Chapitre 3 Article
Liste des figures
Chapitre 1: Introduction
Figure 1 : Schéma de la spermatogenèse chez l’humain 3
Figure 2 : Coupe transversale d’un tubule séminifère 4
Figure 3 : Schéma du complexe axonémal de la queue du spermatozoïde 10
Figure 4 : Photos en microscopie électronique d’un spermatozoïde mature
ainsi que des différentes parties de son flagelle 13
Figure 5 : Structures moléculaires du Nonoxynol-9 et du FTDBA 21
Figure 6 : Types de résultats obtenus à partir de la technique « Cornet assay » 31
Chapitre 3 : Article
Figure 1: Cornparison (mean± SD) of the degree of sperm DNA fragmentation as
measured by the TUNEL assay in sperm treated with PBS (control) or
a sublethal concentration of TDBAF 63
Figure 2: Production ofreactive oxygen species by control and TDBAF-treated
spermatozoa 64
figure 4: Sperm DNA fragmentation measured afier labeling ofisolated DNA from
control sperm and sperm exposed the sublethal concentration of TDBAF 66
Figure 5: Typical electron microscopic appearance of spermatozoa exposed to PBS or
to sublethal concentration of TDBAF 67
Liste des signes et abréviations
ADN Acide désoxyribonucléique ou « Deoxyribonucleic acid» ANOVA Analyse de la variance ou « Analysis of variance» Ad Spermatogonie A sombre
Ap Spermatogonie A pâle
AP Phosphatase alcaline ou « Alcaline phosphatase» ATP Adénosine triphosphate
CASA Analyse du sperme assistée par ordinateur ou «Computer-assisted semen analysis»
CFDA Diacétate de carboxyfluorescéine
CHUM Centre hospitalier de l’Université de Montréal CI Intervalle de confiance ou « Confidence interval»
COMET Analyse unicellulaire sur gel d’électrophorèse ou «Single cell gel electrophoresis»
CV Coefficient de variation ou « Coefficient of variation)> DCFH-DA Dichlorofluorescéine diacétate
DTAB Bromure de dodécyl-triméthyl-ammonium ou « Dodecyltrimethylamonium bromide»
DTT Dithiothréitol
FACS Cytométrie en flux ou « f luorescence activated ceil sorting»
FAEBS Fluorure de 4-(2-aminoéthyl)-benzênesulfonyle
FasL Ligand de f as ou « Fas ligand»
FITC Isothiocyanate de fluorescéine ou « Fluorescein iso-thiocyanate»
FSH Hormone folliculo-stimulante ou <Follicle stimulating hormone»
FTDBA Fluorure de tétradécyl-diméthyl-benzyl ammonium ou fluorure de
myristaikonium
GC/MS Chromatographie gazeuse-spectrométrie de masse
Hi Histone-1
HPLC Chromatographie liquide à haute performance ou « High performance liquid
chromatography»
ICSI Injection intracytoplasmique de spermatozoïdes ou «Intracytoplasmic sperm
injection»
kb Kilo-base
MKF Fluorure de myristaikonium
MTS Maladie transmise sexuellement
NADPH Nicotinamide adénine dinucléotide phosphate (forme réduite)
PBS Tampon phosphate salin ou «Phosphated-buffered saline»
PI Iodure de propidium ou « Propidium iodide»
SCSA Analyse de la structure de la chromatine des spermatozoïdes ou « Sperm
chromatin structure assay»
SD Écart-type ou « Standard deviation»
SOR Substances oxygénées réactives ou « Reactive oxygen species»
TdT Désoxyribonucléotidyle exotransférase ou «Terminal deoxyribonucleotidyle transferase »
IN Tampon Tris-NaC1 ou « Tris-NaC1 buffer>)
TP 1 Protéine de transition-1 ou « Transition protein- 1»
TP2 Protéine de transition-2 ou« Transition protein-2»
TUNEL Marquage des brins d’ADN avec la désoxyribonucléotidyle exotransférase
ou « Terminal uridine nick end-labeling»
VIH Virus de l’immunodéficience humaine
Pour Lisette et Claude, mes parents quej ‘adore.
Remerciements
Tout d’abord, je tiens particulièrement à remercier le Dt Gilles Bleau pour toute sa gentillesse, son aide et la confiance qu’il m’a accordée dès le début de mes travaux. Le temps passé dans son laboratoire restera toujours un merveilleux souvenir dans ma mémoire. Merci aussi aux autres personnes de ce laboratoire qui ont rendu ce passage
encore plus mémorable; Pascal pour nos discussions très constructives mais pas toujours
rassurantes, Karyn pour son sens de l’humour qui m’a souvent fait rire aux larmes, Suzanne pour sa grande gentillesse et Martin qui sait toujours écouter et remonter un moral un peu
bas. Vous me manquerez.
J’aimerais aussi remercier mes parents et ma soeur qui avec tous leurs
encouragements et leur fierté évidente m’ont permis de me rendre là où je suis maintenant.
Vous avez mon amour inconditionnel. Il ne faut pas non plus que j’oublie ma Mamie
Laforest qui me fournissait des sucres à la crème «énergisants» durant mes périodes intenses d’examens et mon amour pour son support et pour le fait qu’il me rende si heureuse...
Finalement, merci au Dt Moïse Bendayan pour son aide en microscopie électronique.
1. Introduction
1.1 Introduction générale
Nous devons aux progrès de la médecine et de l’hygiène la très forte diminution du taux de mortalité infantile et l’augmentation de l’espérance de vie. Paradoxalement, ces deux bienfaits nous ont conduits à une véritable explosion démographique: nous sommes aujourd’hui plus de 6 milliards d’humains sur Terre. La population mondiale s’accroît de quelque 100 millions par an et elle pourrait atteindre les 10 milliards en 2050. Si cet accroissement exponentiel se maintient, toutes les ressources naturelles non renouvelables seront épuisées d’ici quelques générations et les problèmes de pollution et de détérioration du milieu prendront une ampleur effrayante. Même dans les conditions économiques avantageuses des pays dits «développés», une famille nombreuse peut être éprouvante pour la santé des femmes. De là le besoin impérieux de développer de nouvelles méthodes contraceptives financièrement abordables, efficaces et acceptables, particulièrement dans les pays du Tiers-Monde.
L’amélioration des connaissances sur les spermatozoïdes et les mécanismes de la fécondation a permis de développer de nouvelles méthodes contraceptives ciblant le gamète mâle. Notre laboratoire s’intéresse à un nouvel agent spermicide qui, en plus de son effet contraceptif, est doté d’une puissante activité bactéricide et virucide offrant ainsi un certain degré de protection contre les maladies transmises sexuellement. Ce mémoire explore un aspect relatif à l’innocuité du spermicide pour l’ADN des spermatozoïdes, ceci afin d’éviter tout problème génétique d’origine paternelle en cas d’échec de la contraception.
1.2 Les spermatozoïdes
1.2.1 La spermatogenèse
La spermatogenèse est le processus de différentiation cellulaire qui, à partir des
cellules souches, assure la production d’environ 6,5 millions de spermatozoïdes parjour
par gramme de testicule. Débutant à la puberté, elle se poursuit tout au long de la vie de
l’homme, à l’intérieur des tubules séminifères contournés des testicules (Thibault et
Levasseur, 2001). Un schéma des principales étapes de la spermatogenèse ainsi qu’une micrographie d’une coupe d’un tubule séminifère sont présentées aux figures I et 2.
La spermatogenèse comporte des processus mitotique et méiotique sous l’influence
de gènes récemment identifiés, et exprimés dans les cellules de la lignée spermatique. Ils
codent pour des protéines régulatrices (cyclines), des phosphatases, des kinases ainsi que
des composants nucléaires et cytoplasmiques nécessaires à la division cellulaire (pour une
revue récente de la littérature, voir Wolgemuth et coli., 2002). Leur expression est
principalement régulée de manière intrinsèque à partir d’un programme génétique déterminant quels gènes seront utilisés, et quand ils le seront. Un système de régulation interactive, surtout attribué aux cellules de Sertoli, est aussi présent et responsable de la synchronisation de la spermatogenèse. De façon indirecte, une régulation extrinsèque
s’exerce via le système endocrinien, principalement via la F$H et la testostérone (pour une
Spermatogonie (Diploïde)
*
t Division mitotique Différenciation Spermatocyte primaire (Diploïde)/
Première division de la méiose Spermatocytes*
*
/ \
/ \
Seconde division de la méiose\1/ \I/ \I/
SpermatozoïdesFigure 2 : Coupe transversale d’un tubule séminifère. Légende : SA: Spermatogonies de type A
S8 : Spermatogonies de type B Si : Spermatocytes de premier ordre S3 : Spermatides $4: Spermatozoïdes St: Cellules de Sertoli M : Cellules myoïdes
‘s
t 3‘
?‘
e
jM
•
, &_• i•s3 •
Ï’
s
se..
à4
‘J
C’
M I 4I
7: 44 .l p (b# \ F-j, ‘L’épithélium des tubules séminifères est constitué de trois types de cellules germinales (spermatogonies, spermatocytes, spermatides) et de cellules de Sertoli - de
grandes cellules pyramidales s’étendant sur toute la hauteur de l’épithélium séminifère. Les spermatogonies sont les cellules les plus externes et se trouvent directement en contact avec la lame basale de l’épithélium tubulaire, entre les cellules de Sertoli; elles se multiplient par mitose. Une partie des cellules filles, les spermatogonies A sombres (Ad), resteront près de la lame basale afin de perpétuer la lignée de cellules germinales; l’autre partie, les spermatogonies A pâles (Ap) se diviseront par mitose pour constituer des amas de cellules filles reliées entre elles par des ponts cytoplasmiques. Ces spermatogonies Ap se différencieront ensuite en spermatogonies B, qui seront poussées vers la lumière des tubules séminifères où elles se différencieront en spermatocytes de premier ordre.
Les spermatocytes de premier ordre sont de grandes cellules de forme ovalaire au noyau arrondi, et contenant plusieurs nucléoles. Ils subiront la première division de la méiose (durée d’environ 23 jours) pour former 2 cellules haploïdes plus petites, appelées spermatocytes de deuxième ordre. C’est au cours du stade diplotène de cette première division méiotique que se produisent les chiasmas entre les chromosomes homologues maternels et paternels, phénomène à l’origine d’échanges de matériel génétique.
Les spermatocytes de deuxième ordre ainsi produits entreront rapidement dans la deuxième division de la méiose (durée de 1 jour). Leurs cellules filles haploïdes, désignées spermatides, sont de petites cellules rondes au gros noyau sphérique, situées près de la
lumière du tubule séminifère. Elles se différencieront en spermatozoïdes durant la
spermiogenèse. Après leur libération dans la lumière des tubules séminifères (spermiation),
les spermatozoïdes seront dirigés vers l’épididyme pour y terminer leur maturation
(Thibault et Levasseur, 2001).
1.2.2 La spermiogenèse
La spermiogenèse est définie comme le processus de maturation des spermatides en spermatozoïdes, alors que les spermatides sont encastrés à la partie luminale des cellules de
Sertoli (durée d’environ 23 jours). Durant ce processus, des changements majeurs se
produisent dans l’architecture cellulaire incluant la perte de cytoplasme (phagocyté par les cellules de Sertoli), la formation de l’acrosome (dérivé de l’appareil de Golgi) ainsi que l’assemblage des structures du flagelle (à partir des centrioles). Surviennent aussi de nombreuses modifications au niveau nucléaire, principalement une condensation de l’ADN.
Le noyau passe de la forme sphéroïde à allongée, et on note une baisse de la transcription
cellulaire. (Thibault et Levasseur, 2001; Stevens et Lowe, 1997). La transcription des gènes
haploïdes impliqués dans ces modifications morphologiques est régulée par une polymérase poly(A) spécifique au testicule (Kashiwabara et coll., 2002).
Dans les cellules somatiques, l’ADN est légèrement condensé et associé à des
autour d’un octamère d’histones pour former des nucléosomes. La structure de ces complexes nucléo-protéiques est maintenue grâce à des interactions électrostatiques entre les charges positives sur les résidus d’acides aminés des histones et les charges négatives des groupements phosphates de l’ADN. L’adhésion d’une neuvième histone de liaison (Hi) au nucléosome permet un enroulement régulier en spirale du filament ADN-protéine formant alors un solénoïde. Ce conditionnement permet de réduire la longueur de l’ADN d’environ 50 fois.
Dans les spermatozoïdes, l’ADN est à ce point condensé qu’il adopte une structure presque cristalline et biochimiquement inerte. Cette extrême compaction, sous forme de structures toroïdales d’environ 60 kb d’ADN, résulte du remplacement des histones par des protamines (fuentes-Mascorro et coil., 2000). Pour ce faire, les histones sont d’abord acétylées afin de réduire les interactions électrostatiques avec l’ADN et permettre une décondensation. Les histones sont ensuite exposées à des enzymes protéolytiques, remplacées par des protéines de transition (TP1 et TP2), et enfin par les protamines. Ce remplacement, qui se produit à mi-temps de la spenniogenèse (e.g. aux étapes 12-13 de l’élongation du spermatide chez le rat), requiert l’activité d’une nucléase endogène (possiblement l’ADN topo-isomérase II) pour créer des brisures simple brin dans l’ADN. Ces cassures sont nécessaires afin d’enlever les torsions de l’ADN et d’aider à la transition «histones-protamines» ainsi qu’à la condensation (McPherson et Longo, 1992-1993). Ces cassures sont finalement réparées par une enzyme non encore identifiée. Une étude récente
propose que les protéines de transition TP 1 y joueraient un rôle particulier, possiblement en tant que facteur d’alignement de l’ADN (Caron et cou., 2001).
Les protamines ont des masses moléculaires relatives d’environ la moitié de celles des histones; elles sont codées de gènes qui s’expriment seulement dans les cellules germinales. Leur caractère basique (charges positives dues aux résidus arginine et lysine) leur permet d’interagir fortement avec les groupements phosphates de l’ADN, favorisant ainsi une plus grande compaction de la chromatine en diminuant les répulsions électrostatiques. De plus, les protamines contiennent plusieurs résidus cystéine qui généreront des ponts disulfiires inter-moléculaires, ce qui contribuera aussi à la compaction de l’ADN (Baihom, 1982; Eddy, 2002). Cet état de la chromatine assure la protection du génome masculin et une organisation permettant l’expression des gènes spécifiques lors du début de l’embryogenèse (McPherson et Longo, 1992 et 1993).
Théoriquement, l’évolution normale de la lignée germinale devrait produire 16 spermatozoïdes à partir d’une spermatogonie (Thibault et Levasseur, 2001). Cependant, le rendement réel est plus bas, dû à l’apoptose cellulaire nécessaire à l’élimination de cellules anormales et au maintien de l’homéostasie avec les cellules de Sertoli. Ce phénomène sera décrit plus en détail à la section 1.3.2.
1.2.3 Maturation des spermatozoïdes
Suite à la spermiation, les spermatozoïdes ne sont ni mobiles ni aptes à féconder: ils doivent séjourner dans l’épididyme afin de compléter leur maturation. Puisqu’ils ne peuvent effectuer de transcription et que leur taux de traduction est presque nul, ils ne peuvent produire les protéines nécessaires à cette maturation, comme le feraient des cellules somatiques. L’acquisition de leurs nouvelles fonctions, par des mécanismes encore mal précisés, résulte donc d’interactions avec des constituants du milieu épididymaire tels des glycoprotéines, l’acide sialique et la glycéryl-phosphorylcholine (Stevens et Lowe,
1997).
Les spermatozoïdes acquièrent leur aptitude à la mobilité linéaire seulement à la sortie du testicule, après un contact avec les protéines sécrétées par l’épididyme (e.g. c
glucosidase neutre) et les glandes annexes (e.g. antigène spécifique de la prostate (de façon indirecte)) (Elzanaty et coil., 2002). La mobilité dépend essentiellement de l’activité du complexe axonémal, présent sur toute la longueur du flagelle des spermatozoïdes, et composé de microtubules de tubuline A et B. Le mouvement résulte des glissements de ces microtubules qui suivent des cycles d’accrochage et de décrochage des bras de dynéine sur les microtubules B adjacents. Un schéma du complexe axonémal est présenté à la figure 3. L’énergie nécessaire au mouvement résulte de l’hydrolyse de l’ATP par la dynéine (ATPase) (Thibault et Levasseur, 2001).
bras de nexine
(Tiré de Thibault et Levasseur, 200])
central
SCHÉMA
DU COMPLEXEAXONÉMAL
microtubule B bras externe microtubule A bras interne 8 3 pont G tête radiaire fibreuse
Durant leur transit dans l’épididyme, les spermatozoïdes subissent aussi une organisation finale de la chromatine suite à l’accroissement du nombre de ponts disulfures entre les protamines, permettant ainsi la réduction définitive du volume du noyau. Ils seront entreposés en dernier lieu dans la partie caudale de l’épididyme et dans l’ampoule des canaux déférents, jusqu’à la prochaine éjaculation (fuentes-Mascorro et coll., 2000).
1.2.4 Les spermatozoïdes matures
Découverts simultanément en 167$ par Leewenhoek et Hartsoeker, les spermatozoïdes ont d’abord été considérés comme des animalcules vivant dans le sperme et n’ayant aucun lien avec la reproduction. Quelques années plus tard, ces mêmes découvreurs vinrent à penser que chaque spermatozoïde contenait un embryon complet préformé (l’homonculus). Cependant, la plupart des chercheurs de l’époque ne leur attribuaient que peu d’importance. Ce n’est qu’à la fin des années 1700 qu’on a suggéré leur implication dans la fécondation, et seulement en 1896 qu’il a été démontré que le spermatozoïde entrait dans l’ovocyte pour réaliser l’union des 2 noyaux gamétiques cellulaires (revue par Gilbert, 1996).
La fonction et la structure des spermatozoïdes sont maintenant bien connues. Leur observation en microscopie optique montre une tête ovalaire ou aplatie selon l’angle d’orientation, et un flagelle. On peut distinguer le noyau dense recouvert au 2/3 antérieur
par l’acrosome. Ce dernier libérera les enzymes facilitant la pénétration de la zone pellucide de l’ovocyte lors de la fécondation.
Le flagelle est relié à la tête au niveau du col. Il comprend une pièce intermédiaire contenant une gaine de mitochondries allongées et disposées en spirale autour des fibres denses, une pièce principale et une pièce terminale. L’axonème, essentiellement un long cil spécialisé avec neuf doublets de tubules périphériques et une paire centrale, se prolonge sur toute la longueur du flagelle (Stevens et Lowe, 1997). La figure 4 présente un schéma d’un
a) Micrographie 10400X de la tête et de la pièce intermédiaire d’un
spermatozoïde humain.
c) Micrographie 7100X d’une coupe transversale du flagelle au niveau de la pièce principale.
d) Micrographie 7100X d’une coupe transversale du flagelle à la fin de la pièce principale.
Figure 4 Photos en microscopie électronique d’un spermatozoïde mature ainsi que des différentes parties de son flagelle. (Spermatozoïde témoin, traité
au PBS et centriftigé)
Mitochondnes b) Micrographie 4400X d’une coupe
transversale du flagelle au niveau de la pièce
Fibres denses . .
intermediaire. Complexe axonémal
1.3 Les spermicides
1.3.1 Historique et généralités
Les spermicides sont les plus vieux contraceptifs au monde. En Égypte, on a découvert sur un papyrus datant de 1500 avant J.-C. la recette pour préparer un contraceptif: «mélanger du miel à des excréments de crocodiles et en imbiber un linge que l’on introduit dans le vagin» (finch et Hugh, 1967). On sait aujourd’hui que l’action des bactéries sur le sucre produit beaucoup d’acide lactique, la diminution du pH causant ainsi la mort des spermatozoïdes.
Les développements de la chimie ont permis la commercialisation de spermicides au cours des années 1930. Après un maximum d’utilisation de cette méthode contraceptive au cours des années 1950, elle a connu une défaveur dans les années 1960 avec l’apparition de la pilule contraceptive (Creinin et Keith, 1994).
Au début des années 1980, l’utilisation des spermicides (nonoxynol-9, di isobutylphénoxypolyéthoxyéthanol, octoxynol, tri-isopropylphénoxydécaéthoxyéthanol) a causé une grande frayeur: quelques publications les ont associés à certaines anomalies congénitales (syndrome de Down, défauts pulmonaires, hypospadias, etc.). L’effet délétère pouvait théoriquement s’exercer sur les spermatozoïdes eux-mêmes, sur l’ovocyte via une absorption dans le système sanguin, ou sur l’embryon si la femme continuait à utiliser le spermicide après la fécondation (Jick et coil., 1981; Huggings et coll., 1982). Cependant,
plusieurs études ultérieures ont démontré que les spermicides généralement utilisés dans la population n’étaient nullement impliqués dans des effets indésirables sur le développement de l’embryon ou du foetus en cas de grossesse accidentelle (Louik et coll., 1987; Einarson et coil., 1990; Linn et coll., 1983).
L’utilisation des spermicides offre de nombreux avantages tels la facilité d’accès (vente libre), un minimum d’effets toxiques, la simplicité d’utilisation, leur propriété lubrifiante et le faible coût. Selon les études et les populations cibles, leur efficacité contraceptive se situe entre 79 et 94% (indice de Pearl moyen: 15,3 grossesses/100 années-femmes) (Creinin et Keith, 1994; Trussell et Vaughan, 1999), les échecs étant surtout attribués à une mauvaise utilisation plutôt qu’à une pauvre activité du spermicide (Lee, 1996). Le fait que celle méthode soit entièrement sous le contrôle féminin représente un autre atout non négligeable: les femmes peuvent ainsi s’assurer d’une certaine protection contre la grossesse et les maladies transmises sexuellement (MTS) dans les cas où le partenaire ne voudrait pas utiliser le condom. Notons toutefois que le condom reste la méthode contraceptive la plus efficace contre les MTS (Courtot et cou., 1994).
Vers la fin des années 1980, ce moyen contraceptif a regagné en popularité suite à des études in vitro énonçant ses propriétés bactéricides et vimcides contre plusieurs agents pathogènes transmis sexuellement. Par exemple, le nonoxynol-9, l’agent spermicide le plus utilisé dans le monde, dissout la membrane du virus de l’immunodéficience humaine (VIH) (Malkovsky et coll., 1988), de Chlamydia trachomatis (Judson et coll., 1989), du virus de
l’herpès simplex (Judson et col!., 1929), de Neisseria gonorrhoeae (Bolch et Warren, 1973) et aide même à diminuer les risques de cancer du col utérin par son action sur le papillomavirus humain (Celentano et col!., 1987). Le chlorure de benzalkonium, un autre agent spermicide, a aussi la propriété de désactiver le VIH (Wainberg et coll., 1990), ce qui suggère que l’usage de spermicides pourrait aider à prévenir la transmission des MTS.
Par contre, des études récentes montrent qu’une utilisation fréquente de spermicide peut amener une irritation des parois vaginales et de l’exocol, ce qui risque de faciliter la transmission du VIH par le recrutement de cellules du système immunitaire, hôtes de ce virus (e.g. lymphocytes T, macrophages) (fichorova et col!., 2001; Patton et coll., 1999). La concentration en nonoxynol-9 dans les préparations de spermicides disponibles sur le marché est 300 fois plus élevée que celle nécessaire pour tuer les spermatozoïdes; diminuer les doses d’agent actif dans les préparations de spermicides serait primordial pour rendre cette méthode plus sécuritaire (Courtot et col!., 1994).
Plusieurs études cliniques s’intéressant à l’effet protecteur des spermicides contre les MTS se contredisent, probablement dû au fait qu’elles n’utilisent pas les mêmes formes de spermicides et portent sur des populations différentes (éditorial de Richardson, 2002). Par exemple, 2 études ont trouvé un effet protecteur du nonoxynol-9 contre la gonorrhée (Rosenberg et coll., 1987; Kreiss et col!., 1992), 2 autres n’ont constaté aucun effet (Niruthisard et coli., 1992; Roddy et col!., 2002), et une a observé que le spermicide faciliterait ce type d’infection (Richardson et col!., 2001).
1.3.2 Types et modes d’action des spermicides
Que les préparations de spermicides soient sous forme de mousse, de crème, de gelée, de suppositoire, de film ou d’éponge contraceptive, elles se composent toujours de
l’agent spermicide qui interfère avec l’activité fonctioimelle des spermatozoïdes ainsi que d’un excipient. Ce dernier sert de véhicule à l’agent actif et permet de le maintenir à l’intérieur du vagin. Certains excipients peuvent également contribuer à l’effet contraceptif
en empêchant les spermatozoïdes d’entrer en contact direct avec la glaire cervicale (Creinin et Keith, 1994).
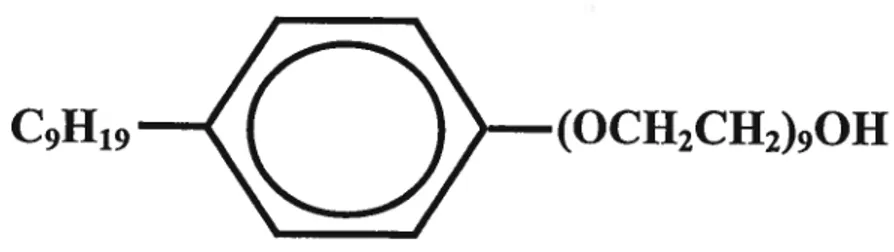
Différents types d’agents spermicides peuvent être utilisés comme principe actif en contraception vaginale; les principaux sont présentés au tableau I. Le plus couramment utilisé à travers le monde, le nonoxynol-9, ainsi que le nouveau spermicide que nous avons utilisé dans celle étude, le FTDBA (fluorure de tétradécyl-diméthyl-benzyl ammonium ou fluorure de myristalkonium), font partie de la catégorie des surfactants. Les structures moléculaires de ces deux agents spermicides sont présentées à la figure 5. Ils se caractérisent par une longue chaîne hydrocarbonée capable de pénétrer facilement la portion phospholipidique de la membrane plasmique du spermatozoïde. Cette propriété tensioactive augmente la perméabilité cellulaire et cause un débalancement osmotique, provoquant de ce fait même la perte de mobilité du spermatozoïde (Creinin et Keith, 1994). Dans le cas du FTDBA, un surfactant cationique, la partie chargée de la molécule interagit
avec les protéines membranaires, par exemple la protéine G, interaction qui influence la
prolifération de nombreuses cellules somatiques (Patarca et Fletcher, 1995).
1.3.3 Tests pour évaluer l’activité des spermicides
Avant qu’un spermicide ne soit mis sur le marché, il doit satisfaire à des normes
strictes d’efficacité et de sécurité. Les tests in vitro sont utilisés afin de vérifier leur efficacité sur les spermatozoïdes. La première méthode standardisée a été le test de Sander Cramer qui consiste à déterminer si un traitement avec des concentrations décroissantes de spermicide peut tuer ou immobiliser tous les spermatozoïdes d’un échantillon de sperme, et
à vérifier que l’immobilisation demeure irréversible après l’ajout de glucose. Si la moindre
mobilité persiste, la dilution testée échoue le test spermicide (pour une revue des tests in
vitro avec spermicide, voir Lee, 1996). Si une substance échoue (à une dilution 1/1 1) à
l’immobilisation complète des spermatozoïdes en moins de 20 secondes, elle n’est pas acceptable en tant qu’agent spermicide, dû à la rapidité avec laquelle les spermatozoïdes pénètrent dans la glaire cervicale et gagnent la sécurité de l’endocol (Green et col!., 2001).
Des avancées technologiques permettent aujourd’hui de mesurer avec précision les
caractéristiques des spermatozoïdes suite à une exposition à un spermicide. Ainsi, le CASA «computer-assisted semen analysis» évalue le type de mobilité, l’angle de déplacement latéral de la tête, la numération et la morphologie. Celle technique, basée sur la vidéo micrographie, rend possible une analyse rapide d’une grande population de
spermatozoïdes. Ce système aide aussi à évaluer la mobilité de façon objective comparativement à l’observation visuelle (Lee, 1996).
La cytométrie en flux permet une analyse rapide de propriétés importantes des
spermatozoïdes grâce à l’utilisation d’anticorps spécifiques et de fluorochromes. Par exemple, la viabilité des spermatozoïdes peut être déterminée par l’iodure de propidium
(PI), un fluorochrome s’incorporant seulement dans l’ADN des spermatozoïdes morts. En
choisissant les fenêtres d’intensité de fluorescence, les résultats sont plus objectifs; de surcroît, en analysant des milliers de cellules en quelques secondes, l’erreur s’en trouve diminuée (Yamamoto et coll., 1998; Lee, 1996).
La membrane plasmique des spermatozoïdes doit obligatoirement être fonctionnelle
pour que se réalisent la capacitation, la liaison à la zone pellucide de l’ovocyte, ainsi que la réaction acrosomiale. Son intégrité, suite à un traitement par un spermicide, peut être vérifiée à l’aide du test de gonflement hypoosmotique (<t hypoosmotic swelling test
»).
Cette technique est basée sur le fait qu’un spermatozoïde dont la membrane plasmique au
niveau du flagelle est non endommagée, permet un passage de l’eau à l’intérieur de la cellule en condition hypoosmotique; ce gonflement implique que le spermatozoïde est intact et fonctionnellement actif. Cette propriété rend donc possible l’évaluation de l’effet d’un spermicide (Lee, 1996).
TYPES DE SPERJ4ICIDES PRINCIPE D’ACTIVITÉ EXEMPLES DE COMPOSÉS
Électrolytes Diminution importante Aucun produit commercial
du métabolisme des
spermatozoïdes en milieu
hypertonique.
Agents réagissant avec Perturbation des fonctions Acétate de mercure
les groupements cellulaires par: (Koromex, retiré du marché)
sulfydryles -oxydation
-alkylation des
groupements sulfydryles
-formation de mercaptides
Agents bactéricides Immobilisation des Chlorure de benzéthonium
spermatozoïdes. (Mousse Emco)
Surfactants Immobilisation suite à -Nonylphénoxypolyéthoxyéthanol l’augmentation de la (Nonoxynol-9)
perméabilité
-Fluorure de tétradécyl-diméthyl
membranaire.
benzyl ammomum (FTDBA ou fluorure de myristaïkonium) -Chlorure
d’ alkylbenzyldiméthylammonium
(Chlorure de benzalkonium)
(Tiré en partie de Creinin et Keith, 1996)
CH3
CH2— N— CH2 (CH2)12 CH3
Figure 5: Structures moléculaires du Nonoxynol-9 et du FTDBA.
a)
Nonoxynol-9 (nonylphénoxypolyéthoxyéthanol)C91119
(OCH2CH2)90H
b) Fluorure de tétradécyl-diméthyl-benzyl ammonium (FTDBA) ou
Fluorure de myristaikonium (MKF)
CH3
L’état de la membrane peut aussi être vérifié par cytométrie en flux en utilisant une combinaison de diacétate de carboxyfluorescéine (CFDA) et de PI. Le CFDA est incorporé dans les cellules dont la membrane est intacte, puis converti par des estérases intracellulaires en un composé fluorescent vert, la carboxifluorescéine. Donc, les spermatozoïdes dont la membrane est intacte seront verts alors que les autres apparaîtront rouges à cause du marquage par le PI (Pena et cou., 199$).
Les tests in vivo sont réalisés pour vérifier le niveau requis de sécurité d’un spermicide avant de passer à l’utilisation humaine. Ils sont basés sur des observations toxicologiques et tératogéniques, après insertion intravaginale des composés à des animaux (e.g. primates, rates, lapines) (Chvapil et coll., 1980; Patton et coli., 1999).
1.4 La fragmentation de l’ADN des spermatozoïdes éjaculés
Trois mécanismes ont été proposés pour expliquer l’existence d’une fragmentation dans l’ADN des spermatozoïdes éjaculés.
1.4.1 Défauts lors de la transition des histones aux protamines
Le premier mécanisme impliquerait un processus anormal de compaction de l’ADN. En effet, la compaction requiert l’activité d’une nucléase endogène pour créer des brisures simple brin dans l’ADN afin de faciliter son déploiement en vue de la protamination et de la condensation, ainsi que celle d’une ligase et de TP1 pour aider à réparer ces cassures (voir les détails à la section 1.2.2). Une maturation nucléaire incomplète durant la spermiogenèse pourrait donc entraîner la persistance de brisures dans l’ADN des spermatozoïdes matures.
De plus, l’extrême compaction de l’ADN des spermatozoïdes procure un certain degré de protection contre les dommages au génome gamétique. Une condensation défectueuse pourrait ainsi causer une susceptibilité accrue de l’ADN aux dommages induits par divers agents telle l’exposition à des toxines environnementales (McPherson et Longo,
1.4.2 Processus apoptotique inachevé
Une apoptose incomplète au cours de la spermatogenèse représente une autre source potentielle de brisures dans l’ADN. L’apoptose, ou mort cellulaire programmée, est le processus par lequel les cellules activent un programme intrinsèque de mort afin de se tuer elles-mêmes, de manière contrôlée et sans provoquer de réponse inflammatoire. La plupart des cellules nuclées des mammifères sont capables d’entrer en apoptose en exprimant toutes les protéines nécessaires à la mort cellulaire. Il est tout à fait normal que les cellules germinales des testicules entrent en apoptose continuellement tout au long de la vie d’un homme. Près de 75% des spermatogonies A et 20% des cellules germinales aux stades entre les spermatocytes de premier ordre et les spermatides seraient ainsi éliminées. Au début de la puberté, il se produirait même une vague d’apoptose massive des spermatogonies, indispensable pour le déclenchement et la poursuite d’une spermatogenèse normale (pour une revue récente sur l’apoptose au cours de la spermatogenèse, voir Levy et Seifer-Aknin, 2001).
Un processus apoptotique normal serait déclenché dans les cellules germinales lorsqu’elles sont défectueuses ou que leur nombre excède la capacité des cellules de Sertoli à les supporter. Ces dernières ne se divisant pas, elles ne peuvent supporter qu’un nombre restreint de cellules germinales à la fois. Le nombre de spermatogonies entrant en méiose est donc limité afin de maintenir l’homéostasie: tout surplus se voit éliminé par apoptose. Lorsque le signal de mort cellulaire est donné, le ligand de Fas (fasL), une protéine
exprimée à la surface des cellules de Sertoli, se fixe au récepteur Fas (CD95 ou APO-1)
ancré dans la membrane plasmique des cellules germinales. La formation du complexe active la voie de signalisation impliquant les caspases et peut provoquer l’apoptose à tous les niveaux de la spermatogenèse.
À
ce jour, on ne connaît pas encore les mécanismesmoléculaires qui provoquent l’activation du fasL (Sakkas et cou., 1999b; Rodriguez et cou., 1997; Levy et Seifer-Aknin, 2001). D’autres systèmes, tel les proto-oncogènes (e.g. $ 3d-2), pourraient aussi être à l’origine du déclenchement de l’apoptose (Levy et Seifer
Aknin, 2001).
La fragmentation de l’ADN survient à une phase tardive du processus apoptotique, suite à l’activation d’endonucléases endogènes (Ramos et Wetzels, 2001). C’est pourquoi une apoptose incomplète lors de la spermatogenèse peut amener la présence de fragments dans l’ADN des spermatozoïdes éjaculés. Ce phénomène pourrait être dû à une mauvaise
synchronisation entre le processus apoptotique et la spermatogenèse; même si le processus apoptotique est initié, le spermatocyte entre en spermiogenèse alors que l’apoptose se
complète. De ce fait, on observe de la fragmentation dans l’ADN des spermatozoïdes éjaculés.
D’autres signes d’un processus apoptotique incomplet sont possibles sous forme d’anomalies dans la chromatine, d’une composition anormale en protamines, ainsi que de rétentions cytoplasmiques (Sakkas et coli., 1999b).
Dans les spermatozoïdes matures, l’apoptose ne peut pas être déclenchée car l’ADN
est tellement condensé qu’aucune activité de transcription n’y est possible; les protéines
nécessaires à l’apoptose ne peuvent donc pas être formées (Ramos et Wetzels, 2001).
1.4.3 Présence de substances oxygénées réactives (SOR)
Un troisième mécanisme veut que les brisures dans l’ADN des spermatozoïdes
résultent d’une surproduction de SOR (Twigg et cou., 199$a) par des spermatozoïdes anormaux ou par des leucocytes (Barroso et cou., 2000). Les SOR provenant d’une source externe au sperme pourraient aussi causer des dommages. Ils sont définis comme étant des molécules comportant un ou plusieurs atomes d’oxygène activés soit sous la forme d’un radical (molécule ayant un électron non apparié sur l’orbital externe; e.g. anion superoxyde
(02), radical hydroxyle (H0)) ou d’un peroxyde (e.g. peroxyde d’hydrogène (H202))
(Punchard et Kelly, 1996).
Le 02 et le HO sont impliqués dans de nombreux effets toxiques pour l’ADN. Il a été suggéré qu’ils seraient mutagènes et qu’ils pourraient causer des délétions
chromosomiques ainsi que des échanges de chromatides soeurs. Ils pourraient attaquer l’ADN autant au niveau des sucres que des bases azotées. L’atteinte des sucres résulterait
en une cassure avec un résidu terminal de sucre fragmenté. Le 11202, quant à lui, attaquerait
surtout les bases de l’ADN, qui sont sensibles au stress oxydatif (Donnelly et cou., 1999). Leur peroxydation pourrait causer des cassures ou du f< cross-linking» dans l’ADN et
amener une interruption de la transcription, de la traduction et de la réplication suite à la fécondation (Kodama et cou., 1997).
Les spermatozoïdes sont vulnérables aux SOR puisque leur cytoplasme est pauvre en systèmes enzymatiques protecteurs tels la gluthation peroxydase, la catalase et la
superoxyde dismutase (Zini et cou., 1993). De plus, leur membrane renferme beaucoup d’acides gras polyinsaturés, nécessaires à la fluidité (Lopes et cou., 199$a); ils sont donc plus vulnérables car les acides gras polyinsaturés peuvent servir de substrats à la peroxydation des lipides et pourrait ainsi contribuer à l’oxydation de l’ADN (Fraga et cou.,
1991).
Il a aussi été démontré que la quantité de SOR capables de causer des dommages
significatifs à l’ADN des spermatozoïdes n’est pas suffisante pour endommager leur membrane. Un spermatozoïde peut donc conserver sa capacité à féconder l’ovocyte mais porter des brisures d’ADN directement transmises au zygote (Duru et coiL, 2000; Ahmadi
1.5 Techniques de détection des dommages à l’ADN 1.5.1 Dosage de la $-hydroxy-2’-désoxyguanidine
Les dommages oxydatifs à l’ADN des spermatozoïdes peuvent être détectés en dosant, par chromatographie liquide à haute performance (HPLC) ou
par
chromatographie gazeuse-spectrométrie de masse (GC/MS), un des 20 principaux produits de l’oxydation de l’ADN: la $-hydroxy-2’-désoxyguanidine ($-OHdG). Cette technique est appliquée à l’étude de différents tissus humains afin d’estimer l’exposition d’un individu à des conditions oxydantes associées au style de vie, aux toxines environnementales, aux prédispositions génétiques et aux maladies dégénératives (fraga et coli., 1991; Kodama et coiL, 1997; Shen et Ong, 2000).1.5.2 Traduction de brèche
(«
Nick translation »)Différentes techniques existent pour détecter la présence de cassures de l’ADN des spermatozoïdes matures éjaculés. Entre autres, il y a la technique de traduction de brèche, mieux connu sous le vocable de «nick translation». Elle consiste à utiliser l’enzyme ADN polymérase I d’Escherichia cou (DNA Pol I) qui catalyse la synthèse de l’ADN dans le sens 5’—÷3’ à partir des désoxyribonucléosides triphosphates et en recopiant la séquence d’une matrice d’ADN. Le désavantage de cette enzyme réside en ce qu’elle dépend d’une
amorce et d’une matrice. Elle ne peut donc pas marquer tous les types d’extrémités de l’ADN, comme les bouts francsparexemple (Sakkas et coil., 1 999a).
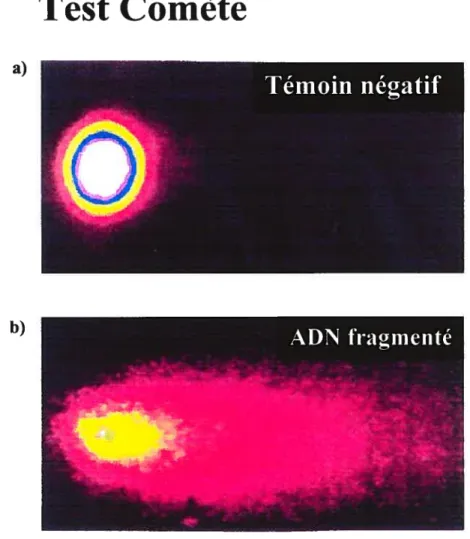
1.5.3 Le test comète(« Cornet assay »)
Le test comète, ou gel électrophorétique sur cellule unique, est une technique
visuelle en fluorescence qui peut être utilisée afin de vérifier la présence de cassures double
et simple brin dans l’ADN d’un seul spermatozoïde à la fois. Cette technique consiste à
emprisonner un spermatozoïde dans l’agarose, à lyser sa membrane et briser sa matrice de
protéines. L’ADN est ensuite soumis à un champ électrophorétique et migre pour former une queue ressemblant à une comète (d’où le nom de la technique) sortant de la tête du
spermatozoïde. Ensuite, le gel est trempé dans un colorant fluorescent qui se lie spécifiquement à l’ADN, par exemple le bromure d’éthidium. Une traînée d’ADN peut
alors être observée sous microscope àfluorescence. D’après la forme et la densité de cette
queue, il est possible de déterminer le niveau de fragmentation de l’ADN du spermatozoïde
(Collins et coll., 1997; Shen et Ong, 2000). Une représentation de résultats obtenus à l’aide
de cette technique est présentéeàla figure 6.
Bien que le test comète soit considéré comme l’un des plus sensibles, des plus simples, des moins coûteux et des plus reproductibles pour la détection de fragments d’ADN, il comporte tout de même le désavantage de n’observer qu’un seul spermatozoïde
alors que nous savons que la population de spermatozoïdes dans un éjaculat est très
hétérogène ($akkas et cou., 1999a).
1.5.4 « Sperm chromatin structure assay» (SCSA)
Le « sperm chromatin structure assay» (SC$A) mesure la susceptibilité de l’ADN à se dénaturer in situ en milieu acide ou à la chaleur, et est efficace pour observer les
dommages à l’ADN. Cette technique utilise l’acridine orange, un fluorochrome spécifique
à l’ADN. Une structure anormale de l’ADN est quantifiée par cytométrie en flux par
l’observation du changement métachromatique de la fluorescence verte (ADN double brin)
à rouge (ADN simple brin, dénaturé). Le traitement au milieu acide cause une dénaturation
partielle de l’ADN seulement dans les spermatozoïdes qui ont une structure de chromatine altérée ou une fragmentation dans leur ADN. Donc, une fluorescence verte est associée à un bas niveau de fragmentation de l’ADN alors qu’une fluorescence rouge est associée à un niveau modéré ou haut de fragmentation. Ce procédé est souvent utilisé pour vérifier l’effet d’une exposition à un agent toxique (Evenson et Jost, 2000; Gorczyca et coll., 1993).
a)
b)
Test Comète
Figure 6: Types de résultats obtenus à partir de la technique «Cornet assay». En a, un témoin négatif n’ayant pas de fragmentation dans son ADN. En b, une cellule contenant beaucoup de brisures dans son ADN. (Cellules sanguines périphériques humaines)
1.5.5 Technique TUNEL
Nous avons choisi d’utiliser la technique TUNEL (terminal uridine nick end labeling) parce qu’elle semblait la plus appropriée à nos besoins (simple, rapide, reproductible). Cette technique était originellement destinée à la détection de fragments d’ADN résultant de l’apoptose dans les cellules somatiques. Ce n’est que récemment qu’on
a commencé à l’utiliser pour la détection de fragments d’ADN dans les spermatozoïdes. Cette méthode utilise l’enzyme désoxyribonucléotidyle exotransférase (TdT) pour
catalyser l’addition de multiples désoxyuridines triphosphates (couplés à des molécules de biotine), à chaque fonction alcool 3’OH de l’ADN simple ou double brins. En présence de magnésium (Mg2
),
cette enzyme a la propriété de ne pas avoir besoin de matrice pour fonctionner; elle peut donc marquer tous les types d’extrémités 3’OH (bouts francs, extrémités 3’OH rentrantes, etc.). Les cassures de l’ADN peuvent ensuite être détectées par cytométrie en flux ou microscopie à fluorescence après avoir ajouté de la streptavidine (couplée à la fluorescéine), laquelle a une affinité extrêmement spécifique et élevée pour la biotine (Sakkas et coil., l999a; Gorczyca et coll., 1993). Donc, plus le taux de fragmentation est élevé, plus grande sera l’intensité de fluorescence.2. Objectifs de l’étude
Debbasch et cou. (1999) ont observé que l’exposition de cellules conjonctivales en culture à de faibles concentrations d’ammonium quaternaire induit une synthèse de substances oxygénées réactives (SOR) (peroxyde d’hydrogène et d’anion superoxyde). Comme il est maintenant bien établi que les SOR peuvent endommager l’ADN, il devenait
donc important de vérifier si le nouvel agent spermicide, le fluorure de tétradécyl-diméthyl
benzyl ammonium (FTDBA), pouvait endommager l’ADN des spermatozoïdes suite à une production de $OR.
Dans la littérature, nous n’avons trouvé aucun test in vitro permettant de vérifier si
les spermicides, en cas d’exposition à une dose sublétale, pouvaient causer des brisures
dans l’ADN des spermatozoïdes. Les dommages à l’ADN des spermatozoïdes ne sont pas toujours associés à une baisse de la mobilité ou de la viabilité (Fraga et coll., 1991). Comme il n’y a aucune activité de réparation de l’ADN dans les spermatozoïdes matures, toute lésion induite dans leur ADN se retrouvera à l’intérieur de l’ovocyte lors de la fécondation. Un spermatozoïde porteur d’un ADN ainsi altéré pourrait alors compromettre soit le processus de fécondation, le développement embryonnaire et foetal ou encore augmenter les risques de maladies génétiques et même de cancers infantiles (Sakkas et
coil., 1999a; fraga et coll., 1991). Quelque 60% des grossesses issues d’un échec de la
contraception étant menées à terme, il devient crucial de s’assurer que l’utilisation de spermicides ne comporte aucun risque pour les futurs enfants (Creinin et Keith, 1994).
L’objectif principal de notre étude était de vérifier si l’exposition des spermatozoïdes à une dose sublétale de FTDBA peut causer une fragmentation de leur ADN. Nos échantillons de sperme provenaient d’hommes affirmant avoir déjà induit une grossesse.
Les résultats obtenus par la technique TUNEL indiquant une augmentation du degré de fragmentation de l’ADN des spermatozoïdes exposés au FTDBA, nous avons poursuivi les objectifs : 1) d’analyser la fragmentation par électrophorèse de l’ADN,
2) de mesurer la fragmentation par une technique enzymatique sur l’ADN purifié,
3) de visualiser en microscopie électronique l’état de condensation du noyau des spermatozoïdes traités au FTDBA,
4) de déterminer si le FTDBA peut induire la formation de substances oxygénées réactives par les spermatozoïdes.
3. Article soumis à « Contraception
»,juin 2003
INNOCUITY 0F TETRADECYL-DIMETHYL-BENZYL AMM0NM FLUORIDE ON THE
DNA
0F SPERMATOZOAG. Laforest, M. Sergerie and G. Bleau
Département d’Obstétrique-Gynécologie, Centre hospitalier de l’Université de Montréal (CHUM), Hôpital Saint-Lue, Montréal, Québec, Canada.
This study was supported by a grant from Philip Morris Extemal Research Program and by Centre de recherche du CHUM—Hôpital Saint-Luc, Montréal, Québec, Canada.
G.L. received a studentship from fonds de recherche en santé du Québec (FRSQ).
Reprint requests: Gilles Bleau, PhD.
Centre de recherche du CHUM Hôpital Saint-Luc
264, boul. René-Lévesque est
Montreal, Québec, Canada H2X 1P1
Tel: 514-890-$000 (35820)
fAX: 514-412-7314
Abstract
Tetradecyi-dimethyi-benzyl-ammonium fluoride (TDBAF) is a powerful new spermicide. This fluoride sait of a quaternary ammonium causes irreversibie ioss of sperm motiiity by inducing ceil necrosis and enzyme inhibition.
In cases of failure of local contraception, there is a theoretical risk that a
spermatozoon exposed to a sublethai concentration of spermicide might suffer DNA strand breaks, with transmission of damaged DNA to the oocyte. The present study aims to ascertain innocuity of TDBAF in this regard.
Spermatozoa from 32 fertile men were exposed to a subiethai concentration of TDBAF, individualiy determined by a modified Sander-Cramer assay. The degree of DNA fragmentation was measured by the TUNEL assay (labeling of 3’OH termini using terminal transferase), foilowed by flow cytometry. DNA integrity was aiso assessed by pulsed field electrophoresis of purified sperm DNA, as well as its enzymatic radioisotopic (a35S ATP) iabeling. Production of reactive oxygen species (ROS) was measured by
chemiluminescence.
With the TUNEL assay, a significant increase in sperm labeling was observed after TDBAF treatment compared to controls (p < 0.001), suggesting increase DNA fragmentation. Antioxidants (vitamin E or superoxide dismutase) faiied to prevent this increase, and TDBAF did flot stimulate ROS production by normal spermatozoa.
Pulsed field electrophoresis showed no evidence of increased DNA fragmentation in
TDBAF-treated sperm. Likewise, enzymatic labeling of purified DNA demonstrated equal numbers of3’OH termini in control and TDBAf-treated sperm.
As shown by electron microscopy, TDBAF at sublethal concentration causes sperm
chromatin decondensation. In the TUNEL assay, this phenomenon allows easier access of terminal transferase to its DNA substrate, thus explaining the apparent increase in DNA fragmentation in the presence of TDBAF.
In conclusion, the use of TDBAF as a spermicide does flot place progeny at
increased risk of abnormalities should pregnancy occur. Conceming the TUNEL assay, we propose that pretreatment of spermatozoa with TDBAF allows a more accurate measure of
sperm DNA fragmentation.
Introduction
Whether used alone or as adjunct to physical barriers, spermicides remain key elements in the armamentarium of local contraception. Because of their powerful effect on spermatozoa, surfactants, of which Nonoxynol-9 is the prototype, rapidly became the most widely used spermicidal agents [1]. They act first by disrupting the phospholipid bilayer of
the plasma membrane, thus increasing in ceil permeability conducive to osmotic imbalance and irreversible loss of sperm motility [21.
Benzalkonium chloride, a cationic detergent with a wide and powerful microbicidal activity, has also been used as a spermicidal drug in various countries for more than 30
years. This compound is known for its lack of toxicity at recommended doses. Because of
the urgent need to develop new spermicides that combine high contraceptive efficacy and protective effect against sexually transmitted diseases, especially 111V infection, quatemary ammoniums are regaining in popularity. In this regard, we recently tested the fluoride sait of the C-14 homologue of benzalkonium, namely tetradecyl-dimethyl-benzyl ammonium fluoride (TDBAF). Preliminary resuits and those presented herein demonstrated powerful spermicidal as weIl as bactericidal and virucidal activities.
The safety of spermicides is a criticai issue. On this regard, reports in the eariy 1980 raised concem that the use of Nonoxynol-9 during the periconception period could be associated with adverse fetal outcomes. This could have significant impact since
contraception with spermicidal agents fails in 6 to 21% of cases. The possibility of fertilization by a damaged spermatozoon or an effect of the spermicide on the oocyte or
developing embryo after absorption in blood lias been invoked. More recent large population studies as well as a meta-analysis failed to find such an association [3,4].
In the case of quaternary ammoniums, absorbtion by the vaginal epithelium and an
effect on oocyte/embryo through the systemic route is flot an issue since these compounds
are not absorbed [5]. However, there remains a possibility of an adverse effect resulting
from fertilization by a damaged sperm exposed to a sublethal concentration of the spermicide.
Recently, Debbasch et aÏ. (1999) [6] reported that quatemary ammoniums can stimulate the production of reaction oxygen species (ROS) by cultured conjunctival ceils, associated with chromatin condensation due to apoptosis. In the case of spermatozoa, it was shown that ROS formation cari cause a significant increase in sperm DNA fragmentation
[7,8,9]. Furthermore, DNA damage could be associated with patemal transmission of
genetic defects to the embryo and resulting fetus [10].
In light of possible detrimental effects on spermatozoa, we sought to determine
whether sperm exposed to a sublethal concentration of spermicide, with TDBAF as model compound, undergo DNA fragmentation as a resuit of ROS formation. The integrity of sperm DNA was assessed by TUNEL assay, pulsed field electrophoresis as well as by a new enzymatic method to measure the incorporation of a radioactive nucleotide in isolated
sperm DNA. The resuits of these studies were further explained by measuring ROS formation by a chemiluminescence assay and by electron microscopy evaluation of sperm chromatin condensation of spermatozoa treated with TDBAF.
Materïals and Methods
$tudy participants
Participants in this study were healthy volunteers of proven fertility, aged between 22 and
45 years old. Before participating in this project, each subject signed an informed consent form approved by the Ethics Committee of the Hospital Center.
$arnple collection
Semen samples were collected by masturbation into sterile polypropylene containers
(Sarstedt, Montreal, Canada) at the Andrology Laboratory, after 2-5 days of sexual
abstinence. Afier a 30-minute liquefaction period at 37°C, a standard clinical semen analysis was performed according to the World Health Organization criteria [11] to determine sperm concentration, motility and morphology.
Determination ofthe subtethal concentration
The sublethal concentration of TDBAF (Aromapharm Ireland Ltd.) was determined by a modification of the Sander-Cramer assay [1,12]. Serial dilutions (1/50, 1/60,... to 1/260) of TDBAF were prepared starting from a 0.1% stock solution of the compound
(2.84 mM); stock solution and dilutions were made with Dulbecco’s phosphate buffered
saline (PBS) (JH 7.4). A 50 iL aliquot ofeach dilution was mixed with to 10 tL ofsemen
and incubated at 37°C for 10 minutes. for each semen sample, the sublethal concentration
was determined corresponding to the first dilution of TDBAF that allowed sperm motility
(progressive or non-progressive motility). Once the sublethal concentration was found, a volume of semen corresponding to 10 million spermatozoa was mixed with this sublethal concentration (semen to dilution ratio was maintained at 1:5, v:v) for different time periods of 10 seconds, 2, 4, 6, 10, 20 and 30 minutes. In parallel, control spermatozoa were exposed
to PBS, under similar conditions. Afier each time period, the spermatozoa were fixed
during 30 minutes in 1% formalin, washed in PBS and stored at 4°C until analysis.
Measurement ofsperm DNA fragmentation by the TUNEL assay
The degree of sperm DNA fragmentation that was measured by labeling 3TOH
termini using a modified terminal deoxynucleotidyl transferase (TdT)-mediated
deoxyuridine triphosphate-biotin end labeling technique (TUNEL), essentially as described previously [13,141. In brief, fixed spermatozoa were incubated for 10 minutes in 100 tL of
TdT buffer containing 1 M sodium cacodylate, 150 mM Tris (pH 7.4), 25 mM CoC12, 1.25
mg/mL bovine serum albumin (BSA) and 0.1% Triton X-100 (Sigma Chemical Co., St
Louis, MO). Afier centrifugation (10 000 g for 4 mm), TUT buffer was removed, and
triphosphate, 10 U of TdT (Roche Diagnostics, Lavai, Canada), and Triton X-100 at a final concentration of 0.1%. The sperm suspension was incubated at 37°C for 60 minutes. Afier one washing with IN buffer (30 mM Tris, pH 7.4, 300 mM NaC1), the spermatozoa were treated with 100 tL of staining AP buffer (50 mM Tris, pH 7.4, 150 mM NaC1) containing 1% streptavidin conjugated to fluorescein isothiocyanate (FITC) (Canadian life technology, Toronto, Canada), followed by incubation at 37°C in the dark for 60 min. Afier another centrifugation (10 000 g for 4 mm), the supematant was removed and the pellet resuspended in imi of AP buffer. DNA fragmentation was measured using a FACScan ftow cytometer (Becton Dickinson, San Jose, CA, USA) equipped with a 15 mW argon-ion laser for excitation.
Light-scattering and fluorescence data were obtained at a fixed gain setting in logarithmic mode. Debris were gated-out based on forward scatter versus side scatter dot plot, by drawing a region enclosing the sperm population of interest; 10 000 ceils were analyzed in each sample. The mean fluorescence intensity of spermatozoa in each sample was determined. for negative controls, TdT was omitted from the reaction mixture. for positive controls, the spermatozoa were pretreated with 200 U of deoxyribonuclease (Dnase I, RNase-free) (Roche Diagnostics) for 45 minutes at 37°C before labeling.
Extraction and isolation ofsperm DNA
The method for the isolation of sperm DNA was a modification of guanidinium
thiocyanate method described by Hossain et al. [15]. A volume of sperm suspension (about
400 tL, control or TDBAf-treated sperm) corresponding to 20 million spermatozoa was
mixed with 5 mL of PBS followed by centrifugation at 943 g for 10 minutes. The sperm
pellet was lysed in 2.5 mL of a lysis buffer containing 6 M guanidinium thiocyanate, 30
mM sodium citrate (pH 7.0), 0.5% sarkosyl, 0.20 mg/mL proteinase K and 0.3 M
f3-mercaptoethanol, and incubated at 55°C for 3-4 hours. Two volumes of isopropyl alcohol
were then added directly to the lysate and the tube was gently inverted until the DNA fibers
formed a visible bail. The DNA was recaptured with a Pipeteman, washed twice in 70%
ethanol, dissolved in approximately 200 iiL of water over a 24-hour period, and the quality
and concentration of extracted DNA assessed by absorbance at 260 and 280 nm.
Detection ofDNA fragmentation by c25S A TP incorporation in extracted DNA
The degree of DNA fragmentation was also assessed on isolated DNA by enzymatic
labeling of 3’OH termini using TdT, and with a35S ATP as radioactive substrate. Four tg of
isolated DNA were incubated in a medium containing 10 pi TdT buffer 5X (1 M
potassium cacodylate, 125 mM tris-HC1, 1.25 mg/mL bovine serum albumin), 5 tL 25 mM
volume was adjusted to 50 iL with water. The reaction mixture was incubated overnight at
37°C.
Unreacted a35S ATP was removed first by chromatography on MicroSpin G-25
columns (Amersham Pharmacia biotech, Baie d’Urfee, Canada). SecondÏy, remaining
traces of unincorporated xS ATP were eliminated by precipitation: 150 pi of t-RNA
(0.25 mglmL t-RNA in 0.1 M sodium pyrophosphate) were added to the DNA fraction of
G-25 columns, precipitated with 200 jiL of 25% tricifioroacetic acid (TCA) and placed on
ice for 10 minutes. Finally, the precipitate was recovered by filtration on SMWP 5 im
ifiters (Millipore, St-Laurent, Canada) and washed sequentially with 10 mL of 10% TCA
and 10 mL of 95% ethanol. Filters were then transfened into scintillation vials containing 5
mL of scintillation cocktail (ICN biochemicals) to measure radioactivity on a LS-1801
Beckman counter. As negative controls, TdT was omitted from the reaction mixture;
strongly positive controls were DNA samples pretreated with combined 40 U EcoRi and
40 U 3amHl (New England Biolabs, Mississauga, Canada) for 1 hour at 37°C prior to
radioactive labeling.
DNA analysis by regular andpulsedfield electrophoresis
DNA from control and TDBAf-treated sperm was isolated as described above and
IsoÏated sperm DNA was also tested for the presence of large fragments using pulsed field
electrophoresis (CHEF-DR III, Bio-Rad, Mississauga, Canada). Separation was achieved in
1% molecular biology certified agarose (Mande! Scientific Cie Ltée, Côte de Liesse,
Canada) at 14°C, with switch time of 1-6 seconds, at an angle of 1200 and voltage gradient
of 6 V/cm during 11 hours. For each sample, between 1 and 6 j.ig of DNA were loaded.
Analysis ofsperm chromatin condensation
Chromatin aspect and density were investigated using transmission electron microscopy of spermatozoa fixed for 30 minutes with 4% glutara!dehyde in 0.1 M sodium cacodylate at 4°C. Spermatozoa were washed twice in 0.2 M sodium cacodylate and stored
at 4°C until processing for electron microscopy by usual techniques. Chromatin densities
were compared on photomicrographs using the program Mesurim 2.4 (Université d’Amien,
France).
Antioxidant treatment and measurement ofROS production
Attempts at preventing ROS formation were performed by adding 5 units ofvitamin
E to 500 jiL of semen, or superoxide dismutase (SOD, Sigma Chemical Co., St Louis, MO)
at 0.1 mg/mL before treatment of sperm with TDBAF. Control and TDBAF-treated sperm