Effets d’un entrainement de précision à la marche sur la
récupération locomotrice et la douleur neuropathique à
la suite d’une lésion médullaire incomplète
Thèse
Charline Dambreville
Doctorat en médecine expérimentale
Philosophiæ doctor (Ph. D.)
Effets d’un entrainement de précision à la marche
sur la récupération locomotrice et la douleur
neuropathique à la suite d’une lésion médullaire
incomplète
Thèse
Charline Dambreville
Sous la direction de :
Laurent Bouyer, directeur de recherche
Andréanne Blanchette, codirectrice de recherche
Résumé
Introduction : La diminution du contrôle volontaire de la marche représente un déficit majeur
affectant la qualité de vie des personnes ayant une lésion médullaire incomplète (LMi). À ce jour, les moyens utilisés pour favoriser la récupération locomotrice sont principalement des entraînements du « rythme locomoteur de base » qui ciblent principalement le contrôle automatique de la marche. Bien que ces entraînements aient démontré certains bénéfices, les améliorations de la capacité locomotrice qui en résultent demeurent limitées. Une explication serait que ces entraînements peu challengeants ne recrutent qu’une partie des circuits neuraux contrôlant la locomotion, ne permettant pas une récupération optimale post-LMi. Notre
hypothèse générale est donc que l’utilisation d’un entraînement locomoteur plus challengeant
permettrait de solliciter davantage les circuits neuraux impliqués dans le contrôle volontaire de la marche (en particulier la voie corticospinale), en plus des circuits déjà impliqués (automatiques), et mènerait à une amélioration globale de la fonction locomotrice en termes de vitesse et d’endurance, incluant aussi la fonction sensorimotrice avec l’équilibre et la proprioception.
À la suite d’une LMi, une deuxième conséquence impactant considérablement la qualité de vie des patients est le développement de douleur neuropathique (DN). Plusieurs études chez l’animal suggèrent que les mécanismes impliqués dans le développement de la DN et ceux impliqués dans la récupération locomotrice partagent certains circuits neuronaux et qu’une inhibition réciproque existerait entre les 2. Cependant, chez l’homme, ces effets demeurent encore méconnus. Notre
hypothèse secondaire est donc que l'utilisation d’un entraînement locomoteur sollicitant
davantage les circuits neuronaux diminuerait la DN, grâce aux effets d’inhibition réciproque. L’objectif général de cette thèse est de développer un entrainement capable de solliciter davantage les circuits neuraux impliqués dans le contrôle volontaire de la marche, afin de mesurer son effet sur la récupération locomotrice incluant la vitesse et l’endurance à la marche, et incluant la fonction sensorimotrice avec la proprioception et l’équilibre, et enfin de mesurer son effet sur la DN.
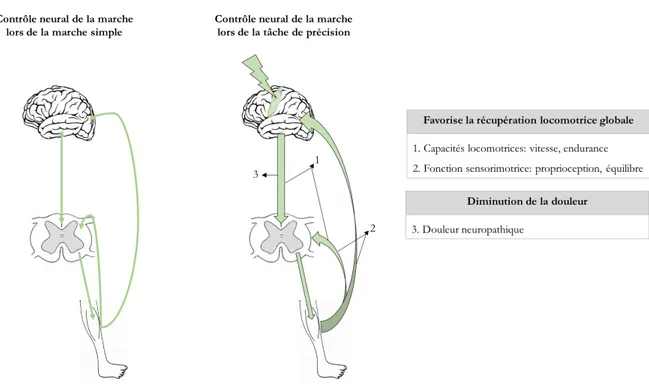
Méthodologie : Afin de mesurer la sollicitation de la voie corticospinale lors de la marche,
l’excitabilité corticospinale a été mesurée de manière non-invasive à l’aide de la stimulation magnétique transcrânienne lors d’une tâche de marche simple et lors d’une tâche de précision à la marche tout d’abord chez des participants en santé (étude 1), puis par la suite chez des
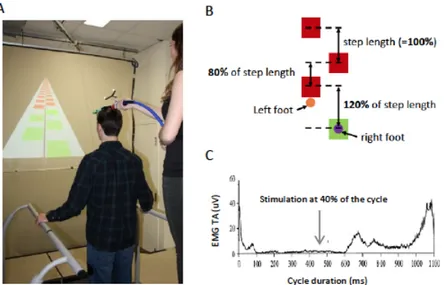
individus ayant une LMi (étude 2). La tâche de précision à la marche consistait à marcher sur tapis roulant tout en plaçant les pieds sur des cibles virtuelles rétro-projetées sur un écran placé en face du tapis. Les cibles étaient séparées par différentes distances.
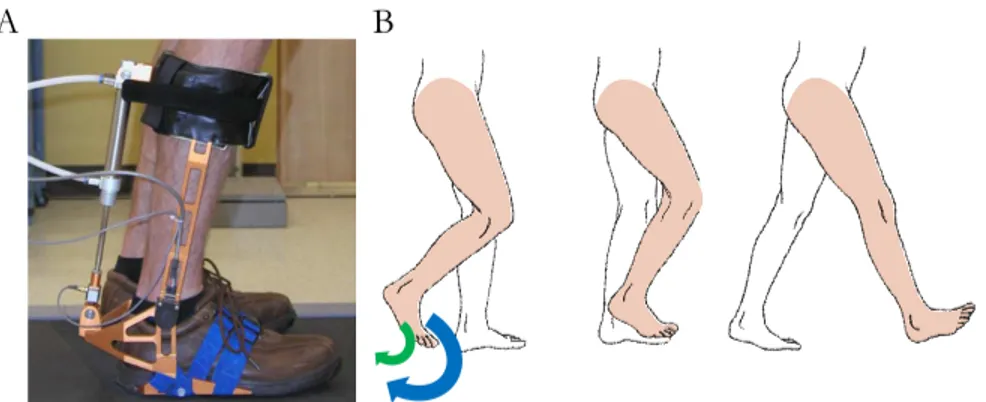
Dans l’étude 3, un nouveau test de mesure de proprioception à la cheville pendant la marche à la suite d’une LMi a été mis au point à l’aide d’une orthèse robotisée afin de caractériser l’aspect sensorimoteur lors d’une tâche dynamique.
Dans l’étude 4, la tâche de précision à la marche a été réalisée sous forme d’entrainement pour un total de 16 sessions étalées sur 4 à 5 semaines chez des individus ayant une LMi. Des mesures de vitesse, d’endurance, d’équilibre, de proprioception et de douleur neuropathique ont été prises pré- et post-entrainement puis comparées. La satisfaction des participants envers l’entrainement a aussi été documentée.
Résultats : Les résultats des études 1 et 2 ont montré qu’une tâche de précision à la marche
permettait de solliciter davantage la voie corticospinale comparée à une tâche de marche simple chez des participants sains et des individus avec une LMi. L’étude 3 a montré une bonne fidélité et validité du test mis au point afin de mesurer la proprioception à la cheville pendant la marche. L’étude 4 a montré la faisabilité d’effectuer un entrainement de précision à la marche chez des individus avec une LMi. Une amélioration de la vitesse, de l’endurance, de la proprioception et de l’équilibre a été observée pour le groupe tandis qu’une tendance vers la diminution de douleur neuropathique a été observée pour les individus préalablement atteints. Les participants ont montré une excellente satisfaction envers l’entrainement en général.
Conclusions : Les résultats de cette thèse ont permis de montrer qu’il était possible, avec une
tâche de précision à la marche, d’augmenter l’excitabilité de la voie corticospinale chez un groupe de participants sains et un groupe de participants ayant une LMi. L’utilisation de cette tâche sous forme d’entrainement a mis en évidence le bénéfice de l’utilisation d’un entrainement challengeant sur la récupération locomotrice incluant l’aspect sensorimoteur, et sur la douleur neuropathique chez une population neurologique.
Abstract
Introduction: After an incomplete spinal cord injury (iSCI), the voluntary control of walking is
often compromised. This reduces the ability to participate in daily activities and has a negative impact on quality of life. Conventional locomotor trainings, based on spinal circuits stimulation, in other words stimulation of the “automatic control” have shown some benefits, but improvements in walking function after iSCI remain limited. It was proposed that these less-challenging trainings do not recruit all the circuits involved in gait control, and so, are not sufficient to optimize gait recovery after an iSCI. The hypothesis is that a more challenging training that stimulate all gait circuits including voluntary control (more particularly the corticospinal tract), and automatic control, could lead to an improvement of gait recovery. This recovery included improvements in gait speed, gait endurance, and in sensorimotor function measured with balance and proprioception.
Another important issue after an iSCI is the development of neuropathic pain (NP). While there is a large body of evidence in animal studies showing that locomotor recovery and NP might be competing for some shared neural circuits, human studies are still sparse. A secondary
hypothesis is that a training that further stimulate all gait circuits could reduce NP. The objective of this thesis is therefore to develop a gait training that further stimulate voluntary
control of gait to measure the effects on gait recovery including gait speed, endurance and sensorimotor aspects (proprioception and balance) and to measure its effect on NP.
Methods: Corticospinal excitability was assessed using transcranial magnetic stimulation during
a simple walking task, and during a precision walking task firstly in healthy participants (study 1), and secondly in individuals with an iSCI (study 2). The precision walking task consisted of stepping onto virtual targets projected on a screen in front of them and separated by different distances during treadmill walking. In study 3, a new robotic test was developed to measure the ankle proprioception during gait in individuals with an iSCI and characterize sensorimotor function during a dynamic task. In study 4, a protocol training using the precision task was performed for 16 sessions over 4 to 5 weeks in individuals with an iSCI. Locomotor recovery including gait speed, endurance, balance and ankle proprioception and neuropathic pain were assessed pre- and post-training and compared. Participants’ satisfaction regarding the training protocol was measured post training.
Results: Results from studies 1 and 2 showed that it is possible to further increase the
corticospinal excitability during a precision walking task compared to a simple walking task in healthy participants and in individuals with an iSCI. Results from study 3 showed a good reliability and validity of the robotic test to measure ankle proprioception during gait. Results from study 4 showed the feasibility to perform a precision gait training in individuals with an iSCI. Significant improvements of gait speed, endurance, proprioception and posture and a trend of NP decrease were measured after training. Participants’ satisfaction regarding this training was excellent.
Conclusions: Results from this thesis showed that it is possible, using a precision walking task,
to further increase corticospinal tract involvement than during normal gait in healthy participants and in individuals with an iSCI. This approach highlights the potential of a more challenging gait training for gait rehabilitation in humans and provide a simple solution to enhance corticospinal drive to optimize gait recovery including sensorimotor function, and to decrease NP after CNS lesions such as spinal cord injury.
Table des matières
Résumé ... ii
Abstract ... iv
Table des matières ... vi
Liste des figures ... xi
Liste des tableaux ... xii
Liste des abréviations, sigles, acronymes ... xiii
Remerciements ... xvi Avant-propos ... xviii Introduction ... 1 1. Introduction générale ... 1 2. Lésions médullaires ... 3 2.2 Statistiques ... 3
2.3 Anatomie de la moelle épinière ... 4
2.4 Conséquences de la lésion ... 5
3. Contrôle neurophysiologique de la marche ... 17
3.1 Contrôle sensorimoteur dynamique ... 17
3.2 Contrôle automatique généré au niveau de la moelle épinière ... 19
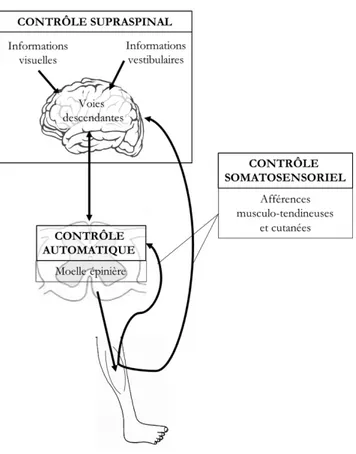
3.3 Contrôle au niveau supraspinal ... 21
3.4 Contrôle du système somatosensoriel ... 26
4. Plasticité adaptative du système nerveux central à la suite d’une lésion médullaire ... 29
4.1 Récupération spontanée ... 29
4.2 Plasticité reliée aux entrainements locomoteurs ... 33
4.3 Autres interventions afin d’induire de la plasticité adaptative ... 42
5. Plasticité maladaptative du SNC à la suite d’une lésion médullaire incomplète ... 45
5.1 Mécanismes périphériques ... 46
5.2 Mécanismes spinaux ... 47
5.3 Mécanismes supraspinaux ... 47
5.4 Traitements ... 47
6. Lien motricité-douleur ... 48
6.1 Évidences chez l’animal ... 49
6.2 Évidences chez l’humain ... 50
7. Objectifs et hypothèses ... 52
Chapitre 1 - Méthodologie générale ... 55
1.1 Protocole général de la thèse et lien entre les études ... 55
1.3 Paradigmes expérimentaux et variables mesurées ... 57
1.3.1 Mesure de l’excitabilité corticospinale lors d’une tâche de précision à la marche ... 57
1.3.2 Mesure de la proprioception à la cheville pendant la marche ... 59
1.3.3 Effets d’un entrainement de précision à la marche ... 61
Chapitre 2. Étude 1: Corticospinal excitability changes during a visually-guided precision walking task in humans: potential for rehabilitation. ... 63
2.1 Résumé ... 64
2.2 Abstract ... 65
2.3 Introduction ... 66
2.4 Materials and Methods ... 67
2.4.1 Participants ... 67
2.4.2 General protocol ... 68
2.4.3 Virtual environment and real-time feedback of foot position ... 69
2.4.4 Corticospinal excitability assessment ... 69
2.4.5 EMG recordings ... 70
2.4.6 Analysis ... 71
2.4.7 Statistical analysis ... 71
2.5 Results ... 72
2.5.1 Methodological consideration: coil displacement, background EMG, MEP saturation ... 72
2.5.2 Comparison of MEPs between locomotor tasks ... 73
2.5.3 Global performance ... 74
2.5.4 Step length adjustments ... 75
2.6 Discussion ... 76
2.6.1 Corticospinal excitability is greatly increased during precision walking ... 76
2.6.2 Corticospinal excitability increase is maintained over time during the task ... 77
2.6.3 Influence of performance and task difficulty on corticospinal excitability. ... 78
2.6.4 Potential influence of other neural structures ... 78
2.6.5 Potential clinical relevance ... 79
2.6.6 Strengths and limitations ... 79
2.7 Conclusion ... 80
2.8 Funding ... 80
2.9 Acknowledgments ... 80
Chapitre 3. Étude 2: Corticospinal excitability changes during a precision walking task after an incomplete spinal cord injury ... 81
3.1 Résumé ... 82
3.2 Abstract ... 83
3.3 Introduction ... 84
3.4.1 Participants ... 85
3.4.2 General protocol ... 86
3.4.3 Conditions ... 87
3.4.4 Experimental set-up ... 87
3.4.5 Corticospinal excitability assessment ... 88
3.4.6 Data collection ... 89
3.4.7 Data analysis ... 89
3.4.8 Statistical analysis ... 90
3.5 Results ... 90
3.5.1 Participants ... 90
3.5.2 Corticospinal excitability changes ... 91
3.5.3 Effect of variables related to precision walking task on corticospinal excitability changes ... 94
3.5.4 Effect of variables related to the participants on corticospinal excitability changes ... 95
3.5.5 Methodological considerations ... 95
3.6 Discussion ... 96
3.6.1 Corticospinal reserve in individuals with a SCI ... 97
3.6.2 Corticospinal excitability changes regarding the precision walking task or factors related to the SCI population ... 98
3.6.3 Strengths and limitations ... 99
3.7 Conclusions and clinical impact ... 100
Chapitre 4. Étude 3: Ankle proprioception during gait in individuals with incomplete spinal cord injury ... 101
4.1 Résumé ... 102
4.2 Abstract ... 103
4.3 Introduction ... 104
4.4 Material and methods ... 106
4.4.1 Participants ... 106
4.4.2 Experimental Protocol ... 106
4.4.3 Data collection and analysis ... 110
4.4.4 Statistics ... 111
4.5 Results ... 111
4.5.1 Test-retest reliability ... 112
4.5.2 Effect of non-lesion related factors on ankle proprioception ... 112
4.5.3 Discriminative validity in individuals with iSCI, and characterization of proprioceptive deficits ... 114
4.6 Discussion ... 115
4.6.1 Reliability of the proprioceptive task ... 115
4.6.2 Non-lesion-related factors that could potentially impact ankle proprioception during gait .... 116
4.6.3 Assessment in individuals with iSCI ... 117
4.8 Conclusion and Perspectives ... 119
Chapitre 5. Étude 4: Effects of a precision gait training on locomotor recovery and neuropathic pain after an incomplete spinal cord injury: A pilot study. ... 121
5.1 Résumé ... 122 5.2 Abstract ... 123 5.3 Introduction ... 124 5.3 Methods ... 125 5.3.1 Participants ... 125 5.3.2 General procedure ... 126 5.3.3 Virtual environnment ... 126
5.3.4 Precision gait training ... 126
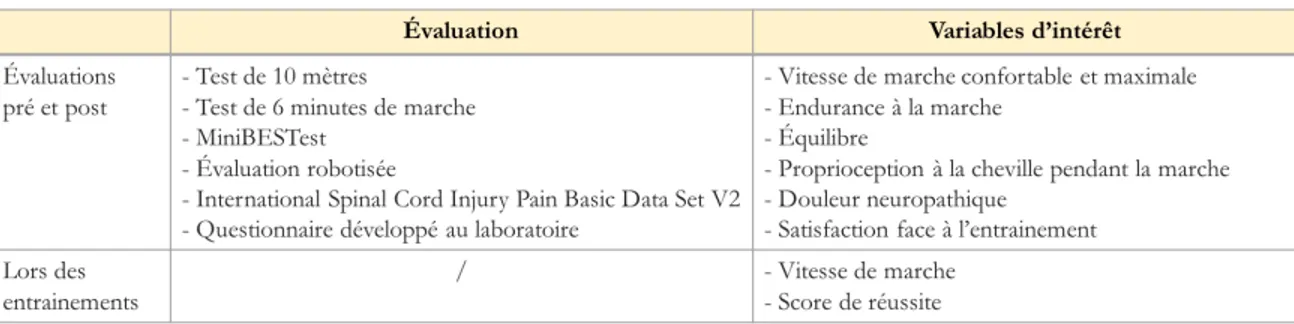
5.3.5 Pre- and post- training clinical assessments ... 128
5.3.6 Data analysis ... 129
5.3.7 Statistical analysis ... Erreur! Signet non défini. 5.4 Results ... 130
5.4.1 Participants characteristics ... 130
5.4.2 Training progression ... 131
5.4.3 Effect of precision training on clinical outcomes ... 132
5.4.4 Participants satisfaction ... 134
5.5 Discussion ... 135
5.5.1 Training progression ... 135
5.5.2 Improvement in locomotor function during the precision gait training task ... 136
5.5.3 Changes in sensorimotor function ... 136
5.5.4 Decrease of neuropathic pain after training ... 137
5.5.5 Satisfaction regarding the training program ... 137
5.6 Strengths and limitation of the study ... 138
5.7 Conclusion and Perspectives ... 138
Chapitre 6 : Discussion générale ... 139
6.1 Avancements et contributions ... 139
6.1.1 Sollicitation de la voie corticospinale lors d’une tâche de précision à la marche ... 139
6.1.2 Mesure de la proprioception à la cheville lors de la marche ... 145
6.1.3 Amélioration de la capacité locomotrice et diminution de DN à la suite d’un entrainement de précision à la marche ... 147
6.2 Forces et impacts de la thèse ... 151
6.3 Limites générales de la thèse ... 152
6.4 Perspectives futures de recherche ... 154
6.4.1 Mesures de l’excitabilité corticospinale ... 154
6.4.2 Récupération sensorimotrice ... 155
6.5 Implications cliniques ... 156
Conclusions ... 158
Annexe A. Échelle ASIA ... 159
Annexe B. Formulaires utilisés dans les études 1 et 2 ... 160
Annexe C. Formulaires utilisés dans l’étude 3 ... 163
Annexe D. Formulaires utilisés dans l’étude 4 ... 167
Annexe E. Autre contribution de l’étudiante ... 177
Liste des figures
Figure 0.1. Anatomie de la moelle épinière ... 5
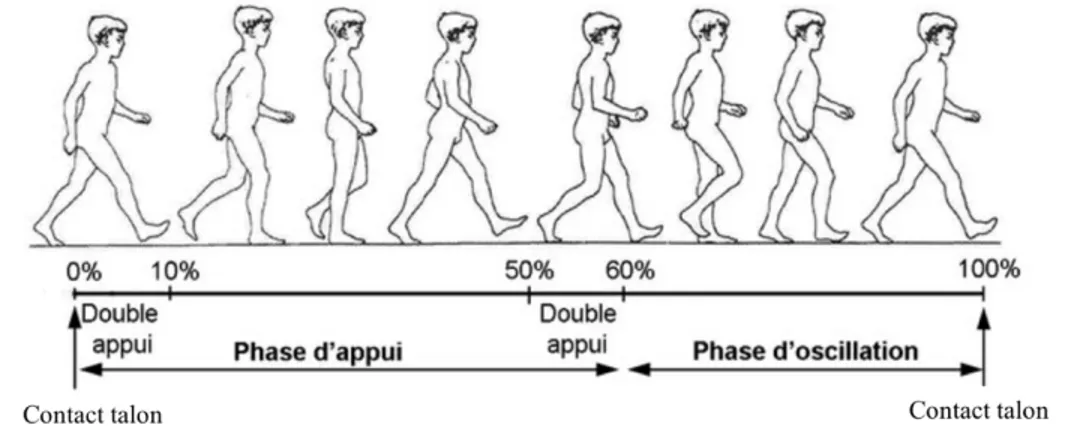
Figure 0.2. Cycle de marche ... 17
Figure 0.3. Interactions sensorimotrices dynamiques dans le contrôle de la marche. .. 18
Figure 0.4. Influences des structures supraspinales dans le contrôle de la marche. ... 26
Figure 0.5. Hypothèses générales ... 54
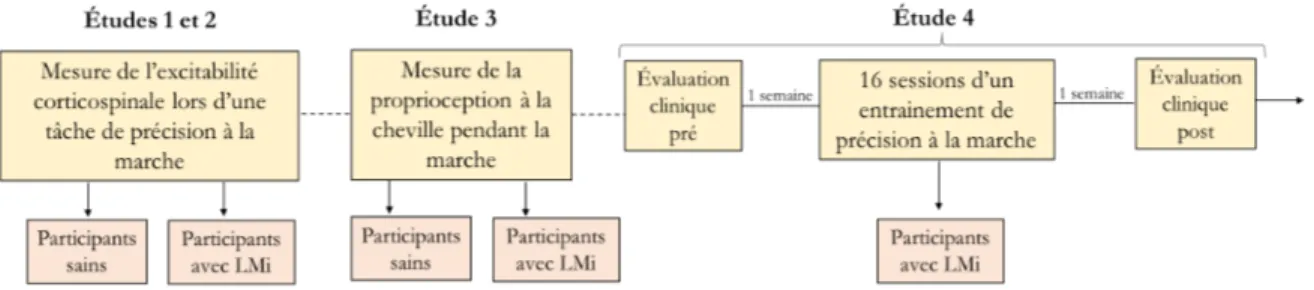
Figure 1.1. Protocole général des 4 études. ... 56
Figure 1.2. Système permettant de projeter les environnements virtuels ... 58
Figure 1.3. Stimulation magnétique transcrânienne ... 58
Figure 1.4. Mesure de la proprioception à la cheville pendant la marche. ... 60
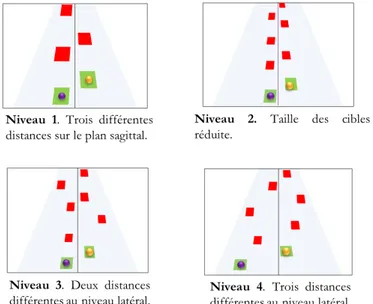
Figure 1.5. Niveaux de difficulté lors des entrainements. ... 61
Figure 2.1. ... 69
Figure 2.2. Methodological considerations. ... 73
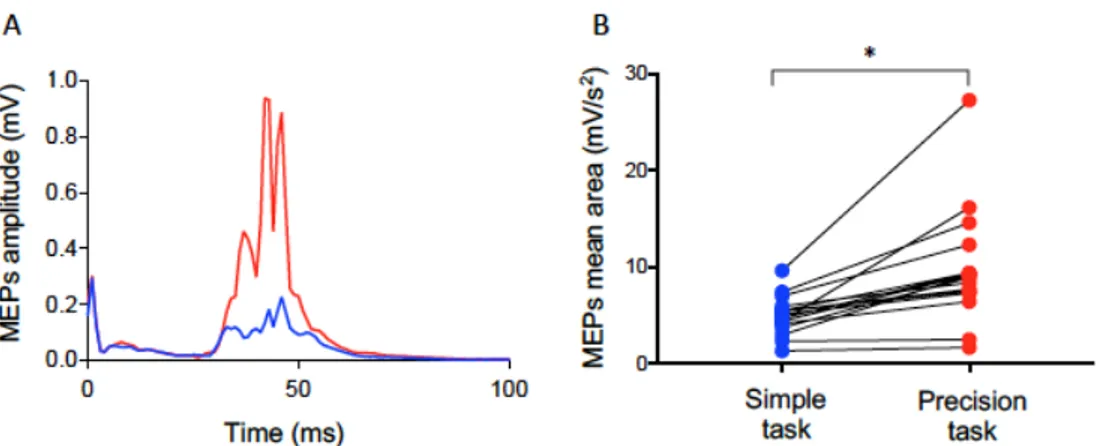
Figure 2.3. Corticospinal excitability modulation during the simple task (blue) and the precision task (red). ... 74
Figure 2.4. ... 75
Figure 2.5. ... 76
Figure 3.1. Experimental design. ... 86
Figure 3.2. Mean amplitude of MEPs for each participant evoked during the 3 conditions ... 92
Figure 3.3. ... 93
Figure 3.4. ... 94
Figure 3.5. ... 95
Figure 3.6. Methodological consideration. ... 96
Figure 4.1. ... 107
Figure 4.2. ... 110
Figure 4.3. Bland-Altman plot of differences between Days 1 and 2 vs. the mean of the two measurements. ... 112
Figure 4.4. Factors that could influence proprioception. ... 113
Figure 4.5. ... 115
Figure 5.1. Experimental protocol and setup. ... 127
Figure 5.2. Progression during training. ... 131
Figure 5.3. Effect of the precision training on clinical outcomes. ... 133
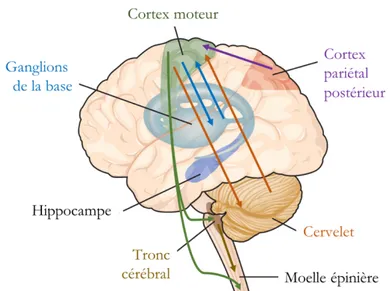
Figure 6.1. Structures impliquées dans la planification et l’exécution du mouvement. ... 144
Liste des tableaux
Tableau 1.1. Recrutement des participants pour les différentes études. ... 56
Tableau 1.2. Mesures effectuées lors des études 1 et 2. ... 59
Tableau 1.3. Mesures effectuées lors de l’étude 3. ... 61
Tableau 1.4. Mesures effectuées lors de l’étude 4. ... 62
Table 3.1. Clinical and demographic characteristics of participants and TMS data (n=14). ... 91
Table 4.1. Demographic and clinical characteristics of each people with SCI. ... 114
Table 5.1. Targets characteristics for each of the 4 blocks of training. ... 128
Table 5.2. Characteristics of the participants ... 130
Table 5.3. Results of clinical outcomes measured PRE- and POST-training for each participant. ... 134
Liste des abréviations, sigles, acronymes
ASIA: American Spinal Injury Association
BDNF: Facteur neurotrophique dérivé du cerveau CNS : central nervous system
CPGs : générateurs de patrons centraux CST : corticospinal tract
DN : douleur neuropathique
dSSEP : potentiel évoqué somatosensoriel au dermatome EEG : électroencéphalogramme
EMG : électromyogramme
fNIRS : imagerie spectroscopique proche infrarouge fonctionnelle IRM : imagerie par résonnance magnétique
IRMf : imagerie par résonnance magnétique fonctionnelle LM : lésion médullaire
LMi : lésion médullaire incomplète M1 : cortex moteur primaire
MAG : glycoprotéine associée à la myéline MCID : minimal clinically important différence MDC : minimal detectable change
MEP : potentiel moteur évoqué
MLR : région locomotrice mésencéphalique ND : non disabled
NMDA : N-méthyl-D-aspartate NP : neuropathic pain
PEST : Parameter Estimation by Sequential Testing PPC : cortex pariétal postérieur
rMT : seuil moteur au repos
rTMS : stimulation magnétique transcrânienne à répétition S1 : cortex somatosensoriel primaire
iSCI : incomplete spinal cord injury SNC : système nerveux central
SSEP : potentiel évoqué somatosensoriel TA : tibial antérieur
TDCS : stimulation transcrânienne à courant directe TMS : stimulation magnétique transcrânienne
It always seems impossible until it’s done. Nelson Mandela
Remerciements
Pour le meilleur et pour le pire! Et c’est ainsi que 5 années plus tard, s’achève cette aventure qu’est le doctorat. Bien entendu, cet aboutissement requiert qu’on s’attarde quelques minutes sur plusieurs personnes que j’aimerais mettre en avant dans ces remerciements.
Tout d’abord, je tiens à remercier mon directeur de recherche. Laurent, la richesse de tes expertises a permis de faire de mes projets un mélange parfait de mes centres d’intérêts, ce qui a permis de m’épanouir dans chacune de mes études. Merci pour tes conseils et remarques avisés ces cinq dernières années, et enfin merci de m’avoir offert l’opportunité de présenter mes projets lors de nombreux congrès à travers le monde.
Je tiens aussi à remercier ma co-directrice de recherche, Andréanne, pour m’avoir transmis son intérêt particulier pour la recherche clinique. Ton expertise et ton encadrement complémentaires à Laurent ont sans nul doute amené beaucoup de richesses aux différents projets. Enfin, un merci particulier pour ta ténacité quant à ma terminologie, j’ai cru apercevoir que j’avais quelques déficits…ciences ? à ce niveau-là !
Je voudrais présenter ma profonde gratitude à Catherine, pour sa présence et son aide précieuse sur mes projets, ainsi que pour son écoute dans les moments plus difficiles.
Je me dois aussi de remercier les nombreuses personnes avec qui j’ai eu le plaisir de travailler et qui ont largement contribué à la réussite des différentes études.
Merci à Steve et Nicolas pour leur soutien technique plus que nécessaire dans le labo, ainsi que pour leur bonne humeur au quotidien.
Merci à Martin et Caroline pour leur aide sur les projets en apportant leurs expertises respectives. Merci aussi à Joëlle et aux physiothérapeutes du programme des myélopathies pour leur confiance et leur intérêt tout au long de mes projets, ainsi que pour le recrutement efficace des participants.
Un merci particulier à Benoit avec qui les nombreuses heures passées au labo avec notre chère orthèse auront permis des moments de rires à travers nos 140 tests.
Enfin, un grand merci à Cécilia, pour une collaboration plus qu’efficace autant pour stimuler des sujets que pour siroter un bon petit bloody, mais surtout un grand merci pour ta précieuse amitié qui ne cesse d’égayer mon quotidien.
Mes remerciements se dirigent désormais vers les personnes qui m’ont permis de maintenir un équilibre parfait entre le milieu de la science et le milieu du social.
Un grand merci bien entendu à mes deux acolytes Mic et Mabie. Ces 3200 kms de dodécagone ne sont pas encore assez longs pour décrire une si belle amitié remplie de souvenirs en tout genre! Ne lâchez pas, je suis la preuve qu’il est possible de graduer, même avec Laurent ;) Anne, un grand merci pour ton soutien, ton écoute et pour ta sagesse bien sûr! Nos belles années de collocation avec ta présence tant au travail que chez nous ont, sans aucun doute, contribué à ma réussite d’aujourd’hui.
Merci aussi à Clémentine pour tes précieux conseils et encouragements, ainsi que pour notre complicité privilégiée développée ces dernières années.
Merci aussi à Mika, Isa, Jean-Philippe, Coren, Céline, Ludo, Samouel, Élodie, Antoine, Renaud, Marion, Alice et bien d’autres d’avoir enivré ce doctorat de pauses café, de rigolades, de 5@7 sans fin, de nombreux partys, de karaokés bien sûr et de défis sportifs. Merci à tous pour cette belle entraide tout au long de mon parcours.
Je tiens aussi à remercier mes amies sherbrookoises Caro, Marie-France et Corinne, pour leur présence et leur sens de la fête inégalable ces 8 dernières années.
Pour terminer sur une note plus personnelle, je voudrais aussi remercier de tout cœur ma famille et plus particulièrement mes parents, ma sœur ainsi que mes grands-parents sans qui toutes ces années d’études n’auraient pas été possibles. Un grand merci pour leur soutien, leurs encouragements et leur affection inconditionnels depuis toujours. Merci de votre compréhension quant à mon choix d’aller vivre à 6000kms, et surtout merci de comprendre ma passion pour la science et les longues études ! Promis, cette fois-ci, c’est bel et bien fini ! Mon doctorat a été financé par les Fonds de Recherche du Québec – Santé, les Fonds de Réadaptation de la faculté de médecine de l’Université Laval, le Centre Thématique de Recherche en Neurosciences, le Centre Interdisciplinaire de Recherche en Réadaptation et Intégration Sociale, ainsi que par les Fonds de recherche et d'enseignement de la Faculté de médecine.
Avant-propos
Cette thèse regroupe les résultats des travaux de recherche effectués sous la supervision de M. Laurent Bouyer et de Mme Andréanne Blanchette. Six chapitres vous seront présentés, dont 4 sous la forme de manuscrits rédigés en anglais.
Nous commencerons cette thèse avec une introduction générale qui a permis de mener aux différentes études de ce projet avec une recension des écrits en lien avec les projets, qui se terminera par les objectifs et hypothèses de la thèse.
Le Chapitre 1 décrit la méthodologie générale qui a permis la réalisation des projets.
Les Chapitres 2, 3, 4 et 5 sont sous la forme d’articles scientifiques qui permettent de présenter les résultats.
Chapitre 2:
Titre: Corticospinal excitability changes during a visually-guided precision walking task in humans: potential for rehabilitation. Soumis dans la revue Neurorehabilitation and Neural Repair en septembre 2020.
Auteurs: C. Dambreville, C. Neige, C. Mercier, A.K. Blanchette et L.J. Bouyer
Contributions de l’étudiante: élaboration de la question et du protocole de recherche, préparation des documents éthiques, collecte et analyses des données, interprétation des résultats et rédaction de l’article comme 1ère auteure.
Aucune modification n’a été apporté au manuscrit original.
Chapitre 3:
Titre: Corticospinal excitability changes during a precision walking task after an incomplete spinal cord injury. Soumis dans la revue Journal of Neurophysiology en octobre 2020.
Auteurs: C. Dambreville, C. Mercier, A.K. Blanchette et L.J. Bouyer
Contributions de l’étudiante: élaboration de la question et du protocole de recherche, préparation des documents éthiques, collecte et analyses des données, interprétation des résultats et rédaction de l’article comme 1ère auteure.
Chapitre 4:
Titre: Ankle proprioception during gait in individuals with incomplete spinal cord injury. Publié dans la revue Physiological Reports en décembre 2019.
Auteurs: C. Dambreville, B. Pairot De Fontenay, A.K. Blanchette, JS Roy, C. Mercier, et L.J. Bouyer
Contributions de l’étudiante: élaboration de la question et du protocole de recherche, collecte et analyses des données, interprétation des résultats et rédaction de l’article comme 1ère auteure.
Aucune modification n’a été apporté au manuscrit original.
Chapitre 5:
Titre: Effects of a precision gait training on locomotor recovery and neuropathic pain after an incomplete spinal cord injury: A pilot study. Sera soumis dans Spinal Cord.
Auteurs: C. Dambreville, C. Mercier, L.J. Bouyer et A.K. Blanchette
Contributions de l’étudiante: élaboration de la question et du protocole de recherche, préparation des documents éthiques, collecte et analyses des données, interprétation des résultats et rédaction de l’article comme 1ère auteure.
Aucune modification n’a été apporté au manuscrit original.
Le Chapitre 6 consiste en la discussion générale des résultats obtenus, avec les forces et limites de la thèse, et se termine sur des perspectives fondamentales et cliniques.
Introduction
1. Introduction générale
Une lésion à la moelle épinière est une condition qui provoque l’interruption ou la diminution des signaux nerveux ascendants et descendants. Cela peut mener entre autre à des déficiences
sensorimotrices associées à une diminution du contrôle volontaire de la marche ainsi qu’une
diminution de la sensibilité, et peut mener à l’apparition de douleur (Dietz & Fouad, 2014). Ces conséquences peuvent avoir un impact important sur la qualité de vie des personnes atteintes (Shin et al., 2012). Étant donné que le retour de la marche représente une des priorités à la suite d’une lésion médullaire (LM) (Ditunno et al., 2008), les programmes de réadaptation se concentrent sur la récupération locomotrice qui est favorisée à l’aide d’entrainements
locomoteurs, mais les bénéfices qui en résultent demeurent limités (Morawietz & Moffat, 2013).
Cela devient d’autant plus vrai lorsque les individus se retrouvent dans des tâches ou environnements plus complexes (monter des escaliers ou marcher sur différentes surfaces par exemple), c’est à dire lorsque les interactions sensorimotrices sont davantage sollicitées (Musselman & Yang, 2007). Il a été proposé que les entrainements actuels en réadaptation, favorisant davantage le contrôle automatique de la marche (basés sur des répétitions de mouvements simples), ne seraient pas suffisants pour maximiser la neuroplasticité sous-jacente à la récupération sensorimotrice (Lam et al., 2015). De plus, la plupart du temps, la rééducation se concentre davantage sur la récupération des capacités à la marche comme la vitesse ou l’endurance, délaissant la fonction sensorimotrice et plus particulièrement l’aspect sensoriel qui pourtant, a un rôle clef dans la récupération locomotrice (Domingo et al., 2011). En effet, la fonction sensorimotrice implique différents aspects incluant les informations motrices, mais aussi sensorielles, ainsi que l’intégration sensorimotrice (Bertrand-Charette et al., 2020). Afin de caractériser la fonction sensorielle, l’évaluation de la proprioception est fréquemment utilisée par les cliniciens (Bertrand-Charette et al., 2020). En effet, la proprioception peut se définir comme étant un ensemble de sens impliquant le sens de la position et du mouvement, de la tension ou de la force, ou de l’effort et de l’équilibre (Proske & Gandevia, 2012). En revanche, les mesures de proprioception actuellement effectuées sont réalisées au repos ou lors de tâches passives, ce qui ne reflètent pas toujours la fonction réelle lors de tâches quotidiennes comme la marche, et de plus, ne permet pas de prendre en compte l’intégration sensorimotrice (Lin, 2005;
Bertrand-Charette et al., 2020). La caractérisation de l’intégration sensorimotrice lors de la marche permettrait de suivre de manière plus précise l’évolution de la fonction sensorimotrice dans le but d’optimiser le retour de la marche.
Actuellement, les entrainements locomoteurs utilisés sont effectués principalement pendant la période de réadaptation intensive, ce qui correspond aussi à la période lors de laquelle la douleur neuropathique (DN) se développe ou est déjà présente (Finnerup et al., 2009). La douleur est, plus souvent qu’autrement, traitée de façon pharmacologique et est considérée à part de l’aspect sensorimoteur. L’effet que peut avoir la douleur sur la récupération sensorimotrice et l’effet d’un entrainement locomoteur sur la douleur demeurent donc encore méconnus. En revanche, des études animales ont démontré une interaction entre ces deux aspects, et ont aussi montré qu’il existerait une forme de compétition entre les mécanismes de récupération sensorimotrice (plasticité adaptative) et les mécanismes de développement de la douleur (plasticité
maladaptative) (Ferguson et al., 2012a).
Considérant les effets limités des entrainements actuels et prenant en compte les liens étroits entre les aspects moteurs et sensoriels lors de la marche, ainsi que la relation potentielle entre les mécanismes sous-jacents à la douleur et à la récupération sensorimotrice, l’objectif général de cette thèse est donc de voir les effets d’un entrainement locomoteur sollicitant davantage le contrôle volontaire de la marche (voie corticospinale) sur la récupération locomotrice incluant l’aspect sensorimoteur, et sur la douleur neuropathique à la suite d’une lésion médullaire incomplète (LMi).
En premier lieu, la sollicitation de la voie corticospinale lors d’une tâche de précision pendant la marche sera mesurée chez des individus sains (Chapitre 2), puis chez des individus avec une LMi (Chapitre 3). Par la suite, une nouvelle méthode sera développée et adaptée pour des individus avec une LMi afin d’obtenir des mesures de proprioception à la cheville pendant la marche afin de mieux caractériser l’intégration sensorimotrice lors d’une tâche dynamique (Chapitre 4). Enfin, les effets d’un entrainement basé sur la tâche de précision sur le niveau de DN et sur la récupération locomotrice (capacité locomotrice, équilibre et proprioception à la marche) seront mesurés chez cette même population (Chapitre 6).
Pour introduire ces études, nous aborderons tout d’abord l’impact d’une LM au niveau anatomique, fonctionnel et clinique sur le contrôle de la marche et sur la douleur. Ensuite, afin de comprendre les mécanismes de récupération à la marche post-lésion, nous aborderons le contrôle neurophysiologique de la marche. Par la suite nous verrons la plasticité adaptative mise
en place afin de favoriser la récupération locomotrice post-lésion, et des moyens utilisés pour promouvoir cette plasticité. Nous aborderons brièvement le développement de la plasticité maladaptative menant à la DN post-lésion, puis nous terminerons par décrire les liens existants entre la douleur et la motricité.
2. Lésions médullaires
Une lésion à la moelle épinière représente une condition majeure ayant des conséquences négatives qui peuvent porter atteinte à la qualité de vie des personnes atteintes. Nous allons voir dans la prochaine section l’épidémiologie en lien avec les lésions médullaires. Nous nous intéresserons ensuite à l’anatomie de la moelle épinière et nous verrons les différents profils cliniques associés à la lésion. Nous verrons par la suite les différentes conséquences associées à une LM aux niveaux anatomique et fonctionnel, ainsi que leurs impacts sur la marche. Enfin nous terminerons par une autre conséquence importante qui peut survenir à la suite d’une LMi qui est l’apparition de douleur.
2.2 Statistiques
2.2.1 Étiologie
Une lésion à la moelle épinière résulte d’un dommage lié à une cause traumatique ou non traumatique. Au niveau traumatique, cela peut provenir d’un dommage physique externe, tel qu’une chute, un accident de la route, ou bien encore suite à des violences (Ackery et al., 2004). La lésion traumatique représente environ 51 % des cas de lésions médullaires (Noonan et al., 2012). Concernant les lésions non traumatiques, elles peuvent avoir différentes causes soit tumorale, dégénérative, vasculaire, inflammatoire ou infectieuse, et représentent 49% des cas (Kirshblum et al., 2002).
2.2.2 Incidence et prévalence
Au Canada, il a été rapporté qu’environ 85 000 personnes vivaient avec une lésion de la moelle épinière en 2010 (Noonan et al., 2012). Concernant l’incidence, elle est d’environ 3500 nouveaux cas par année. De façon générale, l’incidence est plus élevée chez les hommes (75%) que chez les femmes, et il est plus fréquent de subir une lésion entre 15 à 30 ans et après 70 pour les 2
sexes (Singh et al., 2014). Toutefois, considérant l’âge vieillissant de la population, les lésions traumatiques secondaires à une chute pourraient devenir un enjeu majeur en santé publique dans les prochaines années. En effet, il a été projeté que l’incidence de lésion médullaire pourrait atteindre 5800 nouveaux cas par année d’ici 2030 (Ahn et al., 2017).
2.3 Anatomie de la moelle épinière
La moelle épinière fait partie du système nerveux central (SNC) et reçoit les informations provenant de la périphérie et des centres supérieurs. Chez l’humain, elle a une longueur d’environ 43-45cm, et un diamètre d’environ 1-1,5 cm. Elle est divisée en 31 segments dont 8 cervicaux, 12 thoraciques, 5 lombaires, 5 sacraux et 1 coccygien. Chaque segment est composé de 2 nerfs spinaux, soit un sensitif et un moteur. Les informations sensorielles provenant de la périphérie entrent dans la moelle épinière via la racine dorsale pourvue d’un ganglion. Chaque ganglion reçoit les afférences d’une zone cutanée précise sur la surface du corps qu’on appelle dermatome (Nogradi A, 2013). Les informations motrices sortent de la moelle via la racine ventrale par les motoneurones inférieurs (ou alpha), qui étendent leur axone jusqu’à leur cible respective, soit les fibres musculaires (Sheerin, 2004). Les groupes musculaires innervés par une même racine spinale sont regroupés en myotomes. La moelle épinière est constituée de matière blanche située en périphérie et de matière grise située au centre. Dans la matière grise se trouvent les corps cellulaires neuronaux tandis que dans la matière blanche se trouvent les voies ascendantes et descendantes contenant les informations sensorielles et motrices.
Les voies descendantes, responsables de la commande motrice, sont catégorisées en système moteur latéral ou ventromédian. Au niveau latéral, on retrouve la voie corticospinale latérale et rubrospinale. Au niveau ventromédian, on retrouve la voie corticospinale antérieure, la voie vestibulospinale, réticulospinale et tectospinale (Nogradi A, 2013). Au niveau des voies ascendantes, on retrouve les voies antérolatérales, le système lemniscal médial et les voies spinocérébelleuses qui relaient les informations sensorielles vers les centres supérieurs. Les voies antérolatérales contiennent principalement la voie spinothalamique, et relaient l’information sur la pression, la température et la douleur. Le système lemniscal médial, qui comporte le fasciculus gracilis et le fasciculus cuneatus, est responsable du toucher léger, de la sensibilité tactile et de la
vibration. Enfin, les voies spinocérébelleuses relaient les informations concernant la proprioception (Nogradi A, 2013; Patestas et al., 2016; Al-Chalabi & Alsalman, 2020).
Figure 0.1. Anatomie de la moelle épinière (Crossman and Neary, Neuroanatomy, 1995). Les
différentes voies ascendantes transportant les informations sensorielles et les voies descendantes transportant les informations motrices sont représentées.
2.4 Conséquences de la lésion
À la suite d’une LM, une importante réorganisation anatomique, structurelle et fonctionnelle va avoir lieu au niveau spinal, cortical et au niveau de la voie corticospinale et ainsi mener à une altération des circuits neuronaux au niveau du SNC. Cette altération va mener à une diminution du contrôle volontaire descendant, ainsi qu’à une diminution de la transmission d’informations ascendantes (Barthelemy et al., 2010; Ozdemir & Perez, 2018). Cela va altérer les fonctions sensorielles et motrices et ainsi provoquer d’importantes limitations lors de la marche (Barthelemy et al., 2013; Ozdemir & Perez, 2018). Dans cette partie, nous nous intéresserons aux différents changements survenant post-lésion et à leurs conséquences sur la marche. Nous verrons donc l’évolution de la lésion au niveau cellulaire et les répercussions engendrées au niveau clinique.
2.4.1 Changements aux niveaux anatomiques et structurels
Au niveau anatomique, la lésion va provoquer au niveau spinal une importante réponse inflammatoire qui va entrainer une série de cascades moléculaires et cellulaires qui va survenir quelques minutes post-lésion et peut durer jusqu’à plusieurs années après (Silva et al., 2014). Cette réponse inflammatoire peut être divisée en trois phases distinctes (Filipp et al., 2019). La première phase, dite primaire, est due principalement au choc initial (lacération, contusion, compression) et arrive donc immédiatement après la lésion. Le choc va détruire de façon mécanique les cellules neuronales, les astrocytes et les oligodendrocytes situés au niveau de la lésion. Cela peut aussi atteindre les vaisseaux sanguins et ainsi provoquer des saignements (Darian-Smith, 2009). Quelques minutes post-lésion, la phase secondaire débute. Elle est caractérisée par l’autodestruction des cellules avec de l’apoptose, de la nécrose et de la dégénérescence Wallérienne (Beattie et al., 2000; Oudega & Perez, 2012). Il va donc y avoir une diminution des cellules neuronales et gliales ainsi qu’une diminution de myéline. Une atteinte au niveau vasculaire peut aussi à ce stade entrainer l’apparition d’œdème, d’ischémie, ou d’hypoxie (Darian-Smith, 2009). Cette seconde phase se caractérise aussi par la formation de la cicatrice gliale provenant de l’activation des astrocytes. Cette cicatrice aurait à première vue, un rôle protecteur afin de rétablir l’homéostasie du milieu et de limiter la propagation de la mort neuronale. En revanche, il a été montré qu’à long terme, cette barrière physico-chimique empêchait aussi la régénérescence ainsi que la repousse axonale (Leal-Filho, 2011; Filipp et al., 2019).
Lors de la troisième phase, appelée aussi phase chronique qui survient quelques semaines post-lésion, l’apoptose neuronale ainsi que la démyélinisation se poursuivent, menant à l’altération des circuits neuronaux à long terme (Silva et al., 2014). Il a été montré que cette restructuration anatomique caractérisée notamment par la perte cellulaire à long terme va mener à une atrophie de la moelle épinière définie par une diminution de son aire, ainsi qu’une diminution du volume de matière grise et blanche (Freund et al., 2011b; Freund et al., 2013). Une étude a d’ailleurs rapporté que ces changements structurels effectués au niveau spinal prédisaient le degré de réorganisation structurelle au niveau cortical (Freund et al., 2011b).
En effet, au niveau cortical, des changements anatomiques vont aussi apparaitre à la suite de la lésion. La plupart des évidences recensées proviennent d’études immunohistochimiques réalisées chez l’animal. Il a donc été montré qu’à la suite d’une lésion médullaire, il y avait une altération de l’activité neuronale, de l’efficacité synaptique et des atrocytes (Ding et al., 2005), ainsi qu’une
diminution de la longueur et du diamètre des dendrites au niveau du cortex moteur primaire (M1) (Bayona et al., 2005; Kim et al., 2006; Ghosh et al., 2010). Il a aussi été montré que le nombre de neurones au niveau de M1 et du cortex sensoriel primaire (S1) était aussi diminué (Hains et
al., 2003; Lee et al., 2004; Kim et al., 2006). Ces résultats ont été confirmés chez l’homme dans le
cadre d’études utilisant l’imagerie par résonance magnétique (IRM) où il a été montré qu’il y avait une diminution du volume de la matière blanche au niveau du pédoncule cérébelleux, ainsi qu’une diminution du volume de matière grise au niveau de M1 et S1 (Wrigley et al., 2009a; Freund et al., 2011b; Hou et al., 2014).
Au niveau de la voie corticospinale, il a été montré que celle-ci subissait aussi des changements anatomiques. En effet, des études réalisées post-mortem chez des individus avec une LMi ont montré la présence de dégénérescence Wallérienne (Becerra et al., 1995; Buss et al., 2004), qui a été confirmé avec des études en IRM (Terae et al., 1993; Quencer & Bunge, 1996). Il a aussi été montré qu’il y avait aussi une diminution du nombre et de la taille des neurones corticospinaux chez l’animal (Tetzlaff et al., 1994; Hains et al., 2003) et l’homme (Wrigley et al., 2009a).
En résumé, une lésion de la moelle épinière va entrainer des répercussions au niveau spinal, cortical et au niveau de la voie corticospinale. Elle va provoquer une atrophie générale de ces structures/voies, et va porter atteinte au niveau des aires motrices et sensorielles.
2.4.2 Classification des lésions médullaires
Dépendamment du niveau anatomique auquel le dommage survient, de son étendue, ainsi que des déficiences sensorimotrices associées, les lésions médullaires peuvent être caractérisées et classifiées en différentes catégories.
Tout d’abord, en fonction du niveau et de l’étendue du dommage, une lésion à la moelle épinière peut entrainer soit une tétraplégie ou paraplégie, qui peut être complète ou incomplète. La tétraplégie réfère à une atteinte au niveau cervical entrainant une diminution des fonctions sensorielles et/ou motrices au niveau des bras, du tronc, et des jambes. La paraplégie réfère à une atteinte au niveau thoracique, lombaire ou sacrée entrainant une diminution sensorielle et/ou motrice au niveau et des jambes et parfois du tronc. Une lésion complète correspond à une perte totale de sensibilité ou de motricité au niveau des segments sacraux S4-5.
Ensuite, afin de définir le niveau neurologique et d’évaluer le degré d’atteinte des fonctions motrices et sensorielles, et afin de prodiguer une mesure universelle autant pour les cliniciens que les chercheurs, des mesures standardisées sont utilisées. Parmi celles-ci, l’échelle de l’American Spinal Injury Association (ASIA) représente une mesure valide et fidèle des fonctions sensorielles et motrices (Annexe A) (Furlan et al., 2011; Roberts et al., 2017). Il s’agit d’une échelle avec plusieurs niveaux dont le A (lésion complète), le B, C et D (lésions incomplètes) et le E (fonction motrice et sensorielle normale). Pour déterminer le niveau, le degré de force musculaire des muscles en dessous du niveau neurologique de la lésion ainsi que la sensibilité au toucher léger et au toucher par piqûre au niveau des dermatomes sont mesurés (van Middendorp et al., 2011).
2.4.3 Changements au niveau fonctionnel
Nous avons précédemment que de nombreux changements anatomiques étaient provoqués à la suite d’une LMi. Nous allons voir à présent que ces changements peuvent être corrélés avec des changements observés au niveau fonctionnel à différents niveaux du SNC.
Tout d’abord, il a été montré que les circuits spinaux pouvaient être affectés à la suite d’une LM. Au niveau lésionnel, on retrouve le syndrome radiculaire caractérisé par de l’hypoesthésie, une anesthésie en bande, de la parésie et de l’aréflexie. Au niveau sous-lésionnel, on peut retrouver le syndrome pyramidal, une paraplégie ou tétraplégie, ainsi qu’une abolition des réflexes
ostéo-tendineux. En effet, une des premières conséquences de la lésion est l’apparition du choc spinal
caractérisé par l’absence soudaine de réflexes tendineux (hypo-réflexie) en dessous du niveau de lésion qui peut durer de plusieurs jours à plusieurs semaines dépendamment de l’importance de la lésion (Ko, 2018). Ce phénomène serait dû à une hyperpolarisation des neurones qui deviendraient moins excitables dû à une diminution des informations descendantes (Little et al., 1999). En parallèle, une diminution de l’excitabilité des motoneurones alpha a aussi été observée (Curt et al., 1997). Par la suite, un retour progressif de ces réflexes a lieu mais avec un patron d’activation altéré et souvent caractérisé par de l’hyper-réflexie (Ditunno et al., 2004). En effet, plusieurs études ont rapporté que l’excitabilité du réflexe d’étirement et du réflexe de Hoffmann (réflexe H) était augmentée à la suite d’une LMi (Nielsen et al., 1993; Hiersemenzel et al., 2000; Nakazawa et al., 2006; Shimba et al., 2010). De plus, lors de la marche, le patron de modulation
de ces réflexes semble aussi affecté (Yang et al., 1991; Stein et al., 1993; Phadke et al., 2010; Thompson et al., 2019). Ces changements au niveau des mécanismes spinaux à la suite d’une LMi peuvent avoir un impact important lors de la marche et mener à l’apparition de spasticité et/ou clonus (Adams & Hicks, 2005; Nielsen et al., 2007; Wallace et al., 2012), ou encore participer au maintien du pied tombant (Knutsson, 1981).
Au niveau cortical, les représentations des différentes aires sensorimotrices correspondant à des muscles particuliers peuvent être modifiées à la suite d’une LM. Les représentations des aires motrices des membres affectés sont généralement diminuées ou voir abolies (Levy et al., 1990; Freund et al., 2011a). Il a été montré à l’aide de l’IRM que suite à une LMi, lors d’une stimulation électrique du nerf tibial (situé en dessous du niveau de la lésion), aucune augmentation de l’activité corticale au niveau du S1 n’était présente contrairement à la même stimulation effectuée chez les sujets sains. Une autre étude a aussi mesuré l’évolution des représentations sensorimotrices au cours du temps à la suite d’une lésion complète. Les résultats indiquent que lors de la phase aiguë, aucune différence dans l’activation des zones sensorimotrices n’est observée lorsque les participants tentaient d’effectuer une dorsiflexion de la cheville comparée aux sujets sains. En revanche, lorsque cette même mesure a été refaite quelques mois plus tard, ils ont observé une diminution de l’activation de l’aire de la jambe au niveau du M1 et S1. Ces résultats montrent qu’une paralysie persistante au niveau des jambes peut modifier les représentations aux niveaux moteur et sensoriel (Jurkiewicz et al., 2010). Ces résultats ont aussi été confirmés par d’autres études (Turner et al., 2001; Cramer et al., 2005).
Dans le même ordre d’idée, l’étude de Curt et al. en 2002 a rapporté que chez des personnes présentant une tétraplégie, moins d’activation du S1 et M1 était observée lors de mouvements de la main en comparaison à des personnes présentant une paraplégie et des sujets sains. De plus, les résultats de cette étude indiquent aussi qu’une diminution de la force au niveau du poignet ainsi qu’une plus grande atteinte au niveau des membres supérieurs était associée à une diminution de l’activation au niveau du S1 et M1. Ils en ont conclu que la réorganisation des aires corticales était corrélée avec le degré d’atteinte au niveau des membres supérieurs chez des personnes ayant une tétraplégie (Curt et al., 2002b).
Au niveau corticospinal, de nombreuses études ont rapporté que la voie corticospinale était fonctionnellement endommagée et qu’il y avait une diminution du signal nerveux descendant
(Hansen et al., 2005; Barthelemy et al., 2010). En effet, des études utilisant la stimulation magnétique transcrânienne (TMS) ont montré que dans une cohorte d’individus ayant une LMi, il n’était pas possible d’induire de potentiels moteurs évoqués (MEPs) au niveau des muscles de la jambe pour plusieurs d’entre eux (Chang & Lien, 1991; Wirth et al., 2008). Il a aussi été rapporté que la vitesse de conduction était presque diminuée de moitié chez ces mêmes individus (32.1 m/s) comparés à des sujets contrôles (63.3 m/s). Dans un même ordre d’idée, la latence est aussi plus grande que celles des sujets contrôles avec une différence pouvant aller jusqu’à 9.4ms pour des MEPs évoqués au niveau du tibial antérieur (TA) (Smith et al., 2000; Wirth et al., 2008; Barthelemy et al., 2010), et jusqu’à 8.2ms pour des MEPs évoqués au niveau d’un muscle du pouce (Smith et al., 2000; Roy et al., 2011). Cette différence de latence pourrait s’expliquer par la perte de myéline axonale par ou la diminution des neurones myélinisés au niveau corticospinal (Oudega & Perez, 2012).
D’autres études en TMS ont indiqué que le niveau de stimulation nécessaire pour évoquer des MEPs, caractérisé par le seuil moteur, était augmenté au repos, ainsi que lors d’une contraction volontaire à la suite d’une LMi (Smith et al., 2000; Barthelemy et al., 2010; Freund et al., 2011a). À la suite d’une lésion complète, il semble aussi que le niveau de la lésion influence le seuil moteur qui est diminué pour des muscles situés au-dessus de la lésion et au contraire, augmenté pour les muscles situés en dessous de la lésion (Cariga et al., 2002; Ellaway et al., 2007). Cela pourrait être dû à une diminution de l’excitabilité des neurones corticaux, corticospinaux ou spinaux (Rosso & Lamy, 2018). Au niveau anatomique, l’augmentation du seuil moteur pourrait être due à une diminution des axones corticospinaux qui font synapse avec les motoneurones ce qui ferait moins de sites potentiels stimulables (Oudega & Perez, 2012).
Concernant la taille des MEPs, leur amplitude est réduite comparée à des sujets contrôles pour des MEPs évoqués au niveau du TA (Wirth et al., 2008; Barthelemy et al., 2010). Cela pourrait être causé par une désynchronisation de l’activité neuronale, une diminution de nombre d’unités motrices recrutés, ou encore par des changements au niveau de l’excitabilité spinale, corticale ou corticospinale (Bestmann & Krakauer, 2015). Une étude s’intéressant à la courbe de recrutement des MEPs évoqués au niveau d’un muscle de la main a aussi montré une différence dans le patron de recrutement au niveau corticospinal. En effet, les auteurs ont rapporté une diminution de la taille des MEPs en comparaison à des sujets sains, avec une différence plus importante en fonction d’une intensité de stimulation croissante. Cela suggère donc qu’à plus haute intensité, moins d’unités motrices seraient recrutées chez les patients ayant une LM (Davey et al., 1999).
Bien que la TMS soit un outil qui permette de fournir de nombreux résultats qui renseignent sur l’état de la voie corticospinale, la corrélation entre ces résultats et les déficits cliniques observés reste toutefois controversée. En effet, certaines études montrent que, malgré l’absence de MEPs chez certains sujets, il est toutefois possible pour eux d’activer volontairement les muscles sous-lésionnels (McKay et al., 1997; Oh et al., 2017). À l’inverse, il a aussi été rapporté que certains des MEPs pouvaient être enregistrés au niveau des muscles dont l’activité motrice volontaire était nulle (Gianutsos et al., 1987) .
Toutefois, il semble que la réduction de la transmission nerveuse puisse tout de même être corrélée avec les déficiences à la marche observées. En effet, dans l’étude de Barthélémy et al. 2010, l’amplitude et la latence des MEPs obtenus dans le TA au repos et lors d’une contraction volontaire sont corrélés avec le degré de pied tombant (relevé du pied mesuré à l’aide de l’amplitude articulaire de l’orteil par rapport au sol) chez des individus ayant une LMi. De plus, les participants qui n’avaient pas de MEPs au repos étaient ceux qui avaient la vitesse de marche la plus faible et un pied tombant plus important (Barthelemy et al., 2010). Une autre étude a aussi montré que les MEPs évoqués dans le TA étaient corrélés avec le niveau d’ASIA, et permettaient donc de prédire les déficits fonctionnels pour la capacité locomotrice (Curt et al., 1998).
Afin d’évaluer l’état du système nerveux au niveau sensoriel, des études se sont intéressées à mesurer les potentiels évoqués somatosensoriels (SSEPs). Cela permet de mesurer l’état des voies somatosensorielles de la périphérie jusqu’au cortex somatosensoriel. Plusieurs études ont montré l’absence de SSEPs lors d’une stimulation du nerf plantaire à la suite d’une LM complète au niveau cervical. Chez ces mêmes individus, on observe toutefois la présence de SSEPs lorsque le nerf médian est stimulé (Rowed et al., 1978; Kaplan & Rosen, 1981; Perot & Vera, 1982), montrant bien une atteinte sensorielle en dessous du niveau de la lésion. En ce qui concerne les LMi, ces mêmes études ont rapporté qu’il était possible d’obtenir des SSEPs pour le nerf médian et plantaire pour la quasi-totalité des sujets. En revanche, le patron de recrutement des SSEPs observé présentait des différences par rapport à celui des sujets sains (Rowed et al., 1978; Perot & Vera, 1982; Date et al., 1988). De plus, il semblerait que le patron de recrutement des SSEPs, qui peut être classé selon un grade de 1 à 4 (1 étant absence de SSEP et 4 patron normal), peut être corrélé avec le niveau d’ASIA (Cheliout-Heraut et al., 1998). Concernant la latence des SSEPs, aucune différence n’a été observée lors de la stimulation du nerf plantaire et médian comparés aux sujets sains (Kaplan & Rosen, 1981).
Étant donné que la stimulation du nerf plantaire ou médian reflète l’état de la voie somatosensorielle en entier, d’autres études se sont intéressées à mesurer les SSEPs pour chaque dermatome (dSSEPs) afin d’associer chaque segment à une atteinte sensorielle plus spécifique (Kramer et al., 2010). Ces études ont rapporté que les dSSEPs reflétaient davantage l’évaluation clinique sensorielle et permettaient de caractériser de façon plus précise le niveau sensoriel de la lésion après une lésion complète ou incomplète (Louis et al., 1985; Date et al., 1988).
D’autre part, les SSEPs ou dSSEPs ont aussi été utilisés afin de relier ces mesures fonctionnelles avec des mesures cliniques comme la capacité ambulatoire. En effet, il a été montré qu’une corrélation existait entre ces 2 variables à la suite d’une lésion incomplète ou complète, ainsi que pour les personnes en phase aiguë ou chronique (Kaplan & Rosen, 1981; Curt & Dietz, 1997; Kramer et al., 2010; van Middendorp et al., 2011). De plus, il semblerait que la mesure des SSEPs permette aussi de fournir un outil pronostic de la fonction locomotrice en phase aiguë post-LMi (Parneet Kaur & Narkeesh, 2015).
De nombreux changements fonctionnels, corrélés avec des changements anatomiques surviennent aux niveaux moteur et sensoriel à la suite d’une LMi. Nous allons voir, à présent, en quoi ces changements vont causer des déficiences et mener à des limitations lors de la marche.
2.4.4 Déficiences et limitations à la marche
Les changements observés au niveau fonctionnel montrent une diminution importante du contrôle descendant et ascendant à la suite d’une LMi. De ce fait, une atteinte à ces contrôles causée par la lésion peut mener à des déficiences importantes causant des limitations lors de la marche (Curt & Dietz, 1997; Curt et al., 1998).
Déficiences sensorimotrices observées
À la suite d’une LMi, de nombreuses déficiences sensorimotrices peuvent être observées. Il peut s’agir de faiblesse(s) musculaire(s), d’une diminution de la proprioception et de la sensibilité tactile, ou encore de l’apparition de spasticité (Nathan et al., 1986; Adams & Hicks, 2005; Biering-Sorensen et al., 2009).
Au niveau musculaire, il a été montré qu’il pouvait y avoir une atrophie des muscles en dessous du niveau de la lésion avec une densité et une aire musculaire environ 14% plus faible à la suite d’une LMi comparé à des sujets sains (Moore et al., 2015). De plus, d’autres études ont aussi fait
part d’une diminution de la force maximale, ainsi que de la conversion des fibres de types lentes en fibres rapides conduisant à une augmentation de la fatigabilité musculaire (Shields, 1995; Burnham et al., 1997; Gerrits et al., 1999). Cette faiblesse musculaire est causée par une diminution du contrôle descendant qui va diminuer le nombre d’unités motrices recrutées, ou par une diminution de l’activité des unités motrices (Thomas et al., 1997).
Une autre déficience importante pouvant survenir à la suite d’une LM est la spasticité. En effet, la spasticité peut se définir comme étant un symptôme apparaissant suite à une atteinte du motoneurone supérieur et caractérisé par une exagération du réflexe d’étirement résultant d’une hyperexcitabilité des réflexes spinaux (Decq, 2003). Elle implique souvent des symptômes tels que les spasmes, l’hyper-réflexie, le clonus, les co-contractions ou contractures (Pandyan et al., 2005). De plus, il a été montré qu’environ 65 à 78% des individus à la suite d’une LMi développaient de la spasticité (Maynard et al., 1990; Adams & Hicks, 2005).
Des déficits proprioceptifs peuvent aussi être présents à la suite d’une LMi. En effet, il a été rapporté que les individus avec une LMi avaient une moins bonne proprioception comparée à des sujets sains notamment au niveau de la hanche, du genou, et de la cheville (Chisholm et al., 2016; Dambreville et al., 2019). Au niveau cutané, des déficits au niveau du toucher léger, des piqûres, de la sensation de la température et de la vibration sont aussi observés (Krassioukov et
al., 1999; Hayes et al., 2002).
Certaines de ces déficiences peuvent avoir un impact négatif sur le contrôle du mouvement et plus particulièrement sur le contrôle de la marche. L’impact de la faiblesse musculaire sur la marche va principalement dépendre du ou des muscles affectés, de la compensation par d’autres muscles, ou encore de l’importance de la faiblesse. Un exemple très répertorié à la suite d’une LMi est une faiblesse au niveau des fléchisseurs dorsaux menant à l’apparition du pied tombant (Kim et al., 2004a, b; Jayaraman et al., 2006). Outre la faiblesse musculaire, il a aussi été montré que le patron d’activation musculaire lors de la marche était différent comparé aux sujets sains (Wang et al., 2013; Lee et al., 2020). Concernant la spasticité, celle-ci peut affecter la qualité du patron de marche à cause d’une amplitude de mouvement limitée par exemple (Krawetz & Nance, 1996; Nielsen et al., 2007). Enfin, les déficiences proprioceptives peuvent mener à une moins bonne intégration sensorimotrice ce qui peut affecter la commande motrice et ainsi, avoir un impact sur la qualité du patron locomoteur (Chisholm et al., 2019).
Limitations à la marche
Les nombreuses déficiences sensorimotrices observées peuvent affecter la qualité du patron locomoteur et ainsi causer d’importantes limitations lors de la marche. En effet, il a été montré qu’au niveau des paramètres spatio-temporels, la durée de la phase de double support était augmentée, la cadence diminuée, et que la variabilité était plus grande au niveau de la largeur et de la longueur de pas, et aussi au niveau du positionnement du pied par rapport au centre de masse (Krawetz & Nance, 1996; Day et al., 2012). Au niveau de la cinématique, il a été rapporté que la coordination des segments intra-membre était affectée, et que l’amplitude du mouvement au niveau du genou et de la cheville était plus limitée mais que l’abduction de la hanche était au contraire augmentée (Krawetz & Nance, 1996; Gil-Agudo et al., 2011; Awai & Curt, 2014). Une des limitations à la marche les plus fréquentes à la suite d’une LMi est la diminution de la vitesse de marche (Krawetz & Nance, 1996; Barbeau et al., 1999). En effet, il a été montré que celle-ci était en moyenne réduite de 52% par rapport aux sujets sains lorsque les individus quittaient le centre de réadaptation (Waters et al., 1993). Toutefois, comme mentionné précédemment, les profils cliniques varient considérablement d’une personne à une autre, ce qui fait que la vitesse de marche varie aussi selon la lésion. Les résultats d’une étude ont indiqué que la vitesse pouvait varier de 0.34 ± 0.10 m/s pour des individus ayant besoin de surveillance à la marche à 1.46 ± 0.04 m/s pour des individus se déplaçant sans accessoire de marche (van Hedel & Group, 2009).
Une autre limitation importante observée à la suite d’une LMi est la diminution de l’endurance à la marche. Bien qu’il existe une certaine variabilité entre les individus, la distance totale parcourue, lors d’un test chronométré, est généralement inférieure chez les personnes ayant une LMi, comparativement à celles des sujets sains (Teixeira da Cunha-Filho et al., 2003).
Il est aussi important de mentionner que les déficiences mentionnées ci-haut peuvent aussi avoir un impact sur la posture et l’équilibre, qu’il soit statique ou dynamique (Wirz & van Hedel, 2018). En effet, tout comme la marche, l’équilibre résulte de l’intégration et du traitement des informations provenant des systèmes somatosensoriels, visuels et vestibulaires afin d’effectuer la commande motrice appropriée (Peterka, 2002; Horak, 2006). Il a été montré qu’une atteinte au niveau des voies ascendantes et descendantes suite à une LMi était la principale cause de troubles de l’équilibre chez ces personnes (Yoshikawa et al., 2008), et que l’enjeu était davantage important lors de tâches comme la marche (Leroux et al., 2006). Toutefois, il a été rapporté que, pendant la marche, l’équilibre pouvait tout de même être maintenu chez des individus avec une