Caractérisation des mécanismes de remodelage du
microenvironnement hépatique par le mélanome uvéal
Mémoire
Ioana Fugaru
Maîtrise en biologie cellulaire et moléculaire - avec mémoire
Maître ès sciences (M. Sc.)
Caractérisation des mécanismes de remodelage du
microenvironnement hépatique par le mélanome uvéal
Mémoire
Ioana Fugaru
Sous la direction de :
Résumé
Le mélanome uvéal (MU) est la tumeur primaire intraoculaire la plus fréquente chez l’adulte. Divers traitements sont offerts afin d’obtenir un contrôle local de la tumeur. Malgré les interventions locales, 34% des patients développent des métastases fatales au foie moins de dix ans après le diagnostic initial. Les cellules stellaires hépatiques (CSH) sont des cellules quiescentes du foie, qui, une fois activées, se dédifférencient en myofibroblastes et produisent de la matrice extracellulaire (MEC). Les CSH sont des acteurs majeurs de la fibrose et ont été étudiées pour leur participation dans la pathogenèse des cancers primaires hépatiques et des cancers gastro-intestinaux métastatiques. Nous avons donc étudié les interactions entre les CSH et les cellules cancéreuses du mélanome uvéal (CCMU) en réalisant des co-cultures en insert dans le but de mieux comprendre le phénomène de tropisme hépatique. Le profil d’expression des co-cultures CSH/CCMU a ensuite été comparé à celui des monocultures par profilage génique sur biopuces à ADN. Nous avons recensé de multiples gènes dont la transcription était dérégulée pour des acteurs de l’angiogenèse, de la MEC, de la prolifération et de la défense cellulaire. Nous nous sommes également intéressés à la sécrétion de 105 cytokines en réalisant des analyses protéomiques. Nous avons ensuite déterminé que la capacité de migration des CSH en présence de CCMU était plus efficace que celle des CSH en monoculture. Enfin, nous avons réalisé le premier modèle 3D de stroma du foie reconstruit avec des CSH grâce à la technique d’auto-assemblage du Centre LOEX. Nous avons observé une désorganisation matricielle importante lorsque les stromas ont été ensemencés avec des CCMU. Mes travaux représentent une avancée des connaissances sur le mélanome uvéal métastatique et son tropisme hépatique. Mon mémoire pourra guider d’autres projets visant à élucider les interactions entre les CCMU et les cellules du foie afin d’identifier une cible thérapeutique potentielle pour ralentir la croissance des métastases.
Abstract
Uveal melanoma (UM) is the most common primary intraocular tumor in adults. Different treatments are offered in order to control the tumor locally. Despite local interventions, 34% of patients develop fatal metastases to the liver less than ten years after the initial diagnosis. Hepatic stellate cells (HSC) are quiescent cells of the liver, which, once activated, dedifferenciate into myofibroblasts and produce an extracellular matrix (ECM). HSCs are major players in fibrosis and have been studied for their role in the pathogenesis of primary liver cancers and metastatic gastrointestinal cancers. We thus studied the interactions between HSCs and uveal melanoma cells (UMCs) by realizing their co-culture in insert in order to better understand the hepatic tropism phenomenon. The gene expression profile of HSC/UMC co-cultures was then compared to that of monoco-cultures using DNA microarrays. Several genes that participate in the ECM synthesis, proliferation and host defense were found to be deregulated between these conditions. We also focused on the secretion of 105 cytokines by performing cytokine arrays. We then determined that the migration capacity of HSCs in the presence of UMCs was more efficient than that of HSCs grown in monoculture. Moreover, we produced the first 3D model of liver stroma with HSCs using the self-assembly method of the Centre LOEX. We observed an important disorganization of the ECM when stromas were seeded with UMCs. My work represents an advanced of knowledge on metastatic UM and its liver tropism. My master’s thesis can guide other projects to elucidate interactions between UMCs and hepatic cells in order to identify a potential therapeutic target on which we may act upon to slow down the growth of metastases.
Table des matières
Résumé ... III
Abstract ... IV
Table des matières ... V
Liste des tableaux ... VII
Liste des figures ... IX
Liste des abréviations et des sigles ... X
Remerciements ... XIV
Avant-propos ... XVI
Chapitre 1 : Introduction ... 1
1.1 Mise en contexte ... 1
1.2 Le globe oculaire ... 2
1.2.1 Anatomie de l’œil humain ... 2
1.2.2 L’uvée : structure et fonction ... 4
1.3. Le mélanome uvéal ... 7
1.3.1 Prévalence et épidémiologie ... 7
1.3.2 Présentation et diagnostic ... 10
1.3.3 Facteurs pronostiques ... 12
1.3.4 Le mélanome uvéal : traitement local et évolution métastatique ... 18
1.3.5 Évolution métastatique et thérapies actuelles ... 19
1.3.6 Perspectives de traitement du mélanome uvéal métastatique ... 20
1.4. Le foie: un organe vital ... 24
1.4.1 Foie : anatomie et organisation cellulaire ... 25
1.5. Pathophysiologie du développement des métastases hépatiques ... 32
1.5.1 Des premières théories à la compréhension actuelle des métastases ... 33
1.5.2 Le microenvironnement ... 37
1.5.3 Les cellules stellaires hépatiques : de la fibrose au cancer ... 40
1.6. Enjeux et hypothèse ... 43
Chapitre 2 : Article ... 45
Pro-invasive role of activated hepatic stellate cells in experimental uveal melanoma metastasis ... 45
Chapitre 3 : Discussion et conclusion ... 82
3.1 Discussion ... 82
3.1.1 Concordance des analyses transcriptomiques par rapport aux analyses protéiques ... 82
3.1.2 Dérégulations des protéines et cytokines impliquées dans des processus facilitant la prolifération des lésions métastatiques du MU ... 86
3.1.2 Impact des types cellulaires utilisés sur les données extraites ... 89
3.1.5 Modèle de matrice extracellulaire reconstruite par des CSH ... 90
3.2 Perspectives ... 91
3.3 Conclusion générale ... 94
Liste des tableaux
Tableau 1.1. Le pourcentage de naevi choroïdiens qui évoluent en mélanomes avec ou sans présence de
facteurs de risque.
Tableau 1.2. Analyses des anomalies chromosomiques dans 35 cas de mélanome uvéal.
Tableau 1.3. Les gènes discriminants recherchés par le test pronostique DecisionDx-UM élaboré par Harbour
et Chen en 2013.
Tableau 1.4. Études cliniques de phase II complétées ou en cours sur les thérapies moléculaires ciblées du
MU métastatique
Tableau 1.5. Études cliniques avec des agents d’immunothérapie dans le MU métastatique. Table 2.1. Summary of clinicopathological features, and survival data of UM patients.
Table 2.2. Top upregulated transcripts associated to angiogenesis (> twofold change) identified in the
H79i/HSC1 or HSC1/H79i co-culture compared to the HSC1 or H79 monoculture.
Table 2.3. Top upregulated transcripts associated to angiogenesis (> twofold change) identified in the
HSC2i/H79 or H79i/HSC2i co-culture compared to the HSC2 or H79 monoculture.
Table 2.4. Top upregulated transcripts associated to extracellular matrix (> twofold change) identified in the
H79i/HSC1 or HSC1/H79i co-culture compared to the HSC1 or H79 monoculture.
Table 2.5. Top upregulated transcripts associated to extracellular matrix (> twofold change) identified in the
H79i/HSC2 or HSC2/H79i co-culture compared to the HSC2 or H79 monoculture.
Supplementary Table 2.1. Top deregulated cytokine transcripts (> twofold change) identified in H79 cells
co-cultured with HSC1 cells.
Supplementary Table 2.2. Top deregulated cytokine transcripts (> twofold change) identified in H79 cells
co-cultured with HSC2 cells.
Tableau 3.1. Les cytokines exprimées dans le protéome plus de 2 fois lors de la comparaison de la co-culture
H79i/CSH1 par rapport à la monoculture CSH1 et les valeurs correspondantes au niveau génique.
Tableau 3.2. Les cytokines exprimées dans le profilage génique plus de 2 fois lors de la comparaison de la
co-culture H79i/CSH1 par rapport à la monoculture CSH1 et les valeurs correspondantes au niveau protéique.
Tableau 3.3. Les cytokines exprimées dans le protéome plus de 2 fois lors de la comparaison de la co-culture
CSH1i/H79 par rapport à la monoculture H79 et les valeurs correspondantes au niveau génique.
Tableau 3.4. Les cytokines exprimées dans le profilage génique plus de 2 fois lors de la comparaison de la
co-culture CSH1i/H79 par rapport à la monoculture H79 et les valeurs correspondantes au niveau protéique.
Tableau 3.5. Les cytokines exprimées dans le protéome plus de 2 fois lors de la comparaison de la co-culture
Tableau 3.6. Les cytokines exprimées dans le profilage génique plus de 2 fois lors de la comparaison de la
co-culture H79i/CSH2 par rapport à la monoculture CSH2 et les valeurs correspondantes au niveau protéique.
Tableau 3.7. Les cytokines exprimées dans le protéome moins de 2 fois lors de la comparaison de la
co-culture H79i/CSH1 par rapport à la monoco-culture CSH1 et les valeurs correspondantes au niveau génique.
Tableau 3.8. Les cytokines exprimées dans le profilage génique moins de 2 fois lors de la comparaison de la
Liste des figures
Figure 1.1. Représentation schématique de l’uvée. Figure 1.2. Histologie de la choroïde.
Figure 1.3. Aspect macroscopique du mélanome uvéal.
Figure 1.4. Les fonctions cellulaires principales des protéines les plus fréquemment mutées dans le
mélanome uvéal.
Figure 1.5. La classification du mélanome uvéal selon les évènements moléculaires clés, ainsi que les cibles
potentielles de traitement.
Figure 1.6. La microcirculation et l’histologie hépatique. Figure 1.7. Rôles des CSHq dans le foie normal.
Figure 1.8. Interactions des cellules cancéreuses avec les cellules hépatiques dans la colonisation du foie par
des cellules métastatiques.
Figure 1.9. Le processus de développement de métastases.
Figure 1.10. Modèle schématique de la matrice extracellulaire (MEC) physiologique et pathologique. Supplementary Figure 2.1. Layout of co-culture conditions.
Figure 2.1. Characteristics of HSC cell lines.
Figure 2.2. Gene expression profiling of HSCs co-cultured with UMCs. Figure 2.3. Gene expression profiling of UMCs co-cultured with HSCs.
Figure 2.4. Transcript and protein expression of cytokines in H79 cells and HSCs in co-culture or monoculture
conditions.
Figure 2.5. Cell migration of HSCs and UMCs in co-culture vs monoculture conditions.
Supplementary Figure 2.2. Production of 3D tissue-engineered bilayer stromas with HSCs using the
self-assembly approach.
Figure 2.6. Histological colorations of the 3D hepatic stroma. Figure 2.7. Immunofluorescence staining of the 3D hepatic stroma.
Liste des abréviations et des sigles
α-SMA: Alpha smooth muscle actin ACT: Transfert adoptif de lymphocytes ADN: Acide désoxyribonucléique ADNmt: ADN mitochondrial ADNsb: ADN simple brin ARN: Acide ribonucléique ARNc: ARN complémentaire
ARNm: Acide ribonucléique messager ASXL : Additional sex combs like ATP: Adénosine triphosphate BAP1: BRCA1 associated protein 1 BRAF: B-Raf (proto-oncogène) BRCA1: Breast cancer 1
CCC5/C5a: Complement component C5/C5a CCI: Cholangiocarcinome intrahépatique CCL: C-C motif chemokine ligand (7, 20, 21) CCMU: Cellule(s) cancéreuse(s) du mélanome uvéal CD14: Cluster of differenciation 14
CD14: Cluster of differenciation 31
CD40 Ligand: Cluster of differenciation 40 ligand CDH1: Cadherin 1
CFD: Complement factor D CK: Cellule de Kupffer
CHC: Carcinome hépatocellulaire CHI3L1: Chitinase 3-like 1 CO2: Dioxyde de carbone
COL1: Collagène type 1 COL3: Collagène type 3 COL4: Collagène type 4
COMS: Collaborative Ocular Melanoma Study CRP: Protéine C-réactive
CSH: Cellule (s) stellaire(s) hépatique(s)
CSHa: Cellule (s) stellaire(s) hépatique(s) activée(s) CSHq: Cellule (s) stellaire(s) hépatique(s) quiescente(s) CTLA-4 : Cytotoxic T-lymphocyte antigen 4
CUO: Centre Universitaire d’Ophtalmologie CYP2E1: Cytochrome P450 2E1
CYP450: Cytochrome P450
ECM1: Extracellular matrix protein 1
EIF1AX: Eukaryotic translation factor 1A, X-linked EIF1B: Eukaryotic translation initiation factor 1B ELISA : Enzyme-linked immunosorbent assay EMMPRIN: Basigin
ENA-78: C-X-C motif chemokine 5 EPR: Épithélium pigmentaire rétinien ERK: voir MAPK
FGF: Fibroblast growth factor
Flt-3 Ligand: Fms-related tyrosine kinase 3 ligand
FXR1: Fragile X mental retardation syndrome-related protein 1 GDF-15: Growth differenciation factor 15
GFAP: Glial Fibrillary Acidic Protein
GM-CSF: Granulocyte-macrophage colony stimulating factor GNA11: Guanine nucleotide-binding protein subunit alpha 11 GNAQ: Guanine nucleotide-binding protein subunit alpha q GRO- α: C-X-C motif chemokine ligand 1
GTP: Guanosine-5'-triphosphate H2A : Histone 2A
HCF-1 : Host cell factor C1 HGF: Hepatocyte growth factor HIFs: Hypoxia-inducible factors
HTR2B: 5-hydroxytryptamine receptor 2B IC: Intervalle de confiance
ICAM-1: Intercellular adhesion molecule 1 ID2: Inhibitor of DNA binding 2
IL: Interleukine (-1α/β, 2, 3, 4, …) ILGF : Insulin-like growth factor
IP-10: Interferon gamma-induced protein 10 iPSC : Induced pluripotent stem cells LIF: Leukemia inhibitory factor
LOEX : Laboratoire d’organogénèse expérimentale LOX: Lysyl oxidase
LOXLs: Lysyl oxidase-like
LMCD1: LIM and cysteine rich domains LT14H: Leukotriene A4 hydrolase MAPK: Mitogen-activated protein kinase MART1: Antigène pour MLANA
MB: Membrane basale
MCP1: Monocyte chemoattractant protein 1 MDSC : Myeloid-derived suppressor cell MEC: Matrice extracellulaire
MHC: Major histocompatibility complex MIG: Monokine induced by gamma interferon
MIP-1α/β: Macrophage inflammatory protein 1 alpha/beta MIP-3β: Macrophage inflammatory protein 3 beta MMP: Matrix metalloproteinase
MRPS21: Mitochondrial ribosomal protein S21 MTUS1: Microtubule associated scaffold protein 1 MU: Mélanome uvéal
NCAM: Neural cell adhesion molecule NGF: Nerve growth factor
NO: Nitric oxide O2: Oxygène
OASL: Oligoadenylate synthetase-like OR : Odds ratio
PCR: Polymerase chain reaction
PD-1 : Programmed cell death-1 checkpoint PD-L1 : Programmed cell death ligand 1 PDGF: Platelet-derived growth factor
RAB31: Rab-GTPase 31
RAC1: Ras-related C3 botulinum toxin substrate 1
RANTES: Regulated on activation, normal T cell expressed and secreted RBM23: RNA binding motif protein 23
ROBO1: Roundabout guidance receptor 1 ROS: Reactive oxygen species
RT-PCR : Reverse transcription polymerase chain reaction SAP130: Sin3A associated protein 130
SATB1: Special AT-rich binding protein 1 SEM: Standard error of the mean SF3B1: Splicing factor 3b subunit 1 SHBG: Sex hormone-binding globulin
SH3GL1: Src homology 3 (SH3)-domain GRB2-like protein 1 : STAT3: Signal transducer and activator of transcription 3
TDGF1:Teratocarcinoma-derived growth factor 1 (aussi connu sous le nom Cripto-1) TGF-𝛼 : Transforming growth factor alpha
TGF-𝛽1, 2, 3: Transforming growth factor beta, isoforms 1, 2 and 3 TIMP: Tissue inhibitor of metalloproteinase
TIO: Tension intraoculaire TNC: Ténascine C
TNF-α: Tumor necrosis factor alpha uPAR: Urokinase receptor
Remerciements
Je tiens à remercier chaleureusement tous ceux qui, de près ou de loin, m’ont encouragé dans cette aventure académique qu’a été mon projet de maîtrise.
Tout d’abord, je remercie ma directrice de recherche, Pre Solange Landreville, qui m’a accueillie dans son laboratoire pour un premier stage de recherche alors que je n’avais que ma motivation comme seul bagage en sciences fondamentales. Merci pour la confiance que tu m’as accordée, pour tes conseils, ton dévouement, ta patience et ta générosité. J’ai été extrêmement choyée de bénéficier de tes connaissances et de ton encadrement au cours des deux dernières années. Je sors de ce projet de maîtrise avec une toute nouvelle passion et compréhension de l’importance de la recherche fondamentale grâce à toi.
Ensuite, je remercie toute l’équipe Landreville : Cindy Weidmann, Jade Pomerleau, Julie Bérubé, Émilie Bergeron, Dr Léo Piquet et Peter Gerges. Sans vos conseils, votre aide et votre expertise, ce projet n’aurait pas été le même. Votre motivation et votre acharnement ont été une grande source d’inspiration pour moi.
Je voudrais remercier les Prs Stéphanie Proulx et Sylvain Guérin qui ont été disponibles et ont collaboré au succès de ce projet par leur grande disponibilité et le partage de leur expertise et esprit analytique. Je remercie également la Dre Karine Zaniolo pour son expertise dans la réalisation des biopuces à ADN qui sont présentées dans ce mémoire.
Je remercie également tous les étudiants du CUO-Recherche avec qui j’ai partagé de nombreux fous rires. Votre accueil, générosité et surtout votre passion pour votre domaine de recherche resteront à jamais marqués en moi. Un merci spécial à Mathieu Thériault pour les multiples dépannages, allant des pneus dégonflés au sauvetage de lames, et pour sa constante disponibilité. Je remercie Gaëtan Le-Bel, qui a toujours su trouver les bons mots même dans les périodes plus difficiles et qui m’a offert son support inconditionnel. Également merci à Camille Couture, Pascale Desjardins, Kim Santerre, Noémie Parent, Marie Dorr, Marie-Catherine Drigeard Desgarnier; vous avez ensoleillé le deuxième sous-sol comme vous seules savez si bien le faire. Merci à Dr Jean-Michel Bourget qui a été un vrai coach scientifique et qui m’a toujours poussée à donner le meilleur de moi-même dans ce projet.
De plus, je tiens aussi à remercier les organismes qui m’ont permis de travailler sur ce projet: les infrastructures communes mélanome uvéal et tissus oculaires soutenues financièrement par le Réseau de
recherche en santé de la vision, le programme des bourses de leadership et développement durable de l’Université Laval, la bourse de leadership en anatomopathologie de la Faculté de médecine ainsi que le programme de bourse de congrès ThéCell qui m’a permis de présenter mes travaux à l’ARVO 2017. Je suis très reconnaissante envers nos collaborateurs de la clinique des tumeurs oculaires et du Service de pathologie de l’HSS: les Drs Dan Bergeron, Alain Rousseau, Daniel Ovid Black et Yvonne Molgat (ophtalmologistes), le Dr Mohib W. Morcos (pathologiste oculaire) et Mme Michèle Orain (professionnelle de recherche en oncopathologie), ainsi que Mme Marcelle Giasson (coordonnatrice du CUO-Recherche clinique) et les infirmières de recherche Marthe Mercier, Sylvie Boulianne, Sylvie Marcoux et Jocelyne Boivin; ils ont été des ressources précieuses pour les biopsies tumorales et le suivi clinique des patients atteints de mélanome uvéal.
Je remercie également le personnel de la Faculté de médecine de l’Université Laval pour leur compréhension et leur aide dans la réalisation de mon parcours M.D.-M.Sc. Le dévouement des chercheurs-professeurs que j’ai été amenée à côtoyer pendant les cours et les conférences a été très inspirant.
Finalement, j’adresse la plus profonde des gratitudes à ma dévouée grand-maman (Buni), qui a toujours été la première à m’encourager à entreprendre mes projets. Je sais qu’elle aurait partagé ma joie et mon excitation de voir ce projet mené à terme.
Avant-propos
Les travaux de recherche réalisés dans le cadre de ma maîtrise sont présentés dans ce mémoire divisé en 3 chapitres.
Le Chapitre 1 est une introduction sur l’uvée, l’avancée des connaissances sur le mélanome uvéal et son traitement et le microenvironnement des métastases hépatiques dont les cellules stellaires hépatiques (CSH).
Un manuscrit en préparation intitulé « Pro-invasive role of activated hepatic stellate cells in experimental uveal melanoma metastasis » (Chapitre 2), dont les auteurs sont moi-même ainsi que Mme Julie Bérubé, Pre Stéphanie Proulx et Pre Solange Landreville, sera soumis au journal Clinical & Experimental Metastasis. Je suis l’auteure principale de ce manuscrit et ma contribution est majeure puisque j’ai effectué toutes les manipulations ayant mené aux résultats qui y sont présentés. J’ai effectué la culture cellulaire, les co-cultures, les extractions d’ARN, les essais de migration, les immunofluorescences, les analyses protéomiques ainsi que l’optimisation de la méthode d’auto-assemblage du Centre LOEX avec les CSH dans le contexte du mélanome uvéal (avec le support de la professionnelle de recherche Julie Bérubé et la Pre Stéphanie Proulx). Les échantillons d’ARN que j’ai produits ont été analysés par profilage génique par la Dre Karine Zaniolo de la Plateforme de génétique moléculaire du CUO-Recherche. J’ai entièrement rédigé le manuscrit, qui a ensuite été révisé par la Pre Solange Landreville. Ce projet de maîtrise constitue une première étape dans les travaux de recherche du Laboratoire Landreville portant sur les interactions entre les CSH et les cellules cancéreuses du mélanome uvéal, ainsi qu’une première ébauche d’un modèle 3D du mélanome uvéal métastatique. Ces travaux sont notamment poursuivis par le Dr Léo Piquet, stagiaire postdoctoral, qui étudie les interactions entre les CSH et les cellules cancéreuses du mélanome uvéal dans un modèle murin de xénogreffes.
Le Chapitre 3 renferme une discussion générale ainsi que les conclusions et perspectives sur mes travaux de maîtrise.
Enfin j’ai également collaboré à un projet de résident durant ma maîtrise dont les résultats ne sont pas mentionnés dans ce mémoire. Ainsi, je suis co-auteure d’un manuscrit soumis au Radiotherapy and
Oncology.1
1 François Pépin, Anne-Sophie Julien, Ioana Fugaru, Nadia Lihimdi, Juliette Thariat, Solange Landreville,
Frédéric Mouriaux. Regression rate of choroidal melanoma following iodine-125 brachytherapy is not associated with metastatic spread. Radiotherapy and Oncology. Soumis.
Chapitre 1 : Introduction
1.1 Mise en contexte
Le cancer, soit un ensemble de différents types de tumeurs malignes, représente un enjeu majeur de santé mondiale. Cette maladie est causée par la croissance de cellules anormales et indifférentes aux mécanismes de régulation de l’organisme. Les cellules cancéreuses surviennent dans presque n’importe quel tissu et interfèrent avec ses fonctions. Tous les cancers ont la capacité de se disséminer à des sites secondaires (métastases), toutefois, ce ne sont pas tous les patients qui développeront des métastases. De plus, certains types de cancers montrent un tropisme pour un organe secondaire particulier. Les nombreux mécanismes derrière l’apparition des cellules cancéreuses varient d’un type de cancer à l’autre et n’ont donc pas été entièrement élucidés. En 2015, le cancer était la deuxième cause de mortalité après les maladies cardiovasculaires, avec 8.8 million de décès globalement (Organisation mondiale de la santé, 2015) Lorsque les cellules cancéreuses envahissent d’autres organes, leur éradication complète par les traitements médicaux et chirurgicaux actuels devient difficile. L’effort scientifique envers la compréhension des mécanismes menant à la formation des métastases est essentiel au développement de thérapies efficaces et spécifiques aux différentes tumeurs et à leurs sites de métastases.
Le mélanome uvéal est un de ces cancers qui démontrent un tropisme particulier pour un organe vital, le foie. Ce cancer représente environ 5% de tous les diagnostics de mélanome en Amérique du Nord, avec une incidence de 5 cas par million chaque année (Singh et al., 2011). Les facteurs de risque, les changements moléculaires, le traitement de première intention ainsi que la progression métastatique sont entièrement différents du mélanome cutané, bien plus connu et fréquent que le mélanome uvéal (Materin et al., 2011; McLaughlin et al., 2005). Les métastases hépatiques font du mélanome uvéal un des cancers les plus agressifs et à ce stade, les options thérapeutiques sont extrêmement limitées. Les travaux présentés dans ce mémoire représentent une contribution à l’avancement de nos connaissances dans le domaine du mélanome uvéal métastatique dans l’espoir d’en améliorer le pronostic et le traitement.
1.2 Le globe oculaire
1.2.1 Anatomie de l’œil humain
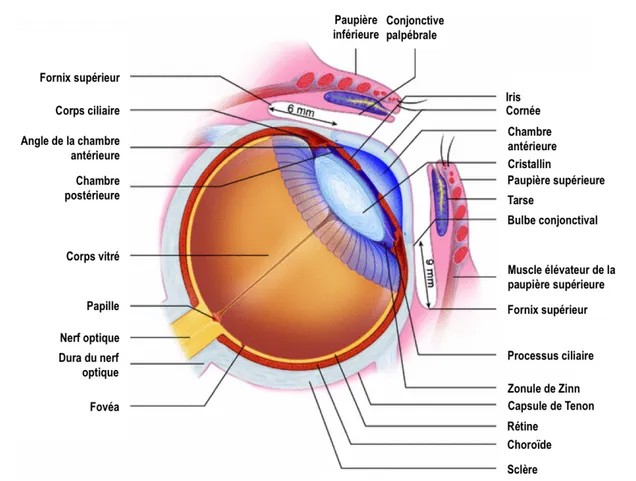
L’œil est un organe qui, de par sa complexité et sa fonction unique, suscite un intérêt particulier. Le globe oculaire est logé dans l’orbite. Il possède un diamètre antéropostérieur variant entre 22 et 27 mm et une circonférence de 69 à 85 mm (Grant-Kels & Kels, 1992). L’œil est divisé en trois chambres, soit les chambres antérieure, postérieure et vitrée, et est composé de trois membranes principales (Collège des ophtalmologistes universitaires de France, 2010).
La chambre antérieure délimite le contenu entre l’iris et la cornée et est remplie par l’humeur aqueuse. Cette dernière, produite par les procès ciliaires, est un liquide clair, pauvre en protéines, qui nourrit la cornée et l’iris. Ce liquide circule à travers la pupille et est normalement réabsorbé à travers le canal de Schlemm. L’obstruction de ce dernier produit une augmentation de la tension intraoculaire pouvant entraîner une crise de glaucome (Barrett & Ganong, 2012). La chambre postérieure est un petit espace entre la partie antérieure des zonules de Zinn et l’iris. La cavité vitréenne représente un grand espace derrière le cristallin et allant jusqu’à la rétine; elle est remplie par environ 4 mL d’humeur vitrée, un liquide gélatineux. Les rayons lumineux traversent les milieux transparents de l’œil (cornée, chambre antérieure, cristallin, vitré) avant d’être transformés en signaux électriques par la rétine et d’être transmis via les fibres du nerf optique et des voies optiques au cortex occipital, qui renferme le centre de la vision (i.e. cortex visuel).
Les tuniques de l’œil lui permettent de s’adapter et de produire les influx nerveux qui seront interprétés par le cortex visuel. La membrane externe de l’œil est constituée de la sclère, une coque fibreuse assurant le support et la forme de l’œil, ainsi que de la cornée en antérieur. La cornée, dont la transparence est essentielle à sa fonction, est responsable, avec le cristallin, de la réfraction de la lumière (Riordan-Eva, 2016). La sclère antérieure est protégée par la conjonctive jusqu’au niveau du limbe. Postérieurement, elle est traversée par le nerf optique. Au fond d’œil, on observe ainsi la papille ou la tête du nerf optique. Antérieurement, la cornée constitue la première lentille de l’œil.
La membrane intermédiaire constitue le tissu vasculaire de l’œil et est composée, postérieurement à antérieurement, de la choroïde, des corps ciliaires et de l’iris. Ces trois structures vasculaires forment l’uvée. La choroïde a pour fonction de permettre la nutrition de l’épithélium pigmentaire rétinien (EPR) et des couches externes de la rétine neurosensorielle. Les corps ciliaires regroupent les procès et muscles ciliaires. Les zonules de Zinn constituent les ligaments suspenseurs du cristallin. Elles s’attachent sur les procès ciliaires qui sécrètent l’humeur aqueuse. Quand à lui, le cristallin est une lentille biconvexe, convergente et capable de
se déformer ou de se relâcher par l’intermédiaire des zonules de Zinn selon l’action des muscles ciliaires. Ainsi, la contraction des muscles ciliaires permet l’accommodation de la vision.
La membrane plus intérieure, soit la rétine, tapisse toute la face interne de la choroïde. La rétine est constituée de dix couches cellulaires formant deux tissus : la rétine neurosensorielle et l’EPR. La rétine neurosensorielle est composée des photorécepteurs (cônes et bâtonnets), des cellules bipolaires et des cellules ganglionnaires. Les axones des cellules ganglionnaires forment les fibres optiques qui s’unissent pour donner naissance au nerf optique (Collège des ophtalmologistes universitaires de France, 2010). L’EPR représente la couche la plus postérieure de la rétine et constitue une membrane basale et une couche nourricière pour les photorécepteurs qui ont de grands besoins métaboliques (Collège des ophtalmologistes universitaires de France, 2010). La rétine est le tissu neuronal qui a pour fonction de transformer les influx lumineux en influx électriques via la phototransduction par les cônes et bâtonnets. Ces influx pourront ensuite être interprétés par le cerveau, donnant ainsi à l’homme le sens de la vision.
L’apport sanguin de l’œil est assuré par les branches de l’artère ophtalmique, dérivée de l’artère carotide interne en sa portion intracrânienne. L’artère ophtalmique voyage avec le nerf optique et pénètre dans le globe oculaire par le foramen optique. Une fois dans le globe oculaire, elle donne lieu à l’artère centrale rétinienne, responsable de l’apport vasculaire de la rétine interne. L’artère ophtalmique se divise également en courtes et longues artères ciliaires postérieures qui assurent l’apport sanguin de l’uvée postérieure (Riordan-Eva, 2016). Alors qu’il a été longtemps considéré que l’œil ne possédait pas de drainage lymphatique, des travaux de recherche récents ont permis d’identifier à l’aide de marqueurs lymphatiques, une fonction lymphatique du canal de Schlemm et des canaux lymphatiques dans le limbe, le corps ciliaire, les glandes lacrymales, les muscles extra-oculaires et peut-être même la choroïde (Karpinich & Caron, 2014; Koina et al., 2015; Nakao et al., 2012; Yucel et al., 2009).
1.2.2 L’uvée : structure et fonction
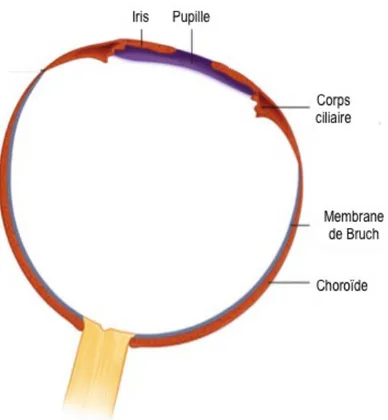
L’uvée constitue une structure vasculaire encerclant l’œil de manière à permettre l’approvisionnement de ses structures en nutriments et oxygène (Figure 1.1). Elle est principalement composée de vaisseaux sanguins, de tissu conjonctif, de fibroblastes et de mélanocytes. Ces derniers sont des cellules pigmentées qui donnent la coloration brunâtre distinctive de la choroïde (Duane et al., 2011). L’uvée est attachée à la sclère à trois niveaux : antérieureurement à l’éperon scléral, à la sortie par les veines vortexet postérieurement au nerf optique. Des espaces existent entre la sclère et l’uvée : l’espace supracilliaire est situé entre les corps ciliaires et la sclère, alors que l’espace sous-choroïdien se situe entre la choroïde et la sclère (Barrett & Ganong, 2012). L’apport vasculaire de l’uvée est assuré antérieurement par les artères cilliaires longues postérieures et les artères ciliaires antérieures. La choroïde reçoit son sang de l’artère cilliaire postérieure et de ses branches.
Figure 1.2. Représentation schématique de l’uvée. La membrane intermédiaire est la couche vasculaire de
l’œil et est composée de la choroïde, du corps ciliaire et de l’iris qui forment l’uvée. Adaptée de (Ansari & Nadeem, 2016)
1.2.2.1 Uvée antérieure : iris
L’iris est un diaphragme musculaire pigmenté et perforé en son centre par la pupille dont le diamètre s’ajuste à l’intensité lumineuse via l’action du sphincter de la pupille et du dilatateur de l’iris. La contraction de l’iris est sous le contrôle du système nerveux parasympathique et la dilatation sous le système sympathique. Une lumière vive fera contracter la pupille par le sphincter de la pupille (myosis) et une lumière faible produira une dilatation de la pupille par le muscle dilatateur de l’iris (mydriase) (Riordan-Eva & Augsburger, 2017).
1.2.2.2 Uvée intermédiaire : corps ciliaire
Le corps ciliaire est responsable de produire l’humeur aqueuse. Sa partie antérieure se nomme pars
plicata et sa partie postérieure pars plana. La pars plana se continue par la choroïde au niveau de l’ora serrata, soit la délimitation entre le corps ciliaire et la choroïde (Ansari & Nadeem, 2016).
1.2.2.3 Uvée postérieure : choroïde
Le segment postérieur de l’uvée est la choroïde et forme un tissu à prédominance vasculaire, responsable d’assurer l’approvisionnement de la rétine externe en nutriments et oxygène (Nickla & Wallman, 2010). La choroïde dérive de deux tissus embryonnaires : les cellules vasculaires et stromales originent du mésoderme, tandis que les mélanocytes originent des crêtes neurales (Duane et al., 2011). Les mélanocytes synthétisent, dans les mélanosomes (organites), le pigment de mélanine. Le rôle de ce pigment dans une structure aussi postérieure que la choroïde en est un d’absorption pour éviter la réflexion et la dispersion des rayons lumineux dans le globe oculaire (Nickla & Wallman, 2010). La choroïde représente l’extension postérieure du corps ciliaire et ne s’interrompt pas au niveau du nerf optique. Cette structure peut être divisée en cinq couches principales : la membrane de Bruch, les choriocapillaires, les couches vasculaires de Haller et Sattler, ainsi que l’espace supra-choroïdien (Figure 1.2) (Nickla & Wallman, 2010). La limite interne de la choroïde est formée par la membrane de Bruch. Cette membrane mince origine en partie de l’EPR et de la couche vasculaire des choriocapillaires (Duane et al., 2011). La membrane de Bruch s’étend du nerf optique à l’ora serrata. C’est une couche de tissu conjonctif qui sépare les cellules métaboliquement actives de l’EPR des choriocapillaires. Elle sert de support aux cellules de l’EPR. Elle constitue également une membrane semi-perméable de filtration et donc, elle peut réguler les échanges ioniques et métaboliques entre l’EPR et les choriocapillaires. Ainsi, les nutriments passent des choriocapillaires vers l’EPR, alors que les déchets métaboliques et cellulaires des photorécepteurs traversent la monocouche d’EPR vers les vaisseaux choroïdiens pour être éliminés.
Les couches vasculaires permettent à la choroïde de jouer son rôle de support métabolique pour la rétine. La couche vasculaire interne de la choroïde contient les choriocapillaires fenêtrés qui apportent nutriments et oxygène à la rétine par diffusion (Ansari & Nadeem, 2016). Ensuite, au niveau intermédiaire se trouve la couche de Sattler composée de vaisseaux sanguins de calibre moyen, alors que la couche de Haller adjacente renferme des vaisseaux de gros calibre. Enfin, l’espace supra-choroïdien représente une zone de transition entre la limite externe de la choroïde et la sclère et draine environ 20% de l’humeur aqueuse (Ansari & Nadeem, 2016). L’espace supra-choroïdien est de plus en plus considéré comme site d’injections d’agents pharmacologiques via des micro-aiguilles, étant donné la difficulté à administrer des traitements dans les structures postérieures de l’œil (Kim et al., 2015).
La choroïde démontre une épaisseur variant de 0.22-0.30 mm à son pôle postérieur et est plus mince (0.10 et 0.15 mm) en périphérie de la rétine et plus antérieurement (Ansari & Nadeem, 2016). En effet, la concentration en vaisseaux sanguins de calibres moyen et large est plus grande au niveau de la choroïde
postérieure: les couches vasculaires y sont donc plus visibles. Postérieurement, la choroïde s’attache au nerf optique, où elle se termine. La différence d’épaisseur centrale et périphérique de la choroïde, qui peut varier selon les apports sanguins et aqueux, permet de moduler l’emplacement de la rétine, et donc l’état réfractif (focus) (Wallman et al., 1995). La choroïde joue également un rôle thermorégulateur dans l’œil étant donné sa riche vascularisation (Nickla & Wallman, 2010). Enfin, cette tunique est innervée par des fibres nerveuses provenant du cinquième nerf crânien (i.e. nerf trijumeau) et par des nerfs du système nerveux autonome (Ansari & Nadeem, 2016)
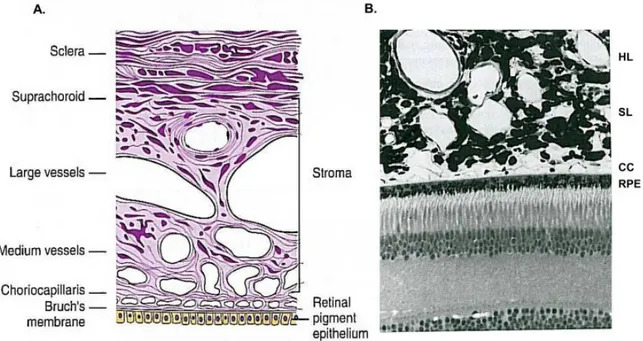
Figure 1.3. Histologie de la choroïde. A. Schémas des couches de la choroïde, du bas vers le haut : la
membrane de Bruch, les choriocapillaires, les vaisseaux de calibre moyen, les vaisseaux de gros calibre, le stroma choroïdien et la suprachoroïde. La choroïde est délimitée en postérieur par l’épithélium rétinien pigmentaire et par la sclère en supérieur. B. Coupe de la rétine externe et de la choroïde d’un primate. RPE= épithélium pigmentaire rétinien; CC = choriocapillaires; SL = couche de Sattler; HL= couche de Haller. Tirée de (Nickla & Wallman, 2010)
1.3. Le mélanome uvéal
1.3.1 Prévalence et épidémiologie
Bien qu’il s’agisse d’une tumeur relativement rare, le mélanome uvéal (MU) demeure la tumeur primaire intraoculaire la plus fréquente chez l’adulte (Krantz et al., 2017). Ce cancer représente environ 3-5% de tous les mélanomes diagnostiqués et l’incidence est demeurée stable depuis les 50 dernières années
(Chang et al., 1998; Singh & Topham, 2003; Singh et al., 2011). Tout comme le mélanome cutané, le MU survient suite à la transformation des mélanocytes, mais il se distingue grandement de la forme cutanée par sa présentation, ses mécanismes moléculaires, sa résistance thérapeutique et sa capacité à métastaser au foie (Tas et al., 2011). La vaste majorité des mélanomes uvéaux apparaissent dans la choroïde (90%), tandis que 6% et 4% des cas se développent au niveau du corps ciliaire et de l’iris, respectivement (Shields, Furuta, Thangappan, et al., 2009). En Amérique du Nord, l’incidence annuelle du MU est de 5 à 6 cas par million d’habitants (Singh & Topham, 2003; Singh et al., 2011) et elle augmente avec l’âge (Andreoli et al., 2015; Singh & Topham, 2003; Singh et al., 2011). L’âge moyen au diagnostic varie de 59 à 62 ans, mais la plus grande proportion de mélanome uvéaux est diagnostiquée chez des individus de 70 ans; un plateau est atteint après 75 ans (Andreoli et al., 2015; Krantz et al., 2017; Shields, Furuta, Thangappan, et al., 2009; Singh & Topham, 2003; Singh et al., 2011). Toutefois, cette tumeur peut survenir à tout âge; des cas ont été rapportés chez des enfants aussi jeunes que 2 ans (Shields, Kaliki, Arepalli, et al., 2013). Les cas de MU congénital sont extrêmement rares, avec seulement 7 cas publiés à ce jour (Broadway et al., 1991; Greer, 1966; Palazzi et al., 2005; Posnick et al., 1993; Pukrushpan et al., 2014; Rai et al., 2011; Singh et al., 2016). Les hommes ont une incidence supérieure de 30% à celle des femmes: 6.8 cas par million comparativement à 5.3 cas par million chez les femmes ont été documentés (McLaughlin et al., 2005). Cette différence a toutefois été observée seulement chez les hommes et les femmes de plus de 65 ans, les incidences étant similaires avant cet âge (Vajdic et al., 2003). L’origine ethnique a également été identifiée comme facteur de risque du MU. Les Caucasiens développent davantage cette tumeur (6 cas par million) que les Africains, les Asiatiques et les Hispaniques, qui présentent des incidences significativement inférieures, soit 0.31, 0.39 et 1.67 cas par million (Hu et al., 2005). De plus, son incidence annuelle en Europe varie de 1.3 à 8.6 cas par million et augmente avec la latitude. En Espagne et au sud de l’Italie, l’incidence du MU est inférieure à 2 cas par million par année, alors qu’en Europe Centrale, elle est de 4 à 6 cas par million. Toutefois, en Norvège et au Danemark, l’incidence du MU est de plus de 8 cas par million (Virgili et al., 2007). Cette variation avec la latitude est associée à une plus faible pigmentation oculaire et cutanée dans les populations nordiques. Cette observation permet de comprendre plusieurs des facteurs de prédisposition du MU, c’est à dire la coloration pâle de l’iris (yeux bleus/verts), la peau pâle ou l’incapacité à bronzer (Weis et al., 2006).
La mélanocytose oculaire (ou oculodermique, selon l’étendue) est une anomalie pigmentaire congénitale qui entraîne une pigmentation brune-grise de la peau adjacente à l’œil, de la sclère, de l’uvée, de l’orbite, de la paupière, du palais et de la membrane tympanique. Les patients avec une mélanocytose oculo(dermique) ont été associés à des plus hauts taux de développement du MU que la population générale, avec un patient sur 400 qui développe ce cancer (Gonder et al., 1982; Singh et al., 1998). De plus, les patients atteints de mélanocytose oculo(dermique) ayant développé un MU sont deux fois plus susceptibles de
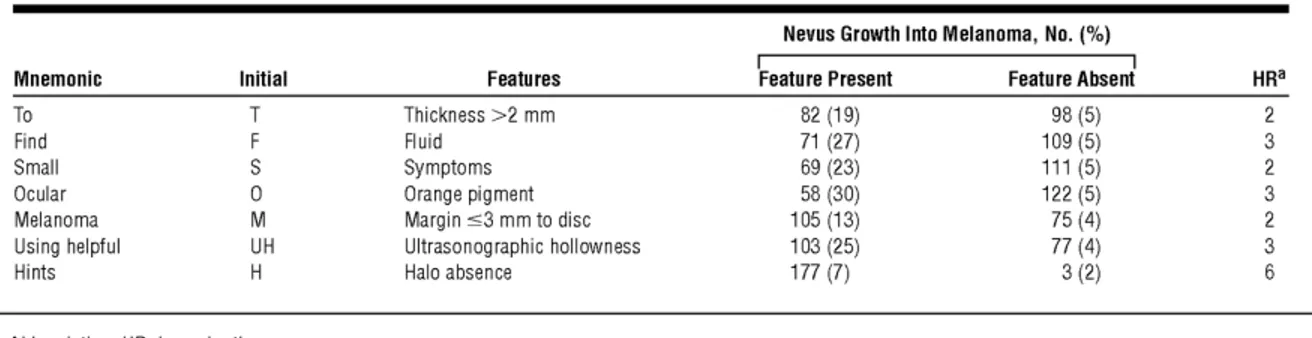
développer des métastases à 10 ans (Shields, Kaliki, Livesey, et al., 2013). Également, les patients avec des naevus, soit une prolifération bénigne de mélanocytes, de l’iris ou des naevus cutanés atypiques sont plus susceptibles de développer un mélanome oculaire que la population générale (Bataille et al., 1995; Weis et al., 2009). Des facteurs associés à l’évolution des naevus choroïdiens en mélanomes, basés notamment sur l’épaisseur de la masse, la présence de fluide sous-rétinien, les symptômes, le pigment orange, les marges et l’apparence échographique, ont été élaborés afin de faciliter la surveillance clinique des naevus choroïdiens (Shields, Furuta, Berman, et al., 2009).
Les travaux publiés sur l’association entre les rayons UV et l’incidence du MU n’ont pas montré de façon concluante que l’exposition au soleil serait un facteur de risque pour le MU (Shah et al., 2005). Un total de 12 études sur le lien entre les rayons UV et le MU avec données originales ont été méta-analysées par Shah et al. : 10 de ces études sont des cas-témoins (rétrospectives), alors que seulement 2 études concernent des cohortes (longitudinales) (Shah et al., 2005). Alors que certaines études ont démontré que l’exposition chronique aux rayons UV serait associée au développement du MU (Hakansson et al., 2001; Seddon et al., 1990; Vajdic et al., 2003), d’autres études ont contredit ces résultats (Gallagher et al., 1985; Guenel et al., 2001; Pane & Hirst, 2000). La méta-analyse des données disponibles a révélé une association non significative entre l’exposition chronique aux rayons UV et le développement de ce cancer (4 études, 572 cas; OR, 1.37 [95% IC, 0.96–1.96]) (Shah et al., 2005). Cinq études ont analysé le lien entre l’exposition des soudeurs à la lumière UV artificielle et l’incidence du MU; la méta-analyse de ces données suggère un risque deux fois plus élevé (5 études, 1 137 cas; OR, 2.05 [95% [IC], 1.20–3.51]) (Shah et al., 2005). Toutefois, les études épidémiologiques sur l’exposition aux UV sont limitées par la difficulté d’estimer et de colliger les nombreuses variables influençant l’exposition aux rayons UV artificiels de manière uniforme (Mallet et al., 2014). Cependant, les analyses génétiques ont démontré des mutations typiques des rayons UV (CpG à TpA) dans le codon 183 de GNAQ (Guanine nucleotide-binding protein subunit alpha q) et GNA11 (Guanine nucleotide-binding protein subunit alpha 11), ainsi que dans le codon 29 du gène RAC1 (Ras-related C3 botulinum toxin substrate 1) (Krauthammer et al., 2012; Mallet et al., 2014). Les mutations dans le codon 209 des gènes GNAQ et GNA11 partagent une homologie avec les mutations rapportées dans le codon du gène BRAF (proto-oncogène B-Raf), qui est le plus fréquemment muté dans le mélanome cutané (Davies et al., 2002; Mallet et al., 2014). De plus, chez l’enfant de moins de 8 ans, le cristallin permet la transmission des rayons UV de 300 à 400 nanomètres, ce qui expose la rétine à des rayons UVA et UVB (Norren & Vos, 1974) . Il est possible que l’exposition précoce au soleil soit un facteur de risque du développement du mélanome uvéal, tout comme c’est le cas pour le mélanome cutané, mais cette association n’a pas encore été démontrée (Leiter & Garbe, 2008).
1.3.2 Présentation et diagnostic
La présentation du MU varie avec sa taille et sa localisation. Les mélanomes iriens, les plus rares, sont souvent asymptomatiques, mais une nouvelle tache brunâtre sur l’iris pourra être remarquée par le patient ou ses proches, ce qui justifiera la consultation (Kaliki & Shields, 2017). Les mélanomes du corps ciliaire sont asymptomatiques jusqu’à ce que la masse tumorale comprime le cristallin, causant de l’astigmatisme et une vision floue ou des changements de la vision chez les patients portant des lunettes (Shields et al., 2015). Le mélanome choroïdien pourra se présenter par des symptômes visuels comme de la photopsie (flashs), des corps flottants ou une perte de la vision si la masse tumorale atteint la macula (Rodriguez et al., 2016). La tumeur peut également se présenter par un décollement rétinien et causer une perte de la vision, et ce, même si elle est localisée à distance de la macula. Rarement, le mélanome choroïdien entraîne un glaucome aigu qui provoque de la douleur et une rougeur sévère à l’œil atteint suite à une augmentation importante de la tension intraoculaire (TIO) (Shields et al., 2015). Cependant, une proportion d’environ 25-30% des patients ne présentent aucun symptôme lors du diagnostic et la tumeur est donc détectée lors d’examens de routine chez l’optométriste ou l’ophtalmologiste ou dans le cadre de plaintes non reliées (Damato & Damato, 2012; Shields et al., 2015). Plusieurs patients souffrant de mélanome choroïdien ou ciliaire se présentent à un stade plus avancé étant donné le délai avant la consultation en ophtalmologie et la fréquence de mauvais diagnostic (Damato & Damato, 2012; Kaliki & Shields, 2017).
Le mélanome choroïdien est une masse pigmentée brune en forme de dôme dans 75% des cas (Figure 1.3). Toutefois, la tumeur peut également se présenter sans pigmentation (15% des cas) ou avoir une pigmentation mixte/faible (30% des cas). Elle peut également présenter une forme en champignon (pédonculée; 19% des cas) ou plate (dite diffuse) (Shields, Furuta, Thangappan, et al., 2009). Les tumeurs en forme de champignon se développent quand la masse perce la membrane de Bruch et s’insère dans l’espace sous-rétinien, lui donnant ainsi son apparence particulière. Une tumeur de forme plate est fréquemment confondue avec un naevus choroidien (Shields, Kaliki, Furuta, et al., 2013; Shields et al., 1996). En effet, le diagnostic différentiel le plus important du mélanome choroïdien est le naevus choroïdien, qui est une condition bénigne. La tumeur peut être classée selon son épaisseur : petite (<3.0 mm), moyenne (3.1-8.0 mm) ou large (>8.0 mm) (Shields, Furuta, Thangappan, et al., 2009). Dans une étude comportant 7 256 cas de mélanomes choroïdiens, l’épaisseur tumorale moyenne était de 5.5 mm et le diamètre basal moyen était de 11.3 mm (Shields, Furuta, Thangappan, et al., 2009).
Normalement, toutes les lésions suspectes de cancer sont évaluées par une biopsie qui permettra de confirmer le diagnostic. Toutefois, en raison des risques de propagation et de dommage aux autres structures de l’œil que comporte une biopsie de tumeur intraoculaire, le diagnostic de MU est souvent posé par un
oncologiste oculaire d’expérience qui dispose de plusieurs méthodes d’investigation non invasives pour caractériser la tumeur, telles que l’échographie oculaire et l’angiographie à la fluorescéine (Figure 1.3). L’utilisation des critères cliniques du COMS permet d’établir un diagnostic avec un taux d’erreur aussi bas que 0.48% (Collaborative Ocular Melanoma Study, 1990). Toutefois, grâce aux percées technologiques, la technique de biopsie par aspiration à l’aiguille fine devient de plus en plus un standard de soins et permet de confirmer le caractère malin d’une masse intraoculaire, d’établir un pronostic et donc d’améliorer la prise en charge des patients (McCannel, 2013).
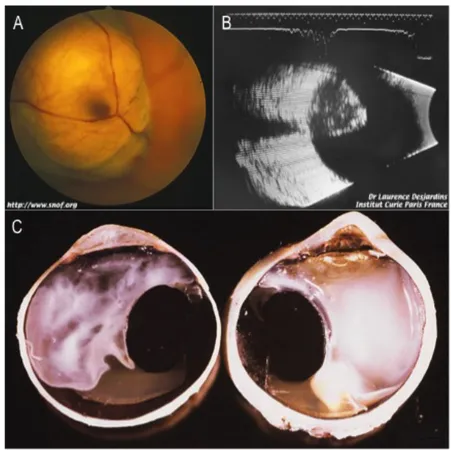
Figure 1.4. Aspect macroscopique du mélanome uvéal. A. Vue du fond d’œil démontrant un mélanome
choroïdien envahissant et comprimant la macula. B. Vue de la même tumeur présentée en A en échographie, démontrant sa forme en dôme. C. Coupe d’un œil énucléé démontrant un mélanome choroïdien pigmenté.
Images A et B tirées de SNOF.org, par Dre Laurence Desjardins
(http://www.snof.org/encyclopedie/mélanome-oculaire) et C de Pathology Outlines (http://www.pathologyoutlines.com/topic/eyeuveamelanoma.html).
1.3.3 Facteurs pronostiques
1.3.3.1 Facteurs cliniques
Des facteurs associés à la transformation maligne des naevi choroïdiens en mélanomes ont été identifiés et sont utilisés pour la surveillance clinique. La taille de la masse lors de la présentation, sa progression ainsi que l’âge du patient sont également des facteurs pronostiques (Tableau 1.1) (Shields, Kaliki, Arepalli, et al., 2013). Les patients qui présentent un MU en bas âge (<20 ans) ont des taux de métastases inférieurs aux patients plus âgés (Kaliki et al., 2013).
Tableau 1.1. Le pourcentage de naevi choroïdiens qui évoluent en mélanomes avec ou sans présence de
facteurs de risque. Les principaux facteurs sont l’épaisseur >2 mm, la présence de fluide sous la rétine, de symptômes, de pigment orange dans la masse, d’une marge tumorale < 3 mm du disque, d’un creux à l’échographie ou l’absence de halo. Ces caractéristiques sont recherchées lors de l’évaluation ophtalmologique d’un naevus choroïdien. Tiré de (Shields, Furuta, Berman, et al., 2009).
1.3.3.2 Facteurs histopathologiques
Quelques-unes des caractéristiques histopathologiques qui suggèrent un mauvais pronostic sont le type cellulaire épithélioïde, un index mitotique élevé, des valeurs élevées du diamètre moyen des nucléoles, une densité microvasculaire tumorale plus élevée, des motifs particuliers de la microvasculature tumorale, des lymphocytes ou des macrophages infiltrants et une surexpression d’ILGF-1 (Insulin-like growth factor 1) ou des HLA classe I/II (Al-Jamal et al., 2003; All-Ericsson et al., 2002; Bronkhorst et al., 2012; de la Cruz et al., 1990; Ericsson et al., 2001; Foss et al., 1996; Frenkel et al., 2013; Huntington et al., 1989; Jager et al., 2002; Kivela et al., 2004; Krishnakumar et al., 2004; Maat et al., 2008; Makitie et al., 1999, 2001; McLean et al., 1997; Mooy et al., 1995; Moshari & McLean, 2001; Seddon et al., 1987; Silverman et al., 1997). La localisation ciliaire, l’extension extraoculaire, le type épithéloïde, le haut index mitotique et les motifs vasculaires pronostiques ont également été associés à la monosomie du chromosome 3 (Scholes et al., 2003).
Cependant, depuis quelques années, les caractéristiques cytogénétiques (i.e. chromosomes) et/ou génétiques (i.e. mutations ou signature moléculaire) sont également utilisées pour compléter la pronostication du MU.
1.3.3.3 Facteurs cytogénétiques
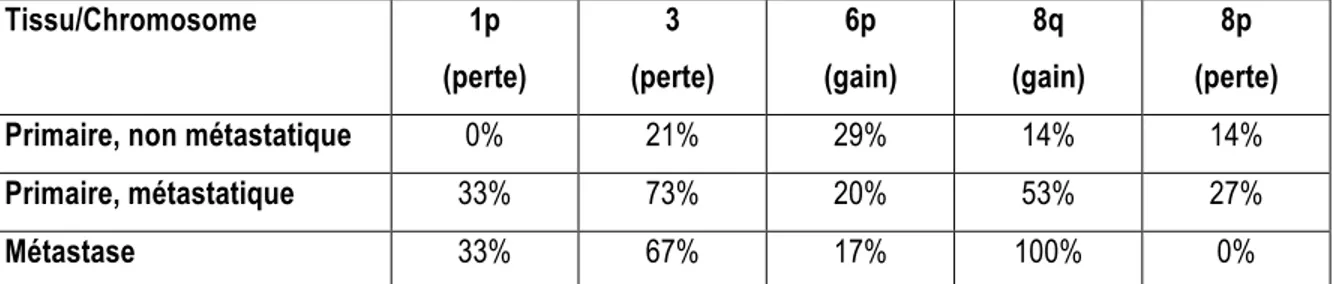
Les aberrations chromosomiques non aléatoires sur les chromosomes 1, 3, 6 et 8 permettent de déterminer la survie des patients (Kilic et al., 2006) et sont résumées dans le Tableau 1.2. Ainsi, la perte du chromosome 1p n’a été observée que dans les tumeurs primaires de patients métastatiques ou dans les métastases dans l’étude de Aalto et al. (2001) et cette anomalie serait associée aux mélanomes du corps ciliaire qui ont un pronostic plus sombre que les mélanomes choroïdiens (McLean et al., 1977; Sisley et al., 2000). La perte du chromosome 3 et le gain du chromosome 8q sont associés directement à un mauvais pronostic et au développement de métastases (Horsman et al., 1990; Kilic et al., 2006; Shields et al., 2011). La monosomie 3 est l’aberration chromosomique la plus prédictive d’une mauvaise évolution (Kilic et al., 2006). Dans une étude de 500 cas de MU dont le chromosome 3 a été analysé après biopsie par aspiration à l’aiguille fine, 48% des patients étaient disomiques, 27% avaient une délétion partielle du chromosome 3 (bras court) et 25% démontraient une monosomie. Lors du suivi à 3 ans, les patients disomiques, avec délétion partielle ou monosomiques pour le chromosome 3 avaient des taux de métastases respectifs de 3%, 5% et 24% (Shields et al., 2011). De plus, les tumeurs avec une monosomie 3 sont davantage associées à l’aneuploïdie, ce qui suggère que la perte d’une copie de ce chromosome mène à une instabilité génomique (Ehlers et al., 2008). Alors que le gain du chromosome 6p est associé aux tumeurs non métastatiques et s’avère être un marqueur de bon pronostic, la monosomie 3 est associée à un fort potentiel métastatique, ce qui suggère une bifurcation vers l’une ou l’autre de ces voies lors du développement tumoral (Ehlers et al., 2008; Parrella et al., 1999). La perte du chromosome 8p ainsi que le gain du chromosome 8q sont des marqueurs de mauvais pronostic indépendants (Ewens et al., 2013) .
Tissu/Chromosome 1p (perte) 3 (perte) 6p (gain) 8q (gain) 8p (perte)
Primaire, non métastatique 0% 21% 29% 14% 14%
Primaire, métastatique 33% 73% 20% 53% 27%
Métastase 33% 67% 17% 100% 0%
Tableau 1.2. Analyses des anomalies chromosomiques dans 35 cas de mélanome uvéal. Données extraites
de (Aalto et al., 2001).
Dans certains centres d’oncologie oculaire, les études chromosomiques sont maintenant complémentées par l’utilisation d’une signature génique qui permet de déterminer deux groupes au pronostic différent: classe 1
(faible risque de métastases) et classe 2 (fort risque de métastases) (test DecisionDX-UM) (Onken et al., 2004; Worley et al., 2007).
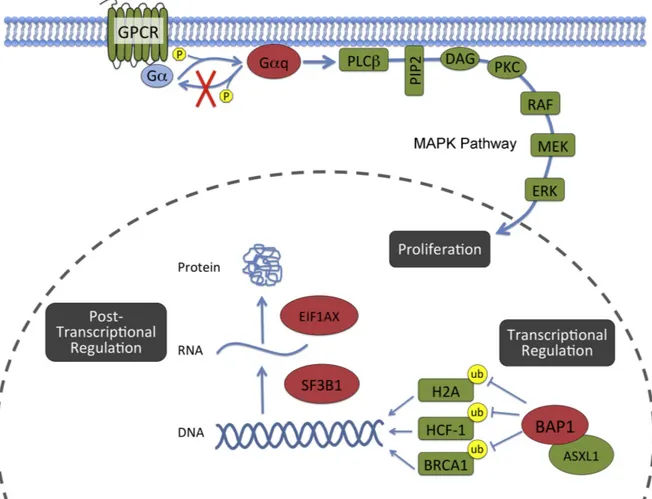
1.3.3.4 Mutations ayant une importance pronostique GNAQ et GNA11
Les mutations dans les gènes GNAQ et GNA11 ont été découvertes en 2008 et 2010 et sont présentes dans environ 85% des patients atteints de MU (Onken et al., 2008; Van Raamsdonk et al., 2009). Les gènes GNAQ et GNA11 codent pour une sous-unité alpha de la protéine G. La protéine Gq est une protéine G hétérotrimérique qui active la phospholipase C. La phospholipase C activée déclenche par la suite une série d’évènements signalétiques qui permettent entre autres l’activation de la voie des MAPK
(Mitogen-activated protein kinase). La sous-unité alpha de la protéine Gq possède normalement une activité
enzymatique GTPase (Guanosine-5'-triphosphatase) qui permet l’inactivation de la phospholipase C. Les mutations qui surviennent autant au niveau de GNAQ que GNA11 résultent en une perte de l’activité GTPase et causent une activation soutenue de la phospholipase C et donc de la voie des MAPK et autres voies de prolifération. Les mutations dans GNAQ et GNA11 sont mutuellement exclusives. Elles sont présentes dans les naevi pré-malins ainsi qu’à tous les stades du MU, indiquant que leur survenue serait un évènement précoce dans la tumorigenèse (Onken et al., 2008; Van Raamsdonk et al., 2009). Toutefois, il n’est pas clair si les mutations GNAQ et GNA11 sont directement corrélées à la survie globale. Certaines études associent les mutations de GNA11 à une progression plus rapide vers la maladie métastatique (Griewank et al., 2014; Van Raamsdonk et al., 2010)
BAP1 (BRCA1 associated protein 1)
Des mutations du gène BAP1, localisé sur le chromosome 3p21, ont été identifiées dans la plupart des MU avec fort risque de métastases (classe 2) et rarement observées dans les MU à faible risque de métastases (classe 1) (Harbour et al., 2010). BAP1 est un gène suppresseur de tumeur. La délétion d’une copie du chromosome 3 supprime un des allèles et l’autre allèle est inactivé par une mutation (Harbour et al., 2010; Worley et al., 2007). La monosomie 3 ayant auparavant été associée au développement de métastases,
BAP1 pourrait être un des facteurs derrière l’agressivité des tumeurs monosomiques. BAP1 régule des
fonctions cellulaires critiques comme l’expression génique, le cycle cellulaire ainsi que l’identité cellulaire (Misaghi et al., 2009; Nishikawa et al., 2009; Yu et al., 2010). Les mécanismes par lesquels la perte de BAP1 mène à la dissémination métastatique restent à élucider. En effet, l’inactivation de BAP1 dans les cellules de MU entraîne une perte de la différentiation et un gain de propriété similaires aux cellules souches. Les cellules dépourvues de BAP1 expriment des marqueurs des cellules souches, ont une capacité augmentée d’auto-renouvellement et sont capables de croitre dans les conditions des cellules souche (Matatall et al., 2013).
Cependant, la perte de BAP1 n’a pas été associée à la tumorigénicité, l’invasion ou la migration des cellules de MU dans cette étude (Matatall et al., 2013).
SF3B1 (Splicing factor 3b subunit 1) et EIF1AX (Eukaryotic translation initiation factor 1A, X-linked)
SF3B1, qui code pour une sous-unité d’un facteur d’épissage des pré-ARNm, est également un autre
gène subissant des mutations dans le MU (Golas et al., 2003). Toutefois, les mutations au niveau de SF3B1 ont été associées aux MU à faible risque de métastases (classe 1) (Harbour et al., 2013). Les mutations au niveau de SF3B1 sont mutuellement exclusives avec celles de BAP1. Leur participation à la tumorigenèse est présentement le sujet de travaux de recherche. Pour sa part, EIF1AX encode un facteur d’initiation requis pour la traduction de l’ARN messager en protéine. Les mutations dans ce gène sont mutuellement exclusives avec celles dans SF3B1; elles sont aussi associées aux tumeurs de classe 1, qui démontrent un meilleur pronostic (Harbour & Chao, 2014; Martin et al., 2013).
Figure 1.5. Les fonctions cellulaires principales des protéines les plus fréquemment mutées dans le
mélanome uvéal. Les mutations au niveau de GNAQ et GNA11 empêchent l’activité GTPase ce qui active plusieurs voies signalétiques subséquentes, incluant la voie des MAPK, qui résulte en une prolifération
cellulaire dérégulée. Le gène BAP1 code pour une enzyme qui, après interaction avec des protéines de la famille ASXL (Additional sex combs like), retire les monoubiquitines de substrats spécifiques comme les H2A (Histone 2A), HCF-1 (Host cell factor C1) et BRCA1 (Breast cancer 1). Ces mutations affectent donc la structure de la chromatine et le processus transcriptionnel. La protéine SF3B1 fait partie du spliceosome majeur U2 et mineur U12. Les mutations de SF3B1 dans le mélanome uvéal affectent l’épissage de certains transcrits ARN. EIF1AX code un facteur d’initiation requis pour la traduction de l’ARN messager en protéine. Il est suspecté que les mutations de EIF1AX affectent la production de protéines facilitant la progression tumorale. DAG = diacylglycerol; ERK = extracellular signal-regulated kinases; Gα = sous-unité G α; Gαq =
sous-unité G-α-q; GPCR = récepteurs couplés aux protéines G; MEK = mitogen-activated protein kinase/extracellular signal-regulated kinase kinase; PKC = protein kinase C; PIP2 = phosphatidylinositol biphosphate; PLCβ = phosphoinositide-specific phospholipase C beta; RAF = rapidly accelerated fibrosarcoma oncoprotein. Tirée de (Harbour & Chao, 2014).
1.3.3.5 Test pronostique : DecisionDX-UM
Après la découverte de deux profils d’expression génique et de deux classes de MU au pronostic différent, une signature moléculaire basée sur le profil d’expression de seulement 15 transcrits a été identifiée (Tableau 1.3) (Onken et al., 2010). Elle permet aujourd’hui de classer les patients en deux catégories: les patients de la classe 1 avec un faible risque de développer des métastases, tandis que ceux de la classe 2 sont à fort risque. Ce test est commercialisé sous le nom de DecisionDx-UM. Les tumeurs de la classe 1 présentent un profil d’expression génique semblable à celui des mélanocytes normaux, tandis que celles de la classe 2 ont un profil comparable à des cellules moins différenciées. Ainsi, les tumeurs qui métastasent (classe 2) perdent leurs marqueurs mélanocytaires et adoptent des caractéristiques propres aux cellules souches primaires de l’ectoderme ou de la crête neurale (Chang et al., 2008; Onken et al., 2006). Pour réaliser ce test, un prélèvement par la technique de biopsie par aspiration à l’aiguille fine réalisé fait avant le traitement par curiethérapie ou immédiatement après l’énucléation. L’ARN est ensuite isolé et converti en ADNc afin de réaliser un PCR (polymerase chain reaction) pour la quantification des 15 transcrits (Onken et al., 2010). Ce test a été validé dans plusieurs centres (Onken et al., 2012).
Figure 1.6. La classification du mélanome uvéal selon les évènements moléculaires clés. Des molécules
thérapeutiques potentielles sont présentées dans les encadrés verts. Alors que les mutations au niveau de
GNAQ/11 surviennent tôt dans la transformation maligne des mélanocytes, les mutations subséquentes
résultent en des tumeurs au comportement différent. Les encardés verts inidiquent des avenues thérapeutiques ciblées. Les tumeurs de la classe 1 ont un faible risque de dissémination métastatique alors que les tumeurs de la classe B sont beaucoup plus agressives. Adaptée de (Harbour & Chao, 2014).
Abréviation Nom
Transcrits surexprimés dans les mélanomes uvéaux de classe 2
CDH1 E-cadherin
ECM1 Extracellular matrix protein 1
HTR2B 5-hydroxytryptamine receptor 2B
RAB31 RAB31, member RAS oncogene family
Transcrits sous-exprimés dans les mélanomes uvéaux de classe 2 EIF1B Eukaryotic translation initiation factor 1B
FXR1 Fragile X mental retardation, autosomal homolog 1
ID2 Inhibitor of DNA binding 2
LMCD1 LIM and cysteine rich domains 1
LT14H Leukotriene A4 hydrolase
MTUS1 Mictrotubule associated scaffold protein 1
ROBO1 Roundabout guidance receptor 1
Gènes contrôle
MRPS21 Mitochondrial ribosomal protein S21
RBM23 RNA binding motif protein 23
SAP130 Sin3A associated protein 130
Tableau 1.3. Les gènes discriminants recherchés par le test pronostique DecisionDx-UM élaboré par Harbour
et Chen en 2013.
1.3.4 Le mélanome uvéal : traitement local et évolution métastatique
Les mélanomes peuvent se développer dans plusieurs sites anatomiques où il y a présence de mélanocytes. Environ 91% des mélanomes surviennent dans la peau et 9% apparaissent dans d’autres sites comme l’œil et ses annexes (uvée, conjonctive, orbite, paupière) ou encore les muqueuses (nasales, oropharyngées, vaginales, gastro-intestinales, urinaires) (Chang et al., 1998).
1.3.4.1 Traitement local du mélanome uvéal
Les options thérapeutiques principales pour le traitement local du MU reposent sur la radiation ou l’énucléation, soit la résection complète de l’œil malade. Les traitements conservateurs, c’est-à-dire favorisant la sauvegarde de l’œil, sont les traitements de curiethérapie (radiation par plaque) ou de radiothérapie externe (faisceaux de particules). La curiethérapie est le traitement local le plus fréquemment utilisé pour le MU depuis qu’il a été démontré qu’il n’y avait pas de différence de survie entre les patients traités par curiethérapie à l’iode-125 ou par énucléation (Collaborative Ocular Melanoma Study Group, 2005). Ainsi, le médecin place sur la sclère au niveau de la tumeur une plaque en or dans laquelle a été incorporé un isotope radioactif, comme l’iode-125, le ruthenium-106, le palladium-103 ou le cobalt-60 (Finger et al., 1999; Lommatzsch & Vollmar, 1966; Sealy et al., 1976; Stallard, 1966). Le plus souvent, il s’agit de grains d’iode-125. La plaque radioactive est retirée quelques jours après son implantation et un suivi régulier des patients est effectué afin d’évaluer la décroissance tumorale sur plusieurs mois. Le traitement sera considéré comme un échec si une croissance tumorale est observée après la curiethérapie. Cette technique permet un contrôle local de 95% des tumeurs (Giustranti, 2017). La radiothérapie externe repose sur l’utilisation d’un faisceau de particules. La principale forme de radiothérapie externe utilisée est la protonthérapie: un faisceau de protons accélérés est dirigé très précisément sur la tumeur, afin d’éviter l’irradiation des organes sains adjacents. La protonthérapie permet de conserver le globe oculaire dans une majorité de cas et d’atteindre un contrôle local de la tumeur dans 95% des cas (Dendale et al., 2006). De plus, cette technologie très dispendieuse (environ 200 000$ par patient) n’est disponible que dans quelques centres d’oncologie; le seul centre canadien pour le MU est à Vancouver