La séroprévalence des zoonoses au Nunavik :
Surveillance, identification des facteurs de risque et intervention
Mémoire présenté
à la Faculté des Études Supérieures de l'Université Laval
dans le cadre du programme de maîtrise en santé communautaire
pour l'obtention du grade de Maître es sciences (M. Sc.)
DEPARTEMENT DE MEDECINE SOCIALE ET PREVENTIVE FACULTÉ DE MÉDECINE
UNIVERSITÉ LAVAL QUÉBEC
2010
En raison de leur mode de vie et de leurs habitudes alimentaires, les Inuit sont probablement parmi les populations les plus exposées aux risques infectieux associés à la faune et à l'environnement. L'objectif principal de cette étude consistait à déterminer la séroprévalence de huit infections zoonotiques parmi la population du Nunavik. Les informations ont été recueillies à l'automne 2004 dans le cadre de l'Enquête sur la santé des Inuit du Nunavik « Qanuippitaa ». Des prélèvements sanguins (n=917) ont été réalisés et analysés afin de vérifier la présence d'anticorps contre les micro-organismes à l'étude, soit Trichinella sp., Toxoplasma gondii, Toxocara canis, Echinococcus granulosus, Brucella sp., Coxiella burnetii, Leptospira sp. et Francisella tularensis. La présence des anticorps IgG a été détectée à l'aide de méthodes immunoenzymatiques (ELISA), à l'exception de F. tularensis, pour lequel un test d'agglutination en tube à été effectué. Des informations sociodémographiques ainsi que sur la pratique d'activités traditionnelles, l'environnement domestique et la nutrition ont été colligées par questionnaires et analysées à l'aide du test de khi carré dans le but de vérifier leur association avec les sérologies positives. Nos résultats montrent que 59,8% de la population inuite a été exposée à T. gondii, 3,9% à T. canis et 8,3% à E. granulosus. Pour les infections bactériennes, la séroprévalence était estimée à 5,9% pour Leptospira sp. et 18,9% pour F. tularensis. En contrepartie, les taux pour Trichinella sp., Brucella sp. et C. burnetii étaient inférieurs ou équivalents à 1,0% (n < 5). De manière générale, la séropositivité tend à augmenter avec l'âge. Les analyses multivariées révèlent que la séroprévalence était associée avec : l'âge et la résidence dans la région de l'Ungava pour F. tularensis; l'âge et la résidence dans la région de l'Hudson pour T. canis; le genre (femme), la scolarité et le nettoyage fréquent du réservoir d'eau domestique pour E. granulosus; l'âge, le genre (femme), la scolarité, l'exposition à de l'eau potable considérée « plus à risque », le nettoyage fréquent du réservoir d'eau domestique ainsi que la consommation de viande de phoque et de gibier à plumes pour T. gondii. Aucun facteur de risque précis n'était associé à la séropositivité pour Leptospira sp. À l'exception de T. gondii, aucune autre association n'a été décelée lorsque les données de séroprévalence étaient croisées avec les variables reliées à l'alimentation et à l'exposition environnementale. Cette étude est complétée par des entrevues qualitatives, réalisées à l'été
IV
2006 afin de mieux comprendre les mécanismes impliqués dans l'exposition aux facteurs de risque et dans la prévention des infections zoonotiques au Nunavik.
Their specific lifestyle and food habits probably place Nunavik Inuit among the populations the most at risk for contracting infectious diseases conveyed by wildlife and the environment. The aim of this study was to determine the séroprévalence of eight zoonotic infections among the Nunavik population in relation to various socio-demographic variables and risk factors. Data collection was completed in the fall 2004, as part of the Qanuippitaa Health Survey of the Inuit of Nunavik. Blood samples (n=917) were collected and analyzed for the presence of antibodies against Trichinella sp., Toxoplasma gondii, Toxocara canis, Echinococcus granulosus, Brucella sp., Coxiella burnetii, Leptospira sp. and Francisella tularensis. Immunoenzymatic methods (ELISA) were used for the detection of serum IgG antibodies, with the exception of F. tularensis, for which a tube agglutination assay was performed. Information on sociodemographic characteristics, outdoor activities, and nutrition was gathered by questionnaires. The proportion of participants with positive results was compared with seronegative subjects to verify the association between the séroprévalence and different variables using the chi-squared test. The results indicate that 59.8% of the Inuit of Nunavik have been exposed to T. gondii, 8.3% to E. granulosus and 3.9% to T. canis. For bacterial infections, the estimated séroprévalence was 5.9% for Leptospira sp. and 18.9% for F. tularensis. Séroprévalence was equal or less than 1.0% (n<5) for Trichinella sp., Brucella sp., and C. burnetii. Generally speaking, seropositivity tends to increase with age. In the multivariate analyses, the variables related to the séroprévalence of antibodies were age and residence in Ungava forF. tularensis; age and residence in Hudson for T. Canis; gender (women), schooling and frequent cleaning of water reservoir for E. granulosus; and age, gender (women), schooling, exposure to "high risk" water, frequent cleaning of water reservoir, consumption of seal meat and feathered game for T. gondii. No precise risk factor has been identified for infection by Leptospira sp. Association with regards to food habits and environmental exposure was dectected only with T. gondii. The study is complemented by qualitative interviews, conducted during the summer 2006 in order to better understand the mechanisms involved in individual exposure to risk factors and prevention of zoonotic infections in Nunavik.
VI
Mots clés : Zoonoses; séroprévalence; Inuit du Nunavik; alimentation traditionnelle; Toxoplasma gondii.
Keywords: Zoonoses, séroprévalence study; Nunavik Inuit; country food; Toxoplasma gondii.
Table des matières vii Liste des tableaux x Liste des figures xi Liste des annexes xi Avant -Propos xii Remerciements xiii INTRODUCTION 1 CHAPITRE 1 - LES ZOONOSES AU NUNAVIK : ÉTAT DE LA SITUATION 3
1.1 Définition de la problématique 3
1.2 Cadre conceptuel 5 1.3 Les zoonoses au Nunavik : mise en contexte 7
1.3.1 Toxoplasmose 8 1.3.2 Trichinellose 11 1.3.3 Toxocarose 14 1.3.4 Échinococcose 17 1.3.5 Brucellose 18 1.3.6 Tularémie 20 1.3.7 Fièvre Q 23 1.3.8 Leptospirose 24 1.4 La population à l'étude : les habitants du Nunavik 26
1.5 L'eau et l'alimentation traditionnelle 27
1.6 Les changements climatiques 29 CHAPITRE 2 - OBJECTIFS DE RECHERCHE 31
CHAPITRE 3 - MÉTHODOLOGIE 33 3.1 Cadre théorique : Modèle d'intervention en santé communautaire 33
3.2 L'Enquête sur la santé des Inuit du Nunavik 36
3.2.1 Analyses sérologiques 36 3.2.2 Analyses statistiques 36 3.3 Les entrevues qualitatives 37
3.3.1 Collecte de données 37 3.3.2 Analyse des entrevues 38 3.3.3 Considérations éthiques 39 CHAPITRE 4 - ZOONOTIC DISEASES, DRINKING WATER AND
GASTROENTERITIS IN NUNAVIK: A BRIEF PORTRAIT 40
Résumé 40 Summary 41
vm
Background of the Nunavik Inuit Health Survey 44
4.1 Introduction 46 4.2 Methodological aspects 47 4.2.1 Data collection 47 4.2.2 Serological analyses 48 4.2.3 Statistical analyses 50 4.3 Results 51 4.3.1 Drinking water 51 4.3.2 Prevalence of gastroenteritis 52 4.3.3 Séroprévalence of zoonotic diseases 53
4.4 Discussion 60 4.4.1 Drinking water 60 4.4.2 Gastroenteritis 61 4.4.3 Zoonotic diseases 62 4.5 Conclusion 69 Key issues 72 Acknowledgements 74
CHAPITRE 5 - SEROPREVALENCE OF TOXOPLASMA GONDII AMONG
NUNAVIK INUIT (CANADA) 75
Résumé 75 Summary 76 5.1 Introduction 78
5.2 Materials and Methods 80
5.3 Results 83 5.4 Discussion 87 Aknowledgements 93 CHAPITRE 6 - SEROPREVALENCE OF SEVEN ZOONOTIC INFECTIONS IN
NUNAVIK, NORTHERN QUEBEC (CANADA) 94
Résumé 94 Summary 95 6.1 Introduction 97
6.2 Methodology 98 6.2.1 Constitution of the sample and data collection 98
6.2.2 Serological analyses 100 6.2.3 Statistical analyses 101 6.3 Results 103 6.4 Discussion 108 6.5 Conclusion 114 Acknowledgements 116
CHAPITRE 7 - ENTREVUES QUALITATIVES 117 7.1 Mécanismes de surveillance et de reconnaissance des zoonoses 117
7.2 Facteurs conditionnant l'exposition aux zoonoses 123 7.2.1 Mesures préventives - chasseurs et trappeurs 127 7.2.2 Mesures préventives - santé et environnement 130 7.3 Moyens de communication de l'information : forces et limitations 133
7.4 Conclusion 137 CHAPITRE 8 - DISCUSSION GÉNÉRALE 139
8.1 Zoonoses 139 8.2 Entrevues qualitatives 141
8.3 Limites de l'étude 145 CHAPITRE 9 - CONCLUSION ET RECOMMANDATIONS 147
BIBLIOGRAPHIE 150
Liste des tableaux
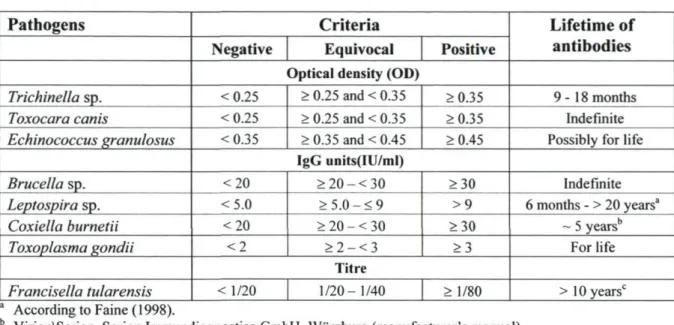
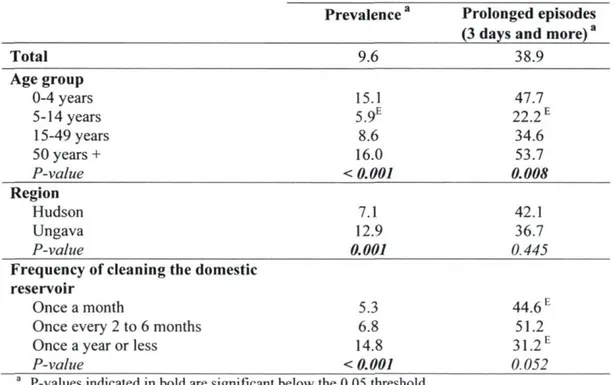
Table 4.1 Interpretive criteria for the serological analyses 49 Table 4.2 Variables significantly associated with episodes of gastroenteritis (%),
members of Inuit households, Nunavik, 2004 53 Table 4.3 Séroprévalence of Trichinella sp., Toxocara canis, Echinococcus granulosus,
Toxoplasma gondii, Brucella sp., Coxiella burnetii, Leptospira sp. and Francisella tularensis (%), population aged 18 to 74 years, Nunavik, 2004
54 Table 4.4 Séroprévalence of Toxocara canis, Echinococcus granulosus, Toxoplasma
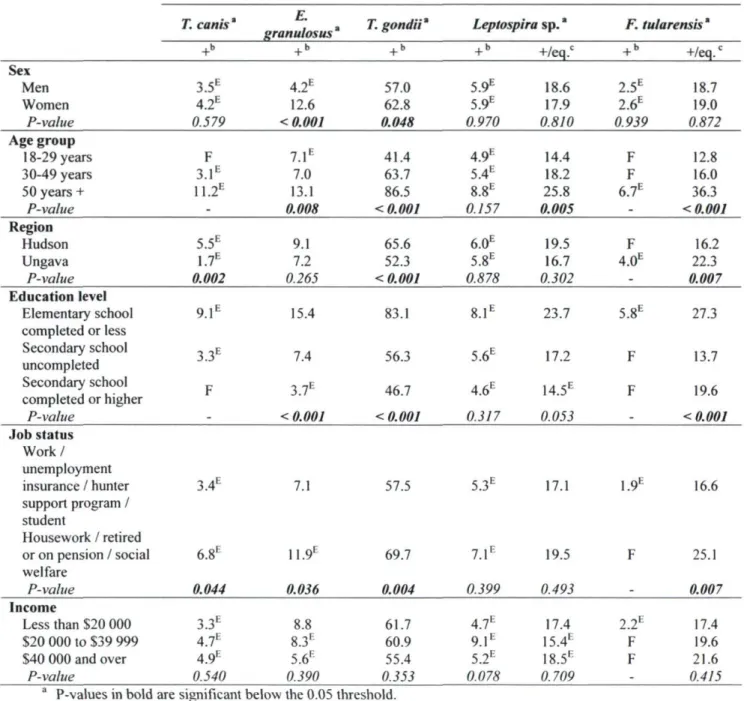
gondii, Leptospira sp. and Francisella tularensis according to sex, age, region and socioeconomic characteristics (%), population aged 18 to 74 years,
Nunavik, 2004 56 Table 4.5 Variables linked to drinking water and food significantly associated with the
séroprévalence of Toxoplasma gondii (%), population aged 18 to 74 years,
Nunavik, 2004 59 Table 5.1 Socio-demographic and traditional activities related determinants of
seropositivity to Toxoplasma gondii among permanent residents of Nunavik in
univariate analyses 84 Table 5.2 Séroprévalence of Toxoplasma gondii among permanent residents of Nunavik
stratified per village 85 Table 5.3 Nutritional and water supply-related determinants of seropositivity to
Toxoplasma gondii among permanent residents of Nunavik in univariate
analyses 86 Table 5.4 Determinants of seropositivity to Toxoplasma gondii among permanent
residents of Nunavik in a multivariate logistic regression model 87 Table 6.1 Interpretive criteria of serological analyses for Trichinella sp., Toxocara canis,
Echinococcus granulosus, Brucella sp., Leptospira sp., Coxiella burnetii and
Francisella tularensis 101 Table 6.2 Séroprévalence of Trichinella sp., Toxocara canis, Echinococcus granulosus,
Toxoplasma gondii, Brucella sp., Coxiella burnetii, Leptospira sp. and
Francisella tularensis in the Nunavik population aged 18 to 74, 2004 103 Table 6.3 Séroprévalence of Toxocara canis, Echinococcus granulosus, Leptospira sp.
and Francisella tularensis according to gender, age, region of residence and socio-economic characteristics of the Nunavik population aged 18 to 74, 2004
105 Table 6.4 Determinants of seropositivity to Toxocara canis, Echinococcus granulosus
and Francisella tularensis among permanent residents of Nunavik in a
Figure 1.1 Les déterminants de la santé 5 Figure 3.1 Algorithme décisionnel de la prévention 34
Figure 5.1 Distribution of the 14 Inuit communities of Nunavik 80 Figure 6.1 Distribution of the 14 Inuit communities of Nunavik 99
Liste des annexes
Annexe 1 Grille d'entrevue : représentants des chasseurs et trappeurs inuits 164 Annexe 2 Grille d'entrevue : représentants des organismes régionaux en santé et
environnement 166 Annexe 3 Information sheet and consent form for Inuit Hunters and Trappers
Representatives 167 Annexe 4 Information sheet for Health and Environment Representatives 170
Avant -Propos
Ce mémoire s'inscrit à l'intérieur d'une étude plus vaste visant à mieux caractériser les paramètres de santé de la population inuite du Nunavik. L'objectif de ce mémoire est de présenter la démarche employée ainsi que les résultats obtenus dans le cadre de l'étude de la séroprévalence des zoonoses au Nunavik. Il se divise en neuf chapitres et comprend la présentation de deux articles scientifiques ainsi que d'un rapport de recherche, préparés dans le but de divulguer les résultats aux professionnels de la santé ainsi qu'à l'ensemble de la communauté scientifique. Ces documents sont présentés dans les quatrième, cinquième et sixième chapitres de ce mémoire. Il s'agit respectivement : 1) du rapport publié en anglais dans le cadre de l'Enquête sur la santé des Inuit du Nunavik par l'Institut national de santé publique du Québec et la Régie régionale de la santé et des services sociaux de Nunavik qui s'intitule: Zoonotic diseases, drinking water and gastroenteritis in Nunavik : a brief portrait; 2) de l'article présentant les résultats d'analyse portant sur la toxoplasmose intitulé : Séroprévalence of Toxoplasma gondii among Nunavik Inuit (Canada); et finalement, 3) de l'article également en anglais en voie d'être soumis pour publication portant le titre : Séroprévalence of seven infections among Nunavik Inuit, Northern Quebec (Canada).
Les textes scientifiques qui forment les chapitres 4, 5 et 6 de ce mémoire ont été rédigés avec la participation d'autres co-auteurs. Une partie des analyses statistiques pour l'étude de séroprévalence a été réalisée par Monsieur Louis Rochette de l'Institut national de santé publique du Québec (INSPQ) dans le cadre de l'Enquête sur la Santé des Inuit du Nunavik (ESIN). J'ai fait les analyses multivariées à l'aide du programme utilisé dans l'enquête permettant l'application du système de poids à l'échantillon. J'ai complété l'ensemble de la revue de littérature et j'ai fait la plupart des interprétations de résultats. Enfin, j'ai conçu le protocole ainsi que les questionnaires et j'ai réalisée l'analyse des entrevues pour le chapitre 7 portant sur la collecte de données qualitatives.
Ce projet a été réalisé grâce au soutien financier du Réseau de centres d'excellence ArcticNet, de Nasivvik, Centre pour la santé des Inuit et les changements environnementaux, et du Programme de Formation Scientifique dans le Nord du Centre d'études nordiques (CEN). Il a également été rendu possible grâce au travail d'une multitude de personnes ayant participé de près ou de loin à la réalisation de l'Enquête sur la Santé des Inuit du Nunavik (ESIN). Je tiens à remercier la Régie régionales de la santé et des services sociaux du Nunavik ainsi que l'équipe de chercheurs et d'enquêteurs de l'ESIN, sans qui la collecte de données n'aurait pu avoir lieu. Un merci tout spécial revient à la population inuite du Nunavik, qui s'est généreusement prêtée à l'exercice en répondant à la panoplie de questionnaires et en participant aux examens cliniques de l'enquête, sa contribution est inestimable. Merci aux participants qui ont accepté de collaborer à la collecte de données qualitatives sur la surveillance, la prévention et la communication des informations sur les zoonoses au sein des communautés du Nunavik, vos commentaires m'ont apporté un regard nouveau sur la problématique et sur le contexte social et culturel dans lequel elle s'inscrit.
Toute ma reconnaissance va également à Benoit Lévesque et à Éric Dewailly, respectivement mes co-directeur et directeur, ainsi qu'aux nombreux collaborateurs de l'étude pour leur révision consciencieuse des manuscrits que je leur ai soumis et leurs judicieux conseils dans toutes les étapes de la réalisation de ce projet. Merci aussi à mes
anciens collègues de l'unité de recherche en santé publique (URSP), maintenant axe santé des populations et environnement du Centre hospitalier universitaire de Québec, qui m'ont servi de modèles et ont fait de mon passage au sein de cette équipe une expérience des plus agréables.
Merci à tous ceux dont la patience et les encouragements m'ont permis de venir à bout de ce travail entrepris depuis si longtemps, et particulièrement à Alexandre et Emmanuel pour leur support inconditionnel.
INTRODUCTION
L'étude de la séroprévalence des zoonoses au Nunavik s'inscrit dans le cadre d'une démarche exploratoire descriptive visant à évaluer les risques microbiologiques associés à la consommation d'eau brute et de viande de gibier par la population inuite du Nunavik. Elle s'intéresse plus spécifiquement à l'exposition de la population inuite adulte aux micro-organismes pathogènes responsables de huit zoonoses, des infections pouvant être transmises de l'animal à l'humain. Ces infections sont peu documentées chez les Inuit du Québec, et pour plusieurs d'entre elles, les hôtes spécifiques ainsi que les modes de transmission dans l'environnement arctique sont encore méconnus. Bien que de nombreuses études se soient intéressées à la séroprévalence des zoonoses dans l'Arctique canadien, peu d'entre elles ont tenté l'identification des caractéristiques sociodémographiques et des facteurs de risque associés à l'infection parmi la population inuite. En outre, la présentation clinique souvent non spécifique de ces maladies peut entraîner de sérieuses difficultés sur le plan diagnostique. Ainsi, on soupçonne que les taux rapportés annuellement ne soient qu'un reflet modeste du nombre réel de cas survenus. Tous ces éléments nuisent à la détermination de l'importance de ces infections pour la population du Nunavik. En regard de cette problématique, il existe des besoins importants en termes de connaissance des facteurs de risque et de surveillance des infections auxquels il faut répondre afin de pouvoir mettre en oeuvre les moyens de prévention appropriés. Ce mémoire de recherche se divise en neuf chapitres. Le premier chapitre consiste en une revue de la littérature. Il inclut le cadre conceptuel et traite de la problématique des zoonoses ainsi que du contexte social, culturel et environnemental dans lequel elle s'inscrit. L'épidémiologie, la symptomatologie ainsi que les facteurs de risque et de prévention associés aux huit zoonoses sont abordés, de même que la population à l'étude, les questions liées à l'eau et l'alimentation traditionnelle et les changements climatiques. Le deuxième chapitre décrit les objectifs de recherche, tandis que le troisième chapitre présente le modèle théorique à l'intérieur duquel s'articule le projet de recherche ainsi qu'un aperçu de la méthodogie, abordée de manière plus approfondie dans les chapitres suivants. Ces derniers s'intéressent à la méthodologie et aux résultats obtenus qui ont été publiés sous forme d'un rapport scientifique (chapitre 4) et de deux articles (chapitres 5 et 6), l'un publié
perspective de la problématique plus près de la réalité inuite puisqu'elle émane de représentants du milieu. Un huitième chapitre présente la discussion générale. Finalement, un dernier chapitre rassemble les principales conclusions de l'étude ainsi que les recommandations qui en découlent. Celles-ci visent à mieux définir la problématique telle qu'elle se présente à l'heure actuelle au Nunavik, et à informer les principaux acteurs concernés des paramètres sur lesquelles il est possible d'intervenir.
C H A P I T R E 1 - L E S Z O O N O S E S A U N U N A V I K : É T A T D E L A S I T U A T I O N
1.1 Définition de la problématique
Le mode de vie traditionnel occupe une place fondamentale dans la culture inuite contemporaine. La capacité de se prémunir contre la rigueur du climat, de tirer le maximum des ressources du milieu et de prédire les conditions environnementales ou le comportement animal traduit le caractère essentiel du savoir traditionnel inuit pour la survie des habitants du nord du Québec et de l'ensemble de la région circumpolaire (Bjerregaard and Young, 1998). De nombreux auteurs ont mis en relief le rôle primordial de l'alimentation traditionnelle pour le bien-être des peuples inuits (Nuttall et a i , 2005; Van Oostdam et a i , 2005; Statistique Canada, 2006). Outre les bienfaits associés à la prévention des maladies cardiovasculaires (Dewailly et al, 2001), la consommation de nourriture traditionnelle participe à la définition même de l'identité culturelle des Inuit à travers le rapport qu'ils entretiennent avec le territoire pour la chasse, la pêche et la trappe (Dorais, 1994; Poirier and Brooke, 1997). Les aliments tirés de ces activités de récolte constituent encore de nos jours une partie importante de l'alimentation des ménages inuits. Ils représentent au moins la moitié de la viande et du poisson consommés dans près de 78% des ménages du Nunavik (Statistique Canada, 2006).
En contrepartie, les habitudes alimentaires des habitants du Nunavik ainsi que leur utilisation des ressources naturelles augmentent les risques d'exposition aux agents pathogènes présents dans l'environnement. Cette situation peut parfois se traduire par la transmission à l'homme de certaines maladies d'origine animale, que l'on nomme zoonoses. À l'heure actuelle, si l'on s'en tient au nombre de cas rapportés, ces maladies ne
semblent pas constituer une problématique de santé majeure chez les Inuit du Nunavik. Cependant, la littérature nous apprend qu'elles sont souvent sous-diagnostiquées au sein de la population générale et que leur prévalence est peu documentée chez les Inuit. En outre, les sources potentielles d'infection ainsi que les modes de transmission dans l'environnement arctique demeurent bien souvent méconnus.
Le savoir traditionnel et la connaissance de leur milieu permettent depuis des générations aux Inuit de s'adapter et d'évoluer au sein d'un environnement souvent hostile. Le transfert
la viande d'ours polaire, le rejet des prises présentant des malformations ou un comportement anormal en sont des exemples (Poirier and Brooke, 1997; Proulx et al, 2002). Malgré cela, des pratiques courantes au Nunavik telles que la consommation d'eau naturelle ou de viande crue de gibier, comprenant les mammifères marins et terrestres, le gibier à plumes et le poisson, persistent et contribuent à accroître le risque d'infection par divers micro-organismes associés à l'environnement. Une meilleure compréhension de l'écologie des pathogènes et des principaux modes de transmission à l'homme dans l'environnement arctique est nécessaire afin de contrôler l'exposition environnementale des individus et de limiter les risques d'infection.
Des mesures de dépistage et de surveillance mises en place par la Régie régionale de la santé et des services sociaux du Nunavik se sont déjà montrées efficaces par le passé dans le suivi et le contrôle de certaines infections zoonotiques, dont la toxoplasmose congénitale et la trichinellose (Grondin et a l , 1996; Proulx et al., 2002; Lavoie et al, 2008). Une compréhension suffisante des zoonoses et de leur epidemiologic au Nunavik s'avère néanmoins primordiale afin de développer des programmes de prévention et d'interventions adaptés au contexte inuit.
En dernier lieu, la littérature scientifique rapporte que les changements environnementaux et climatiques ont un rôle important à jouer dans l'émergence des maladies infectieuses telles que les zoonoses et les maladies transmises par l'eau ou les aliments (Higgins, 1999; Morse, 2004). Les évidences s'accumulent à l'effet que nous subissons un réchauffement marqué du climat et que l'environnement arctique est particulièrement sensible à ces changements (Haines et al., 2000; Epstein, 2001; Bradley et a i , 2005; Parkinson and Butler, 2005). Bien que nous sachions qu'ils auront un impact certain sur la distribution et l'écologie des pathogènes et de leurs hôtes dans l'Arctique, il est encore difficile d'établir comment les changements climatiques influenceront l'incidence et l'épidémiologie des maladies infectieuses au sein des populations animales et humaines du Grand Nord québécois. Les connaissances actuelles limitées renforcent la pertinence d'évaluer la séroprévalence et le risque que présentent ces infections chez l'homme, afin de mieux
définir l'importance de cette problématique d'origine animale et d'en mieux comprendre les modes de propagation.
1.2 Cadre conceptuel
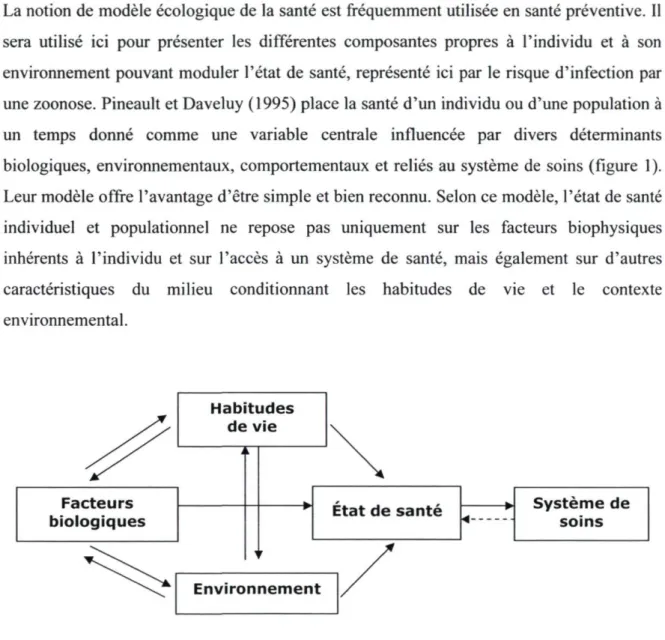
La notion de modèle écologique de la santé est fréquemment utilisée en santé préventive. Il sera utilisé ici pour présenter les différentes composantes propres à l'individu et à son environnement pouvant moduler l'état de santé, représenté ici par le risque d'infection par une zoonose. Pineault et Daveluy (1995) place la santé d'un individu ou d'une population à un temps donné comme une variable centrale influencée par divers déterminants biologiques, environnementaux, comportementaux et reliés au système de soins (figure 1). Leur modèle offre l'avantage d'être simple et bien reconnu. Selon ce modèle, l'état de santé individuel et populationnel ne repose pas uniquement sur les facteurs biophysiques inhérents à l'individu et sur l'accès à un système de santé, mais également sur d'autres caractéristiques du milieu conditionnant les habitudes de vie et le contexte environnemental.
Facteurs biologiques
Habitudes de vie
État de santé Système de
soins
Environnement
Figure 1.1 Les déterminants de la santé (adapté de Pineault et Daveluy, 1995)
Dans un même ordre d'idées, l'approche écosystémique présentée par Lebel (2003) fait le parallèle entre la santé des écosystèmes et la santé des humains, mais tient également
l'économie, de l'environnement que des besoins de la communauté. De même, la santé de l'individu découle selon lui de l'interaction entre les facteurs économiques, environnementaux et culturels au sein desquels il évolue. D'après Furgal et al. (2002), la vulnérabilité d'une population face à un risque sanitaire varie plus spécifiquement en fonction de facteurs modérateurs incluant la densité de la population, le niveau de développement social, économique et technologique, les conditions liées à l'environnement local, l'état de santé initial, la qualité et la disponibilité des services de santé et les infrastructures de santé publique. Le modèle présenté par Curtis et al. (2005) va également en ce sens en suggérant que la santé humaine dépend d'interactions complexes entre des facteurs génétiques, nutritionnels, socioculturels, économiques, et reliés aux infrastructures physiques et à l'écosystème.
En d'autres mots, la définition de l'état de santé, dans un contexte de prévention et d'intervention sanitaire, doit tenir compte non seulement des éléments culturels et sociaux qui caractérisent le milieu d'intervention (Pineault and Daveluy, 1995), mais aussi de l'environnement physique et économique, et des facteurs individuels de prédisposition. En outre, il ne faut pas négliger le rôle important des activités quotidiennes et du style de vie, qui déterminent en grande partie le degré d'exposition des individus aux divers facteurs susceptibles de modifier leur état de santé (Curtis et al, 2005). Au Nunavik, une région où les activités humaines et l'environnement naturel sont intimement liés, plusieurs déterminants peuvent ainsi moduler le risque de contracter une zoonose: l'accès à l'information, les croyances, la culture, les activités traditionnelles, les conditions économiques, l'état de santé des populations animales, le climat, les habitudes de vie, les caractéristiques biologiques individuelles, l'existence de programme de dépistage et de surveillance, les infrastructures physiques en place, etc. Bien que nous comprenions l'influence potentielle de ces divers facteurs sur l'état de santé, dans le cadre de cette étude nous nous intéressons plus particulièrement à la relation entre la séroprévalence de huit infections zoonotiques et certains déterminants spécifiques, incluant plusieurs caractéristiques sociodémographiques (âge, sexe, région d'appartenance, scolarité, statut
d'emploi, revenu) ainsi que des variables liées à l'exposition environnementale, aux habitudes de vie et aux pratiques alimentaires de la population du Nunavik.
1.3 Les zoonoses au Nunavik : mise en contexte
Les zoonoses sont des infections d'origine parasitaire, bactérienne ou virale présentes chez les animaux qui sont transmissibles à l'homme. Les modes de transmission ainsi que les types de relations unissant hôtes et pathogènes sont variés. Les manifestations cliniques qui leur sont associées peuvent également différer d'une espèce à l'autre, et même d'un individu à l'autre. Certains pathogènes n'entraîneront que des conséquences bénignes, alors que d'autres auront des répercussions dramatiques chez l'humain, pouvant même s'avérer fatales. La présence dans l'environnement et dans les tissus de certains animaux des formes infectieuses des micro-organismes responsables des zoonoses (spores, oocystes, formes enkystées, œufs, larves) est à l'origine des nombreuses infections recensées chez l'homme, qui peut servir d'hôte définitif, intermédiaire (paraténique) ou accidentel (Slifko et al, 2000). Pour la majorité de ces maladies, la transmission se fait généralement par contact direct avec des substances ou des matières contaminées par les fèces ou les sécrétions d'animaux porteurs de la maladie, ou encore par ingestion d'eau ou de nourriture contaminée.
La question des infections zoonotiques parmi les populations humaines de l'Arctique a été documentée par différents auteurs depuis le milieu du siècle dernier (Greenberg et al, 1958; Laird and Meerovitch, 1961; Hildes, 1969; Lantis, 1981; Grondin et al, 1996). Ces maladies ne semblent pas constituer une source de préoccupation ou de morbidité majeure chez les Inuit du Nunavik actuellement, notamment si on la compare à d'autres problèmes sociaux et de santé chroniques qui touchent cette population à l'heure actuelle (Bjerregaard et al., 2004). Cependant, la salubrité des aliments traditionnels demeure une question cruciale pour les habitants du Nunavik, particulièrement avec les débats actuels concernant la présence de contaminants dans l'Arctique canadien (Van Oostdam et al, 2005).
Nous savons que plusieurs des zoonoses investiguées sont sous diagnostiquées dans la population humaine à cause de leur présentation clinique non spécifique et des symptômes
parfois bénins qui les accompagnent. Pour l'heure, il nous est difficile de dresser un portrait fidèle de la situation à l'échelle du Nunavik puisque la plupart de ces maladies sont sous rapportées ou ne font pas l'objet d'une surveillance systématique. De plus, leurs modes de transmission et les sources d'infection demeurent peu documentés parmi les populations humaines comme animales de cette région, ce qui nuit à la mise en place de mesures préventives adéquates. En l'absence de données de séroprévalence, il nous est difficile d'évaluer l'ampleur de la problématique et les besoins plus précis en termes de prévention.
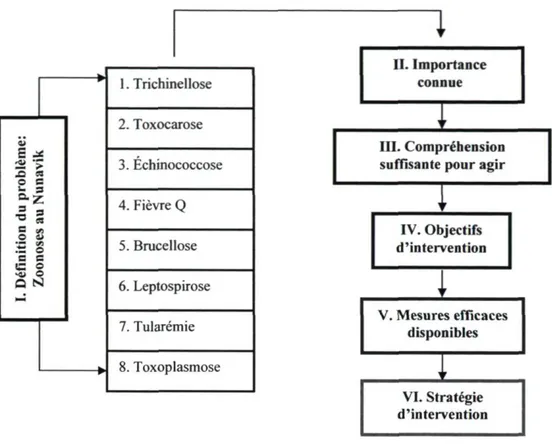
Parmi les sérologies investiguées dans le cadre de cette étude, on retrouve quatre parasites déjà documentés dans les années 1980 (Tanner et a l , 1987; Curtis et al., 1988). Il s'agit des agents responsables de la toxoplasmose (Toxoplasma gondii), de la trichinellose (Trichinella sp.), de la toxocarose (Toxocara canis) et de l'échinococcose, ou maladie hydatique (Echinococcus granulosus). La brucellose (Brucella sp.), la tularémie (Francisella tularensis), la fièvre Q (Coxiella burnetii) et la leptospirose (Leptospira sp.), quatre infections bactériennes peu ou non documentées au Nunavik, mais très susceptibles d'être sous rapportées, ont également été vérifiées. Les pages suivantes offrent une description plus détaillée des huit zoonoses retenues dans le cadre de cette étude.
1.3.1 Toxoplasmose Epidemiologic
La toxoplasmose est transmise par un protozoaire coccidien, Toxoplasma gondii, dont l'hôte définitif est le chat ou tout autre représentant de la famille des félidés. Une fois infectés, ces derniers libèrent des oocystes non sporulés dans leurs excréments. Ceux-ci deviennent infectieux après un à cinq jours selon les conditions environnementales (Dubey, 2004). La distribution de T. gondii s'étend sur l'ensemble de la planète à plusieurs espèces d'animaux à sang chaud, mammifères et oiseaux, qui constituent des hôtes intermédiaires. Le parasite se présente sous trois formes : 1) tachyzoïte, qui constitue la forme invasive durant l'épisode aigu; 2) bradyzoïte, retrouvé dans les kystes tissulaires et qui correspond à la forme latente; et 3) sporozoïte, qui représente le stade infectieux présent dans l'environnement sous forme d'oocystes (Jones et al., 2001). La larve enkystée peut persister dans les tissus de nombreuses années après l'infection (Dubey, 2004).
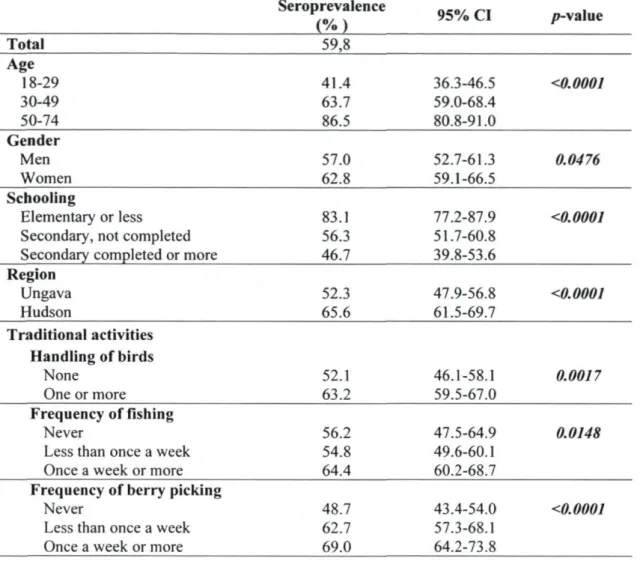
Chez l'humain, la séroprévalence de T. gondii varie énormément d'une population à l'autre. Cependant, elle est relativement élevée parmi la population humaine du Nunavik. L'étude de Tanner et al. (Tanner et a i , 1987) réalisée dans les années '80 sur des sérums provenant de patients inuits hospitalisés ou en consultation externe, révélait un taux de 48% par hemagglutination indirecte (titre > 1:32). Cette même étude chiffrait à 61% et 69% la séroprévalence mesurée à Kuujjuaq et Salluit respectivement (Curtis et al., 2005). En comparaison, la prévalence parmi la population autochtone de l'Alaska, mesurée à l'aide des méthodes d'immunofluorescence indirecte (dilution 1:16) et d'hémagglutination indirecte (titre > 1:32), donnait respectivement des taux de 28% et 16% selon la méthode employée (Peterson et a i , 1974). Aux Etats-Unis, une enquête récente évaluait à 22,5% la séroprévalence globale parmi la population âgée de 12 ans et plus (Jones et ai, 2001).
Compte tenu des graves conséquences qu'une primo-infection chez la mère peut avoir sur la santé du fœtus, de nombreuses études de séroprévalence réalisées à travers le monde portent sur des échantillons de femmes enceintes ou en âge de procréer. Au Canada, les résultats obtenus par immunofluorescence indirecte auprès de 4136 femmes enceintes de la région de Montréal, Québec, montraient une séroprévalence de 40,8% (Viens et a i , 1977). Plus récemment, une étude suédoise rapportait des taux variant entre 14% et 26% selon la région (Petersson et ai, 2000). Les femmes enceintes du Nunavik sont actuellement les seules au Québec à faire l'objet d'un dépistage systématique, et ce depuis 1982 (comm. pers. J.-F. Proulx).
Symptomatologie chez l'humain
L'infection à T. gondii est souvent asymptomatique, mais peut se manifester par des symptômes tels que fièvre, fatigue, malaises et lymphadénopathie (Jones et ai, 2001). Bien que généralement bénigne chez l'être humain adulte immunocompetent, la maladie peut entraîner de graves conséquences chez le fœtus dont la mère acquiert une première infection durant la grossesse (toxoplasmose congénitale). Chez la femme enceinte, les risques sont plus grands pour l'avortement, la mortinatalité, la naissance prématurée et l'hydrocéphalie lorsque l'infection survient tôt durant la grossesse. Dans le cas d'une infection plus tardive, les séquelles chez l'enfant peuvent se traduire notamment par des troubles de vision (choriorétinite), d'audition et d'apprentissage ainsi que des crises
épileptiformes. Les personnes immunodéprimées sont également plus susceptibles de développer des complications suite à l'infection, telles que la choriorétinite et l'encéphalite avec apparition de lésions focales du système nerveux central. La toxoplasmose est d'ailleurs l'infection neurologique sévère la plus fréquente chez les sidatiques (Jones et a i , 2001).
Facteurs de risque et prévention
Les facteurs de risque associés à la seroconversion au nord demeurent mal définis. Une étude conduite auprès de femmes enceintes du Nunavik (n=22) associait la seroconversion durant la grossesse au dépeçage de certains animaux à fourrure (loup, renard, martre) et à l'ingestion de viande de caribou (McDonald et ai, 1990). De plus, les femmes séropositives étaient plus susceptibles d'avoir consommé de la viande de phoque séchée, du foie de phoque, ou de la viande de caribou crue plus d'une fois par semaine. Des tests réalisés sur la faune du Nunavik ont révélé que 1,5% des échantillons de caribou (n=268), 14% des phoques (n=28), 4,2% des oies (n=24) et 2,5% des ptarmigans (n=79) étaient positifs pour Toxoplasma gondii (Leclair and Doidge, 1998).
Les principales voies de transmission de la toxoplasmose identifiées à ce jour dans la littérature sont la consommation de viande crue, séchée ou insuffisamment cuite, contenant la larve enkystée, de même que l'ingestion d'eau, d'aliments ou d'autres substances contaminés par les oocystes provenant d'un animal infecté (contamination environnementale) (Heymann, 2004; Montoya and Liesenfeld, 2004; Dubey and Jones, 2008). L'infection congénitale est acquise lors du passage du parasite de la mère à son fœtus par voie transplacentaire. Le risque de transmission transplacentaire varie de 10-25% au cours du premier trimestre de grossesse, jusqu'à 60-90% au cours du 3'eme trimestre (Jones et a i , 2001). C'est la forme tachyzoïte du parasite, présente lors de l'infection aigûe, qui est alors responsable de l'infection (Tenter et a i , 2000). La transmission par transfusion de sang ou transplantation d'organes provenant d'une personne infectée est également citée dans la littérature (Heymann, 2004; Dubey and Jones, 2008).
Le fait de cohabiter avec un chat, de consommer de la viande d'agneau, de bœuf ou de gibier insuffisamment cuite, d'être en contact avec de la terre contaminée lors d'activité de
11
jardinage, ou de voyager à l'extérieur de l'Europe, des États-Unis ou du Canada constituent également des facteurs de risque rapportés dans la littérature (Cook et ai, 2000; Boyer et ai, 2005). Compte tenu de la persistance des anticorps dans la circulation sanguine durant de nombreuses années (Heymann, 2004), la séroprévalence chez l'humain tend à augmenter avec l'âge. De manière générale, les variations régionales sont attribuées au climat, aux différences culturelles dans la quantité et le type de viande crue consommée, ainsi qu'à la consommation accrue de viande congelée et de viande provenant d'animaux élevés en milieu fermé (Cook et a i , 2000).
L'eau non filtrée constitue également une route de transmission efficace. Un système de distribution d'eau potable contaminé fut à l'origine d'une large éclosion de cas de toxoplasmose en Colombie-Britannique (Bowie et a i , 1997). Des études récentes révèlent que les oocystes peuvent survivre durant une période prolongée, soit plusieurs mois, dans l'eau douce ou l'eau salée (Lindsay et ai, 2003; Dubey, 2004). La maladie se retrouve chez les mammifères marins, bien que le mode de transmission chez ces animaux soit moins documenté. Certains mollusques seraient capables de concentrer les oocystes dans leurs tissus (Dubey, 2004; Lindsay et a i , 2001 ; Lindsay et ai, 2004).
De manière générale, cuire suffisamment la viande, laver ou peler les fruits et légumes, nettoyer les ustensiles de cuisine à l'eau chaude et au savon, porter des gants et se laver les mains lors du jardinage ou de toute activité impliquant la manipulation de terre ou de sable, ainsi que lors du nettoyage de la litière de chat, sont parmi les principales recommandations émises dans la littérature (Jones et a i , 2001).
1.3.2 Trichinellose Epidemiologic
Documentée au Nunavik depuis les années 1930 (Lantis, 1981), l'agent pathogène responsable de la trichinellose est un nematode intestinal présent chez plusieurs animaux sauvages partout sur le globe : Trichinella sp. On le retrouve particulièrement chez les carnivores et les omnivores tels que l'ours, le coyote, le loup, le renard, le chien, le lynx, le raton laveur et le rat. Toutefois, d'autres mammifères peuvent servir d'hôte au parasite. Le
cheval et le porc sont, par exemple, deux espèces où il a également été identifié (Acha and Szyfres, 1980). Parmi les mammifères marins, le parasite a été détecté chez le morse, le phoque et plus rarement le béluga (Forbes, 2000).
Dans l'Arctique, l'ours polaire, le renard arctique et le chien domestique constituent des réservoirs importants de ce micro-organisme (Forbes, 2000). Au Nunavik, l'infection par les trichines a été démontrée chez des ours polaires (60 %), des renards roux (16%) et arctiques (6 %), des chiens (10 %) et des morses (2 %) (Curtis et a i , 1988). Le parasite T. spiralis var. nativa retrouvé au nord se caractérise par sa résistance au gel prolongé. Pour les Inuit, les mammifères marins (morse, phoque, béluga) et l'ours polaire constituent les principales sources potentielles d'infection par Trichinella sp. Bien que la prévalence élevée chez les ours polaires en ferait le principal réservoir de T. nativa dans l'Arctique (Villeneuve, 2003), la majorité des cas d'infection déclarés au Nunavik seraient associés à la consommation de viande de morse, traditionnellement consommée crue ou fermentée, malgré la faible prévalence chez cette espèce (Proulx et a i , 2002). Les sites de prédilections du parasite sont respectivement la langue pour le morse et le diaphragme, le masséter et la langue chez l'ours (Villeneuve, 2003).
Les données présentées par Curtis et al. (1988) dans les années '80 montraient des taux de séroprévalence pour Trichinella sp. variant entre 2 % pour Kuujjuaq jusqu'à 26% à Salluit, tandis que Tanner et al. (1987) fixaient ce taux à 9% parmi les sérums de patients inuits, toutes communautés confondues. À la même époque, cinq éclosions de trichinellose humaine faisant suite à la consommation de viande de morse ont été documentées au Nunavik (Grondin et ai, 1996). Ces éclosions ont incité les autorités de santé publique à mettre sur pied un système de surveillance pour la viande de cet animal (Proulx et ai, 2002). La présence de ce parasite chez plusieurs espèces consommées traditionnellement par les Inuit invite à la prudence. Même si l'ours s'avère impliqué plus rarement dans la transmission de l'infection au Nunavik, sa viande étant consommée bien cuite, des cas de trichinellose associés à l'ours noir surviennent encore régulièrement (Schellenberg et ai, 2003; Ancellee/o/., 2005).
13
Symptomatologie chez l'humain
Plusieurs des infections humaines sont asymptomatiques. La sévérité est proportionnelle à la dose d'infection, soit le nombre de larves libérées dans le tractus digestif (Acha and Szyfres, 1980). Lors de son passage dans l'intestin, le parasite peut causer de l'inflammation associée à la pénétration de la femelle adulte dans la paroi intestinale et à l'introduction de bactéries et de déchets dans la plaie. Les larves libérées par la femelle vont par la suite causer des dommages aux vaisseaux sanguins lors de leur migration vers les fibres musculaires, provoquant de l'œdème, des hémorragies et l'inflammation de différents organes (Appleyard and Gajadhar, 2000). Elles peuvent infecter de façon transitoire tous les types de cellules, et tuent toute cellule qui n'est pas de type musculaire striée. Elles causent aussi de la douleur en pénétrant les fibres musculaires. Dans les cas les plus sévères, l'infection peut occasionner de l'insuffisance cardiaque ainsi que des atteintes neurologiques et respiratoires (Acha and Szyfres, 1980; Heymann, 2004).
L'infection se distingue en une phase aiguë et une phase chronique. La phase aiguë correspond à la dispersion et à la croissance des larves dans les tissus, à laquelle se surajoute l'action du système immunitaire. Les principaux symptômes sont l'œdème et les hémorragies, ainsi qu'un malaise général accompagné de maux de tête, douleurs abdominales, faiblesse, fièvre, sudation, diarrhée, nausée et vomissements (Centre Canadien Coopératif de Santé de la Faune et Association des Biologistes du Québec, 1995; Heymann, 2004). L'infection peut occasionner des douleurs musculaires généralisées, des atteintes oculaires et des troubles nerveux persistants. La phase aiguë peut elle-même être décrite sous forme de deux phases. La première comporte des symptômes digestifs (diarrhée, nausées, douleurs abdominales, vomissements, malaises généraux et fièvre) et fait suite au passage du parasite dans l'intestin, tandis que la seconde correspond à la migration des larves dans les tissus et se traduit par des symptômes tel que myalgies, faiblesses musculaires, œdème periorbital, conjonctivite, maux de tête, fièvre et urticaire (Capo and Despommier, 1996; Appleyard and Gajadhar, 2000; Villeneuve, 2003). La réponse inflammatoire se traduit par une hyperéosinophilie et une leucocytose. La phase chronique (ou de latence) correspond à l'implantation des larves dans les tissus musculaires et peu de symptômes lui sont associés. Par ailleurs, des épisodes de diarrhée chronique ont été observés parmi des patients inuits de Salluit ayant été infectés par T. nativa (Viallet et
a i , 1986). Cette présentation serait associée à une infection secondaire suivant l'acquisition d'une immunité partielle lors d'expositions précédentes (MacLean et a i , 1992).
Facteurs de risque et prévention
La transmission se fait principalement par consommation de viande crue ou insuffisamment cuite contenant la larve enkystée. La cuisson de la viande à une température de 77°C serait suffisante pour détruire le parasite (MRNF, 2010). Chez l'hôte infecté, la larve est libérée dans le tractus digestif et migre dans les fibres musculaires squelettiques où elle s'enkyste et peut demeurer infectieuse durant plusieurs années. La congélation prolongée n'affecte pas le pouvoir infectant de Trichinella, qui peut survivre jusqu'à 12 mois à une température de -15°C dans la viande d'ours polaire (Eaton, 1979), et jusqu'à 20 mois dans la viande de morse conservée à -20°C (Leclair et a i , 2004). Les trichines peuvent également résister à la putréfaction pendant de nombreux mois et demeurent infectieuses sur les carcasses (Centre Canadien Coopératif de Santé de la Faune et Association des Biologistes du Québec, 1995). Le processus de fermentation impliqué dans la préparation de Yigunak, un mets traditionnel inuit fait à base de morse ou de phoque fermenté, ne suffit pas à détruire le parasite. L'infection ne pouvant être détectée par inspection visuelle, la viande doit être analysée avant consommation. À cet effet, un programme de surveillance a été instauré pour les communautés pratiquant la chasse au morse (Proulx et ai, 2002). Cette infection fait également l'objet du programme de surveillance des maladies à déclaration obligatoire du Québec.
1.3.3 Toxocarose Epidemiologic
La toxocarose est causée par un nematode intestinal du chien (Toxocara canis) ou du chat (Toxocara cati) pouvant mesurer de 10 à 18 cm. Le chien porteur du parasite libère des oeufs dans ses excréments. Ceux-ci peuvent survivre dans l'environnement des mois voire des années, mais ils ne résistent généralement pas à l'hiver arctique. D'autres canidés, tels que le loup et le renard, peuvent jouer le rôle d'hôte définitif et libérer des œufs dans l'environnement. Plusieurs autres animaux, mammifères et oiseaux, peuvent également jouer le rôle d'hôte paraténique et contenir des larves enkystées dans leurs tissus (muscles,
15
foie, cerveau) (Heymann, 2004).
Au Canada et aux États-Unis, des taux de séroprévalence inférieurs à 10% ont été observés chez l'enfant comme chez l'adulte parmi la population générale (Barriga, 1988). Une étude plus récente évaluait à 13,9% la séroprévalence de Toxocara spp. ajustée pour l'âge parmi la population américaine de 6 ans et plus (Won et al. 2008). Cependant, la littérature rapporte des taux beaucoup plus élevés en Amérique du Sud, avec une séroprévalence estimée à 31,6% parmi une population rurale du sud de l'Argentine (Filiaux et a i , 2007), tandis qu'au Brésil on trouvait des taux estimés à 24% pour un échantillon de la population générale vivant en périphérie de la municipalité de Campinas (Anaruma Filho et ai, 2002). Cette valeur atteignait 55% parmi une population pédiatrique des environs de Sâo Polo (Figueiredo et a i , 2005).
Une enquête réalisée en 1986 auprès de la population du Nunavik révélait un taux de 11% d'échantillons positifs pour T. canis (Tanner et a i , 1987). Parmi les sérums de patients de Salluit et Kuujjuaq, les taux de séroprévalence étaient respectivement de 7% et 20% (Curtis et a i , 1988). Néanmoins, cette étude rapportait l'absence du parasite parmi les chiens des deux communautés. Une réaction croisée avec les anticorps dirigés contre un autre nematode pourrait en partie être responsable des sérologies positives obtenues dans le cadre des travaux mentionnés précédemment. Par ailleurs, Desrochers et Curtis (1987) ont décelé la présence de Toxascaris leonina chez 40% des chiens testés à Kuujjuaq, un parasite qui pourrait être responsable du larva migrans viscéral, un syndrome également associé à l'infection par T. canis.
Il semble de manière générale que les études de séroprévalence tendent à sous-évaluer le nombre d'individus et d'animaux ayant déjà été infectés par T. canis puisque la présence des anticorps tend à s'estomper avec le temps. De plus, la présence d'œufs infectieux chez les chiens âgés de plus de six mois semble plus rare que chez les jeunes chiots (Unruh et ai, 1973). La persistance de quantités décelables d'immunoglobulines dans le sang serait notamment le fait d'infections répétées ou de la réactivation de larves enkystées (Villeneuve, 2003).
Symptomatologie chez l'humain
Chez l'humain, la toxocarose se présente sous forme de trois différents syndromes selon le nombre de larves ingérées, leur localisation dans l'organisme et la réaction immunitaire de l'hôte : larva migrans viscéral (LMV), larva migrans oculaire (LMO) et la toxocarose cachée (Kerr-Muir, 1994). La majorité des infections à LMV surviennent chez les jeunes enfants et sont souvent associées à une histoire de pica (ou géophagie) et de contacts avec des chiots (Acha and Szyfres, 1980; Magnaval et a i , 2001). Elles se manifestent le plus souvent par des symptômes reliés à la migration des larves au foie et aux poumons, tels que la toux, les râles, la fièvre, les malaises, la douleur abdominale, l'irritabilité et la perte de poids (Heymann, 2004). Le foie est l'organe le plus souvent impliqué et l'hépatomégalie, de même que la splénomégalie, peut être observée. Des atteintes cutanées telles que l'urticaire chronique, le prurit, l'eczéma, la dyshidrose et les vascularites ont également été rapportées (Pelloux and Faure, 2004). Des atteintes neurologiques ont été observées mais demeurent beaucoup plus rares (Magnaval et a i , 2001). L'éosinophilie, souvent accompagnée d'une leucocytose, est habituelle (Barriga, 1988). Le syndrome de larva migrans oculaire (LMO) survient habituellement chez des patients plus âgés et est causé par l'infection de l'œil par le parasite. Il se présente généralement de manière unilatérale sous la forme d'un granulome inflammatoire accompagné de troubles de vision, sans signes ou symptômes systémiques apparents (Despommier, 2003). La toxocarose cachée se traduit pour sa part par des manifestations cliniques plus subtiles et ferait suite à une exposition prolongée aux larves migratrices du parasite (Despommier, 2003).
Facteurs de risque et prévention
La transmission de cette infection se fait par ingestion d'œufs infectieux présents dans le sol ou sur des aliments contaminés (Villeneuve, 2003). Plus rarement, la consommation de larves tissulaires présentes dans le foie ou les abats crus ou insuffisamment cuits d'animaux infectés peut aussi transmettre le parasite (Glickman and Schantz, 1981; Magnaval et a i , 2001). Pour T. canis, les aliments insuffisamment cuits ou mal nettoyés, de même que les objets souillés portés à la bouche constituent le principal mode de contamination à partir de l'environnement. Les jeunes enfants forment un groupe particulièrement vulnérable compte tenu de leur propension à placer des objets dans leur bouche et de leur exposition aux
17
animaux et à la terre lorsqu'ils s'amusent à l'extérieur. Parmi les mesures préventives privilégiées, on recommande de vermifuger les chiens régulièrement et d'éviter que les jeunes enfants entrent en contact avec leurs excréments (Grondin et a i , 1996). Une bonne
hygiène personnelle et des mains est également de mise.
1.3.4 Échinococcose Épidémiologie
L'échinococcose, ou maladie hydatique, est causée par un cestode des canidés (Echinococcus granulosus) dont il existe deux biotypes : européen et nordique. Le cycle infectieux associant l'orignal, le caribou avec le loup constituerait le principal réservoir de ce parasite dans l'Arctique (Rausch, 2003). Par contre, d'autres mammifères partageant le territoire de ces animaux peuvent être parasités, comme le cerf de Virginie et le wapiti par exemple, et d'autres prédateurs et canidés peuvent jouer le rôle d'hôte définitif. C'est le cas notamment du chien domestique, du coyote, du renard, du lynx, de l'ours noir et de l'ours brun (Villeneuve, 2003).
Chez l'humain, qui constitue un hôte accidentel du parasite, la prévalence est élevée en certains endroits d'Europe, d'Asie, d'Afrique, d'Australie et d'Amérique du Sud (Eckert and Deplazes, 2004). Il est toutefois absent de certaines régions insulaires telles que l'Islande et le Groenland et sa présence n'est que rarement rapportée dans certaines parties d'Europe et de l'Amérique du Nord et centrale, de même que dans la région Pacifique et dans les Caraïbes (Eckert and Deplazes, 2004). E. granulosus est présent au Canada et en Alaska avec prédominance du cycle sylvatique (forestier) (Torgerson and Budke, 2003). Au Nunavik, des études réalisées dans les années '80 nous rapportent des taux de séroprévalence humaine variant entre 1% et 4% (Tanner et ai, 1987; Curtis et a i , 1988).
Symptomatologie chez l'humain
Bien qu'asymptomatique dans plus de la moitié des cas, l'échinococcose primaire se présente généralement sous la forme d'un kyste unique pouvant se développer au sein de différents organes (Torgerson and Budke, 2003). Ses manifestations cliniques s'apparentent à celles d'une lésion occupant de l'espace. La maladie affecte le plus souvent le foie et les
poumons (Heymann, 2004). Les kystes hydatiques hépatiques sont communs chez les adultes, tandis que chez les enfants, les poumons sont plus souvent touchés (Kanat et a i , 2004). Cependant, comme pour les autres mammifères, les kystes peuvent être retrouvés dans plusieurs autres organes et tissus (Acha and Szyfres, 1980). Les cas d'échinococcose secondaire font suite à la rupture d'un kyste causant la dissémination du parasite, le plus souvent à l'intérieur de la cavité abdominale (Torgerson and Budke, 2003).
Le biotype nordique semble bénin chez l'homme. Seulement 5% des personnes atteintes présentent des signes cliniques pouvant se limiter à des douleurs thoraciques, de l'hémoptysie et des expectorations liquides ou infectées (Villeneuve, 2003). Les guérisons spontanées sont également possibles, d'où potentiellement le faible nombre de cas rapportés. De manière générale, la séroprévalence des anticorps contre ce parasite tend également à augmenter avec l'âge.
Facteurs de risque et prévention
L'échinococcose se transmet surtout par l'ingestion d'oocystes libérés par les canidés (chien, loup, coyote, etc.). Ces oocystes se retrouvent dans le sol, à la surface des végétaux ou directement sur les animaux. L'homme s'infecte essentiellement par l'ingestion d'œufs du parasite, soit par contact avec des chiens parasités, par manipulation de carcasses de loup ou par ingestion de végétaux contaminés (herbes, fruits, légumes). Les enfants forment un groupe particulièrement à risque. En ce qui concerne la présence de kystes hydatiques sur le foie ou les poumons des herbivores, les hôtes intermédiaires d'E. granulosus, ils seraient généralement évités et ne seraient donc pas impliqués dans la transmission du parasite à l'humain (Curtis et a i , 1988). Comme pour T. canis, une bonne hygiène lors de la manipulation des aliments ou des carcasses d'animaux, de même que le lavage des mains constituent des mesures pouvant réduire le risque de contamination (Heymann, 2004).
1.3.5 Brucellose Epidemiologic
L'agent pathogène responsable de la brucellose est une bactérie Gram", Brucella sp. Ce coccobacille est présent essentiellement chez les mammifères, et particulièrement chez les
19
ruminants et les suidés. Au nord, les principaux vecteurs de cette maladie sont le caribou et le bœuf musqué, ainsi que les renards roux et arctique, le loup, le chien et l'ours qui constituent des hôtes potentiels. Le phoque (commun, annelé et du Groenland) et d'autres mammifères marins comme le morse, le béluga et le dauphin sont également des hôtes reconnus de Brucella sp. (Forbes et a i , 2000).
L'infection par Brucella sp. est relativement répandue parmi les troupeaux de caribous du nord canadien (O'Reilly and Forbes, 1994), ainsi que chez plusieurs espèces de mammifères marins (Forbes et a i , 2000; Nielsen et a i , 2001). Les cas humains de brucellose dans l'Arctique canadien seraient principalement associés à B. suis biovar 4 du caribou, qui en constitue l'hôte principal (MSSS, 1998). Au Nunavut, 90 cas de brucellose ont été rapportés depuis 1950, notamment dans les régions de Baffin et Qitiqmiut (Grondin et a i , 1996), et deux cas sont survenus en 2001 (ASPC, 2006). Néanmoins, un seul cas de brucellose humaine a été déclaré au système des MADO du Nunavik depuis 1990 (RRSSSN, 2003). Chez les mammifères terrestres, en particulier le caribou, la distribution de cette bactérie semble limitée aux territoires situés à l'ouest de la Baie d'Hudson, tandis que le rôle des mammifères marins dans la transmission de l'infection à l'homme n'est pas encore bien défini. Malgré les nombreuses opportunités d'exposition humaine dans le cas des phoques, les biotypes de Brucella sp. retrouvés chez les mammifères marins diffèrent de ceux présents chez les mammifères terrestres et, à l'exception d'un cas en laboratoire, aucun cas d'infection humaine par cet organisme n'a été rapporté à ce jour. Lors d'une récente étude (Nielsen et a i , 2001), aucun des échantillons prélevés chez des morses et des phoques annelés du Nunavik ne s'était révélé positif, mais il semble que la bactérie était présente chez les bélugas. La brucellose est considérée comme éradiquée de certaines populations d'animaux d'élevage dans plusieurs pays industrialisés, mais malgré cela des cas continuent d'être déclarés (Maurin, 2005). La majorité des cas rapportés dans la littérature sont associés aux souches présentes chez les animaux d'élevage (bétail, porc, chèvre, mouton) (Godfroid et a i , 2005; Maurin, 2005). On croit que l'infection chez l'animal serait principalement associée au contact avec les produits utérins infectieux accompagnant les fœtus avortés. L'infection est la cause d'avortements spontanés, de stérilité et d'autres problèmes reliés à la reproduction chez les animaux (caribous, ruminants, porc, chien, etc.) pouvant réduire le succès reproducteur de la population
touchée.
Symptomatologie chez l'humain
Le premier stade de l'infection comporte une à trois semaines d'incubation. Des manifestations non spécifiques peuvent apparaître à plus ou moins long terme telles que fièvre ondulante (continue, intermittente ou irrégulière), maux de tête, frissonnements, sueurs, faiblesse, douleurs abdominales, malaise général, perte de poids et d'appétit, éruptions cutanées, arthralgies et myalgies (Heymann, 2004). La brucellose peut entraîner des complications dans à peu près tous les organes du corps : problèmes gastro-intestinaux et du système nerveux, hépatite, ostéomyélite (Dieterich, 1981), splénomégalie, ainsi qu'atteintes au niveau ostéo-articulaire, pulmonaire, cardiovasculaire et urogénitale (Young, 1995). Il importe de noter que l'infection peut souvent passer inaperçue, ses multiples symptômes peu spécifiques rendant le diagnostic plus difficile (Heymann, 2004). Facteurs de risque et prévention
L'infection est principalement transmise à l'humain lors de la consommation de viande crue contaminée, de lait cru ou de produits laitiers non pasteurisés (vache, chèvre, mouton) (Godfroid et a i , 2005). Cependant, le contact direct entre une lésion cutanée et la chair ou les parties génitales d'un animal infecté lors de la préparation du gibier peut servir de route de transmission, tout comme le contact d'une muqueuse ou de la conjonctive avec un animal infecté, sa carcasse ou ses sécrétions (urine, sang, lymphe, ainsi que produits associés au système reproducteur tels que sécrétions génitales, fœtus avortés, placentas). Finalement, l'inhalation d'aérosols contaminés peut aussi être à l'origine d'une infection (Heymann, 2004). La congélation de la viande ne constitue pas un moyen efficace de tuer l'organisme (O'Reilly and Forbes, 1994). La brucellose fait partie des maladies à déclaration obligatoire au Québec.
1.3.6 Tularémie Epidemiologic
La tularémie est causée par une bactérie Gram", Francisella tularensis, retrouvée principalement chez les léporidés (lièvres et lapins) et les rongeurs (rats musqués, castors,
21
écureuil, etc.), mais pouvant aussi infecter d'autres mammifères (Dieterich, 1981). Cette maladie présente deux biovars : tularensis (A) et paleartica (B). Les rongeurs, particulièrement le rat musqué et le lièvre, ainsi que les arthropodes sont principalement impliqués dans la transmission de F. tularensis à l'homme. Au Canada, le rat musqué serait un vecteur important de la maladie (Ford-Jones et a i , 1982; Martin et ai, 1982; Lévesque et a i , 1995), tandis qu'aux États-Unis le lièvre et la tique constituent les principales sources d'infection (CDC, 2002). D'autres arthropodes, tels que les moustiques, peuvent servir de vecteur à la maladie. On trouve également l'organisme dans les eaux naturelles.
Plusieurs auteurs ont étudié la tularémie chez les populations autochtones du Nord canadien et de l'Alaska (Wood, 1951; Greenberg et ai, 1958; Philip et a i , 1962; Martin et ai, 1982). Chez les Inuit du Nunavik, une séroprévalence de 29% a été rapportée par Greenberg et al. avec un titre d'agglutination de 1:8 et plus comme seuil diagnostic. Plus récemment, Lévesque et al. (1995) ont obtenu une séroprévalence de 2,4% pour un titre supérieur ou égal à 1:20 chez des trappeurs de la région de Québec. Chez des chasseurs et trappeurs Cris du Québec, ce taux s'élevait à 28,3% pour un seuil diagnostique équivalent (Lévesque et a i , 2007). Toutefois, peu de symptômes ont été observés chez les populations nordiques, indiquant que l'infection pourrait être causée par la souche moins virulente de la bactérie (type B) à ces latitudes (Philip et ai, 1962; Martin et a i , 1982). Ceci pourrait expliquer l'absence de cas déclarés au système des maladies à déclaration obligatoire (MADO) au Nunavik.
Symptomatologie chez l'humain
Les manifestations cliniques varient en fonction de la voie d'infection et de la virulence de la souche. Il en existe six formes différentes : ulcéroglandulaire, glandulaire, oculoglandulaire, pneumonique, typhoïdale et oropharyngée (Feldman, 2003). Néanmoins, l'infection par F. tularensis est généralement caractérisée par une ulcération locale de la peau, souvent sur la main, suivie d'une inflammation des ganglions lymphatiques situés près du site d'exposition. L'infection est associée à de la fièvre et à des symptômes généraux ressemblant à ceux de l'influenza tels que frissonnement, myalgies, maux de tête, fatigue et nausées (Heymann, 2004). Une infection par inhalation peut causer un syndrome septicémique primaire ou engendrer une pneumonie. La pneumonie et la septicémie sont
des conséquences cliniques pouvant s'avérer fatale si elles ne sont pas traitées adéquatement. En cas d'ingestion, la bactérie peut occasionner des douleurs intestinales, de la diarrhée ou des vomissements ainsi qu'une inflammation du pharynx. Par contre, une infection par une souche moins virulente de la bactérie peut s'avérer asymptomatique (Morton, 1981).
Facteurs de risque et prévention
La transmission de la tularémie se fait principalement par contact direct avec un animal infecté, son sang, ses sécrétions ou sa carcasse, tandis que les piqûres d'insecte (tiques, mouches et moustiques) jouent un rôle plus limité. Parmi les autres voies d'acquisition de la tularémie, notons l'ingestion d'eau contaminée, la consommation de viande insuffisamment cuite provenant d'un animal infecté et l'inhalation d'aérosols contaminés sous forme de particules ou de poussière. Plus rarement, un individu peut acquérir l'infection suite à la morsure d'un animal dont la bouche est contaminée parce qu'il a mangé un animal infecté (Feldman, 2003). Il est à noter que les animaux malades peuvent parfois adopter des comportements étranges, comme avoir de la difficulté à courir, avoir une démarche lente ou inhabituelle, ou se laisser facilement capturer. Ils peuvent également arborer des petites taches blanches sur le foie, la rate, les poumons et les reins, ou encore présenter une hypertrophie du foie et de la rate et des hémorragies au niveau rénal et pulmonaire (MRNF, 2010).
Dans le cas de la tularémie, il est donc préférable de s'abstenir de consommer la viande provenant d'un animal dont le comportement a pu sembler étrange, ou dont la chair présentait un aspect inhabituel. Il est également recommandé de se prémunir contre les morsures de tiques ou d'autres arthropodes, de même que d'éviter le contact avec de l'eau non traitée dans les zones endémiques. Enfin, le port de gants lors de la manipulation des carcasses, particulièrement lorsqu'il s'agit de rongeurs ou de léporidés, ainsi que la cuisson suffisante de la viande provenant de ces animaux sont fortement conseillés (Heymann, 2004). La tularémie fait partie du registre des maladies à déclaration obligatoire du Québec et chaque cas diagnostiqué doit donc être rapporté aux autorités de santé publique.
23
1.3.7 Fièvre Q
Epidemiologic
Coxiella burnetii, une très petite bactérie de la famille des rickettsies, est responsable de la fièvre Q. Cette zoonose est considérée en émergence au Québec. En effet, le nombre de cas déclarés annuellement a augmenté de manière importante depuis 1990, atteignant un sommet de 110 cas déclarés en 1999 (MSSS, 2001). Les ovins et les bovins constituent le principal réservoir de cette bactérie intracellulaire obligatoire. Elle est présente dans l'urine, les excréments, le lait ainsi que les tissus placentaires et autres produits associés à la conception, qui sont très infectieux. Bien que les ruminants domestiques soient généralement reconnus comme les hôtes principaux, le chat ainsi que plusieurs mammifères (chien, rongeurs), oiseaux et arthropodes, dont les tiques, peuvent être porteurs de la bactérie. La prévalence chez l'animal serait en augmentation depuis les années 60 (MSSS,
1998). Cependant, la non spécificité des symptômes chez l'humain en fait une maladie sous diagnostiquée parmi la population.
L'infection par C. burnetii a été documentée chez des patients de la région de Trois-Rivières (Goyette et ai, 1994) ainsi qu'auprès d'un groupe de trappeurs en bonne santé de la région de Québec, parmi lesquels la séroprévalence s'élevait à 15,1% (Lévesque et ai, 1995). Ce taux atteignait 18% lors d'une étude réalisée auprès de chasseurs et trappeurs Cris (Lévesque et ai, 2007). La fièvre Q a été décrite dans plusieurs pays industrialisés (France, Royaume-Uni, Espagne, Allemagne, Suisse, Grèce, Italie, Israël, États-Unis, Russie, Japon), mais ne fait pas l'objet d'une surveillance systématique dans bon nombre d'entre eux. Toutefois, des taux de séroprévalence atteignant 30% ont été décrits dans des populations rurales de France (Maurin and Raoult, 1999).
Symptomatologie chez l'humain
Bien que certains individus infectés demeurent asymptomatiques, la symptomatologie chez l'humain durant l'épisode aigu comprend habituellement une fièvre élevée et prolongée accompagnée de maux de tête, de myalgies, de fatigue, de frissons, de sudations, d'anorexie et d'autres symptômes non spécifiques d'allure grippal (Maurin and Raoult, 1999; Heymann, 2004). La pneumonie est fréquente et peut se manifester par de la toux et des
douleurs à la poitrine. Selon Marrie et al. (1985), la fièvre Q pourrait constituer une cause importante de pneumonie atypique. L'hépatite et l'hépatosplénomégalie sont aussi rapportées dans l'épisode aigu. La maladie peut également se manifester sous forme chronique, pour laquelle l'endocardite et l'hépatite sont les manifestations les plus fréquentes (McQuiston et a i , 2002; Arricau-Bouvery and Rodolakis, 2005). Chez la femme enceinte, l'infection par la bactérie est associée à un risque accru d'avortement spontané, d'accouchement prématuré et de mortinaissance (Raoult et a i , 2002; Langley et ai, 2003) [RAIZO, 2001 #80].
Facteurs de risque et prévention
Chez l'humain, l'infection est généralement transmise par inhalation d'aérosols contaminés libérés par des matières provenant d'animaux infectés (produits de conception, tissus, fourrure, laine, viande, fumier, paille, poussière). L'ingestion de produits contaminés, comme le lait cru ou les produits laitiers non pasteurisés, de même que les piqûres d'insectes, dont les tiques, peuvent occasionnellement transmettre l'infection. De plus, la capacité de la bactérie à sporuler lui confère une grande résistance aux désinfectants. On recommande de manière générale d'éviter le contact direct avec toute substance potentiellement contaminée, particulièrement pour les travailleurs à risque. Les instruments en contact avec des matières et fluides provenant d'un animal infecté doivent être désinfectés, et ces derniers doivent être disposés de manière sécuritaire (Heymann, 2004). Cette infection fait partie du registre des maladies à déclaration obligatoire du Québec et doit être rapportée aux autorités de santé publique lorsque diagnostiquée.
1.3.8 Leptospirose Epidemiologic
Considérée comme sous-diagnostiquée dans la population générale (Lévesque et a i , 1995), la leptospirose est causée par une bactérie Gram" retrouvée surtout chez les rongeurs : Leptospira sp. Certains herbivores et insectivores peuvent être des porteurs rénaux et constituent un véritable réservoir pour la maladie. Plusieurs animaux domestiques et sauvages (chien, porc, bétail, rat, renard, cerf, mammifères marins, reptiles, etc.) peuvent également excréter cette bactérie dans leur urine (Plank and Dean, 2000; Heymann, 2004).