Étude des projections axonales sérotoninergiques dans
un modèle murin de la maladie de Parkinson et des
dyskinésies induites par la lévodopa
Mémoire
Charles-Étienne Couture
Maîtrise en neurobiologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Charles-Étienne Couture, 2016
iii
Résumé
OBJECTIFS: La libération de dopamine par les afférences à sérotonine (5-HT) du striatum constitue un déterminant pré-synaptique important des dyskinésies induites par la L-Dopa (DILs), un effet délétère du traitement pharmacologique de la maladie de Parkinson. En effet, les axones 5-HT seraient en mesure de libérer de façon non-physiologique de la dopamine lorsque la L-Dopa est administrée au patient, contribuant ainsi à l’expression des DILs. Certaines afférences striatales 5-HT contiennent un transporteur vésiculaire du glutamate (VGluT3) et nous croyons que sa présence puisse avoir un effet synergique sur la libération de dopamine. L’objectif général de ce mémoire est donc d’évaluer la quantité de VGluT3 présent au sein des axones 5-HT et de mesurer son implication dans l’expression des DILs. MÉTHODES : Dix-huit souris C57/Bl6 ont été séparées en trois groupes expérimentaux. Douze souris ont reçu une injection intracérébrale de 6-hydroxydopamine (6-OHDA) dans le faisceau prosencéphalique médian afin de léser les afférences dopaminergiques du striatum. Six souris lésées ont reçu des injections systémiques de L-Dopa (12 jours, 1 fois/jour). Six autres souris ont reçu une injection intracérébrale du véhicule afin de servir de contrôle. La sévérité des mouvements involontaires anormaux induits par la L-Dopa (équivalent des dyskinésies) a été quantifiée selon une échelle reconnue. Un double marquage en immunofluorescence pour le transporteur membranaire de la 5-HT (SERT) et le VGluT3 a permis d’évaluer la densité des varicosités SERT+ et SERT+/VGluT3+ dans le striatum dorsal et de comparer ces données entre les trois groupes expérimentaux. RÉSULTATS: Chez les trois groupes de souris, un faible pourcentage des varicosités axonales 5-HT sont également VGluT3+. Ces varicosités doublement marquées sont souvent retrouvées sur une même branche axonale. Aucune différence significative n’a été observée entre les trois groupes expérimentaux en ce qui a trait à la proportion de varicosités SERT+ qui contiennent le VGluT3+. CONCLUSION: Nos données expérimentales ne nous permettent pas de conclure que la densité des varicosités axonales SERT+ ou SERT+/VGluT3+ au sein du striatum dorsal varie en fonction de la sévérité des mouvements involontaires anormaux induits par l’administration de L-Dopa.
v
Abstract
Objectives: The release of dopamine by serotonin (5-HT) afferent projections of the striatum is known to be a major pre-synaptic determinant of L-Dopa-induced dyskinesia, a debilitating side effect of the pharmacological treatment of the Parkinson’s disease. The fact that 5-HT axons are able to release dopamine in a non-physiological manner following the administration of L-Dopa might lead to the expression of dyskinesias. Some striatal 5-HT axons are known to contain VGluT3 and we hypothesize that this vesicular glutamate transporter has a synergic effect on dopamine packaging into synaptic vesicles and its release. The main goal of this research project is to measure VGluT3 in 5-HT striatal afferent projections and to evaluate its role in the expression of dyskinesias. Methods: Eighteen C57Bl6 mice were divided in 3 experimental groups. Twelve mice received intracerebral injection of 6-hydroxydopamine (6-OHDA) in the medial forebrain bundle to lesion the striatal dopaminergic afferent projections. Systematic daily injections of L-Dopa (during 12 days) were administrated in 6 of these 6-OHDA-lesioned mice. The other 6 mice received injections of the vehicle only and served as controls. The abnormal involuntary movements (the equivalent of dyskinesias in primates) were scored using a well-known and widely used motor scale. Double immunofluorescence for the 5-HT membrane transporter (SERT) and VGluT3 was performed to evaluate the density of immunolabeled axon varicosities and assess statistical differences between the 3 experimental groups. Results: Among the 3 groups, only a small percentage of 5-HT axonal varicosities express VGluT3 and these doubly labeled varicosities often occur along the same axonal branch. There is no significant difference between the 3 experimental groups regarding the density of SERT or SERT/VGluT3 axon varicosities in the dorsal striatum. Conclusion: Our data indicate that the density of SERT or SERT/VGluT3 immunolabeled axon varicosities in the dorsal striatum is not correlated with the severity or the expression of abnormal involuntary movement following L-Dopa administration
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... xi
Liste des abréviations ... xiii
Remerciements ... xv
Introduction ... 1
1.1 Historique ... 1
1.2 Les noyaux du raphé ... 1
1.3 Le noyau raphé dorsal ... 2
1.3.1 Contenu chimique des neurones du raphé dorsal chez la souris ... 4
1.3.2 La sérotonine ... 5
1.3.3 Le glutamate ... 7
1.4 Projections sérotoninergiques ascendantes en provenance du noyau raphé dorsal ... 10
1.4.1 L’innervation sérotoninergique des ganglions de la base ... 10
1.4.1 Importance de la collatéralisation des axones sérotoninergiques ... 11
1.5 La maladie de Parkinson et l’implication de la sérotonine ... 13
1.5.1 Les symptômes de la maladie de Parkinson ... 13
1.5.2 Les caractéristiques neuropathologiques de la maladie de Parkinson ... 14
1.5.5 Les modèles animaux de la maladie de Parkinson ... 15
1.5.6 Les traitements pharmacologiques de la maladie de Parkinson ... 16
1.5.7 Les dyskinésies induites par la L-Dopa ... 17
1.5.8 L’implication de la sérotonine dans les dyskinésies induites par la L-Dopa ... 18
1.6 Objectifs du projet ... 19
2. Matériel et Méthode ... 19
2.1 Les animaux ... 19
2.2 Injections unilatérales de 6-hydroxydopamine (6-OHDA) ... 20
2.3 Traitement à la L-Dopa ... 20
2.4 Traitement du tissu ... 21
2.5 Immunomarquage TpH2 / VGlut3 ... 21
2.6 Immunomarquage SERT / VGluT3 ... 22
2.8 Immunohistochimie TH ... 23
2.9 Stéréologie ... 24
2.11 Statistiques ... 26
viii
3.1-Observations générales ... 27
3.2 Description du contenu neurochimique des corps cellulaires formant les noyaux du raphé dorsal et médian ... 27
3.3 Distribution régionale des varicosités axonales SERT et VGluT3 en condition normale ... 31
3.4 Validation du modèle parkinsonien et dyskinétique ... 36
3.5 Densité des varicosités axonales SERT+ et SERT+/VGluT3+ dans le striatum dorsal chez la souris parkinsonienne et dyskinétique ... 36
4. Discussion ... 40
4.1 Description de la distribution de SERT et de VGluT3 ... 40
4.2 L’innervation SERT+/VGlut3+ du système ventriculaire ... 41
4.3 Quantification stéréologique des varicosités axonales en contexte parkinsonien et dyskinétique ... 42
4.4 Considérations techniques ... 43
4.5 L’impact du nombre de varicosités sérotoninergiques riches en VGluT3 sur la sévérité des mouvements involontaires anormaux induits par la L-Dopa ... 43
4.6 Limites du modèle murin parkinsonien ... 45
5. Conclusion ... 47
ix
Liste des tableaux
Tableau 1 Distribution régionale du VGluT3, du SERT ainsi que de leur co-localisation dans les varicosités axonales. ... 33
xi
Liste des figures
Figure 1: Distribution des neurones 5-HT dans le tronc cérébral humain. ... 3
Figure 2: Sections transversales des noyaux du raphé dorsal. ... 6
Figure 3: Mécanismes fonctionnels des transporteurs vésiculaires et de leur synergie moléculaire ... 8
Figure 4: Conceptualisation du protocole expérimental ... 25
Figure 5: Sections transversales des noyaux raphé dorsal et médian immunomarquées pour la TpH et le VGluT3. ... 29
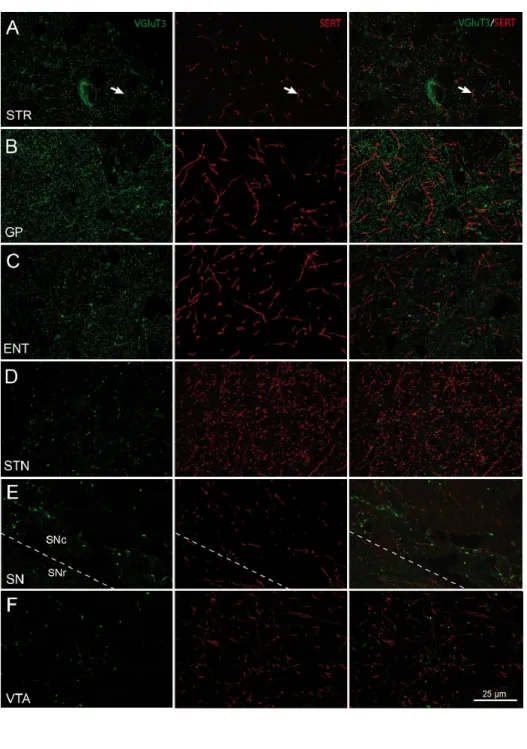
Figure 7: Image confocale à fort grossissement montrant la distribution du VGluT3 et des axones SERT-immunomarqués dans les principales composantes associées aux ganglions de la base. ... 34
Figure 8: Image confocale à fort grossissement du marquage VGluT3 et SERT retrouvé dans certaines structures associées au système limbique chez la souris. ... 35
Figure 9: Validation du protocole expérimental ainsi que du modèle animal ... 37
Figure 10: Histogramme comparant la densité des varicositées axonales SERT et SERT/VGluT3 ainsi que le nombre de varicosités axonales par mm d'axone pour le groupe sham, 6-OHDA et L-DOPA. ... 39
xiii
Liste des abréviations
+ Immunopositif
- Immunonégatif
5-HT Sérotonine
6-OHDA 6-hydroxydopamine
AIMs Mouvements involontaires anormaux D1 Récepteur dopaminergique 1
DRc Sous-noyau caudal du raphé dorsal DRd Sous-noyau dorsal du raphé dorsal
DRif Sous-noyau interfasciculaire du raphé dorsal DRv Sous-noyau ventral du raphé dorsal
DRvl Sous-noyaux ventrolatéraux du raphé dorsal GB Ganglions de la base
L-Dopa 3,4-dihydroxyphénylalanine DILs Dyskinésies induite par la L-Dopa MFB Faisceau prosencéphalique médian MP Maladie de Parkinson
NRD Noyau raphé dorsal NRM Noyau raphé médian
SERT Transporteur sérotoninergique SN Substance noire
SNc Substance noire compacte SNr Substance noire réticulée
VGluT1 Transporteur vésiculaire du glutamate 1 VGluT2 Transporteur vésiculaire du glutamate 2 VGluT3 Transporteur vésiculaire du glutamate 3 VGLUT3 Gène du transporteur vésiculaire du glutamate 3 VMAT2 Transporteur vésiculaire des monoamines 2
xv
Remerciements
Mes premiers remerciements vont à tous ceux qui ont rendu possible la réalisation de ce projet.
Je tiens à remercier tout spécialement mon directeur de recherche Dr Martin Parent pour m’avoir accordé l’opportunité d’intégrer son laboratoire et pour avoir partagé avec moi sa passion de la neuroanatomie et de la recherche fondamentale.
J’aimerais également remercier Marie-Josée Wallman, la professionnelle de recherche de notre laboratoire, pour sa gentillesse et son support technique, éducatif et humain tout au long de la réalisation de ce projet. Le laboratoire n’aurait pas été le même sans mes estimés collègues Lara Eid, Dave Gagnon, Sarah Petryszyn et Laurent Goetz qui m’ont aidé à cheminer dans le processus de la réalisation de ce mémoire. C’est grâce à vous s’il faisait si bon venir travailler à compter des varicosités!
Je remercie particulièrement les docteurs André Parent et Martin Lévesque pour avoir accepté de faire partie du comité chargé de l’évaluation de ce mémoire.
Ces remerciements ne seraient pas complets sans prendre le temps de remercier toute la famille et les amis qui ont été d’un grand support. Je tiens à remercier particulièrement ma conjointe Laurence Plouffe qui a accepté que je parte réaliser mon rêve de faire de la recherche et qui a dû endurer la distance. Elle fut également d’une aide précieuse lors de la rédaction du mémoire. Encore Merci.
1
Introduction
1.1 Historique
Découverte dans les années 1930 (Vialli and Erspamer, 1937), la sérotonine ou 5-hydroxytryptamine (5-HT) fut d’abord nommée entéramine. En effet, on s’est aperçu que l’extrait de cellules entérochromaffines contenant de l’entéramine pouvait induire des contractions intestinales. Parallèlement à l’expérience sur l’entéramine, en 1949, on mentionne le terme sérotonine (5-HT) suite à la découverte d’une molécule vasoconstrictrice (Rapport et al., 1949). Toutefois, ce n’est qu’en 1952 que l’entéramine et la 5-HT furent reconnues comme étant une seule et même molécule (Erspamer, 1952). La première démonstration de la présence de 5-HT dans le cerveau fut rapportée un an plus tard (Twarog et Page, 1953 cité dans Woolley & Shaw, 1954) et Woolley & Shaw (1954) furent les premiers à suggérer l’implication de la 5-HT dans certaines maladies mentales. Aujourd’hui, la 5-HT est reconnue comme un neurotransmetteur majeur du système nerveux central jouant, entre autres, un rôle crucial dans les processus impliquant la modulation de l’humeur, la perception sensorielle, la récompense, la colère, l’agression, l’appétit, la mémoire, la sexualité, l’attention et la locomotion (Berger & al., 2009).
1.2 Les noyaux du raphé
Au début des années 1960, Falck et Hillarp découvrent que l’imprégnation du tissu cérébral par des vapeurs de paraformaldéhyde transforme les monoamines contenues dans ce tissu en dérivés fluorescents (Falck et al., 1962). Cette méthode histochimique relativement simple a permis à Dalhstrom et Fuxe (1964) de démontrer, et ce pour la première fois, l’existence, dans le cerveau des mammifères, de neurones contenant de la 5-HT ainsi que d’autres neurones riches en dopamine ou en noradrénaline. Ces auteurs ont donc pu décrire en détails les caractéristiques morphologiques ainsi que la distribution des différentes populations neuronales 5-HT. Celles-ci forment une colonne cellulaire plus ou moins continue qui s’étend le long de la ligne médiane sur les trois étages du tronc cérébral soit le mésencéphale, le pont (ou protubérance) et le bulbe rachidien (Fig.1). Les neurones 5-HT peuvent être classés en 9 entités distinctes chez les mammifères (désignées B1 à B9 par Dahlström & Fuxe, 1964), mais que l’on fusionne généralement en un groupe rostral et un groupe caudal dont l’organisation hodologique diffère fondamentalement (Felten and Sladek, 1983). Cette distinction s’appuie également sur le fait que, durant le développement embryonnaire, ces deux grands
2
groupes de neurones 5-HT se développent suite à l’expression différentielle de gènes selon leur position sur l’axe rostro-caudal (Li et al., 2001).
Situé entre le bulbe rachidien et la partie caudale du pont, le groupe caudal est constitué des noyaux raphés obscurus, pallidus et magnus projetant principalement leurs axones vers le tronc cérébral, le cervelet et la moelle épinière. Situés le plus caudalement, les neurones 5-HT du noyau raphé obscurus (B2) forment une feuille de chaque côté de la ligne médiane entre les décussations pyramidales et la partie caudale du noyau hypoglosse. Situés plus ventralement, les neurones 5-HT du noyau raphé pallidus (B1) forment une colonne sur la ligne médiane entre la partie caudale du noyau hypoglosse et la section ventromédiane de la formation réticulée au niveau de la région caudale du pont. Situés dans la section rostrale du bulbe et la partie caudale du pont, les neurones 5-HT du noyau raphé magnus (B3) se distribuent le long de la ligne médiane, paramédiane et latérale à partir de l’olive inférieure jusqu’au niveau du nerf trijumeau (Fig. 1).
Le groupe rostral est constitué des noyaux raphés dorsal (NRD) et médian (NRM) où sont concentrés près de 85% des neurones 5-HT du cerveau chez l’humain (Hornung, 2003). Situé entre la partie caudale du pont et le mésencéphale, le groupe rostral contient des neurones 5-HT qui projettent leurs axones principalement vers la partie antérieure du cerveau, mais aussi, de façon beaucoup moins importante, vers le tronc cérébral et le cervelet. Reposant sur le plancher du quatrième ventricule, le groupe B4 représente l’extension la plus caudale du groupe rostral chez le rongeur. Il est toutefois absent chez les primates. Il n’est pas associé à un noyau spécifique du raphé, mais s’étend entre les noyaux d’origine des nerfs vestibulaires et abducens. Le noyau raphé pontin (B5) est situé ventromédialement au faisceau longitudinal médian (medial forebrain bundle MFB), entre le noyau du nerf facial et l’olive supérieure. Pour sa part, le NRD, comprenant les groupes B6-B7 de Dalstrom et Fuxe, renferme le plus grand nombre de neurones 5-HT du tronc cérébral. Il s’étend de la partie rostrale du pont, où l’on retrouve le locus coerulus, au mésencéphale renfermant le noyau trochléaire. Pour sa part, le NRM, comprenant les groupes B8 et B9 de Dalstrom et Fuxe, est localisé entre le pôle caudal du locus coeruleus et la partie caudale du noyau du nerf oculomoteur.
1.3 Le noyau raphé dorsal
Chez l’humain, le NRD contient environ 235 000 neurones (Baker & al., 1991). Chez le rongeur, il se divise en trois parties: la partie rostrale, médiane et caudale (Abrams & al., 2004).
3 Figure 1: Distribution des neurones 5-HT dans le tronc cérébral humain (figure modifiée de
Nieuwenhuys & al., 2008).
Représentation en vue dorsale du tronc cérébral humain. La partie gauche du schéma montre l’organisation cytoarchitecturale des différents noyaux 5-HT, alors que la partie droite illustre les régions et noyaux suivants : région tegmentaire médiane (gris pâle); région tegmentaire latérale (gris foncé); noyaux du raphé (rouge), locus coeruleus (orange).
4
D’un point de vue morphologique, 4 types de neurones peuvent être distingués selon la forme de leur corps cellulaire : (1) rond, (2) ovoïde, (3) fusiforme ou (4) triangulaire. Cette distinction morphologique a permis d’identifier 5 sous-noyaux au sein du NRD (Kerry & al., 1990). Ces sous-noyaux sont le sous-noyau interfasciculaire (DRif), le sous-noyau ventral (DRv), le sous-noyau ventro-latéral (DRvl), le sous-noyau dorsal (DRd) et le sous-noyau caudal (DRc) (Fig. 2).
Le DRif est situé sur la ligne médiane et séparé ventralement du NRM par une bande dépourvue de neurones 5-HT ; dorsalement il fusionne avec le DRv. Le DRif est constitué majoritairement de neurones de type fusiforme, mais également de neurones ronds.
Le DRv est situé dorsomédialement au MFB dans la région centrale de la substance grise au niveau du noyau occulomoteur accésoire. Le DRv contient principalement des neurones de type ronds, mais également des neurones de type triangulaires.
Le DRvl est situé dorsomédialement au MFB. Bien que constitué majoritairement de neurones ronds, il contient également des neurones triangulaires.
Le DRd, pour sa part, se retrouve près du noyau trochléaire et comprend principalement des neurones de type rond, fusiforme et triangulaire densément regroupés. Il s’agit du plus volumineux des cinq sous-noyaux formant le NRD.
Le DRc chez l’homme se retrouve 1 mm plus rostral que l’isthme et il s’étire sur plus de 15 mm, ce qui en fait le sous-noyau le plus long. Il est principalement formé de neurones de type fusiforme, triangulaire et ovoïde.
1.3.1 Contenu chimique des neurones du raphé dorsal chez la souris
L’analyse détaillée du NRD chez la souris a révélé une composition neurochimique hétérogène, incluant plus d’une dizaine de neurotransmetteurs ou neuropetides distincts (Fu et al., 2010). Outre la 5-HT, on y retrouve de la dopamine, du glutamate, du GABA, de la somatostatine, de la substance P, de la dynorphine, de la neurotensine et du neuropetide Y. Un niveau de complexité supplémentaire provient du fait que plus d’un neurotransmetteur ou neuropeptide peuvent être contenus dans un même neurone. La description détaillée de chacun des neurotransmetteurs contenus dans le NRD dépassant le cadre de ce mémoire, seuls ceux nécessaires à sa compréhension, soit la 5-HT et le glutamate, seront décrits en détail.
5
1.3.2 La sérotonine
La 5-HT est synthétisée à partir du tryptophane, un acide aminé qui provient exclusivement de l’alimentation et qui possède la capacité de passer facilement la barrière hématoencéphalique. L’accumulation de tryptophane à l’intérieur du neurone s’effectue grâce à un transporteur membranaire considéré comme l’étape limitante. Le tryptophane sera hydroxylé par l’une des deux isoformes connues du tryptophane hydroxylase (TpH1 et TpH2). Alors que la TpH1 est exprimée principalement dans la région gastro-intestinale, la glande pinéale, la rate et le thymus, la TpH2 est exclusivement exprimée dans le cerveau. Le produit de l’hydroxylation est ensuite décarboxylé par une décarboxylase des acides aminés (DAA). La 5-HT est empaquetée dans les vésicules synaptiques par le transporteur vésiculaire des monoamines 2 (VMAT2) suivant un échange entre deux molécules d’hydrogènes provenant de l’intérieur de la vésicule contre une molécule de 5-HT. Une fois relâchée à l’extérieur du neurone par exocytose, la 5-HT peut se lier à l’un des sept grands types de récepteurs 5-HT comprenant chacun plusieurs sous-types de récepteurs pour un grand total de 23 récepteurs 5-HT différents dont chacun possède sa distribution propre dans le cerveau.
À l’exception du récepteur 5HT3,, les récepteurs 5-HT sont des récepteurs métabotropiques couplés aux protéines G. Une fois que la 5-HT s’est liée à un récepteur, elle peut retourner à l’intérieur d’une cellule via un transporteur transmembranaire spécifique (SERT). Par la suite, la 5-HT peut être catabolisée par la monoamine-oxydase A ou B (MAOA ou MAOB), produisant un métabolite appelé acide 5-hydroxyindol-acétique (5-HIAA) (Purves et al., 2001).
La 5-HT semble jouer un rôle important dans la modulation du comportement moteur (Jacobs and Fornal, 1997). Ce neurotransmetteur ne peut, à lui seul, déclencher un potentiel d’action au sein des motoneurones dont le corps cellulaire est situé dans la corne ventrale de la moelle épinière. Cependant, via les projections axonales descendantes des neurones du raphé, la 5-HT peut modifier de façon substantielle le potentiel membranaire des motoneurones, facilitant ainsi le déclenchement d’un potentiel d’action suite à l’arrivée d’entrées excitatrices supplémentaires. En absence de 5-HT, les capacités motrices des animaux ne semblent pas être drastiquement affectées (Jacobs and Fornal, 1997). Toutefois, on remarque que l’absence de 5-HT est associée à une augmentation des comportements exploratoires chez une grande variété de mammifères, ce qui sous-tend l’idée d’un lien complexe entre les comportements moteurs et la 5-HT. Une indication supplémentaire du lien étroit entre la HT et la motricité provient de l’étude de la distribution des axones 5-HT. En effet, une forte innervation 5-HT est présente au niveau des motoneurones primaires de la moelle épinière, ainsi que des principales structures des GB auxquels sont associés plusieurs comportements psychomoteurs (Steinbusch, 1981).
6
Figure 2: Trois sections transversales du noyau raphé dorsal (figure modifiée de Paxinos & Franklin, 2004).
Illustration d’une section rostrale contenant le sous-noyau ventral (en bleu), d’une section médiane contenant les sous-noyaux intrafasciculaire (en jaune), ventro-latéral (en vert) et dorsal (en rouge) et d’une section caudale contenant le sous-noyau intrafasciculaire et le sous-noyau caudal (en mauve).
7
1.3.3 Le glutamate
Le glutamate est un acide aminé synthétisé lors de la transformation du glucose en ATP durant le cycle de l’acide citrique. Traversant la barrière hématoencéphalique, le glucose est acheminé dans le milieu intracellulaire des neurones et des astrocytes par des transporteurs membranaires. La synthèse du glutamate s’effectue lors de l’étape limitante du cycle de l’acide citrique, soit la décarboxylation de l’α-kétoglutarate en succinyle-CoA par l’α-kétoglutarate déshydrogénase. En effet, la cinétique de la réaction enzymatique entre l’α-kétoglutarate et l’α-kétoglutarate déshydrogénase amène à l’accumulation de l’α-kétoglutarate. La présence de l’aspartate-aminotransférase transfère une amine comme l’alanine à l’α-kétoglutarate afin de former du glutamate (Mason & al., 1992). Cette synthèse peut s’effectuer dans les neurones et les astrocytes. Toutefois, dans les astrocytes, le glutamate est transformé en glutamine par la glutamine synthéase
(Akiyama & al., 1990). Par la suite, la glutamine est relâchée dans le milieu extracellulaire et captée par les neurones afin d’être convertie en glutamate par la glutaminase.
Suite à la synthèse du glutamate dans le cytosol, un mécanisme d’empaquetage dans des vésicules synaptiques devient nécessaire. Bien que la séquence exacte des mécanismes impliqués soit encore inconnue, l’empaquetage du glutamate ferait intervenir deux protéines transmembranaires distinctes (Juge et al., 2010). Il s’agirait premièrement d’une pompe à proton (H+) dépendante de l’ATP augmentant le nombre de H+ à l’intérieur de la vésicule synaptique et deuxièmement, d’un transporteur vésiculaire au glutamate (VGluT) permettant au glutamate d’entrer à l’intérieur de la vésicule synaptique. L’utilisation de l’ATP par la pompe permet de créer un gradient de H+ à l’intérieur de la vésicule. Comme le glutamate est chargé négativement, celui-ci aura tendance à entrer par le transporteur afin de respecter le principe d’homéostasie de charge électrique. Il semblerait également que l’anion chlore (Cl-) puisse jouer un rôle important, que ce soit pour les vésicules synaptiques en général (Xie & al., 1983), que pour celles contenant du glutamate (Naito and Ueda, 1985). En effet, le Cl- aurait un effet activateur à faible concentration et un effet inhibiteur à forte concentration. Dans un article de revue, El Mestikawy & al., (2011) proposent que, à faible concentration, le chlore (Cl-) puisse se lier à un site provoquant le changement structurel du transporteur afin de permettre l’entrée du glutamate. À forte concentration, le Cl- agirait comme tampon au H+, ce qui résulterait en une diminution de la différence de potentiel membranaire et donc une diminution de l’entrée de glutamate.
8
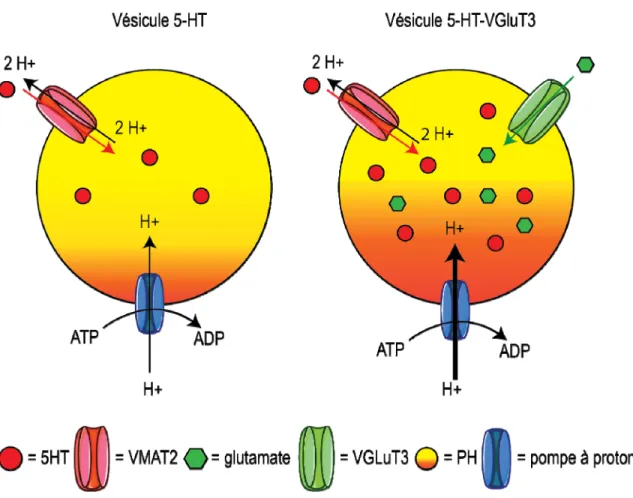
Figure 3 : Mécanismes fonctionnels des transporteurs vésiculaires et synergie moléculaire (figure adaptée de El Mestikawy et al., 2011)
L’empaquetage de la 5-HT est dépendant du gradient électrochimique de protons (H+) maintenu entre l’intérieur et l’extérieur de la vésicule synaptique (la valeur intravésiculaire du pH est illustrée de jaune - pH basique - à orange - pH acide). Ce gradient est maintenu grâce une pompe ATPase (illustrée en bleu). La 5-HT est empaquetée grâce au transporteur de monoamines 2 (illustré en rouge) selon l’échange d’une molécule de 5-HT pour deux H+. Cet échange a pour conséquence de diminuer rapidement le nombre de H+ à l’intérieur de la vésicule. De par sa charge négative, l’entrée de glutamate par liaison au transporteur du glutamate 3 (illustré en vert) facilite l’entrée de H+ par la pompe à H+ ATPase. Cette synergie aurait comme conséquence de favoriser l’empaquetage de la 5-HT au sein des vésicules synaptiques.
9 Trois transporteurs vésiculaires du glutamate ont été identifiés à ce jour : VGluT1, VGluT2 et VGluT3. Ils ont initialement été identifiés comme transporteurs sodium-dépendant du phosphate inorganique par Ni & al., (1994), avant d’être formellement identifiés comme transporteurs vésiculaires du glutamate (Bellocchio & al., 2000). Le VGluT1 est principalement présent dans le cortex cérébral, l’hippocampe et le cervelet (Ni et al., 1994) alors que le VGluT2 est davantage localisé dans les structures sous-corticales (Varoqui & al., 2000). Le VGluT3 est, quant à lui, présent dans les structures corticales et sous-corticales (Gras 2002). Contrairement au VGluT1 et au VGluT2, le VGluT3 est principalement localisé dans les corps cellulaires des neurones pour lesquels la libération du glutamate n’était pas connue. Les deux principaux systèmes qui co-expriment le VGluT3 sont les neurones libérant l’acétylcholine ou la 5-HT (Gras et al., 2002). Il a été démontré que le VGluT3 aurait un rôle de synergie vésiculaire (Gras et al., 2008). En effet, la présence de VGluT3 sur les membranes vésiculaires favoriserait l’empaquetage de l’acétylcholine ou de la 5-HT dans les vésicules synaptiques. Puisque les transporteurs vésiculaires de l’acétylcholine ou de la 5-HT doivent faire sortir 2 H+ pour chaque molécule de neurotransmetteur qui entre, la présence de VGluT3 sur la membrane vésiculaire, de par sa charge négative, faciliterait l’entrée de H+ créée par la pompe à H+ vésiculaire (Fig. 3).
L’élaboration d’un modèle de souris transgéniques dont l’expression du VGLUT3 a été supprimée (VGLUT3-KO) a permis de mieux comprendre le rôle comportemental de ce transporteur vésiculaire du glutamate.Bien qu’il soit fortement présent dans le striatum en condition normale, tant dans les interneurones cholinergiques que dans les afférences 5-HT, l’absence du transporteur VGluT3 ne semble avoir d’effet significatif sur le comportement moteur des souris transgéniques (Gras et al., 2008). La 5-HT étant également impliquée dans la régulation de l’humeur, les compétences sociales et l’anxiété (Dinan, 1996), il a été démontré que la suppression du VGLUT3 chez la souris augmente les comportements anxieux ainsi que les comportements de type obsessifs-compulsifs (Amilhon et al., 2010). De plus, une étude menée chez des souris dont les neurones riches en VGluT3 émettent une fluorescence caractéristique a permis de démontrer un rôle significatif de ce transporteur dans le circuit de la récompense (Liu et Al. 2014).
Une fois que le glutamate contenu dans les vésicules synaptiques est relâché à l’extérieur du neurone, il peut se lier à deux grandes familles de récepteurs : les récepteurs ionotropiques, dont l’activation provoque l’ouverture d’un canal et l’entrée d’ions, et les récepteurs métabotropiques, dont l’activation est reliée à une cascade de seconds messagers intracellulaires. Lorsque le glutamate est relâché dans la fente synaptique, son élimination doit s’effectuer rapidement à cause de son haut niveau de toxicité (Choi, 1985). Cette recapture rapide est principalement effectuée par les astrocytes grâce à l’un des 5 transporteurs d’acides aminés excitateurs connus à ce jour (Kanai & Hediger, 1992 ; Arriza & al., 1997; Fairman & al., 1995). Une fois dans le cytoplasme des astrocytes, le glutamate est transformé en glutamine par la glutamine synthèse
10
(Akiyama et al., 1990). La glutamine est ensuite convertie en glutamate par la glutaminase afin d’être à nouveau empaquetée dans des vésicules synaptiques.
1.4 Projections sérotoninergiques ascendantes en provenance du
noyau raphé dorsal
1.4.1 L’innervation sérotoninergique des ganglions de la base
Chez l’humain, les axones 5-HT s’arborisent dans pratiquement toutes les structures majeures de l’encéphale (Wallman & al., 2011) et ce neurotransmetteur est particulièrement abondant dans le cortex, le thalamus et les ganglions de la base (GB). En ce qui a trait aux GB, on remarque que la substance noire (SN) est la structure la plus densément innervée alors que le noyau subthalamique est deux fois moins innervé que la SN (Wallman et al., 2011). Le pallidum reçoit une innervation modérée comparativement aux autres composantes des GB. Le striatum est la structure dont l’innervation en 5-HT est la plus hétérogène. Quoique le noyau caudé soit légèrement moins innervé que le putamen, ces deux composantes du striatum reçoivent une innervation 5-HT tout aussi hétérogène l’une que l’autre. En effet, dans la partie caudale du putamen, un gradient dorsoventral est clairement visible où la partie ventrale est nettement plus innervée que la partie dorsale. Au niveau post-commissural, les axones sont distribués de façon uniforme, sauf dans la bordure dorsale du noyau caudé où l’innervation est moins abondante que dans le reste du striatum (Wallman & al. 2011). Une analyse quantitative de l’innervation 5-HT du striatum chez le rat a permis d’observer une différence importante entre sa partie dorsale et sa partie ventrale (Soghomonian & al., 1987). En effet, la partie ventrale du striatum semble être deux à trois fois plus riche en axones 5-HT que la partie dorsale. Toutefois, aucune distinction entre deux compartiments du striatum nommés matrice et striosomes, n’a pu être observée.
1.4.3 Types d’axones sérotoninergiques
L’étude de la morphologie des axones 5-HT permet de regrouper ceux-ci en plusieurs catégories. Steinbusch, (1981) propose trois types d’axones 5-HT chez le rat, soit les types A, B et C. Les fibres de types A seraient longues, dépourvues de varicosités axonales, et préférentiellement orientées suivant l’axe rostro-caudal. Les axones de type B seraient encore plus fins que ceux de type A. Sans orientation particulière, ils se
11 différentieraient toutefois par la présence de varicosités. Finalement, les axones de type C se caractériseraient par leur abondance dans les régions les plus densément innervées ainsi que par l’absence de varicosités axonales. Kosofsky & Molliver (1987) proposent plutôt deux catégories d’axones 5-HT, soit les axones de type M et D, qui se différencieraient par la forme de leurs varicosités. Les axones de type M, qui proviendraient principalement du noyau raphé médian, seraient caractérisés par la présence de varicosités volumineuses, rondes et relativement espacées les unes des autres. Les axones de type D, qui émergeraient surtout du noyau raphé dorsal, seraient caractérisés par de petites varicosités tant de forme ronde que de forme fusiforme. Par contre, le traçage unicellulaire complet d’un neurone provenant du NRD a permis d’observer les deux catégories de varicosités axonales sur une même axone (Gagnon & al., 2014). Ce résultat vient donc nuancer la présence d’une distinction morphologique des axones 5-HT basée sur la provenance des projections au sein des noyaux du raphé.
1.4.1 Importance de la collatéralisation des axones sérotoninergiques
Tel que mentionné plus haut, les projections 5-HT ascendantes proviennent principalement du noyau raphé dorsal, mais également du noyau raphé médian. Chez le rat, les axones 5-HT peuvent être divisés en deux grands systèmes ascendants distincts, soit le système transtegmentaire et le système paraventriculaire (Parent et al., 1981). Le système paraventriculaire circule le long de la partie dorsale du faisceau longitudinal de Schütz. Ces axones émettent des collatérales dans les collicules supérieurs et inférieurs ainsi que dans l’organe subcommissural, mais la vaste majorité d’entre eux passe dorsalement à la commissure postérieure avant de plonger ventralement pour rejoindre la partie dorsale de l’hypothalamus. C’est durant ce trajet que des collatérales axonales se détachent afin d’aller innerver densément la matière grise périventriculaire (Parent et al., 1981). Quant aux axones 5-HT qui forment la voie transtegmentaire, ils plongent ventralement juste au-dessus de la limite dorsale du noyau interpédonculaire (Lidov et al., 1980). Formant un arc en direction rostrale, les axones pénètrent ensuite dans l’aire tegementaire ventrale avant de poursuivre leur course dans le MFB. À ce niveau, un grand nombre de collatérales axonales sont émises et innervent la substance noire compacte (SNc) et réticulée (SNr). La voie paraventriculaire et transtegmentaire fusionnent dans le MFB, au niveau de la partie caudale de l’hypothalamus, et circulent dans l’aire hypothalamique latérale. Les axones empruntant le fasciculus retroflexus s’arborisent principalement dans la partie médiane de l’habenula. Ceux qui circulent dans les stries médulaire et terminale du thalamus s’arborisent dans l’habenula mais également dans l’amygdale. Ceux passant par le fornix, se projettent dans l’hippocampe, la bandelette diagonale de Broca, le septum et l’induseum griseum. Ceux passant par le faisceau cingulaire de l’hippocampe et la capsule interne se rendent au globus pallidus et au striatum. Finalement, les axones qui
12
cheminent ventralement traversent les noyaux olfactifs pour finalement s’arboriser dans la couche glomérulaire du bulbe olfactif.
La reconstruction entière et individuelle de plusieurs neurones du NRD a permis d’apporter des évidences directes de l’importance de la collatéralisation des axones 5-HT (Gagnon & Parent, 2014). Dans le cas des neurones du NRD, il ressort qu’un même neurone est en mesure d’innerver simultanément plusieurs structures cibles grâce à un jeu de collatérales axonales complexes. L’innervation du striatum émerge principalement d’axones dont le corps cellulaire repose dans la région médiane de la partie caudale du NRD. Deux types de patron d’innervation ont été rapportés. Le premier type regroupe les axones dont les premiers branchements innervent la région dorsolatérale du striatum. L’axone principal poursuit sa trajectoire et traverse le claustrum pour déployer son arborisation terminale dans le cortex préfrontal. Le deuxième type d’axone passe par la SN sans émettre de collatérale, mais plusieurs boutons axonaux sont visibles. L’axone poursuit sa course à travers l’hypothalamus latéral, le noyau préoptique magnocellulaire, le globus pallidus, puis la partie dorsale du corps calleux. C’est à ce niveau qu’une collatérale majeure se sépare de l’axone principal pour former plusieurs petites collatérales et innerver la partie dorsale du striatum. L’axone principal continue ensuite sa course vers le cortex moteur où il déploie son arborisation terminale. Ce travail présentant plusieurs reconstructions neuronales unitaires (Gagnon & Parent, 2014) démontre l’importance de l’arborisation axonale d’un même neurone qui varie en fonction de la structure cible. Cette importante collatéralisation axonale représente un substrat morphologique aux diverses fonctions associées à la 5-HT. Enfin, en envoyant une copie d’un même message à plusieurs neurones localisés dans différentes structures cibles, les neurones du NRD seraient en mesure de moduler et de synchroniser l’activité de plusieurs régions du cerveau.
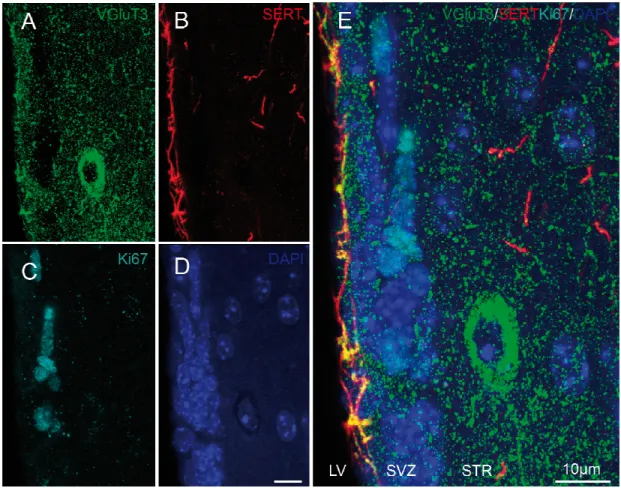
Le traçage unitaire des neurones du NRD a également permis de caractériser la présence du VGluT3 à la fois à l’intérieur des corps cellulaires 5-HT ainsi qu’au sein des varicosités axonales 5-HT retrouvées dans les structures cibles et appartenant aux neurones injectés. En effet, les corps cellulaires 5-HT du NRD observés lors de cette étude contenaient tous le VGluT3. Cependant, une proportion seulement des varicosités axonales 5-HT contenait le VGluT3 et cette proportion variait en fonction de la région innervée. En effet, 93 % de varicosités 5-HT contenaient le VGluT3+ dans le striatum par rapport à 75 % dans le cortex moteur. Le fait que tous les corps cellulaires 5-HT contiennent le VGluT3 mais que seulement certaines collatérales axonales en soit pourvues suggère fortement l’existence d’un mécanisme de triage des vésicules synaptiques au sein d’axones fortement collatéralisés (Gagnon & Parent, 2014).
13 La co-transmission du glutamate et de la 5-HT par les neurones du NRD pourraient accroître significativement la plasticité synaptique importante au cours du développement, du vieillissement ainsi que dans plusieurs processus neuropathologiques. Bérubé-Carrière et al. (2009) ont observé au microscope électronique que l’incidence synaptique de la 5-HT varie en fonction des sites d’innervation et que la proportion de jonction synaptique reste très faible. Il a été suggéré que cette faible incidence synaptique puisse représenter le substrat morphologique de la transmission volumique. Contrairement aux axones 5-HT, il a été démontré que la vaste majorité des varicosités axonales glutamatergiques présentent une ou plusieurs synapses (Bérubé-Carrière et al., 2009). Au sein du système 5-HT, il est tentant de proposer que les varicosités contenant à la fois la 5-HT VGluT3+ soient celles qui présentent un contact synaptique alors que celles étant dépourvues de VGluT3, soient celles qui n’en présentent pas.
1.5 La maladie de Parkinson et l’implication de la sérotonine
Affectant près d’un million de personnes en Amérique du Nord, la maladie de Parkinson (MP) est la deuxième maladie neurodégénérative en importance, après la maladie d’Alzheimer (Lang and Lozano, 1998). Apparaissant en moyenne vers 65 ans, l’âge demeure le principal facteur de risque connu (Lang and Lozano, 1998). Suivant le diagnostic, le taux de mortalité est d’au moins deux fois plus élevé par rapport au vieillissement normal (Bennett et al., 1996). Décrit pour la première fois dans un fascicule intitulé «An Essay
on the Shaking Palsy» publié en 1817 par James Parkinson, la cause exacte de la MP demeure inconnue
dans la majorité des cas. La découverte de formes familiales rares de parkinsonisme a toutefois permis d’identifier plusieurs gènes codant pour l’α-synucléine (PARK1-PARK11) impliqués dans le développement de la MP (recensés dans (Moore et al., 2005). Par contre, les études effectuées chez des jumeaux identiques n’ont pas montré une héritabilité importante de la MP, ce qui laisse supposer une interaction importante entre les facteurs environnementaux et génétiques dans la pathogenèse de la MP (Marsden, 1987).
1.5.1 Les symptômes de la maladie de Parkinson
De façon générale, la plupart des patients parkinsoniens vont présenter les trois symptômes cardinaux de la maladie, soit de la bradikinésie (ou de l’akinésie dans les stades plus avancés), des tremblements aux repos et de la rigidité musculaire. Plusieurs patients vont également présenter de l’instabilité posturale. Bien que les symptômes moteurs de la MP soient plus apparents, cette maladie est également caractérisée par un ensemble de symptômes non-moteurs qui peuvent parfois être très handicapants. Ceux-ci peuvent précéder
14
d’une dizaine d’années les symptômes moteurs (Shulman et al., 2001). Moins visibles, ces symptômes sont mal diagnostiqués dans 64% des cas et mènent souvent à des hospitalisations pouvant faire quadrupler le coût du traitement de la MP (Chaudhuri and Naidu, 2008). Les symptômes non-moteurs comprennent : a) des troubles neuropsychiatriques, b) des perturbations du sommeil, et c) des affections du système autonome et digestif (Chaudhuri and Naidu, 2008). Ces trois grandes catégories regroupent près de 50 symptômes spécifiques. L’auto-administration d’un test particulier chez 545 patients parkinsoniens a révélé que ces derniers souffraient en moyenne de 9 à 12 symptômes non-moteurs (Martinez-Martin et al., 2007). Après l’âge de 65 ans, le nombre de symptômes non-moteurs tend à augmenter significativement (Martinez-Martin et al., 2007).
Les troubles neuropsychiatriques regroupent principalement la dépression, l’anxiété, l’apathie et les dysfonctions cognitives. La dépression est un symptôme non-moteur important de la MP puisqu’elle affecte jusqu’à 45% des patients (Burn, 2002). Ce symptôme serait attribuable à une dysfonction des systèmes dopaminergique, noradrénergique et 5-HT (Remy, 2005). L’anxiété fait également partie des symptômes non-moteurs fortement associés à la dépression chez les parkinsoniens. En effet, 75% des patients parkinsoniens dépressifs vont également souffrir d’anxiété (Schiffer et al., 1988). Parallèlement au problème de dépression et d’anxiété, les troubles cognitifs représentent des symptômes importants de la MP. En effet, jusqu’à 80% des patients vont montrer des déficits cognitifs allant d’un trouble léger jusqu’à la démence (Aarsland et al., 2003).
1.5.2 Les caractéristiques neuropathologiques de la maladie de Parkinson
La principale caractéristique neuropathologique de la MP est la dégénérescence sélective des neurones dopaminergiques de la SNc située dans le mésencéphale et dont les axones innervent le striatum. De plus, on note la présence d’inclusions intracellulaires typiques que l’on retrouve autant dans les corps cellulaires (corps de Lewy) que dans l’axone (neurites de Lewy) des neurones affectés (Baba et al., 1998). L’analyse biochimique de la composition des corps de Lewy a montré une forte présence d’α-synucléine alors que l’étude neuropathologique de tissus post-mortem humain provenant de patients parkinsoniens a révélé un patron particulier de mort neuronale. En effet, on observe une perte de neurones dopaminergiques plus importante dans la partie ventrale que dans la partie dorsale de la SNc (Falck et al., 1962). Des marquages immunohistochimiques pour la calbindine ont permis de mettre en évidence une perte neuronale plus importante des régions dépourvues de cette protéine servant à lier le calcium (Damier & al., 1999). La dégénérescence sélective de neurones dopaminergiques nigrostriés entraîne une diminution significative de la quantité de dopamine au sein du striatum. Dans les stades précoces de la MP, la dégénérescence des axones
15 DA est observée principalement dans la région dorsolatérale du putamen, correspondant au territoire sensorimoteur du striatum (Fearnley and Lees, 1991). La région ventrale du striatum (noyau accumbens) correspondant au territoire limbique du striatum et recevant une innervation dopaminergique en provenance de l’aire tegmentaire ventrale est relativement bien préservée dans les premiers stades de la MP.
En ce qui concerne les neurones 5-HT, l’étude post-mortem de tissus provenant de patients parkinsoniens a démontré la présence de corps de Lewy. Cependant, ces inclusions neuronales semblent être principalement restreintes aux noyaux du raphé les plus caudaux et ce, dans les stades les plus avancés de la maladie (Braak et al., 2002). Toutefois, certains corps de Lewy ont également été observés dans le NRD et le NRM (Halliday et al., 1990). Une seule étude post-mortem a rapporté des corps de Lewy dans l’ensemble des noyaux du raphé (Paulus and Jellinger, 1991). En ce qui a trait à la perte de neurones 5-HT dans la MP, celle-ci semble se restreindre exclusivement au noyau raphé médian (Cheshire et al., 2015). La mesure de l’acelle-cide 5-hydroxyindoleactique (5-HIAA), le métabolite de la 5-HT, donne également un aperçu de l’intégrité de ce système dans la MP. Comparés aux participants contrôles, les patients parkinsoniens ont montré un niveau de HIAA inaltéré dans le néocortex, mais nettement plus bas dans l’hippocampe, le noyau caudé, le putamen et le liquide céphalo rachidien (revue dans Huot & al., 2011).
1.5.5
Les modèles animaux de la maladie de Parkinson
Afin de mieux comprendre la MP, de tester de nouveaux traitements qui pourraient permettre de soulager les symptômes moteurs et non-moteurs et de comprendre l’impact de ces médicaments sur le cerveau, de nombreux modèles animaux ont été développés. Que ce soit chez le rongeur ou les primates non-humains, plusieurs toxines peuvent être utilisées afin de provoquer une lésion dopaminergique qui caractérise la MP. La description détaillée de chacun de ces modèles dépassant l’objectif de ce mémoire, il ne sera question que du modèle utilisé dans le cadre de la présente étude, soit l’injection intracérébrale unilatérale de 6-hydroxydopamine (6-OHDA) chez la souris.
L’étude détaillée de la synthèse de la norépinéphrine (NE) a mené à la découverte de la (6-OHDA) comme molécule analogue à la dopamine dans la synthèse de la NE (Senoh & al., 1959). Le caractère toxique de la 6-OHDA sur les sites de relâche de la NE au sein des muscles cardiaques chez la souris a été démontré par Porter & al., (1963), une découverte qui a conduit à l’utilisation de cette molécule pour effectuer des lésions spécifiques des neurones catécholaminergiques. Toutefois, c’est l’injection intracérébrale unilatérale dans le striatum, dans la SN ainsi que dans le MFB qui a permis d’observer l’effet toxique de la 6-OHDA sur les
16
neurones dopaminergiques et noradrénergiques. Puisque l’administration de désipramine, un inhibiteur du transporteur de la NE, permet d’épargner les neurones NE, on peut maintenant utiliser la 6-OHDA pour léser spécifiquement les neurones dopaminergiques (Breese and Traylor, 1971). L’injection unilatérale de 6-OHDA permet donc d’étudier les conséquences d’une dénervation dopaminergique, tout en conservant un hémisphère intact à des fins de comparaison.
Les mécanismes exacts permettant d’expliquer la mort des neurones dopaminergiques induite par la 6-OHDA demeurent inconnus. Cependant, on croit qu’ils impliquent les mitochondries. En effet, la 6-OHDA pénètre dans les neurones dopaminergiques grâce au transporteur membranaire de la dopamine (DAT) (Michel and Hefti, 1990). Sa présence dans le cytosol amène son accumulation dans les mitochondries où elle inhibe de façon permanente le complexe mitochondrial 1 provoquant une diminution de la respiration cellulaire et, ultimement, la mort cellulaire (Cleeter, & al., 1992). Une lésion unilatérale à la 6-OHDA se traduit principalement par des mouvements de rotation spontanés qui peuvent être amplifiés en administrant de l’amphétamine (Ungerstedt, 1971). Évidement, plusieurs différences notables existent entre ce modèle animal et la maladie humaine. En effet, la lésion chimique provoquée par l’injection de 6-OHDA induit une mort cellulaire beaucoup plus subite et drastique que ce qui est observé chez un patient souffrant de la MP. De plus, aucun corps de Lewy n’est observé chez ce modèle contrairement à ce qu’on retrouve chez les patients parkinsoniens. Enfin, si la mort des neurones dont l’axone forme la voie nigrostriée se traduit par de l’akinésie et des tremblements au repos chez l’humain, les symptômes moteurs chez le rongeur se traduisent plutôt par une propension à tourner, de façon spontanée, vers le côté lésé (Ungerstedt, 1971).
1.5.6 Les traitements pharmacologiques de la maladie de Parkinson
Le fait que la dégénérescence des afférences dopaminergiques soit la principale caractéristique neuropathologique de la MP a tout naturellement orienté les efforts vers un traitement pharmacologique de remplacement dopaminergique. En effet, la démonstration de la spécificité de la perte de dopamine dans le cas de la MP par Ehringer & Hornykiewicz, (1960) a immédiatement stimulé la recherche afin de pouvoir rapidement proposer un traitement de remplacement de la dopamine perdue. Le premier article présentant une restauration des capacités motrices suite à l’administration de L-Dopa inégalée par les autres médicaments disponibles à l’époque sera publié un an plus tard par Birkmayer & Hornykiewicz en 1961. C’est toutefois la démonstration que le bromocriptine, un agoniste des récepteurs dopaminergiques, a la même efficacité clinique pour rétablir les capacités motrices qui a finalement convaincu la communauté scientifique de l’efficacité de la L-Dopa (Calne et al., 1974).
17 Aujourd’hui, deux principales options pharmacologiques sont disponibles, soit l’administration d’agonistes dopaminergiques ou l’administration du précurseur de la dopamine, la L-Dopa (L-3,4-dihydroxyphenylalanine). Six agonistes dopaminergiques sont actuellement disponibles soit la bromocriptine, la pergolide, la cabergoline, le lisurdide, le ropinirole et le pramipexole. On leur reconnait la capacité de soulager les symptômes moteurs associés à la MP et de retarder l’utilisation de la L-Dopa. Bien qu’encore peu compris, ces effets seraient liés à une demi-vie plus longue de ces molécules par rapport à la L-Dopa. Toutefois, les agonistes dopaminergiques peuvent induire plusieurs effets secondaires comme des hallucinations, de la somnolence, des nausées, des oedèmes ainsi que des troubles d’impulsivité (Stowe et al., 2008).
L’approche pharmacologique la plus répandue face à la MP reste encore le traitement visant à remplacer la dopamine manquante. L’impossibilité pour la dopamine de traverser la barrière hématoencéphalique oblige la prise de son précurseur immédiat, la Dopa. Celle-ci sera par la suite convertie en dopamine par l’enzyme L-aromatique amino acid decarboxylase (AADC) dans les quelques neurones dopaminergiques restants, mais aussi dans les astrocytes et les neurones 5-HT qui contiennent également l’AADC. La prise de L-Dopa peut, dans un premier temps, restaurer les capacités motrices perdues. Malgré ses avantages évidents, la L-Dopa occasionne également beaucoup d’effets secondaires. La courte demi-vie de la L-Dopa provoque une alternance des moments où les capacités motrices sont restaurées (état “on”) suivi d’un retour brusque des symptômes moteurs parkinsoniens (état “off”). De plus, la L-Dopa est également associée, entre autres, à des nausées, de la compulsion au jeu et de l’hypersexualité. Enfin, l’administration de L-Dopa est associée à l’apparition de mouvements involontaires anormaux de forte amplitude que l’on nomme dyskinésies induites par la L-Dopa (DIL).
1.5.7 Les dyskinésies induites par la L-Dopa
Après seulement quelques années de traitement pharmacologique à la L-Dopa, la vaste majorité des patients parkinsoniens vont présenter des effets secondaires qui peuvent parfois être plus handicapants que les symptômes de la MP. Ces complications peuvent être divisées en trois catégories, soit : a) les dyskinésies induites par la L-Dopa, b) l’épuisement de l’effet thérapeutique en fin de dose, et c) l’alternance entre des phases de mouvements et de rigidité (effet on-off). La première complication à survenir est habituellement les dyskinésies, chez 50% des patients, après seulement 5 à 6 ans de traitement. Une analyse détaillée a permis de constater que les patients plus jeunes souffrent davantage de DIL et que la dose cumulée de L-Dopa influence également l’expression des DIL. Après 20 ans de traitement à la L-Dopa, plus de 80% des patients présentent des dyskinésies (Rajput et al., 2002).
18
1.5.8 L’implication de la sérotonine dans les dyskinésies induites par la L-Dopa
Dans un striatum privé d’innervation dopaminergique, les neurones 5-HT seraient les principaux contributeurs de la conversion de la L-Dopa exogène en dopamine ainsi que de son relâchement (Carta & al., 2007). En effet, les terminaisons 5-HT possèdent la machinerie biochimique requise pour transformer la L-Dopa en dopamine. Cependant, puisqu’elles sont dépourvues du transporteur membranaire de la dopamine (DAT) et de l’autorécepteur inhibiteur D2, les terminaisons 5-HT relâchent la dopamine de manière non-physiologique et
en trop grande quantité. La relâche de la dopamine par les varicosités axonales 5-HT conduit à des poussées excessives de dopamine extracellulaire se traduisant cliniquement par l’apparition de dyskinésies (Carta et al., 2008). L’hypothèse de l’implication de la 5-HT dans l’apparition et le maintien des dyskinésies induites par la L-Dopa est confortée par la réduction de ces mouvements anormaux involontaires (AIMs), soit l’équivalent des DILchez l’animal, suite à une diminution de l’activité des neurones 5-HT, tel que démontré par de nombreuses approches. En effet, il est pratiquement impossible d’induire des AIMs chez des animaux dont les afférences striatales 5-HT ont été préalablement lésées (Carta et al., 2007). À l’inverse, une augmentation de la sévérité des AIMs peut être observée suite à une greffe de neurone 5-HT dans le striatum (Carlsson & al., 2007). De plus, une diminution de l’intensité des AIMs a été observée suite à l’administration d’agonistes des récepteurs 5-HT1A/5-HT1B qui réduisent la relâche de neurotransmetteurs par les neurones 5-HT (Carta et al., 2008).
Les études effectuées chez des singes rendus parkinsoniens suite à l’intoxication au MPTP plaide en faveur d’une hyperinnervation du striatum par les axones 5-HT. En effet, il est possible d'observer un bourgeonnement des fibres 5-HT dans le striatum suite à une désafférentation dopaminergique (Gagnon & al. sous presse). Toutefois, aucun bourgeonnement n’est visible dans le noyau accumbens, une région limbique du striatum dans laquelle l’innervation dopaminergique est préservée chez le singe MPTP. Cette étude nous porte à croire que les afférences 5-HT puissent prendre la place laissée vacante par la dégénérescence des afférences dopaminergiques. Les nouveaux axones 5-HT établissent davantage de synapses (Gagnon et al., sous presse), ce qui peut être expliqué par le fait que les axones immatures présentent davantage de synapses qui agissent comme point d’encrage lors de la croissance axonale (Crissman & al., 1993). En ce qui a trait à la L-Dopa, l’administration de celle-ci semble induire, chez le rongeur ayant subit une lésion dopaminergique, un bourgeonnement des axones 5-HT dont l’importance varie en fonction de la dose de L-Dopa administrée (Rylander et al. 2010). Puisque les varicosités axonales glutamatergiques sont fortement synaptiques (Bérubé-Carrière et al., 2009), il devient donc raisonnable de penser que les axones 5-HT immatures puissent contenir davantage de VGluT3. De plus, comme la présence du VGluT3 semble induire un effet synergique sur l’empaquetage vésiculaire des monoamines, la présence de ce transporteur au sein des
19 varicosités axonales 5-HT pourrait favoriser la libération de dopamine suite à l’administration de L-Dopa et ainsi l’expression des AIMs.
1.6 Objectifs du projet
Bien que le patron d’innervation 5-HT des GB chez la souris soit relativement bien connu, la distribution détaillée des axones 5-HT et VGluT3 ainsi que la colocalisation des deux molécules n’a pas été rapportée de façon exhaustive. Ainsi, le premier objectif de notre étude est de décrire le patron de distribution des axones 5-HT et VGluT3 dans différentes régions des GB ainsi que dans certaines structures associées au système limbique. Afin de réaliser cet objectif, une observation minutieuse a été effectuée grâce à un protocole immunohistochimique appliqué à du tissu provenant de souris C57/Bl6 saines. Le deuxième objectif de notre étude est d’évaluer l’importance fonctionnelle du VGluT3 au sein des axones 5-HT sur l’expression des mouvements anormaux induits par l’administration de L-Dopa en contexte de dénervation dopaminergique. Ce deuxième objectif se divise en deux objectifs spécifiques. Objectifs spécifiques : [1] démontrer que l’état parkinsonien et l’état dyskinétique se caractérisent par une altération de l’innervation striatale 5-HT. [2] Démontrer que l’état dyskinétique s’accompagne d’une augmentation de la quantité de VGluT3 au sein des varicosités axonales 5-HT. Ces objectifs sont également associés à des hypothèses spécifiques. Hypothèses : [1] dans la MP, la place laissée vacante par les axones dopaminergiques permet aux afférences striatales 5-HT de bourgeonner, constituant ainsi un déterminant présynaptique important des DILs. Suite à une dénervation dopaminergique, la densité des varicosités axonales 5-HT sera augmentée, particulièrement dans le territoire sensorimoteur du striatum. [2] Suite à un traitement chronique à la L-Dopa, la proportion des varicosités 5-HT du striatum qui contiennent le VGluT3 sera corrélée positivement avec la sévérité des DILs.
2. Matériel et Méthode
2.1 Les animaux
Au total, 20 souris C57/BL6 âgées de 2 mois et dont le poids variait de 20 à 30g ont été utilisées afin de réaliser cette étude. Les souris ont été hébergées dans une pièce à température contrôlée avec un cycle de luminosité jour/nuit de 12 h, sans restriction à l’accès à l’eau ou à la nourriture. Toutes les interventions chirurgicales et les procédures de soins ont été approuvées par le comité de protection des animaux de
20
l'Université Laval (numéro de certification : 2011165-3) et ont suivi les règles et recommandations du guide canadien pour le soin et l'utilisation des animaux en laboratoire.
2.2 Injections unilatérales de 6-hydroxydopamine (6-OHDA)
Douze souris ont reçu une injection intracérébrale de 6-OHDA afin de produire une lésion sélective des neurones dopaminergiques. Pour ce faire, les animaux ont été anesthésiés à l'isoflurane (1,5%) puis placés dans un cadre stéréotaxique. Afin de préserver les neurones noradrénergiques, de la désipramine (D3900, Sigma, Canada) a été préalablement administrée en mode intrapéritonéal (i.p.) 30 minutes avant l'injection intracérébrale de 6-OHDA. Dissoute dans une solution saline d’acide ascorbique, la 6-OHDA (1,5 g, H4381 Sigma, Canada) a ensuite été injectée unilatéralement dans le MFB chez 12 souris. Le MFB a été atteint en utilisant les coordonnées stéréotaxiques suivantes : antéro-postérieur: -1,2 mm, médio-latéral -1,1 mm et dorso-ventral 5,0 mm. Ces coordonnées ont été calculées à partir du bregma (antéropostérieur et médiolatéral) et de la surface du cortex cérébral (dorsoventral), et ce, selon l’atlas stéréotaxique de Paxinos & Franklin, 2004. Les 6 souris restantes ont reçu une injection d’acide ascorbique afin de servir de contrôle (sham) (Fig. 4). Trois semaines après la chirurgie, un test de rotations spontanées a été réalisé sur l'ensemble des 18 souris. Le test a été effectué dans un cylindre transparent avec une caméra Sony Handycam DCR-5X43 pendant 10 minutes puis le nombre de tours ipsilatéraux et controlatéraux à la lésion ont été comptabilisés.
2.3 Traitement à la L-Dopa
Quatre semaines après l’injection unilatérale de 6-OHDA, 6 des 12 souris lésées au 6-OHDA ont reçu une dose quotidienne de 3 mg/kg (i.p.) de L-Dopa méthyl-ester (D1507-1G; Sigma) et de 12 mg/kg de bensérazide (B7283-1G, Sigma, Canada) pendant 3 jours. Pour les 10 jours suivants, la dose de L-Dopa a été augmentée à 6 mg/kg. Ce régime d’administration a permis d’induire des (AIMs) chez toutes les souris ayant été lésées à la 6-OHDA puis traitées à la L-Dopa. Les 6 souris sham ainsi que 6 souris 6-OHDA ont reçu une injection i.p. de saline plutôt que de L-Dopa. Dans ce mémoire, le groupe ayant seulement été lésé à la 6-OHDA mais traité à la saline sera appelé «groupe 6-OHDA» et le groupe ayant été lésé à la 6-OHDA et traité à la L-Dopa sera appelé «groupe L-Dopa». Le groupe ayant été faussement lésé sera appelé «sham». Sept jours après le début de l'administration de L-Dopa, la sévérité des AIMs a été évaluée. Cette évaluation a été réalisée à
21 partir d’enregistrements vidéo d’une durée de 10 minutes effectués dans un cylindre transparent, à l’aide d’une caméra Sony Handycam DCR-5X43, 20 minutes suivant l’administration i.p. de L-Dopa. Neuf jours après le début du traitement de L-Dopa, la sévérité des AIMs a été évaluée à nouveau selon une échelle d’évaluation développée par Cenci et al. (1991) qui permet de diviser le comportement selon quatre composantes (locomoteur, axial, membres antérieurs et oro-lingual). Vingt minutes suivant l’injection i.p. de L-Dopa ou de saline, les souris ont été filmées dans un cylindre transparent pendant 1 minute et ce, toutes les 20 minutes, pour une durée totale de 140 minutes. Pour chaque minute enregistrée, nous avons accordé un pointage de 0 à 4 pour chacune des sous-échelles suivant l’amplitude du mouvement observé, à l’exception de la sous-échelle oro-linguale. En effet, nous n’avons pas été en mesure d’évaluer rigoureusement ce paramètre dû à un manque de résolution de la caméra et à la vitesse trop grande de rotation des souris. Le pointage de toutes les autres composantes de l’évaluation comportementale ont été additionnés.
2.4 Traitement du tissu
Quarante deux jours après la lésion au 6-OHDA et 24h après la dernière injection de L-Dopa (ou de saline), les souris ont été profondément anesthésiées par injection i.p. d’un mélange de kétamine (80 mg/kg) et de xylazine (10 mg/kg). Ensuite, chaque souris a subi une perfusion transcardiaque de 50 ml d’acroléine (2%) et de 200 ml de paraformaldéhyde (4%). Les cerveaux ont ensuite été rapidement extraits du crâne et post-fixés pendant 1h dans une solution de paraformaldéhyde 4%. Ils ont été coupés selon un plan coronal, à une épaisseur de 50 µm, à 4 °C, en utilisant un vibratome (Leica VT1200S). Les sections ont été conservées à -20°C dans une solution d’antigel composé de tampon phosphate (0,5M), de 30% d’éthylène glycol et de 30% de glycérol, jusqu’à leur utilisation. Afin d’examiner la colocalisation de SERT et de VGluT3 en condition normale dans différentes composantes des GB et dans les structures associées, deux souris supplémentaires ont été utilisées. Ces souris ont été perfusées le jour même de leur arrivée à l’animalerie et le tissu a été préparé selon le protocole décrit plus haut.
2.5 Immunomarquage TpH2 / VGlut3
À partir des cerveaux des 2 souris qui ont servi à la description de la distribution de SERT et de VGluT3 en condition normale, 3 sections coronales de 50 µm d’épaisseur ont été choisies à des coordonnées stéréotaxiques correspondant à -4.60 mm et -4,96 mm selon l’atlas de Paxinos & Franklin (2004). Ces
22
sections ont été d’abord traitées afin d’éliminer les groupes aldéhydes des fixateurs chimiques utilisés lors de la perfusion transcardiaque. Pour ce faire, elles ont été incubées pendant 30 minutes dans une solution de borohydrure de sodium (0,05 g/10 ml), suivi par 5 rinçages au PBS de 5 minutes chacun. Les sections ont ensuite été incubées pendant 1 heure dans une solution de pré-incubation composée de 0,05% de triton, de 2% de sérum normal d'âneet de 2% de sérum normal de lapin dilué dans du PBS. Cette même solution a, par la suite, servi de solution de dilution des anticorps utilisés pour ce marquage. À cet égard, les sections ont été incubées pendant une nuit à 4 °C avec de l’anticorps primaire de mouton (1:250, n° de catalogue AB1541, Chemicon) et de cochon d’Inde (1:500, n° de catalogue AB5421, Santa Cruz Biotechnology) dirigé respectivement contre l’enzyme de synthèse de la 5-HT, soit la tryptophane hydroxylase (TpH) et le VGluT3. Ces incubations ont été suivies par 3 rinçages au PBS. Les anticorps primaires ont été détectés avec des anticorps secondaires faits chez l’âne dirigés contre le lapin (1: 200, no de catalogue 711-545-152, Jackson) ou la chèvre (1: 200, n° de catalogue A11057, Invitrogen). Ces anticorps secondaires étaient respectivement couplés à de l’Alexa Fluor 488® et l’Alexa Fluor 568®. Les sections ont ensuite été étalées sur lame et recouvertes d’une lamelle dans un milieu de montage adapté à la fluorescence (Dako, n° de catalogue S3023).
2.6 Immunomarquage SERT / VGluT3
À partir des 2 souris qui ont servi à la description de la distribution de SERT et de VGluT3 en condition normale, des sections coronales de 50 µm d’épaisseur ont été choisies à des coordonnées stéréotaxiques correspondant à 0,70 mm, -1,34 mm, -2,06 mm, -3,16 mm et -4,84 mm, selon l’atlas de Paxinos & Franklin (2004). Quatre sections coronales supplémentaires par souris des groupes expérimentaux sham, 6-OHDA et L-Dopa prises entre les coordonnées stéréotaxiques 1,18 mm et 0,38 mm ont été utilisées. Toutes les sections ont été immunomarquées pour SERT de VGluT3 et suivant le même protocole. Ces sections ont été traitées afin d’éliminer les groupements aldéhydes des fixateurs chimiques utilisés. Pour ce faire, elles ont été incubées pendant 30 minutes dans une solution de borohydrure de sodium (0,05 g/10 ml), suivi par cinq rinçages au PBS de 5 minutes chacun. Les sections ont ensuite été incubées pendant 1 heure dans une solution de PBS composée de 0,05% de triton et de 2% de sérum d'âne normal. Cette même solution a servit de solution aux anticorps utilisés pour ce marquage. Par la suite, les sections ont été incubées pendant une nuit à 4 °C avec de l’anticorps primaire de lapin (1: 250, Système Synaptic, n ° de catalogue 135 203 122) et de chèvre (1:500, Santa Cruz Biotechnology, no de catalogue SC-1458) dirigé respectivement contre VGluT3 et SERT. Les anticorps primaires ont été détectés grâce à des anticorps secondaires faits chez l’âne et dirigés soit contre le lapin (1:200, Jackson, n° de catalogue 711-545-152) ou contre la chèvre (1:200, Invitrogen, n°