FACULTÉ DES SCIENCES
Rabat
N° d’ordre : 2593THÈSE DE DOCTORAT
Présentée par
BOURASS Khadija
Discipline : Science de la vie
Spécialité : Ecologie animale
Régime alimentaire de l’Outarde houbara nord africaine,
Chlamydotis undulata undulata
Soutenue le 24/07/2012
Devant le jury
Président :
A. YAHYAOUI Professeur à la Faculté des Sciences de Rabat
Examinateurs :
A. BENHOUSSA Professeur à la Faculté des Sciences de Rabat
Y. HINGRAT Dr. Responsable de recherche. Reneco Wildlife
Consultants, Abu Dhabi, United Arab Emirates
A. QNINBA Professeur à l’Institut Scientifique de Rabat
M. A. EL AGBANI
Professeur à l’Institut Scientifique de Rabat
A. ZAIME Professeur à l’Institut Agronomique et Vétérinaire Hassan II
Avant Propos
Le travail présenté dans ce mémoire a été effectué dans la Faculté des Sciences de Rabat à l’UFR : « Biodiversité et Aquaculture », sous la Direction de Monsieur Abdelaziz Benhoussa, Professeur à la Faculté des Sciences de Rabat. Il a été réalisé avec l’encadrement de Monsieur Yves Hingrat responsable de recherche à RENECO Wildlife Consultant.
Il a été réalisé au sein du centre de recherche et de conservation l’Emirates Centre for Wildlife Propagation à Missour.
Je tiens à saluer ici les personnes qui, de près ou de loin, ont contribué à la concrétisation de ce travail de thèse de doctorat.
Tout d’abords j’exprime mes profonds remerciements à l’ensemble des fondateurs du centre ECWP (Emirates Centre for Wildlife Propagation) : son altesse Cheikh Mohamed bin Zayed Al Nahyan, Prince Héritier d'Abou Dhabi et président de l’International Fund for Houbara Conservation (IFHC), son excellence Mohammed Al Bowardi vice-président de l’IFHC., M. Jacques Renaud, directeur général de l’ECWP et M. Frédéric Lacroix son directeur exécutif.
Mon profond respect s’adresse à Monsieur Abdel Aziz Benhoussa, Professeur au laboratoire de Zoologie et Biologie Générale de la faculté des Sciences de Rabat d’avoir accepté de m’encadrer et suivre le déroulement de ce travail.
Mes vifs remerciements s’adressent vers Monsieur Yves Hingrat, Docteur en
écologie et responsable de recherche à RENECO Wildlife Consultants L.L.C. pour son
encadrement, son soutien et sa patience. Je te dois mon apprentissage sur la rigueur scientifique, le souci du détail et l’esprit de synthèse.
Je tiens à exprimer toute ma gratitude à Monsieur Ahmed Yahyaoui, Professeur à la faculté des Sciences de Rabat de m’avoir accueilli dans son UFR, Je le remercie également d’avoir accepté de présider mon jury
Ma profonde reconnaissance à Monsieur Abdelkader Zaime, Professeur à l’Institut Agronomique et Vétérinaire de Rabat, pour ses conseils, ses remarques avisées et pour bien vouloir participer au jury d’évaluation de ce travail.
Mes remerciements s’adressent aussi à Monsieur Abdeljabbar Qninba Professeur à l’Institut Scientifique de Rabat, pour l’intérêt qu’il a apporté à ce travail et d’avoir accepté de le juger.
Je tiens à remercier Messieurs Mohamed Aziz El Agbani Professeur à l’Institut Scientifique de Rabat, Hamid Idrissi Rguibi Professeur à la faculté des Sciences d’El jadida et Lahcen Chillasse Professeur à faculté des Sciences de Meknes de bien vouloir juger ce travail.
Je ne saurais oublier le personnel de l’ECWP qui ont participé de près ou de loin au travail de thèse : merci tout d’abord à Fadila Ouled Ezza et Alexandre François, toujours disponible pour m’aider dans les déterminations. Une pensée particulière pour tous ceux qui ont participé au laborieux travail de prélèvement et de laboratoire particulièrement Soufiane Touil, Mohamed Sbaii, et Hadhoum Saada.
Merci à Fadila, Hadhoum et sa famille, Patricia, Alex, jef, Hayat et sa famille et Naima Hamdaoui pour leur soutien et leur amitié.
Je remercie tout particulièrement mon regretté père et ma mère pour m’avoir témoigné leur confiance, je leur dois une reconnaissance éternelle pour m’avoir soutenu et encouragé tout au long de mes études. Je tiens également à remercier mes sœurs et frères pour leur soutien constant et bienveillant. Merci tout particulièrement à Najia, d’avoir partagé avec moi les moments difficiles de rédaction, ça fait du bien de ne pas se sentir seule dans cette galère.
Table des matières
Introduction générale….…...………..………...………..………1
Généralités……….………..…..3
1. Régime et stratégie alimentaire ... 3
1.1. Définition du régime alimentaire ... 3
1.2. Stratégie alimentaire ... 3
1.2.1. La théorie de l’approvisionnement optimal (Optimal Foraging Theory, OFT) ... 4
1.2.1.1. Composition du régime alimentaire (optimal diet) ... 4
1.2.1.2. Répartition spatio-temporelle de l’effort de recherche alimentaire ... 5
1.2.2. Gain d’information par la présence d’autres individus ... 5
1.2.3. Spécialiste ou généraliste ? ... 5
1.2.3.1. Influence du facteur temps ... 6
1.2.3.2. Influence du facteur espace ... 6
1.2.4. Stéréotypie et plasticité du comportement alimentaire ... 7
2. Présentation de l’espèce : l’Outarde houbara Chlamydotis undulata ... 8
2.1. Taxonomie et aire de répartition ... 8
2.2. Densité et statut de conservation ... 8
2.3. Causes du déclin des populations ... 9
2.4. Préservation de l’Outarde houbara ... 9
2.4.1. International Fund for Houbara Conservation ... 9
2.4.2. L’Emirates Centre for Wildlife Propagation (ECWP) ... 10
2.5. Biologie et écologie de l’Outarde houbara ... 12
2.5.1. Reproduction ... 12
2.5.2. Mouvement et utilisation de l’espace ... 12
2.5.3. Disponibilité en ressources ... 13
2.5.4. Régime alimentaire ... 14
Partie I : Régime alimentaire de l’Outarde houbara nord-africaine, Chlamydotis undulata undulata, en période de non-reproduction…….…….20
1. Introduction ... 20
2. Matériels et méthodes ... 20
2.1. Zone d’étude ... 20
2.2. Etude du régime alimentaire ... 22
2.3. Echantillonnage ... 22
2.4. Constitution des outils de référence ... 23
2.5. Tri et identification des contenus stomacaux ... 25
2.6. Analyses statistiques ... 26
3. Résultats ... 28
3.1. Proportions relatives des fractions animale et végétale ... 28
3.2. Fraction végétale ... 29
3.2.2. Variation taxonomique des contenus stomacaux selon les régions, les
années et le sexe. ... 31
3.3. Fraction animale ... 32
3.3.1. Composition taxonomique de la fraction animale ... 32
3.3.2. Variation taxonomique des contenus stomacaux selon les régions, les années et le sexe. ... 35
4. Discussion ... 36
Partie II : Comparaison du régime alimentaire d’outardes houbara sauvages et lâchées………..42
1. Introduction ... 42
2. Matériels et méthodes ... 45
2.1. Zone d’étude ... 45
2.2. Préparation des outardes au lâcher : condition d’élevage et alimentation . ... 46
2.3. Etude du régime alimentaire ... 47
2.3.1. Choix des échantillons ... 47
2.3.2. Description du régime alimentaire ... 48
2.3.3. Analyses statistiques ... 48
2.4. Etude des organes digestifs : variation de la taille des estomacs ... 50
2.4.1. Choix des échantillons ... 50
2.4.2. Mesure des estomacs ... 51
2.4.3. Analyses statistiques ... 51
3. Résultats ... 52
3.1. Régime alimentaire ... 52
3.1.1. Proportions relatives des fractions animale et végétale ... 52
3.1.2. Fraction végétale ... 52
3.1.3. Fraction animale ... 54
3.2. Variation de la taille des estomacs ... 56
3.2.1. Variation de la taille des estomacs selon l’origine et le sexe ... 56
3.2.2. Variation de la taille des estomacs d’outardes lâchées et temps d’adaptation dans la nature. ... 57
4. Discussion ... 57
Partie III : Stratégies alimentaires de l’Outarde houbara nord-africaine : variations du régime selon la disponibilité en ressources trophiques………63
Chapitre I : Disponibilité en ressources trophiques………...………67
1. Introduction ... 67
2. Matériel et méthode ... 67
2.1. Choix des stations ... 67
2.2. Piégeage de l’arthropofaune ... 69
2.3. Relevés botaniques ... 70
3. Résultats ... 72
3.1. Variation spatiale des assemblages de plantes par saison ... 72
3.2. Variation spatiale des assemblages d’arthropodes par saison ... 74
3.3. Variation temporelle des assemblages de plantes ... 77
3.4. Variation temporelle des assemblages d’arthropodes ... 77
4. Discussion ... 83
Chapitre II : Evolution saisonnière du régime alimentaire de l’Outarde houbara………...………....86
1. Introduction ... 86
2. Matériel et méthode ... 88
2.1. Etude du régime alimentaire ... 88
2.1.1. Choix des échantillons ... 88
2.1.2. Analyses statistiques ... 89
2.2. Etude des tailles d’estomacs ... 90
2.2.1. Choix des échantillons ... 90
2.2.2. Analyses statistiques ... 92
3. Résultats ... 92
3.1. Choix de saisons ... 92
3.2. Variation saisonnière du RA selon la saison et le sexe ... 92
3.2.1. Proportions relatives des fractions animale et végétale ... 92
3.2.2. Composition de la fraction végétale ... 94
3.2.3. Composition de la fraction animale ... 99
3.3. Variation de la taille des estomacs selon la saison et le sexe. ... 104
4. Discussion ... 105
Chapitre III : Sélection des ressources trophiques.………...………...110
1. Introduction ... 110 2. Matériel et méthode ... 111 2.1. Utilisation ... 111 2.2. Disponibilité ... 112 2.2.1. Disponibilité en arthropodes ... 112 2.2.2. Disponibilité en plantes ... 112 2.3. Analyse de sélection ... 113 2.3.1. Analyse statistique ... 113 2.3.2. Niveaux d’analyses ... 113 2.3.2.1. Arthropodes ... 113 2.3.2.2. Plantes ... 115 3. Résultats ... 117
3.1. Sélection des arthropodes ... 117
3.2. Sélection des plantes ... 121
Discussion générale ………..129
1. Régime alimentaire de l’Outarde houbara ... 130
1.1. Un régime omnivore ... 130
1.2. Une stratégie opportuniste... 131
1.2.1. Effets des fluctuations spatio-temporelles des ressources trophiques ... 131
1.2.2. Relation entre régime alimentaire, disponibilité en ressources et cycle biologique de l’Outarde ... 134
1.3. Entre un régime généraliste et sélectif ... 136
1.4. Critères de choix ... 137
1.5. Distribution des ressources trophiques et distribution spatiale des outardes ... 139
2. Apport à la conservation de l’espèce ... 140
2.1. Apport à la conservation ex-situ : élevage en captivité et lâchers ... 140
2.1.1. Préparation des individus ... 141
2.1.2. Les lâchers ... 141
2.2. Apport à la conservation in situ : gestion des ressources trophiques .... 143
2.2.1. Indicateurs des milieux ... 143
2.2.2. Anthropisation des milieux ... 144
Bibliographie..……….………...…..146
Annexes………..………...……160 Annexe I : Synthèse bibliographique des espèces végétale et animale consommées par différentes espèces d’Outarde
Annexe II : Tableaux comparatifs des abondances et des abondances relatives des différents taxons animales et végétales présents dans le milieu et consommés par l’Outarde
Annexe III : Liste des taxons animaux et végétaux consommées par l’Outarde houbara Nord Africaine
Figures
Figure 1. Schéma de Morse (1980) montrant que la dichotomie Stéréotypie vs Plasticité (=Opportuniste) est indépendante de la dichotomie spécialisation vs généralisation. ... 7 Figure 2. Photo d'une outarde (Chlamydotis undulata undulata) femelle (à gauche) et un
mâle en parade (à droite) - © ECWP ... 8 Figure 3. Evolution de la production et des lâchers d’Outarde houbara nord africaine au
Maroc ... 11 Figure 4. Localisation géographique des deux régions d’études : Bouârfa et Missour et
position des oiseaux lors du prélèvement des estomacs. Les triangles indiquent les estomacs (n=18) collectés sur Missour. Les cercles indiquent les estomacs (n=24) collectés sur Bouârfa. ... 21 Figure 5. Photos microscopiques des cuticules des feuilles de quelques espèces
(grossissement x100). Hammada scoparia (a), Scorzonera undulata (b), Agatophora alopecuroides (c), Medicago sativa (d), Launaea arborescens (e), Herniaria cinerea (f). ... 24 Figure 6. Photos des débris de quelques insectes trouvés dans les estomacs d’outardes
houbara (Chlamydotis undulata). ... 25 Figure 7. Proportions relatives des masses sèches des fractions végétale (FV) et animale
(FA), présentes dans les estomacs de 19 mâles (a) et 20 femelles (b) d’outardes houbara (Chlamydotis undulata). ... 29 Figure 8. Ordination (analyse canonique en coordonnées principales) de 39 contenus
stomacaux d’outardes houbara (Chlamydotis undulata) mâles et femelles échantillonnés en 2004 et 2006 à Missour et en 2007 à Bouârfa.. ... 32 Figure 9. Ordination (analyse canonique en coordonnées principales) de 39 contenus
stomacaux d’outardes houbara (Chlamydotis undulata) mâles et femelles échantillonnés en 2004 et 2006 à Missour et en 2007 à Bouârfa. ... 36 Figure 10. Localisation géographique des deux régions d’études : Bouârfa et Missour et
position des oiseaux lors du prélèvement des estomacs. Les cercles blancs indiquent les estomacs d’individus sauvages (n=42). Les cercles noirs indiquent les estomacs d’individus lâchés (n=32). ... 45 Figure 11. Position des oiseaux lors du prélèvement des estomacs utilisés dans la
comparaison des tailles. Les cercles blancs indiquent les estomacs d’individus sauvages (n=149). Les cercles noirs indiquent les estomacs d’individus lâchés (n=58). ... 46 Figure 12. Moyennes des proportions relatives de la fraction végétale présente dans les
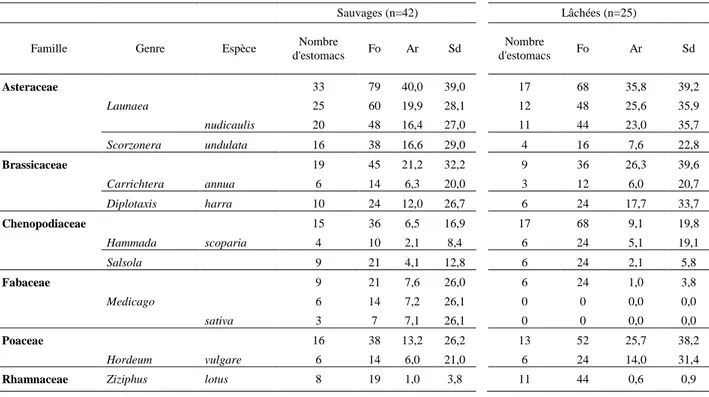
estomacs des 2 catégories d’outardes houbara (Chlamydotis undulata) : sauvages et lâchés, échantillonnés en période de non-reproduction. ... 52 Figure 13. Fréquences d’occurrences (Fo) des familles des plantes identifiées dans les
estomacs d’individus sauvages (n=42) et d’individus lâchés (n=25) échantillonnés en 2004 et 2006 à Missour et en 2007 à Bouârfa. ... 53
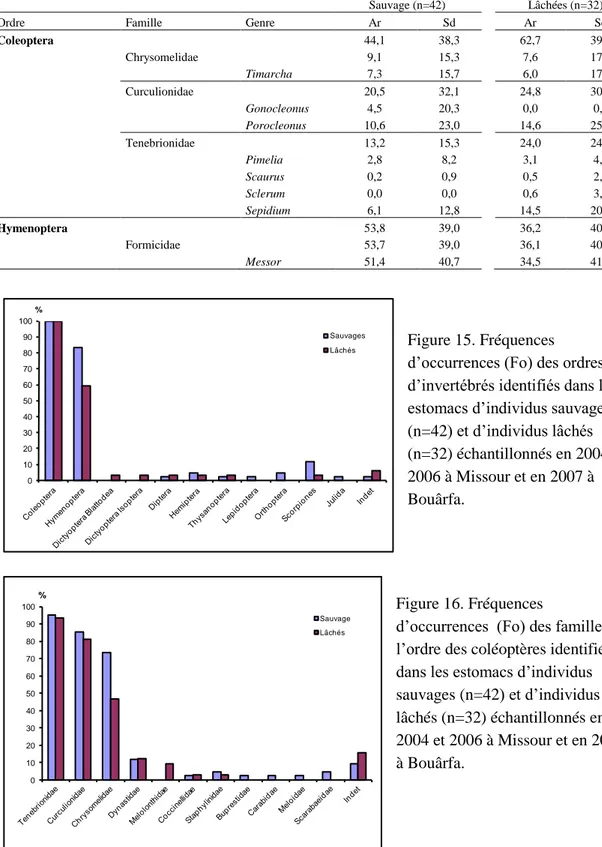
Figure 14. Abondances relatives moyennes (Ar) des familles des plantes identifiées dans les estomacs d’individus sauvages (n=42) et d’individus lâchés (n=25) échantillonnés en 2004 et 2006 à Missour et en 2007 à Bouârfa. ... 54 Figure 15. Fréquences d’occurrences (Fo) des ordres d’invertébrés identifiés dans les
estomacs d’individus sauvages (n=42) et d’individus lâchés (n=32) échantillonnés en 2004 et 2006 à Missour et en 2007 à Bouârfa. ... 55 Figure 16. Fréquences d’occurrences (Fo) des familles de l’ordre des coléoptères
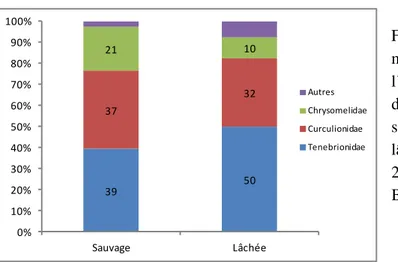
identifiés dans les estomacs d’individus sauvages (n=42) et d’individus lâchés (n=32) échantillonnés en 2004 et 2006 à Missour et en 2007 à Bouârfa. ... 55 Figure 17. Abondances relatives moyennes (Ar) des familles de l’ordre des coléoptères
identifiés dans les estomacs d’individus sauvages (n=42) et d’individus lâchés (n=32) échantillonnés en 2004 et 2006 à Missour et en 2007 à Bouârfa. ... 56 Figure 18. Variation de la taille des estomacs de 58 outardes houbara lâchées en
fonction du temps passé dans la nature. ... 57 Figure 19. Modèles de sélection selon Thomas et Taylor, 1990. ... 64 Figure 20. Répartition des groupes d’outardes observés sur Tamlelt lors des comptages
d’Automne 2007 ... 68 Figure 21. Localisation des sites d’échantillonnages d’arthropodes et des relevés
botaniques effectués durant l’année 2007-2008 sur la plaine de Tamlelt (Bouârfa). ... 68 Figure 22. Ordination (analyse de proximité) et classification ascendante hiérarchique
(CAH) par saison des 20 stations selon leur composition en plantes. Les relevés ont été effectués au cours de la période octobre-07-octobre-08 à Tamlelt (Bouârfa). .. 73 Figure 23. Ordination (analyse de proximité) et classification ascendante hiérarchique
(CAH) par saison des 20 stations selon leur composition en arthropodes sur l’année octobre-07-octobre-08 à Tamlelt (Bouârfa). ... 75 Figure 24. Ordination (analyse de proximité) et classification ascendante hiérarchique
(CAH) par saison des 20 stations selon leur composition en arthropodes sur les 16 semaines coïncidant la période de prélèvement d’estomacs en 2007-2008 à Tamlelt (Bouârfa). ... 76 Figure 25. Ordination (analyse de proximité) et classification ascendante hiérarchique
(CAH) des 20 stations selon leur composition en plantes. Les relevés ont été effectués au cours de la période octobre-07-octobre-08 à Tamlelt (Bouârfa).. ... 78 Figure 26. Ordination (analyse de proximité) et classification ascendante hiérarchique
(CAH) des 20 stations selon leur composition en arthropodes sur l’année octobre-07-octobre-08 à Tamlelt (Bouârfa). ... 79 Figure 27. Ordination (analyse de proximité) et classification ascendante hiérarchique
(CAH) des 20 stations selon leur composition en arthropodes sur les 16 semaines coïncidant les périodes de chasse... 80 Figure 28. Variation annuelle de l’abondance moyenne des arthropodes (tous groups
confondus) au cours de la période octobre 2007- octobre 2008 en parallèle avec le cycle biologique de l’Outarde houbara . ... 81
Figure 29. Variation annuelle de l’abondance moyenne de certains groupes d’arthropodes. ... 82 Figure 30. Moyenne des précipitations et des températures, maximale, moyenne et
minimale par semaine de collecte d’arthropodes. Données ECWP, à partir de la station Boujnah, Bouârfa. ... 85 Figure 31. Localisation géographique de la région d’étude : Bouârfa et position des
oiseaux lors du prélèvement des estomacs. a : représente la position des échantillons collectés en automne (n=31), b : en hiver (n=10), c : au printemps (n=19) et d : échantillons prélevés en été (n=11). ... 89 Figure 32. Position des oiseaux sauvages lors du prélèvement des estomacs. Les cercles
blancs indiquent les estomacs d’individus prélevés en période de reproduction (n=28). Les cercles noirs indiquent les estomacs d’individus prélevés en période de non reproduction (n=152). ... 91 Figure 33. Evolution saisonnière des proportions relatives moyennes des masses sèches
végétales présentent dans les estomacs d’outardes houbara (Chlamydotis undulata) échantillonnés à Bouârfa sur l’année 2007-2008... 93 Figure 34. Variation selon la saison et le sexe des proportions relatives moyennes des
masses sèches végétales contenues dans les estomacs d’outardes houbara (Chlamydotis undulata) échantillonnés à Bouârfa en automne-hiver et au printemps de l’année 2007-2008. ... 93 Figure 35. Variation saisonnière des fréquences d’occurrence (Fo) des familles de
plantes identifiées dans les estomacs d’individus échantillonnés sur les trois saisons en 2007-2008 à Bouârfa. ... 95 Figure 36. Variation saisonnière des fréquences d’occurrence (Fo) des ordres
d’invertébrés identifiés dans les estomacs d’individus échantillonnés sur les trois saisons en 2007-2008 à Bouârfa. ... 102 Figure 37. Variation saisonnière des fréquences d’occurrence (Fo) des familles de
coléoptères identifiés dans les estomacs d’individus échantillonnés sur les trois saisons en 2007-2008 à Bouârfa. ... 102 Figure 38. Abondances relatives moyennes (Ar) des genres de la famille des
Tenebrionidae identifiés dans les estomacs d’individus échantillonnés sur les trois saisons en 2007-2008 à Bouârfa. ... 103 Figure 39. Abondances relatives moyennes (Ar) des genres de la famille des
Curculionidae identifiés dans les estomacs d’individus échantillonnés sur les trois saisons en 2007-2008 à Bouârfa. ... 103 Figure 40. Variation selon les saisons et le sexe de la taille des estomacs d’outardes
houbara sauvages prélevés entre 2002 et 2008 sur différentes zones d’intervention de l’ECWP. * (L x l/100) en mm. ... 105
Tableaux
Tableau 1. Nombre d’estomacs d'outarde houbara (Chlamydotis undulata) sauvages collectés par région, année et sexe. Les collectes ont été conduites en période de non-reproduction. ... 23 Tableau 2. Fréquences d’occurrences (Fo), abondances et abondances relatives
moyennes (Ar±SD) des taxons végétaux identifiés dans 42 estomacs d'outardes houbara (Chlamydotis undulata) collectés sur Missour et Bouârfa en période de non-reproduction. Un test Chi-2 d’agrégation a été effectué afin de caractériser la distribution de chaque taxon au sein de l’échantillon (Agg = Agrégative ; Ran = Aléatoire). ... 30 Tableau 3. Fréquences d’occurrences (Fo), abondances et abondances relatives
moyennes (Ar±SD) des taxons animaux identifiés dans 42 estomacs d'outardes houbara (Chlamydotis undulata) collectés sur Missour et Bouârfa en période de non-reproduction. Un test Chi-2 d’agrégation a été effectué afin de caractériser la distribution de chaque taxon au sein de l’échantillon (Agg = Agrégative ; Ran = Aléatoire). ... 34 Tableau 4. Nombre d’estomacs d'outarde houbara (Chlamydotis undulata) sauvages et
lâchées collectés par région et par année. Les collectes ont été réalisées en période de non reproduction. ... 48 Tableau 5. Variations de la composition des assemblages spécifiques des végétaux et
génériques de la fraction animale selon la région, l’année et le sexe. Ces variations ont été testées via une régression multiple multivariée non paramétrique basée sur les distances de dissimilarité effectuée à l’aide du logiciel DISTLM forward. ... 50 Tableau 6. Nombre d’estomacs d'outarde houbara (Chlamydotis undulata) sauvages et
lâchées utilisé dans la comparaison des tailles. Les collectes ont été conduites entre 2002 et 2008 en période de non reproduction et sur différentes régions du territoire d’intervention de l’ECWP. ... 51 Tableau 7. Fréquence d’occurrence (Fo) et abondances relatives moyennes (Ar±SD) des
principaux taxons végétaux identifiés dans 42 estomacs d'outardes houbara (Chlamydotis undulata) sauvages et 25 lâchées collectés sur Missour et Bouârfa en période de non-reproduction. ... 53 Tableau 8. Abondances relatives moyennes (Ar±SD) des principaux taxons animaux
identifiés dans 42 estomacs d'outardes houbara (Chlamydotis undulata) sauvages et 32 lâchées collectés sur Missour et Bouârfa en période de non-reproduction... 55 Tableau 9. Moyennes des tailles en mm2 (±SD) des estomacs d’outardes houbara par
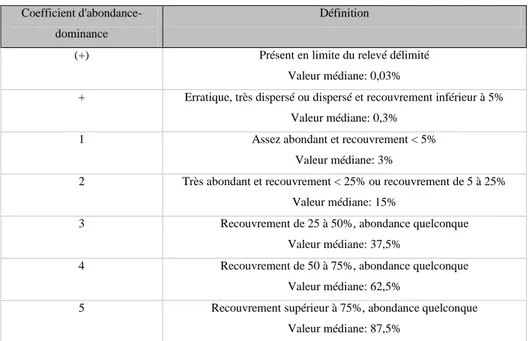
sexe et par catégories d’outardes ... 56 Tableau 10. Coefficients d'abondance-dominance et leurs recouvrements et
recouvrements médian respectifs (Braun-Blanquet et al. 1932, Guinochet 1973). . 70 Tableau 11. Résultats des tests global et appariés issus de l’ANOSIM à un facteur
(saison) appliquée aux données de la composition des communautés de plantes. .. 77 Tableau 12 : Résultats des tests global et appariés issus de l’ANOSIM à un facteur
Analyse effectuée en utilisant seulement les contenus des pièges récoltés en période d’échantillonnage d’estomacs (16 semaines). ... 78 Tableau 13. Nombre d’estomacs d'outardes houbara (Chlamydotis undulata) sauvages et
lâchées collectés sur les quatre saisons (2007-2008) à Bouârfa. ... 88 Tableau 14. Nombre d’estomacs d'outardes houbara (Chlamydotis undulata) sauvages
prélevés entre 2002 et 2008 sur différentes zones d’intervention de l’ECWP. ... 91 Tableau 15. Abondances relatives moyennes (Ar±SD) des taxons végétaux identifiés
dans 67 estomacs d'outardes houbara (Chlamydotis undulata) collectés sur Bouârfa sur trois saisons. ... 96 Tableau 16. Les cinq premières espèces de plantes les plus contributives dans la
dissimilarité entre la composition taxonomique du régime alimentaire des différentes saisons (SIMPER). Comp. : Les saisons comparées, Dis. : La dissimilarité moyenne, Ab : Abondance moyenne (1 et 2 représentent les saisons comparées), TDis. : Dissimilarité moyenne de chaque taxon, Co% : Pourcentage de la contribution moyenne du taxon, Cum.% : cumule de la contribution des taxons dans la dissimilarité. ... 98 Tableau 17. Abondances relatives moyennes (Ar±SD) des taxons d’invertébrés
identifiés dans 71 estomacs d'outardes houbara (Chlamydotis undulata) collectés sur Bouârfa sur trois saisons. ... 100 Tableau 18. Les cinq premières espèces d’arthropodes les plus contributives dans la
dissimilarité entre la composition taxonomique du régime alimentaire des différentes saisons (SIMPER). Comp. : Les saisons comparées, Dis. : La dissimilarité moyenne, Ab. : Abondance moyenne (1 et 2 représentent les saisons comparées), TDis. : Dissimilarité moyenne de chaque taxon, Co% : Pourcentage de la contribution moyenne du taxon, Cum.% : cumule de la contribution des taxons dans la dissimilarité. ... 104 Tableau 19. Nombre d’estomacs d'outardes houbara (Chlamydotis undulata) collectés
sur les trois saisons (2007-2008) à Bouârfa. ... 112 Tableau 20. Abondances Moyennes (Ab M±SD) des ordres d’arthropodes consommés
par 41 outardes en A-H, 19 au printemps et 11 en été, comparées aux abondances relatives (Ar) des ordres disponibles pour chaque saison. L’évaluation de la sélectivité à l’aide du test χ2 (Neu et al., 1974) est indiquée pour chaque saison et pour chaque ordre (Ajustement de Bonferroni) (* = P< 0,05 ; ** = P< 0,001; *** = P< 0,0001). ... 119 Tableau 21. Abondances Moyennes (Ab M±SD) des genres de Formicidae consommés
par 41 outardes en A-H, 19 au printemps et 11 en été comparées aux abondances relatives (Ar) des genres disponibles pour chaque saison. L’évaluation de la sélectivité à l’aide du test χ2 (Neu et al., 1974) est indiquée pour chaque saison et pour chaque ordre (Ajustement de Bonferroni) (* = P <0,05; ** = P <0,001; *** = P <0,0001). ... 119 Tableau 22. Abondances Moyennes (Ab M±SD) des familles de Coleoptera
consommées par 41 outardes en A-H, 19 au printemps et 11 en été comparées aux abondances relatives (Ar) des familles disponibles pour chaque saison. L’évaluation de la sélectivité à l’aide du test χ2 (Neu et al., 1974) est indiquée pour chaque
saison et pour chaque ordre (Ajustement de Bonferroni) (* = P< 0,05; ** = P< 0,001; *** = P< 0,0001). ... 119 Tableau 23. Abondances Moyennes (Ab M±SD) des genres des familles de
Tenebrionidae, Curculionidea et Chrysomelidae consommés par 41 outardes en A-H, 19 au printemps et 11 en été comparées aux abondances relatives (Ar) des mêmes genres disponibles pour chaque saison. L’évaluation de la sélectivité à l’aide du test χ2 (Neu et al., 1974) est indiquée pour chaque saison et pour chaque genre (Ajustement de Bonferroni) (* = P <0,05; ** = P < 0,001; *** = P < 0,0001). ... 120 Tableau 24. Abondances Moyennes (Ab M±SD) des familles de plantes consommées
par 18 outardes au printemps comparées aux abondances relatives (Ar) des mêmes familles disponibles. L’évaluation de la sélectivité à l’aide du test χ2 (Neu et al., 1974) est indiquée pour chaque saison et pour chaque espèce (Ajustement de Bonferroni) (* = P <0,05; ** = P <0,001; *** = P <0,0001). ... 122 Tableau 25. Abondances Moyennes (Ab M±SD) des espèces des familles Asteraceae,
Brassicaceae, Fabaceae et Poaceae consommées par 18 outardes au printemps et 10 en été comparées aux abondances relatives (Ar) des mêmes espèces disponibles pour chaque saison. L’évaluation de la sélectivité à l’aide du test χ2 (Neu et al., 1974) est indiquée pour chaque saison et pour chaque espèce (Ajustement de Bonferroni) (* = P< 0,05; ** = P< 0,001; *** = P< 0,0001). ... 123
Introduction générale
Le régime alimentaire a une influence prépondérante sur la morphologie et le comportement des animaux (Cook et al. 2001). D’un point de vue évolutif, il traduit la stratégie adoptée par un animal pour acquérir les nutriments essentiels à sa survie et à sa reproduction (Gaulin 1979, Gotthard & Nylin 1995). Dans le cas d’espèces menacées comme l’Outarde houbara, l’étude du régime alimentaire est primordiale afin d’identifier les éléments clefs de l’alimentation conditionnant leur survie et d’appliquer des mesures de conservation garantissant la disponibilité et l’accessibilité de ces éléments dans l’environnement (Recher 1990).
Les populations d’outarde houbara sont en déclin sur l’ensemble de leur aire de répartition en raison du braconnage, d’une chasse intensive non gérée et de la dégradation de leurs habitats (Lavee 1985, Lavee 1988, Combreau et al. 2001b, Chammem et al. 2003, Tourenq et al. 2005).
Pour faire face au déclin des populations sauvages de l’Outarde houbara nord africaine, des mesures de protection (limitation des périodes de chasse, création de réserves), une gestion d’un élevage conservatoire et un programme de renforcement sont assurés par le centre de recherche et de conservation, l’ECWP (Lacroix, 2003).
Le développement et l’application de ces mesures de conservation ex et in-situ ont reposé sur l’acquisition préalable de données fondamentales sur la biologie et l’écologie de l’Outarde.
Les premiers travaux sur l’écologie de l’Outarde houbara ont porté essentiellement sur l’utilisation de l’espace (domaine vital, migration) et sur la sélection des habitats afin de définir les besoins de l’espèce. Ces travaux dans un premier temps ont surtout concerné l’espèce asiatique (Osborne et al. 1997, van Heezik & Seddon 1999, Combreau et al. 2000, Yang et al. 2002, Yang et al. 2003) et plus récemment l’espèce nord-africaine (Hingrat 2004, Le Cuziat et al. 2005a, Le Cuziat et al. 2005b, Hingrat et al. 2007, Hingrat et al. 2008, Lesobre et al. 2009). Cependant, le régime alimentaire a été très peu étudié, le peu de données existantes concerne essentiellement l’espèce asiatique et restent souvent descriptives (Combreau & Rambaud 1994, Nadeem et al. 2004, Gubin 2008). Toutefois, Tigar et Osborne (2000) ont affiné leur méthode par une approche qualitative et quantitative des différents items présents dans les fèces d’outardes
asiatiques. Cependant, dans cette étude, seule la fraction animale a été décrite au niveau taxonomique alors que plusieurs auteurs soulignent la prédominance des plantes (Mian 1986, Nadeem et al. 2004). Ces différentes approches d’analyse du RA semblent moins précises que l’analyse quantitative des contenus stomacaux. Aussi les variations saisonnières, spatiales et les éventuelles divergences entre les sexes n’ont pas été prises en considération dans la plupart des travaux réalisés à ce jour.
Les objectifs de cette étude sont de définir le régime alimentaire de l’Outarde houbara nord-africaine, de caractériser son évolution au cours du cycle annuel et inter-annuel en utilisant une analyse qualitative et quantitative des contenus stomacaux, et de déterminer la stratégie alimentaire adoptée par cette espèce en analysant la relation entre son régime alimentaire et la disponibilité des ressources trophiques dans son habitat naturel.
Avant de développer ces objectifs, il est important de rappeler les définitions majeures associées au régime et à la stratégie alimentaire, et de présenter le modèle de cette étude : l’Outarde houbara nord-africaine.
Généralités
1. Régime et stratégie alimentaire
Afin de mieux comprendre les relations qui lient un oiseau et son habitat, les recherches scientifiques se sont orientées vers l’étude de la disponibilité alimentaire et l’utilisation des ressources trophiques par les oiseaux. Ces études ont commencé au XXème siècle avec des descriptions qualitatives de l’habitat et des sites d’alimentation, puis elles ont progressé vers des analyses quantitatives du comportement alimentaire. A partir des années 1980, le nombre d’études portant sur l'utilisation des ressources trophiques par rapport à leur disponibilité n’a pas cessé d’augmenter (Morrison et al. 1990).
1.1. Définition du régime alimentaire
Le régime alimentaire se définit comme une habitude de vie liée au choix de la nature, de la qualité et de la quantité des aliments constituant l’alimentation. C’est un facteur important dans l’histoire de vie des organismes (Ojala et al. 2005, Taylor et al. 2005, Naya et al. 2007). L’alimentation affecte certains traits de vie comme la croissance de l’individu, sa masse corporelle à l’âge adulte, sa reproduction, son aptitude à la thermorégulation, à la locomotion, ou encore sa résistance aux pathogènes etc. (Cook et
al. 2001, Brommer et al. 2002, Taylor et al. 2005). Au niveau évolutif, le maintien de
ces changements de traits d’histoire de vie va influencer le processus de la spéciation (Kassen 2002).
1.2. Stratégie alimentaire
Au delà de la description du régime, les questions traitées dans la littérature portent sur les habitudes alimentaires des animaux : où se nourrir ? De quoi ? Quel est le moment de la journée le plus favorable à l’alimentation ? Pendant combien de temps ? (Engen 1984, Pyke 1984, Krebs & Davies 1997). Ces interrogations supposent une notion de choix alimentaire et impliquent l’existence de différentes stratégies alimentaires adoptées en réponse à une situation donnée (Harvey 1994).
1.2.1. La théorie de l’approvisionnement optimal (Optimal Foraging Theory, OFT) Selon la théorie de l’approvisionnement optimal (OFT), les organismes devraient exploiter les ressources qui leur procurent le meilleur bilan énergétique entre le coût d’acquisition et l’apport énergétique de ces ressources (Charnov 1976, Pyke et al. 1977).
Les principaux champs d’investigation de cette théorie concernent (1) la composition du régime alimentaire (optimal diet) et (2) la répartition spatio-temporelle de l’effort de recherche alimentaire (Pyke et al. 1977, Pyke 1984).
1.2.1.1. Composition du régime alimentaire (optimal diet)
La composition du régime alimentaire a fait l’objet d’une grande attention. Les prédictions les plus communément admises concernant le choix alimentaire par un consommateur (Emlen 1966, Pyke et al. 1977, Stephens 1990, Krebs & Davies 1997) sont :
- Un item alimentaire est soit systématiquement accepté soit systématiquement rejeté lors de chaque rencontre selon qu’il fait partie ou non des items inclus dans le régime alimentaire.
- L’animal devient de plus en plus sélectif lorsque l’abondance absolue des items augmente. Ainsi les animaux se comporteront en généralistes lors d’une faible abondance absolue des items alimentaires et en spécialistes lorsqu’elle augmente.
- L’item ayant la plus forte profitabilité (valeur énergétique de l’aliment/ temps passée pour y accéder) est toujours inclus dans le régime alimentaire.
- Les divers items peuvent être ordonnés en fonction de leur profitabilité et sont incorporés au régime alimentaire dans cet ordre. Ainsi une réduction de l’abondance des items de rang supérieur conduit à l’acceptation de nouveaux items alimentaires délaissés. Dans ce cas, le régime peut basculer (switching) vers la prédominance de ces derniers éléments.
1.2.1.2. Répartition spatio-temporelle de l’effort de recherche alimentaire Afin d’optimiser leur prise alimentaire (OFT), les individus se trouvent face à des décisions à prendre à différentes échelles spatiales (site, habitat, patch : surface bien délimitée, dans laquelle la ressource est uniformément distribuée (Arditi & Dacorogna 1988)) et temporelles (instant, jour, mois, saison) imbriquées selon la disponibilité en ressources. Les caractéristiques fondamentales de ces ressources résident dans l’hétérogénéité de leur distribution en terme de quantité et de qualité, à la fois, dans le temps et dans l’espace (Li & Reynolds 1995, Sparrow 1999). La variation de ces caractéristiques va guider l’effort de recherche alimentaire du consommateur (Sutherland & Anderson 1993, van Gils et al. 2004).
L’intérêt d’exploiter un site d’alimentation ou un patch (agrégat de ressources) diminue au fur et à mesure que le temps de l’exploitation augmente (Charnov 1976). Ainsi, l’animal se trouve obligé de quitter un patch donné après un certain temps d’exploitation (alors qu’il y reste des ressources) pour se rendre sur un autre.
1.2.2. Gain d’information par la présence d’autres individus
En plus des interactions directes avec son environnement (cité ci-dessus), un autre facteur peut intervenir dans le choix des aliments : il s’agit de l’information « sociale » (Giraldeau & Caraco 2000). Un individu peut changer son comportement d’acquisition de ressources en imitant ses congénères, sans qu’il y ait pour autant un processus cognitif de mémorisation. L’individu va en effet réagir à la présence et au comportement d’autres oiseaux indiquant la localisation d’un stock d’aliments potentiellement exploitable (Clark & Mangel 1984, Buckley 1996). Les avantages de cette stratégie sont principalement l’augmentation de la probabilité de détecter une zone riche en ressources, la diminution du temps de recherche de patchs riches en ressources et la diminution des risques de prédation (Clark & Mangel 1984).
1.2.3. Spécialiste ou généraliste ?
Une espèce est dite spécialiste quand elle emploie une gamme étroite de ressources et une espèce est généraliste quand elle emploie un large éventail de ressources (Recher 1990, Sherry 1990). Parmi les espèces spécialistes les plus connues, nous citerons par exemple le Pandas (Ailuropoda melanoleuca) qui ne se nourrit que du Bambou, le Milan des marais (Rostrhamus sociabilis) qui s’alimente principalement sur les
escargots ou encore le Psammomys obesus spécialiste inféodé aux feuilles de Salsola
vermiculata (Zaim & Gautier 1989). Cependant, la plupart des espèces ne sont pas
strictement spécialistes, d’où la nécessité de mesurer le degré de la spécialisation qui consiste à évaluer le rapport spécialisation/généralisation (Sherry 1990). Il est difficile de définir une espèce comme étant généraliste ou spécialiste car ceci dépend de la disponibilité des ressources trophiques qui varie en fonction du temps et de l’espace (Sherry 1985). L'évaluation du degré de sélectivité d'un animal dépend aussi du choix fait pour décrire les ressources trophiques (trait ou niveau taxonomique). Par exemple, un animal pourra être décrit comme généraliste si on considère le nombre d’aliments consommés, alors que l'étude de la taille ou de la forme de ces aliments pourrait révéler un régime sélectif (Green & Jaksic 1983, Sherry 1990).
1.2.3.1. Influence du facteur temps
Le régime et le comportement alimentaires varient selon les saisons et les années. Ces variations sont dues au changement du climat, de l'abondance et de la disponibilité des ressources trophiques et des besoins physiologiques de l’individu (reproduction, mue, migration, élevage). De tels changements auront non seulement une influence sur l’espèce étudiée (dynamique, densité), mais également sur la composition de toute la communauté aviaire, agissant ainsi sur les degrés de compétition intra et inter spécifique. Ces changements peuvent aussi provoquer une augmentation ou une diminution du degré de la spécialisation de l’espèce (Recher 1990).
1.2.3.2. Influence du facteur espace
L’abondance et la distribution des ressources ne changent pas uniquement en fonction du temps mais elles changent aussi en fonction des habitats et des régions. En effet, l’hétérogénéité spatiale de la diversité et de l’abondance des ressources va guider le consommateur à chercher ses aliments sur les endroits les plus profitables (van Gils et
al. 2004). Cette hétérogénéité se présente à différentes échelles spatiales. A grande
échelle, les individus choisissent un ensemble bio-climatique (région), puis des habitats (Anderson et al. 2005, Pinaud & Weimerskirch 2007) puis, ils sont capables de détecter, à plus fine échelle, la présence de micropatchs à l’intérieur d’un même habitat (Klaassen et al. 2006). Ainsi, la diversité et l’abondance des aliments trophiques disponibles dans l’endroit choisi pour s’alimenter peuvent influencer le comportement alimentaire de l’espèce (généraliste vs spécialiste) (Kassen 2002).
1.2.4. Stéréotypie et plasticité du comportement alimentaire
Face aux effets temps et espace, les espèces auront des réponses comportementales différentes. Certaines auront un comportement alimentaire stéréotypé (fixé, non flexible) et d’autres seront davantage plastiques, c.à.d. auront la capacité de répondre rapidement aux changements de la disponibilité en ressources = opportunisme (Greenberg 1990). A titre d’exemple, les espèces tropicales et continentales sont plus stéréotypiques que les espèces des zones tempérées, arides ou insulaires, plus pauvres en ressources (Klopfer et MacArthur 1960 in Sherry 1990 ; Morse 1980). Aussi, selon Wiens et Rotenberry (1979), les oiseaux steppiques sont généralement relativement opportunistes.
En combinant la stéréotypie et la plasticité au degré d'amplitude écologique (spécialiste vs généraliste), Morse (1980) a établi une classification du régime alimentaire et obtient 4 types de régimes (Figure 1). Ainsi, un oiseau peut être stéréotypique-spécialiste, stéréotypique-généraliste, opportuniste-spécialiste ou opportuniste-généraliste.
Stéréotypie Plasticité Spécialisation Stéréotypique Spécialiste Opportuniste Spécialiste Généralisation Stéréotypique Généraliste Opportuniste Généraliste
Figure 1. Schéma de Morse (1980) montrant que la dichotomie Stéréotypie vs Plasticité (=Opportuniste) est indépendante de la dichotomie spécialisation vs généralisation.
2. Présentation de l’espèce : l’Outarde houbara Chlamydotis undulata
2.1. Taxonomie et aire de répartition
L’Outarde houbara (Figure 2) appartient à l’Ordre des Otidiformes et à la famille des Otididae (Hackett et al. 2008, Gill & Donsker 2010). Selon la dernière révision taxonomique, on distingue deux espèces : l’asiatique C. macqueenii (Gray 1832) dont l’aire de distribution couvre le Moyen Orient jusqu’à l’Asie occidentale et la nord-africaine C. undulata, séparée en deux sous-espèces : C. undulata undulata (Jacquin 1784) dont l’aire de distribution comprend toute l’Afrique du Nord jusqu’au Sinaï (Brosset 1961, Goriup 1997) et C. undulata fuertaventurae (Rothschild & Hartert 1894) endémique des Iles Canaries.
Figure 2. Photo d'une outarde (Chlamydotis undulata undulata) femelle (à gauche) et un mâle en parade (à droite) - © ECWP
2.2. Densité et statut de conservation
Aucune estimation globale et fiable de la densité des populations d’outardes n’est disponible. Selon « BirdLife International » (2009), l’effectif total du genre
Chlamydotis serait de l’ordre de 49 000 à 62 000 individus dont 30% en Afrique du
Nord.
A l’échelle du Maroc et plus précisément dans sa partie orientale, la densité de la population d’outardes a été estimée de 0,27 à 1,05 outarde/km² selon les zones (Ferlat & Orhant 2007), suite au programme de renforcement et de protection des populations mis en œuvre par l’ECWP.
La chute des populations est estimée, au cours des vingt dernières années, à 25% pour les populations de l’Afrique du Nord et 35 à 50% pour celles de l’Asie, avec une chute globale d’environ 35% (BirdLife 2009).
Des comptages réguliers menés au Kazakhstan ont montré un déclin alarmant des populations au printemps avec une chute globale de la densité de 26 à 36% entre 2000 et 2009 correspondant à une chute annuelle de 4,8% (Riou et al. 2010). Une autre étude antérieure a montré une chute de la densité de 57 à 75% entre 1998 et 2002 (de 0,06 à 0,02 outardes/km² en Kazakhstan, de 0,2 à 0,06 outardes/km² en Chine et de 0,05 à 0,01 outardes/km² en Oman) (Tourenq et al. 2005).
Ce déclin rapide a valu son classement comme espèce « vulnérable » dans la liste rouge de l’Union Internationale pour la Conservation de la Nature (IUCN) en 2004 (http://www.iucnredlist.org).
2.3. Causes du déclin des populations
La chute des populations d’Outarde est due essentiellement aux chasses non gérées qui se sont intensifies sur l’ensemble de l’aire de répartition de l’espèce dans les dernières décennies (Goriup 1983, Mian 1984, Haddane 1985, Saint Jalme et al. 1996a, Combreau et al. 2001a, Tourenq et al. 2005) et au braconnage (Bailey et al. 2000, Tourenq et al. 2005). A ceci s’ajoute la dégradation des habitats (Le Cuziat et al. 2005a, Le Cuziat et al. 2005b).
2.4. Préservation de l’Outarde houbara
Face au déclin de l’Outarde houbara et afin de renforcer ses populations naturelles, plusieurs centres d’élevage ont été créés dont certains sont sous l’égide de l’International Fund for Houbara Conservation (IFHC).
2.4.1. International Fund for Houbara Conservation
L’International Fund for Houbara Conservation a été créé en 2006 par le Cheikh Mohammed bin Zayed Al Nahyan, prince héritier d'Abou Dhabi et président de l’IFHC, afin d’unir tous les efforts de recherche et de conservation de l’Outarde houbara entrepris par certains centres tels que le NARC à Abou Dhabi, l’ECWP à l'Est du Maroc et le SKHBC (Sheikh Khalifa Houbara Breeding Center) au Kazakhstan. Les objectifs
de l’IFHC sont la protection des populations d’Outarde houbara des deux espèces (africaine et asiatique), la prise de conscience de leur fragilité et la mise en œuvre d’efforts de conservation sur l’ensemble de leurs aires de répartition via une coopération internationale (http://www.thenational.ae/lifestyle/chick-magnates).
2.4.2. L’Emirates Centre for Wildlife Propagation (ECWP)
L’ECWP est un centre de recherche et de conservation créé en 1995 par feu Sa Majesté le Cheikh Zayed Bin Sultan Al Nayan à Missour (Maroc) au cœur de l’aire de répartition de l’Outarde houbara nord-africaine. Son objectif prioritaire est de concevoir et d’appliquer une stratégie globale de conservation visant à restaurer et préserver les populations naturelles d’Outarde houbara d’Afrique du Nord tout en maintenant une activité de chasse traditionnelle au faucon durable (Lacroix et al. 2003).
Pour atteindre ses objectifs, l’ECWP a développé plusieurs approches complémentaires en se basant sur les recommandations émises par l’IUCN (IUCN 1998) relatives à la réintroduction et au renforcement des populations :
- Réalisation des études sur le terrain afin d’acquérir les connaissances essentielles sur la biologie, l’écologie et l’éthologie de l’espèce et évaluer la distribution des populations et leur statut.
- L’établissement d’un élevage en captivité en maintenant un potentiel génétique initial.
- Détermination des zones favorables à la création de réserves naturelles et au renforcement des populations existantes.
- Renforcement des populations sauvages par des lâchers réguliers et la réalisation de programmes de suivi de ces individus lâchés afin d’évaluer la pertinence et l’efficacité des actions de renforcement des populations.
L’élevage en captivité
La population fondatrice de cet élevage conservatoire est issue d’une collecte d’œufs sauvages effectuée en Algérie en 1986 et 1987, transférés et reproduits au National Wildlife Research Center (NWRC, Taif) en Arabie Saoudite (Saint Jalme & van Heezik 1996). Ces outardes ont été transférées avec leur descendance à l’ECWP en 1996. Cette population a été enrichie en intégrant des œufs collectés dans la zone d’intervention de
l’ECWP. Le choix des accouplements a été réalisé en croisant préférentiellement les individus qui présentaient un apparentement moyen à la population captive le plus faible (Ballou & Lacy 1995, Lesobre 2008).
Afin d’optimiser la gestion génétique et la reproduction, l’ECWP s’est orienté vers des techniques de reproduction artificielle : collecte de la semence, insémination des femelles, incubation des œufs et élevage des jeunes (Saint Jalme et al. 1994, Saint Jalme
et al. 1996b, Saint Jalme & van Heezik 1996). Les techniques d’élevage des poussins
sont différentes selon la destination de ces derniers : ceux destinés à renouveler le stock de reproducteurs captif et ceux destinés aux lâchers dans le milieu naturel. La première catégorie reçoit une imprégnation très forte et la deuxième suit un protocole qui la prépare à la vie sauvage pour pouvoir se reproduire et contribuer à la régénération naturelle de la population (Partie II).
Renforcement de la population sauvage
La production et les lâchers de l’ECWP sont en augmentation progressive depuis la création du projet. Entre 1998 et 2011, environ 73 000 individus ont été produits en captivité (Figure 3). A la fin du printemps 2012 plus de 54 500 outardes auront été lâchées dans le nord de l’Afrique et principalement au Maroc. La capacité de ces oiseaux à survivre (taux de survie moyen supérieur à 50% un an après le lâcher, (Rautureau et al. 2008)) et à se reproduire dans la nature, combinée aux mesures de protection des populations (gestion de la chasse) ont permis de rétablir des populations viables au sein des zones d’intervention de l’ECWP.
Figure 3. Evolution de la production et des lâchers d’Outarde houbara nord africaine au Maroc
2.5. Biologie et écologie de l’Outarde houbara 2.5.1. Reproduction
Le système socio-sexuel de l’Outarde houbara est de type lek diffus avec des distance inter-mâles élevées d’une moyenne de 550 mètres dans l’orientale marocain (Hingrat et
al. 2004, Hingrat et al. 2008).
La saison de reproduction est longue. Elle commence en janvier avec le début des parades des mâles matures au niveau des sites auxquels ils peuvent rester fidèles d’une année à l’autre (Hingrat et al. 2004, Hingrat & Saint Jalme 2005). Cette période se termine fin mai. Les femelles commencent à pondre au mois de février avec un pic de ponte au mois de mai. La couvaison dure en moyenne 22 jours (Gaucher 1995). Les pontes peuvent se prolonger jusqu’en juin pour les couvées les plus tardives (Hingrat & Saint Jalme 2005). Les poussins sont nidifuges et sont nourris à la béquée par la mère. Ils commencent à voler à l’âge de 30 jours, mais ils n’acquièrent leur autonomie qu’à l’âge de 2 à 3 mois (Saint Jalme & van Heezik 1996, Combreau et al. 2002). En captivité, les femelles peuvent pondre dès leur première année et les mâles paradent à l’âge de deux ou trois ans (Saint Jalme & van Heezik 1996). Des résultats similaires ont été observés dans la nature (Données ECWP non publiées).
2.5.2. Mouvement et utilisation de l’espace
L’Outarde houbara nord-africaine a été longtemps considérée comme sédentaire, voire localement erratique (Brosset 1961, Cramp & Simmons 1980). Mais, selon des études récentes, cette espèce présente des modalités d’utilisation de l’espace indiquant l’existence d’une migration partielle et différentielle (Hingrat & Saint Jalme 2005). L’Outarde houbara présente des différences entre les sexes et les saisons dans l’utilisation de l’espace et dans la sélection des habitats. En effet, les femelles sont caractérisées par un domaine vital multimodal et sont capables de parcourir des distances de plusieurs centaines de kilomètres entre les aires distinctes de reproduction et d’hivernage, alors que les mâles sont majoritairement sédentaires avec un domaine vital unimodal (Hingrat et al. 2004, Hingrat & Saint Jalme 2005).
En période de non reproduction, les mâles et les femelles utilisent souvent les mêmes habitats, choisissant préférentiellement les surfaces d’épandage et les oueds et évitant les regs à pérennes rases. Par contre en période de reproduction, l’utilisation de l’habitat
est différente entre les sexes. En effet les femelles sélectionnent des habitats à forte hétérogénéité structurale (oueds traversant un reg à pérennes hautes) favorables à la nidification et à l’élevage des jeunes. Au contraire, les mâles sélectionnent les regs à pérennes rases et les surfaces d’épandage adjacentes (Hingrat et al. 2008).
2.5.3. Disponibilité en ressources
Plusieurs études ont montré que la disponibilité en ressources végétale et animale représentait un facteur explicatif de la distribution des outardes.
En étudiant l’espèce asiatique, Combreau et al. (2000) ont constaté que l’Outarde a tendance à élargir son domaine vital quand la disponibilité alimentaire est élevée, alors que ses mouvements étaient limités dans le cas contraire. D’autres auteurs ont montré que la phénologie de la végétation est le principal facteur qui influence le choix d’habitat (Combreau & Smith 1997, van Heezik & Seddon 1999). Van Heezik et Seddon 1999 ont précisé que la variation saisonnière et la variation entre habitats en arthropodes n’ont aucune influence sur le choix de l’utilisation de l’habitat par les outardes. Toutefois, selon Combreau et al. (1997), les habitats les plus riches en Ténébrionidés et en Araignées étaient plus fréquentés que d’autres.
Concernant l’espèce nord-africaine, Hingrat et al. (2004) ont constaté que les outardes, en période de non reproduction, présentaient une préférence pour les surfaces d’épandage en raison de leur richesse en arthropodes et en plantes. Selon cette étude, l’hétérogénéité de la disponibilité en ressources trophiques est responsable en partie du grégarisme de ces oiseaux en période de non reproduction (Hingrat & Saint Jalme 2005) ainsi que de leurs mouvements migratoires (Hingrat et al. 2004). Cette même étude a montré, qu’en période de reproduction, la disponibilité en arthropodes n’a aucune influence sur le choix de l’habitat vu leur abondance et leur répartition uniforme. Cependant les femelles ont choisi des regs à pérennes hautes riches en fourmis et en coléoptères, milieu probablement favorable au nourrissage des jeunes.
2.5.4. Régime alimentaire
2.5.4.1. Régime alimentaire de l’Outarde houbara
La majorité des données concernant le régime alimentaire de l’Outarde houbara repose sur des observations récoltées secondairement lors d’autres études. Le peu d’études portant directement sur le régime alimentaire a été réalisé essentiellement sur l’espèce asiatique. Le plus souvent ces études sont effectuées sur des échantillons fécaux qui sont moins informatifs que les contenus stomacaux (Tigar & Osborne 2000, Gubin 2008) ou sur de faibles échantillons. Elles sont souvent restées très descriptives ou ne portaient que sur une seule fraction du régime : animale ou végétale (Combreau & Rambaud 1994, Nadeem et al. 2004, Gubin 2008). Seule une étude portant sur l’Outarde asiatique s’est attachée à qualifier et à quantifier les items alimentaires présents dans les fèces de cette espèce (Tigar & Osborne 2000).
Proportions relatives des fractions animale et végétale
Les études menées sur l’Outarde asiatique ont montré une variation saisonnière des proportions des deux fractions (végétale et animale) et un régime alimentaire riche en matériel végétal en période hivernale (Mian 1986, Nadeem et al. 2004) et riche en matériel animal en période de reproduction (Alekseev 1985). Toutefois, selon d’autres auteurs, le RA est plutôt riche en arthropodes en période hivernale (Tigar & Osborne 2000) et riche en plantes au printemps (80% du volume) (Gubin 2008).
En ce qui concerne l’espèce africaine, le matériel végétal constituait une part importante du régime alimentaire au au printemps (Heim de Balsac & Heim de Balsac 1954, Gaucher 1991) et pendant la saison sèches (Collins 1984, McCormick 1999).
Composition végétale
La composition végétale du régime alimentaire de l’Outarde diffère d’une zone à une autre.
Au Pakistan, les espèces végétales les plus fréquentes étaient Dipterygium glaucum avec une fréquence d’occurrence de 91% et un poids sec total de 40%, Capparis (65-74% et 2,7-11,9%), Farsetia (32-(65-74% et 11-26,5%), Tribulus terrestris (84% et 9,9%) et Haloxylon salicornicum (35% et 1,7%) (Annexe I : Tableau 1) ; (Fox 1988, Nadeem
et al. 2004).
Au Kyzylkum, Gubin (2008) a montré que les plantes consommées comprenaient des
Poa bulbosa, Bromis tectorum, Carex pachystilis, C. physodes, feuilles de Oedibasis apiculata, Salsola Arbuscula, S. richteri, S. rigida et Tulipa et les graines d’Erodium oxyrrhynchum et de Salsola (Annexe I : Tableau 1).
D’autres études menées en Arabie Saoudite et à Abou Dhabi ont montré que le régime alimentaire de l’Outarde comprenait les feuilles et fruits de Farsetia aegyptia, les fruits de Medicago laciniata, les fleurs d’Achillea fragrantissima (Goriup & Norton 1992); les fleurs, les bourgeons et les feuilles de Farsetia, de Fagonia, de Moretia et de Lycium
shawii (Combreau & Rambaud 1994). Tigar et Osborne (2000) ont signalé la
dominance de Dypterygium glaucum et de quelques Graminae (Annexe I : Tableau 1). En ce qui concerne l’espèce nord-africaine, le matériel végétal entrant dans le régime alimentaire est constitué principalement de Launaea arborescens, les fruits de Lycium sp, des feuilles de Cruciferae (Lobularia lybica et de Notoceras bicorne) et Medicago
minima aux îles Canaries (Collins 1984). En analysant quelques estomacs provenant de
l’Algérie, Gillet (1988) a constaté que les principales espèces consommées étaient
Anabasis articulata, Matricharia sp. et Fagonia (Annexe I : Tableau 2 et 3).
Outre les plantes sauvages, il a été montré que l’Outarde houbara prospecte les champs cultivés et y consomme surtout des légumineuses comme la luzerne (Lavee 1985, Martín et al. 1996, Saint Jalme & van Heezik 1996, Medina 1999, Aghainajafi-Zadeh et
Composition animale
Toutes les études et les observations (Annexe I : Tableaux 1 à 3) soulignent l’importance des coléoptères et des fourmis dans le régime alimentaire de l’Outarde houbara (Fox 1988, Combreau & Rambaud 1994, Tigar & Osborne 2000, Nadeem et al. 2004, Gubin 2008).
Au Pakistan, la fraction animale était composée surtout de fourmis et de coléoptères principalement les Tenebrionidae dont les espèces les plus fréquentes étaient Adesmia
aenescens avec une fréquence d’occurrence de 22,6-94% et d’un poids sec total de 11%, Pimelia sp. (19,5-24% et 2,2%) et Arthrodosis sp. (9,7-21% et 2,5%) (Fox 1988,
Nadeem et al. 2004). En plus des coléoptères et des fourmis, Mian (1988) a signalé l’importance des criquets.
Au Kyzylkum, Gubin (2008) a montré que les coléoptères présentaient l’un des groupes les plus importants du régime alimentaire. Ils étaient présents dans 50% des échantillons, leur volume variait selon les saisons (1,4% en mars, 56% en mai-juin, 11,8% en septembre et 80% en octobre). Les Tenebrionidae, principalement Adesmia
panderi, constituaient la famille la plus importante avec un minimum de 0,1% du
volume total en mars et un maximum de 41,9% en mai. Les autres familles fréquemment consommées étaient les Curculionidae et les Scarabaeidae. Cependant, certaines espèces du genre Scarabeus qui sont de grande taille et abondantes dans le milieu faisaient rarement partie du régime. Les arachnides représentaient aussi un aliment important dans le régime alimentaire de cette espèce (Gubin 2008). Les orthoptères, principalement les Acrididae, étaient prédominants durant la période juin-août quand les autres groupes commencent à disparaître à cause de la chaleur en cette période (Gubin 2008). Gubin a mentionné aussi l’importance des vertébrés dans la composition du régime alimentaire de l’Outarde au Kazakhstan. Les lézards (Eremias
arguta, Phrynochepalus helioscopus) étaient les plus fréquents dans les échantillons de
mai et juin.
A Abou Dhabi, les Tenebrionidae (Coleoptera) les plus consommés étaient Tentyrina
palmeri, Pimelia arabica, Akis elevator, Blaps kollari, Erodius sp et Adesmia sp.
Messor était le genre le plus fréquent des Formicidae (Tigar & Osborne 2000). Selon
ces auteurs, le régime alimentaire contenait aussi des arachnides, principalement les Scorpions.
Des taxons différents ont été signalés dans le régime alimentaire des outardes en Arabie Saoudite dont les plus fréquents étaient des Formicidae (Camponotus sp) et des coléoptères (Trachyderma, Zophosis, Mesostena, Scaurus) (Combreau & Rambaud 1994).
En ce qui concerne la sous-espèce africaine des Iles Canaries, les insectes les plus abondants étaient Conorhynchus conicirostris (Coleoptera : Curculionidae), Zophosis
plicata (Coleoptera : Tenebrionidae) et Messor maurus (Hymenoptera : Formicidae)
avec un passage de l’alimentation des fourmis aux Zophosis chaque fois que ces derniers sont disponibles (Collins 1993).
Stratégie alimentaire de l’Outarde houbara
La stratégie alimentaire de l’outarde houbara n’a pas été sujet d’études approfondies (calcul d’indice de sélection…).
L’oiseau a été souvent décrit comme opportuniste, son régime reflète les variations locales et saisonnières de la disponibilité (Collins 1984, Mian 1988, Saint Jalme & van Heezik 1996, Tigar & Osborne 2000). Selon Collins (1984), en se basant sur des observations directes, l’Outarde peut adopter deux types de stratégies selon la disponibilité en aliments. Stratégie 1 : l’individu se déplace d’une ressource à une autre en la consommant pendant une longue durée. Stratégie 2 : stratégie adoptée dans les habitats nus où l’outarde explore de grandes surfaces et consomme ce qu’elle trouve dans le milieu pendant des courtes durées.
Tigar et Osborne (2000) ont montré qu’en période de non-reproduction, les Outardes houbara asiatiques hivernant aux Emirats Arabes Unis présentaient un régime non sélectif (généraliste). Néanmoins, d’autres auteurs ont constaté le contraire (Gillet 1988, Goriup & Norton 1992, Collins 1993, Tigar & Osborne 2000). Gillet (1988) par exemple a constaté que l’outarde présente un régime alimentaire très sélectif, au moins en hiver et au printemps humide, durant lesquels l’outarde semblerait choisir les jeunes pousses à cause de leur apport nutritif riche en acide nucléique. Collins (1993) a montré une préférence des outardes aux aliments les plus profitables. Selon Goriup et Norton (1992), l’houbara peut développer un régime spécifique pour une seule espèce telle que les fourmis ce qui pourrait refléter une préférence alimentaire ou une abondance à court terme de certaines espèces de proie.
2.5.4.2. Régime alimentaire d’autres espèces d’Outarde
Contrairement à l’Outarde houbara, des études quantitatives du régime alimentaire ont été réalisées sur la Grande et l’Outarde canepetière (Lane et al. 1999, Jiguet 2002). Cependant chez la Canepetière l’étude a porté principalement sur les arthropodes.
Proportions relatives des fractions animale et végétale
Selon Jiguet et al. (2002), la proportion relative en poids sec du matériel végétal chez l’Outarde canepetière (Tetrax tetrax), était plus importante : elle était d’environ 99% en mars et octobre et 97% en août. Néanmoins, le matériel végétal n'a jamais été retrouvé dans les fèces des poussins, ceci illustre un régime alimentaire exclusivement animal au moins pendant les premières semaines après leur naissance (Jiguet 2002). Selon ce même auteur, la comparaison entre sexes de la proportion du poids sec des arthropodes durant la période de ponte (Juin-Juillet) n’a montré aucune différence.
La composition du régime alimentaire chez la Grande Outarde (Otis tarda), était dominée par le matériel végétal (93%) avec une variation saisonnière atteignant un maximum de 99,9% durant la période décembre - mars et un minimum de 59% au mois d’août (Lane et al. 1999).
Composition végétale
Dans les fèces de la Grande Outarde, Lane (1999) a déterminé 65 espèces appartenant à 20 familles (Annexe I : Tableau 4). Les espèces les plus importantes étaient Medicago
sativa (plante cultivée) avec une dominance maximale durant la période novembre-mai,
des graminées sauvages, Papaver rhoeas qui était présente toute l’année excepté en octobre et novembre et des feuilles de Vitis vinifera fortement sélectionnées en juillet et août.
Composition animale
En Europe, les proies animales de l’Outarde canepetière se composaient de sept ordres d'insectes dont les principaux étaient par ordre d’importance Coleoptera, Orthoptera, Dermaptera et Hymenoptera et de deux ordres d’arachnides (Annexe I : Tableau 5). Indépendamment de l'âge et du sexe, les proies les plus courantes de la canepetière étaient représentées par le groupe des Coleoptera (56% de la fraction animale). Les Orthoptera contribuaient largement dans ce régime alimentaire mais seulement pendant
l’été (juin-août), ils étaient rarement consommés en dehors de cette saison. Ces résultats sont similaires à ceux constatés chez la grande Outarde (Lane et al. 1999).