ﺍﻮﻟﺎﻗ
ﺎﻣ ﻻﺇ ﺎﻨﻟ ﻢﻠﻋ ﻻ ﻚﻧﺎﺤﺒﺳ
ﺎﻨﺘﻤﻠﻋ
ﻚﻧﺇ
ﻢﻴﻜﳊﺍ ﻢﻴﻠﻌﻟﺍ ﺖﻧﺃ
ﺔﻳﻵﺍ :ﺓﺮﻘﺒﻟﺍ ﺓﺭﻮﺳ
)
31
(
MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT
DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 - 2013 : Professeur Najia HAJJAJ – HASSOUNI
ADMINISTRATION :
DoyenProfesseur Mohamed ADNAOUI
Vice-Doyen chargé des Affaires Académiques et estudiantines
Professeur Brahim LEKEHAL
Vice-Doyen chargé de la Recherche et de la Coopération
Professeur Toufiq DAKKA
Vice-Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général
1 - ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS
PROFESSEURS :
DECEMBRE 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation Pr. SETTAF Abdellatif Pathologie Chirurgicale NOVEMBRE ET DECEMBRE 1985
Pr. BENSAID Younes Pathologie Chirurgicale
JANVIER, FEVRIER ET DECEMBRE 1987
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
DECEMBRE 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie JANVIER ET NOVEMBRE 1990
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique Pr. TAZI Saoud Anas Anesthésie Réanimation
FEVRIER AVRIL JUILLET ET DECEMBRE 1991
Pr. AZZOUZI Abderrahim Anesthésie Réanimation- Doyen de FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZAD Rachid Gynécologie Obstétrique Méd. Chef Maternité des Orangers
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie- Dir. du Centre National PV Rabat Pr. TAOUFIK Jamal Chimie thérapeutique V.D à la pharmacie+Dir. du CEDOC +
DECEMBRE 1992
Pr. AHALLAT Mohamed Chirurgie Générale Doyen de FMPT Pr. BENSOUDA Adil Anesthésie Réanimation Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie Pr. CHRAIBI Chafiq Gynécologie Obstétrique Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
MARS 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid
Endocrinologie et Maladies Métaboliques Doyen de la FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique Pr. EL BARDOUNI Ahmed Traumato-Orthopédie Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale – Directeur du CHIS-Rabat Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
MARS 1994
Pr. ABBAR Mohamed* Urologie Directeur Hôpital My Ismail Meknès Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
MARS 1995
Pr. ABOUQUAL Redouane Réanimation Médicale
Pr. AMRAOUI Mohamed Chirurgie Générale Pr. BAIDADA Abdelaziz Gynécologie Obstétrique
Pr. BARGACH Samir Gynécologie Obstétrique Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie Inspecteur du Service de Santé des FAR Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale DECEMBRE 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie Pr. BOULANOUAR Abdelkrim Ophtalmologie Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie DirecteurHôp.Mil. d’Instruction Med V Rabat NOVEMBRE 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TOUFIQ Jallal Psychiatrie Directeur Hôp.Ar-razi Salé Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
NOVEMBRE 1998
Pr. BENOMAR ALI Neurologie Doyen de la FMP Abulcassis Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. BENKIRANE Majid* Hématologie
JANVIER 2000
Pr. ABID Ahmed* Pneumo-phtisiologie
Pr. AIT OUAMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Directeur Hôp. My Youssef
Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Pr. TACHINANTE Rajae Anesthésie-Réanimation Pr. TAZI MEZALEK Zoubida Médecine Interne NOVEMBRE 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie - Directeur Hôp.Cheikh Zaid
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. ROUIMI Abdelhadi* Neurologie
DECEMBRE 2000
Pr.ZOHAIR ABDELLAH * ORL
Pr. BALKHI Hicham* Anesthésie-Réanimation Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie Pr. EL MADHI Tarik Chirurgie-Pédiatrique Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie - Directeur Hôp. d’EnfantsRabat Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale Pr. KABBAJ Saad Anesthésie-Réanimation
Pr. KABIRI EL Hassane* Chirurgie Thoracique Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale Pr. MIKDAME Mohammed* Hématologie Clinique Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie - Directeur Hôpital Ibn Sina Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
DECEMBRE 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie Pr. BERNOUSSI Zakiya Anatomie Pathologique Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL Fellous Sidi Zouhair Chirurgie Pédiatrique Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie Pr. KRIOUILE Yamina Pédiatrie
Pr. MABROUK Hfid* Traumatologie Orthopédie Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie Pr. RACHID Khalid * Traumatologie Orthopédie Pr. RAISS Mohamed Chirurgie Générale Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumo-phtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
JANVIER 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie Pr. CHERRADI Nadia Anatomie Pathologique Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie Pr. HACHI Hafid Chirurgie Générale Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire Pr. OUBAAZ Abdelbarre * Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
JANVIER 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie Directeur Hôp. Al Ayachi Salé
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim* Biophysique Pr. EL HAMZAOUI Sakina * Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire Pr. LYAGOUBI Mohammed Parasitologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique Pr. ZERAIDI Najia Gynécologie Obstétrique
AVRIL 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique
Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire. Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation Pr. HARMOUCHE Hicham Médecine Interne Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie Pr. OUANASS Abderrazzak Psychiatrie Pr. SAFI Soumaya* Endocrinologie Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie DECEMBRE 2006
Pr SAIR Khalid Chirurgie générale Dir. Hôp.Av.Marrakech OCTOBRE 2007
Pr. ABIDI Khalid Réanimation médicale Pr. ACHACHI Leila Pneumo phtisiologie Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi * Chirurgie cardio vasculaire Pr. AMHAJJI Larbi * Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed * Anesthésie réanimation Directeur ERSSM Pr. BALOUCH Lhousaine * Biochimie-chimie
Pr. BOUTIMZINE Nourdine Ophtalmologie Pr. CHERKAOUI Naoual * Pharmacie galénique Pr. EHIRCHIOU Abdelkader * Chirurgie générale
Pr. EL BEKKALI Youssef * Chirurgie cardio-vasculaire Pr. EL ABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice Pr. HADADI Khalid * Radiothérapie
Pr. ICHOU Mohamed * Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar * Anesthésie réanimation Pr. LOUZI Lhoussain * Microbiologie
Pr. MADANI Naoufel Réanimation médicale Pr. MAHI Mohamed * Radiologie
Pr. MARC Karima Pneumo phtisiologie Pr. MASRAR Azlarab Hématologie biologique
Pr. MRANI Saad * Virologie
Pr. OUZZIF Ez zohra * Biochimie-chimie Pr. RABHI Monsef * Médecine interne Pr. RADOUANE Bouchaib* Radiologie Pr. SEFFAR Myriame Microbiologie Pr. SEKHSOKH Yessine * Microbiologie Pr. SIFAT Hassan * Radiothérapie
Pr. TABERKANET Mustafa * Chirurgie vasculaire périphérique Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale Pr. TANANE Mansour * Traumatologie-orthopédie Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
DECEMBRE 2008
Pr TAHIRI My El Hassan* Chirurgie Générale MARS 2009
Pr. ABOUZAHIR Ali * Médecine interne
Pr. AGADR Aomar * Pédiatrie
Pr. AIT ALI Abdelmounaim * Chirurgie Générale Pr. AIT BENHADDOU El Hachmia Neurologie
Pr. AKHADDAR Ali * Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. ARKHA Yassir Neuro-chirurgie Directeur Hôp.des Spécialités Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae * Biochimie-chimie Pr. BOUI Mohammed * Dermatologie Pr. BOUNAIM Ahmed * Chirurgie Générale Pr. BOUSSOUGA Mostapha * Traumatologie-orthopédie
Pr. CHTATA Hassan Toufik * Chirurgie Vasculaire Périphérique Pr. DOGHMI Kamal * Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale Pr. EL OUENNASS Mostapha* Microbiologie Pr. ENNIBI Khalid * Médecine interne Pr. FATHI Khalid Gynécologie obstétrique Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. LAMSAOURI Jamal * Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique Pr. MSSROURI Rahal Chirurgie Générale Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-Phtisiologie OCTOBRE 2010
Pr. ALILOU Mustapha Anesthésie réanimation Pr. AMEZIANE Taoufiq* Médecine Interne Pr. BELAGUID Abdelaziz Physiologie Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine Aéronautique Pr. DAMI Abdellah* Biochimie- Chimie Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie Pédiatrique Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie Plastique et Réparatrice Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro-Entérologie Pr. LAMALMI Najat Anatomie Pathologique Pr. MOSADIK Ahlam Anesthésie Réanimation Pr. MOUJAHID Mountassir* Chirurgie Générale
Pr. NAZIH Mouna* Hématologie
DECEMBRE 2010
Pr.ZNATI Kaoutar Anatomie Pathologique MAI 2012
Pr. AMRANI Abdelouahed Chirurgie pédiatrique Pr. ABOUELALAA Khalil * Anesthésie Réanimation Pr. BENCHEBBA Driss * Traumatologie-orthopédie Pr. DRISSI Mohamed * Anesthésie Réanimation Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek * Médecine Interne Pr. EL OUAZZANI Hanane * Pneumophtisiologie Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie Pathologique Pr. MEHSSANI Jamal * Psychiatrie
Pr. RAISSOUNI Maha * Cardiologie
* Enseignants Militaires FEVRIER 2013
Pr.AHID Samir Pharmacologie
Pr.AIT EL CADI Mina Toxicologie Pr.AMRANI HANCHI Laila Gastro-Entérologie Pr.AMOR Mourad Anesthésie Réanimation Pr.AWAB Almahdi Anesthésie Réanimation Pr.BELAYACHI Jihane Réanimation Médicale Pr.BELKHADIR Zakaria Houssain Anesthésie Réanimation Pr.BENCHEKROUN Laila Biochimie-Chimie
Pr.BENKIRANE Souad Hématologie
Pr.BENNANA Ahmed* Informatique Pharmaceutique Pr.BENSGHIR Mustapha * Anesthésie Réanimation Pr.BENYAHIA Mohammed * Néphrologie
Pr.BOUATIA Mustapha Chimie Analytique et Bromatologie Pr.BOUABID Ahmed Salim* Traumatologie orthopédie
Pr BOUTARBOUCH Mahjouba Anatomie
Pr.CHAIB Ali * Cardiologie
Pr.DENDANE Tarek Réanimation Médicale
Pr.DINI Nouzha * Pédiatrie
Pr.ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr.ECH-CHERIF EL KETTANI Najwa Radiologie
Pr.EL FATEMI NIZARE Neuro-chirurgie Pr.EL GUERROUJ Hasnae Médecine Nucléaire Pr.EL HARTI Jaouad Chimie Thérapeutique
Pr.EL JAOUDI Rachid * Toxicologie
Pr.EL KABABRI Maria Pédiatrie
Pr.EL KHANNOUSSI Basma Anatomie Pathologique
Pr.EL KHLOUFI Samir Anatomie
Pr.EL KORAICHI Alae Anesthésie Réanimation Pr.EN-NOUALI Hassane * Radiologie
Pr.ERRGUIG Laila Physiologie
Pr.FIKRI Meryem Radiologie
Pr.GHFIR Imade Médecine Nucléaire
Pr.IMANE Zineb Pédiatrie
Pr.IRAQI Hind Endocrinologie et maladies métaboliques
Pr.KABBAJ Hakima Microbiologie
Pr.KADIRI Mohamed * Psychiatrie
Pr.MAAMAR Mouna Fatima Zahra Médecine Interne
Pr.MEDDAH Bouchra Pharmacologie
Pr.MELHAOUI Adyl Neuro-chirurgie
Pr.MRABTI Hind Oncologie Médicale
Pr.NEJJARI Rachid Pharmacognosie
Pr.OUBEJJA Houda Chirugie Pédiatrique Pr.OUKABLI Mohamed * Anatomie Pathologique
Pr.RAHALI Younes Pharmacie Galénique
Pr.RATBI Ilham Génétique
Pr.RAHMANI Mounia Neurologie
Pr.REDA Karim * Ophtalmologie
Pr.REGRAGUI Wafa Neurologie
Pr.RKAIN Hanan Physiologie
Pr.ROSTOM Samira Rhumatologie
Pr.ROUAS Lamiaa Anatomie Pathologique
Pr.ROUIBAA Fedoua * Gastro-Entérologie Pr SALIHOUN Mouna Gastro-Entérologie
Pr.SAYAH Rochde Chirurgie Cardio-Vasculaire Pr.SEDDIK Hassan * Gastro-Entérologie
Pr.ZERHOUNI Hicham Chirurgie Pédiatrique
AVRIL 2013
Pr.EL KHATIB MOHAMED KARIM * Stomatologie et Chirurgie Maxillo-faciale MAI 2013
Pr.BOUSLIMAN Yassir Toxicologie
MARS 2014
Pr. ACHIR Abdellah Chirurgie Thoracique
Pr.BENCHAKROUN Mohammed * Traumatologie- Orthopédie Pr.BOUCHIKH Mohammed Chirurgie Thoracique
Pr. EL KABBAJ Driss * Néphrologie
Pr. EL MACHTANI IDRISSI Samira * Biochimie-Chimie
Pr. HARDIZI Houyam Histologie- Embryologie-Cytogénétique
Pr. HASSANI Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie
Pr. JANANE Abdellah * Urologie
Pr. JEAIDI Anass * Hématologie Biologique Pr. KOUACH Jaouad* Gynécologie-Obstétrique Pr. LEMNOUER Abdelhay* Microbiologie
Pr. MAKRAM Sanaa * Pharmacologie
Pr. OULAHYANE Rachid* Chirurgie Pédiatrique Pr. RHISSASSI Mohamed Jaafar CCV
Pr. SABRY Mohamed* Cardiologie
Pr. SEKKACH Youssef* Médecine Interne Pr. TAZI MOUKHA Zakia Gynécologie-Obstétrique AVRIL 2014
PROFESSEURS AGREGES : DECEMBRE 2014
Pr. ABILKASSEM Rachid* Pédiatrie
Pr. AIT BOUGHIMA Fadila Médecine Légale Pr. BEKKALI Hicham * Anesthésie-Réanimation Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale Pr. BOUABDELLAH Mounya Biochimie-Chimie Pr. BOUCHRIK Mourad* Parasitologie Pr. DERRAJI Soufiane* Pharmacie Clinique
Pr. DOBLALI Taoufik* Microbiologie
Pr. EL AYOUBI EL IDRISSI Ali Anatomie
Pr. EL GHADBANE Abdedaim Hatim* Anesthésie-Réanimation Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique
Pr. JAHIDI Mohamed* O.R.L
Pr. LAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI NEZHA Anesthésie-Réanimation Pr. RAMI Mohamed Chirurgie Pédiatrique
Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine préventive, santé publique et Hyg. AOUT 2015
Pr. MEZIANE Meryem Dermatologie
Pr. TAHRI Latifa Rhumatologie
JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale
Pr. EL ASRI Fouad* Ophtalmologie
Pr. ERRAMI Noureddine* O.R.L
Pr. NITASSI Sophia O.R.L
JUIN 2017
Pr. ABI Rachid* Microbiologie
Pr. ASFALOU Ilyasse* Cardiologie
Pr. BOUAYTI El Arbi* Médecine préventive, santé publique et Hyg.
Pr. BOUTAYEB Saber Oncologie Médicale
Pr. EL GHISSASSI Ibrahim Oncologie Médicale
Pr. OURAINI Saloua* O.R.L
Pr. RAZINE Rachid Médecine préventive, santé publique et Hyg.
2 - ENSEIGNANTS-CHERCHEURS SCIENTIFIQUES
PROFESSEURS/Prs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie-chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique Pr .BARKIYOU Malika Histologie-Embryologie
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. CHAHED OUAZZANI Lalla Chadia Biochimie-chimie
Pr. DAKKA Taoufiq Physiologie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. IBRAHIMI Azeddine Biologie moléculaire/Biotechnologie Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 10/10/2018 Khaled Abdellah
A mes très chers parents
Aucune expression, ni aucune dédicace ne pourrait exprimer mes
meilleures reconnaissances.
Vous avez guidé mes premiers pas, et vous étiez toujours une source
intarissable d'amour et de sacrifice.
J'espère réaliser en ce jour un de vos rêves, et être digne, toute ma vie
personnelle et professionnelle, de votre éducation et de votre confiance.
A ma sœur Yousra et mon frère Youssef
En témoignage de ma grande affection.
Merci pour votre soutien et encouragements.
Je vous dédie ce travail en vous souhaitons une
vie meilleure, pleine de bonheur de prospérité et de réussite.
A mon mari Nabil Kadari
Pour ta tendresse, tes conseils judicieux, ta présence et tes
encouragements, je te dédie ce travail en témoignage de mes
A la famille Kadari
A mes amies Hasnae et Manal
J’ai beaucoup d’estime pour vous…
Et j’espère que notre amitié restera éternelle…
A notre maître et président de jury de thèse
Monsieur le Professeur Ahmed GAOUZI
Professeur de pédiatrie
Nous sommes immensément touchés par l’insigne honneur que vous
nous faites en acceptant de siéger parmi les membres du jury de
notre thèse.
Ce geste dénote non seulement de votre gentillesse mais surtout de
votre souci du devoir envers vos étudiants.
Veuillez accepter Monsieur le Professeur, ma profonde
reconnaissance et mes remerciements les plus sincères, Soyez assuré
que c’est une fierté pour nous de vous compter parmi les membres de
A notre maitre et rapporteur de thèse
Madame le Médecin Colonel SAIDA TELLAL
Professeur de Biochimie
Votre présence parmi le jury de cette thèse m'a honoré, Je vous
remercie pour vote disponibilité, votre modestie et votre gentillesse,
qui sont de grands atouts à côté de sa rigueur scientifique.
Je vous dédie ce travail en témoignage de ma profonde
reconnaissance et de mes respectueux sentiments.
Merci pour votre disponibilité.
A notre maître et Juge de thèse
Madame le Professeur Colonel SAKINA ELHAMZAOUI
Professeur de Microbiologie
J'ai eu le privilège de profiter de votre enseignement, et j'espère être
digne de votre confiance.
Que ces lignes puissent témoigner de mon grand respect, ma très
haute considération de ma profonde reconnaissance.
Merci d’avoir accepté de siéger parmi notre jury, Merci pour votre
compétence qui n’a d’égale que votre gentillesse, Merci pour votre
A notre maitre et juge de thèse
Monsieur le professeur colonel YASSINE SEKHSOKH
Professeur de Microbiologie
Nous sommes particulièrement touchés par la spontanéité et la
gentillesse avec laquelle vous avez bien voulu accepter de juger ce
travail.
Nous Vous remercions ce grand honneur que vous nous faites.
Veuillez accepter, cher maître, ce travail avec toute notre estime et
Liste des abréviations
Abréviations
AAA+ : ATPases Associated with various cellular Activities.
BAG : Bcl-2 associated athanogene.
CHIP : Carboxyl terminus of Hsc70 interacting protein.
CTD : C-Terminal Domain.
eIF4G : Eucaryotic Initiator Factor 4G.
Hip : HSC70-interacting protein.
Hop : Hsp70-Hsp90 Organizing Protein.
HSE : Heat Shock Element.
HSF : Heat Shock Factors.
hsp : gene codant pour les HSP
HSP : Heat Shock Proteins.
HSR1 :Heat shock RNA-1.
JDP : J-Domain Proteins.
NBD : Nucléotide Binding Domains.
NEF : Nucléotide Exchange factor.
SBD : Substrat Binding Domain.
Liste des figures
Figure 1: Evolution de la résistance de l’organisme au cours des trois phases du «
Syndrome général d’adaptation » de Selye ... 8
Figure 2: Représentation schématique du stress... 9 Figure 3: Organisation des domaines pour les différentes sous familles de HSP110. ... 13 Figure 4: Structures des HSP110 de classes 1 et 2 et de leurs domaines AAA+. ... 14 Figure 5: Fonctionnement de la HSP110 en collaboration avec le complexe HSP40/
HSP70. ... 15
Figure 6: Structure du dimère de HSP90 dans ces différentes conformations. ... 16 Figure 7: Cycle des interactions du dimère de HSP90 avec ses Co-chaperonne. ... 17 Figure 8: Structure et conformations de la HSP70. ... 18 Figure 9: Cycle des interactions de la HSP70 avec les Co-chaperonnes de types NEF et
JDP. ... 20
Figure 10: Formation du complexe HSP60/HSP10. ... 21 Figure 11: Structure d’une HSP60 et du complexe chaperon HSP60-HSP10. ... 22 Figure 12: Structures des 3 types de HSP40. ... 24 Figure 13: Structure de la HSP27. ... 25 Figure 14: Schéma de synthèse des effets régulateurs des chaperons moléculaires (HSP)
sur les principaux processus cellulaires ... 27
Figure 15: Effets de HSP70 libre sur le système immunitaire. ... 34 Figure 16: Synthèse de protéines de choc thermique. ... 37 Figure 17: Représentation des récepteurs de la mort TNF-R1, Fas et DR4. ... 41 Figure 18: Apoptose mitochondrial. ... 45
Figure 19: Schéma récapitulatif du rôle anti-apoptotique des HSP dans les deux voies de
l’apoptose. ... 46
Figure 20: Analyse de la viabilité cellulaire après 72 h de traitement par les inhibiteurs de
Hsp90 AUY922, BIIB021. ... 58
Figure 21: Analyse de la viabilité cellulaire après 72 h de traitement par les inhibiteurs de
Hsp90 NVP-AUY922, BIIB021 et AT-13387. ... 58
Figure 22: Analyse de la viabilité cellulaire après 72 h de traitement par les inhibiteurs de
HSP90 NVP-AUY922, BIIB021 et AT-13387. ... 59
Figure 23: Analyse de HSF1 en réponse à NVP-AUY922. ... 60 Figure 24: Analyse de HSF1 en réponse à NVP-AUY922. ... 60 Figure 25: Analyse de viabilité des cellules SK-BR-3 et T-47D. ... 61 Figure 26: Corrélation de l'activité basale de HSF1 caractérisée par le rapport HOP / CHIP
avec la sensibilité aux inhibiteurs de HSP90. ... 63
Figure 27: Expression de HSP27 dans les cœurs de souris Tg. ... 70 Figure 28: Images représentatives du doppler pulsé de l'échocardiographie valvulaire
bicuspide. ... 71
Figure 29: HSP27 diminue l'expression de p16 et p53 dans le cœur de souris âgées. ... 72 Figure 30: Petits HSP et stress cardiaque. ... 88 Figure 31: Les Small HSP et le stress cardiaque. ... 93 Figure 32: Les inhibiteurs de HSP70. ... 106 Figure 33: HSP90 différences entre les cellules tumorales et les cellules normales
Liste des tableaux
Tableau I: Les différentes familles d’HSP et leur poids moléculaire, localisation cellulaire,
fonction et conditions d’expression. ... 12
Tableau II: Implications de HSP dans le pronostic et la pathologie cancéreuse ... 85 Tableau III: intervention des HSP selon les conditions pathologiques. ... 97 Tableau IV: Liste des inhibiteurs de HSP90 en essai clinique. ... 110
I. Introduction ...2 II. Présentation des HSP « Heat Shock Proteins » ...6
A. Le stress systémique et les Heat Shock Proteins ...6 1. Qu’est-ce que le stress ...6 1.1. Définitions ...6 1.2. Histoire ...6 1.3. Intégration temporelle ...9 2. Les différentes familles des Heat Shock Proteins ... 10 2.1. Les HSP de haut poids moléculaire ... 13 2.1.1. La famille des HSP110 ... 13 2.1.2. La famille des Hsp90 ... 15 2.1.3. La famille des HSP70 ... 17 2.1.4. La famille des HSP60 ... 21 2.1.5. La famille des HSP40 ... 23 2.2. Les petites HSP : les small heat proteins (sHSP) ... 24 3. Rôles des Heat Shock Proteins ... 26 3.1. Selon les conditions... 26 3.1.1. Dans les conditions basales ... 26 3.1.2. Dans les conditions de stress ... 27 3.1.3. Dans le pré-conditionnement... 28 3.2. Rôles des HSP en intracellulaires ... 28 3.2.1. Activité de chaperon moléculaire ... 28 3.2.2. Activité anti-apoptotique ... 30
3.2.3. Autres fonctions intracellulaires ... 30 3.3. Rôles des HSP en extracellulaires ... 30 3.3.1. Comment les HSP peuvent se retrouver à l’extérieur de la cellule ?... 31 3.3.2. Fonction extracellulaire de HSP70 ... 33 3.3.2.1. Rôle de HSP70 sous sa forme libre ... 33 3.3.2.2. Rôle de HSP70 associée aux membranes ... 34 4. L’induction de la réponse au stress ... 35 4.1. Signal inducteur ... 35 4.2. Facteurs de transcription « Heat Shock Factor » ... 36 5. Les interactions glucocorticoïdes-HSP ... 38 5.1. L’effet potentialisateur des glucocorticoïdes ... 38 5.2. L’effet inhibiteur des glucocorticoïdes ... 39 B. HSP et régulation cellulaire ... 39 1. L’inhibition de l’activité des récepteurs de la mort cellulaire ... 40 1.1. L’apoptose ... 40 1.2. Les récepteurs de mort (voie extrinsèque)... 40 1.3. Protection engendrée par les protéines de stress ... 42 2. L’inhibition des effecteurs de la mort cellulaire ... 43 2.1. La voie apoptotique mitochondriale (voie intrinsèque) ... 43 2.1.1. L’apoptose mitochondriale ... 43 2.1.2. Mécanismes moléculaires du blocage induit par les HSP... 45 2.2. La mort cellulaire indépendante des caspases (l’autophagie) ... 47 3. Les voies de transduction des signaux ... 48 3.1. La modulation de kinases ... 48
3.2. Le cycle et la division cellulaire ... 49 3.2.1. Modulation directe du cycle ... 49 3.2.2. HSP et mitose ... 49 4. Facteurs de transcription ... 50 4.1. Le suppresseur de tumeur p53 ... 50 4.2. Les autres facteurs de transcriptions ... 51
III. Exploration ... 53
A. Marqueur prédictif de la sensibilité des cellules cancéreuses à l'inhibition de HSP90 .... 53 1. Introduction ... 53 2. Matériels et Méthodes... 54 2.1. Cultures cellulaires ... 54 2.2. Test de viabilité ... 54 2.3. SDS-PAGE et immunoblot ... 55 2.4. Analyse de la phosphorylation de HSF1 ... 55 2.5. qRT-PCR ... 56 3. Résultats ... 56 3.1. Les lignées cellulaires du cancer du sein ont une réponse variable à l'inhibition de HSP90 ... 56 3.2. Caractérisation de l'activité de HSF1 ... 59 3.3. L’activité de HSF1 définie par le rapport HOP / CHIP est corrélée à la sensibilité à l’inhibition de HSP90 ... 62 4. Discussion ... 64 B. HSP27 attenue le vieillissement cardiaque par mitophagie ... 66 1. Introduction ... 66 2. Matériels et méthodes ... 67
2.1. Anticorps et Réactifs ... 67 2.2. Animaux ... 67 2.3. Échocardiographie ... 68 2.4. Coloration au trichrome de Masson ... 68 2.5. Dosage DCFH ... 68 2.6. Carbonylation des protéines ... 69 2.7. Coloration par immunofluorescence ... 69 2.8. Western Blot ... 69 2.9. Analyses statistiques ... 70 3. Résultats ... 70 3.1. HSP27 atténue le déclin de la fonction cardiaque induit par le vieillissement ... 70 3.2. HSP27 diminue les niveaux de vieillissement des marqueurs p53 et p16 dans le myocarde de souris âgées ... 72 3.3. HSP27 Atténue La Fibrose Dans Le Myocarde Interstitiel De Vieilles Souris ... 73 3.4. HSP27 diminue la teneur en ROS dans le myocarde de souris âgées ... 73 3.5. HSP27 réduit l'accumulation de LC3-II et de p62 dans les cœurs âgés ... 73 3.6. HSP27 augmente l'expression de PINK1 et de Parkin chez les cœurs âgés... 74 3.7. HSP27 réduit les protéines conjuguées à l'ubiquitine ... 74 4. Discussion ... 74
IV. HSP et maladies : rôles protecteurs, mais aussi délétère ... 79
A. Caner ... 79 1. HSP et transformation tumorale ... 79 2. Cancer et expression des HSP ... 80 2.1. HSP27 et cancer ... 80
2.2. HSP70 et cancer ... 80 2.3. HSP90 et cancer ... 80 2.4. HSP110 et cancer ... 81 3. Rôle cytoprotecteur des HSP en thérapie anticancéreuse ... 82 3.1. La chimiothérapie ... 82 3.2. La radiothérapie ... 83 4. Les HSP et l’agressivité tumorale ... 83 5. Le diagnostic cancéreux... 85 B. Maladies neurologiques ... 86 1. Les maladies neurodégénératives ... 86 2. Ischémie cérébrale ... 87 C. Maladies cardiaques ... 87 1. Ischémie/Reperfusion ... 87 2. Hypertrophie cardiaque... 92 3. Fibrillation auriculaire ... 95 D. HSP et immunité ... 96 1. HSP40 ... 98 2. HSP70 ... 99 V. HSP et la thérapeutique ... 103 A. Inhibition des HSP ... 103 1. HSP27 une cible thérapeutique ... 103 2. HSP70 une cible thérapeutique ... 104 2.1. Inhibiteurs liant le SDB ... 104 2.2. Inhibiteurs ciblant l’ABD ... 104
2.3. Inhibiteurs des Co-chaperons de HSP70 ... 105 3. HSP90 une cible thérapeutique ... 107 3.1. Les inhibiteurs naturels ... 108 3.2. Les inhibiteurs de synthèse ... 109 B. HSP et immunité ... 111 1. HSP et système immunitaire ... 111 2. HSP et vaccination ... 111 VI. Conclusions ... 114 Résumés ... 116 Bibliographie ... 120
I. Introduction
L’étude de l’adaptation des organismes à leur environnement permet une meilleure compréhension des mécanismes de colonisation, d’expansion, voire de déclin des espèces en fonction des conditions écologiques. Les réponses adaptatives peuvent être décelées à différents niveaux : comportementaux, physiologiques, cellulaires et moléculaires. Les avancées technologiques permettent maintenant d’appréhender les phénomènes adaptatifs à l’échelle moléculaire et de les intégrer dans un contexte plus global, physiologique voire écologique. Globalement, les organismes répondent aux variations des paramètres écologiques par trois processus. Les premières réponses mises en jeu lors de fluctuations de ces paramètres difficilement supportables pour l’espèce portent sur des modifications comportementales d’évitement. Les animaux par exemple peuvent manifester un comportement de fuite ou d’enfouissement. Ces réponses précoces peuvent également s’observer à l’échelle moléculaire, par des mécanismes d’induction ponctuels de protéines de stress. Si les organismes restent dans ces conditions écologiques plus longuement, ils développent alors des réponses d’acclimatation, illustrées par des modifications physiologiques et morphologiques induites par des accentuations ou inhibitions plus larges d’expressions géniques. Enfin, si les conditions environnementales deviennent stables et permanentes sur le long terme, seuls les individus possédant des aptitudes à tolérer ces paramètres écologiques survivront et transmettront leurs gènes. On parle alors de processus adaptatif (par ancrage génique), pour signifier l’irréversibilité du phénomène.
Plus généralement, l’expression de certaines protéines appelées protéines de stress thermique « Heat shock Proteins » ou « HSP » conditionne le succès des organismes à la colonisation pérenne de leur environnement. Il est montré que les gènes des protéines de stress sont présents en multiple copies, souvent organisées en regroupement, et issues de duplications liées à l’activité d’éléments transposables.
D’autre part, le niveau d’expression constitutif des protéines de stress est souvent bien plus élevé chez les organismes thermotolérants, que chez les organismes thermosensibles issus de régions tempérées. Cette particularité, serait une stratégie d’adaptation pour l’anticipation des variations de la température. La présence continuelle d’une concentration
élevée de ces protéines permettrait d’éviter la mise en place de mécanismes d’induction lors de stress thermiques fréquents et modérés, et permettrait de minimiser cette induction lors de chocs thermiques plus importants.
Chez les organismes thermotolérants, le niveau basal important des protéines de stress et son induction modérée pendant un stress thermique peuvent être accompagnés d’une expression particulièrement faible des facteurs de transcription des gènes codant pour ces protéines (HSF-1 ou Heat Shock Factor-1). Cependant, des expériences complémentaires montrent que HSF-1 a une affinité plus grande pour leurs promoteurs chez les espèces thermotolérantes, par rapport aux espèces sensibles. Le seuil d’activation de HSF-1 par la température est variable d’une espèce à l’autre, et semble primordial dans les mécanismes d’acclimatation. En effet, le seuil d’activation, et en conséquence l’induction des gènes codant, est directement corrélé avec la température d’acclimatation des organismes.
Les différentes familles d'HSP ont un rôle dans l'organisme normal et elles sont aussi impliquées dans certains mécanismes physiopathologiques. Leur fonction de chaperon dans l'assemblage, le reploiement, la translocation et parfois la stabilisation ainsi que la régulation d'activité de protéines importantes suggèrent fortement un rôle vital des HSP dans les cellules sous conditions physiologiques. De plus, elles semblent avoir un rôle protecteur vis-à-vis de certains stress et occuper une place centrale lors de lésions cellulaires ou tissulaires causées par des stress locaux ou systémiques via un dommage protéique. Choc, infarctus du myocarde, syndromes inflammatoires, maladies infectieuses et parasitaires, désordres auto-immuns, cancers et pathologies liées à une mauvaise conformation protéique sont autant d'exemples de conditions dans lesquelles les HSP sont examinées minutieusement. Le rôle de ces chaperons moléculaires dans la récupération cellulaire de lésions induites par une variété de nuisances d'ordre clinique ou chirurgical soulève également un grand intérêt.
Quelques études commencent à élucider la signification de cette induction afin de présenter les utilisations potentielles des HSP comme marqueurs diagnostiques et/ou indicateurs pronostiques.
Notre travail vise les objectifs suivants :
Définir les protéines de choc thermique « HSP », donner leurs classifications et leurs rôles dans différentes situations.
Décrire l’intervention des HSP dans les processus vitaux en conditions physiologiques normales.
Définir leurs rôles dans certaines maladies et montrer comment elles peuvent être des marqueurs de diagnostic ou de pronostic.
Présentation des HSP « Heat Shock
Proteins »
II. Présentation des HSP « Heat Shock Proteins »
A. Le stress systémique et les Heat Shock Proteins
1. Qu’est-ce que le stress
1.1. DéfinitionsEtymologiquement, le mot « stress » provient du latin « stringere » qui signifie « mettre en tension ». Mais se réfère-t-il à ce qui met en tension ou ce qui est mis en tension ? Cette ambiguïté de la définition du stress entre agent inducteur et l’état induit est retrouvée dans les définitions habituelles.
D’un côté le mot stress décrit la réaction de l’organisme à une situation :
Stress : réaction de l’organisme à un agent d’agression ou à un traumatisme quelconque. (Encyclopaedia Universalis) ou réponse de l’organisme aux facteurs d’agressions physiologiques et psychologiques ainsi qu’aux émotions (agréables ou désagréables) qui nécessitent une adaptation. (Larousse)
D’un autre côté, il signifie plutôt la situation subie par l’organisme :
Stress : agent ou processus physique, chimique ou émotionnel qui s’exerce sur l’organisme et provoque une agression ou une tension pouvant devenir pathologique. (Encyclopédie encarta) ou agression contre un organisme vivant, par extension : réactions biologiques et psychologiques d’un organisme face à une situation nouvelle de quelque origine qu’elle soit, dangereuse ou agréable.
Dans ce travail, nous entendons le stress comme étant la réaction biologique de l’organisme, indépendamment de sa valeur. La situation déclenchant cette réaction correspond au «stresseur » ou « agent stressant », ou encore « agresseur ».
1.2. Histoire
A la fin du 19ème siècle, le physiologiste Claude Bernard souligne que l’une des propriétés essentielles des êtres vivants est la faculté de maintenir la stabilité du milieu intérieur, condition indispensable à la survie dans un environnement toujours changeant. Ce
concept sera nommé « homéostasie » au début du 20ème siècle par Cannon. La préservation de l’environnement interne est faite par des ajustements compensatoires et anticipatoires grâce au système sympathico-adrénal homéostatique augmentant les chances de survie par le maintien de l’homéostasie[1]. Les paramètres physiologiques essentiels pour la vie, maintenus dans les limites de la normalité par ces ajustements sont la Tco, le pH, la PO2, la PCO2 et l’osmolarité[2]. Cette théorie présente l’inconvénient de concevoir l’organisme dans un état trop statique, non flexible.
Le terme de stress fut réellement introduit par Selye comme la réaction apsécifique de l’organisme à des agresseurs différents. « Le stress est indispensable à la vie et l’absence totale de stress, c’est la mort » [3]. On entrevoit dans cette phrase les connotations négatives du stress (les conséquences délétères du stress inadapté ou « distress ») mais aussi positive (la réponse adpatée de l’organisme ou « eustress »). Le stress a donc été associé au concept de « syndrome général d’adaptation » [4](Figure1). Face à divers agents nocifs, ce syndrome se développe en trois phases :
(i) L’alarme correspond à la réaction biologique initiale de courte durée (catabolisme, hypoglycémie, hémoconcentration, sécrétion catécholaminergique surrénalienne).
(ii) La phase de résistance correspond à la mobilisation de processus physiologiques donnant les moyens de résister (anabolisme, hémodilution, sécrétion de glucocorticoïdes).
(iii) Si le stresseur persiste trop longtemps, l’organisme entre dans la phase d’épuisement correspondant au débordement des capacités adaptatives de l’organisme avec la réapparition des manifestations de la réaction d’alarme et l’apparition des premiers signes lésionnels.
Figure 1: Evolution de la résistance de l’organisme au cours des trois phases du « Syndrome général d’adaptation » de Selye[5].
La première réaction à un agent stressant est marquée par une diminution de la résistance. Si l’organisme s’adapte, le niveau de résistance augmente et la réaction d’alarme disparaît. Une exposition au stress trop prolongée conduit à un épuisement des ressources et une réapparition des signes de la réaction d’alarme. L’axe des abscisses représente le temps et en ordonnées représenté le niveau de résistance. Les notions d’homéostasie et les aspects
que recouvre le « syndrome général d’adaptation » ont été repris et complétés par Sterling[6]à travers les termes d’allostasie et de charge allostasique. L’allostasie est l’ensemble des mécanismes permettant à l’organisme de fonctionner en dehors des zones homéostasiques de repos mais au prix d’un coût biologique (charge allostasique). L’organisme se trouve alors dans un état d’équilibre dynamique non économique qui peut être maintenu durant une période limitée du fait de la charge allostasique. Les médiateurs de l’allostasie, incluent les hormones de l’axe hypothalamo-hypophyso-corticosurrénalien (HPA), les catécholamines et les cytokines. Un état allostasique s’accompagne donc de modifications d’activité de ces médiateurs primaires en réponse à un changement environnemental. Lorsque la charge allostasique dépasse les mécanismes adaptatifs, on parle de surcharge allostasique avec l’apparition des premiers signes pathologiques[6].
1.3. Intégration temporelle
De ces théories ressort l’idée d’un continuum allant d’une phase d’alarme à une phase de résistance (d’adaptation, « d’eustress », d’état allostasique) où l’organisme reste en bonne santé au prix d’un coût qu’il peut assumer sans dommage pour sa structure, vers une phase d’épuisement (« distress », surcharge allostasique) où l’organisme devient malade (Figure2). L’optimum est donc une phase de résistance à coût minimal et non une absence totale de stress. La transition d’un état physiologique vers un état pathologique se déroule lorsque le stress trop intense, prolongé trop longtemps ou répété trop souvent finit par induire une charge allostérique excédant les capacités de l’organisme.
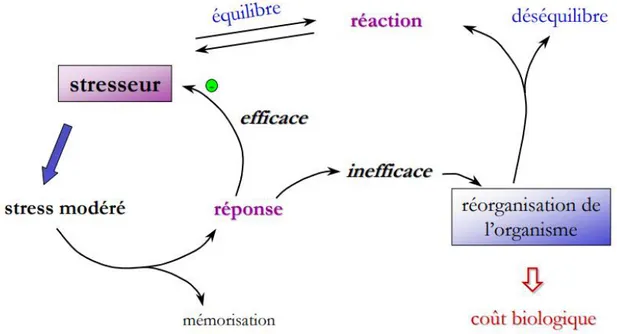
Figure 2: Représentation schématique du stress.
Le stresseur déclenche une réponse de l’organisme qui sera mémorisée et qui conduit (i) soit à l’atténuation du stresseur si elle est efficace (état allostasique maintenant l’homéostasie), (ii) soit à une réorganisation de l’organisme si elle est inefficace. Cette réorganisation présente un coût biologique aboutissant (i) soit à un état d’équilibre dynamique (charge allostasique) avec le stresseur (ii) soit à un déséquilibre si l’organisme ne parvient pas à s’adapter (surcharge allostasique). Il existe donc une dynamique de la réaction
défini par l’efficacité avec laquelle l’organisme éteint ou non le stresseur. Le schéma ci-dessus représente les différents types de réponses à un stresseur aboutissant soit à l’extinction du stresseur, soit à l’établissement d’un équilibre entre le stresseur et l’organisme, soit à un déséquilibre entre l’organisme et le stresseur. Cependant, les connaissances actuelles ne fournissent que peu d’idées concernant les mécanismes sous-jacents de cette transition. Ceci peut être expliqué par l’existence de différences inter-individuelles dans la mise en place des mécanismes de lutte contre un agresseur, conduisant à une grande variabiité de profil de résistance.
2. Les différentes familles des Heat Shock Proteins
Le maintien de l’homéostasie cellulaire est essentiel pour le bon fonctionnement des cellules. Celles-ci sont cependant continuellement soumises à différentes agressions qui menacent leur intégrité. L’état de stress des cellules peut être provoqué par de nombreux facteurs environnementaux (choc thermique, choc oxydatif, ultraviolet), l’exposition à des agents pharmacologiques (métaux lourds, alcool, agents oxydants, chimiothérapies anticancéreuses), ou encore par certaines conditions pathologiques (fièvre, inflammation). Ces stress physiques, chimiques ou physiologiques entraînent une modification de l’expression de certains gènes, ce phénomène est appelé « réponse au choc thermique » ou « réponse au stress».
La réponse au choc thermique a été mise en évidence en 1962 par Ferrucio Ritossa suite à l’observation d’un renflement des chromosomes géants des glandes salivaires de drosophile après l’augmentation accidentelle de la température de son incubateur. L’activation chromosomique a ensuite été corrélée à l’expression de protéines de thermorésistance appelées « protéines de choc thermique » ou HSP.
Les HSP sont des protéines cellulaires très conservées d’une espèce à l’autre et sont retrouvées aussi bien chez les bactéries, les levures, les plantes, les animaux que chez l’homme. Alors que les HSP représentent déjà 2 à 3% des protéines cellulaires totales à l’état basal, leur expression est fortement induite en condition de stress. L’induction des gènes des HSP nécessite l’activation et la translocation au noyau de facteurs de transcription spécifiques, les « heat Shock Factors » (HSF).
Les HSF se lient à l’ADN sur des séquences particulières, les « Heat Shock Element » (HSE), présentes en plusieurs copies dans le promoteur des gènes des HSP permettant ainsi leur expression. Les HSP sont retrouvées dans tous les compartiments cellulaires (cytoplasme, noyau, mitochondrie, réticulum endoplasmique, lysosomes…) et agissent comme des chaperons moléculaires.
Afin de maintenir l’homéostasie cellulaire, les HSP prennent en charge la conformation tridimensionnelle des protéines nouvellement formées ou anormales et participent à la formation de complexes multi-protéiques en condition physiologique ou suite à un stress.
Les HSP peuvent participer au transport de leur substrat au travers des compartiments cellulaires, ainsi que dans la régulation de voies de signalisation. Si les HSP échouent à replier et maintenir la bonne conformation de protéines anormales, elles peuvent alors les orienter vers la voie de dégradation du système ubiquitine/protéasome. Lors d’un stress engageant la mort cellulaire programmée, l’apoptose, les HSP peuvent bloquer les voies de signalisation apoptotiques à différents niveaux et favoriser les voies de signalisation de survie cellulaire. Les HSP interviennent finalement dans la différenciation et l’érythropoïèse en régulant la stabilité ou la localisation de protéines et facteurs de transcription clefs.
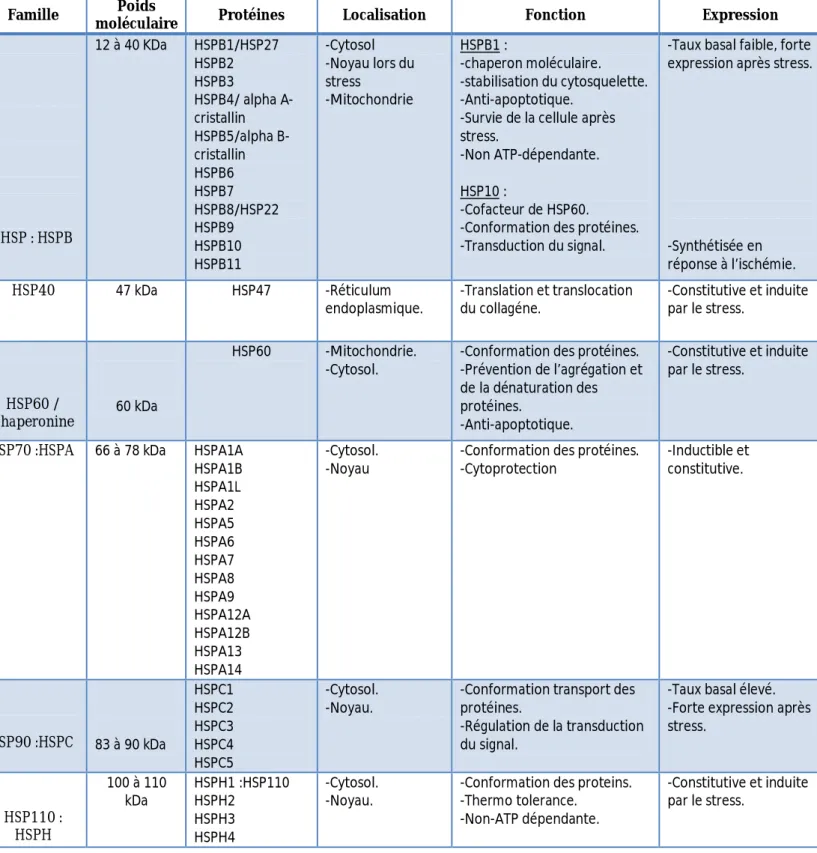
Les protéines de stress sont classées en deux groupes distincts suivant leur poids moléculaire: les petites HSP ou sHSP (small HSP) et les grandes de poids moléculaire supérieur à 40kDa. Et elles se différencient aussi par leurs localisation, leur fonction et leurs conditions d’expression (constitutives ou inductibles) (tableau I) [7].
Tableau I: Les différentes familles d’HSP et leur poids moléculaire, localisation cellulaire, fonction et conditions d’expression.
Famille Poids
moléculaire Protéines Localisation Fonction Expression
sHSP : HSPB 12 à 40 KDa HSPB1/HSP27 HSPB2 HSPB3 HSPB4/ alpha A-cristallin HSPB5/alpha B-cristallin HSPB6 HSPB7 HSPB8/HSP22 HSPB9 HSPB10 HSPB11 -Cytosol -Noyau lors du stress -Mitochondrie HSPB1 : -chaperon moléculaire. -stabilisation du cytosquelette. -Anti-apoptotique.
-Survie de la cellule après stress.
-Non ATP-dépendante. HSP10 :
-Cofacteur de HSP60. -Conformation des protéines. -Transduction du signal.
-Taux basal faible, forte expression après stress.
-Synthétisée en réponse à l’ischémie. HSP40 47 kDa HSP47 -Réticulum endoplasmique. -Translation et translocation du collagéne. -Constitutive et induite par le stress. HSP60 / Chaperonine 60 kDa HSP60 -Mitochondrie. -Cytosol.
-Conformation des protéines. -Prévention de l’agrégation et de la dénaturation des protéines. -Anti-apoptotique. -Constitutive et induite par le stress.
HSP70 :HSPA 66 à 78 kDa HSPA1A HSPA1B HSPA1L HSPA2 HSPA5 HSPA6 HSPA7 HSPA8 HSPA9 HSPA12A HSPA12B HSPA13 HSPA14 -Cytosol. -Noyau
-Conformation des protéines. -Cytoprotection -Inductible et constitutive. HSP90 :HSPC 83 à 90 kDa HSPC1 HSPC2 HSPC3 HSPC4 HSPC5 -Cytosol. -Noyau.
-Conformation transport des protéines.
-Régulation de la transduction du signal.
-Taux basal élevé. -Forte expression après stress. HSP110 : HSPH 100 à 110 kDa HSPH1 :HSP110 HSPH2 HSPH3 HSPH4 -Cytosol. -Noyau.
-Conformation des proteins. -Thermo tolerance.
-Non-ATP dépendante.
-Constitutive et induite par le stress.
2.1. Les HSP de haut poids moléculaire
2.1.1. La famille des HSP110
La famille des HSP110, les plus largement exprimées après les HSP70 et 90 [8], existe de manière constitutive principalement dans le cerveau et le foie. Ces protéines cytosoliques et nucléaires sont fortement induites lors du choc thermique.
Les HSP110 (ou Clp chez les procaryotes) regroupent plusieurs sous-familles de chaperonnes réparties en deux grandes classes (1 et 2).
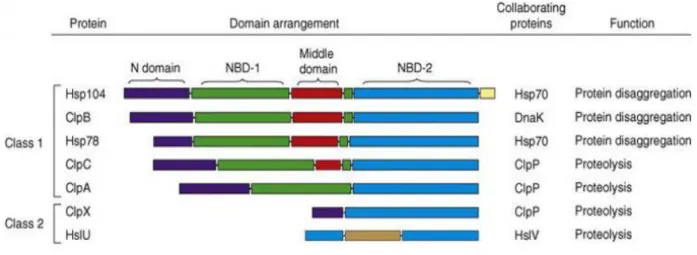
Classe 1 : sont caractérisées par un domaine N-terminal et β domaines NBD (Nucleotide Binding Domains) conservés, ainsi qu’un « Middle domain » de taille variable (Figure 3).
Classe 2 : ne possèdent en revanche qu’un seul NBD, ainsi qu’un domaine N-terminal pour certaines d’entre elles (Figure 3).
Les HSP110 sont également incluses dans la superfamille des ATPases de type AAA+ (ATPases Associated with various cellular Activities). Les domaines AAA+ sont constitués d’environ 200 à 250 résidus aminés et sont assimilés aux NBD avec des motifs particuliers nommés Walker A et B (Figure 4).
Les NBD-1 et NBD2 sont très conservés chez les procaryotes et les eucaryotes. Le domaine N-terminal et le Middle domaine sont beaucoup plus variables. Seule la HSP104 possède un domaine C-terminal. La HslU quant à elle, n’a de domaine N-terminal, mais un domaine I (jaune foncé). La droite du tableau indique les principales protéines collaboratrices et la principale fonction de chaque type de HSP110 [9].
Figure 4: Structures des HSP110 de classes 1 et 2 et de leurs domaines AAA+.
Chaque domaine AAA+ est similaire au NBD. Il est constitué d’environ 200 à 250 acides aminés et de motifs particuliers nommés Walker A et Walker B représentés en rouge [9].
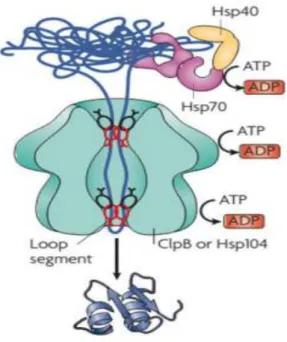
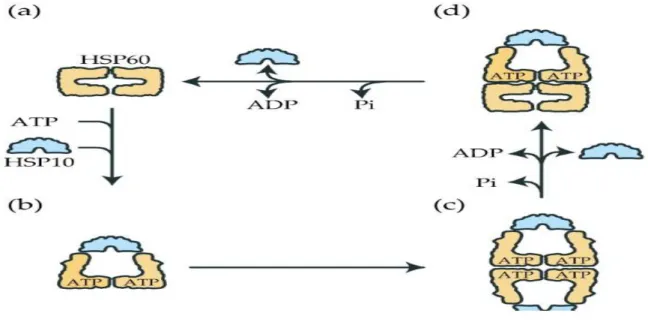
Les HSP110 agissent sous forme d’hexamères disposés en anneau, dont la fonction principale est la dissociation d’agrégats de peptides dénaturés et de prions. D’autres fonctions plus spécifiques, comme le repliement des peptides extraits des agrégats ou leur dégradation, dépendent du type de HSP110 concerné et des Co-chaperonnes associées [9]. Par exemple, les HSP104/ClpB collaborent avec le couple HSP40/HSP70. Les peptides sont alors extraits un à un et conduits dans l’hexamère de HSP104/ClpB pour leur redonner leur conformation native en coopération avec la HSP70 (Figure5) [10]. Les complexes de HSP110 peuvent également être associés avec des protéases et dégrader directement les peptides dénaturés extraits des agrégats [9]. Les HSP110 ont également un rôle de Co-chaperonne detype NEF (Nucleotide Exchange Factor) en facilitant l’échange ADP-ATP sur le NBD des HSP70 [11, 12].
Figure 5: Fonctionnement de la HSP110 en collaboration avec le complexe HSP40/ HSP70.
La dissociation des agrégats par le complexe peut être suivie par la restauration du repliement correct des peptides, nécessitant l’hydrolyse de plusieurs ATP en ADP. Si la HSP110 est associée à une protéase, les agrégats peuvent alors être dégradés à leur sortie du complexe[10].
2.1.2. La famille des Hsp90
Les HSP90 (HptG chez les procaryotes) regroupent des molécules dont le poids moléculaire varie entre 83 et 90 kDa. Chez les eucaryotes, elles sont présentes dans le cytosol et le réticulum endoplasmique (sous le nom de Grp94 ou Grp96). Les HSP90 partagent les mêmes caractéristiques structurales et fonctionnent sous forme de dimères.
En région N-terminale, elles sont constituées d’un domaine ATPase conservé d’environ 25 kDa (N-Terminal Domain ou NTD), et d’une zone riche en acides aminés chargés, suivie d’un Middle Domain (MD) environ 35 kDa plus variables.
Les HSP90 possèdent un dernier domaine à leur extrémité carboxyle (C-Terminal Domain ou CTD) nécessaire à leur dimérisation et terminée par le motif hautement conservé MEEVD (Figure 6) [13] .
Figure 6: Structure du dimère de HSP90 dans ces différentes conformations.
La dimérisation est dû à l’interaction entre les domaines carboxy-terminaux (CTD) de chaque HSP90. Le dimère peut avoir 3 types de conformation : ouvert (a), partiellement fermé et lié à l’ADP (b) ou fermé et lié à l’ATP (c) [14].
Les HSP90 sont capables de se lier à une très large gamme de substrats protéiques, sans motif commun connu. Ces substrats partagent la particularité d’être instables ou de nécessiter l’assistance d’une chaperonne pour leur maturation, comme par exemple des kinases ou divers facteurs de transcription [15] . Elles s’associent par leur domaine Nterminal et leur middle domain aux cyclines dépendantes des kinases (Cdk4) ou encore à la protéine suppresseur de tumeur p53, participant ainsi à la régulation du cycle cellulaire.
Les HSP90 contrôlent également le niveau des protéines T, en prévenant ainsi leur agrégation (ces derniers sont hautement impliqués dans la maladie d’Alzheimer). Elles sont également capables, comme d’autres types de HSPs, d’adresser des protéines à la voie de dégradation du protéasome par marquage à l’ubiquitine.
En tant que chaperonnes, les HSP90 peuvent également replier les protéines néo synthétisées [16]. Elles permettent par exemple la maturation de nombreux récepteurs (ceux aux glucocorticoïdes et progestérone, aux Tumor Necrosis Factor, les Toll-like receptor…). Elles contribuent également à l’assemblage des ARN polymérases III, des kinétochores, télomérases, hélicases, protéosome 26S [15].
Les mécanismes permettant l’interaction des HSP90 à une telle variété de substrats sont encore mal connus. Ils seraient probablement liés à l’intervention des HSP40 et HSP70, ainsi que d’un ensemble tout aussi diversifié de Co-chaperonnes (Figure 7) [17].
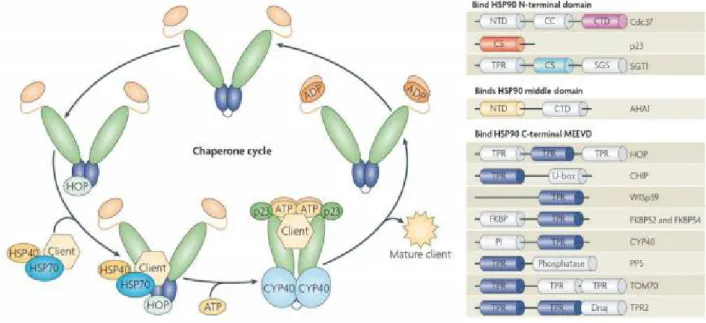
Figure 7: Cycle des interactions du dimère de HSP90 avec ses Co-chaperonne.
Ce cycle fait intervenir les HSP40, HSP70 et la HSP90, ainsi que de nombreuses Co-chaperonnes indiquées à droite. Les domaines de liaisons de la HSP90 dépendent du type de Co-chaperonne concernée [17].
2.1.3. La famille des HSP70
Les HSP70 (ou DnaK chez les procaryotes) constituent une famille de molécules de 66 et 78 kDa et ont été les premières HSPs découvertes, en raison de leur expression abondante lors de stress cellulaires. Les HSP70 sont des membres majeurs de la superfamille des HSPs, ubiquistes et de loin les plus conservées [18] .
Leur structure est composée d’un domaine ATPase de 44 kDa (NBD pour Nucleotide Binding Domain) en région N-terminale, et d’un domaine de fixation des substrats d’environ 18 kDa (SBD ou Substrate Binding Domain) séparés par une jonction inter-domaine (Interdomain linker) riche en leucine et particulièrement conservée. L’extrémité carboxyle plus variable d’approximativement 10 kDa (CTD ou C-terminal Domain) ferme le complexe SBD-substrat et permet la fixation de nombreuses Co-chaperonnes (Figure 8) [19] .
Le fonctionnement des HSP70 peut être résumé par un cycle en 3 étapes, régit par les communications allostériques entre les différents domaines :
La HSP70 fixe l’ATP et prend une conformation ouverte à la liaison peu spécifique de nombreux substrats.
L’hydrolyse de l’ATP en ADP augmente l’affinité du SBD au substrat et permet une fixation renforcée de ce dernier, qui sera alors replié dans sa conformation native.
La HSP70 libère l’ADP et fixe un nouvel ATP, ce qui diminue son affinité pour le substrat et permet la séparation du complexe HSP70/ligand (Figure 8) [20] .
La jonction inter-domaines (interdomain linker), particulièrement conservée, est indispensable aux changements de conformation de la HSP70 (liée à l’ATP ou à l’ADP) [21] .
Figure 8: Structure et conformations de la HSP70.
Dans sa conformation liée à l’ADP, le ligand est fixé de façon stable à la HSP70 (a). Dans le cas où la HSP70 est liée à l’ATP, cela permet son ouverture pour la fixation ou libération du substrat (b)[14].
L’efficacité de la HSP70 est régulée par des Co-chaperonnes (Figure 9) impliquées dans la fixation et la libération des substrats, dans l’activité ATPase du NBD ou dans la fixation d’un nouvel ATP sur la chaperonne (NEF ou Nucleotide Exchange Factor) [22] .
On distingue principalement les Co-chaperonnes :
JDP à domaine J » (J-domain proteins). Les JDP ont une fonction essentielle dans la fixation ATPase-dépendante du substrat au sein de la cavité du SBD de la HSP70; et ce, même si elles ne semblent pas jouer un rôle prépondérant dans la stabilité du complexe formé.
La famille des BAG (Bcl-2 associated athanogene) est diversifiée, à l’image de leur « domaine BAG » hautement variable. La plupart des protéines BAG interagit directement avec les HSP70 : elles sont impliquées dans le ciblage de ses substrats, mais surtout dans la stimulation de la libération de l’ADP et donc la libération du substrat.
Les protéines Hip (HSC70-interacting protein), au contraire, stabilise le complexe HSP70-substrat et évite ainsi une libération prématurée de la protéine cible.
Hop (Hsp70-Hsp90 Organizing Protein);
CHIP (Carboxyl terminus of Hsc70 interacting protein). Les protéines CHIP et Hop qui sont en compétition pour se fixer sur l’extrémité C-terminal de la HSP70, réglerait l’activité ATPase du NBD [23] .
Les HSP70 interagissent également avec tous les autres membres de la superfamille des HSPs, pour les assister ou réguler leurs fonctions de chaperonnes, ou moduler leur affinité pour certains substrats. Elles peuvent également fonctionner seules, ou former des dimères pour assurer leurs multiples fonctions [24].
Figure 9: Cycle des interactions de la HSP70 avec les Co-chaperonnes de types NEF et JDP.
Après liaison de la protéine-client (non-native) sur la HSP70, la Co-chaperonne à domaine J (JDP) interagit avec le NBD pour stimuler l’hydrolyse de l’ATP (1). La libération de la JDP et du phosphate inorganique permet le changement de conformation de la HSP70 et la stabilisation du complexe lié au substrat (2). Le facteur d’échange de nucléotide (NEF) se fixe au NBD pour faciliter le remplacement de l’ADP par un nouvel ATP (3). La conformation de la HSP70 liée à l’ATP abaisse l’affinité de cette dernière pour son substrat et permet la libération de ce dernier, quel que soit son état de repliement (4) [25]. Les HSP70 ont trois
principales fonctions connexes :
Le repliement correct des protéines dénaturées dans leur état natif.
La prévention de la formation des agrégats, ou leur dissolution pour le rétablissement de la conformation protéique correcte. Mais leurs fonctions s’étendent au bon repliement de protéines néosynthétisées,leur « contrôle qualité », leur translocation d’un compartiment cellulaire à l’autre et, le cas échéant, leur dégradation dans le protéasome. De plus, les HSP70 permettent l’activation de protéines régulatrices (récepteurs, kinases, facteurs de transcription) et interviennent ainsi dans des voies de signalisation cellulaires aussi nombreuses que diversifiées (spécialisation, division, apoptose/survie cellulaire) [23] .
les HSP70 sont également impliquées dans la réponse immunitaire avec la stimulation de la production de cytokines, de leucocytes et de la présentation d’antigènes [26].
![Figure 1: Evolution de la résistance de l’organisme au cours des trois phases du « Syndrome général d’adaptation » de Selye[5]](https://thumb-eu.123doks.com/thumbv2/123doknet/14387695.700676/49.892.212.707.148.371/figure-evolution-résistance-organisme-phases-syndrome-général-adaptation.webp)