UNIVERSITE MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT
DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 - 2013 : Professeur Najia HAJJAJ – HASSOUNI
ADMINISTRATION:
Doyen
Professeur Mohamed ADNAOUI
Vice-Doyen chargé des Affaires Académiques et estudiantines
Professeur Brahim LEKEHAL
Vice-Doyen chargé de la Recherche et de la Coopération Professeur Toufiq DAKKA
Vice-Doyen chargé des Affaires Spécifiques à la Pharmacie Professeur Younes RAHALI
1. ENSEIGNANTS.·CHERCHEURS MEDECINS ET PHARMACIENS
PROFESSEURS DE L'ENSEIGNEMENT SUP2RIEUR:
Décembre 1984
Pr. MMOUNI Abdelaziz Médecine Interne - Clinique Rovale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation Pr. SETTAF Abdellatif Pathologie Chirurgicale Janvier, Février et Décembre 1987
Pr. LA..CHKAR Hassan Médecine Interne
Décembre 1988
Pr. DAFIRI Rachida Radiologie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne -Doyen de l a FMPR
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1 990
Pr. KHARBACH Aîcha Gynécologie .Obstétrique Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AZZOUZI Abderrahim Anesthésie Réanimation- Doven de FMPQ
Pr. BAYAHIA Rabéa Néphrologie Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale Pr. BENSOUDA Yahia Pharmacie galénique Pr.BERRAHO Amina Ophtalmologie
Pr.BEZAD Rachid Gynécologie Obstétrique Méd. Chef Maternité des Orangers
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie Pr. KHATTAB Mohamed Pédiatrie
Pr. SOUIAYMANI Rachida Pharmacologie ·Dir. du Centre National PV Rabat
Pr. TAOUFIK Jamal Chimie thérapeutique
Décembre 1992
Pr. AHALIAT Mohamed Chirurgie Générale Doyen de FMPT
Pr. BENSOUDA Adil Anesthésie Réanimation Pr. CHAHED OUAZZANI Laaziza Gastro·Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique Pr.EL OUAHABI Abdessamad Neurochirurgie
Pr.FELIAT Rokaya Cardiologie
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie Pr. BEN RAIS Nozha Biophysique Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques Doven de la FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique Pr. EL BARDOUNI Ahmed Traumato-Orthopédie Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale - Directeur du CHIS
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie - Orthopédie Pr. RHRAB Brahim Gynécologie -Obstétrique Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie Inspecteur du SSM
Pr. BENTAHIIA Abdelali Pédiatrie
Pr. BERRADA Mohamed Saleh Traumatologie - Orthopédie Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. IAKHDAR Amina Gynécologie Obstétrique Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale Pr. AMRAOUI Mohamed Chirurgie Générale Pr. BAIDADA Abdelaziz Gynécologie Obstétrique Pr. BARGACH Samir Gynécologie Obstétrique Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie Pr. IBEN ATIYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décembre 1996
Pr. BELKACEM Rachid Chirurgie Pédiatrie Pr. BOUIANOUAR Abdelkrim Ophtalmologie Pr. EL AIAMI EL FARICHA EL Hassan Chirurgie Générale Pr. GAOUZI Ahmed Pédiatrie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie Directeur HMI Mohammed V Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie Pr. ERREIMI Naima Pédiatrie Pr. FELIAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique Pr. KOUTANI Abdellatif Urologie
Pr. I.AHLOU Mohamed Khalid Chirurgie Générale Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TOUFIQ Jallal Psychiatrie Directeur Hôp•.Ar.-razi Salé Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Pr. BENOMAR ALI Neurologie Doyen de la FMP Abu/cassis
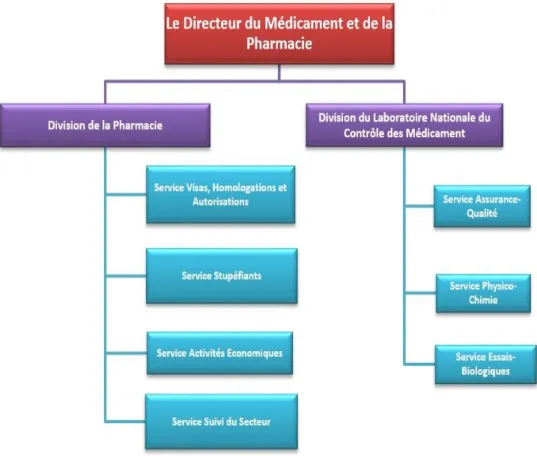
Pr.BOUGTAB Ahdesslam Chirurgie Générale Pr. ER RIHANI Hassan Oncologie Médicale Pr. BENKIRANE Majid* Hématologie
Janvier 2000
Pr. ABID Ahmed* Pneumo-phtisiologie Pr. AIT OUAMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr .Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Directeur Hôp. My Youssef
Pr.CHARIF CHEFCHAOUNI Al Montacer
Chirurgie Générale Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-phtisiologie Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. TACHINANTE Rajae Anesthésie-Réanimation Pr. TAZI MEZALEK Zoub_ida Médecine Interne
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro·Entérologie Pr.BENAMR Said Chirurgie Générale Pr.CHERTI Mohammed Cardiologie
Pr. ECH.CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie • Directeur Hôp. Cheikh Zaid
Pr. EL KHADER Khalid Urologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Décembre 2001
Pr. BALKHI Hicham* Anesthésie Réanimation Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologi e Pr. BENELBARHDADI lmane Gastro-Entérologie Pr.BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie Pr. BEZZA Ahmed* Rhumatologie Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale Pr. EL HIJRI Ahmed Anesthésie Réanimation Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie • Directeur Hôp. d’Enfants Rabat Pr.GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale Directeur Hôpital Ibn Sina Pr. KABIRI EL Hassane* Chirurgie Thoracique
Pr. lAMRANI Moulay Omar Traumatologie Orthopédie
Pr.LEKEHAL Brahim Chirurgie Vasculaire Périphérique V-D chargéAH Acad Est. Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Sournia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr.AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr.BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie
Pr. BERNOUSSI Zakiya Anatomie Pathologique
Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL AlAMI EL Fellous Sidi Zouhair Chirurgie Pédiatrique
Pr. EL HAOURI Mohamed * Dermatologie
Pr.·FILALIADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique
Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie
Pr. RAISS Mohamed Chirurgie Générale
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr.ABDELIAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Ota-Rhine-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr.BOUI.AADAS Malik Stomatologie et Chirurgie Maxille-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique
Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. HACH!Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. MOUGHIL Said Chirurgie Cardia-Vasculaire Pr. OUBAAZ Abdelbarre * Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. BAHIRI Rachid Rhumatologie Directeur Hôp. Al Ayachi Salé
Pr. BARKA.T Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim * Biophysique
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire
Pr. LYAGOUBI Mohammed Parasitologie
Pr. SBIHI Souad Histo-Embryologie Cytogénétique
Pr. ZERAIDI Najia Gynécologie Obstétrique
AVRIL 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie ·Pédiatrique
Pr. BOULAHYA Abdellatif* Chirurgie Cardio-Vasculaire. Directeur Hôpital Ibn Sina M
Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELIAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. HARMOUCHE Hicham Médecine Interne
Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie - Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique
Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr.SOUALHI Mouna Pneumo - Phtisiologie
Pr.TELLAL Saida* Biochimie
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHACHI Leila Pneumo phtisiologie
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi * Chirurgie cardia vasculaire
Pr. AMHAJJI Larbi * Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed * Anesthésie réanimation
Pr. BALOUCH Lhousaine * Biochimie-chimie
Pr. BENZIANE Hamid * Pharmacie clinique
Pr. BOUTIMZINE Nourdine Ophtalmologie
Pr. CHERKAOUI Naoual * Pharmacie galénique
Pr. EHIRCHIOU Abdelkader * Chirurgie générale
Pr. EL BEKKALI Youssef * Chirurgie cardio-vasculaire
Pr. EL ABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid * Radiothérapie
Pr. ICHOU Mohamed * Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LOUZI Lhoussain * Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed * Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MRANI Saad * Virologie
Pr. OUZZIF Ez zohra Biochimie-chimie
Pr. RABHI Monsef * Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine * Microbiologie
Pr. SIFAT Hassan * Radiothérapie
Pr. TABERKANET Mustafa "* Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour * Traumatologie-orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Mars 2009
Pr. ABOUZAHIR Ali * Médecine interne
Pr.AGADR Aomar * Pédiatrie
Pr. AIT AIJAbdelmounaim * Chirurgie Générale
Pr. AIT BENHADDOU El Hachmia Neurologie
Pr. AKHADDAR Ali * Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMINE Bouchra Rhumatologie
Pr. BELYAMANI Lahcen • Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae * Biochimie-chimie Pr.BOUI Mohammed * Dermatologie Pr. BOUNAIM Ahmed * Chirurgie Générale Pr. BOUSSOUGA Mostapha * Traumatologie-orthopédie Pr. CHTATA Hassan Toufù.< * Chirurgie Vasculaire Périphérique Pr. DOGHMI Kamal * Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale Pr.EL OUENNASS Mostapha* Microbiologie Pr. ENNIBI Khalid * Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawa Gastro-entérologie Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. IAMSAOURI Jamal * Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale Pr.NASSAR lttimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-Phtisiologie
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation
Pr. AMEZIANE Taoufiq* Médecine Interne Directeur ERSSM
Pr. BEIAGUID Abdelaziz Physiologie Pr.CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine Aéronautique Pr. DAMI Abdellah* Biochimie, Chimie P r. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie Pédiatrique Pr.EL HAFIDI Naima Pédiatrie
Pr.EL KHARRAS Abdennasser* Radiologie
Pr.EL MAZOUZ Samir Chirurgie Plastique et Réparatrice Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH lkram Gastro-Entérologie Pr. LAMALMI Najat Anatomie Pathologique Pr. MOSADIK Ahlam Anesthésie Réanimation Pr. MOUJAHID Mountassir* Chirurgie Générale Pr. NAZIH Mouna* Hématologie
Pr. ZOUAIDIA Fouad Anatomie Pathologique
Decembre 2010
Pr.ZNATI Kaoutar Anatomie Pathologique
Mai 2012
Pr. AMRANI Abdelouahed Chirurgie pédiatrique Pr. ABOUEWAA Khalil * Anesthésie Réanimation
Pr.BENCHEBBA Driss * Traumatologie-orthopédie Pr. DRISSI Mohamed * Anesthésie Réanimation Pr. EL AIAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATIABI Abdessadek * Médecine Interne Pr. EL OUAZZANI Hanane * Pneumophtisiologie Pr.ER-RAJI Mounir Chirurgie Pédiatrique Pr. JAHID Ahmed Anatomie Pathologique Pr.RAISSOUNI Maha * Cardiologie
* Enseignants Militaires
Février 2013
Pr.AHID Samir Pharmacologie
Pr.AIT EL CADI Mina Toxicologie
Pr.AMRANI HANCHI Laila Gastro-Entérologie Pr.AMOR Mourad Anesthésie Réanimation PrAWAB Almahdi Anesthésie Réanimation Pr.BEIAYACHI Jihane Réanimation Médicale Pr.BELKHADIR Zakaria Houssain Anesthésie Réanimation Pr.BENCHEKROUN Laila Biochimie-Chimie Pr.BENKIRANE Souad Hématologie
Pr.BENNANA Ahmed* Informatique Pharmaceutique Pr.BENSGHIR Mustapha * Anesthésie Réanimation Pr.BENYAHIA Mohammed * Néphrologie
Pr.BOUATIA Mustapha Chimie Analytique et Bromatologie Pr.BOUABID Ahmed Salim* Traumatologie orthopédie
Pr BOUTARBOUCH Mahjouba Anatomie Pr. CHAIB Ali * Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr.DINI Nouzha * Pédiatrie
Pr.ECH-CHERIF EL KEITANI Mohamed Ali
Anesthésie Réanimation Pr.ECH-CHERIF EL KEITANI Najwa Radiologie
Pr.ELFATEMI NIZARE Neure-chirurgie Pr.EL GUERROUJ Hasnae Médecine Nucléaire Pr.EL HARTI Jaouad Chimie Thérapeutique Pr.EL JAOUDI Rachid * Toxicologie
Pr.EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologique Pr.EL KHLOUFI Samir Anatomie
Pr.EL KORAICHI Alae Anesthésie Réanimation Pr.EN-NOUAL! Hassane * Radiologie
Pr.ERRGUIG Laila Physiologie Pr.FIKRI Meryern Radiologie
Pr.GHFIR lmade Médecine Nucléaire
Pr.IMANE Zineb Pédiatrie
Pr.IRAQ!Hind Endocrinologie et maladies métaboliques Pr.KABBAJ Hakima Microbiologie
Pr.KADIRI Mohamed * Psychiatrie Pr.LATIB Rachida Radiologie
Pr.MAAMAR Mouna Fatima Zahra Médecine Interne Pr.MEDDAH Bouchra Pharmacologie Pr.MELHAOUI Adyl Neuro-chirurgie Pr.MRABTI Hind Oncologie Médicale Pr.NEJJARI Rachid Pharmacognosie Pr.OUBEJJA Houda Chirugie Pédiatrique Pr.OUKABLI Mohamed * Anatomie Pathologique
Pr. RAHALI Younes Pharmacie Galénique Vice-Doyen à la Pharmacie
Pr.RATBI Ilham Génétique Pr.RAHMAN! Mounia Neurologie Pr.REDA Karim * Ophtalmologie Pr.REGRAGUI 'X'afa Neurologie Pr.RKAIN Hanan Physiologie Pr.ROSTOM Samira Rhumatologie
Pr.ROUAS Lamiaa Anatomie Pathologique Pr.ROUIBAA Fedoua * Gastro-Entérologie Pr SALIHOUN Mouna Gastro-Entérologie
Pr.SAYAH Rochde Chirurgie Cardio-Vasculaire Pr.SEDDIK Hassan * Gastro-Entérologie
Pr.ZERHOUNI Hicham Chirurgie Pédiatrique Pr.ZINE Ali * Traumatologie Orthopédie
• Enseignants Militaires
AVRIL 2013
Pr.EL KHATIB MOHAMED KARIM * Stomatologie et Chirurgie Maxillo-faciale
MARS 2014
Pr.ACHIR Abdellah Chirurgie Thoracique Pr.BENCHAKROUN Mohammed T Traumatologie- Orthopédie Pr.BOUCHIKH Mohammed Chirurgie Thoracique Pr. EL KABBAJ Driss * Néphrologie
Pr. EL MACHTANI IDRISSI Samira " Biochimie-Chimie
Pr.HARDIZI Houyam Histologie·Embryologie.Cytogénétique Pr. HASSAN! Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie Pr. JANANE Abdellah • Urologie
Pr. JEA.IDI Anass * Hématologie Biologique Pr. KOUACH Jaouad* Génycologie-Obstétrique Pr. LEMNOUER Abdelhay* Microbiologie
Pr. MAKRAM Sanaa * Pharmacologie Pr. OUIAHYANE Rachid* Chirurgie Pédiatrique Pr. RHISSASSI Mohamed Jaafar CCV
Pr. SEKKACH Youssef* Médecine Interne Pr. TAZI MOUKHA Zakia Génécologie-Obstétriq
DECEMBRE 2014
Pr.ABILKACEM Rachid* Pédiatrie
Pr.AIT BOUGHIMA Fadila Médecine Légale
Pr. BEKKALI Hicham * Anesthésie-Réanimation
Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale
Pr. BOUCHRIK Mourad* Parasitologie
Pr. DERRAJI Soufiane* Pharmacie Clinique
Pr. DOBLALI Taoufik Microbiologie
Pr. EL AYOUB! EL IDRISSI Ali Anatomie
Pr. EL GHADBANE Abdedaim Hatim* Anesthésie-Réanimation
Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique
Pr. JAHIDI Mohamed* O.R.L
Pr. lAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI NEZHA Anesthésie-Réanimation
Pr. RAMI Mohamed Chirurgie Pédiatrique
Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine préventive, santé publique et Hyg.
AOUT 2015
Pr. MEZIANE Meryem Dermatologie
Pr. TAHIRI Latifa Rhumatologie
PROFESSEURSAGREGES 1
JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale
Pr. EL ASRI Fouad* Ophtalmologie
Pr. ERRAMI Noureddine* O.R.L
Pr. NITASSI Sophia O.R.L
JUIN 2017
Pr. ABI Rachid* Microbiologie
Pr. ASFALOU Ilyasse* Cardiologie
Pr.BOUAYTI El Arbi* Médecine préventive, santé publique et Hyg.
Pr. BOUTAYEB Saber Oncologie Médicale
Pr. EL GHISSASSI Ibrahim Oncologie Médicale
Pr. HAFIDI Jawad Anatomie
Pr. OURAINI Saloua* 0. R.L
Pr. RAZINE Rachid Médecine préventive, santé publique et Hyg.
Pr. ZRARA Abdelhamid* Immunologie
NOVEMBRE 2018
Pr. AMELLAL Mina Anatomie
Pr. SOULY Karim Microbiologie
Pr. TAHRI Rjae Histologie-Embryologie-Cytogénétique
"' Enseignants Militaires"
2. ENSEIGNANTS-CHERCHEURS SCIENTIFIQUES
PROFEURS/Prs. HABILITES
Pr. ABOUDRAR Saadia Physiologie Pr. AlAMI OUHABI Naima Biochimie-chimie Pr. AIAOUI KATIM Pharmacologie
Pr. AIAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr .BARKIYOU Malika Histologie-Embryologie Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. CHAHED OUAZZANI Lalla Chadia Biochimie-chimie
Pr. DAKKA Taoufiq Physiologie Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. IBRAHIMI Azeddine Biologie moléculaire/Biotechnologie
Pr. KHANFRI Jamal Eddine Biologie
Pr. OUIAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 04/02/2020 Khaled Abdellah
Chef du Service des Ressources Humaines FMPR
À ALLAH
Tout puissant
Qui m’a inspiré
Qui m’a guidé toujours dans le bon chemin
Je vous dois ce que je suis devenue, Louanges et remerciements pour votre
clémence et miséricorde.
Toutes les lettres ne sauraient trouver les mots qu’il faut…
Tous les mots ne sauraient exprimer la gratitude.
L’amour, le respect, la reconnaissance…
Aussi, c’est tout simplement que
À Mes très chers parents
Aucune phrase, aucun mot ne saurait exprimer à sa juste valeur le respect et
l'amour que je vous porte.
Vous m'avez entouré d'une grande affection, et vous avez été toujours pour moi
un grand support dans mes moments les plus difficiles.
Sans vos précieux conseils, vos prières, votre générosité et votre dévouement, je
n'aurais pu surmonter le stress de ces longues années d'étude.
Vous m'avez apporté toute la tendresse et l'affection dont j'ai eu besoin. Vous
avez veillé sur mon éducation avec le plus grand soin.
Vous êtes pour moi l'exemple de droiture, de lucidité et de persévérance.
A travers ce modeste travail, je vous remercie et prie dieu le tout puissant qu'il
vous garde en bonne santé et vous procure une longue vie que je puisse vous
combler à mon tour.
À mes très chères sœurs et frères.
Aucune dédicace ne pourrait traduire ma gratitude et ma profonde
reconnaissance et mon amour.
Je vous dédie ce travail comme témoignage de mon respect et mon amour éternel.
À mes très chers amis
Vous trouverez ici l’expression de mes sentiments les plus sincères.
Avec tout mon amour, je vous souhaite un avenir souriant.
À toute la famille
J’ai beaucoup de chance de vous avoir à mes côtés, et je vous souhaite beaucoup
de bonheur et de réussite.
Veuillez retrouver en ce travail l’expression de mon amour, ma gratitude et mon
grand attachement.
À
Notre maître et Président de thèse,
Monsieur le professeur Mohamed Meiouet
Professeur de droit pharmaceutique à la faculté de médecine et
de pharmacie de Rabat
Nous sommes profondément reconnaissants de l’honneur que vous nous faites
en acceptant de présider ce travail.
Votre grand savoir, votre dynamisme et votre amabilité ont toujours suscité en
nous grand estime.
Veuillez trouver ici, le témoignage de notre vive gratitude et haute
considération.
À
Notre maître et Rapporteur de thèse,
Madame la professeur Bouchra Meddah professeure de
pharmacologie à la faculté de médecine et de pharmacie de
rabat.
Et Directrice du laboratoire national de contrôle des
médicaments
Nous vous remercions pour la gentillesse et la spontanéité avec lesquelles vous
avez bien voulu diriger ce travail.
Nous avons eu un grand plaisir à travailler sous votre direction. Nous avons eu
auprès de vous le conseiller et le guide qui nous a reçus en toute circonstance avec
sympathie, sourire et bienveillance.
Votre amabilité, votre compétence pratique, vos qualités humaines et
professionnelles nous inspirent une admiration et un grand respect.
Nous voudrions être dignes de la confiance que vous nous avez accordée et vous
prions, cher Maître, de trouver ici le témoignage de notre sincère reconnaissance
À
Notre maître et juge de thèse
Monsieur le Professeur Jaouad EL Harti Professeur de chimie
thérapeutique à la faculté de médecine et de pharmacie de
rabat
Et Responsable de la stérilisation à CHU à Rabat
L'honneur que vous nous accordez en acceptant de juger ce travail, n'a d'égal
que notre profonde gratitude et reconnaissance.
Veuillez trouver ici, Monsieur, l'expression de notre haute estime et notre
grand respect.
À
Notre maître et juge de thèse
Madame la Professeur Samira Serragui professeure de
toxicologie à la faculté de médecine et de pharmacie de rabat
C’est pour nous un immense privilège de vous voir accepter de juger ce travail.
Veuillez, cher Maître, trouver dans ce modeste travail le témoignage de notre
LISTE DES
FDA : Food and Drug administration. BPL : Les bonnes pratiques de laboratoire. ICH : International Council for Harmonisation . PFDA : Pure Food and Drug Act.
FFDCA : Federal Food, Drug, and Cosmetic Act.
NDA : New Drug Application.
OTC : Over the Counter.
PDUFA : Prescription Drug User Fee Act.
FDAMA :Food and Drug Administration Modernization Act.
BPCA : Best Pharmaceuticals for Children Act. PREA : Pediatric Research Equity Act.
FSPTCA : Family Smoking Prevention and Tobacco Control Act. PPACA : Patient Protection and Affordable Care Act.
FDASIA : FDA Safety and Innovation Act.
CDER : The Center for Drug Evaluation and Research. OPQ : The Office of Pharmaceutical Quality.
OPPQ : The Office of Policy for Pharmaceutical Quality. AMM : Autorisation de Mise sur le Marché.
IND : Investigational New Drug.
EIND : Emergency Investigational New Drug.
PGR : Plan de Gestion de Risque.
REMS : Risk Evaluation and Mitigation Strategies. Risk MAPS : Risk Minimization Action Plans.
ANSM : Agence Nationale de Sécurité du Médicament et des produits de santé.
PIP : Poly Implant Prothèse.
Afssaps : Agence française de sécurité sanitaire et des produits de santé. Anses : l’Agence nationale de sécurité sanitaire de l’alimentation, de
l’environnement et du travail. InVS : Institut de veille sanitaire.
ATU : Autorisation temporaire d’utilisation. RTU : Recommandation Temporaire d’utilisation.
CNAMTS : La caisse nationale d’assurance maladie des travailleurs salariés. BPF : Bonnes Pratiques de Fabrication.
RCP : Résumé des Caractéristiques du Produit.
EMA : European Medicine Agency.
CHMP : Committee for Human Medicinal Products. SIDA : Syndrome d'Immunodéficience Acquise. CRPV : Centres régionaux de pharmacovigilance.
PRAC : Pharmacovigilance Risk Assessment Committee. COMP : Committee for Orphan Medicinal Products.
PDCO : Paediatric Committee.
CAT : Committee for Advanced Therapies.
HMPC : Committee on Herbal Medicinal Products.
CVMP : Committee for Medicinal Products for Veterinary Use. ATMP : Advanced therapy medicinal product.
RMP : Risk management plans.
PIP : Plans d’Investigations Pédiatriques. PUMA : Paediatric use marketing authorization.
COMP–WGIP : COMP Working Group with Interested Parties. OMS : Organisation mondiale de santé.
CE : Commission Européen.
eCTD : electronic commun technical document. OMCL : Official Medicines Control Laboratories.
EEE : Espace Economique Européen.
UE : Union Européenne.
SFDA : Saudi Food and Drug Administration. CCG : Coopération du Conseil de Golfe.
ISO : International Organization for Standardization. RAQ : Responsable assurance qualité.
CAQ : Correspondant assurance qualité.
QQOQCCP : Qui fait Quoi ? Où ? Quand ? Comment ? Combien ? Et Pourquoi ?
PDCA : plan, do, control and act.
APR : Analyse Préliminaire des Risques.
AMDEC : Analyse d'Effet de Mode de Défaillance et leur Criticité.
HAZOP : Hazard and Operability study.
CEI : Communauté des États indépendants. Cofrac : Comité français d’accréditation.
VIM : vocabulaire international des termes fondamentaux et généraux en métrologie.
BPLC : Bonnes pratiques applicables par les laboratoires de contrôle qualité pharmaceutique.
POS : procédures opérationnelles standards.
ANRM : Autorité nationale de réglementation des médicaments. LNCM : Laboratoire national de contrôle qualité des médicaments. DMP : Direction du médicament et de la pharmacie.
HPLC : Chromatographie Liquide à Haute Performance.
UV : Ultraviolet.
RQ MENA PUMA
: Renouvellement Quinquennal. : Middle East And North Africa.
LISTE DES
Liste des figures
Figure 1 : l'organigramme de la FDA ... 8 Figure 2 : Organigramme du centre de recherche et d’évaluation des médicaments ... 9 Figure 3 : Résumé de la procédure d’autorisation du médicament par la FDA ... 19 Figure 4 : organigramme de l'ANSM ... 22 Figure 5 : organigramme d’INFARMED ... 39 Figure 6 : les procédures de soumission d’une demande d’autorisation de mise sur le marché . ... 43 Figure 7 : Résumé des procédures de l’obtention de l’autorisation de mise sur le marché . .. 44 Figure 8 : résumé de la documentation ... 48 Figure 9 : une comparaison entre les principes de la norme ISO 9001 :2008 et ISO 9001 :2015. ... 50 Figure 10 : les éléments d'un processus ... 52 Figure 11 : L'organigramme officiel de la DMP ... 70 Figure 12 : les composants d'un document technique commun ... 72 Figure 13 : Les étapes de l’accord de principe. ... 74 Figure 14 : Une cartographie de processus ... 77
I. Introduction ... 1 II. Généralité ... 2 III. Système international de régulation pharmaceutique ... 4 1. Food and Drug administration ... 4 1.1. Histoire ... 4 1.2. Rôles ... 6 1.3. Organigramme et organisation ... 7 1.4. Les procédures de l’obtention de l’autorisation de mise sur le marché, et la
surveillance post-AMM ... 11 2. L ’Agence nationale de sécurité du médicament et des produits de santé (ANSM) ... 20 2.1. Histoire ... 20 2.2. Missions ... 20 2.3. Organigramme ... 22 2.4. Histoire de mondialisation du processus de l’évaluation pour l’obtention de
l’AMM ... 23 2.5. Les phases de développement d’un médicament ... 25 2.6. La démarche de l’obtention de l’AMM ... 27 2.7. La surveillance post-AMM en termes de la pharmacovigilance ... 29 3. L’agence européenne de médicament (EMA) ... 30 3.1. Les composants de l’EMA ... 30 3.2. Le rôle des comités de l’EMA ... 30 3.3. Les types de procédures par lesquelles les médicaments peuvent être approuvés . 34 4. Le réseau de laboratoires officiels de contrôle des médicaments (OMCL) ... 36 5. INFARMED – L’autorité nationale des médicaments et les produits de santé ... 37 5.1. Rôles ... 37 5.2. Activités ... 37 5.3. Organigramme ... 39 6. L’autorité alimentaire et pharmaceutique saoudienne ... 40 6.1. Objectives ... 40 6.2. Missions ... 40 6.3. Les règles d’enregistrements des médicaments en Arabie saoudite ... 41 IV. Le système qualité ... 44 1. Les définitions de la qualité ... 44 2. La définition d’un système qualité ... 45 3. Les composants du système qualité ... 45 4. La certification, l’accréditation et la préqualification ... 48
4.1. La certification ISO 9001 ... 48 4.1.1. La définition de la certification ISO 9001 ... 48 4.1.2. L’évolution de la norme ISO 9001 ... 49 4.1.3. Les principes de la norme ISO 9001 : 2015 ... 50 4.1.4. Les composants du référentiel ISO 9001 version 2015 ... 54 4.1.5. Les outils d’analyse et d’identification du risque ... 55 4.1.6. L’amélioration continue et les outils de traitement des non- conformités ... 56 4.2. L’accréditation ISO 17025 ... 57 4.2.1. La définition de l’accréditation ISO 17025 ... 57 4.2.2. Les étapes de l’accreditation ISO 17025 ... 57 4.3. La préqualification ... 60 4.3.1. La définition de la préqualification ... 60 4.3.2. Les principes des BPL ... 60 4.3.3. Les étapes de participation à la démarche de la préqualification ... 62 5. L’apport du système qualité au laboratoire de contrôle de médicament... 65 V. Le cas du Maroc : le laboratoire national de contrôle des médicaments ... 66 1. Rôles et missions et composants ... 66 2. Organisation et organigramme ... 69 3. Le système qualité ... 70 VI. Conclusion ... 79 Résumé ... 80 Bibliographie ... 84
1
I. Introduction
Chaque système national de santé via le système de régulation de médicament met la protection de la santé publique parmi ses responsabilités à travers la mise en œuvre des médicaments sûrs et efficaces, et s’engage à évaluer et à contrôler la sécurité, l’efficacité, et la qualité des médicaments soumissionner à une autorisation de mise sur le marché. La réglementation des produits pharmaceutiques constitue le premier pas vers une protection de haut niveau de la santé publique [1], l’implémentation de ces lois et réglémentations se fait au niveau des agences nationales des médicaments ou des laboratoires nationaux de contrôle des médicaments [2]. Selon l’OMS un laboratoire national de contrôle des médicaments est un laboratoire qui est chargé de contrôle et de la surveillance de la qualité, de la sécurité, et de l’efficacité des produits pharmaceutiques, c’est un laboratoire indépendant qui prend l’autorité du ministre de la santé et c’est un élément indispensable de tout système national d'assurance de la qualité des médicaments. Ce type de laboratoire manque encore dans un nombre de pays en développement [3]. Car un laboratoire pareil doit avoir des compartiments fonctionnels néanmoins un système de management qualité qui gère tout le laboratoire, des normes, des exigences, réglementations nationales et internationales que doit suivre. Sachant que la qualité est nécessaire dans ce type de laboratoire. Parce qu’on parle de la qualité des médicaments la responsabilité est certainement très lourde et toutes les erreurs coûtent très chère car leur utilisation n’est pas adressée aux gens sains seulement mais elle s’adresse spécialement à des patients qui souffre déjà de leurs maladies, et les défauts de qualité de médicament ne touche pas seulement le critère ; de la qualité mais également la sécurité et l’efficacité de ce dernier. Et pour avoir des médicaments en bonne qualité les laboratoires de contrôle des médicaments se présente pour contrôler la qualité des médicaments fournit au patient avant qu’il soit mise sur le marché et même après leur commercialisation, et pour arriver à ces objectives les laboratoires doivent avoir non seulement des ressources humaines très compétent, des équipements très qualifier avec des infrastructures très organisé mais également des outils de mangement de qualité. C’est pour cela un système qualité a été mise en œuvre pour garantir que tous les compartiments sont en harmonie en gardant toujours à l’esprit l’amélioration continue de la qualité, cela n’est juste qu’une aperçue de la politique
2
interne du laboratoire, mais pour être externaliser il y a la préqualification, normes et exigences internationaux que doit y répondre.
II. Généralité
L’émergence du concept de commercialisation des produits pharmaceutiques et les incidents résultants de l’utilisation des produits pharmaceutiques avec une mauvaise qualité, inefficaces et contrefaits, ont été les raisons pour lesquelles on commençait la réglementation de la fabrication, de l’utilisation et de la distribution des produits pharmaceutiques. D’où la nécessité d’une autorité réglementaire qui vise à réguler le domaine pharmaceutique.
Les agences nationales de contrôle des médicaments existe presque dans chaque pays pour renforcer la régulation et les lois, et pour la mise en œuvre des directives pour le développement des médicaments, l’enregistrement, l’autorisation, la fabrication, l’étiquetage, et la commercialisation des produits pharmaceutiques. La réglementation pharmaceutique a permet de s’assurer de l’efficacité, de la qualité, et de la sécurité des médicaments, la garantie de ces trois derniers constitue un vrai défis pour les agences nationales de contrôle des médicaments, la finalité des agences réglementaires est non seulement d’assurer la bonne qualité des produits pharmaceutiques mais également de protéger la santé et la sécurité public. Les autorités de régulation des produits médicamenteux jouent un rôle indispensable durant tout le cycle de vie du médicament car elles interviennent dans la production, la conservation, la vente, l’importation, la distribution, et l’approvisionnement des médicaments, ainsi durant toutes les étapes de développement de médicament c’est-à- dire dès la phase des recherches cliniques jusqu’à la commercialisation et la surveillance post-AMM du produit pharmaceutique. On note notamment le soutient fourni par ces autorités pendant le développement, la fabrication, et l’enregistrement du médicament à travers la communication avec l’industriel et les agences de réglementation de médicament à fin d’éviter les erreurs qui peuvent être faites dans la documentation ou les pratiques cliniques. Aussi bien elle met en disposition les informations sur les contrôles réglementaires et sur la politique réglementaire dans le monde pour le développement, la fabrication, et l’enregistrement du produit à fin
3
d’aider l’industriel à progresser un produit acceptable dans le monde entier, aussi bien elle contribue dans le développement des étiquettes, et des prospectus comme par exemple le RCP, bien que l’élaboration des formats standards pour l’étiquetage de chaque médicament développé pour confirmer toutes les informations données sur le produit comme par exemple la date de fabrication, la date d’expiration, et les ingrédients. Et elle complète les enregistrements des données sur le produit et les maintiens en conformité avec les réglementations et les directives en vigueur [4].
Les agences nationales jouent un rôle crucial dans l’accessibilité équitable, la bonne qualité et l’utilisation rationnel des médicaments. Chaque système de santé développe sa propre politique national du médicament. L’implémentation d’une politique national du médicament permet de fixer plusieurs objectives à entamer à savoir s’assurer de la qualité c’est-à-dire la qualité, la sécurité, et l’efficacité de tous les médicaments pour octroyer l’AMM, de s’assurer de l’accessibilité qui inclut la disponibilité et l’abordabilité (se fait via la réduction des taxes, les tarifs, les marges, et la politique de prix des médicaments ) équitable des médicaments essentiel et finalement elle assure l’utilisation rationnel du médicament à fin de promouvoir l’effet thérapeutique et l’utilisation rentable du médicament par les professionnels et le patient.
L’autorité réglementaire de médicament constitue une agence qui développe et implémente des réglementations et des législations sur le domaine pharmaceutique caractérisée par une indépendance et une transparence dans la régulation des médicaments [2]. Au niveau international on traite d’abord le cas de l’agence national des médicaments des états unis : Food and Drug Administration ( FDA), ensuite le cas europpéne représenter par : l’ASNM ( l’agence nationale de sécurité du médicament et des produits de santé) en France, l’EMA (l’agence européene de médicament), l’OMCL (le réseau de laboratoires officiels de contrôle des médicaments), l’INFARMED au Portugal, également le cas de région MENA représenter par : la SFDA (Saudi Food and Drug Authority ), et finalement au niveau national (Maroc) : la DMP ( la direction des médicaments et de la pharmacie).
4
III. Système international de régulation pharmaceutique
1. Food and Drug administration
1.1.
Histoire
Food and Drug administration (FDA) est devenue parmi les grandes agences de protection du consommateur dans le monde entier grâce à son évolution il ‘y a plus de 150 années, les procédures d’une autorisation de mise sur le marché que ça soit pour les médicaments ou pour les dispositifs médicaux prend une moyenne de 12 et de 7 ans respectivement [5].
Le statut de la FDA actuel n’est que le résultat de plusieurs étapes, événements, et lois qui ont été adopté. À savoir : En 1848, une agence fédérale de protection des consommateurs a été créée pour la première fois dans les états unis. Puis en 1906, l’adoption de la loi sur les aliments, et les médicaments (Pure food and drug act : PFDA) a mis en œuvre l’étiquetage dans les principaux intérêts, en ignorant l’importance de l’évaluation de la sécurité d'un médicament. Ensuite en 1937, un point révolutionné qui a mis en valeur la sécurité de produit et la naissance de New Deal période c’était la mort de 100 adultes et enfants suite à l’utilisation de l’élixir de Massengill, qui est un médicament à base de sulfanilamide. Ainsi en 1938, les autorités réglementaires de la FDA avec le congrès ont adopté la loi fédérale sur les aliments, les médicaments et les cosmétiques (FFDCA : Federal Food, Drug, and Cosmetic Act) avec ce nouvel pouvoir la FDA a pu examiner les preuves fournies par les fabricants de médicament qui atteste la sécurité de médicament. Ce qui a prévenu les fausses déclarations des fabricants de médicaments et, pour la première fois, les fabricants devaient déposer une NDA (New Drug Application). Cependant, l’approbation d’une NDA était automatique si la FDA ne pouvait pas trouver des évidences qui preuve l’insécurité du produit médicamenteux. En outre, la FFDCA se concentre plus sur ce que le produit médicamenteux utilisé soit sûr, et la fourniture des informations scientifiques aux consommateurs. Après en 1951, la FFDCA a entraîné des distinctions juridiques peu claires entre les médicaments en vente libre (OTC: over the Counter) et les médicaments sur l’ordonnance puis l'amendement de Durham-Humphrey a clarifié la distinction juridique entre les OTC et les médicaments d'ordonnance et créé un processus pour la FDA de catégoriser les médicaments. En 1961, la thalidomide, un
5
sédatif utilisé pour traiter les nausées matinales chez les femmes enceintes, a été retiré du marché après avoir été liée à des malformations congénitales, ensuite en 1962, la FDA a promulgué l'amendement de Kefauver-Harris, qui a élargi le rôle de la FDA en tenant compte les essais de l’efficacité et de la sécurité des nouveaux médicaments que doivent être démontrer par les promoteurs ainsi que les effets indésirables avant la commercialisation. Conformément à cette modification, tous les médicaments qui ont été sur le marché ont été évalués et classés par l'étude sur l'efficacité des médicaments en programme efficace, inefficace ou nécessitant un complément d'étude. Les amendements à la FFDCA se sont poursuivis au cours des 30 prochaines années. Ensuite en 1983, et en 1984, l’adoption de l’acte des médicaments orphelins et de l’acte de Hatch-Waxman successivement ont encouragé les fabricants pharmaceutiques de développer des médicaments pour les maladies rares et les rendre accessible par diminution des coûts et la fabrication des médicaments génériques respectivement.
En 1992, en raison de la réglementation intense, manque des ressources pour la FDA, la
demande accrue des consommateurs et le développement rapide de médicaments pharmaceutiques, les établissements pharmaceutiques ont subi des retards importants dans l’octroi de l’autorisation de mise sur le marché des médicaments, le congrès a adopté la loi sur les frais d'utilisation de médicaments sur ordonnance (Prescription Drug User Fee Act : PDUFA) ce qui a permet aux fabricants de médicaments eux-mêmes de financer le processus d'approbation des médicaments en contribuant aux ressources de la FDA pour l’ examen des demandes. Ensuite en 1997, le congrès a adopté la loi sur la modernisation de l’administration des aliments et médicaments), ou FDAMA (Food and Drug Administration Modernization Act) ce qui a conduit à la modification des exigences des tests cliniques, l'augmentation de l’accès aux thérapies expérimentales et la publicité sur l'utilisation de médicaments hors AMM n'était plus interdite. Puis les tests pédiatriques ont finalement été réglementés par la loi des meilleurs produits pharmaceutiques pour les enfants (Best Pharmaceuticals for Children Act : BPCA) en 2002, et la loi sur l’équité en matière de recherche en pédiatrie, ou PREA : Pediatric Research Equity Act en 2003, qui exigeait l’évaluation des médicaments à inclure dans les NDA. En 2009, l’adoption de l’acte de contrôle de tabac (Family Smoking Prevention and Tobacco Control Act : FSPTCA), et la promulgation de la loi de la protection
6
et les soins abordables de patient (Patient Protection and Affordable Care Act : PPACA) en 2010, ensuite l’adoption de la loi sur la qualité et la sécurité des médicaments en 2013. Dans la même année l’adoption de la loi sur la sécurité et l'innovation de la FDA (FDA Safety and Innovation Act : FDASIA), également connue sous le nom de l’acte de frais d'utilisation de la ré autorisation, a continué et élargi la pratique de la FDA de collecte des frais des demandeurs pour financer les tests des médicaments génériques, des médicaments innovateurs ou spécialisés de nouvelles maladies, des dispositifs médicaux et des produits biologiques et les biosimilaires. Suite à ce qui a passé en 2013, les maladies ou des populations spécifiques, y compris les orphelins, les médicaments de l’oncologie et les médicaments contre l'obésité, ont été identifiés comme le moteur de l'augmentation de la prescription de dépenses de médicaments en 2014, avec une nouvelle augmentation prévue en 2015. La FDASIA a également élargi le rôle des cliniciens et des patients tout au long du processus de développement et a permis à la FDA de désigner les médicaments comme thérapie de pointe.
Finalement l’adoption de la loi sur la qualité des dispositifs médicaux [6].
1.2. Rôles
La FDA règlemente les médicaments et les produits biologiques en se basant sur la science, la loi, et l’impact sur la santé public, ainsi qu’elle fournit des informations aux professionnelles de la santé et aux patients sur la qualité, l’efficacité et la sécurité de produits à travers la communication avec ces parties. A l’addition la FDA est responsable de l'examen des présentations réglementaires, de l’élaboration et de la mise en œuvre d’une politique réglementaire, de la recherche et de l’échange scientifique, de la surveillance des produits, et de la conformité [7], en outre la FDA avait un rôle de recouvrir la qualité du médicament en se basant sur les BPL avant la réalisation des ICH [8].
La FDA joue un rôle très important dans la protection du consommateur en assurant la sécurité des cosmétiques, des compléments alimentaires, les aliments et les produits émettant des radiation, assurer encore la sécurité et l'efficacité des produits biologiques, des médicaments destinées à l’usage humains ou animales, des dispositifs médicaux et vaccins, promouvoir l'innovation des produits, fournir les informations scientifiques et approuvé des nouveaux médicaments. La FDA ne fait pas réglementer la publicité (à l'exception des
7
médicaments d'ordonnance, et les dispositifs médicaux), d’assurance maladie, et des
médicaments illégaux [9].
8
9
Figure 2 : Organigramme du centre de recherche et d’évaluation des médicaments [11]
La FDA est une agence qui dépend du ministère de la Santé et des Services humains.
Elle se compose de bureau commissaire avec quatre divisions [9], elle englobe sept centre,
trois de ces centres sont responsables de la réglementation des produits médicaux destinés à
usage humains [12], le bureau du commissaire existe dans le centre de l’organigramme. Ce
bureau est attaché directement à plusieurs bureaux à savoir le bureau de chef de conseil, le
bureau de conseiller du commissaire, le bureau de directeur scientifique [13]. Ainsi le bureau
du commissaire est lié aux : bureau des affaires extérieures, bureau de la science et de la
sécurité du laboratoire, bureau de la politique, de la planification ,de la législation et d’analyse, bureau de la santé des minorités, bureau de la santé des femmes, bureau des aliments et des médicaments vétérinaires qui assure; la sécurité des aliments pour les êtres humains et les animaux, ainsi que la sécurité et l'efficacité des médicaments vétérinaires, ce dernier dirige ; le bureau de planification des ressources et gestion stratégique, le centre de la sécurité des aliments et la nutrition appliquée qui sert à effectuer des analyses sur les aliments et les produit cosmétiques à l’intérêt des consommateurs et des industrielles, et un centre pour les médicaments vétérinaires qui protège la santé des animaux de différentes destinations [9], puis il y’a le bureau des opérations réglementaires et politique global qui prend ses pouvoirs
du bureau du commissaire et qui pilote le bureau des affaires réglementaires et le bureau des
programmes internationaux, ensuite il y’a le bureau des produits médicaux et tabac qui est attaché en haut au bureau du commissaire et en bas au bureau des programmes médicaux
10
spéciaux et cinq centres spécialement le centre d’oncologie d’excellence, le centre pour l’évaluation et la recherche biologique [13] qui réglemente les produits biologiques, y compris les vaccins, destinés à un usage humain afin de garantir leurs sécurité, efficacité, et leurs disponibilité pour les patients, le centre des dispositifs médicaux et de la santé radiologique qui veille à réglementer la fabrication, la reconditionnement, l’étiquetage, et l’importation des
dispositifs médicaux et tous les produits électronique émettant des radiations, et le centre de
l’évaluation et de la recherche du médicament (CDER ) qui réglemente les médicaments en
vente libre et sur ordonnance et assure leur sécurité, leur efficacité et leur disponibilité [9]. Le
CDER est le plus grand des centres de la FDA, l'objectif principal du CDER est d'évaluer l'innocuité, l'efficacité et les risques associés aux nouveaux médicaments princeps et génériques. Depuis 2002, le CDER a activement promu des mesures de la qualité pour moderniser les politiques et les procédures de la réglementation des médicaments pour l’usage humain et vétérinaire, encourager l'adoption précoce de la technologie et améliorer les processus commerciaux et les politiques réglementaires de la FDA. Cependant, l'augmentation des manques de médicaments (y compris stériles les médicaments injectables, médicaments orphelins et médicaments oncologiques) ont conduit à un décret en Octobre 2011 qui a élargi l'autorité du CDER pour contenir la rupture de ces médicaments. Le bureau des nouveaux médicaments qui existe au sein du CDER exerce une surveillance réglementaire, étudie et prend des décisions de commercialisation pour les nouveaux et existants médicaments. En janvier 2015, un nouveau bureau de la qualité pharmaceutique (OPQ) a été inclut dans CDER suite à une restructuration faite par la FDA. Ce nouveau bureau regroupe beaucoup des objectives notamment l’amélioration de la surveillance de la qualité d'un médicament pendant le cycle de vie du produit. En outre, le bureau réaligne les ressources de l’agence, on créant un programme cohérent pour le nouveau produit, nom de la spécialité, des génériques, des médicaments en vente libre (OTC), et des médicaments
d’ordonnance [6]. Via le Bureau de la politique de la qualité pharmaceutique (OPPQ) l’OPQ
élabore, met en œuvre et met à jour les politiques et les normes basées sur la science et sur le risque, y compris l’évaluation de la politique et des normes de l‘inspection de la BPF en vigueur.
11
OPPQ est responsable de l’évaluation, de la cohérence et de l'adhésion aux politiques et aux normes qui ont été met par l'agence, et coordonne la communication liée à la qualité entre l'Agence et les intervenants externes. La mission principale de l'OPPQ est d’assurer une interprétation et une application uniforme de la politique qualité à propos du produit médicamenteux, y compris la collaboration avec les autorités réglementaires internationales. La "surveillance de la qualité" pharmaceutique concerne la surveillance de la qualité des produits pharmaceutiques qui existe déjà dans le marché. La surveillance de la qualité va grandement améliorer la capacité de la FDA à surveiller la qualité, en fournissant la possibilité à la fois pour la FDA et l'industriel pour répondre rapidement à un problème notifié de qualité avant que ce dernier s’aggrave. OPQ identifiera un ensemble de mesure de qualité à utiliser dans la surveillance afin que la FDA puisse mieux surveiller et prioriser les installations pour l'inspection de surveillance basée sur le risque. Le bureau de la surveillance (BS) conserve l'information sur toutes les installations impliquées dans la fabrication de médicaments destinés aux patients américains et effectue une analyse des risques et de la surveillance à travers un groupe de ces installations. Le BS génère et gère les connaissances liées à l'état de qualité des installations et des produits pharmaceutiques, de sorte que l'ensemble du médicament de la chaîne d'approvisionnement peut être mieux surveillée et comprise. L’intelligence générée grâce à ces efforts, ainsi que les données de d’approvisionnement de l'industrie, s’explique par l’aptitude de la FDA à prendre des décisions qui régissent la fréquence des inspections [14].
1.4. Les procédures de l’obtention de l’autorisation de mise sur le marché, et la surveillance post-AMM
Avant de décrire le procédé qu’il faut suivre pour octroyer l’AMM par la FDA, d’abord il faut définir c’est quoi un médicament pour la FDA. La FDA voit que pas toutes les substances prises par les patients "pour leur santé" sont considérés comme des médicaments. La FDA classe les produits à base de plantes, des vitamines et autres thérapies médicales complémentaires en tant que "compléments alimentaires ». La FDA définit un médicament comme une substance reconnue par une pharmacopée ou un formulaire officiel, une substance destinée à être utilisée pour le diagnostic, la guérison, l’atténuation, traitement ou prévention
12
de la maladie, Une substance (autre que de la nourriture) destinée à affecter la structure ou toute fonction du corps, ou une substance destinée à être utilisée comme le composant d'un médicament mais non périphérique ou un composant, une pièce ou un accessoire d'un périphérique.
Les procédures d’obtention de l’AMM d’un médicament par la FDA exige que tout développement d’un nouveau médicament doit passer par les mêmes étapes et suivre le même chemin, car après une longue durée de recherche fondamentale qui conduit à la conception d’un médicament, il doit poursuivre les étapes précliniques selon un ordre bien déterminé ; premièrement il faut comprendre le processus de la maladie, deuxièmement les cibles potentielles pour l’action du médicament doivent être identifier ainsi que les autres produits chimique qui peuvent modifier les cibles troisièmement les études précliniques commencent qui implique les études in vivo et in vitro pour déterminer l'efficacité et l'innocuité des médicaments proposés sur les modèles des animaux, y compris la cancérogénicité, la mutagénicité et la tératogénicité ensuite à la base des résultats obtenues les essais cliniques vont commencer à se préparer pour étudier la sécurité et l’efficacité du médicament chez l’homme, puis il faut avoir la formulation pharmaceutique approprié pendant la phase du développement pharmaceutique avec la description du procédé de fabrication potentiel, finalement il faut évaluer la pureté et la stabilité du médicament formulé. La substance donc est prête pour continuer son parcours et entamer les études cliniques, mais avant d’impliquer les hommes dans ces tests il faut impliquer la FDA. Ensuite l’industriel contacte la division appropriée de la FDA et met en place un programme de consultation de la pré-IND de cela la FDA fournit un certain nombre de documents d'orientation qui peuvent être utile pour assembler les données nécessaires et les matériaux pour la demande d’IND pour être sûr que le nouveau médicament ne se qualifie pas pour une exonération de la demande d'IND (rare, mais peut se produire avec certains médicaments génériques et des produits radiologiques). Puis les essais cliniques commencent lorsque le promoteur du médicament remplie une demande d’IND (investigational new Drug) avec l’agence et selon la nature de produit pharmaceutique le centre approprié est mis en ligne pour contribuer dans l’étude de ce produit
pharmaceutique [5]. La demande présente des informations sur les études pharmacologiques
13
cliniques [6], et les informations sur les experts cliniques qui prouvent ses habilités à mener
ces essais avec des engagements d’obtention de l’accord du comité d’éthique institutionnel. Tous les médicaments seront examinés par un comité, ou la division du nouveau médicament, spécialisée dans la classe des médicaments en question selon le but thérapeutique du
médicament [5]. Le comité d’éthique institutionnel demande le détail du plan proposé pour la
protection des participants humains, y compris le langage d’agrément éclairé et une déclaration des risques. Le demandeur doit spécifier l'indication d'utilisation, et noter le mécanisme d'action, les conditions cliniques, et la population prévue pour l’utilisation du
médicament [6]. L’industriel peut tomber dans de l’une des deux situations ; la première
situation est que la FDA ne présente aucune objection dans les 30 jours après la soumission de la demande, et donc l’expert clinique peut commencer. Et la deuxième situation c’est que la FDA émet un « hold clinique » qui peut donner lieu à un retard d’un an ou plus, ou répond avec des suggestions ou des changements obligatoires, et qu’il faut soumettre à nouveau la demande. Il existe deux catégories d’IND commercial et recherche mais également trois types de demande d’IND ; d’abord il y’a IND investigateur, l’IND en cas d’urgence (EIND) et IND traitement. Pourtant Toutes les applications IND nécessitent que l'investigateur fournit 3 catégories d'informations de base : 1) les données concernant les études précliniques et toxicologiques sur les animaux et toute expérience humaine antérieure avec le médicament (par exemple, expérience étrangère); 2) l'information de la fabrication, y compris la composition, le fabricant, la stabilité et les contrôles; et 3) les protocoles cliniques de l'étude, des informations sur les enquêteurs prouver qu'ils sont qualifiés pour mener les essais, comme ainsi que les engagements pour obtenir le consentement éclairé des sujets, obtenir l’approbation du comité d’éthique institutionnel , et adhérer à toute réglementation concernant les IND. Ensuite les essais cliniques prennent place pour établir la sécurité qui se fait à partir de la détermination de la dose maximale tolérable ou la dose optimale nécessaire pour obtenir le but thérapeutique souhaité et les effets indésirables potentiels dans la gamme exposée, l’efficacité qui détermine si un médicament a un avantage clinique positif devant un placebo. Les tests d'efficacité supposent « l’idéal », c'est-à-dire les conditions sont strictement contrôlées, et l’activité thérapeutique qui décrit les avantages cliniques d'un médicament dans la situation du « monde réel », par exemple, où les patients peuvent avoir des conditions de
14
comorbidités ou d'autres médicaments qui entre en interaction avec d’autre médicament, et où l'administration des médicaments peut ne pas suivre une étude stricte des lignes directrices. Les essais cliniques sont divisés en essais de phase 0, I, II et III. Les essais de surveillance post-approbation sont généralement appelés les essais de la phase IV.
On commence par les essais cliniques de la phase 0 qui nécessitent la soumission d'un IND
exploratoire suivi d'un IND complet. Les essais de phase 0 représentent le plus tôt, et la première utilisation de l’Homme d'un traitement médicamenteux proposé. Ils sont effectués sur une très petite cohorte (10 à 15 patients), avec des doses inférieures à 1% de la dose calculée pour produire l’effet clinique et les plannings d'administration ne devraient pas produire une toxicité clinique. La durée chez tout patient ne doit pas dépasser une semaine. Un essai de phase 0 peut aider à déterminer si un médicament entame sa cible prévue et est susceptible d'avoir l’effet thérapeutique attendu chez les êtres humains. Il peut également illuminer les caractéristiques pharmacocinétiques et pharmacodynamiques du médicament. Ces essais peuvent éliminer les thérapies inefficaces au début des processus la FDA et aider le chercheur à choisir entre les analogues agents concurrents pour d'autres développements. L’Approbation d'un essai de phase 0 en général nécessite moins de tests de toxicité que pour les essais de la phase I complets. Les essais de la phase 0 peuvent également être menés en attente de l'étude de la FDA d'une demande d’IND standard, par conséquent en fournissant des informations précieuses concernant les effets sur l’homme tout en évitant les retards du processus complet d'approbation de la FDA. Les IND de la phase 0 sont en fait un sous-ensemble des essais de la phase I de tous les nouveaux médicaments. Les IND de la phase 0 passent à la phase « complète » I des essais cliniques si les premiers résultats sont encourageants. Les fins d'un essai de la phase I sont de fournir une évaluation précoce de la sécurité, déterminer des plages de doses sûres et identifier les effets secondaires communs et le profil de toxicité du médicament. Le nombre de sujets est encore bas, généralement entre 20 et 80, et les sujets sont généralement sains parce que à ce stade des essais cliniques l'efficacité ce n'est pas le point finale de l'essai. Les études à dose unique sont le lieu de départ habituel des essais de la phase I : le sujet reçoit une dose unique de médicament pas plus grand que le dixième de la dose la plus élevée associée à aucun effet indésirable dans la plus sensible étude sur la sécurité des animaux. De nombreux chercheurs croient maintenant que
![Figure 1 : l'organigramme de la FDA [10]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041837.691884/42.1263.176.1162.82.610/figure-l-organigramme-de-la-fda.webp)
![Figure 2 : Organigramme du centre de recherche et d’évaluation des médicaments [11]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041837.691884/43.892.133.758.112.379/figure-organigramme-centre-recherche-évaluation-médicaments.webp)
![Figure 3 : Résumé de la procédure d’autorisation du médicament par la FDA [15]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041837.691884/53.1263.46.1177.73.616/figure-résumé-procédure-autorisation-médicament-fda.webp)
![Figure 4 : organigramme de l'ANSM [21]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041837.691884/56.1263.179.1155.174.638/figure-organigramme-de-l-ansm.webp)
![Figure 5 : organigramme d’INFARMED [43]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041837.691884/73.1263.164.1135.139.664/figure-organigramme-d-infarmed.webp)
![Figure 6 : les procédures de soumission d’une demande d’autorisation de mise sur le marché [44]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041837.691884/77.892.148.774.335.844/figure-procédures-soumission-demande-autorisation-mise-marché.webp)
![Figure 7 : Résumé des procédures de l’obtention de l’autorisation de mise sur le marché [44]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041837.691884/78.892.155.782.116.559/figure-résumé-procédures-l-obtention-autorisation-mise-marché.webp)

![Figure 10 : les éléments d'un processus [68]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041837.691884/86.892.126.778.695.997/figure-éléments-processus.webp)