Participation des patients à l'audit de l'hygiène des
mains des soignants: une étude pilote
Mémoire
Lori Côté
Maîtrise en sciences cliniques et biomédicales - avec mémoire
Maître ès sciences (M. Sc.)
Participation des patients à l’audit de l’hygiène des
mains des soignants : une étude pilote
Mémoire
Lori Côté
Sous la direction de :
Résumé
L’hygiène des mains (HDM) est la mesure la plus importante pour prévenir les infections nosocomiales. L’audit des pratiques d’HDM est essentiel à son amélioration. L’Organisation mondiale de la santé suggère que les patients peuvent procéder à l’audit, mais peu d’études ont exploré cette avenue.
Une étude exploratoire de type pilote a été réalisée auprès de patients hospitalisés à l’unité de chirurgie bariatrique de l’IUCPQ-UL1 (Canada), afin d’explorer : 1) la faisabilité d’impliquer les patients pour auditer les
pratiques d’HDM des soignants « avant le contact avec le patient ou son environnement » (acceptation, compétence, réalisation du comportement), 2) les variables psychosociales associées au comportement d’audit, 3) le vécu des patients-auditeurs. Aux phases A (n=14) et B (n=25) de l’étude, les patients ont été formés pour auditer l’HDM. Leur compétence a été vérifiée, puis ils ont procédé à l’audit pendant 24 heures. À la phase B, les déterminants du comportement (analyses multivariées) et le vécu des patients ont été mesurés à l’aide de questionnaires fidèles et valides développés pour l’étude.
Une proportion appréciable des patients ont accepté de participer (57% (17/30)), ont démontré la compétence d’auditer (93% (13/14)) et ont réalisé le comportement (100% (12/12)). Deux patients se sont retirés de l’étude et deux autres ont obtenu leur congé avant la fin de l’étude. La norme morale et la perception du contrôle comportemental ont expliqué 86% de la variabilité de l’intention de réaliser l’audit. Le niveau de scolarité a expliqué 50% de la variabilité de la fréquence du comportement. 94% (30/32) des patients ont rapporté une expérience générale positive. 80% (16/20) ont trouvé l’audit facile à réaliser.
Il est possible d’impliquer les patients hospitalisés en chirurgie bariatrique à titre d’auditeurs prospectifs de l’HDM des soignants et ils en retirent une expérience positive. Il est justifié d’investiguer davantage l’avenue du patient-auditeur de l’HDM.
Abstract
Hand hygiene (HH) is the most important measure to prevent hospital-acquired infections. Audit of HH practices is a key step towards its improvement. The WorldHealth Organization suggests that patients can perform HH audits, but few studies have explored this avenue.
A pilot-type exploratory study was conducted among patients hospitalized at the IUCPQ-UL2‘s bariatric surgery
unit to explore: 1) the feasibility of involving patients to audit healthcare workers’s (HCW) HH practice “before contact with the patient or their environment” (acceptance, competence, performing the behavior), 2) psychosocial variables associated with auditing behavior, and 3) patient-auditors experience. In phases A (n=14) and B (n=25) of the study, patients were trained to audit HCW’s HH. Following verification of their competency, they performed HH audits over a 24-hour period. In phase B, the behavioral determinants (multivariate analysis) and patient-auditors experience were measured with questionnaires developed for this study and for which the criteria of fidelity and validity have been met.
An appreciable proportion of patients agreed to participate (57% (17/30)), demonstrated competence to perform HH audits (93% (13/14)) and performed the behavior (100% (12/12)). Two patients withdrew from the study and two others discharged before the end of the study. Moral norm and perceived behavioral control accounted for 86% of the variability of the intention to perform the audit. The level of education accounted for 50% of the variability in behavioral frequency. 94% (30/32) of patients reported a positive overall experience. 80% (16/20) found the audits easy to accomplish
In conclusion, it is possible to involve patients hospitalized on a bariatric surgery unit as prospective auditors of HCW’s HH and their overall experience is positive. These results could be taken into account when planning future interventions involving patient-auditors. Further investigations of this avenue are warranted.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures et tableaux ... ix
Liste des abréviations, sigles, acronymes ... xi
Remerciements ... xii
Introduction générale ... 1
Chapitre 1 : Introduction ... 3
1.1 La problématique ... 3
1.1.1 Impact des infections nosocomiales ... 3
1.1.2 L’hygiène des mains des soignants pour réduire les infections nosocomiales ... 4
1.1.3 Lignes directrices canadiennes et québécoises en matière d’hygiène des mains ... 6
1.1.4 Faible observance de l’hygiène des mains par les soignants ... 8
1.1.5 L’audit des pratiques d’hygiène des mains des soignants : une pratique essentielle pour améliorer l’HDM dans les milieux de soins... 9
1.1.6 Les méthodes d’audit d’hygiène des mains ... 9
1.1.6.1 Méthodes indirectes ... 10
1.1.6.2 Les méthodes directes ... 11
1.1.7 Les limite de l’observation directe de l’HDM ... 13
1.1.8 Participation des patients à l’audit de l’hygiène des mains : une approche à explorer... 14
1.2 La recension des écrits ... 15
1.2.1 Participation des patients aux soins de santé et ses bénéfices ... 16
1.2.1.1 Résultats de santé ... 16
1.2.1.2 Sécurité et qualité des soins ... 17
1.2.1.3 Efficacité des soins et du système de santé ... 18
1.2.1.4 Nécessité d’un rôle accru du patient : le patient-partenaire ... 18
1.2.2 État actuel de la participation des patients aux stratégies et programmes d’amélioration de l’HDM des soignants ... 21
1.2.2.1 Pertinence de la participation des patients à l’amélioration de l’HDM des soignants ... 21
1.2.2.2 Formes de participation des patients aux améliorations de l’HDM des soignants ... 22
1.3 Le but de l’étude ... 30
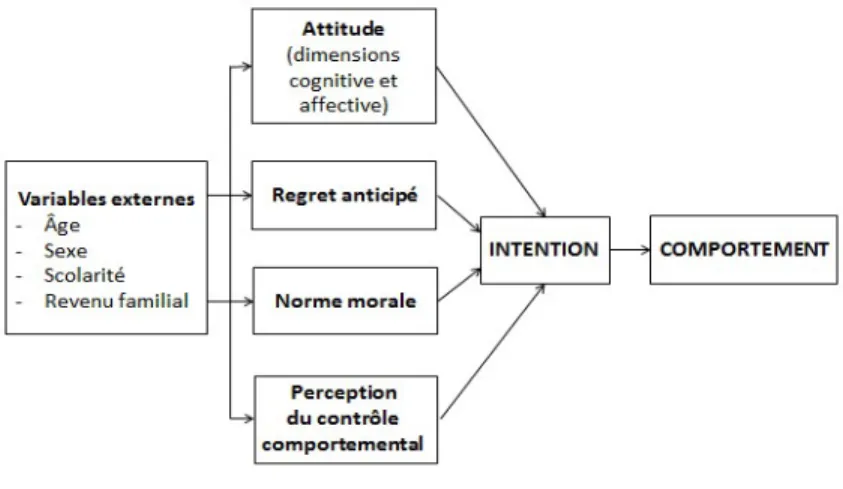
1.4.1 Le comportement d’audit de l’HDM et les déterminants psychosociaux ... 30
1.4.2 La théorie du comportement planifié ... 33
1.4.3 Limites de la théorie du comportement planifié ... 34
1.4.4 Modèle intégrateur de Godin pour l’étude du comportement d’audit de l’HDM ... 35
Chapitre 2 : Objectifs de l’étude ... 38
Chapitre 3 : Méthodologie ... 39 3.1 Devis de l’étude ... 39 3.2 Site de la recherche ... 39 3.3 Population et échantillon ... 39 3.3.1 Population cible ... 39 3.3.2 Échantillon ... 40 3.3.2.1 Mode d’échantillonnage ... 40
3.3.2.2 Critères d’inclusion et d’exclusion ... 40
3.3.2.3 Taille de l’échantillon ... 40
3.4 Déroulement de l’étude ... 40
3.4.1 Phase A : Proportion de patients qui acceptent de participer à l’étude, qui démontrent de la compétence pour réaliser d’audit de l’HDM des soignants et qui réalisent le comportement d’audit ... 40
3.4.1.1 Démarches préalables : considérations en lien avec les soignants ... 40
3.4.1.2 Déroulement de la phase A ... 41
3.4.1.2.1 Le recrutement (T1) ... 42
3.4.1.2.2 La formation et la démonstration de la compétence d’auditer (T2) ... 43
3.4.1.2.3 La période d’audit de l’HDM des soignants (T3)... 44
3.4.1.2.4 La mesure du comportement et l’évaluation sommaire de l’expérience (T4) ... 44
3.4.1.3 Instruments de mesures utilisés à la phase A de l’étude ... 45
3.4.1.3.1 Fiches d’observation de l’hygiène des mains ... 45
3.4.1.3.2 Guide d’entrevue individuelle partiellement structurée ... 45
3.4.1.3.3 Mesure des variables sociodémographiques et cliniques ... 46
3.4.1.4 Analyse des données à la phase A de l’étude ... 46
3.4.2 Phase B : Les variables psychosociales potentiellement déterminantes du comportement d’audit et le vécu de l’expérience des patients-auditeurs ... 47
3.4.2.1 Démarches préalables : considérations en lien avec les soignants ... 47
3.4.2.2 Déroulement de la phase B et variables collectées ... 47
3.4.2.2.2 La formation, démonstration de la compétence à auditer et mesure des déterminants du
comportement (T2) ... 49
3.4.2.2.3 La période d’audit de l’HDM des soignants (T3)... 50
3.4.2.2.4 La mesure du comportement et exploration du vécu de l’expérience des patients-auditeurs (T4) ... 50
3.4.2.3 Instruments de mesures utilisés à la phase B de l’étude ... 50
3.4.2.3.1 Fiches d’observation de l’HDM ... 50
3.4.2.3.2 Questionnaire de mesure des variables psychosociales potentiellement déterminantes du comportement d’audit de l’HDM des soignants ... 51
3.4.2.3.3 Questionnaire d’exploration du vécu de l’expérience des patients-auditeurs de l’HDM ... 52
3.4.2.3.4 Variables sociodémographiques et cliniques... 52
3.4.2.4 Analyse des données de la phase B ... 53
3.4.2.4.1 Analyse des données quantitatives ... 53
3.4.2.4.2 Analyse des données qualitatives ... 53
3.5 Considérations éthiques ... 53
Chapitre 4 : Résultats ... 55
4.1 Caractéristiques de l’échantillon : variables sociodémographiques et cliniques ... 55
4.1.1 Caractéristiques de l’échantillon à la phase A de l’étude ... 55
4.1.2 Caractéristiques de l’échantillon à la phase B de l’étude ... 55
4.2 Faisabilité d’impliquer les patients à titre d’auditeurs des pratique d’HDM des soignants « avant le contact avec le patient ou son environnement » dans un milieu de soins aigus québécois ... 56
4.2.1 Proportion d’acceptation de participer ... 57
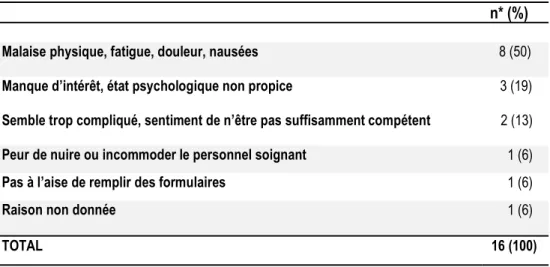
4.2.1.1 Raisons de refus ... 57
4.2.1.2 Limites rencontrées lors du recrutement des patients ... 58
4.2.1.3 Durée du recrutement ... 58
4.2.2. Formation et démonstration de la compétence d’auditer ... 58
4.2.3 Statistiques descriptives relatives à la réalisation et à la fréquence du comportement d’audit de l’hygiène des mains par les patients ... 60
4.2.3.1 Réalisation du comportement ... 60
4.2.3.2 Fréquence du comportement ... 61
4.3 Les variables psychosociales potentiellement déterminantes du comportement d’audit de l’HDM des soignants par les patients ... 63
4.3.1 Analyse descriptive ... 63
4.4 Le vécu de l’expérience des patients-auditeurs ... 65
4.5 Caractéristiques des observations d’HDM réalisées par les patients ... 72
4.5.1 Distribution des soignants audités en fonction de leur titre d’emploi ... 72
4.5.2 Distribution des observations d’HDM selon le moment de la journée ... 72
4.5.3 Statistiques descriptives relatives à la proportion d’observations d’HDM valides réalisées par les patients... 73
4.5.4 Taux d’observance de l’HDM au moment 1 tel qu’observé par les patients ... 74
Chapitre 5 : Discussion ... 75
5.1 Discussion des résultats en lien avec les trois objectifs de l’étude ... 75
5.1.1 La faisabilité du comportement ... 75
5.1.2 Les déterminants du comportement ... 80
5.1.3 Le vécu de l’expérience des patients-auditeurs ... 82
5.2 Discussion des autres résultats de l’étude ... 84
5.3 Recommandations pour la réalisation future d’audits de l’HDM des soignants par les patients hospitalisés ... 86
5.4 Forces et limites de l’étude ... 88
5.5 Recherches futures ... 90
Conclusion ... 91
Annexe A : Collaborateur-clés de l’IUCPQ-UL rencontrés avant l’initiation des phases A et B ... 93
Annexe B : Lettres d’appui au projet de recherche par les trois comités-conseils professionnels de l’IUCPQ (CII, CM, CMDP) ... 94
Annexe C : Affiche informative destinée aux patients et aux visiteurs ... 97
Annexe D : Affiche destinée aux soignants ... 98
Annexe E : Aide-mémoire pour l’identification des patients éligibles, destiné aux assistantes infirmières-chef de l’unité de soins de chirurgie bariatrique ... 99
Annexe F : Discours pour le recrutement des patients ... 100
Annexe G : Formation des patients à la phase A de l’étude ... 102
Annexe H : Fiche d’observation de l’hygiène des mains ... 104
Annexe I : Développement et validation des fiches d’observation de l’hygiène des mains des soignants (validité d’apparence et prétest) ... 105
Annexe J : Guide d’entrevue individuelle partiellement structuré permettant d’explorer sommairement le vécu de l’expérience des patients-auditeurs de l’hygiène des mains à la phase A de l’étude ... 106 Annexe K : Développement et validation (validité d’apparence) du guide d’entrevue partiellement
Annexe L : Questionnaire sociodémographique et clinique utilisé à la phase A de l’étude ... 111
Annexe M : Contenu de la formation théorique et pratique des patients à la phase B ... 112
Annexe N : Démonstration de la compétence des patients à auditer l’hygiène des mains des soignants à la phase B ... 114
Annexe O: Développement et validation du questionnaire explorant les variables psychosociales potentiellement déterminantes du comportement d’audit de l’hygiène des mains des soignants par les patients (validité de contenu, prétest et fidélité) ... 115
Annexe P: Outil d’évaluation de la validité de contenu du questionnaire explorant les variables psychosociales potentiellement déterminantes du comportement d’audit de l’hygiène des mains des soignants par les patients, destiné aux juges-experts ... 118
Annexe Q: Guide d’entrevue cognitive : prétest du questionnaire explorant les variables psychosociales potentiellement déterminantes du comportement d’audit de l’HDM des soignants par les patients ... 136
Annexe R : Questionnaire : Exploration des variables psychosociales potentiellement déterminantes du comportement d’audit de l’hygiène des mains des soignants par les patients à la phase B de l’étude ... 147
Annexe S : Questionnaire : Exploration du vécu de l’expérience des patients-auditeurs de l’hygiène des mains des soignants à la phase B de l’étude ... 153
Annexe T : Développement et validation du questionnaire explorant le vécu de l’expérience des patients-auditeurs de l’hygiène des mains des soignants (validité de contenu et prétest) ... 159
Annexe U : Outil d’évaluation de la validité de contenu du questionnaire explorant le vécu de l’expérience des patients auditeurs de l’HDM des soignants, destiné aux juges-experts ... 162
Annexe V : Guide d’entrevue cognitive : prétest du questionnaire explorant le vécu de l’expérience des patients-auditeurs de l’hygiène des mains des soignants ... 178
Annexe W : Questionnaire sociodémographique et clinique utilisé à la phase B de l’étude ... 187
Annexe X : Formulaire d’information et de consentement utilisé à la phase A de l’étude ... 188
Annexe Y : Formulaires d’information et de consentement utilisés à la phase B de l’étude ... 195
Annexe Z : Taux d’observance de l’hygiène des mains au moment 1 à l’unité de chirurgie bariatrique de l’IUCPQ-UL, tel qu’observé par l’équipe de prévention des infections (2010-2016) ... 203
Liste des figures et tableaux
Figure 1.1 Les quatre moments pour l’hygiène des mains lors des soins de santé Figure 1.2 La zone-patient et la zone-unité de soins
Figure 1.3 Calcul du taux d’observance de l’hygiène des mains
Figure 1.4 Modèle conceptuel des facteurs qui influencent la participation des patients à la prévention des erreurs.
Figure 1.5 Schématisation de la Théorie du comportement planifié (TCP) Figure 1.6 Schématisation du modèle intégrateur
Figure 1.7 Schématisation du modèle intégrateur tel qu’adapté pour l’étude du comportement d’audit de l’hygiène des mains des soignants par les patients
Figure 3.1 Schéma des analyses de corrélation
Figure 4.1 Organigramme relatif au recrutement, à la formation et à la démonstration de la compétence des patients à auditer l’HDM des soignants (phase A)
Figure 4.2 Organigramme relatif au recrutement, à la formation et à la démonstration de la compétence des patients à auditer l’HDM des soignants (phase B)
Figure 4.3 Réalisation du comportement d’audit de l’HDM des soignants par les patients à la phase A de l’étude
Figure 4.4 Réalisation du comportement d’audit de l’HDM des soignants par les patients à la phase B de l’étude
Figure 4.5 Distribution du nombre d’observations d’hygiène des mains par patient à la phase A de l’étude (n=122)
Figure 4.6 Distribution du nombre d’observations d’hygiène des mains par patient à la phase B de l’étude (n=162)
Figure 4.7 En général, avez-vous trouvé difficile ou facile d’observer si les soignants avaient fait ou non l’hygiène des mains ? (n=20)
Figure 4.8 Avez-vous trouvé difficile ou facile de noter vos observations de l’HDM des soignants dans votre cahier ? (n=20)
Figure 4.9 À quel point êtes-vous certain(e) que vos observations soient fidèles à la réalité ? n=20) Figure 4.10 Lors de cet exercice d’observation, vous êtes-vous senti… (n=20)
Figure 4.11 Y a-t-il des moments où vous avez observé qu’un soignant n’a pas fait l’hygiène des mains comme prévu ? (n=20)
Figure 4.12 Est-ce que le fait d’avoir observé des manquements à l’hygiène des mains vous a rendu anxieux (se) ? (n=19)
Figure 4.13 Est-ce qu’un ou des soignants se sont aperçus que vous étiez observateur de l’hygiène des mains ? (n=18)
Figure 4.14 Avez-vous l’impression que de noter vos observations de l’hygiène des mains des soignants a modifié la relation que vous avez avec eux ? (n=16)
Figure 4.15 Cet exercice d’observation a-t-il changé votre impression de la qualité des soins que vous recevez ? (n=20)
Figure 4.16 Si vous deviez être hospitalisé de nouveau, accepteriez-vous d’évaluer d’autres aspects des soins et services que vous recevez, par exemple, le nettoyage des chambres ou la distribution des médicaments, etc. ? (n=20)
Figure 4.17 Distribution des soignants audités en fonction de leur titre d’emploi (n=259)
Figure 4.18 Distribution des observations d’hygiène des mains selon le moment de la journée (heure) (n=248)
Figure 4.19 Proportion d’observations de l’hygiène des mains valides et exclues à la phase A de l’étude (n=122)
Tableau 3.1 Déroulement de la phase A de l’étude et types de variables collectées à chaque étape Tableau 3.2 Déroulement de la phase B de l’étude et types de variables collectées à chaque étape Tableau 4.1 Principales caractéristiques sociodémographiques et cliniques des patients participant à la
phase A de l’étude (n=12)
Tableau 4.2 Principales caractéristiques sociodémographiques et cliniques des patients participant à la phase B de l’étude (n=25)
Tableau 4.3 Raisons de refus de participer à l’étude à la phase A de l’étude (n=13) Tableau 4.4 Raisons de refus de participer à l’étude à la phase B de l’étude (n=21)
Tableau 4.5 Distribution des patients en fonction de la note de réussite attribuée lors de la démonstration de la compétence d’auditer (phase B)
Tableau 4.6 Fréquence du comportement aux phases A et B de l’étude
Tableau 4.7 Mesures de position et de dispersion des variables psychosociales potentiellement déterminantes du comportement (n=24)
Tableau 4.8 Matrice de corrélation (rho de Spearman) associant les variables psychosociales potentiellement déterminantes du comportement (n=24)
Tableau 4.9 Analyse de régression linéaire – les déterminants de l’intention comportementale (n=24) Tableau 4.10 Corrélation (rho de Spearman) entre l’intention, l’âge, le niveau de scolarité et la fréquence
du comportement d’audit par les patients (n=20)
Tableau 4.11 Analyse de régression linéaire – les déterminants du comportement d’audit de l’hygiène des mains des soignants (n=20)
Tableau 4.12 Réponses des patients concernant leur expérience générale à titre d’auditeur de l’hygiène des mains et leur fréquence (n=32)
Tableau 4.13 Facteurs facilitant l’observation de l’hygiène des mains, tels qu’exprimés par les patients (n=8) Tableau 4.14 Barrières à l’observation de l’hygiène des mains, telles qu’exprimées par les patients (n=12) Tableau 4.15 Suggestions des patients pour améliorer l’audit de l’HDM des soignants (n=8)
Liste des abréviations, sigles, acronymes
AIC Assistante-infirmière chef
APTS Alliance du personnel professionnel et technique de la santé et des services sociaux CDC Centers for Disease Control and Prevention
CHU Centre hospitalier universitaire CII Conseil des infirmières et infirmiers CISSS Centre intégré de santé et services sociaux
CIUSSS Centre intégré universitaire de santé et services sociaux
CM Conseil multidisciplinaire
CMDP Conseil des médecins, dentistes et pharmaciens DBP Dérivation biliopancréatique
DCPP Direction collaboration et partenariat patient (Université de Montréal) DVD Digital Video Disc (disque vidéographique numérique)
ÉT Écart type
FHA Friction hydroalcoolique
FIQ Fédération interprofessionnelle de la santé du Québec
HDM Hygiène des mains
ICSP Institut canadien pour la sécurité des patients
IN Infection nosocomiale
IU Institut universitaire
IUCPQ-UL Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval MSSS Ministère de la santé et des services sociaux (Gouvernement du Québec)
OMS Organisation mondiale de la santé PCI Prévention et contrôle des infections
SARM Staphylococcus aureus résistant à la méticilline SCFP Syndicat canadien de la fonction publique
SHA Solution hydroalcoolique
SIIQ Syndicat interprofessionnel de la santé de l’IUCPQ
SPSS Statistical Package for the Social Science (logiciel d’analyse statistique)
TCP Théorie du comportement planifié
Remerciements
La réalisation de ce projet n'aurait été possible sans la contribution de plusieurs personnes. Tout d'abord, je tiens à remercier le Dr Yves Longtin, qui a su me soutenir et me guider tout au long de cette grande aventure
qu’est l’achèvement d’un mémoire de maîtrise. Sa grande expertise et sa passion pour la recherche en prévention et contrôle des infections (PCI) ont su m’inspirer et pousser plus loin ma curiosité scientifique. J’aimerais ensuite remercier ma directrice de recherche, Maria Cecilia Gallani, pour sa rigueur, sa disponibilité et sa bienveillance qui ont su me donner l’élan nécessaire pour conclure ce projet au cours duquel j’ai appris énormément.
Je tiens à remercier tous les patients hospitalisés à l’Unité de chirurgie bariatrique de l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval (IUCPQ-UL), ainsi que ceux qui se sont présentés en clinique externe, d’avoir participé avec enthousiasme à cette étude. Merci également à tous les soignants de l’Unité de chirurgie bariatrique, ainsi qu’aux gestionnaires et médecins qui ont soutenu la réalisation du projet et sans lesquels ce dernier n’aurait pu voir le jour. Tout spécialement, j’aimerais remercier Marie-Laurence Tremblay qui a brillamment participé au recrutement des patients.
Je tiens également à remercier ma supérieure immédiate, Bianka Paquet-Bolduc, ainsi que la direction des soins infirmiers de l’IUCPQ-UL, d’avoir rendu possible la réalisation de ce mémoire en m’accordant un congé d’études et également, mes collègues de l’équipe de PCI pour avoir gardé le fort lors de mes absences. Merci également à la Fondation de l’IUCPQ-UL qui m’a accordé une bourse de maîtrise.
Je ne peux passer sous silence le soutien et les encouragements que j’ai reçus de ma famille et de mes amis tout au long de la réalisation de ce projet de longue haleine. J’aimerais aussi remercier ma mère et Isabelle Argall pour leurs yeux de réviseures.
Finalement, et non le moindre, merci à mon conjoint qui a su me soutenir de maintes façons au cours de mes études de 2e cycle, pendant lesquelles il a su faire plus que sa juste part. Merci également à mes deux petits
trésors, qui ont dû, à l’occasion, se passer de maman et qui m’ont donné la détermination nécessaire pour compléter ce beau projet.
Introduction générale
Les infections nosocomiales (IN) constituent un problème de santé publique d’importance [1-4]. Elles entraînent une morbidité et mortalité élevées chez les personnes atteintes [2-7]. Même si les connaissances dans le domaine de la prévention et contrôle des infections (PCI), de la microbiologie et de la médecine ont progressé depuis les dernières années et ont permis de mieux les détecter, les prévenir, les contrôler et les traiter [4], les IN continuent de constituer une menace importante à la santé des populations, entre autres par la progression très rapide de la résistance antimicrobienne qui limite ou élimine les chances de traitement de certaines de ces infections [8].
La lutte contre les IN se doit d’être une responsabilité partagée à tous les niveaux du système de santé[9]. Par exemple, la Direction générale de santé publique du Québec a la responsabilité d’identifier les priorités et de soutenir les établissements de santé dans l’élaboration et la mise en œuvre des programmes de PCI [4]; Les CIUSSS3, CISSS4, CHU5 et IU6 doivent fournir des soins sécuritaires et de qualité, en plus de déployer les
ressources nécessaires pour composer des équipes de PCI performantes [4]; Les équipes de PCI doivent, entre autres, assurer la surveillance des IN dans leurs établissements, éduquer et former les intervenants, gérer les éclosions et mettre en place des politiques visant les meilleures pratiques de PCI [4]; Les soignants ont la responsabilité professionnelle d’adopter ces meilleures pratiques auprès de tous leurs patients, comme adopter de bonnes pratiques d’hygiène des mains (HDM) lors des soins et des procédures [10]. Enfin, les patients ont eux-mêmes un rôle important à jouer. Il est démontré que leur participation active dans leurs soins de santé améliore leurs résultats de santé [11-18] et qu’elle joue un rôle important dans l’amélioration de la qualité des soins, de la sécurité des soins et de la prévention des erreurs médicales [11, 12, 15, 16, 19-27].
Les patients hospitalisés représentent l’une des populations les plus à risque de contracter des IN[5]. L’environnement des soins de santé (procédures invasives, contacts multiples avec différents soignants, proximité avec les autres patients, matériel de soins partagé, etc.) augmente le risque pour les patients d’être exposés directement ou indirectement à plusieurs pathogènes infectieux. De plus, les caractéristiques des clientèles hospitalisées d’aujourd’hui les rendent de plus en plus vulnérables aux infections (âge avancé, déficit immunitaire, nombreuses comorbidités, etc.)[5].
3 Centre intégré universitaire de santé et de services sociaux 4 Centre intégré de santé et de services sociaux
L’amélioration continue des connaissances, des programmes et des pratiques en matière de PCI est devenue essentielle afin de protéger la population hospitalisée contre les IN.
Le présent mémoire traite à la fois de l’amélioration des pratiques de PCI que de la participation des patients hospitalisés à leurs soins. L’approche du patient-auditeur de l’HDM des soignants, bien que recommandée et supportée par plusieurs organisations d’importance dans le domaine de la PCI, de la santé publique et de la sécurité des patients [3, 28] a très peu été étudiée jusqu’à présent. De plus, elle n’a jamais été étudiée, à notre connaissance, dans un contexte de soins aigus de courte durée québécois.
Au chapitre 1 de ce mémoire, sont présentés la problématique, la recension des écrits, le but de l’étude et le cadre de référence. Les objectifs de l’étude sont présentés au chapitre 2. La méthodologie utilisée pour réaliser l’étude pilote est présentée au chapitre 3. Les résultats, de natures quantitative et qualitative, sont présentés au chapitre 4 et la discussion de ces résultats, ainsi que les propositions de recherches futures, se retrouvent au chapitre 5.
Chapitre 1 : Introduction
1.1 La problématique
1.1.1 Impact des infections nosocomiales
Les infections nosocomiales (IN) constituent un problème de santé publique important au Canada[1, 2, 4] et à travers le monde[29], en plus de constituer un enjeu majeur pour la sécurité des patients[30]. Elles sont définies comme les infections associées aux soins de santé, contractées lors d’un épisode de soins en milieu hospitalier de courte durée ou autre milieu de soins, tels les soins de longue durée, les soins en centre de réadaptation ou les soins à domicile[5]. À tout instant, plus de 1,4 million de personnes dans le monde souffrent d’une IN[29]. Dans les pays développés, 5 à 10 % des patients admis à l’hôpital contactent une ou plusieurs infections nosocomiales à cause des soins reçus[5, 29]. Au Canada, le taux de prévalence serait de 9,8 %[5]. Aux États-Unis, on dénombre plus de 2 millions de nouvelles IN annuellement[5, 29], 115 000 en Belgique[5], 100 000 en Angleterre[29] et 800 000 en France[5]. Au Canada, on estime à plus de 200 000 patients par année qui contractent une IN[2].
Les IN ont un impact majeur sur les personnes atteintes, en particulier en ce qui a trait à la mortalité, la morbidité, et la qualité de vie de ces dernières[4, 5]. La mortalité probable attribuable à ces infections serait de 1 % à 10 %, selon le type d’infection[5]. Au Canada, on estime à plus de 8 000 décès attribuables aux IN annuellement[2], ce qui les placent au 6e rang des 10 principales causes de décès au Canada[31]. Aux États-Unis, on estime que
80 000 décès sont attribuables aux IN annuellement[29], ce qui les classent au 8e rang des causes de décès
dans ce pays[32]. En Angleterre, les IN causent 5 000 décès par an[29].
Au Canada et aux États-Unis, IN les plus fréquentes sont les pneumonies, les infections de site chirurgical, les infections gastro-intestinales (dont les infections à Clostridium difficile), les infections des voies urinaires et les bactériémies primaires[5, 33, 34]. Lorsqu’elles sont associées à la ventilation mécanique, les pneumonies nosocomiales entraînent un taux de mortalité de 27%[5]. Les infections de site chirurgical surviennent dans 2 % à 5 % des interventions et le taux de mortalité attribuable à ces infections varie en général de 0,5 à 4,3 %, selon le type d’intervention[5]. L’infection au Clostridium difficile reste la principale cause de diarrhée nosocomiale chez les patients hospitalisés au Canada et dans les autres pays développés[35, 36]. Au Canada, même si le taux d’incidence de cette infection a diminué au cours des dernières années[37], sa létalité (toutes les souches de la bactérie confondues) a augmenté de 4,3 % chez les 18-64 ans et de 9,6 % chez les personnes âgées de 85 ans et plus entre 2009 et 2015 [37]. Au Québec, pour l’année 2016-2017, 2 079 cas nosocomiaux ont été
taux de mortalité associé aux infections urinaires est de 0,5 % à 4 % et peut atteindre 12 % si une bactériémie est associée à l’infection. Le taux de mortalité attribuable aux bactériémies nosocomiales est calculé à 5 % pour les décès directs et de 5 % pour les décès indirects[5].
Les IN ont également un impact majeur sur la performance du système de santé en plus d’entraîner des coûts immenses. Par exemple, en prolongeant la durée du séjour hospitalier des personnes atteintes, elles restreignent l’accès aux soins de santé pour les autres patients. La durée de séjour est augmentée en moyenne de 10 à 17 jours lorsqu’une pneumonie nosocomiale associée à la ventilation mécanique est diagnostiquée chez un patient. Pour les infections de site chirurgical, le séjour est prolongé en moyenne de 12 jours et pour les bactériémies nosocomiales, de 8,5 à 22 jours[5]. Les coûts supplémentaires associés aux IN sont non seulement causés par l’hospitalisation prolongée du patient, mais aussi par les mesures de contrôle particulières, les traitements dispendieux et la surveillance intensive[39]. Aux États-Unis seulement, les coûts annuels s’élèvent entre 4,5 et 5,7 milliards de dollars USD[29]. Au Canada, les coûts estimés pour l’année 2010 étaient de 129 millions de dollars[39].
Les IN font partie des principaux évènements indésirables pouvant être prévenus chez les patients[40, 41]. Les études épidémiologiques ont estimé que le tiers des IN peuvent être prévenues par des programmes de PCI bien organisés[41]. En effet, des pratiques exemplaires de PCI dans les milieux de soins peuvent réduire à près de zéro le risque de contracter certaines IN[2]. Ces pratiques, comprises dans les programmes de PCI des établissements de soins, sont multiples et touchent à la fois aux comportements individuels qu’à l’ensemble des politiques de l’établissement[2, 4]. Parmi ces mesures, le respect des six pratiques de base en PCI est incontournable pour lutter contre ces infections. Il s’agit de l’hygiène et l’étiquette respiratoires, du port de l’équipement de protection personnelle, de la protection de l’environnement (p. ex., nettoyage et désinfection), de la gestion des visiteurs, des pratiques de travail sécuritaires et, la plus importante, l’HDM des soignants[42, 43].
1.1.2 L’hygiène des mains des soignants pour réduire les infections nosocomiales
L’HDM est la pierre angulaire de la PCI[5, 42, 44]. Elle est considérée comme le moyen le plus efficace et le plus simple pour prévenir la transmission des IN[3, 28, 45-48]. Depuis la découverte historique de Ignaz Philipp Semmelweis, un obstétricien hongrois qui a démontré, en 1861, que l’HDM pouvait réduire drastiquement la mortalité causée par la fièvre puerpérale chez femmes en période post-partum [49, 50], de multiples études ont confirmé la place centrale de l’HDM pour réduire et prévenir les IN. En effet, de nombreuses recherches démontrent que les mains sont le principal agent de transmission des microorganismes[28, 45] et que l’HDM,
lorsqu’elle est réalisée au bon moment et de la bonne façon, permet de diminuer les IN en diminuant considérablement la transmission de ces microorganismes aux patients[3, 39, 42, 45]. Même de petites améliorations de l’HDM peuvent entraîner des bienfaits considérables. Par exemple, une étude effectuée à Genève, en Suisse, a démontré que l’augmentation de l’HDM des soignants de 48 à 66 % sur cinq ans a diminué de 40 % les IN[51]. Une autre étude menée dans un hôpital universitaire multicentrique de Melbourne de 850 lits, a démontré que l’observance à l’HDM des soignants est passée de 21 % (IC 95 % : 20,3 %-22,9 %) à 42 % (IC 95 % : 40,2 %-43,8 %) sur une période de 12 mois (p < 0.001) et que cela a été associé à une diminution de 57 % des bactériémies nosocomiales à Staphylococcus aureus résistant à la méthicilline (SARM) (p = 0.01)[52]. Un autre étude réalisée dans une unité néonatale d’un hôpital universitaire pour enfants de Genève, a démontré qu’une augmentation graduelle de l’observance de l’HDM des soignants de 42 % à 54 % sur une période de 27 mois, a permis une réduction des taux globaux d’IN (passant de 11 à 8,2 infections par 1 000 jours-présence) et a diminué le risque d’IN de 60 % chez les bébés de très faibles poids à la naissance (15,5 à 8,8 épisodes / 1 000 jours-présence)[53].
Le terme « hygiène des mains » est une expression générique qui fait référence à toutes les actions posées pour éliminer les microorganismes de la surface des mains[44]. Il existe différents types d’HDM, selon le produit et la technique utilisés, soit le lavage hygiénique (eau et savon sans agent antiseptique), le lavage antiseptique (eau et savon avec agent antiseptique) et la friction hydroalcoolique (FHA) avec une solution hydroalcoolique (SHA)[42, 44]. La SHA est préférée aux autres produits, puisqu’elle a une activité antimicrobienne supérieure au savon régulier et au savon antiseptique et est pratique, rapide d’utilisation et moins asséchante pour la peau que les savons[3, 42]. Par contre, trois situations nécessitent l’utilisation de l’eau et du savon : lorsque les mains sont visiblement souillées, après être allé aux toilettes et après le contact avec un patient ou un environnement contaminé par le Clostridium difficile[44].
Respecter les bonnes pratiques d’HDM par les soignants lors des soins de santé fait consensus à travers le monde. En 2005, l’Organisation mondiale de la santé (OMS), voyant la nécessité de mener une lutte planétaire contre les IN, a lancé le premier Défi mondial pour la sécurité des patients, une campagne internationale visant à encourager les différents pays à réduire les IN dans leurs milieux de soins[2, 3]. Le Canada participe à cette campagne depuis 2006 et a lancé, en 2008, le Défi national pour l’hygiène des mains Arrêt! Nettoyez-vous les mains[54]. Ce programme canadien a pour but de soutenir les établissements de soins dans l’adoption des meilleures pratiques d’HDM pour réduire les IN[2, 54]. Depuis, de nombreux pays ont joint le Défi mondial de l’OMS de sorte que le respect des bonnes pratiques d’HDM fait maintenant partie intégrale des recommandations mondiales, nationales, régionales et locales en matière de PCI dans les milieux de soins[3,
1.1.3 Lignes directrices canadiennes et québécoises en matière d’hygiène des mains
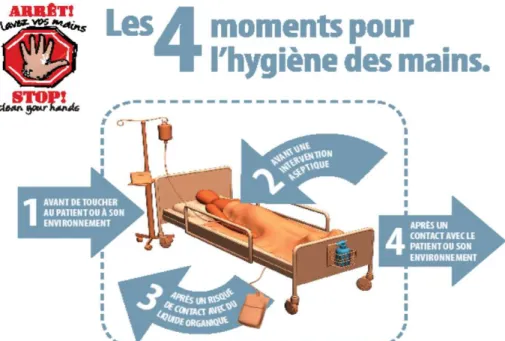
Au Canada et au Québec, les lignes directrices en matière d’HDM des soignants dans les soins de santé[44, 55, 64], qui découlent des lignes directrices de l’OMS[3], statuent l’importance pour les soignants de respecter les quatre indications pour l’HDM lors des soins aux patients (aussi appelées les quatre moments pour l’HDM). Les quatre moments correspondent à l’HDM « avant de toucher au patient ou son environnement » (moment 1), « avant une intervention aseptique » (moment 2), « après un risque de contact avec du liquide organique » (moment 3) et « après un contact avec le patient ou son environnement » (moment 4) (Figure 1.1) et ce, en réalisant une FHA ou un lavage des mains à l’eau et au savon (selon les indications propres à chacune de ces techniques)[44, 55, 64].
Figure 1.1 : Les quatre moments pour l’hygiène des mains lors des soins de santé
Document adapté avec la permission de Public Health Ontario qui n'assume aucune responsabilité pour le contenu de toute publication résultant de la traduction / modification / adaptation de documents de PHO par des tiers.
Disponible en ligne au :
https://www.patientsafetyinstitute.ca/fr/toolsresources/Documents /Hand%20Hygiene/Four%20Moments%20Poster%20FR.pdf
Lors des soins aux patients, ce sont les moments 1 et 4 qui sont les plus fréquemment indiqués pour les soignants au cours d’une journée[65, 66]. Selon Boyce et collaborateurs[45], ces indications représentent environ 80 % de toutes les opportunités d’HDM qui se présentent dans une journée pour un soignant et c’est
possible, de réaliser l’HDM à l’endroit où les soins sont prodigués, soit à l’intérieur de la zone-patient (Figure 1.2), afin de diminuer le risque de contamination accidentelle des mains[3, 28, 44, 69]. La zone-patient inclus le patient, ainsi que les objets et les surfaces qui lui sont temporairement et exclusivement dédiés durant son épisode de soins[69]. La zone-patient est souvent délimitée par les murs de la chambre d’hôpital (chambres privées) ou par les rideaux séparateurs à l’intérieur des chambres d’hôpital occupées par plus d’un patient (Figure 1.2).
Figure 1.2 : La zone-patient et la zone-unité de soins
Source: World Health Organization (2009, p. 9) En attente de l’autorisation de reproduire
Disponible en ligne au :
https://apps.who.int/iris/bitstream/handle/10665/44196/ 9789241598606_ eng.pdf?sequence=1&isAllowed=y
Notons que l’importance de procéder à l’HDM au moment 1 vient du fait qu’elle prévient la colonisation du patient ou des objets présents dans son environnement immédiat (dans zone-patient) avec les pathogènes retrouvés dans la zone de l’unité de soins[3, 69]. Ainsi, le transfert de pathogènes induits par le non-respect du moment 1 par le soignant, met le patient à risque de développer une IN.
1.1.4 Faible observance de l’hygiène des mains par les soignants
Même si l’importance de l’HDM dans la prévention des IN est bien reconnue, l’observance aux recommandations d’HDM par les soignants reste faible dans les milieux de soins et ce, à travers le monde[3, 45, 70-72]. En effet, de nombreuses études rapportent des taux en deçà de 50 % de ce qui devrait normalement être réalisé par les soignants[3, 45]. Plusieurs autres études rapportent des taux de base de moins de 40 % avant que les interventions promotionnelles n’aient lieu[3]. Au Québec, les plus récents taux d’observance d’HDM des soignants, tels que déclarés obligatoirement par les différents établissements de soins de la province au Ministère de la santé et des services sociaux du Québec (MSSS)[71], sont en moyenne de 59,1 % (i.e. pour l’ensemble du Québec, moments 1 et 4 confondus, pour les infirmières, médecins, préposés aux bénéficiaires, ergothérapeutes et physiothérapeutes confondus, pour l’année financière 2017-2018).
De plus, il est démontré que certaines indications pour l’HDM en particulier sont souvent moins bien respectées que les autres. En effet, lorsque l’on examine les taux d’observance d’HDM pour les deux moments d’HDM les plus fréquemment indiqués pour les soignants dans une journée (moments 1 et 4), le moment 1 est généralement moins bien respecté que le moment 4[67, 68, 71]. Par exemple, pour l’année financière 2017-2018, les taux moyens québécois démontrent que l’HDM au moment 1 est respecté à 49,2 % comparativement à 67,3 % pour le moment 4 (i.e. pour l’ensemble du Québec, tous les soignants confondus, pour l’année financière 2017-2018)[71]. Bien que le moment 1 pour l’HDM est à la fois très fréquemment indiqué pour les soignants au cours d’une journée de soins et à la fois très important pour prévenir les IN, le fait qu’il soit l’un des moments d’HDM le moins bien respecté par les soignants représente un risque accru d’IN pour les patients. Afin d’améliorer ces taux, l’OMS[3] et l’Institut canadien pour la sécurité des patients (ICSP)[64] proposent une approche multimodale qui inclut 5 grands axes : 1) l’augmentation de la disponibilité des SHA pour l’HDM aux endroits où les soins sont dispensés (p. ex., à l’intérieur des zone-patients); 2) l’éducation des soignants; 3) l’audit de l’observance des soignants à l’HDM et la rétroaction régulière des taux d’observance; 4) les campagnes de promotion; et 5) le développement d’une culture axée sur la sécurité des patients et le soutien institutionnel. L’un de ces axes, soit la réalisation d’audits réguliers des pratiques d’HDM des soignants, fera l’objet de la prochaine section.
1.1.5 L’audit des pratiques d’hygiène des mains des soignants : une pratique essentielle pour améliorer l’HDM dans les milieux de soins
Auditer l’HDM des soignants signifie d’évaluer son taux de conformité relativement aux recommandations reconnues pour prévenir les IN. Auditer l’HDM des soignants est une étape clé pour améliorer cette pratique dans les établissements de soins de santé[3, 45, 55, 64, 69, 73, 74] et fait également partie intégrante des lignes directrices en matière d’HDM dans les milieux de soins[3, 28, 45, 55]. Plus spécifiquement, la réalisation d’audits d’HDM permet de[3, 28, 64] :
calculer le taux d’observance de cette pratique et de faire de la rétroaction aux soignants et aux gestionnaires ;
identifier les cibles d’action les plus pertinentes à l’amélioration de l’HDM des soignants ;
évaluer l’impact des actions déployées pour améliorer la pratique et des campagnes de promotion d’hygiène des mains ;
suivre l’évolution de l’observance de l’HDM dans le temps pour une institution ou un secteur d’activité ; comparer différents secteurs d’une institution afin de stimuler l’amélioration des pratiques d’HDM ; faire de la rétroaction immédiate sur la pratique de l’HDM aux soignants à des fins de formation
continue (lors des audits) ;
évaluer les pratiques d’HDM dans un contexte d’investigation d’éclosions d’IN ;
comparer la qualité des soins entre différents hôpitaux ou entre différents secteurs d’activité ayant la même vocation.
De plus, les résultats d’observance des soignants aux recommandations d’HDM est un important indicateur de qualité et de sécurité des soins[3, 4, 75], puisqu’il existe une évidence substantielle qui démontre la corrélation entre de bonnes pratiques d’HDM et des bas taux d’IN[3]. L’audit de l’HDM des soignants est une pratique obligatoire dans tous les établissements de soins canadiens[75]. En effet, l’audit est une pratique organisationnelle requise, sans quoi les établissements de soins ne pourraient obtenir leur accréditation d’Agrément Canada leur permettant d’affirmer que les soins de santé qu’ils dispensent sont sécuritaires et de qualité[75]. Au Québec, l’audit de l’HDM des soignants est également une pratique réglementée, puisque tous les établissements de santé sont dans l’obligation d’auditer et de transmettre annuellement leurs taux d’observance au MSSS[76].
1.1.6 Les méthodes d’audit d’hygiène des mains
Il existe plusieurs méthodes pour réaliser l’audit de l’HDM des soignants. Elles sont divisées en méthodes indirectes et directes qui comportent chacune leurs avantages et leurs désavantages[3, 28].
1.1.6.1 Méthodes indirectes
Les méthodes indirectes comprennent la consommation des produits d’HDM et la surveillance électronique[3, 28].
Consommation de produits d’hygiène des mains
La consommation du papier à mains, de SHA ou de savon liquide peut être utilisée pour estimer le nombre d’actions d’HDM réalisées par les soignants[3, 28, 45, 77]. Pour faire cette estimation, le volume total utilisé est divisé par la quantité moyenne normalement utilisée pour une action d’HDM[3, 28]. Les avantages de cette technique sont qu’elle est objective et simple, qu’elle peut être réalisée de façon continue, à tout moment et dans tous lieux de l’organisation, qu’elle permet de réduire les coûts et qu’elle n’est pas sujette au biais d’observation, puisqu’il n’y a pas d’observateur présent près du soignant[3, 77]. Le biais d’observation, aussi appelé l’effet Hawthorne [3, 78-80] est généré par la présence d’un observateur qui influence le comportement du soignant[3, 28, 77]. Par contre, cette technique ne permet pas de savoir si les produits ont été utilisés par les soignants, les visiteurs ou les patients et ne permet pas de savoir si l’HDM était indiquée, si elle a été réalisée au bon moment et de la bonne façon pour prévenir les IN [3, 28, 77].
Surveillance électronique
Plusieurs systèmes de surveillance électronique ont été développés au cours des dernières années, dont les systèmes de surveillance dédiés, les systèmes de localisation en temps réel et la surveillance électronique de l’utilisation des distributeurs de SHA et de savon liquide[77].
Les systèmes de surveillance dédiés comprennent l’utilisation de capteurs permettant de surveiller l’entrée et la sortie des soignants dans la chambre d’hôpital ou dans la zone-patient et d’associer ces déplacements avec la réalisation ou non d’une HDM, par l’entremise d’une badge sensible à l’alcool portée par le soignant ou par des capteurs positionnés sur les distributeurs de SHA ou de savon liquide [81, 82]. Ces systèmes peuvent envoyer une rétroaction lumineuse, vocale, sonore ou vibratoire au soignant si ce dernier omet de procéder à l’HDM à l’entrée ou la sortie de ces zones[81, 82]. Dans les systèmes de localisation en temps réel, les soignants portent un badge qui peut communiquer avec les distributeurs de SHA et de savon liquide, puis avec des capteurs installés dans des endroits ciblés de l’hôpital en utilisant une technologie sans fil. Les informations concernant la pratique de l’HDM sont ensuite transmises à un serveur central qui réalise l’analyse et rapporte, en temps réel, le taux d’observance d’HDM pour chaque soignant, à chaque quart de travail, pour chaque unité de soins, pour chaque catégorie de professionnel de la santé, etc.[77]. Enfin, la surveillance électronique de l’utilisation des distributeurs de SHA et de savon liquide consiste à installer des dispositifs électroniques à l’intérieur des
distributeurs afin d’enregistrer le nombre de fois que le dispositif est utilisé[83-86], et parfois, d’enregistrer la date et l’heure de cette l’utilisation[86].
Les principaux avantages de la surveillance électronique sont qu’elle permet de mesurer un nombre très élevé d’indications d’HDM comparativement à l’observation directe, qu’elle permet d’évaluer une tendance dans la fréquence d’HDM, dont les changements dans la pratique suite à une intervention promotionnelle. Aussi, elle permet de réaliser des analyses et de la rétroaction en temps réel aux soignants sur leur pratique d’HDM[77]. Cependant, à ce jour, la surveillance électronique ne permet pas de calculer les réels taux d’observance de la pratique d’HDM des soignants, puisque le nombre d’opportunités totales d’HDM (le dénominateur) ne peut être identifié[77, 87]. Elle ne permet pas non plus de mesurer les moments 2 et 3 pour l’HDM[77] et entraîne des coûts annuels élevés qui atteignent environ 300 $ CAN par chambre[88].
1.1.6.2 Les méthodes directes
Les méthodes directes comprennent l’auto-évaluation par les soignants, la surveillance par vidéo et l’observation directe (OMS, 2009; Joint Commission, 2009).
L’auto-évaluation par les soignants
Il est possible de demander aux soignants qu’ils rapportent leur propre observance de d’HDM (auto-évaluation). Même si cette technique a l’avantage de comporter très peu de frais pour un établissement de soins de santé, il est démontré qu’elle n’est souvent pas fiable du fait que les soignants ont tendance à surestimer leur adhérence aux recommandations d’HDM[3, 28, 89-91] ou qu’ils pourraient difficilement se rappeler de leur comportement passé[28]. En effet, les taux rapportés par les soignants sont souvent largement plus élevés que ceux rapportés par l’observation directe, ce qui estime à la hausse la pratique de l’HDM chez les soignants[3].
La surveillance vidéo
La surveillance par vidéo consiste à installer des caméras sur l’unité de soins afin d’observer la pratique des soignants. Suite au visionnement de la bande vidéo par les investigateurs, ces derniers peuvent calculer le taux d’observance de l’HDM des soignants et de réaliser de la rétroaction sur la pratique[77, 92]. Cette technique a l’avantage de permettre l’observation d’un nombre très élevé d’opportunités d’HDM sans nécessiter la présence d’un auditeur sur place[93]. Elle permet aussi de différencier les indications pour l’HDM et le type de soignant qui procède à l’HDM. Cependant, des considérations concernant l’intimité des patients (qui sont également
À l’heure actuelle, l’observation directe de l’HDM constitue la technique de référence ou la mesure étalon (gold standard) pour évaluer la pratique de l’HDM des soignants [3, 28, 77, 87]. Elle signifie de regarder directement le soignant lorsqu’il est en contact avec un patient, afin de vérifier s’il procède ou pas à l’HDM selon les recommandations et de consigner ces observations[3, 28]. Les observations doivent se faire directement là où les activités de soins se produisent[3, 28]. Par exemple, l’observateur se positionne au corridor de l’unité de soins pour observer si les soignants procèdent ou non à l’HDM selon les 4 moments de l’HDM lors des contacts avec le patient ou son environnement. Afin d’assurer la qualité des données d’observation, les observateurs doivent être formés et leur compétence doit être validée avant d’entreprendre l’observation directe[3, 28]. Ce sont principalement les professionnels en PCI qui réalisent les observations dans les établissements de soins, mais parfois il peut s’agir d’autres soignants qui ont de l’expérience avec les soins aux patients[3, 28].
À ce jour, l’observation directe est la principale méthode disponible permettant de mesurer le taux d’observance de l’HDM des soignants du fait qu’elle est l’une des seules méthodes qui permet de détecter toutes les opportunités d’HDM qui se présentent (i.e. : détecter lorsque l’HDM est indiquée lors des soins, soit le dénominateur) et de consigner le nombre de fois où l’HDM a été réalisée alors qu’elle était indiquée[28, 45, 64, 69, 77, 87]. Ce taux est calculé en divisant le nombre d’opportunités pour l’HDM qui ont été réussies, par le nombre d’opportunités pour l’HDM qui étaient indiquées, multiplié par 100 (Figure 1.3)[3, 45, 69, 77].
Figure 1.3 : Calcul du taux d’observance de l’hygiène des mains
Taux d’observance de l’HDM (%) = Nombre d’opportunités réussies X 100 Nombre d’opportunités observées Adapté de World Health Organization (2009, p. 19)
Les autres avantages de l’observation directe est qu’elle est encadrée par une méthodologie normalisée qui a été validée par plusieurs études[3, 51, 95, 96], qu’elle permet de différencier les quatre moments pour l’HDM, qu’elle permet de collecter d’autres types d’informations utiles pour l’amélioration de la pratique, comme le port des gants de procédure, le type de soignant observé, la technique et les produits utilisés, le port de faux ongles et de bijoux aux mains[3, 28] et permet d’identifier d’autres facteurs propres à une unité de soins pouvant influencer l’adhérence aux recommandations d’HDM[3, 28].
1.1.7 Les limite de l’observation directe de l’HDM
Même si l’observation directe est considérée la technique de référence pour l’audit des pratiques d’HDM, elle comporte plusieurs limites[3, 28, 77, 87].
Un des principaux biais de cette méthode est qu’elle est sujette au biais d’observation (l’effet Hawthorne)[3, 28, 77-80]. Le biais d’observation est généré par la présence de l’observateur (habituellement l’infirmière en PCI) qui influence le comportement du soignant[3, 28]. Se sachant observé, et parce que la présence de l’observateur augmente l’attention envers le comportement à l’étude, le soignant a tendance à adopter une meilleure observance de l’HDM. Le biais d’observation peut résulter en une surestimation de la pratique de l’HDM des soignants[3, 28, 73, 97-100]. Par exemple, Eckmanns et ses collaborateur[100] ont réalisé une étude comparative sur cinq unités de soins intensifs (clientèle adulte) en Allemagne. Dans cette étude qui totalisait 2 808 opportunités d’HDM, l’observance des soignants envers l’HDM était de 45 % lorsque les observations étaient à découvert, mais il était de seulement 29 % lorsque les observations étaient cachées/discrètes. Les autres biais possibles sont le biais de l’observateur et le biais de sélection[3]. Le biais de l’observateur a lieu lorsque des observateurs différents interprètent la méthode d’observation et/ou les définitions d’une bonne ou mauvaise observance de l’HDM à leur propre manière, ce qui en résulte en des résultats d’observations différents pour une même situation[3]. Le biais de sélection se produit lorsque les observateurs sélectionnent systématiquement certaines périodes de temps, situations de soins, unités de soins ou opportunités pour l’HDM lors de la réalisation des audits. Ceci fait en sorte que leurs observations ne reflètent pas l’observance globale de l’HDM des soignants de l’établissement de soins de santé[3].
L’observation directe nécessite d’avoir des observateurs qualifiés et validés pour le faire, en plus de consommer beaucoup de temps et d’engendrer des coûts élevés [3]. Ceci implique qu’elle soit difficile à déployer à grande échelle dans un établissement de soins de santé[3, 28, 77, 87]. En effet, l’observation directe ne permet de connaître qu’un faible pourcentage (1-3 %) de toutes les opportunités d’HDM qui se présentent dans l’établissement de soins, ce qui remet en question la validité statistique des taux d’observance générés[28, 83, 101, 102].
Cette technique peut déranger les soins et compromettre l’intimité des patients, à cause de la proximité de l’observateur qui doit réaliser des observations lorsque les soins sont prodigués[28]. Aussi, l’observation directe est difficile ̶ voire impossible ̶ à réaliser dans certains milieux ou contextes de soins, comme par exemple la nuit, le soir et la fin de semaine[51, 103-105] ou lorsque le soignant ferme les rideaux séparateurs autour de la
zone-patient pour préserver l’intimité lors des soins[77]. Dans ce dernier cas, certaines opportunités pour l’HDM ne peuvent être observées par l’observateur externe[106], comme les moments 1, 2 et 3.
1.1.8 Participation des patients à l’audit de l’hygiène des mains : une approche à explorer
Puisque l’observation directe, telle qu’elle est réalisée actuellement dans les milieux de soins, comporte plusieurs limitations, l’OMS[3] et les Centers for Disease Control and Prevention américain (CDC) américain [45] recommandent dans leurs dernières lignes directrices en matière d’HDM dans les milieux de soins, que de nouvelles stratégies d’audit de l’HDM soient développées. Ces derniers suggèrent, tout comme d’autres organisations d’importance (Association for Professionals in Infection Control and Epidemiology, Inc., Institute for Healthcare Improvement, National Foundation for Infectious Diseases, Society for Healthcare Epidemiology of America, World Health Organization World Alliance for Patient Safety)[28], que les patients pourraient réaliser les observations de l’HDM des soignants, mais que cette avenue doit être davantage explorée. Par ailleurs, ces auteurs, comme plusieurs autres (Accréditation Canada, Association for Professionals in Infection Control and Epidemiology, Inc., Institute for Healthcare Improvement, National Foundation for Infectious Diseases, Society for Healthcare Epidemiology of America, World Health Organization World Alliance for Patient Safety)[28, 75, 107], affirment la nécessité d’identifier de nouveaux modèles de participation active et d’engagement des patients dans l’amélioration de la pratique de l’HDM des soignants[28, 69].
L’OMS[3] précise qu’à ce jour, l’approche du patient-observateur de l’HDM reste peu documentée et souligne la nécessité de démontrer sa fiabilité et sa validité. Elle souligne aussi l’importance de prendre en considération les éléments suivants, soit que les patients pourraient ne pas se sentir à l’aise dans ce rôle d’observateur, qu’ils pourraient ne pas toujours avoir la capacité physique ou psychologique de réaliser les observations et que l’observation pourrait potentiellement entraîner un impact sur la relation patient-soignant[3].
Les travaux du Joint commission américain et ses collaborateurs (Association for Professionals in Infection Control and Epidemiology, Inc., Institute for Healthcare Improvement, National Foundation for Infectious Diseases, Society for Healthcare Epidemiology of America, World Health Organization World Alliance for Patient Safety) [28], concluent également que les patients peuvent être des auditeurs de l’HDM des soignants mais que cette approche doit être étudiée davantage. Ces travaux indiquent que les patients seraient en mesure d’évaluer les indications de base pour l’HDM, comme les moments 1 et 4 [28]. De plus, ils soulignent que si les patients réalisent les observations d’HDM des soignants, il faudra informer les soignants que l’HDM doit être faite devant le patient et non à l’extérieur de la zone-patient afin qu’elle puisse être vue et évaluée par le patient [28]. Boyce et ses collaborateurs [77] se sont également prononcés sur l’approche du patient-observateur de l’HDM.
soignants, quant à son niveau de précision, sa faisabilité de sa mise en œuvre à l’échelle de l’hôpital et sa généralisabilité[77].
Dans la revue systématique Davis et ses collaborateurs[108], les auteurs concluent que l’avenue du patient-auditeur de l’HDM dans laquelle le patient complète une carte d’observation de l’HDM, pourrait aider les soignants à améliorer leur pratique de l’HDM. Ces auteurs mentionnent que cette avenue mérite d’être davantage explorée, puisqu’elle pourrait augmenter l’observance de l’HDM des soignants et qu’en plus, les patients semblent à l’aise de le faire[108, 109]. Ils précisent que l’exactitude des observations des patients pourrait être évaluée, principalement lorsque le soignant omet de procéder à l’HDM, et comparée avec une méthode d’observation plus traditionnelle déjà utilisée dans le milieu étudié[108]. Enfin, puisque la recherche dans le domaine de la participation des patients est jeune, ils soulignent l’importance de considérer dans les recherches futures l’exploration des conséquences possibles d’une telle participation (qui sont largement inexplorées à ce jour), comme par exemple si cette participation crée de l’anxiété chez le patient[110, 111] ou une tension entre le patient et le soignant [110-112].
Lee et ses collaborateurs[113] mentionnent que l’approche du patient-observateur de l’HDM est une avenue pertinente pour réaliser l’audit des pratiques, puisqu’il permet d’obtenir des informations privilégiées dans la mesure où le patient est toujours présent pour chaque soin prodigué. En comparaison, l’observation directe réalisée par des professionnels formés ne permet de collecter qu’une petite fraction des opportunités d’HDM réalisées auprès d’un patient au cours d’une journée et peut gonfler les résultats (dû à l’effet Hawthorne).
L’état des connaissances sur la participation des patients à l’audit de l’HDM des soignants fera partie intégrante de la recension des écrits.
1.2 La recension des écrits
L’état des connaissances sur la participation des patients aux soins de santé et aux stratégies et programmes d’amélioration de l’HDM des soignants (dont leur participation aux audits de l’HDM des soignants) constituera la prochaine section.
1.2.1 Participation des patients aux soins de santé et ses bénéfices
Au cours des 20 dernières années, le rôle du patient au sein du réseau de la santé a progressivement évolué[114]. Sa participation à ses propres soins et à l’amélioration des services de santé est de plus en plus grande, en plus d’être de plus en plus souhaitée par la communauté des patients, la communauté professionnelle, scientifique, politique[115, 116] et les ordres professionnels[117, 118]. L’approche de soins paternaliste ̶ dans laquelle les professionnels priorisent le plan d’intervention en faisant peu de place au patient ̶ a graduellement laissé place à un modèle de soins centré sur le patient, dans lequel les professionnels mettent le patient au centre de leurs tâches et de leurs préoccupations afin de collaborer activement avec lui vers des objectifs communs pour mieux répondre à ses besoins[116].
Et pour cause, la participation grandissante des patients a démontré de nombreux impacts positifs sur leurs résultats de santé[12-14], sur l’amélioration de la sécurité et de la qualité des soins[12] et même sur l’efficacité des soins et du système de santé[115].
1.2.1.1 Résultats de santé
La participation des patients a démontré une amélioration de leurs résultats de santé[12, 115]. Les revues systématiques ont démontré que l’approche des soins centrés sur le patient ̶ dans laquelle le patient participe activement ̶ ont augmenté son adhérence aux protocoles et traitements, ont réduit la morbidité et amélioré la qualité de vie des patients[13]. D’autres études concluent que la participation des patients entraîne un soulagement plus rapide de leurs symptômes[14], une meilleure gestion de la douleur[14] et de meilleurs paramètres physiologiques (p.ex., tension artérielle, glycémie)[14]. La participation des patients dans les programmes de gestion des maladies chroniques a été démontrée efficace pour une meilleure gestion de l’asthme et du diabète de type 2[15] et entraîne une baisse du taux de mortalité chez les personnes atteintes de bronchopneumopathie obstructive chronique[16]. Les patients qui s’impliquent comprennent mieux leur état de santé, les options de traitements, leur plan de soins[16, 115], utilisent plus efficacement les ressources disponibles[17] et ont une meilleure autogestion de leur pharmacothérapie[18].
Les patients ne participent pas seulement à leurs soins directs, mais s’engagent aussi à tous les niveaux du système de santé[115]. Cet engagement a récemment été défini dans l’un des ouvrages de l’Institut canadien pour la sécurité des patients (ICSP) et ses collaborateurs[115] comme suit :
L’engagement des patients signifie de faire participer les patients, les familles ou les patients partenaires à leurs propres soins de santé et à la conception, prestation et l’évaluation des
services de santé […]. Les connaissances expérientielles des patients sont reconnues et le pouvoir est partagé dans des relations continues, significatives et constructives à tous les niveaux du système, que ce soit au niveau des soins directs aux patients, au niveau de l’établissement de soins (organisation et conception des services) ou au niveau système de santé (établissement de priorités et des politiques). (Traduction libre : ICSP et al., 2018, p.7).
Quant à l’OMS[3], elle décrit l’engagement des patients comme un processus dans lequel les patients comprennent leur rôle, se font donner par leurs professionnels de la santé les connaissances et habiletés nécessaires pour accomplir une tâche dans un environnement qui reconnait les différences culturelles et qui encourage la participation des patients.
1.2.1.2 Sécurité et qualité des soins
Inclure les patients dans les initiatives de sécurité des soins est une tendance grandissante[15] et est soutenue par les organisations majeures en matière de sécurité des patients, comme l’OMS, Santé Canada, Agrément Canada et le Joint Commission, par le biais de divers programmes et recommandations officielles[3, 28, 72, 115, 119]. Les patients jouent un rôle important dans l’amélioration de la sécurité et de la qualité des soins[16, 19, 115], étant des yeux et des oreilles supplémentaires qui doivent s’intégrer aux processus de sécurité de toutes les organisations de santé[20]. La participation des patients permet d’identifier les risques de manière plus proactive et de prévenir plus efficacement les futurs incidents[115]. Les études démontrent que les patients peuvent fournir des renseignements uniques pour assurer la surveillance de la sécurité des soins[19, 21-24], pour améliorer la qualité des soins[12], pour prévenir les erreurs médicales[15, 16, 25-27] et pour prévenir les incidents préjudiciables[115].
Pour assurer la sécurité des soins, les patients sont entre autres appelés à fournir des observations ou donner leurs commentaires sur les soins reçus[120]. Plusieurs études se sont penchées sur la façon dont les patients observent les méthodes de travail des soignants, comme la distribution des médicaments[121] et l’identification des patients[122]. Les patients participent à améliorer la qualité des soins[12, 115] en donnant de la rétroaction sur leurs expériences pendant ou après l’épisode de soins (sondages, entrevues qualitatives individuelles, focus groups)[12]. Par exemple, certaines études suggèrent que la participation des patients a permis d’améliorer la qualité des soins en améliorant l’HDM des soignants lors des soins aux patients[15, 16], de réduire les erreurs médicales comme le nombre d’erreurs de médicaments[16, 25], de diminuer les chutes des patients[16] et de prévenir le mauvais site de chirurgie[26]. D’autre études suggèrent que la participation des patients aurait diminué les infections nosocomiales[15, 16], comme les infections des cathéters centraux[27]. Aussi, les nouvelles données probantes[123] affirment que les patients sont en mesure de reconnaître et de signaler les