Étude de la perception et de l’adaptation à l’hypoxie
chez la levure pathogène opportuniste Candida albicans
Thèse
Anais Burgain
Doctorat en biologie cellulaire et moléculaire
Philosophiæ doctor (Ph. D.)
Étude de la perception et de l’adaptation à
l’hypoxie chez la levure pathogène opportuniste
Candida albicans
Thèse
Anaïs Burgain
Doctorat en biologie cellulaire et moléculaire
Philosophiae doctor (Ph.D.)
Sous la direction de :
Adnane Sellam, directeur de recherche
Résumé
Candida albicans est une levure pathogène opportuniste responsable d’infections appelées candidoses. Ce type d’infection est particulièrement grave chez les personnes ayant un système immunitaire affaibli. Toutefois, peu de traitements sont disponibles et une augmentation des résistances font que les infections fongiques sont un problème de santé publique majeur.
Au sein de l’hôte, cette levure doit s’adapter à l’environnement parfois hostile des différentes niches. Afin de persister chez l’être humain, ce micro-organisme doit être en mesure de percevoir les changements environnementaux et adapter son métabolisme en conséquence. L’adaptation aux nutriments disponibles ainsi que de la teneur en oxygène sont deux éléments importants pour le développement dans les différentes niches. La compréhension de l’adaptation de cette levure au sein de l’hôte pourra permettre l’identification de nouvelles cibles thérapeutiques.
Nous avons effectué une analyse métabolomique à différents temps d’exposition à l’hypoxie dans le but de découvrir pour la première fois la réponse métabolomique de C. albicans lorsque cette levure est confrontée à une déplétion en oxygène. Nous avons observé un remodelage métabolique important en particulier concernant la glycolyse, la voie des pentoses phosphates et la paroi cellulaire. Le lipidome de C. albicans est également fortement affecté par l’hypoxie, en particulier les composants de la membrane plasmique tels que les phospholipides, les sphingolipides et l’ergostérol. Les données transcriptomiques corroborent les résultats observés lors de l’étude métabolomique. Enfin, nous avons testé la sensibilité de C. albicans à différents stress afin de confirmer l’altération physiologique provoquée par l’hypoxie comme suggérée par l’analyse du métabolome.
Nous avons également réalisé un criblage de banques de mutants afin d’identifier des régulateurs de la flexibilité métabolique hypoxique. Nous avons identifié le rôle de Snf5, une sous-unité du complexe de remodelage de la chromatine SWI/SNF, permettant de coordonner la disponibilité en nutriments et en oxygène avec la réponse transcriptionnelle pour permettre l’adaptation aux changements environnementaux. Snf5 est nécessaire pour la réponse transcriptionnelle relative au commensalisme et aussi aux traits de virulence de C. albicans.
Nous avons confirmé ces observations par des tests de colonisation intestinale dans un modèle murin et le mutant snf5 s’est révélé incapable de persister dans le tractus digestif des souris. Le mutant snf5 présente également une atténuation des traits de pathogénicité : il ne peut former des hyphes, ne cause pas de dommage aux cellules de l’hôte et il est avirulent dans un modèle d’infection des larves de Galleria mellonella. L’étude des interactions génétiques a permis d’identifier un lien entre SNF5 et le gène de l’adénylate cyclase CYR1. Ceci suggère que Snf5 et Cyr1 appartiennent à la même voie de signalisation afin de permettre la flexibilité métabolique hypoxique.
Les travaux de cette thèse ont permis de connaitre la réponse métabolomique hypoxique chez C. albicans et apportent des connaissances fondamentales sur cette levure. Cette compréhension pourra par la suite servir à cibler les voies métaboliques importantes pour la survie au sein de l’hôte et ainsi permettre le développement de nouveaux antifongiques. Nous avons également identifié le rôle de Snf5 pour la flexibilité métabolique hypoxique. L’absence de Snf5 provoque un défaut majeur de virulence chez C. albicans, ceci renforce l’idée de cibler les voies métaboliques pour lutter contre cette levure. Ainsi Snf5 ou un autre membre du complexe SWI/SNF pourrait être une cible thérapeutique pour le développement de nouveaux traitements antifongiques.
Table des matières
Résumé ... ii
Table des matières ... iv
Liste des figures ... viii
Liste des abréviations ... ix
Avant-propos ... xi
Introduction ... 1
Partie I. Candida albicans ... 1
1. Les candidoses... 2
1.1 Les candidoses superficielles ... 3
1.1.1 Les candidoses des muqueuses ... 3
1.1.2 Les candidoses cutanées ... 4
1.1.3 Les candidoses des ongles ... 4
1.2 Les candidoses invasives ... 5
2. Les traitements antifongiques... 7
2.1 Les azoles ... 7
2.2 Les polyènes ... 8
2.3 Les échinocandines ... 8
2.4 L’analogue pyrimidique ... 9
2.5 Les résistances aux antifongiques ... 10
2.6 Vers de « nouveaux » antifongiques ... 11
3. Les traits de virulence ... 11
3.1 Polymorphisme ... 12
3.1.1 La transition levures-filaments ... 13
3.1.2 La transition white-gray-opaque ... 15
3.2 Adhésion, invasion et dommage cellulaire ... 15
3.2.2 Les enzymes hydrolytiques ... 16
3.3 Les biofilms ... 17
4. Le fitness fongique ... 18
4.1 Le pH ... 18
4.2 Les métaux ... 19
4.3 La réponse aux stress ... 20
4.3.1 Le stress oxydatif ... 20
4.3.2 Le stress osmotique ... 20
4.3.3 Le stress thermique... 21
5. La régulation commensal/pathogène ... 22
Partie II. La flexibilité métabolique ... 23
1. Flexibilité métabolique de la levure modèle S. cerevisiae ... 23
1.1 Perception et signalisation du glucose ... 24
1.2 Déplétion en glucose et utilisation de sources de carbones alternatives ... 26
2. Flexibilité métabolique chez C. albicans ... 27
2.1 Sources de nutriments disponibles au sein de l’hôte ... 27
2.2 Perception et signalisation du glucose ... 29
2.3 Utilisation des sources de carbone alternatives et absence de glucose ... 32
2.4 Divergences métaboliques entre S. cerevisiae et C. albicans ... 32
2.5 Lien entre pathogénicité et flexibilité métabolique ... 34
Partie III. La perception et l’adaptation à l’hypoxie ... 37
1. Perception et adaptation à l’hypoxie chez l’être humain ... 38
2. Perception et adaptation à l’hypoxie chez les champignons ... 39
3. Perception et adaptation à l’hypoxie chez C. albicans... 40
Partie IV. Le remodelage de la chromatine ... 44
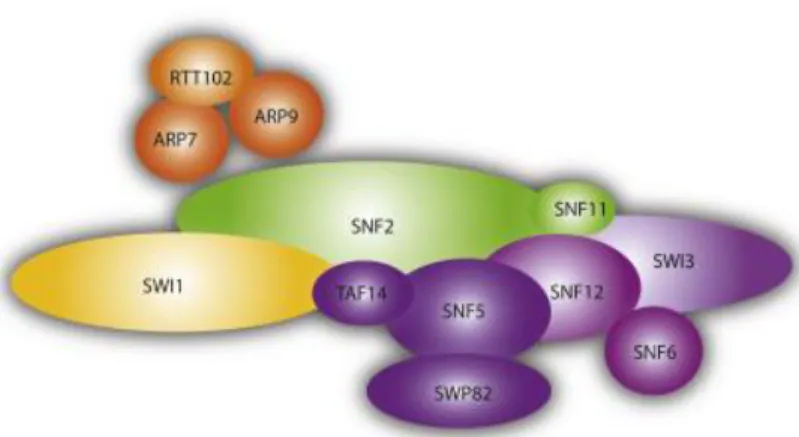
1. Généralités sur le complexe SWI/SNF... 45
1.1 Composition du complexe SWI/SNF ... 45
2. Le complexe SWI/SNF chez C. albicans ... 47
3. Rôle de la sous-unité Snf5 ... 49
Chapitre 1. Hypothèses et objectifs ... 53
Chapitre 2. Reprogrammation métabolique chez la levure pathogène opportuniste C. albicans en réponse à l’hypoxie ... 55
2.1 Résumé ... 55
2.2 Article 1 ... 56
2.2.1 Introduction ... 58
2.2.2 Materials and methods ... 59
2.2.3 Results and discussion ... 62
2.2.4 Conclusion ... 69
Chapitre 3. Un nouveau circuit génétique contrôlant la flexibilité métabolique, le commensalisme et la virulence chez le pathogène fongique Candida albicans... 88
3.1 Résumé ... 88
3.2 Article 2 ... 89
3.2.1 Introduction ... 91
3.2.2 Materials and methods ... 94
3.2.3 Results ... 99
3.2.4 Discussion ... 110
Chapitre 4. Discussion et perspectives ... 144
1. Le métabolisme hypoxique ... 144
1.1 Importance du métabolisme pour la virulence ... 144
1.2 Métabolisme et signalisation... 146
1.3 Homéostasie du statut énergétique et équilibre redox ... 147
1.3.1 Production de glycérol ... 148
1.3.2 Détoxication des ROS et génération du NADPH par la voie des pentoses phosphates ... 149
1.4 Métabolisme des pyrimidines ... 151
1.5 Les lipides membranaires ... 153
2. Les acteurs de la perception hypoxique et le rôle de la sous-unité Snf5 ... 155
2.1 Rôle de l’ATP ... 155
2.2 Perception de l’homéostasie cellulaire par l’AMPK (Snf1) ... 156
2.3 Relation entre Snf5 et l’adénylate cyclase (Cyr1) ... 159
2.4 Le rôle de Snf5 et le fonctionnement mitochondrial ... 160
3. Importance des poly glutamines (poly Q) ... 163
Conclusion ... 167
Liste des figures
Figure 1 : Premières illustrations imprimées de Candida (Oidium) albicans réalisées par
Charles Phillipe Robin. ... 1
Figure 2 : Pathogenèse des candidoses invasives. ... 6
Figure 3 : Mécanismes d’action des quatre classes d’antifongiques pour lesquels les antifongiques les plus courants sont représentés. ... 9
Figure 4 : Schéma représentant les différents traits de virulence chez C. albicans... 12
Figure 5 : Représentation des différents morphotypes de C. albicans. ... 13
Figure 6 : Polymorphisme chez C. albicans. ... 14
Figure 7 : Représentation des voies de signalisation gouvernant la réponse aux sucres chez la levure S. cerevisiae. ... 25
Figure 8 : Disponibilité en nutriments au sein des différentes niches de l'être humain et les réponses de C. albicans face à ce changement en nutriments. ... 28
Figure 9 : Schéma représentant les voies de signalisation des sucres chez C. albicans. ... 31
Figure 10 : Schéma représentant l'influence des nutriments sur l'expression des différents traits de virulence de C. albicans. ... 35
Figure 11 : Composition du complexe SWI/SNF chez la levure S. cerevisiae. ... 46
Figure 12 : Effet de la perte de la sous-unité Snf5 sur l'intégrité du complexe SWI/SNF chez S. cerevisiae. ... 49
Figure 13 : Fonctionnement mitochondrial et quantification des ROS. ... 161
Liste des abréviations
AC adénylate cyclase
ADN acide désoxyribonucléique ADP adénosine diphosphate
Als de l'anglais Agglutinin‐Like Sequence
AMP adénosine monophosphate
AMPc adénosine monophosphate cyclique ATP adénosine triphosphate
BCAA acides aminés ramifiés
CCCP carbonylcyanure m-chlorophénylhydrazone
CDC de l’anglais Center for Disease Control and preventions
CO2 dioxyde de carbone
CTP cytidine triphosphate
DHODH dihydroorotate déshydrogénase G6PDH glucose-6-phosphate déshydrogénase GFP protéine fluorescente verte
GPI GlycosylPhosphatidylInositol
GUT de l'anglais Gastrointestinally indUced Transition H2O2 peroxyde d’hydrogène
HIF facteur induit par l’hypoxie
HRE de l'anglais Hypoxia Resonse Element Hsp de l’anglais Heat Shock Proteins
MAPK de l'anglais Mitogen-activated protein kinases mmHg millimètre de mercure
NAC espèces de Candida non-albicans NaCl chlorure de sodium
NAD nicotinamide adénine dinucléotide oxydé NADH nicotinamide adénine dinucléotide réduit
NADP nicotinamide adénine dinucléotide phosphate oxydé NADPH nicotinamide adénine dinucléotide phosphate réduit PCR réaction en chaîne par polymérase
pH potentiel hydrogène
pHi potentiel hydrogène intracellulaire poly Q poly glutamine
ppO2 pression partielle en oxygène
ROS de l’anglais Reactive Oxygen Species Sap de l’anglais Secreted Aspartyl Proteases
SAPK de l’anglais Stress-Activated MAPK
SOD superoxyde dismutase
SREBP de l'anglais Sterol Regulatory Element-Binding Protein SRR de l’anglais Sugar Receptor Repressor
Thr thréonine
UTP uridine triphosphate
VIH virus de l'immunodéficience humaine XTT chlorure de triphényltétrazolium
Avant-propos
L’article du chapitre 2 est intitulé « Metabolic Reprogramming in the Opportunistic Yeast Candida albicans in Response to Hypoxia ». Il a été publié le 26 février 2020 dans le journal mSphere. Je suis première auteure de cet article. J’ai effectué les cultures de C. albicans qui ont servi à l’extraction des métabolites, les tests de croissance des mutants ainsi que les tests de croissance en présence de stress. J’ai participé aux analyses et à la rédaction du manuscrit. Faiza Tebbji et Inès Khemiri m’ont aidé pour la préparation des cultures. Adnane Sellam a supervisé le projet et a participé à l’analyse des données ainsi que la rédaction du manuscrit.
L’article du chapitre 3 est intitulé « A novel genetic circuitry governing hypoxic metabolic flexibility, commensalism and virulence in the fungal pathogen Candida albicans ». Il a été publié le 6 décembre 2019 dans le journal PLOS Pathogens. Je suis première auteure de cet article. J’ai effectué le criblage, testé la croissance dans les différentes conditions, réalisé les expériences de filamentation, de qPCR, d’adhésion et de mesure du dommage cellulaire en condition hypoxique, les mesures de l’ATP, les immunobuvardages et les infections des larves de Galleria mellonella. J’ai généré les mutants pour les interactions génétiques, testé leur phénotype et participé à la rédaction du manuscrit. Émilie Pic a testé le dommage cellulaire en condition normoxique et a participé au test d’adhésion en cultivant les cellules mammifères. Laura Markey a réalisé les tests de colonisation intestinale chez les souris, supervisée par la Dre Carol A. Kumamoto. Faiza Tebbji a testé la croissance du double mutant snf5cyr1. Adnane Sellam a réalisé les puces à ADN, les analyses bio-informatiques, a supervisé le projet et a rédigé le manuscrit.
J’ai participé à l’article intitulé « Repurposing the anthelminthic salicylanilide oxyclozanide against susceptible and clinical resistant Candida albicans strains ». Cet article a été publié le 14 mai 2018 dans le journal Medical Mycology. J’ai réalisé les tests de cytométrie en flux pour cette étude. Cet article ne sera pas discuté dans cette thèse.
J’ai participé à l’article intitulé « A phenotypic small-molecule screen identifies halogenated salicylanilides as inhibitors of fungal morphogenesis, biofilm formation and host cell invasion ». Cet article a été publié le 01 aout 2018 dans le journal Scientific Reports. J’ai participé aux tests de croissance et de filamentation, réalisé les qPCR et la cytométrie en flux. Cet article ne sera pas discuté dans cette thèse.
Introduction
Partie I. Candida albicans
Entre les années 1839 et 1844, trois scientifiques indépendants : Fredrik Berg à Stockholm, David Gruby à Paris et John Bennett à Édimbourg rapportent la présence de muguet buccal chez les enfants [1]. En 1853, Charles Phillipe Robin réalise une description précise du micro-organisme qu’il dessine et publie pour la première fois en le nommant Oidium albicans (figure 1) [2]. Après de nombreux changements de classification et d’appellation, c’est en 1923 que la scientifique Christine Marie Berkhout nomme ce micro-organisme Candida albicans. C. albicans est un micro-organisme eucaryote unicellulaire, une levure appartenant au phylum des Ascomycètes.
Figure 1 : Premières illustrations imprimées de Candida (Oidium) albicans réalisées par Charles
Les infections fongiques sont un problème de santé publique mondiale selon le CDC (Center for Disease Control and preventions). Bien que les infections fongiques puissent toucher toute la population y compris les personnes saines, les avancées majeures en santé des dernières décennies ont conduit à une augmentation du nombre d’infections fongiques, mettant en danger la vie des personnes atteintes [3]. En effet, les avancées médicales permettent d’allonger l’âge de la population mais augmentent aussi la morbidité. Ainsi, de plus en plus de personnes sont à haut risque d’infection, telles que les personnes ayant reçu une transplantation d’organe, les personnes atteintes par le cancer ou le VIH (Virus de l'Immunodéficience Humaine). Les maladies fongiques imposent un fardeau économique considérable au système de santé. À titre d’exemple, le coût des infections fongiques aux États-Unis s’élevait à 7.2 milliards de dollars pour l’année 2017 [4]. Parmi les infections fongiques, les infections provoquées par les champignons du genre Candida sont les plus répandues. Le genre Candida compte plus de 200 espèces, parmi lesquelles seulement 20 peuvent être pathogènes. 90 % des infections sont causées par six espèces: C. albicans, C. auris, C. glabrata, C. krusei, C. parapsilosis et C. tropicalis. C. albicans est l’espèce la plus fréquemment en cause, elle est responsable de la majorité des infections orales, vaginales et systémiques [5]. Mais ces dernières années, la tendance tend à s’inverser avec la propagation des espèces dites non-albicans (NAC), telles que C. glabrata. De plus, depuis 2009, l’émergence de C. auris tend également à inverser la domination de C. albicans [6]. Néanmoins, C. albicans cause chaque année 250 000 infections systémiques à travers le monde et est responsable de plus de 50 000 morts [7].
1. Les candidoses
C. albicans est une levure dite pathogène opportuniste, c’est-à-dire qu’elle réside de façon commensale dans le tractus digestif, le tractus uro-génital et sur la peau sans causer de dommages. Elle devient pathogène à la suite de modifications chez l’hôte telles qu’un affaiblissement du système immunitaire ou un changement de la flore microbienne environnante. Les infections à Candida sont appelées candidoses et il en existe deux catégories : les candidoses superficielles et les candidoses invasives.
1.1 Les candidoses superficielles
Elles comprennent les candidoses des muqueuses, les candidoses cutanées et les infections des ongles. Elles sont plus fréquentes que les candidoses profondes, bien que ces dernières reçoivent plus d’attention à cause du taux élevé de mortalité qu’elles engendrent. Néanmoins, les candidoses des muqueuses sont responsables d’une morbidité importante chez les patients hospitalisés mais également chez des sujets en bonne santé [8]. Elles sont non négligeables car bien que bénignes elles affectent la qualité de vie et le moral des personnes atteintes. Les candidoses des muqueuses touchent principalement la cavité buccale, l’oropharynx et l’œsophage et les muqueuses vulvovaginales.
1.1.1 Les candidoses des muqueuses
Les candidoses buccales ou orales sont aussi connues sous l’appellation « muguet ». Le muguet est fréquemment retrouvé chez les nourrissons (5 à 10 %) du fait de l’immaturité de leur système immunitaire. Les manifestations cliniques sont la présence de plaques blanchâtres pouvant ressembler à des résidus de lait au niveau du palais, de la langue, des gencives ou des muqueuses buccales. La prise d’antibiotiques, de corticostéroïdes, d’immunosuppresseurs sont des facteurs qui prédisposent à l’infection. Chez les patients adultes, la candidose orale peut être la résultante de facteurs locaux et/ou systémiques. Les facteurs locaux sont la présence d’appareil dentaire, de xérostomie (sècheresse de la bouche) et l’utilisation d’inhalateurs à corticostéroïdes. Les facteurs systémiques sont dus à une immunosuppression, les patients atteints par le VIH sont souvent touchés par ce type d’infection [9, 10].
Les candidoses œsophagiennes sont moins fréquentes que les candidoses buccales et sont retrouvées chez les personnes très fortement immunosupprimées telles que celles infectées par le VIH. La candidose œsophagienne est un indicateur pour les infections par le VIH puisqu’elles sont fréquemment un des premiers signes de cette infection [11]. Elle est également retrouvée chez des patients sous chimiothérapie ou ayant reçu une radiothérapie dans la zone du cou. La muqueuse de l’œsophage est ainsi épaissie et tapissée de plaques blanches qui peuvent provoquer de graves ulcérations [12].
Les candidoses vulvovaginales sont fréquentes, en effet entre 70 à 75 % des femmes présenteront au moins un épisode de candidose vulvovaginale au cours de leur vie [13]. Ce type de candidose est dû à une dérégulation tripartite entre : i) C. albicans; ii) la flore vaginale, en particulier les Lactobacilles et iii) la réponse immunitaire [14]. Les candidoses vulvovaginales sont hormono-dépendantes, elles sont moins fréquentes chez les jeunes filles et les femmes ménopausées que chez les femmes en âge de procréer [15]. Les candidoses vulvovaginales se manifestent par du prurit, une irritation, de la douleur et des pertes vaginales [16].
C. albicans peut également provoquer une infection du gland et du prépuce chez l’homme, ce qui conduit à une inflammation locale appelée balanoposthite. Elle se manifeste par une irritation causant des rougeurs, du prurit et par la présence de petits points rouges en reliefs. Les facteurs de prédisposition pour ce type d’infection sont le diabète, l’immunosuppression et la non-circoncision [17].
1.1.2 Les candidoses cutanées
Les candidoses cutanées sont caractérisées par des lésions intertrigineuses (des petits et grands plis). C. albicans peut être la cause principale des maladies de peau mais dans la majorité des cas, l’infection à C. albicans apparait secondairement à la suite d’autres maladies de peau telles que des dermatites, du psoriasis ou autres [18]. Elles se manifestent par la présence de larges plaques rouges et des petites plaques satellites, et dans certains cas par la présence de fissures. Elles sont le résultat d’une macération excessive, que ce soit pour les grands plis dû à un excès de masse grasse pour les personnes obèses par exemple ou d’un environnement chaud et humide dans les infections des petits plis (interdigitales) comme le pieds d’athlète [19]. Dans le cas des dermatites de couche chez le nouveau-né, une modification de l’environnement telle que le pH et la flore de la peau rend celle-ci plus susceptible aux infections dont les candidoses [20].
1.1.3 Les candidoses des ongles
Les infections des ongles peuvent toucher la peau autour de celui-ci (péri-unguéale) ou l’ongle lui-même, il s’agit respectivement de panaris et d’onychomycose. Un panaris est une infection souvent associée à une exposition prolongée des doigts dans l’eau et le contact
répété avec des substances irritantes, provoquant un endommagement de la cuticule et ainsi un bris de barrière naturelle conduisant à de l’inflammation [21]. Les onychomycoses provoquent une modification de la couleur, un épaississement et une déformation des ongles. La fréquence des onychomycoses augmente avec l’âge, elles sont très rares chez les enfants et beaucoup plus présentes chez les personnes âgées [22]. Le diabète et l’immunosuppression sont également des facteurs prédisposants à ce type d’infection.
1.2 Les candidoses invasives
Les candidoses invasives comprennent les infections du sang par Candida, appelées candidémies et les infections profondes des organes (le plus souvent intra-abdominales). La majorité des candidoses invasives est endogène et initiée au niveau de l’intestin. En effet, C. albicans étant un organisme commensal, il est présent dans l’intestin puis par translocation ou par fuite de la cicatrice après une opération intestinale, cette levure peut infecter le péritoine (infection profonde) et/ou coloniser le sang (candidémie). La seconde cause de candidoses invasives est exogène et fait suite à la pose d’un cathéter central. Ce dernier est très problématique car il peut servir de support pour la formation de biofilms. Les levures du biofilm peuvent se détacher et être relâchées dans la circulation sanguine provoquant ainsi une candidémie persistante. Plus rarement, C. albicans peut également causer des infections des voies urinaires et infecter les reins pour ensuite éventuellement rejoindre le sang. Quel que soit le site d’initiation de la candidémie, lorsque la levure est présente dans la circulation sanguine, elle peut ensuite coloniser les différents organes de l’être humain tels que les poumons, le foie, la rate, les reins, les os ou encore les yeux (figure 2) [7].
Les facteurs de risque des candidoses invasives sont les maladies graves avec un risque particulier pour les patients restant en unité de soins intensifs pour une longue durée, les chirurgies abdominales, les cancers du sang, les transplantations d’organes, les tumeurs, les enfants prématurés, l’usage d’antibiotiques à large spectre, la présence d’un cathéter central, la prise de glucocorticoïdes et les chimiothérapies [7].
Le nombre de candidoses invasives est corrélé aux avancées médicales et est reconnu comme une cause majeure de morbidité et de de mortalité [23]. Les taux de mortalité pour ce type d’infection sont très élevés, de l’ordre de 30 à 40 %. Les personnes atteintes de candidoses invasives souffrent également de graves problèmes médicaux sous-jacents,
rendant ainsi difficile l’évaluation de la mortalité attribuée uniquement aux candidoses [24]. Les points majeurs pour lutter contre les candidoses invasives sont la prévention, le diagnostic précoce de l’infection et la mise en place d’un traitement antifongique systémique [25].
Figure 2 : Pathogenèse des candidoses invasives.
Candida colonise l’intestin puis par translocation ou par suite d’une fuite de cicatrice après une opération peut causer des infections locales du péritoine ou rejoindre la circulation sanguine et provoquer une candidémie. La pose de cathéter vasculaire est quant à elle une cause exogène de candidémie. La candidémie peut ensuite provoquer des infections profondes secondaires aux divers organes (provenant de [7]).
Il est donc important d’avoir des outils de diagnostic des candidoses rapides et efficaces. La culture sanguine est la technique de référence pour la détection des candidoses invasives bien qu’elle soit peu rapide et avec des sensibilités de 70 % pour les candidémies et de 30 % pour les infections profondes des organes [26]. Un des outils de diagnostic disponible est la détection des antigènes manannes et β-D-glucanes qui sont des constituants de la paroi cellulaire de C. albicans, ainsi que celle des anticorps anti-manannes. Enfin, la PCR (Réaction en Chaîne par Polymérase) permet de détecter l’ADN du micro-organisme présent dans un échantillon sanguin de patient.
2. Les traitements antifongiques
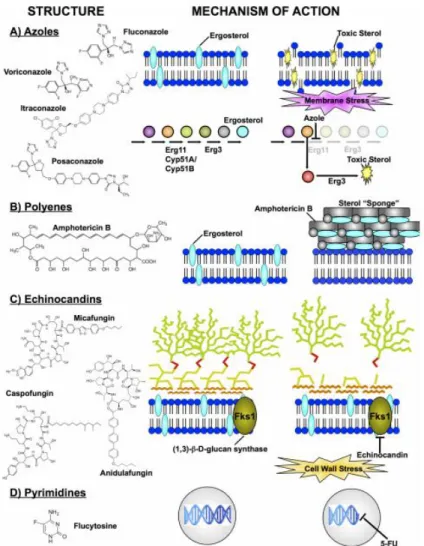
Les cellules C. albicans ainsi que les cellules humaines sont des cellules eucaryotes, ce qui limite les cibles moléculaires pouvant être exploitées pour le développement d’antifongiques. Les différences majeures entre ces deux types de cellules sont la présence d’une paroi cellulaire et d’ergostérol au niveau de la membrane plasmique de C. albicans tandis que la membrane plasmique de la cellule humaine est composée de cholestérol. Ainsi, les principales cibles des antifongiques sont la paroi et l’ergostérol. Le type d’infection (superficielle ou invasive) ainsi que sa localisation vont déterminer l’antifongique à employer [27]. Les antifongiques utilisés contre les candidoses invasives peuvent être classés en quatre groupes en fonction de leur mode d’action : les azoles, les polyènes, les échinocandines et l’analogue pyrimidique (la figure 3 résume les modes d’action de ces différents antifongiques) [28].
2.1 Les azoles
Les azoles tels que le fluconazole, l’itraconazole, le voriconazole et le posaconazole sont les antifongiques de première ligne les plus utilisés pour lutter contre les candidoses, bien qu’ils ne possèdent qu’une activité fongistatique contre C. albicans [29]. Les azoles ont pour cible la biosynthèse de l’ergostérol et plus particulièrement l’enzyme lanostérol 14-α-déméthylase Erg11. Ainsi, les azoles se fixent sur cette enzyme et inhibent son activité ce qui provoque une diminution de la production d’ergostérol et une accumulation de lanostérol, un intermédiaire de la biosynthèse de l’ergostérol. Ces intermédiaires vont alors être transformés par l’enzyme Erg3 en composés toxiques pour la cellule (figure 3A). Ces composés sont
incorporés dans la membrane à la place de l’ergostérol causant alors un stress membranaire important qui inhibe la croissance de C. albicans. Les azoles sont les antifongiques de première ligne pour lutter contre les candidoses superficielles, ils peuvent dans ce cas être administrés par voie topique ou orale. Lors de candidoses invasives, les azoles peuvent également être administré par voie intraveineuse.
2.2Les polyènes
Les polyènes, dont fait partie l’amphotéricine B, la nystatine et la natamycine, ont été les premiers antifongiques à être découverts dans les années 1950. Ce sont des composés amphiphiles qui agissent comme des éponges et permettent ainsi d’extraire l’ergostérol de la membrane plasmique (figure 3B) [30]. Cependant, à de fortes concentrations, l’amphotéricine B peut également cibler le cholestérol présent dans la membrane des cellules mammifères du fait de sa similarité de structure avec l’ergostérol. De plus, l’amphotéricine B peut être néphrotoxique ce qui peut limiter son usage. En outre, une formulation liposomale d’amphotéricine B a été développée et permet de réduire la toxicité de cet antifongique [31]. Malgré ces inconvénients, l’administration intraveineuse d’amphotéricine B est utilisée pour les infections sévères lorsque d’autres traitements ne peuvent être utilisés. La nystatine est principalement administrée par voie orale pour traiter le muguet buccal et la natamycine est appliquée par voie topique dans le cas des infections de l’œil.
2.3 Les échinocandines
Les échinocandines dont font partie la caspofongine, la micafongine et l’anidulafongine sont la dernière classe d’antifongiques à avoir été découverts. Ces composés ont pour cible la paroi cellulaire fongique, ils agissent comme des inhibiteurs non compétitifs de la (1,3)-β-glucane synthase (figure 3C) [32]. Cette enzyme est responsable de la synthèse du (1,3)-β-glucane qui est un polysaccharide essentiel de la paroi. Ce manque de glucane provoque une perte de l’intégrité de la paroi cellulaire conduisant à une instabilité osmotique et une lyse cellulaire. Les échinocandines sont exclusivement administrées par voie intraveineuse pour lutter contre les candidoses invasives.
2.4 L’analogue pyrimidique
La flucytosine (5-FC) est un analogue fluoré de la base pyrimidique cytosine qui a été utilisé pour traiter les candidoses pour la première fois en 1968. Dans le cytosol, la flucytosine est désaminée par la cytosine désaminase fongique pour donner le 5-fluorouracile (5-FU) qui agit comme un antimétabolite inhibant ainsi la synthèse de l’ADN et de l’ARN (figure 3D) [33]. Cependant, cet antifongique provoque l’apparition rapide de résistances, il est par conséquent utilisé seulement en association avec d’autres antifongiques tels que les polyènes. L’administration de flucytosine se fait par voie orale sous forme de comprimés ou par voie intraveineuse.
Figure 3 : Mécanismes d’action des quatre classes d’antifongiques pour lesquels les antifongiques
les plus courants sont représentés.
(A) La classe des azoles représentée par le fluconazole, le voriconazole, l’itraconazole et le posaconazole. Les azoles ont pour cible l’enzyme Erg11, qui est impliquée dans la biosynthèse de l’ergostérol. (B) La classe des polyènes dont fait partie l’amphotéricine B, forment des agrégats
extra-membranaires qui extraient l’ergostérol de la membrane tels des éponges. (C) La classe des échinochandines représentée par la micafongine, la caspofongine et l’anidulafongine. Ces antifongiques inhibent une enzyme importante pour l’intégrité de la paroi, la (1,3)-β-glucane synthase. (D) La classe des pyrimidines dont fait partie la flucytosine, celle-ci est transformée en 5-fluorouracile par la cellule fongique qui perturbe la synthèse de l’ADN et de l’ARN (provenant de [28]).
2.5 Les résistances aux antifongiques
L’évolution de la résistance aux traitements est un phénomène ubiquitaire dès lors qu’un micro-organisme s’adapte pour survivre à son nouvel environnement [34]. Tout comme la résistance aux antibiotiques est problématique pour lutter contre les bactéries, la résistance aux antifongiques est également un problème de santé publique mondial. La résistance peut être acquise à la suite de l’exposition à l’antifongique mais elle peut également être naturelle, c’est le cas pour les cellules des biofilms qui sont naturellement moins sensibles aux antifongiques que les cellules planctoniques. La croissance de C. albicans sous forme de biofilm sera développée dans la section des facteurs de virulence. Les mécanismes de résistance acquis sont la modification de la cible (diminution ou augmentation), la surexpression de pompes à efflux ainsi que l’activation des voies de signalisation de la réponse aux stress.
L'émergence de la résistance aux antifongiques est généralement associée à l’utilisation d’antifongiques de manière répétée chez les individus présentant une infection persistante ainsi que l’utilisation prophylactique d’un antifongique [35]. La fréquence d’apparition d’une résistance acquise est dépendante de l’antifongique utilisé. En effet, un médicament peut provoquer une pression sélective en faveur des champignons moins sensibles à ce médicament [36]. C’est le cas du fluconazole, sa nature fongistatique permet l’apparition de résistances. Une gestion adéquate de la candidose avec l’utilisation de l’antifongique le plus adapté au patient est donc cruciale pour prévenir la résistance. De plus, pour toutes les classes d’antifongiques des cas de résistances sont observés et même dans certains cas des résistances multiples, ce qui justifie l’urgence de trouver de nouveaux traitements ayant de nouvelles cibles thérapeutiques fongiques [37].
2.6 Vers de « nouveaux » antifongiques
Le développement de nouveaux traitements est un processus couteux et relativement lent. Pour contrer ces difficultés, une nouvelle stratégie dite de « repositionnement » ou repurposing en anglais, consiste en une nouvelle utilisation de médicaments déjà approuvés pour des applications qui ne relèvent pas de l’indication médicale initiale. Cette stratégie s’applique à tous les domaines de la santé, par exemple un antiépileptique utilisé pour les traitements anti-cancéreux ou bien encore un médicament pour le traitement de l’ostéoporose utilisé pour lutter contre l’obésité. Le kétoconazole par exemple, un antifongique de la classe des azoles, a été autorisé en 2014 par l’Union Européenne pour le traitement du syndrome de Cushing (taux anormalement élevé de cortisol) en tant qu’inhibiteur de la synthèse du cortisol [38].
Face à l’augmentation des résistances microbiennes, il est urgent de trouver de nouveaux traitements, et le repositionnement s’applique également au domaine de la microbiologie afin de trouver de nouveaux agents antimicrobiens. À titre d’exemple, le torémifène qui est un médicament anti-cancéreux pourrait être utilisé pour lutter contre C. albicans. En association avec la caspofongine, il permet de réduire la formation de biofilms et améliore la survie d’environ 30 % dans un modèle d’infection de C. albicans [39]. Plusieurs autres composés ont donné des données prometteuses mais les efforts de développement restent encore au stade préclinique [40].
3. Les traits de virulence
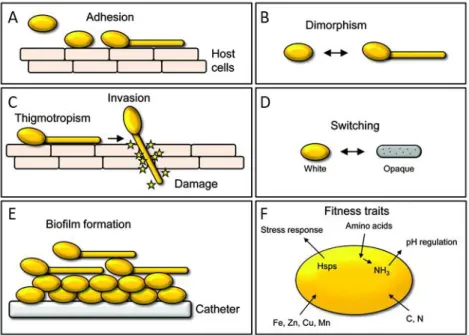
C. albicans est une levure commensale qui peut coloniser l’être humain sans lui causer de dommage. Cependant, ce champignon possède une grande capacité d’adaptation et peut devenir pathogène lorsque les conditions lui sont favorables. Cette transition est permise grâce à l’activation de différents traits de virulence, les plus importants sont l’adhésion sur les cellules de l’hôte, son polymorphisme et son aptitude à former des biofilms. La grande capacité d’adaptation de C. albicans aux différents stimuli environnementaux lui confère une flexibilité lui permettant de proliférer dans des conditions hostiles. En anglais le terme fitness est utilisé pour définir la capacité de l’organisme étudié à survivre et à se reproduire. Cette flexibilité ou fitness concerne l’adaptation aux perturbations extérieures telles que des
modifications du pH, de la teneur en nutriments et également de l’oxygène disponible. Les différents traits de virulence sont résumés dans la figure 4 [41].
Figure 4 : Schéma représentant les différents traits de virulence chez C. albicans.
(A) Les levures adhèrent aux cellules de l’hôte grâce à l’expression d’adhésines. (B) En réponse à divers stimuli les levures changent de morphologie, la transition levure-filament est un facteur de virulence important chez C. albicans, de même que le passage de la forme white à opaque (D). (C) La croissance des hyphes est dirigée grâce au thigmotropisme, à la suite du contact avec les cellules de l’hôte. (E) Le biofilm créé un environnement particulier aux levures qui leur confère de la résistance à divers stress et en particulier aux antifongiques. (F) Enfin, le fitness fongique permet l’adaptation rapide à des conditions suboptimales de croissance (provenant de [41]).
3.1 Polymorphisme
C. albicans est une levure qui a la particularité de présenter différents morphotypes (figure 5), cette plasticité phénotypique lui permet de s’adapter aux changements environnementaux, de survivre et de croître dans des conditions parfois hostiles [42]. Des modifications de l’environnement telles que la disponibilité en nutriments, la température et le pH vont induire un changement phénotypique. La capacité de cette levure pathogène opportuniste de passer d’un morphotype à un autre est importante pour le commensalisme et est également étroitement liée à la virulence.
Les principaux changements morphologiques sont la transition levures-filaments, la transition white-gray-opaque, les chlamydospores et la forme GUT (Gastrointestinally indUced Transition).
Figure 5 : Représentation des différents morphotypes de C. albicans.
La partie bleue représente les formes végétatives et la partie rose les formes associées au mating et au changement de ploïdie (provenant de [42]).
Récemment décrite en 2013, la forme GUT correspond à un phénotype observé lorsque les levures colonisent de façon commensale l’intestin pendant une longue période. Cette forme semble donc être le morphotype spécialisé pour le commensalisme du tractus gastrointestinal des mammifères. Les cellules GUT sont allongées, de façon semblable aux cellules opaques et de la même façon forment des colonies plates et grisâtres [43].
3.1.1 La transition levures-filaments
La forme dite levure est la plus connue, toutefois grâce à son polymorphisme, C. albicans peut également se développer sous la forme de pseudo-hyphes ou hyphes aussi appelés filaments (figure 6) [44]. Lorsque les cellules ont la forme dite levure, elles sont ovoïdes et unicellulaires. Les pseudo-hyphes forment une chaîne de cellules allongées, ils
possèdent des constrictions au niveau des septa et sont plus larges que les hyphes. En revanche, les hyphes forment de longs filaments qui ne présentent pas de constriction au niveau des sites de septation.
Figure 6 : Polymorphisme chez C. albicans.
(A) La forme levure unicellulaire est représentée, (B) et (C) représentent respectivement des pseudo-hyphes et hyphes. La barre d’échelle représente 5 μm (adapté de [44]).
Les facteurs environnementaux tels qu’un pH supérieur à 7, une carence nutritive, la présence de sérum ou de N-acétylglucosamine, une température de 37 °C, une teneur élevée en CO2 (≥5 %) et une faible quantité en oxygène favorisent la transition levures-filaments. Le quorum sensing, un mécanisme qui permet à la cellule d’estimer et de répondre à la densité cellulaire environnante, joue également un rôle de régulation dans le polymorphisme. Une forte concentration cellulaire va promouvoir la forme levure, tandis qu’une faible densité cellulaire favorise la formation d’hyphes.
Les hyphes sont intrinsèquement invasifs, l’extrémité de l’hyphe est capable de thigmotropisme, c’est-à-dire qu’elle est capable de percevoir et suivre les sillons ou trous dans la surface, lui permettant ainsi une croissance dirigée dans le substrat solide ou les muqueuses. Bien que la forme hyphe permette l’invasion des cellules de l’hôte, la forme levure, plus petite par sa taille, est impliquée dans la dissémination. Les différentes formes sont donc importantes pour la pathogenèse. Les études d’infections systémiques chez les souris ont permis de démontrer que la capacité de pouvoir alterner entre les formes levures-filaments est déterminante pour la virulence [45].
3.1.2 La transition white-gray-opaque
Cette transition est un second changement phénotypique observé chez C. albicans. Les cellules dites white correspondent à la forme ovale classique de C. albicans, elles forment des colonies bombées et de couleur crémeuse. Les cellules dites opaques quant à elles, sont plus allongées et d’aspect rugueux. Les colonies formées par les cellules opaques sont plus plates et grisâtres par rapport aux colonies des levures white. Découverte plus récemment en 2014, la forme gray est décrite comme une nouvelle possibilité de morphologie, formant ainsi le triangle de transitions morphologiques white-gray-opaque [46]. La forme gray est une forme à part entière, qui ne doit pas être considérée comme un intermédiaire entre les formes white-opaque. Les cellules gray sont de forme allongée mais plus petites que les cellules opaques et elles forment des colonies lisses et grisâtres (figure 5).
Tout comme la transition levure-filament, la transition white-gray-opaque est régulée par les facteurs environnementaux. La présence de N-acétylglucosamine, d’une forte teneur en CO2 (≥5 %)et d’un pH acide favorisent la forme opaque tandis que de faibles teneurs en CO2 (<5 %), un pH alcalin, une température de 37 °C et une forte concentration en glucose favorisent la forme white [47]. En présence de glucose et d’une température de 37 °C, la forme gray va alors être favorisée.
Un autre changement morphologique est la formation de chlamydospores (figure 5). Ce sont de larges cellules sphériques, possédant une paroi épaisse, qui sont retrouvées aux extrémités distales des hyphes. Les chlamydospores ont été observées in vitro dans des conditions de carence nutritive et d’hypoxie [48].
3.2 Adhésion, invasion et dommage cellulaire
Lors de la pathogenèse, les trois étapes clés sont l’adhésion, l’invasion et le fait de causer du dommage cellulaire [49].
3.2.1 Les adhésines
Une des caractéristiques des pathogènes fongiques dont fait partie C. albicans est leur capacité d’adhésion sur des surfaces abiotiques (cathéters, prothèses…) et des surfaces
biotiques telles que les cellules de l’hôte. En tant que levure commensale, l’adhésion de C. albicans sur les surfaces biotiques joue un rôle prédominant afin de permettre la persistance de la colonisation de l’hôte. L’adhésion est également primordiale lors de la pathogenèse car elle est considérée comme la première étape lors d’une infection fongique [50].
Les adhésines sont des glycoprotéines retrouvées au niveau de la paroi cellulaire, elles sont ancrées par un groupement GPI (GlycosylPhosphatidylInositol) à la membrane plasmique. Les adhésines comprennent la famille des Als (Agglutinin‐Like Sequence) et Hwp1 (Hyphal Wall Protein 1).
Les Als permettent l’attachement de C. albicans aux différents substrats de l’hôte. Les plus étudiées sont Als1 et Als3, elles permettent l’adhésion de C. albicans aux cellules endothéliales et épithéliales. L’expression d’Als1 est dépendante de la composition du milieu [51] tandis que celle d’Als3 est spécifique de la forme pseudo-hyphes et hyphes et n’est pas retrouvée chez la forme levure [52]. Le rôle de l’Als3 ne se limite pas à l’adhésion, elle permet également l’invasion par le processus d’endocytose et permet aussi à C. albicans de se fixer sur la ferritine de l’hôte lui permettant ainsi d’utiliser cette protéine comme source de fer [53].
La protéine Hwp1 sert de substrat aux transglutaminases de l’hôte, permettant ainsi de lier de façon covalente C. albicans aux cellules épithéliales. Cette glycoprotéine est retrouvée uniquement lorsque C. albicans forme des pseudo-hyphes et hyphes.
3.2.2 Les enzymes hydrolytiques
Lors de la pathogenèse, l’adhésion de C. albicans est suivie par la sécrétion d’enzymes hydrolytiques permettant la pénétration des cellules de l’hôte. Ces hydrolases sont divisées en trois classes : les Saps (Secreted Aspartyl Proteases), les phospholipases et les lipases. Les Saps sont importantes pour envahir l’épithélium. Par exemple Sap5 dégrade les E-cadhérines (qui permettent la liaison intercellulaire des cellules de l’hôte) et conduit ainsi à une perte de l’intégrité de l’épithélium, facilitant l’invasion de C. albicans. Les phospholipases et les lipases ont pour but de participer à l’hydrolyse des lipides des cellules de l’hôte, afin de faciliter l’invasion des tissus [54].
Récemment décrite en 2016, la candidalysine est une toxine peptidique cytolytique, il s’agit de la seule toxine connue à ce jour qui est produite par C. albicans [55]. Cette toxine est sécrétée par la forme filamenteuse de cette levure. Elle est incriminée dans les infections superficielles et systémiques en perméabilisant les membranes des cellules épithéliales et endothéliales de l’hôte [56]. Mais le rôle de ce peptide ne se limite pas à la pathogenèse, il aurait également un rôle dans la réponse inflammatoire et le commensalisme [57].
3.3 Les biofilms
La capacité de C. albicans à former des biofilms est un autre trait de virulence important, car ces derniers sont plus résistants aux antifongiques et aux facteurs immunitaires par rapport à des cellules planctoniques. Les étapes de formation d’un biofilm mature sont : l’adhésion à un substrat biotique ou abiotique, la prolifération des levures, la formation de pseudo-hyphes et hyphes, la formation d’une matrice extracellulaire et enfin le détachement de certaines levures du biofilm permettant ainsi la colonisation de nouveaux sites [58]. Le biofilm joue alors un rôle de réservoir pour C. albicans et permet la dissémination des levures dans le sang lorsque des levures se détachent du biofilm.
En clinique, les biofilms de C. albicans sont retrouvés principalement au niveau des prothèses dentaires et sur les cathéters intravasculaires. Les biofilms sont un problème majeur du fait de leur résistance aux antifongiques. En effet, la matrice extracellulaire composée de protéines (55 %), de polysaccharides (25 %), de lipides (15 %) et d’acides nucléiques (5 %) joue un rôle protecteur pour les levures dans le biofilm. Elle apporte une stabilité mécanique au biofilm, elle protège les cellules des dommages physiques, elle peut servir de source de nutriments, elle est également une barrière contre la reconnaissance par le système immunitaire et enfin elle permet de préserver les levures du biofilm des agents chimiques [59]. La surexpression des pompes à efflux qui favorisent l’exportation des antifongiques en dehors de la cellule, ne permettant pas à la molécule d’atteindre sa cible, réduit la sensibilité des levures du biofilm aux antifongiques. Enfin, une particularité d’un biofilm est qu’il contient un variant phénotypique qui lui est propre : les cellules persistantes. Ce sont des cellules métaboliquement en dormance et très résistantes aux agents antimicrobiens [60].
Finalement, il est important de mentionner qu’in vivo, les biofilms sont souvent constitués de plusieurs espèces microbiennes. C. albicans est retrouvé dans des biofilms mixtes avec d’autres espèces du genre Candida telles que C. dubliniensis, C. tropicalis, C. parapsilosis, C. guillermondii, C. krusei, et C. glabrata [61]. C. albicans a également la capacité de former des biofilms avec différentes espèces bactériennes telles que Streptococcus mutans sur les prothèses dentaires ainsi qu’avec Pseudomonas aeruginosa au niveau des poumons des personnes atteintes de fibrose kystique. De plus, les biofilms formés par C. albicans créent un microenvironnement hypoxique qui permet le développement des bactéries anaérobies strictes telles que Bacteroides fragilis et Clostridium perfringens [62].
4. Le fitness fongique
Le terme anglais fitness désigne la capacité d’un organisme à croitre lorsque les conditions sont hostiles, ceci grâce à une perception et une adaptation efficace face aux changements environnementaux. C. albicans colonise et infecte différentes niches au sein de l’hôte où les conditions environnementales sont variables entre les niches mais également dynamiques au sein d’une même niche. Les principaux facteurs variables au sein de l’hôte sont le pH, les nutriments, l’oxygène, les minéraux tels que le fer, le zinc et le cuivre. La réponse aux stress tels que le stress osmotique et le stress oxydatif fait également partie du fitness fongique. C. albicans est un pathogène opportuniste robuste capable de s’adapter et de proliférer dans une très large gamme de conditions environnementales. Le fitness est par conséquent important pour le commensalisme et la virulence.
4.1 Le pH
Au sein de l’être humain, le pH est un facteur très variable, il est plutôt neutre pour le sang (7.4), acide pour le vagin (~ 4) et varie de 2 à 8 pour le tractus digestif. C. albicans peut se développer à des pH variant de pH 2 à pH 10, ce qui nécessite une perception et une adaptation efficace de ce champignon pour survivre et se développer [63]. Le pH environnemental a un impact sur les cellules, en effet, les protéines ont un pH optimal pour leur activité, ainsi, un pH inférieur ou supérieur à ce pH optimal peut conduire à des protéines non fonctionnelles. Les protéines sécrétées et celles exposées à la surface du
micro-organisme sont particulièrement sujettes aux variations de pH. C. albicans perçoit et s’adapte au pH environnant et régule l’expression des gènes codant pour les protéines exposées.
Chez C. albicans, la perception et l’adaptation au pH est régi par la voie de transduction du signal Rim101. Le pH environnemental est perçu par deux récepteurs membranaires Dfg16 et Rim21. Lorsque le pH est alcalin, la protéine Rim8, associée à Rim21 est ubiquitinylée, provoquant le recrutement de la protéase Rim13 au niveau du domaine inhibiteur C-terminal de Rim101. Ce domaine inhibiteur est ensuite clivé, conduisant à la forme active du facteur de transcription Rim101, qui va ensuite migrer au noyau pour activer la réponse transcriptionnelle associée à un pH alcalin [64].
Le facteur de transcription Rim101 est un régulateur du morphotype de C. albicans, un pH acide favorise la transition white-opaque [65], tandis qu’un pH basique favorise la transition levure-filament [66].
C. albicans perçoit et s’adapte au pH environnemental, et de façon plus surprenante, cette levure à la capacité de modifier le pH environnant. C. albicans peut augmenter le pH de 4 à 7 grâce à un processus d’alcalinisation via l’ammoniac [67]. Ce processus a lieu lorsque l’environnement est pauvre en glucose et riche en acides aminés, une condition retrouvée dans les cellules phagocytaires. Cette augmentation de pH est alors corrélée à la filamentation, un trait de virulence important de cette levure.
4.2 Les métaux
La présence de métaux est essentielle pour tous les organismes vivants, bien que les quantités requises soient faibles. Les métaux les plus importants sont le fer, le zinc, le cuivre, le manganèse et sont nécessaires au fonctionnement des métalloprotéines telles que certains facteurs de transcription et des enzymes [68]. Cependant, à de fortes concentrations ils peuvent être toxiques pour les cellules, une régulation de leurs teneurs cellulaires est donc primordiale.
L’homéostasie cellulaire du fer est la plus étudiée chez C. albicans néanmoins, les autres métaux sont tout aussi importants. La solubilité d’éléments essentiels tels que les ions est dépendante du pH, ainsi la transition du fer de la forme Fe2+ (soluble) à Fe3+ (insoluble) dépend du pH. Au sein de l’être humain, presque tout le fer est séquestré par des protéines
(hémoglobine, ferritine, transferrine). Contrairement au champignon pathogène de l’être humain Aspergillus fumigatus, qui dépend uniquement des sidérophores, peptides sécrétés chélatant le fer, C. albicans peut utiliser différentes sources de fer [69]. En effet, C. albicans possède plusieurs perméases au fer, il peut également tirer profit du fer contenu dans l’hémoglobine, la ferritine et la transferrine [70]. C. albicans exploite aussi les sidérophores produits par d’autres micro-organismes [71].
4.3 La réponse aux stress
4.3.1 Le stress oxydatif
Durant l’infection, C. albicans rencontre des cellules immunitaires qui exercent en partie leur activité antimicrobienne en produisant des espèces réactives de l'oxygène (ROS) [72]. Pour faire face au stress oxydatif, cette levure possède différents mécanismes de défense. Dans la levure, les ROS sont transformés en peroxyde d’hydrogène (H2O2) par les superoxydes dismutases (Sods) puis en eau (H2O) par la catalase.
En présence d’H2O2 le facteur de transcription Cap1 subit une oxydation de ses résidus cystéines et s’accumule dans le noyau. Cap1 permet ensuite l’expression de nombreux gènes impliqués dans la réponse au stress oxydatif tels que la catalase (CAT1), la glutathion réductase (GLR1), la thiorédoxine (TRX1) ainsi que la superoxyde dismutase (SOD1) afin de neutraliser les ROS [73].
Lorsque les teneurs en ROS sont très élevées, la voie Hog1 SAPK (Stress-Activated MAPK) participe également dans la réponse au stress oxydatif [74]. En effet, le facteur de transcription Hog1 est hyperphosphorylé en présence d’H2O2 et le mutant hog1 est plus sensible à ce stress.
4.3.2 Le stress osmotique
Le stress osmotique est également un stress auquel C. albicans fait face au sein de l’hôte en particulier dans le tractus digestif. Lorsque l’environnement est hyperosmotique, le facteur de transcription Hog1 est phosphorylé par la voie des MAPK (Mitogen-Activated Protein Kinase). Hog1 permet ensuite l’activation de la transcription des gènes de la biosynthèse du glycérol RHR2 et GPD2 [75]. Hog1 active aussi l’expression du gène STL1
codant pour un transporteur à glycérol [76]. Ainsi l’activation de Hog1 par sa phosphorylation conduit à une accumulation du glycérol intracellulaire afin de contrecarrer une déshydratation due au stress osmotique [77].
4.3.3 Le stress thermique
Le stress thermique peut provoquer une augmentation du nombre de protéines mal repliées et engendrer des agrégations non spécifiques entre les protéines pouvant conduire à la mort cellulaire. Pour faire face à cela, lors d’un stress thermique il y a une augmentation de l’expression des Heat Shock Proteins (Hsps) qui jouent un rôle clé pour le repliement correct des protéines. Lors d’une fièvre, la température corporelle de l’hôte augmente, cette augmentation thermique provoque une modification de la fluidité membranaire. Ceci conduit à une hyperphosphorylation du facteur de transcription Hsf1 qui va activer la transcription des gènes de la réponse au stress thermique dont HSP107, HSP70 et HSP90 codant pour des protéines chaperons. Hsf1 régule également l’expression de gènes impliqués dans divers processus tels que la réponse au stress oxydatif (TRX1, TSA1, GPX3), l’adhésion (ALS1, ALS3, ALS4) et la filamentation (ACE2) [78, 79].
La capacité de perception et d’adaptation de C. albicans à divers stimuli est tout aussi importante pour son mode de vie en tant que micro-organisme commensal que pathogène. À ce titre, les mutants de gènes impliqués dans diverses voies de signalisation se sont avérés avoir un défaut de colonisation commensale et sont avirulents dans un modèle d’infection de C. albicans [80]. Ces différentes voies de signalisation sont donc indispensables pour une réponse efficace face aux changements environnementaux qui peuvent survenir brutalement. Bien qu’elles aient été décrites de façon distincte, de plus en plus d’études mettent en évidence des connexions complexes entre ces différentes voies, qu’il faut alors plutôt voir comme un réseau de signalisation en réponse aux modifications environnementales. À titre d’exemple, Hog1 est impliqué dans la réponse au stress osmotique, oxydatif, au fer et dans la réponse aux métaux lourds [75, 81]. De façon non dépendante de la température, le régulateur de la réponse à la température, Hsf1, est également impliqué dans la réponse au fer [82].
5. La régulation commensal/pathogène
Le microbiote humain comporte différentes communautés de bactéries, champignons, archées et virus. Ce microbiote peut être subdivisé en fonction de la localisation au sein de l’hôte, on parle alors de microbiote cutané, vaginal, buccal, pulmonaire et le plus étudié le microbiote intestinal. Bien que le règne bactérien soit majoritaire en abondance et diversité, les autres règnes ne sont pas moins importants et les interactions entre les différents règnes sont responsables d’un microbiote équilibré [83]. Ces micro-organismes doivent pouvoir persister et se développer malgré la pression causée par la présence des autres micro-organismes (compétition pour les nutriments, modification du pH…) mais également par la pression du système immunitaire. C. albicans est le champignon le plus présent dans le microbiote intestinal, sa croissance comme commensal et également comme pathogène est influencée par la flore environnante. En effet, la prise d’antibiotiques peut permettre à ce champignon de surproliférer [84].
C. albicans a très longtemps été étudié en tant que pathogène, bien que les études sur le portage comme micro-organisme commensal soient récentes, les études de colonisation intestinale dans des modèles murins sont en train de permettre de mieux comprendre comment C. albicans colonise de façon commensale le tractus digestif. Un aspect qui semble important est la morphologie de ce champignon. Comme évoqué précédemment, C. albicans possède différents morphotypes, qui diffèrent par leur morphologie, mais également par leur profil transcriptomique, métabolique, ainsi que la présence de certaines protéines de surface. Des études ont démontré que dans l’intestin des mammifères, la forme levure semble être la forme majoritaire, de l’ordre de 90 % [85, 86], les formes pseudo-hyphes et hyphes sont également présentes mais en moindre proportion. Une étude a également mis en évidence la présence d’un morphotype particulièrement adapté au tractus digestif, la forme GUT [43]. Les régulateurs transcriptionnels permettant à C. albicans de favoriser la forme levure et ainsi réprimer la filamentation sont donc mieux adaptés à la colonisation commensale. La délétion du gène TUP1, qui bloque les cellules sous la forme filamenteuse, ne permet pas à C. albicans de coloniser le tractus digestif des souris [87]. Ces études menées avec différentes approches confirment que la forme levure est la morphologie permettant une colonisation commensale de C. albicans dans l’intestin.
Cependant, une récente étude nuance les précédentes et apporte d’autres connaissances à ce sujet [88]. Grâce à la technique de l’hybridation fluorescente in situ (FISH), il a été mis en évidence que dans un modèle murin, la forme levure est majoritaire au niveau de l’estomac (60 %) et de l’intestin grêle (80 %), tandis qu’une majorité d’hyphes (60 %) est retrouvée au niveau du colon. Plus que la morphologie, le commensalisme semble être contrôlé par le niveau d’expression de marqueurs spécifiques de la forme filamenteuse tels que la protéase Sap6 et l’adhésine Hyr1. Leur expression transcriptionnelle étant sous le contrôle du régulateur de la transition levure-filament Ume6.
Les bactéries présentent peuvent également moduler la morphologie de cette levure en secrétant des molécules, par exemple la bactérie Enterococcus faecalis secrète une bactériocine qui inhibe la filamentation de C. albicans sans altérer sa croissance [89].
Partie II. La flexibilité métabolique
La flexibilité métabolique décrit la capacité d’un organisme à répondre et à s’adapter en fonction des changements de la demande métabolique et des apports disponibles.
Chez l’être humain, l’alternance entre des phases de jeûne entre les repas, le cycle circadien, et l’activité physique vont influencer la flexibilité métabolique. Dans un contexte d’organismes multicellulaires aussi complexes, la réponse est tissu spécifique, mais doit être vue globalement, le terme adaptabilité physiologique est alors employé [90]. L’organisme a la possibilité d’alterner entre oxydation glucidique et lipidique, cela est régi par les hormones pancréatiques. Mais dans le cas d’un organisme unicellulaire qui dépend uniquement des apports nutritifs disponibles dans l’environnement, comment cette réponse est-elle régulée ? Cette partie traitera de la flexibilité métabolique chez la levure Saccharomyces cerevisiae qui est l’organisme modèle pour les organismes eucaryotes puis chez C. albicans.
1. Flexibilité métabolique de la levure modèle S. cerevisiae
S. cerevisiae est une levure ubiquitaire retrouvée dans l’environnement. Grâce à sa capacité de fermentation, elle a été largement utilisée pour la fermentation des boissons ainsi que des aliments depuis des millénaires. Les premières traces de son utilisation pour la fermentation datent d’environ 9000 ans [91]. Toutefois, bien qu’elle soit présente sur les
fruits, le dogme selon lequel la niche écologique de S. cerevisiae serait les fruits est remis en question. Il semblerait qu’il s’agisse plutôt d’une levure nomade capable de survivre dans des environnements divers [92]. Bien que l’on ne puisse pas utiliser le terme niche écologique, S. cerevisiae est retrouvée préférentiellement dans des environnements riches en sucres. Cette levure peut utiliser différentes sources de carbones telles que le sucrose, le maltose, le glycérol, l’éthanol, cependant le glucose est sa source de carbone de préférence. Ainsi, la présence de glucose réprime les voies d’utilisation des sources de carbone alternatives, il s’agit de la répression par le glucose. S. cerevisiae est une levure dite Crabtree positive, c’est-à-dire qu’elle produit de l’ATP par la fermentation même en présence d’oxygène lorsque la teneur en glucose est élevée. Ceci est également contrôlé par la répression par le glucose.
1.1 Perception et signalisation du glucose
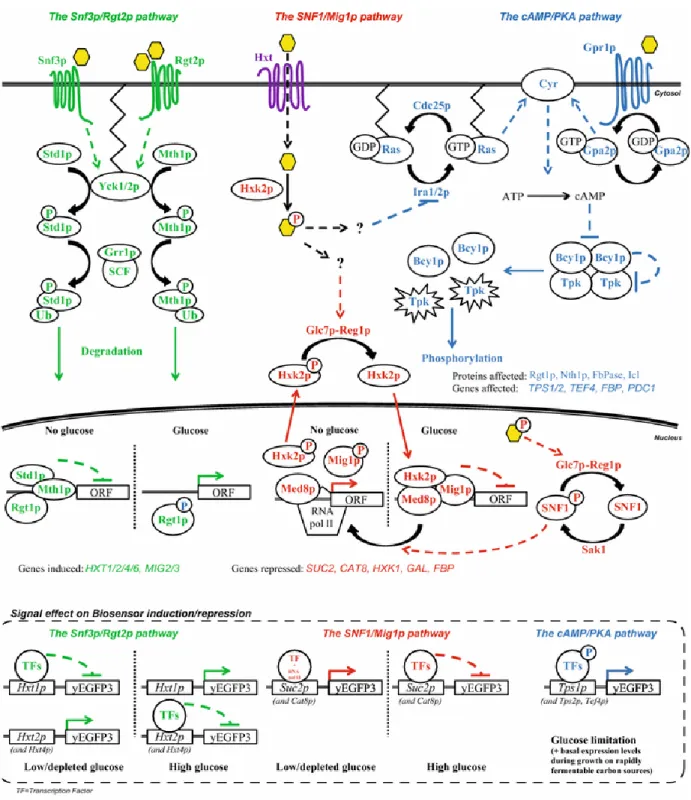
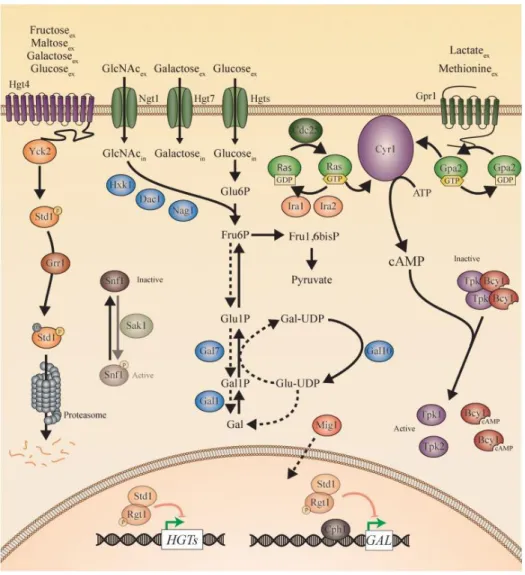
Trois voies de signalisation gouvernent la perception des sucres et la réponse métabolique : la voie Snf3/Rgt2, la voie Snf1/Mig1 et la voie de l’AMPc/PKA (figure 7) [93].
Voie Snf3/Rgt2 ou voie SRR (Sugar Receptor-Repressor). La levure S. cerevisiae perçoit le glucose grâce à deux senseurs transmembranaires Snf3 et Rtg2. Ces récepteurs vont ensuite activer les kinases Yck1 et Yck2, qui vont phosphoryler les protéines Mth1 et Std1. La phosphorylation de ces protéines est un signal de dégradation par le système protéasome. La dégradation de Mth1 et Std1, provoque l’hyperphosphorylation du facteur de transcription Rgt1 par les protéines kinases. L’hyperphosphorylation de Rgt1 provoque sa perte de liaison à l’ADN, il ne peut ainsi plus réprimer les gènes codant pour les transporteurs d’hexose HXT1-17 qui sont alors transcrits.
Figure 7 : Représentation des voies de signalisation gouvernant la réponse aux sucres chez la levure
S. cerevisiae.
Les trois voies majeures gouvernant la perception et la signalisation en réponse aux sucres sont représentées. La voie Snf3/Rgt2 ou voie SRR (Sugar Receptor Repressor) est représentée en vert, la voie Snf1/Mig1 appelée voie de répression par le glucose est en rouge et la voie de l’AMPc est en bleu (provenant de [93]).
Voie Snf1/Mig1 (Glucose Repression Pathway). La disponibilité en glucose régule l’activité de l’AMPK (Snf1) qui est un régulateur central de la répression par le glucose. En présence de grande quantité de glucose, Snf1 est inactif et reste dans le cytoplasme. Les gènes impliqués dans le métabolisme alternatif pour l’utilisation d’autres sources de carbone que le glucose sont alors maintenus réprimés par Mig1. En présence de glucose, l’action répressive de Mig1 est également maintenue grâce à l’hexokinase Hxk2 qui permet la première étape de phosphorylation de la glycolyse en générant du glucose-6-phosphate. En interagissant avec Mig1, Hxk2 cache le résidu de Mig1 phosphorylable par Snf1, permettant ainsi la formation du complexe répresseur Hxk2/Mig1 [94].
Voie de l’AMPc. Le glucose est perçu par Gpr1, un récepteur transmembranaire couplé aux protéines G, ce qui permet l’activation de l’adénylate cyclase Cyr1 qui va alors produire de l’AMPc [95]. Il est également possible pour la cellule d’activer Cyr1 par l’activation préalable de Ras par le fructose-1,6-bisphosphate (intermédiaire de la glycolyse) [96]. L’augmentation de la concentration cytoplasmique d’AMPc active les protéines kinases A (PKA) : Tpk1, Tpk2 et Tpk3 en les dissociant de la sous-unité régulatrice Bcy1. Ces PKA vont alors phosphoryler diverses protéines impliquées dans le métabolisme et la moduler la transcription des gènes cibles (répression de la néoglucogenèse, activation de la glycolyse) [97].
Dans la cellule, le glucose est oxydé par la glycolyse qui a lieu au niveau du cytoplasme, puis par la respiration, c’est-à-dire par le cycle de Krebs suivi de la phosphorylation oxydative au sein des mitochondries lorsque la teneur en oxygène est élevée. Lorsque la teneur en oxygène se réduit, le pyruvate produit par la glycolyse est transformé en éthanol par la fermentation. Cependant, S. cerevisiae est une levure dite Crabtree positive, lorsque le glucose est présent en concentrations élevées il est oxydé par la voie de la glycolyse suivi par la fermentation alcoolique, au niveau cytoplasmique. [98]
1.2 Déplétion en glucose et utilisation de sources de carbones alternatives
Lorsque le glucose s’épuise dans l’environnement, la levure active les voies permettant l’utilisation de sources de carbones alternatives. La kinase Snf1 joue un rôle central afin de permettre ce changement métabolique [99]. Par l’effet Crabtree, la déplétion