HAL Id: tel-01374738
https://tel.archives-ouvertes.fr/tel-01374738
Submitted on 24 Nov 2016HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
de biohydrogène
Nicolas Fontaine
To cite this version:
Nicolas Fontaine. Modélisation de système synthétique pour la production de biohydrogène. Bio-Informatique, Biologie Systémique [q-bio.QM]. Université de la Réunion, 2015. Français. �NNT : 2015LARE0016�. �tel-01374738�
pour l'obtention du Doctorat en Sciences
spécialité Biologie Informatique
par
Nicolas Fontaine
Modélisation de système synthétique pour la production
de biohydrogène
Rapporteurs :
Christine Sinoquet Maître de Conférences HDR, Université de Nantes Jean-Loup Faulon Directeur de Recherche, Université d'Evry Val d'Essone
Examinateurs :
Frédéric Cadet Professeur, Université de la Réunion
Directeurs de thèse :
Brigitte Grondin-Pérez Professeur, Université de la Réunion Directeur Bernard Offmann Professeur, Université de Nantes Co-Directeur
∆Gr Enthalpie libre d’une r´eaction
∆Gc Enthalpie libre d’un compos´e
λ Constante enzymatique de d´egradation E0 Concentration initiale d’une enzyme
BES Bio Electrical System, syst`eme bio´electrique kcat Constante enzymatique d’activi´e
Km Constante enzymatique d’affinit´e
MEC Microbial Electrolysis Cell, cellule d’´electrolyse microbienne MFC Microbial Fuel Cell, pile `a combustible `a microbes
N°EC Enzyme Commission number PHB Polyhydroxybutyrate
PNS Purple Non Sulfur bacteria, bact´eries pourpres non-sulfureuses RMSE Root-Mean-Square Error
R2 Coefficient de d´etermination
SAB Syst`eme acellulaire de Biotransformation
SBML Systems Biology Markup Language,Hucka et al. (2003) TTN Total Turn-over Number
Table des mati`eres v
1 Introduction 1
1.1 Introduction sur la production de biohydrog`ene . . . 2
1.1.1 Hydrog`ene et biofuels . . . 2
1.1.2 Biohydrog`ene . . . 4
1.2 Hydrog`ene et enzymes . . . 5
1.2.1 Les hydrog´enases . . . 5
1.2.2 Les nitrog´enase . . . 7
1.3 Biohydrog`ene `a partir de voies m´etaboliques . . . 8
1.3.1 Biophotolyse . . . 8
1.3.2 Photofermentation . . . 12
1.3.3 Dark fermentation . . . 14
1.4 Hydrog`ene biologique issu de proc´ed´es artificiels . . . 17
1.4.1 Les syst`emes bio´electriques (BES) . . . 17
1.4.2 Les syst`emes artificiels de biotransformation acellulaire . . . 17
1.4.3 Int´egration de syst`emes. . . 20
1.5 L’accessibilit´e `a l’hydrog`ene . . . 23
1.5.1 G´en´eralit´es ´economiques sur le biohydrog`ene . . . 23
1.5.2 Point sur les syst`emes acellulaires . . . 24
1.6 Etudes de syst`´ emes m´etaboliques via des m´ethodes in silico . . . 26
1.6.1 Mod´elisation analytique . . . 26
1.6.2 Mod´elisation syst´emique . . . 32
1.7 Objectifs de la th`ese . . . 37
2 Mod´elisation analytique d’un syst`eme acelluaire de biotransformation de polysaccharide en hydrog`ene 39 2.1 Mod´elisation dynamique du syst`eme enzymatique . . . 40
2.1.1 Identification des ´el´ements biochimiques du r´eseau . . . 40
2.1.2 Identification d’un mod`ele dynamique . . . 44
2.1.3 Validation du mod`ele . . . 50
2.2 Optimisation in silico du syst`eme enzymatique. . . 53
2.2.1 Optimisation : choix du syst`eme et des param`etres `a modifier . . . . 53
2.2.2 Optimisation : fonctionnement et strat´egie employ´ee. . . 55
2.2.3 R´esultats . . . 57
2.2.4 D´etermination des param`etres cin´etiques de mutants . . . 68
3 Mod´elisation syst´emique d’un syst`eme acelluaire de biotransformation de polysaccharide en hydrog`ene 79 3.1 Contexte . . . 80
3.2 M´ethodes . . . 81
3.2.1 Elaboration de la base d’apprentissage´ . . . 81
3.2.2 Normalisation . . . 83
3.2.3 Les variables de sorties . . . 84
3.2.4 Base de validation . . . 84
3.2.5 Identification de mod`ele de type r´eseau de neurones . . . 84
3.2.6 Les crit`eres de performances . . . 85
3.3 R´esultats. . . 87
3.3.1 Mod´elisation de la pente . . . 87
3.3.2 Mod´elisation du plateau . . . 89
3.4 Base minimaliste . . . 92
3.4.1 Mod´elisation de la pente . . . 93
3.4.2 Mod´elisation du plateau . . . 100
4 Reconstruction et simulation de voies synth´etiques 107 4.1 Contexte et objectif . . . 108
4.2 Architecture du workflow . . . 110
4.3 Pr´erequis pour la reconstruction de voies synth´etiques . . . 111
4.3.1 Base de donn´ees m´etaboliques . . . 111
4.3.2 Repr´esentation de r´eseaux m´etabolique sous forme de graphe . . . 113
4.4 Le fonctionnement du workflow . . . 114
4.4.1 D´etermination d’un r´eseau m´etabolique d´edi´e `a la production du pro-duit final. . . 114
4.4.2 Enum´eration de voies m´etaboliques . . . 116
4.4.4 Mod´elisation de voies synth´etiques . . . 121
4.5 Discussion . . . 122
5 Conclusions et perspectives 125
5.1 Diff´erentes mod´elisations de syst`emes acellullaires de biotransformation . . . 126
5.2 Optimisation de syst`emes acellullaires de biotransformation . . . 127
5.3 Reconstruction et simulation automatique de syst`emes acellullaires de
bio-transformation . . . 129
Liste des tableaux 131
Table des figures 135
Introduction bibliographique de la
1.1
Introduction sur la production de biohydrog`
ene
1.1.1
Hydrog`
ene et biofuels
Apr`es des ann´ees d’exploitation intensive, les ressources fossiles se tarissent et se rar´efient. Ce ph´enom`ene engendre de nombreux probl`emes au niveau de l’´economie, de la soci´et´e et pose la question sur l’approvisionnement en ´energie dans le futur.
Cette utilisation massive des ´energies fossiles a g´en´er´e des ´emissions en CO2 importantes avec des cons´equences n´efastes sur l’environnement de la plan`ete et sur la sant´e de la population. Cet autre probl`eme doit ˆetre pris en compte pour la g´en´eration de nouvelles sources d’´energies. En effet depuis plusieurs ann´ees, de nombreux travaux ont ´et´e r´ealis´es pour l’´elaboration de nouveaux carburant alternatifs respectant l’environnement et capable de suppl´eer ou de sub-stituer les carburants fossiles.
L’hydrog`ene est un des candidats aux sources alternatives d’´energie. Il a ´et´e mis en ´evidence dans sa forme gazeuse par le chimiste britannique Henry Cavendish en 1766 qui l’a d´esign´e sous l’expression air inflammable . Apr`es diverses manipulations Cavendish a montr´e que
la combustion de ce gaz engendre de l’eau. En 1781, le chimiste fran¸cais Antoine Lavoisier a nomm´e ce gaz hydrog`ene suite `a la combinaison du pr´efixe grec hydro signifiant eau
et du suffixe grec g`ene signifiant engendrer. L’hydrog`ene en tant que vecteur d’´energie
est en fait un gaz constitu´e de deux atomes d’hydrog`ene H2. Bien qu’il faudrait appel´e ce gaz
dihydrog`ene , il se fait couramment d´esign´e par le simple terme hydrog`ene .
Ce gaz poss`ede de nombreuses caract´eristiques int´eressantes au niveau de l’´energie. Son uti-lisation dans un moteur `a combustion adapt´e demeure propre, elle relˆache de l’eau dans l’environnement. Elle poss`ede aussi une forte densit´e ´energ´etique soit 142.35 kJ.g-1, soit approximativement trois fois plus que la valeur issue des carburants classiques actuels. L’hy-drog`ene peut ˆetre aussi utilis´e dans des piles `a combustible pour la production d’´electricit´e. Son taux de conversion en ´electricit´e est deux fois plus important que la source utilis´e dans les proc´ed´es thermiques classiques. Cependant, l’hydrog`ene pose plusieurs probl`emes de sto-ckage et de transport. Suite `a sa faible densit´e, il doit ˆetre stocker sous haute pression pour optimiser le volume de stockage. Malgr´e cette pressurisation le stockage d’hydrog`ene occupe un plus grand volume que le stockage de carburant fossile. Ainsi `a ´energie ´egale, un volume d’hydrog`ene est trente fois sup´erieure `a un volume de gasoil. Un autre probl`eme demeure au niveau de la s´ecurit´e et de la manutention ; l’hydrog`ene est un gaz tr`es inflammable n´ecessitant une manipulation avec pr´ecaution.
Actuellement, l’hydrog`ene est couramment utilis´e dans l’industrie en dehors du contexte ´
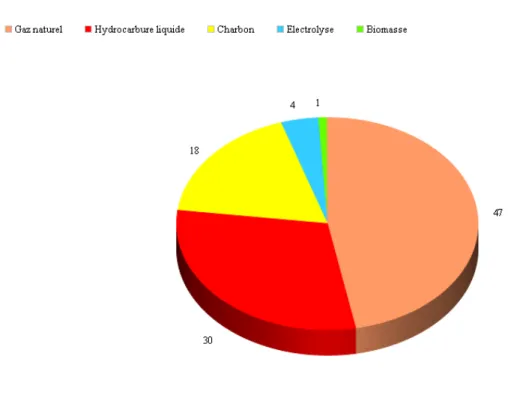
sta-tions de production d’hydrocarbure. L’hydrog`ene sous forme gazeuse est peu pr´esent dans notre environnement. Il est en effet mal retenu dans l’atmosph`ere et subsiste `a l’´etat de trace (environ 0,5 ppm). Les industries ont acc`es `a une source artificiel d’hydrog`ene produite grˆace `a des proc´ed´es bas´ees sur des m´ecanismes thermodynamiques utilisant gaz naturels, charbon ou p´etrole. Ces proc´ed´es requi`erent une consommation cons´equente d’´energie fos-sile afin d’atteindre des temp´eratures ´elev´ees. Une production de CO2 et d’autres polluants viennent s’ajouter `a cette production. Ainsi bien que l’hydrog`ene soit un candidat potentiel comme sources d’´energie alternative, sa production actuelle est bas´ee sur une consommation de ressources fossiles p´erissables et source de pollution.
Figure 1.1: Les principales sources actuelles de production d’hydrog`ene (d’apr`es IFP EN, 2011). Les ressources fossiles comme le gaz naturel(47%), les hydrocarbures (30%) et le charbon (18%) sont `a l’origine de 95% de la production globale d’hydrog`ene.
1.1.2
Biohydrog`
ene
Pour r´epondre `a ce probl`eme, une s´erie de travaux a ´et´e initi´ee afin de d´evelopper des proc´ed´es de production d’hydrog`ene ne n´ecessitant pas de ressources fossiles et respectueux de l’envi-ronnement.
Une des r´eponses est l’utilisation de proc´ed´es biologiques. Le biohydrog`ene est l’hydrog`ene issu de ces proc´ed´es biologiques. L’approche biologique consiste `a d´eterminer l’existence et `a ´
etudier les m´ecanismes de production de biohydrog`ene au sein du vivant, puis de s’y inspirer pour construire un processus industriel.
Pour survivre dans son environnement, un organisme doit ˆetre capable d’extraire de son mi-lieu des ressources naturelles, qu’il peut transformer pour synth´etiser l’ensemble des ´el´ements n´ecessaire `a son maintien. Le m´etabolisme d’un organisme est l’ensemble des r´eactions phy-sicochimiques participant `a la survie, qui englobe la synth`ese d’´el´ement. Les enzymes sont les ´el´ements cl´es des r´eactions biochimiques. Les enzymes sont essentiellement des prot´eines avec un rˆole de catalyseur facilitant les r´eactions biochimiques par l’abaissement du seuil de l’´energie d’activation. Elles augmentent ainsi la vitesse de r´eaction, sans modifier l’´equilibre. Sans leur pr´esence, ces r´eactions sont impossibles ou tr`es lentes dans les conditions internes de l’organisme.Une enzyme est con¸cue pour catalyser un type de r´eaction. Elle transforme un type de substrat sp´ecifique en un type de produit. Chaque famille d’enzyme est d´edi´ee `a un type de r´eaction.
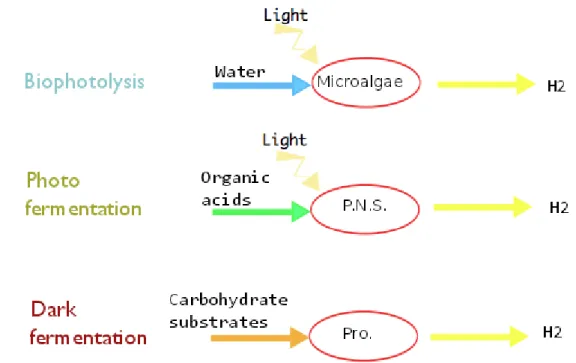
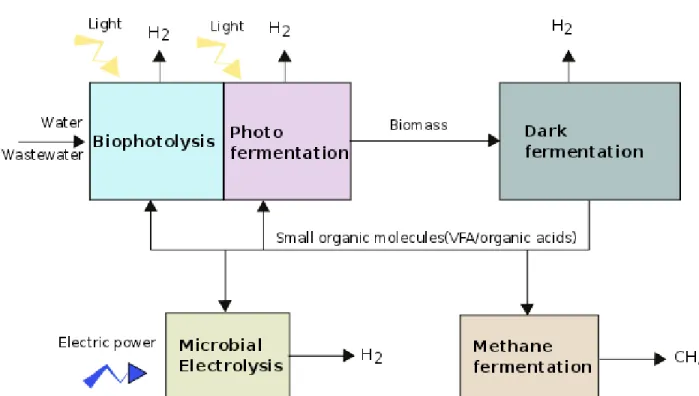
Au sein du vivant, il a ´et´e observ´e des microorganismes poss´edant un m´etabolisme capable de synth´etiser de l’hydrog`ene. Trois voies m´etaboliques de production d’hydrog`ene ont ´et´e mises en ´evidence `a partir de ces entit´es biologiques (figure1.2) :
la biophotolyse se d´eroule dans les microalgues et permet la d´ecomposition de l’eau via l’´energie lumineuse pour g´en´erer de l’hydrog`ene
la photofermentation n´ecessite aussi la lumi`ere donnant lieu chez les bact´eries pourpres non sulfureuses pour une d´ecomposition d’acides organiques pour g´en´erer l’hydrog`ene la dark fermentation s’effectue `a l’obscurit´e chez les prot´eobact´eries o`u des
poly-saccharides servent de substrat de d´epart afin de produire l’hydrog`ene.
Ces diff´erentes voies regroupent un ensemble d’enzymes pour permettre la production d’hy-drog`ene via une cascade de r´eactions diff´erentes.Elles poss`edent n´eanmoins toutes un mˆeme type de r´eaction qui permet la synth`ese directe d’hydrog`ene par l’action d’une famille enzy-matique pr´ecise et couramment appel´ee les hydrog´enases.
Figure 1.2: Les diff´erents m´ecanismes de production de l’hydrog`ene au sein de diff´erents microorganismes. la biophotolyse et la photofermentation n´ecessitent la pr´esence de lumi`ere et se d´eroulent respectivement dans les microalgues et les bact´eries pourpres non sulfeureuses. La dark fermentation est localis´ee dans un grand nombre de prot´eobact´eries pouvant vivre en ana´erobie partiel ou total.
1.2
Hydrog`
ene et enzymes
Cette famille enzymatique regroupe en fait deux types d’enzymes : les hydrog´enases
et les nitrog´enases
Le m´ecanisme de l’enzyme repose sur un ´echange d’´electrons entre r´eactifs pour g´en´erer une mol´ecule H2`a partir de 2 protons H+. Les voies de production d’hydrog`ene utilisent diff´erentes enzymes afin de d´ecomposer leur substrat de d´epart et g´en´erer un gradient de concentration d’´electrons qui alimentera une hydrog´enase ou une nitrog´enase.
Ces types d’enzymes poss`edent des propri´et´es particuli`eres.
1.2.1
Les hydrog´
enases
Les hydrog´enases permettent la r´eduction de protons lors de la formation d’hydrog`ene ou l’oxydation de mol´ecules H2 lors de consommation d’hydrog`ene.
H2 ←−→ 2 H++ 2 e–
De multiples formes d’hydrog´enases ont ´et´e mises en ´evidence pour un large panel de mi-croorganismes. La majorit´e de ces organismes sont des procaryotes. Mais il existe un nombre cons´equent de formes chez les eucaryotes, chez les algues photosynth´etiques plus pr´ecis´ement. Malgr´e cette h´et´erog´en´eit´e, toutes les hydrog´enases pr´esentent un complexe m´etallique au ni-veau de leur site actif. Selon la nature du complexe m´etallique pr´esent, les hydrog´enases sont regroup´ees en trois classes (Meyer (2007)) :
les [NiFe]-hydrog´enases, les [FeFe]-hydrog´enases, et les [Fe]-hydrog´enases.
Les [NiFe]-hydrog´enases constituent le groupe le plus ´etendu. Les [FeFe]-hydrog´enases sont plus sujets `a l’inhibition via l’oxyg`ene mais ils sont 100 fois plus actifs que les [NiFe]-hydrog´enase. Ces deux types d’hydrog´enase poss`edent un centre actif compos´e d’un clus-ter fer-souffre, Fe-S, coordonn´ees par des ligands carbonyle(CO) ou cyanide(CN-). Les [Fe]-hydrog´enases ne poss`edent pas ce cluster Fe-S et ne peuvent pas catalyser la r´eaction redox r´eversible H2 ←−→ 2 H++ 2 e–. Elles sont moins abondantes et se trouvent uniquement dans
1.2.2
Les nitrog´
enase
Les nitrog´enases sont essentiellement rencontr´ees chez les bact´eries pourpres non sulfureuses et dans les h´et´erocystes des cyanobact´eries dans la production de l’hydrog`ene via la lumi`ere
(Meyer (1978)). Les nitrog´enases sont essentielles pour constituer les r´eserves azot´ees de leur
hˆote par la fixation de l’azote, N2, ambiant. Comme les hydrog´enases, diff´erentes classes de nitrog´enases existent selon la nature du complexe m´etallique pr´esent au site actif :
les [MoFe]-nitrog´enase les [VaFe]-nitrog´enase les [FeFe]-nitrog´enase
La [MoFe]-nitrog´enase est la mieux d´ecrite. Elle peut fixer l’azote, N2, via la r´eaction sui-vante : N2+ 8 H++ 8 e–+16 ATP −−→ 2 NH
3 +H
2+ 16 ADP
La nitrog´enase produit de l’hydrog`ene durant la fixation de l’azote. En absence d’azote et en pr´esence d’une source importante d’ATP, la nitrog´enase produit des quantit´es plus impor-tantes d’hydrog`ene (Koku (2002)) :
8 H++ 8 e–4 ATP −−→ 4 H
2+ 4 ADP
Les nitrog´enases agissent comme des verrous de r´egulation du potentiel r´eductif de la cellule (Kars (2010)). La pr´esence d’azote est un inhibiteur de la production d’hydrog`ene. Pour des concentrations sup´erieures `a 20 µmol, la nitrog´enase est en mode de fixation de l’azote (
Wa-lig´orska et al. (2009)). Une diminution de la concentration d’azote inverse le processus, et
oriente la nitrog´enase vers le mode de production d’hydrog`ene uniquement. Propri´et´es Nitrog´enase Hydrog´enase
Substrats ATP, H+, N2, ´electron H2, H+
Produits H2, NH4+ ATP, H+, N2, ´electron Structure de prot´eines Dim`ere monom`ere
Complexe m´etallique Mo, Fe Ni, Fe, S
Temp´erature optimale 30°C (A.vinelandii) 55°C (R.rubrum), 70°C (R.capsulatus) pH optimum 7.1 -7.3 (A.vinelandii ) 6.5(R. sulfidophilus)
Inhibiteur N2, NH4+,O2 CO, O2, EDTA, pr´esence d’acides organiques Table 1.1: Comparaison entre les nitrog´enases et les hydrog´enases ( d’apr`esNi et al.(2006),
1.3
Biohydrog`
ene `
a partir de voies m´
etaboliques
Comme ´enonc´e pr´ecedemment, il existe 3 grandes voies m´etaboliques associ´ees `a l’hydrog`ene. Toutes ces voies d´ecomposent un substrat initial pour g´en´erer un gradient de concentration d’´electrons n´ecessaire au fonctionnement d’une hydrog´enase ou d’une nitrog´enase. Ces 3 voies sont :
la biophotolyse, la photofermentation, et la dark fermentation.
L’int´egration de microoganismes effectuant une de ces voies m´etaboliques dans un proc´ed´e de production est un sch´ema classique pour produire du biohydrog`ene.
1.3.1
Biophotolyse
La biophotolyse se d´eroule chez les algues vertes et les cyanobact´eries avec quelques diff´erences entre ces deux organimes (Yu and Takahashi (2007),Oh et al. (2011)Ananyev et al. (2012)). Les algues vertes poss`ede une [FeFe]-hydrog´enase ayant une forte activit´e sp´ecifique mais une inhibition tr`es forte par l’O2. Les cyanobact´eries comporte pr´eferentiellement une [NiFe]-hydrog´enase beaucoup moins sensible `a l’O2 mais moins active pour la production d’hy-drog`ene. Les cyanobact´eries peuvent d´eployer aussi une nitrog´enase dans un h´et´erocyte. Un h´et´erocyte est une cyanobact´erie sp´ecialis´ee pour la fixation de l’azote. Elle poss`ede une paroi plus ´epaisse qu’une cyanobact´erie normale, permettant de limiter l’entr´ee d’O2 dans la cellule et d’empˆecher une ´eventuelle inhibition de la nitrog´enase.
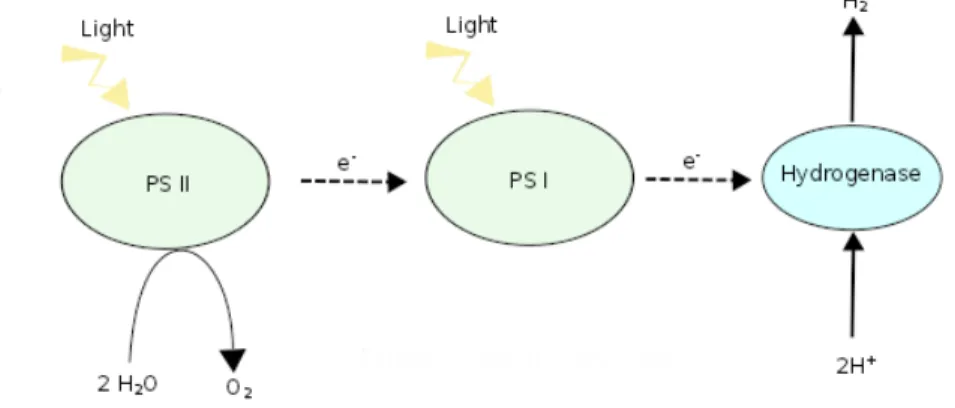
La biophotolyse consiste `a d´ecomposer l’eau en pr´esence de lumi`ere afin de g´en´erer de l’O2 et H2. Le principal int´erˆet de cette voie m´etabolique est l’utilisation de substrats de d´epart tr`es accessible, l’eau et la lumi`ere. La culture d’algues peut ˆetre aussi associ´ee `a la fixation du CO2 par la photosynth`ese, et `a la production de compos´es utiles comme des huiles, des compl´ements nutritionnels, du bioplastique. La biophotolyse et la photosynth`ese utilisent la mˆeme structure cellulaire de capture de lumi`ere, compos´ee des photosyt`emes I (PS I) et II(PS II). PS I et PS II absorbent les photons lumineux afin de g´en´erer un pouvoir oxydant capable d’oxyder l’eau. L’oxydation de l’eau produit des protons, une source d’´electrons via des compos´es r´eduits, et de l’O2 (1.3). PS I et PS II absorbent pr´ef´erentiellement la lumi`ere dans les longueurs d’ondes respectives de 700nm et 680 nm. La photosynth`ese utilise le gra-dient de concentration d’´electrons pour l’accumulation de polysaccharide dans la cellule. La
biophotolyse dirige ce pouvoir oxydant vers l’hydrog`enase pour la synth`ese d’hydrog`ene. La
Figure 1.3: Sch´ema adapt´e de Yu and Takahashi (2007). M´ecanismes de la photosynth`ese et de la biophotolyse chez les microorganismes photoautotrophes. L’excitation des photo-syst`emes I et II (PS I et PS II) par la lumi`ere permet de d´ecomposer l’eau et d’augmenter le taux d’´electrons g´en´erant un flux dans la cellule. Ce flux d’´electrons peut ˆetre dirig´e vers la photosynth`ese o`u des voies m´etaboliques comme le cycle de Calvin pour fournir la cellule en r´eserve carbon´e. La biophotolyse est l’autre destination de ce flux pour la formation de l’hydrog`ene au niveau d’une hydrog´enase. La photosynth`ese et la biophotolyse se d´eroulent en parall`ele, selon ses besoins la cellule favorisera une voie plutˆot qu’une autre. Un cer-tain nombre de r´eactions permettent aussi de passer de l’une `a l’autre par l’utilisation des r´eserves carbon´ees de la photosynth`ese pour g´en´erer de l’hydrog`ene ou par la consommation de d’hydrog`ene pour g´en´erer des r´eserves carbon´ees.
biophotolyse poss`ede deux modes : direct et indirect. Le mode direct (figure 1.4) produit de l’hydrog`ene directement durant la phase d’absorption de la lumi`ere.
Le mode indirect (figure 1.5) est d´ecoup´e en deux phases. Dans la premi`ere, les photo-syst`emes absorbent de la lumi`ere afin de g´en´erer une source de polysaccharide endog`ene via la photosynth`ese. La deuxi`eme phase se d´eroule en absence de lumi`ere ; la source de polysac-charide est d´ecompos´ee par fermentation afin d’alimenter l’hydrog´enase avec un gradient de concentration d’´electrons et de synth´etiser l’hydrog`ene.
Figure 1.4: Biophotolyse classique se d´eroulant en pr´esence de lumi`ere conjointement avec la photosynth`ese.
Figure 1.5: Biophotolyse d’une absence de lumi`ere. En pr´esence de lumi`ere, seul la photo-synth`ese est active pour g´en´erer des r´eserves de carbone. En absence de lumi`ere, ces r´eserves sont utilis´ees pour alimenter la production d’hydrog`ene.
Malgr´e une production d’hydrog`ene avec des substrats de d´epart simples, la biophotolyse soul`eve plusieurs probl`emes constituant un frein `a son utilisation `a l’´echelle industrielle. Les principaux d´efauts sont :
la sensibilit´e des hydrog´enases face `a O2,
et la faible efficacit´e de la conversion de la lumi`ere en compos´e biologique, soit l’efficacit´e photosynth´etique.
ana´erobie pour ´eviter l’apport de l’O2 externe. Cependant la biophotolyse g´en`ere durant son processus de l’O2 et inhibe elle-mˆeme son hydrog´enase. Des travaux ont tent´e de produire des hydrog´enases plus r´esistantes `a l’inhibition par isolement de nouvelles enzymes issues d’organismes divers ou ing´enierie prot´eique et g´en´eration d’une banque de mutants (
Lieb-gott et al. (2010), Wu et al. (2011), Rousset et al. (2008), Cohen et al. (2005)). Une autre
approche consiste `a utiliser pr´ef´erentiellement des [NiFe]-hydrog´enase moins sensibles `a l’O2 et d’augmenter leur activit´e. Une autre solution est de s´eparer l’activit´e de l’hydrog´enase de la production d’O2 durant la conversion par la lumi`ere. Plusieurs m´ethodes ont ´et´e test´ees telles que la s´eparation spatiale, l’immobilisation des chloroplastes, des consommateurs d’O2 et la purge de gaz. Ces m´ethodes ont eu peu de r´esultats. L’utilisation de la biophoto-lyse indirecte repr´esente un meilleur choix pour cette solution de s´eparation. En absence de lumi`ere, la production d’hydrog`ene peut s’effectuer via la source endog`ene de polysaccharide et sans activit´e li´ee `a la lumi`ere g´en´erant l’O2. L’utilisation pr´ef´erentielle des h´et´erocytes de cyanobact´eries est aussi une solution (Yu and Takahashi (2007), voir figure 1.6). Les cyano-bact´eries ont la particularit´e de vivre en colonie, sous forme de filaments de cellules normales avec quelques h´et´erocytes, en quantit´e plus ou moins variable selon les conditions ext´erieures. Etant ´etanche `a l’O2, les h´et´erocytes prot`egent la nitrog´enase de l’inhibition par l’O2. Ainsi la phase de conversion de la lumi`ere se d´eroule dans une cyanobact´erie normale et g´en`ere une source de polysaccharide. Ensuite, cette source est transport´ee vers un h´et´erocyte pour g´en´erer de l’hydrog`ene via la nitrog´enase. Un environnement pauvre en azote et riche en carbone favorisera d’autant plus la nitrog´enase. L’efficacit´e de la conversion de la lumi`ere
Figure 1.6: Production d’hydrog`ene par une nitrog´enase au sein d’un h´et´erocyte, d’apr`es
Yu and Takahashi(2007) . La g´en´eration d’oxyg`ene et synth`ese d’hydrog`ene s’effectuent dans
deux cellules distinctes. La cellule de gauche sous la lumi`ere produit une source de carbone et de l’oyxg`ene. Le substrat carbon´e est ensuite transport´e dans l’h´et´erocyte (cellule de droite) isol´e d’oxyg`ene pour g´en´erer l’hydrog`ene.
est le second point limitant la biophotolyse. En th´eorie, le rendement photosynth´etique est sup´erieure `a 80%, mais en pratique seulement une faible quantit´e de la lumi`ere absorb´ee,
entre 1 et 2%, est utilis´ee pour g´en´erer des ´electrons lors de la biophotolyse (Hallenbeck and
Benemann (2002), Melis (2002)). Un rendement proche de 10% est `a atteindre pour avoir
un mod`ele viable ´economiquement (Hallenbeck and Benemann (2002), Melis (2002)). Les photosyst`emes poss`edent des collecteurs de lumi`ere optimis´es pour la capture de lumi`ere de faible intensit´e. Ainsi face `a une haute intensit´e lumineuse, les photosyst`emes ne peuvent pas retenir toute l’´energie. L’´energie est perdue par dissipation thermique et par cons´equent engendre ce faible taux de conversion. Dans la nature, ce ph´enom`ene de dissipation permet `
a la cellule de survivre face `a une absorption massive de lumi`ere suite `a une exposition trop intense (Govindjee (2002)). Diff´erents travaux ont tent´e de modifier la taille des collecteurs de lumi`ere avec un l´eger gain de conversion (Govindjee(2002),Polle et al.(2002),Mussgnug
et al. (2007), Berbero˘glu et al. (2008)). L’efficacit´e photosynth´etique diminue aussi par le
ph´enom`ene d’ombragement entre microorganisme dans un milieu de culture. Les individus en surface captent l’essentiel de la lumi`ere et empˆechent une capture de lumi`ere suffisante pour les individus plus en profondeur. Le design des photobior´eacteurs est associ´e `a ce probl`eme. Une surface large est requise pour une exploitation efficace si la conversion de la lumi`ere reste faible. En outre, le prix en surface des photobior´eacteurs demeure important actuellement. Des photobior´eacteurs moins chers doivent ˆetre mis en place pour une utilisation industrielle .
1.3.2
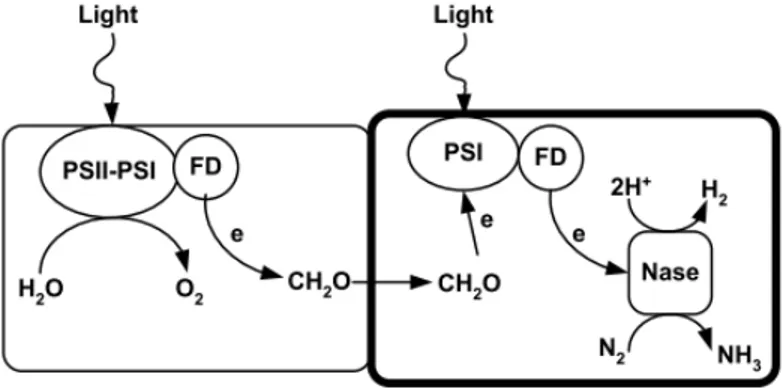
Photofermentation
Les bact´eries pratiquant la photofermentation g´en`erent de l’hydrog`ene en pr´esence de lumi`ere et d’acides organiques en ana´erobie. Les d´echets alimentaires et la fermentation de produits issus de l’agriculture sont des sources importantes d’acides organiques pour la photofermenta-tion. Parmi les bact´eries ayant cette voie m´etabolique, les bact´eries pourpres non-sulfureuses (PNS) sont les plus connues et nombreuses. Les PNS poss`edent un unique photosyst`eme pour la capture de la lumi`ere. Cette absorption de lumi`ere, coupl´ee `a la d´ecomposition des acides organiques, g´en`ere via diff´erentes r´eactions un flux d’´electrons vers une nitrog´enase (
Hal-lenbeck and Benemann (2002),Koku (2002),Akkerman et al. (2002),Harwood et al. (2008),
Brentner et al. (2010),McKinlay and Harwood (2010)). L’utilisation de la lumi`ere donne la
possibilit´e d’effectuer des r´eactions thermodynamiquement non favorables. Les PNS peuvent diriger 100% des ´electrons produits `a partir d’acides organiques vers la synth`ese d’hydrog`ene.
(Harwood et al. (2008)).
La photofermentation a ses limites. Elle poss`ede un bon rendement de d´ecomposition en acides organiques mais sa vitesse de production d’hydrog`ene demeure faible. Comme la bio-photolyse, elle est sujette `a une faible efficacit´e photosynth´etique.
Figure 1.7: La photofermentation. Les bact´eries pourpres non-sulfureuses captent les pho-ton de la lumi`ere via un photosyt`eme.Ce photosyst`eme excit´e par la lumi`ere et la pr´esence d’acides organiques dans le milieu permettent de g´en´erer un flux d’´electron utilisable par une nitrog´enase. Un apport en ATP est n´ecessaire pour la synth`ese de l’hydrog`ene via la nitrog´enase.
Elle pr´esente aussi des contraintes plus sp´ecifique li´ees `a la nitrog´enase,
`a la pr´esence d’une hydrog´enase consommant l’hydrog`ene chez les PNS, et `a la pr´esence d’une voie comp´etitive.
Les efforts pour augmenter l’efficacit´e photosynth´etique de la photofermentation sont simi-laires aux travaux effectu´es pour la biophotolyse (Kondo et al. (2002),Kim et al. (2006),
Eltsova et al.(2010)).
La photofermentation se d´eroule en ana´erobie, diminuant l’inhibition li´ee `a l’O2 pour la nitrog´enase. Cependant pour ˆetre dans les conditions optimales de production en H2, la concentration en N2 doit ˆetre la plus faible possible. Diff´erentes manipulations g´en´etiques ont ´et´e effectu´ees afin d’obtenir des mutants moins sensibles la concentration en N2 (Kars
(2010),Drepper et al.(2003), Kim et al. (2008),Hallenbeck et al. (2012))
La nitrog´enase doit consommer, durant la synth`ese de H2, une quantit´e constante d’ATP qui est g´en´er´ee par l’activit´e photosynth´etique. Une variation de l’intensit´e lumineuse engendre une chute majeure de la concentration en ATP, bloquant la synth`ese d’hydrog`ene.
pour alimenter d’autres voies m´etaboliques actives parall`element. La modification du g`ene de l’hydrog´enase, hup, peut diminuer cette consommation et favoriser la g´en´eration de H2 du syst`eme (Rey et al. (2006),Kars et al. (2009),Liu et al. (2010)).
Les PNS produisent du polyhydroxybutyrate (PHB) comme source de stockage de carbone dans un environnement riche en carbone et pauvre en azote (Kemavongse et al. (2007), Wu
et al. (2012a)). Ce stockage n´ecessite une quantit´e importante de m´etabolites et d’´el´ements
r´eduits qui sont aussi requis dans la synth`ese d’hydrog`ene. La synth`ese de PHB est en comp´etition avec la synth`ese d’hydrog`ene (Wu et al. (2012a),Hustede et al. (1993),
Vin-cenzini et al. (1997)). L’enzyme PHB synthase permet de synth´etiser le polym`ere de PHB.
L’´elimination de son g`ene bloque la synth`ese du polym`ere (Kim et al. (2006)). N´eanmoins une g´en´eration faible de PHB n’est pas toujours synonyme d’une synth`ese forte d’hydrog`ene
(Hustede et al. (1993)). Les travaux de Wu et al. (2012a) ont fait l’hypoth`ese que le PHB,
en tant que r´eserve d’´energie, procure une protection et une stabilit´e de la cellule face `a des perturbations ext´erieures comme le stress li´e au pH. Cet effet b´en´efique permet le maintien de la cellule et la production d’hydrog`ene lors de conditions de stress. La g´en´eration de PHB est en comp´etition avec la synth`ese d’hydrog`ene. Mais elle permet `a la cellule de mieux faire face aux conditions externes et de maintenir son activit´e. Ainsi `a court terme, elle peut in-hiber la synth`ese, mais `a long terme elle permet de maintenir plus longtemps un niveau de production d’hydrog`ene par la bact´erie. Lors d’une exploitation `a grande ´echelle et inten-sive, il peut ˆetre judicieux de bien analyser les conditions de cultures pour d´eterminer si la synth`ese de PHB peut ˆetre utile ou pas . De plus, le PHB est un polym`ere biod´egradable ; son accumulation, comme sous produit d’une production d’hydrog`ene, pourrait servir pour la synth`ese de bioplastique.
1.3.3
Dark fermentation
La dark fermentation s’applique chez un grand nombre de bact´eries organotrophes. La
d´ecomposition d’un polysaccharide , dans cette voie m´etabolique, procure la source de d´epart pour g´en´erer un flux d’´electrons. La dark fermentation, comme son nom l’indique, est une fermentation et se d´eroule donc uniquement en ana´erobie. Pourtant cette voie m´etabolique poss`ede quelques variations selon si l’organisme est un hˆote en ana´erobie obligatoire, ou est un hˆote en ana´erobie facultative (figure 1.8).
Le genre Clostridium et Escherichia coli servent de mod`eles respectivement pour les bact´eries en ana´erobie stricte et en ana´erobie facultative. Chacune d’elles utilise une hydrog´enase lors de la synth`ese. Mais elles divergent dans les r´eactions biochimiques employ´ees entre la consommation du substrat et l’action de l’hydrog´enase. Les strictes ana´erobies ont comme
Figure 1.8: La dark fermentation est la production d’hydrog`ene `a partir d’un polysaccharide en absence de lumi`ere par fermentation. Il existe 2 modes de dark fermentation selon que l’organisme vit exclusivement en ana´erobie(voie jaune) ou en ana´erobie partielle(voie bleu). enzymes sp´ecifiques la pyruvate ferredoxine oxydor´eductase (PFOR, Hallenbeck (2005)) et la NADH/Ferredoxine oxydor´eductase (NFOR, Wang et al. (2010)) qui utilisent respecti-vement le pyruvate, produit final de la glycolyse, et le NADH issu de la voie des pentoses phosphates. Ces enzymes fournissent l’hydrog´enase en ´electrons. Les ana´erobies facultatives utilisent uniquement le pyruvate qui donne les ´electrons n´ecessaires, suite `a la catalyse de la pyruvate formate lyase suivi de la catalyse de la formate hydrog`ene lyase (Hallenbeck and
Benemann(2002) ; Hallenbeck and Ghosh (2009),Kim et al. (2009)).
La dark fementation est, parmi les voies m´etaboliques li´ees `a l’hydrog`ene, la plus facile `a mettre en place par l’absence de gestion de la lumi`ere et l’application d’une simple fermenta-tion. La fermentation est un processus biologique utilis´e depuis l’antiquit´e avec la production de diff´erents breuvages alcoolis´es. La mise en place `a l’´echelle industrielle est courante et plus simple que de bˆatir des proc´ed´es utilisant la lumi`ere.Les esp`eces du genre Clostridium sont les plus utilis´ees en fermentation industrielle. Ainsi les infrastructures et le contrˆole sont d´ej`a
relativement bien connus pour la dark fermentation. Le principal d´efaut de la dark fermen-tation est le mauvais rendement en hydrog`ene `a partir de la consommation de sucres. Selon la stœchiom´etrie de l’oxydation du glucose, 1 mole de glucose g´en`ere 12 moles de H2. Cepen-dant, le maximum th´eorique dans un proc´ed´e biologique comme la dark fermentation est de 4 moles d’hydrog`ene par mole de glucose, soit seulement 33% de la stœchiom´etrie maximale. La production d’une grande quantit´e de sous produits comme le lactate, l’ac´etate, l’´ethanol rentre en comp´etition avec la production d’hydrog`ene. Comme le PHB pour les PNS, ces sous-produits sont la r´esultante de voies m´etaboliques ne participant pas `a la production d’hydrog`ene, mais ils sont n´ecessaires `a la survie de la cellule. En pratique le rendement est inf´erieur `a 4 moles H2/mole de glucose, il est proche des 1-2 moles H2/mole de glucose avec un rendement sup´erieur chez les an´erobies strictes par rapport aux ana´erobies facultatives
(Hallenbeck (2005)).
De nombreuses manipulations g´en´etiques ont ´et´e r´ealis´ees dans l’optique de r´eduire l’activit´e des voies comp´etitives et de favoriser la production d’hydrog`ene par l’hydrog´enase.
1.4
Hydrog`
ene biologique issu de proc´
ed´
es artificiels
L’existence dans la nature des voies m´etaboliques li´ees `a la production d’hydrog`ene a servi de base `a l’´elaboration de proc´ed´es de production. Cependant le biohydrog`ene peut ˆetre produit via des concepts non existant dans la nature mais utilisant des outils issues de la biologie.
1.4.1
Les syst`
emes bio´
electriques (BES)
Un syst`eme bio´electrique combine des microorganismes et une cellule d’´electrolyse ou une pile `a combustible. Ce syst`eme donne lieu `a des r´eactions de r´eductions d’acides organiques, dans des microorganismes fix´es `a l’anode ou la cathode. Dans la pile `a combustible `a microbes (MFC, Verstraete and Rabaey (2006)), le syst`eme est con¸cu pour produire de l’´electricit´e. Les bact´eries fix´ees sous la forme de biofilm lib`erent des ´electrons dans le milieu externe grˆace `
a la r´eduction des acides organiques via leur activit´e biologique. Ces bact´eries sont nomm´ees bact´eries exo´electrog`enes. Les ´electrons g´en´er´es sont r´ecup´er´es par l’anode pour ˆetre utilis´es par la cellule d’´electrolyse.
La production d’hydrog`ene par un BES a ´et´e mise en place en 2005(Liu et al. (2005)). Ce syst`eme est appel´e cellule d’´electrolyse microbienne (MEC, Logan et al. (2008)). La MEC est une variante de la MFC (voir figure 1.9). Elle n´ecessite en plus de la pr´esence de mi-croorganismes dans le syst`eme, la pr´esence d’une source de courant externe et une absence d’O2 au niveau de la cathode. La production d’hydrog`ene est situ´ee au niveau de la cathode. Une ´electrolyse classique, sans les microorganismes, g´en`ere de l’hydrog`ene mais l’ajout de cet ´el´ement dans la MEC diminue le voltage, n´ecessaire, d’un facteur 10 (Rozendal et al.(2007),
Hu et al.(2008)).
Les BES ont tendance `a perdre en efficacit´e lors de l’augmentation de la taille du proc´ed´e et par la perte d’´energie issue de l’ensemble des activit´es biologiques des microorganisme sans int´erˆets, ou mˆeme gˆenants, pour la g´en´eration des ´electrons.
1.4.2
Les syst`
emes artificiels de biotransformation acellulaire
La biologie synth´etique est un paradigme r´ecent, d´ej`a appliqu´e dans la production de biohy-drog`ene, visant `a ´etablir des proc´ed´es biologiques de production non retrouv´es dans la nature. Ce paradigme consid`ere les ´el´ements du vivant comme des outils et des pi`eces de construc-tion, pouvant ˆetre utilis´es et assembl´es afin de parvenir `a construire un syst`eme biologique,
Figure 1.9: Deux syst`emes bio´electriques : la pile `a combustible `a microbe (MFC) `a gauche et la cellule d’´electrolyse microbienne (MEC) `a droite. Ces 2 syst`emes ont un biofilm de bact´eries exo´electrog`enes sur l’anode. Ces bact´eries d´ecomposent les acides organiques du milieu pour transf´erer des ´electrons vers l’anode. La MFC utilise cette source d’´electrons pour produire de l’´electricit´e en pr´esence d’oxyg`ene. La MEC produit de l’hydrog`ene `a partir de ces ´electrons et d’une source d’´electricit´e en absence d’oxyg`ene.
in´edit des syst`emes biologiques naturels mis en place par les organismes vivants.
Les enzymes sont les ´el´ements cl´es d’une voie m´etabolique. En consid´erant les enzymes comme des briques du vivant, il est possible de prendre celles qui sont int´eressantes afin de construire une voie m´etabolique artificielle totalement in´edite par rapport aux voies naturelles. En outre, il est possible d’utiliser directement ces enzymes `a l’ext´erieur de cellules.
Un syst`eme acellulaire de biotransformation (SAB) est un assemblage uniquement d’enzymes ou d’autres sous-composants d’une cellule dans un milieu hors cellule. Cet assemblage a pour fonction de transformer un substrat en un produit d’int´erˆet. L’utilisation d’un syst`eme sans cellule permet d’´eviter la pr´esence d’´eventuelles voies m´etaboliques ´etant en comp´etition avec la voie d´ebouchant sur la fonction d’int´erˆet. Ce syst`eme est enti`erement d´edi´e `a cette nouvelle fonction et consacre les ressources du milieu disponibles dans cette tˆache. Un SAB est plus simple au niveau de l’architecture vu qu’il ne comporte que les ´el´ements utiles `a la tˆache et qu’ils sont tous connus contrairement `a un syst`eme utilisant un organisme en entier. Par cons´equent, le contrˆole d’un SAB est plus facile que dans le cas d’une population de microor-ganismes g´erant eux-mˆemes leur m´etabolisme selon les conditions rencontr´ees. Cependant, l’exp´erimentateur doit maintenir directement les diff´erentes conditions n´ecessaires `a l’emploi des ´el´ements biologiques employ´es, comme le maintien de la concentration des enzymes dans le temps et le maintien des conditions externes optimales `a la catalyse des enzymes, `a l’instar de la temp´erature, de la pression et du pH.
Diff´erents travaux sur les SAB ont ´et´e publi´es dans le domaine de la production d’hy-drog`ene. Deux types de syst`emes sont observ´es : le premier n´ecessitant la lumi`ere, et le second n´ecessitant des polysaccharides.
Syst`eme artificiel de production d’hydrog`ene via la lumi`ere
La biophotolyse et la photofermentation ont inspir´e la conception de SAB produisant de l’hy-drog`ene via la lumi`ere (Winkler et al. (2011)). Ces syst`emes rassemblent un photor´ecepteur, un donneur d’´electron et un catalyseur d’hydrog`ene. Le photor´ecepteur est un photosyst`eme I (PSI) isol´e de cyanobact´eries, d’algues, ou de cellules chlorophylliennes qui sont en g´en´eral des cellules d’´epinards. La plastocyanine ou le cytochrome 6 sont isol´es et directement utilis´es comme donneur d’´electrons du syst`eme. Le photosyst`eme, sous l’effet de la lumi`ere, va pou-voir, avec le donneur d’´electrons, g´en´er´e des ´electrons excit´es utilis´es par le catalyseur. Une hydrog´enase peut faire office de catalyseur (Ihara et al.(2006),Winkler et al.(2009),Lubner
et al.(2009), Lubner et al. (2010)). Une autre solution est l’emploi de catalyseur m´etallique
comme des nanoparticules de m´etaux nobles `a l’instar du platine Pt, ou de l’or Au (Grimme
et al.(2008),Grimme et al.(2009),Iwuchukwu et al.(2010)). Bien que fonctionnels, les SAB
utilisant la lumi`ere pr´esentent un faible rendement en comparaison avec les proc´ed´es utilisant des microorganismes. De plus, l’utilisation de m´etaux nobles est on´ereux et les syst`emes avec l’hydrog´enase souffre de l’inhibition par l’O2. Le probl`eme principal demeure les ´echanges d’´electrons entre les diff´erents composants :
entre le photor´ecepteur et le donneur d’´electrons et entre le photor´ecepteur et le catalyseur
La diffusion entre ces ´el´ements est limit´ee. Diverses am´eliorations tentent de favoriser les ´echanges par l’addition au syst`eme de mol´ecules interm´ediaires facilitant le transfert d’´electrons. L’immobilisation des diff´erents ´el´ements en un seul complexe, comme un complexe avec le photosyst`eme li´e `a une hydrog´enase, facilite aussi l’´echange.
Syst`eme artificiel de production d’hydrog`ene via les polysaccharides
Ce type de syst`eme est bas´e sur la dark fermentation. L’int´erˆet d’utiliser un SAB d´edi´e `a l’hydrog`ene `a partir de la consommation de sucres est de parvenir `a mettre en place un syst`eme plus performant que la dark fermentation au niveau des rendements tout en conser-vant la possibilit´e de consommer comme substrat de d´epart des polysaccharides, famille de macromol´ecules abondantes dans la nature. De multiples combinaisons d’enzymes, provenant
d’une source vari´ee en microorganismes, ont ´et´e utilis´ees dans des syst`emes de ce type (
Wood-ward et al. (2000), Zhang et al. (2007), Ye et al. (2009)). Outre l’hydrog´enase, ces syst`emes
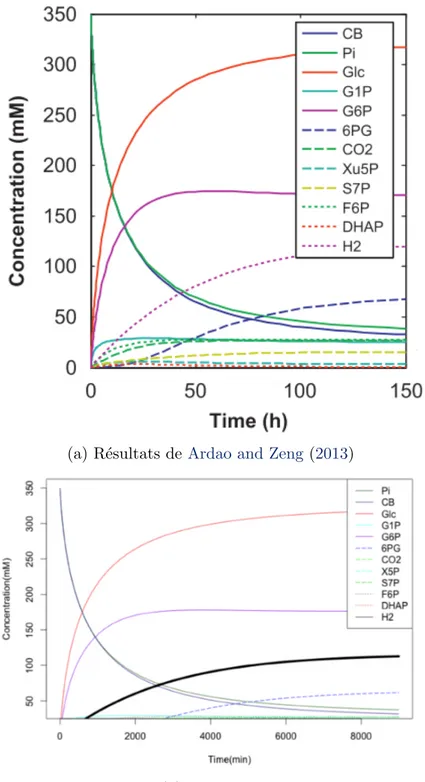
poss`edent des enzymes associ´ees au m´etabolisme du carbone. En 2007, Zhang et al. ont construit un syst`eme de 13 enzymes convertissant un polysaccharide en hydrog`ene. L’amidon a ´et´e le substrat de d´epart test´e dans ce syst`eme. Puis en 2009, Ye et al.adaptent le syst`eme pour utiliser des compos´es cellulosiques au d´epart. La cellulose est un compos´e moins cher que l’amidon et elle est facilement accessible `a partir de v´eg´etaux et de d´echets verts. Avec un syst`eme similaire `a la figure 1.10, le rendement s’approche du maximum th´eorique de l’oxydation du glucose, donnant de l’hydrog`ene. Une mole d’anhydroglucose, produit `a partir de la d´ecomposition de polysaccharide, donne 11,2 moles d’hydrog`ene soit 93.1% du rendement th´eorique (Ye et al. (2009)). La vitesse de production d’hydrog`ene `a partir du cellobiose a atteint 3.92 mmol d’ hydrog`ene par heure par litre de culture. Ce syst`eme est efficace en terme de rendement, mais il reste perfectible au niveau de la vitesse de produc-tion. Zhang indiquent qu’un gain de vitesse d’un facteur 1000 est possible avec l’utilisation de hautes temp´eratures, une augmentation de concentrations en enzymes et en substrats, l’emploi d’enzymes modifi´ees et l’am´elioration de divers composants du syst`eme.
1.4.3
Int´
egration de syst`
emes
Plusieurs travaux (Guwy et al. (2011), Eroglu and Melis (2011)) ont assembl´es diff´erents proc´ed´es de g´en´eration d’hydrog`ene en un seul dans l’optique d’augmenter le rendement et la vitesse de production. Actuellement, la dark fermentation est l’un des seuls potentiellement viable pour une utilisation industrielle de par sa vitesse de production. Sa combinaison avec la photofermentation ou la MEC permet d’augmenter le rendement par la consommation des sous produits g´en´er´es lors de la dark fermentation.
Ces combinaisons sont coˆuteuses `a mettre en place. Elles n´ecessitent de larges infrastructures avec des parties d´edi´ees `a la r´ealisation et au contrˆole de conditions de chaque proc´ed´e.
Figure 1.10: Syst`eme synth´etique mis en place par Zhang et al. (2007) pour produire du biohydrog`ene `a partir d’amidon comme polysaccharide de d´epart. Les abr´eviations sont : PPP, voie des pentoses phosphates ; G1P, glucose-1-phosphate ; G6P, glucose-6-phosphate ; 6PG, 6-phosphogluconate ; Ru5P, ribulose-5-phosphate ; et Pi, phosphate inorganique. les enzymes employ´ees sont :#1, glucane phosphorylase ;#2, phosphoglucomutase ;#3, G-6-P d´ehydrog´enase ;#4, 6-phosphogluconate d´ehydrog´enase, #5 Phosphoribose isom´erase ; #6, Ribulose 5-phosphate ´epim´erase ; #7, Transaldolase ; #8, Transketolase, #9, Triose phos-phate isom´erase ; #10, Aldolase, #11, Phosphoglucose isom´erase : #12, Fructose-1, 6-bisphosphatase ; #13, Hydrog´enase.
Figure 1.11: Int´egration de plusieurs syst`emes artificiels ou issus de proc´ed´es biologiques pour produire du biohydrog`ene.
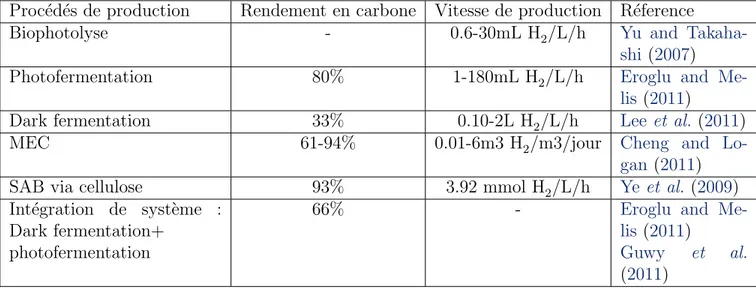
Proc´ed´es de production Rendement en carbone Vitesse de production R´eference
Biophotolyse - 0.6-30mL H2/L/h Yu and
Takaha-shi (2007)
Photofermentation 80% 1-180mL H2/L/h Eroglu and
Me-lis (2011)
Dark fermentation 33% 0.10-2L H2/L/h Lee et al. (2011) MEC 61-94% 0.01-6m3 H2/m3/jour Cheng and
Lo-gan (2011)
SAB via cellulose 93% 3.92 mmol H2/L/h Ye et al. (2009) Int´egration de syst`eme :
Dark fermentation+ photofermentation
66% - Eroglu and
Me-lis (2011)
Guwy et al.
(2011) Table 1.2: Diff´erents indicateurs de rendement et de vitesse de production de biohydrog`ene de plusieurs proc´ed´es de production.
1.5
L’accessibilit´
e `
a l’hydrog`
ene
1.5.1
G´
en´
eralit´
es ´
economiques sur le biohydrog`
ene
Le coˆut de production est le facteur cl´e pour permettre d’avoir de l’hydrog`ene accessible pour l’utilisation courante. Chaque type de production d’hydrog`ene poss`ede un coˆut d´ecoulant de la nature du proc´ed´e de fabrication et des mati`eres premi`eres utilis´ees. Ce coˆut et la distribution sont les principaux freins de l’exploitation de l’hydrog`ene
Fuel Mati`ere premi`ere Coˆut de production (US $/MBtu) Hydrog`ene photobiologique eau, acides organiques 10 Hydrog`ene par fermentation m´elasse 30 Hydrog`ene par pyrolyse charbon, biomasse 4 Hydrog`ene par ´electrolyse eau 10 Hydrog`ene par d´ecomposition de vapeur eau 13
´
Ethanol par fermentation m´elasse 31.5 Gasoil p´etrˆole 6
Table 1.3: Coˆut de revient de diff´erents proc´ed´es de production de carburants(Wu et al.
Le d´epartement li´e aux ´energies des ´Etats-Unis poss`ede un plan de d´eveloppement de l’hy-drog`ene comme vecteur d’´energie. Il s’est fix´e pour objectif un coˆut de production de 14-21$ par gigajoule (Wu et al. (2012b)) soit approximativement 2$/kg d’hydrog`ene pour ˆetre comp´etitif par rapport au coˆut des carburants fossiles. La pyrolyse est le proc´ed´e de pro-duction d’hydrog`ene le plus ´economique. Cependant elle n´ecessite de brˆuler du charbon ou de la biomasse ; dans une perspective environnementale et d’exploitation `a long terme, le biohydrog`ene est plus durable.
La mati`ere premi`ere, utilis´ee dans la fabrication d’un carburant, a un impact important sur le coˆut de production d’un carburant. Elle repr´esente 50 voir 80 % du prix du produit fini
(Lynd et al.(1999); Zhang(2010) ) comme c’est le cas pour
le gasoil issu du p´etrˆole,
le biodiesel issu des huiles v´eg´etales,
l’´ethanol issu du ma¨ıs et autres plantes sources de polysaccharides.
A cet ´egard, le biohydrog`ene poss`ede la caract´eristique de pouvoir ˆetre g´en´er´e `a partir de diff´erents d´echets peu couteux `a l’instar des d´echets solides municipaux, des effluents indus-triels, des boues d’´epuration. Outre leur coˆut infime en tant que d´echet, l’emploi de ces rejets permet leur recyclage. La production d’hydrog`ene pourrait alors d´evelopper un rˆole parall`ele cibl´e sur la d´epollution de secteurs industriels.
1.5.2
Point sur les syst`
emes acellulaires
Dans le cas des SAB, le coˆut de revient d´epend aussi beaucoup des enzymes utilis´ees. En ef-fet, les enzymes doivent ˆetre synth´etis´ees et purifi´ees contrairement aux proc´ed´es utilisant un microorganisme entier. Cette ´etape de synth`ese et de purification doit ˆetre la moins coˆuteuse possible et doit avoir la meilleure efficacit´e catalytique possible. La mesure de l’efficacit´e est bas´ee sur le rapport entre la quantit´e de produit synth´etis´e(=QP) et la quantit´e d’enzyme utilis´ee(=QE). Ce rapport est le total turn-over number , TTNw :
TTNw = QPQE (Zhang et al.(2010))
La stabilit´e de l’enzyme dans le temps joue aussi un rˆole important sur le coˆut de pro-duction d’hydrog`ene. L’ing´enierie enzymatique est une solution pour obtenir des enzymes performantes et durables permettant d’acc´eder `a des coˆuts proches de 2$/kg H2.
Figure 1.12: Diagramme publi´e par Zhang et al. (2010) donnant des estimations du coˆut de production d’hydrog`ene via un SAB `a partir des coˆut de synth`ese et du TTN qui est le rapport entre la quantit´e de produit synth´etis´e(P) et la quantit´e d’enzyme ou de biocatalyste utilis´ee (E). TTN = quantit´quantit´e(P )e(E) , TTNw = masse(QP )masse(E) .
Les estimations de coˆuts sont bas´ees sur le prix du de la mati`ere premi`ere, des 13 enzymes du syst`eme, et des cofacteurs ´etudi´es qui sont le NADP, ses rempla¸cants potentiels comme le NAD et des biomim´etiques artificiels. Le prix de la mati`ere premi`ere est de 0.18/kg de polysaccharide.
Le graphe (a) donne une estimation du coˆut de production d’hydrog`ene partir des coˆuts de synth`ese des enzymes, quand le TTN des cofacteurs = 1000000. Le coˆut d´ecroit rapidement avec l’augmentation du TTNw des enzymes. Une valeur de TTNw `a 2 ∗ 105 est le seuil
d’am´elioration au del`a duquel aucune baisse du coˆut n’est observ´ee.
Le graphe (b) montre l’impact du choix et du TTN des cofacteurs sur le coˆut quand TTNw est de 100000 pour les enzymes.
1.6
Etudes de syst`
´
emes m´
etaboliques via des m´
ethodes
in silico
L’utilisation de SAB permet en partie d’´eliminer le probl`eme li´e au rendement mais le syst`eme reste `a am´eliorer notamment au sujet de la vitesse de production d’hydrog`ene et du coˆut de revient. Pour contourner ces difficult´es, l’am´elioration des enzymes par ing´enierie des prot´eines est souvent mise en œuvre. L’ing´enierie des prot´eines a d´ej`a fait ses preuves pour optimiser des enzymes, cependant elle n´ecessite la mise en place de processus exp´erimentaux assez longs et coˆuteux pour produire et identifier l’enzyme id´eale. Le passage au pr´ealable par une approche in silico permet d’aiguiller vers la direction `a suivre pour optimiser avec un gain de temps et de coˆut.
Dans le cas d’un r´eseau m´etabolique `a am´eliorer, la d´emarche in silico consiste d’abord `a conceptualiser ce syst`eme en un mod`ele math´ematique pouvant reproduire le plus fid`element le comportement du syst`eme r´eel. Une fois le mod`ele g´en´er´e et valid´e, il pourra ˆetre utilis´e pour identifier les points `a modifier du syst`eme et leur influence sur le comportement du syst`eme. Deux approches de mod´elisation sont possibles :
une approche analytique n´ecessitant une connaissance d´etaill´ee de tous les composants ´el´ementaires du syst`eme. Un mod`ele analytique est aussi appel´e mod`ele de connaisance. une approche syst´emique qui consiste regrouper des composants ´el´ementaires en une seule entit´e reproduisant le comportement du syst`eme. Ce regroupement impose une mod´elisation plus macroscopique du syst`eme.
Le choix de l’approche d´epend de l’usage attendu et des connaissances disponibles sur le syst`eme. Quelle que soit l’approche utilis´ee, le mod`ele doit pouvoir reproduire un comporte-ment donn´e du syst`eme. La pr´ecision du mod`ele est variable selon la m´ethode employ´ee et la complexit´e du syst`eme.
1.6.1
Mod´
elisation analytique
Reconstruction de r´eseaux m´etabolique
L’approche analytique est le type de mod´elisation le plus utilis´e par les biochimistes dans l’´etude du m´etabolome. Elle n´ecessite de d´eterminer le plus grand nombre de m´ecanismes mol´eculaires pr´esents, qui sont les briques ´el´ementaires du syst`eme m´etabolique. La recons-truction in silico de r´eseaux m´etaboliques permet d’identifier et d’analyser les m´ecanismes
mol´eculaires impliqu´ees dans un ´etat physiologique d’un organisme. La premi`ere phase consiste `
a r´ecup´erer les informations m´etaboliques des r´eactifs, des enzymes et des r´eactions impliqu´ees dans une voie m´etabolique (Francke et al.(2005)) . Cette phase n´ecessite le recueil de donn´ees `
a partir de publications et de bases de donn´ees biologiques regroupant des informations li´ees aux voies m´etaboliques et aux g`enes, aux prot´eines, aux r´eactions impliqu´es. De nombreuses bases permettent la collecte de ces donn´ees, nous pouvons citer quelques exemples :
la base KEGG (Kyoto Encyclopedia of Genes and Genomes) est une des premi`eres bases, sur internet, regroupant les informations de g`enes, prot´eines, r´eactions et de voies m´etaboliques issues du s´equen¸cage d’un panel important d’organismes.
La base BioCyc, apparue plus tard, regroupe actuellement des informations sur 3530 voies m´etaboliques et g´enomes.
la base BRENDA (BRaunschweig ENzyme DAtabase, Schomburg et al. (2013)) est d´edi´ee `a la collecte de donn´ees d’enzymes `a partir de publications ou de divers travaux exp´erimentaux. Elle propose une fiche d´ecrivant les propri´et´es biochimiques de chacune de ses enzymes.
Ce recueil d’informations doit permettre de lister tous les agents biochimiques d’une voie et leurs r´eactions associ´ees, et de d´ecrire leurs interactions entre eux. Une fois le mod`ele construit et v´erifi´e, la phase de simulation `a proprement dit peut d´ebuter.
Mod´elisation via l’´etude du r´eseau
Le but de la mod´elisation consiste, `a partir d’un mod`ele, `a pr´evoir le comportement du syst`eme ou de la voie m´etabolique ´etudi´ee, dans des situations donn´ees et sur des ´echelles de temps donn´ees. Il existe plusieurs m´ethodes pour effectuer ces pr´evisions `a partir du mod`ele, mais elles se basent toutes sur la stœchiom´etrie des r´eactions pr´esentes souvent repr´esent´ees dans une matrice S. S est la matrice stœchiom´etrique regroupant en lignes les m´etabolites et en colonnes les r´eactions. Une case ij donne le coefficient stœchiom´etrique du m´etabolite i pour la r´eaction j. Cependant, deux approches peuvent ˆetre distingu´ees :
des pr´evisions bas´ees sur l’´etude de pseudos ´etats stationnaires du syst`eme, c’est-`a-dire lorsque que les variations de concentrations, de volumes sont nulles ;
des pr´evisions bas´ees sur la dynamique de l’ensemble, o`u quel que soit l’´etat du syst`eme le mod`ele peut pr´evoir le comportement des ´el´ements biochimiques.
Mod`ele `a l’´etat stationnaire
L’´etat stationnaire est d´efini par l’´equation d’´equilibre suivante : dc(t)
dt = 0 = S ∗ v
c est un vecteur d´ecrivant la concentration des m´etabolites, c(t) est constant `a l’´etat sta-tionnaire. v est un vecteur ayant les vitesses des r´eactions du syst`eme.
Les principales m´ethodes bas´ees sur l’´etat stationnaire sont l’analyse des flux d’´equilibre ( flux balance analysis ), l’´etude des modes ´el´ementaires, et l’observation des voies extrˆemes.
Un flux est la vitesse de synth`ese ou de consommation d’un m´etabolite au niveau d’une r´eaction ou plusieurs r´eactions associ´ees dans un syst`eme m´etabolique. L’analyse des flux d’´equilibre consiste `a observer les flux m´etaboliques sous des contraintes de deux types :
des contraintes aux extrˆemes du syst`eme limitant l’apport du substrat de d´epart ou l’excr´etion du produit final
des contraintes internes qui limitent les flux internes du syst`eme
Cette analyse permet d’avoir une estimation de l’importance des flux dans le syst`eme `a l’´equilibre et dans des conditions particuli`eres.
Les modes ´el´ementaires (Schuster et al.(2002)) et les voies extrˆemes (Schilling et al. (2000)) utilisent le concept de chemin m´etabolique. Dans un organisme, plusieurs jeux de r´eactions permettent d’obtenir le mˆeme produit. Chacun de ces jeux forme un chemin m´etabolique. Un mode ´el´ementaire est un chemin m´etabolique unique au sein d’un r´eseau, d´ecrit `a l’´etat stationnaire :
un mode ´el´ementaire est constitu´e d’un nombre minimal de r´eactions et forme une unit´e fonctionnelle du r´eseau.
l’´elimination d’une r´eaction d’un mode ´el´ementaire rend caduque sa fonctionnalit´e. Les voies extrˆemes sont des sous-parties des chemins formant des modes ´el´ementaires. La d´etermination d’une voie extrˆeme repose sur les mˆeme r`egles qu’un mode ´el´ementaire avec deux particularit´es suppl´ementaires.
Les r´eactions internes au syst`eme sont d´ecompos´ees en deux r´eactions une sens et l’autre antisens
Une voie extrˆeme est unique, elle ne peut ˆetre repr´esent´ee par la combinaison d’autres voies extrˆemes pr´eexistantes du r´eseau.
Les modes ´el´ementaires et les voies extrˆemes permettent d’identifier tous les processus pos-sibles au sein d’un r´eseau m´etabolique, en tenant compte de sa topologie, de la stoechiom´etrie des r´eactions, leur sens et leur r´eversibilit´e.
Figure 1.13: Figure dePapin et al.(2004). Exemple d’un r´eseau m´etabolique avec ses modes ´el´ementaires et ses voies extrˆemes. Le r´eseau est compos´e de 3 m´etabolites, r´eactions internes et 3 r´eactions d’´echange(a). Le r´eseau poss`ede 4 modes ´el´ementaires (b) et 3 voies extrˆemes (c). La r´eaction d’´echange du m´etabolite A est r´eversible, elle est d´ecompos´ee en 2 r´eactions irr´eversibles dans le cas de voie extrˆeme (c).
Il existe une ´equivalence entre les modes ´el´ementaires et les voies extrˆemes de cet exemple : EIMo 1 = ExPa 1, EIMo 2 = ExPa 2, EIMo 3 = ExPa 3, EIMo4 = ExPa 1 + ExPa 2. Les mod`eles stationnaires permettent d’avoir une visualisation globale de l’intensit´e et de l’orientation des flux pr´esents au sein du m´etabolisme. Cependant, par leur nature, ces mod`eles ne peuvent pr´edire que le comportement des syst`emes `a l’´etat stationnaire.
Mod`ele dynamique
Un mod`ele dynamique, aussi appel´e mod`ele cin´etique, permet de donner une pr´evision du comportement du syst`eme durant un temps donn´e qui peut englober aussi bien l’´etat station-naire que l’´etat initial et la transition entre ces ´etats. La conception d’un mod`ele dynamique
repose, le plus souvent, sur l’identification et l’utilisation d’´equations diff´erentielles. Dans le cas d’un syst`eme m´etabolique, les ´equations diff´erentielles permettent de d´ecrire la concen-tration des diff´erents m´etabolites du syst`eme.La r´esolution de l’ensemble de ces ´equations permet la reproduction des diff´erents comportements du syst`eme.
Une r´eaction, dans un mod`ele dynamique, est d´efinie non seulement par les m´etabolites qui lui sont associ´es, mais aussi par sa vitesse. L’ensemble des vitesses de r´eactions est la base du mod`ele dynamique d’un syst`eme m´etabolique. En effet, l’int´egration dans le mod`ele d’une ´
equation donnant la vitesse permet le suivi dynamique des concentrations des m´etabolites du syst`eme. Chaque vitesse de r´eaction du syst`eme doit ˆetre retranscrit en une expression alg´ebrique, une loi cin´etique, fonction de la concentration des m´etabolites dans le temps. Cette loi cin´etique est une estimation de la vitesse r´eelle. Ainsi, la difficult´e d’identification de tel mod`ele r´eside dans l’utilisation d’une loi cin´etique la plus adapt´ee au cas de figure rencontr´e. Plusieurs lois cin´etiques ont ´et´e mises en place et souvent utilis´ees pour traduire une vitesse au sein d’une r´eaction. Parmi ces lois, nous trouvons :
la loi d’action de masse la loi de Michaelis-Menten
la loi de convenance cin´etique ( convenience rate law )
La loi d’action de masse a ´et´e d´etermin´ee en 1867 par les chimistes norv´egiens Cato Guldberg et Peter Waage. Elle associe les concentrations des m´etabolites `a l’´equilibre `a une constante KT qui d´epend uniquement de la temp´erature.
KT =
Y
[produit]/Y[substrat] Cette loi permet d’obtenir l’´equation de vitesse simple :
r = kYRvii r est la vitesse de r´eaction.
k est une constante de vitesse propre `a cette r´eaction.
Ri d´esigne les concentrations des r´eactifs et vi leur coefficient stœchiom´etrique en tant que r´eactif.
La loi d’action de masse est utilis´ee pour exprimer la cin´etique de r´eactions chimiques, mais elle reste insuffisante pour d´ecrire des r´eactions biochimques. En effet, elle ne tient pas compte du comportement de l’enzyme, elle ne d´ecrit pas les interactions enzyme-substrat(s) possibles.
La loi de Michaelis-Menten est issue des travaux de l’allemand Leonor Michaelis et de la canadienne Maud Menten en 1913. Elle est sp´ecifique aux r´eactions enzymatiques. Elle ´etablit un lien entre la vitesse de la r´eaction avec la concentration de substrat et des param`etres cin´etiques de l’enzyme utilis´ee. L’´equation de vitesse v pour une enzyme irr´eversible `a 1 substrat-1 produit est : A → B
v = kcat ∗ [E] ∗ [S] Km + [S]
kcat est la constante catalystique de l’enzyme qui donne la quantit´e de substrat transform´e par quantit´e d’enzyme en une unit´e de temps, en seconde g´en´eralement.
[E] et [S] sont les concentrations respectives d’enzyme et de substrat en mol/L.
Km est la constante de Michaelis, elle traduit l’affinit´e d’association d’une enzyme pour un substrat. Km est en mol/L.
Une cin´etique michaelienne peut aussi repr´esenter les enzymes r´eversibles, ayant des inhibi-teurs, et plusieurs substrats-produit.
La loi de convenance, publi´ee en 2006 par Liebermeister and Klipp (2006), est d´eriv´ee du mod`ele de Michaelis-Menten. La loi de Michaelis-Menten demande la connaissance d’un grand nombre de param`etres pas toujours disponibles. Le but de la loi de convenance est d’avoir un mod`ele proche de la loi de Michaelis avec des param`etres estim´es `a partir de lois de ther-modynamique. Ces param`etres sont facilement obtenus apr`es exp´erimentation en mesurant l’enthalpie libre de la r´eaction et en utilisant la constante d’´equilibre, Keq de la r´eaction. La loi de convenance permet de d´ecrire une grande partie des cas de figure couvert par un mod`ele Michaelis-Menten.
Le d´eveloppement des lois cin´etiques des r´eactions, selon les mod`eles ´enonc´es, n´ecessite la connaissance de diff´erents param`etres internes sp´ecifiques comme la constante d’affinit´e Km pour une loi de Michaelis-Menten. L’estimation de ces param`etres est essentielle pour repro-duire la cin´etique du syst`eme. La difficult´e de cette phase d’estimation est en lien direct avec la complexit´e du r´eseau m´etabolique `a simuler. Apr`es la d´etermination des lois cin´etiques de toutes les r´eactions, les ´equations diff´erentielles ainsi obtenues permettront de connaitre la concentration des m´etabolites `a chaque pas de temps.
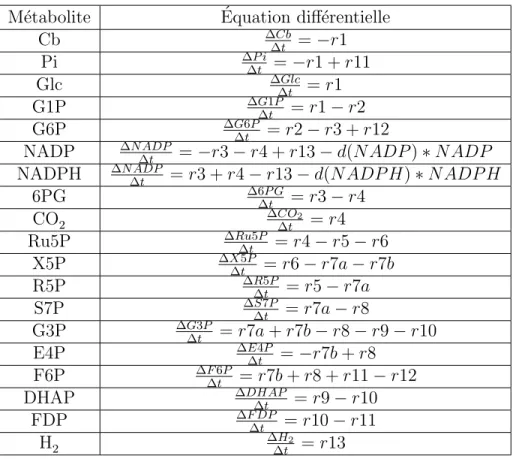
Soit la chaine de r´eactions suivante : A−−→v1
r1 B v2
−−→
r2 C
pour v2 issue de la loi cin´etique de r2. Le syst`eme a donc pour ´equations diff´erentielles : ∆A ∆t = −v1 ∆B ∆t = v1 − v2 ∆C ∆t = v2
Le mod`ele dynamique permet une reproduction du syst`eme de meilleure qualit´e, en terme de pr´ecision, que la m´ethode stationnaire. N´eanmoins elle n´ecessite de connaˆıtre les param`etres cin´etiques de chaque enzyme. Sur l’´evaluation d’un syst`eme m´etabolique complexe ou sur l’´etude du m´etabolome d’un organisme en entier, la recherche de ces param`etres peut ˆetre un point limitant de la mod´elisation dynamique. Ainsi bien que moins pr´ecis, le mod`ele stationnaire peut ˆetre plus facile `a identifier sur des r´eseaux de taille importante. Au sein de la m´ethode dynamique, le mod`ele michaelien demeure l’un des plus fid`eles et des plus exigeants `a mettre en place pour repr´esenter la cin´etique d’une r´eaction enzymatique.
1.6.2
Mod´
elisation syst´
emique
L’approche syst´emique consiste non pas `a analyser chaque entit´e ´el´ementaire du syst`eme, mais `a globaliser l’ensemble en parties fonctionnelles. Les interactions entre les sous-parties et l’environnement autour du syst`eme sont `a prendre en compte dans la mod´elisation. Une technique de l’approche syst´emique est d’accentuer la g´en´eralisation du syst`eme en le transposant `a une boite noire. L’´etude d’un syst`eme assimil´e `a une boite noire ignore totalement sa composition interne et consid`ere uniquement les interactions entre l’ext´erieur et la boite noire.
Figure 1.14: Syst`eme repr´esent´e sous la forme d’une boite noire. La constitution du syst`eme et ses interactions internes demeurent inconnues. L’identification de ce type de mod`ele n´ecessite la constitution de bases de donn´ees d´ecrivant les sorties mesur´ees en fonction de l’´evolution des entr´ees.
Les entr´ees et sorties du syst`eme sont les seuls ´el´ements connus et d´ecrits ; mais les entit´es in-ternes et les m´ecanismes internes impliqu´es pour passer de l’un `a l’autre restent ind´etermin´es. Cette approche est appliqu´ee dans de nombreux domaines comme la physique, la chimie, l’´economie, la biologie. Quelque soit le domaine, la d´emarche d’identification est la mˆeme. Cette approche est bas´ee sur l’empirisme et l’heuristique, elle n´ecessite d’avoir une base de donn´ees transcrivant l’´etat du syst`eme dans une situation r´eelle par rapport au ph´enom`ene de sortie `a mod´eliser. Cette approche se d´eroule en deux phases.
A partir de la base de donn´ee, une phase d’apprentissage permet d’estimer les pa-ram`etres du mod`ele qui reproduira un comportement similaire dans les conditions de la base de donn´ee initiale. Cette premi`ere base est d´esign´ee sous le terme de base d’ap-prentissage et elle d´ecrit le comportement du syst`eme suite `a l’application de diff´erentes conditions op´eratoires bien pr´ecises. Le mod`ele repr´esente les relations et les liens lo-giques entre les conditions et les comportements du syst`eme, repr´esent´es par les sorties, rencontr´es dans la base d’apprentissage.
Ensuite une phase de validation est r´ealis´ee en utilisant le mod`ele identifi´e et une deuxi`eme base. Cette base dite de validation comporte des conditions op´eratoires diff´erentes de la base d’apprentissage et les comportements associ´es `a ces conditions. Le but de cette phase est de pr´edire le comportement du syst`eme en utilisant le mod`ele pr´ec´edemment identifi´e. A partir de l’apprentissage effectu´e, le mod`ele d´eduit une es-timation du comportement du syst`eme dans les conditions de la base de validation. Le comportement pr´edit est ensuite compar´e au comportement r´eel, afin de savoir si la pr´ecision du mod`ele est acceptable. Dans le cas d’un ´ecart acceptable, le mod`ele est valid´e et il est apte `a ˆetre utilis´e pour effectuer d’autres pr´edictions.
Il existe une multitude de m´ethodes de mod´elisation syst´emique qui ont ´et´e utilis´ees dans un grand nombre de disciplines scientifiques. Ces diff´erentes m´ethodes ont une m´ethodologie bas´ee sur l’application d’une phase d’apprentissage et l’application d’une phase de validation, comme ´enonc´ee pr´ec´edemment. Ces m´ethodes diff`erent sur la mani`ere de structurer le mod`ele et d’estimer les param`etres du mod`ele. Nous pr´esentons la m´ethode par r´eseaux de neurones qui a ´et´e utilis´ee lors de nos travaux.
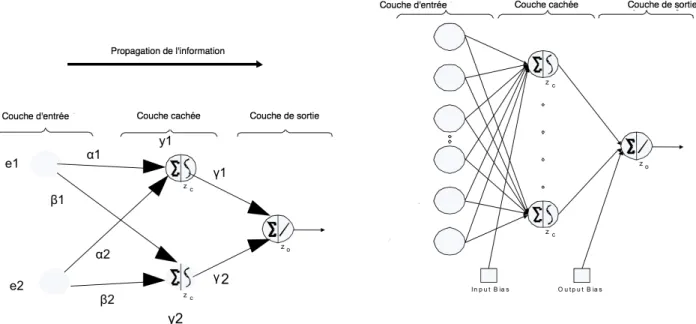
Les r´eseaux de neurones artificiels
Cette structure de mod`ele a ´et´e inspir´ee du syst`eme neuronal biologique. Les neurologues ont d´evelopp´e et con¸cu les premiers r´eseaux de neurones durant les ann´ees 1940-1950 (McCulloch
Figure 1.15: M´ethodologie appliqu´ee pour l’identification d’un mod`ele syst´emique. de plusieurs neurones formels. Un neurone formel est une unit´e de calcul ´el´ementaire r´ealisant deux op´erations, en analogie avec le comportement d’un neurone biologique qui fonctionne sur les deux phases suivantes :
le neurone est capable de recevoir les informations port´ees par un ou plusieurs signaux d’entr´ee et effectue une sommation de ces informations
le neurone analyse et traite cette somme de signaux pour ´emettre en r´eponse un signal de sortie r´esultant du traitement des signaux d’entr´ee.
Par analogie, le neurone formel r´ealise ces deux phases :
la r´eception des signaux d’entr´ee en une somme pond´er´ee, Σ,
le traitement de cette somme par une fonction d’activation, Fa, pour g´en´erer le signal de sortie
Chaque signal `a l’entr´ee d’un neurone est associ´e `a un coefficient de pond´eration afin de donner des poids diff´erents aux informations arrivant sur la cellule de calcul. Les signaux de sortie se dirigent vers l’entr´ee d’autres neurones formels ou vers l’ext´erieur du syst`eme. Les neurones formels sont assembl´es en r´eseau. Un assemblage classique est le r´eseau mul-ticouche d´eterministe, qui utilise une organisation de trois couches (voir fig. 1.17) selon le th´eor`eme de Hornik (Hornik(1991)) :