THÈSE
En vue de l’obtention du
DOCTORAT de L’UNIVERSITE de TOULOUSE
Délivré par : l’Université Toulouse III – Paul Sabatier
Spécialité : Développement des plantes
Présentée et soutenue par Marie NAVARRO Le 16 juillet 2009
Etude fonctionnelle de gènes de facteurs de
transcription CBFs impliqués dans la tolérance au
froid chez l’Eucalyptus.
JURY
M. DURAND-TARDIF Directeur de recherche, INRA, Versailles Rapportrice M. HERZOG Professeur, Université de Grenoble, Grenoble Rapporteur N. LEBORGNE-CASTEL Maitre de conférences, Université de Bourgogne, Dijon Examinatrice C. DUNAND Professeur, Université Paul Sabatier, Toulouse Examinateur C. TEULIERES Professeur, Université Paul Sabatier, Toulouse Directrice de thèse C. MARQUE Maitre de conférences, Université Paul Sabatier, Toulouse Co-directrice de thèse
Ecole Doctorale Sciences Ecologiques, Vétérinaires, Agronomiques, et Bioingénéries ERT 1045, 24 chemin de Borde Rouge BP 42617 Auzeville, 31326 Castanet-Tolosan, France
Remerciements à ceux sans qui cette thèse n’aurait pu exister...
Je voudrais, en tout premier lieu, remercier Chantal Teulières et Christiane Marque qui m’ont accueillie dans leur équipe et qui m’ont accordé leur confiance pendant ces quatre années. Leur disponibilité, leur qualité d’écoute, leurs paroles encourageantes et leur compétence m’ont été particulièrement précieuses. Elles m’ont aussi laissé l’autonomie et l’initiative, sans lesquelles je n’aurais pu acquérir la confiance en moi indispensable à l’élaboration de ce travail.
Je tiens à remercier les membres du jury, Mylène Durand-Tardif, Michel Herzog, Nathalie Leborgne-Castel, et Christophe Dunand qui ont accepté d’évaluer cette thèse.
J’aimerais formuler ma gratitude à toute l’équipe pédagogique qui m’a donné l’opportunité de découvrir et apprécier l’enseignement au cours de mon monitorat.
Vielen Dank à Dirk Hincha et Ellen Zuther de m’avoir accueillie chaleureusement dans leur équipe au Max Planck Institut de Gölm.
Merci à toutes les personnes de l’équipe qui ont participé, directement ou indirectement à ce travail. Merci à Walid qui m’a transmis son savoir-faire durant mon M2R. Une mention particulière à Gilles pour la qualité de ses conseils et ses légendaires « hum !?! », à Céline, ma binôme sous la lumière tamisée des hottes, et enfin à Julie qui a animé le bureau de toutes ses richesses! Merci à eux pour les instants partagés au labo et ailleurs...lors de soirées « à thèmes »!
Enfin, je voudrais adresser un grand merci à tous ceux qui sont essentiels à mon équilibre. Merci à mes parents qui m’ont constamment soutenue et encouragée à faire le métier que j’ai toujours eu envie de faire. Merci à mes neveux et nièces qui ont le don de me redonner le sourire en toutes circonstances (Adèle et Elise ont élaboré l’illustration de cette page, la consigne était : « dessine moi un arbre … »). Merci à mes amies, Lulu, Vané, Sab, Do, et Lise pour leurs inlassables encouragements et pour les moments de détente partagés.
Résumé
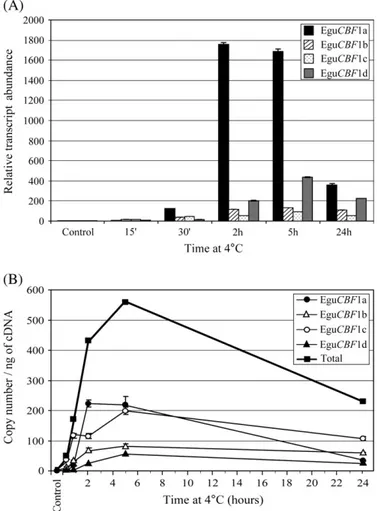
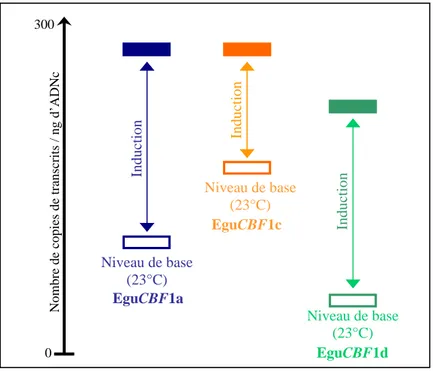
Les CBFs sont des facteurs de transcription de type AP2, considérés comme des éléments majeurs de la réponse au froid. Ils sont conservés entre les espèces végétales, mais leur régulation et la composition de leur régulon semblent influencer le niveau de tolérance au gel. L’Eucalyptus, arbre à feuilles persistantes très exposé au froid, met peut-être en œuvre des mécanismes de tolérance particuliers. Afin d’étudier chez ce ligneux les mécanismes mettant en jeu la voie CBF, une étude fonctionnelle a été réalisée sur quatre gènes CBFs d’Eucalyptus gunnii. L’analyse de l’expression de ces gènes par RTqPCR en réponse au froid a montré une régulation différentielle avec des profils complémentaires. L’obtention de lignées d’Eucalyptus surexprimant les gènes EguCBF1a ou 1b a prouvé la fonctionnalité des protéines correspondantes et révélé une différence d’efficacité entre les deux paralogues. En parallèle, le phénotypage des lignées transgéniques a apporté de premières informations sur des stratégies adaptatives de l’Eucalyptus et sur le lien entre la réponse au froid des EguCBF1s et le développement de la plante.
Abstract
CBFs genes are AP2 transcription factor demonstrated as key elements of cold response. Although highly conserved among species, their regulation as well as regulon composition are suggested to be important in the differential freezing tolerance. Eucalyptus as an evergreen tree is very exposed to cold and might develop particular frost tolerance mechanisms. In order to investigate on this woody plant the mechanisms involving the CBF pathway, a functional study was carried out on four Eucalyptus gunnii CBF genes. RTqPCR expression analysis under cold has shown a differential regulation with complementary profiles. Generation of EguCBF1a or 1b overexpressing transgenic lines has demonstrated the functionality of the corresponding proteins and revealed a different efficiency between the two paralogs under study. In parallel, the phenotyping of the transgenic lines provided first informations on the possible adaptative strategies of Eucalyptus and the relation-ship between the CBF cold response and plant development.
Liste des abbréviations
ABF : ABRE Binding FactorABA : Abscissic Acide ADNc : ADN complémentaire
AFOCEL : Association Foret CELlulose AFP : Antifreeze Protein
AP2 : Apetala 2
APX : Ascorbate Peroxidase bHLH : basic Helix Loop Helix bZip : Basic region leucine Zipper
CAMTA: Calmodulin Binding Transcription
Activator
CBF: C-repeat Binding Factor
CDPK: Calcium Dependent Protein Kinase CDS : Cu/Zn Superoxide Dismutase
COR : Cold Regulated
CRT/DRE : C-repeat/Dehydration Element Ct : Cycle threshold
DHN : Déhydrine
DREB : DRE Binding factor
ERF : Ethylene Responsive element binding factor EST : Expressed Sequence Tag
FCBA : Institut Foret Cellulose Bois et
Ameublement
GA: Gibbérelline
GA20ox : Gibberellin 20 oxydase GC-MS : Gas Chromatography-Mass
Spectrometry
GFP : Green Fluorescent Protein
eGFP : Enhanced Green Fluorescent Protein HC: Hydrophobic Cluster
HSP : Heat Shock Protein
ICE1: Inducer of CBF expression 1 IP3: Inositol triphosphate
LEA : Late Embryogenesis-Abundant Lti6 : Low Temperature Induced 6
LT50 : Lethal Temperature 50
LTRE : Low Temperature Responsive Element NLS : Nuclear Localization Signal
NPC : Nuclar Pore Complex NUP : Nucleoporin
ORF : Open Reading Frame PP: Phosphatase Protein QTL : Quantitative Trait Loci RAV : Releated to ABI3/VP1 RD : Responsive to Dessication ROS : Reactive Oxygen Species
RTqPCR : Reverse Transcriptase quantitative
Polymerase Chain Reaction
STA1 : Stabilized 1
SOD : SuperOxide Dismutase
ZIM : Zinc-finger protein expressed in
Sommaire
Introduction générale ____________________________________________
1I. Les végétaux face aux stress abiotiques_____________________________________ 2 I.1. Sécheresse, salinité, froid : quels éléments communs ? _____________________ 2 I.1.1. Dommages communs causés par ces stress abiotiques __________________ 2 I.1.2. Réponses communes de la plante face à ces stress abiotiques_____________ 3 I.2. La réponse complexe conduisant à la tolérance au froid ____________________ 5 I.2.1. Adaptation morphologique des plantes pérennes ______________________ 5 I.2.2. Adaptation physiologique : acclimatation et dormance__________________ 6 II. L’Eucalyptus, une essence tropicale pour étudier la tolérance au gel ? ____________ 8 II.1. L’Eucalyptus, le gommier bleu ou encore le « bien coiffé »_________________ 8 II.1.1. Classification _________________________________________________ 8 II.1.2. Description botanique___________________________________________ 8 II.2. L’étude des mécanismes de tolérance au gel de l’Eucalyptus : un intérêt
économique régional et un intérêt fondamental ______________________________ 9 III. Objectifs du travail de thèse ___________________________________________ 11
Chapitre 1 - Etude de la régulation des gènes CBFs d’Eucalyptus :
EguCBF1a, 1b, 1c, 1d ___________________________________________
12I. Les gènes impliqués dans la tolérance au gel _______________________________ 13 I.1. Perception et transduction du signal froid ______________________________ 13 I.2. Régulation: voie CBF, voie ABA dépendante et autres ____________________ 14 I.2.1. Voie CBF (voie ABA indépendante) _______________________________ 14 I.2.2. Voie ABA dépendante __________________________________________ 16 I.2.3. Autres voies __________________________________________________ 16 I.2.4. Régulations post-transcriptionnelles _______________________________ 17 I.3. Protection cellulaire : induction des gènes CORs_________________________ 18 I.3.1. Protection des membranes et des protéines __________________________ 19 I.3.2. Synthèse d’osmolytes___________________________________________ 20 I.3.3. Détoxification ________________________________________________ 21 II. Les CBFs : des facteurs de transcription AP2 ______________________________ 22 II.1. Les familles multigéniques CBF _____________________________________ 22 II.2. Les éléments conservés des facteurs de transcription AP2 _________________ 23 II.3. La régulation des gènes CBFs _______________________________________ 24 II.4. Les quatre gènes CBFs d’Eucalyptus _________________________________ 25 III. Résultats : Régulation des gènes EguCBF1s_______________________________ 26 IV. Conclusion ________________________________________________________ 56
Chapitre 2 - Surexpression des gènes EguCBF1a ou 1b chez E. urophylla x
E. grandis et Arabidopsis thaliana _________________________________
59I. La surexpression de gènes de facteur de transcription de type DREB et ERF ______ 60 I.1. La surexpression des gènes DREB et ERF comme outil d’amélioration des plantes de grande culture _____________________________________________________ 60 I.2. La surexpression des gènes DREB et ERF comme outil de compréhension des voies de régulation ___________________________________________________ 62
I.2.1. Les différents modes de surexpression, leurs intérêts __________________ 62 I.2.2. Interprétation des phénotypes observés _____________________________ 63 I.3. Effet de la surexpression des gènes DREB et ERF sur le développement et la croissance __________________________________________________________ 64
I.3.1. Les modifications de développement_______________________________ 64 I.3.2. Implication des gènes DREB et ERF dans le développement ? __________ 65 II. Surexpression des gènes EguCBF1a ou 1b chez E. urophylla x E. grandis: Résultats et discussion ____________________________________________________________ 68 II.1. Obtention des lignées transformées ___________________________________ 68 II.1.1. Efficacité de transformation _____________________________________ 69 II.1.2. Taux de régénération et pourcentage de bourgeons transformés (GFP+) __ 69 II.1.3. Efficacité finale de transformation ________________________________ 70 II.2. Sélection de la lignée contrôle, de 3 lignées surexprimant le gène EguCBF1a et 3 lignées surexprimant le gène EguCBF1b __________________________________ 70
II.2.1. Choix de la lignée vecteur vide ou lignée contrôle ___________________ 71 II.2.2. Choix des lignées transgéniques__________________________________ 71 II.2.2.1. Choix de trois lignées surexprimant le gène EguCBF1a _________ 72 II.2.2.2. Choix de trois lignées surexprimant le gène EguCBF1b____________ 73 II.2.2.3. Comparaison des lignées surexprimant le gène EguCBF1a ou 1b ____ 74 II.3. Analyse phénotypique des lignées transgéniques sélectionnées _____________ 75 II.4. Données complémentaires sur les 6 lignées sélectionnées _________________ 96 II.4.1. L’expression des gènes CBFs____________________________________ 96 II.4.2. Les autres gènes testés impliqués dans la tolérance au froid ____________ 96 III. Surexpression des gènes EguCBF1a ou 1b chez E. urophylla x E. grandis : Conclusions ___________________________________________________________ 99 IV. Surexpression des gènes EguCBF1a ou 1b chez Arabidopsis thaliana : Résultats 102 IV.1. Tolérance au gel ________________________________________________ 102 IV.2. Taux de germination ____________________________________________ 103 IV.3. Mesure de la croissance et du développement _________________________ 103 V. Surexpression des gènes EguCBF1a ou 1b chez Arabidopsis thaliana : Discussion et conclusion ___________________________________________________________ 104 VI. Conclusions _______________________________________________________ 106
Matériel et Méthodes ___________________________________________
114 I. Matériel végétal _____________________________________________________ 115 I.1. Arbres au champ _________________________________________________ 115 I.2. Plants en conditions contrôlées ______________________________________ 115 II. Mesure de la tolérance au froid sur les plants en conditions contrôlées__________ 116 II.1. Exposition des plants à des températures fraîches : l’acclimatation _________ 116 II.2. Estimation de la tolérance au gel : mesure de la fuite d’ions ______________ 116 III. Analyse d’expression _______________________________________________ 117 III.1. Extraction d’ARN ______________________________________________ 117 III.2. RTqPCR ______________________________________________________ 117 III.2.1. Synthèse d’ADNc ___________________________________________ 117 III.2.2. Amplification en temps réel ___________________________________ 117 III.2.3. Interprétation des résultats ____________________________________ 118 IV. Surexpression du gène EguCBF1a ou 1b chez l’E. urophylla x E. grandis en culture in vitro ______________________________________________________________ 119 IV.1. Construction des vecteurs ________________________________________ 119 IV.2. Transformation d’E. urophylla x E. grandis clone 201 __________________ 120 IV.3. Sélection des transformants _______________________________________ 120 V. Phénotypage des transformants E. urophylla x E. grandis____________________ 122 V.1. Détermination de la tolérance au froid _______________________________ 122 V.1.1. Estimation de la tolérance au gel ________________________________ 122 V.1.2. Programme d’acclimatation ____________________________________ 122 V.2. Détermination de la tolérance à la sécheresse __________________________ 122 V.3. Dosage des anthocyanes __________________________________________ 123 V.4. Microscopie ____________________________________________________ 123 V.4.1. Fixation des échantillons ______________________________________ 123 V.4.2. Observation de la surface des feuilles-MEB _______________________ 123 V.4.3. Observation à l’aide du microscope à épifluorescence _______________ 124 VI. Obtention et analyse de lignées d’Arabidopsis thaliana (Col 0) transgéniques ___ 125 VI.1. Culture d’A. thaliana ____________________________________________ 125 VI.2. Transformation d’A. thaliana (Col 0) et sélection des transformants _______ 125 VI.3. Stérilisation des graines __________________________________________ 125 VI.4. Phénotypage des A. thaliana transgéniques (T3)_______________________ 126 VI.4.1. Niveau de transgène _________________________________________ 126 VI.4.2. Croissance et développement __________________________________ 126 VI.4.3. Tolérance au gel ____________________________________________ 126Références bibliographiques _____________________________________
127Introduction générale
Introduction générale
I. Les végétaux face aux stress abiotiques
La sécheresse, le froid et la salinité des sols représentent un obstacle pour les espèces cultivées. Ces stress abiotiques entraînent une diminution de 70% du rendement des plantes de grandes cultures (Boyer 1982) via des altérations morphologiques et physiologiques. De ce fait, la compréhension des mécanismes de tolérance à ces stress constitue un enjeu économique majeur.
Les stress abiotiques présentent des éléments communs à la fois pour les dommages occasionnés et pour la réponse de la plante. Cependant, au-delà des mécanismes communs (présentés dans cette partie), la réponse à ces stress présente des spécificités. A travers les mécanismes mis en jeu lors d’un stress froid, nous en verrons un exemple.
I.1. Sécheresse, salinité, froid : quels éléments communs ?
Les différents stress abiotiques présentent des similitudes dans les dommages causés et les réponses mises en place par la plante.
I.1.1. Dommages communs causés par ces stress abiotiques
En réponse à la sécheresse, la salinité ou le froid, le ralentissement de la croissance observé permet à la plante de diminuer les effets du stress, par exemple par l’utilisation des réserves glucidiques pour la protection cellulaire ou par la réduction de la surface exposée au stress.
La sécheresse et l’excès de sel se traduisent par un stress osmotique qui entraîne un dérèglement de l’homéostasie et donc une fragilisation des membranes et des protéines. Le froid provoque aussi un stress osmotique dû à la formation de cristaux de glace dans l’apoplaste aboutissant à une sortie d’eau.
En outre, ces trois stress donnent lieu à un stress secondaire dû à l’accumulation d’espèces actives d’oxygène: le stress oxydatif. C’est le cas par exemple au cours d’un stress froid pendant lequel le déséquilibre entre la quantité de lumière reçue et l’énergie consommée par la photosynthèse (photoinhibition) entraîne la formation d’espèces actives d’oxygène.
Salinité Sécheresse
Froid Stress osmotique Stress oxydatif
- Déséquilibre de l’homéostasie. - Fragilisation des membranes et des
protéines.
Perception du signal et transduction Récepteurs
Messagers secondaires (Calcium, ROS, Inositol triphosphate) Ca2+ sensor
CDPKs, PPs
Régulation des gènes régulateurs Facteurs de transcription
(CBF/DREB, ABF, bZip, MYC, MYB, etc.)
Régulation des gènes effecteurs
LEA, HSP, Aquaporine, SOD, Synthèse de sucres simples, etc.
Rétablissement de l’équilibre osmotique Protection des membranes et des protéines
Détoxification
Tolérance au stress Adapté de Wang et al. 2003 Figure i-1 : Schéma général de la réponse des plantes aux stress abiotiques majeurs (sécheresse, froid et salinité des sols).
La sécheresse, la salinité et le froid induisent un stress osmotique et un stress oxydatif qui entraînent un déséquilibre de l’homéostasie et une fragilisation des membranes et des protéines. La perception puis la transduction du signal aboutissent à l’expression de gènes régulateurs qui eux-mêmes contrôlent les gènes effecteurs permettant la mise en place des mécanismes de tolérance aux stress.
ROS : Reactive Oxygen Species, CDPK: Calcium Dependent Protein Kinase, PP: Phosphatase Protein, CBF: C-repeat Binding Factor, DREB : DRE Binding factor, ABF : ABRE Binding Factor, LEA : Late Embryogenesis-Abundant, HSP : Heat Shock Protein, SOD : SuperOxide Dismutase.
Introduction générale
I.1.2. Réponses communes de la plante face à ces stress abiotiques
La sécheresse, la salinité ainsi que le froid se traduisent au niveau cellulaire par un stress osmotique et oxydatif. De ce fait, face aux différents stress abiotiques la plante met en place des mécanismes de tolérance qui impliquent parfois les mêmes voies de signalisation, conduisant aux mêmes stratégies de protection de la cellule. En effet, le rétablissement de l’équilibre osmotique, la protection des membranes et des protéines et la détoxification du milieu sont souvent les objectifs des stratégies de tolérance.
Un schéma de la réponse complexe (moléculaire et biochimique) des plantes face aux stress abiotiques est présenté dans la figure i-1. Le stress serait perçu par des récepteurs membranaires qui initient un signal, ensuite transmis par l’intermédiaire de second messager comme le calcium, les espèces actives d’oxygène ou bien l’inositol triphosphate. L’augmentation de calcium cytosolique est analysée par des senseurs de calcium qui provoquent une cascade de phosphorylation donnant lieu à l’activation des gènes impliqués dans la réponse au stress (régulateurs et effecteurs). Ces gènes permettent la mise en place de mécanismes pour la survie de la plante : rétablissement de l’équilibre osmotique, protection des membranes et des protéines, et détoxification par élimination des espèces actives d’oxygène.
La perception du stress donne lieu en parallèle à la production d’hormones comme l’ABA, l’acide salycilique et l’éthylène. Ces hormones conduisent à la mise en place de mécanismes de tolérance par des voies identiques ou parallèles à celles décrites ci-dessus.
Comment cette réponse commune se traduit-elle au niveau de la régulation des gènes de la réponse au stress ? Des analyses globales du transcriptome en réponse aux stress froid, à la sécheresse ou au sel mettent en évidence des régulations communes. Chez Arabidopsis thaliana, sur 407 gènes induits par le froid, la sécheresse et l’ABA, 20 sont communs aux trois stress (soit environ 4.9%) (Fig.i-2). Cependant, 26% des gènes induits par l’ABA, la sécheresse et le sel, ont une régulation commune. Il semble donc qu’il y ait des recouvrements plus importants entre les stress sel, ABA et sécheresse qu’entre les stress froid, ABA et sécheresse (Seki et al., 2002). Le même type d’étude réalisée chez le riz ou chez Brassica rapa mettent en évidence de la même manière des chevauchements entre les gènes induits en réponse aux stress abiotiques (Rabbani et al., 2003; Lee et al., 2008). L’ensemble de ces résultats suggère l’existence de points de convergence entre les voies de signalisation en réponse aux stress abiotiques (Fig.i-3). En effet, l’ABA apparaît comme principal point
Sécheresse (299 gènes au total) Froid (54 gènes au total) Sel (213 gènes au total) Sécheresse (299 gènes au total) ABA (245 gènes au total) ABA (245 gènes au total)
Fig i-2: Diagrammes de Venn décrivant les gènes régulés durant les stress abiotiques majeurs chez Arabidopsis thaliana (d’après Seki et al. 2002).
Plusieurs banques d’ADNc construites à partir de plantes soumises à différents stress, ont permis d’isoler 7000 gènes qui ont été déposés sur microarray. L’hybridation du microarray avec des ADNc issus de plantes soumises à un stress froid, sécheresse, sel ou ABA a permis de quantifier les gènes régulés en réponse à un stress spécifique ou de manière commune. Le nombre de gènes induits à un niveau supérieur à 5 sont indiqués entre parenthèses.
Froid
Sel
Sécheresse
ABRE
CRT/DRE Gènes effecteurs
(communs ou spécifiques)
DREB1/CBF DREB2 ABF
ABA
Fig i-3 : Schéma simplifié des voies de signalisation connues mises en jeu dans la réponse aux stress froid, sel et sécheresse.
Ces stress induisent des voies de signalisation qui ont des points de convergence. Chacun de ces stress induit une voie ABA indépendante et une voie ABA dépendante. Cette dernière fait intervenir des facteurs de transcription ABFs qui se fixent sur les éléments ABREs des promoteurs des gènes effecteurs afin de les induire.
En parallèle de la voie ABA dépendante, le froid induit les facteurs de transcription DREB1s ou CBFs qui se fixent sur les éléments CRT/DRE des parties promotrices des gènes effecteurs pour les activer. De même, les facteurs de transcription DREB2s, induits par le sel ou la sécheresse, se fixent sur les CRT/DRE et sont ainsi capables d’induire les gènes effecteurs.
ABA : Acide ABscissique, CBF: C-repeat Binding Factor, CRT/DRE: C-repeat/Dehydration Element, DREB: DRE Binding factor, ABFs: ABRE Binding Factor, ABRE: ABA Responsive Element.
Introduction générale
commun entre ces stress car pour chacun d’eux on connaît une voie de signalisation dépendante de l’ABA mais aussi une voie indépendante de l’ABA (Yamaguchi-Shinozaki and Shinozaki, 1994).
En réponse à un stress froid, la voie indépendante de l’ABA conduit à l’activation d’une famille de gènes de facteurs de transcription appelés les DREB1s (DRE Binding factor) ou CBFs (C-repeat Binding Factor), induisant à leur tour les gènes effecteurs en se fixant sur l’élément cis CRT/DRE (C-RepeaT/DehydRation Element) situé dans leur région promotrice (Stockinger et al., 1997). En parallèle, le froid induit une accumulation de l’hormone ABA qui conduit à l’expression des ABFs (ABA responsive element binding Factor) pouvant aussi induire les gènes effecteurs mais par l’intermédiaire d’une autre séquence cis: l’élément ABRE (ABA Responsive Element). La sécheresse entraîne également une augmentation de l’ABA qui conduit à l’induction des ABFs, mais aussi à une induction des DREB2s indépendante de l’ABA. Comme les CBFs, les DREB2s se lient à l’élément CRT/DRE afin d’induire les gènes effecteurs. Enfin les voies de signalisation connues en réponse à un stress salin sont proches de celles décrites en réponse à la sécheresse avec une induction des ABFs et des DREB2s. Ainsi, les DREBs semblent aussi être un carrefour possible entre les stress froid, sécheresse et sel (Liu et al., 1998; Sakuma et al., 2006).
Récemment, un lien entre tolérance au froid et sécheresse a été démontré par une étude sur deux clones d’Eucalyptus globulus dans laquelle le clone tolérant à la sécheresse est aussi plus tolérant au froid en comparaison au clone sensible (Costa e Silva et al., 2009). De plus, dans notre équipe nous avons aussi constaté un gain de tolérance au froid après un été très sec sur des E. gunnii au champ (Keller, 2006), illustrant encore un lien entre la tolérance aux différents stress abiotiques.
Au-delà de ce schéma général correspondant à la réponse à la déshydratation, chaque stress abiotique aboutit à des stratégies adaptatives spécifiques, comme par exemple la tolérance au froid.
Introduction générale
I.2. La réponse complexe conduisant à la tolérance au froid
Les températures froides se divisent en deux catégories: le chilling correspondant aux températures fraîches et positives (< 15°C) et le freezing correspondant aux températures gélives (< 0°C). Ces deux types de froid peuvent affecter la croissance et le développement de la plante ainsi que sa répartition géographique. Les plantes d’origine tropicale ou subtropicale sont souvent sensibles au chilling alors que les plantes issues de milieu tempéré tolèrent le chilling et sont plus ou moins tolérantes au gel.
Au-delà de l’effet osmotique, le gel affecte les cellules principalement au niveau du système membranaire, par les blessures mécaniques dues aux cristaux de glace et par une rigidification due au froid.
La tolérance au froid est la résultante de la tolérance intrinsèque (de base) et de la tolérance induite appelée acclimatation. Le niveau de la tolérance de base dépend de la mise en place, au cours de l’évolution des espèces, d’adaptations lentes et progressives ayant des conséquences morphologiques. Par ailleurs, l’acclimatation correspond à une adaptation rapide et transitoire, initiée par la baisse saisonnière des températures et de la photopériode (cf paragraphe I.2.2).
Le niveau de tolérance au froid dépend des stratégies mises en œuvre : l’évitement et/ou l’adaptation. La première consiste à éviter l’exposition au froid, c’est le cas par exemple lorsque les plantes entrent en dormance, ou perdent leurs feuilles. Les stratégies adaptatives visent dans tous les cas à limiter les conséquences dues au stress froid.
I.2.1. Adaptation morphologique des plantes pérennes
Les plantes persistantes d’altitude ou vivant dans un environnement froid sont souvent de petite taille. En effet, le nanisme permet de garder les parties végétatives dans les couches d’air les plus chaudes se trouvant près du sol, et réduit également l’exposition au vent. Ainsi, certains ligneux comme le myrtillier ou le laurier rose ont un port buissonnant qui leur permet de mettre à profit l’effet positif de la densité des branches (Dhanaraj et al., 2004). Par ailleurs, les conifères, par exemple, ont développé le nanisme au niveau des feuilles qui sont réduites à l’état d’aiguilles.
Les plantes très exposées au froid développent d’autres stratégies d’évitement comme la protection des bourgeons et de l’appareil végétatif. Par exemple, la cuticule épaisse et isolante qui recouvre les aiguilles des conifères les protège contre le gel et empêche
Introduction générale
l’accumulation d’eau qui pourrait initier la formation de glace. En limitant l’évapotranspiration, la cuticule sert également à éviter la déshydratation. Chez les arbres à feuilles caduques, seuls le tronc et les branches sont exposés au froid et les bourgeons sont recouverts d’écailles. Chez l’Eucalyptus, seuls les bourgeons de réserve, à l’arrêt végétatif, sont isolés du froid par leur localisation sous l’écorce et les lignotubers, ce qui permet un rejet de souche lorsque toute la partie aérienne est tuée par le gel. D’autre part, la cuticule protège les feuilles matures des espèces les plus tolérantes au froid.
I.2.2. Adaptation physiologique : acclimatation et dormance
La diminution de la photopériode à l’automne entraîne l’arrêt de la croissance et l’entrée en dormance chez de nombreuses plantes pérennes. On distingue deux types de dormance : l’éco- et l’endo-dormance. La première est régulée par les conditions environnementales, qui provoquent l’entrée en dormance (début de l’automne) et la fin de la dormance (fin de l’hiver/début du printemps). Entre ces deux périodes, la plante est en endodormance, les variations rapides des conditions extérieures n’ont plus d’influence sur la croissance, seule une exposition longue à des températures fraîches permet la levée d’endodormance (fin de l’hiver). Dès que les conditions sont favorables la plante, alors en écodormance, peut reprendre sa croissance.
La réduction du jour (longueur et intensité) initie la dormance chez la majorité des plantes pérennes ainsi que l’acclimatation au froid, autre stratégie adaptative qui permet d’augmenter transitoirement la tolérance au froid en réponse à une exposition durable à des températures fraîches. Durant cette période des mécanismes de protection se mettent en place. Chez les herbacées, l’acclimatation est un phénomène très rapide (12 jours à 4°C), alors que chez les ligneux, elle est plus lente mais permet de tolérer des froids plus intenses (Gilmour et al., 1998; Welling and Palva, 2006). La plupart des études sur les arbres ont été faites sur des espèces comme le bouleau ou le peuplier qui entrent en dormance dès la diminution de la photopériode (Li et al., 2005). Étant donné que la dormance et l’acclimatation sont contrôlées en partie par les mêmes facteurs environnementaux, et que la dormance contribue à l’augmentation de la tolérance au froid, il est difficile d’étudier l’un sans l’influence de l’autre.
Les arbres à feuilles persistantes comme le citronnier, l’oranger ou l’Eucalyptus sont particulièrement exposés au froid. Chez les agrumes, les bourgeons entrent en dormance l’hiver, contrairement à l’Eucalyptus chez qui seuls les bourgeons de réserve sont en
Introduction générale
dormance jusqu’à ce qu’un stress intense lève cet arrêt végétatif. De ce fait ce ligneux est particulièrement intéressant pour étudier l’acclimatation sans interférence avec ce phénomène de dormance. L’Eucalyptus est donc un bon modèle pour étudier la tolérance au gel mais aussi le lien entre les mécanismes de tolérance au froid et le développement. En effet, sa croissance est continue et varie selon les conditions de température et la disponibilité en eau : c’est un arbre opportuniste.
Introduction générale
II. L’Eucalyptus, une essence tropicale pour étudier la tolérance au
gel ?
II.1. L’Eucalyptus, le gommier bleu ou encore le « bien coiffé »
Le genre Eucalyptus comprend plus de 700 espèces réparties sur toutes les zones climatiques de l’Australie (sauf la forêt tropicale humide). Cependant 12 espèces sont retrouvées en dehors de cette aire d’origine et seulement une, n’y est pas représentée.
II.1.1. Classification
Les Eucalyptus sont des angiospermes dicotylédones de la famille des Myrtacées. Le terme Eucalyptus fait généralement référence aux genres Eucalyptus, Corymbia et Angophora. La principale classification est celle de Pryor et Johnson qui définit 7 sous-genres sur la base de caractères morphologiques et l’absence d’infertilité (Pryor and Johnson, 1971). C’est depuis 1995 que Corymbia n’a plus été considéré comme un sous-genre du genre Eucalyptus mais comme un genre à part entière.
L’hybride naturel « E. gundal » (E. gunnii x E. dalrympleana) utilisé dans ce travail, appartient au sous genre des Symphyomyrtus, section des Maidenaria. Ce sous-genre est le plus important en nombre d’espèces et comprend la majorité des espèces cultivées.
II.1.2. Description botanique
J.H. de la Billardière découvre le gommier bleu, E. globulus, en 1792 au sud de la Tasmanie. Ce nom fait allusion à la gomme résineuse que l’arbre exsude quand il est blessé. La couleur bleue est caractéristique du feuillage.
C’est un botaniste français, Charles Louis L'héritier de Brutelle, qui décrit et nomme le genre Eucalyptus. Dans son étymologie grecque eu signifie «bien» et kaluptos « couvert » ou «coiffé». Le bouton floral est en effet recouvert d’un opercule, constitué de pétales soudés, il tombe lorsque la fleur s’épanouit, laissant apparaître les étamines colorées (Fig.i-4A). L’inflorescence des Eucalyptus est le plus souvent sous forme d’ombelle. Le fruit est une capsule lignifiée qui contient des graines en général petites pour faciliter la dispersion par le vent. La fécondation se fait préférentiellement de manière croisée entre deux individus distincts (allogamie).
E D
C B
A
Figure i-4: Organes d’Eucalyptus
A : bouton floral; B : lignotuber ; C : tronc d’Eucalyptus gunnii (Longages, France) ; D : feuilles d’Eucalyptus gunnii âgées (Lectoure, France) ; E : feuilles d’Eucalyptus gunnii jeunes (Lectoure, France).
B
D C
A
Figure i-5: Les différentes formes de l’Eucalyptus.
A : buisson (E. kruseana, jardin de maranoa, Melbourne) ; B : « mallee » (E. pileata, Ouest de l’Australie) ; C : E. rubida poussant en plaine ; D : peuplement forestier (E. grandis, USA).
Introduction générale
Un Eucalyptus adulte peut, suivant les espèces, se présenter comme un petit buisson ou un arbre de grande taille avec un port plus ou moins étalé selon qu’il appartient à un peuplement forestier ou qu’il pousse en plaine de façon isolée. Le terme anglophone « mallee » désigne les Eucalyptus présentant plusieurs troncs partant d’un même lignotuber (Fig.i-5).
Le lignotuber est un organe souterrain lignifié présent chez la plupart des espèces (Fig.i-4B). Il se caractérise par sa richesse en réserves énergétiques et la présence de nombreux bourgeons végétatifs (Hignard, 1998). Lorsque la récolte, le feu ou le gel entraînent la destruction de la partie aérienne de l’arbre, le lignotuber permet de produire des rejets feuillus abondants.
L’écorce de la plupart des espèces est lisse et tombe par lambeau tous les ans ce qui donne au tronc une couleur souvent chamarrée (Fig.i-4C).
Comme chez tous les autres végétaux appartenant à la famille des myrtacées, les feuilles d’Eucalyptus sont couvertes de glandes huileuses qui pourraient être une protection contre les insectes et champignons, un moyen de stocker du CO2 ou de limiter
l’évapotranspiration. Récemment, une fonction de stabilisation des membranes suite à un stress de déshydratation a été évoquée.
Le feuillage des Eucalyptus présente un dimorphisme entre le feuillage juvénile et le feuillage adulte. Les feuilles jeunes sont rondes ou ovoïdes, opposées alors que les feuilles âgées sont plus allongées et alternes (Fig.i-4D et E). Ces deux types de feuillage peuvent être présents sur un même arbre, en même temps.
II.2. L’étude des mécanismes de tolérance au gel de l’Eucalyptus : un intérêt économique régional et un intérêt fondamental
Avec 19 millions d’hectares de plantation dans le monde, l’Eucalyptus est le feuillu le plus planté au monde (16% des plantations forestières). La majeure partie des plantations se situent en Inde et au Brésil (FAO, 2000). En Europe, on trouve 1.4 millions d’hectares qui sont essentiellement de l’E. globulus planté au Portugal et en Espagne.
L’intérêt économique de l’Eucalyptus repose sur sa croissance rapide avec des rotations courtes de 8 à 10 ans, et une plus forte production que celle du peuplier. De plus, ses qualités papetières le rendent aussi très attractif : son rendement papetier (quantité de bois
Introduction générale
utilisée/ quantité de pâte produite) est bon, ces fibres contiennent peu de lignine, elles sont de bonne qualité et de bonne longueur.
En région Midi Pyrénées, la société TEMBEC utilise à hauteur de 14% l’Eucalyptus comme essence pour la fabrication de la pâte à papier, un dixième provenant des plantations régionales, le reste étant importé. Le programme d’implantation de l’Eucalyptus en Midi Pyrénées, initié par l’AFOCEL (aujourd’hui FCBA) en 1972, a été freiné par le gel de 1985 qui a décimé les populations. Un programme de recherche, soutenu par le Conseil Régional de Midi Pyrénées (auquel participe l’ERT1045-Equipe de Rechercher Technologique-), est mené depuis 2002 afin d’améliorer la tolérance au froid de l’Eucalyptus dans le but d’implanter 10 000 hectares et d’assurer ainsi l’approvisionnement de l’usine de Saint Gaudens.
Un des objectifs de notre équipe est de fournir des marqueurs moléculaires de la tolérance au froid au sélectionneur FCBA afin d’assister les programmes de sélection dont le papetier bénéficiera.
En amont de toute stratégie de recherche de marqueurs, basée sur la stratégie « gène candidat », il est nécessaire de mener une recherche fondamentale qui, ici, vise à comprendre les mécanismes moléculaires spécifiques de la tolérance au froid de l’Eucalyptus (une espèce très différente des modèles herbacées).
L’Eucalyptus est un arbre à feuilles persistantes et sans dormance. Il est donc exposé au froid de manière continue durant l’hiver. Il fait partie des espèces qui sont capables de s’acclimater. Il est possible que l’Eucalyptus utilise des stratégies particulières par rapport à des plantes herbacées (produisant des graines au moment de l’hiver et dont la partie végétative persistante est très réduite) ou par rapport à certaines plantes pérennes (mettant en place des stratégies d’évitement comme la dormance ou la perte des feuilles pendant l’hiver). De ce fait, la recherche fondamentale menée sur la tolérance au froid de l’Eucalyptus peut permettre de mettre à jour de nouveaux mécanismes adaptatifs en réponse au froid.
Introduction générale
11
III. Objectifs du travail de thèse
L’équipe ERT1045 a adopté une démarche qui conjugue la recherche fondamentale et appliquée. La compréhension des mécanismes de tolérance au froid de l’Eucalyptus conduit à la mise en évidence de gènes « candidats » qui pourront être utilisés pour la recherche de marqueurs moléculaires comme outil de sélection. Mon travail a concerné l’étude des mécanismes de tolérance au froid qui mettent en jeu la voie CBF, considérée comme majeure dans cette réponse.
Notre équipe a isolé 4 gènes CBFs d’E. gunnii (El Kayal et al., 2006; Navarro et al., 2009) ayant une similarité avec le gène CBF1 d’A. thaliana : EguCBF1a-d. L’objectif de ma thèse a été de réaliser une étude fonctionnelle de ces gènes. En premier lieu, l’étude de l’expression de ces gènes a permis l’analyse de leur régulation par le froid et par d’autres stress. Dans un deuxième temps, la génération de lignées in vitro d’Eucalyptus surexprimant le gène EguCBF1a ou 1b a permis d’évaluer l’impact de ces gènes sur la tolérance au stress et sur le développement. En parallèle, ces deux gènes CBFs ont été surexprimés chez A. thaliana afin de comparer l’effet des CBFs d’Eucalyptus avec ceux d’autres espèces déjà introduits dans cette plante modèle.
Cette approche a pour but de confirmer l’implication des CBFs dans la tolérance au froid mais aussi de mettre en évidence des différences entre la voie CBF de l’Eucalyptus et les voies CBF connues comme celles des herbacées ou bien des arbres à feuilles caduques qui entrent en dormance. Sans ces stratégies d’évitement, l’Eucalyptus doit mettre en place des mécanismes de tolérance particuliers par rapport à ceux développés par les espèces déjà étudiées.
Chapitre 1 - Etude de la régulation des gènes CBFs
d’Eucalyptus : EguCBF1a, 1b, 1c, 1d
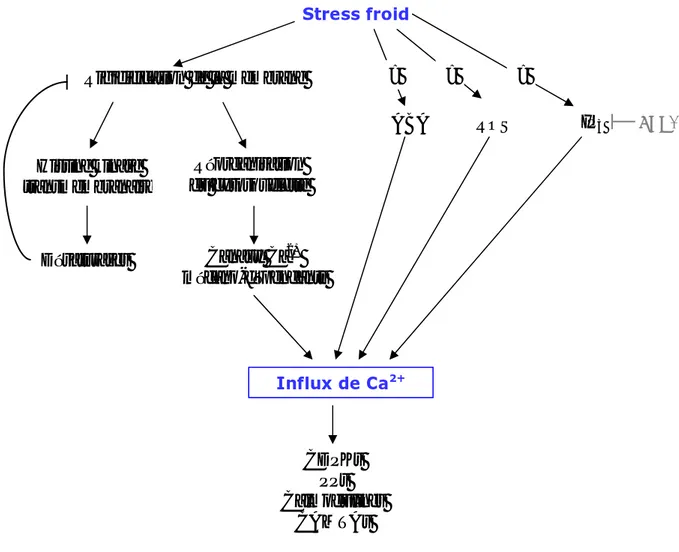
Stress froid Histine kinase transmembranaire Rigidification de la membrane Réorganisation du cytosquelette Canaux Ca2+ mécano-dépendants Influx de Ca2+ Désaturases ABA ROS IP3 ? ? ? FRY1 CDPKs PPs Calmodulines CAMTAs
Figure I-1 : Hypothèses de perception et transmission du signal stress froid.
Lors d’un stress froid, un influx de calcium est observé mais le lien entre cet évènement et la perception du froid n’est pas encore élucidé. Plusieurs hypothèses sont avancées, basées sur la modification des propriétés de la membrane qui la rendent moins fluide, ou bien sur l’implication de l’ABA, de l’IP3 ou des espèces actives d’oxygène. L’influx de calcium est ensuite détecté par des senseurs comme les CDPKs, les PPs, les calmodulines ou les CAMTAs qui permettent la transduction du signal afin d’induire les gènes impliqués dans la tolérance au stress froid.
ABA : Acide ABscissique, ROS : Reactive Oxygen Species, IP3: Inosotol triphosphate, CDPK: Calcium Dependent Protein Kinase, PP: Phosphatase Protein, CAMTA: CAlModulin binding Transcription Activator.
Chapitre 1 - Etude de la régulation des gènes CBFs d’Eucalyptus : EguCBF1a, 1b, 1c, 1d
I. Les gènes impliqués dans la tolérance au gel
Pour qu’une plante mette en place des mécanismes efficaces de tolérance au froid il faut (i) tout d’abord que les températures basses soient perçues, (ii) puis que le signal soit transmis afin de réguler les gènes appropriés, (iii) et enfin que les protéines soient synthétisées pour limiter les dommages causés par le froid.
I.1. Perception et transduction du signal froid (Fig.I-1)
La membrane est considérée comme un élément de perception du stress froid (Uemura et al., 2006). La perte de fluidité membranaire est un des effets directs et précoces de la baisse des températures et cette modification de la fluidité serait à l’origine de l’induction des gènes impliqués dans la réponse au froid, comme décrit chez alfalfa (Örvar et al., 2000).
L’influx de calcium, dû à l’activation des canaux calciques mécano-dépendants est observé de manière très précoce après un stress froid (Monroy and Dhindsa, 1995). Il serait associé à une réorganisation du cytosquelette (Örvar et al., 2000), en rapport avec la perte de fluidité de la membrane.
Les espèces actives d’oxygène ainsi que l’ABA pourraient être aussi impliqués dans la variation de calcium associée au stress froid (Chinnusamy et al., 2007).
Murata et Los suggèrent qu’un changement de conformation d’une histidine kinase suite à la perte de fluidité membranaire permettrait l’activation d’une désaturase (Murata and Los, 1997). Chez Arabidopsis une histidine kinase qui répond au froid a été isolée (Urao et al., 1999).
Bien que le changement d’état de la membrane semble jouer un rôle essentiel dans la perception du stress via la modulation de la quantité de calcium, les protéines intégrant ce changement ne sont pas encore identifiées.
Outre le calcium, un autre messager secondaire semble être important dans la réponse au stress froid : l’Inositol 1.4.5-triphosphate (IP3). Le mutant fiery1 (fry1) d’Arabidopsis,
déficient pour une enzyme impliquée dans le catabolisme de l’IP3, présente une tolérance
réduite au froid, à la sécheresse et à l’excès de sel. De plus, en réponse à l’ABA, la quantité d’IP3 accumulée chez ce mutant est plus élevée que chez le sauvage. La tolérance aux stress
Chapitre 1 - Etude de la régulation des gènes CBFs d’Eucalyptus : EguCBF1a, 1b, 1c, 1d
abiotiques serait donc liée à la quantité d’IP3 (Xiong et al., 2001). L’intervention de l’IP3
comme second messager dans cette réponse n’est pas en contradiction avec le rôle du calcium puisqu’il a déjà été montré qu’il pouvait influencer les variations de calcium (Allen et al., 1995).
Le calcium joue donc un rôle important dans la signalisation du stress froid, mais le lien entre la perception et l’influx de calcium n’est pas encore clairement établi.
L’influx de calcium cytosolique est perçu par différents senseurs comme les calmodulines, les protéines kinases calcium dépendantes (CDPK) et les protéines phosphatases (PP). En effet, W7 (N-(aminohexyl)-5-chloro-1-naphthalenesulfonamide) un antagoniste des CDPK et des calmodulines empêche l’acclimatation au froid d’A. thaliana (Tahtiharju et al., 1997). Une protéine kinase C (PKC), une CDPK, ainsi que des phosphatases comme CNB like protein (CBL, Calcineurin B-Like), synthétisées en réponse au froid ont été identifiés chez les plantes (Sharma et al., 2005). Cependant la relation entre l’influx de calcium, les cascades de phosphorylation et la régulation des gènes impliqués dans la tolérance au froid n’est pas encore totalement élucidée.
De récents travaux sur les CAMTAs (CAlModulin binding Transcription Activator), protéines qui se lient aux calmodulines, montrent leur importance dans la réponse au froid puisqu’elles feraient le lien entre les modifications de concentration en calcium et l’induction des gènes CBFs (Doherty et al., 2009). En effet, CAMTA3 chez Arabidopsis induit le gène AtCBF2 en se fixant sur des éléments cis de type CG-1. Ces éléments cis sont de plus très abondants sur les séquences promotrices des gènes induits de manière précoce en réponse au froid comme AtCBF1. Cependant, ils ne sont pas retrouvés sur le gène AtCBF3.
I.2. Régulation: voie CBF, voie ABA dépendante et autres
I.2.1. Voie CBF (voie ABA indépendante)
La voie impliquée dans l’acclimatation au froid la plus décrite chez Arabidopsis est la voie CBF (aussi appelé DREB1).
Chez Arabidopsis, les gènes CBFs répondant au froid sont au nombre de trois : AtCBF1-3 (Stockinger et al., 1997; Gilmour et al., 1998). Induits dès 15 min après le stress froid, ils provoquent la régulation des gènes cibles par fixation sur l’élément cis
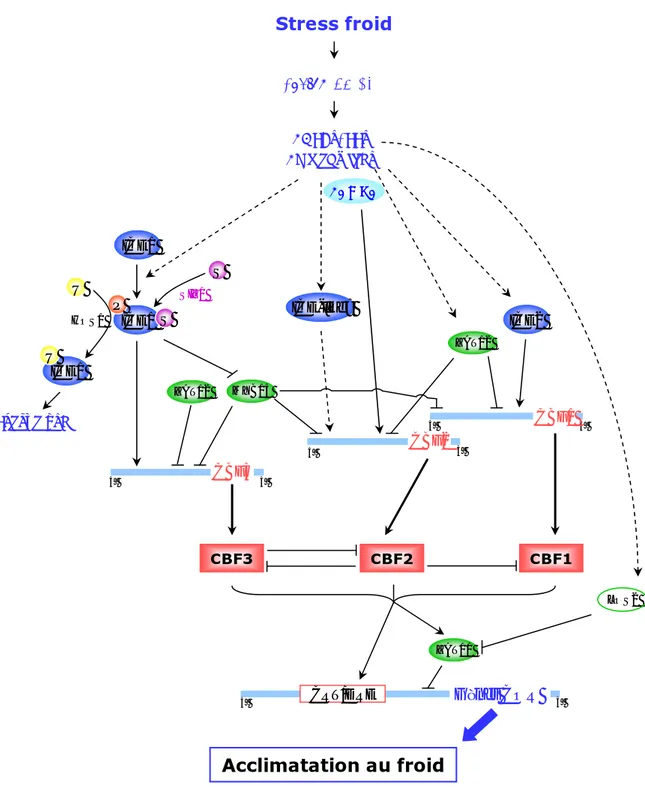
Stress froid Influx de Ca2+ CDPKs, PPs Calmodulines ICE1 ICE1 P U ICE1 U S S Protéolyse ICE2 ICE-like? SIZ1 CBF2 CBF1 CBF3 5’ 3’ 5’ CBF2 5’ 3’ 3’ MYB15 ZAT12 Gènes COR 5’ CRT/DRE 3’ ZAT10 LOS2 CBF3 CBF1 ZAT12 CAMTA Acclimatation au froid HOS1
d’après Chinnusamy et al. 2007
Figure I-2 : Schéma de la voie CBF, voie majeure dans la réponse au froid.
CDPK : Calcium Dependant Kinase Protein, PP: Phosphatase Protein, ICE1: Inducer of CBF expression 1, S: sumoylation, P: phosphorylation, U: ubiquitination, CAMTA: Calmodulin binding Transcription Activator, CBF: C-repeat Binding Factor, CRT/DRE: C-repeat/Dehydration Element.
Chapitre 1 - Etude de la régulation des gènes CBFs d’Eucalyptus : EguCBF1a, 1b, 1c, 1d
LTRE/CRT/DRE (Low Temperature Responsive Element/ C-RepeaT/Dehydration Element) situé sur leur séquence promotrice (Fig.I-2). L’ensemble de ces gènes potentiellement régulés par un CBF est appelé « régulon CBF ».
Les événements entre la cascade de phosphorylation déclenchée par l’influx de Ca2+ cytosolique et l’induction des gènes CBFs sont encore peu connus par rapport aux mécanismes en aval des gènes CBFs. Chez Arabidopsis, la description des premiers éléments révèle l’implication d’autres facteurs de transcription agissant sur les membres de la famille AtCBF mais aussi des régulations croisées entre les AtCBFs.
Régulation positive des gènes CBFs :
Le gène AtCBF3 est régulé de manière positive par le facteur de transcription de type bHLH, ICE1 (Inducer of CBF expression 1) qui se lie aux éléments MYC du promoteur du gène AtCBF3 (Chinnusamy et al., 2003). ICE1, exprimé de manière constitutive, est activé par phosphorylation lors du stress froid (Zhu et al., 2007). L’activité de ICE1 est régulée négativement par HOS1, une ubiquitin E3 ligase qui entraîne sa protéolyse (Dong et al., 2006). Lors d’un stress froid, la protéolyse est empêchée par la sumoylation d’ICE1 en particulier par SIZ1, une SUMO E3 ligase (Miura et al., 2007).
En plus de cette régulation du gène AtCBF3 par ICE1, Fursova et al. ont récemment isolé chez A. thaliana un autre facteur de transcription ICE2 et posent l’hypothèse qu’il régule de manière positive le gène CBF1 d’A. thaliana (Fursova et al., 2009). Chez le blé, 2 facteurs de transcription ICE exprimés de manière constitutive, interagissent avec des éléments MYC du promoteur du gène TaCBFIV in vitro (Badawi et al., 2008). Lorsque ces 2 facteurs de transcription ICE sont surexprimés chez A. thaliana, ils activent les gènes AtCBFs et augmentent la tolérance au gel.
Régulation négative des gènes CBFs :
Le premier régulateur négatif des CBFs isolé a été ZAT12, le facteur de transcription de type C2H2 à doigt de zinc. La surexpression de ZAT12 entraîne la réduction de l’expression des gènes CBFs au cours d’un stress froid (Vogel et al., 2005).
Le facteur de transcription MYB15 se lie aux trois gènes CBFs d’A. thaliana pour réprimer leur expression mais il est régulé de manière négative par ICE1 (Agarwal et al., 2006).
L’analyse du mutant nul cbf2 montre qu’AtCBF2 régule de manière négative l’expression des gènes AtCBF1 et 3 pendant l’acclimatation (Novillo et al., 2004).
Chapitre 1 - Etude de la régulation des gènes CBFs d’Eucalyptus : EguCBF1a, 1b, 1c, 1d
Par ailleurs, l’étude du mutant ice1 révèle que la réduction observée de l’expression du gène AtCBF3 est associée à l’induction du gène AtCBF2, ce qui suggère une régulation négative d’AtCBF3 sur le gène AtCBF2 (Chinnusamy et al., 2003).
Ces 2 derniers résultats mettent en évidence une régulation croisée entre les gènes AtCBFs par voie indirecte car aucun élément CRT/DRE n’a été retrouvé sur les promoteurs des gènes AtCBFs.
Régulation négative du régulon CBF :
In vitro ZAT10 est capable de réprimer l’expression du gène RD29a (gène cible des CBFs) (Lee et al., 2005). ZAT10 est lui-même régulé de manière positive par les CBFs et de manière négative par LOS2 (une enolase) (Maruyama et al., 2004).
I.2.2. Voie ABA dépendante
Il est reconnu que l’ABA joue un rôle majeur dans la réponse aux stress abiotiques. Si l’importance de cette hormone est établie dans la réponse à la sécheresse, son implication dans la réponse au stress froid n’est pas claire. L’application d’ABA exogène entraîne l’induction de gènes répondant à la sécheresse et au froid. Cependant, certains gènes sont induits par le froid mais pas par l’ABA (Yamaguchi-Shinozaki and Shinozaki, 2006).
L’analyse de la séquence promotrice des gènes répondant à l’ABA a mis en évidence la présence de cis éléments ABRE (ABA responsive element). Les facteurs de transcription qui sont capables de s’y lier sont appelés ABFs (ABRE binding factor). Parmi ceux isolés chez Arabidopsis (ABF1-4), seulement ABF1 et 4 sont induits par le froid après 24h de traitement (Choi et al., 2000). La surexpression d’un des 4 gènes ABFs d’A. thaliana entraîne une hypersensibilité à l’ABA et pour les gènes ABF3 et 4 une augmentation de la tolérance au froid (Kang et al., 2002; Kim and Zhang, 2004). De même le gène HvABI5 (isolé chez le blé), induit par le froid dès 15 min, lorsqu’il est surexprimé chez le tabac donne aux plantes transgéniques une meilleure tolérance au froid (Kobayashi et al., 2008).
I.2.3. Autres voies
L’analyse globale d’expression génique chez Arabidopsis a montré que 12% des gènes répondant au froid sont régulés par les CBFs ce qui met en évidence l’existence de voies indépendantes des CBFs (Fowler and Thomashow, 2002). Par ailleurs, des mutants
Chapitre 1 - Etude de la régulation des gènes CBFs d’Eucalyptus : EguCBF1a, 1b, 1c, 1d
caractérisés pour une meilleure tolérance au stress froid ne présentant aucune modification de la voie CBF, permettent de confirmer l’existence de voies parallèles à celle des CBFs :
- Le mutant d’A. thaliana eskimo1 est tolérant au gel de manière constitutive (Xin and Browse, 1998). Plus récemment Bouchabke-Coussa et al. ont observé une meilleure tolérance au gel du mutant esk1 seulement après acclimatation (Bouchabke-Coussa et al., 2008). La différence entre ces deux résultats pourrait venir des conditions de test, en culture in vitro pour les premiers travaux et sur des plantes en pot pour les plus récents. Dans ces derniers les auteurs posent l’hypothèse qu’ESKIMO1 intervient dans la gestion de l’eau lors d’un stress abiotique.
- La mutation du facteur de transcription R2R3 MYB, hos10 entraîne la diminution de la tolérance au froid, sans impact sur l’expression des gènes CBFs mais avec une réduction de l’expression de quelques gènes du régulon CBF. La diminution de la tolérance au froid est certainement due à une incapacité du mutant à initier la synthèse d’ABA en réponse au froid (Zhu et al., 2005).
- Dans le mutant hos9, l’expression des gènes CBFs n’est pas modifiée mais certains gènes CORs (COld Regulated factor) sont plus induits que chez le sauvage en réponse au stress froid (Zhu et al., 2004). HOS9 code un facteur de transcription (protéine à homéodomaine) qui régule l’expression des gènes répondant au froid indépendamment de la voie CBF.
- Enfin, chez le soja, un facteur de transcription de type C2H2 à doigt de zinc appelé SCOF1 induit certains gènes CORs. SCOF1 permettrait une meilleure liaison d’un autre facteur de transcription SGBF1 (bZIP) sur les motifs ABREs (Kim et al., 2001).
I.2.4. Régulations post-transcriptionnelles
Ces régulations regroupent : le contrôle de l’épissage, la stabilité des ARNs et le transport des ARNs du noyau vers le cytoplasme. Des études récentes sur ce sujet suggèrent l’importance de ces mécanismes dans la réponse au froid.
Chez Arabidopsis, le mutant sta1 est hypersensible au chilling. STA1 (Stabilized1) est un régulateur de l’épissage de COR15, il est induit en réponse au froid et exprimé dans le noyau (Lee et al., 2006).
L’export de l’ARN du noyau vers le cytoplasme fait intervenir un complexe NPC (Nuclear Pore Complex) qui est constitué de protéines appelées NUP (Nucleoporin). Ces protéines sont connues chez les animaux, et des homologues ont été identifiés chez
Chapitre 1 - Etude de la régulation des gènes CBFs d’Eucalyptus : EguCBF1a, 1b, 1c, 1d
Arabidopsis, notamment AtNUP160 qui pourrait jouer un rôle dans l’acclimatation au froid. En effet lorsque ce gène est inactif, l’induction de gènes impliqués dans la tolérance au froid est réduite et en particulier celle des CBFs (Dong et al., 2006). L’analyse du mutant los4 sensible au chilling a révélé l’implication d’une DEAD-box RNA hélicase dans le transport des ARNs et la tolérance au froid qui pourrait aussi jouer un rôle de chaperonne (Gong et al., 2002).
Enfin, les microARNs sont impliqués dans la régulation négative des gènes régulés par le froid, et la majorité des études les concernant ont été effectuées sur Arabidopsis. Les microARNs miR393, miR397b et miR402 sont induits lors d’un stress froid alors que le miR389 est réprimé. Les cibles connues de ces microARNs sont des E3 ubiquitin ligase et F-box protéines, impliquées dans la protéolyse ou le métabolisme des sucres (Sunkar and Zhu, 2004). Par ailleurs le miR389, réprimé, a pour cible des CDS (Cu/Zn superoxide dismutase) impliqués dans les mécanismes de détoxifaction cellulaire (Sunkar et al., 2006).
En outre, le groupe de microRNA miR169 est induit par le froid et pourrait être régulé par les CBFs en raison de la présence d’élément LTRE sur leur séquence promotrice. Ces microARNs réprimeraient les facteurs de transcription ZIM (Zinc-finger protein expressed in Inflorescence Meristem) impliqués dans l’élongation cellulaire (Zhou et al., 2008).
L’ensemble de ces voies conduisent à la régulation de gènes impliqués dans la tolérance au froid, qui sont appelés les gènes CORs.
I.3. Protection cellulaire : induction des gènes CORs
La diminution des températures entraîne la formation de cristaux de glace sur la surface de la feuille, mais aussi dans l’apoplaste, occasionnant des blessures (Pearce, 2001). A cause de la formation de ces cristaux, le gel conduit à un stress osmotique (déshydratation), à un stress mécanique (blessures sur la membrane), puis à un stress oxydatif.
En réponse au froid, les gènes sont donc impliqués dans la limitation de la formation de cristaux de glace, la protection des membranes et des protéines, la synthèse d’osmolytes et d’antioxydants.
Dans notre équipe, une banque d’ADNc issus de feuilles acclimatées d’Eucalyptus (plantules et arbres aux champs) a été réalisée (Keller, 2006; Keller et al., 2009). Les gènes
Tableau I-1 : Gènes CORs identifiés chez Eucalyptus gunnii à partir d’une banque d’ADNc construite à partir de feuilles d’arbres et de plantules acclimatés (Keller et al., 2009).
Catégories de gènes CORs Gènes identifiés chez Eucalyptus gunnii
Protection des membranes et des protéines
Class I endochitinase-antifreeze protein Chloroplast ω-6 fatty acid desaturase LEA
Dehydrin Pollen coat
Heat shock protein, HSP70 DNAJ heat shock protein
Synthèse d’osmolytes β-amylase Fructose-1.6-biphosphatase Sucrose synthetase Galactinol synthase α-galactosidase P5CS Détoxification Catalase Glutathion transferase Iron superoxide dismutase Thioredoxin family protein Metalothionein
Chapitre 1 - Etude de la régulation des gènes CBFs d’Eucalyptus : EguCBF1a, 1b, 1c, 1d
isolés, présentés dans le tableau I-1, appartiennent aux principales catégories fonctionnelles déjà décrites dans la littérature.
I.3.1. Protection des membranes et des protéines
Les protéines antigel ou AFP (Antifreeze protein) sont sécrétées dans l’apoplaste et possèdent des domaines hydrophiles qui leur permettent de se fixer sur les cristaux de glace limitant ainsi leur taille et inhibant la recristallisation (Griffith and Yaish, 2004). Elles sont induites en réponse au froid et ne semblent pas être régulées par l’ABA (Griffith and Yaish, 2004).
La déshydratation de la cellule au cours d’un stress froid est limitée par la fermeture des canaux à eau (les aquaporines) qui pourraient jouer un rôle dans la tolérance au froid en maintenant la turgescence. Chez l’Eucalyptus, le gène PiP2-1, codant une aquaporine située dans la membrane plasmique, a été isolé à partir de culture cellulaire exposée au froid (El Kayal, 2004).
Les membranes, une des premières cibles du froid, subissent une perte de fluidité liée au passage à un état semi-cristallin. Pour limiter cette altération des membranes, de nombreux végétaux accumulent des phospholipides insaturés et des stérols libres (Uemura et al., 2006; Upchurch, 2008). En effet, l’induction de gènes codant des désaturases a été corrélée avec l’acclimatation au froid et la tolérance au gel chez de nombreuses espèces herbacées et ligneuses comme le rhododendron ou le bouleau (Martz et al., 2006; Wei et al., 2006). Dans notre groupe, il a été montré que, grâce à une plus grande liberté de rotation des lipides, le plasmalemme et le tonoplaste d’un génotype d’E. gunnii tolérant au froid sont plus fluides que ceux d’un génotype sensible (Leborgne et al., 1992).
Les déhydrines appartiennent à la famille des LEAs (Late Embryogenesis-Abundant) qui constitue la plus grande classe des gènes CORs connus. Ce sont de petites protéines hydrophiles accumulées en réponse à différents stress abiotiques et à l’ABA qui serviraient à protéger la cellule contre les effets de la déshydratation. Beaucoup contiennent dans leur promoteur la séquence LTRE/CRT/DRE, ce qui suggère leur appartenance au régulon CBF.
Dans une banque d’ADNc construite à partir de feuilles de Rhododendron acclimatées au froid, les déhydrines et autres LEAs sont parmi les gènes les plus abondants alors qu’aucun
Chapitre 1 - Etude de la régulation des gènes CBFs d’Eucalyptus : EguCBF1a, 1b, 1c, 1d
d’eux n’est présent dans une banque construite à partir de feuilles non acclimatées (Wei et al., 2005). Elles sont également très abondantes dans la collection d’ESTs issue de feuilles d’Eucalyptus acclimatés au froid (Keller et al., 2009).
Si leur implication dans la tolérance au froid est établie, leur fonction n’est pas encore clairement définie. Il a été montré que les déhydrines pouvaient avoir un rôle de cryoprotection et d’antigel (Wisniewski et al., 1999; Hara et al., 2001). Le rôle des déhydrines a aussi été mentionné dans la stabilisation des membranes et du cytosquelette (Reyes et al., 2005; Abu-Abied et al., 2006). Récemment, un rôle de protéine chaperonne a été mis en évidence (Kovacs et al., 2008). L’ensemble de ces résultats suggère que les déhydrines sont capables d’interagir avec les protéines et les membranes pour les stabiliser lors d’un stress. Les déhydrines semblent aussi avoir la capacité de lier de l’eau et des ions pendant un stress de déshydratation (Tompa et al., 2006). Elles pourraient agir comme un tampon pour limiter la sortie d’eau de la cellule. Enfin, Hara et al. proposent l’interaction d’une déhydrine de Citrus avec les acides nucléiques dans le but de les stabiliser lors d’un stress froid (Masakazu Hara, 2009).
Enfin, les protéines de choc thermique ou HSP (Heat Shock Protein) sont des protéines chaperonnes qui aident au repliement, à l’assemblage et au transport des protéines. Souvent induites par la chaleur, certaines le sont aussi par le froid et protégeraient ainsi les protéines de la dénaturation et de l’agrégation (Sung et al., 2001).
I.3.2. Synthèse d’osmolytes
Les composés solubles peuvent jouer un rôle d’osmolytes ou de cryoprotection des membranes et des protéines. Les osmolytes les plus connus sont la proline, la glycine bétaïne et les sucres simples (Kamata and Uemura, 2004; Hincha, 2006).
Différents sucres simples sont synthétisés en réponse au froid et sont corrélés à la tolérance au gel des végétaux. La dégradation de l’amidon, le métabolisme du saccharose et les oligosaccharides de la famille du raffinose sont les 3 principaux éléments connus pour être impliqués dans la tolérance au froid (Klotke et al., 2004; Kaplan et al., 2006; Korn et al., 2008). Dans notre équipe, le contenu en sucres totaux a été corrélé au niveau de tolérance au gel de différents génotypes d’Eucalyptus (Leborgne et al., 1995a). En outre, il a été observé que des sucres solubles et plus particulièrement le fructose, le raffinose et le saccharose
Chapitre 1 - Etude de la régulation des gènes CBFs d’Eucalyptus : EguCBF1a, 1b, 1c, 1d
s’accumulent lors de l’exposition au froid d’arbres dans la nature, de plants en conditions contrôlées et de cultures cellulaires d’E. gunnii (Teulières et al., 1989; Leborgne et al., 1995a). Il a été montré que ces sucres agissaient plutôt par un effet cryoprotecteur et non osmoprotecteur (Leborgne et al., 1995a; Travert et al., 1997).
Les acides aminés comme la proline, sont impliqués dans la tolérance au froid. Dans notre équipe, le contenu en proline a, en effet, été corrélé à la tolérance au froid chez l’Eucalyptus (Teulières, 1990). D’autre part, lorsque le gène de la P5CS (intervenant de la voie de biosynthèse de la proline) est surexprimé chez le tabac, le taux de proline élevé observé est corrélé à une augmentation de la tolérance au gel (Konstantinova et al., 2002). Chez l’Eucalyptus le gène codant une P5CS a été isolé à partir d’une culture cellulaire exposée au froid (El Kayal, 2004).
I.3.3. Détoxification
L’action antioxydante fait intervenir les enzymes comme la catalase, superoxide dismutase (SOD), ascorbate peroxidase (APX) et la glutathione reductase, mais aussi des molécules sans activité enzymatique comme l’ascorbate, le glutathion, les caroténoïdes et les anthocyanes (Wang et al., 2003).
L’ensemble de ces mécanismes de protection contribuerait à la fois à la tolérance de base (en l’absence de stress) et à la tolérance induite (acclimatation). Ils sont induits par l’ensemble des voies décrites plus haut. La part de ces gènes induits par les CBFs, c'est-à-dire appartenant au régulon CBF, est estimée à une trentaine de gènes chez Arabidopsis thaliana répartis dans toutes les classes présentées ici.
Chez l’Eucalyptus, l’analyse de la banque d’ADNc a mis en évidence plusieurs gènes appartenant aux catégories décrites ci-dessus (Tab.I-1) et a révélé une expression particulièrement forte en réponse au froid des gènes codant des métallothionéïnes, des pollen coat (qui font parties des LEAs) et des déhydrines (Keller et al., 2009).
Chapitre 1 - Etude de la régulation des gènes CBFs d’Eucalyptus : EguCBF1a, 1b, 1c, 1d
II. Les CBFs : des facteurs de transcription AP2
La voie CBF est considérée comme la plus importante dans la réponse au froid pour essentiellement trois raisons (Van Buskirk and Thomashow, 2006):
- Les gènes CBFs sont retrouvés dans toutes les plantes supérieures étudiées (cf.II.1). - La surexpression d’un gène CBF augmente dans la plupart des cas la tolérance au froid (cf deuxième chapitre).
- Un QTL de tolérance au froid a été identifié chez Arabidopsis et explique 20% de la variabilité d’acclimatation entre deux accessions Cvi et Ler. La position de ce QTL est fortement liée à celle des gènes AtCBF1/2/3 d’A. thaliana (Alonso-Blanco et al., 2005).
II.1. Les familles multigéniques CBF
Le séquençage du génome d’A. thaliana a permis de déterminer que la famille comprend 6 gènes CBFs. Les 3 premiers sont disposés en tandem sur le chromosome 4 alors que le gène CBF4 se situe sur le chromosome 5 et les gènes CBF5 et 6 (appelés aussi AtDDF1/2) sont positionnés sur le chromosome 1. Les gènes CBF1/2 et 3 sont induits surtout par le froid, le CBF4 par la sécheresse et les CBF5 et 6 sont induits par un stress salin.
De nombreux gènes CBFs ont été isolés chez près de 60 genres de dicotylédones et monocotylédones. Le nombre de gènes CBFs au sein d’une famille chez les dicotylédones est relativement restreint avec un maximum de sept chez Brassica napus alors qu’il peut atteindre 25 chez une monocotylédone comme le blé (Badawi et al., 2007). Cette variabilité dans la taille de la famille CBF est essentiellement liée à la complexité du génome des monocotylédones.
Concernant les ligneux, les premières données sur les CBFs ont été apportées par une étude fonctionnelle sur le merisier (Prunus avium) (Kitashiba et al., 2004). Puis, notre équipe a isolé les 2 premiers gènes CBFs d’Eucalyptus (E. gunnii) EguCBF1a et EguCBF1b (El Kayal et al., 2006). Par la suite, des gènes CBFs ont été isolés chez le peuplier (6 CBFs), le bouleau (4 CBFs), la vigne (4 CBFs), l’Eucalyptus (E. globulus, 1 CBF), et le citronnier (4 CBFs) (Benedict et al., 2006; Xiao et al., 2006; Champ et al., 2007; Gamboa et al., 2007; Welling and Palva, 2008; Xiao et al., 2008).
Figure I-3 : Arbre phylogénétique représentant les facteurs de transcription à domaine AP2 chez les végétaux (Sakuma et al., 2002).
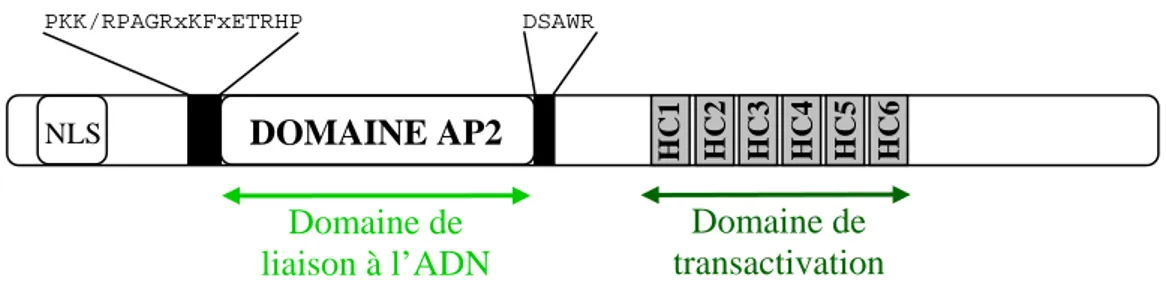
PKK/RPAGRxKFxETRHP DSAWR HC6 HC5 HC4 HC3 HC2 HC1 DOMAINE AP2 NLS Domaine de transactivation Domaine de liaison à l’ADN
Figure I-4 : Représentation schématique de la protéine CBF1 d’Arabidopsis thaliana de la partie N-terminale à la partie C-terminale.