T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
DO
OC
CT
TO
O
RA
R
A
T
T
DE
D
E
L’
L
’
UN
U
NI
IV
V
ER
E
RS
SI
IT
TÉ
É
DE
D
E
TO
T
OU
UL
LO
OU
US
SE
E
Délivré par L’Université Toulouse III – Paul SabatierDiscipline ou spécialité : Radiophysique et imagerie médicale
JURY
Roland Peyron – PH Rapporteur Laurent Machet – PU/PH Rapporteur Isabelle Berry – PU/PH Présidente Michèle Allard - PU/PH Examinatrice Christine Brefel-Courbon MCU/PH Examinatrice Pierre Celsis – DR Inserm Directeur David Black – phD Membre invité
Ecole doctorale : GEET
Unité de recherche : INSERM UMR 825 Directeur(s) de Thèse : Pierre Celsis
Rapporteurs : Roland Peyron et Laurent Machet
Présentée et soutenue par Laure Bergeret Le 26 Avril 2010
Etude en TEP – H
215O, des bases cérébrales de la sensation
prurigineuse, induite par la technique d’iontophorèse à l’histamine, et
de sa modulation par une tâche cognitive.
1
A mes parents, ma sœur,
Ma grand-mère
2
Remerciements
Je remercie Pierre Celsis, en tant que directeur de l’unité de m’avoir accueillie dans son laboratoire mais aussi en tant que directeur de thèse pour m’avoir accordé sa confiance, m’avoir guidée et faite évoluer tout au long de cette thèse.
Je voudrais remercier David Black, co-directeur « non-officiel », pour son aide durant ce travail de thèse, sa disponibilité, son écoute et son grand sens de l’orientation qui nous a aidés dans Tokyo.
Je remercie M. Roland Peyron et M. Laurent Machet d’avoir accepté de juger ce travail et d’en être les rapporteurs.
Je remercie Mme Michèle Allard et Mme Christine Brefel-Courbon d’avoir accepté de faire partie de ce jury.
Je remercie Mme Isabelle Berry d’avoir accepté de faire partie du jury et d’en être la présidente. Merci à Florent Aubry avec qui tout a commencé lors de mon stage de DEA.
Merci à toute l’équipe du centre TEP et plus particulièrement à Gérard Viallard et Hélène Gros. Merci pour votre aide et votre soutien au centre TEP puis au pavillon Guitard, merci pour votre « coaching » pour les présentations.
Je voudrais aussi remercier Nicolas Chauveau et Chantal Blanchard pour leur aide dans cette thèse. Merci à Irène Delcroix et Martine Penault pour la gestion administrative.
Je tiens à remercier Anne-Marie Schmidt de m’avoir accueillie dans ses locaux de l’Hôtel Dieu et d’avoir financé cette collaboration avec Pierre Fabre.
Merci aussi à Jennifer Theunis avec qui j’ai eu plaisir à collaborer tout au long de ce travail. Merci à toutes les autres personnes du CERPER que j’ai rencontrées lors de mes quelques séjours à l’Hôtel Dieu.
Merci à Laurent Misery pour son aide sur le projet.
Merci à Hideki Mochozuki d’avoir accepté d’envoyer son matériel pour les expériences. Merci à tous les volontaires qui ont accepté de participer à cette étude.
Mes remerciements vont maintenant à tous mes amis.
Merci à Cécile et Elodie parfois mes coéquipières de volley parfois mes adversaires et quelque soit la situation mes amies. Merci de votre soutien et pour toutes nos discutions « volleyistiques » et autres. Je vous souhaite beaucoup de bonheur dans vos nouvelles vies de maman. Merci aussi à Kamel et Abdel pour votre soutien.
Merci à Marie et Coralie qui m’ont « dévergondée » pendant ces années de bio et j’en suis bien heureuse, merci pour tous ces bons moments passés et je suis sure que c’est loin d’être fini.
Merci à Justine ma dentiste attitrée, et ma copine de galères. Merci pour toutes nos discutions sur notre sujet préféré…
3
Merci à toutes mes amies d’enfance : Florence, Laure, Emilie, Lucie, Bénédicte, Géraldine qui font que le proverbe « loin des yeux loin du cœur » sonne faux,
Merci à Léo, je garde pleins de bons souvenirs en ta compagnie depuis Formath jusqu’à mon baptême de plongée. Merci pour ta bonne humeur.
Merci à Lydia « ma petite suisse », pour tous ces moments de fous rires que ce soit en soirées ou au camping. Merci pour ta bonne humeur qui est un vrai regain d’énergie.
Merci à toutes mes coéquipières et mon coach du volley de Balma Quint Fonsegrives. Un merci tout particulier à Lauren, Oriane, Anne Sophie et Rislène.
Merci à tous ceux que j’ai découvert depuis mon arrivée sur Toulouse et avec qui j’ai des souvenirs inoubliables merci à : Floriane dit Patanem, Aurélie, Mathieu, Manu, Antoine, Anne Cécile, Olivier alias Pépito, Camille, Florence, Alex, Hugo, Jaafar, la Super Bom Crew Family et la Kung Fu family.
Merci à tous les étudiants du labo qui m’ont aidée et ont supporté mes « râleries » quotidiennes. Merci à Giovanni, Fabrice, Julien, Olivier, Rodolphe, Stephanie qui, comme moi, ont cru qu’ils connaitraient un jour « Baudot ». Merci à Yoni et Mickael je n’oublierai jamais notre séjour sur Lyon et surtout le retour. Merci aussi à Deborah le joli rossignol, Estelle la schokobons addict, Caro notre danseuse, Seb aux maladies étranges, et Perrine l’exclue du pavillon Guitard. Merci aussi à Nathalie, Laure, Mélanie pour les bons moments lors des repas du midi et merci à la petite Estelle.
Merci à Mélanie, Evelyne et Perrine pour notre amitié au-delà du labo.
Je tiens à remercier Sébastien, je suis heureuse que le labo nous ait « connectés », merci pour ton soutien et ta « zénitude » quelque soit la situation,
Je tiens enfin à remercier ma famille.
Merci Catherine pour tous tes conseils de grande sœur toujours utiles, merci d’avoir été là malgré la distance, de m’avoir écoutée et soutenue dans mes projets. Merci à Baptiste, mon filleul, et Jeanne, ma nièce, même si vous ne vous en rendez pas compte vous avez apporté beaucoup de joie et de soutien à votre « tata Laure ». Merci Pierre d’avoir accueilli tant de fois ta belle sœur pour qu’elle puisse se reposer…. et ce n’est pas fini.
Merci à mes parents, je sais que sans vous je ne serais jamais arrivée jusque là. Merci d’avoir cru en moi et de m’avoir aidée à réaliser mes rêves. Merci pour les valeurs que vous m’avez apprises … je vous admire et ne vous remercierez jamais assez.
4
SOMMAIRE
Introduction ... 11
Etat de l’art ... 14
I - Généralités ... 15
A - Définition ... 15 B - Classification ... 16a - Classification basée sur l’origine ... 17
b - Classification basée sur les modifications cutanées ... 18
C - Epidémiologie et étiologie du prurit... 19
D - La dermatite atopique ... 20
II - Induction expérimentale d’un prurit ... 22
A - Evaluation de la sensation ... 22
a - Réactions cutanées ... 22
b - Evaluation par les échelles ... 23
c - Evaluation par les questionnaires ... 24
d - Grattage nocturne ... 25
e - Imagerie cérébrale ... 26
B - Induction chimique ... 27
a - Les différentes techniques ... 27
b - Les différentes molécules ... 30
C - Induction électrique ... 34
a - Electrique ... 34
b - Neurometer ... 36
D - Induction psychologique ... 36
III - De la peau au cerveau : voie de la démangeaison ... 38
A - Le système sensoriel cutané : généralités ... 39
a - Les constituants de la peau ... 39
5
B - Circuits neuronaux de la démangeaison ... 43
a - De la peau à la moelle épinière pour l’histamine ... 43
b - Relais dans la moelle épinière ... 44
c - Circuits pour d’autres pruritogènes ... 45
C - Les médiateurs de la démangeaison ... 46
a - L’histamine (Wallengren 2005) ... 47
b - Autres médiateurs (Wallengren 2005) ... 49
c - Cas de la dermatite atopique (Stander, Steinhoff et al. 2003; Wallengren 2005) ... 50
IV - Les aires cérébrales du prurit ... 52
A - Les différentes aires cérébrales et leur rôle ... 52
a - Fonctions cérébrales ... 52
b - Les différentes aires cérébrales ... 53
B - Les aires de la démangeaison : étude en IRMf et TEP ... 55
a - Dimension sensorielle et émotionnelle du prurit ... 58
b - Dimension cognitive : attention et préparation au mouvement ... 62
c - Aspect moteur... 65
d - Autres aires impliquées ... 66
e - Activations ipsi/contro ou bilatérales ... 69
f - Activations suite aux allergènes ... 70
C - Etude temporelle de la sensation de démangeaison ... 71
D - Cas de la dermatite atopique ... 71
V - La modulation ... 73
A - Théorie du « gate control » ... 73
B - Différentes modulations du prurit ... 74
a - Modulation chimique ... 74
b - Modulation mécanique ... 76
c - Modulation électrique ... 77
d - Modulation thermique ... 78
e - Cas d’un prurit chronique : la dermatite atopique ... 79
6
a - Modulation de la douleur ... 80
b - Modulation de la démangeaison ... 83
D - Intérêt de l’étude des modulations en imagerie ... 86
Partie expérimentale ... 88
I - Méthodologie... 89
A - La technique d’iontophorèse ... 89
a - La barrière cutanée ... 89
b - Intérêt de la technique d’iontophorèse ... 90
c - Principe de la technique ... 90
d - Facteurs influençant le transport par iontophorèse ... 92
e - L’iontophorèse et le prurit ... 93
B - La tomographie par émission de positons : TEP ... 97
a - Bases neurophysiologiques de l’imagerie cérébrale ... 97
b - Fonctionnement de la TEP ... 99
c - Analyse des images acquises ... 101
II - Validation du modèle d’induction ... 104
A - Choix du modèle et objectifs ... 104
B - Matériel ... 105 a - Description du matériel ... 105 b - Paramètres de stimulation ... 108 C - Protocole expérimental ... 109 a - Sujets ... 109 b - Déroulement de l’étude ... 109 D - Résultats ... 111 a - Etudes statistiques ... 111
b - Effet de la zone de stimulation ... 113
c - Effet du rang... 115
d - Dynamique de la sensation ... 118
e - Tests complémentaires de classification ... 121
7
E - Conclusion – Discussion ... 122
III - Modulation de la sensation prurigineuse par une tâche cognitive ... 126
A - Intérêts et objectifs de l’étude ... 126
B - Matériel ... 128
a - Induction de la démangeaison... 128
b - Tâche de Stroop visuel des couleurs ... 128
C - Protocole expérimental ... 130 a - Les sujets ... 130 b - Déroulement de l’étude ... 130 D - Résultats ... 136 a - Résultats comportementaux ... 136 b - Résultats de neuroimagerie... 138 E - Discussion ... 149 a - Résultats comportementaux ... 149
b - Activations spécifiques à la démangeaison sans Stroop ... 150
c - Activations spécifiques à la démangeaison avec Stroop ... 154
d - Différences d’activations dans le réseau de la démangeaison entre les deux conditions avec et sans Stroop ... 155
e - Etude de corrélations ... 157
F - Conclusions ... 159
IV - Etude exploratoire en connectivité effective ... 162
A - Définition de la connectivité... 162
a - Définition, présentation de la connectivité effective ... 162
b - Construction d’un modèle et indicateurs ... 163
B - Application à notre étude ... 165
a - Choix du modèle ... 165
b - Résultats ... 167
c - Discussion... 170
8
Limites et perspectives ... 174
I - Limites de nos études ... 175
A - Limite de la technique d’iontophorèse et de l’évaluation ... 175
B - Limite du modèle de connectivité ... 175
C - Limite de l’étude en imagerie ... 176
II - Perspectives ... 177
A - Utilisation de différentes techniques d’induction et d’imagerie ... 177
B - Etudes chez les patients ... 178
Annexes ... 179
Liste des illustrations ... 193
Bibliographie ... 198
Ce travail a été soutenu par une allocation de l’Institut de Recherche
Pierre Fabre.
9
Liste des abréviations
EVA : échelle visuelle analogique EV : échelle verbale
EN : échelle numérique
TEP : tomographie par émission de positons
IRMf/a : imagerie par résonnance magnétique fonctionnelle ou anatomique EEG : électroencéphalographie
MEG : magnétoencéphalographie DSCr : débit sanguin cérébral régional DA: dermatite atopique
BA: Brodmann area H: Histamine S: Sérum
HSt: Histamine avec la tâche de Stroop SSt: Sérum avec la tâche de Stroop
Liste des abréviations des aires cérébrales
M1 : cortex moteur primaire PM : cortex prémoteur
AMS : aire motrice supplémentaire
LPP ou CPP : lobe pariétal postérieur ou cortex pariétal postérieur CPF(DL) : cortex préfrontal (dorsolatéral)
COF : cortex orbitofrontal S1 : cortex somatosensorielle 1 S2 : cortex somatosensorielle 2 Ia : insula antérieure
Ip : insula postérieure
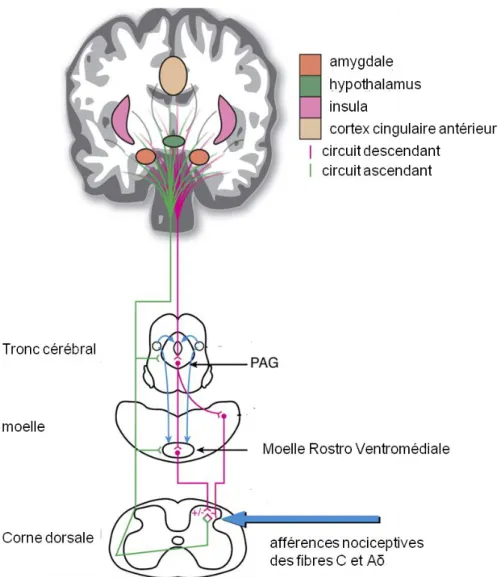
CCA : cortex cingulaire antérieur CCM : cortex cingulaire médian PAG : substance grise périaqueducale CCP : cortex cingulaire postérieur
10
Knock de Jules Romains : Acte II scène 1
LE TAMBOUR
Attendez que je réfléchisse ! (Il rit.) Voilà. Quand j’ai dîné, il y a des fois que je sens une espèce de démangeaison ici. (Il montre le haut de son épigastre.) Ca me chatouille, ou plutôt, ça me gratouille.
KNOCK, d’un air de profonde concentration
Attention. Ne confondons pas. Est-ce que ça vous chatouille, ou est ce que ça vous gratouille ?
LE TAMBOUR
Ca me gratouille. (Il médite.) Mais ça me chatouille bien un peu aussi *…+
KNOCK
Ah ! Ah ! (Il médite d’un air sombre.) Est-ce que ça ne vous gratouille pas davantage quand vous avez mangé de la tête de veau à la vinaigrette ?
LE TAMBOUR
Je n’en mange jamais mais il me semble que si j’en mangeais, effectivement, ça me gratouillerait plus.
11
Introduction
12
Le prurit est défini depuis 1660 comme : « une sensation désagréable provoquant le désir de se gratter » (Hafenreffer 1660). Il est, dans 70% des cas, le symptôme de maladies dermatologiques comme la dermatite atopique ou l’eczéma mais il peut être aussi lié à des maladies systémiques comme l’insuffisance rénale ou des pathologies hépatiques. Dans ces cas le prurit est intense et chronique. Son retentissement sur la vie quotidienne peut être très néfaste. L’histamine est l’un des médiateurs les plus connus et les mieux étudiés comme inducteur d’une sensation de démangeaison. Cependant nous savons que toutes les pathologies prurigineuses ne font pas intervenir l’histamine. Les antihistaminiques restent donc inefficaces dans de nombreux cas. Certaines causes de prurit sont alors encore intraitables. Bien que les connaissances sur le prurit aient désormais progressées, sa physiopathologie exacte reste encore mal comprise. Il est donc important de continuer les recherches en prenant en compte les autres médiateurs afin de mieux comprendre les mécanismes qui sous tendent la démangeaison.
Pendant longtemps le prurit a été considéré comme une sous-douleur. On pensait qu’une stimulation faible entrainait une démangeaison et dès qu’elle s’intensifiait la douleur apparaissait. Il aura fallu attendre la découverte de fibres C spécifiques du prurit pour enfin admettre que la douleur et la démangeaison sont deux sensations bien distinctes. Les études faites en neuro-imagerie ont permis de mettre en évidence que non seulement ces deux sensations avaient des trajets neuronaux différents mais aussi des activations cérébrales qui pouvaient différer.
Comme la douleur, le prurit peut être modulé par différents types de stimulation : mécanique, thermique et attentionnel. Le grattage est l’un des moyens les plus utilisés pour le soulager. Les études montrent qu’il est aussi possible de le calmer par le froid. De nombreux patients rapportent que pendant la journée, là où les stimulations sensorielles sont les plus importantes, leurs démangeaisons diminuent et qu’elles s’accentuent durant la nuit.
Notre travail cherche à améliorer nos connaissances sur les bases cérébrales du prurit. Nous voulons plus précisément identifier en quoi une modulation de la sensation prurigineuse par une tâche cognitive peut influencer les activations cérébrales qui l’accompagnent. Nous aborderons dans un premier temps de façon générale le prurit, ses caractéristiques et l’épidémiologie de ce symptôme. Pour pouvoir étudier ses mécanismes il faut être capable de le déclencher chez des sujets sains. Nous verrons donc les principales
Introduction
13
techniques et les médiateurs utilisés pour induire expérimentalement une démangeaison. Les voies prurigineuses seront décrites par étape de la génération du prurit au niveau de la peau, en passant par la moelle épinière pour enfin finir au niveau du cerveau. Nous décrirons donc le système nerveux cutané et les récepteurs spécifiques à la démangeaison, les circuits neuronaux et enfin les aires cérébrales spécifiques à la démangeaison. Pour conclure la première partie nous verrons les différentes façons de moduler une sensation prurigineuse. Nous préciserons les mécanismes de cette modulation au niveau spinal et supra spinal. Dans une deuxième partie nous décrirons les deux expériences réalisées. La première ayant pour but d’optimiser le modèle d’iontophorèse à l’histamine afin qu’il soit utilisable pour une étude en tomographie par émission de positons (TEP) et la seconde de montrer comment une tâche cognitive sollicitant beaucoup de ressources attentionnelles pouvait modifier la perception de la sensation prurigineuse et l’activité des aires cérébrales concernées par cette sensation. Pour cela, nous étudierons en imagerie TEP-H215O les
modifications des circuits cérébraux suite à une modulation par une tâche de Stroop visuel des couleurs. Nous parlerons dans une dernière partie de l’étude en connectivité effective qui nous a permis d’approfondrir nos résultats d’imagerie et de construire un réseau orienté pour le prurit. Nous finirons par les conclusions et les limites de ces deux études et les perspectives envisagées.
14
Etat de l’art - généralités
15
I - Généralités
A - Définition
La première définition du prurit, proposée par Samuel Hafenreffer en 1660, reste encore largement utilisée. « Le prurit ou démangeaison est défini comme une sensation
désagréable ressentie au niveau de la peau et conduisant à l’envie de se gratter ». Ce n’est
pas une maladie mais un symptôme particulier de la peau et des semi muqueuses qui peut révéler la plus part du temps des infections cutanées ou des pathologies systémiques.
Tout le monde a déjà expérimenté une fois dans sa vie la démangeaison induite par exemple par une piqûre de moustique. Dans ce cas là le prurit est aigu et aura alors un rôle de protection. La réaction sera l’action de l’autre bras pour venir enlever l’élément nocif par le grattage. Lorsqu’il est chronique le prurit aura un effet destructeur sur l’organisme avec des répercutions plus ou moins importantes sur la vie quotidienne et le moral de la personne (Terranova, Guarneri et al. 2005). Nous arrivons à bien nous rendre compte des conséquences que peut avoir la douleur sur la vie de tous les jours mais celles d’un prurit sont souvent sous estimées. Les personnes atteintes de prurit chronique voient leur vie quotidienne perturbée. Il peut entrainer des troubles du sommeil, des perturbations psychologiques qui peuvent alors conduire dans certains cas au suicide (Terranova, Guarneri et al. 2005). Qu’il soit chronique ou aigu le prurit est fondé sur les mêmes mécanismes sauf que dans le premier cas une neuroplasticité va provoquer un changement de la sensibilité (Stander and Schmelz 2006). Le prurit aigu, comme celui de l’urticaire ou celui consécutif à la prise de certains médicaments (chloroquine), peut être traité efficacement (Stander, Steinhoff et al. 2003). Le prurit chronique, symptôme de nombreuses maladies dont les plus fréquentes sont l’insuffisance chronique rénale, la cholestase hépatique ou encore la dermatite atopique est plus délicat à traiter (Yosipovitch, Greaves et al. 2003). Tous les prurits ne répondent pas à des traitements, certains sont même intraitables (Stander, Weisshaar et al. 2007).
Prurit vient du latin prurire qui signifie démanger. Dans la langue anglaise deux termes sont utilisés pour qualifier la démangeaison « prurit » et « itch ». D’après la définition du Webster’s international dictionary of the English language (Terranova, Guarneri et al.
Etat de l’art - généralités
16
2005), « prurit » est utilisé dans le cas d’une démangeaison généralisée en l’absence d’une pathologie cutanée d’origine. La démangeaison, « itch », est définie comme arrivant suite à une altération de la peau (Terranova, Guarneri et al. 2005). Cependant de nombreux auteurs trouvent cette distinction abusive et utilisent les deux termes de façon interchangeable (Bernhard 2005; Terranova, Guarneri et al. 2005; Stander 2007). En français, d’après la définition du Larousse, le prurit, terme médical, est une « sensation naissant au niveau de la peau et entrainant une envie de se gratter », le synonyme étant la démangeaison. La distinction est donc moins évidente entre ces deux termes. Le mot démangeaison sera plutôt utilisé en langage courant alors que le prurit sera plutôt utilisé dans le cadre scientifique et médical. Pour parler d’un prurit aigue ou chronique non associé à une dermatose le terme de « prurit sine materia » est employé.
L’alloknésie est décrite quand un stimulus, qui à la base n’est pas prurigineux, va pouvoir entrainer une sensation de démangeaison (Terranova, Guarneri et al. 2005). Elle est dérivée du terme allodynia qui correspond au même phénomène mais dans le cadre de la douleur. Ce phénomène d’alloknesis a été décrit dans le cas de la dermatite atopique suite à une légère stimulation mécanique qui va induire un prurit dans les zones qui entourent les lésions prurigineuses (Ikoma, Steinhoff et al. 2006).
B - Classification
Le prurit peut avoir de multiples origines et peut être associé à des pathologies cutanées mais aussi à des maladies systémiques, neurologiques, psychogènes ou multifactorielles. Afin d’établir son diagnostic le médecin va devoir prendre en compte plusieurs de ses caractéristiques. En effet la démangeaison peut :
- être un épisode ponctuel ou chronique s’il dure au moins depuis 6 semaines (défini par le forum international de l’étude sur la démangeaison IFSI),
- être localisée ou généralisée,
- être ressentie qualitativement différemment d’un sujet à l’autre,
- avoir plusieurs sortes d’évolution : par crise, continue, plutôt diurne ou nocturne - être ou non associée à des modifications cutanées.
La question de la classification est toujours en débat. L’intérêt d’une classification est d’aider le médecin lors de son diagnostic. Suivant les symptômes associés au prurit il pourra
Etat de l’art - généralités
17
alors diagnostiquer une pathologie et ainsi proposer le traitement le plus adéquat. Une classification selon les bases neurophysiologiques du symptôme (Schmelz 2003; Twycross, Greaves et al. 2003; Yosipovitch, Greaves et al. 2003; Bernhard 2005), ou une classification selon les signes cliniques associés au prurit (Stander, Weisshaar et al. 2007) peuvent être envisageables. Chacune ayant ses avantages et ses inconvénients suivant l’utilisation que l’on veut en avoir.
a - Classification basée sur l’origine
Une première classification comporte quatre catégories suivant l’origine étiologique du prurit (Schmelz 2003; Twycross, Greaves et al. 2003; Yosipovitch, Greaves et al. 2003; Bernhard 2005):
- origine pruritoceptive : le prurit est généré au niveau de la peau et est dû notamment à un processus inflammatoire cutané. On peut y classer la xérose (sécheresse) cutanée, l’eczéma, l’urticaire, les réactions suite à une piqûre d’insecte ou la gale.
- origine neurogénique : il est généré dans le système nerveux central en réponse à des agents pruritogènes circulants (comme dans la cholestase) ou en réponse à la morphine injectée en intrarachidien. Le prurit d’origine neurogénique peut être dû à l’effet des opiacés sur leurs récepteurs. La sensation de démangeaison est présente sans qu’il n’y ait eu de stimulation périphérique. Cette partie inclut aussi les pathologies d’origine systémique ou des pathologies associées à un dérèglement des processus nerveux et sensoriels qui régulent normalement la démangeaison, comme dans le cas de l’alloknésie.
- origine neuropathique : le prurit est alors dû à une lésion, un écrasement ou autre traumatisme anatomique au niveau du système nerveux central et périphérique. En font partie la neuralgie postherpétique, le prurit brachioradial et les démangeaisons liées à des scléroses multiples ou consécutives à des évènements vasculaires cérébraux.
- origine psychogénique comme la parasitose délirante. C’est un état au cours duquel le patient se croit infecté de parasites corporels.
Cependant certains prurits ne peuvent pas rentrer dans une classification aussi stricte. Pour certains patients il est difficile de trouver quelle maladie est à l’origine du symptôme, certains cas peuvent également rentrer dans plusieurs catégories car l’origine est multifactorielle, comme c’est le cas de la dermatite atopique ou du psoriasis. Bernhard va
Etat de l’art - généralités
18
alors proposer une version améliorée de cette classification plus adaptée à la clinique car plus simple et moins ambigüe. Il ne fait plus la distinction fine entre neurogénique et neuropathique, il remplace le terme pruritoceptive par dermatologique. Il ajoute aussi deux autres catégories qui sont « autres » car dans certains cas l’origine est inconnue et la catégorie « mixte » dans le cas d’origines multiples.
Le gros défaut de cette classification reste qu’elle nécessite une identification de l’origine de la pathologie pour pouvoir le classer
b - Classification basée sur les modifications cutanées
La classification proposée par Stander (Stander, Weisshaar et al. 2007) est basée sur la présence ou l’absence de signes cliniques cutanés accompagnants le symptôme prurigineux. Lors d’un diagnostic, le médecin doit prendre en compte l’existence de changements au niveau de la peau. Il faut être prudent car le prurit même s’il peut être accompagné de lésions dues à l’inflammation de la peau peut aussi entrainer l’envie de se gratter et faire apparaitre des lésions secondaires. Ces réactions peuvent elles-mêmes entrainer la libération de médiateurs de l’inflammation qui vont alors aggraver le prurit, on assiste alors au cercle vicieux prurit/ grattage.
Cette classification comprend trois groupes:
- prurit accompagné de lésions cutanées : il regroupe les maladies prurigineuses accompagnées de changements cutanés. Ce sont principalement les maladies dermatologiques comme les maladies cutanées d’origine inflammatoire (le psoriasis), infectieuses (la varicelle, la teigne ou encore le VIH) ou auto-immunes (les pemphigoides), les genodermatoses, les toxidermies médicamenteuses liées aux effets indésirables de certains médicaments, les dermatoses qui apparaissent chez la femme enceinte et les lymphomes de la peau.
- prurit sans signe cutané : dans certains cas la démangeaison n’est pas associée à des manifestations cutanées on parle alors de prurit sine materia. Il regroupe les maladies systémiques rassemblant les pathologies hématologiques, endocriniennes ou métaboliques (hyper/hypothyroïdie), l’insuffisance rénale chronique ou la cholestase hépatique. On retrouve aussi les pathologies neurologiques (notalgie paresthésique ou prurit
Etat de l’art - généralités
19
brachioradial), psychosomatiques ou psychiatriques. Dans cette catégorie se trouve aussi le prurit aquagénique.
- prurit avec lésions cutanées secondaires au grattage : se trouve chez les personnes qui ont des lésions de la peau mais qui sont la conséquence d’un grattage trop intense et répété. Chez ces patients atteints de lésions secondaires l’origine peut être soit une pathologie dermatologique soit systémique. Ces patients sont atteints de prurit chronique qui dure pour certains depuis plusieurs années et il est donc difficile pour eux de se souvenir des symptômes présents au début ce qui rend le diagnostic plus difficile.
Cette classification semble plus adaptée à la clinique car elle passe par un examen des signes cutanés associés au prurit qui permet une meilleure classification. Les lésions identifiées permettent d’orienter le diagnostic (Vaillant, Berbis et al. 2002).
C - Epidémiologie et étiologie du prurit
Malgré le fait que ce soit un symptôme souvent exprimé par les patients, il existe très peu d’études épidémiologiques sur cette sensation alors que la douleur est elle-même assez étudiée.
Une étude menée en Norvège (Dalgard, Dawn et al. 2007) montre une prévalence du prurit de 7.5% chez les hommes et de 9.2% chez les femmes. Les personnes ayant vécu des évènements négatifs dans leur vie ou des épisodes de dépression, reportent plus de sensation de démangeaison. Le cadre social semble aussi être un facteur dans la perception de la sensation de démangeaison. D’autres études montrent que la prévalence d’avoir un prurit augmente avec l’âge (Terranova, Guarneri et al. 2005).
La fréquence de découverte d’une cause systémique lors d’un prurit généralisé est de 25 à 50 % des cas étudiés (Vaillant, Berbis et al. 2002; Afifi, Aubin et al. 2004; Terranova, Guarneri et al. 2005). Les causes systémiques sont diverses : hypothyroïdisme, leucémie lymphocytique chronique, hépatite B et C, diabète, cancer du poumon, urémie, anémie déficitaire en fer. Les cas de prurit dus à des affections générales sont plus rares que ceux dus à une dermatose. Une étude rétrospective sur 263 patients atteins d’un prurit chronique a montré que dans 41,8% des cas la cause était une dermatose, dans 13,3% une maladie systémique et dans 0.4% un désordre neurologique. Dans 44,5% des cas la pathologie n’était
Etat de l’art - généralités
20
pas identifié et parmi eux 55,6% avaient une accumulation de cofacteurs donc peut être une origine du prurit multifactorielle (Stander 2008).
D - La dermatite atopique
La dermatite atopique est la dermatose prurigineuse la plus fréquente, après la piqûre d’insecte. Elle est aussi appelé eczéma constitutionnel. Elle touche 15 % de la population européenne. La prévalence de la dermatite atopique est en augmentation constante en Europe. On lui connait une part génétique mais aussi une intervention de l’environnement qui va déclencher des manifestations inflammatoires au niveau de la peau, des muqueuses respiratoires ou oculaires. La dermatite atopique atteint le nourrisson et le petit enfant. Dans 60 à 70 % des cas elle apparait avant 6 mois et dans 30 à 40 % avant 3 mois. Elle touche rarement l'adolescent et l'adulte jeune. La sémiologie et la topographie des lésions sont variables en fonction de l'âge: chez l'enfant de moins de 2 ans, les placards érythémato-vésiculeux prédominent au visage et aux convexités des membres, après 2 ans, les plis des coudes et des genoux préférentiellement atteints sont lichénifiés (Figure 1). A ces symptômes s’ajoutent une sécheresse au niveau de la peau ou xérose cutanée. Le prurit est toujours présent.
On ne sait pas trop encore comment se passe le processus. Est ce que la sensation vient avant ou est-ce une conséquence ? Il y aurait un cercle vicieux avec le grattage qui se met en place. Il relancerait les dégâts causés par la démangeaison. Les envies de gratter arrivant le plus souvent le soir, un manque de sommeil et une irritabilité chez les patients altèrent leur quotidien Dans le cas de dermatite atopique un stimulus non pruritogène est ressenti comme prurigineux. C’est l’alloknésie.
Les traitements sont dans un premier temps le respect de certaines règles d’hygiène qui permettent d‘atténuer les symptômes. Un traitement local, notamment par des dermocorticoïdes, permet de diminuer l’inflammation. Les anti histaminiques sont utilisés mais ne sont pas très efficaces. L’histamine n’est pas le médiateur principal, on pense plutôt aux cytokines et aux protéases. Les opioïdes pourraient être aussi impliqués. La photothérapie et la photochémothérapie semblent aussi être efficaces.
Etat de l’art - généralités
21
Figure 1 : lésions de dermatite atopique derrière le genou chez un enfant.
A travers cette première partie qui traite du symptôme prurigineux en général on se rend compte de l’énorme diversité des pathologies qui lui sont associées et du manque de connaissance sur les mécanismes exacts. Dans la majorité des cas les traitements ne sont que symptomatiques et sont donc souvent faiblement efficaces. Il est donc important d’améliorer encore nos connaissances sur cette sensation qu’est la démangeaison afin d’améliorer la qualité de vie des personnes atteintes de prurit chronique.
Etat de l’art – induction expérimentale d’un prurit
22
II - Induction
expérimentale
d’un
prurit
Pour pouvoir améliorer nos connaissances sur les différents mécanismes du prurit il faut pouvoir l’induire chez des personnes saines ou des patients. Pour cela différentes techniques ont été développées. Les études chez l’animal sont assez rares. En effet le seul moyen chez l’animal d’évaluer la sensation de démangeaison est de pouvoir observer le grattage et de le quantifier. Cependant chez l’animal le grattage peut apparaitre régulièrement et n’est pas une réponse spécifique à la démangeaison (Schmelz, Schmidt et al. 1997). De plus, chez le chat et le rat, il n’y a pas de réponse érythémateuse. Les mastocytes cutanées du rat ne contiennent pas d’histamine, mais beaucoup de sérotonine molécule absente dans les mastocytes humains.
Pour pouvoir caractériser un prurit il faut recueillir l’intensité de la sensation engendrée, sa qualité et les modifications cutanées qui l’accompagnent. Nous allons donc voir les différents moyens d’évaluation utilisés lors d’induction expérimentale. Certaines évaluations sont subjectives et d’autres sont plus physiologiques. Nous décrirons ensuite les différentes techniques chimiques et électriques employées pour induire expérimentalement un prurit.
A - Evaluation de la sensation
a - Réactions cutanées
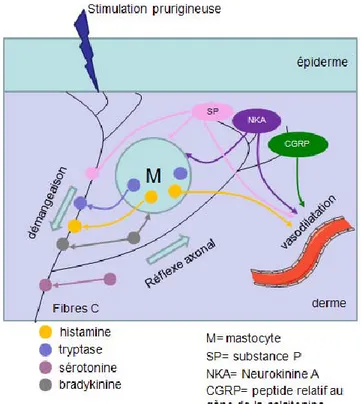
Les différents médiateurs prurigineux, lorsqu’ils sont introduits au niveau de la peau sont capables d’engendrer des réactions cutanées. Ces réactions sont appelées en anglais « wheal » et « flare ». « Wheal » correspond à un œdème et « flare » à un érythème entourant l’œdème (Figure 2). Le premier est dû à une perméabilité au niveau des capillaires entrainant une fuite d’eau et le second au réflexe axonal (explication dans chapitre III -C -a - ).
La mesure de leur taille est un bon moyen d’évaluer les effets des différents médiateurs ainsi que leur mode d’action. Les mesures peuvent s’effectuer, à différents temps pour un même médiateur afin de voir l’évolution des caractéristiques de la sensation induite par ce
Etat de l’art – induction expérimentale d’un prurit
23
médiateur. On peut aussi faire une comparaison des tailles correspondant à l’induction par deux médiateurs différents ou deux techniques différentes.
Les médiateurs vont aussi entrainer des modifications au niveau du débit sanguin
cutané. Des mesures physiologiques, comme les changements de flux sanguin dans le réseau
micro vasculaire de la peau, sont effectuées. Le débit cutané est mesuré par Doppler laser. C’est une méthode non invasive qui permet de mesurer de façon continue la perfusion de la microcirculation.
Figure 2 : réactions cutanées liées à l’histamine
On sait qu’il existe une relation entre peau sèche et démangeaison. Les mesures de
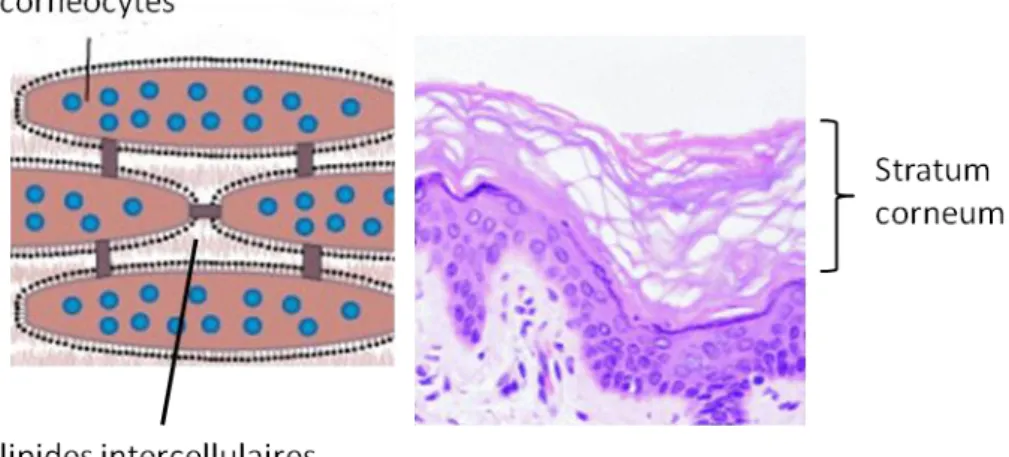
l’hydratation de la peau et de la perte en eau transépidermique sont des mesures objectives
afin de connaître le niveau d’hydratation de la peau et l’état de la fonction de barrière du stratum corneum.
b - Evaluation par les échelles
Dans toutes les études il existe un moyen d’évaluer la quantité de la sensation de démangeaison. L’intensité du prurit va varier suivant les individus, suivant le moment de la journée et suivant la partie du corps stimulée.
Pour juger l’aspect quantitatif de la sensation on peut utiliser une échelle visuelle
analogique (EVA). Le patient évalue la sensation de sa démangeaison sur une ligne droite de
dix centimètres. 0 correspond à « aucune sensation » et le 10 au « prurit le plus fort ». Le patient place une marque entre ces deux extrémités en fonction de l’intensité de sa sensation. La distance, en centimètres, du zéro à sa marque nous donne l’intensité de la sensation ressentie (Figure 3). Cette évaluation est strictement subjective. Elle a été mise au point pour la cotation de la douleur par Huskinsson en 1974.
Pour essayer de palier ce coté très subjectif certains auteurs proposent quelques techniques. Afin de normaliser l’échelle ils demandent à chaque sujet de placer l’intensité associée à une
Etat de l’art – induction expérimentale d’un prurit
24
piqûre de moustique (Johanek, Meyer et al. 2007). L’échelle est alors normalisée par rapport à l’intensité de la piqûre.
On peut aussi placer arbitrairement un point qui sera le seuil de grattage pour aider le sujet à se repérer sur l’échelle. C’est à partir de ce point que la sensation commence à gratter. Ce seuil est souvent placé à 1/3 de l’EVA (Darsow, Ring et al. 1996; Pfab, Valet et al. 2006).
Figure 3 : Echelle visuelle analogique : exemple de cotation
On peut aussi utiliser des échelles verbales (EV). Elles sont un peu moins abstraites que l’EVA. On propose au patient une série de qualitatifs hiérarchisés pouvant aller de pas de démangeaison, à démangeaison faible, modérée ou insupportable.
L’échelle numérique (EN) consiste à donner une note, par exemple de 0 à 10, pour
exprimer l’intensité de la sensation. O correspondant à aucune sensation et 10 à la démangeaison la plus insupportable.
Ces trois échelles faciles et rapides ne mesurent que l’intensité. Toutes les composantes de prurit ne peuvent pas être décrites seulement par ces échelles ou par les réactions cutanées, d’autres outils sont nécessaires.
c - Evaluation par les questionnaires
Des questionnaires servent en clinique pour évaluer le degré du prurit. Ils sont dérivés du « Mac Gill pain questionnaire » (Yosipovitch 2003; Yosipovitch and Fleischer 2003; Yosipovitch, Greaves et al. 2003). Ce questionnaire a été mis au point par Melzack aux Etats-Unis pour la douleur. Il comporte une liste de 78 qualificatifs, répartis en 20 sous-classes, et explore les aspects qualitatifs et quantitatifs de la douleur
Deux questionnaires ont été validés pour évaluer le prurit (Darsow, Scharein et al. 2001; Yosipovitch, Zucker et al. 2001). L’un d’entre eux permet d’obtenir une description
Etat de l’art – induction expérimentale d’un prurit
25
sensorielle du prurit, tandis que l’autre évalue son impact sur la qualité de vie et les activités quotidiennes.
Expérimentalement on utilise l’ « Eppendorf Itch Questionnaire » (Darsow, Scharein et al. 2001). C’est un questionnaire de 80 items sur l’aspect qualitatif et quantitatif des propriétés de la sensation ressentie suite à une stimulation. Les sujets doivent évaluer chaque item de 0 (pas applicable) à 4 (très applicable) (Pfab, Valet et al. 2006). Plusieurs qualificatifs vont définir la sensation. Un premier groupe permet l’aspect descriptif (brûlure, piqûre, fourmillement, picotement, démangeaison …) et l’autre l’aspect émotionnel (ennuyeux, affreux, fatiguant …) (Voir annexe 1)
d - Grattage nocturne
Le grattage est un comportement en réponse à la démangeaison. Il a été reconnu pendant longtemps comme le moyen le plus fiable pour repérer la sensation de démangeaison (Wallengren 2005). Même si dans un premier temps le grattage va permettre de soulager la sensation il va avoir des effets néfastes lorsqu’il sera répété. Il peut entrainer des dommages au niveau de la peau qui vont induire la sécrétion de neuropeptides et de médiateurs de l’inflammation qui à leur tour activeront les fibres inductrices de prurit. Il se met alors en place le cercle vicieux prurit/grattage (Schmelz 2003). Le grattage est un facteur important dans le maintien du symptôme prurigineux et par conséquence dans la diminution de la qualité de vie des patients (Wahlgren 1999). Les lésions secondaires liées au grattage peuvent être des effritements, des excorations, des croutes, une hyper ou hypo pigmentation, une lichénification, un prurigo et des cicatrices (Figure 4).
La journée, le prurit est influencé par les activités diurnes et les facteurs psychologiques. Il est en général exacerbé la nuit. Les patients ont donc tendance à plus se gratter davantage la nuit ce qui peut entrainer des troubles du sommeil. Cette augmentation peut venir aussi du rythme circadien des médiateurs mis en jeu dans le prurit ou d’une augmentation de la température de la peau durant la nuit.
Le grattage nocturne sera donc aussi un indicateur quantitatif de la sensation de démangeaison. L’analyse du grattage semble plus objective la nuit. Une étude a utilisé une caméra vidéo infra-rouge, afin d’enregistrer le grattage nocturne chez les patients atteints de dermatite atopique. Les résultats montrent que les sujets atopiques dorment en
Etat de l’art – induction expérimentale d’un prurit
26
moyenne quarante cinq minutes de moins que les sujets contrôles (Ebata, Aizawa et al. 1996).
On peut aussi utiliser un transducteur piézoélectrique qui est attaché aux ongles des mains afin d’enregistrer les mouvements des doigts.
Figure 4 : lésions consécutives au grattage (Schmelz 2003)
e - Imagerie cérébrale
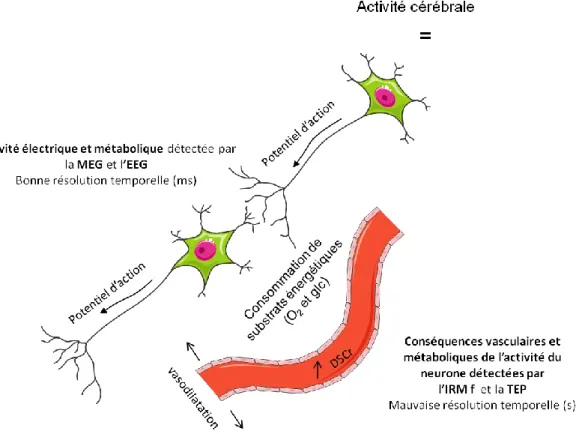
Les techniques de neuroimagerie vont permettre d’étudier les activations cérébrales consécutives à une stimulation prurigineuse. Ces observations pourront être faites chez des sujets sains suite à une stimulation prurigineuse ou chez des sujets atteints de prurit chronique. Les études en imagerie sur la démangeaison sont assez récentes la première date de 1994 (Hsieh, Hagermark et al. 1994). Suivant le stimulus pruritogène utilisé, l’activation au niveau des aires impliquées dans la sensation de démangeaison peut varier. Le niveau d’activation de ces aires pourra être corrélé avec l’intensité de la sensation ressentie et avec son caractère déplaisant. Toutes ces informations concernant l’imagerie cérébrale et les aires de la démangeaison seront vues plus en détail dans les chapitres IV et V.
Etat de l’art – induction expérimentale d’un prurit
27
B - Induction chimique
a - Les différentes techniques
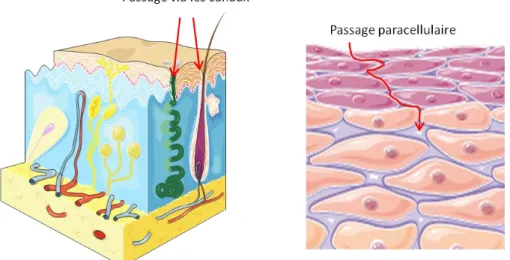
a - 1 - IontophorèseL’application d’une substance par iontophorèse (IP) consiste à faire pénétrer une molécule ionisée à l’aide d’un courant électrique. La substance est placée sur une électrode reliée à un appareil délivrant un courant électrique. Une deuxième électrode est placée au niveau de la peau et sert d’électrode de contact. Elle aussi est reliée à un générateur de courant (Figure 5). Sa position par rapport à l’électrode contenant la solution n’est pas critique (Magerl, Westerman et al. 1990). Cette méthode va permettre de délivrer des substances au derme, aux mastocytes et à la microcirculation. Elle induit une pure sensation de démangeaison qui n’est pas accompagnée de sensation de douleur. Cette méthode sera plus amplement détaillée dans la partie expérimentale (voir chapitre I -A - de la partie expérimentale).
Figure 5 : méthode d’iontophorèse
La quantité d’histamine introduite dépend de la densité du courant (D) et de la charge du courant (Q). La charge du courant correspond à l’intensité du courant (en milliampères mA) multipliée par le temps d’application du courant (en secondes). Ces paramètres sont très variables suivant les publications. L’intensité varie de 0.5 à 2mA, équivalent à une densité de courant de 0.15 à 12.5mA/cm2. Le temps d’application peut varier aussi donnant une charge de courant délivrée allant de 5 à 540 mC. Suite à différentes combinaisons de temps et de courant, la charge totale transférée intradermiquement semble être le paramètre le plus corrélé à la réaction cutanée (Magerl, Westerman et al. 1990).
Etat de l’art – induction expérimentale d’un prurit
28
a - 2 - Prick-test
Le prick-test (PT) consiste en l’introduction d’une substance par microponcture dans les couches superficielles de la peau à l’aide d’un stylet. Une goutte de substance est déposée sur la surface de la peau, et la piqûre de la peau à l’aide du stylet permet son introduction (Figure 6). Cette méthode est souvent utilisée lors du diagnostic des allergies, pour dépister les terrains allergiques d’un sujet à différents allergènes.
Dans le cas de l’histamine les prick-tests permettront de délivrer la molécule à la jonction derme/épiderme là où la densité en récepteurs est la plus forte (Smith 1992; Wallengren 2005).
Pour certains auteurs cette technique ne doit pas être utilisée car elle induit une sensation de douleur lors de la piqûre (Magerl, Westerman et al. 1990). La sensation de démangeaison n’est donc pas pure.
Figure 6 : méthode de prick test
a - 3 - Sonophorèse
La pénétration de l’histamine à travers la peau a récemment été étudiée par une nouvelle technique, la sonophorèse ou phonophorèse (Maruani, Vierron et al. 2010) (Figure 7). Comme l’iontophorèse, cette méthode a d’abord été utilisée pour la pénétration de médicaments, comme par exemple l’insuline. L’utilisation d’ultra son de basse fréquence (36kHz) pour faire pénétrer l’histamine permet d’induire un prurit, un érythème et un œdème comme le prick test. Les ultra sons sont responsables d’un effet de cavitation qui permet la pénétration de la substance active ici l’histamine. Cette technique présente l’intérêt comme l’iontophorèse d’être non invasive et pourrait donc être utilisée dans les tests d’allergie à la place du prick test, méthode invasive qui détruit la barrière cutanée.
Etat de l’art – induction expérimentale d’un prurit
29
Figure 7 : matériel de sonophorèse
a - 4 - Intradermique
C’est une méthode invasive. Elle consiste en l’injection intradermique d’une molécule, l’histamine, à l’aide d’une seringue (Hsieh, Hagermark et al. 1994).
a - 5 - Par microdialyse
Des petits tuyaux sont insérés en intracutanée (0.4 mm de diamètre), sur une largeur d’un centimètre, transversalement à l’axe du bras (Figure 8). Il n’y a pas d’anesthésie locale pour l’insertion des tubes. Le bras est refroidi par des glaçons pendant 5 min avant l‘insertion. Un premier érythème apparait suite à l’insertion des tuyaux de microdialyse puis disparait au bout de trente minutes (Herde, Forster et al. 2007).
Figure 8 : méthode de microdialyse (Herde, Forster et al. 2007). On peut observer l’érythème (entouré de pointillés noirs) et l’œdème (sur la fibre de dialyse) formés
Etat de l’art – induction expérimentale d’un prurit
30
b - Les différentes molécules
b - 1 - L’histamineL’histamine est un médiateur important dans de nombreuses réactions biologiques. C’est le prurigène le mieux connu et le mieux décrit de tous. C’est aussi le médiateur le plus utilisé pour déclencher de façon expérimentale un prurit. Elle est impliquée dans la plupart des formes d’urticaire, les réactions aux piqûres d’insectes et les réactions cutanées aux médicaments notamment aux antibiotiques. Son rôle dans les autres dermatoses et dans le prurit généralisé lors de maladies systémiques est minimal. Cela est mis en évidence par l’inefficacité des antihistaminiques dans ces pathologies (Yosipovitch, Greaves et al. 2003).
Elle ne peut pas pénétrer passivement la peau ayant une fonction de barrière intacte (Darsow, Ring et al. 1996). Elle devra donc être insérée grâce aux techniques citées ci-dessus. Nous verrons plus en détail, dans le chapitre sur les voies de la démangeaison et les médiateurs, son mécanisme d’action (chapitre III - C - a).
La peau réagit aux injections d’histamine par une triple réponse (Darsow, Ring et al. 1996) décrite en 1927 par Lewis (Figure 2, Figure 8):
- une rougeur localisée due à l’augmentation du flux sanguin - un œdème, dû à une augmentation de la perméabilité vasculaire
- un érythème secondaire, en périphérie de l’œdème, dû au réflexe axonal.
Si l’histamine est insérée par la méthode du prick test la démangeaison apparait rapidement dans les cinq à soixante secondes après l’application d’histamine. La sensation maximum de démangeaison est atteinte au bout de deux minutes et dure entre deux et cinq minutes. Elle atteint en moyenne 30% de l’EVA. L’érythème est visible une minute après l’application d’histamine, l’œdème apparait au cours de la troisième minute. Après 2h30, la démangeaison ainsi que l’œdème et l’érythème ont complètement disparu. La démangeaison et l’érythème sont tous les deux causés directement par une activité neuronale des fibres C. L’œdème est un phénomène indépendant, dû à l’effet de l’histamine sur la perméabilité vasculaire. Il n’est donc pas nécessairement le reflet de la puissance d’activation des afférences pruritoceptives (Darsow, Ring et al. 1996).
L’histamine peut être insérée par microdialyse (Herde, Forster et al. 2007). Un
mélange d’histamine/codéine a été utilisé afin de provoquer une sensation de
Etat de l’art – induction expérimentale d’un prurit
31
(Herde, Forster et al. 2007). L’effet produit est alors plus fort qu’avec l’histamine seule. Après l’injection un érythème et un œdème apparaissent. La sensation de démangeaison apparait dans les vingt à soixante secondes après l’injection. Elle atteint un plateau au bout d’une minute. Elle atteind un score > 40% sur l’EVA. La sensation est stoppée par la lidocaine.
Après l’injection d’histamine par iontophorèse, la réponse triple est observée. Le flux sanguin augmente rapidement à l’endroit de la stimulation, environ trente secondes après la fin du courant (Heyer, Hornstein et al. 1989). Les différents temps de latence, temps d’apparition de la sensation maximum, durée du plateau et durée de la sensation sont fortement dépendants de la charge totale transférée. La sensation prurigineuse commence environ trente secondes après l’arrêt du courant, elle atteint un plateau dans les deux minutes et la sensation ne diminue pas significativement durant les huit minutes suivantes. La démangeaison dure en moyenne dix minutes (Schmelz 2001).
L’histamine introduite par sonophorèse induit la formation d’un œdème et d’un érythème et l’induction d’un prurit (Maruani, Vierron et al. 2010). Les effets sont augmentés dès que l’on augmente l’intensité de la stimulation qui à des niveaux trop élevés entraine des effets indésirables (Boucaud, Montharu et al. 2001; Machet and Boucaud 2002). L’œdème ainsi formé commence à diminuer au bout de deux heures et ne persiste pas au bout de vingt quatre heures. L’intensité du prurit varie de 1 à 3 sur l’EVA.
Nous venons de voir quatre façons d’induire un prurit via l’histamine. Chaque technique a ses avantages et ses inconvénients. Il convient donc avant d’en choisir une de savoir quels paramètres l’on veut étudier. Le prick test va provoquer une démangeaison qui est plus longue et plus forte que celle provoquée par l’iontophorèse ou l’injection intradermique. Il semble alors plus approprié pour tester des traitements antihistaminiques car la démangeaison est mieux perçue car plus intense. Cependant cette méthode est invasive et certains préféreront une méthode non invasive comme l’iontophorèse. Elle est aussi utilisée pour l’administration de médicaments, notamment des substances ionisées. Des macromolécules comme l’insuline ont déjà été délivrées par iontophorèse avec succès dans la peau de certains animaux diabétiques. L’utilisation des ces techniques couplées avec l’histamine permet d’obtenir une réponse cutanée caractéristique. La sonophorèse n’est pas encore utilisée dans les études sur la démangeaison. Son mécanisme d’action, proche de celui l’iontophorèse en font une technique utilisable pour ce type d’études.
Etat de l’art – induction expérimentale d’un prurit
32
b - 2 - Autres molécules
En dehors de l’histamine qui est la molécule la plus utilisée pour induire un prurit d’autres substances ont été testées.
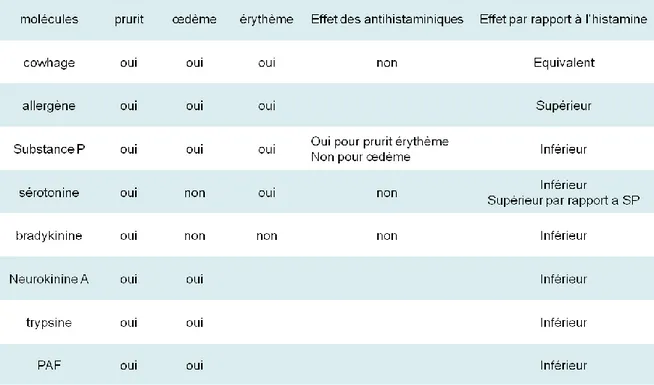
Les réactions cutanées et de démangeaison accompagnant l’injection de ces différentes substances, les effets des antihistaminiques sur celles-ci et la comparaison avec les réactions suite à l’application d’histamine sont résumés dans le tableau suivant (Tableau 1).
Tableau 1 : réactions cutanées accompagnant l’injection de différentes substance, effet des antihistaminiques et comparaison avec l’effet de l’histamine (SP =
substance P). Le cowhage ou poils à gratter
Le « cowhage » ou Mucuna Pruriens (M.Pruriens), appelé en France le pois mascate ou encore poils à gratter, est utilisé comme médiateur expérimental du prurit (Figure 9).
Etat de l’art – induction expérimentale d’un prurit
33
Figure 9 : Mucuna Pruriens
Shelley et Arthur dans les années 1950 utilisent des spicules du fruit M. Pruriens pour déclencher une sensation de démangeaison (Shelley and Arthur 1957). Il est formé de pois couverts de poils qui pénètrent facilement la peau humaine ou animale. Ces pois sont pressés sur la peau permettant leur passage à travers la barrière cutanée (Johanek, Meyer et al. 2007). Une sensation de démangeaison déclenchée par le cowhage n’induit qu’une faible rougeur localisée (Johanek, Meyer et al. 2007). L’intensité maximum de démangeaison atteint 20% sur l’EVA. La latence est de trente secondes, le maximum est atteint en une minute et dure deux minutes. La sensation disparait au bout de 6 min. Il n’y a pas d’effet des antihistaminiques sur la sensation ainsi déclenchée. M. Pruriens contient des protéases, ligands des PAR-2 et PAR-4, et induit ainsi un prurit histamine indépendant.
Les allergènes :
Les allergènes induisent un prurit moins rapide, plus long et plus intense que celui induit par l’histamine. Le flux sanguin est aussi plus important avec les allergènes (Leknes, Bantick et al. 2007). Le fait que la latence pour les allergènes soit plus longue que pour l’histamine peut venir du fait que lorsque l‘on injecte l’allergène il faut d’abord contact entre celui-ci et les IgE avant d’avoir dégranulation des mastocytes, alors que quand on injecte l’histamine la réaction est directe (Leknes, Bantick et al. 2007).
La substance P
L’application de substance P (SP) chez l’humain induit un prurit, un érythème et un œdème (Hosogi, Schmelz et al. 2006). L’intensité et la durée du prurit ainsi que la taille de l’érythème et de l’oedeme induit par la SP sont inférieurs à ceux produis par l’histamine (Hosogi, Schmelz et al. 2006). La démangeaison ainsi que l’érythème sont significativement
Etat de l’art – induction expérimentale d’un prurit
34
diminués par l’administration d’antihistaminiques, alors que l’œdème perdure (Hosogi, Schmelz et al. 2006).
La sérotonine
Quand elle est appliquée chez des sujets sains, elle induit un prurit et un érythème moins intense que ceux provoqués par l’histamine. L’application de sérotonine sur une peau normale n’entraine pas d’œdème. La sérotonine est un prurigène histamine-indépendant car l’administration d’antihistaminiques n’a aucun effet sur la réaction cutanée induite par la sérotonine (Hosogi, Schmelz et al. 2006).
La bradykinine
Chez des sujets sains la bradykinine entraine un prurit faible. Son application n’entraine pas d’œdème ni d’érythème. Les antihistaminiques n’ont aucun effet sur la réaction cutanée à la bradykinine, suggérant un mécanisme indépendant de l’histamine.
La neurokinine
L’application de neurokinine A sur une peau normale induit un prurit et un œdème moins intenses que ceux provoqués par l’histamine.
La Trypsine et le PAF (facteur d’agrégation plaquettaire)
Lors de leur application sur une peau normale un prurit ainsi qu’un œdème apparaissent. Ils sont cependant moins importants que lors de l’application d’histamine (Thomsen, Sonne et al. 2002).
C - Induction électrique
a - Electrique
La démangeaison par stimulation électrique est étudiée depuis longtemps, mais l’intensité du prurit induit est faible et la reproductibilité des expériences difficiles. Les principales études ont débutées il y a plus d’un demi-siècle.
En 2005, Ikoma et son équipe, a essayé d’utiliser une nouvelle méthode d’induction d’un prurit intense par un stimulus électrique (Ikoma, Handwerker et al. 2005). Ils ont évalué l’effet de la durée, de l’intensité, et de la fréquence du stimulus électrique sur l’intensité de la démangeaison. Ils mesurent aussi des paramètres physiologiques comme l’érythème dû au réflexe axonal. L’appareil utilisé pour délivrer le courant est un générateur de courant avec un modulateur d’impulsions (Digitimer Ltd, UK). Deux électrodes sont utilisées l’une est
Etat de l’art – induction expérimentale d’un prurit
35
un fil d’acier inoxydable de 0.1 x 7 mm (Ikoma, Handwerker et al. 2005) fixée sur le poignet orthogonalement à l’axe du bras et l’autre est une électrode de référence. Les stimulations sont appliquées au poignet gauche. Ils comparent ces résultats en électrique avec une induction par iontophorèse à l’histamine.
La durée (0.08ms-8ms) ainsi que la fréquence (2-200Hz) du stimulus sont variables. Pour un stimulus de deux millisecondes à 50Hz le délai d’apparition de la sensation est de 1 seconde et sa durée de une à deux secondes. L’intensité de la sensation est de 3/10. Il faut une intensité d’au moins 0.05mA pour avoir une envie de gratter. Quand la durée de la stimulation change, la sensation perçue varie. Une diminution à 0.5 et à 0.8 ms entraine une forte diminution alors qu’une augmentation à 4 et 8 ms augmente légèrement l’intensité. La fréquence de stimulation et l’intensité de la sensation de prurit augmentent elles de façon linéaire. La stimulation électrique cause de l’alloknésie et de l’hyperknésie. Les diamètres des zones de d’alloknésie et d’hyperknésie sont corrélés à l’intensité de la sensation. Par rapport à l’histamine la stimulation électrique ne provoque pas d’érythème dû au reflexe axonal.
Une amélioration de ce système a été proposée par Mochizuki (Mochizuki, Inui et al. 2008). Cela consiste en une plaque sur laquelle le fil inoxydable (diamètre 0.1mm) est croisé de façon à obtenir quatre points de croix (Figure 10). La surface de contact est plus grande mais les points de contact sont plus fins. La stimulation se fait au poignet droit. Il reprend les mêmes paramètres de stimulation que l’étude précédente avec une durée de 2ms et une fréquence de 50 Hz. L’intensité seuil est d’en moyenne 0.24 mA. La sensation est ressentie à peu près une seconde après la stimulation et est notée à 5.6/10 sur l’EVA.
Etat de l’art – induction expérimentale d’un prurit
36
b - Neurometer
Les électrodes, la fréquence et la durée des pulsations utilisées lors de l’induction d’un prurit par stimulation électrique varient d’étude en étude (Ozawa, Tsuchiyama et al. 2006). Il est donc difficile de reproduire exactement les mêmes expériences car chacun fabrique son propre circuit, ses propres électrodes. Afin de standardiser ces paramètres un stimulateur électrique transcutané neurosélectif a récemment été commercialisé : le Neurometer, Neurotron. Le premier rôle de cet appareil est de déterminer le seuil de sensibilité des personnes ayant des troubles neuropathiques, comme les neuropathies diabétiques par exemple. Il permet d’évaluer quantitativement la sensibilité à la douleur par la détermination du seuil de perception, c'est-à-dire l’intensité minimum qui va déclencher une sensation chez le patient. Ce qui nous intéresse dans le Neurometer c’est qu’il génère un stimulus de courant alternatif sinusoïdal constant de différentes fréquences : 5Hz, 250 Hz et 200 Hz. On sait d’un point de vue physiologique que chacune de ces fréquences activerait des fibres sensorielles différentes. A 5 Hz on active les fibres C, à 250 Hz les fibres Aδ et les fibres Aβ à 200 Hz.
Ozawa et al ont montré qu’il était possible de déclencher un prurit avec le Neurometer en se plaçant à une fréquence de 5Hz qui stimule les fibres C responsables du prurit (voir chapitre suivant). Une même stimulation électrique pouvait provoquer une sensation différente suivant la zone stimulée (Ozawa, Tsuchiyama et al. 2006). La sensation est accompagnée d’alloknésie mais pas d’érythème. La cheville et le dos de la main sont les endroits où le prurit est le plus intense.
Nous avons testé le Neurometer mais aucune sensation de démangeaison n’a été reportée quelque soit la fréquence utilisée.
D - Induction psychologique
Nous avons vu ici les différentes techniques chimiques et électriques pouvant induire un prurit. On sait qu’il est possible d’intensifier, par des conditions stressantes, une démangeaison induite expérimentalement. Nous savons qu’un prurit peut aussi être induit de façon psychologique. En effet nous nous rendons bien compte qu’à force de parler de démangeaison on va avoir l’impression que tout notre corps nous gratte. Quelques équipes se sont intéressées à l’induction mentale d’un prurit. Une équipe a voulu tester comment le
Etat de l’art – induction expérimentale d’un prurit
37
prurit et le grattage pouvaient être induit par une intervention verbale et visuelle (Niemeier 2000). Pour cela on montrait à des sujets des images en relation avec la démangeaison (mites, lésions de grattage, réactions allergiques) et on leur parlait du prurit. Dans une deuxième partie le dialogue et les images étaient axés sur la relaxation. Le comportement des participants était observé dans les deux situations. La fréquence de grattage est plus importante dans le cas où les stimulations auditives et visuelles sont axées sur la démangeaison par rapport à la condition de relaxation.
Etat de l’art – voie de la démangeaison
38
III - De la peau au cerveau : voie de la
démangeaison
La connaissance de la physiopathologie du prurit est passée par plusieurs étapes. En 1922 Von Frey pense que le prurit est induit par des faibles fréquences qui vont exciter des nocicepteurs aussi responsables de la médiation de la douleur. A cette époque le prurit est encore considéré comme une sous-douleur. Plusieurs années après, les connaissances sur les fibres responsables du prurit s’approfondissent et on découvre que le prurit sera médié par des fibres C qui répondent à l’histamine (Ikoma, Steinhoff et al. 2006). Les études en microneurographie permettent l’enregistrement de ces fibres C et montrent que celles répondant au prurit sont les mêmes que celles répondant à la douleur déclenchée par une température très élevée. Il faut attendre 1997 avec la découverte de fibres C répondant spécifiquement aux pruritogènes pour enfin considérer la douleur et le prurit comme deux sensations ayant des trajets distincts (Schmelz, Schmidt et al. 1997; Schmelz, Hilliges et al. 2003). Les études électrophysiologiques permettent de caractériser les circuits neuronaux impliqués dans la démangeaison et de mettre en avant le tractus spinothalamique (TST). Ce tractus est sélectivement sensible aux pruritogènes et aux algogènes (Andrew and Craig 2001). Les dernières études ayant permises d’améliorer les connaissances sont les études en neuroimagerie. Elles permettent une meilleure connaissance du réseau cérébral impliqué dans la sensation de démangeaison et de ses différences avec celui de la sensation de douleur (Hsieh, Hagermark et al. 1994; Darsow, Scharein et al. 2001; Drzezga, Darsow et al. 2001).
Nous allons dans ce chapitre décrire le trajet de la sensation de démangeaison depuis son origine au niveau des récepteurs cutanés jusqu’à son arrivée au thalamus. Les mécanismes au niveau du cerveau seront décrits dans le chapitre suivant. Les circuits neuronaux et les pruritocepteurs identifiés ici sont ceux impliqués dans une sensation de démangeaison induite par l’histamine. En effet c’est le médiateur le plus utilisé pour induire expérimentalement un prurit. Cependant il existe d’autres molécules pouvant intervenir et nous verrons en quoi leur trajet diffère.