Identification et caractérisation de VSTM2A comme un
nouveau facteur modulant l’adipogenèse
Thèse
Blandine Secco
Doctorat en physiologie-endocrinologie
Philosophiae doctor (Ph. D.)
Québec, Canada
© Blandine Secco, 2017
iii
Résumé
Aujourd’hui encore, l’obésité touche de plus en plus d’individus, et sa complexité reflète son aspect multifactoriel. Parmi les facteurs impliqués dans le développement de l'obésité, on compte la génétique qui expliquerait notamment la susceptibilité de certains êtres humains à devenir obèse. D'un point de vue moléculaire, la cascade adipogénique permettant à des préadipocytes de devenir des adipocytes matures est un phénomène dynamique et bien caractérisé. En revanche, les facteurs définissant le potentiel adipogénique des préadipocytes ainsi que le renouvellement des adipocytes demeurent encore inconnus. Notre objectif a été d’identifier et de caractériser de nouveaux gènes définissant l’identité des préadipocytes et pouvant influencer le développement du tissu adipeux.
Par dilutions sériées d’une culture de 3T3-L1, nous avons isolé et amplifié 23 nouvelles lignées cellulaires que nous avons classées selon leur potentiel adipogénique. Une puce à ADN nous a permis d’identifier les gènes s’exprimant différemment entre les lignées à fort et à faible potentiel adipogénique. Nous avons identifié un nouveau gène inconnu de la littérature nommé V-set and transmembrane domain containing
2A (Vstm2a). Les travaux réalisés dans le cadre de ma thèse ont été de comprendre l’implication de ce gène
dans le développement de l’adipocyte in vitro et dans la formation du tissu adipeux in vivo.
Nous avons d’abord identifié Vstm2a comme le gène le plus différentiellement exprimé entre les différentes lignées cellulaires, son expression étant très élevée dans les lignées à fort potentiel adipogénique. Une corrélation positive s’est dessinée entre l’expression de Vstm2a et Peroxisome Proliferator-Activated Receptor
γ2 (Pparγ2) dans les préadipocytes. Lors du développement de l’adipocyte in vitro, l’expression de Vstm2a
précède toujours l’activation de Pparγ2, un facteur clé régulant l’adipogenèse. Cette expression précoce est retrouvée in vivo, lors de la formation et de l’expansion du tissu adipeux. Les cellules exprimant Vstm2a au stade développemental se retrouvent à proximité de vaisseaux sanguins et de cellules musculaires, une caractéristique de précurseurs adipeux. Chez l’adulte, ces cellules s’apparentent à la population de précurseurs
adipeux identifiée à partir des marqueurs de surface LIN-CD29+CD34+SCA1+PDGFRα+. Nous avons découvert
que VSTM2A est une protéine glycosylée et abondamment sécrétée par des cellules ayant un fort potentiel adipogénique. La surexpression de VSTM2A intracellulaire suffit à favoriser la différenciation adipocytaire de cellules fibroblastiques, entre autres par l’induction de Pparγ2. À l’inverse, sa sous-expression dans les préadipocytes entraine un défaut adipogénique, réduisant l’expression de Pparγ2. Nous avons montré que VSTM2A agit en amplifiant la réponse aux Bone Morphogenetic Protein (BMP) favorisant ainsi l’expression de
Pparγ2. Nous proposons un modèle dans lequel VSTM2A est essentiel pour maintenir et amplifier le potentiel
adipogénique des préadipocytes. Une meilleure compréhension des facteurs régulant les phases précoces de l'adipogenèse pourrait permettre le développement de nouveaux outils régulant la formation du tissu adipeux.
iv
Abstract
Obesity affects the life of millions of humans worldwide and is the result of complex interactions between genes and environment. Factors involved in the development of obesity include genetics, which may explain why some humans are more susceptible to become obese. From a molecular point of view, the adipogenic cascade allowing preadipocytes to differentiate into mature adipocytes is a dynamic and well characterized phenomenon. However, the factors defining the adipogenic potential of the preadipocytes as well as the renewal of the adipocytes remain unknown. Our objective was to identify and characterize new genes defining the identity of preadipocytes capable of influencing the development of adipose tissue.
By performing serial dilutions of a culture of 3T3-L1 preadipocytes, we have isolated and amplified 23 new cell lines that we have classified according to their adipogenic potential. A microarray allowed us to identify the genes differently expressed between high and low adipogenic lines. We have identified a new gene, unknown from the literature, named V-set and transmembrane domain containing 2A (Vstm2a). The objective of my thesis was to understand the implication of this gene in the development of the adipocytes in vitro and in the formation of adipose tissue in vivo.
We first identified that Vstm2a was the most differentially expressed gene between the Low and High adipogenic lines, its expression being elevated in lines with a high adipogenic potential. A positive correlation emerged between the expression of Vstm2a and Pparγ2 in the preadipocytes. During adipocyte development in
vitro, the expression of Vstm2a always precedes PPARγ2 activation, a key factor regulating adipogenesis. This
expression pattern was also found in vivo during adipose tissue formation and expansion. VSTM2A-expressing cells at the developmental stage are found in the vicinity of the vasculature and muscle cells, a characteristic of adipose precursors. In adults, Vstm2a expression is enriched in the adipose precursor population identified with
the surface markers LIN-CD29+CD34+SCA1+PDGFRα+. We found that VSTM2A is a glycosylated protein that is
abundantly secreted by cells with a high adipogenic potential. Overexpression of intracellular VSTM2A is sufficient to promote the adipogenic potential of fibroblastic cells, an effect associated with a rise in basal Pparγ2 expression. Conversely, VSTM2A knockdown impairs adipogenesis by reducing the expression of Pparγ2. We found that VSTM2A promotes Pparγ2 expression by amplifying BMP signaling. Here, we propose a model in which VSTM2A is expressed to maintain and amplify the adipogenic potential of adipose precursors. A better understanding of the factors regulating early steps in adipogenesis could allow the development of new tools to regulate adipose tissue formation.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... ix
Liste des figures ... x
Liste des abréviations ... xi
Remerciements ... xv
Avant-propos ... xviii
Article présenté ... xix
Introduction ... 1
1.
Quand déséquilibre des apports et des dépenses rime avec obésité :
préoccupation actuelle et prédispositions génétiques au développement du
tissu adipeux ... 1
1.1. L’obésité, un phénomène de société oppressant avec des conséquences désastreuses pour la santé ... 1
1.1.1. Qu’est-ce que l’obésité ? ... 1
1.1.2. L’obésité, un phénomène croissant et menaçant pour la santé ... 2
1.1.3. Le tissu adipeux, un héritage de l’évolution non adapté à notre société ... 2
1.2. Les causes génétiques favorisant l’obésité ... 3
1.2.1. Environnement obésogène et études de corrélation familiales ... 3
1.2.2. Obésité monogénique ... 4
1.2.3. Obésité syndromique ... 5
1.2.4. Obésité polygénique ... 5
2.
Le tissu adipeux, un tissu complexe : ... 9
2.1. Les différents dépôts adipeux ... 9
2.1.1. Le tissu adipeux blanc ... 9
2.1.1.1. Délimitation du tissu adipeux blanc ... 10
2.1.1.2. Différences régionales ... 10
2.1.2. Les tissus adipeux brun et beige ... 12
2.1.2.1. Brun ... 12
2.1.2.2. Beige ... 13
2.2. Le tissu adipeux blanc : des fonctions et types cellulaires différents ... 14
2.2.1. Lien entre obésité et fonction endocrine du tissu adipeux ... 14
2.2.1.1. L’infiltration de macrophages associée à l’obésité ... 14
vi
2.2.1.2.1. Leptine ... 16
2.2.1.2.2. TNFα ... 17
2.2.1.2.3. IL-6 ... 17
2.2.1.2.4. Les autres molécules inflammatoires ... 17
2.2.1.3. Les adipokines anti-inflammatoires ... 18
2.2.2. Fibroblastes et matrice extracellulaire du tissu adipeux ... 19
2.2.3. Innervation et tissus adipeux ... 20
3.
Mise en place, expansion et renouvellement adipocytaire : mécanismes
d’hyperplasie et d’hypertrophie ... 23
3.1. Formation du tissu adipeux ... 23
3.1.1. Chez l’homme ... 23
3.1.2. Chez la souris... 24
3.2. Développement et expansion du tissu adipeux ... 24
3.3. Renouvellement adipocytaire au sein du tissu adipeux ... 27
3.4. Limites concernant les études mesurant l’expansion d’un tissu adipeux 27
4.
L’adipogenèse : étapes de détermination et de différenciation ... 29
4.1. La différenciation terminale : facteurs clés et mécanismes moléculaires 29 4.1.1. Peroxisome proliferator-activated receptor γ (PPARγ) ... 29
4.1.2. Les modèles cellulaires pour étudier l’adipogenèse ... 30
4.1.3. La cascade adipogénique ... 31
4.1.4. Modulation de l’activité de PPARγ ... 34
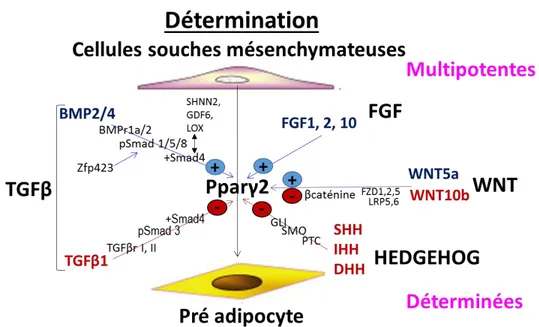
4.2. Détermination adipogénique ... 35
4.2.1. Les cellules souches mésenchymateuses (MSC) : différentes voies de différenciation ... 36
4.2.2. Facteurs participants à l’engagement adipeux ... 37
5.
Les préadipocytes ... 41
5.1. Marqueurs de surface définissant un préadipocyte ... 41
5.2. Marqueurs géniques définissant un préadipocyte ... 44
5.2.1. Pparγ2 ... 44
5.2.2. Pref1 ... 44
5.2.3. Zfp423 ... 45
5.2.4. Wisp2 ... 45
5.3. Caractérisation in vivo des préadipocytes ... 48
5.3.1. Traçage cellulaire in vivo : les modèles de souris ... 48
5.3.2. Les précurseurs adipeux en étroite association avec les vaisseaux sanguins ... 53
5.3.3. Origine du tissu adipeux ... 54
6.
Complexité des préadipocytes ... 57
6.1. Des précurseurs adipeux présentant une différence temporelle ... 57
6.1.1. Identification de précurseurs adipeux embryonnaires et adultes... 57
6.1.2. Deux types de précurseurs adipeux avec des modes de fonctionnement différents ... 58
6.2. Caractérisation de la prolifération des précurseurs adipeux dans un environnement obésogène ... 59
vii
6.2.2. Des précurseurs adipeux différemment activés, suite à un signal nutritionnel, selon le dépôt
et le genre ……….60
6.3. Des différences spatiales pour les précurseurs adipeux ... 62
6.3.1. Différents dépôts, différents précurseurs... 62
6.3.2. Les précurseurs beiges-bruns ... 63
6.4. Aux frontières des précurseurs adipeux ... 64
6.4.1. Les limites des précurseurs adipeux ... 64
Conclusion ... 70
Problématique, objectifs généraux et hypothèse de recherche : ... 71
Objectifs spécifiques ... 72
ARTICLE ... 73
AMPLIFICATION OF ADIPOGENIC COMMITMENT BY VSTM2A... 73
AVANT PROPOS ... 74
RÉSUMÉ ... 75
ABSTRACT ... 75
INTRODUCTION... 76
RESULTS ... 78
Identification of VSTM2A as a factor expressed by committed preadipocytes ... 78
VSTM2A a conserved protein expressed early during adipocyte development ... 79
VSTM2A expressing cells closely associate with the vasculature in developing WAT and express markers of adipose progenitors in adult WAT. ... 80
VSTM2A is a glycoprotein secreted by committed preadipocytes ... 81
Overexpression of VSTM2A induces the spontaneous differentiation of preadipocytes whereas its depletion severely impairs this process. ... 82
VSTM2A controls adipogenic commitment by amplifying BMP signaling and Pparg2 expression. ... 83
DISCUSSION ... 85
MATERIAL AND METHODS ... 88
AUTHORS CONTRIBUTION ... 91
ACCESSION NUMBERS ... 91
ACKNOWLEDGEMENTS ... 91
FIGURES ... 92
SUPPLEMENTAL INFORMATION ... 100
Supplemental methods ... 100 Supplementary figures ... 106Discussion générale ... 115
Partie 1 : Résumé des principaux résultats ... 115
Identification de VSTM2A comme un facteur hautement enrichi dans les préadipocytes commis ... 115
VSTM2A est une protéine conservée et exprimée tôt durant le développement d’un adipocyte in vitro et in vivo 115 Chez l’adulte, VSTM2A est une protéine exprimée dans le tissu adipeux en expansion ... 116
VSTM2A est exprimé par des cellules en périphérie des vaisseaux sanguins et par des cellules exprimant des marqueurs préadipocytaires ... 116
viii
La surexpression de VSTM2A in vitro favorise la différenciation adipocytaire spontanée et sa
sous-expression empêche cette différenciation ... 117
VSTM2A contrôle l’engagement adipeux en amplifiant le signal BMP et l’expression de PPARγ2 ... 117
Partie 2 : Discussion et pistes de recherches futures ... 118
Dualité Vstm2a-Pparγ2 ... 118
La voie des BMP, un mécanisme à approfondir ... 120
VSTM2A, une protéine inconnue se présentant sous plusieurs formes ... 121
VSTM2A, une protéine sécrétée mais dans quel but ? ... 122
VSTM2A une protéine exprimée dans le cerveau, de nouvelles perspectives de recherche ... 126
Le modèle KO VSTM2A, un projet futur pour l’exploration des hypothèses in vivo ... 128
Discussion sur les modèles murins pouvant être développés pour étudier VSTM2A in vivo ... 128
VSTM2A un potentiel marqueur de précurseurs adipeux ?... 130
Conclusion générale ... 131
ix
Liste des tableaux
Introduction :
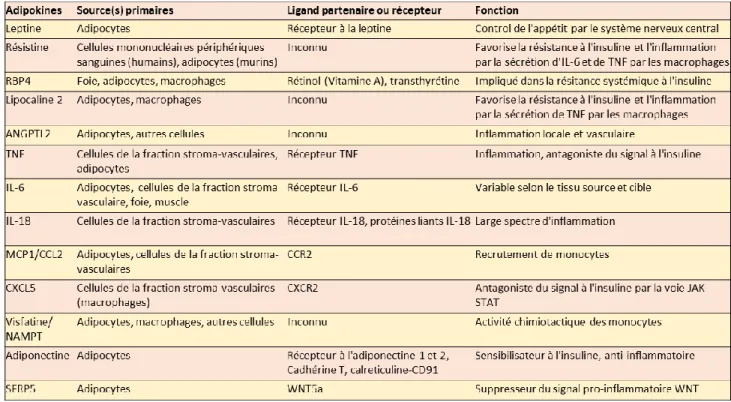
Tableau 1 : Tableau regroupant les adipokines clés du tissu adipeux et quelques informations les concernant. ... 16 Tableau 2 : Répertoire des informations de gènes identifiés comme marqueurs de préadipocytes ... 47
x
Liste des figures
Introduction
Figure 1 : Schéma décrivant les différentes étapes d’études polygéniques. ... 6
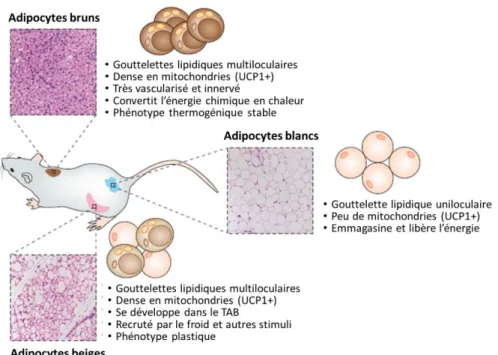
Figure 2 : Représentation schématique récapitulant des caractéristiques propres aux adipocytes bruns, blancs, beiges. ... 9
Figure 3 : Schéma des deux processus participant à l’expansion du tissu adipeux. ... 23
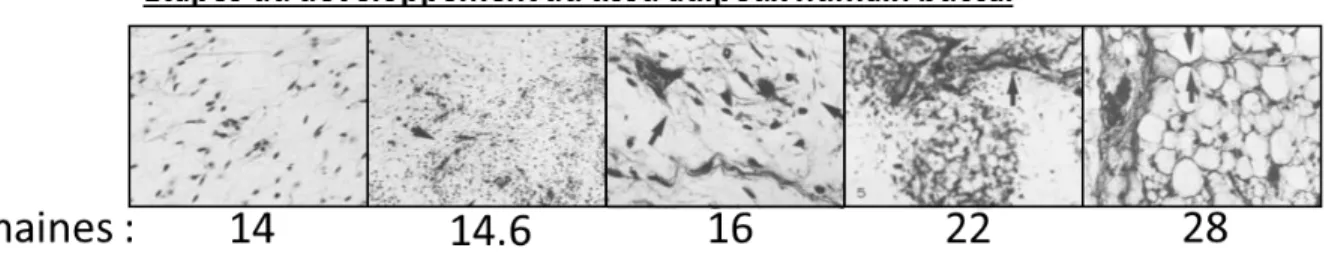
Figure 4 : Photographies microscopiques des différentes étapes de développement du tissu adipeux humain buccal. ... 23
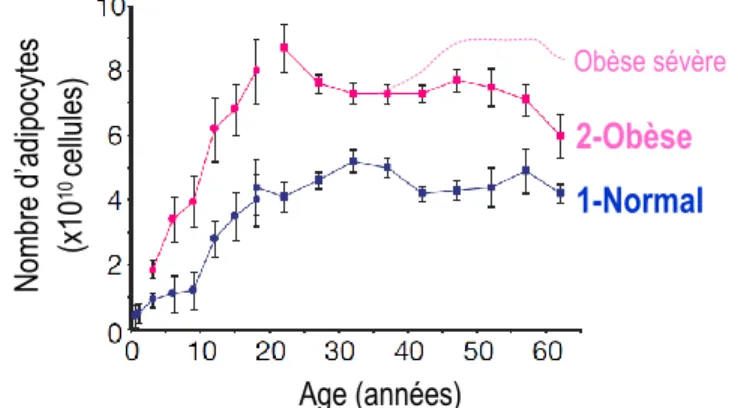
Figure 5 : Graphique représentant le nombre d’adipocytes en fonction de l’âge pour des individus de poids normal (1 bleu) ou obèse (2 rose). ... 25
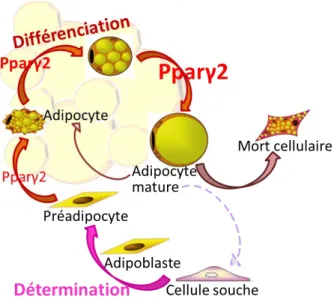
Figure 6 : Schéma du cycle de vie de l’adipocyte. ... 29
Figure 7 : Schéma simplifié de la cascade adipogénique durant la phase de différenciation. ... 34
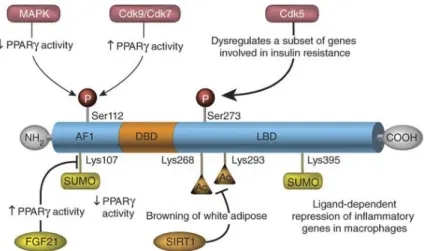
Figure 8 : Schéma des modifications post-traductionnelles de PPARγ. ... 35
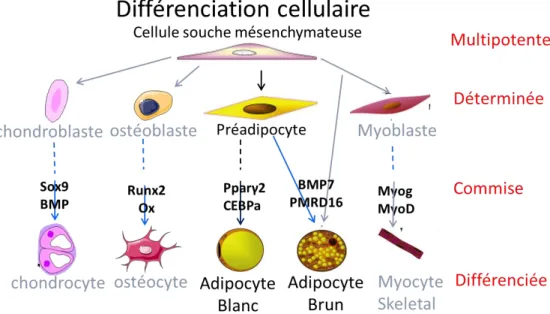
Figure 9 : Schéma montrant les différentes voies de différenciation que peut prendre une cellule mésenchymateuse. ... 36
Figure 10 : Schéma des voies impliquées dans la détermination des cellules souches mésenchymateuses vers le stade préadipocytaire. ... 37
Figure 11 : Représentation schématique indiquant les marqueurs de surface de cellules adipeuses à différents stades durant l’adipogenèse. ... 43
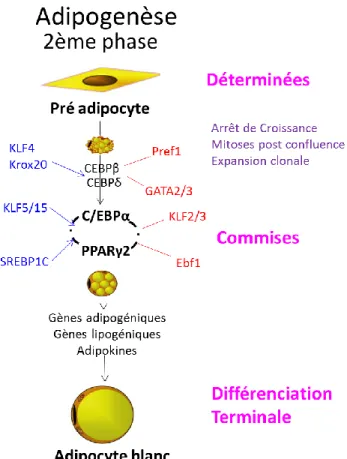
Figure 12 : Schéma de l’interaction de régulateurs transcriptionnels précoces menant à la formation d’adipocytes blancs... 46
Figure 13 : Schéma des différents systèmes utilisés pour l’étude in vivo des précurseurs adipeux. ... 50
Article
Figure 1. Identification of VSTM2A as a gene highly expressed in committed preadipocytes. ... 92Figure 2 - VSTM2A is expressed early in adipose cell development in vitro and in vivo ... 93
Figure 3. VSTM2A expressing cells in WAT are adipose precursors that closely associate with the vasculature. ... 94
Figure 4 - VSTM2A is a glycoprotein secreted by committed preadipocytes. ... 95
Figure 5 - VSTM2A induces the spontaneous conversion of preadipocytes and MSCs into adipocytes. ... 96
Figure 6 - VSTM2A knockdown impairs adipogenesis. ... 97
Figure 7 - VSTM2A controls adipogenic commitment by amplifying BMP signaling and Pparg2 expression. .. 98
Discussion générale
Figure 1: Schéma bilan de l’étude « Amplification de l’engagement adipeux par Vstm2a ». ... 117xi
Liste des abréviations
AA = Acides Aminés
ACC = Acetyl Coenzyme A Carboxylase AdipoQ = Adiponectine
ADN = Acide désoxyribonucléique ASC = Adipose Derived Stem Cell AGL= Acide Gras Libre
AgRP = Agouti Related Protein
AMO = adipocytes de la moelle osseuse AMPc = Adénosine Monophosphate cyclique AMPK = AMP-activated protein Kinase ATP = Adénosine Triphosphate
BCL6 = Zinc finger protein B cell lymphome 6 BDNF = Brain-Derived Neurotrophic Factor BMP = Bone Morphogenetic Protein CDK = Cyclin Dependant Kinase
CEBP = CCAAT-Enhancer-Binding Proteins CHOP = CEBP Homologous Protein CIDEA = Cell Death Activator CNV = Copy Number Variation
CREB = C-AMP Response Element-Binding protein
CSMO = Cellules Souches mésenchymateuses de Moelle Osseuse DIES1 = Differentiation of Embryonic Stem cells 1
D = Dimension
EBF = Early b cell Factor E = Embryonnaire
En1 = Engrailed homeobox protein 1
ERK1 = Extracellular signal Regulated Kinase 1 FACS = Fluorescence-Activated Cell Sorting FGF = Fibroblast Growth Factor
GIANT = Genetic Investigation of Anthropometric Traits GLI = Glioblastoma
GLUT4 = Glucose Transporter type 4 GWAS = Genome Wide Association Study GWLS = Genome Wide Link Study HDAC = Histone Désacétylase IBMX = 3-Isobutyl-1-Methylxanthine
IFN = Interféron gamma
IGF= Insulin like Growth Factor IL= Interleukine
IMC = Indice de Masse Corporelle iNOS = inducible Nitric Oxide Synthase IRS = Insulin Receptor Substrate
xii
JAK2/STAT3 = Janus Kinase 2/Signal Transducer and Activator of Transcription 3 KLF = Kruppel Like Factor
KO = Knock Out LEP= Leptine
LEPR = Récepteur de la Leptine LPL= Lipoprotein Lipase LPS = Lipopolysaccharide M = Macrophage
MAPK = Mitogen-Activated Protein Kinase MC4R = Récepteur Mélanocortine 4 MCP1 = Monocyte Chemotactic Protein-1 MEC = Matrice Extracellulaire
MEF= Mouse Embryonic Fibroblasts mES= mouse Embryonic Stem cell Mir = MicroRNA
MSC = Mesenchymal Stem Cell NE = Norépinéphrine
NG2 = Neural Glial antigen 2
OMS = Organisation Mondiale de la Santé
PDGFR = Platelet-Derived Growth Factor Receptor
PGC1 = Peroxisome Proliferator-Activated Receptor Gamma Coactivator 1 Alpha
PI3K = Phosphoinositide 3-Kinase PKB = Protein Kinase b
PLA = Processed Lipoaspirate PLIN1 = Périlipine
POMC = Pro-Opiomélanocortine P = Postnatal
PPAR = Peroxisome Proliferator-Activated Receptors PRDM16 = PR Domain containing 16
PREF1 = Preadipocyte Factor 1 QTL = Quantitative Trait Locus ROS = Dérivé Réactif de l’Oxygène SFRP = Secreted Frizzled-Related Protein SHH = Sonic Hedgehog
α-SMA = α-Smooth Muscle Actin SNC = Système Nerveux Central SNP = Single Nucleotide Polymorphism SNS = Système Nerveux Sympathique SVF = Stromal Vascular Fraction
TABsc = Tissu Adipeux Blanc sous cutané TABr = Tissu Adipeux Brun
TABv = Tissu Adipeux Blanc viscéral
TAF7L= TATA-box binding protein Associated Factor 7 Like TCF7l1 =Transcription Factor 7 Like 1
xiii TG = Triglycérides
TGFβ =Transforming Growth Factor beta Th = Lymphocyte T
TNF = Tumor Necrosis Factor TZD =Thiazolidinedione UCP= Uncoupling Protein
VEGF = Vascular Endothelial Growth Factor VSTM2A = Vset and Transmembrane protein 2A WHR = Waist-to-Hip Ratio
WISP2 = WNT1 Inducible Signaling Pathway protein-2 WT1 = Wilms Tumor protein 1
xiv
« Si vous voulez que vos rêves se réalisent ne dormez pas. »
Proverbe Juif
Mais…
« Sachez vous éloigner car, lorsque vous reviendrez à votre travail, votre jugement sera plus sûr. »
xv
Remerciements
Je ne peux que prendre la peine de remercier les personnes qui ont été à mes côtés au cours de toutes ces années et également lors de ces travaux de Doctorat. Sans vous formateurs, collègues, amis, famille je n’aurais jamais pu atteindre ce niveau de savoir-faire, connaissances, ni même cette persévérance et motivation. La vie, tout comme la science ne peut être qu’une scène de partage pour un enrichissement et un accomplissement entier.
Je tiens plus que tout à remercier mon directeur de recherche Mathieu Laplante pour m’avoir accueilli dans son laboratoire et fait confiance pour avancer dans tous les labyrinthes de la recherche scientifique. Cette personne exemplaire, ce talentueux directeur de recherche m’a tellement appris : que ce soit les diverses techniques de laboratoire ou la réflexion et la persévérance. Merci beaucoup de toujours avoir été présent, même dans les moments les plus délicats qui peuvent tomber les samedis matins… Ton ingéniosité et ta motivation sont une réelle force qui ont permis de mener ce projet aussi loin qu’il nous a été possible. Merci beaucoup pour ton soutien, qui, jusque dans les moments difficiles de la thèse s’est révélé être un véritable moteur.
Je tiens également à remercier du fond du cœur Yves Gélinas, une personne exceptionnelle, un véritable « parrain », qui avec sa rigueur m’a permis d’acquérir des techniques avec précision, qui avec sa joie de vivre illumine nos quotidiens, et qui avec sa force et sa délicatesse s’occupe de nous dans la vie de laboratoire et même plus. Je ne peux énumérer tous les services rendus tellement la liste serait longue, merci.
Enfin Mr Deshaies, mon co-directeur de recherche fait partie des personnes les plus admirables à mes yeux et je remercie sa gentillesse, son soutien et sa générosité.
Je tiens bien entendu à remercier les collègues devenus amis : Marie Pier une personne d’une bonté hors norme, qui nous a tous accueillis les bras ouverts, nous a partagé son amour et bien plus. Son énergie débordante, sa générosité et son intelligence sont des forces impressionnantes à mes yeux, c’est une véritable perle à l’état pur. Mathilde l’amie que j’aurais aimé rencontrer bien plus tôt, de nombreux moments partagés en l’espace d’une année sont ancrés dans ma mémoire à tout jamais, se ponctuant des meilleurs plaisirs de la vie : visites, musique, chocolats, sorties cafés, alcool, beaucoup de joie et de rires ! Une fille talentueuse, gentille, tolérante avec laquelle je ne me lasse pas d’avoir du plaisir. Mon post doctorant préféré Christian avec qui le laboratoire était un réel plaisir, une personne formidable d’une tolérance et d’une gentillesse impressionnante. Ta joie de vivre m’a bien manqué, tu es parti trop tôt. Alex qui m’a fait découvrir et apprécier la vie à Québec à mon arrivée et qui avec Sophie ont toujours été présents jusque dans les moments les plus difficiles à l’hôpital, je les en remercie.
xvi
Les collègues que j’ai pu côtoyer au laboratoire mais aussi autour d’un verre, qui ont su me conseiller comme Kanta, Boris, Inan, Christophe et un remerciement spécial à Damien qui a toujours été là pour me redonner le sourire.
Les filles du laboratoire avec qui j’ai partagé d’excellents moments au laboratoire, mais aussi en dehors lors de nos sorties : Stéphanie, Sandrine, Catherine vous êtes des personnes que j’apprécie du fond du cœur, vous avez toujours su me choyer, je vous en suis très reconnaissante. Je remercie aussi les gars Nico et Romain ainsi que les membres des autres équipes qui nous ont entourés, supportés, aidés et avec qui j’ai eu beaucoup de plaisir à travailler : Julie, Geneviève, Marie Claude, Élise, Camila. Je tiens également à remercier les personnes qui ont participé au projet comme stagiaire et qui ont travaillé avec motivation et rigueur : Armande, Marc Antoine et un remerciement particulier à Etienne qui est resté en maîtrise.
J’ai également une pensée pour les personnes qui m’ont entourée durant ces nombreux moments passés au laboratoire comme les gens du ménage, les gardiens, m’accompagnant ainsi aux heures les moins communes.
Enfin, j’en arrive aux amis avec lesquels j’ai pu partager d’excellentes soirées qui étaient animées de rire, de bonne humeur, et d’excellents souvenirs : merci Marion, Marine, Vincent, Angélique, Yann, Noémie. Merci aussi à mon groupe d’amis dont mes ex colocataires Julio et Francy ainsi que Kevan, Renato, Catherine, Yohana avec qui les soirées étaient toujours de véritables réussites qui me réchauffaient le cœur et m’aidaient à repartir sur des bases saines et positives.
Je tiens également à remercier du fond du cœur les bras qui m’ont câlinée, réconfortée, soutenue… Je tairais volontairement l’identité pour garder cette part d’intimité néanmoins l’importance n’a d’égale à mes yeux. Un partage spécial où plaisir, pureté, passion remplissaient mon cœur et mon âme.
Je tiens bien entendu à remercier par-dessus tout ma famille qui a toujours été là pour moi, et qui malgré la distance m’a accompagnée et portée durant cette aventure. Un amour si fort nous unit et me donne la force d’avancer au quotidien et de me dépasser. Mon père, ma mère et mon frère, le noyau de la famille qui sont tout ce que j’ai de plus précieux sur terre, mais également les cousins et cousines et toute la famille que j’aime du fond du cœur. Des personnes qui sont toujours là pour me réconforter, me soutenir et me rappeler les véritables valeurs de la vie. Je tiens également à remercier les amis et la famille qui ont fait le grand pas et sont venus jusqu’à Québec pour profiter de moi et des beautés de la ville. Ces présences étaient de véritables bouffées d’oxygène, et pendant l’espace d’un moment, les journées de folies du Doctorat étaient mises entre parenthèses et le temps était consacré au partage humain. Je tiens bien entendu à remercier les amis laissés en France que j’ai malheureusement légèrement délaissés durant ces années mais à qui je n’ai cessé de penser.
Une mention spéciale va à Mr Guy Houde mon propriétaire « ange gardien », toujours prêt à m’aider et à être disponible pour me faire découvrir Québec. Les nombreux services rendus ne se comptent plus, de même que les expériences inimaginables que j’ai pu vivre à bord de son avion, visitant Québec au gré des
xvii
saisons mais aussi des places (Ottawa, Gaspésie, Québec et ses alentours). Ces souvenirs dignes de l’imaginaire resteront à tout jamais associés en la personne généreuse et dévouée que représente Mr Guy Houde.
Je tiens également à remercier les nombreuses personnes avec qui j’ai passé d’excellents moments à Québec comme celle de la danse dont Michael qui m’a fait découvrir le Rock’n’roll, mais aussi les gens du fitness qui ont toujours été très accueillants, dynamiques et motivants et qui ont su m’entourer dans ces moments de solitudes par leurs énergies positives débordantes.
Mais quels délicieux moments j’ai passé à Québec ! Je repars tellement enrichie autant sur le plan scientifique où je dispose désormais d’un bagage de techniques, de connaissances et de réflexions que sur le plan personnel. Les Québécois sont des gens formidables où les sourires, la positivité, l’accueil, l’entraide rayonnent au quotidien. La richesse et la beauté de la ville par toutes les saisons font désormais partie de moi. Je finis donc cette thèse tellement grandie, enrichie, femme mais aussi triste de devoir partir si tôt et de laisser toutes les amitiés tissées et toutes les habitudes adoptées.
xviii
Avant-propos
Le présent ouvrage est déposé à la Faculté des études supérieures de l'Université Laval pour l'obtention du diplôme de Philosophiae Doctor ès Sciences (Ph.D.). Cette thèse porte essentiellement sur le rôle de la nouvelle protéine VSTM2A dans l’engagement adipeux d’un préadipocyte. La thèse comprend une introduction générale rédigée en français qui s’articule autour de la problématique de l’obésité, de ces préoccupations actuelles notamment en rapport avec la santé, ainsi que des prédispositions génétiques pouvant favoriser son développement. On y évoque aussi la complexité du tissu adipeux, se catégorisant en plusieurs types de dépôts chacun avec des caractéristiques différentes, puis l’accent est mis sur le tissu adipeux blanc en évoquant ces différentes fonctions et constituants. Par la suite, les mécanismes intervenants lors de la mise en place, l’expansion et le renouvellement adipocytaire ont été soulevés. Puis les deux phases participant à l’adipogenèse à savoir la phase de différenciation terminale et de détermination ont également été développées. Enfin, les différents marqueurs de surface et géniques définissant un préadipocyte, ainsi que sa caractérisation
in vivo ont largement été décrits. Pour finir, le préambule souligne la complexité qui règne autour des
préadipocytes qui présentent des caractéristiques temporelles, spatiales et régionales variables. L’unique chapitre qui compose le corps de ma thèse expose l’ensemble des résultats les plus pertinents obtenus durant ces 4 années de thèse. Ce chapitre est sous forme d’article scientifique rédigé en anglais, tel que publié dans la revue Cell Reports. Enfin, une discussion finale résume les découvertes réalisées et aborde différentes perspectives de recherche sur le projet.
xix
Article présenté
Mon aventure au sein du laboratoire du Dr Mathieu Laplante m’aura permis de participer à différentes études connexes, cependant le principal de mon travail aura été consacré au projet VSTM2A. Les études connexes ne seront pas évoquées dans la thèse, elles sont néanmoins référées ci-dessous précédées d’un numéro.
Secco, B., Camire, E., Briere, M. A., Caron, A., Billong, A., Gelinas, Y., Lemay, A. M., Tharp, K. M., Lee, P. L.,
Gobeil, S., Guimond, J. V., Patey, N., Guertin, D. A., Stahl, A., Haddad, E., Marsolais, D., Bosse, Y., Birsoy, K., & Laplante, M. 2017. Amplification of Adipogenic Commitment by VSTM2A. Cell Rep, 18(1): 93-106.
1. Caron, A., Mouchiroud, M., Gauthier, N., Labbe, S., Villot, R., Turcotte, L., Secco, B., Lamoureux, G.,
Schum, M., Gelinas, Y., Marette, A., Richard, D., Sabatini, D., M. Laplante, M. 2017. Loss of hepatic DEPTOR alters the metabolic transition to fasting. Mol Metab, 6(5): 447-458.
2. Labbe, S., Mouchiroud, M., Caron, A., Secco, B., Freinkman, E., Lamoureux, G., Gelinas, Y.,
Lecomte, R., Bosse, Y., Chimin, P., Festuccia, W.T., Richard, D., Laplante, M. 2016. mTORC1 is Required for Brown Adipose Tissue Recruitment and Metabolic Adaptation to Cold. Sci Rep, 6: 37223.
3. Carbonneau, M., Gagne, L.M., Lalonde, M. E., Germain, M. A., Motorina, A., Guiot, M. C., Secco, B.,
Vincent, E. E., Tumber, A., Hulea, L., Bergeman, J., Oppermann, U., Jones, R. G., Laplante, M., Topisirovic, I., Petrecca, K., Huot, M. E., Mallette, F. A. 2016. The oncometabolite 2-hydroxyglutarate activates the mTOR signalling pathway. Nat Commun, 7: 12700.
1
Introduction
1. Quand déséquilibre des apports et des dépenses rime avec obésité :
préoccupation actuelle et prédispositions génétiques au développement
du tissu adipeux
1.1. L’obésité, un phénomène de société oppressant avec des conséquences désastreuses pour la santé
1.1.1. Qu’est-ce que l’obésité ?
Dans notre société occidentale, l’image psychosociale de la « graisse » a évolué au cours des années. Signe de santé au Moyen Âge, elle renvoie désormais à une image négative. Toutefois, la graisse ne se limite pas à sa simple valeur esthétique [1]. La première définition de l’obésité (XVIIIème siècle) se restreignait à sa dimension esthétique : « un excès de graisse ou de chair ». Seulement, l’Organisation mondiale de la santé (OMS) intègre en plus dans sa définition la composante santé : « une accumulation anormale ou excessive de graisse corporelle qui peut nuire à la santé » [2]. Pourtant la relation excès de gras/santé n’est pas nouvelle, Hippocrate avait déjà associé l'obésité à un "risque accru de mort subite" [3]. La notion de "poids idéal" et d'obésité, définie comme une dégradation d'un état parfait vers un état pathologique, apparaît au début du XIXe siècle. Les travaux d'Adolphe Quetelet définissent "le poids idéal" à partir de l'Indice de Masse Corporelle (IMC), conçu pour exprimer la corpulence en fonction de la taille. Il se définit comme le rapport du poids en kilogramme sur le carré de la taille en mètre. Cette approche connaîtra un vrai succès dans les années 1950-60, pour la définition des facteurs de risque dont les compagnies d'assurance ont besoin pour fixer les niveaux des primes [4]. Le poids santé se situe à un IMC entre 18,5-25. On parle de surpoids pour un IMC de 25-30 et d’obésité au-delà de 30, avec une classification pour les stades d’obésités : classe I pour un IMC de 30-35, classe II pour un IMC de 35-40 et classe III pour un IMC de 40-45. Bien que l’IMC ne fournisse pas une mesure directe du contenu en graisse de l’individu, des études ont montré que cette mesure corrèle assez bien avec la masse adipeuse dans une vaste partie de la population. Chez l’enfant, la classification de l’obésité est moins claire. En Amérique du Nord, on peut mentionner l’utilisation de courbes de croissance donnant l’IMC pour l’âge et le sexe divisées en percentiles. Ces courbes sont basées sur des données du National Hospital Care Survey (NHCS) et mise à jour en 2000 par le Center
for Disease Control and Prevention (CDC). Le percentile 85-95 définit le surpoids, un percentile supérieur à
95 correspond à l’obésité. En Europe, l’International Obesity Task Force aboutit à une courbe de référence différente mais équivalente. A ces données s’ajoutent les références propres à chaque pays et celles établies par l’OMS [5-7]. Les données de l’IMC chez l’enfant ne reposent pas sur des données épidémiologiques mais statistiques [8]. D’autres outils s’ajoutent à l’IMC pour évaluer l’obésité comme le tour de taille, le rapport tour
2
de taille/tour de hanches (WHR), le diamètre du cou (ou Tour de cou), les plis cutanés [9]. Cependant, du fait de sa simplicité et de son application rapide, l’IMC reste le plus utilisé.
1.1.2. L’obésité, un phénomène croissant et menaçant pour la santé
D’après l’OMS, en 2014, 39% de la population mondiale est en surpoids, et parmi eux, 15% sont obèses [2]. Cette proportion d’individus obèses est élevée aux États-Unis atteignant 36,5% d’après le constat
de 2011-2014 du CDC [8]. Un phénomène d’autant plus inquiétant qu’il ne se limite pas aux adultes. La
prévalence de l’obésité s’est accrue à un rythme alarmant parmi les enfants. On estime à 17% le nombre d’enfants/d’adolescents obèses aux États-Unis [8] et on parle de 42 millions d’enfants en surpoids dans le monde [2]. L’obésité infantile ayant plus que doublée en l’espace de 30 ans. Ainsi, l’obésité ne se limite plus à l’observation qu’en avait fait Buffon en 1749 l’associant à un processus inéluctable du vieillissement « Lorsque le corps a acquis toute son étendue en hauteur et en largeur par le développement entier de toutes ses parties, il augmente en épaisseur» [10]. Son ampleur présente dans toutes les tranches d’âge est désormais inquiétante. Une grande partie de la population mondiale vit dans des pays où le surpoids et l’obésité tuent plus de gens que l’insuffisance pondérale.
Initialement, l’obésité était considérée comme simple « facteur de risque » pour certaines maladies chroniques non transmissibles, or dès 1997, l’OMS lui assigne le statut de « maladie » pour faire face à la recrudescence mondiale et aux conséquences métaboliques associées [11]. Désormais, le système de santé publique est en alerte, le terme « épidémie » est évoqué pour souligner la dimension de cette menace collective et sanitaire [12]. En effet, les conséquences métaboliques liées à l’obésité sont nombreuses : diabète, maladies cardiovasculaires, cancer, syndrome métabolique, apnée du sommeil et cirrhose [13]. Les données de 2000-2005 ont abouti à une estimation de 168 milliards de dollars pour les coûts qu’imposaient le surpoids et l’obésité au système public américain [14]. L'Union européenne quant à elle constatait déjà en 2002 des coûts annuels directs et indirects de 32,8 milliards d'euros, des coûts qui n’ont fait qu’augmenter [15]. Pour le Québec, on parle de 1,5 milliards de dollars chaque année [16]. L’augmentation de la prévalence de l’obésité n’est pas limitée aux pays industrialisés. En effet, la proportion de gens obèses augmente aussi drastiquement dans les pays en développement, du fait de l’occidentalisation de leur style de vie, et d’une génétique favorable.
1.1.3. Le tissu adipeux, un héritage de l’évolution non adapté à notre société
Les temps modernes sont marqués par un haut apport calorique (alimentation grasse et sucrée) et un manque d’exercice physique en lien avec un mode de vie relativement sédentaire [17]. Cependant, ce qui est désormais considéré comme une maladie provient d’un mécanisme qui était considéré comme un avantage dans les temps primitifs où la nourriture était moins accessible et que la haute dépense énergétique
3
par l’activité physique était un mode de vie [18]. L’évolution a contribué à cette capacité de stockage du gras, un processus conservé entre les vertébrés et invertébrés par de nombreux aspects, incluant le programme développemental, les cascades de transcriptions et les protéines maîtresses qui régulent la synthèse, le stockage et la lipolyse du gras [19-22].
Des mécanismes homéostatiques permettent de garder une balance énergétique équilibrée tout au long de notre vie. La régulation des apports et dépenses est contrôlée par des signaux neuronaux dans l’hypothalamus et des dérégulations à ce niveau central peuvent s’avérer fatales pour cet équilibre énergétique. Un surplus de tissu adipeux comme un déficit de celui-ci s’avèrent néfastes pour l’organisme [23, 24]. De plus, le tissu adipeux est un tissu plastique et dynamique ayant une grande capacité d’expansion. Face à différents facteurs homéostatiques et externes, il est capable d’une expansion allant jusqu’à 15 fois. Ainsi, une balance énergétique positive mène à une augmentation des réserves énergétiques sous forme de triglycérides (TG) dans les cellules adipeuses, se traduisant chez l’adulte par une augmentation de taille de l’adipocyte. Une balance énergétique négative quant à elle résulte en une diminution de la taille des adipocytes sans altérer le nombre. Ceci explique en grande partie l’échec de la perte de poids chez l’adulte car l’organisme maintient un même nombre d’adipocytes mais laissés dans un état avide en TG et économe d’énergie [25].
Ainsi, l’épidémie d’obésité à laquelle nous faisons face rend le tissu adipeux un objet d’étude d’intérêt. L’obésité est une condition complexe impliquant différents facteurs. Parmi ces facteurs nous pouvons souligner le rôle synergique entre la génétique et l’environnement.
1.2. Les causes génétiques favorisant l’obésité
1.2.1. Environnement obésogène et études de corrélation familiales
L’industrialisation et ses conséquences économiques ont mené à une augmentation de l’urbanisation et la sédentarisation de la force de travail. Couplé à un accès facile à la nourriture en lien avec la globalisation du marché, cette réduction des dépenses énergétiques et augmentation des apports caloriques ont contribué à créer ce que l’on appelle l’environnement « obésogène ». Ainsi, l’excès de gras s’avère être une adaptation collective à cet environnement pathologique [13, 18]. Or, bien que la population soit soumise au même environnement « obésogène » participant à l’augmentation de la proportion de personnes obèses dans notre société, des groupes d’individus génétiquement susceptibles de gagner du poids sont devenus excessivement obèses [26]. On peut toutefois noter que le dernier et le premier percentile de l’IMC n’a pas vraiment changé indiquant la présence dans notre société d’un sous-groupe d’individus génétiquement plus susceptible à l’obésité et d’un autre plus résistant.
4
Le lien entre génétique et obésité est souligné par de nombreuses études : études d’épidémiologie génétique, études d’association génétique, études du génome, études de séquençage du génome, études basées sur des gènes candidats, l’analyse de single nucleotide polymorphism (SNP) avec une exploration fonctionnelle ou positionnelle, études de génomes à grande échelle basées sur des études de liens ou d’association, études de criblage du génome [27-31].
Les arguments en faveur de la génétique dans le développement de l’obésité ont été mis en évidence très tôt à partir d’études de corrélations familiales. L’étude des jumeaux réalisée entre des vrais et des faux jumeaux révèle que ce sont les vrais jumeaux qui montrent une ressemblance plus élevée dans la composition en gras corporel [32]. On peut ajouter que des jumeaux élevés séparément n’ont pas un poids significativement différent de ceux élevés ensemble indiquant une faible contribution de l’environnement face
à un même bagage génétique [30, 33]. De plus, les études d’adoption montrent que la relation entre la
catégorie de poids des enfants adoptés et leurs parents biologiques est fortement liée tandis qu’aucun lien n’est fait avec leurs parents adoptifs [34]. Dans une autre étude de jumeaux, la réponse observée face à une suralimentation est très similaire entre jumeaux d’une même paire, mais variable d’une paire à l’autre. Ce résultat montre l’importance des gènes dans la réponse à l’environnement nutritionnel mais démontre aussi un déterminisme génique dans la répartition du tissu adipeux [35]. Cette domination de la génétique face à l’environnement dans la répartition de la graisse a également été soulignée avec l‘étude des familles de Québec [36].
1.2.2. Obésité monogénique
D’un point de vue strictement génétique, plusieurs types de mutations ont été liées à l’obésité aboutissant à trois groupes : monogénique, syndromique et polygénique/obésité commune.
Pour l’obésité monogénique, un seul défaut dans un gène est responsable (1% des adultes obèses et 2-6% chez les enfants). Ce cas rare et très sévère survient dès l’enfance, il se traduit par une augmentation de l’appétit et une diminution de la satiété. Pour la plupart, ces mutations correspondent à un défaut dans la voie signalétique leptine-mélanocortine du Système Nerveux Central (SNC) qui est importante dans la régulation de l’homéostasie énergétique. On peut mentionner l’apparition des souris ob/ob et db/db qui montrent un excédent de tissu adipeux et un problème de reproduction. Une mutation dans le gène codant pour la leptine (Lep) est en cause pour la ob/ob [37] et une mutation dans le gène codant pour le récepteur de la leptine pour la db/db (Lepr) [38]. Des mutations de la leptine ou de son récepteur ont aussi été retrouvées chez l’homme donnant également lieu à un phénotype obèse [39, 40]. Pour la déficience en leptine, le phénotype a pu être en partie renversé par l’ajout de leptine chez l’enfant atteint [41]. Un même phénotype d’obésité est observé suite à des mutations dans des gènes comme : Carboxypeptidase E (CPE), agouti (AGRP), Pro-opiomélanocortine (POMC) [42], Proprotein Convertase Subtilisin/Kexin Type 1 (PCSK1) [43,
5
44], Récepteur de la mélanocortine 4 (MC4R) [45, 46], Facteur neurotrophique dérivé du cerveau (BDNF),
Récepteur neurotrophique tyrosine kinase 2 (TRKB), tous des gènes impliqués dans le contrôle alimentaire
au niveau central.
La mutation de MC4R est la plus observée dans la population pour causer l’obésité monogénique, et elle est dominante. Cependant, du fait d’une pénétrance incomplète, l’expression de cette mutation est variable au sein de la population touchée. L’étendue du défaut génique et signalétique de MC4R corrèle avec le degré d’obésité. La relation gène-environnement est d’importance car des rats déficients en Mc4r sont non hyperphagiques sur un régime normal et hyperphagiques sur un régime riche en gras [47-49].
Ces mutations ont facilité la compréhension d’une partie du mécanisme de régulation centrale de l’appétit : la leptine, « hormone de satiété » synthétisée par le tissu adipeux, agit au niveau du noyau arqué de l’hypothalamus grâce à son récepteur et déclenche ainsi la sécrétion de neuropeptides anorexigènes parmi lesquels une protéine dérivée de la POMC, α-Melanocyte stimulating hormone (αMSH), qui agit par un récepteur hypothalamique (MC4R) pour exercer un effet anorexigène. En parallèle, la leptine inhibe les neuropeptides orexigènes comme AgRP. L’obésité monogénique facilite l’identification du lien gène-phénotype.
1.2.3. Obésité syndromique
L’obésité syndromique provient de défauts génétiques discrets ou d’anomalies chromosomiques créant des syndromes rares. Parmi les caractéristiques de ces syndromes, on compte l’obésité et des anomalies du développement comme un retard mental, des anomalies malformatives (dysmorphie, viscérale), des atteintes neurosensorielles, des troubles endocriniens (hypogonadisme, retard de croissance). Il n’est pas exclu que les conditions de vie de ces personnes, souvent en institut, puissent aussi participer au développement de cette obésité. Cependant, certains de ces syndromes partagent comme caractéristique une sévère hyperphagie et/ou des signes de dysfonctionnement hypothalamique. Parmi ces syndromes, on compte : Prader Willi, Alstrom, Cohen, Angelman, Bardet-Biedl, Osteodystrophie d’Albrigh, S. de Borjeson Forssman-Lehmann, Fragile X, Trisomie 21. Le plus fréquent, le syndrome Prader Willi, est une maladie autosomale dominante qui est caractérisée par de l’obésité, de l’hyperphagie, une diminution de l’activité fœtale, de l’hypotonie musculaire, un retard mental, une petite taille et un hypogonadisme. De nombreux problèmes de fonctionnement hypothalamiques et endocriniens ainsi que des taux anormaux de ghréline ont été répertoriés [30, 50, 51].
1.2.4. Obésité polygénique
L’obésité polygénique est déterminée par plusieurs gènes qui n’ont pas beaucoup d’effet pris individuellement mais dont la contribution cumulative devient significative en interaction avec des facteurs
6
environnementaux; on parle de gènes de prédisposition [52-54]. On compte deux stratégies élaborées par les chercheurs pour l’identification de ces gènes. Dépendante d’une hypothèse, c'est-à-dire en connaissant le gène d’intérêt ou gène candidat, mais aussi sans hypothèse, c’est-à-dire basée sur des régions d’ADN [55]. Pour la stratégie des gènes candidats, il s’agit d’étudier des gènes potentiellement impliqués dans la physiopathologie de la maladie. Les gènes candidats peuvent être fonctionnels ou positionnels (Figure 1). Ils peuvent être impliqués dans la prise alimentaire (signaux ou neuromédiateurs orexigènes ou anorexigènes), la dépense énergétique (protéines découplantes, leptine, récepteurs aux catécholamines), la biologie des adipocytes (facteurs de transcription, cytokines) [56]. De nombreux gènes candidats ont été proposés et étudiés menant à certains résultats intéressants, comme par exemple les récepteurs β1 à 3 ainsi qu’α2a [57-62], les protéines découplantes 1 à 3 (UCP), [63-69], l’adiponectine (ADIPOQ) [70, 71], LEP [72-75], LEPR [76, 77], Récepteurs Activés par les Proliférateurs de Peroxisomes γ (PPARγ) [78-81].
Cependant, peu de gènes candidats ont été associés à des phénotypes d’obésité à l’issue de méta analyses et seulement quelques-uns ont été validés par plusieurs études indépendantes (127 gènes candidats dont 22 validés dans la mise à jour de 2005) [29, 55]. Cette méthode s’avère donc peu concluante car quelques gènes seulement ont été confirmés au sein de la population générale du fait d’effets faibles et difficiles à reproduire dans les différentes populations humaines étudiées [82].
Figure 1 : Schéma décrivant les différentes étapes d’études polygéniques.
Pour étudier l’obésité chez l’homme d’un point de vue polygénique deux grands types de stratégie s’affrontent, elles-mêmes divisées en deux méthodes différentes. GWLS= genome-wide linkage scans; GWAS=genome-wide association studies. Inspiré de [55]
Pour la deuxième stratégie, l’analyse d’association pangénomique, le génome complet d’une large population est étudié afin de trouver de nouveaux gènes associés à l’obésité [83]. Les explorations de « génome entier » sont sans cesse à l’origine de nouveaux loci associés à l’obésité, découverts sur différents chromosomes et présentant une variabilité inter-ethnie évidente [84, 85]. Leur identification, associée aux techniques de clonage positionnel et de génomique fonctionnelle, permettra de mieux connaitre les déterminants moléculaires de l'obésité et de définir de nouvelles cibles thérapeutiques.
D’abord le Genome Wide Link Study (GWLS) consiste à parcourir le génome entier à grande échelle afin d’identifier des liens entre des loci potentiels et la condition d’obésité partagée par des familles (Figure
7
1). Une carte représentant la force des liens par des pics sous des régions de chromosome, permet d’identifier la position de gènes candidats. De cette analyse, des loci correspondant aux gènes Glutamate decarboxylase
2 (GAD2) [86], Ectonucléotide pyrophosphatase / phosphodiestérase 1 (ENPP1) [87, 88], Solute carrier family 6 member 14 (SLC6A14) ont été mis en évidence [89, 90]. Plus de quarante microsatellites ont ainsi été
identifiés, mais aucun des gènes correspondant n’a été validé pour le moment. Cette méthode basée sur des populations obèses a permis d’identifier de nombreux Quantitative Trait Loci (QTL). Dans la mise à jour de 2005, on notait 253 QTL répertoriés chez l’homme dont 52 validés dans plus de 2 études, et 408 QTL identifiés chez la souris [55, 91].
Cette approche est désormais remplacée par le Genome Wide Association Study (GWAS), une méthode qui permet d’identifier des SNP (variation d'une seule paire de bases) dans le génome entier en utilisant des statistiques puissantes pour étudier les interactions entre une maladie possible et toutes les variations communes dans le génome [92-95] (Figure 1). Parmi les différents loci identifiés par cette méthode on peut mentionner Insulin induced gene 2 (INSIG2) bien que des inconsistances pour sa validation demeurent [96-99]. Une large méta-analyse menée par le consortium Genetic Investigation of ANthropometric
Traits (GIANT), définit comme une collaboration internationale, a permis d’identifier de nombreux gènes
supplémentaires [100, 101]. La plupart de ces études ayant d’abord été réalisées chez les caucasiens, de nouvelles études apparaissent maintenant dans d’autres ethnies permettant d’identifier des loci supplémentaires dû à des structures haplotypiques différentes [102, 103]. La méta-analyse a également été confrontée à une cohorte d’enfants afin d’identifier quelques loci communs et ainsi de caractériser des variants opérants très tôt dans le développement de l’obésité [104, 105]. Le succès du GWAS repose à la fois sur le projet HAP MAP qui est un effort à grande échelle pour caractériser extensivement les variations de séquences chez l’humain, mais aussi du développement de panels de génotypage à haute densité permettant de marquer les allèles d’un large nombre de SNP en parallèle sur le génome (SNP consortium) [92-95, 106]. Cette méthode est très pratique car elle ne requiert aucun a priori sur le gène étudié, seule la génétique nous amène à la région du génome la plus fortement associée. D’après l’analyse de 2009, l‘approche GWAS a permis d’estimer un effet moyen sur l’IMC de 0,03-0,5 kg/m2 pour les variants polygéniques connus. De plus, 17 régions de gènes ont été identifiées comme ayant un petit effet répétable sur le poids corporel [107, 108]. Il reste encore à comprendre les mécanismes biologiques de ces loci et comment ils confèrent un risque pour l’obésité. Cependant, bien que de nombreux variants aient été identifiés, très peu de l’héritabilité a été expliquée. Typiquement on parle de 10% de l’héritabilité expliquée avec le GWAS (loci identifiés expliquant 2% et 1% de la variation interindividuelle de l'IMC et de la WHR). La technique n’est encore pas idéale : les variants les plus rares, l’épigénétique, les interactions entre variants ne sont pas pris en compte et de nombreuses limites concernent aussi l’hypothèse d’analyse [109, 110]. Une amélioration statistique est aussi
8
envisageable par une augmentation du nombre d’intervenants ou bien en ciblant une population davantage représentative.
Ainsi on peut évoquer les pratiques qui se développent dernièrement comme l’étude des SNP rares qui tient compte des allèles peu fréquents <5%, possible grâce au développement du génotypage. Elle a, par exemple, permis d’identifier des variants moins délétères sur les mêmes sites que des obésités monogéniques connues [111]. L’étude du Copy Number Variation (CNV) se développe aussi, car bien que ces produits de réarrangements génomiques soient assez rares, ils contribuent à expliquer des phénotypes d’obésité. Par exemple, le gène SH2B adapter protein 1 (SH2B1) est détecté par délétion, son dysfonctionnement se répercute sur la réponse à la leptine et l’insuline [112, 113]. Enfin, les études de modifications épigénétiques visent les mécanismes moléculaires affectant l’expression d’un gène sans en altérer la séquence, comme les modifications d’histones ou les méthylations d’ADN. Ces variations épigénétiques sont en grande partie dépendantes de l’environnement, ainsi le développement d’un embryon dans l’environnement intra-utérin est exposé à ce type de modification [114-116], de même plus tard durant le développement d’un individu comme rapporté pour des jumeaux dont l’écart épigénétique augmentait avec l’âge [117]. Les nouvelles techniques comme les ChIP-Seq et le séquençage de nouvelle génération, devraient être en mesure de fournir une image plus détaillée du profil épigénétique et ainsi tenir compte de cette variable dans les analyses de génome.
La part de la génétique dans l’obésité est dure à estimer du fait de différents critères utilisés dans les études, mais on peut citer une héritabilité estimée à 30-60% pour le WHR et 40-70% pour l’IMC [108, 118, 119]. L’identification de SNP liés à l’obésité est le point de départ d’études d’associations, qui elles-mêmes donneront l’importance du gène au sein d’une population afin de justifier la poursuite de sa caractérisation du côté fonctionnel. Les complications de l’obésité peuvent elles aussi être modulées par des facteurs génétiques, en particulier les dyslipoprotéinémies et le diabète de type 2 (gènes du métabolisme des lipides ou du glucose).
9
2. Le tissu adipeux, un tissu complexe :
Comme précédemment cité, l’obésité est la résultante d’une « accumulation anormale ou excessive de graisse corporelle [….] », sous-entendant le tissu adipeux blanc, cependant le dépôt blanc n’est pas le seul dépôt adipeux de l’organisme.
2.1. Les différents dépôts adipeux
Pendant longtemps, la littérature rapportait deux types de tissu adipeux, le blanc (TAB) et le brun
(TABr) (Figure 2). Cependant, une 3ème catégorie de tissu a émergé depuis quelques années, qui porte les
propriétés des deux premières, on parle de tissu adipeux Beige ou Brite. Ces tissus se discriminent par des différences histologiques, moléculaires et fonctionnelles. Le tissu adipeux blanc permet de stocker l’énergie, le brun assure la thermogenèse c’est-à-dire la production de chaleur, et le beige se comporte comme le brun
en réponse à un stimulus [120]. Le tissu adipeux blanc est beaucoup plus prépondérant que le brun ou le
beige qui restent restreints à des zones bien définies et dispersées.
Figure 2 : Représentation schématique récapitulant des caractéristiques propres aux adipocytes bruns, blancs, beiges.
Il existe trois types d’adipocytes : bruns, blancs, beiges. Leurs caractéristiques sont perceptibles sur les observations microscopiques illustrées sur les schémas et développées en une liste de points informatifs. Inspiré de [121].
2.1.1. Le tissu adipeux blanc
Le tissu adipeux blanc est caractérisé par des adipocytes présentant une seule large gouttelette lipidique entourée de protéines spécifiques [122]. Ces adipocytes permettent de conserver les acides gras, sources énergétiques importantes, sous un agencement sécuritaire pour l’organisme. Un excès calorique se traduit par une séquestration d’acides gras dans les adipocytes sous forme de TG. À l’opposé, un jeûne
10
favorise la libération des acides gras libres qui sont utilisés pour produire de l’énergie dans les tissus périphériques (Figure 2).
2.1.1.1. Délimitation du tissu adipeux blanc
Le tissu adipeux blanc, omniprésent dans l’organisme, peut être divisé en différents types basés sur leur situation anatomique mais qui témoigne aussi de caractéristiques différentes comme : un temps de développement, une apparence microscopique, une signature moléculaire et une fonction biologique différents.
Le tissu adipeux sous-cutané retrouvé en position interscapulaire et inguinale chez la souris se retrouve chez l’homme dans des positions abdominales, glutéales, crâniales et faciales. On peut noter une différence entre la couche superficielle et profonde séparées par un fascia superficiel pour le tissu abdominal. On peut également noter une différence entre les hommes et les femmes avec une disposition hanche-fesse chez la femme et épaule-nuque chez l’homme [123]. Ce dépôt se forme in utero au stade Embryonnaire 16
(E16) pour la souris et à la 14ème semaine de gestation pour l’homme [124, 125]. Une adiposité sous-cutanée
est associée à une protection métabolique [126-128].
Le tissu adipeux viscéral/intra abdominal est réparti en position péritonéale (omentale, mésentérique), rétropéritonéale (périaortique, périrénale) et périgonadique. Ce dépôt se forme juste après la naissance chez la souris (Postnatal 4 (P4)). Chez l’humain, il est difficile d’identifier le moment exact de sa formation car il y en a très peu avant la puberté [129]. Le tissu rétro-péritonéal a une localisation et des caractéristiques intermédiaires du sous-cutané et du viscéral. Une adiposité viscérale est associée à un profil métabolique perturbé et des risques de développer du diabète de type 2, de l’hyperlipidémie, des maladies cardiovasculaires, une résistance à l’insuline, de l’hypertension, entrainant un haut taux de mortalité et de morbidité [130-132].
D’autres dépôts adipeux existent dans l’organisme, ce sont des tissus de soutien retrouvés dans des endroits comme les paumes, les plantes de pieds, les orbites, le cuir chevelu, les régions péri-articulaires. Ils peuvent avoir un fonctionnement différent comme par exemple une régulation épidermique et hématopoïétique. Du tissu adipeux est également retrouvé dans la moelle osseuse (canaux médullaires des os longs) et en position péri ou intramusculaire ainsi que péricardiaque.
2.1.1.2. Différences régionales
Les différences métaboliques entre le tissu adipeux sous-cutané et viscéral peuvent être expliquées par des propriétés divergentes. D’abord, d’un point de vue histologique, le tissu adipeux viscéral est composé de larges adipocytes uniloculaires tandis qu’on note dans le sous-cutané la présence de nombreux adipocytes multiloculaires en plus des adipocytes matures. Le tissu adipeux viscéral est plus innervé, vascularisé, et
11
riche en cellules inflammatoires. Il est aussi plus susceptible à leur infiltration en cas d’obésité [133]. Le dépôt sous-cutané a un meilleur taux de renouvellement et de formation adipocytaire [134-136]. Il possède aussi une Lipoprotéine Lipase (LPL) plus active et une meilleure capacité de captation des acides gras libres (AGL) et des TG [137]. Le taux lipolytique entre les deux dépôts est également différent, identifié comme plus élevé dans le viscéral [138]. Ceci peut être expliqué en partie par une différence d’activité des récepteurs β-adrénergiques ainsi que des récepteurs à l’insuline, α2-β-adrénergiques et d’adénosine entre ces dépôts [139, 140]. Le tissu adipeux viscéral est métaboliquement plus actif et résistant à l’insuline libérant ainsi davantage d’AGL, d’adipokines et ayant une captation de glucose plus élevée [133]. D’autres facteurs, comme le flux sanguin, la proximité avec d’autres organes métaboliquement importants comme le foie ou l’intestin participent à ces différences inter-dépôts.
D’un point de vue fonctionnel, on note aussi une différence dans le profil moléculaire notamment en lien avec la taille de l’adipocyte. Par exemple, le tissu adipeux sous-cutané produit davantage de leptine et de glycogène synthase [141, 142]. Le tissu adipeux viscéral quant à lui exprime davantage d’interleukine 6 (IL-6), d’angiotensinogène, de Plasminogen Activator Inhibiteur PAI-1, de récepteurs aux glucocorticoïdes et d’androgènes [143-147]. Ces deux dépôts répondent également différemment à des stimuli externes. Par exemple, leur réponse face aux thiazolidinediones (TZD) et aux hormones stéroïdes est différente [148, 149]. Les œstrogènes sembleraient agir préférentiellement sur les dépôts sous-cutanés (seins, cuisses) en favorisant leur accumulation, en augmentant l’adipogenèse et en influençant leur métabolisme. Les tissus adipeux de la nuque et viscéraux sont par contre plus sensibles aux glucocorticoïdes et aux agonistes β-adrénergiques [149-152]. Ce sont ces caractéristiques qui expliquent une disposition différente du tissu adipeux entre les femmes fertiles et les hommes, responsable de la morphologie gynoïde-androïde. Cette répartition des dépôts adipeux est en partie héréditaire [35]. Mis à part les adipocytes, c’est l’ensemble des constituants du dépôt adipeux qui participe à ces différences de propriétés incluant les progéniteurs adipeux. Ainsi, des cellules souches avec des caractéristiques différentes pourraient participer à expliquer ces différences inter-dépôts [153].
Afin d’identifier si l’origine de la différence entre les dépôts est dépendante de facteurs internes ou externes, différentes études ont été effectuées et la mixité des résultats révèle une implication des deux. De nombreuses études indiquent une expression génique différente entre les deux dépôts, parmi eux des gènes de développement comme les HOX et FOX [154, 155]. Par exemple, le tissu adipeux intra-abdominal exprime des gènes comme HOXA5, HOXA4, HOXC8, Glypican (Gpc4), et nuclear receptor subfamily 2 group F
member 1 (Nr2f1) tandis que le sous-cutané exprime des gènes comme HOXA10, HOXC9, Twist Family BHLH Transcription Factor 1 (TWIST1), TBX15, Short stature homeobox 2 (Shox2), Homeobox protein engrailed-1 (EN1), et SFRP2. Le même type de résultat est observé avec les préadipocytes issus de dépôts
12
affectent préférentiellement certains emplacements adipeux sans atteindre l’ensemble illustre cette diversité
génique dans la formation des différents dépôts [158]. Des expériences de transplantation ont permis
d’identifier l’influence de l’environnement sur la spécificité du dépôt. Il a notamment été rapporté qu’un tissu adipeux transplanté se comporte davantage comme le tissu receveur que le donneur indiquant un rôle du microenvironnement [159]. Le microenvironnement peut se caractériser par sa composition en hormones, cytokines, neurohormones, nutriments et matrice extracellulaire (MEC). Une transplantation de tissu adipeux épididymal prélevé à P4 donne des dépôts différents selon que la greffe soit réalisée au niveau des muscles abdominaux ou du péritoine. Une modification du profil des gènes exprimés par le dépôt est observée, par exemple pour le viscéral greffé au niveau du sous-cutané, un réarrangement génique est observé [160]. Cependant, la transplantation de tissu adipeux sous-cutané à la place du viscéral est bénéfique mais pas l’inverse, soulignant une limite intrinsèque au dépôt lui-même [128]. On note aussi que les différences concernant le potentiel des adipocytes isolés du tissu adipeux sont en partie conservées en culture cellulaire, bien que leur potentiel adipeux soit différent de celui observé in vivo. Il existe ainsi une certaine orientation intrinsèque pour les cellules caractéristiques de chaque dépôt, cependant le microenvironnement est capable de moduler leur finalité au moins en partie [153, 160].
2.1.2. Les tissus adipeux brun et beige 2.1.2.1. Brun
Contrairement aux adipocytes blancs, qui ne contiennent qu’une seule grosse gouttelette lipidique, les adipocytes bruns en contiennent de nombreuses petites et ont un nombre élevé de mitochondries. Le TABr est un organe thermogénique qui a la capacité de découpler la respiration mitochondriale et la production d’adénosine triphosphate (ATP) transformant ainsi l’énergie chimique en chaleur. C’est une structure très vascularisée et innervée. La présence de la protéine UCP1 située sur la membrane interne des mitochondries est responsable de la dissipation du gradient de protons sans production d’ATP convertissant l’énergie issue de l’oxydation des substrats en chaleur [161](Figure 2).
Le TABr est surtout présent chez les mammifères hibernants. Chez l’homme, sa présence a essentiellement été notée chez le fœtus et le nouveau-né, bien que de récentes études de captage de glucose réalisées chez l’adulte indiquent la présence de petits dépôts encore métaboliquement actifs. Des exceptions concernent les individus obèses âgés pour lesquels le TABr est limité, et les patients avec phéochromocytome ou travailleurs à l’extérieur qui possèdent quant à eux un TABr développé [162-164]. Ce dépôt brun se retrouve chez le fœtus et le nouveau-né dans les zones axillaires, cervicales, rénales et péri-surrénaliennes. Chez l’adulte il a surtout été associé à des zones comme cervicales, supraclaviculaires, axillaires et paravertébrales [165].