Emma DONZ
Etude d’émulsions à forte teneur en matière grasse, stabilisées par des protéines sériques
Mémoire présenté en vue de l’obtention dugrade de Docteur de l’Université d’Angers
sous le label de l’Université Nantes Angers Le Mans
École doctorale : Biologie SantéDiscipline : Biochimie CNU 64 Spécialité : Sciences de l’aliment
Unité de recherche : UMR INSERM S1066 MINT 1066 Soutenue : le 30 janvier 2014
Thèse N° : 79402 N° d’ordre : 1392
Facteurs et mécanismes à l’origine de la déstabilisation d’émulsions
sèches, lors de leur réhydratation dans l’eau
JURY
Rapporteurs : M. Pierre SCHUCK | Ingénieur de recherche à l’UMR STLO, Université de Rennes
M. Jean-Michel GIRARDET | Ingénieur de recherche au laboratoire UR AFPA, Université de Lorraine Examinateurs : M. Gérard Cuvelier | Professeur, AgroParisTech
M. Patrick Saulnier | Professeur, Université d’Angers
M. Jean-Christophe GIMEL | Chargé de recherche CNRS, Université du Mans Invités : M. Didier MAJOU | Directeur Général de l’ACTIA
M. Bernard RIVANO | Directeur Général, Bonilait Protéines
M. Philippe BOIRON | Directeur du CRITT Agro-Alimentaire et Biotechnologies, La Rochelle Directeur de Thèse : M. Jean-Luc COURTHAUDON | Professeur, Université d’Angers
Erreur ! Utilisez l'onglet Accueil pour appliquer _ua_Titrt méthodes
au texte que vous souhaitez faire apparaître ici.
L’auteur du présent document vous autorise à le partager, reproduire, distribuer et communiquer selon les conditions suivantes :
− Vous devez le citer en l’attribuant de la manière indiquée par l’auteur (mais pas d’une manière qui suggérerait qu’il approuve votre utilisation de l’œuvre).
− Vous n’avez pas le droit d’utiliser ce document à des fins commerciales. − Vous n’avez pas le droit de le modifier, de le transformer ou de l’adapter. Consulter la licence creative commons complète en français :
http://creativecommons.org/licences/by-nc-nd/2.0/fr/
e 1" Résultats et discussion
REME
RC
IE
MENT
S
Cette thèse CIFRE a été réalisée pour Bonilait Protéines, en partenariat avec l’Inserm U1066 d’Angers. Je tiens donc tout d’abord à remercier M. Bernard Rivano, Directeur Général de Bonilait Protéines, sans qui cette thèse n’aurait vu le jour, d’avoir accepté de me confier ce projet ainsi que d’avoir participé aux comités de thèse.Merci à Jean-Luc Courthaudon, mon directeur de thèse, pour ses connaissances scientifiques et pour m’avoir fait confiance au cours de ces trois années.
Je remercie sincèrement Pierre Schuck, ingénieur de recherche au STLO, pour ses cours théoriques, son aide en DSC et pour avoir accepté avec tant d’enthousiasme de juger mon travail en tant que rapporteur de ma thèse. Merci à M. Jean-Michel Girardet, ingénieur de recherche à l’université de Lorraine, d’avoir également accepté de rapporter ce travail de thèse.
Merci à M. Patrick Saulnier, Professeur à l’université d’Angers, et à M. Jean-Christophe Gimel, chargé de recherche CNRS, d’avoir bien voulu participer au jury de cette thèse en tant qu’examinateur. Mes remerciements les plus vifs à Gérard Cuvelier, Professeur à AgroParisTech, pour avoir accepté de juger cette thèse en tant qu’examinateur, et surtout pour sa curiosité insatiable, son soutien et sa bienveillance lors de ce projet et de mes années à AgroParisTech.
Un grand merci à M. Didier Majou, Directeur de l’ACTIA, pour avoir accepté de participer au jury de cette thèse.
Je tiens également à remercier Etienne Brosse, Directeur technique et développement de Bonilait Protéines, pour sa disponibilité et son franc-parler indispensable face aux problèmes du quotidien. Merci à Gaylord Sénard, responsable R&D de Bonilait Protéines, pour son accueil et son soutien durant ma thèse.
Merci à Elodie pour avoir été une excellente amie et mon binôme dans la réalisation de certaines manipulations, notamment pour les dosages impressionnants de protéines que j’ai pu fournir grâce à son aide. Ce remerciement s’étend à Emmanuelle Lainé, pour avoir également été mon binôme, à temps plein, quelques mois. Je suis très heureuse d’avoir pu travailler avec toi.
Merci à David, entre autres, pour les pauses café.
Merci à l’équipe du laboratoire qualité, notamment Véronique, Laurence et Willy. Je tiens à remercier plus particulièrement Nadine, Mélanie et Françoise pour leur aide enthousiaste et indispensable au cours de ces trois années. Merci aussi à Philippe et Delphine pour leur gentillesse et leur bonne humeur.
Merci également aux personnels de production de Bonilait pour leur aide dans la mise au point des essais et surtout dans leur réalisation.
Merci à M. Benoit pour son accueil au sein du laboratoire Inserm U1066 d’Angers, ainsi qu’à toute son équipe.
Je tiens également à faire part de ma gratitude aux doctorants du laboratoire, notamment Anne-Claire, Amine, Fabien, Audrey… pour leur gentillesse lors de mes semaines de manip. là-bas. Evidemment, merci à Leila pour m’avoir fait me sentir comme chez moi à Angers, et surtout pour m’avoir permis de partager cette expérience avec quelqu’un qui me comprend.
Je tiens à saluer tous les membres de mon comité de thèse pour les discussions scientifiques passionnantes que nous avons pu avoir durant ces journées semestrielles fortement remplies.
Je tiens à remercier Alain Guibert, Directeur du SAIC, et son équipe pour leur participation au projet. Merci à Philippe Boiron, du CRITT agroalimentaire de La Rochelle d’avoir aidé à faire avancer les discussions aux réunions régulières et d’avoir aidé à l’organisation du projet.
Merci à David Bonneau pour ses connaissances en qualité, et surtout pour avoir accepté de contresigner mes nombreux cahiers de laboratoire.
Merci également au laboratoire LBMA et surtout à Anne-Marie, Fabrice Ducept et Delphine Huc, pour leur accueil et leur aide lors de notre collaboration.
Je tiens évidemment à remercier Pierre pour son aide et son point de vue scientifique non négligeable sur certains sujets.
e 1" Résultats et discussion
Sommairee 1" Résultats et discussion
SOMMAIRE ... 4
TABLE DES FIGURES ET TABLEAUX ... 8
ABREVIATIONS ... 16
INTRODUCTION ... 20
ETAT DE L’ART ... 26
1. Physico-chimie des émulsions ... 29
1.1. Les interactions permettant la stabilisation ... 29
1.2. Le choix du surfactif ... 31
1.3. Déstabilisation des émulsions ... 36
2. La formulation ... 39
2.1. La phase grasse : l’huile de palme ... 39
2.2. Obtention du lactosérum ... 40
2.3. La phase aqueuse : le lactosérum ... 42
2.4. Auxiliaires de fabrication et additifs ... 51
3. Le procédé de fabrication des émulsions sèches ... 53
3.1. La concentration par évaporation du lactosérum ... 53
3.2. L’homogénéisation des deux phases ... 55
3.3. Le procédé de séchage par atomisation ... 57
4. Les émulsions sèches ... 64
4.1. Structure ... 64
4.2. Les propriétés inhérentes aux émulsions sèches ... 65
5. Effets conjugués de la formulation et du procédé ... 68
5.1. Les effets sur les émulsions avant séchage ... 68
5.2. Effet sur les grains de poudre ... 73
MATERIELS ET METHODES ... 80
1. Formulation ... 82
1.1. La matière grasse : l’huile de palme ... 82
1.2. La phase aqueuse : le lactosérum doux ... 82
2. Procédé de fabrication des émulsions sèches ... 83
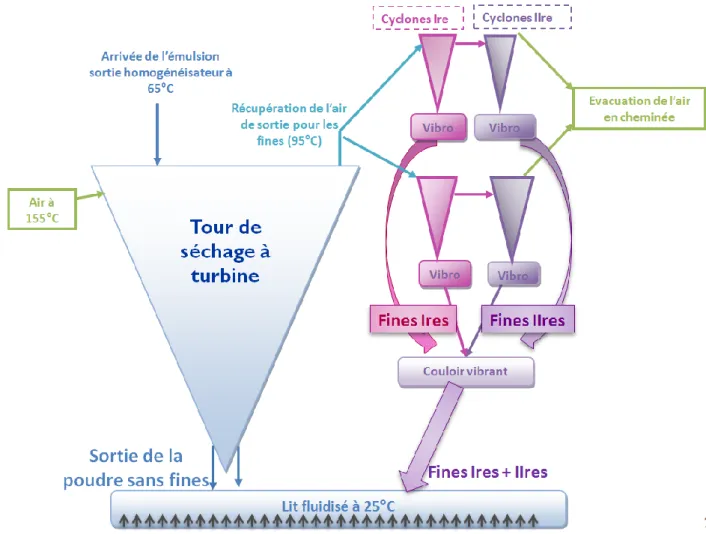
2.1. Etapes principales (Fig. 17) ... 83
2.2. Spécificités de la tour à turbine ... 84
2.3. Spécificités de la tour à buses ... 85
2.4. Le bilan matière en fonction des formulations ... 87
3. Les méthodes de caractérisation ... 89
3.1. Caractérisation du lactosérum ... 89
3.2. Caractérisation des poudres ... 95
3.3. Caractérisation des émulsions liquides ... 97
4. Analyses statistiques des données ... 111
RESULTATS ET DISCUSSION ... 112
1. Les types possibles d’instabilité ... 115
1.1. Etude qualitative ... 115
1.2. Etude quantitative... 118
2. Cause possible d’agrégation 1 : le milieu de reconstitution des ER ... 123
2.1. Etude de l’effet du milieu de reconstitution des émulsions ... 123
2.2. Détermination du rôle du calcium, au niveau microscopique ... 132
2.3. Comment expliquer la variation de l’effet du calcium d’une ER à une autre ?... 140
3. Cause possible d’agrégation 2 : les paramètres de fabrication ... 151
3.1. Hypothèse 1 : la viscosité des émulsions avant séchage varie entraînant une moins bonne optimisation du séchage ... 151
3.2. Hypothèse 2 : le procédé de séchage de la tour à buses ne permet pas d’obtenir un produit d’aussi bonne qualité que celui issu de la tour à turbine ... 162
4. Les solutions envisageables pour limiter la floculation due au calcium ... 176
Sommairee 1" Résultats et discussion
4.2. Etude prédictive de la stabilité, en laboratoire ... 184
CONCLUSION ET PERSPECTIVES ... 190
REFERENCES BIBLIOGRAPHIQUES ... 196
ANNEXES ... 214
Annexe 2 : Tableau de valeurs d’air inclus ... 217
Annexe 3 : Granulogramme ER à base de poudre sans fine ... 217 Abstract 218
e 1" Résultats et discussion
Table des figures et tableauxe 1" Résultats et discussion
Figure 1 : Schéma explicatif du rôle des interactions stériques dans la stabilité d’une émulsion ... 30
Figure 2 : Schéma explicatif du principe de déplétion dans une émulsion ... 31
Figure 3 : Schéma explicatif de l’angle de contact (Yuan & Lee, 2013). ... 35
Figure 4 : Schéma récapitulatif des principaux mécanismes de déstabilisation d’une émulsion liquide. ... 38
Figure 5 : Formule chimique du TPP ... 51
Figure 6 : Représentation de la réaction de saturation du phosphate par le sodium... 51
Figure 7 : Représentation de la réaction de polymérisation menant à la formation de TPP ... 51
Figure 8 : Schéma simplifié du fonctionnement d’un évaporateur multiple effet (azprocede.fr)... 54
Figure 9 : Exemple d’un Utra-Turrax (LabX.com). ... 55
Figure 10 : Exemple d’un homogénéisateur haute pression de laboratoire. ... 56
Figure 11 : A : schéma d’une buse haute pression (Renze, Heinen, & Schönherr, 2011) ; B : photo du cône de liquide obtenu à l’entrée de la tour, en fonction de la pression de la buse (Walzel, 2011). ... 58
Figure 12 : Photos montrant le fonctionnement d’une turbine, vue de loin (A : GEA-PE.fr) et vue détaillée (B : Walzel, 2011). ... 59
Figure 13 : Photos de buses bi-fluides (GEA-PE.fr). ... 59
Figure 14 : Schéma représentatif d’une particule de poudre réengraissée à 50% de matière grasse (adapté de Vignolles et al. (2007)). ... 64
Figure 15 : Schéma représentatif d’un globule gras (GG). ... 64
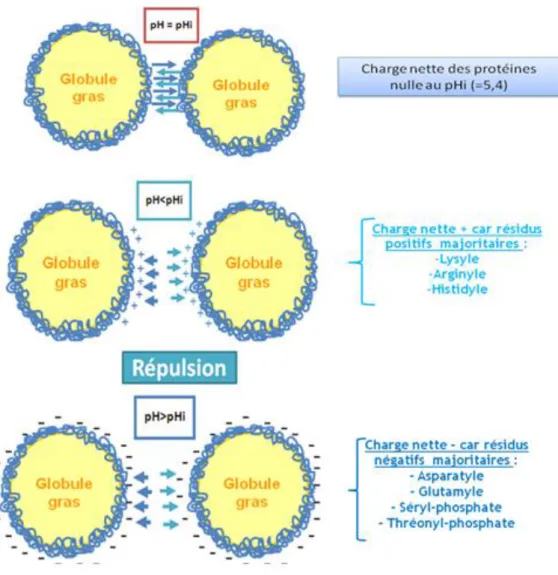
Figure 16 : Schéma explicatif des interactions attractives et répulsives dues aux charges des protéines adsorbées. ... 71
Figure 17 : Schéma d’une ligne de production type de Bonilait Protéines. ... 84
Figure 18 : Schéma du procédé de séchage sur tour à turbine de Bonilait Protéines. ... 85
Figure 19 : Schéma du procédé de séchage sur tour à buses de Bonilait Protéines. ... 86
Figure 20 : Schéma du montage utilisé pour le dosage des ions calcium et magnésium. ... 93
Figure 21 : Schéma explicatif du principe de fonctionnement d’un granulomètre laser (issu de Malvern.com). ... 101
Figure 22 : Schéma explicatif de la méthode d’analyse de stabilité. ... 102
Figure 23 : Exemple d’émulsions reconstituées à différentes stabilités. ... 103
Figure 24 : Schéma explicatif du principe de fonctionnement d’un Turbiscan (Issu de Formulaction.com). 103 Figure 25 : Exemple de résultats obtenus lors de l’analyse d’émulsion à l’aide d’un Turbiscan. ... 104
Figure 26 : Schéma explicatif du principe de fonctionnement d’un zetamètre (malvern.com). ... 105
Figure 27 : Exemple de résultats obtenus lors de l’analyse d’émulsion à l’aide d’un zetamètre. ... 106
Figure 28 : Schéma du mode opératoire permettant la récupération des protéines non adsorbées d’une émulsion liquide. ... 107
Figure 29 : Exemple de courbe étalon obtenue avec différentes dilutions de lactosérums doux en poudre, à teneur en protéines connues. ... 107
Figure 30 : Schéma du mode opératoire permettant la récupération des protéines totales d’une émulsion liquide... 108
Figure 31 : Exemple de résultats obtenus par analyse au Turbiscan d’une émulsion reconstituée. ... 115
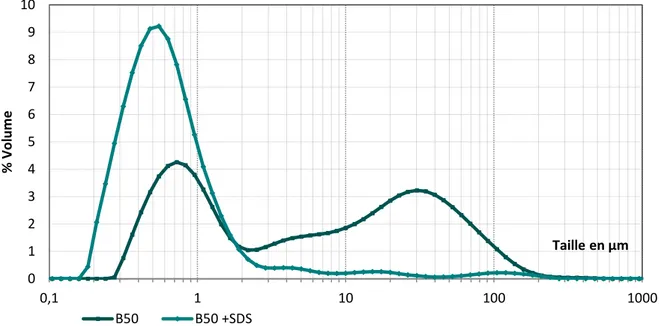
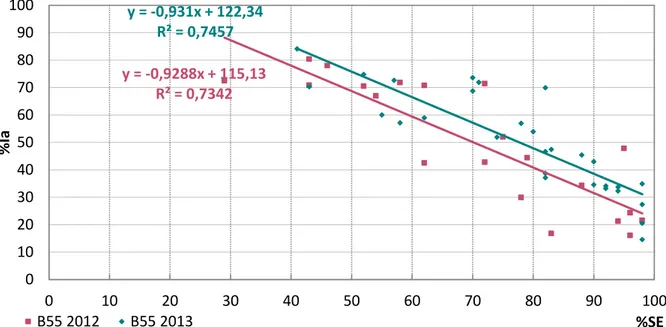
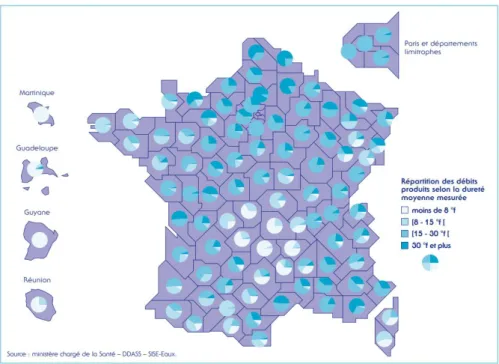
Table des figures et tableauxe 1" Résultats et discussion Figure 33 : Exemple de modification de granulogramme lors de l’ajout de SDS dans l’émulsion reconstituée. ... 117 Figure 34 : Distribution granulométrique de différentes ER en présence de SDS. ... 117 Figure 35 : Présentation de distributions granulométriques, en présence et absence de SDS dans le but d’expliquer le calcul de l’indice de coalescence. ... 118 Figure 36 : Présentation de distributions granulométriques, en présence et absence de SDS dans le but d’expliquer le calcul de l’indice d’agrégation. ... 119 Figure 37 : Indice d’agrégation (%Ia) des différentes émulsions reconstituées à base de B50 et B55, en fonction de l’indice de stabilité, détaillée pour l’année 2012 et l’année 2013 (avec leur courbe de tendance). ... 119 Figure 38 : Indice d’agrégation des différentes émulsions reconstituées à base de B55, en fonction de l’indice de stabilité, détaillée pour l’année 2012 et l’année 2013 (avec leur courbe de tendance)... 120 Figure 39 : Indice d’agrégation (%Ia) des différentes émulsions reconstituées, en fonction de l’indice de stabilité, détaillée pour la tour à buses et la tour à turbine (avec leur courbe de tendance). ... 121 Figure 40 : Etude de la stabilité de quatre émulsions reconstituées à partir de poudre de la tour à turbine en fonction de la concentration de calcium dans l’eau de reconstitution. ... 126 Figure 41 : Etude de la stabilité de quatre émulsions reconstituées à partir de poudre de la tour à buses en fonction de la concentration de calcium dans l’eau de reconstitution. ... 127 Figure 42 : Etude de l’évolution de la distribution granulométrique, d’une ER de la tour à turbine, en fonction de la concentration de calcium de l’eau de reconstitution. ... 128 Figure 43 : Etude de l’évolution de l’indice d’agrégation (%Ia) en fonction de la concentration de calcium de l’eau de reconstitution, pour différentes ER. ... 129 Figure 44 : Carte de la dureté des eaux mises en distribution : répartition des débits par département en 2006 (sante.gouv.fr). ... 130 Figure 45 : Hypothèses de mécanismes d’action du calcium sur l’émulsion. ... 132 Figure 46 : Micrographes d’émulsion reconstituée à base de B50, dans l’eau à 100 mg de calcium/l : A : vue générale de l’émulsion ; B : agrandissement de la zone centrale ; C : observation de la matière grasse uniquement (Rouge Nile) ; D : Observation de la phase aqueuse et surtout des protéines sériques (FITC). ... 135 Figure 47 : Valeur de potentiel zéta obtenue pour différentes ER en fonction de l’eau de remise en suspension. ... 136 Figure 48 : ... 137 Figure 49 : Electrophorèse PAGE-NATIVE de lactosérums : 1 : tank initial 1, 2 : tank initial 1 +TPP, 3 : tank initial 2, 4 : tank initial 2 enrichi en chlorure de calcium. ... 138 Figure 50 : Electrophorèse SDS-PAGE (sans mercaptoéthanol) de lactosérums : 1 : tank initial 1, 2 : tank initial 1 +TPP, 3 : tank initial 2, 4 : tank initial 2 enrichi en chlorure de calcium. ... 138 Figure 51 : Teneur en MM en g/100g d’extrait sec sérum, en fonction du fournisseur (F). ... 141 Figure 52 : Teneur en calcium en g/100g d’extrait sec sérum, en fonction du fournisseur (F). ... 141 Figure 53 : teneur en MM en g/100 qg d’extrait sec sérum, en fonction du fournisseur et la citerne (1 à 18 ~ 3 mois). ... 142
Table des figures et tableauxe 1" Résultats et discussion Figure 54 : teneur en calcium en g/100 g d’ES sérum, en fonction du fournisseur et la citerne (1 à 18 ~ 3 mois). ... 142 Figure 55 : Conductivité et matière minérale (MM) des tanks initiaux de lactosérum (~ 1 mois). ... 143 Figure 56 : Pourcentage de calcium présent dans les tanks initiaux de lactosérums (~ 1 mois). ... 144 Figure 57 : Teneur moyenne en MAT en g/100g d’ES, détaillée en quantité de protéines vraies et de NPN. Les étiquettes de données correspondent aux pourcentages de NPN pour 100g de MAT. ... 145 Figure 58 : Teneur en MAT en g/100g d’extrait sec sérum, en fonction du fournisseur et la citerne (1 à 20 ~ 1 mois). ... 146 Figure 59 : Teneur en NPN en g/100g d’extrait sec sérum, en fonction du fournisseur et la citerne considérés (1 à 20 ~ 1 mois). ... 147 Figure 60 :concentration de protéines sériques (g/100g d’ES sérum), en fonction du fournisseur et la citerne (1–20 ~ 1mois). ... 147 Figure 61 : Etude de la MAT détaillée en NPN + protéines vraies, de différents tanks initiaux (1 à 12). .... 148 Figure 62 : Courbes d’écoulement des EAS. ... 152 Figure 63 : Courbes d’écoulement par palier des EAS : viscosité apparente en fonction de la vitesse de cisaillement. ... 153 Figure 64 : Comparaison des courbes d’écoulement de deux lots de produits : Lactosérum concentré (12C et 17C) ; EAS55 Tk12 et Tk17. ... 156 Figure 65 : Courbes d’écoulement des produits : Lactosérum initial avec TPP (12 ini+TPP) ; Lactosérum concentré (12C) ; EAS55 Tk12. ... 156 Figure 66 : Effet de la formulation sur la viscosité de l’émulsion pilote (EP Tk2) équivalent aux émulsions avant séchage. ... 158 Figure 67 : Etude du modèle de l’équation de puissance des EAS, formulées à base du Tk B ou du Tk C, en fonction de leur teneur en matière grasse (%MG). ... 159 Figure 68 : Photos de poudres issues (A) de la tour à buses (B) de la tour à turbine en MEB environnementale (x100). ... 164 Figure 69 : Photos de poudres issues (A) de la tour à buses (B) de la tour à turbine en MEB environnementale (x200). ... 164 Figure 70 : Photos de poudres issues (A) de la tour à buses (B) de la tour à turbine en MEB environnementale (x500). ... 164 Figure 71 : Distribution granulométrique d’ER en présence de SDS selon leur procédé de séchage. ... 167 Figure 72 : Photos de poudres issues des cyclones (A) de la tour à buses (B) de la tour à turbine (MEB x100). ... 168 Figure 73 : Analyse de la chimie des particules par imagerie chimique élémentaire de spectrométrie rayon X : A : image avec le point sélectionner pour l’analyse, B : Tableau des éléments présents à cet endroit, exprimés en pourcentage de masse et en pourcentage atomique, C : spectre correspondant. ... 169 Figure 74 : Distribution granulométrique d’une ER à base de fines de la tour à buses, en présence et en absence de SDS. ... 172 Figure 75 : Photo d’émulsions reconstituées de poudre provenant des différentes étapes du procédé de la tour à turbine. A : ER à base de la poudre finale (PF) ; B : ER à base de la poudre issue de la chambre de
Table des figures et tableauxe 1" Résultats et discussion séchage, sans fines (SF) ; C : ER à base de la poudre issue du premier cyclone, soit les fines primaires (F1) ; D : ER à base de la poudre issue du second cyclone, soit les fines secondaires (F2). ... 173 Figure 76 : Observation en CLSM d’émulsions reconstituées à partir de fines secondaires... 173 Figure 77 : Valeurs de stabilité (SE) et de coalescence (Ic) en fonction du pourcentage de fines dans la poudre SF. ... 174 Figure 78 : Valeurs de coalescence (Ic) et de stabilité (SE) pour des pourcentages de fines inférieurs à 25%. ... 174 Figure 79 : Effet de l’ajout de TPP dans un lactosérum sur la conductimétrie. ... 176 Figure 80 : Comparaison de l’effet du TPP sur la conductivité d’un lactosérum en présence et en absence d’ajout de calcium. ... 177 Figure 81 : Comparaison de l’effet du calcium sur la conductivité d’un lactosérum en présence et en absence d’ajout de TPP. ... 178 Figure 82 : Courbe d’écoulement des lactosérums en fonction des différentes étapes de productions : ajout de TPP et concentration. ... 179 Figure 83 : Valeur de stabilité obtenue, pour les deux poudres, pour toutes les modalités du plan d’expériences. ... 180 Figure 84 : Résultats de stabilité de l’ER A en fonction du milieu de redispersion (concentration molaire en citrate de 0 à 5 mM ; concentration massique en calcium de 0 à 200 mg/l) ... 181 Figure 85 : Résultats de stabilité de l’ER B en fonction du milieu de redispersion (concentration molaire en citrate de 0 à 5 mM ; concentration massique en calcium de 0 à 200 mg/l) ... 182 Figure 86 : Schéma explicatif du rôle du chélateur dans les émulsions reconstituées. ... 183 Figure 87 : Distribution granulométrique d’EP en présence et en absence de SDS : étude de l’impact de la formulation sur l’instabilité de l’émulsion. ... 185 Figure 88 : Distribution granulométrique d’EP en présence et en absence de SDS : étude de l’impact de la formulation sur l’instabilité de l’émulsion. ... 186 Figure 89 : Distribution granulométrique d’EP en présence et en absence de SDS : étude de l’impact de la formulation sur l’instabilité de l’émulsion. ... 186 Figure 90 : Distribution granulométrique d’EP en absence de SDS : étude de l’impact du lot de lactosérum. ... 187 Figure 91 : Mise en parallèle de la distribution granulométrique d’EP50 avec la SE d’une ER B50 pour chaque sérum. ... 188 Figure 92 : Mise en parallèle de la distribution granulométrique d’EP55 avec la SE d’une ER B55 pour chaque sérum. ... 189 Figure 93 : Micrographes d’émulsions reconstituées à base de B55, dans l’eau à 100 mg de calcium/l. .... 216 Figure 94 : Exemple de distribution granulométrique d’une poudre sans fine, remise en suspension dans l’eau. ... 217
Table des figures et tableauxe 1" Résultats et discussion Tableau 1 : Composition moyenne des lactosérums de différentes origines (Laits et produits laitiers, 1990)51 Tableau 2 : données concernant l’évaporation sous vide : à chaque température (θ°C) correspond une pression (Poe en bar), une enthalpie (hv en kJ/kg), en chaleur latente de vaporisation (Lv en kJ/kg) et une
masse volumique (φv en kg/m3) (Kessier 1981). ... 53
Tableau 3 : Détails de composition et de propriétés de l’huile de palme réceptionnée à Bonilait Protéines. . 82
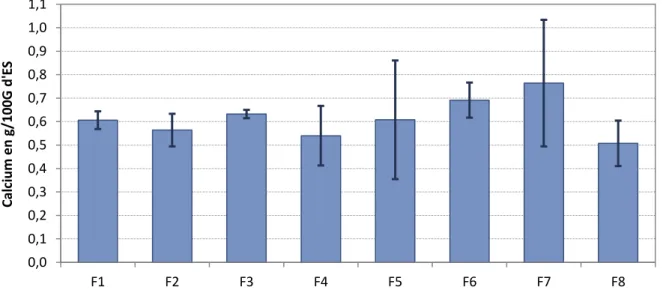
Tableau 4 : Exemple de fournisseurs de lactosérums et détails des fromages dont ils sont issus. ... 82
Tableau 5 : Paramètres de procédé de séchage de la ligne de la tour à turbine, en fonction de la formule. . 84
Tableau 6 : Paramètres de procédé de séchage de la ligne de la tour à buses, en fonction de la formule. ... 86
Tableau 7 : Composition des différentes formules de poudre Bonigrasa Palme... 88
Tableau 8 : Détails de la formulation des différentes émulsions pilotes (EP) effectuées pour l’étude pilote. 97 Tableau 9 : Description des différents marqueurs étudiés en bibliographie sur des produits laitiers ... 100
Tableau 10 : Valeurs moyennes de stabilité des différents produits en fonction de leur formule et de leur tour de séchage. ... 121
Tableau 11 : Stabilité obtenue pour le plan d’expériences mené sur l’ER tour à turbine. ... 124
Tableau 12 : Analyse statistique du plan d’expériences tour à turbine : étude de la somme des carrés des écarts (SCE) de chaque facteur. ... 124
Figure 13 : Analyse statistique du plan d’expérience tour à turbine : étude de l’effet moyen du calcium sur la stabilité. ... 124
Tableau 14 : Exemple de stabilité obtenu pour un plan d’expérience mené sur des ER tour à buses. ... 125
Tableau 15 : Analyse statistique du plan d’expériences tour à buses. ... 125
Figure 16 : Analyse statistique du plan d’expérience tour à buses : étude de l’effet moyen du calcium sur la stabilité. ... 125
Tableau 17 : Validation de l’eau modèle choisie par comparaison des stabilités obtenues sur des émulsions reconstituées dans l’eau de ville et dans l’eau modèle. ... 130
Tableau 18 : Exemple de pourcentage de protéines adsorbées (%FADS) d’ER, en fonction de la teneur en calcium de l’eau de reconstitution. ... 133
Tableau 19 : Exemple de couverture protéique surfacique d’ER, en fonction de la teneur en calcium de l’eau de reconstitution. ... 134
Tableau 20 : Valeur de MM calcium et conductivité en fonction de l’ES sérum, pour les différents tanks initiaux. ... 144
Tableau 21 : Récapitulatif des données obtenues sur les tanks initiaux de lactosérums, mises en parallèle avec les valeurs de SE obtenues lors de la remise en suspension des poudres issues de ces lactosérums. 149 Tableau 22 : Viscosité apparente d’émulsions homogénéisées avec un homogénéisateur haute pression (excepté pour le lait : ultrason), à différentes vitesses de cisaillement et paramètres du modèle. ... 155
Tableau 23 : Effet du procédé de production sur les paramètres de l’équation d’Oswald. ... 157
Tableau 24 : Viscosité moyenne apparente des lactosérums à différentes étapes de production. ... 157
Tableau 25 : Etude de la viscosité des émulsions pilotes de chaque formulation. ... 159
Tableau 26 : Etude de la viscosité à 750 s-1 des émulsions pilotes (EP) 55 en fonction du lactosérum utilisé. ... 160
Table des figures et tableauxe 1" Résultats et discussion Tableau 27 : Etude de la viscosité à 750 s-1 des émulsions pilotes (EP) 50 en fonction du lactosérum utilisé. ... 160 Tableau 28 : Etude de la viscosité de différents lactosérums concentrés, issus de la production industrielle. ... 160 Tableau 29 : Comparaison des paramètres rhéologiques de différentes EP et EAS. ... 161 Tableau 30 : Valeur moyenne de densité des poudres de formulation B50 et B55, en fonction du type de tour dont elles sont issues (375 produits de la tour à buses et 527 produits de la tour à turbine). ... 163 Tableau 31 : Valeur moyenne de teneur en matière grasse libre (MGL) pour les poudres B50 et B55 issues des deux types de tour de séchage. ... 165 Tableau 32 : Etude de la couverture surfacique protéique (Csp) des émulsions reconstituées (ER) en fonction du type de tour dont elles sont issues. ... 167 Tableau 33 : Tableau détaillant le %MGL des poudres finales, en fines et sans fine, pour les formulations B50 et B55 de la tour à turbine. ... 170 Tableau 34 : Tableau détaillant le %MGL des poudres finales, en fines et sans fine, pour les formulations B55 et B50 de la tour à buses. ... 171 Tableau 35 : Données rhéologiques de deux sérums, aux différentes étapes de production. ... 178 Tableau 36 : Analyse statistique du plan d’expériences pour les deux ER étudiées : étude de la somme des carrés des écarts (SCE) de chaque facteur et de leur interaction. ... 180 Tableau 37 : Analyse statistique du plan d’expériences pour les deux ER étudiées : étude de l’effet moyen de chaque facteur et de leur interaction. ... 180 Tableau 38 : Analyse statistique du plan d’expériences pour les deux ER étudiées : étude de la somme des carrés des écarts (SCE) de chaque facteur et de leur interaction. ... 182 Tableau 39 : Analyse statistique du plan d’expériences pour les deux ER étudiées : étude de l’effet moyen de chaque facteur et de leur interaction. ... 182 Tableau 40 : Diamètre médian des globules gras indépendants de différentes formulations pilotes d’EAS. 184 Tableau 41 : Indice d’agrégation (%Ia) et de coalescence (%Ic) de différentes formulations EP. ... 187 Tableau 42 : Effet du lot de lactosérum sur l’indice d’agrégation d’EAS pilotes 50 et 55. ... 188 Tableau 43 : Récapitulatif des principaux résultats de l’étude. ... 195 Tableau 44 : Détails des essais menés sur l’air inclus lors de l’homogénéisation de l’émulsion avant séchage ... 217
e 1" Résultats et discussion
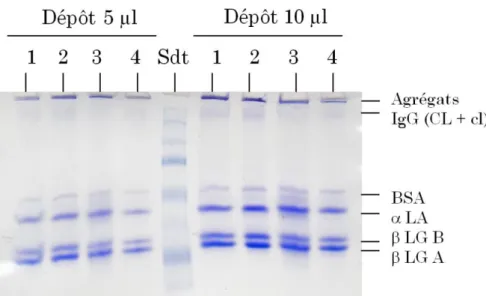
Abréviationse 1" Résultats et discussion α-LA : α-lactalbumine
β-LG : β-lactoglobuline
B26 : Bonigrasa 26% (m/m) de matière grasse B50 : Bonigrasa 50% (m/m) de matière grasse B55 : Bonigrasa 55% (m/m) de matière grasse BSA : Sérum Albumine Bovine
CLSM : Confocal Light Scanning Microscopy CV : Coefficient de variation
EAS : Emulsion avant séchage
EAS50 : Emulsion avant séchage donnant un B50 EAS55 : Emulsion avant séchage donnant un B55 EDTA : Acide éthylène diamine tétraacétique EP50 : Emulsion pilote à 50% (m/m) de MG EP55 : Emulsion pilote à 55% (m/m) de MG ER : Emulsion reconstituée
ES : Extrait sec
F1 : Fines issues du premier cyclone ; fines primaires F2 : Fines issues du second cyclone ; fines secondaires FADS : Fraction de protéines adsorbées
FITC : Isothiocyanate de fluorescine
GG : Globules gras
h/e : Huile-eau
Ia : Indice d'agrégation Ic : Indice de coalescence
IgG CL+cl : Immunoglobuline G chaînes lourdes et chaînes légères K : indice de consistance (Pa.sn)
MAT : Matière azotée totale
MEB : Microscopie Electronique à Balayage
MG : Matière grasse
MGL : Matière grasse libre
MGLS : Matière grasse libre de surface MSD : Multi-Spray-Drying
n : Indice de comportement NPN : Azote non protéique
PA : Huile de palme
PAGE : PolyAcrylamide Gel Electrophoresis PNA : Protéines non adsorbées qsp : Quantité suffisante pour SCE : Somme des Carrés des Ecarts SDS : Sodium dodecyl sulfate SE : Indice de stabilité sérum(s) : Lactosérum(s) SF : Poudre sans fine SH : Groupement sulfhydrile
Tk : Tank
tpm : Tour par minute
TPP : Tripolyphosphate de sodium WPC : Whey Protein Concentrate WPI : Whey Protein Isolat
e 1" Résultats et discussion
Introductione 1" Résultats et discussion
ne émulsion liquide simple est un mélange de deux produits non miscibles, l’un formant une phase continue et l’autre une phase dispersée. L’énergie libre interfaciale, est définie comme l’énergie due aux interfaces séparant les deux liquides non miscibles. Elle est minimale lorsque la surface de contact entre les deux phases est également minimale. Cela correspond à l’état où les deux phases sont séparées de façon distincte. Dans ces conditions, l’émulsion est en équilibre thermodynamique.
L’une des deux phases est dispersée par la création de gouttelettes via l’apport d’énergie mécanique. La surface interfaciale devient plus grande, tout comme la tension interfaciale. Le mélange engendré est alors instable thermodynamiquement : l’émulsion tendra à retourner à son état d’énergie minimale en séparant les deux phases. Plus la tension interfaciale est élevée, plus le retour à l’état d’équilibre est rapide, c’est-à-dire, plus la déstabilisation est lente.
L’ajout d’un tensioactif permet d’abaisser cette tension interfaciale, même lors de la formation des gouttelettes, ce qui permet une stabilisation cinétique de l’émulsion. Plus le tensioactif sera efficace, plus l’émulsion sera stable dans le temps.
Il existe deux sortes d’émulsion liquides simples : les émulsions eau dans huile (e/h) où des gouttelettes d’eau sont dispersées dans une phase lipidique et les émulsions huile dans eau (h/e) où des gouttelettes d’huile sont dispersées dans une phase aqueuse. Les émulsions h/e sont des systèmes complexes dont les gouttelettes d’huile ne peuvent être stabilisées que par un surfactant tel que des protéines ou un émulsifiant.
Une grande partie des produits de l’alimentation humaine et animale est basée sur les émulsions. Soit directement, avec des produits tels que le beurre (émulsion e/h), le lait (émulsion h/e). Soit indirectement, en utilisant les émulsions en tant qu’ingrédients. Ces ingrédients se retrouvent, par exemple, en chocolaterie ou en biscuiterie et dans les aliments d’allaitement à destinations des animaux. Leur stabilité est donc un enjeu majeur.
Les stabilisations physique et microbiologique des émulsions peuvent être facilitées par leur transformation en poudre via une opération de séchage. Ce procédé consiste à diminuer la teneur en eau présente dans l’émulsion, à une valeur inférieure à 5% et permet de :
- réduire la teneur en eau libre et donc les réactions microbiologiques, - éviter l’altération des ingrédients, notamment par oxydation, - conserver la structure et donc la stabilité originelle de l’émulsion, - diminuer les coûts de transport.
Il existe deux méthodes industrielles de séchage : le séchage par ébullition, sur cylindres chauffants, et le séchage par entraînement avec un système de pulvérisation (ou atomisation) du produit. En industrie laitière, du fait de la thermosensibilité des protéines, l’obtention de poudre se fait grâce au séchage par atomisation. Grâce à cette technique, les altérations dues au traitement thermique sont minimisées par l’application d’un couple temps/température faible.
Introductione 1" Résultats et discussion En France, les industries laitières représentent 2,2% des entreprises de l’agroalimentaire. Sur ces 2,2%, seules 6,3% fabriquent des poudres. Ces dernières étant principalement des poudres de lactosérum (56,2% des poudre totales), principalement dédiées à l’industrie des laits infantiles, et des poudres de lait écrémé non réengraissé (29,6%). Les émulsions sèches, soit les lactosérums ou laits réengraissés, représentent 14,2% des poudres laitières alimentaires françaises.
Les entreprises proposant ce type d’ingrédients laitiers sont, en majorité, de grands groupes traitant le lait dans sa globalité. On y trouve par exemple : Bongrain, avec sa filiale Armor Protéines, Lactalis, Nestlé ou encore des groupes coopératifs tels que Sodiall, avec Eurosérum et Bonilait Protéines.
Les ventes de ces ingrédients se font à plus de 50% à l’export vers des régions telles que la Russie, l’Asie ou encore l’Amérique du Sud ou l’Afrique.
A l’heure actuelle, les connaissances concernant le procédé de fabrication et les poudres, restent empiriques. Cela est d’autant plus vrai pour les poudres à forte teneur en matière grasse (>26%). Or, il devient primordial pour les industriels de comprendre les mécanismes entrant en jeu dans la formation de ces émulsions, d’une part pour optimiser les procédés et les produits actuels, d’autre part pour prédire le comportement des nouvelles formulations.
C’est dans ce contexte que s’inscrit le projet mis en place par Bonilait Protéines.
Bonilait Protéines, spécialisée dans la fabrication d’ingrédients secs et riches en matière grasse, est leader français et européen dans la formulation et la fabrication de poudres laitières. L’entreprise, filiale de coopératives, possède quatre sites de production à travers la France (Chasseneuil-du-Poitou (86), Belleville-sur-Vie (85), Tauves (63) et Saint Flour (15)), avec au total, 6 tours de séchage et une production annuelle d’environ 90 000 tonnes de produits secs. Elle commercialise ses produits auprès des professionnels de l’agroalimentaire dans une cinquantaine de pays. Son leadership s’explique notamment par la grande diversité de ses produits, aux formulations variables aussi bien en type de matière grasse (végétale, animale, laitière) qu’en teneur (de 26 à 80%).
Les produits de Bonilait Protéines sont dénommés comme suit :
- un nom, comme par exemple « Bonigrasa » pour les produits formulés à base de lactosérum, - un numéro indiquant leur teneur en matière grasse : « 26 » ; « 50 » et « 55 »,
- une ou plusieurs lettres pour préciser la nature de la matière grasse (MG) utilisée. Par exemple « PA » pour indiquer que c’est un produit à base d’huile de palme.
Les ingrédients formulés et séchés par Bonilait Protéines sont utilisés, chez les clients, en alimentation animale, principalement comme base pour les aliments d’allaitement.
En alimentation humaine, les clients les utilisent pour différents types d’applications :
- le Bonigrasa 26 PA sert principalement à remplacer le lait dans les pâtisseries comme les clafoutis et les madeleines ; dans la chocolaterie pour les ganaches et les mousses au chocolat ;
- le Bonigrasa 50 PA (B50) et le Bonigrasa 55 PA (B55) servent à remplacer le lait ainsi que la matière grasse : beurre ou huile, notamment dans les biscuits, le porridge, les gâteaux au chocolat, les crêpes, le
Introductione 1" Résultats et discussion glaçage, la crème pâtissière, et la crème anglaise,… Le Bonigrasa 55 permet également la formulation de glaces, de pâte à tarte ou encore de caramel.
Ces produits, à base d’huile de palme (PA), moins sensibles à la chaleur, sont privilégiés pour les applications avec cuisson.
Bonilait Protéines propose d’autres types d’ingrédients, notamment à base de sirop de glucose et de caséinates ou à base de lait au lieu de lactosérum.
Bonilait Protéines tient son succès de part son savoir-faire à produire des émulsions sèches à forte teneur en MG, à base de lactosérum, sa matière première principale. Le lactosérum est un ingrédient laitier permettant le maintien de la stabilité physique d’une émulsion, grâce aux protéines sériques se plaçant à l’interface des deux phases. De plus, la présence de lactose facilite la conservation des poudres puisqu’il agit comme matrice protectrice des globules gras. Outre la qualité de ses produits finis, Bonilait Protéines se révèle également compétitive en termes de prix, par l’utilisation de lactosérums issus de fromageries, un lactosérum à moindre coût.
Malgré la qualité de ses produits finis, la production actuelle, à base de lactosérum et de matière grasse végétale, connaît des fluctuations de stabilité lors de la reconstitution des émulsions dans de l’eau. En effet, les poudres fabriquées doivent permettre de recréer une émulsion à forte teneur en matière grasse, qui soit stable lors de sa remise en suspension dans l’eau. Or, pour une formulation donnée, et pour des paramètres de production identiques, la qualité des poudres obtenues est variable d’une production à une autre.
Les connaissances sur le séchage et sur les propriétés physico-chimiques et biochimiques des émulsions de l’entreprise sont encore empiriques. Cela ne lui permet pas toujours de répondre aux importantes problématiques auxquelles elle est confrontée. C’est pourquoi l’entreprise a souhaité, en partenariat avec l’université d’Angers, monter un projet de recherche sur 3 ans.
Ce projet a pour finalité de définir les hypothèses et de mettre en évidence les facteurs et les mécanismes engendrant la déstabilisation de certaines émulsions lors de la remise en suspension des poudres dans l’eau.
Cela implique de caractériser les émulsions reconstituées pour comprendre l’origine des phénomènes engendrant des variations de stabilité. Une fois les causes de déstabilisation identifiées, il sera nécessaire de mettre en avant des solutions permettant de remédier à ces variations.
De par les produits fabriqués par Bonilait Protéines, le projet est exclusivement basé sur les émulsions huile dans eau, plus précisément sur les produits à base d’huile de palme et de lactosérum.
Les produits étudiés ici sont des produits à 50 et 55% de matière grasse (B50 et B55). Les produits à 26 et 60% de matière grasse ont été également évalués, ponctuellement, à titre de comparaison entre des produits à fort et à faible taux de MG.
e 1" Résultats et discussion L’exposé des travaux se découpe en trois grandes parties. La première intitulée Etat de l’art, détaille les acquis scientifiques actuels sur les émulsions, le lactosérum, ainsi que les différentes opérations unitaires menant à l’obtention de poudre.
La seconde partie, intitulée Matériels et méthodes, décrit, dans un premier temps, les différentes formulations et les procédés de fabrication propres à Bonilait Protéines, puis dans un second temps les nombreuses méthodes analytiques utilisées par thématiques : étude du lactosérum, des émulsions liquides et des poudres.
Enfin, la partie Résultats et discussion comprend une étude sur l’instabilité des émulsions reconstituées, suivie d’une recherche de causes probables expliquant ce phénomène, et une analyse des solutions pouvant être mises en place afin d’éviter la déstabilisation.
e 1" Résultats et discussion
Etat de l’art
Cet état des lieux des connaissances est principalement basé sur une étude bibliographique. Cependant, concernant les aspects technologiques, la bibliographie étant insuffisante (surtout sur les équipements d’échelle industrielle), certaines
informations proviennent de notices de constructeurs de matériels. Les observations empiriques accumulées par l’entreprise, depuis plusieurs décennies, ont également été prises en compte.
Etat de l’arte 1" Résultats et discussion ors de la recherche bibliographique, la question s’est posée de savoir quelles étaient les connaissances indispensables à avoir afin de répondre au mieux à la problématique.
Le premier élément mis en avant fut de connaître précisément les matières premières avec lesquelles sont fabriquées les poudres, mais aussi et bien sûr le principe de chacune des opérations unitaires de fabrication : l’homogénéisation, les traitements thermiques et le séchage.
Pour pouvoir comprendre comment se déstabilise une émulsion il faut, en premier lieu, savoir par quel(s) mécanisme(s) une émulsion se stabilise, c'est-à-dire les forces et les interactions en jeux, mais aussi le rôle de chaque ingrédient dans la formation de cette émulsion.
De même, le travail ne portant pas seulement sur une émulsion liquide, mais aussi sur une émulsion sèche, la même veille scientifique était à faire sur la formation de la poudre, le rôle du procédé et de chacun des ingrédients sur la formation d’une poudre.
La partie Etude de l’art se divise donc en cinq grandes parties : - La physico-chimie des émulsions ;
- Les matières premières, soit la formulation ; - Le procédé de fabrication ;
- Les émulsions sèches ;
- Les effets conjugués de la formule et du procédé sur l’émulsion sèche et l’émulsion liquide.
L
Etat de l’arte 1" Résultats et discussion
1. Physico-chimie des émulsions
La stabilité des émulsions dépend des interactions existantes entre les composés et leur aptitude à résister aux différentes contraintes qu’ils peuvent subir. Les différentes interactions présentes dans une émulsion, les phénomènes menant à la déstabilisation ainsi que les façons de choisir le tensioactif le mieux adapté à la stabilisation de l’interface, sont détaillés ci-dessous.
1.1. Les interactions permettant la stabilisation
Il existe principalement quatre types d’interactions (Demetriades & McClements, 1998) : l’attraction de Van Der Waals et les interactions : stériques, électrostatiques et hydrophobes.
1.1.1. L’attraction de Van Der Waals
L’attraction de Van Der Waals apparaît si les molécules sont très proches les unes des autres, puisque ce sont des interactions dipolaires au niveau moléculaire. L’énergie potentielle d’attraction dépend de la nature du matériau, du milieu de dispersion, de la taille des particules et de la distance interparticulaire (Jeantet et al. 2006).
Cette interaction est donc très sensible à la présence de sels. En effet, l’ajout de sel, favorise les interactions électrostatiques au détriment de l’attraction de Van Der Waals. Cette interaction contribue à la stabilisation des structures internes des protéines et favorise leur précipitation si les forces ioniques augmentent ou si les effets électrostatiques diminuent. Elle diminue quand la température augmente.
1.1.2. Les interactions électrostatiques (ou ioniques)
Les interactions électrostatiques sont répulsives entre deux charges identiques, et attractives entre deux charges inverses. Elles résultent du potentiel de surface des particules chargées et de l’interaction des doubles couches électriques à la surface des particules (Jeantet et al. 2006). Ce type d’interaction est notamment dû aux groupements ionisables des chaînes latérales des protéines.
Elles sont donc très sensibles aux modifications des électrolytes compris dans la phase continue. Les interactions électrostatiques ont un rôle direct sur la solubilisation ainsi que sur les propriétés moussantes et foisonnantes des protéines.
Quand les interactions de Van Der Waals prédominent dans l’émulsion, les gouttelettes ont tendance à s’agréger, alors que si ce sont les répulsions électrostatiques qui sont principalement présentes, la tendance à l’agrégation diminue (Demetriades, Coupland, & McClements, 1997b).
Lorsque la force ionique augmente, les charges de la phase aqueuse recouvrent les charges des protéines et diminuent ainsi la qualité des répulsions électrostatiques (Demetriades, Coupland, & McClements, 1997a).
Etat de l’arte 1" Résultats et discussion
1.1.3. Les interactions stériques
Les interactions stériques sont dues aux composés de masse molaire élevée : protéines ou polyosides par exemple, et dépendent de leur conformation. Dans les émulsions, ce sont des interactions répulsives se produisant lors d’une rencontre entre les couches interfaciales de deux gouttelettes.
Lorsque deux globules gras (GG) se rapprochent, par exemple, sous l’effet du crémage ou du mouvement brownien, la densité de polymère dans l’espace interglobulaire devient localement très élevée, ce qui provoque une augmentation de la pression osmotique dans cette zone ; il en résulte un appel d’eau, par diffusion, de l’espace extraglobulaire (phase continue) vers l’espace interglobulaire, entraînant une disjonction, c’est-à-dire une séparation des GG l’un de l’autre. Ce mécanisme est la stabilisation stérique.
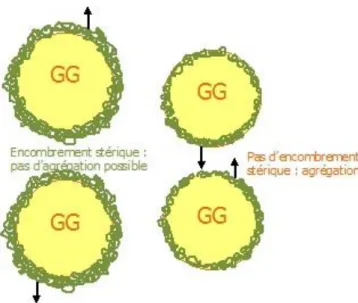
Les interactions stériques sont d’autant plus efficaces que les particules de l’interface sont disposées sur l’extérieur des gouttelettes (convexe), c'est-à-dire quand les protéines sont préférentiellement mouillables dans la phase continue (Dickinson, 2010b). En effet, l’intensité de ces répulsions est d’autant plus élevée que l’espace occupé dans la phase continue par le matériel de l’interface est important (Figure 1).
Figure 1 : Schéma explicatif du rôle des interactions stériques dans la stabilité d’une émulsion
1.1.4. Les interactions hydrophobes
Les interactions hydrophobes correspondent aux interactions entrainant, dans un milieu aqueux, le rapprochement dans l’espace de groupements apolaires hydrophobes, ceci afin de limiter leur zone de contact avec l’eau. Leur intensité augmente avec la température dans les milieux aqueux, et peut atteindre quelques dizaines de kJ/mol.
1.1.5. Les autres phénomènes
Etat de l’arte 1" Résultats et discussion a) Les interactions hydrogènes
Appelées aussi liaisons hydrogènes (bien qu’il ne s’agisse pas de liaison chimique), elles s’établissent entre les groupements amide et carbonyle, phénol ou hydroxyle, des protéines. Avec les autres interactions, elles conditionnent les structures secondaires et tertiaires des protéines.
L’intensité de cette interaction diminue lorsque la température augmente.
b) Le phénomène de déplétion
Il est dû à une force attractive entre gouttelettes due à la diminution de la quantité de liquide les séparant. Lorsque deux GG se rapprochent sous l’effet du crémage, par exemple, la densité de polymère non tensioactif et de ce fait non adsorbé – polyosides ou gomme - devient plus élevée dans l’espace extraglobulaire que dans l’espace interglobulaire (Fig. 2). La pression osmotique est donc plus élevée dans la phase continue que dans l’espace interglobulaire, ce qui provoque le rapprochement des GG (Boode & Walstra, 1993).
Figure 2 : Schéma explicatif du principe de déplétion dans une émulsion
1.2. Le choix du surfactif
1.2.1. Les différents types de tensioactifs
Un composé tensioactif est un composé qui possède une partie hydrophile et une partie hydrophobe, lui conférant un caractère amphipathique, c’est-à-dire une affinité plus élevée pour l’interface que pour l’une ou l’autre des deux phases.
C’est le cas des émulsifiants de faible masse moléculaire, comme les monoglycérines, les lécithines… et de composés de masse molaire élevée, comme les protéines ou les amidons transformés.
Il existe donc différents types de composés capables de s’adsorber aux interfaces. Cependant, leur façon de stabiliser l’interface varie d’un composé à l’autre. Voici quelques exemples de tensioactifs ainsi que leur rôle dans la stabilisation d’une émulsion.
Etat de l’arte 1" Résultats et discussion a) Les émulsifiants
Ce sont des composés de faible masse molaire, comme les mélanges mono- et diglycérides (E322), les sucroesters (E472b)…
Plus les émulsifiants sont variés dans une même émulsion, plus l’interface est stable (Pichot, Spyropoulos, & Norton, 2010). De même, l’ajout de particules colloïdales en plus de l’émulsifiant permet d’améliorer la stabilité de l’émulsion ainsi que de diminuer la taille des gouttelettes. C’est le cas des particules solides de moutarde qui sont responsables de la stabilisation de la mayonnaise.
Le moment d’intégration des composés formant la couche interfaciale a également son importance. En effet, les particules colloïdales (type silice) et les émulsifiants sont plus efficaces lorsqu’ils sont ajoutés dans la phase lipidique plutôt que dans la phase aqueuse (Pichot et al., 2010). Cette phase aqueuse entraîne des forces électrostatiques et des forces d’hydratation qui empêchent en partie l’adsorption de la silice à l’interface.
b) Les protéines
Les protéines, composés macroioniques, sont à la fois émulsifiantes et stabilisantes. Elles forment une fine couche à la surface des gouttelettes lipidiques permettant ainsi de protéger l’émulsion contre la coalescence via les répulsions stériques et électrostatiques.
c) Les protéines et les émulsifiants
Dans la plupart des émulsions alimentaires, sont présents des protéines et des émulsifiants de faible masse molaire. Les protéines forment un réseau viscoélastique immobile, alors que les surfactants stabilisent une interface grâce à leur fort degré de mobilité (mécanisme Gibbs-Marangoni).
Selon leurs proportions relatives dans une émulsion, les protéines et les émulsifiants on une action synergique ou antagoniste (compétition pour stabiliser l’interface).
En effet, ces deux types de composés étant tensioactifs, ils se coadsorbent à l’interface h/e pour stabiliser la surface interfaciale et favoriser la formation de fines gouttelettes.
En revanche, au-delà d’une certaine dose d’émulsifiant, plus précisément, au-delà d’un certain ratio émulsifiant/protéine, l’adsorption de l’émulsifiant prédomine au détriment des celui des protéines. Ceci est dû à la tensioactivité plus élevée des émulsifiants que des protéines. Il en résulte une interface dépourvue de protéines ; la stabilisation stérique est électrostatique est donc annulée.
Les protéines ne diminuent pas la tension interfaciale aussi efficacement que les émulsifiants, mais elles permettent d’atteindre la saturation de la surface bien avant.
Les surfactants hydrophiles sont plus efficaces pour déplacer les protéines que les hydrophobes. Il est donc plus efficace d’utiliser l’une ou l’autre de ces catégories de tensioactifs, mais pas les deux en même temps.
Etat de l’arte 1" Résultats et discussion
1.2.2. Les caractéristiques des tensioactifs
Il existe différentes méthodes pour choisir un tensioactif, et qualifier ses propriétés émulsifiantes dans une émulsion huile/eau ou eau/huile. Les deux méthodes les plus connues et les plus utilisées sont décrites ci-dessous.
a) Balance hydrophile-lipophile (HLB)
Introduite par Griffin en 1949, c’est la première méthode mise au point pour quantifier l’affinité du tensioactif avec les différentes phases (Chow & Ho, 1996).
A l’heure actuelle, c’est encore la méthode la plus utilisée pour caractériser les molécules amphipathiques. Cette méthode consiste à attribuer un nombre HLB au tensioactif en fonction d’une échelle arbitraire allant de 1 à 20, où 1 correspondant à l’acide oléique (lipophile) et 20 à l’oléate de potassium (hydrophile). Le tensioactif dont le nombre HLB est inférieur ou égal à 7 stabilise une interface eau/huile, si sa valeur est supérieure à 7 (Pichot et al., 2010).
Lorsque deux ou plusieurs tensioactifs sont présents ; ce nombre est calculé à partir des teneurs relatives de chacun d’eux part l’équation suivante :
𝐻𝐿𝐵𝑚
é
𝑙𝑎𝑛𝑔𝑒
=
∑
𝑛𝑖=1𝑥𝑖
.
𝐻𝐿𝐵𝑖
avec xi et HBLi respectivement la fraction massique et le nombre HLB du composé i.
Le HLB requis est un nombre qui caractérise la phase huileuse. Il correspond au HLB du surfactant qui permet, dans des conditions données, d’obtenir l’émulsion la plus stable possible.
Le HLB se détermine de différentes façons, selon le type de surfactant considéré.
Pour les surfactants non-ioniques polyéthoxylés, le HLB correspond au pourcentage massique de la chaîne d’oxydes d’éthylène divisé par 5. Dans ces conditions, si les parties hydrophiles et lipophiles du composé considéré sont équilibrées, le HLB est de 10. Au-dessus de cette valeur, le composé est plus hydrophile et en-dessous plus lipophile.
Pour les surfactants de type ester non-ioniques, l’équation suivante est utilisée :
𝐻𝐿𝐵
= 20(1 −
𝑆 𝐴)
avec S l’indice de saponification de l’ester et A l’indice d’acide gras lié au glycérol de la partie acide du surfactant.
(1)
Etat de l’arte 1" Résultats et discussion Dès 1957, une seconde méthode est mise au point par Davies qui propose l’équation suivante :
𝐻𝐿𝐵 = 7 + ∑ 𝑔𝑟𝑜𝑢𝑝𝑒𝑠 ℎ𝑦𝑑𝑟𝑜𝑝ℎ𝑖𝑙𝑒𝑠 – ∑ 𝑔𝑟𝑜𝑢𝑝𝑒𝑠 𝑙𝑖𝑝𝑜𝑝ℎ𝑖𝑙𝑒𝑠
Chaque groupement possède une valeur HLB prédéfinie, par exemple, l’acide carboxylique a un HLB de +2,1 ; l’oxygène de +1,3…
Bien que cette méthode soit encore très utilisée, elle est très simpliste et génère un certains nombre d’erreurs notamment parce que les valeurs moyennes du HLB selon Griffin et Davies sont différentes (respectivement 10 et 7) ou encore parce qu’elles ne prennent pas en compte l’environnement physico-chimique du tensioactif considéré. Elle ne devrait donc être employée que comme une première approche dans le choix du tensioactif.
b) Différence Hydrophile Lipophile (HLD)
C’est un nombre sans dimension qui traduit la différence entre la formulation considérée et la formulation optimale.
Le nombre HLD augmente avec le caractère lipophile du tensioactif. Ce concept prend en compte les différents paramètres définis dans les corrélations empiriques des années 70.
Il s’exprime différemment en fonction du type de surfactant.
Pour les surfactants ioniques :
𝐻𝐿𝐷 = 𝜎 + 𝐿𝑛 𝑆𝑒𝑙 𝐾 × 𝐴𝐶𝑁 + 𝑡𝛥𝑡 + 𝑎𝐴
Pour les non-ioniques éthoxylés :
𝐻𝐿𝐷 = 𝛼 − 𝐸𝑂𝑁 + 𝑏 × 𝑆𝑒𝑙 − 𝐾 × 𝐴𝐶𝑁 + 𝑡𝛥𝑡 + 𝑎𝐴
Avec : EON : nombre de groupes « oxyde d’éthylène » Sel : la salinité de l’eau en %massique de NaCl
ACN : nombre d’atomes de carbone de la molécule n-alcane 𝛥t : la différence de température avec 25°C
A : pourcentage pondéral d’alcool ajouté
𝜎, α, K, t, les paramètres caractéristiques du composé considéré a : constante caractéristique de l’alcool et du type de surfactant b : constante caractéristique du sel éventuellement ajouté
(3)
(4)
Etat de l’arte 1" Résultats et discussion c) Le choix d’une protéine
Ces deux méthodes (HLB et HLD) ne sont pas adaptées aux protéines car elles ne prennent en compte que la formule chimique. Or les propriétés des protéines dépendent fortement de leur structure tertiaire (Damodaran, 2005). En effet, deux protéines ayant le même nombre de groupements hydrophobes et hydrophiles peuvent avoir des propriétés émulsifiantes très différentes selon le positionnement de ces groupements au sein de la structure.
Le choix d’une protéine pour jouer le rôle d’un tensioactif doit se baser sur trois critères (Damodaran, 2005) :
- sa rapidité d’adsorption à une interface,
- sa flexibilité afin de se déplier et de couvrir l’interface,
- sa possibilité d’interaction avec les composés qui l’entourent afin de former un film interfacial cohésif.
d) Angle de contact
La couche interfaciale doit contenir des composés amphipathiques (ou surfactifs) pour faire le lien entre les deux phases (dispersée et continue). Pour des émulsions huile dans eau, l’adsorption du surfactant à la surface des gouttelettes d’huile, dépend de son degré d’hydrophobie (Pichot et al., 2010). Leur positionnement peut être quantifié par l’angle de contact qu’ils ont avec l’eau (Fig.3).
Cet angle atteint 90° pour le surfactant le mieux adapté. En effet, c’est à cette valeur qu’il faut le plus d’énergie pour pouvoir le déloger de l’interface.
Si l’angle est inférieur à 90°, le surfactant stabilise des émulsions huile dans eau et s’il est supérieur, il stabilise les émulsions inverses (Aronson & Princen, 1980).
Si l’angle est maintenant très petit (surfactant très hydrophile) ou très grand (très hydrophobe), alors il n’assumera pas son rôle à l’interface et se dispersera dans la phase pour laquelle il a le plus d’affinité (Pichot et al., 2010).
Plus la chaîne du tensioactif est longue, mieux il stabilise l’interface.
Etat de l’arte 1" Résultats et discussion
1.3. Déstabilisation des émulsions
Une émulsion peut subir différents phénomènes de déstabilisation macroscopique pouvant mener au déphasage. Il en existe principalement quatre, décris ci-dessous.
1.3.1. L’agrégation
Ce phénomène provoque le regroupement des gouttelettes de matière grasse qui restent indépendantes ; il n’y a pas de rupture du film qui sépare chaque gouttelette.
Plusieurs mécanismes sont responsables de l’attraction des globules gras (GG) : l’attraction de Van Der Waals qui agit dès que deux gouttelettes sont à une distance l’une de l’autre comprise entre 0,2 et 10 nm, la mise en commun de cristaux de matière grasse entre deux GG, les interactions ioniques et les liaisons chimiques entre les composés adsorbés à la surface des GG (Damodaran, 2005).
L’augmentation apparente de la taille des gouttelettes engendre une diminution de la stabilité de l’émulsion face au crémage (Jeantet et al. 2006).
Ces amas ne seront plus séparables : c’est un phénomène irréversible.
1.3.2. La floculation
Souvent définie comme un synonyme de l’agrégation, ce terme désigne en fait un phénomène d’agrégation réversible (Sliwinski, Roubos, Zoet, van Boekel, & Wouters, 2003).
A de faibles contraintes, les agrégats agissent comme des solides car la force subie est plus faible que les forces d’attraction qui maintiennent les gouttelettes entre elles. Pour une contrainte élevée, les gouttelettes peuvent être séparées (Hayati, Che Man, Tan, & Aini, 2007).
La floculation des particules entraîne une augmentation de la viscosité car l’eau emprisonnée dans les floculats augmente le volume effectif des particules, comparé à celui de la phase aqueuse (Demetriades et al., 1997b).
Seules les forces de répulsion stériques dues à la protubérance des protéines adsorbées à l’interface, dans la phase aqueuse peuvent empêcher un rapprochement de deux globules gras à moins de 10 nm (Damodaran, 2005).
1.3.3. La coalescence
C’est la fusion de deux ou plusieurs gouttelettes pour n’en former plus qu’une de plus grosse taille. Elle dépend donc de la stabilité du film de phase continue qui sépare deux gouttelettes. La coalescence se produit généralement lorsque le contact entre deux gouttelettes est très prolongé.
Ce phénomène est ralenti par certaines capacités viscoélastiques de surface. Il est également dépendant de la taille des gouttelettes, de leur capacité de répulsion et de la tension interfaciale (Jeantet et al. 2006). La prédiction de la coalescence peut être déterminée en étudiant la diminution de la viscosité de l’émulsion (Hayati et al., 2007).
Etat de l’arte 1" Résultats et discussion
1.3.4. Le crémage
Il correspond au déplacement des gouttelettes d’huile sous l’effet de la gravité ou d’une force centrifuge, entraînant la formation d’une couche concentrée de globules gras, dans la phase supérieure de l’émulsion, sans changement de la taille des gouttelettes.
Ce phénomène est réversible par une agitation douce.
La vitesse de transfert v des éléments dispersés est régie par la loi de Stokes (Jeantet, Croguennec, Schuck, & Brulé, 2007):
V
=
𝐷²18𝜂
× ∆𝜌 × 𝑔
Où D diamètre des particules dispersées (m),
η la viscosité dynamique de la pahse dispersée (Pa.s),
∆𝜌
la différence de densité entre les deux phases (kg.m-3), G l’accélération gravitationnelle (m.s-2).La vitesse de crémage est dépendante de la fraction volumique de phase dispersée, de l’étendue de la distribution des tailles de gouttelettes, des propriétés thermodynamiques et interfaciales des gouttelettes ainsi que du comportement rhéologique de la phase continue (Damodaran, 2005). Par exemple, pour une émulsion liquide dont la phase aqueuse a une viscosité d’environ 0,001 Pa.s, et des globules gras de diamètre d’environ 1 µm, la vitesse de crémage d’une gouttelettes est estimée à 0,012 mm.h-1. Si la taille des gouttelettes passe à 0,1 µm, la vitesse diminue et passe à environ 0,12 µm.h-1 (Damodaran, 2005).
Pour réduire le crémage, il est possible d’agir de trois façons différentes : - réduire la taille des gouttelettes,
- diminuer la différence de masse volumique entre les deux phases ou - augmenter la viscosité du milieu dispersant.
En général, l’émulsion est stable si les globules font moins d’un micromètre de diamètre (Jeantet et al. 2006).
Le crémage est souvent initié par une agrégation et/ou une coalescence.
Etat de l’arte 1" Résultats et discussion
1.3.5. Schéma récapitulatif
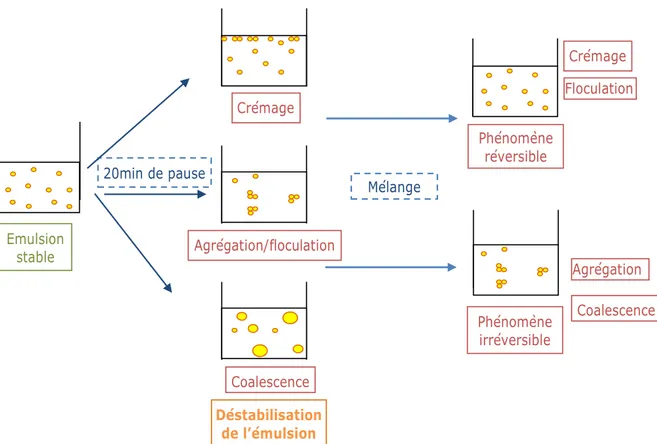
Figure 4 : Schéma récapitulatif des principaux mécanismes de déstabilisation d’une émulsion liquide.
Crémage Agrégation/floculation Coalescence Emulsion stable 20min de pause Mélange Floculation Phénomène réversible Crémage Phénomène irréversible Agrégation Coalescence Déstabilisation de l’émulsion
Etat de l’arte 1" Résultats et discussion
2. La formulation
Les émulsions étudiées se composent de deux phases non miscibles : la phase grasse (huile de palme) et la phase aqueuse (le lactosérum).
2.1. La phase grasse : l’huile de palme
2.1.1. Composition
L’huile de palme est principalement composée de triglycérides à base d’acide palmitique (44%, acide gras saturé) et d’acide oléique (38%, acide gras monoinsaturé), mais aussi d’acides linoléique (polyinsaturé), stéarique, myristique et linolénique. Sa température de fusion se situe entre 36 et 42°C, de par la diversité de triglycérides qui la constituent. Elle contient 3 à 5% d’acides gras, souvent appelés d’acides gras libres.
2.1.2. Altérations
Même si l’huile de palme est une huile riche en antioxydants naturels, elle reste tout de même sensible aux réactions d’oxydation, par contact avec de l’oxygène et donc avec de l’air. Il existe différents types d’oxydations décrites ci-dessous.
a) La photooxydation
Cette réaction est due à la conversion d’oxygène triplet en oxygène singulet en présence de lumière visible ou d’UV. Les oxygènes singulets s’additionnent ensuite rapidement aux doubles liaisons. Des intermédiaires instables sont alors formés, puis transformés en hydroperoxydes. Ces derniers sont inodores, incolores et sans goût.
b) L’oxydation enzymatique
Le même type de réaction a lieu lorsqu’il y a présence d’une lipase : la lipoxygénase. Tout comme la présence d’oxygène, cet enzyme entraîne la formation de peroxydes et hydroperoxydes.
c) L’auto-oxydation
Les radicaux produits par la photooxydation ou l’oxydation enzymatique attaquent les chaînes grasses polyinsaturées et génèrent de nouveaux peroxydes et hydroperoxydes. Ils détruisent partiellement les acides gras indispensables présents dans l’huile et diminuent donc ses qualités nutritionnelles. Ce degré d’oxydation est mesuré par l’indice de peroxyde. La vitesse de réaction augmente avec le nombre d’insaturations. La réaction s’achève avec la formation de composés type Radical-Oxygène-Oxygène-Radical.
Etat de l’arte 1" Résultats et discussion d) Les quatre facteurs aggravant l’oxydation
L’oxydation est facilitée par la présence de chlorophylle, phéophytine, métalloporphyrine ou riboflavine. Les métaux lourds tels que le fer, le cuivre et le cobalt, surtout lorsqu’ils sont à l’état réduit, catalysent l’oxydation puisqu’ils favorisent la scission des peroxydes et des hydroperoxydes en radicaux libres.
Les interactions protéines/lipides sont, quant à elles, responsables de la formation de lipoprotéines insolubles et du blanchiment de la matière grasse.
La réaction de réticulation forme des ponts entre les groupements phénols et les produits d’oxydations aldéhydique. Ces derniers donnent des composées moins digestes ayant des propriétés altérées, qui apportent le goût rance auquel est associée l’acidification du milieu.
2.2. Obtention du lactosérum
Le lactosérum, constituant du lait, contient principalement de l’eau (95%), du lactose, des protéines et des minéraux. Un lactosérum contient, en matière sèche, environ 80% de lactose ; 10% de protéines ; 9% de cendres et 1% de matière grasse (MG). Chacun de ces composés est détaillé ci-dessous.
2.2.1. Composition du lait
Le lait est composé : - d’eau (87%),
- de lactose (4,8 - 5% p/p), - de matière grasse (4% p/p),
- de protéines (3,2 - 3,5% p/p) constituées par les caséines et les protéines sériques, dont les teneurs massiques relatives sont respectivement 80 et 20%,
- de minéraux.
C’est la transformation de ce produit qui permet l’obtention du lactosérum. Il existe principalement deux types de technologie : la technologie fromagère et la technologie de caséinerie.
2.2.2. Lactosérum de fromagerie
La technologie fromagère résulte d’une concentration de 6 à 12 fois de différents composés du lait : les caséines, la matière grasse et les minéraux.
L’eau éliminée entraîne avec elle une partie des éléments solubles et les protéines non coagulées. Cette phase aqueuse est le lactosérum (Lapointe-Vignola, 2002).