HAL Id: tel-01558909
https://tel.archives-ouvertes.fr/tel-01558909
Submitted on 10 Jul 2017HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
calcification chez le corail rouge de méditerranée
Corallium rubrum
Carine Le Goff
To cite this version:
Carine Le Goff. Approches physiologique et moléculaire de la calcification chez le corail rouge de méditerranée Corallium rubrum. Biologie animale. Université Pierre et Marie Curie - Paris VI, 2016. Français. �NNT : 2016PA066439�. �tel-01558909�
Université Pierre et Marie Curie
École Doctorale Complexité du Vivant
Centre Scientifique de Monaco / Département de Biologie Marine
Équipe de Physiologie et Biochimie
Approches physiologique et moléculaire de la
calcification chez le corail rouge de Méditerranée
Corallium rubrum
par Carine LE GOFF
Thèse de doctorat en Sciences de la vie
Directrice de thèse : Sylvie Tambutté
Co-encadrant : Philippe Ganot
Présentée et soutenue publiquement le 14 Décembre 2016 à Monaco
Remerciements
Les premières lignes de ce manuscrit sont souvent, de façon paradoxale, les dernières à être rédigées. Et lorsque l’on arrive à cette étape, qui n’est pas la plus facile, cela signifie véritablement que la thèse se termine. Je voudrais bien évidemment remercier de façon générale toutes les personnes qui ont contribué, de près ou de loin, à la réalisation de cette thèse. Ces trois années auront été une véritable aventure humaine, personnelle et professionnelle.
En premier lieu, je voudrais remercier les membres de mon comité de thèse, Paola Furla, Georges Carle et Jean-Yves Sire. Ce fut un plaisir de vous présenter l’évolution de mes travaux et d’avoir pu échanger avec vous.
Je tiens également à remercier les membres du jury de thèse, Daniel Vielzeuf et Catherine Lorin-Nebel pour avoir accepté d’être rapporteurs de ce travail, ainsi que François Lallier, Clemente Capasso, Stéphanie Barnay-Verdier et Georges Carle en leur qualité d’examinateurs.
Je souhaite remercier le Pr. Patrick Rampal et Mme Corinne Gaziello, respectivement Président et Secrétaire Générale du Centre Scientifique de Monaco, pour m’avoir permis de réaliser cette thèse au sein de l’équipe de Physiologie et Biochimie du laboratoire.
Je remercie également le Pr. Denis Allemand, Directeur du Centre Scientifique de Monaco, pour les échanges que nous avons eus, pour son enthousiasme et ses connaissances qu’il aime partager, dans le domaine de la Science et bien au-delà.
Mes remerciements vont ensuite tout naturellement à mes encadrants, Sylvie Tambutté et Philippe Ganot, ainsi qu’aux autres membres de l’équipe de Physiologie et Biochimie.
Merci Sylvie pour tes conseils, tes relectures, et tes corrections. Ce fût un plaisir de partager avec toi les résultats obtenus au cours de cette thèse. Le corail rouge a désormais moins de secrets pour nous.
Philippe, tu auras su m’encadrer par ton côté « tyrannique» et « grand frère » (selon tes propres mots !). Egalement partenaire graphiste, malgré nos différents pour le choix des couleurs... Je te passe la main (verte ou rouge ?) pour prendre soin de ces petites colonies et boutures.
Merci Didier pour tes connaissances notamment en biologie moléculaire, mais également pour les cours matinaux de Japonais et de Russe, et pour avoir essayé de parfaire
Je pense bien évidemment aussi aux deux techniciennes de l’équipe qui m’auront appris les bases pour travailler sur les coraux, et avec qui la mise au point des protocoles pour le corail rouge n’a pas été une mince affaire ! Merci également pour vos talents de cuisinières. Natacha, ce fut un plaisir de déguster tes gâteaux qui sont des réalisations incroyables à chaque fois, et Nathalie, pour m’avoir faire découvrir la cuisine Réunionnaise.
Merci aux post-doc, ancienne et actuelle. Nathalie, tu auras égayé mes journées avec ta joie de vivre, ce fût un plaisir de t’avoir comme voisine de bureau et d’avoir partagé du temps ensemble au labo. Duygu, merci pour ta bonne énergie, les cours de yoga en bord de mer les lundis matins, et pour tes délicates attentions.
Merci aux stagiaires pour leur bonne humeur inconditionnelle : Lisandrina, Gaëlle, Apolline, Astrid, Jonas...
Je tenais également à remercier les personnes avec qui nous avons collaboré autour ce projet. Merci à Didier Aurelle et Anne Haguenauer de l’IMBE à Marseille pour les colonies de corail rouge que vous êtes allés chercher pour nous.
Merci à Georges Carle de l’UMR TIRO-MATOs à Nice pour le cryobroyage des échantillons.
Merci également à Claudiu Supuran de l’Université de Florence, et Clemente Capasso de l’Institute of Biosciences and BioResources de Naples, pour les échanges que l’on a eus sur les anhydrases carboniques, ainsi que pour votre accueil si chaleureux lors de notre venue à Naples.
Mes remerciements vont ensuite à l’équipe d’Ecophysiologie, avec qui je n’ai pas seulement que partagé des discussions autour du corail : Christine, Renaud, Stéphanie, Eric B., Cécile, et Lucile, ainsi que les post-doc actuels, Jeroen et Vanessa.
Merci aussi à Eric E. et Robert pour leur aide technique.
Merci aux membres de l’équipe de Biologie Polaire actuels, avec qui c’est toujours un plaisir d’échanger : Céline, Victor, Hannah et Aymeric. Mais je pense bien évidemment aussi à Cindy, Robin et Jason, à qui je souhaite de vivre de belles aventures aux quatre coins du monde.
Un grand Merci à Alexandra, notre Secrétaire scientifique, qui m’a vraiment bien aidée pendant ces trois années, et d’autant plus pendant ces dernières semaines.
Merci à tous les autres membres du laboratoire du 5ème comme du 2ème. La liste serait bien trop longue pour tous vous citer mais vous faites aussi partie de cette aventure.
Merci notamment à l’Administration, à Patricia, Barbara et Muriel.
Un grand merci à toutes les personnes avec qui j’ai partagé de si bons moments en dehors du labo. Encore une fois, la liste serait trop longue pour tous vous citer ici.
Leïla, un grand Merci pour beaucoup de choses. On aura vécu cette aventure en parallèle, à partager nos joies et nos stress, mais pas seulement, heureusement ! Pour les salades tomates/mozza, les pizzas, les chaï latte, pour tes nombreuses Leïlades et pour toutes nos aventures en dehors du labo, que ce soit à pied dans le Mercantour, ou au bout d’une corde sur une falaise. Nous y sommes arrivées !
Un Merci plus large à toutes les personnes du CSM qui m’auront témoigné leur soutien de quelques façons que ce soit aux moments où j’en ai eu besoin.
Une petite pensée pour les trains de la région PACA, monégasques ou même Bourguignons qui m’auront menée, moi et mes compagnons de galère, tous les jours jusqu'au labo. Avec ses retards, ses suppressions et ses justifications douteuses...
Je ne peux pas clôturer ces remerciements sans remercier mes ami(e)s Breton(ne)s et ma famille qui auront suivi de loin cette thèse. Merci à vous pour votre soutien, et les bouffées d’oxygène lors de mes retours, parfois trop courts.
Sommaire
Chapitre 1
... L
AB
IOMINERALISATION CHEZ LES CORAUX1
1. Généralités sur les biominéraux chez les Métazoaires ... 3
1.1. La biominéralisation dans l’échelle des temps ... 3
1.2. Diversité, propriétés et fonction des biominéraux ... 5
2. La biominéralisation chez les coraux ... 8
2.1. Les coraux: des cnidaires qui (bio)minéralisent ... 8
2.2. Histoire évolutive des coraux ... 11
2.3. Processus de biominéralisation chez les coraux ... 15
a) Physico-chimie de la biominéralisation b) Processus cellulaires et moléculaires de la biominéralisation 3. Problématique de l’étude de la biominéralisation ... 25
Chapitre 2
... L
AB
IOMINERALISATION CHEZC
ORALLIUM RUBRUM27
1. La biominéralisation chez les Octocoralliaires ... 291.1. Etat des connaissances sur la biominéralisation chez les Octocoralliaires .. 29
1.2. Diversité des structures minéralisées ... 31
2. Présentation du modèle d’étude ... 44
2.1. Le corail rouge : minéral, végétal ou animal ? ... 44
2.2. Distribution, exploitation et protection ... 46
2.3. Classification ... 48
3. La biomineralisation chez Corallium rubrum... 49
3.1. Anatomie de Corallium rubrum ... 49
3.2. Les biominéraux chez Corallium rubrum ... 51
a) Les sclérites b) L’axe squelettique
Chapitre 3
... L
E DEVELOPPEMENT DE MICROCOLONIES POUR L’
ETUDE IN VIVO DE LA CALCIFICATION CHEZC
ORALLIUM RUBRUM61
1. Apport des microcolonies pour l’étude de la calcification ... 631.1. Développement de la technique ... 63
1.2. Microcolonies et étude de la calcification ... 64
2. Résultats personnels : Caractérisation des microcolonies de Corallium rubrum ... 66
2.3. Discussion ... 83
a) Avantages et inconvénients des microcolonies poussant sur lamelle b) Formation des biominéraux dans les microcolonies de Corallium rubrum 2.4. Perspectives ... 85
Chapitre 4
... A
PPROCHE PHYSIOLOGIQUE DE LA CALCIFICATION PAR LA MESURE DU PH AUX SITES DE CALCIFICATION87
1. Généralités sur le pH ... 892. Méthodes pour mesurer le pH au site de calcification ... 90
2.1. Composition isotopique du bore ... 90
2.2. Microélectrodes ... 91
2.3. SNARF-1 ... 92
3. pH et calcification chez les coraux ... 94
4. Résultats personnels : Mesures de pH aux sites de calcification chez Corallium rubrum 97 4.1. Contexte de l’étude ... 97
4.2. Matériel et méthodes ... 98
a) Préparation des échantillons b) Système d’incubation et analyses par microscopie confocale c) Calibration du pH d) Mesures du pH intracellulaire des cellules isolées e) Mesures de pH intra- et extracellulaires dans les microcolonies 4.3. Résultats : Mesures de pH chez Corallium rubrum ... 102
a) pH intracellulaires b) pH extracellulaires 4.4. Discussion ... 104
Chapitre 5
... A
PPROCHE MOLECULAIRE DE LA CALCIFICATION PAR L’
ETUDE DES ANHYDRASES CARBONIQUES111
1. Historique des anhydrases carboniques ... 1132. La superfamille des anhydrases carboniques ... 114
3. Alpha anhydrases carboniques ... 116
3.1. Site actif et mécanisme d’action ... 116
3.2. Carbonic Anhydrases Related Proteins ... 118
4. Alpha anhydrases carboniques et calcification ... 119
4.1. Alpha anhydrases carboniques et calcification chez les organismes marins . 120 4.2. Alpha anhydrases carboniques et calcification chez les coraux ... 122
5. Résultats personnels : Etude des anhydrases carboniques chez Corallium rubrum ... 124
5.1. Contexte de l’étude ... 124
5.2. Résultats et discussion ... 125
5.3. Perspectives... 132
5.4. Publication ... 134
Conclusion Générale et Perspectives
...
PROCESSUS PHYSIOLOGIQUES ET MOLECULAIRES DE LA CALCIFICATION CHEZC
ORALLIUM RUBRUM158
Références Bibliographiques
... 168
Liste des figures
1| Schéma résumant l’apparition des biominéraux chez les Métazoaires.. ... 4
2| Classification des Cnidaires.. ... 9
3| Photographies de représentants de Cnidaires.. ... 10
4| Hypothèses avancées sur la phylogénie des Cnidaires montrant les relations possibles au sein de cet embranchement.. ... 11
5| Schéma représentant les oscillations du ratio Mg/Ca et les évènements majeurs au cours des temps géologiques, et les estimations de temps de divergence des Cnidaires.. ... 13
6| Diversité des scléractiniaires dérivée des données fossiles en fonction du temps. ... 14
7| Concentrations des espèces carbonatées dans l'eau de mer en fonction du pH. ... 16
8| Diagramme de cinétique de phase du taux de nucléation relatif entre la calcite et l’aragonite. ... 19
9| Taux de nucléation en fonction de la supersaturation relative. ... 19
10| Représentation schématique de l’interface entre un épithélium calcifiant et une structure biominéralisée en carbonate de calcium. ... 21
11| Schéma récapitulatif du transport par la voie transcellulaire des ions nécessaires à la précipitation de CaCO3 chez un corail scléractiniaire, entre l’ectoderme aboral et le site de calcification. ... 24
12| Proportion des thématiques de recherche menées sur la biominéralisation chez les Octocoralliaires entre 1864 et 2016 ... 31
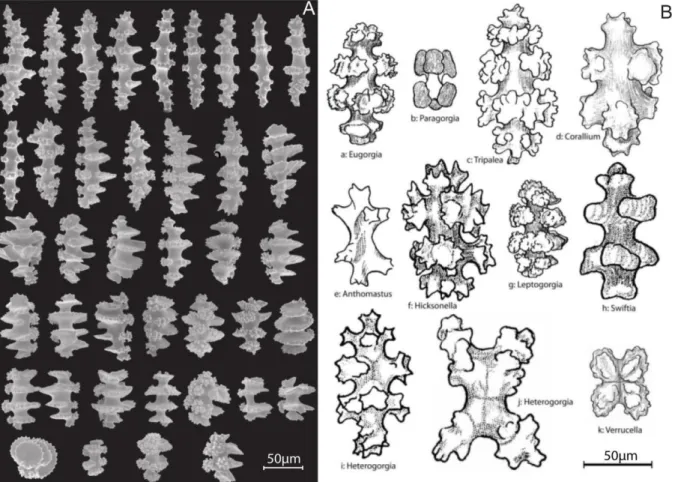
13| Exemples de diversité de formes des sclérites chez les Octocoralliaires. ... 32
14| Illustrations de la diversité des structures minéralisées élaborées par les Octocoralliaires.. ... 34
15| Etapes hypothétiques de formation d’un spicule chez Pseudoplexaura flagellosa. ... 38
16| Illustrations des différents stades de développement des sclérites chez Alcyonium digitatum. ... 39
17| Agrégation de vésicules multicellulaires (MCV) autour d’un sclérite (sc) de Sinularia gibberosa. ... 40
18| Différentes étapes du développement d’un spicule chez Renilla reniformis. ... 41
19| Schéma récapitulatif des processus cellulaires de formation des sclérites chez les Octocoralliaires ... 43
20| Anatomie d’une colonie de Corallium rubrum dessinée par Lacaze-Duthiers.. ... 45
21| Carte de la distribution géographique de Corallium rubrum. ... 46
22| Classification de Corallium rubrum.. ... 48
23| Organisation générale d'une branche de Corallium rubrum.. ... 49
24| Etude histologique d’une colonie de Corallium rubrum après décalcification. ... 51
25| Schéma hypothétique de la formation de monocristaux biogéniques à partir de «clusters» d’ions ... 52
26| Morphologie des sclérites de Corallium rubrum observés en microscopie à balayage. ... 53
27| Organisation des sclérites avec les scléroblastes chez Corallium rubrum. ... 53 28| Images optiques de sclérites de Corallium rubrum observés en lumière blanche (a et d) et en lumière
35| Organisation des tissus d’une microcolonie de Corallium rubrum ... 72
36| Système de canaux gastrodermiques d’une microcolonie de Corallium rubrum ... 73
37| Coupe sagittale d’une microcolonie décalcifiée de Corallium rubrum colorée avec de l’hématoxyline et de l’éosine ... 75
38| Relation entre la taille et la couleur des sclérites situés au front de croissance d'une microcolonie de Corallium rubrum ... 76
39| Observations des cristaux déposés sur la lamelle, réalisées au microscope électronique à balayage ... 77
40| Observation au microscope confocal inversé du marquage à la calcéine des cristaux déposés sur la lamelle et des cellules avec la phalloïdine et le Dapi ... 78
41| Observations en microscopie confocale du marquage par le SNARF-1 du milieu extracellulaire autour des cristaux déposés sur la lamelle ... 79
42| Observations in vivo en microscopie optique de sclérites ... 80
43| Observations en microscopie confocale de sclérites en croissance marqués avec l’anti-MOS de sclérites, et des scléroblastes marqués avec la phalloïdine pour l’actine, et du Dapi pour les noyaux ... 81
44| Observations en microscopie électronique à transmission d’une section transversale de microcolonie de C. rubrum, montrant la présence de jonctions septées entre deux scléroblastes.. ... 82
45| Observations en microscopie confocale du marquage par le SNARF-1 du milieu extracellulaire autour d'un sclérite en croissance ... 82
46| Observations en microscopie confocale d’un sclérite mature marqué avec l’anti-MOS de sclérites, et des cellules environnantes marqués avec la phalloïdine pour l’actine, et le Dapi pour les noyaux..83
47| Diagramme schématique montrant comment le pH du milieu calcifiant est calculé à partir de la composition isotopique du bore (11B). ... 91
48| Représentation schématique de l’utilisation des deux sondes fluorescentes SNARF-1 et SNARF-1 AM pour les mesures de pH extracellulaires et intracellulaires respectivement. ... 92
49| Spectre d'émission de la sonde fluorescente SNARF-1 en fonction du pH du milieu. ... 93
50| Exemple de courbe de calibration du pH réalisée avec la sonde SNARF-1 dans une eau de mer tamponnée 94 51| Protocole d’isolation des cellules de Corallium rubrum. ... 98
52| Système d’incubation et d’observation des préparations pour la microscopie confocale ... 99
53| Méthode d’analyse ratiométrique de la fluorescence émise par la sonde SNARF-1 ou SNARF-1 AM par sections optiques. ... 99
54| Courbes de calibration du pH réalisées à partir du ratio des intensités de fluorescence (R) de la sonde émises à 585 et 640 nm. ... 101
55| Mesures de pH intra- et extracellulaires dans une microcolonie de Corallium rubrum. ... 103
56| Arbre phylogénétique bayésien des Ca2+-ATPases chez les cnidaires ... 107
57| Structure tridimensionnelle des anhydrases carboniques obtenues par cristallisation à rayons X ... 115
58| Représentation structurale de l’hCAII (human carbonic anhydrase II) ... 117
59| Représentation schématique du mécanisme catalytique de l’anhydrase carbonique. ... 118
60| Alignement des séquences protéiques de CruCAs par Clustal Omega ... 126
61| Histologie de Corallium rubrum et protocole de dissection afin d’obtenir les trois différentes fractions... 127
62| Expression relative des gènes codant les CruCAs et Western blot sur des extraits protéiques de différentes fractions de Corallium rubrum ... 128
63| Arbre phylogénétique des 71 séquences protéiques des -ACs de cnidaires ... 130
64| Représentation schématique de l’histologie d’une microcolonie de Corallium rubrum intégrant les valeurs de pH dans les différents compartiments intra- et extracellulaires, ainsi que les données concernant les anhydrases carbonique dont la localisation est connue ... 161
Liste des tableaux
1| Diversité des biominéraux en carbonate de calcium en fonction du polymorphe et des différents
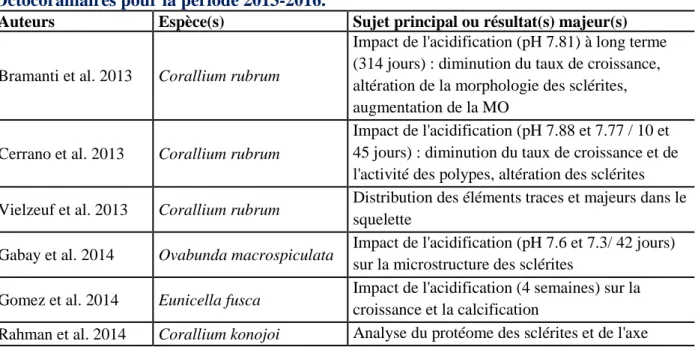
embranchements des métazoaires. ... 7 2| Liste des principales études relatives à la biominéralisation chez les Octocoralliaires pour la période
2013-2016. ... 29 3| Diversité des structures minéralisées élaborées par les Octocoralliaires. ... 33 4| Tableau récapitulatif des études menées sur le processus cellulaire de formation des sclérites chez les
Octocoralliaires. ... 36 5| Tableau récapitulatif des études utilisant des microcolonies de coraux scléractiniaires poussant sur des
supports. ... 64 6| Tableau récapitulatif des études sur le pH au site de calcification des Hexacoralliaires produisant un
squelette en aragonite.. ... 96 7| Caractéristiques des six familles d'anhydrases carboniques : ... 114 8| Tableau récapitulatif des principales études menées sur les anhydrases carboniques impliquées dans le
Liste des communications scientifiques
Communications orales
Le Goff Carine, Ganot Philippe, Zoccola Didier, Allemand Denis, Tambutté Sylvie. Inorganic
carbon and calcification in the Mediterranean red coral Corallium rubrum. BiominXIII. Grenade, Espagne. 16-19 Septembre 2015.
Le Goff Carine, Venn Alexander A, Ganot Philippe, Tambutté Eric, Allemand Denis, Tambutté
Sylvie. In vivo measurement of pH at the sites of calcification of the red coral Corallium rubrum.
17èmes Journées Françaises de Biologie des Tissus Minéralisés. Clermont-Ferrand, France.
04-06 Février 2015.
Communications affichées
Le Goff Carine, Venn Alexander A., Ganot Philippe, Tambutté Eric, Allemand Denis, Tambutté
Sylvie. Carbonic anhydrases and calcification in the red coral Corallium rubrum. The Society of
Experimental Biology (SEB), Prague, République tchèque. 30 Juin-03 Juillet 2015.
Le Goff Carine, Ganot Philippe, Zoccola Didier, Allemand Denis, Tambutté Sylvie. Molecular
characterization of carbonic anhydrases in the red coral Corallium rubrum: different isoforms with specific tissue-expression. 10th Carbonic Anhydrase Conference. Maastricht, Pays-Bas. 20-22 Avril 2015. Lauréat d’un prix pour le meilleur poster
Le Goff Carine, Ganot Philippe, Zoccola Didier, Allemand Denis, Tambutté Sylvie.
Caractérisation et rôle des anhydrases carboniques dans la biominéralisation de Corallium
rubrum. 16èmes Journées Françaises de Biologie des Tissus Minéralisés. Limoges, France.
14-16 Mai 2014. Lauréat d’un prix pour le meilleur poster
Liste des publications
Le Goff Carine, Ganot Philippe, Zoccola Didier, Caminiti-Segonds Natacha, Allemand Denis, &
Tambutté Sylvie (2016). Carbonic anhydrases in Cnidarians: Novel perspectives from the Octocorallian Corallium rubrum. Plos One, 11(8), e0160368.
Le Goff Carine, Tambutté Eric, Venn Alexander A., Techer Nathalie, Allemand Denis, Tambutté
Sylvie. pH measurement by in vivo cell imaging in the high Mg-calcite skeleton forming coral,
Liste des abréviations
Etat de saturation
AC Anhydrase carbonique
AO Acidification des océans
ARNm Acide ribonucléique messager
Ca2+ Ion calcium
CaCO3 Carbonate de calcium
CARP « Carbonic anhydrase related protein »
CCA Carbonate de calcium amorphe
CID Carbone inorganique dissous
CO2 Dioxyde de carbone
CO32- Carbonate
DMG Coefficient de partage du magnésium EDTA Acide éthylène diamine tétra-acétique
GPI Glycosylphosphatidylinositol
H+ Protons
H2O Eau
HCO3- Bicarbonate
HIS Hybridation in situ
Kcat Constante catalytique
K*ps Constance de solubilité
Ma Million d’années
Mg2+ Ion magnésium
MO Matrice organique
MOI Matrice organique insoluble
MOS Matrice organique soluble
pH Potentiel d’hydrogène
pHi pH intracellulaire
pHe pH extracellulaire
PMCA « Plasma membrane calcium ATPase »
qPCR « Quantitative polymerase chain reaction » ROI « Region of interest »
CHAPITRE 1
La biominéralisation chez les coraux
Chapitre 1
L
AB
IOMINERALISATION CHEZ LES CORAUX1.
Généralités sur les biominéraux chez les Métazoaires
Le processus de biominéralisation désigne les phénomènes physico-chimiques, cellulaires, moléculaires et physiologiques qui conduisent à l’élaboration de structures minéralisées, les biominéraux, par des organismes vivants. Ces biominéraux sont présents dans les trois règnes du vivant : Archaebactéries, Eubactéries et Eucaryotes. Au cours de cette thèse nous nous intéresserons aux biominéraux formés chez des animaux pluricellulaires, les Métazoaires, et plus particulièrement à ceux formés par les coraux.
1.1. La biominéralisation dans l’échelle des temps
Les premières traces découvertes de biominéraux sont des squelettes d’origine animale, trouvés sous la forme de fossiles calcaires datant de la période Néoprotérozoïque du Précambrien. Il s’agit de fossiles d’organismes possiblement multicellulaires retrouvés dans la Formation du Trezona découverte dans le Sud de l’Australie et datée de -660 Millions d’années (Ma) (Maloof et al., 2010), et des formes animales faiblement minéralisées comme
Cloudina et Namacalathus (Grotzinger et al., 2000) de l’Ediacarien (-635 à -542 Ma). A la fin
de l’ère Néoprotérozoïque, la transition entre les périodes de l’Ediacarien et du Cambrien (-542 Ma) est caractérisée par une augmentation importante de la diversité et de l’abondance des organismes multicellulaires et des squelettes minéralisés retrouvés dans les archives fossiles. Cette période est appelée « explosion cambrienne » ou « radiation cambrienne ». Mais la signification biologique de l’explosion cambrienne a fait l’objet de débats pendant longtemps, dans la mesure où elle allait à l’encontre de la théorie de la sélection naturelle proposée par Darwin en 1872. Deux hypothèses sont d’ailleurs toujours avancées pour expliquer l’apparition soudaine des principaux embranchements dans une courte fenêtre de temps :
Quelle que soit la date d’apparition de la biominéralisation et de sa diversification, une question demeure : est-ce-que les organismes composant les différents embranchements de Métazoaires ont développé leur capacité à minéraliser de façon indépendante au cours de l’évolution ou, est-ce-que cette capacité à développer un squelette minéralisé est hérité d’un ancêtre commun (Murdock & Donoghue, 2011) ? Si l’on se réfère aux archives fossiles et à l’hypothèse 2 présentée ci-dessus, qui est la plus couramment admise, l’apparition des squelettes minéralisés dans les différents embranchements métazoaires a eu lieu dans une courte fenêtre de temps géologiques, après leur divergence, à la transition Ediacarien/Cambrien (entre -570 et -542 Ma) (Figure 1).
Figure 1| Schéma résumant l’apparition des biominéraux chez les Métazoaires.
Les relations phylogénétiques, l’estimation des temps de divergence et la minéralogie squelettique de chaque groupe sont indiquées. Les couleurs représentent les différents systèmes de minéralisation : le trait rouge pour la minéralisation siliceuse, les traits bleus pour le carbonate de calcium, et les traits verts pour le phosphate de calcium. Les estimations de temps de divergence indiqués aux nœuds (1) par un cercle, proviennent de Peterson & Butterfield (2005), (2) par une étoile, sont basées sur les archives fossiles. Modifié d’après Murdock and Donoghue (2011).
Les diverses origines des squelettes calcaires et phosphatés reflètent de multiples cooptions indépendantes de processus moléculaires et physiologiques qui sont largement partagés entre les organismes eucaryotes (Westbroek & Marin, 1998).
De plus, des gènes orthologues qui codent des protéines avec des similarités de fonction impliquées dans la mécanistique de biominéralisation ont été mis en évidence chez des organismes très éloignés phylogénétiquement tels que les Vertébrés, Mollusques, Eponges et Echinodermes (Jackson et al., 2007; Livingston et al., 2006). Le concept d’une “caisse à outils de la biominéralisation” a ainsi été proposé. Celle-ci comprend différentes protéines retrouvées chez les organismes de différents embranchements et jouant un rôle essentiel dans la biominéralisation, tels que les anhydrases carboniques, le collagène, des transporteurs ioniques, des protéines riches en cystéines, et des protéines acides.
1.2. Diversité, propriétés et fonction des biominéraux
En 1989, plus de soixante types de biominéraux ont été répertoriés dans 55 embranchements des trois règnes du vivant (Lowenstam & Weiner, 1989), mais il est fort probable que leur nombre actuel soit bien supérieur. Parmi ce large répertoire, 39 types de biominéraux ont été identifiés dans le règne animal. Cette diversité s’explique en partie par la variété de constituants ioniques utilisés et intégrés au sein des structures biominéralisées (calcium, magnésium, fer, silice ...). Le calcium est le constituant de 50% des biominéraux identifiés à ce jour et se retrouve précipité sous la forme de phosphate de calcium (Ca3(PO4)2), d’oxalate de calcium (CaC2O4) ou de carbonate de calcium (CaCO3). Le terme de « calcification » est utilisé pour ce type de biominéralisation impliquant du calcium. Le pourcentage élevé de biominéraux contenant du calcium est certainement lié au fait que les organismes ont présenté très tôt au cours de l’évolution, la capacité à métaboliser ce cation (Knoll, 2003; Lowenstam & Weiner, 1989), qui est nécessaire pour de nombreuses fonctions physiologiques et cellulaires (Berridge et al., 1998; Lowenstam & Margulis, 1980; Simkiss & Wilbur, 1989). Une des théories possible serait que la biominéralisation s’est développée chez les organismes marins en tant que processus de détoxification suite aux changements de la chimie des océans au Précambrien. En effet, la concentration en calcium a augmenté dans les océans à ce moment-là. Les organismes auraient alors développé des molécules de liaisons au
Le carbonate de calcium existe sous la forme de cinq polymorphes : calcite, aragonite, vatérite, monohydrocalcite, et carbonate de calcium amorphe. Les polymorphes cristallins ont la même formule chimique mais diffèrent par leur structure cristalline, qui leur confère des propriétés physiques et chimiques différentes. Différents polymorphes peuvent être synthétisés au sein d’un même organisme, comme la calcite et l’aragonite que l’on retrouve dans la coquille de certains mollusques (ormeaux, huîtres...) ou chez le corail bleu Epiphaxum
micropora qui synthétise un squelette en aragonite et des sclérites en calcite1. Si l’on classe les polymorphes de CaCO3 en fonction de leur solubilité, on obtient : carbonate de calcium amorphe > vatérite > aragonite > calcite. Le carbonate de calcium amorphe est par nature hautement instable, et tend à cristalliser sous forme d’aragonite ou de calcite.
Les carbonates en calcite et aragonite peuvent incorporer du magnésium au sein de leur structure cristalline. L’aragonite d’une part, présentera des concentrations rarement supérieures à 1 mol%2 de MgCO
3, tandis que pour la calcite, on distingue la « calcite faiblement magnésienne », avec une concentration inférieure à 4 mol% de MgCO3, et la « calcite hautement magnésienne » avec une concentration supérieure à 4 mol% de MgCO3. Ce pourcentage de magnésium incorporé dans la structure cristalline influence la solubilité, avec les biominéraux composés de calcite hautement magnésienne plus solubles que ceux en calcite faiblement magnésienne (Morse & Mackenzie, 1990). Des exemples d’organismes produisant ces différents polymorphes sont reportés dans le Tableau 1. Chez les cnidaires, les coraux tropicaux qui appartiennent à la sous-classe des Hexacoralliaires, produisent un squelette en aragonite, tandis que les coraux qui appartiennent à la sous-classe des Octocoralliaires produisent des structures minéralisées en calcite hautement magnésienne, comme Corallium rubrum.
Le carbonate de calcium amorphe (CAA) peut être utilisé en tant que précurseur transitoire pour la formation de calcite ou d’aragonite. C’est en 1951 que l’analyse par diffraction des rayons X a permis de mettre en évidence l’existence de calcite et de CCA dans les spicules de nudibranches Archidoris (Odum, 1951). Chez les oursins, les spicules grandiraient par transformation d’une phase transitoire de CCA en calcite (Beniash et al., 1997). Par la suite, il a été suggéré que l’ensemble des parties dures des échinoïdes (épines, spicules et dents) soit formé par ce processus (Politi et al., 2009).
1 Voir p. 33_Tableau 3
2 L’unité « mol% » correspond à la fraction molaire de MgCO
3 contenue dans un biominéral, multiplié par 100.
Dans les spicules d’autres organismes tels que l’ascidie et les éponges calcaires, le CCA coexiste également avec du CaCO3 cristallin sous forme de biominéraux composites (Aizenberg et al., 1996, 2002; Sethmann & Wörheide, 2008). Enfin, chez les crustacés, le CCA présent dans les gastrolithes sert de réservoir temporaire de CaCO3 pour former ultérieurement l’exosquelette lors des périodes de mues (Simkiss & Wilbur, 1989).
Les propriétés physiques et chimiques des biominéraux en carbonate de calcium leur permettent de remplir une large gamme de fonctions chez les Métazoaires, répertoriées dans le Tableau 1.
Tableau 1| Diversité des biominéraux en carbonate de calcium en fonction du polymorphe et des différents embranchements des métazoaires. Les lignes concernant les
Cnidaires sont en bleu.
Minéral Polymorphe Embranchement Organismes Structure
biominérale Fonction
Carbonate de calcium
Chordata Oiseaux Coquille d'œuf Protection Mammifères Otoconie/Oreille
interne Perception Calcite Arthropoda Trilobites Lentille oculaire Vision
Crustacés Carapace/Cuticule Protection Mollusca Bivalves Coquille Protection Echinodermata Oursins Dents Nutrition
Spicules Protection Test Protection Mg-calcite Cnidaria Coraux
Octocoralliaires
Sclérites Axe squelettique
Protection Maintien Méduses Statolithes Perception Foraminifera Foraminifères Test Protection Porifera Eponges calcaires Spicules Protection Chordata Teleostéens Otolithe Perception Mollusca Bivalves Coquille Protection Aragonite Gastropodes Pénis Reproduction
La fonction prépondérante des biominéraux carbonatés est d’assurer la protection de l’organisme, que ce soit envers les prédateurs (carapace ou coquille des mollusques/bivalves), ou encore pour l’isoler de l’environnement extérieur (coquille d’œuf). Chez les coraux, la fonction du squelette est sans doute la même que chez l’Homme, il permet le maintien/support de la colonie ou de l’organisme (dans le cas des coraux non coloniaux). Les sclérites, quant à eux, serviraient (1) de support structurel en limitant la flexibilité des organismes ne possédant pas d’axe minéralisé (Van Alstyne et al., 1992), (2) de protection/dissuasion contre les poissons prédateurs (Hoang Xuan et al., 2015; Van Alstyne et al., 1994; West, 1997), ou (3) de protection contre l’abrasion comme proposé pour le corail rouge de Méditerranée Corallium rubrum (Allemand & Bénazet-Tambutté, 1996), ce qui expliquerait le taux élevé de synthèse et de renouvellement des sclérites chez cette espèce (Allemand & Grillo, 1992).
2.
La biominéralisation chez les coraux
2.1. Les coraux : des cnidaires qui (bio)minéralisent
Lorsque l’on parle de coraux, on pense en premier lieu aux coraux dits « constructeurs de récifs ». Or, le terme « corail » du latin corallium3, est lui-même issu du grec korallion qui est composé de koréô et hals respectivement traduits par « j’orne » et « la mer», et désignait initialement Corallium rubrum, le corail rouge présent en Méditerranée. De nos jours, « corail » désigne un vaste ensemble d’organismes marins calcifiants appartenant à l’embranchement des Cnidaires. Sous le terme de « corail », sont regroupés des Cnidaires calcifiants qui appartiennent 1) aux Octocoralliaires (classe Anthozoa), avec des organismes qui présentent des degrés variables de minéralisation, 2) aux Hexacoralliaires (classe Anthozoa) représentés par les coraux constructeurs de récifs (ordre des Scléractiniaires) qui élaborent un squelette massif, et les coraux profonds, ainsi qu’aux 3) Hydrozoaires (sous embranchement Medusozoa) avec par exemple le corail de feu (genre Millepora).
L’embranchement des Cnidaires est le groupe frère des Bilatériens et comprend cinq grandes classes (Figure 2) : les Anthozoaires, les Scyphozoaires, les Cubozoaires, les Hydrozoaires et les Staurozoaires. Les quatre dernières classes citées sont regroupées dans le sous-embranchement des Médusozoaires.
3 D’autres origines sont proposées : de l’hébreu ‘goral’= petit caillou ; ou de l’arabe ‘garal’= petite pierre
Figure 2| Classification des Cnidaires. D’après World Register of Marine Species
(WoRMS).
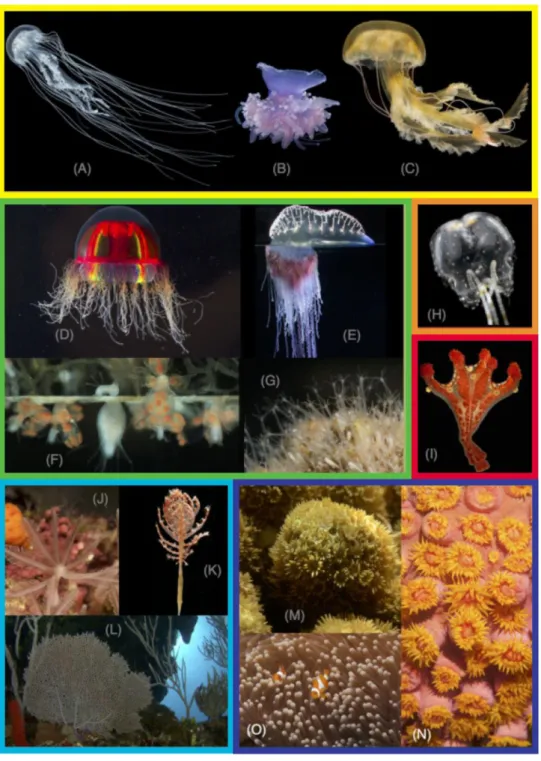
L’embranchement des Cnidaires comprend plus de 11 000 espèces décrites d’invertébrés marins (Appeltans et al., 2012), minéralisants, tels que les coraux constructeurs de récifs, et non minéralisants, tels que les anémones de mer, les hydres et les méduses (Figure 3). « Cnidaire » vient du grec knide signifiant “ortie, urticant”. En effet, tous les organismes de cet embranchement possèdent des cellules spécialisées urticantes appelées cnidocytes. Selon qu’ils sont constitués d’un ou plusieurs individus dénommés polypes, les Cnidaires sont respectivement dits solitaires (cas de l’anémone de mer et de certains coraux) ou coloniaux (la plupart des coraux constructeurs de récifs). Au stade adulte, ils peuvent être fixés sur un substrat (l’hydre, l’anémone de mer et le corail adulte) ou libres dans la masse d’eau (la méduse).
Figure 3| Photographies de représentants de Cnidaires. Jaune (A, B, C) :
Scyphozoaires ; (A) Pelagiidae: Chrysaora quinquecirrha. (B) Cepheidae: Cephea cephea. (C) Scyphozoa. Vert (D, E, F, G) : Hydrozoaires ; (D), Trachylinae: Crossota millsae. (E) Siphonophora: Physalia physalis. (F) Filifera: Podocoryna carnea. (G) Filifera: Hydractinia. Orange et rouge (H, I): Cubozoaires; (H) Copula sivickisi. (I) Haliclystus californiensis. Bleu clair (J, K, L): Octocoralliaires ; (J) Clavulariidae: Clavularia sp. (K) Pennatulidae:
Pennatula sp. (L) Gorgoniidae: Gorgonia ventalina. Bleu foncé (M, N, O) :
Hexacoralliaires ; (M) Poritidae: Porites sp. (N) Dendrophylliidae: Tubastrea faulkneri. (O) Stichodactylidae: Heteractis magnifica. Crédits photos: S. Siebert (A-D), P. Cartwright (F), A. Collins (H-I), and C. Dunn (E, G, J-N). Modifié d’après Zapata et al. (2015).
2.2. Histoire évolutive des coraux
L’histoire évolutive des Cnidaires reste encore difficile à reconstruire et leur taxonomie subit régulièrement des remaniements. Concernant leur phylogénie, deux hypothèses principales s’opposent selon les marqueurs moléculaires étudiés. La première repose sur l’analyse des gènes nucléaires ou des ARN ribosomaux (ARNr) (Bernstein & Schraer, 1972; Berntson et al., 1999; Cavalier-Smith, 2004; Collins et al., 2006) et suggère une monophylie de la classe des Anthozoaires (Figure 4A). Cette monophylie est également suggérée par deux études phylogénomiques (Zapata et al., 2015, Pratlong et al. 2016). A contrario, les reconstructions phylogénétiques basées sur l’étude des génomes mitochondriaux des Cnidaires (Collins, 2002; Kayal & Lavrov, 2008; Park et al., 2012) suggèrent une paraphylie des Anthozoaires (Figure 4B), montrant les Octocoralliaires plus proches des Médusozoaires que des Hexacoralliaires.
Figure 4| Hypothèses avancées sur la phylogénie des Cnidaires montrant les relations possibles au sein de cet embranchement. Modifié d’après Zapata et al. (2015).
(A) Phylogénie traditionnelle des Cnidaires montrant la monophylie des Anthozoaires. (B) Paraphylie des Anthozoaires, avec les Octocoralliaires composant un groupe sœur des Médusozoaires.
Une autre problématique est l’estimation des temps de divergence au cours de l’histoire évolutive des Cnidaires et la datation de l’origine des différentes classes. Deux méthodes principales sont actuellement utilisées pour répondre à cette question :
- Le couplage d’une analyse phylogénétique avec des points de calibration basés sur la datation des archives fossiles est une des méthodes actuellement utilisées pour répondre à
- Des modèles d’évolution génétique, sur la base d’horloges moléculaires, sont également utilisés afin d’extrapoler la datation des radiations phylogénétiques pour lesquelles aucune donnée fossile n’est disponible (Cartwright & Collins, 2007).
A l’heure actuelle, peu de génomes ou de transcriptomes représentatifs de l’embranchement des cnidaires sont séquencés. En se basant sur l’analyse des génomes mitochondriaux des principaux groupes taxonomiques couplée à l’utilisation de cinq archives fossiles, l’étude menée par Park et al. (2012) a permis d’estimer l’origine des Cnidaires à -741 Ma (Figure 5). Le répertoire de fossiles de Cnidaires est bien plus large4 que ces cinq archives fossiles, mais leur attribution taxonomique est encore discutée. Selon cette même étude (Park et al., 2012) les deux sous-classes des Anthozoaires (Hexacoralliaires et Octocoralliaires) semblent avoir divergé très tôt au cours de l’histoire des Métazoaires, avant l’explosion cambrienne, et donc avant -542 Ma. Ces données suggèrent donc que la biominéralisation ait été acquise chez les Cnidaires après la divergence des deux sous-classes Hexacoralliaires/Octocoralliaires.
4 Se référer aux bases de données de paléobiologie (www.paleobiodb.org et http://fossilworks.org).
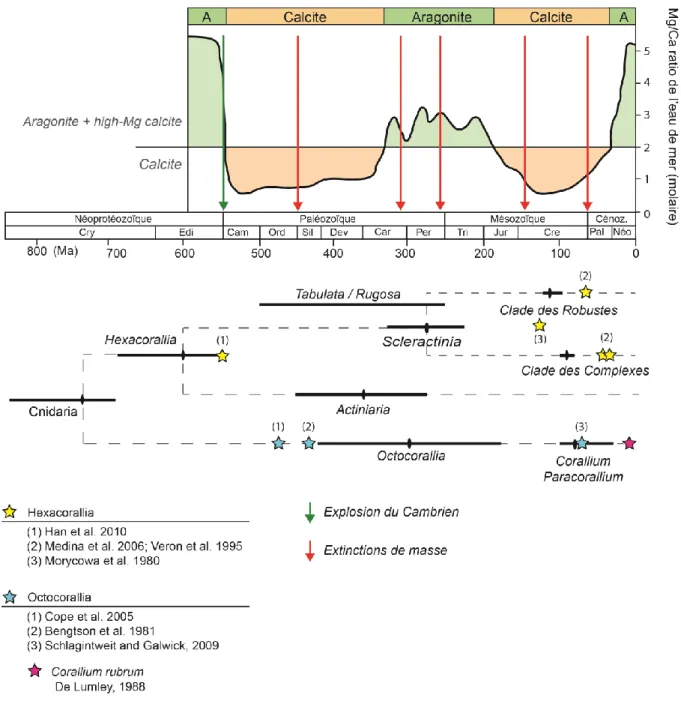
Figure 5| Schéma représentant les oscillations du ratio Mg/Ca et les évènements majeurs au cours des temps géologiques, et les estimations de temps de divergence des Cnidaires. Le graphique du haut représente les oscillations du ratio Mg/Ca de l’eau de mer au
cours des temps géologiques (Hardie, 1996; Demicco et al., 2005). Les flèches représentent les évènements majeurs : la flèche verte correspond à l’explosion du Cambrien (542 Ma), les flèches rouges aux extinctions de masse. En dessous, les barres horizontales noires
Les premières traces d’un Hexacoralliaire sont celles d’un fossile non minéralisant (Eolympia pediculata, Han et al., 2010) daté du Cambrien (-540 Ma). Puis de -542 à - 252 Ma, les Hexacoralliaires dominant au Paléozoïque étaient des coraux appartenant aux groupes des Tabulata (coraux coloniaux) et des Rugosa (coraux solitaires) dont le squelette était fait de calcite ; mais ces deux groupes se sont éteints à l’extinction de masse Permien/Trias (-252 Ma) (Scrutton, 1997). Les coraux scléractiniaires seraient ensuite apparus au milieu du Trias (-200 Ma), produisant un squelette en aragonite (Stanley, 1981). Ces coraux n’auraient pas évolué à partir des Tabulata et Rugosa, mais auraient évolué à partir d’ancêtres à corps mou, similaires aux anémones, qui auraient acquis la capacité à sécréter un squelette calcaire (Oliver, 1980; Stolarski et al., 2011). L’étude des données fossiles d’environ 4 000 espèces (Simpson & Watling, 2011) montrent ensuite un pic de diversité des scléractiniaires il y a environ 150 Ma (Figure 6). Concernant les Octocoralliaires, les données fossiles sont beaucoup moins abondantes, et la difficulté réside aussi dans l’attribution du genre à ces fossiles, qui reste encore parfois discutée, Octocoralliaire ou Hydrozoaire (Cope, 2005).
Figure 6| Diversité des scléractiniaires dérivée des données fossiles en fonction du temps. Les bandes grises alternées avec les bandes blanches représentent les époques
géologiques. La flèche rouge montre le pic de diversité à la fin du Jurassique. Modifié d’après Simpson et al. (2011)
En parallèle à l’évolution des Cnidaires, la chimie des océans a subit de grandes oscillations avec des variations de concentration des éléments chimiques au cours des temps géologiques. La chimie des océans aurait joué un rôle primordial dans la détermination de la minéralogie des organismes élaborant un squelette calcaire au moment de leur première apparition (Porter, 2010).
Notamment, le rapport des ions magnésium sur les ions calcium (Mg/Ca), qui aurait, semble-t-il, influencé (Porter, 2010), mais non contrôlé (Stanley & Hardie, 1998), la minéralogie des organismes précipitant le CaCO3 au moment de leur première apparition. Les périodes caractérisées par un rapport Mg/Ca inférieur à 2 sont associées à des organismes produisant de la calcite faiblement magnésienne et ont donc été dénommées « mers calcitiques », tandis que les périodes avec un rapport Mg/Ca supérieur à 2 sont caractérisées par la dominance d’organismes produisant de la calcite hautement magnésienne et/ou de l’aragonite et sont dénommées « mers aragonitiques » (Figure 5). Les oscillations ultérieures du ratio Mg/Ca au cours de l’histoire évolutive des organismes auraient ensuite influé sur l’abondance de certains taxons, voir même entraîné leur extinction5. D’après Kiessling et al. (2008), les évènements d’extinctions de masse auraient joué un rôle prédominant dans la régulation de la minéralogie squelettique.
Par exemple, l’extinction de masse qui a eu lieu à la transition Ordovicien/Silurien aurait entraîné une forte diminution de la proportion d’organismes précipitant de l’aragonite en faveur de ceux précipitant de la calcite, ce qui semble d’ailleurs être corrélé avec l’apparition des Octocoralliaires calcifiants (Figure 5) .L’extinction de masse à la transition Permien/Trias serait également associée à une augmentation de la diversité des taxons précipitant de l’aragonite, et correspond à la divergence des Scléractiniaires en clades robustes et complexes.
2.3. Processus de biominéralisation chez les coraux
L’étude de la biominéralisation concerne d’une part le produit fini, c'est-à-dire la structure minéralisée synthétisée par un organisme vivant (le biominéral) et d’autre part le processus dynamique qui regroupe l’ensemble des processus physico-chimiques, cellulaires et moléculaires par lesquels des organismes vivants élaborent des structures minéralisées. Cette deuxième partie sera détaillée ci-dessous dans la mesure où c’est sur cet aspect que j’ai
Ca
2++ CO
32−→ CaCO
3(1)
Le calcium est présent à une concentration constante d’environ 10 mmol.kg-1 dans les océans actuels, sous la forme du cation divalent Ca2+. Le carbone inorganique dissous (CID), quant à lui, existe sous trois formes qui sont à l’équilibre : le dioxyde de carbone (CO2), les ions bicarbonates (HCO3-) et les ions carbonates (CO32-).
𝐂𝐎
𝟐+ H
20 ⇌ H
2CO
3⇌
𝐇𝐂𝐎
−𝟑+ H
+⇌
𝐂𝐎
𝟑𝟐−+ 2H
+(2)
Dans une eau de mer à pH ~8.1, les ions HCO3- contribuent pour près de 90% au CID total (Figure 7), le CO32-, 9%, et le CO2 pour seulement 1%.
Figure 7| Concentrations des espèces carbonatées dans l'eau de mer en fonction du pH. Au pH de l’eau de mer (~8,1), à une salinité de 35 psu et une température de 25°C, la
forme majoritaire de carbone inorganique dissous est le HCO3-. À pH=6,4 (pH=pK1) on a égalité des concentrations en CO2 et en HCO3-. À pH=10,4 (pH=pK2) on a égalité des concentrations en HCO3- et en CO32-.
La Figure 7 montre que le pH va déterminer le sens de la réaction (2) et la proportion de chaque espèce carbonatée dans le milieu. Une augmentation du pH par rapport à celui de l’eau de mer actuel va favoriser la formation de CO32-. Le pH est donc un paramètre majeur dans la mécanistique de la biominéralisation, et sera l’objet d’étude du chapitre 4.
D’un point de vue physico-chimique, la précipitation du CaCO3 est thermodynamiquement favorisée quand la concentration en Ca2+ et CO32- atteint ou dépasse la solubilité du CaCO3 (K*ps), ou en d’autres termes lorsque l’état de saturation du CaCO3 (ΩCaCO3) dépasse la valeur de 1. On parle alors de sursaturation de l’eau de mer en CaCO3. Au contraire, si ΩCaCO3 est inférieur à 1 on parle de sous-saturation, ce qui favorise alors la dissolution du CaCO .
L’état de saturation du CaCO3 est le produit des concentrations en Ca2+ et CO32- dans l’eau de mer, ou dans le milieu d’intérêt, divisé par le produit de solubilité du CaCO3 (K*ps) :
Ω
CaCO3=
[Ca2+]milieu x [CO32−]milieuK∗
ps
(3)
La constante du produit de solubilité (K*ps) est la constante d'équilibre de la réaction de dissolution : CaCO3 Ca2+ + CO32-, et correspond donc au produit des concentrations au seuil de solubilité. La solubilité dépend de la température, de la salinité et de la pression, donc la constante K*ps dépend également de ces paramètres (Mucci, 1983).
K∗
ps = [Ca2+]𝑠𝑎𝑡𝑢𝑟é x [CO32−]𝑠𝑎𝑡𝑢𝑟é
(4)
Comme présenté au début de ce chapitre, les coraux forment des biominéraux carbonatés cristallisés principalement sous forme de calcite et d’aragonite. L’état de saturation de ces deux polymorphes s’écrit selon ces deux équations :
Ω
aragonite=
[Ca2+]milieu x [CO32−]milieuK∗ps aragonite
(5)
Ω
calcite=
[Ca2+]milieu x [CO32−]milieuK∗
ps calcite
(6)
Ces deux polymorphes sont caractérisés par des K*ps différents, avec le K*ps de l’aragonite supérieur au K*ps de la calcite (Mucci, 1983). Aux mêmes concentrations de Ca2+ et CO32-, l’état de saturation de l’aragonite est donc inférieur à celui de la calcite, ce qui se traduit par une solubilité plus élevée de l’aragonite par rapport à la calcite. Que ce soit dans le cas de l’aragonite ou de la calcite, afin de favoriser la précipitation, il faut donc augmenter l’état de saturation de la solution et pour cela la concentration en Ca2+ ou en CO
32-. Comme vu précédemment, le pH va influencer la disponibilité en CO32- et donc modifier l’état de saturation, et ainsi jouer de façon indirecte un rôle sur la précipitation du CaCO3.
A ce niveau le rapport des ions magnésium sur les ions calcium (Mg/Ca) en solution joue un rôle essentiel et va gouverner la sélection du polymorphe des carbonates. La présence de magnésium en solution n’affecte pas la nucléation de l’aragonite, tandis qu’elle présente un effet inhibiteur sur la nucléation de la calcite pure en augmentant l’énergie de surface et la solubilité. Lorsque le magnésium est présent en solution, il peut être incorporé dans la calcite en se substituant au calcium, donnant de la calcite dite « magnésienne ». L’incorporation du magnésium est régie par des lois physico-chimiques et est définie selon un coefficient de partage (DMG) qui relie le rapport Mg/Ca mesuré dans la calcite à celui de la solution de précipitation :
𝐷𝑀𝐺 = 𝑀𝑔/𝐶𝑎𝐶𝑎𝑙𝑐𝑖𝑡𝑒
𝑀𝑔/𝐶𝑎𝑠𝑜𝑙𝑢𝑡𝑖𝑜𝑛 (7)
De nombreuses études ont cherché à comprendre l’influence de la température, du pH, ou encore de la salinité sur ce coefficient de partage. Mais aucun consensus n’a été établi sur le ou les facteurs contrôlant le DMG. Un schéma récapitulatif a été proposé par Sun et al. (2015) pour expliquer la relation entre la supersaturation de la solution, le rapport Mg/Ca, l’énergie de surface et la nucléation des polymorphes de carbonate de calcium (Figure 8). Dans une solution sans magnésium, seule la calcite pure précipite avec un ΩCaCO3 faible de 5. Mais lorsque la concentration de magnésium, et donc le rapport Mg/Ca, augmente et atteint une valeur de 2, l’ΩCaCO3 doit être augmenté à une valeur de 18 pour observer la nucléation de la calcite. Pour l’aragonite, il faut un ΩCaCO3 de 18 pour que la nucléation ait lieu, indépendamment du rapport Mg/Ca. Et lorsque l’on se situe à un Mg/Ca de 5,2 (océans actuels), l’ ΩCaCO3 doit être augmenté à 35 pour déclencher la nucléation de la calcite, ce qui est bien plus élevé que ce qui est nécessaire pour la nucléation de l’aragonite.
Figure 8| Diagramme de cinétique de phase du taux de nucléation relatif entre la calcite et l’aragonite. La nucléation dépend du rapport Mg/Ca de la solution et de la
supersaturation (Ωcalcite). Dans une solution sans Mg2+, la calcite est la seule phase à précipiter avec un Ωcalcite de 5. La nucléation de l’aragonite débute à partir d’un Ωcalcitede 18, indépendamment de Mg/Ca (étoile verte). À Mg/Ca = 5,2 (rapport actuel des océans), l’Ωcalcitedoit être augmenté à 35 pour déclencher la nucléation de la calcite (étoile jaune).
Ces résultats sont valables dans des environnements abiotiques et inorganiques, les règles s’appliquent dans des situations biologiques mais les molécules organiques (protéines, polysaccharides...) sécrétées par les cellules calcifiantes de l’organismes au site de calcification vont interagir avec les ions en solution et moduler la nucléation, la croissance et l’inhibition de la croissance des biominéraux carbonatés (Belcher et al., 1996; Falini et al., 1996). Il existe deux types de nucléation, la nucléation homogène versus celle hétérogène (S. Mann, 2001). La nucléation homogène correspond à la nucléation spontanée dans une solution supersaturée. La nucléation hétérogène, quant à elle, décrit la formation de cristaux à la surface d’un substrat présent dans le milieu. La présence de molécules organiques en solution va diminuer la supersaturation nécessaire pour obtenir un même taux de nucléation (Figure 9).
La physico-chimie au site de calcification qui va déterminer l’état de saturation et les taux de nucléation est, dans le cas des organismes biominéralisateurs, sous le contrôle de processus cellulaires et moléculaires essentiels pour réguler la concentration ionique et l’apport de macromolécules organiques au site de calcification.
b) Processus cellulaires et moléculaires de la biominéralisation
Les processus de biominéralisation au sein du vivant peuvent être divisés en deux types « Biominéralisation biologiquement induite » ou « Biominéralisation biologiquement contrôlée » selon le niveau de contrôle exercé par l’organisme au niveau cellulaire et moléculaire. Souvent il est difficile de classer un type de biominéralisation dans une de ces deux catégories parce que 1) tous les niveaux de contrôle ne sont pas connus, 2) la terminologie utilisée par les géochimistes et les biologistes n’est pas comparable. Cependant il existe un consensus sur le fait que la biominéralisation au niveau cellulaire et moléculaire doit prendre en compte trois aspects :
- La délimitation d’un milieu où a lieu la calcification, dénommé site de calcification ; - La sécrétion de macromolécules, qui vont constituer la matrice organique ;
- Le transport des ions et leur régulation (calcium, bicarbonates et protons).
Le site de calcification
Chez les coraux, le site de calcification, dans le cas de la formation d’un squelette (dit exosquelette), est extracellulaire et se trouve à l’interface entre les cellules calcifiantes et le substrat. Lors des premiers stades larvaires, c’est un biofilm qui sert de substrat à la fixation et c’est ensuite le squelette néoformé qui sert de substrat lors des stades suivants de calcification. Dans le cas de la formation des sclérites, le processus est intracellulaire dans les premiers stades, puis extracellulaire lors de la maturation (bien qu’il semble exister des différences selon les espèces, cf. chapitre 2, Tableau 4) L’important, qu’il s’agisse d’un processus intra- ou extracellulaire, c’est la composition du site de calcification et sa régulation tant du point de vue ionique que moléculaire.
La matrice organique
Les cellules calcifiantes synthétisent et sécrètent vers le site de calcification des macromolécules organiques (protéines, polysaccharides, lipides...) qui sont regroupées sous le terme de « matrice organique » (MO), ou de « sécrétome » (Figure 10).
Une partie des macromolécules du sécrétome joue un rôle dans la formation du biominéral, il s’agit du sécrétome dit « calcifiant » qui comprend des molécules non-incluses dans le biominéral, qui interviennent au site de calcification, et des molécules incluses dans le biominéral constituant le squelettome. Le squelettome comprend des macromolécules sécrétées ainsi que des domaines extracellulaires clivés de protéines transmembranaires de l’épithélium calcifiant. La présence de contaminants cellulaires dans le squelette (comme de l’actine), est également possible (Marin et al., 2016).
Figure 10| Représentation schématique de l’interface entre un épithélium calcifiant et une structure biominéralisée en carbonate de calcium. D’après Marin et al.
(2016).
L’étude de la MO incluse dans le squelette se fait après déminéralisation. Deux fractions sont dissociables selon leur solubilité en milieux aqueux et se retrouvent séparées au moment de leur extraction du biominéral : les fractions soluble et insoluble. La majorité des études porte d’ailleurs sur la fraction soluble car plus facilement obtenue. La fraction soluble comprend principalement des polysaccharides, glycoprotéines et des protéines acides et
Afin d’élucider le rôle de ces protéines dans la minéralisation, des expériences de précipitation in vitro de CaCO3 ont été réalisées en présence d’extraits totaux de MO ou de protéines spécifiques et ont permis de déterminer que la MO peut jouer un rôle sur la nucléation des cristaux, le polymorphe de CaCO3, l’assemblage, ou encore la morphologie des cristaux formés (Falini et al., 2013; Mass et al., 2013). La fraction insoluble, quant à elle, comprend principalement des glycosaminoglycanes complexes et d’autres macromolécules hydrophobes (Addadi et Weiner, 1985; Allemand et al., 1994; Mann, 2001). Ce sont ces macromolécules qui constitueraient la trame sur laquelle se forme le minéral.
Les travaux menés sur les coraux ont principalement porté sur l’identification des protéines constitutives de la MO soluble. La Galaxine a été la première protéine identifiée dans la MO du squelette de Galaxea fascicularis (Fukuda et al., 2003; Watanabe et al., 2003), suivie de la caractérisation de la Scléritine dans la MO des sclérites de Corallium rubrum (Debreuil et al., 2012a). Les avancées moléculaires par le développement de la protéomique, génomique et transcriptomique, ont notamment permis d’étudier le protéome des squelettes d’Hexacoralliaires comme Stylophora pistillata (Drake et al., 2013) et Acropora millepora (Ramos-Silva et al., 2013), et de l’Octocoralliaire Corallium konojoi (Rahman et al., 2014). Récemment, une étude comparative des protéines impliquées dans la précipitation du CaCO3 chez les Cnidaires, Mollusques et Echinodermes a montré la cooptation de protéines ayant des rôles similaires (propriétés d’adhésion, structurelles, de signalisation et de régulation) entre ces trois embranchements (Drake et al., 2014), qui va dans le sens d’une convergence fonctionnelle de la biominéralisation. Parmi ces molécules, on trouve notamment les anhydrases carboniques (ACs), des enzymes qui catalysent l’interconversion du CO2 en HCO3-. Certaines de ces ACs sont préférentiellement localisées au niveau des membranes des cellules calcifiantes (Miyamoto et al., 1996; Moya et al., 2008a). D’autres sont retrouvées dans le squelette où leur activité catalytique est maintenue après leur extraction (Borelli et al., 2003; Drake et al., 2013; Mann et al., 2008). Dans la mesure où ces caractéristiques ne sont pas propres aux coraux mais se retrouvent chez de nombreux organismes biominéralisateurs, il est admis que ces ACs jouent un rôle clef dans la biominéralisation que ce soit au niveau du site de calcification ou dans le squelette.
Le transport des ions et leur régulation (calcium, bicarbonates et protons)
Le site de calcification des coraux est séparé de l’eau de mer par plusieurs couches de cellules animales.
Le calcium et le carbone inorganique dissous (CID) qui sont présents dans l’eau de mer doivent être transportés jusqu’au site de calcification. Le CID peut également être produit par la respiration cellulaire (dioxyde de carbone, CO2).
Quelle que soit leur origine (eau de mer ou métabolisme animal), deux modes de transport existent pour le transport des ions et molécules :
- Un transport paracellulaire, entre les cellules. Les ions/molécules sont transportés selon leur gradient électrochimique, par diffusion et de façon passive. Ce sont les propriétés de permselectivité des barrières intercellulaires, représentées par les jonctions septées, qui vont déterminer le passage des ions entre les cellules des différents épithélia, depuis l’eau de mer jusqu’au site de calcification (Bénazet-Tambutté et al., 1996; Ganot et al., 2015; Gao et al., 2006) ;
- Un transport transcellulaire, à travers les cellules. Dans ce cas, les ions/molécules membrane-imperméants sont transportés de façon active et sélective contre leur gradient chimique par l’intermédiaire de transporteurs membranaires (canaux, pompes et échangeurs ioniques) (Zoccola et al., 1999, 2004, 2015).
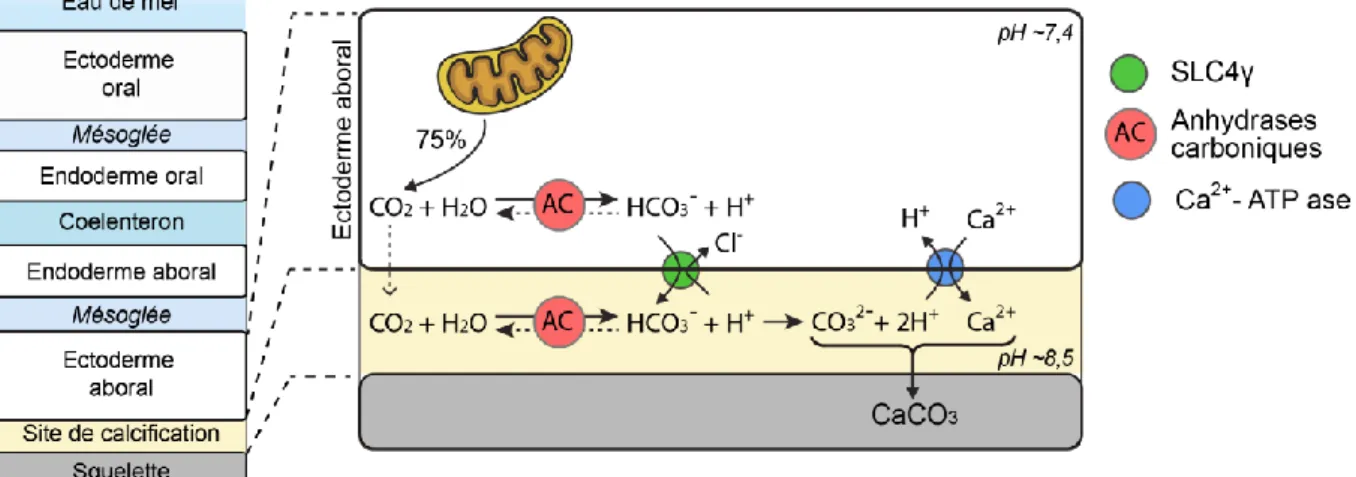
Les études menées jusqu’à présent pour caractériser le transport des ions impliqués dans la calcification ont porté principalement sur les coraux scléractiniaires (Figure 11) qui produisent un squelette massif. Concernant le transport transcellulaire de calcium, deux transporteurs ont été identifiés et localisés au niveau de l’ectoderme calicoblastique, responsable de la sécrétion du squelette, chez le scléractiniaire Stylophora pistillata : des canaux calciques voltages dépendants permettant l’entrée de calcium dans les cellules (Tambutté et al., 1996; Zoccola et al., 1999), et une pompe Ca2+-ATPase (Zoccola et al., 2004) permettant la sortie de calcium intracellulaire vers le site de calcification. Ce transporteur actif serait également responsable du retrait de protons au site de calcification générés lors de la précipitation de CaCO3 afin de limiter l’acidification engendrée par cette réaction (McConnaughey & Whelan, 1997). En effet, il a été montré chez les coraux scléractiniaires que le pH au site de calcification est plus élevé que le pH de l’eau de mer. Cet
Le CO2 diffuse librement à travers les membranes vers le site de calcification, mais l’HCO3- doit être transporté. Il existe deux voies pour amener le CO2 métabolique vers le site de calcification. Soit il diffuse librement à travers la membrane plasmique pour être ensuite converti en HCO3- (action d’une AC présente dans le milieu calcifiant), soit il est converti en HCO3- au sein de la cellule (par une AC intracellulaire), puis transporté activement (par un transporteur de bicarbonates) au site de calcification. Ces deux voies semblent être utilisée comme le suggère (1) le pH favorable mesuré dans les cellules de l’ectoderme aboral (Venn et al., 2009) et au site de calcification (Venn et al., 2011), (2) l’identification d’ACs intracellulaires et extracellulaires (Bertucci et al., 2013, 2011; Moya et al., 2008a), (3) ainsi que l’identification d’un transporteur de bicarbonate spécifique (SLC4γ, Solute carrier 4; Zoccola et al., 2015).
Figure 11| Schéma récapitulatif du transport par la voie transcellulaire des ions nécessaires à la précipitation de CaCO3 chez un corail scléractiniaire, entre l’ectoderme
aboral et le site de calcification.
En revanche, les études menées chez les Octocoralliaires, qui forment un axe squelettique et/ou des sclérites, sont moins nombreuses et donc la compréhension de la mécanistique est moins avancée. Chez Leptogorgia virgulata, une Ca2+-ATPase intervient dans la concentration du calcium dans des vacuoles nécessaires à la formation des sclérites (Kingsley & Watabe, 1985) et chez cette espèce, le CO2 produit de la glycolyse, ne représente que 33% du carbone utilisé pour la formation des sclérites (Lucas & Knapp, 1997), suggérant donc un rôle prépondérant du HCO3- provenant de l’eau de mer environnante pour leur calcification.