T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier Discipline ou spécialité : Immunologie
JURY
Pr Salvatore Valitutti Président du Jury Pr Jacques Urbain Rapporteur
Pr Thierry Velu Rapporteur Dr Gervaise Loirand Examinatrice
Dr Anne Françoise Tilkin-Mariamé Directrice de Thèse Pr Gilles Favre Co-directeur de Thèse
Ecole doctorale : Biologie-Santé-Biotechnologies Unité de recherche : INSERM U563
Directeur(s) de Thèse : Dr Anne-Françoise Tilkin-Mariamé et le Pr Gilles Favre Rapporteurs : Pr Jacques Urbain et Pr Thierry Velu
Présentée et soutenue par Guillaume SARRABAYROUSE Le 14 décembre 2007
Résumé
Les stratégies d’immunothérapie sont basées sur l’existence d’antigènes de tumeur (TAA) contre lesquels l’hôte est capable d’induire une réponse immune spécifique. Cependant, les cellules tumorales sont souvent peu immunogènes à cause de leur faible densité en
complexes CMH de classe I (CMH-I)/TAA ou à cause de leur incapacité à délivrer des signaux de costimulation.
Au cours de ce travail, nous avons mis en évidence, que l’inhibition de la géranylgéranyl transférase I par le GGTI-298 favorise l’induction d’une réponse immune anti-mélanome, en induisant, sur les cellules tumorales murines B16F10 traitées, une expression des molécules de costimulation (CD80 et CD86) et une surexpression des molécules du CMH-I, induite par l’INF-γ. Ces modifications permettent de favoriser le rejet immun des mélanomes traités injectés à des souris immunocompétentes et induisent chez ces souris l’activation de
lymphocytes T spécifiques. Comme différentes petites protéines G de la famille Rho peuvent être géranylgéranylées, l’utilisation d’inhibiteurs spécifiques des protéines Rho (Rho A, Rho B et Rho C) a montré leur(s) implication(s) dans ces régulations. Ainsi, le traitement in vitro des cellules mélaniques murines par la combinaison d’INF-γ et d’inhibiteurs des protéines Rho (C3 exoenzyme) induit une forte surexpression des molécules CMH-I et des molécules de costimulation CD80 et CD86 à la membrane des cellules tumorales.
Par ailleurs, nous avons évalué l’intérêt thérapeutique de nos traitements pharmacologiques associant l’IFN-γ et le GGTI-298. Nous avons dans un premier temps testé le potentiel vaccinal de nos traitements en montrant que des souris injectées avec des cellules B16F10 préalablement traitées et iradiées étaient partiellement protégées contre le développement de tumeurs sauvages. Dans un deuxième temps, nous avons montré que ces traitements induisent sur des tumeurs humaines une surexpression des molécules HLA de classe I et des molécules de costimulation ayant des activités activatrices (CD86) ou inhibitrices (PD- L1) et provenant des familles B7 ou TNF/TNFR. De plus, nous avons mis en évidence la capacité stimulatrice de ces mélanomes humains prétraités à induire in vitro l’activation de lymphocytes T CD8 cytotoxiques spécifiques des mélanomes et sécrétant de l’IFN−γ, à partir de donneurs sains HLA-compatibles.
Au cours de cette thèse nous avons également mis en évidence le rôle régulateur des protéines Rho dans l’expression de deux molécules de la famille des TNF : « FasL et CD70 ». La molécule FasL est exprimée sur de nombreuses lignées tumorales et favorise le mécanisme de contre-attaque tumorale en induisant l’apoptose de LT ou LB Fas positifs par la voie d’apoptose induite par la fixation du ligand Fas-L sur son récepteur Fas. Nous avons montré que la protéine RhoA et son effecteur ROCKp160 régulent de façon négative
l’expression de Fas-L à la membrane des cellules de mélanome murin B16F10. Ces
protéines limitent ainsi in vitro le mécanisme de contre-attaque tumorale. La molécule CD70 est exprimée sur diverses lignées tumorales mais son rôle fait encore l’objet de
controverses. Nous avons montré pour la première fois qu’une lignée de mélanome métastatique humaine exprime de façon constitutive la molécule CD70 et que cette expression, régulée positivement par la protéine RhoA, inhibe in vitro la prolifération de lymphocytes allogéniques.
L’ensemble de ce travail de thèse a permis de montrer que les protéines Rho régulent l’expression de nombreuses molécules impliquées dans la mise en place de réponses immunes anti-mélanome. Ces résultats permettent d’envisager le développement de protocoles d’immunothérapie clinique utilisant des cellules de mélanomes HLA-compatibles prétraitées in vitro par l’association IFNγ plus GGTI-298 comme cellules « thérapeutiques » ou vaccinales.
Summary
Melanoma is a highly lethal cutaneous tumor, killing affected patients through multiple, poorly immunogenic metastases. Suboptimal activation of T lymphocytes by melanoma cells is often due to the defective expression of class I major histocompatibility antigens (MHC-I) and costimulatory molecules, or to the capacity of FasL molecules expressed on melanoma cells to induce lymphocyte apoptosis.
In this work, I demonstrated that statins, inhibitors of HMGCoA reductase, enhance mIFN-γ induced expression of MHC class I antigens on murine B16F10 melanoma. GGTI-
298, a geranylgeranyl transferase I inhibitor, mimics this effect of statins that is related to peptide transporter protein TAP1 up-regulation. Simultaneously, GGTI-298 induces the expression of CD80 and CD86 costimulatory molecules. C3 exoenzyme, which selectively inactivates Rho proteins, phenocopies the effects of GGTI-298, indicating a role for Rho proteins in these events. Furthermore, the treatment of B16F10 cells with GGTI-298 or C3 exoenzyme associated with mIFN-gamma induces in vivo tumor growth slowing down in immunocompetent but not in nu/nu syngeneic mice. Both in vivo injections and in vitro
restimulation of splenocytes with GGTI-298- and mIFN-gamma-treated B16F10 cells induces an enhancement of specific CD8 T lymphocytes labeled by TRP-2/H-2K(b) tetramers. Using a human melanoma model (LB1319-MEL), we demonstrated that in vitro treatment with hIFN-γ and GGTI-298 led to the up regulation of MHC-I and a costimulatory molecule CD86 and down regulation of an inhibitory molecule PD-1L. Co-culture experiments with peripheral blood mononuclear cells (PBMC) revealed that modifications induced by hIFN-! and GGTI- 298 on the selected melanoma cells, enables the stimulation of lymphocytes from HLA compatible healthy donors. Indeed, as compared with untreated melanoma cells,
pretreatment with hIFN-γ and GGTI-298 together rendered the melanoma cells more efficient at inducing the: i) activation of CD8 T lymphocytes (CD8+/CD69+); ii) proliferation of tumor- specific CD8 T cells (MelanA-MART1/TCR+); iii) secretion of hIFN-γ; and iv) anti-melanoma specific cytotoxic cells. In this study, it is shown that vaccination with mIFN-γ and GGTI-298 pretreated B16F10 cells induces a protection against untreated tumor growth and pulmonary metastases implantation.
Furthermore the capacity of FasL molecules expressed on melanoma cells to induce
lymphocyte apoptosis contributes to either antitumor immune response or escape depending on their expression level. Little is known, however, about the mechanisms regulating FasL protein expression. Using the murine B16F10 melanoma model weakly positive for FasL, we demonstrated that in vitro treatment with statins enhances membrane FasL expression. C3 exotoxin and the geranylgeranyl transferase I inhibitor GGTI-298, mimic this effect. Inhibition of RhoA expression by small interfering RNA (siRNA) increased membrane FasL expression, whereas overexpression of constitutively active RhoA following transfection of RhoAV14 plasmid decreased it. Moreover, the inhibition of a RhoA downstream effector p160ROCK also induced this FasL overexpression. We conclude that the RhoA/ROCK pathway
negatively regulates membrane FasL expression in these melanoma cells. Furthermore, we have shown that B16F10 cells, through the RhoA/ROCK pathway, promote in vitro apoptosis of Fas-sensitive A20 lymphoma cells.
All together, these data indicate that protein geranylgeranylation as well as Rho protein are critical for regulating on melanomas the expresion of molecules involved in anti-melanoma immune response. These results, indicate that treatment of melanoma cell lines with pharmacological molecules targeting Rho proteins, be a novel approach to produce tumor cells suitable for vaccination and for stimulation of anti-melanoma effector cells.
SOMMAIRE
Données Bibliographiques
………..p1
Partie I : La réponse immune anti-tumorale et ses limites
I-La réponse immune innée anti-tumorale
………...p3
A-Les cellules Natural Killer : NK
B-Les lymphocytes Natural Killer T : NKT
C-Les lymphocytes T gamma-delta : LT
γδ
D-Les Cellules Dendritiques : Les CD
1) La capture de l’antigène2) La dégradation et l’apprêtement des antigènes
2.1) Voie de présentation par les molécules du CMH-I 2.2) Voie de présentation par les molécules du CMH-II 2.3) Voie alternative, présentation croisée
3) Migration et maturation des CD 4) Les cytokines et chémokines
E-Les Cellules dendritiques myéloïdes (CDm) et plasmacytoïdes (CDp)
F-Les IKDC le chaînon manquant
II-La réponse immune adaptative anti-tumorale
………...p25
A-Les Antigènes de tumeurs
1) Les antigènes d’origine embryonnaire 2) Les antigènes de différenciation 3) Les antigènes surexprimés4) Les antigènes spécifiques des tumeurs
B-L’activation de la réponse immune adaptative
1) La signalisation par le TCR : le premier signal d’activation lymphocytaire 2) Le signal de costimulation
2-1) Les molécules de costimulation de la famille des immunoglobulines:
2-2) Les molécules de costimulation de la famille des TNF (Tumor Necrosis Factor)
2-3) Les ligands activateurs des cellules NK
3) La synapse immunologique
C-Acquisition des fonctions effectrices des LT et rôles dans la réponse
immune anti-tumorale.
1) Les LTCD8 cytotoxiques 2) Les LTCD4 auxiliaires
D-La mémoire immunitaire associée aux LT
E-Les Lymphocytes B
III Mécanismes d’échappement des tumeurs à
l’immunosurveillance
………...p44
A-Mécanismes d’échappement tumoral lié à des modifications membranaires
des cellules tumorales
6) Perte ou diminution de l’expression des molécules du CMH-I
2) La contre attaque tumorale associée à l’expression de protéines de la famille du TNF
3) Rôle de deux molécules inhibitrices de la famille des immunoglobulines dans l’échappement
tumoral : les protéines PD-L1 et PD-L2
4) Rôle des molécules de CMH non classique dans l’échappement tumoral : les protéines HLA-
G et HLA-E
B-Mécanismes d’échappement tumoral associés aux effecteurs immuns
6) Les LT régulateurs : les Treg2) Les Macrophages Associés aux Tumeurs : Les TAM
3) Les cellules dendritiques : Les CD
3.1) Les cellules dendritiques immatures (Cdi)
4) Les cellules suppresseurs myéloïdes : Les MSC
C-Les Mécanismes d’échappement tumoral associés auxmolécules du
microenvironnement
1)L’ indoleamine 2,3-dioxygenase : IDO
2) Le facteur de croissance transformant béta : TGFβ 3) Le VEGF (Vascular Endothelial Growth Factor):
4) Les Chémokines
5) La cyclooxygénase 2 : COX2
6) L’arginase et la nitric-oxide synthase : ARG et NOS
Partie II : Les protéines Rho de nouvelles cibles
thérapeutiques dans l’immunothérapie du mélanome
I Le mélanome cutané
………...p60
A-Les divers types de mélanomes
B-Histologie et développement des mélanomes
C-Altérations génétiques impliquées dans l’apparition des mélanomes
D)
La voie de signalisation Ras / Raf / MEK / Erk2) Le facteur de transcription MITF 3) La voie de la PI3K
4) Mutations des voies de survie et d’apoptose 5)Altérations des gènes suppresseurs de tumeur
D-Traitements ciblés des mélanomes
II Immunothérapies du mélanome
………p72
A-L’Interféron alpha (IFN-
α) et l’Interleukine 2 (IL-2)
B-La chimio-immunothérapie
C-Les immunoadjuvants
D-La vaccination par cellules tumorales
E-La vaccination par protéines de choc thermiques
F-La vaccination par peptides ou protéines de tumeurs
G-La Vaccination par cellules dendritiques
H-Vaccination par plasmides ou vecteurs viraux
I-L’immunothérapie adoptive
J-Electrochimiothérapie et électroimmunothérapie
III Les statines
………..p83
A-Origine et mode d’action des statines
B-Statines et cancer
1) Lignées de cancers colorectaux
2) Lignées de cancers du sein 3) Lignées de mélanomes
C-Rôles immunomodulateurs des statines
IV Les petites protéines G de la famille Rho………...p91
A-Propriétés générales des protéines Rho
B-Fonctions des protéines Rho
1) GTPases Rho et cytosquelette1-a) GTPases Rho et cytosquelette d’actine 1-b) GTPases Rho et microtubules
2) GTPases Rho et trafic cellulaire 3) GTPases Rho et expression génique
4) GTPases Rho et progression du cycle cellulaire 5) GTPases Rho et apoptose
C-Propriétés immunomodulatrices des protéines Rho
1) GTPases Rho et sélection thymique3) GTPases Rho et cytotoxicitée
4) GTPases Rho et présentation antigénique
E-Moyens d’étude des fonctions des protéines Rho dans les cellules
1) Modification de l’activité et de la localisation des protéines Rho :la prénylation 2) Transfection des différentes formes mutantes des Rho3) Extinction de la protéine Rho ou de ses régulateurs par siRNA 4) Modulation de l’activité des Rho
5) Quantification des protéines Rho activées
Objectifs des travaux
………...p104
Résultats
……….p105
RESULTAT I
Geranylgeranyl transferase inhibition stimulates antimelanoma immune response through MHC class I ans costimulatory molecule expression.
Tilkin-Mariamé, AF ; Cormary ,C; Ferro, N; Sarrabayrouse, G; Lajoie-MAZENC, I; Faye, JC; Favre,
G.
FASEB J. 2005 Sep;19(11):1513-5.
RESULTAT II
Enhancement of melanoma specific immune response induced by IFN-γ and GGTI-298 treatment of
human melanoma cells.
Sarrabayrouse, G; Armand-Labit, V; Moriez, R; Leveque, K; Favre,G ; Tilkin-Mariamé A-F.
Manuscrit soumis: Molécular Cancer Therapeutics
RESULTAT III
Induction of protective antitumor immunity by vaccination with melanoma cells treated with IFN-γ and
geranylgeranyltransferase inhibitor : GGTI-298.
Sarrabayrouse, G; Armand-Labit, V; Favre, G ; Tilkin-Mariamé, A-F.
Résultats préliminaires
RESULTAT IV
Statins stimulate in vitro membrane FasL expression and lymphocyte apoptosis through RhoA/ROCK pathway in murine melanoma cells.
Sarrabayrouse, G; Synaeve, C; Leveque, K; Favre, G; Tilkin-Mariamé A-F.
Néoplasia Décembre 2007 in press
RESULTAT V
RhoA protein positively regulates CD70 expression on a human melanoma cell line: implication toward T lymphocytes proliferation.
Sarrabayrouse, G. ; Favre,G ; Tilkin-Mariamé, AF Résultats préliminaires
Conclusion générale
………P134
Discussion
………P136
I Rôle régulateur des protéines Rho dans l’expression des protéines
impliquées dans la réponse immune anti-mélanome p137
I-1) Mécanisme dépendant de l’IFN-γ
A) Les molécules du CMH de classe I B) La protéine PD-L1
I-2) Mécanisme indépendant de l’IFN-γ
A) CD80/CD86
B) FasL
C) CD70
II Rôle régulateur des protéines Rho dans le développement de la réponse
immune anti-mélanome……… p148
II-1) Présentation des TAA par les cellules tumorales traitéesII-2) Rôle in vivo de l’expression de FasL sur les cellules de mélanomes
mise en place de la réponse immune anti-mélanome
III Perspectives……….p153
III- 1) Etude du rôle régulateur des protéines Rho dans l’expression des CMH-II dépendante del’IFN-γ et ses conséquences sur la réponse immune anti-tumorale
III-2) Rôle régulateur des protéines Rho dans l’expression par les cellules de mélanome des
molécules activatrices de l’immunité innée
III-3) L’inhibition des protéines Rho a-t-elle un intérêt dans la mise en place de protocoles
d’immunothérapie clinique?
Bibliographie
……….p157
Index des figures et tableaux
Figure 1 : Balance des signaux activateurs et inhibiteurs au cours des réponses immunes médiées par
les cellules NK. (p4)
Figure 2: Modèle d’activation des NKT par l’IL-12 (a) ou l’α-GalCer (b). (p7)
Figure 3 : Rôle des LTγδ résidents et circulants dans la surveillance anti-tumorale. (p9)
Figure 4 : Présentation du protéasome et de l’immunoprotéasome. (p13)
Figure 5 : Voie d’apprêtement et de présentation des molécules de CMH-I. (p15)
Figure 6 : Voie de présentation des antigènes par les molécules de CMH-II. (p17)
Figure 7 : Présentation croisée. (p19)
Figure 8 : Activation de la réponse immune adaptative par les cellules dendritiques. (p22)
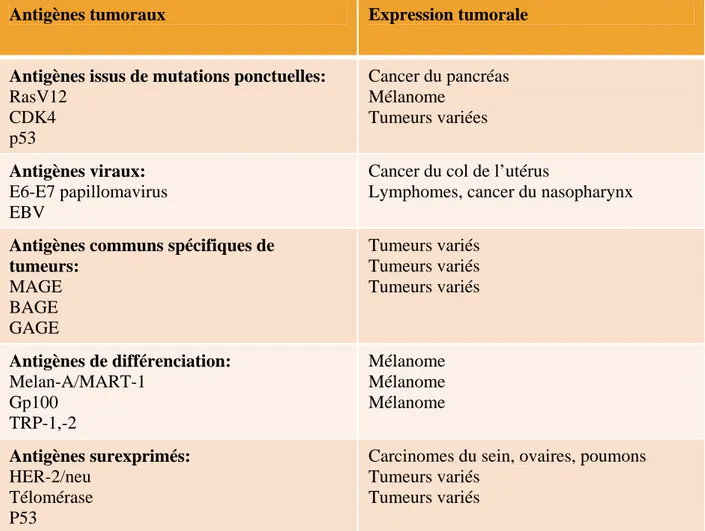
Tableau 1 : Les Antigènes de tumeurs. (p26)
Figure 9 : Représentation du TCR. (p31)
Figure 10 : Réarrangement des fragment VDJ du TCR. (p31)
Figure 11 : La synapse immunologique. (p35)
Figure 12 : Les deux voies de cytotoxicité lymphocytaire : voie Fas/Fas ligand et la voie
perforine/granzyme. (p37)
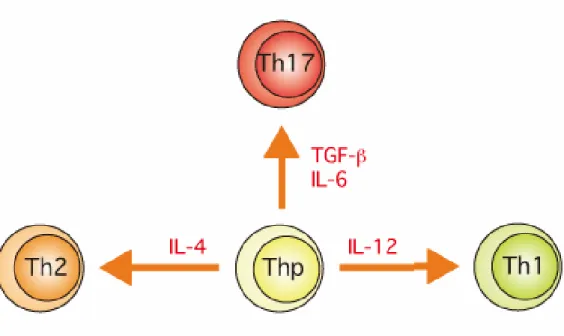
Figure 13 : Différenciation TH1/TH2/TH17. (p40)
Figure 14 : Les trois phases du processus d’immunoédition des cancers. (p45)
Figure 15 : Contre attaque tumorale dépendante de FasL. (p48)
Figure 16 : Contre attaque tumorale dépendante de CD70. (p48)
Figure 17 : Les différents stades de la liaison mélanocytaire. (p62)
Figure 18 : Cycle d’activation des GTPases Ras. (p64)
Figure 19 : Activation de la voie des MAPK par les facteurs de croissance.(p64)
Figure 20 : La Phosphatidyl-Inositol3Kinase (PI3K). (p67)
Figure 21 : Le rôle de la voie p16INK4a/RB dans l’arrêt du cycle cellulaire. (p69)
Figure 22 : Structure d’un tétramère de CMH. (p78)
Figure 23 : La voie du mévalonate. (p84)
Figure 24 : La prénylation protéique. (p85)
Figure 25 : La famille des protéines Rho. (p92)
Figure 26 : Cycle d’activation des protéines Rho. (p92)
Les recherches de ces vingt dernières années indiquent que les tumeurs sont potentiellement immunogènes, c’est-à-dire capables de déclencher des réponses immunes visant à les éliminer. Le système immunitaire, inné et adaptatif, intervient dans la reconnaissance des tumeurs malignes permettant parfois leur élimination.
L’immunologie des tumeurs est fondée ainsi sur deux concepts essentiels : la surveillance immunitaire des cellules tumorales et les mécanismes d’évasion permettant à la cellule cancéreuse d’échapper à la destruction tumorale. Nous développerons par la suite ces deux concepts.
En 1893, William Coley a observé que l’injection d’extraits bactériens pouvait entraîner la régression de tumeurs chez des patients atteints de cancer (Coley et al., 1991). Ainsi le système immunitaire après une activation non spécifique a été capable de mettre en place une réponse immune anti-tumorale efficace. Mais les toxines de Coley, n’aboutissant qu’à des résultats partiels et disparates, sont abandonnées à partir de 1910.
Paul Ehrlich, en 1909, suggéra que les cellules modifiées de l’organisme pouvaient être considérées comme étrangères et être ainsi éliminées par le système immunitaire.
Cinquante ans plus tard, Lewis Thomas émet l’hypothèse que l’immunité à médiation cellulaire est le principal mécanisme impliqué dans l’élimination des cellules cancéreuses. D’après ces théories, un cancer survient s’il y a échappement des cellules tumorales au système immunitaire, ce qui a conduit Macfarlane Burnet à proposer le concept d’IMMUNOSURVEILLANCE (Burnet et al., 1970). Les travaux de Burnet ont suggéré l’existence d’une relation entre système immunitaire et cancer, et l’ont conduit à élaborer ainsi la théorie de la surveillance immunitaire. Celle-ci repose sur l’hypothèse selon laquelle le système immunitaire, et en particulier les lymphocytes T (LT), joueraient un rôle de surveillance de l’organisme en reconnaissant les cellule néoplasiques comme étrangères et en les éliminant à un stade précoce, grâce à l’expression d’antigènes à leur surface. Selon ce concept, les tumeurs ne se développent que lorsque les cellules cancéreuses échappent au système immunitaire.
En l’absence de preuves expérimentales formelles, cette théorie est restée longtemps très controversée.
Cette notion d’immunosurveillance a évolué parallèlement aux progrès majeurs réalisés en immunologie. Elle connaît aujourd’hui un regain de vigueur (Dunn et al., 2002 ; Dunn et al.,
2004) grâce à différentes observations ; notamment, la découverte, au cours d’autopsies, de
tumeurs non détectées car jusqu’alors contrôlées par le système immunitaire, ou encore l’observation, confirmée par des données anatomopathologiques, de régressions spontanées de tumeurs. De plus, les cancers sont plus fréquents pendant la période néonatale ainsi que chez les sujets âgés, deux périodes de la vie au cours desquelles le système immunitaire est moins efficace. Ces maladies sont également plus fréquentes chez les sujets immunodéprimés. Un argument encore plus probant concerne l’infiltration de certaines tumeurs par des cellules lymphoïdes (lymphocytes T, cellules Natural Killer : NK)
(Pagès et al., 2006). Depuis longtemps, cette infiltration est considérée comme le signe d’un
pronostic favorable.
L’immunosurveillance serait un processus hétérogène nécessitant l’action de différents effecteurs du système immunitaire et ceci de façon dépendante de la cellule tumorale, des mécanismes de transformation et des mécanismes d’identification immunologique.
Dans ce processus d’immunosurveillance, l’immunité innée et l’immunité adaptative sont toutes les deux impliquées et collaborent pour éliminer les cellules tumorales. Dans cette première partie, nous discuterons des rôles respectifs des effecteurs de l’immunité innée et adaptative dans la réponse immune anti-tumorale mais également des mécanismes par lesquels les cellules tumorales échappent à la surveillance du système immunitaire.
I La réponse immune innée anti-tumorale
Les cellules impliquées dans l’immunité innée ou naturelle constituent une première barrière pour éliminer les cellules anormales, en particulier les cellules tumorales. Cette réponse immunitaire anti-tumorale innée est assurée par différentes cellules effectrices : les cellules Natural Killer (NK), les cellules NKT, les lymphocytes T gamma-delta (γδ), les cellules dendritiques (CD), les monocytes/macrophages, les polynucléaires neutrophiles et les polynucléaires éosinophiles.
Dans cette partie, nous présenterons les principales cellules impliquées dans la surveillance immunitaire innée: les cellules NK, les cellules NKT, les lymphocytes Tγδ et les CD.
A-Les cellules Natural Killer : NK
Les NK représentent 10 à 20 % des PBMCs (Peripheral Blood Mononuclear Cells). Elles sont localisées dans le sang périphérique, les ganglions lymphatiques, la rate, la moelle osseuse (Ferlazzo al.,2004) et migrent aux sites de la réponse immune grâce à différentes cytokines chimioattractantes (Robertson et al., 2002). De part, le niveau d’expression membranaire de la molécule CD56 et la présence ou l’absence du marqueur de surface CD16 on distingue différentes sous populations de NKs (Farag et al., 2002).
De nombreuses études in vitro ont démontré la capacité des lymphocytes NK à lyser des cellules tumorales et particulièrement des cellules tumorales ayant perdues l’expression des complexes majeurs d’histocompatibilité de classe I (CMH-I) (Smyth et al., 2002 ; Soloski et
al., 2001). De plus, le rôle des cellules NK dans l’immunosurveillance anti-tumorale a
également été mis en évidence in vivo chez les souris beiges. Ces souris qui possèdent des NK dépourvus d’activité lytique, ont une incidence élevée de tumeurs spontanées ou induites
(Haliotis et al., 1985 ; Talmadge et al.,1980). Les cellules NK sont capables de lyser des
cellules étrangères à l'organisme de manière indépendante de l'antigène et sans activation préalable, au contraire des lymphocytes T et B. Par leur fonction de lyse, on peut les rapprocher des lymphocytes T CD8+, mais la reconnaissance de la cible des NK est très différente de celle des lymphocytes T. En effet, les lymphocytes T reconnaissent et
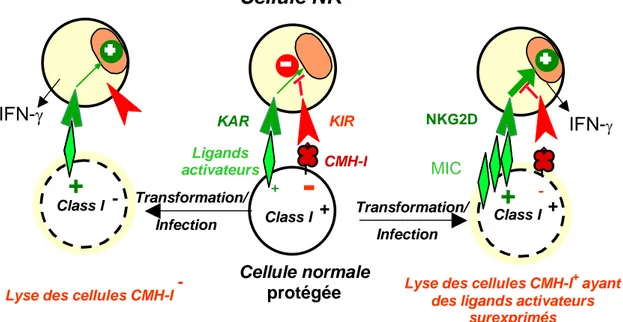
Cellule NK
IFN-
γ
Ligands activateurs CMH-I KIR KAR + Class I Cellule normale protégée Class I - Transformation/ Infection Class I-Lyse des cellules CMH-I -
Class I + Transformation/
Infection
Class I +
Lyse des cellules CMH-I+ ayant des ligands activateurs
surexprimés
IFN-
γ MIC NKG2D ++
-
+
-
Figure 1 : Balance des signaux activateurs et inhibiteurs au cours des réponses immunes médiées par les cellules NK.
répondent à des cibles portant un peptide particulier présenté par les molécules du complexe majeur d'histocompatibilité (CMH), alors que les cellules NK sont spontanément lytiques envers toutes les cellules. Cependant, de nombreux mécanismes de régulation empêchent les NK de s'attaquer aux cellules saines. Il existe sur la membrane cellulaire des NK des récepteurs activateurs et/ou inhibiteurs de la fonction lytique (Bottino et al., 2004 ; Mol
Moretta et al., 2004). Lorsqu'une cellule NK rencontre une autre cellule, la lyse de cette
cellule ne se produira que si les signaux d'activation présents sur la cellule cible, surpassent les signaux d'inhibitions (Figure 1).
Les récepteurs inhibiteurs comprennent les KIRs (Killer Ig Like Receptors) (Bottino et al.,
2004) qui interagissent avec différents allèles du CMH de classe I et les récepteurs
hétérodimériques CD94-NKG2A/B qui lient la molécule du CMH non-classique HLA-E
(Braud et al., 1998). L’interaction d’un récepteur inhibiteur avec son ligand va transmettre à
la cellule NK un signal négatif inhibant sa fonction lytique. C’est pourquoi les cellules NK ne lysent pas les cellules autologues saines qui expriment les molécules de CMH-I du soi alors qu’elles sont capables de lyser les cellules tumorales du même individu si ces cellules ont perdu l’expression des CMH-I.
En absence de signal inhibiteur, l’activité cytotoxique de ces cellules est dépendante de récepteurs activateurs ; NKG2D et DNAM-1. Les récepteurs NKG2D et DNAM-1 reconnaissent des ligands induits par le stress, et exprimés à la surface des cellules tumorales comme MIC-A, UL-16 BP (Binding Protéin) et la Nectine-2 (DNAM-1 ligands)
(Pende et al., 2001 ; Cerwanka et al., 2003 ; Pende et al., 2005).
En plus de la balance entre signaux activateurs et inhibiteurs l’activité cytotoxique des NK est dépendante de la présence de cytokines (IL-1, IL-2, IL-12, IL-15, IL-18, IL-21 et IFN-γ)
(Bottino et al., 2004 ; Trinchieri et al., 2003). Suite à l’activation obtenue en présence de
cytokines, les cellules NK deviennent des LAK (lymphokine-activated killer) qui prolifèrent, produisent à leur tour des cytokines, et surexpriment diverses protéines telles que des molécules d’adhésions, les protéines FasL, TRAIL, granzyme, perforine impliquées dans la
fonction cytotoxique des NK (Bottino C et al., 2004 ; Moretta et al., 2004 ; Trinchieri et
al., 1989 ; Zamai et al., 1998).
B-Les lymphocytes Natural Killer T : NKT
Les lymphocytes NKT, classiquement définies comme des cellules NK1.1+αβ+ chez la souris, présentent des caractéristiques qui les distinguent des cellules T et des cellules NK conventionnelles. Ces cellules expriment un récepteur pour l’antigène (TCR) (comme les Lymphocytes T) et reconnaissent des antigènes non pas par l’intermédiaire des molécules de CMH classique mais via la molécule CD1d.
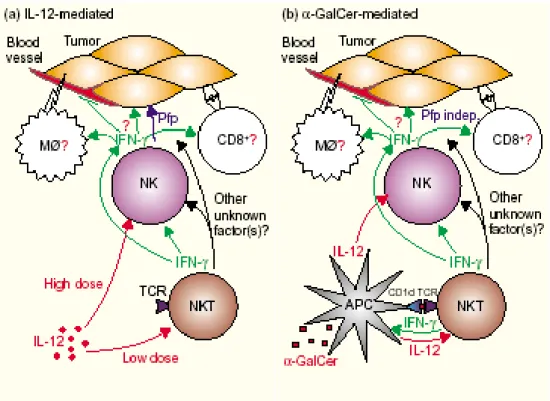
Plusieurs travaux ont démontré l’importance des NKT dans le rejet tumoral, notamment dans des souris suite à des injections d’galactosylcéramide (α-GalCer) ou d’IL-12. (Morita et al.,
1995 ; Nakagawa et al., 1998 ; Nakagawa et al., 2000). L’ α-GalCer a été identifié comme
le ligand présenté par la molécule CD1d au TCR des cellules NKT murines et humaines
(Kawano et al., 1997 ; Brossay et al., 1998). Bien que possédant un TCR capable de
reconnaître l’ α-GalCer, il a été montrés que les NKT ne jouaient pas le rôle d’effecteurs lytiques mais plutôt celui d’activateurs des cellules NK dans cette réponse anti-tumorale
(Kitamura et al., 1999; Hayakawa et al., 2001; Tomura et al., 1999 ; Yang et al., 2000).
Un modèle d’activation en trois étapes a même été suggéré pour expliquer comment la reconnaissance de cet antigène par les cellules NKT favorise l’activation des cellules NK
(figure 2). Concernant l’implication des NKT dans l’effet anti-métastatique de l’IL-12 il a été
montré qu’une faible quantité de cette cytokine stimulait une réponse dépendante uniquemment des NKT alors que des doses plus importantes favorisaient une réponse de type NK comme dans le cas de l’α-GalCer (Takeda et al., 2000; Smyth et al., 2000).
Par ailleurs, Smyth et al ont montré que la population NKT jouait un rôle important dans la protection contre des tumeurs induite par le methylcholanthrene (MCA), en effet des souris déficientes pour la population NKT développent plus de tumeurs que des souris sauvages lorsqu’elles sont traitées par le MCA (Smyth et al.,2001).
L’ensemble de ces observations semble démontrer l’implication des cellules NKT dans le rejet tumoral. Néanmoins, les travaux de Terabe et al (Terabe et al., 2000) rapportent que
les NKT sont capables d’inhiber la réponse immune dépendante des lymphocytes T cytotoxiques (CTL) via la production d’IL-13. Diverses études ont été entreprises savoir si ces cellules favorisaient ou pas la réponse immune anti-tumorale. Elles suggèrent que l’affinité du ligand, l’environnement cytokinique, la présence de signaux de costimulations ou le type de cellule présentatrice d’antigènes (APC) présentant le ligand conditionne la réponse des NKT dans le rejet tumoral. (Miyamoto et al., 2001; Hayakawa et al., 2001;
Arase et al., 1994 ; Leite-De-Moraes et al., 2001 ; Hochrein et al., 2000 ; Kadowaki et al., 2001).
C-Les lymphocytes T gamma-delta : LTγδ
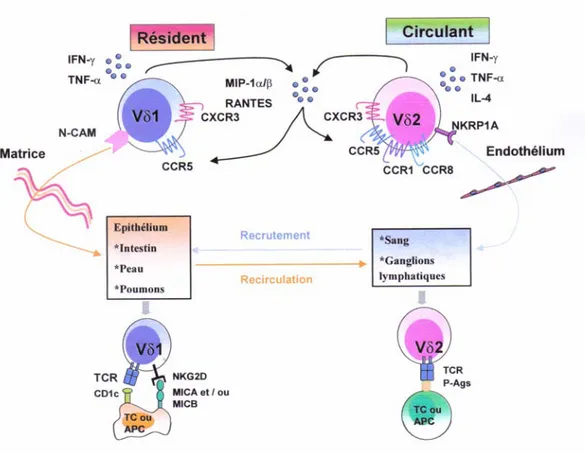
Les lymphocytes T (LT) expriment à leur surface un récepteur appelé TCR (T Cell Receptor) leur permettant de reconnaître les antigènes. On différencie deux grandes sous populations de lymphocytes T, selon que leur TCR est composé d’un hétérodimère αβ ou γδ, les Ltαβ et le LTγδ. Les cellules Tγδ proviennent de précurseurs hématopoïétiques, comme les cellules Tαβ, mais elles s’en différencient par plusieurs aspects. Les principales différences portent sur l’absence d’expression de co-récepteurs CD4 ou CD8 pour le complexe majeur d’histocompatibilité (CMH), la distribution dans l’organisme et la nature des structures antigéniques reconnues. En effet, les lymphocytes ab reconnaissent des complexes constitués d’un peptide antigénique lié à une molécule du CMH. Ce n’est pas le cas pour les LTγδ puisque la reconnaissance antigénique par le TCR γδ est indépendante d’une présentation par les molécules du CMH et les structures antigéniques ne sont pas des peptides. Les LTγδ représentent en moyenne 2 à 5% des lymphocytes circulants et sont abondants dans les tissus épithéliaux (Triebel et al., 1989). Dans le système sanguin ils se répartissent en deux sous populations principales différant par la nature des régions variables du TCR : les lymphocytes Vγ9Vδ2 (environ 2/3) et les lymphocytes VγxVδ1 (environ 1/3) (Figure 3). Présentes dans les tissus épithéliaux, les cellules Tγxδ1 pourraient intervenir comme première ligne de défense contre certaines infections et tumeurs (Ferrarini et al.,
2002). Les cellules T qui expriment les régions variables du TCR Vγ9 et Vδ2, représentent la
Figure 3 : Rôle des LTγδ résidents et circulants dans la surveillance anti-tumorale.
Les LTγδ résidents interagissent avec des tumeurs solides exprimant MIC-A/-B ou reconnaissent les molécules CD1, alors que les LTγδ circulants reconnaissent des Ag phosphatés exprimés par les tumeurs hématologiques.
al., 1989). Ces lymphocytes peuvent infiltrer certaines tumeurs et in vitro ont une activité
cytotoxique contre certaines lignées de myélomes, de lymphomes ou de carcinomes
(Kunzmann et al., 2000). L’implication de ces cellules dans l’immunité anti-tumorale a été
mise en évidence chez la souris et chez l’homme. Girardi et al ont montré que des souris KO pour la chaîne δ du TCR, développant plus de tumeurs spontanées que les souris sauvages (Girardi et al 2001) et le groupe de Francine Jotereau a isolé à partir de l’acite d’un patient souffrant de tumeur colorectale (un clone lymphocytaires Tγ9δ2 capables de lyser les cellules tumorales autologues (Corvaisier et al 2005).
Les LTγ9δ2 du sang périphérique sont activés par une variété d’antigènes de nature non peptidiques et phosphorylés appelés des phosphoantigènes. Chez les eucaryotes, ces molécules dérivent des isoprénoïdes de la voie de biosynthèse du mévalonate. Ces isoprényl-pirophosphates (IPP) capables d’activer les LTγ9δ2 sont présents en faible quantité dans les cellules saines mais leur concentration augmente dans certaines cellules tumorales. Certains types tumoraux produisent même de très grandes quantités de ces IPP permettant aux LTγ9δ2 de les reconnaître comme des antigènes tumoraux. Outre ces phosphoantigènes, il a récemment été montré que ces cellules reconnaissent la sous unité F1 de l’ATPase mitochondriale et l’apolipoprotéine A1 délipidée présente à la surface de lymphomes (Scotet et al., 2005). Par ailleurs, les récepteurs activateurs et inhibiteurs initialement caractérisés sur les cellules NK ont également été mis en évidence à la surface des LTγ9δ2. Comme pour les NK, le récepteur NKG2D est exprimé à la surface des LTγ9δ2 et interagit avec les molécules MICA/MICB et ULBPs exprimées à la surface des cellules tumorales. NKG2D joue un double rôle puisque en lui même il est capable d’activer les γ9δ2
(Rincon-Orozco et al., 2005) et potentialise l’activation des γ9δ2 induite par la liaison du
TCR et de son ligand (Das et al., 2001).
Tout comme les Vγ9δ2, les Tδ1 interagissent avec les molécules MICA/B et ULBPs et participent à la réponse immune anti-tumorale. En effet, Maeureur et al ont mis en évidence parmi les TIL de patients atteints de cancer colorectaux la présence de LTδ1 présentant une grande activité cytotoxique vis à vis des tumeurs autologues (Maeurer et al., 1996).
D-Les Cellules Dendritiques : Les CD
Les CD sont des cellules présentatrices professionnelles d’antigène (CPA) qui constituent une catégorie cellulaire extrêmement importante au niveau de la mise en place et de l’orchestration des différents acteurs lymphocytaires impliqués dans la réponse immunitaire anti-tumorale. Les CD intègrent une quantité de signaux de l’environnement et participent ainsi à l’immunité innée. Elles jouent le rôle de sentinelles du système immunitaire et se trouvent à l’interface entre l’immunité naturelle et l’immunité acquise.
Les CD expriment à leur surface des glycoprotéines membranaires du CMH de classe I et de classe II dont la principale fonction est la présentation des antigènes peptidiques aux lymphocytes T. Le CMH (système HLA chez l’homme et H-2 chez la souris) est un système multigénique, multiallélique et d’expression codominante. Il existe deux classes de molécules du CMH : classe I et classe II qui diffèrent de par leur localisation, leur fonction et l’origine des peptides présentés. Les CD ont la capacité de capturer, dégrader et d’apprêter ces antigènes sur les molécules de CMH. En effet, les lymphocytes T (LT) sont incapables de reconnaître un antigène sous forme native et entière. Le TCR αβ peut interagir avec un antigène uniquement si celui-ci est présenté par les molécules de CMH.
1) La capture de l’antigène :
Les CD immatures possèdent une forte activité endocytique. Elles peuvent internaliser efficacement différents types d’antigène. La capture de ces antigènes peut se faire par trois mécanisme principaux : la phagocytose, la pinocytose et l’endocytose via des récepteurs membranaires.
2) La dégradation et l’apprêtement des antigènes :
Les antigènes endogènes, c’est-à-dire les antigènes liés à la physiologie normale de la cellule et les antigènes provenant de pathogènes présents dans le cytosol, sont présentés aux lymphocytes T CD8+ en association avec des molécules du CMH de classe I ; alors que les antigènes exogènes ou extracellulaires sont présentés aux lymphocytes T CD4+ en association avec des molécules du CMH de classe II. Cependant plusieurs études montrent
que ce modèle n’est pas absolu, notamment pour les CD. Des peptides dérivés de protéines exogènes peuvent être présentés en association avec des molécules du CMH-I dans les CD.
2.1) Voie de présentation par les molécules du CMH-I :
Les molécules du CMH de classe I (HLA-A, B, C chez l’homme et H2-K, D, L chez la souris) sont exprimées de façon ubiquitaire à la surface de toutes les cellules nucléées de l’organisme sauf celles du trophoblaste, de la rétine et des spermatogonies.
Elles présentent donc, aux lymphocytes T cytotoxiques (CTL) CD8+, des peptides le plus souvent générés à partir de protéines endogènes cytosoliques ou nucléaires. Les antigènes endogènes présents dans le cytosol sont dégradés en peptides par le complexe enzymatique : le protéasome.
La molécule du CMH de classe I est formée par l’association non covalente d’une chaîne légère non polymorphe : la β2 microglobuline (β2M) et d’une chaîne lourde α polymorphique. La chaîne α est constituée de trois domaines extracellulaires (α1, α2, α3), d’une région transmembranaire et d’une région cytoplasmique. La structure tridimensionnelle de la molécule fait apparaître une cavité entre les domaines α1 et α2 dont le fond est un feuillet β plissé et les bords des hélices α. C’est dans cette zone que se situent les résidus polymorphiques qui vont interagir avec les peptides des molécules antigéniques et permettre de cette façon la présentation antigénique de peptides d’une longueur définie (9-10 acides aminés).
La présentation des peptides antigéniques à la surface des CPA résulte de la dégradation intracellulaire des protéines normales ou pathologiques et de l’assemblage de ces peptides avec les molécules de CMH-I. La dégradation des protéines cellulaires est réalisée au niveau cytoplasmique par un complexe protéique multicatalytique ubiquitaire appelé PROTEASOME (Pamer et al., 1998). Une brève description de ce système s’impose
(Figure 4).
Le système ubiquitine-protéasome fonctionne de manière ATP-dépendante en marquant tout d’abord, en plusieurs étapes et grâce à l’intervention de plusieurs types d’enzymes, les substrats protéiques avec des molécules d’ubiquitine. Les substrats portant une chaîne
Figure 4 : Présentation du protéasome et de l’immunoprotéasome.
Le protéasome 20S constitue le cœur catalytique du protéasome (nommé 26S). Il est formé de 4 anneaux superposés (α-β-β-α), chaque anneau étant constitué de 7 sous-unités. Les activités peptidases sont portées par 3 types de sous-unités (β1, β2 et β5). Le protéasome résulte de l’assemblage du protéasome 20S avec 2 complexes régulateurs 19S fixés à chacune de ses extrémités (un seul complexe est représenté sur la figure). Chacun de ces complexes est formé d’un couvercle dont le rôle est de fixer les protéines ubiquitinées et d’une « base » constituée de 6 ATPases responsables du dépliement des protéines et de leur translocation vers le cœur catalytique 20S.
Sous l’effet de l’IFN-γ, les sous-unités catalytiques constitutives du protéasome sont remplacées par des sous-unités inductibles. Le protéasome portant ces sous-unités est appelé immunoprotéasome.
d’ubiquitine seront ensuite reconnus puis dégradés par le protéasome 26S en peptides longs de quelques acides aminés. Le protéasome 26S est un complexe multicatalytique présent à la fois dans le noyau et dans le cytoplasme de la cellule. Il est formé d’un cœur catalytique en forme de cylindre appelé protéasome 20S (baptisé ainsi en fonction de son coefficient de sédimentation) qui est entouré à chaque extrémité par un complexe régulateur de 19S. Le protéasome 20S est formé de quatre anneaux superposés (α-β-β-α), chaque anneau étant constitué de 7 sous-unités de type : α (α1 à 7) ou β (β1 à 7). L’ensemble forme un cylindre de type α7-β7-β7-α7 avec 2 anneaux externes α et 2 anneaux internes β. Les 2 anneaux externes α sont catalytiquement inactifs mais ont un rôle dans l’assemblage du protéasome et permettent l’association avec les complexes régulateurs à chaque extrémité du complexe 20S. Les 2 anneaux internes, formés par les sous-unités β, contiennent les sites catalytiques responsables des activités peptidases du protéasome 20S. Celles-ci sont portées par 3 des 7 sous-unités β : β1, β2 et β5.
L’effet de certains facteurs environnementaux, notamment la présence d’IFN-γ induit le remplacement des trois sous-unités catalytiques β1, β2 et β5 du protéasome 20S standard par 3 nouvelles sous-unités : β1i (LMP2), β2i (MECL-1 ou LMP10) et β5i (LMP7) (Tanaka al.,
1998). Le protéasome portant ces sous-unités est appelé : immunoprotéasome alors qu’en
référence, le protéasome portant les sous-unités constitutives est appelé : protéasome standard. Ces modifications structurales vont entraîner une modulation de l’activité du protéasome et vont conférer à l’immunoprotéasome une spécificité d’hydrolyse plus appropriée à la production de peptides immunocompétents.
De plus, le complexe activateur PA28 (Proteasom Activator), appelé aussi 11S, peut se fixer aux extrémités du protéasome 20S et entraîner ainsi des modifications fonctionnelles en favorisant également la production de peptides antigéniques (Groettrup et al., 1995). Ce complexe PA28 est constitué de deux types de sous-unités inductibles par l’IFN-γ : PA28α et PA28β. Ces protéines peuvent s’associer entre elles et s’organiser en anneau heptamérique. Les peptides générés par le protéasome sont la source majeure de peptides antigéniques présentés par le CMH-I (Figure 5). Les peptides générés au niveau cytoplasmique sont alors pris en charge par des protéines de « heat shock » (HSP 70 et HSP 90) dont le rôle est de
Golgi
calnexine
HLA
classe I
β2-m
tapasine
TAP-1
TAP-2
ATP
peptide
Protéasome
LMP-2
LMP-7
protéine
Membrane plasmique
Golgi
calnexine
HLA
classe I
β2-m
tapasine
TAP-1
TAP-2
ATP
peptide
Protéasome
LMP-2
LMP-7
protéine
Membrane plasmique
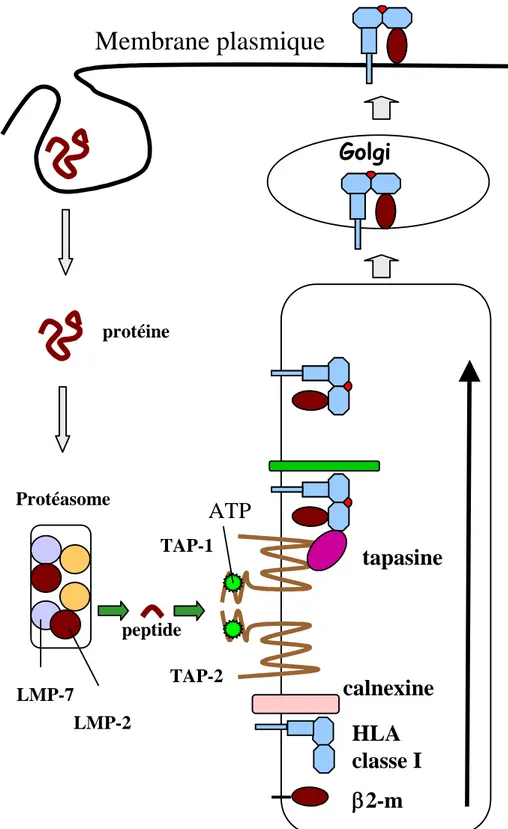
Figure 5 : Voie d’apprêtement et de présentation des molécules de CMH-I.
Les protéines du cytosol sont dégradées en peptides par le protéasome. Via les transporteurs TAP (TAP-1 et TAP-2), les peptides sont transportés dans la lumière du réticulum endoplasmique et associés à la chaîne lourde α. La fixation de la β2-microglobuline stabilise le complexe, qui est transporté dans le Golgi puis à la membrane de la cellule.
transporter les peptides et de les protéger d’une dégradation supplémentaire. Ces peptides sont ensuite transportés de façon active dans le RE par les protéines transporteurs TAP (Transporteurs associés à l’apprêtement de l’antigène). Les transporteurs TAP sont formés d’un hétérodimère TAP1 et TAP2 et possèdent une spécificité de liaison pour les peptides présentant des résidus particuliers au sein de la séquence peptidique. Les peptides antigéniques s’associent avec la chaîne lourde de CMH-I et la β2M au niveau du réticulum. La formation de ce complexe nécessite plusieurs protéines chaperonnes (calnexine, calréticuline, Erp57) nécessaires au repliement correct de la molécule de CMH et à son association à la β2M. La tapasine permet ensuite le rapprochement du complexe CMH-β2M avec les protéines TAP. Après liaison du peptide antigénique, le complexe CMH-peptide-β2M ainsi formé traverse l’appareil de Golgi puis est transporté par les vésicules de sécrétion vers la surface de la cellule (York et al., 1996). Après ancrage à la membrane plasmique l’épitope, présenté par ce complexe CMH-peptide-β2M et exprimé à la surface, sera éventuellement reconnu par les CTL conduisant ainsi à une réponse immunitaire à médiation cellulaire.
2.2) Voie de présentation par les molécules du CMH-II :
Les molécules de CMH de classe II (HLA-DR, DP, DQ chez l’homme et H2-IA, IE chez la souris) sont exprimées essentiellement à la surface des CPA regroupant : les CD, les monocytes-macrophages et certains lymphocytes B.
Elles présentent, aux lymphocytes T CD4, des peptides provenant de protéines exogènes phagocytées entraînant ainsi la prolifération et la différenciation de clones de lymphocytes T CD4+.
La molécule de classe II est formée de l’association de deux chaînes polypeptidiques α et β comportant chacune deux domaines extramembranaires. Leur organisation tridimensionnelle est semblable à celle des molécules de CMH-I, cependant la cavité peptidique (formée par les domaines α1 et β1) est plus ouverte à ses extrémités que celle des molécules de CMH-I. Les ouvertures permettent la fixation de peptides plus long que ceux qui sont présentés par les CMH-I.
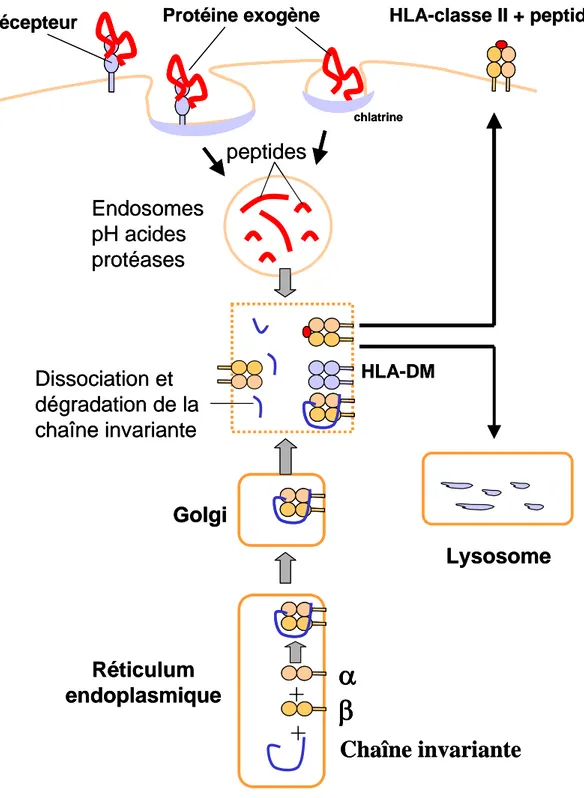
+
+
peptides
Endosomes
pH acides
protéases
HLA-DM
Dissociation et
dégradation de la
chaîne invariante
α
β
Chaîne invariante
Réticulum
endoplasmique
Golgi
Lysosome
HLA-classe II + peptide
Récepteur
Protéine exogène
chlatrine
+
+
peptides
Endosomes
pH acides
protéases
HLA-DM
Dissociation et
dégradation de la
chaîne invariante
α
β
Chaîne invariante
Réticulum
endoplasmique
Golgi
Lysosome
HLA-classe II + peptide
Récepteur
Protéine exogène
chlatrine
Figure 6 : Voie de présentation des antigènes par les molécules de CMH-II.
La chaîne invariante (Ii) se fixe à des molécules du CMH-II nouvellement synthétisées et bloque la liaison des peptides et des protéines non repliées dans le réticulum endoplasmique et durant le transport des molécules du CMH-II dans les vésicules d’endocytose (premier schéma). Dans ces vésicules, les protéases clivent la chaîne invariante, laissant le peptide CLIP fixé à la molécule du CMH-II (deuxième schéma). Les pathogènes et leurs protéines sont dégradés en peptides à l’intérieur de vésicules d’endocytose acidifiées, mais ces peptides ne peuvent pas fixer les molécules du CMH-II qui sont occupées par le CLIP (troisième schéma). La molécule du CMH-II, HLA-DM, se fixe au complexe CMH-II/CLIP, catalysant la libération du CLIP et la liaison aux peptides antigéniques (quatrième schéma).
Les peptides présentés par les molécules du CMH-II sont généralement des protéines exogènes endocytées par la cellule puis dégradées par protéolyse acide dans des compartiments successifs (Figure 6). Lorsque la molécule du CMH-II est synthétisée au niveau du RE, elle s’associe à une autre protéine, la chaîne invariante (Ii). Cette dernière entre en interaction avec la cavité de liaison au peptide, empêchant tous les peptides dérivés des protéines endogènes de se lier à la cavité tant que la molécule du CMH-II est dans le RE. Elle semble également être impliquée dans le repliement des chaînes α et β de classe II, dans leur sortie du RE et dans l’acheminement ultérieur des molécules de CMH-II vers la voie d’apprêtement endocytaire à partir de l’appareil de Golgi. Les chaînes α et β sont glycosylées dans l’appareil de Golgi, puis transportées dans les endosomes ou les lysosomes. Dans ces compartiments, la chaîne invariante est progressivement dégradée (l’activité protéolytique augmente dans chaque compartiment successif). Cependant un court fragment de la chaîne invariante, appelé CLIP (Class II-associated Invariant chain Peptide), continue de bloquer la cavité de liaison au peptide, empêchant toute liaison prématurée avec un autre peptide. La molécule HLA-DM ou son homologue murin H2-M permettent ensuite l’échange entre le peptide CLIP et le peptide issu de la dégradation des protéines exogènes. Les complexes CMH-II/peptide qui en résultent sont adressés vers la membrane plasmique.
2.3) Voie alternative, présentation croisée :
Dans la plupart des cellules, les protéines exogènes n’ont pas accès au compartiment cytosolique et donc à la présentation par le CMH-I. Néanmoins, un certain nombre de travaux ont mis en évidence l’existence d’une présentation « croisée » permettant la présentation d’antigène d’origine exogène par le CMH-I (Figure 7) (Catros-Quemener et
al., 2003).
Dans les CD, comme dans toutes autres cellules, les vésicules d’endocytose (pinocytose ou endocytose spécifique) sont adressées au réseau des endosomes au sein duquel les éléments internalisés (antigènes exogènes) transitent. Dans le cas d’une tumeur, ces antigènes proviennent de débris cellulaires, de lysats ou de corps apoptotiques des cellules tumorales. Les endosomes précoces fusionnent avec des vésicules golgiennes qui
Figure 7 : Présentation croisée
Des antigènes exogènes sont internalisés et dégradés dans les lysosomes et peuvent être adressés à la surface cellulaire par la voie des protéines endogènes. Selon leur mode d’adressage intracellulaire, les peptides exogènes peuvent être complexés aux molécules de CMH de classe II mais aussi aux molécules de CMH de classe I, cette voie étant appelée la présentation croisée.
favorisent une acidification progressive à l’origine de la dégradation partielle des composés endocytés. Les endosomes tardifs contenant ces éléments dégradés peuvent, dans les CPA professionnelles (comme les CD), fusionner avec des vésicules de rétention des molécules du CMH-II. Dans ces compartiments, les peptides endosomiques de bonne affinité se positionnent dans le sillon des molécules de CMH de classe II. Les vésicules contenant les complexes peptides-CMH-II sont alors adressés à la membrane plasmique par un mécanisme d’exocytose, comme c’est le cas pour des vésicules de recyclage.
La phagocytose est un mécanisme distinct de l’endocytose par lequel les CD peuvent internaliser des fragments ou encore des corps apoptotiques de cellules tumorales. Dans ce cas, et à la suite d’une reconnaissance d’éléments membranaires, la cellule phagocytaire encercle les particules extracellulaires. Les éléments internalisés peuvent être hydrolysés dans les lysosomes jusqu’au stade de molécules élémentaires qui pourront rejoindre les protéines cytosoliques susceptibles d’être secondairement adressées à la surface cellulaire par la voie des protéines endogènes-CMH-I. On comprend ainsi que, selon leur mode d’adressage intracellulaire, des peptides exogènes internalisés par les CD, peuvent se retrouver non seulement complexés à des molécules de classe II, mais également de classe I. Il s’agit du phénomène de présentation croisée ou crosspriming. Celui-ci, dans les CD, peut également s’expliquer par l’importance des recyclages membranaires qui ont lieu dans ce type cellulaire. En effet, les molécules de classe I naturellement ancrées dans la membrane de la CD peuvent transiter par les endosomes au cours de ces recyclages, et les conditions physicochimiques de ce compartiment sont favorables à un échange de peptides entre molécules du CMH. Cet échange permet d’expliquer que des peptides provenant d’éléments internalisés peuvent être présentés par des molécules de classe I sans passage par le réticulum endoplasmique.
Le phénomène de présentation croisée reflète l’activité de capture des cellules mortes ou leurs débris, et notamment des corps apoptotiques par des CPA (CD).
La présentation croisée est un phénomène extrêmement important pour la présentation efficace par les CD d’antigènes dérivés de cellules tumorales en particulier de corps
apoptotiques de cellules tumorales ou provenant de la nécrose tumorale (Berard et al.,
2000).
3) Migration et maturation des CD :
Les CD résidentes à un stade « immature » ont une forte capacité d’endocytose et de macropinocytose elles capturent ainsi les antigènes. En présence de certains signaux environnementaux (TNFα, IL-1β), les CD vont passer du stade immature au stade mature, transition qui se traduit par une perte de la capacité d’endocytose, une forte augmentation de l’expression de molécules du CMH de classe I et II, ainsi qu’une augmentation forte de l’expression des molécules de costimulation (CD80, CD40).
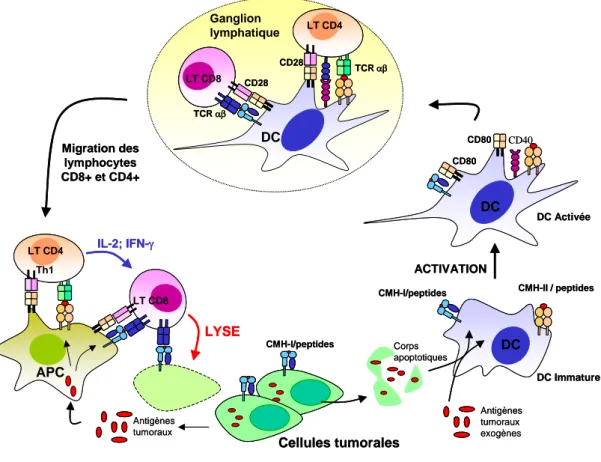
Les CD activées possèdent un pouvoir migratoire vers les organes lymphoïdes secondaires extrêmement important. Cette propriété migratoire est essentielle puisque c’est là qu’elles vont présenter les antigènes aux lymphocytes T naïfs spécifiques (Figure 8).
La capacité des CD à induire une réponse immune anti-tumorale a été décrite dans de nombreux modèles animaux (Zitvogel et al., 1996) mais aussi chez l’homme (Kugler et al.,
2000).
4) Les cytokines et chémokines :
Avec les CD, les cytokines et les chémokines constituent, elles aussi, un pont entre l’immunité innée et l’immunité adaptative dirigée contre les tumeurs (Belardelli et al., 2002). En effet, le champ de cytokines joue un rôle capital. Le champ de cytokines d’une tumeur conditionne en partie le type de réponse immunitaire qu’elle suscite (Kourilsky et al., 2001). On distingue deux classes de cytokines entre le type 1 et le type 2. Les cytokines de type 1, telles que l’IL-2, IL-12 les IFNαβγ, sont impliqués dans la réponse immune TH1 (T helper 1) et principalement dans l’immunité cellulaire. Par contre l’IL-4, IL-6, IL-10, IL-13 sont impliquées dans les réponses immunes Th2 à médiation humorale. On sait aujourd’hui que le niveau basal d’IFN-γ notamment joue un rôle particulièrement important dans la surveillance anti-tumorale (Street et al., 2001 ; Street et al., 2002). L’IFN-γ collabore notamment avec les lymphocytes T en contrôlant l’émergence de cellules tumorales
CMH-I/peptides
CD80 CD80
CMH-I/peptides CMH-II / peptides
ACTIVATION LT CD8 TCR αβ CD28 LT CD4 CD28 TCR αβ DC DC LT CD8 LT CD4 Migration des lymphocytes CD8+ et CD4+ Th1 IL-2; IFN-γ LYSE Antigènes tumoraux APC Cellules tumorales Antigènes tumoraux exogènes Corps apoptotiques DC DC Immature DC Activée Ganglion lymphatique CD40 CMH-I/peptides LT CD4 CD28 TCR αβ CD80 CD80
CMH-I/peptides CMH-II / peptides
ACTIVATION LT CD8 TCR αβ CD28 LT CD8 TCR αβ CD28 LT CD4 LT CD4 CD28 TCR αβ DC DC Ganglion lymphatique LT CD8 LT CD4 LT CD4 CD40 Migration des lymphocytes CD8+ et CD4+ Th1 IL-2; IFN-γ LYSE Antigènes tumoraux APC Cellules tumorales Antigènes tumoraux exogènes Corps apoptotiques DC DC Immature DC Activée
(Shankaran et al., 2001). D’autres cytokines telles que l’IL-12 et le GM-CSF et des
chemokines telles que CXCL10 et CCL16 jouent un rôle significatif dans la réponse immune anti-tumorale, c’est pourquoi on peut envisager d’utiliser certaines chemokines et/ou cytokines dans un but d’immunothérapie des cancers (Homey et al., 2002; Smyth et al.,
2000). De nombreux essais cliniques ont été réalisés ou sont en cours avec de l’IFN-α ou γ,
l’IL-2, l’IL-12, l’IL-13, le GM-CSF, TRAIL, notamment. Ces différentes molécules interviennent au niveau de la présentation antigènique, la cytotoxicité des cellules effectrices, l’angiogenèse des tumeurs ou encore l’apoptose des cellules tumorales (Dranoff et al
2004).
E-Les Cellules dendritiques myéloïdes (CDm) et
plasmacytoïdes (CDp):
Nous venons de détailler l’ensemble des caractéristiques fonctionnelles des CDs. Les cellules dendritiques peuvent être divisées morphologiquement et fonctionnellement en deux types : les CD myéloïdes (CDm) comprenant les cellules de Langerhans et les CD interstitielles (Banchereau et al., 2003), et les cellules dendritiques plasmacytoïdes (CDp)
(Arpinati et al., 2003). Les CDm se développent à partir de progéniteurs myéloïdes alors
que les CDp dérivent de progéniteurs lymphoïdes. L’ensemble des caractéristiques que nous venons de décrire sont retrouvées dans les deux types cellulaires cependant ces deux populations se distinguent par des marqueurs de surfaces différents et également par le type de réponses immunes qu’elles initient. Les CDm présentent les marqueurs CD11c+/CD4+/CD45RO+ alors que les CDp sont de phénotype CD11c-/CD4+/CD45RA+/CD123+. Les CDm capturent des antigènes soit par phagocytose, soit par endocytose dépendante de récepteur, ces antigènes sont alors respectivement présentés par les CMH de classe I ou de classe II. Les CDp présentent uniquement des antigènes associés aux molécules de CMH-II qui ont été internalisés par la voie d’endocytose. Les cellules d’origines myéloïdes expriment un plus fort niveau de molécules de CMH et de costimulations que les cellules plasmacytoïdes ce qui leur confèrent une plus grande
capacité à stimuler la prolifération des lymphocytes T. La production de cytokines et chemokines est également différente entre ces deux types cellulaires (Mohamadzadeh et
al., 2005 ; Vollstedt et al., 2004 ; Chuang et al., 2002). Enfin les Cdm sont plus a même
d’induire des réponses de type T cytotoxique anti-tumorales alors que les pDC favorisent plutôt des réponses de type CD4 helper et en particulier des réponses de cellules T CD4 régulatrices. Comme nous le verrons ultérieurement ces réponses jouent un rôle dans les mécanismes d’échappement tumoraux.
F-Les IKDC le chaînon manquant :
Le groupe de Laurence Zitvogel a récemment mis en évidence une nouvelle population cellulaire les IKDCs (Interferon, Killer, Dendritic, Cells). Ces cellules sont des hybrides entre les cellules dendritiques plasmacytoïdes, les cellules NK et les lymphocytes T (Taïeb et al.,
2006). Comme les cellules NK, les IKDCs peuvent tuer des cellules ayant dérégulé
l’expression des CMH-I, comme les cellules dendritiques plasmacytoïdes elles secrètent de grandes quantités d’IFN-α, et comme les CD m elles sont capables de d’apprêter et de présenter les antigènes aux LT (Shortman et al., 2002). Toutes ces fonctions font des IKDC le lien entre l’immunité innée et adaptative. Ces cellules présentent des marqueurs de surface communs aux NK (CD49b, NK1.1, NKG2D), aux CDp et aux CDm (CD11C) mais elles ont cependant des caractéristiques propres. Dans le modèle du mélanome, les IKDC reconnaissent et détruisent mieux les cellules tumorales que les NK (Colucci et al., 2003). Cette capacité à tuer est dépendante des ligands de TRAIL, qui sont exprimés à la surface des IKDCs. Cependant dans les modèles tumoraux murins étudiés l’activation des IKDC est induite par un traitement associant le Gleevec et l’IL-2, de ce fait le rôle des IKDC dans la réponse immune naturelle reste encore controversée d’autant plus qu’aucune donnée actuelle ne met en évidence la présence des ces cellules chez l’homme.
II La réponse immune adaptative anti-tumorale
La réponse immune innée constitue la première ligne de défense contre les tumeurs, mais elle n’a pas la capacité d’installer un état immunitaire spécifique qui préviendrait les métastases. L’immunité adaptative se base sur la sélection clonale à partir d’un répertoire préexistant de lymphocytes, dotés de récepteurs spécifiques d’un antigène. Dans la réponse immune adaptative, les lymphocytes spécifiques d’un antigène prolifèrent et se différencient en cellules effectrices capables de reconnaître les cellules tumorales ou en cellules mémoires capables de prévenir l’apparition de métastases. Les principaux effecteurs de l’immunité adaptative sont les lymphocytes T CD8+ (LTCD8+) et lymphocytes T CD4+ (LTCD4+). Ces cellules reconnaissent respectivement les antigènes tumoraux présentés soit par les molécules de CMH-I ou CMH-II. La première caractérisation d’un antigène dit « associé aux tumeurs » (TAA) fut réalisée par le groupe de T BOON en 1991. Ces travaux pionniers réalisés à partir de cellules de mélanomes humains, ont permis d’identifier le gène MAGE (Melanoma Antigen). Depuis, différentes techniques se sont développées et ont permis d’identifier de nouveaux antigènes tumoraux. Diverses catégories d’antigènes de tumeurs peuvent êtres distingués, mais aucune classification n’est véritablement satisfaisante.A-Les Antigènes de tumeurs : (tableau 1)
1) Les antigènes d’origine embryonnaire :
Ces antigènes résultent de la réactivation de gènes embryonnaires, transcriptionnellement actifs dans différents types de tumeurs (DeSmet et al., 1999) mais généralement silencieux dans les tissus adultes (DeSmet et al., 1994) mis à part, les spermatozoïdes, les spermatogonies des testicules et occasionnellement le placenta. Bien que la présence de ces antigènes dans les cellules tumorales induise une réponse immune spécifique, leur expression dans les cellules germinales n’entraîne pas de réponse de type auto-immune,
Antigènes tumoraux
Expression tumorale
Antigènes issus de mutations ponctuelles:
RasV12
CDK4
p53
Cancer du pancréas
Mélanome
Tumeurs variées
Antigènes viraux:
E6-E7 papillomavirus
EBV
Cancer du col de l’utérus
Lymphomes, cancer du nasopharynx
Antigènes communs spécifiques de
tumeurs:
MAGE
BAGE
GAGE
Tumeurs variés
Tumeurs variés
Tumeurs variés
Antigènes de différenciation:
Melan-A/MART-1
Gp100
TRP-1,-2
Mélanome
Mélanome
Mélanome
Antigènes surexprimés:
HER-2/neu
Télomérase
P53
Carcinomes du sein, ovaires, poumons
Tumeurs variés
Tumeurs variés
ces cellules n’exprimant pas les molécules de CMH-I et CMH-II (Jassim et al., 1989). Les antigènes de tumeur d’origine embryonnaire représentent l’un des plus important groupe d’antigènes testé en protocoles clinique anti-tumoraux depuis ces 10 dernières années. Le premier gène identifié de cette catégorie chez l’homme est le gène MAGE-A1 (van der
Bruggen et al., 1991). Cet antigène MAGE-1 (Melanome AntiGEn) est retrouvé dans de
nombreuses tumeurs solides : 37% des mélanomes, 17% des cancers du sein, 35% des cancers bronchiques autres que ceux à petites cellules. Aujourd’hui, de nombreux autres gènes ont été caractérisés par analogie au gène MAGE-A1 sur des mélanomes humains. La famille des gènes MAGE regroupe 12 membres de MAGE-A1 à MAGE-A12. Ces gènes sont aussi exprimés dans des proportions variables de tumeurs de divers types histologiques, le plus souvent des tumeurs solides. D’autres gènes ont été identifiés sur d’autres types de tumeurs solides: BAGE (Bladder AntiGEn), GAGE (Gastric AntiGEn), RAGE (Renal tumor AntiGEn), LAGE/N-ESO-1(Lethe et al., 1998; Chen et al., 1997) et SXX (Gure et al., 1997
; Gure et al., 2002). 60 à 70% des mélanomes malins expriment au moins un de ces
antigènes pouvant constituer des cibles potentielles pour des lymphocytes T cytotoxiques (CTL) induits par vaccination.
2) Les antigènes de différenciation :
Il a été montré que les CTL, de certains patients atteints de mélanome, reconnaissent des antigènes de différenciation exprimés non seulement par les cellules de mélanome mais aussi par les mélanocytes normaux. Les antigènes spécifiques de la lignée mélanocytaire sont issus pour la plupart des protéines de la membrane du mélanosome, organelle impliquée dans la synthèse de la mélanine. Plusieurs antigènes de différenciation de la lignée mélanocytaire ont été identifiés tels que la tyrosinase, Melan-A/MART-1, gp100, TRP-1 et TRP-2 (Brichard et al., TRP-1993 ; Coulie et al., TRP-1994 ; Bakker et al., TRP-1994 ; Kawakami et
al., 1994). L’immunodominance de l’antigène Melan-A/MART-1 est reflétée par la fréquence
élevée de CTL circulants chez la majorité des patients atteints du mélanome, mais aussi chez des donneurs sains à une fréquence beaucoup plus faible. Plusieurs observations ont associé la dépigmentation par la destruction des mélanocytes sains (vitiligo) avec une