Université de Sherbrooke
Caractérisation fonctionnelle de l’interactome de RAB21
Par
Tomas Del Olmo
Programme de biologie cellulaire
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de philosophiae doctor (Ph.D.)
en Biologie cellulaire
Sherbrooke, Québec, Canada Janvier 2020
Membres du jury d’évaluation
Pr Steve Jean, programme de biologie cellulaire Pr Fernand-Pierre Gendron, programme de biologie cellulaire
Pr Christine Lavoie, programme de pharmacologie
Pr Nicolas Bisson, Département de biologie moléculaire, de biochimie médicale et de pathologie, Faculté de médecine, Université Laval
1R
ÉSUMÉCaractérisation fonctionnelle de l’interactome de RAB21 Par
Tomas Del Olmo
Programme de biologie cellulaire
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de philosophiae doctor (Ph.D.) en biologie cellulaire, Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 Le trafic membranaire régule l’ensemble du transport vésiculaire de cargos entre les différents organites de la cellule ainsi qu’avec le milieu extracellulaire. On distingue les voies de sécrétion et d’endocytose mais celles-ci sont interconnectées. Ce trafic est un réseau complexe qui assure l’intégrité cellulaire. Une panoplie de protéines agissent donc en concert afin de permettre sa régulation. Les RAB sont considérées comme les chefs d’orchestre du trafic. Activées, elles recrutent une large gamme d’effecteurs qui permettent de médier chacune des étapes du trafic membranaire. Des défauts d’activité des RAB sont impliqués dans le développement de pathologies telles que les maladies neurodégénératives et le cancer. RAB21 est une RAB endosomale impliquée dans la régulation de l’internalisation des intégrines, du récepteur à l’EGF et dans la régulation du flux autophagique. Cependant, peu d’effecteurs et régulateurs sont connus pour RAB21. En effet, la compréhension des mécanismes moléculaires d’action des RAB reste un enjeu majeur dans le décryptage du trafic membranaire. En effet, l’identification des partenaires protéiques des RAB comporte de nombreuses limitations. Ici, la combinaison d’une approche de spectrométrie de masse quantitative (SILAC) avec une approche de marquage par proximité (APEX2) a permis d’identifier l’ensemble des partenaires protéiques de RAB21. L’approche APEX2 a permis d’identifier la plupart des interacteurs connus de RAB21 ainsi que de nouveaux effecteurs et régulateurs potentiels. La comparaison des enrichissements relatifs aux RAB5, 4, 7 et 21 a permis d’identifier des interactions spécifiques à chacune des RAB. L’approche SILAC a permis l’identification de cargos potentiels. La validation des interactions identifiées par des techniques de biochimie ont validé l’interaction de RAB21 avec les complexes WASH et Rétromère, impliqués dans des évènements de tri endosomal, ainsi qu’avec TMED10 qui régule la progression de cargos le long de la voie de sécrétion. Par la suite, la délétion de RAB21 par l’approche CRISPR/Cas9 a mis en évidence un rôle de RAB21 dans la stabilité du Rétromère et dans l’activité de WASH. La déplétion de RAB21 affecte le recyclage de cargos clathrine indépendants à la membrane plasmique. Par ailleurs, la délétion de RAB21 affecte la stabilité et la localisation au Golgi de TMED10. L’ensemble de ces travaux ont permis de caractériser de nouveaux effecteurs et cargos spécifiques ainsi que deux nouvelles fonctions impliquant RAB21. Ce projet a permis d’établir de nouvelles approches expérimentales pour élucider les mécanismes moléculaires de régulation du trafic membranaire et pourra servir de base à l’étude de l’ensemble des RAB.
2S
UMMARYRAB21 functional interactome characterisation By
Tomas Del Olmo Cellular biology Program
Thesis presented at the Faculty of medicine and health sciences for the obtention of Doctor degree diploma philosophiae doctor (Ph.D.) in cellular biology, Faculty of medicine and
health sciences, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 Membrane trafficking regulates vesicular transport between the different organelles of the cell as well as exchanges with the extra-cellular space. Endocytic and secretory pathways are interconnected and form a complex network assuring cell integrity. Therefore, membrane trafficking is regulated by a large set of proteins which all act in concert to enable its proper function. RABs are considered as master regulators of trafficking. When activated, RABs recruit a wide range of effectors to mediate each steps of trafficking. Impairment of RAB activity are involved in the development of diseases such as neurodegenerative diseases and cancer. RAB21 is an endosomal RAB which regulates autophagic flux and is involved in the internalization of integrins and the EGF receptor. Despite these identified functions, only a few effectors and regulators are known for RAB21. Understanding the molecular mechanisms of action of RABs remains a major challenge to decode membrane trafficking. Indeed, identification of RABs partners with current approaches has some limitation. Here, the combination of a quantitative mass spectrometry (SILAC) approach with a proximity labeling approach (APEX2) made it possible to identify almost every RAB21 protein partners. The APEX2 approach allowed the identification of most of the known RAB21 interactors as well as potential effectors and regulators. The comparison of the relative protein enrichments obtained with RAB5, 4, 7 and 21 permitted to identify specific interactions. The SILAC approach has essentially allowed the identification of potential cargos for RAB21. Biochemical techniques validated the interactions of RAB21 with the WASH and Retromer complexes, both involved in endosomal sorting events, as well as with TMED10 which regulates the cargoes progression through secretory pathway. Subsequently, the deletion of RAB21 by CRISPR/Cas9 highlighted a role for RAB21 in maintaining the stability of the retromer complex and in regulating WASH complex activity. The deletion of RAB21 affected recycling of clathrin-independent-cargos to the plasma membrane. In addition, deletion of RAB21 decreased the stability of TMED10 and its location at Golgi. All this work allowed the characterization of new specific effectors and cargos as well as two new functions involving RAB21. This project is an example in the study of the molecular mechanisms of membrane trafficking regulation that can be used as a basis for the study of all RABs.
3T
ABLE DES MATIERES1 Résumé ... iii
2 Summary ... iv
3 Table des matières ... v
4 Liste des figures ... vii
5 Liste des abréviations ... ix
1 Introduction... 1 1.1 Le trafic membranaire ... 1 1.1.1 Définition ... 1 1.1.2 La voie de sécrétion ... 2 1.1.2.1 Le réticulum endoplasmique ... 3 1.1.2.2 Le Golgi ... 5 1.1.2.3 Le ERGIC ... 6
1.1.2.4 Les vésicules COPII et COPI ... 7
1.1.3 La famille p24 ... 8
1.1.3.1 Les différentes protéines de la famille p24 ... 8
1.1.3.2 Structure des protéines p24 ... 10
1.1.3.3 Fonction des protéines p24 ... 11
1.1.3.4 Spécificités de TMED10 ... 11
1.2 La voie d’endocytose... 18
1.2.1 Rôles de l’endocytose ... 18
1.2.1.1 Endocytose clathrine dépendante ... 19
1.2.1.2 Endocytose cavéoline dépendante ... 21
1.2.1.3 Endocytose clathrine et cavéoline indépendante ... 22
1.2.1.4 Endosomes précoces : gares de triage... 24
1.2.1.5 Dégradation lysosomale ... 26
1.2.1.6 Recyclage endosomal ... 27
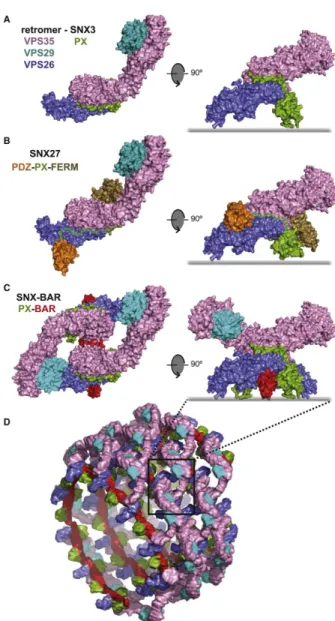
1.2.2 Le complexe Rétromère ... 29
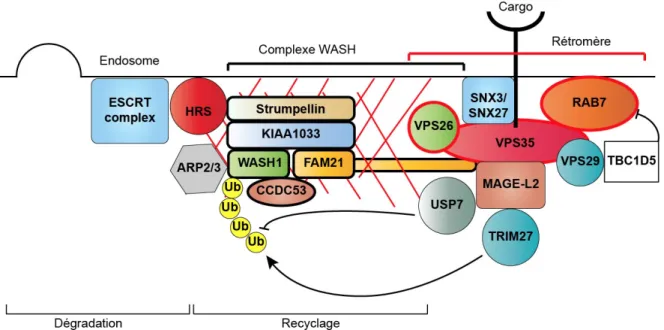
1.2.3 Le complexe WASH ... 35
1.3 Les régulateurs du trafic membranaire ... 43
1.3.1 Les RAB ... 43
1.3.1.1 Généralités ... 43
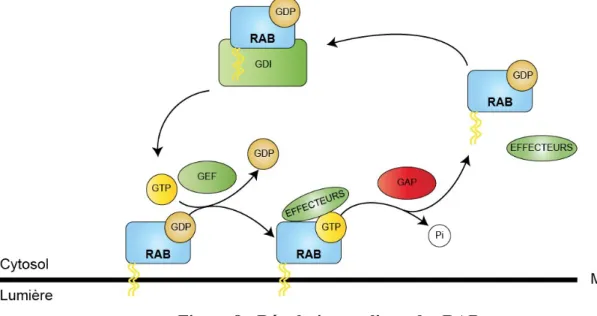
1.3.1.3 Régulation des RAB ... 45
1.3.1.4 Les GEF ... 47
1.3.1.5 Les GAP ... 47
1.3.1.6 Effecteurs et fonctions des RAB ... 48
1.3.1.7 Localisation des RAB ... 52
1.3.2 RAB21 ... 53
1.3.2.1 Généralités concernant RAB21 ... 53
1.3.2.2 Localisation de RAB21 ... 55
1.3.2.3 Fonctions de RAB21 ... 56
1.3.2.4 Rôle de RAB21 dans des pathologies ... 60
Hypothèse ... 61
Objectifs ... 62
2 Article 1 ... 63
3 Article 2 ... 135
4 Discussion... 170
4.1 Comparaison des approches d’identification des partenaires de RAB21 ... 171
4.2 RAB21 régule l’activité de WASH et du Rétromère ... 176
4.3 Rôle de RAB21 dans la régulation de TMED10 ... 182
4.4 Nouvelles fonctions potentielles de RAB21 ... 185
5 Conclusion et perspectives ... 191
6 Remerciements ... 196
7 Liste des références ... 197
4L
ISTE DES FIGURESFigure 1 : La voie de sécrétion du trafic endosomal ... 4
Figure 2 : Structure des protéines de la famille p24 ... 10
Figure 3 : Localisations et fonctions de TMED10 ... 15
Figure 4 : Les différents types d’endocytose ... 20
Figure 5 : L’endosome précoce, centrale de triage ... 25
Figure 6 : Structures cristallographiques des différents manteaux formés par le Rétromère ... 32
Figure 7 : Relation des complexes WASH et Rétromère ... 37
Figure 8 : Régulation cyclique des RAB ... 46
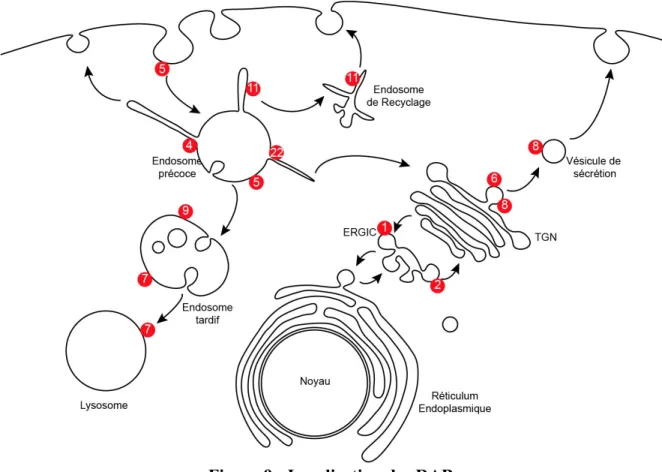
Figure 9 : Localisation des RAB ... 53
Figure 10 : Principales fonctions associées à RAB21 ... 57
Figure 11 : Rôle potentiel de RAB21 dans la régulation mTOR ... 187
Article 1 Figure 1 : APEX2:RAB expression lead to endosomal biotinylation ... 122
Article 1 Figure 2 : Comparison of APEX2:RAB21-, 5-, 4- and 7-generated proteomes .. 123
Article 1 Figure 3 : RAB21 interacts and colocalizes with the WASH and retromer complexes. ... 124
Article 1 Figure 4 : Characterization of RAB21 knockout HeLa cells. ... 125
Article 1 Figure 5 : RAB21 modulates WASH and retromer endosomal recruitment and WASH activity. ... 126
Article 1 Figure 6 : RAB21 is required for endosomal sorting of specific cargo types. .... 127
Article 1 Figure 7 : WASH and retromer complexes are required for SLC3A2 and Basigin sorting, and for full RAB21 activation and endosomal localization. ... 128
Article 1 Figure 8 : Model of RAB21-mediated WASH/retromer cargo sorting. ... 129
Article 1 Figure EV 1 : Network of merged HCT116 and HeLa cells highlights new potential RAB21 interactors with roles in trafficking ... 130
Article 1 Figure EV 2 : AP-MS identification of RAB21 interactors and Gene Ontology enrichments of these interactors. ... 131
Article 1 Figure EV 3 : APEX2:RAB neighbors weakly overlap with a generic endosomal
probe. ... 132
Article 1 Figure EV 4 : Validation of specific APEX2:RAB21 hits and further characterization of RAB21 knockout cells. ... 133
Article 1 Figure EV 5 : RAB21 regulates WASH and endosomal retromer recruitment, while RAB21 knockout leads to increased SLC3A2 lysosome colocalization. ... 134
Article 2 Figure 1 : RAB21 interacts with TMED10 ... 163
Article 2 Figure 2 : RAB21 interacts with TMED10 ... 164
Article 2 Figure 3 : TMED10 Golgi localization is altered in RAB21 knockout cells ... 165
Article 2 Figure 4 : RAB21 knockout reduces TMED10 and TMED2 protein levels ... 166
Article 2 Figure S 1 Indirect interaction between RAB21 and TMED10 ... 167
Article 2 Figure S 2 TMED10 localization at trans-Golgi is modulated by RAB21 ... 168
Article 2 Figure S 3 TMED10 stability is not affected by blocking proteasomal or lysosomal functions ... 169
Tableau 1 : Régulateurs, effecteurs et localisations des RAB ... 50
5L
ISTE DES ABRÉVIATIONS ACAP1 ADN ALK5 AMBRA AMPK ANKRD50 AP2 APEX2 APP ARF ARHGAP10 ARN ARP2/3 ATG4B ATP7A 2AR BMDM CAPZ CCC CCDC5 CDC42 CFL1 CG CHO CI-MPR CLIC COPI COPII CRISPR/Cas9 CRMP2 CSC CSE1L DAF DENN DMT1-II DOP1B EEA1 EGFR EHD1 EHD3ArfGAP With Coiled-Coil, Ankyrin Repeat And PH Domains 1 Acide désoxyribonucléique
Activin Receptor-Like Kinase Receptor 5
Activating Molecule In Beclin-1-Regulated Autophagy AMP-activated Protein Kinase
Ankyrin Repeat Domain 50 Adaptor Protein complex 2 Ascorbic acid Peroxidase Amyloid Beta Precursor Protein ADP ribosylation factor
Rho GTPase Activating Protein 10 Acide Ribonucléique
Actin Related Protein 2/3 Autophagy Related Genes 4B ATPase Copper Transporting Alpha Beta-2 Adrenergic Receptor
Bone Marrow Derived Macrophages Capping Actin Protein Of Muscle Z-Line COMMD/CCDC22/CCDC93
Coiled-Coil Domain-Containing Protein 53 Cell Division Cycle 42
Cofilin 1 CLIC/GEEC
Chinese Hamster Ovary
Cation-Independent-Mannose 6-Phosphate Receptor Clathrin-Independent Carriers
Coat Proteins I Coat Proteins II
Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR associated protein 9
Collapsin Response Mediator Protein-2 Cargo Selective Complex
Chromosome Segregation 1 Like Decay-Accelerating Factor
Differentially Expressed in Normal and Neoplastic cells Divalent Metal Transporter 1
DOP1 leucine zipper like protein B Early Endosome Antigen 1
Epidermal Growth Factor Receptor EH Domain Containing 1
ERAD ERD2 ERES ERGIC ESCRT FAK FAM21 FANSHY FCHO1/2 FERM FKBP15 GAP GAPCENA GAPVD1 GBF1 GCN1 GDI GDP GEEC GEF GLUT1 GOLD GPCR GPI GPI-AP GRAF1 GST GTP HOPS HRS HSC70-4 IL-1b IL-6 LC3 LPS LRP1 LST8 MAGE-L2 MCT-1 MEF MICAL MICAL-L1 ER-Associated Degradation
KDEL Endoplasmic Reticulum protein retention receptor 1 Endoplasmic Reticulum Exit Site
ER-to-Golgi Intermediate Compartment
Endosomal Sorting Complex Required for Transport Focal Adhesion Kinase
Family with Sequence Similarity 21 Phe-Ala-Asn-Ser-His-Tyr
FCH domain only 1
4.1 protein, Ezrin, Radixin and Moesin FK506 Binding Protein 15
GTPase Activating Protein GAP and Centrosome-Associated
GTPase Activating Protein and VPS9 Domains 1
Golgi Brefeldin A Resistant Guanine Nucleotide Exchange Factor 1
General Control of amino-acid synthesis 1, GDP Dissociation Inhibitor
Guanosine Diphosphate
Glycophosphatidylinositol anchored protein Enriched Endosomal Compartments
Guanosine Nucleotide Exchange Factor Glucose Transporter 1
Golgi Dynamic
G Protein-Coupled Receptors Glycosylphosphatidylinositol
Glycosylphosphatidylinositol Anchored Protein
GTPase Regulator Associated with Focal Adhesion Kinase 1 Glutathion S-transférase
Guanosine Triphosphate
Homotypic fusion and Protein Sorting
Hepatocyte growth factor-Regulated tyrosine kinase Substrate Heat Shock Protein Family A (Hsp70) Member 4
Interleukin-1b Interleukin-6 Light Chain 3 Lipopolysaccharides
Lipoprotein Receptor-Related Protein 1 Lethal with SEC13 protein 8
MAGE Family Member L2
Multiple Copies in T-cell lymphoma-1
Mouse Embryonic Fibroblast
Microtubule Associated Monooxygenase, Calponin and LIM Domain containing 1
mTOR mTORC1 mTORC2 MVBs NAPA NFAT NFkB NMDA NPF NSF N-WASP PAR-2 PDS5A PDZ PI(3)P PI3Ks PI4KIIIb PIK3R2 PIKFYVE PIP PKC PLEKHM2 PS1 PX PYGB RAB RAC1 RE RNF2 RhoA RME-8 RTK S6K SAR-1 SARA Sec SLC3A2 SNARE SNX SURF4 SWIP TBC1D TbRII TbVps23 TGF-
Mammalian Target Of Rapamycin
Mammalian Target Of Rapamycin Complex 1 Mammalian Target Of Rapamycin Complex 2 Multivesivular Bodies
NSF Attachment Protein Alpha Nuclear Factor Activated T cell
Nuclear Factor kappa-light-chain-enhancer of activated B cells N-Methyl-D-Aspartate
Nucleation-Promoting Factor N-Ethylmaleimide Sensitive Factor Wiskott Aldrich Syndrome protein Protease Activated Receptor 2 PDS5 Cohesin Associated Factor A PSD95-Dlg1-Zo-1
Phosphatidylinositol-3-phosphate Phosphoinositide 3-kinase
Phosphatidylinositol 4-Kinase Type 2 Beta Phosphoinositide-3-Kinase Regulatory Subunit 2
Phosphoinositide Kinase, FYVE-Type Zinc Finger Containing Phosphatidylinositol Phosphate
Protein Kinase C Delta
Pleckstrin Homology And RUN Domain Containing M2 Presenilin 1
Phox
Glycogen Phosphorylase B Ras gene from rat Brain
Ras-related C3 botulinum toxin substrate 1 Réticulum Endoplasmique
Ring Finger protein 2 Ras homolog gene family A
Required for Receptor-Mediated Endocytosis 8 Receptor Tyrosine kinase
S6 Kinase
Secretion Associated Ras Related GTPase 1 Smad Anchor for Receptor Activation Staphylococcal enterotoxin C
Solute carrier family 3 member 2
Soluble N-éthylmaleimide-sensitive-factor Attachment protein REceptor
Sorting Nexin Surfeit 4
Strumpellin and WASH-Interacting Protein Tre-Bub2/Cdc16 1 Domain Family
Transforming Growth Factor Beta Receptor 2
Trypanosoma brucei Vaccuolar protein-associated sorting 23 Transforming Growth Factor Beta 1
TGN TI-VAMP TLR4 TMED TNF TnFR TRAPPI TRF2 TRIM27 UIM UPR USP7 VAMP VARP V-ATPase VCA VPS VSVG WASH WASP WDH Wls WNT XPO1
Trans Golgi Network Tetanus-Insensitive VAMP Toll-Like Receptor 4
Transmembrane emp24 domain-containing protein Tumor necrosis factor alpha
Transferin Receptor
Transport Protein Particle I
Telomeric Repeat-binding Factor 2 Tripartite Motif 27
Ubiquitin Interacting Motif Unfolded Protein Response
Ubiquitin-specific-processing protease 7 Vesicle-Associated Membrane Protein
Vacuolar protein sorting-associated Ankyrin-Repeat Protein Vacuolar-type H+-ATPase
Verpolin Connecting and Acidic Vacuolar Protein Sorting-associated Virus de la Stomatite Vésiculeuse G
Wiskott Aldrich Syndrome protéine et SCAR Holomogue Wiskott–Aldrich Syndrome Protein
WASH Domain Homology Wnt ligand secretion Wingless-Type Exportin 1
1I
NTRODUCTION 1.1 Le trafic membranaire1.1.1 Définition
Chez les eucaryotes les espaces intracellulaires et extracellulaires de chaque cellule sont délimités par une bicouche lipidique : la membrane plasmique (Le Roux et al. 2019). Cette membrane joue à la fois le rôle de barrière mais aussi d’échangeur avec le milieu extracellulaire. De plus, les cellules eucaryotes sont sous-compartimentées en unités fonctionnelles, appelées organites (Voeltz et Barr 2013). Par exemple, la réplication de l’acide désoxyribonucléique (ADN) est centralisée dans le noyau (Razin 2018), et la respiration dans la mitochondrie (Rich et Maréchal 2010). En réalité, il existe de nombreux compartiments chacun associé à une fonction. On peut noter : le cytosol, le réticulum endoplasmique lisse et rugueux, l’appareil de Golgi, les endosomes, les lysosomes, les péroxysomes, les vésicules de sécrétion, les autophagosomes, etc (Mellman et Warren 2000). Chacun de ces compartiments est délimité par des membranes lipidiques (van Meer et al. 2008). Les cellules étant sous-compartimentées, il est donc nécessaire d’effectuer des échanges entre ceux-ci (Costanzo et al. 2016).
L’ensemble des échanges vésiculaires entre les différents organites ainsi qu’entre l’intérieur et l’extérieur de la cellule peut être défini comme le trafic membranaire (Chavrier et Goud 1999). Le trafic s’effectue via le bourgeonnement de vésicules à partir de la membrane d’un compartiment initial, (A) (Gonzalez et Scheller 1999). Cette vésicule se détache, et migre le long du cytosquelette. Pour terminer, cette vésicule va s’ancrer et
fusionner avec la membrane d’un compartiment cible, (B) (Gonzalez et Scheller 1999). L’ensemble des protéines présentes à la membrane et le contenu de la vésicule sont transportés du compartiment (A) vers le compartiment (B) (Pizarro et Norambuena 2014). Le trafic est très finement régulé et des défauts de ce dernier sont impliqués dans de nombreuses pathologies, telles que les maladies neurodégénératives et le cancer (Niedergang et al. 2017). Ainsi, de nombreux complexes protéiques sont impliqués dans la régulation de chacune de ces étapes. On peut noter les protéines motrices telles les dynéines, kinésines et myosines qui jouent un rôle dans le transport des vésicules le long du cytosquelette (Hehnly et Stamnes 2007). Les protéines de manteau et SNX (Sorting Nexin) vont générer des courbures des membranes lipidiques (Gallon et Cullen 2015). Les SNARE (Soluble N-éthylmaleimide-sensitive-factor Attachment protein REceptor), pour leur part, régulent la fusion des vésicules avec leur compartiment cible (Wang et al. 2017). Afin de maintenir une cohérence entre les différents compartiments malgré les échanges, l’enjeu est de maintenir l’identité membranaire de chaque compartiment. Cette identité est conservée par la nature des lipides, les phosphoinositides, et les protéines telles que les RAB (Ras-like in rat Brain) qui composent une membrane (Jean et Kiger 2012). On distingue deux grandes voies au sein du trafic : la voie de sécrétion et la voie de l’endocytose.
1.1.2 La voie de sécrétion
La voie de sécrétion régule les échanges de l’intérieur vers l’extérieur de la cellule (Sallese et al. 2009). Les protéines synthétisées dans le cytosol sont transloquées au réticulum endoplasmique (RE) de façon co-traductionnelle (McCaffrey et Braakman 2016). Ces protéines sont ensuite transportées dans le compartiment ERGIC (ER-to-Golgi Intermediate
compartment) (Appenzeller-Herzog et Hauri 2006). Enfin, ces protéines transitent via l’appareil de Golgi afin d’être stockées dans des vésicules de sécrétion et être adressées à la membrane plasmique ou vers le milieu extracellulaire (Boncompain et Perez 2013). L’ensemble des récepteurs, transporteurs, canaux, et hormones destinés à être adressés à la membrane plasmique ou sécrétés vont emprunter la voie de sécrétion.
1.1.2.1 Le réticulum endoplasmique
Le RE est impliqué dans de nombreuses fonctions dont la synthèse de lipides, de protéines et le stockage de calcium (Ca2+) (Schwarz et Blower 2016). Le RE est une structure constituée d’une bicouche lipidique prenant sa source dans la membrane externe du noyau. Il est principalement constitué de citernes situées dans la région périnucléaire et formées par l’apposition de membranes très rapprochées (Westrate et al. 2015). En revanche, le RE s’étend à travers la cellule formant un réseau complexe grâce à l’extension de tubules pouvant créer des points de contact avec l’ensemble des autres organites de la cellule tels que la membrane plasmique, la mitochondrie, le Golgi, les endosomes et les lysosomes (Zhang et Hu 2016). Ces points de contact jouent un rôle dans l’échange de lipides mais aussi dans la régulation d’évènements de signalisation (Dong et al. 2016; Quon et al. 2018). Le RE est le point de départ de la voie de sécrétion (Figure 1). L’ensemble des protéines sécrétées et des protéines transmembranaires sont modifiées au sein du RE. Les ribosomes synthétisant les protéines sont associés au RE, et permettent la translocation de celles-ci dans la lumière du RE au cours de leur synthèse (Aviram et Schuldiner 2017). Lors de leur séjour dans le réticulum les protéines vont subir des changements de conformation grâce à l’intervention de protéines chaperonnes (Hartl et Hayer-Hartl 2009). Aussi, ces protéines sont soumises à des modifications post-traductionnelles telles que des N-glycosylation ou la formation de
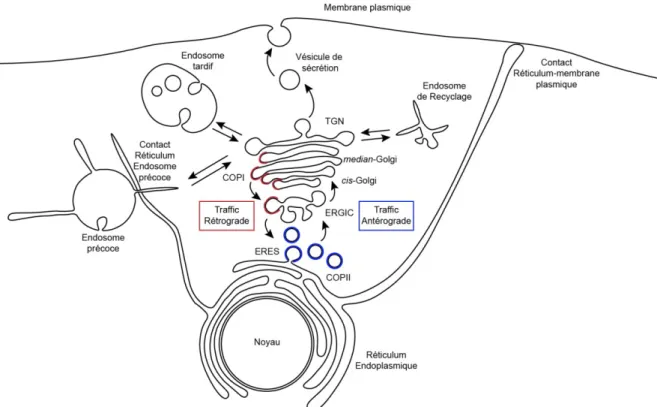
Figure 1 : La voie de sécrétion du trafic endosomal
Les protéines synthétisées dans le réticulum endoplasmique sont transférées au ERGIC via la formation de vésicules COPII aux sites ERES. Depuis l’ERGIC les cargos vont progresser vers le cis-Golgi, et finalement atteindre le réseau transgolgien. Le transport de cargos du RE vers le Golgi s’appelle le transport antérograde. Le réseau transgolgien (TGN) connecte la voie de sécrétion à l’ensemble des organites de la cellule. D’ici, les cargos sont adressés à la membrane plasmique et vers le milieu extracellulaire via les vésicules de sécrétion. Des échanges bidirectionnels sont aussi réalisés entre le TGN et les endosomes précoces, tardifs, et de recyclage. De plus, il existe un transport antérograde du Golgi au réticulum en passant par le ERGIC via la formation de vésicules COPI. Le RE représente un réseau qui s’étend à travers la cellule et réalise des contacts avec plusieurs organites ayant pour effet de réguler la scission de tubules endosomaux ou d’induire des échanges de protéines et lipides avec la membrane plasmique.
ponts disulfures (Cherepanova et al. 2016). L’ensemble de ces modifications confère leur structure tertiaire aux protéines. Ici, s’effectue un premier tri entre les protéines dont la conformation est conforme et celle dont la conformation est incorrecte. Les protéines avec des erreurs de repliement sont séquestrées dans le RE et dégradées via le système de dégradation associé au RE, ERAD (ER-associated degradation) (McCaffrey et Braakman
dans des vésicules recouvertes d’un manteau de protéines COPII (Coat proteins II), et quittent le réticulum à partir des sites de sortie du réticulum, appelés : ERES (ER-Exit Sites) (McCaughey and Stephens 2018).
1.1.2.2 Le Golgi
Après avoir quitté le RE, les cargos transitent via le ERGIC avant d’atteindre le Golgi (Hauri et al. 2000). Le transport du RE vers le Golgi par les vésicules COPII, s’appelle le transport antérograde. Le Golgi est constitué de multiples citernes pouvant être classées en trois sortes : le cis-Golgi qui fait face au RE et reçoit les cargos issus de celui-ci, les citernes médianes et le trans-Golgi (Wang et Huang 2017). Chacune des citernes comporte des enzymes qui permettent l’ajout de glycan sur les protéines présentes dans le Golgi (Potelle et al. 2015). Il existe deux modèles de progression des cargos à travers le Golgi. Le premier suppose que chaque citerne évolue et progresse à travers les cis-, median- et trans-Golgi (Nakano et Luini 2010). Dans ce modèle, des vésicules COPI (Coat proteins I) contenant des protéines résidentes du Golgi, émergent depuis chaque citerne et effectuent un transport rétrograde afin de maintenir l’identité de chaque compartiment. Le second modèle propose que des vésicules COPII soient formées à chaque citerne du Golgi et permettent le transport de cargo entre les différentes parties du Golgi (Glick et Luini 2011). Une fois que les cargos ont progressé à travers le Golgi, ils atteignent le réseau transgolgien (TGN). C’est au TGN que sont formées les vésicules de sécrétions qui sont adressées à la membrane plasmique permettant ainsi la sécrétion de molécules vers le milieu extracellulaire mais aussi l’adressage de protéines transmembranaires et de lipides à la membrane plasmique (Guo, Sirkis, and Schekman 2014). Le TGN constitue la gare de triage de la voie de sécrétion (Figure 1). Des échanges entre le Golgi et les différents compartiments sont réalisés (Boncompain et Perez
2013). En effet, il existe des échanges membranaires bidirectionnels entre le Golgi et les endosomes précoces, de recyclage et tardifs. Il existe aussi un transport rétrograde via des vésicules constituées de protéines de manteau COPI, du Golgi vers le RE (Lee et al. 2004).
1.1.2.3 Le ERGIC
Les échanges entre le RE et le Golgi sont très dynamiques et bidirectionnels. Entre ces deux compartiments existe un compartiment intermédiaire, le ERGIC (Appenzeller-Herzog et Hauri 2006). Formé de l’accumulation de vésicules COPII et COPI transportant des cargos entre le RE et le Golgi, l’ERGIC constitue un compartiment facilitant les échanges entre le RE et le Golgi mais aussi un compartiment supplémentaire de contrôle de la progression des cargos le long de la voie de sécrétion (Figure 1). En effet, il existe deux hypothèses concernant le fonctionnement du ERGIC (Appenzeller-Herzog et Hauri 2006). La première considère le transport antérograde de l’ERGIC le long des microtubules. L’ERGIC émergerait de la fusion de vésicules COPII, migrerait le long des microtubules et fusionnerait avec le cis-Golgi, participant ainsi à sa formation (Stephens et Pepperkok 2001). La formation de vésicules COPI émergeant du Golgi, et leur transport rétrograde le long des microtubules, dans ce cas, permettent le recyclage de composants résidents du RE. La deuxième hypothèse considère que l’ERGIC est un compartiment stable (Presley et al. 1997). Dans ce cas, les vésicules COPII émergeant du RE migreraient vers l’ERGIC indépendamment des microtubules puis de l’ERGIC vers le Golgi via les microtubules. Ici, le recyclage du Golgi vers l’ERGIC serait aussi dépendant de vésicules COPI migrant le long des microtubules.
1.1.2.4 Les vésicules COPII et COPI
Les vésicules COPII et COPI régulent l’ensemble du trafic, à savoir la progression et le recyclage des cargos entre le RE et le Golgi (Béthune et Wieland 2018). Ces vésicules sont dénommées ainsi en fonction du manteau protéique qui les constitue. Les vésicules COPII naissent au sites ERES lors de l’accumulation de cargos (Langhans et al. 2012). Des protéines de contrôle qualité sont présentes à ces sites et permettent d’exclure les protéines avec des défauts de conformation. Le bourgeonnement de ces vésicules est initié par SAR-1 (Secretion Associated Ras Related GTPase 1) qui est activée par Sec12 (Weissman, et al. 2001). Sec12 étant une protéine résidente du RE, cela permet de limiter l’activité de SAR-1 au RE (Kurokawa, et al. 2016). Une fois activée, SAR-1 est ancrée dans la bicouche lipidique du RE. Ensuite, SAR-1 recrute l’hétérodimère Sec23/Sec24 qui constitue le pré-manteau des vésicules COPII (Matsuoka et al. 1998). Sec23 interagit avec SAR-1 alors que Sec24 interagit directement avec les cargos présents à la membrane des ERES (Mancias and Goldberg 2008). Il existe plusieurs isoformes de Sec24 ce qui permet la sélection et le transport d’une grande variété de cargos (Wendeler et al. 2007). Enfin, l’hétérodimère Sec13/Sec31 est recruté via l’interaction entre Sec23/Sar1 et Sec31 (Bi et al. 2007). Sec13/Sec31 forment une cage qui induit une courbure de la membrane et participe à la fission de la vésicule (Stagg et al. 2006). Ainsi, la vésicule est transportée le long des microtubules puis dénudée de son manteau COPII via l’inactivation de SAR-1. Finalement, la fusion de cette vésicule avec la membrane du ERGIC permet la progression des cargos le long de la voie de sécrétion (Peotter et al. 2019). Les vésicules COPI diffèrent par la composition de leur manteau, et réalisent le trajet inverse. En effet, elles sont formées au Golgi ou à l’ERGIC. L’activation de ARF1 (ADP ribosylation factor 1) par GBF1 (Golgi Brefeldin A Resistant Guanine Nucleotide Exchange
Factor 1) permet le recrutement du complexe COPI formé d’un hétéro-heptamère (Monetta et al. 2007). Ces sept protéines peuvent être divisées en deux complexes. Le complexe F, composé des unités , ’ et -COP, et le complexe B, formé des sous-unités , , et -COP (Bykov et al. 2017). De la même manière que COPII, le manteau COPI va permettre le bourgeonnement et la fission d’une vésicule permettant son transport le long des microtubules vers le RE (Arakel et Schwappach 2018). L’inactivation d’ARF1 va faciliter le détachement du manteau COPI et permettre la fusion de la vésicule avec la membrane du RE, réalisant le transport rétrograde de cargo (Presley et al. 2002). Les sous-unités -COP, ’-COP ainsi que -COP et -COP ont la capacité d’interagir avec différents motifs des cargos (Bremser et al. 1999). La sélection des cargos aux vésicules COPI ou COPII représente une étape essentielle dans le trafic des cargos afin qu’ils soient triés vers le bon compartiment. Il a été montré que les protéines de la famille p24 jouent un rôle essentiel dans la formation des vésicules COPI par le recrutement d’ARF1 mais aussi dans la sélection des cargos puisque les protéines p24 interagissent directement avec le motif KDEL qui est un signal de transport rétrograde vers le RE (Irina Majoul et al. 2001).
1.1.3 La famille p24
1.1.3.1 Les différentes protéines de la famille p24
Avec 11 membres chez les vertébrés, ces protéines sont impliquées dans la régulation du trafic des cargos entre le RE et le Golgi (Strating et Martens 2009). Les membres de la famille p24 sont toutes des protéines transmembranaires de type I d’environ 24 kD qui ont été classées selon leur homologie en acide aminé. Elles sont séparées en quatre sous catégories , , et (Bremser et al ). Les protéines p24 sont exprimées chez
l’ensemble des eucaryotes (Pastor-Cantizano et al. 2016). En revanche, la conservation des sous catégories varie selon les espèces. L’expression de la plupart des protéines de la famille p24 est ubiquitaire chez les vertébrés malgré des niveaux variables selon le tissu, ceci pouvant être expliqué par la nécessité de médier le transport de cargos spécifiques (Rötter et al. 2002). En effet, les protéines p24 sont hautement exprimées dans les cellules sécrétrices comme les cellules endocrines. Par exemple, la forte expression des p24 dans les cellules pancréatiques sont associées à une forte sécrétion d’insuline (L. Zhang et Volchuk 2010). Il existe les deux exceptions p24α1 and p24γ5 qui chez la souris semblent avoir un profil d’expression restreint au pancréas et aux poumons, foie, rein et tractus intestinal, respectivement (Strating et al. 2009). Les protéines p24 sont localisées sur l’ensemble des organites associés à la voie de sécrétion c’est-à-dire au RE, à l’ERGIC et au Golgi (Füllekrug et al. 1999). Des sous populations ont aussi été identifiées à la membrane des péroxysomes, aux vésicules de sécrétion et à la membrane plasmique (Marelli et al. 2004; Langhans et al. 2008). Par ailleurs, les protéines p24 sont associées aux vésicules COPI et COPII (Montesinos et al. 2014; Muñiz et al. 2000). L’ensemble des membres possèdent un motif dibasique permettant de lier les sous unités Sec23/Sec24 du manteau COPII (Belden et Barlowe 2001). De même toutes les protéines de la famille p24 ont la capacité d’interagir avec la sous-unité γ-COP des vésicules COPI (Béthune et al. 2006). Bien que les mécanismes soient méconnus, les sous-catégories et arborent un motif dilysine ayant été caractérisé comme étant important (L. P. Jackson et al. 2012). Ainsi les protéines p24 peuvent cycler entre le RE et le Golgi via le transport médié par les vésicules COPI et COPII.
1.1.3.2 Structure des protéines p24
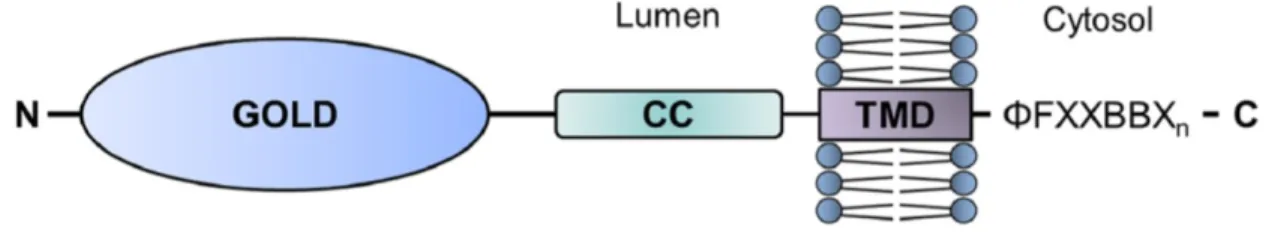
L’ensemble des protéines p24 possède la même structure. Elles sont constituées d’un court domaine cytosolique de 13 à 20 acides aminés en C-terminal (Pastor-Cantizano et al. 2016). Les motifs dilysine et dibasique sont présents sur ce domaine (Figure 2). Un domaine transmembranaire permet l’intégration dans la bicouche lipidique. Dans la lumière des organites, les p24 présentent un domaine en superhélice, suivit d’un domaine d’association et d’un domaine GOLD (Golgi dynamique) (Anantharaman et Aravind 2002). Le domaine en superhélice est impliqué dans l’oligomérisation de protéines p24 (Ciufo et Boyd 2000). En effet, des expériences de co-immunoprécipitations et de purifications GST (Glutathion S-transférase), ont montré qu’il existe différentes combinaisons d’association entre les membres de la famille p24, formant des hétérodimères et hétérotétramères (Fujita et al. 2011). Par ailleurs, il a été montré que l’inhibition de l’un des membres de la famille p24 entrainait la réduction de l’expression des autres membres, soutenant le fait qu’ils soient associés en complexes (D’Arcangelo et al. 2015).
Les protéines de la famille p24 possèdent quatre domines distincts. Un court domaine cytosolique en C-terminal possède le motif ΦFXXBBX de liaison aux protéines des manteaux COPI et COPII. Φ est un résidu hydrophobique, et BB sont deux groupes basiques. Le domaine transmembranaire (TMD) permet l’insertion dans la bicouche lipidique et l’association avec d’autres protéines de la famille p24. Les protéines p24 possèdent deux domaines dans la lumière du l’organite. Le domaine CC (coil-coiled) est séparé du domaine
Enfin, le domaine GOLD joue un rôle dans les interactions protéine-protéine et dans la reconnaissance de cargos (Ciufo et Boyd 2000).
1.1.3.3 Fonction des protéines p24
Initialement identifiées comme jouant un rôle dans le trafic de cargos associés à une ancre GPI (glycosylphosphatidylinositol), il a été montré que l’expression des membres de la famille p24 est impliquée dans le maintien de l’intégrité du Golgi (Emery et al. 2000). De même, l’inhibition de leur expression induit la réponse UPR (unfolded protein response), réponse du stress au RE (Belden et Barlowe 2001). Les protéines p24 sont aussi impliquées dans la formation des vésicules COPI (Aguilera-Romero et al. 2008). En effet, ARF1 est recruté au Golgi par interaction directe avec les domaines cytosoliques du dimère TMED10/TMED2 (Transmembrane emp24 domain-containing). Ensuite, les p24 interagissent avec les sous-complexes F et B, favorisant la formation des vésicules COPI (Pastor-Cantizano et al. 2016; Popoffe et al. 2011). De plus, les protéines p24 possèdent un domaine cytosolique permettant le recrutement et l’intégration dans les vésicules COPI d’ERD2 (KDEL Endoplasmic Reticulum protein retention receptor 1), un récepteur des cargos possédant un motif KDEL (Montesinos et al. 2014). Enfin les protéines p24 permettent l’inhibition d’ARF1, étape nécessaire à démanteler le manteau COPI (Majoul et al. 2001).
1.1.3.4 Spécificités de TMED10
TMED10 (Transmembrane Emp24 Domain), aussi appelé p231 ou encore p23 et Tmp21, est l’un des membres de la famille p24 qui a été le plus étudié. Chez les humains, l’expression de TMED10 est induite par le facteur de transcription NFAT (Nuclear Factor
Activated T cell) (S. Liu et al. 2011). TMED10, l’un des deux membres constituant la sous-catégorie chez les vertébrés est conservée des mammifères à la levure (Pastor-Cantizano et al. 2016). TMED10 est présent dans la plupart des tissus avec des niveaux qui varient puisque TMED10 est fortement exprimé dans les reins, de manière modérée dans le cerveau, et faiblement dans les muscles (Strating et al. 2009). De plus, l’expression de TMED10 est modulée au cours du développement. En effet, TMED10 est fortement exprimé dans le cerveau dans les étapes précoces du développement et voit son expression diminuer au cours de la vie de l’individu (Vetrivel et al. 2008). Par ailleurs, la déplétion de TMED10 chez la souris est homozygote léthale au stade embryonnaire (Denzel et al. 2000). Ainsi, TMED10 semble jouer un rôle au cours du développement. Enfin, TMED10 est régulé par des modifications post-traductionnelles. En effet, selon les modèles cellulaires TMED10 peut être glycosylé (Osiecka-Iwan et al. 2014). TMED10 dans des cellules humaines possède une demi-vie de trois heures. Les niveaux protéiques de TMED10 sont régulés par sa dégradation au protéasome en réponse à son ubiquitination (S. Liu et al. 2008).
De la même manière que les autres membres de la famille p24, TMED10 forme des hétérodimères. Des expériences de co-immunoprécipitation montrent que TMED10 interagit avec TMED2 dans des cellules CHO (Chinese hamster ovary) (Gommel et al. 1999). Dans les cellules HeLa, il a été montré par co-immunoprécipitation que TMED10 pouvait interagir avec TMED7 (Füllekrug et al. 1999). Enfin, des expériences de purification GST dans des cellules CHO montrent des interactions entre TMED10 et les membres TMED9, TMED5 et TMED2 (Fujita et al. 2011). Pour soutenir la formation d’hétérodimères fonctionnels, il a été montré que l’inhibition de l’expression de TMED10 entraine une réduction des niveaux d’expression de TMED9 et TMED2 et ce, dans des lignées cellulaires pancréatiques (Denzel
et al. 2000). Aussi, la déplétion de TMED10 dans des cellules CHO induit la réduction des niveaux d’expression de TMED9, TMED2 et TMED5 (Zhang et Volchuk 2010). Inversement, des souris mutantes déplétées pour TMED2 montrent des niveaux d’expression de TMED10 réduits (Theiler et al. 2014). La déplétion de TMED10 entraine une réduction des niveaux d’expression des isoformes TMED1, TMED7, et TMED3 (Vetrivel et al. 2007). L’ensemble de ces données suggèrent que TMED10 peut former plusieurs hétérodimères et/ou des tétramères.
Comme les autres protéines de la famille p24, TMED10 est essentiellement localisé au cis-Golgi, au RE et à l’ERGIC (Blum et al. 1999). Des données montrent que la localisation de TMED10 dépend de son domaine superhélice (coil-coiled) intraluminal et des dimères formés avec les différents membres de la famille p24 (Emery et al 2000). Cependant, d’autres résultats montrent que les domaines transmembranaire et cytosolique sont suffisants pour le trafic de TMED10 entre le RE et le Golgi, alors que le domaine intraluminal ne semble pas nécessaire (Blum et Lepier 2008). En revanche, le domaine luminal est nécessaire au transport du Golgi à la membrane plasmique.
Il a été montré que TMED10 forme un complexe avec TMED2 transitant entre le ER et le Golgi. Le complexe TMED10/TMED2 est particulièrement enrichi au niveau de vésicules COPI (Gommel et al. 1999). En effet, le domaine cytosolique de TMED10 interagit avec ARF1 et les sous-complexes B et F du manteau COPI permettant leur recrutement à la membrane du Golgi et régulant ainsi la formation des vésicules COPI (Bremser et al. 1999). De même, TMED10 interagit avec le manteau COPII mais avec une affinité moindre (Dominguez et al. 1998). L’impact de TMED10 ne se limite pas à la formation des vésicules COPI, puisque la perte et la surexpression de TMED10 affectent la structure du Golgi. Par exemple, la surexpression de TMED10, dans des cellules neuronales N2, entraine une
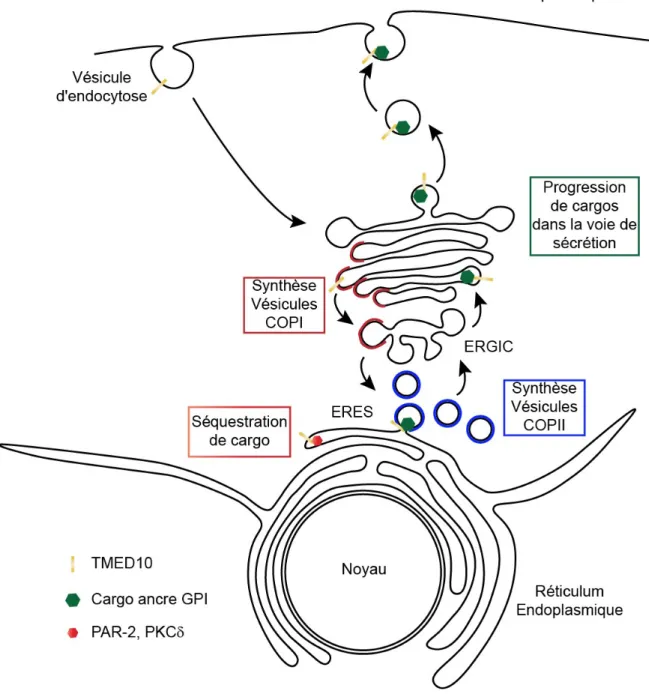
fragmentation du Golgi (Gong et al. 2011). Enfin, TMED10 est impliqué dans le transport de cargos associés à une ancre GPI (Figure 3). L’inhibition de TMED10 dans les cellules CHO induit un retard de transport à la membrane plasmique de la protéine virale VSVG (Vesicular Stomatitis Virus G) seulement lorsque celle-ci est liée à une ancre GPI (Takida et al. 2008). De même, la déplétion de TMED10 entraine des retards de maturation d’autres protéines possédant une ancre GPI telles que DAF (Decay-Accelerating Factor), et CD59 (Takida et al. 2008). Aussi, il a été montré que TMED10 par l’intermédiaire de TMED2 permet la séquestration du récepteur PAR-2 (Protease Activated Receptor 2) au niveau du Golgi lorsque les cellules ne sont pas stimulées (Luo et al. 2011).
Les fonctions de TMED10 ne se limitent pas à la régulation du trafic membranaire entre le RE et le Golgi (Figure 3). Certes, TMED10 est localisé au cis-Golgi mais des sous-populations sont aussi présentes à la membrane des vésicules de sécrétion dans les cellules pancréatiques (Zhang et Volchuk 2010). Ainsi, l’inhibition de TMED10 inhibe la sécrétion d’insuline en réponse à des stimulations en glucose.
Aussi, des évidences montrent que TMED10 est impliqué dans des processus tumorigènes. Suivant les mêmes types de mécanismes moléculaires impliqués dans la rétention de PAR-2 au Golgi, l’interaction de TMED10 avec le domaine C1 de la PKC (Protein Kinase C) favorise la séquestration de celle-ci à des compartiments périnucléaires, et ce, prévenant sa localisation à la membrane plasmique (Wang et al. 2011). La réduction de l’expression de TMED10 par une approche d’ARN (Acide Ribonucléique) interférence (ARNi) a donc pour effet de favoriser l’accumulation de la PKC à la membrane plasmique. De plus, la déplétion de TMED10 est associée à une activation de la PKC et une induction de l’apoptose. Par ailleurs, une étude montre que l’expression de TMED10 est impliquée
TMED10 est principalement localisée entre le réticulum endoplasmique et le Golgi. TMED10 régule la formation de vésicules COPI et COPII. TMED10 est aussi impliquée dans la progression de cargos avec une ancre GPI et est donc présente sur tous les compartiments le long de la voie de sécrétion du réticulum endoplasmique à la membrane plasmique. TMED10 est aussi localisée aux vésicules d’endocytose. Enfin, TMED10 permet la rétention de cargo au réticulum endoplasmique tels que PAR-2 et la PKC
dans l’inhibition de la voie de signalisation mTOR (Xu et al. 2015). La voie mTOR est impliquée dans l’inhibition de l’autophagie et l’induction de la synthèse protéique jouant un rôle dans la croissance cellulaire (Wei et al. 2019). La voie mTOR est suractivée dans la plupart des types de cancer. La réduction de l’expression de TMED10 a pour effet de réduire les niveaux de phosphorylation de mTOR sur la Ser2448 et de S6K sur la Thr389 qui est une cible de mTOR. De plus, la déplétion de TMED10 active la phosphorylation de la AMPK (AMP-activated Protein Kinase) et augmente le ratio LC3-II/LC3-I (Light Chain 3), synonyme d’une induction de l’autophagie (Xu et al. 2015). Finalement, la croissance cellulaire est augmentée lors de la surexpression de TMED10 et inhibée lors de sa déplétion. Ces deux études semblent montrer que TMED10 est impliquée dans l’inhibition de la mort cellulaire et la promotion de la survie et de la croissance. En revanche, TMED10 a aussi pour effet d’inhiber la signalisation TGF- (Transforming Growth Factor ). En effet, le domaine extracellulaire de TMED10 interagit avec les deux récepteurs au TGF de type I (ALK5) et de type II (TRII) (Nakano et al. 2017). L’inhibition de l’association entre ALK5 (Activin Receptor-like Kinase receptor 5) et TRII (Transforming Growth Factor Beta Receptor 2) induite par la surexpression de TMED10 a pour effet d’inhiber la signalisation TGF-. En effet, l’expression du peptide correspondant au domaine cytosolique de TMED10 suffit à inhiber la phosphorylation et l’activité du facteur de transcription Smad2 qui est impliqué dans la signalisation TGF- Finalement, dans des modèles de xénogreffes de cellules cancéreuses JygMC dont la croissance dépend de la voie TGF-, la surexpression de TMED10 a pour effet de réduire la taille de la tumeur (Nakano et al. 2017). Dans ce même contexte la déplétion de TMED10 induit la croissance des tumeurs. Selon le contexte
cellulaire TMED10 semble avoir des effets ambivalents concernant la régulation de la survie et de la croissance cellulaire.
De plus, TMED10 semble jouer un rôle dans le développement de la maladie d’Alzheimer (Shin et al. 2019). Le premier indice vient de l’observation que l’expression de TMED10 est fortement réduite dans le cerveau des personnes atteintes de la maladie d’Alzheimer (Shin et al. 2019) alors que l’expression de TMED10 diminue dans le cerveau au cours du vieillissement (Vetrivel et al. 2008). L’un des symptômes de la maladie d’Alzheimer est l’accumulation de plaques d’amyloïdes- L’amyloïde- est formé par le clivage successif de la protéine APP (Amyloid Beta Precursor Protein) par la - et la -sécrétase (Selkoe 2001). Ainsi des études montrent que l’inhibition de TMED10 favorise la stabilité et la sécrétion de l’APP ainsi que l’augmentation de la phosphorylation de l’APP favorisant le clivage par la -sécrétase. Ceci ayant pour résultat une accumulation des amyloïde et dans des neuroblastomes (Pardossi-Piquard et al. 2009). Enfin, La déplétion de TMED10 induit l’autophagie. TMED10 interagit avec ATG4B (Autophagy Related 4A) qui est impliqué dans le clivage de LC3. Lors de carence, l’interaction entre TMED10 et ATG4B est inhibée, ce qui a pour effet d’induire le clivage de LC3 et d’activer l’autophagie. Or, l’autophagie a un rôle protecteur dans la maladie d’Alzheimer car elle permet la dégradation de l’amyloïde- (Li et al. 2017) Ici aussi, le rôle de TMED10 dans le développement de cette pathologie semble complexe. D’une part, son expression semble prévenir l’accumulation des amyloïde et et d’autre part TMED10 semble inhiber l’autophagie.
Pour résumer, TMED10 est un membre de la famille p24 qui joue un rôle essentiel dans la voie de sécrétion et semble être impliquée dans chacune des étapes, du trafic de protéines du RE à la membrane plasmique (Figure 3). Enfin, TMED10 joue un rôle particulier
dans la formation de vésicules COPI et COPII. Par son domaine intraluminal TMED10 est impliquée dans la régulation de plusieurs voies de signalisation en jouant sur la séquestration et la sécrétion de différents cargos. De plus, son domaine cytosolique a aussi la capacité de réguler des voies de signalisation par interaction directe avec des récepteurs membranaires. Ainsi, TMED10 joue des rôles importants dans la régulation des processus tumorigènes en modulant l’activité des voies mTOR, TGF-, PKC et de l’autophagie. Enfin, TMED10 est importante dans le développement de la maladie d’Alzheimer. En revanche, les mécanismes moléculaires impliqués dans le recrutement de TMED10 en amont de la formation des vésicules COPI et COPII, et en particulier ceux impliqués dans le triage de la sous population présente à la membrane plasmique sont méconnus.
1.2 La voie d’endocytose
1.2.1 Rôles de l’endocytose
Le trafic endosomal permet l’internalisation et le transport vésiculaire de macromolécules issues du milieu extracellulaire et de protéines présentes à la membrane plasmique vers l’ensemble des compartiments cellulaires (Elkin et al. 2016). En effet, l’invagination de la membrane plasmique et la formation de vésicules permet de capturer et de transporter des cargos au sein de sphères lipidiques appelées vésicules d’endocytose (Roth et Porter 1964). Les vésicules nouvellement formées sont alors transportées et incorporées par fusion des membranes aux endosomes précoces (Helenius et al. 1983). Les endosomes précoces peuvent aussi fusionner entre eux, maturer et finalement fusionner avec les lysosomes (Huotari et Helenius 2011; Luzio et al. 2000). Une fois aux endosomes précoces, les cargos, en fonction des besoins cellulaires, sont triés vers les différents organites
transportés au réseau transgolgien ou encore triés vers la dégradation lysosomale (Elkin et al. 2016). L’intégrité du trafic endosomal joue un rôle essentiel dans l’homéostasie membranaire et dans la régulation de nombreuses voies de signalisation (Blazek et al. 2015; Lobingier et von Zastrow 2019). Ce trafic est extrêmement complexe et hautement régulé. De nombreux complexes protéiques ainsi que différentes classes de lipides sont coordonnés afin d’assurer le maintien du trafic endosomal (Lodish et al. 2000; Blazek et al. 2015). Il existe plusieurs types d’endocytose avec chacune ses spécificités (Mayor et al. 2014; Kaksonen et Roux 2018). Le type d’endocytose influence aussi le destin des cargos endocytés.
1.2.1.1 Endocytose clathrine dépendante
Le type d’endocytose la plus étudiée est l’endocytose clathrine dépendante (Figure 4), appelée ainsi en raison du manteau de clathrine présent à la surface de ces vésicules (McMahon and Boucrot 2011). Les vésicules de clathrine sont formées soit de manière aléatoire à la membrane plasmique soit de manière induite. En effet, l’activation de récepteurs couplés aux protéines G (RCPG) ou des récepteurs à activité tyrosine kinase (RTK) peut induire l’endocytose (Goh et Sorkin 2013; Pavlos et Friedman 2017). L’endocytose peut être découpée en plusieurs étapes successives : l’initiation, la sélection des cargos, la croissance, la fission et enfin le relargage du manteau (Gallon et Cullen 2015; Kaksonen et Roux 2018; Jackson 2014). L’initiation se fait par le recrutement de protéines adaptatrices telles que AP2 (adaptor protein 2), FCHO1/2 (FCH domain only 1/2) qui interagissent avec des récepteurs à la membrane plasmique ainsi qu’avec le PI(4,5)P2 (Henne et al. 2010).
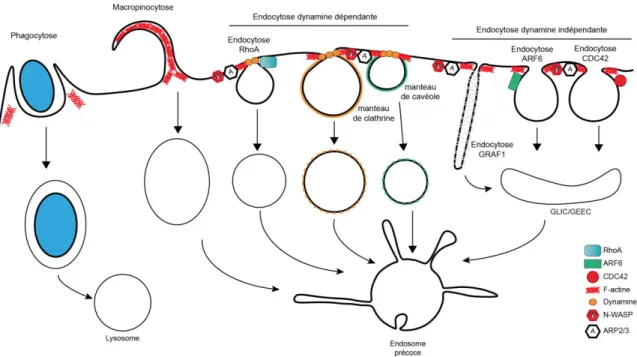
Les différents types d’endocytose peuvent être classés selon la taille des vésicules, le type de manteau et les mécanismes moléculaires impliqués. La phagocytose permet à la cellule d’internaliser des agents pathogènes et de les dégrader par la voie lysosomale. La macropinocytose permet la capture de composants extracellulaires par l’extension de la membrane plasmique. Ces deux types d’endocytose forment des vésicules de l’ordre de 1m. Il existe les endocytoses impliquant la dynamine. Parmi ces endocytoses, on distingue les vésicules qui arborent soit un manteau de clathrine (120 m) soit de cavéolines (60 m) ou qui dépendent de RhoA (90 m). Enfin, il existe trois types d’endocytose qui ne dépendent pas de la dynamine mais de GRAF1, ARF6 ou CDC42, formant des vésicules de l’ordre de 90 m. Tout type d’endocytose dépend de la polymérisation d’actine par les complexes N-WASP et ARP2/3. Enfin, toutes les vésicules formées vont fusionner avec les endosomes précoces. Les structures CLIC/GEEC (Clathrin-Independent Carriers/ GPI-AP-enriched early endosomal compartments) résultent de la fusion des vésicules d’endocytoses indépendantes de la clathrine et de la dynamine.
Les protéines adaptatrices recrutent ensuite la clathrine. De la même manière que pour les vésicules COPI et COPII, l’assemblage de clathrine induit une courbure de la membrane plasmique et le bourgeonnement de la vésicule (Ungewickell et Hinrichsen 2007). La sélection des cargos se fait via l’interaction entre le domaine cytosolique de protéines transmembranaires et les protéines adaptatrices présentes dans le manteau telles que les Epsines et le complexe AP-2 (Kazazic et al. 2009; Jackson et al. 2003). Les mécanismes de
croissance et de fission sont régulés par le recrutement du complexe WASP (Wiskott–Aldrich Syndrome protein) qui médie la polymérisation d’active via ARP2/3 (Actin Related Protein 2/3) (Alekhina, et al. 2017). La polymérisation d’actine va induire une tension qui favorise le détachement de la vésicule d’endocytose. La fission est modulée par l’action de la dynamine qui étrangle la membrane de la vésicule à sa base en formant un tubule étroit et permettant le détachement de la vésicule (Antonny et al. 2016). Enfin, le manteau de clathrine se détache par l’effet de HSC70-4 (Heat Shock Protein Family A (Hsp70) Member 4) qui interagit avec le manteau de clathrine et déstabilise l’intégrité du maillage (Xing et al. 2010).
1.2.1.2 Endocytose cavéoline dépendante
La clathrine n’est pas le seul type de manteau impliqué dans la voie d’endocytose (Figure 4). Il existe plusieurs endocytoses indépendantes des clathrines, dont l’endocytose dépendante des cavéolines (Pelkmans et Helenius 2002). Les cavéolines sont des protéines ancrées et adressées à la membrane plasmique via la voie de sécrétion décrite précédemment. Les cavéolines arborent une structure avec un domaine cytosolique tige-boucle (Stan 2005). Les cavéolines recrutent les cavines, protéines qui participent à la formation du manteau et l’induction des courbures de la membrane (Hill et al. 2008). Les cavéolines ont la spécificité d’être enrichies aux niveaux de radeaux lipidiques, et peuvent interagir avec le cholestérol (Lajoie et Nabi 2010). Il a été montré que les cavéolines sont impliquées dans l’internalisation des glycosphingolipides et d’acides gras au sein de la cellule (Örtegren et al. 2004). Par ailleurs, le domaine cytosolique des cavéolines peut jouer le rôle de plateforme de signalisation indépendamment de leur rôle dans l’endocytose (Martinez-Outschoorn et al. 2015). De la même manière que pour l’endocytose dépendante de la clathrine, l’endocytose
via les cavéolines nécessite l’intervention de la dynamine, et de la polymérisation d’actine afin d’induire le détachement de la vésicule (Henley et al. 1998).
1.2.1.3 Endocytose clathrine et cavéoline indépendante
L’endocytose clathrine et cavéoline indépendantes peut être classifiée en sous-catégories selon la taille des vésicules mais aussi l’intervention de la dynamine (Mayor et al. 2014). Les endocytoses permettant l’internalisation de larges structures membranaires, supérieures à 200 nm, sont la macropinocytose et la phagocytose (Lim et Gleeson 2011), (Flannagan et al. 2012). Ces types d’endocytose utilisent des machineries communes aux autres classes, et en particulier le réarrangement du cytosquelette d’actine pour remodeler la membrane plasmique (Figure 4). Les endocytoses dépendantes de la dynamine sont caractérisées par le type de cargos endocytés. Par exemple, l’accumulation du récepteur à l’interleukine II dans des radeaux lipidiques permet l’activation de RhoA (Ras homolog gene family A) puis Rac1 (Ras-related C3 botulinum toxin substrate 1) qui induit le recrutement du complexe N-WASP et ARP2/3 (Lamaze et al. 2001). La polymérisation d’actine facilite alors l’internalisation du récepteur de l’interleukine. L’internalisation de ces cargos se produit par leur accumulation dans des domaines membranaires riches en cholestérol, ce qui induit l’internalisation de ceux-ci via la formation de vésicules sous l’effet du complexe N-WASP et de RhoA (Liu et al. 2009). Il existe ensuite les voies d’endocytose ne dépendant ni de la clathrine ni de la dynamine (Figure 4). Ces voies sont associées à des structures riches en protéines possédant une ancre GPI (Elkin et al. 2016). Des vésicules ou des tubules d’endocytose émergent de la membrane plasmique sans protéine de manteau, structures appelées CLIC (Clathrin-Independent Carriers), fusionnent ensemble et forment des
endocytoses clathrine indépendantes, CLIC et GEEC, sont nommées CG. Cette endocytose est induite par l’activation à la membrane plasmique d’ARF1 par GBF1 (Monetta et al. 2007). ARF1 activée, elle recrute ARHGAP10 (Rho GTPase Activating Protein 10), un inhibiteur de CDC42 (Cell Division Cycle 42) (Kumari et Mayor 2008). Cela permet de maintenir CDC42 dans son cycle d’activation, et donc de permettre la polymérisation d’actine à la membrane plasmique. Une autre protéine importante pour cette endocytose est GRAF1 (GTPase Regulator Associated with Focal Adhesion Kinase 1) qui détient un domaine BAR pouvant induire des courbures de la membrane plasmique (Hansen et Nichols 2009). Les cargos endocytés via la voie CG (CLIC/GEEC) sont principalement des protéines avec des ancres GPI mais aussi des protéines transmembranaires telles que CD44 (Howes et al. 2010). Il existe aussi l’endocytose ARF6 (ADP ribosylation factor 6) qui est clathrine et dynamine indépendante (Figure 4). Elle possède beaucoup de similitudes avec la voie CG à la différence qu’ici le rôle de ARF6 est essentiel (Radhakrishna et Donaldson 1997). Comme pour la voie CG, les cargos internalisés par la voie ARF6 sont des protéines possédant une ancre GPI mais aussi des protéines transmembranaires telles que CD44, GLUT1 (Glucose Transporter 1), CD98, Basigin (CD147) ou encore des protéines de l’immunité comme CD1a (Eyster et al. 2009).
Il existe donc de nombreuses catégories d’endocytose faisant intervenir différents complexes protéiques régulant la formation des vésicules d’endocytose, leur scission et leur transport. Chacune de ces voies semble associée à la sélection de cargos spécifiques même si certains sont communs à plusieurs voies. L’un des points communs à toute endocytose est le rôle essentiel dans la courbure de la membrane plasmique et les tensions générées induites par la polymérisation de l’actine. L’autre point commun est que l’ensemble des vésicules d’endocytose fusionnent avec les endosomes précoces.
1.2.1.4 Endosomes précoces : gares de triage
Les endosomes précoces sont des structures membranaires composées essentiellement de PI(3)P, mais la présence de PI(4,5)P2, PI(3,4)P2 et de PI(4)P y est aussi détectée (Vicinanza et al. 2008). L’ensemble du contenu vésiculaire issu de l’endocytose converge vers les endosomes précoces et fusionne avec ceux-ci (Eisenberg-Bord et al. 2016). Avant de fusionner, les vésicules d’endocytoses doivent se maintenir à proximité l’une de l’autre afin de stabiliser les complexes de fusion des membranes (Cruz et Kim 2019). EEA1 (Early Endosome Antigen 1) est l’une des principales protéines d’ancrage médiant la fusion des vésicules d’endocytose (Christoforidis et al. 1999). La présence de SNARE à la surface des endosomes régule la fusion des vésicules d’endocytose avec les endosomes précoces. En effet, la présence de quatre SNARE, soit Qa, Qb, Qc et R-SNARE permet la formation d’un complexe stable qui induit la fusion de deux membranes lipidiques (Südhof et Rothman 2009). Il a aussi été montré que les endosomes précoces peuvent fusionner entre eux, fusion dite homotypique, ou avec des endosomes de recyclage (ER), fusion dite hétérotypique (Cruz et Kim 2019). Chacun de ces évènements est médié par l’action de SNARE telles que la STX13 (Syntaxin 13) ou VAMP4 (Vesicle Associated Membrane Protein 4) (Skalski et al. 2010). Aussi, il a été montré que les dynéines, protéines motrices, permettent le transport des endosomes précoces le long des microtubules vers des régions périnucléaires, appelées centres des endosomes de recyclage (Driskell et al. 2007). Ce mécanisme induit la transition des endosomes précoces en endosomes de recyclage. De la même manière, les endosomes précoces peuvent évoluer en endosomes tardifs et enfin fusionner avec les lysosomes (Huotari et Helenius 2011). Les endosomes précoces sont donc des organites extrêmement
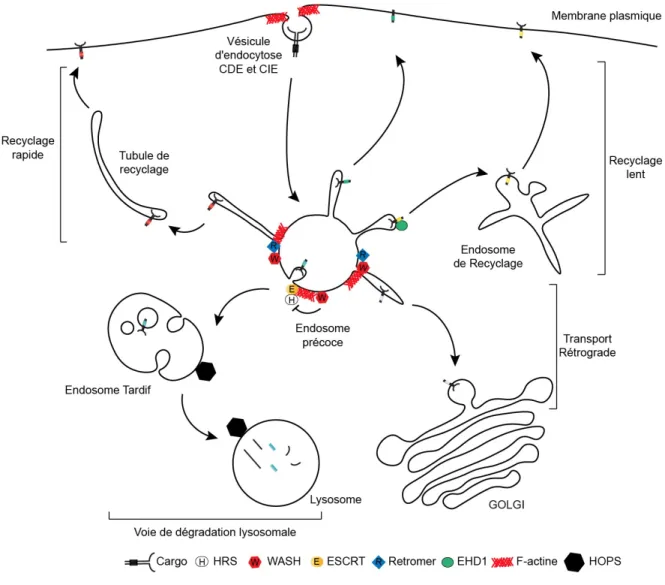
Figure 5 : L’endosome précoce, centrale de triage
L’endosome précoce représente le point névralgique de la voie endosomale. Les cargos endocytés vont transiter par l’endosome précoce ou ils seront redirigés vers le recyclage ou la dégradation. Les cargos recyclés sont triés via la formation des tubules endosomaux qui émergent de manière spontanée ou de façon régulée par les complexes WASH ou Retromère. Les cargos sont triés soit directement à la membrane plasmique soit au Golgi ou aux endosomes de recyclage. EHD1 permet la sélection des cargos pour le triage vers les endosomes de recyclages. Le complexe ESCRT, contenant la protéine HRS, permet l’internalisation de cargos au sein de microvésicules et ainsi la maturation de l’endosome précoce en endosome tardif. Le complexe HOPS permet la fusion de l’endosome tardif avec les lysosomes et donc la dégradation de son contenu.
En effet, de nombreux complexes protéiques permettent de moduler la morphologie de l’endosome précoce et génèrent des microdomaines nécessaires au triage de cargos spécifiques (van Weering et al. 2012). Ainsi, c’est aux endosomes précoces qu’est décidé le destin des cargos endocytés. Les cargos transitant par les endosomes précoces peuvent être triés soit vers la dégradation lysosomale, soit recyclés vers le réseau transgolgien via le transport rétrograde ou encore recyclés à la membrane plasmique (Figure 5). Chaque voie de triage mobilise des complexes protéiques spécifiques, et possède ses particularités.
1.2.1.5 Dégradation lysosomale
Tout d’abord, le triage vers la dégradation lysosomale s’effectue par la reconnaissance de cargos ubiquitinylés. Les motifs ubiquitinylés présents sur la partie cytosolique des cargos endocytés sont reconnus par le motif UIM (Ubiquitin Interacting Motif) de la protéine HRS (Hepatocyte growth factor-Regulated tyrosine kinase Substrate) (Shih et al. 2002). HRS interagit aussi avec la clathrine formant ainsi des microdomaines spécifiques. Enfin, HRS recrute les membres du complexe ESCRT-I (Endosomal Sorting Complex Required for Transport) lequel recrute successivement ESCRT-II et -III. Les complexes ESCRT ont pour effet de générer des invaginations membranaires formant ce qu’on appelle des corps multivésiculaires (MVB; Multivesivular Body) (Williams et Urbé 2007). La maturation des MVB conduit au recrutement du complexe HOPS (Homotypic Fusion and Protein Sorting) qui comporte des SNARE permettant de médier la fusion avec les lysosomes (Spang 2016). Enfin, les cargos sont dégradés par les enzymes lysosomales (Piper et Katzmann 2007). Le transport rétrograde des endosomes précoces vers le réseau transgolgien permet de connecter la voie d’endocytose avec la voie de sécrétion et de réinjecter les cargos endocytés dans la
1.2.1.6 Recyclage endosomal
Les cargos endocytés, en fonction des besoins de la cellule, peuvent être recyclés directement à la membrane plasmique. On dissocie deux types de recyclage endosomal. Un recyclage, dit lent, qui nécessite le passage des cargos via les endosomes de recyclage ou le recyclage, dit rapide, qui permet un retour direct des cargos de l’endosome précoce à la membrane plasmique via la formation de tubules de recyclage (Naslavsky et Caplan 2018). Le recyclage de type lent correspond au transit de cargos via les endosomes de recyclage (Figure 5). Les endosomes de recyclage sont des structures tubulaires et vésiculaires qui s’accumulent dans des régions périnucléaires au niveau du centre d’organisation des microtubules (Taguchi 2013). Les cargos sont majoritairement issus des endosomes précoces mais des évidences montrent qu’il existe des échanges directs entre le Golgi, la membrane plasmique et les endosomes de recyclage. La famille des protéines EHD (EH Domain Containing) est fortement liée aux endosomes de recyclage. Les protéines EHD sont caractérisées par la présence d’un domaine EH, en C-terminal, impliqué dans des interactions protéine-protéine (Naslavsky et Caplan 2011). La protéine EHD1 est considérée comme des ciseaux qui permettent la fission de tubules ou vésicules formées aux endosomes précoces. De plus, EHD1 interagit avec les protéines MICAL-L1 (Microtubule Associated Monooxygenase, Calponin And LIM Domain Containing 1-Like 1) et CRMP2 (Collapsin response mediator protein-2) régulant le transport, des endosomes précoces vers les endosomes de recyclages, de vésicules le long des microtubules et ce, via le contrôle des dynéines (Naslavsky et Caplan 2018). Aussi, EHD3 permet de stabiliser les tubules de recyclages au niveau des endosomes de recyclage en interagissant avec MICAL-L1, protéine
qui possède un domaine BAR pouvant induire des courbures de la membrane (Bahl et al. 2016).
Le recyclage de cargos des endosomes précoces à la membrane plasmique nécessite deux évènements essentiels : la reconnaissance du cargo et la formation de tubules de recyclage qui permettent d’isoler les cargos recyclés au sein de structures spécifiques du reste de l’endosome précoce (Van Weering et al. 2012). De nombreux complexes et protéines peuvent sélectionner des cargos et induire leur recyclage rapide. Les SNX ont la capacité d’être recrutées aux endosomes précoces via l’interaction entre leur domaine PX et le PI(3)P composant la membrane des endosomes précoces (Van Weering, et al. 2012). En revanche, les SNX ont aussi la capacité d’interagir directement avec certains cargos. Ainsi, SNX17 est impliquée dans le recyclage de l’intégrine 5 et autres protéines avec un domaine FERM (Steinberg et al. 2012). De plus, SNX17 interagit avec le domaine cytosolique de LRP1 (Lipoprotein Receptor-Related Protein 1) (Donoso et al. 2009). D’autres protéines que les SNX sont aussi impliquées dans des évènements de recyclage. Par exemple, la protéine ACAP1 (ArfGAP With Coiled-Coil, Ankyrin Repeat And PH Domains 1) interagit avec les domaines cytosoliques du récepteur à la transferrine (TfR), de GLUT4, et des intégrines régulant leur triage vers la membrane plasmique (J. Li et al. 2007). Enfin, les trois complexes CCC, Retriever et Retromer agissent en concert avec les SNX pour réguler le recyclage de cargos spécifiques (McNally et Cullen 2018). En effet, le Retriever, composé des sous unités VPS29, VPS35L et VPS26C interagit avec SNX17 et régule le recyclage de l’intégrine 1. Aussi le complexe CCC interagit avec la sous unité VPS35L du Retriever et régule le recyclage de récepteurs aux lipoprotéines à faible densité (McNally et al. 2017).