THÈSE
Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR de médecine et de pharmacie
Institut de chimie des milieux et matériaux de Poitiers - IC2MP (Diplôme National - Arrêté du 25 mai 2016)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Santé-Environnement
Présentée par :
Claire Grignon
Toxicocinétique en santé environnementale : application à la mesure de l'exposition aux perturbateurs endocriniens
Directeur(s) de Thèse : Antoine Dupuis, Nicolas Venisse Soutenue le 12 décembre 2016 devant le jury Jury :
Président Franck Saint-Marcoux Professeur et praticien hospitalier, Université de Limoges
Rapporteur Pascal Le Corre Professeur, Université de Rennes
Rapporteur Valerie Sautou Professeure et praticienne, Université de Clermont-Ferrand
Membre Antoine Dupuis Maître de conférences et praticien, Université de Poitiers
Membre Nicolas Venisse Praticien hospitalier, CHU de Poitiers
Membre Nicolas Simon Maître de conférences, Université de Lille
Pour citer cette thèse :
Claire Grignon. Toxicocinétique en santé environnementale : application à la mesure de l'exposition aux
perturbateurs endocriniens [En ligne]. Thèse Santé-Environnement. Poitiers : Université de Poitiers, 2016.
THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS (Faculté de Médecine et de Pharmacie) (Diplôme National - Arrêté du 7 août 2006)
Ecole Doctorale : Sciences pour l’environnement Gay Lussac Secteur de Recherche : Santé-Environnement
Présentée par : Claire GRIGNON
************************
Toxicocinétique en Santé Environnementale :
Application à la mesure de l’exposition aux Perturbateurs Endocriniens
************************
Directeur de Thèse : Dr Antoine DUPUIS Co-Directeur de Thèse : Dr Nicolas VENISSE
************************ Soutenance prévue le 12 Décembre 2016
devant la Commission d’Examen
************************
Exemplaire final avant soutenance
JURY
Dr Antoine DUPUIS Maître de Conférence (Université de Poitiers) Directeur Pr Pascal LE CORRE Professeur (Université de Rennes) Rapporteur Pr Franck SAINT-MARCOUX Professeur (Université de Limoges) Examinateur Pr Valérie SAUTOU Professeur (Université de Clermont-Ferrand) Rapporteur Dr Nicolas SIMON Maître de Conférence (Université de Lille) Examinateur Dr Nicolas VENISSE Praticien Hospitalier (CHU de Poitiers) Co-directeur
REMERCIEMENTS
A Madame le Professeur Valérie SAUTOU,
Je suis très honorée que vous ayez accepté de juger ce travail et d’en être le rapporteur. Vos connaissances et activités dans le domaine des perturbateurs endocriniens et de l’analyse font toute mon admiration. Vos remarques me fourniront assurément des éléments pour améliorer ma réflexion.
A Monsieur le Professeur Pascal LE CORRE,
Je suis très honorée que vous ayez accepté de juger ce travail et d’en être le rapporteur. Vos connaissances et activités dans le domaine de la santé environnementale et de la pharmacocinétique apporteront un jugement pertinent pour l’évaluation de cette thèse. C’est avec beaucoup d’intérêt que je prendrai connaissance de vos commentaires et critiques.
A Monsieur le Professeur Franck SAINT-MARCOUX,
Je suis très honorée de vous compter parmi les membres de mon jury et vous suis reconnaissante de l’intérêt que vous avez porté à ce travail.
A Monsieur le Docteur Nicolas SIMON,
Je suis très honorée que vous ayez accepté de participer à ce jury et d’avoir accepté de juger ce travail.
A Monsieur le Docteur Nicolas VENISSE,
Je te remercie pour ton encadrement tout au long de cette thèse. Merci pour ta disponibilité, ta gentillesse, ton aide et ton soutien tant sur le plan professionnel que personnel. Merci pour tes « on va y arriver ». Je ne pouvais espérer meilleur directeur de thèse. Trouve ici le témoignage de ma profonde reconnaissance.
A Monsieur le Docteur Antoine DUPUIS,
Difficile pour moi de synthétiser en quelques lignes toute la reconnaissance que j’éprouve à ton égard pour m’avoir proposé ce sujet et guidé tout au long de ce travail de thèse (et bien plus encore). Merci de l’opportunité que tu me donnes de faire des choses qui me passionnent à la pharmacie comme en recherche. Travailler à tes côtés est toujours enrichissant et stimulant.
Ce travail est le résultat d’un travail d’équipe,
Merci à Virginie Migeot pour le dynamisme, l’optimisme et la motivation que tu portes au développement de notre équipe.
Merci à Pascal Carato et Manon Doumas pour votre travail sur la synthèse des dérivés conjugués du BPA et des ClxBPA.
Merci à Marion Albouy-Llatty pour ton travail dans la constitution des cohortes, pour tes idées et ton optimisme.
Merci à Laurence Barrier et Sabrina Ingrand pour votre aide dans le travail sur le métabolisme.
Merci à Pascale Pierre-Eugène pour ton aide dans la préparation et la réalisation des manips.
Merci à Maxime Condylis, Amélie Cant, Camille Rochais et Frédérike Limousi pour votre aide précieuse dans la réalisation de ce travail.
Merci à Astrid Bacle, Sarah Thévenot, Sylvie Rabouan et Steeve Rouillon.
Je remercie Monsieur le Professeur Guilhot d’avoir accueilli notre équipe au sein du CIC.
Je remercie également toutes les personnes qui par leur aide, leur soutien, ou leur présence ont permis la réalisation de ce travail,
Merci à Jérémy Lelong pour tes précieux conseils, ton aide, ta bonne humeur et ton immense disponibilité. J’espère que l’on travaillera encore longtemps ensemble. Même si les
papaillons ont disparu, il reste le petit escargot…
Merci à Patrick Mura pour votre soutien sans faille depuis tant d’années.
Merci à l’équipe du laboratoire de pharmacocinétique et toxicologie de m’accueillir dans leur laboratoire.
Merci à Joëlle Faucher-Grassin, et Mathieu Bay pour la confiance que vous m’avez portée jusqu’à présent.
Merci Karine, pour m’avoir transmis l’envie d’aller au fond des choses et pour nos petits cafés.
Merci aux internes qui ont défilés en pharmacotechnie : Karen Waton, Elise Clavier, Marine Dermu, Jean-Baptiste Monteil, Vivien Pigeon, Fanny Durand, Mérédith Boutet, Guillaume Binson.
Merci à mes parents et à mon frère. Merci à ma famille et à ma belle famille. Merci à mes amis.
Merci à Cécile d’être toujours là quand il le faut après tant d’années.
Et bien sûr, merci à toi, Bertrand, d’être là. Merci pour ton aide, ton soutien, ta présence, ton amour. Ta force et ta détermination à aller mieux m’ont permis d’entamer cette dernière ligne droite avec sérénité et même parfois avec joie…
9
SOMMAIRE
LISTE DES ABREVIATIONS ET ACRONYMES 15
LISTE DES FIGURES 17
LISTE DES TABLEAUX 19
INTRODUCTION 21
1ère PARTIE : SYNTHESE BIBLIOGRAPHIQUE 25
CHAPITRE I : LA SANTE ENVIRONNEMENTALE 27
I.1. Définition 27
I.2. Historique 28
II.3. Santé environnementale : de la recherche à la réglementation 29 I.4. Expologie et méthodes d’estimation de l’exposition humaine 31
CHAPITRE II : LES PERTURBATEURS ENDOCRINIENS 33
II.1. Généralités 33
II.1.A. Définition 33
II.1.B. Classification 33
II.1.C. Mécanisme d’action 34
II.1.D. Présence dans l’environnement 37
II.1.E. Courbe dose effet non monotone 38
II.1.F. Effet cocktail 39
II.2. Le BPA 39
II.2.A. Propriétés physico-chimiques 39
II.2.B. Sources, réglementations et présence dans l’environnement 40 II.2.C. Exposition de la population générale 44
II.2.D. Mécanisme d’action et toxicité 45
II.2.D.a. Mécanisme d’action 45
II.2.D.b. Toxicité 46
II.3. Les dérivés chlorés du BPA 50
II.3.A. Formation et propriétés physico-chimiques 50 II.3.B. Présence dans l’environnement et exposition de la population
10
II.3.C. Mécanisme d’action et toxicité 53
CHAPITRE III : TOXICOCINETIQUE ET BIOMONITORING 55
III.1. Toxicocinétique 55 III.1.A. Généralités 55 III.1.A.a. Absorption 55 III.1.A.b. Distribution 57 III.1.A.c. Métabolisme 58 III.1.A.d. Elimination 63
III.1.B. Toxicocinétique du BPA 65
III.1.B.a. Absorption 65
III.1.B.b. Distribution 66
III.1.B.c. Métabolisme 66
III.1.B.d. Elimination 70
III.1.B.e. Passage fœto-placentaire 71
III.1.C. Toxicocinétique des dérivés chlorés du BPA 72
III.2. Biomonitoring 74
III.2.A. Généralités 74
III.2.A.a. Matrices 75
III.2.A.b. Biomarqueurs 76
III.2.A.c. Méthodes analytiques 76
III.2.A.d. Valeurs de référence 78
III.2.A.e. Utilisations et limites du biomonitoring 91
III.2.B. Biomonitoring du BPA 93
III.2.B.a. Biomonitoring dans l’urine 96
III.2.B.b. Biomonitoring dans le sang 101
III.2.B.c. Biomonitoring dans le lait maternel et le colostrum 102 III.B.2.d. Biomonitoring dans le tissu adipeux 103 III.B.2.e. Biomonitoring dans le placenta, le sang de cordon et le
Méconium 104
III.2.B.f. Biomonitoring dans les matrices alternatives 105
III.2.C. Biomonitoring des dérivés chlorés du BPA 107
11
2ème PARTIE : METHODES ANALYTIQUES POUR LA MESURE D’UN
PERTURBATEUR ENDOCRINIEN 113
CHAPITRE I : VALIDATION D’UNE METHODE ANALYTIQUE 115
I.1. Séléctivité et spécificité 116
I.2. Linéarité 117
I.3. Limite de quantification basse (LLOQ) 117
I.4. Limite de quantification haute (ULOQ) 118
I.5. Limite de détection (LOD) 118
I.6. Justesse 119
I.7. Fidélité 119
I.8. Robustesse 120
I.9. Stabilité 121
I.10. Effet matrice 121
I.11. Autres critères 122
CHAPITRE II : PARTICULARITES DE LA MESURE D’UN
PERTURBATEUR ENDOCRINIEN A L’ETAT DE TRACES 124
II.1. Détermination de la LLOQ et de la LOD 124
II. 2. Traitement des données <LOD et <LLOQ 127
II.3. Précautions contre les contaminations 128
II.4. Présence des PE dans les matrices blanches 129
II.5. Effet matrice 130
II.6. Stabilité des analytes 133
CHAPITRE III : METHODE D’ANALYSE DU BPA ET DE SES
DERIVES CHLORES DANS L’URINE 135
Quantification du bisphénol A et de ses dérivés chlorés dans l'urine humaine
par UPLC-MS/MS 135
Résumé 135
Reliable quantification of bisphenol A and its chlorinated derivatives in
human urine using UPLC-MS/MS method 136
Abstract 136
III.1. Introduction 137
12
III.2.A. Chemicals and reagents 139
III.2.B. Preparation of reagent and standard solutions 140
III.2.C. Sample preparation 141
III.2.D. UPLC-MS/MS analysis 141
III.2.E. Method validation 142
III.2.F. Method application 144
III.3. Results and discussion 144
III.4. Conclusion 154
References 154
CHAPITRE IV : OPTIMISATION D’UNE METHODE D’ANALYSE DU BPA
ET DE SES DERIVES CHLORES DANS L’URINE 157
Détermination rapide et ultrasensible du bisphénol A et de ses dérivés chlorés
dans l'urine par UPLC-MS/MS 157
Résumé 157
Ultra-sensitive determination of bisphenol A and its chlorinated derivatives in
urine using a high throughput UPLC-MS/MS method 158
Abstract 158
IV.1. Introduction 159
IV.2. Materials end methods 160
IV.2.A. Chemicals and reagents 160
IV.2.B. Preparation of reagents and standard solutions 161 IV.2.C. Preparation of calibration standards and quality controls 161 IV.2.D. Online SPE and UPLC-MS/MS conditions 164
IV.2.E. Method validation 164
IV.2.F. Method application 165
IV.3. Results and discussion 165
IV.4. Conclusion 171
References 171
CHAPITRE V : MESURES DU BPA ET DE SES DERIVES CHLORES
DANS LES URINES DE FEMMES ENCEINTES 175
V.1. Introduction 175
V.2. Materiel et méthodes 177
13
V.2.B. Ajustement à la créatinine urinaire 178
V.3. Résultats 178
V.3.A. Dosage du BPA et des ClxBPA dans les urines 178
V.3.B. Ajustement à la créatinine urinaire 181
V.4. Discussion 183
IV.5. Conclusion 184
3ème PARTIE III : ETUDE DU METABOLISME DES
PERTURBATEURS ENDOCRINIENS 187
CHAPITRE I : METHODE INDIRECTE (DECONJUGAISON) 194
Validation d'un marqueur pour l'évaluation de la déconjugaison des métabolites
de phase II analysé par LC-MS/MS dans les matrices biologiques 196
Résumé 196
Validation of a probe for assessing deconjugation of phase II metabolites
assayed through LC-MS/MS in biological matrices 197
Abstract 197
I.1. Introduction 198
I.2. Materials and methods 199
I.2.A. Chemicals and reagents 199
I.2.B. Monitoring deconjugation efficiency 200
I.2.C. Standard and quality control sample preparation 201 I.2.C.a. Preparation of reagent and standard solutions 201
I.2.C.b. Urine samples 201
I.2.C.c. Plasma samples 202
I.2.D. LC-MS/MS conditions 202
I.2.E. Method validation 203
I.2.F. Method application 204
I.2.F.a. Urine samples 204
I.2.F.b. Plasma samples 204
I.3. Results and discussion 204
I.3.A. Monitoring deconjugation efficiency 204
I.3.B. Sample preparation 205
I.3.C. Method validation 205
14
I.4. Conclusion 209
References 210
CHAPITRE II : METHODE DIRECTE 214
Qunatification des formes conjuguées du bisphénol A et de ses dérivés chlorés
dans l’urine par LC-MS/MS 215
Résumé 215
Quantification of conjugated forms of bisphenol A and dichlorobisphenol A in
human urine using LC-MS/MS method 216
Abstract 216
II.1. Introduction 217
II.2. Materials and methods 219
II.2.A. Chemicals and reagents 219
II.2.B. Preparation of reagents and standard solutions 220 II.2.C. Preparation of calibration standards and quality control 220
II.2.D. Online SPE and LC-MS/MS analysis 221
II.2.E. Method validation 222
II.2.F. Method application 223
II.3. Results and discussion 223
II.3.A. Method validation 223
II.3.B. Method application 227
II.4. Conclusion 228 References 231 DISCUSSION GENERALE 235 CONCLUSION 247 REFERENCES BIBLIOGRAPHIQUES 249 RESUMES DE LA THESE 279
15
LISTE DES ABREVIATIONS ET ACRONYMES
ADI : Acceptable Daily Intake
AFSSET : Agence Française de Sécurité Sanitaire de l’Environnement et du Travail ANSES : Agence Nationale de SEcurité Sanitaire
APCI : Ionisation Chimique à Pression Atmosphérique BE : Biomonitoring Equivalent
BMD : Benchmark Dose
BMDL : Limite inférieure de l’intervalle de confiance de la Benchmark Dose BPA : Bisphénol A
CE : Commission Européenne
ClxBPA : Dérivés chlorés du bisphénol A
CV : Coefficient de Variation DCBPA : DichloroBisphénol A DJA : Dose Journalière Acceptable DJT : Dose Journalière Tolérable
ELISA : Enzyme-Linked ImmunoSorbent Assay EFSA : European Food Safety Autority
EMA : Agence Européenne des Médicaments ERα : Récepteur aux œstrogènes α
ERβ : Récepteur aux œstrogènes β ESI : Ionisation par electrospray FDA : Food and Drug Administration GC : Gas Chromatography
HBM : Human Biomonitoring
HPLC : High-Performance Liquid Chromatography
ICH : International Conference on Harmonization of technical requirements for registration of pharmaceuticals for human use
INSEE : Institut National de la Statistique et des Etudes Economiques INSERM : Institut National de la Santé et de la Recherche Médicale ISO : International Organization for Standardization
ITMS : Ion Trap Mass Spectrometry LC : Liquid Chromatography
16 LOAEL : Lowest Observed Adverse Effect Level LOD : Limit de détection (Limit of Detection) MCBPA : Monochlorobisphénol A
MS : Mass Spectrometry
NHANES : National Health And Nutrition Examination Survey NIEHS : National Institute of Environmental Health Sciences NOAEL : No Observed Adverse Effect Level
NORMAN : Network of Reference laboratories and related organizations for monitoring and biomonitoring of emerging polluants
OMS : Organisation Mondiale de la Santé OR : Odds Ratio
PBTK : Physiologically based Toxicokinetics PE : Perturbateur Endocrinien
POD : Point Of Departure
PPARγ : Peroxisome Proliferator Activated Receptor γ RIA : Radio ImmunoAssay
SPE : Solid Phase Extraction TCBPA : Trichlorobisphénol A TeCBPA : Tétrachlorobisphénol A UF : Uncertainty Factor
VTR : Valeur Toxicologique de Référence WHO : World Health Organization (OMS)
17
LISTE DES FIGURES
Figure 1. Définition de l’environnement selon l’OMS. 27
Figure 2. Déterminants de la santé. 28
Figure 3. Entre recherche et gestion du risque, les quatre étapes de l’évaluation des
risques pour la santé humaine, d’après le National Research Council (1983). 29
Figure 4. Méthodes pour l’estimation de l’exposition humaine. 31
Figure 5. Le système endocrinien. 35
Figure 6. Différents types de récepteurs des xénobiotiques. 36
Figure 7. Présence des perturbateurs endocriniens dans l’environnement. 37
Figure 8. Exemples de courbe dose-réponse non monotone des perturbateurs
endocriniens 38
Figure 9. Structure chimique du bisphénol A. 39
Figure 10. Synthèse du bisphénol A. 40
Figure 11. Frise chronologique des réglementations mises en place par les différents
gouvernements visant à réduire l’utilisation du BPA. 43
Figure 12. Arbre décisionnel pour qualifier les effets sanitaires du BPA. 46
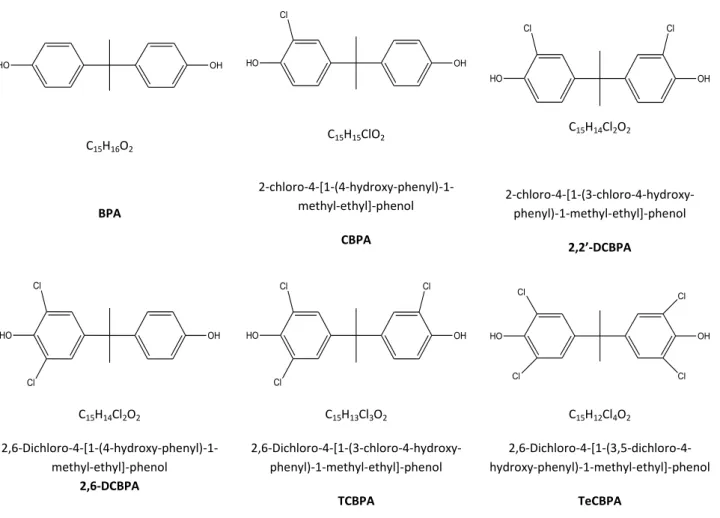
Figure 13. Formules chimiques et structures du BPA et des ses dérivés chlorés. 51
Figure 14. Coupe de la peau. 57
Figure 15. Réactions de Phase I et de Phase II. 59
Figure 16. Voies proposées de biotransformation du bisphénol A chez les mammifères
(sur la base d’études in vitro et in vivo). 67
Figure 17. Structures moléculaires proposées pour les dimères du BPA. 68
Figure 18. Mécanisme proposé par Nakamura et al. pour la formation par le
cytochrome P450 du 4-isopropylphenol (IPP) et l’alcool hydroxycumyl (HCA). 69
Figure 19. Voies métaboliques majeures du BPA chez les mammifères. 70
Figure 20. Synthèse des mécanismes possibles intervenant dans l’exposition du
fœtus au BPA et au BPA-glucuronide. 72
Figure 21. Evaluation de l’exposition et du risque. 74
Figure 22. Relation dose-réponse et définitions de la BMD (benchmark dose) et de
la BMDL (limite inférieure de l’intervalle de confiance de la BMD). 80
Figure 23. Description d’un modèle PBTK générique avec différents sites
d’administration, d’excrétion et de métabolisme. 84
18
modèle PBTK 85
Figure 25. Schéma général représentant les étapes pour le calcul des équivalents
pour le biomonitoring urinaire. 88
Figure 26. Equivalent de biomonitoring pour le BPA (BE). 89
Figure 27. Définition des valeurs HBM et recommandations associées. 91
Figure 28. Passage du BPA depuis des tubes en polycarbonate dans le plasma de
mouton et dans de l’eau. 129
Figure 29. Schéma du système d’infusion post-colonne. 131
Figure 30. Exemple de la mise en évidence de l’Effet Matrice par infusion
post-colonne. 132
Figure 31. Variation de la concentration de BPA total et de BPA non conjugué dans un
échantillon d’urine stocké à température ambiante. 134
Figure 32. Schématisation de la méthode des triades. 176
Figure 33. Chronologie du déroulement de l’étude EDDS et localisation des femmes
dans les Deux-Sèvres. 177
Figure 34. Comparaison des concentrations en BPA par millilitres d’urine et par
grammes de créatinine. 181
Figure 35. Relations linéaires entre les concentrations en BPA exprimées en ng.mL-1 d’urine et les concentrations exprimées en µg.g-1
de créatinine. 182
Figure 36. Illustration de l’isolement des fractions subcellulaires. 191
19
LISTE DES TABLEAUX
Tableau 1. Classification des perturbateurs endocriniens selon leurs
propriétés physicochimiques et leur source. 34
Tableau 2. Données sur la consommation du BPA en Europe de l’ouest (2005/2006)
issues du rapport d’évaluation des risques de la commission européenne. 42
Tableau 3. Synthèse de l’expertise de l’ANSES sur les effets sanitaires du BPA. 47
Tableau 4. Valeurs toxicologiques de référence pour le BPA de divers organismes
dans le monde. 81
Tableau 5. Hypothèses pour le poids corporel, le volume urinaire moyen par 24 heures
et les estimations de concentration urinaire moyenne de BPA total en cas d'exposition
à une dose unitaire (1 µg.kg-1.j-1). 88
Tableau 6. Biomarqueurs potentiels de l’exposition au BPA. 95
Tableau 7. Détections et concentrations de BPA et de ses conjugués par dosage direct
dans l’urine (LC-MS/MS). 97
Tableau 8. Détections et concentrations de BPA total et BPA non conjugué dans
l’urine. 98
Tableau 9. Détections et concentrations de BPA et de ses conjugués dans le sang par
dosage direct (LC-MS/MS). 101
Tableau 10. Détections et concentrations de BPA total et de BPA non conjugué dans
le sang. 101
Tableau 11. Détections et concentrations de BPA total et de BPA non conjugué dans
le lait maternel et le colostrum. 102
Tableau 12. Détections et concentrations de BPA total et de BPA non conjugué dans
le tissu adipeux. 104
Tableau 13. Détections et concentrations de BPA total et de BPA non conjugué
dans le placenta, le sang de cordon et le méconium. 105
Tableau 14. Détections et concentrations de BPA total et de BPA non conjugué
dans les matrices alternatives. 106
Tableau 15. Détections et concentrations du BPA et de ses dérivés chlorés dans les
matrices biologiques. 109
Tableau 16. Critères de validation analytique de la sélectivité. 116
20
Tableau 18. Critères de validation analytique de la limite de quantification basse. 117
Tableau 19. Critères de validation analytique de la limite de quantification haute. 118
Tableau 20. Critères de validation analytique de la limite de détection. 118
Tableau 21. Critères de validation analytique de la justesse. 119
Tableau 22. Critères de validation analytique de la fidélité. 119
Tableau 23. Critères de validation analytique de la robustesse. 120
Tableau 24. Critères de validation analytique de la stabilité. 121
Tableau 25. Critères de validation analytique de l’effet matrice. 122
Tableau 26. Fréquence de détection du BPA et ClxBPA dans les urines du deuxième
trimestre (urines 1) et dans les urines du troisième trimestre (urines 2). 179
Tableau 27. Gammes de concentration, concentrations moyennes, médianes et
écart-types du BPA et des ClxBPA retrouvés dans les urines. 180 Tableau 28. Ajustement par la créatinine des valeurs de concentration en BPA
21
23
Depuis la conférence d’Helsinki organisée par l’Organisation Mondiale de la santé en 1994, l’importance de l’influence de l’environnement sur la santé est reconnue. Plus d’une centaine de produits chimiques fabriqués par l’Homme ont montré qu’ils perturbaient le système endocrinien de l’animal et de l’Homme. Le bisphénol A (BPA), utilisé dans l’industrie depuis les années 1950, est reconnu comme étant un perturbateur endocrinien (PE) et l’Homme est en contact régulier avec ce produit. La forte réactivité du BPA avec le chlore (présent par exemple dans l’eau) entraine la formation de dérivés chlorés du BPA (ClxBPA),
qui ont montré une activité perturbatrice endocrinienne plus importante que celle du BPA. En santé environnementale, la recherche et l’évaluation du risque (du ressort du domaine scientifique) doivent être distingués de la gestion du risque (du ressort de la décision politique). L’évaluation du risque comprend entre autres l’évaluation des expositions des populations qui permet d’identifier les populations qui ont été, sont, ou seront exposées à un agent dangereux, et les niveaux et durées d’exposition. L’évaluation de l’exposition peut être réalisée par le monitoring de l’environnement, le monitoring individuel, l’administration de questionnaires et des études de biomonitoring. Les études de biomonitoring consistent en l’analyse de polluants environnementaux et/ou de leurs métabolites dans les milieux biologiques des individus. Le choix du milieu biologique et du biomarqueur c’est-à-dire du polluant et/ou de ses métabolites est guidé par les études de toxicocinétique associées aux études de toxicité.
Les mesures obtenues par le biomonitoring pouvant avoir une certaine influence sur la gestion du risque, sur les décisions politiques, sur la définition de valeurs de référence et sur la santé des populations, il est important que les études de biomonitoring soient conduites avec rigueur afin d’obtenir des résultats fiables. Pour cela les méthodes d’analyse doivent être validées selon les recommandations en vigueur et les phases pré-analytique (prélèvement, stockage, préparation des échantillons) et post-analytique (interprétation des analyses) doivent être maîtrisées.
L’objectif de ce travail a été de mettre au point des méthodes d’analyse de PE dans les matrices biologiques. Le BPA et ses dérivés chlorés ont été choisis comme exemple de PE. Pour le BPA de nombreuses études de biomonitoring et des études de toxicocinétique sont déjà disponibles alors que pour les ClxBPA, moins étudiés, quelques études de biomonitoring
24
Dans la première partie de ce document, la santé-environnementale, les PE, le biomonitoring et la toxicocinétique sont définis. Une revue de la littérature est faite au sujet du BPA et de ses dérivés chlorés.
La deuxième partie évoque les recommandations actuellement disponibles pour la validation des méthodes analytiques dans le domaine environnemental et dans le domaine de la santé et aborde les particularités de l’analyse des micropolluants à l’état de trace. Afin d’estimer l’exposition des populations au BPA et aux ClxBPA, une méthode d’analyse par
LC-MS/MS du BPA et des ClxBPA non conjugués a été validée dans l’urine. Cette méthode a
ensuite été modifiée afin d’améliorer la rapidité et la sensibilité du dosage, et a été appliquée à la mesure de l’exposition aux PE dans une cohorte de femmes enceintes.
La troisième partie aborde l’étude du métabolisme et de la toxicocinétique. L’étude de la toxicocinétique du BPA montre la formation de dérivés conjugués, éliminés par voie urinaire. Classiquement, pour la mesure des dérivés conjugués, des méthodes indirectes utilisant la déconjugaison enzymatique sont proposées. Dans ce cadre, nous avons développé une méthode originale permettant de valider l’efficacité de la déconjugaison. Si la mesure indirecte des métabolites après déconjugaison semble plus aisée, il reste néanmoins plus rationnel de doser directement l’analyte recherché. C’est pourquoi, après synthèse des substances étalons, nous avons pu développer, une méthode de dosage des dérivés glucuronides et sulfates du BPA et du dichloroBPA dans l’urine. Cette méthode de dosage a été appliquée à la même cohorte de femmes enceintes.
Enfin, une discussion générale des résultats obtenus et des études futures qui pourraient découler de ce travail ainsi qu’une conclusion terminent ce mémoire.
25
1
èrePARTIE :
27
CHAPITRE I : LA SANTE ENVIRONNEMENTALE
I.1. DEFINITION
Selon l’OMS (Organisation Mondiale de la Santé), l’environnement englobe les pollutions anthropiques des milieux (air, eaux, sols), les milieux naturels, pollués ou non, les facteurs sociaux et les facteurs comportementaux (1). Selon cette définition, l’environnement comprendrait tout ce qui n’est pas génétique même si les gènes pourraient être influencés par l’environnement à court ou long terme (2). La figure 1 représente l’environnement de sa définition la plus large à sa définition la plus restreinte.
Figure 1. Définition de l’environnement selon l’OMS (1).
Toujours, selon l’OMS, la santé est un état de complet bien-être physique, mental et social, et ne consiste pas seulement en une absence de maladie ou d'infirmité (3). Cette définition est celle du préambule de 1946 à la Constitution de l'OMS, elle n’a pas été modifiée depuis. La figure 2 représente les déterminants de la santé selon le modèle de Dahlgren et Whitehead. Selon les estimations de l’OMS, 24 % de la charge morbide (années de vie en bonne santé perdues) et 23% de tous les décès (mortalité prématurée) sont imputables aux facteurs environnementaux.
28
Figure 2. Déterminants de la santé (4).
Entre ces représentations de l’environnement (figure 1) et de la santé (figure 2), des liens peuvent être mis en évidence :
« environnement physique et naturel » et « conditions de vie et de travail » « environnement social » et « réseaux sociaux et communautaires »
« environnement comportemental » et « facteurs liés au style de vie personnel » Ces liens peuvent être le témoin de l’effet de l’environnement sur la santé.
La santé environnementale (Environmental health) étudie l’impact de l’environnement sur la santé de l’Homme. Selon l’OMS, « la santé environnementale comprend les aspects de la santé humaine, y compris la qualité de la vie, qui sont déterminés par les facteurs physiques, chimiques, biologiques, sociaux, psychosociaux et esthétiques de notre environnement » (5).
Les pathologies liées à l’environnement peuvent être des pathologies aiguës (infections, intoxications) ou des pathologies chroniques (allergies, cancers, altérations de la fertilité, maladies neurologiques, maladies métaboliques, maladies du développement).
I.2. HISTORIQUE
Les termes « Environnement » et « Santé » ont longtemps été séparés car le terme « Environnement » était entendu au sens écologique. Depuis les années 1980 il y a eu une
29
prise de conscience de l’interaction de l’environnement sur l’Homme, notamment via le cas des PE. Depuis les années 1950, l’accumulation d’observations écologiques (oiseaux sans libido, loutres décimées, visons stériles, oisillons difformes, alligators au pénis atrophié,…) et épidémiologiques (baisse du nombre de spermatozoïdes dans le sperme humain de 50% entre 1938 et 1990), a conduit des scientifiques à supposer une origine chimique de ces perturbations, mettant en lumière l’impact de l’environnement sur l’Homme (6,7).
Lors de la conférence de l’OMS de Francfort en 1989, « la santé environnementale » a été définie comme englobant « les aspects de la santé humaine et des maladies qui sont déterminés par l’environnement. Cela se réfère également à la théorie et à la pratique de contrôle et d’évaluation dans l’environnement des facteurs qui peuvent potentiellement affecter la santé. » (8). Evoquée en 1989, ce n’est qu’en 1994, que la définition actuelle de la santé environnementale a été écrite par l’OMS dans la déclaration d’Helsinki sur l’action pour l’environnement et la santé en Europe (5).
II.3. SANTE ENVIRONNEMENTALE : DE LA RECHERCHE A LA REGLEMENTATION
La santé environnementale peut être divisée en 3 domaines, représentés dans la figure 3 (9) :
La recherche
L’évaluation des risques La gestion du risque
Figure 3. Entre recherche et gestion du risque, les quatre étapes de l’évaluation des risques
30
La recherche en santé environnementale étudie les effets néfastes sur la santé suite à l’exposition à un agent (études épidémiologiques, expérimentation animale), estime les expositions dans différentes populations (mesures sur le terrain, biomonitoring), et extrapole les données obtenues chez l’animal à l’Homme.
Les évaluateurs de risques sont chargés de déterminer la probabilité d’occurrence et la gravité des effets d’un danger sur la santé d’une population donnée. Le danger se réfère à la propriété intrinsèque d’un agent physique, chimique ou biologique d’exercer un effet néfaste sur la santé. Il peut s’agir par exemple d’un trouble du comportement, de l’altération d’un organe ou d’une fonction, d’une pathologie grave ou bénigne, voire d’un décès. Le risque traduit la probabilité de survenue d’un (ou de plusieurs) effet(s) néfaste(s) pour la santé d’un individu ou d’une population à la suite d’une exposition à un « agresseur ». Plus l’exposition à cet agresseur est importante, plus le risque sera élevé. Mais, un produit caractérisé « très dangereux » peut ne présenter aucun risque si l’on garantit qu’aucun individu n’y est exposé. L’évaluation des risques est définie comme « une démarche méthodique de synthèse des connaissances scientifiques disponibles en vue d’évaluer les effets sur la santé résultant d’une exposition d’une population ou d’individus à une substance, un agent ou une situation dangereuse ». Elle est décomposée classiquement en quatre étapes :
Identification du caractère dangereux de l’agent à étudier, indépendamment de la probabilité d’apparition d’effets néfastes ;
Estimation de la relation dose-effet ou dose-réponse, qui vise à quantifier la relation entre la dose d’exposition et la réponse de l’organisme ou sa probabilité de réponse ;
Évaluation des expositions qui permet d’identifier les populations qui ont été, sont, ou seront en contact avec l’agent dangereux et les niveaux et durées d’exposition correspondants ;
Caractérisation du risque, qui constitue l’étape de synthèse de la démarche de présentation et de discussion des résultats.
La gestion des risques consiste à explorer les différentes solutions possibles et leurs conséquences, et à mettre en œuvre les mesures permettant de prévenir, réduire, réparer ou compenser les risques identifiés.
Il est important de distinguer la fonction d’évaluation des risques (du ressort du domaine scientifique) de la gestion des risques (qui relève de la décision politique) pour assurer
31
l’intégrité de l’expertise scientifique en garantissant son indépendance et sa transparence tout en évitant les conflits d’intérêt.
I.4. EXPOLOGIE ET METHODES D’ESTIMATION DE L’EXPOSITION
HUMAINE
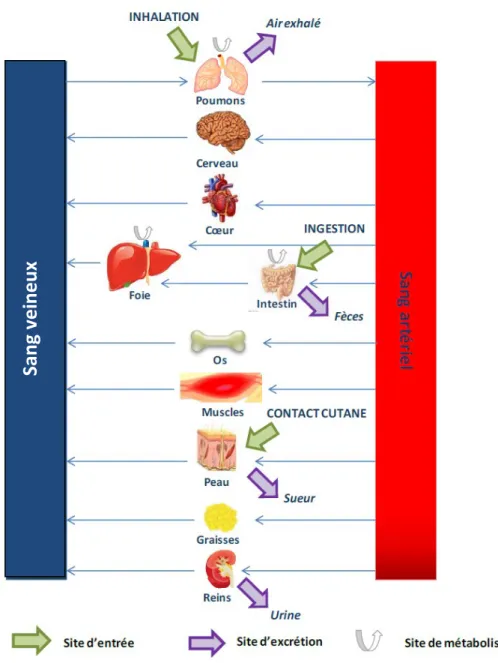
L’expologie (exposure assessment ou exposure science) étudie la relation entre les facteurs environnementaux physiques, chimiques, biologiques et la santé humaine. Cette science collecte les informations qualitatives et quantitatives dans le but de comprendre l’interface entre les facteurs environnementaux et les personnes (10). L’expologie utilise différentes méthodes qui permettent de tenir compte des milieux environnementaux (sol, air, eau, alimentation), des voies d’absorption (orale, pulmonaire, cutanée) et de la toxicocinétique.
Les méthodes d’estimation de l’exposition humaine aux PE, représentées dans la figure 4, peuvent être directes (monitoring individuel et biomonitoring) ou indirectes (monitoring de l’environnement ou questionnaires d’exposition) (11).
Evaluation de l’exposition
Méthodes directes Méthodes indirectes
Biomonitoring Monitoring individuel Monitoring de l’environnement Questionnaires Modèles d’exposition Modèles physiologiques-toxicocinétiques Modèles de dose
32 Biomonitoring
Le biomonitoring par la mesure de biomarqueur d’exposition fait partie des méthodes directes d’estimation de l’exposition à des toxiques. Ces dernières années, le recours à la mesure de biomarqueurs s’est énormément développé en épidémiologie environnementale.
Monitorage individuel
Parmi les méthodes directes, le monitoring individuel est la mesure de polluants à l’aide de capteurs individuels. Cette méthode, très utilisée dans la recherche en santé au travail, a l’avantage d’être plus précise que le monitoring de l’environnement mais elle est plus complexe et plus coûteuse à mettre en œuvre.
Monitorage de l’environnement
Parmi les méthodes indirectes, le monitoring de l’environnement est la mesure de substances chimiques, physiques ou biologiques dans les milieux de l’environnement par des techniques analytiques.
Questionnaire d’exposition
Une autre méthode indirecte d’estimation de l’exposition est le questionnaire. Les études d’épidémiologie environnementale utilisent les questionnaires pour estimer une exposition, notamment en l’absence d’autres données, ou en association avec des données de monitoring de l’environnement ou de biomonitoring. Les questionnaires permettent d’obtenir une information sur la présence ou non d’une exposition, sa durée, sa fréquence. Les questionnaires contiennent les informations nécessaires pour l’évaluation des différentes sources d’exposition (eau, air, alimentation). Ils permettent également d’obtenir des informations liées à l’exposition, comme les différents lieux où les personnes peuvent être exposées.
33
CHAPITRE II : LES PERTURBATEURS ENDOCRINIENS
Les substances chimiques qui perturbent le système hormonal sont appelées « perturbateurs endocriniens », ces substances sont très largement répandues dans l’environnement.
II.1. GENERALITES
II.1.A. Définition
Parmi les définitions des PE, la définition proposée par l’OMS en 2002 est la plus communément admise : "Un perturbateur endocrinien potentiel est une substance ou un mélange exogène, possédant des propriétés susceptibles d’induire une perturbation endocrinienne dans un organisme intact, chez ses descendants ou au sein de (sous-) populations" (12).
II.1.B. Classification
Il n’existe pas à ce jour de classification pour les PE équivalente à celle des produits cancérogènes du CIRC (Centre International de Recherche sur le Cancer), même si les endocrinologues souhaiteraient une telle classification. Cependant, la commission européenne a récemment émis un projet qui prévoit une classification binaire où les substances seraient soit considérées comme PE et donc interdites soit considérées comme non PE et autorisées (13). Cela exclut notamment toutes les substances pour lesquelles le niveau de preuve est insuffisant balayant ainsi le principe de précaution.
Parmi les substances suspectées d’être des PE on retrouve le BPA, les phtalates, les composés bromés… Les PE peuvent être classés en familles selon leurs propriétés physicochimiques et/ou leurs origines (tableau 1).
Un inventaire européen des molécules à effets perturbateurs endocriniens a été établi en 2000, classant 564 molécules selon le groupe des pesticides (188 molécules), des produits industriels (315 molécules), des métaux (29 molécules) et autres (32 molécules). Cet inventaire a classé 42 substances dont le BPA en catégorie 1 (prioritaire) car présentant de toute évidence un effet perturbateur endocrinien (14).
34
Tableau 1. Classification des perturbateurs endocriniens selon leurs propriétés
physicochimiques et leur source (12).
Classification Exemples de perturbateurs endocriniens Substances chimiques halogénées persistantes et bioaccumulables
Polluants persistants chimiques PCDDs/PCDFs, PCBs, HCB, PFOS, PBDEs, PBBs, Chlordane, Mirex,
Toxaphène, DDT/DDE, Lindane, Endosulfan
Autres HBCDD, SCCP, PFCAs, Octachlorostyrène, PCB méthylsulfones
Substances chimiques moins persistantes et moins bioaccumulables Plastifiants et autres additifs dans les matériaux et
produits
Phtalate esters (DEHP, BBP, DBP, DiNP), Triphényl phosphate, Bis (2 éthylexyl) adipate, n-Butylbenzène, Triclocarban, hydroxyanisole butylé
Substances chimiques aromatiques polycycliques Benzopyrène, Benzoanthacène, Pyrène, Anthacène
Substances chimiques phénoliques halogénées 2,4-Dichlorophénol, Pentachlorophénol, Hydroxy-PCBs, Hydroxy-PBDEs, Tétrabromobisphénol A, 2,4,6-Tribromophénol, Triclosan
Substances chimiques phénoliques non halogénées Bisphénol A, Bisphénol F, Bisphénol S, Nonylphénol, Octylphénol, Résorcinol
Pesticides, résidus médicamenteux et ingrédients des produits soins corporels
Pesticides couramment utilisés 2,4-D, Atrazine, Carbaryl, Malathion, Mancozeb, Vinclozoline, Procloraz, Procymidone, Chlorpyrifos, Fénitrothion, Linuron
Résidus médicamenteux, facteurs de croissance, ingrédients des produits de soins corporels
Diéthylstilbestrol, Ethinylestradiol, Tamoxifène, Lévonorgestrel, Inhibiteurs de la recapture de la sérotonine (Fluoxétine), Flutamide,
4-Méthylbenzylidène camphor, Octyl
méthoxycinnamate, Parabènes, Cyclic méthyl silxanes, Galaxolide, 3-benzylidène camphor
Autres
Métaux et substances organométalliques Arsenic, Cadnium, Plomb, Mercure, Méthylmercure, Tributyltin, Triphényltin
Hormones naturelles 17β estradiol, estrone, testostérone
Phyto-œstrogènes Isoflavones (génistein, daidzéin), Coumestans (coumestrol), Mycotoxines (zéaralénone), Phénylfavonoides (8-prénylnaringénin)
PCDDs polychlorodibenzodioxines, PCDFs polychlorodibenzofuranes, PCBs polychlorobiphényls, HCB hexachlorobenzène, PFOS acide
perfluorooctanesulfonique, PBDEs polybromodiphényléthers, PBBs polybromobiphényls, DDT dichlorodiphényltrichloroéthane , DDE dichlorodiphényldichloroéthylène, HBCDD hexabromocyclododécane, SCCP paraffine à courte chaîne chlorée, PFCAs acides perfluorocarboxyliques, DEHP diethylhexylphthalate, BBP benzyl butyl phthalate, DBP dibutylphthalate, DiNP diisononyl phthalate, 2,4-D acide 2,4-dichlorophénoxyacétique.
II.1.C. Mécanisme d’action
Les PE sont des substances chimiques d’origine naturelle (hormones, nitrates par exemple) ou artificielle (certains pesticides, médicaments, plastifiants par exemple) qui peuvent interférer avec le fonctionnement des glandes endocrines, organes responsables de la
35
sécrétion des hormones (androgènes, œstrogènes, progestérone, prostaglandine, hormones hypophysaires, parathyroïdiennes, thyroïdiennes, insuline, glucocorticoïdes, aldostérone…). Les hormones sont transportées par le système sanguin pour permettre la communication et la coordination entre les différents tissus de l’organisme. Le système endocrinien est présenté dans la figure 5. Les PE interagissent sur le métabolisme humain et affectent la fonction reproductrice, la croissance et le développement, l’homéostasie, la disponibilité énergétique (12).
Figure 5. Le système endocrinien (9).
L’action des PE peut passer par différentes voies :
Le PE peut mimer l’action d’une hormone naturelle et entrainer ainsi la réponse due à cette hormone.
La substance peut empêcher une hormone de se fixer à son récepteur et ainsi empêcher la transmission du signal hormonal.
La substance peut perturber la production ou la régulation des hormones ou de leurs récepteurs.
36
Les PE peuvent activer différentes catégories de récepteurs que l’on peut classer en deux grands types : les récepteurs des xénobiotiques au sens strict (récepteur à l’aryl hydrocarbone AhR de la dioxine et des hydrocarbures aromatiques polycycliques, récepteur pregnan X PXR capable de lier des médicaments et des pesticides, le récepteur constitutif des androstanes CAR) et les récepteurs de composés endogènes comme les récepteurs hormonaux qui sont susceptibles d’être modulés par ces xénobiotiques (récepteurs aux œstrogènes ER et , récepteur aux androgènes AR) (15). Les récepteurs des xénobiotiques comme PXR ou AhR ont pour fonction principale l’adaptation de l’organisme à l’afflux de xénobiotiques. En ce qui concerne les récepteurs à des ligands endogènes, leur activation illégitime par des facteurs environnementaux conduit à une perturbation endocrinienne ou métabolique (figure 6). La toxicité d’un xénobiotique peut provenir à la fois de l’interaction avec son récepteur spécifique et de l’interaction avec des récepteurs de composés endogènes. Une classification schématique des mécanismes d’action est donc difficile, d’autant que l’affinité de ces substances exogènes aux récepteurs de composés endogènes est à prendre en compte. Les PE peuvent agir à plusieurs niveaux : synthèse des hormones, transport, métabolisme, ou encore liaison avec les récepteurs nucléaires constituant les cibles naturelles des hormones. Leur liaison aux récepteurs nucléaires perturbant la liaison des ligands naturels reste toutefois le mécanisme le plus fréquent (15).
Figure 6. Différents types de récepteurs des xénobiotiques. ER : récepteur aux œstrogènes ;
AR : récepteur aux androgènes ; PPAR : récepteur au proliférateur de peroxysome activé ; AhR : récepteur à l’aryl hydrocarbone ; PXR : récepteu pregnan X ; CAR : récepteur consitutif des androstanes (15).
37
Les PE sont susceptibles de perturber la synthèse des ligands de récepteurs nucléaires. Ils peuvent altérer la liaison aux protéines de transport comme la SHBG (sex hormone binding globlulin) ou la transthyrétrine (protéine de transport de la thyroxine). Les PE modifient la clairance des ligands de récepteurs nucléaires en activant des enzymes du métabolisme comme certains cytochromes P450 (15). Ils peuvent influencer la concentration en récepteurs nucléaires. Les œstrogènes contrôlent l’expression de certains récepteurs nucléaires et la perturbation œstrogénique peut donc par ricochet agir sur d’autres systèmes hormonaux. Enfin, les PE régulent l’expression de gènes importants pour le développement du tractus reproducteur et participent aux modifications du génome (15).
II.1.D. Présence dans l’environnement
Les PE chimiques peuvent entrer dans l’environnement principalement par le biais des effluents industriels et urbains, le ruissellement des terres agricoles et l’incinération et le rejet des déchets (figure 7). L’être humain peut y être exposé lors de l’ingestion de nourriture, de poussière et d’eau ou de l’inhalation de gaz et de particules présents dans l’air, ainsi que par contact cutané. Production chimique Eaux usées Epandage Eaux usées non traitées Décharges industrielles Emission dans l’atmosphère Emission dans l’atmosphère Incorporation dans les
produits de consommation
Emission dans les rivières, lacs et océans
Traitement des eaux usées
38
II.1.E. Courbe dose effet non monotone
La relation dose-réponse des PE est aujourd’hui reconnue comme non monotone (courbe en forme de U, courbe en forme de U inversée, courbe multiphasique) (Figure 8) (17). Cette relation dose-effet correspond à l’hormésis, phénomène biologique se traduisant par une manifestation contraire des effets selon les doses. Ainsi, une stimulation apparaît aux faibles doses et une inhibition aux fortes doses (18). En santé environnementale, le fait que les micropolluants à effets perturbateurs endocriniens soient retrouvés à l’état de traces c’est-à-dire à de très faibles concentrations, et que la relation dose-effet des PE soient non monotone oblige à reconsidérer le modèle toxicologique des ces molécules (17). Le principe évoqué par Paracelse, où plus la dose augmente, plus la toxicité du produit chimique est forte, ne s’applique donc pas aux PE (19).
Figure 8. Exemples de courbe dose-réponse non monotone des perturbateurs endocriniens.
A : courbe en forme U, B : courbe en forme de U inversé, C : courbe multiphasique (17).
II.1.F. Effet cocktail
Lors de l’évaluation de la toxicité des produits chimiques, l’étude de l’effet toxique est faite isolément pour un seul produit chimique avec l’hypothèse que l’effet provient de ce seul toxique. Mais la réalité de l’exposition correspond à une contamination multiple et cette hypothèse devient fausse lorsqu’il y a une exposition à plusieurs produits chimiques supplémentaires. Des PE ayant isolément peu d’effet voient leur pouvoir perturbateur endocrinien augmenter lorsqu’ils sont associés entre eux, c’est l’effet cocktail ou effet mélange. Les effets de plusieurs PE peuvent être additifs mais également synergiques.
39
Certains modèles peuvent prédire les effets des mélanges multi-composants lorsque la puissance individuelle des composés est connue (20).
Une étude réalisée dans le Maryland aux Etats-Unis entre 1992 et 1998 montre un risque de cancer chez l’enfant plus élevée lorsqu’il est exposé à un mélange de PE avec un Odds Ratio (OR) = 7,56 (4,16 à 13,73) par rapport à une exposition à l’atrazine seule OR = 1,10 (0,78 à 1,56) ou au metolachlor seul OR = 1,54 (1,14-2,07) (21). Dans une autre étude publiée en 2015, l’effet synergique de deux molécules a été démontré in vitro : l'éthinylestradiol, un des composants actifs des pilules contraceptives et le transnonachlor, pesticide organochloré interdit mais persistant dans le sol. Bien que très faiblement actifs par eux-mêmes, ces deux composés utilisés ensemble ont la capacité de se fixer simultanément à un récepteur des xénobiotiques situé dans le noyau des cellules et de l'activer de façon synergique, pouvant induire un effet toxique. Les analyses à l’échelle moléculaire indiquent que les deux composés se lient coopérativement au récepteur, c’est-à-dire que la fixation du premier favorise la liaison du second. Cette coopérativité est due à de fortes interactions au niveau du site de liaison du récepteur, de sorte que le mélange binaire induit un effet toxique à des concentrations largement plus faibles que les molécules individuelles (22).
II.2. LE BPA
Le bisphénol A, considéré comme un PE, est largement utilisé dans l’industrie plasturgique depuis les années 1950 et est de ce fait ubiquitaire dans l’environnement.
II.2.A. Propriétés physico-chimiques
Le bisphénol A (BPA, 4,4’-dihydroxy-2,2’-diphénylpropane) (N°CAS 80-05-7) est une substance chimique de synthèse utilisée depuis plus de 50 ans (figure 9). Il fait partie de la famille des diphénylalcanes hydroxylés ou bisphénols. Sa masse est de 228,29 g.mol-1 et il se présente sous forme de poudre blanche peu soluble dans l’eau (120-300 mg/L à 25°C)(23). Son coefficient de partage (log de Kow) de 3,32 indique son affinité pour les graisses (23).
HO OH
40
La première synthèse chimique du BPA serait due à Alexandre Dianin, chimiste russe, en 1891. Le BPA est produit à partir de phénol et d’acétone par une réaction de condensation catalysée par un alcalin ou un acide (figure 10).
Figure 10. Synthèse du bisphénol A.
Il a été très étudié dans les années 1930 lors de la recherche d'œstrogènes synthétiques, mais jamais utilisé comme tel du fait de la découverte à la même époque du diéthylstilbestrol aux propriétés jugées plus intéressantes. En 1960 débute son utilisation massive par l'industrie du plastique.
II.2.B. Sources, réglementations et présence dans l’environnement
Le BPA est une substance anthropique utilisée dans la fabrication de plastiques de type polycarbonates (pour les rendre plus durs et transparents) et celle de résines époxydes. Il est aussi utilisé comme composant d’autres polymères et résines (polyester, polysulfone, résines vinylesters…) et intervient dans la synthèse de certains retardateurs de flamme (le tétrabromobisphénol A et le bisphénol A bis) et comme révélateur dans les papiers thermiques (24). Le BPA est utilisé dans la fabrication de nombreux produits ayant de multiples usages, aussi bien dans la sphère domestique qu’industrielle.
Le BPA est présent en tant que monomère dans (25) :
Les polycarbonates qui sont utilisés pour la fabrication de nombreux produits destinés à l’emballage alimentaire, tels que les bonbonnes d’eau réutilisables, la vaisselle (assiettes et tasses), le petit-électroménager de cuisine, les récipients de conservation, et divers produits plastiques non alimentaires, tels que les pare-chocs automobiles, les lunettes (lunette de protection, montures, verres solaires), les CD,… ;
Les polyesters carbonates, synthétisés à partir de deux bisphénols : BPA et Bisphénol TMC (1,1-bis(4-hydroyphényl)-3,3,5-triméthylcyclohexane) et utilisés notamment dans l’automobile, les transports, les portes de micro-onde, les sèche-cheveux, les fers à repasser, les emballages médicaux ;
41
Les résines époxydes qui sont utilisées comme revêtement intérieur des cannettes et des boîtes de conserve, dans des peintures, encres et dans les réseaux d’adduction d’eau potable (revêtements de cuves et de canalisations). Les résines époxydes sont la deuxième utilisation du BPA avec 191 520 tonnes de BPA utilisés par an (23) ;
Les résines époxydes et polyacrylates qui peuvent être utilisées pour la synthèse de ciment dentaire (24) ;
Les polyarylates qui sont utilisés dans les équipements médicaux, le traitement des eaux (conduites, pompes…), l’automobile… ;
Les polysulfones qui sont utilisées dans le domaine médical (plateaux chirurgicaux, humidificateurs, membrane de filtration pour eau potable, pour hémodialyse), dans l’électroménager (cafetières, cuisinières, sèche-cheveux) et en plomberie ;
Les polyéthérimides qui entrent dans la composition de pompes de distributeur de boisson ;
Les plastiques recyclés : vinyle, polychlorure de vinyle, polystyrène, polycarbonate.
La production mondiale annuelle du BPA en 2006 était estimée à 3,8 millions de tonnes (26). Selon l’INSEE (Institut National de la Statistique et des Etudes Economiques), en 2007, il n’y a pas d’entreprise française qui produise du BPA en France. Les données sur la consommation de BPA en Europe sont présentées dans le tableau 2.
42
Tableau 2. Données sur la consommation du BPA en Europe de l’ouest (2005/2006) issues
du rapport d’évaluation des risques de la commission européenne (27).
Données sur l’utilisation Tonnes/an consommation (%) Pourcentage de la
Total de la consommation 1 084 870 100%
Polycarbonates (PC) 865 000 79.55%
Résines Epoxydes (EP) dont : 196 535 18.08%
- Revêtement de cannettes 2 755 0.25%
Résines à mouler, phénoplastiques 8 800 0.82%
Polyesters insaturés (UP) 3 600 0.33%
Papier thermique 1 890 0.17%
Polychlorure de vinyle (PVC) dont : 1 800 0.17%
- Pack stabilisant contenant du BPA 450 0.04%
- Plastifiant du PVC 900 0.08%
- Antioxydant de synthèse du PVC 450 0.04%
Additif de revêtement électrolytique de l’étain 2460 0.23%
Autres 7245 0.67%
Le BPA est interdit dans les biberons depuis juin 2010 en Europe, à la suite d’une action française, ainsi que dans les contenants alimentaires destinés aux nourrissons et enfants en bas âge depuis janvier 2013 (28,29). Entrée en vigueur au 1er janvier 2015, l’interdiction du bisphénol A s’est étendue à tous les matériaux au contact alimentaire mais la loi de 2012 qui prévoyait l’interdiction de la production en France et de l’exportation du BPA a été annulée suite à une demande de Plastics Europe auprès du conseil constitutionnel (29). La figure 11 représente la chronologie des réglementations mises en place par les différents gouvernements visant à réduire l’utilisation du BPA.
43 1891 1936 1950 2006 2008 2010 2015 2011 2013 1èresynthèse
chimique du BPA par Alexandre Dianin 1èredescription de l’activité œstrogénique du BPA Utilisation du BPA par l’industrie plasturgique
La France interdit la vente de contenants alimentaire fabriqués à partir de BPA
La France interdit la vente de biberons fabriqués à partir de BPA
DJA fixée à 50 µg.kg-1.j-1par l’EFSA (UE)
DJA fixée à 50 µg.kg-1.j-1par la FDA (USA)
La France interdit la vente de tous contenants alimentaires à destination des nourrissons et enfants de moins de 3 ans contenant du BPA
L’ensemble des pays membres de l’UE interdisent la vente de biberons fabriquées à partir de BPA
L’EFSA revoit temporairement la
DJA à 4 µg.kg-1.j-1
Figure 11. Frise chronologique des réglementations mises en place par les différents
gouvernements visant à réduire l’utilisation du BPA. DJA : Dose Journalière Acceptable. Le BPA étant retrouvé dans de nombreux produits de consommation courants, il est ubiquitaire dans l’environnement. Il a aussi été retrouvé dans l’eau, la terre et l’air.
De nombreuses études ont quantifié le BPA dans différents milieux aquatiques dont les eaux résiduaires, les eaux souterraines, les eaux superficielles, les eaux minérales et l’eau du robinet. Les sources de contamination du milieu aquatique par le BPA sont majoritairement les eaux résiduaires municipales et industrielles des stations de traitements des eaux usées (30,31). Dans les effluents des stations d’épuration la concentration en BPA est souvent inférieure à 1,5 µg.L-1 (30), mais des concentrations supérieures jusqu’à 370 µg.L-1 ont été retrouvées dans les effluents traités des usines de recyclage de papier (32). Dans les eaux superficielles les concentrations retrouvées sont inférieures à 4 µg.L-1 (32) et varient selon la période de l’année (34). La contamination des eaux souterraines est en général faible même lorsqu’une source de contamination est proche, la concentration maximale retrouvée a été de 1.9 µg.L-1 (30). Malgré le traitement de l’eau, du BPA est encore retrouvé en sortie d’usine et jusque dans l’eau du robinet à des concentrations comprises entre 2,3 et 317,0 ng.L-1
(35–38). Le BPA est également présent dans l’eau de bouteille par sa libération à partir du contenant plastique en polycarbonate (36). La contribution de l’eau à l’exposition totale de l’Homme au
44
BPA serait de 2,8% (39,40). Pour cette raison, l’OMS ne considère pas l’eau potable comme un contributeur majeur de l’exposition au BPA (41).
Le BPA est présent dans la terre et les sédiments. La contamination de la terre se fait par l’épandage des boues d’épuration, le BPA étant retrouvé dans ces boues à des concentrations variant entre 0,1 et 3,2.107 µg.kg-1. Lorsque le BPA est mesuré à la fois dans l’eau et les sédiments d’une même rivière, des concentrations plus importantes sont retrouvées dans les sédiments (30).
Dans l’air, une étude a rapporté que les concentrations en BPA étaient en moyenne de 707 ng.g-1 dans les poussières de domicile (42).
II.2.C. Exposition de la population générale
Exposition par l’alimentation
L’alimentation est considérée comme la principale source d’exposition de la population au BPA, via l’ingestion d’aliments ou de boissons contaminés par du BPA. Les monomères résiduels de BPA présents dans les produits en polycarbonate ou en résine époxyde sont susceptibles de migrer dans les aliments et les boissons. Du BPA est également libéré par l’hydrolyse du polymère, notamment lors du chauffage du polycarbonate, quelle que soit la source de chaleur ; la migration est d’autant plus importante que le récipient en polycarbonate est usagé, ou en contact avec des solutions alcalines (43,44). La concentration de BPA retrouvée dans les aliments est élevée. Ainsi, du BPA a été retrouvé dans les conserves au Japon à une concentration de 842 µg.kg-1 (45). De même, au Canada, du BPA a été retrouvé à des concentrations comprises entre 0,032 et 4,500 µg.L-1 dans des boissons en cannette (46).
Exposition par les composites dentaires
Des dérivés du BPA (BPA glycidyl dimethacrylate et BPA diglycidylether) entrent dans la composition d’agents de scellement ou dans des résines composites utilisés en dentisterie (47,48). Le BPA est libéré de la résine dentaire dans la salive grâce à des estérases salivaires et est détectable dans les 3 heures qui suivent la mise en place (49).
Exposition par la voie inhalée
L'inhalation de BPA contenu dans la poussière domestique est peu probable étant donné que les particules de grandes tailles rencontrées dans la poussière ne pénètrent pas dans les
45
poumons (42). Cependant, la poussière contenant du BPA peut être piégée dans le système muco-ciliaire et peut être avalée entraînant une exposition par voie orale supplémentaire (44). Dans l’étude de Wilson et al. (42), l’exposition journalière par voie inhalée (en supposant une inhalation complète par les voies respiratoires) du BPA a été estimée entre 0,008 et 0,014 µg/jour/personne, alors que l'ingestion d'aliments conduit à une exposition de 1,7 à 2,7 µg/jour/personne.
Exposition cutanée
Etant donné que le BPA est présent dans de nombreux produits de consommation courante, la peau est en contact régulier avec ce type de produits : CD et DVD, emballages alimentaires, papiers thermiques, lunettes….(15).
II.2.D. Mécanisme d’action et toxicité
II.2.D.a. Mécanisme d’action
Le BPA répond à la définition de PE. Tous les mécanismes d’action du BPA ne sont pas encore connus. Le BPA a un mécanisme d’action œstrogénique reconnu mais il aurait également des effets sur d’autres récepteurs cellulaires (23) :
Action œstrogénique : le BPA est reconnu comme agoniste faible des récepteurs aux œstrogènes α et β (ERα et ERβ) (50),
Liaison au récepteur γ apparenté aux récepteurs aux œstrogènes ERRγ (51),
Induction de l’expression du récepteur nucléaire impliqué dans la prolifération des peroxysomes PPARγ (53),
Action probable sur le récepteur cellulaire aux androgènes (entrainant un effet anti-androgénique modéré), le récepteur des hydrocarbures aromatiques, le récepteur transmembranaire des œstrogènes, les récepteurs des hormones thyroïdiennes et le récepteur GPR30 impliqué dans la prolifération cellulaire (15,54,55).
Lors de l’exposition au BPA, plusieurs mécanismes seraient impliqués, ce qui pourrait expliquer certains effets observés à faibles doses et les relations dose-réponse non monotones (23).
46 II.2.D.b. Toxicité
Dans son rapport de 2011, l’ANSES a compilé les études de toxicité du BPA (23). Pour chaque type d’effet, le groupe de travail a caractérisé et qualifié ces effets en termes d’effets avérés, d’effets suspectés, d’effets controversés, et d’effets pour lesquels les données disponibles ne permettent pas de conclure. Les effets ont été classés dans ces différentes catégories en fonction des résultats des études, du nombre d’études, de la qualité des études. L’arbre décisionnel ayant permis de classer les effets dans les différentes catégories est présenté dans la figure 12. Le tableau 3 résume les effets sanitaires du BPA issus du rapport d’expertise de l’ANSES de 2011.