HAL Id: tel-01172164
https://hal.ird.fr/tel-01172164
Submitted on 7 Jul 2015
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
auropunctata et la myrmécofaune Comparaison d’une
situation en zone d’introduction : la Nouvelle-Calédonie
et d’une situation en zone d’origine : la Guyane
Française
Julien Le Breton
To cite this version:
Julien Le Breton. Étude des interactions entre la fourmi Wasmannia auropunctata et la myrmécofaune Comparaison d’une situation en zone d’introduction : la Nouvelle-Calédonie et d’une situation en zone d’origine : la Guyane Française. Ecologie, Environnement. Université Paul Sabatier - Toulouse 3, 2003. Français. �NNT : 2003TOU300178�. �tel-01172164�
U.F.R. Sciences de la Vie
THÈSE
Présentée pour l’obtention du grade de
DOCTEUR DE L’UNIVERSITÉ TOULOUSE III
Biologie des organismes
(Mention : Écologie des Communautés)
par
Julien Le Breton
Étude des interactions entre la fourmi Wasmannia auropunctata
et la myrmécofaune
Comparaison d’une situation en zone d’introduction :
la Nouvelle-Calédonie
et d’une situation en zone d’origine :
la Guyane Française
A soutenir le Jeudi 20 Novembre 2003 devant le jury composé de :
J. LAUGA Professeur Président
(Université Toulouse III)
D. CHERIX Professeur Rapporteur
(Université de Lausanne)
A. LENOIR Professeur Rapporteur
(Université de Tours)
J. CHAZEAU Directeur de recherche Examinateur
(Laboratoire de Zoologie Appliquée, IRD)
A. DEJEAN Professeur Examinateur
(Unversité Toulouse III)
C. ERRARD Maître de Conférence Examinateur
(Université de Tours)
V. FOURCASSIE Chargé de Recherche Examinateur
(Centre de Recherche sur la Cognition Animale)
Merci d’abord à Messieurs Jean Chazeau et Alain Dejean, co-directeurs de cette thèse. Vos connaissances entomologiques, vos conseils ainsi que la rapidité de votre travail m’ont été extrêmement bénéfiques. Messieurs, je ne sais pas si vous vous êtes rendu compte, mais à votre contact je pense être devenu quelqu’un d’autre.
Toute ma reconnaissance au Professeur Jaques Lauga pour me faire l’honneur de présider ce jury de thèse et pour m’avoir, il y a quelques années de cela, éveillé aux sciences statistiques.
Mes remerciements s’adressent également au Professeur Daniel Cherix de l’Université de Lausanne qui, en dépit de ses lourdes responsabilités professionnelles, a accepté de juger ce travail en tant que rapporteur et membre du Jury.
Merci au Docteur Christine Errard, qui a eu la gentillesse d’expertiser ce travail de thèse.
Le Professeur Alain Lenoir a gentiment accepté d’être rapporteur de ce travail de thèse ainsi que membre du jury ; je l’en remercie vivement.
J’aimerai remercier tout particulièrement le Docteur Vincent Fourcassié, qui en acceptant de me prendre sous son aile en DEA, m’a mis le pied à l’étrier dans le monde de la recherche. Sa rigueur scientifique et ses qualités humaines constituent pour moi un exemple que j’aimerais pouvoir suivre. Merci pour avoir accepté d’être membre du jury de cette thèse.
La majeure partie de ce travail est le fruit de collaborations :
Tout d’abord merci au Docteur Jérôme Orivel. Nous avons côtoyé ensemble la belle cabresse et cette relation à trois s’est maintenue sous toutes les latitudes. Merci pour tout et puisse notre amitié durer très très longtemps, mille merci pour tes nombreux conseils « Junior ».
Un énorme Merci au Docteur Hervé Jourdan. Ses apports considérables sur la connaissance de la myrmécofaune Néo-Calédonienne ont permis de mener mes recherches sur une base solide. Sans son travail, la fourmi électrique aurait sûrement continué à envahir la Nouvelle-Calédonie sans que peu de personnes n’aient pu réaliser l’impact majeur de cette peste sur les écosystèmes. J’espère que, dans un futur proche, tous ces efforts seront récompensés à leur juste valeur.
Merci à toute l’équipe du Laboratoire de Zoologie Appliquée du centre IRD de Nouméa. Merci Djoël, Lydia et Tana, vous avez toujours été là pour partager vos connaissances dans tous les domaines et pour me procurer une aide précieuse quand j’en ai eu besoin. J’en profite pour remercier aussi tout le personnel du Centre IRD de Nouméa. Ce centre est un endroit idéal pour mener à bien des recherches qui serviront au développement futur de la Nouvelle-Calédonie. Merci à toute la bande de l’électronique chez qui on trouve toujours une petite tasse de café. Merci à l’équipe de reprographie qui apporte toujours une note artistique à nos présentations scientifiques. Merci à l’équipe du garage qui, toujours gentiment, m’a prêté des véhicules pour aller explorer les terrains sauvages du territoire. Un petit signe d’amitié à tous les étudiants, V.A.T, collègues rencontrés lors de mes études que ce soit à Nouméa ou à Toulouse. Pakalou, je te remercie de tout mon cœur, pour ton soutien dans les derniers moments difficiles. Je m’excuse de t’abandonner en cours de route mais je serais toujours là si tu as besoin de moi. A la bande de Toulouse, à savoir Audrey (Groarrr), Francesca, Raphi et Jé, si mes séjours se sont toujours bien passés dans la ville rose, c’est en grande partie grâce à vous tous, merci beaucoup.
L’ensemble des études de terrain en Guyane n’aurait pu se faire sans le chaleureux accueil et la logistique du Laboratoire Environnement de Petit-Saut. Merci également au centre IRD de Cayenne qui ont mis des moyens logistiques à notre disposition pendant ce séjour. Merci pour leur aide sur le terrain aux étudiants Toulousains venus en mission en Guyane, à savoir David, Yohann et Stéphanie. Milles bises à Ariane et Laureline qui ont su nous régaler de pâtisseries pendant le séjour. Bon courage à Pablito, le frère de lutte, c’est à toi maintenant de te lancer dans l’aventure de la thèse. Je te souhaite beaucoup de réussite dans tout ce que tu vas entreprendre.
C’est au cours de ces séjours en Guyane que j’ai pu faire la connaissance des Docteurs Jean Paul Lachaud et Bruno Corbara. Cette rencontre m’a montré que l’on pouvait avoir une activité scientifique et des activités parallèles intenses. Merci également à Bruno grâce à qui je vais pouvoir continuer mon voyage myrmécologique au pays du soleil levant.
Merci à Messieurs Rémy Amys (Service Vétérinaire et de la Protection des Végétaux), Raoul Bouacou (Sénat Coutumier de Nouvelle – Calédonie), Lionel Brinon (Direction du Développement Rural), Jean-Louis d’Auzon (Association pour la Sauvegarde de la Nature Néo–Calédonienne), Patrick Daly (Institut Agricole Calédonien), Laurent L’Huillier (Chambre d’Agriculture), Joseph Manauté (Direction des Ressources Naturelles de la Province Sud) et Yves Magnier (Gouvernement de la Nouvelle-Calédonie), pour avoir soutenu initialement ce projet de thèse. Merci également à la Province Sud de Nouvelle-Calédonie qui par leur « Prix d’Encouragement à la Recherche » permettent à de jeunes étudiants calédoniens de mener de telles études dans de bonnes conditions.
Un grand merci aux personnes de la Direction des Ressources Naturelles de la Province Sud de Nouvelle-Calédonie qui m’ont donné un accès complet au site et aux infrastructures du Parc de la Rivière Bleue. Merci à Joseph, Joël, Jean-Marc et Yves pour leurs nombreuses visites durant mes campagnes en solitaire dans ce magnifique Parc de la Rivière Bleue. J’espère que leur passion et leur travail acharné pour sauvegarder les richesses naturelles du pays sera transmise et considérée à leur juste valeur par les générations futures.
Un petit message personnel aux ouvrières de Wasmannia auropunctata. J’espère que vous ne m’en voulez pas trop pour tout ce que je vous ai fait subir durant ces années. Finalement c’est de bonne guerre si on prend en compte les milliers de piqûres reçues depuis ma plus tendre enfance. Allez, sans rancune …
Merci à mes parents et grands parents, pour tous leurs sacrifices qui m’ont permis de continuer mes études en métropole. J’espère qu’ils considèrent ce travail comme une récompense personnelle même si le monde des fourmis leurs semble bien abstrait. Je vous remercie de m’avoir donné cette liberté dans mes choix personnels et de m’avoir poussé à continuer mes études à une époque où le chant des sirènes des plages de Nouvelle-Calédonie m’attirait plus que les bancs de l’Université. Merci à Hélène et Marcel qui ont accepté qu’un farfelu de scientifique entre dans la famille.
TABLE DES MATIERES
AVANT PROPOS ... - 7 -
INTRODUCTION -... FACTEURS DU SUCCES ECOLOGIQUE ET DU SUCCES INVASIF DES FOURMIS... - 11 -
I. L’importance écologique des fourmis et l’organisation de leurs communautés.- 12 A. Importance écologique des fourmis ... - 12 -
B. Organisation des communautés... - 12 -
C. Principales interactions ... - 14 -
D. Modes de défense ou d'attaque... - 18 -
II. Les Fourmis comme envahisseurs biologiques ... - 23 -
A. Les invasions biologiques ... - 23 -
B. Les fourmis vagabondes ou « tramp species »... - 25 -
C. Les super-invasives ... - 27 -
D. La petite fourmi de feu Wasmannia auropunctata... - 32 -
CHAPITRE 1 - SITUATION EN ZONE D’INTRODUCTION... - 37 -
I. Le Milieu néo-calédonien... - 39 -
A. Géographie physique et contexte climatique ... - 39 -
B. Particularité de la biodiversité terrestre néo-calédonienne ... - 40 -
C. La Flore et les principales formations végétales de la Nouvelle-Calédonie ... - 40 -
D. La faune néo-calédonienne ... - 44 -
E. Wasmannia auropunctata en Nouvelle-Calédonie ... - 49 -
II. Structure sociale des populations de W. auropunctata en Nouvelle-Calédonie - 51 - III. Interactions entre W. auropunctata et la myrmécofaune... - 56 -
A. Interactions avec les autres espèces introduites ... - 56 -
IV. Discussion et conclusion... - 84 -
A. Une hiérarchie chez les invasives ? ... - 84 -
B. Invasions des milieux natifs et théorie de l’écologie des communautés ... ... - 85 -
CHAPITRE 2 - SITUATION EN ZONE D’ORIGINE... - 88 -
I. Wasmannia auropunctata dans sa zone d’origine ... - 90 -
II. La Guyane, cadre géographique et écologique ... - 93 -
III. Détection de W. auropunctata en Guyane ... - 95 -
A. Zones agricoles... - 95 -
B. Zones dégradées ... - 99 -
C. Zones naturelles... - 102 -
D. Discussion ... - 106 -
IV. Structure sociale des populations de W. auropunctata dans sa zone d’origine- 108 - A. Zones agricoles... - 108 -
B. Zones naturelles guyanaises...- 109 –
C. Discussion ...- 112 –
V. Interactions entre W. auropunctata et la myrmécofaune locale ... - 113 -
A. Zones agricoles... - 113 -
B. Bords de route ... - 121 -
C. Marigots... - 128 -
D. Situation de super dominance ... - 132 -
E. Action de Neivamyrmex sp. ... - 136 -
VI. Interactions avec d’autres insectes... - 137 -
A. Parasitisme ... - 137 -
B. Mutualisme ... - 138 -
C. Compétition avec d’autres insectes sociaux ... - 140 -
VII. Discussion et conclusion... - 141 -
CONCLUSION GENERALE... - 143 -
I. Comparaison de la structure sociale entre les deux situations... - 144 -
III. Perspectives d’applications des résultats obtenus en Nouvelle-Calédonie pour une amélioration des techniques de contrôle de l’envahisseur envahissantes...
... - 148 -
LISTE DES ARTICLES... - 150 -
Article 1 : Experimental evidence of large scale unicoloniality in the tramp ant Wasmannia auropunctata (Roger) ... - 151 -
Article 2 : Immediate impacts of invasion by Wasmannia auropunctata (Hymenoptera: Formicidae) on native litter ant fauna in a New Caledonian rain forest- 158 Article 3 : Niche opportunity and ant invasion: the case of Wasmannia auropunctata (Roger) in a New Caledonian rainforest ... - 169 -
Article 4 : Using Pheidole species to test the "enemy release" hypothesis on the invasive ant species Wasmannia auropunctata ... - 181 -
Article 5 : Field experiments to assess the use of repellent substances by Wasmannia auropunctata (Roger) (Formicidae: Myrmicinae) during food exploitation .. ... - 196 -
ARTICLE 6 : Neivamyrmex sp. is a specific predator of the pest ant Wasmannia auropunctata ... - 203 -
REFERENCES BIBLIOGRAPHIQUES... - 209 -
ANNEXE 1 ...- 231 –
A
VANT PROPOSL’organisation sociale est un facteur primordial du succès écologique des espèces. Elle a permis aux populations humaines de se développer et d’exploiter intensivement les milieux dans lesquels elles évoluent. La transformation anthropique des milieux et l’essor des échanges et des transports de biens et de matériaux sur de grandes distances a permis parallèlement l’expansion d’autres espèces sociales, parmi lesquelles les fourmis tiennent une place particulière.
Les travaux que nous développons dans ce mémoire s’intéressent à la prolifération de la petite fourmi de feu Wasmannia auropunctata (Roger), espèce originaire de l’Amérique tropicale qui, parce que l’Homme l’a involontairement transportée, a envahi aujourd’hui une grande partie de la ceinture tropicale du globe. Ce succès, comme celui de plusieurs autres espèces du groupe, est impressionnant.
La plupart des connaissances acquises sur la biologie des fourmis envahissantes sont issues d’études réalisées dans leurs zones d’introductions. En effet, c’est dans ces zones que leur présence est la plus remarquée. Néanmoins, les études menées dans les zones d’origine devraient apporter les repères nécessaires à une meilleure compréhension (1) des mécanismes qui prédisposent ces espèces à devenir invasives et (2) des facteurs qui régulent significativement leur populations.
L’objectif de ce travail de thèse est de comprendre dans quelles mesures les espèces de fourmis qui sont en compétition avec W. auropunctata influencent le devenir de ses populations. Ce travail a été conduit en Nouvelle-Calédonie, envahie par W. auropunctata dans les années 1970, et dans la zone néo-tropicale d’origine de l’espèce. Il ne s’agit pas de dresser une liste exhaustive des interactions qu’entretient W. auropunctata avec toutes les espèces de fourmis présentes dans les milieux étudiés : les études ont porté sur les interactions avec les espèces dominantes, car ce sont elles qui vont avoir la plus grande influence, en particulier dans les phénomènes de compétition.
Les données écologiques concernant W. auropunctata ont souvent été tirées d’observations de terrain ponctuelles. Mais des expériences comportementales doivent permettre d’approcher plus finement les causes et les conséquences de son succès dans les zones d’introduction. Les connaissances sur les fourmis invasives sont inégales selon les espèces considérées et il est tentant de généraliser les connaissances acquises sur les espèces les mieux étudiées. Mais, si toutes les espèces invasives possèdent des caractéristiques communes, les mécanismes proximaux diffèrent profondément, car toutes ces espèces varient en morphologie, type d’armement et capacité d’exploitation des ressources. Les caractéristiques écologiques et comportementales doivent donc être étudiées pour chaque espèce invasive.
Ce travail s’organise en 4 parties.
Dans l’introduction, nous exposerons certaines caractéristiques biologiques propres au groupe, qui expliquent la réussite écologique des Formicidae dans les milieux dont elles sont originaires comme dans les milieux qu’elles sont susceptibles d’envahir quand elles ont été déplacées. Nous présenterons succinctement les principaux traits connus de la biologie de W. auropunctata.
Dans le premier chapitre, nous dépeindrons la situation de W. auropunctata dans une situation d’invasion en milieu insulaire, bien illustrée par la Nouvelle-Calédonie où elle a été introduite voici plus de 30 ans. Dans un premier temps, nous nous attacherons à caractériser la structure sociale des populations de W. auropunctata sur l’ensemble du territoire, en réalisant des tests d’agressivité entre colonies proches et distantes. Dans un deuxième temps, nous observerons l’expression de W. auropunctata dans divers milieux néo-calédoniens, son incidence sur les autres espèces de fourmis et les mécanismes qui interviennent.
Le second chapitre traitera de la situation de W. auropunctata dans la zone géographique Guyane-Amazone où elle native. Après avoir résumé les principaux travaux traitant directement ou indirectement de W. auropunctata en Amérique du Sud, nous présenterons l’expression de cette espèce dans divers types de milieux Guyanais. Dans un second temps, nous étudierons la structure sociale de W. auropunctata dans ces milieux par le biais de tests d’agressivité entre colonies proches et distantes. Puis nous analyserons la place de W. auropunctata dans les communautés de fourmis de ces milieux et les interactions qu’elle entretient avec les espèces dominantes.
Dans une conclusion générale, nous résumerons les données acquises sur la structure sociale de W. auropunctata, sur son expression dans les communautés de fourmis insulaires
nos résultats en perspective avec certains travaux portant sur d’autres espèces envahissantes et plus généralement sur l’écologie des communautés. Nous exposerons ensuite les pistes qui pourraient être explorées pour améliorer les méthodes de lutte contre cette espèce envahissante. D'un point de vue fondamental, nous verrons enfin dans quelle mesure l’étude que nous avons conduite confirme le rôle régulateur de la communauté des fourmis sur une espèce donnée et la complexité des acteurs qui interviennent dans ces phénomènes.
I
NTRODUCTION
FACTEURS
DU SUCCES ECOLOGIQUE ET
DU SUCCES INVASIF DES FOURMIS
I
NTRODUCTIONF
ACTEURS DU SUCCES ECOLOGIQUE ET DU SUCCE S INVASIF DES FOURMISI. L’importance écologique des fourmis et l’organisation de leurs communautés
A. Importance écologique des fourmis
La famille des Formicidae compte plus de 10 000 espèces, réparties en 296 genres et 12 sous-familles (Bolton 1994). Cette forte diversité, leur présence dans la quasi totalité des écosystèmes terrestres et le fait qu'elles constituent une part importante de la biomasse animale, reflètent l'importance de leur succès écologique (Hölldobler et Wilson 1990). Leur mode de vie sociale, qui se retrouve également chez d'autres groupes d'insectes comme les abeilles, les guêpes et les termites, est en grande partie à l’origine de ce succès (Wilson 1971). Par la diversité de leurs modes de vie, les fourmis jouent un rôle primordial au sein des écosystèmes terrestres : ce sont des « espèces clés de voûte » ou «Keystones species » (Bond 1993, Hölldobler et Wilson 1990). Elles sont à la fois des prédateurs qui régulent les populations de nombreux autres insectes, des éboueurs qui font disparaître les cadavres d’insectes ou de petits animaux, des pollinisateurs et des acteurs essentiels dans la dispersion des graines et l’enrichissement des sols (Floren et al. 2002, Tobin 1994, Wilson 1987).
B. Organisation des communautés
Dans les communautés animales, les espèces sont dites organisées lorsque leurs interactions se traduisent par un agencement trop fréquent pour être le simple fruit du hasard. Chez les fourmis, de nombreuses études ont mis en évidence des agencements d’espèces dans la plupart des milieux (Davidson 1998, Andersen et Patel 1994, Savolainen et Vepsäläinen 1988, Fellers 1987, Wilson 1971). Les différentes espèces de fourmis se distinguent par la taille de leurs colonies et/ou de leurs ouvrières, par leurs comportements et par les éléments de leur biologie (régime alimentaire, sites de nidification, rythme d’activité…). Ces caractéristiques vont permettre à chaque espèce un « succès » écologique plus ou moins important, en fonction du milieu considéré et des interactions avec le reste de la communauté.
De ce succès dépend leur place dans la communauté. Il existe plusieurs classifications des fourmis au sein d’une communauté, en fonction de leur abondance, de leur comportement et de leur habileté à monopoliser leurs ressources alimentaires.
Les espèces dominantes sont généralement les plus abondantes et sont caractérisées par des colonies de grandes tailles, réparties en un ou plusieurs nids (Davidson 1998). Ces dominantes vont tolérer sur leur territoire des espèces non dominantes, mais vont exclure les autres dominantes de leurs territoires, ce qui va conduire à une répartition des dominantes en mosaïque. Cette répartition a surtout été mise en évidence au sein de la strate arboricole (Dejean et Corbara 2003, Majer 1993). Chez la plupart des espèces de fourmis, la territorialité ou les comportements agressifs utilisés contre tout type d’intrus, s’échelonnent depuis une zone restreinte autour de l’entrée du nid (la plupart des espèces) jusqu’au territoire dans son ensemble pour les « dominantes territoriales », comme certaines espèces arboricoles qui défendent d’une manière absolue l’accès à leur territoire aux niveaux intra et interspécifiques.
Savolainen et Vepsäläinen (1989) donnent trois classes à la territorialité. La territorialité de type I réside en la défense du nid uniquement, celle de type II en la défense du nid et de la nourriture exploitée et enfin celle de classe III, en une réelle défense d’une aire donnée.
Il est possible de distinguer la « dominance numérique », ou prédominance d’une espèce en nombre et/ou en biomasse (Davidson 1997), la « dominance comportementale », ou dominance au cours de compétition interspécifique due à des capacités supérieures de combat et/ou de recrutement (Schoener 1983) et la « dominance écologique », qui combine les deux précédentes et concerne surtout les espèces invasives (Holldobler et Wilson 1990; Davidson 1998).
Les espèces non dominantes ou opportunistes sont généralement organisées en petites sociétés. Ces espèces persistent dans les milieux en découvrant rapidement les sources de nourritures, mais elles ne peuvent s’y maintenir à l’arrivée des espèces de rang supérieur (Wilson 1971). Certaines espèces sont dites cryptiques, car elles ont un mode vie endogé et ne s’observent que très rarement.
Certaines classifications ne sont valables que dans une communauté donnée. Ainsi, Andersen et Patel (1994) classent les fourmis australiennes en 4 groupes principaux : les Dolichoderines dominantes, les Myrmicines généralistes, les Camponotini subordonnées et les espèces cryptiques. Dans le bush australien, la communauté de fourmis est dominée par
de rang inférieur est complètement dépendante de celle des Iridomyrmex.
L’organisation des espèces au sein d’une communauté s’établit par le jeu de leurs interactions. Ce sont surtout les espèces dominantes qui vont intervenir dans cette organisation.
C. Principales interactions
« Les plus grands ennemis des fourmis sont d’autres fourmis tout comme les plus grands ennemis des Hommes sont d’autres Hommes »
Auguste FOREL
Au sein d’une communauté de fourmis, l’organisation des espèces repose principalement sur les interactions entre les ouvrières, au niveau intra spécifique et/ou interspécifique. Plusieurs types d'interactions peuvent être observés : la compétition, la prédation, le parasitisme, le commensalisme et le mutualisme. La compétition et la prédation sont les interactions les plus déterminantes dans l’organisation des communautés (Ribas et Schoereder 2002, Davidson 1998, Hölldobler et Wilson 1990, Schoener 1983, Wilson 1971).
1. La compétition pour les ressources a) La compétition
"Il y a compétition quand plusieurs organismes (de même espèce ou d'espèces différentes) utilisent des ressources communes ou présentes en quantité limitée ou, si ces ressources ne sont pas limitantes, quand en les recherchant, les organismes en concurrence se nuisent" (Barbault 1992). La compétition peut être intra spécifique, quand les individus impliqués appartiennent à la même espèce, ou interspécifique, lorsque ceux-ci appartiennent à des espèces différentes. Deux grands types de compétition peuvent être distingués :
1 La compétition d’exploitation. L'exploitation des ressources par l'un des concurrents diminue leur disponibilité pour l'autre, entraînant une action indirecte entre les individus ou populations en concurrence. Chez les fourmis, ce mode de compétition intervient par exemple lors de l’acquisition de petites proies, qui sont des sources « instables », se trouvant par hasard dans le milieu.
2 La compétition par interférence. Ce mode de compétition implique une interaction directe des concurrents, l'un interdisant à l'autre l'accès à la ressource recherchée ou
nuisant à son développement. Cette interférence peut être active (un comportement de type agressif oppose les concurrents), ou passive (les compétiteurs s'ignorent, mais l’interférence se fait par l'intermédiaire de substances chimiques secrétées ou excrétées par l'un deux). En effet, de nombreuses espèces de fourmis marquent leur territoire ou leurs ressources avec des substances répulsives pour les compétiteurs (Leston 1978).
Fellers (1987) puis Davidson (1998) ont montré que les différentes espèces exploitant les même types de ressources coexistent dans une même communauté par le jeu d’un équilibre, ou « trade-off », entre leur capacité à découvrir les ressources (compétition d’exploitation) et leur capacité à dominer ces ressources en excluant les autres espèces (compétition d’exploitation). Ainsi, les espèces non dominantes ou sous-dominantes peuvent obtenir des ressources en les découvrant plus rapidement et en les exploitant jusqu’à ce qu’elles en soient chassées par l’arrivée d’autres espèces de rang supérieur.
b) Les ressources
On qualifie de ressources toute substance ou facteur qui peut entraîner une augmentation des taux de croissance lorsque sa disponibilité dans le milieu s'accroît, et qui est consommé par le type d'organisme considéré (Barbault 1992). Ainsi, les sources de nourriture et leurs apports essentiels - nutriments, énergie - sont évidemment des ressources, mais on peut également considérer les partenaires sexuels comme des ressources. De même, certains éléments de l'espace peuvent être des ressources pour des organismes sessiles, dont le taux d'accroissement peut augmenter avec la disponibilité en sites vacants, qui sont "consommés" par le biais de leur colonisation (sites d'habitation ou de nidification). Chez les Formicidae les principales ressources sont d’ordre alimentaire ou spatial (sites de nidifications ou territoire autour du nid). La fréquence des phénomènes de compétition observés chez une espèce dépend de son caractère généraliste ou spécialiste et de la diversité de compétiteurs potentiels présents. Les espèces généralistes vont s’opposer à un plus grand nombre de compétiteurs, mais elles vont, en contre partie, pouvoir exploiter plus de ressources. Pour les quelques espèces dites « spécialisées », qui n’exploitent qu’un seul type de ressources, la diversité de compétiteurs est moindre, tout comme la fréquence des ressources, sans forcément limiter la compétition d’exploitation.
c) Les ressources alimentaires les plus communément exploitées par les fourmis
Deux grands types de ressources alimentaires peuvent être distinguées : les ressources sucrées, ou glucidiques, et les ressources protéiques. Les ressources de type glucidique proviennent de plusieurs sources mais leur origine est directement ou indirectement végétale (Tobin 1994). Les nectaires (organes de production de nectar) qui se retrouvent sur différentes parties des végétaux sont de deux grands types : les nectaires floraux, situés au niveau des fleurs et impliqués dans les processus de pollinisation, et les nectaires extra-floraux. L'hypothèse protectionniste prévaut pour expliquer l’apparition de ces derniers chez les végétaux : en effet, les fourmis attirées par ces ressources vont débarrasser la plante des herbivores rencontrés lors de leurs visites (de la Fuente et Marquis 1999, Oliveira et al. 1999, Jolivet 1996, Beattie 1985, Schemske 1980, mais voir aussi Zachariades et Midgley 1999).
Les fourmis se procurent également ces ressources glucidiques par l’intermédiaire des insectes piqueurs de sève et excréteurs d’un excédent liquide sucré, le miellat (Delabie 2001). La plupart de ces insectes sont des hémiptères, comme les pucerons et les cochenilles, mais des relations de trophobiose peuvent également exister entre fourmis et larves de Lépidoptères (DeVries 1992). De nombreuses espèces de fourmis entretiennent des populations d'hémiptères sur les parties aériennes ou souterraines des végétaux. Il s’instaure une relation mutualiste : les fourmis obtiennent de la nourriture et les hémiptères sont protégés en retour.
Les ressources protéiques, nécessaires au développement des stades larvaires des fourmis, peuvent avoir plusieurs origines. Certains végétaux produisent ce type de ressources. Des fourmis néo-tropicales appartenant au genre Azteca trouvent non seulement des sites de nidification dans les tiges creuses des Cecropia, mais aussi une source de nourriture riche en protéine, les corps de Muller, situés à l’aisselle des feuilles (Davidson et McKey 1993). Un exemple semblable est la relation qui existe entre des fourmis du genre Pseudomyrmex et des Acacia : là encore, les fourmis trouvent un site de nidification dans les tiges creuses et des sources de protéines les corps de Belt (Benson 1985). Les « fourmis moissonneuses » du genre Messor ou Pogonomyrmex tirent leur ressources protéiques des graines qu’elles ramènent au nid (Cerdan 1989). Néanmoins, la majorité des espèces de fourmis trouvent leurs ressources protéiques en chassant d’autres arthropodes ou en récupérant leurs cadavres dans le milieu. Les espèces qui entretiennent des relations de mutualisme avec des homoptères producteurs de miellat peuvent, dans certaines conditions,
consommer aussi quelques individus de leur cheptel (Sakata, 1994).
Enfin les fourmis « champignonnistes » ou « coupeuses de feuilles » tirent leurs ressources alimentaires du mycélium d’un champignon qu’elles cultivent à l’intérieur de larges chambres de leur nid. Ce champignon, Leucocoprinus gongylophorus (Agaricaceae, Basidiomycètes), se développe sur des fragments de feuilles découpées, que les ouvrières ramènent continuellement de l’extérieur (Hölldobler et Wilson, 1990).
d) Une ressource spatiale : les sites de nidification
A l’exception de certaines fourmis dites « légionnaires » dont le mode de vie nomade ne nécessite pas la construction d’un nid, la plupart des autres espèces s’installent dans des cavités naturelles ou construisent de véritables édifices, dans le sol ou dans la végétation. De nombreuses espèces sont opportunistes quant au choix d’un site de nidification, utilisant généralement des cavités naturelles (tiges creuses de branches mortes, interstices entre des feuilles de la litière, etc.). En Amérique tropicale, les fourmis champignonnistes appartenant au genre Atta construisent des nids de grande taille, très élaborés, dans le sol des forêts humides. En Europe, les fourmis granivores du genre Messor, creusent aussi des nids complexes dans le sol (Cerdan 1989).
C’est dans la végétation que l’on trouve les modes de nidification les plus remarquables. Les jardins de fourmis, édifiés par un petit nombre d’espèces de fourmis néo-tropicales en sont un exemple : elles produisent ces structures en incluant des graines d’épiphytes dans les parois en carton du nid quelque temps après la fondation. Le développement des racines va ensuite solidifier la structure (Orivel 2000, Corbara et al. 1999, Corbara et Dejean 1996). Notons que les jardins de fourmis existent également en Asie (Kaufmann et al. 2001). En Afrique, Asie et en Australie, les fourmis du genre Oecophylla ou « fourmis tisserandes » construisent leurs nids en « cousant » les feuilles des arbres avec la soie produite par leurs larves (Références dans Hölldobler et Wilson 1990). Enfin, certaines espèces citées précédemment exploitent les domaties que portent les végétaux avec lesquels elles entretiennent des relations mutualistes.
L’acquisition ou la défense de ces diverses ressources motive et conditionne ainsi les relations de compétition que développent les fourmis.
2. La prédation
« The major predators of ant species are frequently other ant species » (Hölldobler et Wilson 1990)
Les fourmis sont des prédateurs « clés » au sein de la guilde des arthropodes (Floren et al. 2002, Risch et Caroll 1982). Contrairement à la compétition, dont l’impact sur les populations de compétiteurs est plus ou moins long à mettre en évidence, la prédation a des conséquences immédiates et particulièrement néfastes pour l’un des protagonistes car elle va entraîner sa disparition.
Certaines espèces de fourmis sont spécialisées dans la prédation d’autres fourmis. Les plus efficaces sont les fourmis légionnaires. Elles sont présentes dans la plupart des zones tropicales et leurs « raids » prennent souvent pour cibles les jeunes stades (le couvain) qu’elles récoltent en pillant les nids d’autres espèces. Elles jouent un rôle très important dans la régulation des communautés d’arthropodes (Berghoff et al. 2003, Hirosawa et al. 2000, Gotwald 1995). De nombreuses espèces, moins spécialisées que les fourmis légionnaires, peuvent également avoir pour proies les ouvrières d’autres fourmis qu’elles rencontrent au hasard dans le milieu ou sur des ressources alimentaires.
Les interactions au sein de la guilde des fourmis jouent donc un rôle primordial dans l’organisation de leurs communautés. Mais d’autres paramètres jouent un rôle non négligeable dans cette organisation. Ces paramètres peuvent être d’ordre abiotique comme la température (Cerdá et al. 1998), le rythme circadien (Baroni Urbani et Aktaç 1981) et/ou d’ordre biotique comme la pression des parasites et des pathogènes (Feener 2000, Porter et al. 1997).
D. Modes de défense ou d'attaque
Les ouvrières possèdent des moyens de défense ou d’attaque, qu’elles utilisent lors des interactions avec d’autres fourmis (ou avec d’autres taxa) qu’elles chassent ou qui les chassent. Ces mécanismes peuvent être considérés aux niveaux individuel et collectif.
1. Au niveau individuel
L’arsenal dont les ouvrières disposent est très diversifié. Ne seront exposés ici que les moyens de défense et d’attaque les plus communément observés. En général, ils peuvent être rattachés à la sous-famille de l’espèce considérée.
Le Tableau 1 présente, de façon très simplifiée, les principaux moyens de défense ou d’attaques utilisés par les ouvrières des principales sous-familles rencontrées lors de cette étude.
Pour la plupart des espèces, le premier comportement agressif observé est la morsure. L’efficacité de cette attaque dépend de la taille de l’espèce considérée et de la proie ou de l’ennemi rencontré. Certaines espèces au cours de l’évolution ont fait de leurs mandibules des armes redoutables, ainsi les espèces du genre Odontomachus dont les mandibules qui s’ouvrent à 180° se referment à une vitesse extraordinaire sur les proies ou ennemis (Dejean 1980). Les espèces du genre Pheidole (Myrmicinae) possèdent des aiguillons qui ne sont plus fonctionnels : la fonction offensive et défensive est assurée par une caste spécialisée, les majors ou soldats, qui possèdent une tête hypertrophiée portant de larges mandibules, actionnées par des muscles puissants (Wilson 2003).
Tableau 1. Moyens de défense ou d’attaque utilisés au niveau individuel et collectif chez les principales espèces des sous-familles de fourmis rencontrées lors de notre étude. Les sous-familles y sont ordonnées suivant leur degré d’évolution, les Ponerinae étant considérées comme les fourmis les plus primitives et les Formicinae comme les plus évoluées (Hölldobler et Wilson 1990)
Sous-familles Niveau individuel Niveau collectif Ponerinae Morsure, venin injecté avec un
aiguillon
Recrutement faible
Ecitoninae Morsure, venin injecté avec un aiguillon, caste spécialisée
Raids
Pseudomyrmecinae Morsure, venin injecté avec un aiguillon
Recrutement faible à explosif Myrmicinae Morsure, venin injecté avec un
aiguillon, substances répulsives, Castes spécialisées
Recrutement faible à explosif
Dolichoderinae Morsure, venin déposé sur l’adversaire, substances répulsives, Castes spécialisées ( ?)
Recrutement faible à explosif
Formicinae Morsure, Acide formique pulvérisé, substances
Recrutement faible à explosif
répulsives, castes spécialisées
A part les Dolichoderinae et les Formicinae, qui sont les sous-familles les plus évoluées et qui ont perdu ce caractère, toutes les autres espèces possèdent un aiguillon avec lequel elles injectent un venin ou émettent une substance répulsive. Les Dolichoderinae n’injectent plus leur venin mais le déposent sur leurs adversaires et les Formicinae projètent de l’acide formique.
D’autres caractéristiques, que l’on retrouve chez toutes les sous-familles, interviennent au niveau individuel : la taille des ouvrières, l’épaisseur de leur cuticule, la présence de scrobes antennaires permettant d’abriter ces appendice. Des comportements comme l’évitement, ou des stratégies de prédation, doivent aussi être pris en compte, (Hölldobler et Wilson 1990).
2. Au niveau collectif
Les fourmis sont des animaux sociaux. Elles diffèrent de la plupart des animaux sub-sociaux ou grégaires par le fait qu’elles effectuent des tâches en groupes, avec une organisation plus ou moins complexe (Theraulaz et al. 1999, Bonabeau et al. 1997, Deneubourg et Goss 1989). Ces taches collectives ont pour objet la construction et la maintenance du nid, l’exploitation de sources de nourriture, la défense du territoire … Ces deux dernières tâches nécessitent le recrutement d’un nombre plus ou moins important d’individus.
a) Le recrutement
Le recrutement est un type de communication qui amène les individus d’une même société à se rassembler dans une région de leur territoire, dans le but d’y accomplir une tâche particulière : récolte de nourriture, défense du nid ou encore déménagement (Passera 1984; Wilson 1971). Le recrutement des fourmis s’inscrit dans un processus évolutif et adaptatif (Passera 1984).
Le recrutement le plus primitif observé est le « tandem running », durant lequel une ouvrière recrutée va suivre l’ouvrière recruteuse, en gardant un contact étroit par l’intermédiaire des antennes. Le recrutement de groupe marque une étape évolutive : dans ce cas, il concerne une dizaine d’individus qui cheminent à la remorque d’un leader qui balise la piste. Le mode le plus élaboré est le recrutement de masse : après avoir découvert une source
de nourriture, les fourrageuses retournent au nid en déposant une piste chimique ; au niveau du nid, d’autres fourrageuses détectent la piste et la suivent jusqu’à la source de nourriture (Beckers et al. 1990 ; Passera 1984). On parle de recrutement explosif lorsque le nombre d’ouvrières recrutées est très important après seulement quelques minutes (Beckers et al. 1993).
Dans ces dernières techniques, l’acte principal est le dépôt d’une piste chimique par la pourvoyeuse et, d’après Lenoir et Jaisson (1982), le comportement d’invitation, s’il a lieu, n’a qu’un rôle très secondaire en terme de transfert d’information : les fourmis recrutées sont stimulées uniquement par la piste. Cependant, de récents travaux suggèrent que d’autres éléments peuvent être pris en compte par les fourrageuses (Le Breton et Fourcassié, in press). De nombreux exemples montrent qu’au niveau collectif, une colonie est capable d’adapter son recrutement en fonction des caractéristiques de la nourriture exploitée, par l’intermédiaire de cette piste. Une colonie pourra ainsi sélectionner, parmi deux sources de nourriture, celle qui est la plus profitable du fait de sa qualité (Beckers et al. 1993) ou de sa distance par rapport au nid (Detrain et al. 1999, Devigne et Detrain 1999).
Certaines espèces de fourmis vont adopter de véritables stratégies collectives de chasse ou de défense.
b) Les stratégies
Certaines espèces adoptent de véritables stratégies collectives pour chasser ou se défendre. Ainsi, les ouvrières de l’espèce arboricole néo-tropicale Azteca shrimperi (Dolichoderinae) chassent à l’affût sur les feuilles de l’arbre support (Morais 1994, Figure 1)
Figure 1. Ouvrières d’Azteca shrimperi chassant à l’affût sur les bords d’une feuille.
Les lois de Lanchester sont des modèles mathématiques, décrits à l’origine pour caractériser des modèles militaires de combats (Lanchester 1916). Ils permettent de prédire les issues de batailles en se basant sur l’effectif des armées et du potentiel combatif des unités au niveau individuel. Ils ont été utilisés pendant la seconde guerre mondiale à des fins militaires. Ces travaux théoriques ont par la suite été appliqués à la mise en place de stratégies de compétition commerciales pour la conquête ou la défense de marchés (Taoka 1977). Plusieurs auteurs ont appliqué ces lois aux mécanismes compétitifs observés entre les colonies de fourmis qui s’affrontent (Borges 2002, McGlynn 1999, 2000, Whitehouse et Jaffe 1996, Franks et Partridge 1993, 1994).
Selon Lanchester, les batailles peuvent être conduites selon deux stratégies de base. La « loi carrée » (Square law) décrit un scénario au cours duquel les compétiteurs de petite taille doivent utiliser leur avantage numérique pour vaincre des compétiteurs de grande taille dans des combats simultanés. La « loi linéaire » (Linear law) décrit un scénario au cours duquel, dans une série d’interactions un-contre-un, un nombre réduit de combattants efficaces est plus avantageux que de nombreux combattants peu efficaces.
Chez les fourmis, l’exemple illustrant le mieux l’application des stratégies de Lanchester a été montré chez la fourmi champignonniste, Atta laevigata (Whitehouse et Jaffe 1996). Lorsque l’attaque du nid est perpétrée par un vertébré de grosse taille, les ouvrières recrutées pour assurer la défense du nid sont des ouvrières majors de grande taille, aux mandibules puissantes. Mais si des fourrageuses de la même espèce, provenant d’une colonie voisine, sont détectées aux abords du nid, ce sont les minors qui sortent en grand nombre (Whitehouse et Jaffe 1996).
Toutes ces tâches, comme bien d’autres effectuées dans le cadre d’une vie sociale, exigent une coopération étroite entre les congénères, ce qui suppose un système de communication efficace impliquant par un grand nombre de signaux (Hölldobler 1999).
II. Les Fourmis comme envahisseurs biologiques
Le succès écologique des Formicidae leur a permis au cours des temps géologiques de se diversifier et de conquérir la plupart des écosystèmes terrestres du globe. Ce succès permet aujourd’hui à de nombreuses espèces de s’implanter hors de leurs zones d’origines lorsqu’elles sont transportées accidentellement par l’homme.
A. Les invasions biologiques
Pour Williamson (1996), les invasions biologiques décrivent l'établissement d'un organisme, quel qu’il soit, en dehors de son aire de répartition originelle, avec domination des nouveaux territoires, le plus souvent au détriment des espèces autochtones. Les invasions biologiques « naturelles » ont permis la colonisation de nouvelles zones par les êtres vivants et ont contribué à l'évolution et à la structuration des communautés vivantes au cours des temps.
Pendant le dernier demi - millénaire, et plus particulièrement les 200 dernières années, le développement des activités humaines a intensifié ce phénomène. Ainsi le développement de l’agriculture, du commerce, des transports et des voyages a permis le déplacement, délibéré ou accidentel, d’un nombre croissant d’espèces d’une aire géographique vers une autre (Mack et al. 2000). Aujourd’hui, l’intensité, la fréquence et la généralisation du phénomène, couplées à l’accroissement des distances de déplacement, mettent en présence des espèces dont les probabilités de contact biogéographique sont naturellement faibles. Toutes les espèces déplacées ne vont pas induire de conséquences graves au sein des communautés dans lesquelles elles s’installent. Mais ces introductions posent dans certains cas de véritables problèmes et leurs conséquences sont observées à plusieurs niveaux (Williamson 1996, Mack et al. 2000) :
1 Au niveau des espèces : l’introduction, l’installation et l’invasion d’espèces allochtones se font souvent au détriment d’espèces indigènes ; elles peuvent conduire à un simple appauvrissement de leurs effectifs mais, dans de nombreux cas, l’invasion peut entraîner leur l’extinction.
2 Au niveau des écosystèmes : des changements au sein de leur structure modifient les relations des organismes, entre eux et avec leur milieu; de tels effets ont des répercussions préjudiciables au bon fonctionnement des
écosystèmes.
3 Au niveau des activités humaines : en pénalisant les rendements agricoles, en ayant des effets négatifs sur la santé publique ou sur d’autres secteurs économiques.
Les invasions biologiques sont maintenant reconnues comme une des menaces les plus graves envers la biodiversité native et le fonctionnement des écosystèmes ; elles sont considérées comme la seconde cause de disparition des espèces, après la destruction des habitats (Lodge et Shrader-Frechette 2003, Mack et al. 2000, Lowe 2000, Vitousek et al. 1996). On les qualifie parfois de « pollutions biologiques » (Mack et al. 2000). Les échanges commerciaux intenses à l’échelle globale, génèrent aujourd’hui des flux de personnes et de marchandises dans des proportions jamais atteintes précédemment, ce qui malheureusement a pour conséquence l’accroissement des transports d'organismes indésirables. Non seulement les invasions biologiques mettent en péril l'avenir évolutif des communautés, mais elles sont également une menace pour certaines activités humaines.
Plusieurs travaux ont tenté de mettre en évidence les facteurs qui sont à l’origine du succès ou de l’échec d’une espèce introduite (Mack et al. 2000, Williamson 1996). Si les invasions sont nombreuses, un nombre bien plus élevé d’espèces déplacées ne parviennent pas à s’établir, à se développer et à s’étendre dans la nouvelle zone où elles ont été déplacées. Williamson (1996) a ainsi établi une règle empirique (dite tens rule, "règle des 10%") qui, bien qu’assez simpliste étant donné le nombre important de facteur mis en jeu, donne un ordre de grandeur de la proportion d'espèces parvenant à franchir avec succès les étapes de l'introduction, de l'établissement et de l'expansion dans une nouvelle région : pour 1000 "candidats", seule une espèce devient un envahisseur biologique.
Les probabilités de succès dans l’invasion d’un milieu ne sont donc pas les mêmes pour toutes les espèces. Elles dépendent autant des caractéristiques spécifiques de l’espèce déplacée que de celles du milieu dans lequel elles sont introduites (Kennedy et al. 2002, Shea et Chesson 2002, Case 1990).
Comme le souligne Moller (1996), une meilleur compréhension des processus d’invasions apportera probablement des connaissances importantes dans de nombreux domaines de l’écologie. Ceci explique en partie l’intérêt grandissant porté à l’étude des invasions biologiques. Mais cet intérêt semble également lié à la menace qu’elles font peser
sur la diversité spécifique (Pascal et al. 2000) et au coût économique qu’elles font supporter aux différentes sphères de l’activité humaine.
Le succès écologique des fourmis permettent à certaines espèces d’être classées parmi les envahisseurs entraînant les conséquences les plus néfastes dans les zones ou elles ont été introduites et ce à tous les niveaux de l’écosystème considéré (Holway et al. 2002, Lowe 2000).
B. Les fourmis vagabondes ou « tramp species »
Il s'agit d'une classification fonctionnelle, indépendante de la phylogénie, qui rassemble un ensemble d'espèces taxinomiquement très divers.
Wilson et Taylor (1967) donnent la première définition formelle du groupe : le critère retenu est "la capacité à être déplacée par l'Homme dans de nouvelles régions et d’y établir des populations" et les auteurs ont dressé sur cette base une liste de 38 espèces. Leur définition est reprise et complétée par Hölldobler et Wilson (1990): « espèces typiquement polygynes largement distribuées dans le monde par le commerce humain et vivant en association étroite avec l'Homme, pouvant être unicoloniales et pouvant se propager par bouturage ”.
Enfin en 1994, Passera donne une définition fonctionnelle du groupe, basée non seulement sur le lien fort avec les activités humaines et l'environnement anthropique, mais aussi sur des caractéristiques biologiques communes. Cette définition réduit le nombre d’espèces concernées, qui constituent les vraies « tramp species » (Tableau 2). Il retient neuf traits principaux pour décrire leurs sociétés.
?? Faculté de vivre à proximité des habitations et infrastructures humaines, malgré la très grande instabilité de ces milieux.
?? Réduction ou absence de vol nuptial, avec accouplement intranidal et bourgeonnement des nouvelles colonies (budding).
?? Polygynie fonctionnelle : plusieurs reines sont présentes, elles pondent sans dominance hiérarchique. Il s'agit d'une polygynie secondaire. La cohabitation entre les reines a toujours lieu en présence d'ouvrière, à la différence de la polygynie primaire où il y a fondation par pléométrose sans ouvrières (Herbers 1993).
?? Unicolonialité : capacité d'échanger des individus (ouvrières, reines ou couvain) entre plusieurs nids occupant une même zone, voire une même région, sans aucune agressivité intra spécifique (Bustos et Cherix 1998).
?? Tendance à la migration : déplacements fréquents des nids à la moindre perturbation, ou pour se rapprocher des sources de nourritures stables, ce qui permet aux espèces d'utiliser une vaste gamme de sites, même temporaires.
?? Agressivité interspécifique exacerbée.
?? Brièveté de la durée de vie des reines, comparativement à la plupart des autres espèces.
?? Stérilité des ouvrières.
?? Petite taille et monomorphie des ouvrières.
Dolichoderinae
Linepithema humile (Mayr), 1868
Tapinoma melanocephalum (Fabricius), 1793 Technomyrmex albipes (Smith, F.), 1861 Formicinae
Anoplolepis gracilipes (Smith, F.), 1861 Lasius neglectus Van Loon et Boomsa, 1990 Paratrechina bourbonica (Forel), 1886 Paratrechina fulva (Mayr), 1862
Paratrechina longicornis (Latreille), 1802 Paratrechina vaga (Forel), 1901
Plagiolepis alluaudi Emery, 1894 Myrmicinae
Cardiocondyla emeryi Forel, 1881 Cardiocondyla nuda (Mayr), 1866 Cardiocondyla wroughtoni (Forel), 1881 Monomorium destructor (Jerdon), 1851 Monomorium floricola (Jerdon), 1851 Monomorium pharaonis (Linnaeus), 1758 Pheidole megacephala (Fabricius), 1793 Wasmannia auropunctata (Roger), 1863
Cependant, même si ces caractères se retrouvent chez la plupart des espèces invasives, certaines d’entre elles montrent des différences, qui ne semblent pas nuire à leur succès. C’est le cas des fourmis de feu Solenopsis invicta et Solenopsis geminata, dont on retrouve les formes polygyne et monogyne dans les zones d’introduction ; comme Pheidole megacephala, Tableau 2. Liste des espèces répondant aux caractères de tramps species selon Passera (1994). Il est important de noter que ne figure pas dans cette liste Solenopsis invicta et S. geminata (Myrmicinae). Ces espèces ne remplissent pas toutes les conditions caractéristiques des tramps species, comme la polygynie dans les zones où elles ont été introduites.
ces espèces ne sont pas monomorphes. Inversement, la possession d’un seul ou de quelques uns de ces caractères ne va pas assurer le succès invasif d’une espèce. Ainsi, d’autres critères ont été pris en compte pour caractériser les fourmis réellement invasives.
C. Les super-invasives
A l’heure actuelle, seul un petit nombre d’espèces ont un impact réellement dévastateur sur les écosystèmes dans lesquels elles ont été introduites. Holway et al. (2002) dans leur revue sur les fourmis invasives, affinent donc encore la caractérisation des espèces invasives par rapport à la définition de Passera (1994) et distinguent, dans le groupe des espèces vagabondes, les six fourmis invasives considérées comme les plus répandues, les plus abondantes et les plus néfastes dans le monde (Tableau 3).
Pour Holway et al. (2002), les caractéristiques les plus importantes de ces fourmis super invasives sont au nombre de quatre : unicolonialité, omnivorie et trophobiose, activité continue, capacité de fourragement et de recrutement.
Unicolonialité. La caractéristique la plus importante partagée par les espèces super invasives est la tendance à être unicoloniale dans les zones d’introduction. Le fait d’être unicoloniale permet de former des super colonies expansives, polygynes (plusieurs reines), avec une absence d’agressivité entre les ouvrières appartenant à des nids séparés. Ainsi une ou plusieurs zones entières pouvant couvrir des surfaces de plusieurs dizaines d’hectares vont être monopolisées, induisant l’impact négatif des ces fourmis sur les écosystèmes, comme cela a été démontré chez la fourmi d’Argentine (Tsutsui et al. 2003, Tsutsui et Suarez 2003, Giraud et al. 2002). Même si l’unicolonialité est considérée comme un avantage décisif, elle n’a été réellement démontrée expérimentalement que chez la fourmi d’Argentine, et elle est seulement supposée pour les autres espèces. Des données précises sur ce point manquent donc cruellement pour la majorité des espèces envahissantes en particulier dans leurs zones d’origines.
Tableau 3. Caractéristiques des six espèces de fourmis invasives les plus répandues et dont la surpopulation engendrent un impact majeur dans les milieux qu’elles ont envahi (modifié d’après Holway et al. 2003).
Répartition b Structure des coloniesc Espèce Sous- Famillea Native Introduite Polymorphie Zone native Zone d’introductions Régime alimentaired Anoplolepis gracilipes (Crazy ant) F AF ? , ASI ? AF, ASI, AU, CAR, OI, OP Non ? U OM Linepithema humile (Fourmi d’Argentine)
D AS AF, AN, AS, ASI, ME, OA, OP,
Non M-V U OM
Pheidole megacephala (Fourmi à grosse tête)
M AF AF, AS, AU, AN, CAR, ME, OI, OP
Oui ? U OM, GR
Solenopsis invicta Fourmi rouge de feu
M AS AN, AU, CAR, NZ Oui V V OM Solenopsis geminata Fourmi gingembre M AC, AN, AS AF, ASI, AU, CAR, OI, OP Oui V V OM, GR Wasmannia auropunctata Petite fourmi de feu
M AC, AS AF, CAR,
OP, AS, AN Non ? U OM
a
D = Dolichoderinae, F = Formicinae, M = Myrmicinae; b AF = Afrique (subsaharienne), AC = Amérique Centrale, AN = Amérique du Nord, AS = Amérique du Sud, ASI = Asie, AU = Australie, CAR = Caraïbes, ME = Méditerranée, NZ = Nouvelle-Zélande, OA = Océan Atlantique (îles), OI = Océan Indien (îles), OP = Océan Pacifique (îles) ; c M = Multicoloniale, U = Unicoloniale, V = Variable
d
L’omnivorie et la trophobiose. Les fourmis envahissantes ont un régime alimentaire très diversifié : elles sont omnivores. Elles se nourrissent d’animaux morts, chassent des petits invertébrés (dont d’autres espèces de fourmis), récoltent divers matériels d’origine végétal (graines, nectars floraux ou extra floraux) et le miellat produit par des insectes suceurs de sèves comme les pucerons, cochenilles avec les lesquelles elles entretiennent des relations mutualistes (trophobiose) très fortes. Le miellat est une source de nourriture d’une grande valeur pour de nombreuses espèces de fourmis. Cette ressource, sûre et constante, est riche en sucres et en acides aminés (Delabie 2001, Hölldobler et Wilson 1990). La permanence de larges populations d’hémiptères, sur les parties aériennes ou souterraines des végétaux, est essentielle pour que les fourmis invasives puissent maintenir de grandes densités d’ouvrières, dont l’activité est principalement fondée sur la consommation des sucres (Davidson 1998). Dans une étude consacrée à la fourmi de feu S. invicta aux Etats-Unis, Helms et Vinson (2002) ont montré que cette prédominance alimentaire est une des caractéristiques importantes qui permettent à cette espèce d’être invasive. Les auteurs estiment qu’il en est de même pour les autres espèces de fourmis invasives, car cette ressource leur permet d'acquérir une autosuffisance alimentaire et la nourriture n’est alors plus un facteur limitant dans l'accroissement des populations.
Plusieurs expériences ont montré que la présence des fourmis favorise les densités d’insectes producteurs de miellats (Delabie 2001). C’est le cas des fourmis invasives, qui ont une propension à maintenir et accroître de fortes populations des ces insectes. Malgré leur caractère omnivore, leur régime alimentaire est en grande partie composé de miellat. Cela a été montré pour A. gracilipes (Haines et al. 1994), L. humile (Vega et Rust 2001), P. megacephala (Bach 1991), S. geminata (Perfecto et Snelling 1995, Perfecto 1991), S. invicta (Helms et Vinson 2002, Kaakeh et Dutcher 1992, Tennant et Porter 1991), W. auropunctata (Delabie et al. 1994, Clark et Guyasamin 1982).
D’une manière générale, la capacité à satisfaire leurs besoins nutritifs est une caractéristique primordiale du succès de tous les organismes invasifs. Ainsi, Baruch et Goldstein (1999) ont démontré que les plantes invasives présentes à Hawaii exploitent les ressources nutritives de manière plus efficace que les espèces natives. Cette caractéristique est aussi rencontrée chez les vertébrés envahissants (Ehrlich 1989).
L’activité continue (24 heures sur 24) constitue un facteur important en terme de compétition d’exploitation sur les sources de nourritures stables (nectaires extra-floraux, miellat produit par les hémiptères, etc.). Une fois ces ressources acquises, elles ne sont
pratiquement jamais abandonnées par les fourrageuses, c'est-à-dire que des ouvrières sont présentes sur ces sources ou à proximité à tout moment de la journée. Solenopsis invicta, S. geminata et P. megacephala construisent des galeries en terre autour de ces sources stables, afin de les protéger et de limiter leur accès aux compétiteurs potentiels. En terme de partition des niches (niche partitionning), cette occupation des sources stables est primordiale dans les communautés de fourmis envahies, puisqu’elle entraîne un chevauchement temporel des niches avec un grand nombre de compétiteurs. En effet les autres espèces (si elles sont moins compétitives, ce qui est souvent le cas), n’auront aucune créneau temporel pour fourrager sur ces sources. L’activité continue a été observée chez A. gracilipes (Haines 1994), P. megacephala (Hoffman 1998), S. invicta (Morrison 2000), L. humile (Human et Gordon 1996), W. auropunctata (Clark et al. 1982, Meier 1994).
Les capacités de fourragement et de recrutement. Les modèles généraux qui décrivent les communautés de fourmis expliquent la co-existence des espèces par des équilibres entre les capacités d’exploitation et d’interférence des compétiteurs (Holway et Suarez 1999, Davidson 1998, Fellers 1987), règles qui régissent aussi les équilibres au sein d’autres communautés animales. Davidson (1998) a montré que la capacité de briser cet équilibre compétitif pouvait expliquer le succès invasif de la fourmi d’Argentine et celui des autres fourmis invasives. Cette caractéristique résulte en grande partie de l’unicolonialité, qui leur permet une dominance numérique. De plus, à effectif équivalent, les fourrageuses des fourmis invasives patrouillent sur une plus grande superficie que les espèce à un seul nid, grâce à leurs colonies polydomiques (Central-place foraging vs dispersed central-place foraging, Holway et Case 2000). Cette polydomie permet aussi une flexibilité du système, car ouvrières, reines et couvain peuvent être déplacés très rapidement pour s’adapter aux ressources ou aux contraintes du milieu. Toutes les fourmis invasives pratiquent un recrutement de masse, mobilisant un très grand nombre d’ouvrières très rapidement, ce qui est un facteur décisif dans l’acquisition des ressources au sein d’une communauté (Traniello 1989). Ce recrutement nécessite un système de communication très efficace entre les ouvrières et induit un temps de réaction très court au niveau collectif.
D’autres caractéristiques moins primordiales peuvent être aussi considérées.
Moyens de défense ou d’attaque. Les fourmis les plus invasives possèdent des moyens d’attaque efficaces, qui diffèrent en fonction de la sous-famille à laquelle elles appartiennent. Les ouvrières de S. invicta, S. geminata et W. auropunctata utilisent leur
aiguillon pour injecter un venin mortel dans le corps de leur proies, compétiteurs ou ennemis. Les ouvrières de P. megacephala sont aussi des Myrmicinae, mais leur aiguillon atrophié ne leur permettent pas d’injecter efficacement du venin et leur système de défense ou d’attaque repose sur la présence d’ouvrières spécialisées très robustes, les majors (ou soldats). Leur tactique associe les ouvrières minors, qui attaquent également en groupe et écartèlent leurs proies ou leurs adversaires. Les ouvrières d’A. gracilipes projettent un jet d’acide formique, caractéristique des Formicinae, alors que L. humile déposent un venin caractéristique des Dolichoderinae. Les fourmis invasives ne sont pas particulièrement mieux « armées » que les fourmis qu’elles éliminent dans les zones envahies, mais la possession de ces « armements » est nécessaire pour faire d’elles des envahisseurs performants et destructeurs. On remarque aussi que les fourmis super invasives se distinguent de la majorité des fourmis vagabondes par leur comportement agressif lors des rencontres interspécifiques. Dans les communautés envahies par les super invasives, le déclin des espèces natives est toujours observé (Passera, 1994). Pour Holway et Suarez (1999) la plus grande agressivité des espèces invasives, comparativement aux espèces qu’elles déplacent, pourrait être liée à leurs milieux d’origines dans lesquels la forte agressivité est adaptative.
Le nombre d’études publiées sur chaque fourmi invasive varie selon l’espèce considérée, en relation avec les enjeux économiques et sociaux de leur impact. En se basant sur la base de données bibliographique FORMIS 2002 (Porter et Wojcik 2002) qui, bien que non exhaustive, est la base la plus complète à ce jour, la plus étudiée est S. invicta, suivie par S. geminata, L. humile, P. megacephala, W. auropunctata et A. gracilipes.
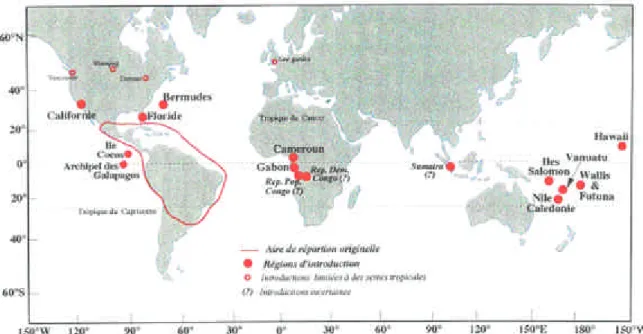
La petite fourmi de feu W. auropunctata est une espèce maintenant largement répandue dans la ceinture tropicale. Sa présence y engendre le plus souvent de nombreux problèmes d’ordre écologiques et économiques. Néanmoins, relativement peu d’études ont été menées sur les facteurs proximaux de son succès à envahir et saturer les zones d’introductions (Wetterer et Porter 2003, Holway et al. 2002, Jourdan et al. 2002).
D. La petite fourmi de feu Wasmannia auropunctata
1. Morphologie de l’espèce et éléments de sa biologie
Les ouvrières de W. auropunctata sont petites (1,2-1,5 mm), d’une couleur variant du brun doré au brun foncé. L’espèce est monomorphe (une seule caste d’ouvrières). Les femelles sexuées (reines) sont beaucoup plus grandes que les ouvrières (4,5 à 5,0 mm), et de couleur plus sombre. Il en est de même pour les mâles.
Le cycle de développement de chaque classe d’individus de cette espèce est résumé dans la Figure 3. La durée moyenne du cycle, de l’œuf à l’adulte, est de 37±2,5 jours pour une ouvrière et leur durée de vie moyenne est de 45 jours. Les reines vivent plus longtemps (11 à 14 mois), et l’on estime l’espérance de vie des mâles entre quelques jours et quelques semaines (Ulloa-Chacón 1990, Jourdan 1999).
La ponte est élevée chez les jeunes reines (jusqu’à 73 œufs en 24 heures) et diminue progressivement au cours de leur vie (seulement 5 œufs en fin de vie). D’autres facteurs interviennent également sur la fécondité, comme la présence de larves au sein de la colonie, ou le nombre de reines dont la coexistence dans le nid va induire un phénomène de
Cuticule épaisse
Aiguillon bien développé
Figure 2. Dessin d’une ouvrière de Wasmannia auropunctata (d’après Hölldobler et Wilson 1990).
compétition pour la nourriture et pour l’attention des ouvrières (Ulloa-Chacón 1990).
Wasmannia auropunctata est une espèce typiquement généraliste, pour son régime alimentaire comme pour le choix de sites de nidification (Jourdan 1999, Tennant 1994, Ulloa-Chacón et Cherix 1990, Young 1986, Clark et al. 1982). L’espèce est décrite comme une opportuniste alimentaire, avec cependant une préférence pour les miellats d’hémiptères et les nectars floraux ou extra-floraux (Apple et Feener 2001, Blüthgen et al. 2000a, De La Fuente et Marquis 1999, Delabie et al. 1994, Schemske 1982). Des observations ont également fait état de la consommation de graines (Clark et al. 1982, Torres 1984), mais la majeure partie des protéines provient de petits arthropodes. Ces derniers sont tués ou récupérés morts dans le milieu (Clark et al. 1982, Torres 1984). Les ouvrières injectent un venin puissant dans le corps de leurs proies avec leur aiguillon bien développé (Howard et al. 1982). Cette capacité de prédation a valu à W. auropunctata d’être étudiée en tant qu’auxiliaire pour lutter contre certains ravageurs des cultures (de Souza et al. 1998, De Medeiros et al. 1995, Bruneau de Miré 1969). Mais sa propension à élever de larges populations d’insectes producteurs de miellat et la piqûre irritante qu’elle inflige aux travailleurs sont des inconvénients majeurs à son utilisation comme auxiliaire. Si W. auropunctata est considérée comme une fourmi agressive envers l’Homme, ses ouvrières ne piquent cependant le plus souvent que quand elles sont coincées entre des plis de la peau (cou, aisselle des bras) ou entre le corps et les vêtements. Il faut donc relativiser cette agressivité, comparée à d'autres espèces de fourmis qui attaquent réellement quand on se trouve sur leur territoire.
La petite fourmi de feu exploite une large gamme de sites de nidification. Ceci est vraisemblablement rendu possible grâce à la petite taille des ouvrières et au déplacement continu des reines et du couvain dans des sites convenables (conditions d’humidité et de température, rapprochement des sources de nourriture). Les ouvrières ne construisent pas de structures complexes pour s’abriter. Elles utilisent des cavités naturelles qu’elles aménagent avec des petits débris. Leurs nids se trouvent aussi bien au niveau du sol que dans la végétation (Way et Bolton 1997, Young 1986, Clark et al. 1982). On l’a souvent observée nichant dans les domaties de plantes myrmécophytes comme Conostegia setosa (Melastomataceae) au Costa Rica et au Panama (Alonso 1998, Tennant 1994). Elle peut occuper les domaties de Tococa sp. (Melastomataceae) en Guyane (obs. pers) et semble aussi affectionner certaines épiphytes (Blüthgen et al. 2000b, Dejean et al. 1995).
Figure 3. Cycle de développement de Wasmannia auropunctata (d’après Jourdan 1999, adapté de Ulloa-Chacón 1990).