© Andrée-Anne Clément, 2019
Santé cardiométabolique chez la femme obèse:
importance de l'état fonctionnel de différents dépôts
adipeux
Mémoire
Andrée-Anne Clément
Maîtrise en kinésiologie - avec mémoire
Maître ès sciences (M. Sc.)
Santé cardiométabolique chez la femme
obèse : importance de l’état fonctionnel
des différents dépôts adipeux
Mémoire
Andrée-Anne Clément
Sous la direction de :
Pascale Mauriège, directrice de recherche
Denis R Joanisse, codirecteur de recherche
ii
Résumé
L’épidémie d’obésité est maintenant bien répandue à l’échelle mondiale. Toutefois, il existerait une relation distincte entre les différents dépôts adipeux et la santé cardiométabolique des individus. Celle-ci pourrait expliquer l’hétérogénéité observée au sein de la population avec une obésité et le fait que certains individus ne présentent pas les complications associées à l'obésité et sont qualifiés de metabolically healthy obese (MHO). Dans le cadre de ma maitrise, je me suis intéressée aux différences entre certains dépôts adipeux, mais également à la dysfonction du tissu adipeux (TA) dans sa globalité, et ce, en situation d’obésité. Dans un premier temps, nous avons étudié chez des femmes avec une obésité sévère, les différences régionales relatives à l’expression de plusieurs gènes impliqués dans certaines fonctions métaboliques et sécrétoires de trois dépôts adipeux intra-abdominaux ainsi que leurs associations respectives avec plusieurs marqueurs du profil cardiométabolique. Les trois dépôts adipeux étudiés ne présentent pas les mêmes caractéristiques fonctionnelles relativement aux différents gènes évalués. De plus, les relations entre l’expression de ces gènes et la résistance à l’insuline et certains biomarqueurs inflammatoires ne sont pas semblables dans les trois dépôts évalués. Dans un deuxième temps, nous avons vérifié si l’adiposopathie, évaluée par le rapport adiponectine/leptine (A/L) et reflétant la santé globale du TA, influence la résistance à l’insuline, chez des femmes sédentaires et avec une obésité modérée, avant et après un programme d'activité physique aérobie de 16 semaines. Nous avons observé que le rapport A/L n’est pas modifié à la suite du programme d’entrainement, bien que l’homéostasie du glucose et de l’insuline le soit avant et après notre intervention. À la lumière de nos résultats, il serait pertinent de considérer l’importance des différents dépôts adipeux et plus particulièrement la répercussion de leur état fonctionnel sur la santé cardiométabolique de femmes avec une obésité.
iii
Abstract
It is well established that obesity has reached epidemic proportions throughout the world. However, it appears that a distinctive relationship exists between each fat depot and the cardiometabolic profile of individuals with obesity. This relationship might explain the presence of different phenotypes within the obese population and the fact that some individuals do not display the cardiometabolic complications associated with this condition which corresponds to the metabolically healthy obese profile named MHO. In this context, the primary aim of this thesis was to investigate different intra-abdominal fat depots and adipose tissue (AT), in terms of their dysfunctions and their respective associations with adverse cardiometabolic complications. Firstly, we compared regional variations in gene expression involved in some AT metabolic and secretory functions and their respective associations with cardiometabolic markers, in women with severe obesity. Our results indicate that the three intra-abdominal fat depots are characterized by different functional characteristics. Moreover, relationships between AT gene expression and insulin resistance as well inflammatory biomarkers differ within each fat depot. Secondly, we investigated the relationship between adiposopathy assessed as the adiponectin/leptin (A/L) ratio and glucose-insulin homeostasis in sedentary women with moderate obesity, before and after an aerobic training program of 16 weeks. Adiposopathy was not modified by aerobic training, despite changes in glucose-insulin homeostasis. However, the A/L ratio was an independent and significant predictor of glucose-insulin homeostasis indices, at pre- and post-intervention. Our results suggest that it would be relevant to examine the contribution of various fat depots and more particularly the impact of their functional status on the cardiometabolic health of women with obesity.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations, sigles, acronymes ... ix
Remerciements ... xiii
Avant-propos ... xv
Introduction générale ... 1
1 Problématique de l’obésité ... 3
1.1 Définition et classification de l’obésité ... 3
1.1.1 L’indice de masse corporelle ... 3
1.1.2 La circonférence de la taille ... 4
1.1.3 Le pourcentage de masse grasse ... 5
1.2 Prévalence de l’obésité ... 6
1.3 Principaux facteurs causals associés à l’obésité ... 9
1.3.1 Facteurs génétiques ... 10
1.3.2 Facteurs environnementaux ... 11
1.3.2.1 Mauvaises habitudes et comportements alimentaires ... 11
1.3.2.2 Inactivité physique et sédentarité ... 12
1.4 Comorbidités associées à l’obésité ... 13
1.4.1 Profil lipidique-lipoprotéique altéré ... 13
1.4.2 Homéostasie du glucose et de l’insuline altérée ... 14
1.5 Le phénotype d’obésité sans anomalie métabolique ... 17
1.5.1 Classification et prévalence des individus MHO ... 17
1.5.2 Caractéristiques principales des individus MHO ... 22
1.5.3 Influence du tissu adipeux dans le phénotype MHO ... 26
1.5.4 Morbidité et mortalité des individus MHO ... 27
1.5.5 Effet d’une perte de poids sur le profil métabolique des individus MHO ... 29
v
2.1 Distribution des différents dépôts adipeux ... 32
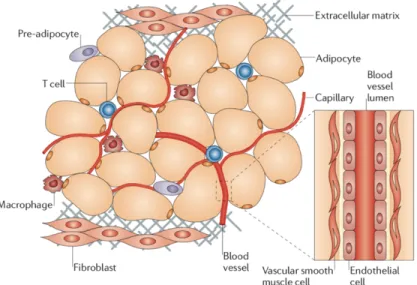
2.2 Composition cellulaire du tissu adipeux ... 37
2.3 Mécanismes d’hyperplasie et d’hypertrophie ... 38
2.4 Adipogenèse ... 39
2.5 Caractéristiques fonctionnelles du tissu adipeux ... 43
2.5.1 Fonctions métaboliques ... 43
2.5.1.1 Transport des AGL ... 43
2.5.1.2 Lipogenèse de novo et synthèse des TG ... 44
2.5.1.3 Variations régionales relatives à l'action de la LPL et à la lipogenèse .. 46
2.5.2 Fonction sécrétoire ... 47
2.5.2.1 Angiogenèse ... 47
2.5.2.2 Hypoxie ... 49
2.5.2.3 Fibrose ... 50
2.5.2.4 Inflammation ... 52
2.5.2.4.1 Tumor necrosis factor-a (TNF-a) ... 52
2.5.2.4.2 Interleukine-6 (IL-6) et protéine C-réactive (CRP) ... 53
2.5.2.4.3 Plasminogen Activator-Inhibitor-1 (PAI-1) ... 54
2.5.2.4.4 Leptine ... 55
2.5.2.4.5 Adiponectine ... 56
2.6 Adiposopathie ... 59
2.6.1 Méthodes d’évaluation de l’adiposopathie ... 60
3 Problématique de recherche ... 62 3.1 Problématique ... 62 3.2 Hypothèse ... 62 3.3 Objectifs ... 62 3.3.1 Volet 1 ... 63 3.3.2 Volet 2 ... 63
4 Intra-abdominal adipose depot variation in adipogenesis, lipogenesis, angiogenesis and fibrosis, and their relationships with insulin resistance and inflammation ... 64
4.1 Résumé ... 65
4.2 Abstract ... 66
5 The relationship between adiposopathy and glucose-insulin homeostasis is not affected by moderate intensity aerobic training in healthy women with obesity ... 102
5.1 Résumé ... 103
vi
6 Discussion ... 128
6.1 Comparaison des fonctions métaboliques et sécrétoires des différents dépôts adipeux intra-abdominaux ... 128
6.2 Association entre l’expression de gènes des fonctions métaboliques et sécrétoires de dépôts adipeux et le profil cardiométabolique de femmes avec une obésité sévère. ... 130
6.3 Association entre l’adiposopathie et la résistance à l’insuline ... 132
6.4 Influence d’un programme d’activité physique sur la relation entre l’adiposopathie et la résistance à l’insuline ... 133
6.5 Meilleurs prédicteurs de l’homéostasie du glucose et de l’insuline parmi les marqueurs disponibles ... 133
6.6 Limites ... 134
6.7 Perspectives ... 135
Conclusion ... 138
Annexe A Liste plus exhaustive (mais non complète) des facteurs sécrétés par le TA ... 139
vii
Liste des tableaux
Tableau 1.1 Classification de l’obésité chez l’adulte en fonction de l’IMC et le risque
développer des problèmes de santé. ... 4
Tableau 1.2 Différents indices d’évaluation de la résistance et de la sensibilité à l’insuline. ... 16
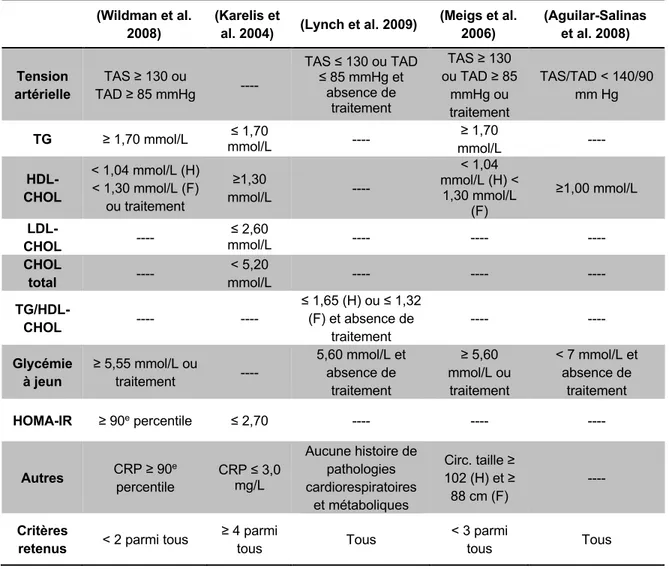
Tableau 1.3 Critères utilisés dans les définitions du phénotype MHO. ... 18
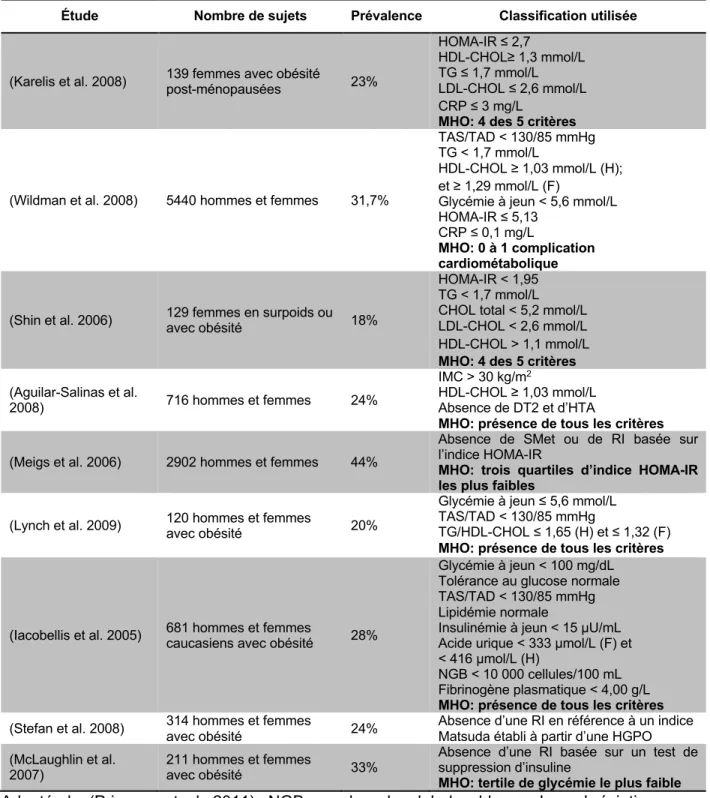
Tableau 1.4 Prévalence du phénotype MHO selon les classifications utilisées. ... 20
Tableau 2.1 Classification des dépôts adipeux viscéraux ... 35
Tableau 2.2 Résumé des principaux biomarqueurs dans le tissu adipeux. ... 58
Table 4.1 Physical and metabolic characteristics of women with severe obesity. .... 70
Table 4.2 Primer sequences and qPCR conditions for genes of interest. ... 73
Table 4.3 Spearman correlation coefficients (ρ) between regional variation in AT gene expression and selected biomarkers of the inflammatory profile. ... 78
Table 4.4 Spearman correlation coefficients (ρ) and p values between adipogenesis and lipogenesis gene expression, within each fat depot. ... 81
Table 4.5 Spearman correlation coefficients (ρ) and p values between adipogenesis and AT hypoxia, angiogenesis, fibrosis gene expression, within each fat depot. ... 83
Table 4.6 Spearman correlation coefficients (ρ) and p values between AT hypoxia, angiogenesis and fibrosis gene expression, within each fat depot. ... 84
Table 4.7 Summary of regional variation in AT gene expression of secretory factors. ... 85
Table 5.1 Physical characteristics and lipid-lipoprotein profile before and after the walking program. ... 119
Table 5.2 Glucose-insulin homeostasis, and inflammatory and adipokine profiles before and after the walking program. ... 120
Table 5.3 Spearman correlation analysis (ρ) between the adiponectin/leptin ratio and participants' characteristics before and after the walking program. ... 121
Tables 5.4 Multiple regression models of predictors of glucose-insulin homeostasis before and after the walking program. ... 122
viii
Liste des figures
Figure 1.1 Modèle de prédiction selon la prévalence du surpoids et de l’obésité chez
la population adulte canadienne entre 2013 et 2019. ... 7
Figure 1.2 Évolution de la proportion de la population âgée de 18 ans et plus présentant une obésité1,2, selon le sexe, Québec, 2003 à 2014. ... 8
Figure 1.3 Composantes du bilan d’énergie. ... 10
Figure 1.4 Obésité et développement de la RI et de l’inflammation systémique. ... 15
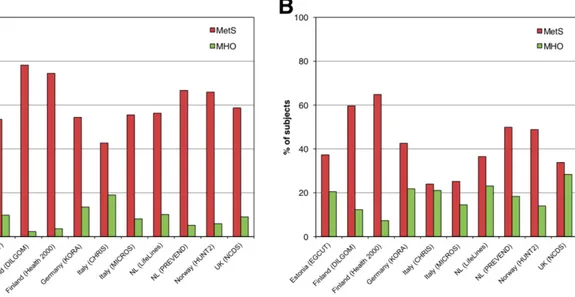
Figure 1.5 Prévalence du syndrome métabolique (SMet) et du phénotype métaboliquement sain d’obésité (MHO) standardisée pour l’âge chez des sujets avec obésité (IMC ³ 30 kg/m2) masculins (A) et féminins (B) de différentes cohortes européennes. ... 22
Figure 1.6 Différences moyennes standardisées (taille de l’effet : d de Cohen) entre les individus avec obésité métaboliquement sains (MHO) et métaboliquement anormaux (MAO). ... 24
Figure 1.7 Caractéristiques principales des individus MHO. ... 25
Figure 2.1 Différences sexuelles dans la répartition de la masse adipeuse. ... 33
Figure 2.2 Distribution régionale de la masse adipeuse. ... 34
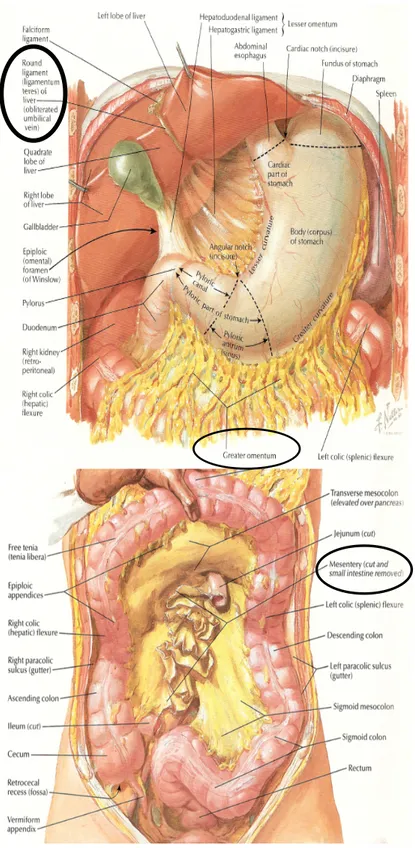
Figure 2.3 Localisation anatomique des dépôts intra-abdominaux étudiés (omental, mésentérique et ligament rond) ... 36
Figure 2.4 Composition du tissu adipeux. ... 37
Figure 2.5 Caractéristiques spécifiques aux mécanismes d’hyperplasie et d’hypertrophie des adipocytes. ... 39
Figure 2.6 Adipogenèse : les différentes étapes de la différenciation adipocytaire. . 40
Figure 2.7 Interactions entre les différents facteurs de transcription de l’adipogenèse. ... 42
Figure 2.8 Transport des AGL et synthèse des TG ... 45
Figure 2.9 Représentation schématique de la relation entre l’hypoxie, la fibrose et le développement de la RI. ... 51
Figure 2.10 Relation entre l’adiposopathie, une dysfonction du tissu adipeux, et différentes complications. ... 59
Figure 2.11 Évolution du rapport adiponectine/leptine en fonction de l’IMC. ... 60
Figure 4.1 Regional variation in AT mRNA levels of early (upper panels) and of late (lower panels) adipogenic factors. ... 92
Figure 4.2 Regional variation in AT mRNA levels of FA transport and lipogenic factors. ... 93
Figure 4.3 Regional variation in AT mRNA levels of hypoxic and angiogenic (upper panels) and fibrotic factors (lower panels). ... 94
Figure 4.4 Relationships between COL6A3 mRNA levels in different fat depots and fasting glycemia (upper panels), fasting insulinemia (middle panels) and HOMA-IR index (bottom panels). ... 95
Figure 5.1. Relationships between adiposopathy (assessed as the adiponectin/leptin ratio) and markers of glucose homeostasis, both before and after training. ... 123
ix
Liste des abréviations, sigles, acronymes
% MG : Pourcentage de masse grasse A/L : Adiponectine/leptine
AdipoR : Récepteur de l’adiponectine AGL: Acides gras libres
AP: Activité physique Apo : Apolipoprotéine
AUC : Aire sous la courbe (Area Under the Curve) C/EBP : CCAAT enhancer binding protein
CHOL : Cholestérol
COL6A3 : Collagène VI sous-unité alpha 3 CRF : Cardiorespiratory fitness
CRP : Protéine C-réactive DAG : Diacylglycérol
DEXA : Dual Energy X-ray Absorptiometry
DGAT : Diacylglycérol acyltransférase (Diacylglycerol acyltransferase) DT2: Diabète de type 2
FAT/CD36 : Fatty Acid Translocase/Cluster of Differentiation 36 FSV : Fraction stroma-vasculaire
HDL : Lipoprotéines de haute densité (High Density Lipoproteins) HGPO : Test d’hyperglycémie provoqué par voie orale
HIF : Hypoxia Inducible Factor
HOMA-IR: Homeostasis Model Assessment of Insulin Resistance HTA : Hypertension artérielle
IL : Interleukine
IMC : Indice de masse corporelle INFg : Interféron-g
IRM : Imagerie par résonance magnétique
QUICKI: Quantitative Insulin Sensitivity Check Index
LDL: Lipoprotéines de faible densité (low density lipoproteins) LOX : Lysyl oxidase
LPL : Lipoprotéine lipase LXR-a: Liver X-Receptor alpha MCV : Maladie cardiovasculaire MEC : Matrice extracellulaire MHO : Metabolically healthy obese
MNHW : Metabolically healthy normal weight MUHO : Metabolically unhealthy obese
NCEP/ATP III : National Cholesterol Education Program Adult Treatment Panel III NGB : Nombre de globules blancs
NHLBI: National Heart, Lung and Blood Institute OMS : Organisation Mondiale de la Santé PAI-1 : Plasminogen Activator-Inhibitor-1
x PO2 : Pression en oxygène
PPAR : Peroxysome proliferator activator receptor QFS : Québec Family Study
RI : Résistance à l’insuline
SCD1 : Stearoyl-CoA desaturase 1 SI : Sensibilité à l’insuline
SMet : Syndrome métabolique
SREBP-1c : Sterol regulatory element binding protein 1c TA : Tissu adipeux
TA SCABD : Tissue adipeux sous-cutané abdominal TAD : Tension artérielle diastolique
TAS : Tension artérielle systolique TASC : Tissu adipeux sous-cutané TG : triglycérides
TGF-b : Transforming Growth Factor-b TNF-a : Tumor necrosis factor-a
VEGF-a : Vascular endothelial growth factor-a
xi
À Grand-papa, tu étais présent pour me voir débuter cette aventure,
en voici l’aboutissement
xii
Le futur appartient à ceux qui croient à la
beauté de leurs rêves
-Eleanore Roosevelt
xiii
Remerciements
D’abord, je tiens à remercier sincèrement ma directrice de recherche, Pascale Mauriège, pour son implication dans ma réalisation scientifique des dernières années. Notre collaboration a débuté il y a quelques années, alors qu’elle m’a accueillie dans son laboratoire afin que je puisse y effectuer mes stages de baccalauréat. Sa patience et sa confiance tout au long de mes stages m’ont permis d’acquérir une base solide en laboratoire, malgré mon inexpérience au début de ceux-ci. Lorsque j’ai décidé de poursuivre mes études à la maîtrise, elle m’a accueillie encore une fois à bras ouverts et nous avons entamé deux belles années de collaboration. Elle a toujours été à l’écoute et ses encouragements constants m’ont permis de m’épanouir dans ce milieu. Elle remplit à merveille son rôle de mentor lors de ces deux années, et m’a donné toutes les opportunités possibles afin que mon expérience à la maîtrise soit des plus complètes. Je suis choyée d’avoir développé une relation privilégiée avec elle et d’avoir bénéficié de son appui à chaque étape de notre collaboration. Sa passion pour son travail est contagieuse, et je peux affirmer hors de tout doute que c’est elle qui m’a donnée la piqure de la recherche à proprement dit.
Je veux également remercier mon co-directeur Denis R. Joanisse, toujours présent dès que j’avais des petites questions et pour son soutien et ses précieux conseils à chacune des étapes qui ont mené à la finalisation de ma maîtrise. Il était présent au bon moment et a contribué, à sa façon, à ma progression au cours des dernières années. Un merci tout particulier à Michel Lacaille pour son expertise et sa passion pour le travail de laboratoire, qu’il a su me partager avec brio.
Je tiens également à remercier les étudiants avec qui j’ai eu l’opportunité de travailler ou d’échanger au PEPS ou au centre de recherche de l’IUCPQ au cours de ces deux merveilleuses années : Dominic Chartrand, Pénélope Paradis-Deschênes, Emma Galbraith, Audrey Drapeau et Sarah Beausoleil. Ce fût un plaisir de vous côtoyer, d’échanger et de discuter avec vous, même si nous ne nous voyions pas souvent.
Je tiens également à remercier le centre de recherche de l’institut universitaire de cardiologie et de pneumologie de Québec pour le soutien financier que j’ai reçu au cours de ma maîtrise. De plus, je remercie la FESP pour la bourse de persévérance à la maîtrise que
xiv
j’ai obtenue ainsi que les bourses de voyage de l’AELIES qui m’ont permis de présenter mes résultats dans des congrès internationaux.
Merci à ma famille, mes parents, Martin et Sylvie et ma sœur Marie-Pier de m’avoir épaulé à leur façon à chaque étape de mon parcours académique et qui continuent de le faire d’une merveilleuse façon, quel que soit le chemin que j’entreprends. Leurs encouragements dans les moments plus ardus m’ont toujours permis d’avancer.
Un dernier mot pour mon amoureux Maxime, qui réussit toujours à me rassurer, peu importe les décisions que nous prenons et qui, de près ou de loin, me supporte dans cette folle aventure.
xv
Avant-propos
Au cours de ma maîtrise, j’ai eu l’opportunité de travailler sur deux projets connexes ayant comme thème principal l’obésité et la santé cardiométabolique de la femme, sous la direction de la Dre Pascale Mauriège. Le premier projet avait pour objectif d’examiner les variations régionales relatives à l’expression de différents gènes impliqués dans les fonctions métaboliques et sécrétoires de dépôts adipeux intra-abdominaux ainsi que les relations entre l’expression de ces gènes et plus précisément la résistance à l’insuline et l’inflammation, chez des femmes avec une obésité sévère. Pour ce projet, j’ai réalisé les différentes analyses de laboratoire sous la supervision de M. Michel Lacaille. J’ai également effectué l’interprétation des données obtenues ainsi que la conception des tableaux et figures, en plus de participer activement à la rédaction du manuscrit. Celui-ci intitulé «Regional variation in adipogenesis, lipogenesis, angiogenesis and fibrosis : relationships
with insulin resistance and inflammation» compose le Chapitre 4 du mémoire. Cet article est
actuellement en préparation et devrait être soumis à la revue PLOS One. Je tiens à remercier les co-auteurs de cet article pour l’ensemble de leurs contributions, lesquelles sont détaillées ci-dessous. Tout d’abord, M. Simon Biron, chef de l’équipe de chirurgie bariatrique de l’Institut Universitaire de Cardiologie et de Pneumologie de Québec (IUCPQ) et M. Denis Richard, directeur du centre de recherche de l’IUCPQ ont permis la constitution de la banque de tissus adipeux grâce à laquelle nous avons pu effectuer cette étude. Mme Isabelle Lemieux et M. Jean Bergeron ont mis à disposition le matériel et les ressources nécessaires aux dosages plasmatiques des adipokines et de PAI-1 qu’ils ont supervisés. Mme Catherine Mounier et M. Denis R. Joanisse, impliqués dans la conception du projet, ont apporté leur soutien scientifique et technique à différents niveaux de l'expérimentation. Les analyses statistiques et la révision de l'écriture du manuscrit ont été réalisées par M. Denis R. Joanisse. M. Michel Lacaille m'a initiée aux différentes techniques de laboratoire et m'a supervisée lors des différentes analyses effectuées. Finalement, Mme Pascale Mauriège a imaginé et mis en œuvre l’ensemble de ce projet de recherche financé par la Fondation de l'IUCPQ et au sein duquel Mme Catherine Mounier et M. Denis R. Joanisse sont codemandeurs, et m’a encadrée tout au long de mon implication dans cette étude, que ce soit de l’analyse et l’interprétation des données jusqu'à la rédaction du manuscrit.
xvi
La seconde étude à laquelle j’ai contribuée au cours de ma maîtrise correspond à une analyse secondaire dont l’objectif était d’examiner la relation entre l’adiposopathie, évaluée par le rapport adiponectine/leptine, et l’homéostasie du glucose et de l’insuline avant et après une intervention d’activité physique, chez des femmes avec une obésité modérée. Il s’agissait de ma première expérience dans l’interprétation de données ainsi que dans la rédaction d’un manuscrit. Ce dernier intitulé: « The relationship between adiposopathy and
glucose-insulin homeostasis is not affected by moderate intensity aerobic training in healthy women with obesity » est présenté au Chapitre 5 de ce mémoire. Cet article est paru en
2018 dans le Journal of Physiology and Biochemistry. J’aimerais remercier les différents co-auteurs de cet article pour leur contribution respective dans le projet MenOEx. Tout d’abord, Éléonore Riesco et Sébastien Tessier, étudiants au doctorat et à la maîtrise respectivement à ce moment-là, ont été impliqués à différents stades du projet (entraînement des participantes, évaluation de leur composition corporelle et de leur condition physique, dosages plasmatiques et tissulaires ainsi que leurs analyses respectives). Mme Francine Pérusse a effectué le recrutement des participantes et a planifié les différents tests faisant partie de cette étude. Les Drs Jean Doré et John Weisnagel ont effectué la supervision médicale et le suivi des participantes ainsi que les biopsies de tissu adipeux prévues dans ce projet. Mme Mélanie Côté a effectué les dosages plasmatiques d’adiponectine et M Jean-Pierre Després (son directeur de recherche) a également mis à disposition les ressources et le matériel nécessaires pour effectuer ces dosages. M Michel Lacaille a supervisé E. Riesco et S. Tessier dans les différentes analyses de laboratoires prévues dans ce projet et a effectué les dosages plasmatiques de leptine qui ont permis d'ajouter un volet à cette étude. M Denis R. Joanisse a contribué au niveau conceptuel, en suggérant l'étude de l’adiposopathie dans le cadre d’une intervention basée sur l’activité physique, en plus de réaliser les analyses statistiques et de participer à la rédaction du manuscrit. Finalement, Mme Pascale Mauriège a conçu et dirigé le projet MenOEx dans son ensemble, projet de recherche financé par les Instituts de Recherche en Santé du Canada (IRSC) et m’a supervisée tout au long des étapes qui ont mené à la publication de l'article en question.
xvii
Au cours de ma maîtrise, j’ai également participé activement à l’écriture d’une revue de littérature. Celle-ci, intitulée « Le phénotype d’obésité sans anomalies métaboliques : un état transitoire? » a été publiée en français dans le journal Obésité en 2018. Avec l’aide de ma directrice de recherche, Mme Pascale Mauriège, j’ai effectué le recensement des articles pour cette revue et j’ai rédigé le manuscrit. À titre de co-auteur, mon co-directeur de recherche, M. Denis R Joanisse a effectué les demandes d’autorisation pour les différentes figures incluses dans cette revue et a contribué à la relecture de la version définitive de l’article.
1
Introduction générale
La prévalence de l’obésité ne cesse de prendre de l’expansion à l’échelle mondiale, celle-ci ayant triplé depuis 1975. En 2016, près 1,6 milliard d’adultes présentaient un surpoids, et près de 650 millions d’entre eux étaient atteints d’obésité ((OMS) 2018a). La problématique de l’obésité est présentée plus en détails au premier chapitre de ce mémoire. Cet accroissement est d’autant plus important puisqu’il est associé au développement de nombreuses complications cardiométaboliques comme le diabète de type 2 (DT2) et le syndrome métabolique (SMet), cette problématique étant traitée plus en détails au Chapitre 1 du présent mémoire. Bien plus qu’à l’obésité elle-même, ces complications sont directement corrélées à l’exacerbation du tissu adipeux (TA) au niveau viscéral (Despres and Lemieux 2006; Arsenault et al. 2010; Bastien et al. 2014). Malgré des distinctions établies entre les TA sous-cutanés et viscéraux dans leur ensemble, celles concernant les différents dépôts adipeux intra-abdominaux sont encore peu connues, en particulier chez les femmes atteintes d’obésité sévère. Dans la littérature, une grande importance est attribuée au dépôt adipeux omental (OM) et, à un moindre niveau, au dépôt mésentérique (ME). Le Chapitre 2 de ce mémoire présente de façon plus approfondie ces différents dépôts adipeux ainsi que les fonctions métaboliques et sécrétoires qui leurs sont propres. Bien que les dépôts OM et ME soient reconnus pour leur implication dans la résistance à l’insuline (RI) et l’inflammation (Bastien et al. 2014; Mauriège et al. 2015), un troisième TA intra-abdominal, celui du ligament rond (LR), a été beaucoup moins étudié dans ce contexte. Cependant, le TA du LR présenterait des différences tant aux niveaux fonctionnels que sécrétoire en comparaison aux deux autres dépôts. En effet, ce dernier jouerait un rôle moins néfaste que les dépôts OM et ME dans l’exacerbation du profil cardiométabolique d’individus présentant une obésité massive (Mauriège et al. 2016). Il apparaît donc pertinent de déterminer les différentes caractéristiques propres à ces trois dépôts adipeux et leurs répercussions sur la santé cardiométabolique de femmes atteintes d’obésité sévère.
Outre l’implication distinctes des différents dépôts adipeux, l’état de santé globale du TA est également d’intérêt dans l’exacerbation du profil cardiométabolique des individus présentant une obésité. Afin d’évaluer cet état de santé, le concept d’adiposopathie est proposé dans la littérature, celui-ci correspondant à un dysfonctionnement du TA (Bays and Stein 2003). Parmi les différentes méthodes proposées pour évaluer ce concept, celle reposant sur le calcul du rapport adiponectine/leptine (A/L) a été utilisée à plusieurs reprises et chez diverses populations (Inoue et al. 2005; Vega and Grundy 2013; Huth et al. 2016;).
2
En effet, l’étude de la santé sécrétoire du TA permet de mieux comprendre son association avec le développement de complications comme la RI, des dyslipidémies ou une inflammation (Bays et al. 2013). Bien que des sections du Chapitre 2 abordent plus en détail les différentes cytokines et adipokines sécrétées par le TA et le concept d’adiposopathie, il est nécessaire de savoir que le rapport A/L a déjà été associé à la RI (Fruhbeck et al. 2017). Cependant, cette mesure n’a jamais été associée à l’homéostasie du glucose et de l’insuline, et ce dans le cadre d’une étude longitudinale portant sur les effets d’une activité physique (AP) régulière chez des femmes initialement sédentaires et présentant une obésité modérée.
À la lumière des éléments retrouvés dans la littérature qui forment les chapitres 1 et 2 de ce mémoire, nous avons voulus évaluer l’importance de l’état fonctionnel des dépôts adipeux dans l’exacerbation du risque cardiométabolique, et ce, chez des femmes atteintes de différents degrés d’obésité. Les travaux présentés au Chapitre 4 traitent des différences observées entre les dépôts adipeux intra-abdominaux en termes d’expression de gènes impliqués dans les fonctions métaboliques et sécrétoires du TA et leurs associations respectives avec le profil inflammatoire et la RI, chez des femmes présentant une obésité sévère. Ces premiers résultats présentés dans ce mémoire permettent d’apporter plus de précisions relatives à l’implication des dépôts adipeux du ligament rond, de l’omental et mésentérique dans l’exacerbation des complications cardiométabolique chez la femme atteinte d’obésité sévère. Ensuite, le Chapitre 5 aborde la notion d’adiposopathie, mesurée par le rapport A/L, et son lien avec l’homéostasie du glucose et de l’insuline, dans un contexte longitudinal impliquant des femmes présentant une obésité modérée ayant participé à un programme de marche active (AP aérobie) de 16 semaines. Les seconds résultats émanant de ce travail mettent en lumière l’utilisation du rapport A/L à titre d’indicateur de l’état de santé globale du TA, en particulier en raison de son association avec la RI, et ce, avant et après un programme d’AP. D’un point de vue clinique, la prise en compte de l’implication des différents dépôts adipeux et de l’état de santé globale du TA dans le risque cardiométabolique permettrait sans nul doute de mieux comprendre les subtilités associées à l’état d’obésité et de prendre en charge adéquatement la population qui en est atteinte.
3
1 Problématique de l’obésité
1.1 Définition et classification de l’obésité
Le surpoids, et plus particulièrement l’obésité, sont définis par l’Organisation Mondiale de la Santé (OMS) par une accumulation anormale ou excessive de graisse corporelle qui représente un risque pour la santé de l’individu ((OMS) 2018a). L’obésité également reconnue à titre de maladie par l’OMS depuis 1997 est associée à un grand nombre de comorbidités comme la résistance à l'insuline (RI) et le diabète de type 2 (DT2), l’hypercholestérolémie et l'hypertriglycéridémie ainsi que l’hypertension artérielle (HTA) (James 2008). Afin d’estimer cette accumulation de masse grasse, différentes mesures issues de l'utilisation d'outils simples ou de techniques sophistiquées et onéreuses peuvent être utilisées.
1.1.1 L’indice de masse corporelle
À l’échelle internationale, la méthode d’évaluation la plus couramment utilisée pour évaluer le degré d’obésité est la mesure de l’indice de masse corporelle (IMC). L’obésité est actuellement catégorisée selon une échelle établie en fonction de la corpulence de l’individu adulte (âgé de 18 à 65 ans). L’IMC d’un individu est obtenu en divisant sa masse corporelle (ou poids) exprimée en kilogramme (kg) par le carré de sa taille exprimée en mètre (m) :
IMC = Poids (kg) Taille (m)4
La valeur obtenue en kg/m2 permet ensuite de déterminer le degré d'obésité associé à un
niveau de risque de développer des problèmes de santé selon la classification de l’OMS (Tableau 1.1). L’obésité proprement dite est donc définie cliniquement par un IMC supérieur ou équivalent à 30 kg/m2. Il faut distinguer plusieurs classes d'obésité : la classe I
correspondant aux valeurs d’IMC comprises entre 30 et 34,9 kg/m2, la classe II associée
aux valeurs d’IMC de 35 à 39,9 kg/m2 et la classe III (morbide) pour les valeurs d’IMC
supérieures ou égales à 40 kg/m2. La classification de l’obésité en fonction de cet indice
présente toutefois plusieurs limites et son utilisation comme outil de diagnostic clinique de la maladie demeure imprécise. En effet, cette variable ne distingue pas la masse osseuse, la masse musculaire et la masse adipeuse de l’individu. De plus, l’IMC demeure un rapport
4
de proportionnalité entre la masse corporelle d’un individu et sa taille. Celui-ci ne permet donc pas de se prononcer sur la santé cardiométabolique de l’individu qui demeure un facteur de risque majeur associé à l’obésité.
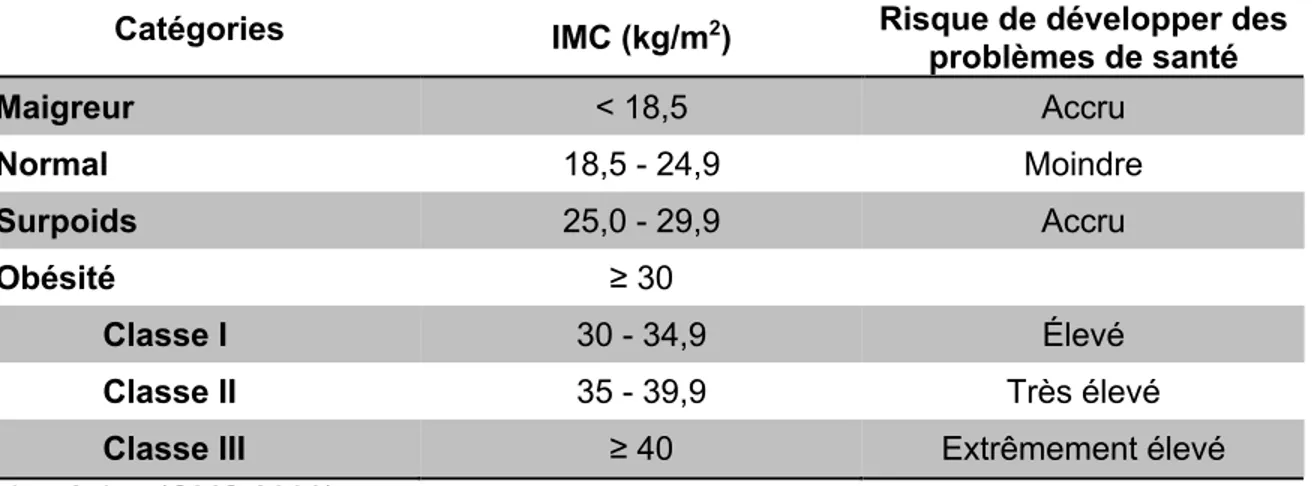
Tableau 1.1 Classification de l’obésité chez l’adulte en fonction de l’IMC et le risque développer des problèmes de santé.
Catégories IMC (kg/m2) Risque de développer des
problèmes de santé Maigreur < 18,5 Accru Normal 18,5 - 24,9 Moindre Surpoids 25,0 - 29,9 Accru Obésité ≥ 30 Classe I 30 - 34,9 Élevé Classe II 35 - 39,9 Très élevé
Classe III ≥ 40 Extrêmement élevé
Adapté de : (OMS 2000).
1.1.2 La circonférence de la taille
Une autre mesure clinique, soit la circonférence de la taille, est d’intérêt dans l’évaluation de l’adiposité puisqu’elle permet d’obtenir une estimation simple de la quantité de tissu adipeux (TA) abdominal. Or, le TA abdominal et plus spécifiquement la masse grasse intra-abdominale ont été associés depuis longtemps et à maintes reprises à différents facteurs de risque cardiométabolique tant chez l’homme que chez la femme (Seidell et al. 1990; Despres et al. 1990; Marin et al. 1992). Toutefois, il est important de noter que les valeurs critiques de la circonférence de la taille diffèrent entre les ethnies. En Amérique du Nord, la valeur-seuil correspondant à un risque élevé de développer des comorbidités est de 102 cm chez l’homme et de 88 cm chez la femme selon les recommandations du National Heart, Lung and Blood Institute (NHLBI) (NHLBI 1998). Cependant, une augmentation du risque cardiométabolique est observée lorsque la circonférence de la taille est supérieure à 94 cm et 80 cm chez l’homme et la femme, respectivement (Han et al. 1995).
5
Dans un contexte où l’IMC et la circonférence de la taille sont des mesures cliniques évaluant sommairement l’obésité chez l’adulte, les techniques d’imagerie médicale (Dual
Energy X-Ray Absorptiometry, tomodensitométrie et imagerie par résonance magnétique)
permettent une évaluation précise de la distribution régionale du TA, différenciant les dépôts sous-cutanés et intra-abdominaux (Ludescher et al. 2009; Browning et al. 2011). Cependant, ces différentes techniques ne seront pas détaillées puisqu’elles n’ont pas été utilisées dans le cadre des deux articles présentés dans ce mémoire.
1.1.3 Le pourcentage de masse grasse
Le pourcentage de masse grasse (% MG) demeure une mesure pertinente dans l’évaluation de la composition corporelle d’un individu, ce que ne permet pas l’IMC. Chez la population caucasienne, bien qu’un IMC de 30 kg/m2 corresponde en moyenne à un taux
de 25% de graisse corporelle chez l’homme et de 35% chez la femme, la variabilité interindividuelle est très grande (Deurenberg and Yap 1999). Le % MG peut être évalué par différents outils, dont les techniques d’imagerie médicale. Cependant, la mesure des plis cutanés ainsi que la bio-impédancemétrie sont des outils de « terrain » particulièrement intéressants(Browning et al. 2011). En effet, bien qu’elles ne permettent pas de distinguer les différents compartiments adipeux (sous-cutané vs intra-abdominal), ces techniques permettent d’obtenir une mesure adéquate de la masse grasse totale dans un contexte de soins ambulatoires (Ludescher et al. 2009).
6
1.2 Prévalence de l’obésité
L’obésité a été longtemps considérée comme un problème spécifique aux pays les plus développés sur le plan économique (McLaren 2007). Cet état ne semble plus prévaloir de nos jours puisqu’une grande majorité de pays en développement observent une augmentation impressionnante de la prévalence de l’obésité au sein de leur population (Collaboration 2016; James 2008). À l’échelle internationale, l'épidémie d’obésité ne cesse de croître depuis de nombreuses décennies. Les dernières valeurs énoncées par l’OMS font état d’un taux mondial d’obésité qui a triplé depuis 1975 passant de 4.3% à près de 13%. De plus, en 2016, l’OMS rapporte que sur près de 1,9 milliards d’individus adultes en surpoids, près de 650 millions présentent une obésité ((OMS) 2018a). On a également constaté une augmentation de la prévalence des IMC élevés, soit ceux associés aux classes d’obésité II et III entre 1975 et 2014, chez les hommes et les femmes, après standardisation pour l’âge (Collaboration 2016).
De façon similaire, la prévalence de l’obésité chez l’adulte au Canada a augmenté considérablement au cours des 15 dernières années, et ce, toutes classes d’obésité confondues. Ainsi, entre 1985 et 2011, les taux d’obésité des classes I, II et III ont augmenté de 5,1 à 13,1%, de 0,8 à 3,6% et de 0,3 à 1,6%, respectivement (Figure 1.1) (Twells et al. 2014). Selon Statistique Canada, en 2017, plus de 60% de la population adulte canadienne âgée de plus de 18 ans présentait un surpoids (IMC ³ 25 kg/m2) ou une obésité (IMC ³ 30
7
Figure 1.1 Modèle de prédiction selon la prévalence du surpoids et de l’obésité chez la population adulte canadienne entre 2013 et 2019.
Adapté de (Twells et al. 2014)
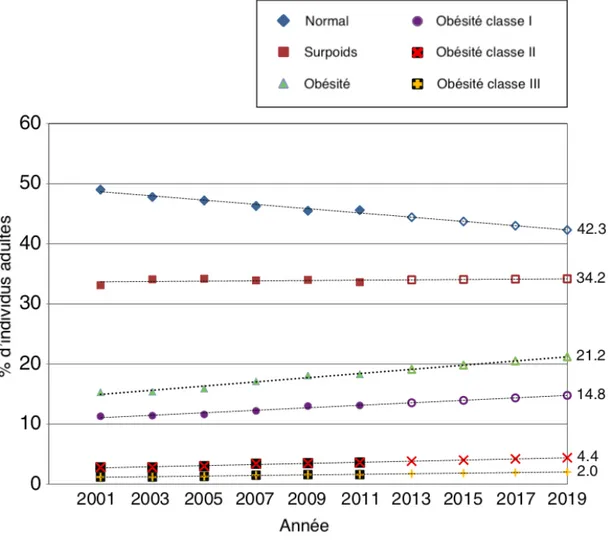
Le scénario est malheureusement similaire dans la province de Québec. Au cours de l’année 2013-2014, l’Institut National de Santé Publique du Québec a évalué à près de 18% la population adulte québécoise avec une obésité (INSPQ 2016). La Figure 1.2 illustre cette proportion, et plus particulièrement son augmentation de 4,1% entre 2003 et 2014, passant ainsi de 14,1 à 18,2%. Il est pertinent de noter dans cette figure l’absence de différences significatives de la prévalence selon le sexe.
8
Figure 1.2 Évolution de la proportion de la population âgée de 18 ans et plus présentant une obésité1,2, selon le sexe, Québec, 2003 à 2014.
1 Obésité déterminée par l’IMC ³ 30 kg/m2 2 À l’exclusion des femmes enceintes
Tiré de Ministère de la santé et des services sociaux du Québec; Enquête sur la santé dans les collectivités canadiennes 2014, Statistique Canada, rapport produit le 3 juin 2016. Mise à jour de l’indicateur le 4 mars 2016
http://www.msss.gouv.qc.ca/professionnels/statistiques-donnees-sante-bien- etre/statistiques-de-sante-et-de-bien-etre-selon-le-sexe-volet-national/evolution-de-la-population-touchee-par-l-obesite/, accédé le 5 octobre 2018
9
1.3 Principaux facteurs causals associés à l’obésité
De façon simplifiée, l’accumulation excessive de masse grasse chez l’Homme est le résultat d’un bilan d’énergie positif, c’est-à-dire une inadéquation entre l’apport et la dépense énergétiques (Sorensen 2009). L’apport en énergie provient entièrement de l’alimentation, et donc des macronutriments (protéines, glucides et lipides). La dépense énergétique, quant à elle, correspond à la somme de différentes composantes: le métabolisme de repos, l’effet thermique des aliments ainsi que l’activité physique (AP) proprement dite (Hill, Wyatt, and Peters 2012; Hall et al. 2012) (Figure 1.3). Le métabolisme de repos varie en fonction de l’âge, du sexe et de la pratique d’AP. Il correspond au besoin énergétique nécessaire aux fonctions vitales de l’organisme. Concernant l’effet thermique des aliments, celui-ci combine l’énergie nécessaire à leur digestion, l’absorption et le stockage des nutriments. La dernière composante, la plus variable, est celle liée à l’AP. Cette dernière comprend, outre les tâches de la vie quotidienne, l’AP volontaire, comme la pratique de sports dans les loisirs (Hill, Wyatt, and Peters 2012). L'équilibre énergétique est atteint lorsque l’apport énergétique est équivalent à la dépense énergétique totale, stabilisant ainsi la masse corporelle. Lorsque l’apport excède la dépense, ce surplus énergétique est conservé et entreposé sous forme de masse grasse, entrainant ainsi l’augmentation de la masse corporelle.
10 Figure 1.3 Composantes du bilan d’énergie.
Adapté de : www.lifetime-weightloss.com/blog/2011/2/20/exercise-is-more-than-just-calories-out.html, accédé le 21 décembre 2018
Bien que le déséquilibre énergétique demeure la caractéristique commune de beaucoup d’individus avec une obésité, cet état a une origine multifactorielle. L’interaction d’un ensemble de facteurs biologiques (génétiques, métaboliques, hormonaux), comportementaux (psychologiques et sociaux) et environnementaux (statut socio-économique, alimentation, AP) contribue donc à son développement (Blakemore and Froguel 2008). Certains éléments ne peuvent pas être modifiés tels les facteurs génétiques, alors que d’autres, comme les aspects sociaux et environnementaux sont modifiables et donc réversibles.
1.3.1 Facteurs génétiques
L’implication de facteurs génétiques dans l’exacerbation du risque d’obésité évalué par plusieurs variables (IMC, % MG et circonférence de la taille) est bien établie. À ce propos, des équipes ont identifié l’héritabilité de la masse grasse à environ 70-90% pour les jumeaux monozygotes vs. 35-45% pour les jumeaux dizygotes (Bouchard et al. 1990; Hebebrand et al. 2003; Farooqi and O'Rahilly 2006; Bell, Walley, and Froguel 2005). La variabilité des pourcentages entre les études citées ci-dessus peut s’expliquer par des différences dans la méthode utilisée pour calculer l’héritabilité de certains facteurs associés
Glucides Protéines Lipides Apports énergétiques Dépenses énergétiques Métabolisme de base Activité physique Thermogenèse des aliments
11
à l’obésité. L’étude des familles de Québec (Québec Family Study, QFS) a permis d’observer une héritabilité attribuée au % MG et à sa distribution régionale de 20 à 30% selon les individus (Bouchard et al. 1988). Par ailleurs, la variation est 2 à 3 fois plus importante entre différentes familles qu’au sein d’une même famille pour l’IMC, la circonférence de taille et le % MG entre autres (Chaput et al. 2014).
Le modèle épidémiologique de l’obésité de Bray et al. fait appel à un « agent pathogène », soit une alimentation hypercalorique et l’inactivité physique, qui s’accompagne de facteurs environnementaux (statut socio-économique, stress, sommeil inadéquat) (Bray et al. 2017). Cette interaction gènes-environnement qu’avait déjà mis en lumière l’étude QFS suggère qu’une partie de l’héritabilité de l’obésité demeure un facteur de risque non négligeable et que la contribution des facteurs environnementaux et psychosociaux est considérable (Chaput et al. 2014; Bray et al. 2017; Perusse and Bouchard 2003).
1.3.2 Facteurs environnementaux
Tel qu'énoncé dans la section précédente, la multitude de facteurs environnementaux favorables au développement de l’obésité (Schwartz et al. 2017) comprend, entre autres, le statut socio-économique, le stress, le sommeil, le tabagisme (Bray et al. 2017). Parmi ces facteurs de risque modifiables, l’aspect nutritionnel ainsi que la sédentarité et l’inactivité physique qui affectent directement le bilan d’énergie seront donc traités dans les prochaines sections.
1.3.2.1 Mauvaises habitudes et comportements alimentaires
Au cours des dernières décennies, l’accroissement de la disponibilité alimentaire a été associée à l’augmentation de la masse corporelle et ce, principalement dans les pays à revenus élevés dont le Canada (Vandevijvere et al. 2015). Entre 1971 et 2008, l’apport énergétique moyen quotidien des canadiens a augmenté de 559 kilocalories par jour, suivant ainsi l'évolution américaine dont l’augmentation a atteint 768 kilocalories par jour au cours de la même période. (Vandevijvere et al. 2015). À l’échelle mondiale, l’accès facilité aux aliments ultra-transformés (par exemple : boissons sucrées, mets surgelés, soupes instantanées, biscuits du commerce) contribuant à la consommation d’aliments à haute teneur calorique ainsi que les modifications des habitudes alimentaires en raison de l’apparition de supermarchés et de chaines de restauration rapide coïncident avec
12
l’apparition de l’épidémie d’obésité (Zobel et al. 2016; Swinburn et al. 2011). Au Canada, une étude récente montre que la consommation d'aliments ultra-transformés représente environ 45 % des calories consommées par jour et par habitant, par rapport à 42 % pour les aliments peu ou pas transformés. Une association était également observée entre la consommation de ces aliments ultra-transformés et l’obésité (IMC ³ 30 kg/m2) (Nardocci et
al. 2018). À la notion d’apport nutritionnel inadéquat (en termes de qualité et de quantité) s’ajoute l’aspect des comportements alimentaires. En effet, les individus avec une obésité seraient plus sujets à une désinhibition alimentaire; de plus, la sensibilité à la faim et à la satiété serait altérée (Hays et al. 2002; Provencher et al. 2003). Le facteur émotionnel associé aux comportements alimentaires est aussi une composante importante de l’apport nutritionnel. En effet, face à des émotions négatives, des mécanismes de compensation souvent involontaires, comme la compulsion alimentaire, sont fréquemment observés chez les individus atteints d’obésité (Gianini, White, and Masheb 2013).
1.3.2.2 Inactivité physique et sédentarité
Le second aspect responsable en bonne partie du dérèglement de l'équilibre énergétique correspond à la sédentarité et à l’inactivité physique. Le comportement sédentaire correspond à une dépense énergétique similaire à celle du métabolisme de repos et est associé généralement au temps passé en position assise (combinant les activités professionnelles et de loisirs). L’inactivité physique est plutôt caractérisée par une pratique d’AP nulle ou inférieure au seuil recommandé (Tremblay et al. 2017). L’inactivité physique est le 4e facteur de risque de mortalité mondiale, après l’HTA, le tabagisme et
l’hyperglycémie ((OMS) 2018b). Selon l’OMS, la diminution de la pratique d’AP serait principalement associée à la nature de plus en plus sédentaire de nombreuses formes d’emplois, de l’utilisation massive des modes de transport passifs et de l’urbanisation croissante ((OMS) 2018b). Par ailleurs, l’accroissement des niveaux de sédentarité et d'inactivité physique s’observe également par une diminution de la pratique d’AP dans les loisirs et une augmentation des comportements sédentaires dans les sphères d’activités domestiques (par exemple : télévision, jeux vidéo, ordinateurs et tablettes électroniques) (Blakemore and Froguel 2008). Pour obtenir des bénéfices subséquents sur la santé chez l’adulte (âgé de 18 à 64 ans), l’American College of Sports Medecine recommande de faire 150 à 300 minutes d’AP aérobie d’intensité modérée par semaine, ou 75 minutes d’AP intense par semaine (Piercy et al. 2018). Au Canada, le plus récent rapport de l’Enquête canadienne sur les mesures de la santé révélait qu’en 2015, 17,6% des adultes âgés de 18
13
à 79 ans respectaient les recommandations en termes de pratique d’AP (Canada 2017). Un faible niveau de pratique d’AP demeure néanmoins un facteur de risque important dans le gain de masse adipeuse (Shook et al. 2015). De plus, une diminution de la pratique d’AP d’intensité modérée associée à une augmentation du temps passé devant la télévision (comportement sédentaire) serait un prédicteur important de l’accroissement de la circonférence de la taille (Shibata et al. 2016). Le maintien d’un déséquilibre du bilan d’énergie prolongé dans le temps (entre autres favorisé par une alimentation inadéquate et/ou la sédentarité) conduit presqu'inévitablement à l’apparition d’un surpoids et de l’obésité, et plus encore, aux comorbidités qui leurs sont associées (Katzmarzyk 2010).
1.4 Comorbidités associées à l’obésité
Représentant bien plus qu’un excès pondéral, l’obésité est considérée comme un élément central dans le risque de développer diverses complications métaboliques et musculosquelettiques (Hotamisligil 2006). Parmi les complications métaboliques associées à l’obésité, citons la RI et le DT2, les dyslipidémies (dont l'hypertriglycéridémie et l'hypercholestérolémie) et l’HTA (Despres 2001). L’obésité, et plus particulièrement l’accumulation de graisse intra-abdominale sont également des facteurs de risque indépendants de la maladie cardiovasculaire (MCV) (Despres and Lemieux 2006; Arsenault et al. 2010). La prochaine section présente sommairement les concepts de profil lipidique-lipoprotéique et d’homéostasie du glucose et de l’insuline (associée à la RI), qui ont été davantage abordés dans le cadre des articles présentés dans ce mémoire.
1.4.1 Profil lipidique-lipoprotéique altéré
Il a été montré à maintes reprises que les sujets avec une obésité ayant une accumulation de graisse plus importante au niveau intra-abdominal ont les profils métaboliques les plus détériorés (Pouliot et al. 1992; Tchernof et al. 1996; Despres 2001). Parmi les nombreuses conséquences sur le plan métabolique, on observe fréquemment une altération du profil lipidique-lipoprotéique. En effet, l’obésité intra-abdominale s’accompagne généralement d’une augmentation du flux d’acides gras libres (AGL) vers le foie, généralement en période post-prandiale (Votruba and Jensen 2007). Cette augmentation du flux d’AGL favorise une sécrétion hépatique plus importante de lipoprotéines riches en triglycérides (TG), dont les lipoprotéines à faible (LDL ou low density
14
générale, l’hypertriglycéridémie associée au TA intra-abdominal serait le résultat de la production excessive des VLDL, puisque celles-ci déterminent en majorité les niveaux plasmatiques de TG (Sniderman et al. 2012). Une diminution de la concentration en lipoprotéines à haute densité (HDL ou high density lipoproteins) anti-athérogènes est également observée en contexte d’obésité intra-abdominale (Tchernof and Despres 2013). Par ailleurs, la dégradation d’apolipoprotéine (apo) B située en surface des VLDL et LDL est inhibée par une présence plus importante de lipoprotéines riches en TG, contribuant à l’augmentation de sa concentration plasmatique (Morita 2016). Ces changements de l’apo B sont également liés à l’accroissement important des concentrations plasmatiques en VLDL et en LDL possédant un très fort potentiel athérogène (Libby, Ridker, and Hansson 2011). Dans son ensemble, la surproduction de VLDL, l’inhibition de la dégradation de l’apo B ainsi que la diminution de la concentration de HDL contribuent de façon importante à l’altération du profil lipidique-lipoprotéique caractéristique de l’obésité intra-abdominale, en plus d’intervenir dans le développement de maladies cardiovasculaires.
1.4.2 Homéostasie du glucose et de l’insuline altérée
Une altération de l’homéostasie du glucose et la RI font partie des complications métaboliques les plus observées en association avec l’obésité (Rutkowski, Stern, and Scherer 2015). Plusieurs études ont également évalué le lien entre l’obésité et le DT2. Parmi celles-ci, l’étude de Hu et al. a révélé que le surpoids et l’obésité étaient les principaux prédicteurs de l’apparition du DT2, chez une vaste cohorte de femmes ayant participé à la
Nurses’ Health Study (Hu et al. 2001). Brièvement, l’intolérance au glucose est définie par
une incapacité à contrôler la glycémie, celle-ci demeurant trop élevée et ce, sur une longue période de temps. L’hyperglycémie entraine une hyperinsulinémie compensatoire et le besoin en insuline augmente graduellement. À ce stade, la RI correspond à l’incapacité de l’organisme à répondre adéquatement au signal insulinique, provoquant une surproduction de l’hormone par les cellules b du pancréas. Ces dernières sont incapables de soutenir la demande accrue en insuline et un épuisement des cellules b pancréatiques est alors observé, favorisant le développement d’un DT2 (Lebovitz 2001; Bergman 2013).
Plusieurs hypothèses sont avancées concernant l’implication du TA dans le développement de la RI. Parmi celles-ci, la théorie de la veine porte suppose un relargage élevé d’AGL et de facteurs pro-inflammatoires par certains dépôts adipeux intra-abdominaux dans la circulation hépatique. Ce relargage important contribuerait à diminuer
15
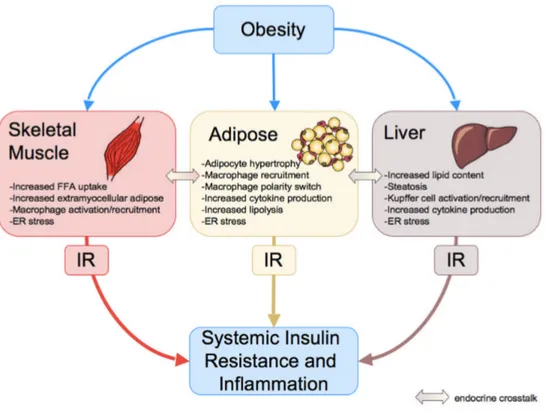
la sensibilité du foie à l’action de l’insuline (Item and Konrad 2012). L’exacerbation de la RI dans le contexte d’obésité implique également une interaction entre le TA, le foie et le muscle squelettique (Figure 1.4). Le relargage d’AGL et de cytokines pro- et anti-inflammatoires par le TA (notion qui sera abordée plus en détail dans le Chapitre 2 du présent mémoire) dans la circulation hépatique, mais aussi systémique, favorise l’accumulation de lipides dans le foie et le muscle squelettique, en plus d’altérer le métabolisme du glucose dans ces organes (de Luca and Olefsky 2008). La contribution du TA dans le développement de la RI et de l’inflammation se manifeste donc par des altérations métaboliques systémiques.
Figure 1.4 Obésité et développement de la RI et de l’inflammation systémique.
Tiré de (de Luca and Olefsky 2008)
L’homéostasie du glucose et de l’insuline peut être évaluée de plusieurs façons, dont la technique de verrouillage (clamp) euglycémique-hyperinsulinémique qui demeure la méthode de référence (Gutch et al. 2015). Puisque l’utilisation de cette technique n’est pas toujours possible, on se réfère également au test d’hyperglycémie provoquée par voie orale (HGPO) qui permet d’obtenir une excellente estimation de la tolérance au glucose d’un
16
individu. Ce test consiste en l’ingestion de 75 g de glucose après 12 h de jeûne. Des échantillons de sang sont prélevés à la suite de cette l’ingestion de glucose, et ce, pendant 120 ou 180 minutes, ce qui permet de suivre la glycémie et l'insulinémie mais aussi d'évaluer la RI à l'aide de différents indices (DeFronzo and Abdul-Ghani 2011). Ainsi, les aires sous la courbe de glucose et d’insuline pouvant être calculées à partir des données recueillies lors d'un HGPO permettent de suivre l’évolution de ces deux marqueurs plasmatiques dans le temps. Par ailleurs, l’indice HOmeostasis Model Assessement of Insulin Resistance
(HOMA-IR) est l’un des plus utilisés afin de quantifier la RI à partir des mesures de glucose
et d’insuline plasmatiques à jeun (Matthews et al. 1985). L’indice HOMA b-cell permet d’évaluer plus spécifiquement la fonction pancréatique associée à la sécrétion d’insuline (Wallace, Levy, and Matthews 2004). Il existe aussi des indices de sensibilité à l’insuline (SI) comme le Quantitative Insulin Sensitivity Check Index (QUICKI), dont l’équation tient également compte des valeurs à jeun de glucose et d’insuline plasmatiques (Katz et al. 2000). Finalement, l’indice de Matsuda permet de déterminer la SI (périphérique et hépatique) en combinant les données recueillies à jeun et lors d'un test d’HGPO (Matsuda and DeFronzo 1999). Les formules de ces différents indices sont présentées dans le Tableau 1.2 ci-dessous.
Tableau 1.2 Différents indices d’évaluation de la résistance et de la sensibilité à l’insuline.
Indice Formule Référence
HOMA-IR Insuline à jeun x Glucose à jeun /22.5 (Matthews et al. 1985)
HOMA β-cell (20 x Insuline à jeun) / (Glucose à jeun – 3.5) (Wallace, Levy, and Matthews 2004)
QUICKI 1/ [log (Insuline à jeun) + log (Glucose à jeun)] = 1/ [log (Insuline à jeun + Glucose à jeun)] (Katz et al. 2000)
Matsuda
104/ [√ (Glucose à jeun x Insuline à jeun x
moyenne des glycémies HGPO x moyenne des insulinémies HGPO]
(Matsuda and DeFronzo 1999)
17
Bien que l’obésité soit associée à un risque accru de DT2 et de MCV, des études avaient déjà révélé que les individus avec une obésité ne présentaient pas toujours un risque élevé de développer ces pathologies (Keyes 1973; Andres 1980). En effet, certains individus avec une obésité ne présentent pas un profil métabolique altéré et sont qualifiés de metabolically healthy obese (MHO), ce phénotype ayant été décrit initialement par Sims en 1982 (Sims 1982). L'identification d'individus avec une obésité mais métaboliquement sains peut être néanmoins source de confusion, étant donné que l'obésité est une maladie
en soi pouvant être associée à d'autres pathologies. La section présentée ci-dessous fait
partie d’une revue de littérature de notre groupe, parue dans le journal Obésité en 2018, et qui aborde le thème des individus avec une obésité ayant un profil métabolique sain ou MHO. Celle-ci s’attarde sur la diversité des classifications permettant d'identifier les individus catégorisés MHO et la description de leurs principales caractéristiques par rapport à leurs homologues qualifiés de metabolically unhealthy obese (MUHO).
1.5 Le phénotype d’obésité sans anomalie métabolique
1.5.1 Classification et prévalence des individus MHO
L’absence d’un consensus quant à la définition des individus MHO rend leur identification complexe (Samocha-Bonet et al. 2014). En effet, plus de 15 classifications différentes ont été répertoriées à ce jour afin de catégoriser les individus ayant un IMC élevé, mais un profil métabolique non altéré, chacune utilisant divers critères afin d’identifier le plus précisément possible cette population (Primeau et al. 2011). Chaque classification se base sur la combinaison d’une mesure de l’obésité de l’individu et de différents facteurs de risque cardiométabolique dont les valeurs-seuils varient selon l’approche utilisée. De ces nombreuses classifications, 6 sont plus couramment utilisées (Tableau 1.3) (Velho et al. 2010). Celle établie par Karelis et al. a été l'une des premières à mettre en évidence les principales caractéristiques des sujets présentant un phénotype MHO en comparaison à des individus MUHO. Ainsi, la SI et les niveaux sanguins de HDL-cholestérol sont plus élevés alors que la quantité de TA intra-abdominal et le taux sanguin de TG sont plus faibles chez les individus MHO que MUHO, et ce, à âge et masse grasse comparables (Karelis et al. 2004).
18
Tableau 1.3 Critères utilisés dans les définitions du phénotype MHO.
(Wildman et al. 2008)
(Karelis et
al. 2004) (Lynch et al. 2009)
(Meigs et al. 2006) (Aguilar-Salinas et al. 2008) Tension artérielle TAS ≥ 130 ou TAD ≥ 85 mmHg ---- TAS ≤ 130 ou TAD ≤ 85 mmHg et absence de traitement TAS ≥ 130 ou TAD ≥ 85 mmHg ou traitement TAS/TAD < 140/90 mm Hg TG ≥ 1,70 mmol/L mmol/L ≤ 1,70 ---- ≥ 1,70 mmol/L ---- HDL-CHOL < 1,04 mmol/L (H) < 1,30 mmol/L (F) ou traitement ≥1,30 mmol/L ---- < 1,04 mmol/L (H) < 1,30 mmol/L (F) ≥1,00 mmol/L LDL-CHOL ---- ≤ 2,60 mmol/L ---- ---- ---- CHOL total ---- < 5,20 mmol/L ---- ---- ---- TG/HDL-CHOL ---- ---- ≤ 1,65 (H) ou ≤ 1,32 (F) et absence de traitement ---- ---- Glycémie à jeun ≥ 5,55 mmol/L ou traitement ---- 5,60 mmol/L et absence de traitement ≥ 5,60 mmol/L ou traitement < 7 mmol/L et absence de traitement HOMA-IR ≥ 90e percentile ≤ 2,70 ---- ---- ---- Autres CRP ≥ 90e percentile CRP ≤ 3,0 mg/L Aucune histoire de pathologies cardiorespiratoires et métaboliques Circ. taille ≥ 102 (H) et ≥ 88 cm (F) ---- Critères
retenus < 2 parmi tous
≥ 4 parmi
tous Tous
< 3 parmi
tous Tous
Adapté de (Velho et al. 2010). CHOL: cholestérol; Circ: circonférence; CRP: Protéine C-réactive; F: femmes; H: hommes; TAS: tension artérielle systolique; TAD, tension artérielle diastolique; TG: triglycérides. Les autres abréviations sont déjà définies dans le texte.
19
La prévalence des individus avec obésité présentant un profil métabolique sain varie selon divers facteurs. Tout d’abord, la proportion d’individus catégorisés MHO diffère en fonction de la classification utilisée pour les identifier. Le Tableau 1.4 issu de la revue de Primeau et al. montre que le pourcentage d’individus MHO varie de 18 % à 44 % selon les études répertoriées (Primeau et al. 2011). Cette différence est due au fait que chaque étude utilise des valeurs-seuils distinctes relativement aux variables sélectionnées dont notamment l’indice de RI, le HOMA-IR, les niveaux sanguins de TG, de HDL-cholestérol, de CRP, de glucose et d’insuline à jeun (Velho et al. 2010; Primeau et al. 2011). À titre d'exemple, l’analyse d’une cohorte italienne de 681 sujets avec une obésité par Iacobellis
et al. a montré qu'en utilisant des critères bien précis (Tableau 1.4), le pourcentage
d’individus présentant une obésité, mais exempts d'apparentes complications physiques ou métaboliques est de 27,5 % (Iacobellis et al. 2005). Dans le même ordre d'idées, une étude prospective regroupant 7122 participants issus de la cohorte Whitehall II et suivis pendant 17 ans s'est intéressée au risque de développer des MCV et un DT2. De la population totale, 9.2% présentent une obésité et la moitié d'entre eux (soit 42.5%) répond aux critères du phénotype MHO défini selon le National Cholesterol Education Program Adult Treatment
20
Tableau 1.4 Prévalence du phénotype MHO selon les classifications utilisées.
Étude Nombre de sujets Prévalence Classification utilisée
(Karelis et al. 2008) 139 femmes avec obésité post-ménopausées 23%
HOMA-IR ≤ 2,7
HDL-CHOL≥ 1,3 mmol/L TG ≤ 1,7 mmol/L LDL-CHOL ≤ 2,6 mmol/L CRP ≤ 3 mg/L
MHO: 4 des 5 critères
(Wildman et al. 2008) 5440 hommes et femmes 31,7%
TAS/TAD < 130/85 mmHg TG < 1,7 mmol/L
HDL-CHOL ≥ 1,03 mmol/L (H); et ≥ 1,29 mmol/L (F)
Glycémie à jeun < 5,6 mmol/L HOMA-IR ≤ 5,13
CRP ≤ 0,1 mg/L
MHO: 0 à 1 complication cardiométabolique
(Shin et al. 2006) 129 femmes en surpoids ou avec obésité 18%
HOMA-IR < 1,95 TG < 1,7 mmol/L CHOL total < 5,2 mmol/L LDL-CHOL < 2,6 mmol/L HDL-CHOL > 1,1 mmol/L MHO: 4 des 5 critères (Aguilar-Salinas et al.
2008) 716 hommes et femmes 24%
IMC > 30 kg/m2
HDL-CHOL ≥ 1,03 mmol/L Absence de DT2 et d’HTA
MHO: présence de tous les critères (Meigs et al. 2006) 2902 hommes et femmes 44%
Absence de SMet ou de RI basée sur l’indice HOMA-IR
MHO: trois quartiles d’indice HOMA-IR les plus faibles
(Lynch et al. 2009) 120 hommes et femmes avec obésité 20%
Glycémie à jeun ≤ 5,6 mmol/L TAS/TAD < 130/85 mmHg
TG/HDL-CHOL ≤ 1,65 (H) et ≤ 1,32 (F) MHO: présence de tous les critères
(Iacobellis et al. 2005) 681 hommes et femmes caucasiens avec obésité 28%
Glycémie à jeun < 100 mg/dL Tolérance au glucose normale TAS/TAD < 130/85 mmHg Lipidémie normale
Insulinémie à jeun < 15 μU/mL Acide urique < 333 μmol/L (F) et < 416 μmol/L (H)
NGB < 10 000 cellules/100 mL Fibrinogène plasmatique < 4,00 g/L MHO: présence de tous les critères (Stefan et al. 2008) 314 hommes et femmes avec obésité 24% Absence d’une RI en référence à un indice Matsuda établi à partir d’une HGPO (McLaughlin et al.
2007)
211 hommes et femmes
avec obésité 33%
Absence d’une RI basée sur un test de suppression d’insuline
MHO: tertile de glycémie le plus faible
Adapté de (Primeau et al. 2011). NGB: nombre de globules blancs. Les abréviations retrouvées dans ce tableau ont été déjà définies dans le Tableau 1.3 et dans le texte.