Études de la structure, de la fibrillation et des interactions
membranaires de l’α-synucléine 71-82 par dichroïsme
circulaire, spectroscopie infrarouge et RMN
Mémoire
Laurie Bédard
Maîtrise en chimie
Maître ès sciences (M. Sc.)Québec, Canada
© Laurie Bédard, 2014
Résumé
L’α-synucléine est une protéine impliquée dans la maladie de Parkinson qui forme des agrégats fibrillaires pathologiques. Une séquence précise de 12 acides aminés est essentielle pour que le phénomène d’agrégation ait lieu. Le peptide correspondant à cette séquence (noté α-syn71-82) a été synthétisé et étudié par dichroïsme circulaire, spectroscopie infrarouge et RMN solide du 31P, afin de mieux comprendre sa structure, ses
interactions membranaires ainsi que son mécanisme de fibrillation. Les résultats montrent que le peptide adopte une conformation majoritairement désordonnée en solution. À haute concentration ou basse température, les chaînes peptidiques s’assemblent de façon réversible en oligomères en formant des feuillets-β intermoléculaires. L’α-syn71-82 interagit fortement avec les membranes anioniques mais n’interagit pratiquement pas avec les membranes zwitterioniques. Grâce aux interactions électrostatiques entre le peptide chargé positivement et les membranes chargées négativement, le peptide semble adopter une structure en feuillets-β parallèles et agrégés.
Table des matières
Résumé ... iii Table des matières ... v Liste des tableaux ... ix Liste des figures ... xi Liste des abréviations ... xv Remerciements ... xix Avant‐propos ... xxi Chapitre 1 Introduction ... 1 1.1 Amyloïdes ... 1 1.1.1 Historique ... 1 1.2 Dépôt amyloïde ... 2 1.2.1 Description ... 2 1.2.2 Composés secondaires ... 3 1.3 Fibrilles et protofibrilles ... 3 1.3.1 Description ... 3 1.3.2 Formation ... 4 1.3.3 Identification ... 4 1.4 Maladie de Parkinson ... 5 1.4.1 La maladie [29] ... 5 1.4.2 Les symptômes [29] ... 6 1.4.3 Traitements disponibles [29] ... 7 1.4.4 Corps de Lewy ... 7 1.4.5 α‐Synucléine ... 9 1.4.6 α‐Syn71‐82 ... 13 1.5 Membranes biologiques ... 15 1.5.1 Membranes du cerveau ... 15 1.5.2 Membranes modèles ... 16 1.6 Objectifs du projet ... 20 Chapitre 2 Formation de fibrilles d’α‐syn71‐82 ... 232.1 Matériels et méthodes ... 23 2.1.1 Matériels ... 23 2.1.2 Synthèse peptidique ... 23 2.1.3 Préparation des échantillons ... 24 2.1.4 Méthodes expérimentales ... 25 2.2 Dichroïsme circulaire ... 25 2.2.1 Études structurales ... 25 2.2.2 Résultats ... 27 2.3 Conclusions partielles ... 28 Chapitre 3 Études spectroscopiques de la structure et de l’interaction membranaire de α‐syn71‐82 ... 29 3.1 Matériel et méthode ... 29 3.1.1 Matériel ... 29 3.1.2 Préparation des échantillons ... 29 3.1.3 Techniques spectroscopiques ... 32 3.2 Effets des membranes modèles sur l’α‐syn71‐82 ... 34 3.2.1 Dichroïsme circulaire ... 34 3.2.2 Spectroscopie infrarouge ... 35 3.2.3 Conclusions partielles ... 45 3.3 Effets de l’α‐syn71‐82 sur les membranes modèles ... 46 3.3.1 Spectroscopie infrarouge ... 46 3.3.2 Conclusions partielles ... 54 3.3.3 Résonance magnétique nucléaire à l’état solide du phosphore‐31 ... 54 Chapitre 4 Besides fibrillation: the role of the peptide fragment 71‐82 on the structural and assembly behavior of α‐synuclein ... 61 4.1 Résumé ... 61 4.2 Abstract ... 62 4.3 Introduction ... 63 4.4 Materials and methods ... 64 4.4.1 Materials ... 64 4.4.2 Peptide synthesis ... 65 4.4.3 Sample preparation ... 65
4.4.4 Spectroscopic techniques ... 66 4.5 Results and discussion ... 67 4.5.1 Pure α‐syn71‐82 in solution ... 67 4.5.2 Effect of membranes on α‐syn71‐82 ... 70 4.5.3 Effect of α‐syn71‐82 on phospholipid membranes... 73 4.6 Discussion ... 76 4.7 Supporting Information ... 79 4.8 Acknowledgements ... 80 4.9 References ... 80 Chapitre 5 Conclusions et perspectives ... 87 5.1 Conclusions ... 87 5.2 Perspectives ... 88 5.2.1 Fibrilles ... 89 5.2.2 RMN solide 15N – PISEMA ... 89
5.2.3 RMN solide 15N ou 13C – REDOR 15N{31P} ou 13C{31P} ... 89
5.3.4 RMN 2H ... 90
Liste des tableaux
Tableau 1.1 Liste des principales fibrilles amyloïdes retrouvées dans le corps humain [2]. ... 1
Tableau 1.2 Liste des inclusions intracellulaires retrouvées chez l’humain [2]. ... 2
Tableau 3.1 Masses et concentrations utilisées lors de la préparation des échantillons en FTIR ... 30
Tableau 3.2 Masses utilisées lors de la préparation des échantillons en RMN ... 31
Liste des figures
Figure 1.1 Fibrilles formées de deux, trois ou quatre protofillaments [1]. ... 4
Figure 1.2 Mécanisme de formation des fibrilles amyloïdes. Au départ, l’α-synucléine est sous la forme d’un monomère désordonné. Par la suite, il y a formation d’oligomères, de protofibrilles et, finalement, de fibrilles. Les fibrilles sont composées de feuillets-β agrégés [3]. ... 4
Figure 1.3 Évolution de la maladie classifiée selon cinq stades ... 6
Figure 1.4 Image microscopique d'un corps de Lewy retrouvé dans la substance noire du cerveau [35]. ... 8
Figure 1.5 Formation de corps de Lewy. Équilibre entre la forme liée et la forme libre, formation des fibrilles et association de celles-ci avec de l'ubiquitine dans le corps de Lewy. Figure modifiée de [37]. ... 8
Figure 1.6 Représentation de l'α-synucléine et ses caractéristiques. Figure modifiée de [37]. ... 9
Figure 1.7 Structure secondaire de l'α-synucléine selon les conditions. Figure modifiée de [52]. ... 10
Figure 1.8 Fibre : feuillets-β parallèles orientés perpendiculairement à la fibre [49]. ... 10
Figure 1.9 Différentes formes cytotoxiques que peut emprunter l'α-synucléine, leur évolution et leur stabilité. Figure modifiée de [37]. ... 11
Figure 1.10 Spectres CD de l'α-syn71-82 selon diverses conditions d'incubation. A) en solution sous forme monomérique, B) à pH 7 et une température de 37 °C, C) à un pH de 10 et une température de 37 °C, D) à pH 4 et une température de 37 °C et E) à un pH 7 et une température de 20 °C [85]. ... 13
Figure 1.11 Images EM des fibrilles d'α-syn71-82 selon diverses conditions d'incubation. i) à pH 10 et une température de 37 °C, ii) à pH 7 et une température de 37 °C et à pH 7 et une température de 20 °C [85]. ... 14
Figure 1.12 Pourcentage de phospholipides dans un cerveau de rat ou d’humain selon le type de tête polaire. Le chiffre entre parenthèse correspond à la charge de la tête polaire [89,90]. ... 15
Figure 1.13 Pourcentage des principales chaînes d’acides gras retrouvés dans les cellules d’un cerveau de rat en fonction du type de la tête polaire [89,90]. ... 16
Figure 1.14 Schéma du modèle membranaire de mosaïque fluide. Figure modifiée de [92]. ... 17
Figure 1.15 Représentation d'un phospholipide. Figure modifiée de [94]. ... 17
Figure 1.16 Schématisation de la transition de phase de bicouches phospholipidiques ... 18
Figure 1.17 Schéma d'une bicouche lipidique, d'une SUV, d'une LUV et d'une MLV. Figure modifiée de [96]. .... 19
Figure 1.18 Représentation des lipides utilisés. ... 20
Figure 1.19 Méthodologie utilisée lors de l’étude. ... 21
Figure 2.1 Schéma de la synthèse peptidique sur support solide selon la stratégie Fmoc ... 24
Figure 2.2 Principe du CD. Lumière circulairement polarisée à gauche et à droite. Figure adaptée de [103]. ... 25
Figure 2.3 Régions spectrales en CD avec les chromophores correspondants. Figure adaptée de [102]. ... 26
Figure 2.4 Spectres CD en UV lointain de plusieurs structures secondaire. Hélice-α : ligne pleine, feuillet-β : longue ligne pointillée, structure désordonné : petite ligne pointillée. Figure adaptée de [103]. ... 26
Figure 2.5 Spectres CD de l'α-syn71-82 en fonction du temps lors d'une incubation dans le tampon TRIS à température 37 °C. ... 27
Figure 2.6 Spectres CD de l'α-syn71-82 en fonction du temps lors d'une incubation dans le tampon phosphate 37 °C. ... 28
Figure 3.1 Séquence d'impulsions de l'écho de Hahn. Image adaptée de 107. ... 33
Figure 3.3 Spectres CD de 15:1 PG/α-syn71-82. ... 35
Figure 3.4 Spectre infrarouge typique et les régions étudiées. ... 36
Figure 3.5 Différents modes de vibration retrouvés en FTIR pour des peptides. ... 37
Figure 3.6 Décomposition typique de la bande amide I' par les structures secondaires présentes. ... 37
Figure 3.7 Couplage des moments de transition en présence de feuillets-β [111]. ... 38
Figure 3.8 Représentation des feuillets-β parallèles et antiparallèles... 39
Figure 3.9 Spectres de feuillets- formés par des peptides. À gauche, spectre de feuillets-β parallèles obtenu avec le peptide amyloïde β 25-35 [113]. À droite, spectre de feuillets-β antiparallèles formé par le 14-mère EC K4K11 [114]. ... 39
Figure 3.10 Bande amide I' de l’ α-syn71-82 en présence de MLV de DMPC pour trois ratios lipides/α-syn71-82 (15:1 rose, 30:1 mauve et 50:1 vert) et du peptide pur (noir), à 37 °C. ... 40
Figure 3.11 Bande amide I' de l’ α-syn71-82 en présence de MLV de DOPC pour trois ratios lipides/α-syn71-82 (15:1 rose, 30:1 mauve et 50:1 vert) et du peptide pur (noir), à 37 °C. ... 41
Figure 3.12 Spectre IR dans la région amide I d’un mélange DOPC-α-syn71-82 en fonction de la température pour un ratio 50:1. ... 42
Figure 3.13 Bande amide I' de l’ α-syn71-82 en présence de MLV de DMPG pour trois ratios lipides/α-syn71-82 (15:1 rose, 30:1 mauve et 50:1 vert) et du peptide pur (noir), à 37 °C. ... 43
Figure 3.14 Bande amide I' de l’ α-syn71-82 en présence de MLV de DOPG pour trois ratios lipides/α-syn71-82 (15:1 rose, 30:1mauve et 50:1 vert) et du peptide pur (noir), à 37 °C. ... 44
Figure 3.15 Spectre IR dans la région amide I’ d’une solution DMPG -α-syn71-82 en fonction de la température à un ratio 50:1. ... 45
Figure 3.16 À gauche, l'α-syn71-82 sous forme libre et désordonnée. À droite, l'α-syn71-82 sous forme de feuillets-β agrégés liés aux membranes. ... 46
Figure 3.17 Schémas de la transition de phase.de bicouches de phospholipides ... 47
Figure 3.18 Déplacement de la bande d'élongation symétrique CH2 en fonction de la température. ... 48
Figure 3.19 Courbes de thermotropisme du DMPC mesurée à l’aide de la bande d’élongation CH2 en l'absence (noir) et en présence de l'α-syn-71-82 (15:1 rose, 30:1 mauve et 50:1 vert). ... 48
Figure 3.20 Courbes de thermotropisme CH2 du DOPC en l'absence (noir) et en présence de l'α-syn-71-82 (15:1 rose, 30:1 mauve et 50:1 vert). ... 49
Figure 3.21 Courbes de thermotropisme CH2 du DMPG en l'absence (noir) et en présence de l'α-syn-71-82 (15:1 rose, 30:1 mauve et 50:1 vert). ... 50
Figure 3.22 Courbes de thermotropisme CH2 du DOPG en l'absence (noir) et en présence de l'α-syn-71-82 (15:1 rose, 30:1 mauve et 50:1 vert). ... 50
Figure 3.23 Bandes d'élongation C=O typiques de bicouches de phospholipides (DMPC) au-dessus et en dessous de Tm ainsi que les spectres déconvolués qui mettent en évidence la contribution des deux types de groupements carbonyle (hydratés et libres) [121]. ... 51
Figure 3.24 Spectres et position de la bande d'élongation C=O en fonction de la température. ... 51
Figure 3.25 Courbes de thermotropisme C=O du DMPC en l'absence (noir) et en présence de l'α-syn-71-82 (15:1 rose, 30:1 mauve et 50:1 vert). ... 52
Figure 3.26 Courbes de thermotropisme C=O du DOPC en l'absence (noir) et en présence de l'α-syn-71-82 (15:1 rose, 30:1 mauve et 50:1 vert). ... 53
Figure 3.27 Courbes de thermotropisme C=O du DMPG en l'absence (noir) et en présence de l'α-syn-71-82 (15:1 rose, 30:1 mauve et 50:1 vert). ... 53
Figure 3.28 Courbes de thermotropisme C=O du DOPG en l'absence (noir) et en présence de l'α-syn-71-82 (15:1 rose, 30:1 mauve et 50:1 vert). ... 54 Figure 3.29 Représentation des trois éléments du tenseur de l'ADC pour le noyau de phosphore-31 dans un phospholipide [128,129]. ... 55 Figure 3.30 Spectre de poudre obtenu en spectroscopie RMN solide du 31P [128,129]. ... 55
Figure 3.31 Exemple d'un spectre obtenu pour des bicouches lipidiques hydratées [128,129]. ... 56 Figure 3.32 Spectres RMN 31P de phospholipides a) en phase gel, b) en phase fluide et c) des micelles
[128,129]. ... 57 Figure 3.33 Schémas illustrant la distribution des lipides dans une vésicule [128,129]. ... 57 Figure 3.34 Spectres RMN solide du 31P. DMPC seul (noir) et en présence d’α-syn71-82 (15:1 rose, 30:1
mauve et 50:1 vert). ... 58 Figure 3.35 Spectres RMN solide du 31P. DOPC seul (noir) et en présence d’α-syn71-82 (15:1 rose, 30:1
mauve et 50:1 vert). ... 59 Figure 3.36 Spectres RMN solide du 31P. DMPG seul (noir) et en présence d’α-syn71-82 (15:1 rose, 30:1
mauve et 50:1 vert). ... 59 Figure 3.37 Spectres RMN solide du 31P. DOPG seul (noir) et en présence d’α-syn71-82 (15:1 rose, 30:1
mauve et 50:1 vert). ... 60 Figure 4.1 CD spectra of α-syn71-82 at a concentration of 1.3 mM in phosphate buffer pH 7.0 (H2O) at 37 °C. .
62 Figure 4.2 CD spectra of α-syn71-82 at a concentration of 1.3 mM in phosphate buffer pH 7.0 (H2O) at 37 °C.
- 67 - Figure 4.3 Infrared spectra of α-syn71-82 in phosphate buffer pH 7.0 (D2O) (a) as a function of concentration at 37 °C and (b) as a function of temperature for a concentration of 40 mM. Spectra are normalized with respect
to the peak height maximum. - 68 -
Figure 4.4 CD spectra of α-syn71-82 at a concentration of 1.3 mM in phosphate buffer pH 7.0 (H2O) in the presence of POPC or POPG vesicles at a lipid:α-syn71-82 molar ratio of 15:1. - 71 - Figure 4.5 Infrared spectra of α-syn71-82 in phosphate buffer pH 7.0 (D2O) in the absence and presence of (a) DOPC and (b) DOPG vesicles, at lipid:α-syn71-82 molar ratios of 15:1, 30:1 and 50:1. Spectra are normalized
with respect to the peak height maximum. - 72 -
Figure 4.6 Temperature-dependence of the (a, b) υs(CH2) and (c, d) υ(C=O) wavenumbers of (a, c) POPC and (b, d) POPG vesicles in the absence and presence of α-syn71-82, at lipid:αsyn71-82 molar ratios of 15:1, 30:1,
50:1 in phosphate buffer pH 7.0 (D2O). - 74 -
Figure 4.7 31P NMR spectra of (a) POPC and (b) POPG vesicles in the absence and presence of α-syn71-82, at lipid:α-syn71-82 molar ratios of 15:1, 30:1 and 50:1 in Tris buffer pH 7.4 at 15 °C. Spectra are normalized
with respect to the peak height maximum. - 76 -
Figure 4.8 Second derivative spectra of α-syn71-82 as a function of concentration - 79 - Figure 4.9 Infrared spectra of α-syn71-82 in phosphate buffer pH 7.0 (D2O) in the presence of (a) POPC and (b) POPG vesicles as a function of temperature, at a lipid:α-syn71-82 molar ratio of 50:1. - 79 - Figure 4.10 Second derivative spectra of α-syn71-82 in the presence of POPG vesicles as a function of concentration. - 80 - Figure 5.1 Schéma résumant les interactions entre l’α-syn71-82 et les membranes modèles. ... 88 Figure 5.2 RMN solide 15N. Figure tirée de [133]. ... 89
Figure 5.3 Représentation de membranes en présence d'un peptide transmembranaire (à gauche) et d'un peptide restant à la surface (à droite). ... 90 Figure 5.4 Spectres 2H de DMPC en absence (haut) et en présence d’α-syn71-82 [86]. ... 90
Liste des abréviations
A AbsorbanceA Alanine
ADC Anisotropie de déplacement chimique AFM Microscopie à force atomique
Bo Champ magnétique
Beff Champ magnétique effectif
CD Dichroïsme circulaire DIEA Diisopropyléthylamine DMF Diméthylformamide DMPC Dimyristoylphosphatidylcholine DMPG Dimyristoylphosphatidylglycérol DOPC Dioléoylphosphatidylcholine DOPG Dioléoylphosphatidylglycérol EM Microscopie électronique
FTIR Spectroscopie infrarouge à transformer de Fourier Fmoc 9-Fluorénylméthyloxycarbonyle G Glycine HOBt Hydroxybenzotriazole HBTU 2-(1H-Benzotriazole-1-yl)-1,1,3,3-tétraméthyluroniumhexafluorophosphate I Radiation transmise Io Radiation incidente K Lysine
LC-MS Chromatographie en phase liquide couplée à un spectromètre de masse LUV Large vésicule unilamellaire
MLV Vésicule multilamellaire NAC Composante non-β-amyloïde
PISEMA Polarization inversion spin exchange at the magic angle POPC Palmitoyloléoylphosphatidylcholine
POPG Palmitoyloléoylphosphatidylglycérol Q Glutamine
REMD Dynamique moléculaire par échange de répliques, replica exchange molecular dynamics RMN Résonance magnétique nucléaire
RPE Résonance paramagnétique électronique SDSL Marquage de spin de site dirigé
SDS-PAGE Électrophorèse sur gel de polyacrylamide en présence de dodécylsulfate de sodium SUV Petite vésicule unilamellaire
T Thréonine
TEM Microscopie électronique à transmission Tm Température de transition de phase
V Valine
XRD Diffraction des rayons-X
α-syn71-82 Peptide provenant des acides aminés 71 à 82 de la protéine d’α-synucléine
γ Rapport gyromagnétique nucléaire
δ Déplacement chimique
δ// Déplacement chimique d’un lipide orienté parallèlement
δ┴ Déplacement chimique d’un lipide orienté perpendiculairement
δaniso Constante d’anisotropie de déplacement chimique
δiso Déplacement chimique isotrope
σ Blindage électronique
σ// Blindage électronique parallèle au champ
Remerciements
Un gros merci à Michèle, sans toi rien n’aurait été possible. Merci de m’avoir fait confiance, de m’avoir acceptée et supervisée tout au long de ma maîtrise. Merci pour tout ce temps accordé, pour tous les conseils apportés et ta vitesse de réponse. Grâce à toi, j’ai pu ouvrir mes horizons, parfaire mes connaissances et être prête pour le marché du travail. Un merci aussi à toi Normand, pour m’avoir accueilli dans ton laboratoire. Sans quoi, je n’aurais jamais eu le peptide nécessaire pour ma maîtrise.
Un merci spécial aussi aux professionnels de recherche qui sont tous aussi dévoués que compétents. Sans eux, les analyses ne pourraient avoir lieu. Thierry, merci pour tous les conseils prodigués, les pistes lancées et ton savoir-faire dans la compréhension des résultats. Merci pour ta grande aide lors de la rédaction de l’article et de mon mémoire. Tu as su me guider à merveille. Pierre, merci d’être toujours disponible quand un problème survient et de le résoudre avec une rapidité sans égale. Jeff, merci pour ton entrain à venir m’aider lorsque tout était bogué. Merci pour tout le temps passé sur mon ordinateur pour faire fonctionner les programmes. Par ailleurs, tes commentaires farfelus ont aussi égayé mes journées. Merci François d’avoir répondu si bien à mes questions sur la synthèse peptidique et le CD. Grâce à toi, j’ai pu facilement mener à terme mes analyses.
Merci aussi à mes collègues de travail Émile, Kim et Matthieu pour les conseils et le temps à discuter de tout et de rien. Un merci spécial à Matthieu pour m’avoir montré tous les rudiments du laboratoire et pour avoir répondu à plusieurs et plusieurs de mes questions avec toujours le même enthousiasme. Il ne faut pas oublier tout le travail de ma stagiaire Émilie Morin-Michaud qui m’a aidée au tout début du projet. Merci pour la patience qu’elle a su démontrer lorsqu’il fallait à nouveau tout recommencer.
J’aimerais également remercier le CRSNG, le FRQ-NT, PROTEO, le CERMA et le CQMF et l’Université Laval pour le soutien financier.
Finalement, mes derniers remerciements vont à ma famille qui m’a épaulée tout au long de ce parcours universitaire peu commun. Merci d’avoir cru en moi et de m’avoir poussée pour en arriver à ce but choisi. Merci
à Manuel de m’avoir encouragée, de m’avoir déstressée et, surtout, d’avoir été patient tout au long de ma rédaction. Ton support m’a été d’une grande aide et je l’apprécie grandement.
Avant-propos
Le chapitre 4 est consacré à un article publié dans la revue Biochemistry, 2014, 53 (41), p. 6463-6472. Cet article est intitulé : « Besides fibrillation: the role of the peptide fragment 71-82 on the structural and assembly behavior of α-synuclein ».Il se concentre sur les résultats obtenus pour l’α-syn71-82 pure en solution, mais aussi de l’effet des membranes modèles de POPC et POPG sur le peptide et l’effet de ce dernier sur ces membranes. La professeure Michèle Auger est l’investigatrice de ce projet. Le professeur Normand Voyer a mis à notre disposition tout le nécessaire pour la synthèse peptidique de l’α-syn71-82. Lors de ma maîtrise, j’ai personnellement fait les expériences et analysé les données. Ma stagiaire, Émilie Morin-Michaud, a aidé au travail lors de l’été 2013. De plus, je suis l’auteure principale de l’article en collaboration avec la professeure Michèle Auger et le professionnel de recherche Thierry Lefèvre.
Chapitre 1 Introduction
1.1 Amyloïdes
1.1.1 Historique
Le nom amyloïde provient du mot «amylon» et fut d’abord utilisé par Scheilden en botanique en 1838 [1]. Vers 1854, Virchow transféra le terme dans le domaine de la médecine pour désigner plutôt un dépôt dans le cerveau. Ce dépôt avait la particularité de devenir bleu-mauve au contact d’une solution constituée d’acide sulfurique et d’iode. Maintenant, le terme amyloïde a beaucoup évolué et est beaucoup plus utilisé. Conséquemment, le Comité de nomenclature de la Société internationale de l’amylose a décidé d’attribuer une définition à ce mot. Elle se lit comme suit : «dépôts extracellulaires de fibrilles protéiques ayant un aspect caractéristique en microscopie électronique, un modèle typique en diffraction des rayons X et une affinité pour le rouge Congo avec une biréfringence verte concomitante.» [2]. Ce comité a émis une liste (tableau 1.1) des principales fibrilles amyloïdes retrouvées dans le corps humain.
D’autres inclusions sont retrouvées dans le corps humain. Par contre, elles ne possèdent pas toutes les propriétés décrites par la définition. Cependant, plusieurs auteurs les incluent tout de même dans le groupe des amyloïdes. Ces agrégats protéiques intracellulaires forment des fibrilles et possèdent une structure majoritairement en feuillets-β. La protéine α-synucléine fait partie de ce type d’amyloïde et est retrouvée dans des inclusions localisées dans le cerveau. Elle est impliquée dans la maladie de Parkinson. Le tableau 1.2 présente la liste des inclusions intracellulaires de ce type [2].
1.2 Dépôt amyloïde
1.2.1 Description
Les dépôts amyloïdes sont caractéristiques de plusieurs maladies neurodégénératives (ex : Alzheimer, Parkinson, diabète de type II) et sont retrouvés dans plusieurs tissus et organes. Malheureusement, l’observation de ces dépôts dans le corps humain est difficile. Une biopsie ou une autopsie doit être effectuée. Les dépôts sont constitués de plusieurs filaments très ordonnés correspondants à des brins-β orientés perpendiculairement à l’axe de la fibre [3-4]. Leur composante majeure est appelée fibrille. Les fibrilles sont composées de plusieurs copies d’un même peptide ou protéine. Le nombre de protéines identifiées pouvant s’agréger et former des dépôts pathologiques ne cesse d’augmenter depuis les dernières années [5]. Des études portant sur les dépôts amyloïdes sont nécessaires puisque ceux-ci endommagent les tissus et créent des dysfonctions causant des maladies. Par conséquent, plusieurs groupes de recherche se penchent maintenant sur le mécanisme d’action des amyloïdes puisqu’ils sont peu ou pas connus.
1.2.2 Composés secondaires
Des composés secondaires se retrouvent dans les dépôts amyloïdes, comme le sérum P amyloïde, l’apolipoprotéine E et les protéoglycanes. Ces trois composés sont conservés, et ce, même lors de maladies neurodégénératives vraiment différentes. Cela suggère donc un mécanisme d’agrégation semblable [5]. Leur importance spécifique est encore mal connue, mais ils semblent jouer un rôle dans la pathogenèse et la persistance des dépôts amyloïdes [2].
Spécifiquement, la fonction du sérum P amyloïde est de protéger les dépôts amyloïdes des mécanismes de digestion du corps comme la protéolyse. Donc, ce composé contribue à l’augmentation du temps de vie des dépôts [5]. L’apolipoprotéine E, plus précisément ApoE4, forme des complexes insolubles avec les fibrilles et augmente ainsi la toxicité des dépôts amyloïdes [6]. Finalement, le rôle des protéoglycanes est de promouvoir les réactions d’agrégation et la nucléation fibrillaire [7].
1.3 Fibrilles et protofibrilles
1.3.1 Description
Les fibrilles et les protofibrilles sont les structures retrouvées lors de maladies amyloïdes. Les fibrilles amyloïdes sont des structures riches en feuillets-β. Elles sont constituées de polypeptides ou de protéines repliés et sont thermodynamiquement stables. Les fibrilles possèdent en moyenne un diamètre de 5 à 25 nm et une longueur de quelques micromètres [8]. Chaque fibrille est composée d’un minimum de deux sous-unités appelées protofibrilles (Figure 1.1). Les protofibrilles apparaissent très tôt lors la formation des amyloïdes et consistent en une rangée linéaire de peptides ou protéines possédant une largeur de 2 à 5 nm [9, 10]. Les fibrilles peuvent adopter une structure en feuillets-β plissés ou en hélices-β. Cependant, la structure précise dépend de plus plusieurs facteurs comme la protéine impliquée, la concentration, la température et le pH [11, 12]. Quelques études affirment que ce sont les agrégats préfibrillaires qui sont responsables de la toxicité et de la mort des cellules [13-16] tandis que d’autres affirment que ce sont les fibrilles [17-20].
Figure 1.1 Fibrilles formées de deux, trois ou quatre protofillaments [1].
1.3.2 Formation
Les fibrilles amyloïdes peuvent être formées à partir d’une partie ou de l’entièreté d’une protéine. Leur formation ressemble à un processus de cristallisation. Les fibrilles se construisent en débutant par une forme native monomérique soluble, suivie d’une structure intermédiaire désordonnée et finit avec l’obtention d’agrégats fibrillaires constitués majoritairement de feuillets-β (Figure 1.2). Ces structures sont stabilisées par des liens non covalents comme des interactions hydrophobes, des liaisons hydrogènes et des interactions π-π qui s’établissent entre les chaînes peptidiques. Comme il est question d’interactions intermoléculaires causant l’agrégation et la précipitation des protéines, les interactions hydrophobes sont très importantes [21]. Plusieurs facteurs comme un bas pH, la présence d’agent oxydant, l’augmentation de la température, la protéolyse et la présence d’ions métalliques peuvent accentuer la formation de fibrilles [22]. Malheureusement, malgré toutes ces informations, les mécanismes d’agrégation demeurent mal compris.
1.3.3 Identification
Les fibrilles peuvent être observées par microscopie à force atomique (AFM) et microscopie électronique à transmission (TEM). La diffraction des rayons-X (XRD) peut aussi être utilisée puisque le patron de diffraction Figure 1.2 Mécanisme de formation des fibrilles amyloïdes. Au départ, l’α-synucléine est sous la forme d’un monomère désordonné. Par la suite, il y a formation d’oligomères, de protofibrilles et, finalement, de fibrilles. Les fibrilles sont composées de feuillets-β agrégés [3].
possède une forte réflexion à 4.6-4.8 Å associée à la structure des fibrilles [23]. Par ailleurs, la résonance magnétique nucléaire à l’état solide (RMN) permet la détermination de la présence de feuillets-β parallèles ou antiparallèles [24,25]. D’autres techniques comme la spectroscopie infrarouge à transformée de Fourier (FTIR) peuvent aussi être utilisées, mais celles-ci possèdent des limitations. Par exemple, les spectres IR possèdent une bande amide I’ ayant un maximum entre 1610 et 1630 cm-1 correspondant à une structure en feuillets-β
représentative des fibrilles amyloïdes [26]. Par contre, cette technique ne peut pas discriminer les agrégats fibrillaires de ceux non fibrillaires [27]. De plus, les tests de rouge Congo ou de thioflavine peuvent être utilisés pour détecter les composés amyloïdes. Par contre, ces tests dépendent des solutions utilisées, des conditions de coloration et des réactions avec des composés secondaires non fibrillaires [2, 28]. Donc, il est important d’utiliser plusieurs techniques pour bien définir la structure des fibrilles.
1.4 Maladie de Parkinson
1.4.1 La maladie [29]
La maladie de Parkinson est une maladie neurodégénérative qui touche la capacité de mouvement des personnes atteintes. Quatre millions de personnes au monde, dont 100 000 au Canada, sont touchées par cette maladie. Autant les jeunes adultes que les personnes âgées peuvent être affectées, mais l’âge moyen de l’apparition des symptômes est de 55 ans. La cause de la maladie est la mort des cellules dans la substance noire, une région du cerveau. Ces cellules sont responsables de la production d’un neurotransmetteur appelé dopamine. La dopamine sert de messager entre le système nerveux central (le cerveau) et le système nerveux périphérique (les membres).
Les études concernant les facteurs causant la maladie sont encore contradictoires. Certaines d’entre elles parlent de facteurs environnementaux tandis que d’autres parlent de facteurs génétiques. Les médecins ont estimé que le diagnostic de la maladie se faisait lorsque 80% des cellules dopaminergiques étaient mortes. Ce diagnostic tardif provient du fait qu’aucun test sanguin ou examen radiologique ne confirme la présence de la maladie avec certitude. Conséquemment, les médecins doivent poser leur diagnostic uniquement sur l’étude des symptômes du patient et sur l’examen neurologique. Plusieurs médicaments sont prescrits pour pallier au manque de la dopamine et garder une qualité de vie respectable pour le patient. Malheureusement, de nos jours, encore aucun médicament n’existe pour ralentir ou arrêter la maladie [30]. La maladie est considérée comme non mortelle, car les personnes affectées vont mourir de complications comme une infection, une pneumonie ou de fractures.
1.4.2 Les symptômes [29]
La diminution substantielle de la dopamine entraîne l’apparition de quatre grands symptômes principaux : le tremblement de repos, l’akinésie (lenteur d’initiation des mouvements) et la bradykinésie (lenteur d’exécution des mouvements), la rigidité et l’instabilité posturale.
Pour 70% des gens atteint, le premier signe sera la présence de tremblement de repos. Celui-ci commence seulement sur un côté du corps au niveau des mains et des pieds. Ce type de tremblement est facile à distinguer puisqu’il a la particularité de s’atténuer lors de l’exécution volontaire de mouvements. Finalement, l’apparition des symptômes bilatéraux se fait au fur et à mesure que la maladie avance.
L’akinésie et la bradykinésie consistent en une rareté et une lenteur dans l’exécution des mouvements. Le visage sera touché par une diminution du clignement des yeux et de l’expression faciale. La voix pourra aussi être affectée. Au niveau des membres, on remarque une lenteur et une difficulté dans l’exécution des mouvements. Par exemple, le malade pourra avoir de la difficulté à effectuer des tâches simples comme se raser, mettre ses souliers et marcher rapidement.
La rigidité est un symptôme plus difficile à diagnostiquer. L’augmentation du tonus musculaire va engendrer des signes comme une diminution du balancement des bras lors de la marche.
L’instabilité posturale va apparaître très tard lors de la manifestation de la maladie. Les troubles d’équilibre vont réduire la mobilité du sujet et entraîner des chutes de plus en plus fréquentes.
Ces symptômes sont regroupés et classifiés selon 5 stades évolutifs (Figure 1.3).
1.4.3 Traitements disponibles [29]
Dans les traitements proposés, l’utilisation des médicaments occupe une grande partie. Présentement, six classes de médicaments sont utilisées soit les précurseurs de la dopamine, les agonistes dopaminergiques, l’amantadine, les inhibiteurs de la monoaminine-oxydase B, les inhibiteurs de la catéchol-O-méthyl transférase et les anticholinergiques. L’approche thérapeutique comporte deux stratégies : le remplacement de la dopamine par les cinq premières classes de médicaments et le rééquilibre entre les niveaux d’acétylcholine et de dopamine par les médicaments anticholinergiques. Pour n’en mentionner qu’un, le lévodopa est le médicament le plus efficace connu à ce jour. Le début et le choix du traitement reposent sur plusieurs facteurs comme l’autonomie du patient dans la vie courante, son âge, le côté atteint et les symptômes principaux.
La neurochirurgie peut être une seconde option. Dès le tout début, cette technique fût utilisée pour soulager les symptômes de tremblements et de rigidité. La technique consistait à créer des lésions dans le cerveau. Les premières interventions étaient peu précises. Par la suite, les chirurgiens ont ciblé une zone précise dans le cerveau, les ganglions gris centraux. Deux techniques sont maintenant utilisées, la thalamotomie et la pallidotomie. La thalamotomie est une intervention chirurgicale au niveau du thalamus lors de laquelle on détruit une infime partie des tissus. Cela a pour effet d’éliminer les tremblements chez 80 à 90% des patients. Quant à elle, la pallidectomie est une intervention qui implique l’utilisation d’un courant électrique sur les cellules du globus pallidus, une structure retrouvée dans la région sous-corticale du cerveau. La pallidectomie permet d’atténuer les mouvements involontaires dus à l’utilisation à long terme et à hautes doses du médicament lévodopa. Récemment, une autre cible neurochirurgicale a été découverte, le noyau sous-thalamique. La technique consiste à utiliser des électrodes pour inhiber les cellules cibles. Dorénavant, cette technique est la plus recommandée. L’intervention permet la réduction significative de l’utilisation des médicaments.
En résumé, peu importe le traitement choisi, il sera spécifique pour chaque patient et visera uniquement la réduction des symptômes. Par ailleurs, les traitements pourront provoquer plusieurs effets secondaires comme des nausées, des diarrhées, des vomissements, des blocages, des dyskinésies, un ralentissement des mouvements, des psychoses, des hallucinations, de l'anxiété, de la dépression, des troubles de comportement et de l'hypersomnie.
1.4.4 Corps de Lewy
Les corps de Lewy sont des agrégats intracellulaires retrouvés lors de certaines maladies neurodégénératives comme la maladie de Gaucher, l’Alzheimer et la maladie de Parkinson [31, 32]. Les corps de Lewy ont été nommés ainsi en l’honneur du Dr Friederich Heinrich Lewy, le scientifique qui a découvert leur présence dans
la substance noire du cerveau [33]. Ils sont constitués de lipides et de protéines et sont identifiés postmortem par immunomarquage [34]. Une image d’un corps de Lewy retrouvé dans la substance noir est présentée à la Figure 1.4.
Figure 1.4 Image microscopique d'un corps de Lewy retrouvé dans la substance noire du cerveau [35].
Lors de la maladie de Parkinson, le corps de Lewy est constitué majoritairement d’une protéine appelée α-synucléine [34]. Cette protéine est retrouvée sous une forme fibrillaire et insoluble [36]. L’α-α-synucléine peut aussi être retrouvée sous des formes instables d’oligomères et des protofibrilles qui vont rapidement être séquestrés dans les corps de Lewy. En second plan, les corps de Lewy sont composés par une protéine nommée ubiquitine qui permet l’agrégation initiale et la déposition de l’α-synucléine (figure 1.5) [37]. D’autres composés mineurs, comme des neurofilaments et des protéines du cytosquelette, sont aussi retrouvés et joueraient un rôle dans l’agrégation [38].
Figure 1.5 Formation de corps de Lewy. Équilibre entre la forme liée et la forme libre, formation des fibrilles et association de celles-ci avec de l'ubiquitine dans le corps de Lewy. Figure modifiée de [37].
1.4.5 α-Synucléine
1.4.5.1 La protéine
L’α-synucléine est une protéine de 140 acides aminés (14 kDa) impliquée dans la maladie de Parkinson et elle est essentielle pour la formation des corps de Lewy. Elle forme naturellement des oligomères, puis des protofibrilles et, finalement, des agrégats composés de fibrilles. L’α-synucléine fait partie d’une famille génétique qui inclut la β-synucléine, la γ-synucléine et le synoretine. Tous les membres de cette famille possèdent une répétition imparfaite de la séquence KTKEGV, une extrémité C-terminale variable et des résidus sérine et tyrosine phosphorylés. L’α-synucléine comporte trois régions : une région amphiphile appelée N-terminale (1-60), une région hydrophobe appelée composante non-β-amyloïde (NAC) (61-95) et une région acide appelée C-terminale (96-140) (Figure 1.6). Elle représente 1% des protéines solubles du cytosol du cerveau. Sa séquence est hautement conservée parmi les mammifères [39]. Sa fonction est encore mal connue, mais la protéine est retrouvée au niveau des membranes synaptiques du cerveau, ce qui suggère un rôle synaptique [37]. Quelques études ont démontré qu’elle pouvait réguler les vésicules synaptiques [40,41].
Figure 1.6 Représentation de l'α-synucléine et ses caractéristiques. Figure modifiée de [37].
1.4.5.2 Les structures
Cette protéine est désordonnée en solution et fait ainsi partie de la famille des protéines intrinsèquement désordonnées [42]. À l’image d’un monomère, elle n’adopte aucune structure secondaire ou tertiaire [42]. Environ 15% de la protéine retrouvée dans le cytosol du cerveau est liée aux membranes et adoptent une
conformation stable en hélice-α [43]. L’hélice-α est orientée parallèlement à la membrane (Figure 1.7) [44-47]. Lorsque liée à des micelles, la protéine adopte une structure en hélice-α brisée et antiparallèle [44,45].
Lorsque la protéine agrège, elle adopte une conformation en feuillets-β riche en fibrilles amyloïdes [48]. Chaque feuillet-β est orienté perpendiculairement à l’axe des fibrilles [49]. Certaines études affirment que les feuillets-β sont de type parallèle (Figure 1.8) grâce à l’obtention de résultats en RMN à l’état solide [50,51], en spectroscopie de résonance paramagnétique électronique (RPE) [51, 52] et en marquage de spin de site dirigé (SDSL) [49]. Par contre, quelques études soutiennent aussi la présence de feuillets-β antiparallèles par l’analyse des fibrilles de la protéine par FTIR [53,54]. Selon une étude faite par Celej et al. en FTIR, les oligomères obtenus à 25°C possèdent des structures en feuillets-β antiparallèles tandis que les fibrilles incubées à 37 ou 70 °C ont une structure en feuillets-β parallèles [54].
Figure 1.7 Structure secondaire de l'α-synucléine selon les conditions. Figure modifiée de [52].
1.4.5.3 Formes cytotoxiques
L’agrégation commence par la formation progressive d'oligomères solubles et de protofibrilles. Ces intermédiaires sont plutôt instables et se transforment rapidement en fibrilles matures insolubles (Figure 1.9). En ce qui à trait la forme de la protéine causant la mort des cellules dopaminergiques, deux hypothèses sont soutenues, soit une forme de fibrilles [38] ou une forme d’oligomères et de protofibrilles [69-74].
Figure 1.9 Différentes formes cytotoxiques que peut emprunter l'α-synucléine, leur évolution et leur stabilité. Figure modifiée de [37].
L’α-synucléine agrège sous forme de feuillets-β plissés stabilisés par des liaisons hydrogène. La diffraction des rayons X a permis de déterminer que l’espacement entre les brins-β est de 4.7 et 10 nm ce qui est typique d’une structure en feuillets-β croisés (cross-) [56,57]. C’est donc ces structures qui forment les fibrilles hautement insolubles et toxiques [38]. In vitro, la protéine forme rapidement des fibrilles similaires à celles extraites des cerveaux des gens malades [58]. In vivo et in vitro, l’utilisation de la microscopie électronique (EM) a permis d’identifier la présence de fibrilles rigides possédant une largeur de 10 nm [53]. Selon les conditions, la formation, le taux d’agrégation et la morphologie des fibrilles peuvent changer. À température élevée, le taux de fibrillation est augmenté. Cet effet provient de l’abaissement de l’énergie d’activation pour la formation des intermédiaires aux fibrilles [54]. Le pH joue aussi un rôle. À un pH de 4 et 5, il y a formation d’agrégats amorphes tandis qu’à un pH de 6 et 7 il y a formation d’agrégats fibrillaires [59]. La région centrale NAC est essentielle pour l’auto-assemblage et la promotion de l’agrégation de l’α-synucléine [17,18]. Cette région est hautement amyloïdogénique et forme rapidement des fibrilles [19,20]. Elle se retrouve complètement liée à la surface des bicouches lorsque le ratio lipide/protéine est élevé [52].Plus spécifiquement, les acides aminés 71 à 82 sont cruciaux pour l’agrégation de la protéine puisque leur suppression in vivo empêche la fibrillation de la protéine. Cette observation est soutenue par le fait que ces 12 acides aminés ne sont pas retrouvés chez la β-synucléine
qui ne s’agrège pas [60]. Conséquemment, la présence de la β-synucléine peut empêcher l’agrégation in vivo et in vitro [60-62]. Les acides aminés 71-82 semblent constituer le cœur des filaments puisqu’ils sont résistants à la digestion protéolytique. Par ailleurs, il a été démontré qu’un peptide synthétique formé de ces 12 acides aminés s’auto-assemble rapidement pour former des filaments et promeut la fibrillation de la protéine complète [56]. Finalement, la région C-terminale inhibe l’agrégation. Lorsqu’on supprime cette région à l’α-synucléine, la protéine s’agrège plus facilement. Donc, sa neurotoxicité est augmentée [56,63,64]. Cela explique pourquoi environ 15% de l’α-synucléine retrouvée dans les corps de Lewy possèdent une extrémité C-terminale tronquée [65-67].
D’autres études ont suggéré le fait que ce soit la forme oligomérique de l’α-synucléine qui serait toxique et non les fibrilles [68-71]. Leur structure est partiellement repliée [58]. Récemment, des oligomères d’α-synucléine ont été isolés dans des cerveaux d’humains atteints de Parkinson [68]. In vitro, il a été prouvé que la toxicité survient avant même l’apparition de plusieurs agrégats d’α-synucléine ce qui suggère que les composés solubles peuvent engendrer de la toxicité [69-71]. Par ailleurs, la mort des cellules arriverait avant même l’agrégation en fibrilles [72]. In vivo, les oligomères et les protofibrilles peuvent endommager les neurones [73]. Finalement, les protofibrilles peuvent créer des structures en forme d’anneau formant ainsi des pores dans la membrane et l’endommageant [74].
1.4.5.4. Interactions
Un autre aspect étudié est le rôle potentiel des lipides dans ce système. Comme mentionné précédemment, les protéines retrouvées dans le cytosol peuvent se lier aux membranes, adopter une conformation en hélice-α et ainsi, empêcher la conversion en fibrilles [71]. En opposition, d’autres études ont démontré que cette liaison protéine-lipides pourrait promouvoir l’oligomérisation et la formation des fibrilles augmentant ainsi la toxicité [75-77].
L’α-synucléine interagit fortement avec les phospholipides anioniques [78] comme il a été démontré par CD [72], RMN [79-81], TEM [76], spectroscopie de fluorescence [72] et SDS-PAGE [74]. Les forces électrostatiques jouent donc un rôle important lors d’interactions protéine-lipides. De plus, certaines études ont démontré que la protéine peut se lier avec une grande affinité à la phase liquide désordonnée retrouvée dans les bicouches lipidiques (en opposition à la phase liquide ordonnée) [78]. Ce phénomène illustre bien que, outre les
interactions électrostatiques, des interactions hydrophobes peuvent avoir lieu [78]. D’autres études ont mis en évidence la relation entre la courbure de la membrane et l’affinité de liaison entre la protéine et les lipides. Plus la membrane est courbée et rigide, plus les liaisons sont favorisées. Par ailleurs, la présence de lipides à chaînes insaturées augmente la capacité de la protéine à se lier aux lipides [82] et accélère sa vitesse d’agrégation et de fibrillation [83].
1.4.6 α-Syn71-82
1.4.6.1 Le peptide
L’α-syn71-82 est un peptide qui comprend les acides aminés 71 à 82 de l’α-synucléine (71VTGVTAVAQKTV82).
Cette séquence est responsable de la fibrillation de la protéine complète puisque, lorsqu’elle est absente, il n’y a pas d’agrégation [59]. Ce peptide est donc un modèle utile pour mieux comprendre la structure et l’agrégation de l’α-synucléine. À pH physiologique, le peptide comporte une charge positive sur l’acide aminé lysine (K) et est hautement hydrophobe [84].
1.4.6.2 Les structures
En solution, le spectre CD du peptide confirme la présence d’une structure désordonnée (Figure 10 a). L’α-syn71-82 se trouve ainsi sous la forme d’un monomère soluble [85]. Lorsqu’incubé pendant plusieurs semaines, l’α-syn71-82 est capable de former des feuillets-β hautement ordonnés, typiques des fibrilles amyloïdes et possédant une morphologie similaire à celle de la protéine entière.
Figure 1.10 Spectres CD de l'α-syn71-82 selon diverses conditions d'incubation. A) en solution sous forme monomérique, B) à pH 7 et une température de 37 °C, C) à un pH de 10 et une température de 37 °C, D) à pH 4 et une température de 37 °C et E) à un pH 7 et une température de 20 °C [85].
La région 71-82 contribue à la fibrillation complète de la protéine [17,86]. Des travaux en CD (Figure 10 b) et en EM (Figure 11 ii) ont illustré cette structure en feuillets-β [17,56]. De plus, des études de dynamique moléculaire par échange de répliques (REMD) ont montré que le peptide s'agrégeait spontanément sous forme de dimères [87], de trimères et de tétramères possédant tous une conformation en feuillets-β antiparallèles [84].
Figure 1.11 Images EM des fibrilles d'α-syn71-82 selon diverses conditions d'incubation. i) à pH 10 et une température de 37 °C, ii) à pH 7 et une température de 37 °C et à pH 7 et une température de 20 °C [85].
1.4.6.3 Incubation
Lors de l’incubation de l’α-syn71-82, le taux d’agrégation et la morphologie de la fibrille sont sensibles au pH et à la température. Après une incubation de six semaines à pH 7 ou 10 et à une température de 37 °C, il y a obtention de fibrilles amyloïdes agrégées (Figure 10 b et c). Des études en EM ont montré que les fibrilles à pH 7 sont plus longues qu’à pH 10 (Figure 11 i et ii). Lors d’une même incubation, mais à pH 4, le peptide reste désordonné (Figure 10 d) comme lorsqu’il est sous sa forme de monomère (Figure 1.10 a). À pH 7, mais une température de 20 °C, les fibrilles sont courtes et possèdent une structure atypique pour des fibrilles amyloïdes (Figure 10 e et Figure 11 iii) [84]. En somme, les travaux ont conclu qu’une incubation de six semaines à pH 7 et à une température de 37 °C sont les meilleures conditions pour obtenir un haut taux de fibrillation et des fibrilles bien définies [88].
1.4.6.4 Interactions
Le groupe de Madine a mis en évidence la capacité de l’α-syn71-82 à se lier aux membranes [86]. Effectivement, lorsqu’ils ont ajouté des lipides DMPC à une solution de peptide, ils ont remarqué un abaissement de 50% de la concentration de peptide en solution. Donc, il y a liaison entre le peptide et les lipides. L’utilisation de la RMN solide du deutérium a aussi permis de confirmer ce résultat puisque les spectres montraient une réduction de l’écart quadripolaire lorsque les lipides DMPC étaient ajoutés à la solution, signe de liaison entre les lipides et le peptide [86]. On remarque par contre qu’il manque encore beaucoup de détails sur la structure, l’agrégation du peptide, notamment en fonction du pH, de la concentration et de la température. Par ailleurs, ses interactions avec les phospholipidiques restent à approfondir.
1.5 Membranes biologiques
1.5.1 Membranes du cerveau
Pour mieux comprendre les mécanismes qui se produisent dans le cerveau, il est important de connaître les membranes lipidiques qui s’y trouvent. La Figure 1.12 représente les quatre têtes polaires principales composant les phospholipides retrouvés dans le cerveau. On peut voir que les proportions sont semblables pour ce qui est des lipides d’un cerveau d’humain ou de rat. Par ailleurs, la majorité des phospholipides possède une charge neutre (tête polaire choline et éthanolamine). Une plus faible proportion sont négativement chargés (tête polaire sérine et inositol) [89,90].
Figure 1.12 Pourcentage de phospholipides dans un cerveau de rat ou d’humain selon le type de tête polaire. Le chiffre entre parenthèse correspond à la charge de la tête polaire [89,90].
La Figure 1.13 représente le pourcentage de chaque type de chaînes acyle des phospholipides retrouvés dans le cerveau en fonction de la tête polaire présente. Pour la tête polaire choline, on retrouve principalement des chaînes saturées comportant 16 atomes de carbone. Pour les têtes polaires éthanolamine, sérine et inositol, on observe principalement des chaînes saturées comportant 18 atomes de carbone. Pour les quatre têtes polaires, on voit aussi une faible proportion de chaînes comportant 18 atomes de carbone avec une insaturation [89,90]. Ces informations seront mises à profit pour choisir des membranes modèles qui soient le plus proches possibles des membranes de cerveau.
Figure 1.13 Pourcentage des principales chaînes d’acides gras retrouvés dans les cellules d’un cerveau de rat en fonction du type de la tête polaire [89,90].
1.5.2 Membranes modèles
Les membranes cellulaires sont constituées de nombreux composés comme des protéines, des phospholipides, des glycolipides, des oligosaccharides, du cholestérol et autres. Ce système est représenté par un modèle dit de la « mosaïque fluide » (Figure 1.14). Selon la fonction et les activités de la cellule, la proportion des composantes va varier [91].
Figure 1.14 Schéma du modèle membranaire de mosaïque fluide. Figure modifiée de [92].
Les membranes cellulaires sont faites de bicouches composées de phospholipides. Un phospholipide comporte quatre parties : une tête polaire, un groupement phosphate, un résidu glycérol et deux chaînes acyle hydrophobes (Figure 1.15). La tête polaire et les chaînes acyle des membranes cellulaires varient beaucoup selon l’endroit du corps [93].
Comme les membranes cellulaires sont très complexes, l’utilisation de membranes modèles est nécessaire. Par exemple, la présence d’autres protéines dans le système pourrait interférer avec l’analyse du peptide voulu. Ainsi, l’utilisation de membranes modèles permet de simplifier les spectres et leur analyse. Il est aussi possible de choisir la tête polaire et les chaînes acyle souhaitées. Pour ce faire, il est nécessaire de choisir la composition lipidique la plus proche des membranes étudiées, notamment le choix de la tête polaire (zwitterionique ou chargée) et celui des chaînes acyle (longueurs, saturées ou insaturées). Le choix de la charge de la tête polaire est important puisque celle-ci peut déterminer de la présence ou non d’une interaction lipides/protéine. Le choix des chaînes acyle a un impact sur la rigidité, la courbure et la fluidité des membranes [93].
D’autres paramètres doivent être pris en compte lors des analyses, dont le choix du pH, la température de transition de phase et l’hydratation des lipides [93]. Un pH de 7 est favorisé lors des analyses puisqu’il correspond au pH physiologique du corps humain. La température de transition de phase (Tm) correspond à la
température où le lipide passe de la phase gel ordonnée à la phase liquide désordonnée (Figure 1.16). Il est nécessaire de considérer la phase des lipides lors des analyses [95]. De plus, une concentration de lipides maximale d’environ 50% est nécessaire afin d’assurer une hydratation complète des têtes polaires puisqu’environ 20 molécules d’eau constituent la sphère d’hydratation d’un lipide [93].
Figure 1.16 Schématisation de la transition de phase de bicouches phospholipidiques
Les membranes modèles peuvent former des vésicules lipidiques comportant une seule bicouche lipidique appelée vésicules unilamellaires (petites vésicules unilamellaires (SUV) ou larges vésicules unilamellaires (LUV)), ou peuvent être constituées de plusieurs bicouches lipidiques nommées vésicules multilamellaires (MLV) (figure 1.17). Les SUVs ont une taille inférieure à 100 nm, les LUVs ont une taille supérieure à 100 nm et les MLVs ont une taille entre 100 et 1000 nm [96]. Pour pouvoir utiliser une haute concentration de lipides, les MLVs vont être utilisées dans ce travail. Les MLVs sont constituées de plusieurs bicouches lipidiques concentriques et hydratés. À l’image d’une pelure d’oignon, les bicouches lipidiques sont séparées par un mince film d’eau. Les têtes polaires font face à l’eau tandis que les chaînes acyle en sont exclues et forment un cœur
hydrophobe. Les MLVs sont formées en mettant en suspension les phospholipides dans l’eau et en chauffant au-dessus de Tm. Certains lipides possèdent une structure moléculaire qui les empêche de former des
bicouches, puisque pour les former l’aire de la tête polaire doit être proche de celle des chaînes acyle [97].
Figure 1.17 Schéma d'une bicouche lipidique, d'une SUV, d'une LUV et d'une MLV. Figure modifiée de [96].
Dans cette étude, six phospholipides ont été utilisés :
trois phospholipides zwitterioniques :
- dimyristoylphosphatidylcholine (DMPC) 14:0
- palmitoyloléoylphosphatidylcholine (POPC) 16:0/18:1
trois phospholipides chargés négativement
- dimyristoylphosphatidylglycérol (DMPG) 14:0
- palmitoyloléoylphosphatidylglycérol (POPG) 16:0/18:1
- dioléoylphosphatidylglycérol (DOPG) 18:1
Figure 1.18 Représentation des lipides utilisés.
1.6 Objectifs du projet
L’intérêt général principal est d’utiliser diverses techniques de spectroscopie afin de mieux comprendre le mécanisme causant l’agrégation de l’α-synucléine. Pour ce faire, nous nous sommes attachés à étudier les propriétés d’une région spécifique de cette protéine, représentée par le peptide α-syn71-82. L’objectif est de mieux comprendre la maladie de Parkinson et, éventuellement, d’apporter des éléments pouvant contribuer à trouver un traitement.
Les objectifs spécifiques regroupent quatre parties. La première consiste à former des fibrilles et confirmer leur formation par chromatographie en phase liquide couplée à un spectromètre de masse (LC-MS) et par dichroïsme circulaire (CD). La deuxième vise à étudier la structure secondaire adoptée par le peptide en solution par CD et par spectroscopie FTIR en fonction de diverses conditions de température et de concentration. La
troisième porte sur l’effet des membranes sur la structure secondaire du peptide étudié par CD et FTIR (Figure 1.19, vert). Finalement, la quatrième implique l’étude de l’effet du peptide sur la conformation de membranes modèles par FTIR et RMN du phosphore 31P (Figure 1.19, bleu, rouge et orange). La FTIR permet d’obtenir de
l’information sur l’ordre des chaînes acyle et l’hydratation des têtes polaires des lipides. La RMN 31P informe
sur la dynamique des têtes polaires et la forme des vésicules. Différents lipides ont été utilisés pour mimer les diverses cellules retrouvées dans le cerveau. Ces lipides possèdent une charge ou non, une insaturation ou non et des longueurs de chaînes différentes.
Chapitre 2 Formation de fibrilles d’α-syn71-82
Ce chapitre portera sur la formation de fibrilles d’α-syn71-82. Plusieurs essais ont été effectués et ceux-ci sont répertoriés ici-bas. La formation des fibrilles permettraient d’analyser le peptide sous sa forme adoptée lors de la maladie de Parkinson.
2.1 Matériels et méthodes
2.1.1 Matériels
Le Na2HPO4 a été acheté chez Aldrich Chemical Company (Milwaukee, WI, USA), le NaH2PO4 a été obtenu de
Fisher Scientific Company (Bridgewater, NJ, USA) et le Tris-HCl a été acquis chez Sigma (St-Louis, MI, USA). Les tampons ont été préparés avec de l’eau distillée et déonisée provenant d’un système Barnstead NANOpurII qui possède quatre colonnes de purification (résistivité de 18.2 MΩ/cm; Boston, MA, USA). Les acides aminés protégés Fmoc ont été achetés chez Matrix Innovation (Québec, QC, Canada). Tous les solvants utilisés sont de grade réactif ou HPLC et ont été utilisés sans purification additionnelle.
2.1.2 Synthèse peptidique
Le peptide α-syn71-82 a été synthétisé au laboratoire du professeur Normand Voyer par la méthode de synthèse peptidique sur support solide selon la stratégie Fmoc (9-fluorénylméthyloxycarbonyle). Selon cette méthode, le peptide en croissance est attaché à une résine insoluble faisant office de support peptidique. La résine utilisée ici est la résine de Wang. Après le couplage de chaque acide aminé, les produits secondaires sont enlevés en effectuant une filtration et une série de lavages. Toutes ces réactions peuvent être facilement réalisées à l’intérieur d’une seule seringue. Les acides aminés sont protégés par un groupement N-Fmoc, ce qui permet une protection orthogonale des chaînes latérales. Ce groupement peut être déprotégé par une solution basique 20% pipéridine dans le DMF. Les chaînes latérales des acides aminés sont déprotégées en condition acide grâce à l’utilisation d’une solution de 95% TFA, ce qui conduit à des peptides possédant un C-terminal acide [98]. Le clivage de la résine de Wang s’effectue aussi avec cette même solution de TFA (Figure 2.1).
Figure 2.1 Schéma de la synthèse peptidique sur support solide selon la stratégie Fmoc
Une résine de Wang possédant le premier acide aminé couplé (soit la valine) a été utilisée pour optimiser le pourcentage de rendement de la synthèse peptidique. Sur cette résine le deuxième acide aminé a été couplé. Tout d’abord, il y a déprotection du premier acide aminé avec une solution 20% pipéridine/DMF. Par la suite, le deuxième acide aminé est couplé grâce à des agents de couplage et d’activation HOBt (hydroxybenzotriazole) et HBTU (2-(1H-Benzotriazole-1-yl)-1,1,3,3-tétraméthyluroniumhexafluorophosphate) en présence de DIEA (diisopropyléthylamine). Le tout est agité mécaniquement pendant une heure à température ambiante. Finalement, la résine est filtrée et lavée trois fois avec du DMF puis du MeOH. La résine est séchée et la complétion de la réaction est contrôlée par un test qualitatif de Kaiser [99]. Le tout est répété jusqu’à l’obtention des 12 acides aminés de l’α-syn71-82.
Finalement, le peptide est déprotégé une dernière fois puis clivé de la résine avec une solution de 95% TFA pendant deux heures. Pour s’assurer qu’il ne reste plus aucune trace de TFA, le peptide est solubilisé trois fois dans une solution de 10 mM HCl et lyophilisé. Pour obtenir le peptide sous forme de monomère, celui-ci a été deux fois solubilisé dans de l’eau nano pure et lyophilisé. La pureté et la séquence du peptide ont été vérifiées par vérification de sa masse exacte (soit 1172.68 g/mol) grâce à la LC-MS de type ionisation par électronébuliseur [100].
2.1.3 Préparation des échantillons
L’α-syn71-82 a été dissout dans un tampon phosphate (pH 7, 10 mM Na2HPO4 et 10 mM NaH2PO4) et dans un
900 µM. Sous agitation mécanique, les deux solutions ont été incubées pendant 6 semaines à une température de 37 °C. Au bout de ces six semaines, les solutions ont été centrifugées pendant 20 minutes et le précipité a été récupéré et lyophilisé [101]. Les échantillons analysés en CD ont été dilués par un facteur 2 avec la solution tampon correspondante.
2.1.4 Méthodes expérimentales
2.1.4.1 Dichroïsme circulaire
Les spectres de CD ont été obtenus avec un spectropolarimètre JASCO J-815 (Jasco, Easton, MD, USA) à température ambiante. Les spectres ont été enregistrés entre 190 et 260 nm à une vitesse de balayage de 100 nm/min, une largeur de bande de 1 nm et une taille de pas de 0,2 nm. Dix balayages ont été effectués pour chacun des échantillons avec une cellule de quartz de longueur de trajet de 0,1 mm. Tous les spectres ont été lissés et corrigés en soustrayant le spectre du tampon phosphate par le logiciel Spectra Manager.
2.2 Dichroïsme circulaire
2.2.1 Études structurales
La spectroscopie de dichroïsme circulaire est utilisée pour déterminer la structure secondaire des peptides et des protéines. Cette technique est intéressante puisqu’elle permet l’utilisation de conditions similaires aux conditions retrouvées dans les milieux biologiques. Elle repose sur le fait que la lumière peut être polarisée circulairement à gauche et à droite (Figure 2.2). Lorsque les composantes gauche et droite possèdent une amplitude différente, la radiation résultante sera une polarisation ellipsoïdale qui produira un signal en CD (Figure 2.2, II). C’est le cas lorsqu’il y a présence de chromophores chiraux comme les acides aminés et les structures secondaires des peptides et des protéines [102].
Les spectropolarimètres mesurent donc la différence d’absorbance entre la composante polarisée circulairement à droite et à gauche. Habituellement, les valeurs sont données en ellipticité molaire (θ) en fonction de la longueur d’onde. Dans le cas présent, le faisceau de lumière utilisé se trouve dans la région des UV lointains pour permettre l’obtention des informations sur la structure secondaire des peptides. Conséquemment, la région entre 190 à 260 nm va être étudiée puisqu’elle contient les informations propres aux liaisons peptidiques (Figure 2.3, mauve).
Figure 2.3 Régions spectrales en CD avec les chromophores correspondants. Figure adaptée de [102].
En ce qui a trait à l’absorbance des structures secondaires, elle correspond à une large transition de n → π* retrouvée à environ 220 nm et une transition π → π* située vers 190 nm. Les structures secondaires possèdent donc des courbes CD caractéristiques. Pour ce qui est des hélices-α, on retrouve un maximum à 195 nm et deux minimums à 208 et 222 nm. Pour les feuillets-β, il y a présence d’un maximum vers 195 nm et un minimum à 216 nm dans le spectre CD. Finalement, les structures désordonnées possèdent un minimum vers 200 nm (Figure 2.4) [103].
Figure 2.4 Spectres CD en UV lointain de plusieurs structures secondaire. Hélice-α : ligne pleine, feuillet-β : longue ligne pointillée, structure désordonné : petite ligne pointillée. Figure adaptée de [103].
2.2.2 Résultats
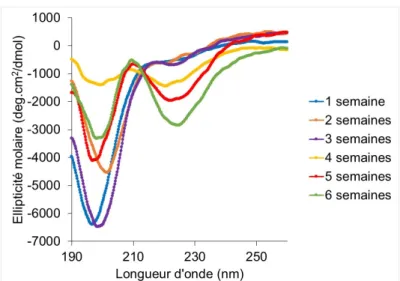
Par l’analyse des spectres CD, il est possible de suivre l’agrégation du peptide. En effet, lorsque le peptide s’agrège, il passe d’une forme désordonnée à une structure majoritairement en feuillets-β. Lorsque l’α-syn71-82 a été incubé dans un tampon TRIS, il n’y a eu aucun changement de forme au cours des cinq semaines, comme vu dans la Figure 2.5. Le peptide est resté sous sa forme désordonnée comme démontré par le minimum vers 200 nm. Par conséquent, il n’y a eu très peu d’agrégation et formation de fibrilles. L’utilisation de ce tampon a donc été abandonnée.
Lors des trois premières semaines d’incubation dans un tampon phosphate, l’α-syn71-82 se trouve majoritairement sous une forme désordonnée (minimum vers 200 nm). Par contre, dès la quatrième semaine d’incubation, il y a apparition d’une autre composante vers 222 nm qui confirme l’apparition de feuillets-β (Figure 2.6). Leur présence indique que le peptide agrège et forme des fibrilles. Néanmoins, même après six semaines, il y a toujours la présence de structures désordonnées, démontrant que la fibrillation n’est pas complète. Après les six semaines, le précipité formé a été récupéré par centrifugation. Malheureusement, le rendement fut très bas, environ 20%, ce qui n’a pas permis de faire les études ultérieures souhaitées, notamment la caractérisation structurales des agrégats formés.
2.3 Conclusions partielles
Les essais précédents ont permis de déterminer le protocole à suivre pour obtenir des fibrilles d’α-syn71-82. Pour ce faire, on doit incuber le peptide sous sa forme désordonnée et monomérique pendant six semaines à 37 °C en agitant mécaniquement. Par contre, comme démontré plus haut, le choix du tampon est très important. On doit utiliser un tampon phosphate pour que les fibrilles puissent se former relativement rapidement. Comme l’utilisation d’un sel possédant une légère force ionique promeut le processus de fibrillation, l’utilisation d’une solution de phosphate est toute à fait indiquée [104].
.
Chapitre 3 Études spectroscopiques de la
structure et de l’interaction membranaire de
α-syn71-82
Dans ce chapitre, les résultats concernant l’interaction entre l’α-syn71-82 et des lipides à chaînes saturées (DMPC, DMPG) ou insaturées (DOPC, DOPG) sera abordée. Les interactions entre le peptide et les membranes de POPC et POPG seront également abordées dans le chapitre 4 puisqu’elles font parties d’un article soumis au journal Biochemistry. Par conséquent, une certaine redondance est présente entre les chapitres 3 et 4, mais celle-ci est inévitable pour pouvoir comparer les lipides saturés et insaturés avec clarté et rigueur. Le choix de présenter les résultats obtenus avec les lipides POPC et POPG dans l’article repose sur le fait que ces lipides sont le plus représentatifs des lipides présents naturellement dans le cerveau. Dans cette même publication, les résultats obtenus pour le peptide pur en solution ont également été présentés.
3.1 Matériel et méthode
3.1.1 Matériel
Les lipides DMPC, DMPG, DOPC et DOPG ont été achetés chez Avanti Polar Lipids (Alabaster, AL, USA) et utilisés sans purification. Le Na2HPO4 a été acheté chez Aldrich Chemical Company (Milwaukee, WI, USA), le
NaH2PO4 a été obtenu de Fisher Scientific Company (Bridgewater, NJ, USA) et le Tris-HCl a été acquis chez
Sigma (St-Louis, MI, USA). L’oxyde de deutérium (D2O) a été acheté de CDN isotopes (Pointe-Claire, QC,
Canada). Les tampons ont été préparés avec de l’eau distillée et déonisée provenant d’un système Barnstead NANOpurII qui possède quatre colonnes de purification (résistivité de 18.2 MΩ/cm; Boston, MA, USA). Les acides aminés sont protégés par un groupement Fmoc et ont été achetés chez Matrix Innovation (Québec, QC, Canada). Tous les solvants utilisés sont de grade réactif ou HPLC et ont été utilisés sans aucune autre purification.
3.1.2 Préparation des échantillons
3.1.2.1 α-syn71-82 pure en solution
L’α-syn71-82 pure a été dissoute dans du tampon phosphate à pH 7. Pour les expériences de CD, la concentration en peptide est de 1,3 mM. Pour les mesures en FTIR, le tampon a été éliminé sous un courant d'azote gazeux et lyophilisé pendant une nuit. Les échantillons ont ensuite été réhydratés avec un tampon phosphate D2O à une concentration de 7 mM.
3.1.2.2 Vésicules multilamellaires
Les MLVs ont été préparés en utilisant une quantité déterminée de DMPC, DMPG, DOPC et DOPG, et en effectuant cinq cycles gel-dégel avec ces échantillons. Un cycle gel-dégel consiste à agiter mécaniquement les échantillons, les geler dans l’azote liquide à -196 °C puis les chauffer pendant 5 minutes à 37 °C grâce à un bloc chauffant. Lors du dernier cycle, l’échantillon est décongelé à température ambiante. Les lipides ont été hydratés par un tampon phosphate (pH 7) dans le D2O en FTIR et par un tampon TRIS (pH 7,4) en RMN. Pour
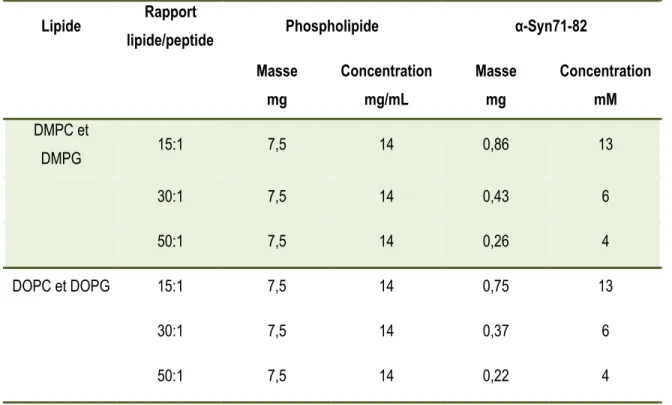
les échantillons qui contiennent de l’α-syn71-82, les vésicules ont été préparées par le même mode opératoire, mais une quantité prédéfinie de peptide a été ajouté aux solutions tampons que précédemment pour obtenir un rapport molaire lipide/peptide de 15:1, 30:1 ou 50:1. Les tableaux 3.1 et 3.2 présentent les masses et les concentrations utilisées pour la préparation des échantillons.
Tableau 3.1 Masses et concentrations utilisées lors de la préparation des échantillons en FTIR
Lipide Rapport
lipide/peptide Phospholipide α-Syn71-82 Masse mg Concentration mg/mL Masse mg Concentration mM DMPC et DMPG 15:1 7,5 14 0,86 13 30:1 7,5 14 0,43 6 50:1 7,5 14 0,26 4 DOPC et DOPG 15:1 7,5 14 0,75 13 30:1 7,5 14 0,37 6 50:1 7,5 14 0,22 4
![Tableau 1.1 Liste des principales fibrilles amyloïdes retrouvées dans le corps humain [2].](https://thumb-eu.123doks.com/thumbv2/123doknet/6707944.184451/23.918.196.764.574.998/tableau-liste-principales-fibrilles-amyloïdes-retrouvées-corps-humain.webp)
![Figure 1.6 Représentation de l'α-synucléine et ses caractéristiques. Figure modifiée de [37]](https://thumb-eu.123doks.com/thumbv2/123doknet/6707944.184451/31.918.147.799.521.802/figure-représentation-α-synucléine-caractéristiques-figure-modifiée.webp)
![Figure 1.7 Structure secondaire de l'α-synucléine selon les conditions. Figure modifiée de [52]](https://thumb-eu.123doks.com/thumbv2/123doknet/6707944.184451/32.918.106.755.478.739/figure-structure-secondaire-α-synucléine-conditions-figure-modifiée.webp)
![Figure 1.14 Schéma du modèle membranaire de mosaïque fluide. Figure modifiée de [92].](https://thumb-eu.123doks.com/thumbv2/123doknet/6707944.184451/39.918.174.785.106.493/figure-schéma-modèle-membranaire-mosaïque-fluide-figure-modifiée.webp)

![Figure 2.2 Principe du CD. Lumière circulairement polarisée à gauche et à droite. Figure adaptée de [103]](https://thumb-eu.123doks.com/thumbv2/123doknet/6707944.184451/47.918.184.776.860.1028/figure-principe-lumière-circulairement-polarisée-gauche-figure-adaptée.webp)
![Figure 2.3 Régions spectrales en CD avec les chromophores correspondants. Figure adaptée de [102]](https://thumb-eu.123doks.com/thumbv2/123doknet/6707944.184451/48.918.156.702.299.464/figure-régions-spectrales-cd-chromophores-correspondants-figure-adaptée.webp)