Interactions membranaires de canaux ioniques artificiels :
une étude approfondie par dichroïsme circulaire orienté
Mémoire
Jean-Daniel Savoie
Maîtrise en chimie
Maître ès sciences (M.Sc.)
Québec, Canada
© Jean-Daniel Savoie, 2016
Interactions membranaires de canaux ioniques artificiels :
une étude approfondie par dichroïsme circulaire orienté
Mémoire
Jean-Daniel Savoie
Sous la direction de :
Résumé
Les peptides et les protéines font partie intégrante de l’arsenal dont l’évolution a pourvu les êtres vivants. Plusieurs fonctions essentielles d’un organisme, tel le transport ionique, dépendent d’ailleurs de leur implication. Les protéines-canal sont ubiquitaires chez tous les êtres vivants et pourtant, plusieurs questions non résolues sont soulevées quand on pense à leur mécanisme d’action et plus précisément à la relation qui existe entre leur structure et leur activité. Puisque l’étude des protéines-canal s’avère très complexe et laborieuse, plusieurs ont cherché à les étudier indirectement en développant, par exemple, des modèles synthétiques.
Ce mémoire présente une catégorie unique de peptides développés par le groupe Voyer et constitués exclusivement de leucines et de 21-couronne-7-L-phénylalanines. La structure du peptide a été conçue spécialement pour qu’il puisse effectuer du transport ionique membranaire et servir de modèle dans l’étude des protéines-canal. Le peptide a été caractérisé de façon exhaustive au cours des vingt dernières années et les études ont bien établi sa conformation et démontré sa capacité à effectuer du transport membranaire sans, toutefois, lever le voile sur le mécanisme par lequel il opère.
Afin d’y voir plus clair et d’en apprendre davantage sur leur mécanisme d’action, les travaux qui sont décrits dans les pages suivantes portent sur la caractérisation par dichroïsme circulaire orienté de la structure et de la topologie membranaire des peptides du groupe Voyer.
Table des matières
Résumé ... iii
Table des matières ... iv
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... xi
Remerciements ... xiv
Chapitre 1 : Introduction ... 1
1.1 La cellule et ses composantes ... 1
1.1.1 Les membranes cellulaires ... 1
1.1.2 Les protéines membranaires ... 3
1.1.3 Les canaux ioniques ... 7
1.2 Les peptides cytotoxiques naturels et leurs modes d’action ... 11
1.2.1 Gramicidine A ... 12
1.2.2 Magainine II ... 14
1.2.3 Alaméthicine ... 17
1.3 Conclusion ... 19
Chapitre 2 : Canaux ioniques artificiels ... 20
2.1 Exemples tirés de la littérature ... 20
2.1.1 β-cyclodextrine tétrasubstituée ... 21
2.1.2 Les canaux synthétiques LS2 et LS3 ... 23
2.1.3 Nanotube de peptides cycliques β3 ... 25
2.1.5 G-quartet ... 28
2.1.6 Canaux éther-couronnes ... 30
2.2 Les peptides éther-couronnes du groupe Voyer ... 32
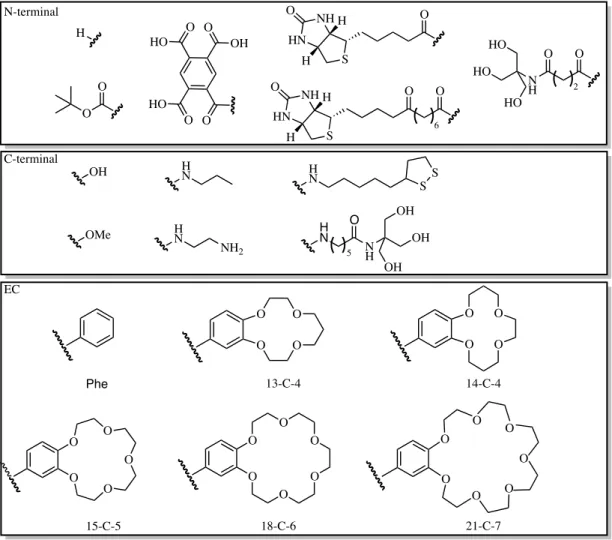
2.2.1 Design ... 33
2.2.2 Synthèse ... 38
2.2.3 Études de transport membranaire ... 43
2.2.4 Caractérisations biophysiques ... 47
2.2.5 Problématique et objectif général ... 55
Chapitre 3 : Dichroïsme circulaire orienté ... 57
3.1 Théorie sur le dichroïsme circulaire ... 57
3.1.1 Biréfringence circulaire ... 58
3.1.2 Dichroïsme circulaire (CD) ... 59
3.1.3 CD de peptides et de protéines ... 62
3.2 Origine et théorie sur le dichroïsme circulaire orienté ... 65
3.2.1 Origine ... 65
3.2.2 Théorie ... 66
3.2.3 Méthode ... 69
3.2.4 Avantages et inconvénients de l’OCD ... 71
Chapitre 4 : Résultats ... 73
4.1 Objectifs spécifiques ... 73
4.2 Étude des spectres isotropes ... 75
4.2.1 CD dans un solvant ... 76
4.2.2 CD dans des micelles ... 77
4.3 Étude des spectres orientés ... 85
4.3.1 Influence de la concentration et du N-/C-terminal ... 85
4.3.2 Influence de l’épaisseur des bicouches et de la concentration ... 89
4.3.3 Influence de phospholipides dont les têtes polaires sont chargées ... 98
Chapitre 5 : Conclusions et perspectives ... 101
Chapitre 6 : Travaux expérimentaux ... 103
6.1 Produits chimiques ... 103 6.2 Spectroscopie de CD ... 103 6.3 Spectroscopie OCD ... 105 6.4 Spectroscopie SR-OCD ... 107 6.5 Traitement de données ... 108 ANNEXES ... 110
ANNEXE I : SPECTRES OBTENUS POUR LE CD DE 1 DANS LES SOLVANTS ... 110
ANNEXE II : SPECTRES OBTENUS POUR LE CD DE 1, 2 et 3 DANS LES MICELLES DE SDS ET DE DPC ... 111
ANNEXE III : SPECTRES OBTENUS POUR LE CD DE 1 DANS LES VÉSICULES DE DMPC, DMPG, DMoPC, DOPC ET DErPC ... 112
ANNEXE IV : SPECTRES OBTENUS EN OCD POUR 1 DANS LES BICOUCHES DE DMPC (DONNÉES BRUTES ET NORMALISÉES) ... 113
ANNEXE V : SPECTRES OBTENUS EN OCD POUR 2 DANS LES BICOUCHES DE DMPC (DONNÉES BRUTES ET NORMALISÉES) ... 114
Bibliographie ... 122
Liste des tableaux
Tableau 1.1 Quelques canalopathies, leur canal mutant et leurs symptômes ... 10 Tableau 2.1 Propension des résidus à former des hélices-α (Pα) et des feuillets-β (Pβ) ... 33
Tableau 2.23 Étude de sélectivité sur les peptides EC par spectroscopie de fluorescence .. 51 Tableau 2.34 Rapport dichroïque (R) et angle (θ) adopté par le peptide en présence de films lipidiques orientés ... 54 Tableau 4.15 Nombre de carbones des chaînes acyle (nC), épaisseur de la région
hydrophobe (dC) et épaisseur de la bicouche totale (dL) des phospholipides étudiés en OCD ... 90
Liste des figures
Figure 1.1 Glycérophospholipides assemblés sous forme de bicouche ... 1
Figure 1.2 Membranes cellulaires selon le modèle de la mosaïque fluide, ... 2
Figure 1.3 Quatre classes de protéines transmembranaires ... 3
Figure 1.4 Activation d’une protéine G par un récepteur 7TM ... 5
Figure 1.5 Transporteur passif (à gauche) et actif (à droite) ... 6
Figure 1.6 Protéine-canal fermée (à gauche) et ouverte (à droite) permettant le transport membranaire passif d’espèces moléculaires et ioniques ... 7
Figure 1.7 Étapes décrivant la formation d’un potentiel d’action nerveux ... 9
Figure 1.8 Structure primaire du peptide antibiotique gramicidine A ... 12
Figure 1.9 Conformation de gramicidine A sous sa forme (A) inactive et (B) active ... 14
Figure 1.10 Structure primaire du peptide antimicrobien magainine II ... 15
Figure 1.11 Formation d’un pore toroïdale par la magainine II ... 16
Figure 1.12 Structure primaire du peptide antimicrobien alaméthicine ... 17
Figure 1.13. Vue de profil du « membrane thinning » de l’alaméthicine ... 18
Figure 1.14. Formation d’un pore en douves de tonneau (« barrel stave ») par l’alaméthicine ... 19
Figure 2.115Stratégies envisageables pour le développement de canaux ioniques artificiels ... 21
Figure 2.216β-cyclodextrine vue de face (A) et de profil (B) ... 22
Figure 2.317« Demi-canal » β-cyclodextrine tétrasubstituée de Tabushi ... 22
Figure 2.418Projection illustrant les caractères amphiphiles LS2 (A) et de LS3 (B) ... 24
Figure 2.519LS2 forme un tétramère (A) et LS3 forme un hexamère (B)67B ... 24
Figure 2.620Acides aminés β3 (A) et stratégie de Ghadiri pour former un canal ionique (B) ... 26
Figure 2.721Stratégie de Matile pour former des barils-β ... 27
Figure 2.822Passage de la conformation « en escalier » à celle en baril ... 28
Figure 2.923Stratégie de Davis pour former un canal ionique à base de G-quartet ... 29
Figure 2.1024Polymère de Nolte (A) et représentation schématique du canal résultant (B) 31 Figure 2.1125Canal ionique artificiel de Fyles ... 31
Figure 2.1226Molécule développée par Gokel (A) pour former un canal ionique (B) ... 32
Figure 2.1327Structure de deux unités du tétramère de la protéine KcsA (A) et zoom sur les quatre sites de liaison du filtre sélectif (B) ... 35
Figure 2.1428La taille des macrocycles est intrinsèque à leur sélectivité ... 36
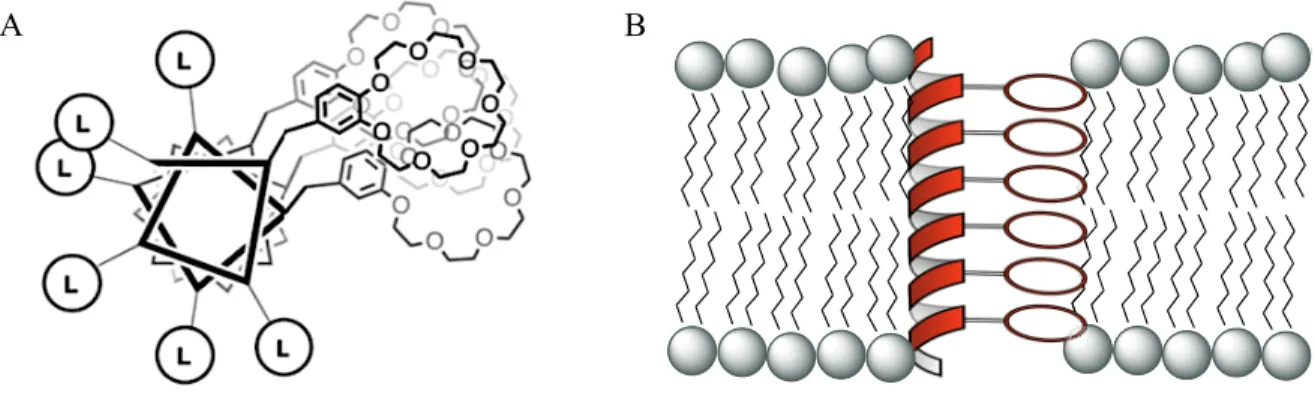
Figure 2.1529Prototype de canal ionique artificiel développé par notre groupe ... 37
Figure 2.1630Projection de l’hélice illustrant le caractère amphiphile et l’alignement des EC (A) et représentation du canal monomoléculaire de Voyer en présence de membranes (B) ... 38
Figure 2.1731Méthode utilisée pour la synthèse de la 21-couronne-7-L-phénylalanine ... 39
Figure 2.1933Premier couplage : a) DIC, HOBt, DMAP, DIEA, DMF, 3h, b) Ac2O/DMF
(1/1), DIEA, 1h ... 40
Figure 2.2034Paramètres modifiés pour obtenir différents analogues du peptide 21-mère . 42 Figure 2.2135Principe du pH-stat pour évaluer le transport membranaire ... 43
Figure 2.2236Profil de transport du peptide EC par pH-stat91 ... 44
Figure 2.2337Principe de la méthode de « patch clamp » ... 45
Figure 2.2438Spectres caractéristiques de canaux ioniques obtenus par une méthode dérivée du « patch clamp » ... 46
Figure 2.2539Spectres de CD de A) Boc-P21-(14C4)6-OMe, B) Boc P21-(14C4)6-OH, C) H2N- P21-(14C4)6-OH, D) Boc-P21-(18C6)6-OMe, E) Boc P21-(21C7)6-OMe dans TFE à 5 x 10-5 M. ... 48
Figure 2.2640Spectre FTIR du peptide Boc-P21-(14C4)6-OMe qui adoptent une conformation en hélice-α dans différents milieux103 ... 49
Figure 2.2741Spectre de fluorescence de P21-(21C7)6-OtBu suggérant l’alignement des EC91 ... 50
Figure 2.2842Efflux ionique de peptides dont les EC sont séparés de différentes distances105 ... 52
Figure 2.2943Spectre RMN 15N de P21-(21C7)6 marqué incorporé dans des bicouches lipidiques orientées entre des lamelles de verre (P/L = 1/60)107 ... 53
Figure 2.3044Graphique de l’angle adopté par P21-(21C7)6 en fonction du ratio L/P ... 55
Figure 3.145La lumière polarisée linéairement peut être décomposée en LCPG et en LCPD ... 57
Figure 3.246Principe de la biréfringence à gauche avec un exemple visuel à droite ... 58
Figure 3.347La biréfringence résulte du déphasage de la LCPG et de la LCPD ... 59
Figure 3.448Vue de face du dichroïsme des composantes LCPG et LCDP causant une lumière elliptiquement polarisée ... 60
Figure 3.549Système optique d’un spectropolarimètre ... 62
Figure 3.650Transitions électroniques d’une liaison amide ... 63
Figure 3.751Signature spectrale des différentes conformations adoptées par un peptide ... 63
Figure 3.852Scission de l’exciton expliquée par la théorie de Moffitt118B ... 64
Figure 3.953Les transitions électroniques ont lieu lorsque le vecteur de champ électrique (E) est parallèle au moment dipolaire des transitions ... 67
Figure 3.1054Spectres de OCD théoriques d’hélices adoptant l’état-S (A) et l’état-I (B) et la déconvolution de leurs bandes ... 68
Figure 3.1155Compartimentation (A) et représentation 3D d’une cellule d’OCD (B) ... 70
Figure 4.1561, 2 et 3 ont été étudiés en OCD ... 73
Figure 4.257Études de CD de 1 dans différentes proportions d’eau et de méthanol ... 76
Figure 4.358Micelles sphériques (A) et les détergents SDS et DPC (B) ... 78
Figure 4.459Étude de CD de 1, 2 et 3 en présence de micelles de SDS et de DPC ... 79
Figure 4.560Vésicules unilamellaires (A) et les phospholipides DMPC, DMPG, DMoPC, DOPC et DErPC utilisés (B) ... 80
Figure 4.661CD de 1 en présence de vésicules unilamellaires de DMPG (A), de DMPC (B), de DMoPC, DOPC et DErPC (C) et le SRCD de ces derniers systèmes (D) ... 81
Figure 4.762Quantification des structures secondaires de 1 en présence vésicules unilamellaires (A) de DMPG et (B) de DMPC ... 83
Figure 4.863Spectres OCD dans des bicouches de DMPC agencés de façon à illustrer (A)
l’effet de la concentration sur chaque analogue (1, 2 et 3) et (B) l’effet du
N-/C-terminal comparé à chaque ratio P/L (1/20, 1/100 et 1/200) ... 87 Figure 4.964Spectres de SR-OCD de 1 illustrant l’influence de l’épaisseur des bicouches en
utilisant DMoPC, DOPC et DErPC à différent P/L ... 91 Figure 4.1065En OCD les courbes intermédiaires peuvent être interprétées de trois façons
... 93 Figure 4.1166Graphiques traçant l’ellipticité à 210 nm en fonction de la réciproque du P/L
... 94 Figure 4.1267Les lipides et les peptides peuvent s’adapter pour réduire les « mismatch »
négatifs ... 96 Figure 4.1368La concentration de 1 influence son orientation membranaire ... 97
Figure 4.1469Comparaison de l’orientation de 1 dans des bicouches de DMPC et de DMPG
par OCD ... 99 Figure 4.1570Comparaison de l’absorbance de 1 dans des bicouches de DMPC et de
DMPG ... 100 Figure 4.1671Photos microscopiques comparant les échantillons des systèmes
membranaires composés de DMPC et de DMPG ... 100 Figure 5.172Le canal est fonctionnel à basse concentration et non fonctionnel à haute
concentration ... 102 Figure 6.173Exemples de quantités utilisées pour préparer les solutions mères et des
quantités déposées sur la fenêtre de quartz pour l’analyse OCD de 1 dans DMPC ... 106 Figure 6.274Exemples de quantités utilisées pour préparer les solutions mères et des
quantités déposées sur la fenêtre de quartz pour l’analyse SR-OCD de 1 dans DMoPC ... 108
Liste des abréviations
Å Angström
Aib Acide 2-aminoisobutyrique ADP Adénosine diphosphate ARN Acide ribonucléique ATP Adénosine triphosphate
ATR Réflexion totale atténuée (Attenuated Total Reflectance)
Boc tert-butoxycarbonyle
CD Dichroïsme circulaire (Circular Dichroism)
DAN Dialkoxynaphtalène
DCE 1,2-dicloroéthane
DErPC 1,2-dierucoyl-sn-glycéro-3-phosphocholine
DIEA Diisopropyléthylamine
DiPhy Diphytanoylglycérol phosphatidylcholine
DMAP Diméthylaminopyridine DMF Diméthylformamide DMPC 1,2-dimyristoyl-sn-glycéro-3-phosphocholine DMPG 1,2-dimyristoyl-sn-glycéro-3-phosphoglycérol DMoPC 1,2-dimyristoléoyl-sn-glycéro-3-phosphocholine DMSO Diméthylsulfoxyde DIC Diisopropylcarbodiimide DOPC 1,2-dioléoyl-sn-glycéro-3-phosphocholine DPC Dodécylphosphocholine
DRX Diffraction des rayons X
EC Éther-couronne
Fmoc Fluorénylméthoxycarbonyle
FCCP 1,3-dinitrilo-2-propanone (4-(trifluorométhoxy)phényl)-hydrazone
GMO Monooléate de glycérol
HEG Hexaéthylène glycol
HOBt Hydroxybenzotriazole
HPLC Chromatographie liquide à haute performance
(High Performance Liquid Chromatography) K2SO4 Sulfate de potassium
LD Dichroïsme linéaire (Linear Dichroism)
LPCD Lumière polarisée circulairement à droite LPCG Lumière polarisée circulairement à gauche mdeg Millidegré
MeOH Méthanol
mg Milligramme
MS Spectrométrie de masse (Mass Spectrometry)
MRE Ellipticité moyenne par résidu (Mean Residue Ellipticity) mV Millivolt
n Indice de réfraction
NDI Naphtalènediimide
OCD Dichroïsme circulaire orienté (Oriented Circular Dichroism)
P/D Peptide/détergent
PEG Polyéthylène glycol
Pheol Phénylalaninol P/L Peptide/lipide ppm Partie par million
RMN Résonance magnétique nucléaire
Sat Saturé
SDS Laurylsulfate de sodium
SFG Génération de fréquence-somme (Sum Frequency Generation)
SPPS Synthèse peptidique sur support solide (Solid Phase Peptide Synthesis) SRCD Dichroïsme circulaire à radiation synchrotron
(Synchrotron Radiation Circular Dichroism)
(Synchrotron Radiation-based Oriented Circular Dichroism) TFA Acide trifluoroacétique
TFE Trifluoroéthanol
Tm Température de transition de phase
TIS Triisopropylsilane
µg Microgramme
Remerciements
J’aimerais avant tout remercier mon directeur de recherche, Normand Voyer, qui m’a accueilli à la maîtrise dans son laboratoire de recherche. Merci énormément pour ton enthousiasme contagieux et ta passion pour la recherche, qui font de toi un excellent directeur. La confiance dont tu as fait preuve quand tu m’as proposé de parfaire mes connaissances en Allemagne m’a permis de vivre une aventure extraordinaire et pour cela je te remercie. Il me serait impossible de compléter ce mot sans mentionner ton ambition (15 publis en 2015) qui pousse tout le groupe à donner son cent pour cent.
Des gens qui se sont montrés d’un soutien parfois moral, parfois (souvent) technique, je dois remercier François Otis. Bien sûr, tu as contribué à l’ensemble de mes travaux en synthétisant et purifiant plusieurs des peptides que j’ai caractérisés, mais tu t’es aussi montré présent quand j’avais besoin de quelqu’un pour relire mes travaux (comme ce mémoire) et dans mes nombreux moments de stress. J’aimerais aussi te remercier de m’avoir accueilli au laboratoire dès ma première journée, de m’avoir légué ton bureau (tant convoité par mes collègues) et de m’avoir initié au merveilleux monde de l’OCD.
Je dois aussi remercier tous les gens du KIT, qui m’ont accueilli chaleureusement lors de mon séjour de quatre mois à Karlsruhe. Merci à Anne S. Ulrich de m’avoir accepté dans son laboratoire, à Jochen Bürck qui a été mon mentor dans l’apprentissage de la technique d’OCD, à Siegmar Roth pour l’explication détaillée sur le fonctionnement du synchrotron, les discussions interminables et le prêt de sa guitare et à Bianca Posselt qui, en plus de m’avoir appris à préparer rigoureusement les échantillons en OCD, m’a accueilli chez elle pendant toute la durée mon séjour. Merci pour les beaux moments vécus ensemble et pour cette chère amitié que nous partageons. Enfin, j’aimerais aussi remercier Marie-Claude avec qui j’ai partagé mon expérience au KIT. Merci pour le soutien moral et surtout pour ton support intarissable lors de mon séjour à la Augenklinik.
Sans les membres de ma famille, rien de tout ça n’aurait été possible. Je tiens à remercier mes parents, Marc et Pauline, pour m’avoir toujours soutenu dans mes études et pour la fierté que je perçois dans votre regard. Merci aussi à mon frère, Marc-Olivier, et tout spécialement à ma sœur, Marie-Pier, pour sa visite en Allemagne qui m’a fait franchement du bien. Merci aussi de t’être intéressé à mes travaux de recherches (au point de visiter le synchrotron) et pour tes mots d’encouragements remplis de fierté après la rédaction de mon article et la présentation de mon séminaire. Enfin, pour avoir été présent lors des bons moments et des moins bons, pour m’avoir encouragé à réaliser mon stage à Karlsruhe, pour avoir supporté mes nombreuses pratiques de présentations sur des sujets assez spécialisés et aussi pour ajouter du soleil dans ma vie (comme quand je me réveille et que tu as préparé mon lunch), un grand merci à toi Danny.
Un merci aussi à mes collègues qui se chargent sans trop de difficulté, voire avec facilité, de faire d’une ambiance de travail l’une des plus festive.
Chapitre 1 : Introduction
1.1 La cellule et ses composantes
1.1.1 Les membranes cellulaires
La membrane cellulaire est une paroi qui délimite et protège la cellule du milieu où elle se trouve. Elle est majoritairement constituée de glycérophospholipides, des molécules amphiphiles dont l’une des extrémités est hydrophile (tête polaire) et l’autre hydrophobe (chaînes acyle)1. En milieu aqueux, afin de limiter les interactions défavorables entre l’eau et les chaînes hydrophobes, ils s’assemblent spontanément en bicouche (Figure 1.1)2. Agencés de la sorte, les têtes polaires hydrophiles sont exposées à l’eau, alors que les chaînes acyle hydrophobes se retrouvent piégées entre les deux couches de têtes polaires, protégées de tout contact avec l’eau.
Figure 1.1 Glycérophospholipides assemblés sous forme de bicouche3
1 Schroeder, F.; Wood, W. G.; Kier, A. B. Lipid Domains and Biological Functions. Dans Cell Physiology Source Book : Essentials of
Membrane Biophysics; Sperelakis, N. Ed.; Elsevier, 2012; 3rd ed.; p 90.
2 Tanford, C. Science 1978, 200, 1012–1018.
3 Boundless. “Phospholipids.” Boundless Biology. Boundless, 21 juillet 2015. Consulté le 30 nov. 2015 :
https://www.boundless.com/biology/textbooks/boundless-biology-textbook/biological-macromolecules-3/lipids-55/phospholipids-300-11433/ Milieu extracellulaire Milieu intracellulaire Têtes polaires hydrophiles Chaînes acyle
Puisque les membranes sont principalement constituées de ces glycérophospholipides, on peut aisément se les imaginer comme étant une bicouche lipidique de forme sphérique. En effet, les têtes polaires hydrophiles tapissent les surfaces internes et externes des membranes alors que les chaînes acyle se retrouvent en leur centre, coincées «en sandwich». La partie maîtresse des membranes est sans aucun doute cette portion hydrophobe constituant non seulement une barrière épaisse d’environ 30 angströms (Å) qui non seulement délimite les milieux intra et extracellulaire, mais qui empêche également les échanges de se produire entre les deux milieux4.
Figure 1.2 Membranes cellulaires selon le modèle de la mosaïque fluide5,6
Les membranes cellulaires sont très complexes et ne sont pas que de simples bicouches lipidiques. En fait, leur composition est tellement élevée en protéines, que l’un des tout premiers modèles utilisés pour les représenter les décrivait comme un sandwich dont le contenu est une bicouche lipidique et le pain, un film de protéine7. De nos jours, le modèle de la mosaïque fluide, proposé par Singer et Nicolson en 1972, représente plus fidèlement la réalité des membranes cellulaires (Figure 1.2). Dans celui-ci, elles sont plutôt décrites comme une mer de glycérophospholipides, assemblés en bicouches, où se déplacent avec
4 Van Meer, G.; Voelker, D. R.; Feigenson, G. W. Nat. Rev. Mol. Cell Biol. 2008, 9, 112–124.
5 GetMedEdu. Plasma (or Cell) Membrane. Consulté le 30 nov. 2015 : http://www.getmededu.com/plasma-or-cell-membrane.html 6Singer, S. J.; Nicolson, G. L. Science 1972, 175, 720–731.
7 Danielli, J. F.; Davson, H. J. Cell. Compar. Physiol. 1935, 5, 495–508.
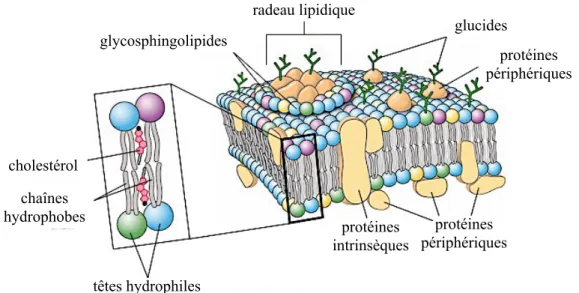
cholestérol chaînes hydrophobes têtes hydrophiles radeau lipidique glycosphingolipides glucides protéines périphériques protéines périphériques protéines intrinsèques
une certaine liberté leurs nombreux constituants, tels que le cholestérol, les glycoprotéines, les glycolipides et les protéines membranaires6, 8. Ces dernières occupent plusieurs fonctions essentielles à la survie des cellules et seront donc discutées plus en profondeur dans le sous-chapitre suivant.
1.1.2 Les protéines membranaires
Dans les membranes biologiques, il existe deux catégories de protéines membranaires. La première est celle des protéines périphériques, qui se retrouvent uniquement en surface des membranes. Elles occupent entre autres des fonctions de structure et de soutien (protéines du cytosquelette) qui permettent de solidifier la membrane4. La seconde catégorie est celle des protéines intrinsèques également appelées protéines transmembranaires. Ces protéines sont particulièrement intéressantes pour la diversité des fonctions qu’elles peuvent accomplir et se divisent en quatre classes: les enzymes, les protéines d’ancrage, les récepteurs et les canaux/transporteurs (Figure 1.3).
Figure 1.3 Quatre classes de protéines transmembranaires9
4 Van Meer, G.; Voelker, D. R.; Feigenson, G. W. Nat. Rev. Mol. Cell Biol. 2008, 9, 112–124. 6 Singer, S. J.; Nicolson, G. L. Science 1972, 175, 720–731.
8 Nicolson, G. L. Biochim. Biophys. Acta 2014, 1838, 1451–1466.
9 Scitable by Nature Education. Protein Function. Consulté le 30 nov. 2015 :
http://www.nature.com/scitable/topicpage/protein-function-14123348
Enzymes
Les enzymes transmembranaires ont pour mission de catalyser les réactions chimiques qui se produisent à l’intérieur des cellules10. L’activation de l’enzyme se produit lorsqu’une molécule extracellulaire s’y fixe. Généralement, les réactions qui s’en suivent ont un lien avec la croissance, la prolifération, la spécialisation ou la survie des cellules11.
Protéines d’ancrage
Les extrémités d’une protéine peuvent former des points d’ancrage liant celle-ci à d’autres molécules. Les ancrages existent à la fois chez les protéines périphériques12 et chez les protéines intrinsèques. En ce qui concerne les protéines intrinsèques, l’ancrage le plus commun est l’ankyrine. Cette dernière ancre les protéines du cytosquelette (la spectrine et l’actine) aux protéines transmembranaires, contribuant ainsi considérablement au maintien de la forme et à la stabilité mécanique de la membrane13.
Récepteurs
La famille la plus notable de récepteurs transmembranaires est très certainement celle des récepteurs transmembranaires-7 (7TM), aussi connue sous le nom de récepteurs couplés à la protéine G14. Leur structure est composée de sept hélices-α transmembranaires, d’où la plus juste appellation de 7TM.
10 Alberts, B.; Johnson, A.; Lewis, J.; Raff, M.; Roberts, K.; Walter, P. Molecular Biology of the Cell, 4th ed, Garland Science : New
York ; 2002.
11 Schlessinger, J. Cell 2000, 103, 211–225.
12 Low, M. G. Glycosylphosphatidylinositol-Anchored Proteins and Their Phospholipase. Dans Biology of Phosphoinositides; Cockroft,
S. Ed.; Oxford University Press, 2000; p 210.
13 Denker, S. P.; Barber, D. L. Curr. Opin. Cell Biol. 2002, 14, 214–220. 14 Kobilka, B. K. Biochim. Biophys. Acta (Biomembranes) 2007, 1768, 794–807.
Lorsque les récepteurs 7TM reçoivent un stimulus (fixation extracellulaire d’un agoniste), ils induisent une réponse (souvent l’activation d’une protéine G) qui induit un processus intracellulaire (Figure 1.4).
Figure 1.4 Activation d’une protéine G par un récepteur 7TM15
Les récepteurs 7TM sont très nombreux tant chez les plantes que chez les animaux et sont à l’origine de plusieurs processus physiologiques. Ce sont d’ailleurs des cibles très prisées en pharmacologie où 50% des médicaments visent justement ces récepteurs16,17.
Transporteurs et protéines-canal
La survie de la cellule dépend des échanges qu’elle peut effectuer avec le milieu extracellulaire, ceux-ci assurant l’apport en nutriments et l’évacuation des déchets de la cellule. Pour des molécules comme l’eau et l’urée, la diffusion à travers la membrane cellulaire est lente, mais possible18. Par contre, pour les ions, les sucres, les acides aminés, les nucléotides et les autres métabolites cellulaires, la tâche est plus ardue. C’est donc par le biais de transporteurs et de protéines-canal que ces échanges ont lieu19.
15 Scitable by Nature Education. GPCR. Consulté le 30 nov. 2015 : http://www.nature.com/scitable/topicpage/gpcr-14047471 16 Pierce, L. K.; Premont, R. T.; Lefkowitz, R. J. Nat. Rev. Mol. Cell Biol. 2002, 3, 639–650.
17 Tautermann, C. S. Bioorg. Med. Chem. Lett. 2014, 24, 4073–4079. 18 Renkin, E. M. J. Gen. Physiol. 1954, 38, 225–243.
19 Hediger, M. A.; Clémençon, B.; Burrier, R. E.; Bruford, E. A. Mol. Aspects Med. 2013, 34, 95–107.
7TM (RCPG) Agoniste Protéine G (inactive) Protéine G (active) Envoie de signaux
Un transporteur est une molécule qui se lie à un soluté et qui subit ensuite un changement de conformation afin de lui faire traverser la membrane cellulaire20. Les transporteurs peuvent soit effectuer du transport passif, qui respecte le gradient de concentration, ou du transport actif, qui va à l’encontre du gradient (Figure 1.5). Pour ce dernier, le terme pompe peut également être utilisé. Ces pompes servent généralement à rétablir le gradient usuel de la cellule et fonctionnent en consommant l’énergie résultant de l’hydrolyse de l’adénosine triphosphate (ATP) en adénosine diphosphate (ADP)21.
Figure 1.5 Transporteur passif (à gauche) et actif (à droite)22
Les protéines-canal, quant à elles, forment des pores transmembranaires communément appelés : «canaux». Entièrement recouverts d’eau, ces derniers permettent aux molécules polaires de traverser les membranes par l’entremise d’un pore hydrophile23. La force motrice qui régule le transport membranaire est le gradient de concentration existant de part et d’autre de la membrane. Conséquemment, le type de transport effectué par ces canaux est du transport passif.
20 Cooper, G. M. Transport of Small Molecules. Dans The Cell : A Molecular Approach, 2nd ed, Sinauer Associates : Sunderland ; 2000. 21 Gadsby, D. C. Nat. Rev. Mol. Cell Biol. 2009, 10, 344–352.
22 Midlands Technical College. Prokaryotes Internal Structures. Consulté le 30 nov. 2015 :
http://classes.midlandstech.edu/carterp/courses/bio225/chap04/lecture5.htm
23 Herrington, J.; Arrey, B. J. Conformational Mechanisms of Signaling Bias of Ion Channels. Dans Biased Signaling in Physiology,
Pharmacology and Therapeutics. Herrington, J.; Arrey. Ed.; Elsevier, 2014; p 175.
Transporteur Transport passif Gradient Pompe Transport actif Gradient ATP ADP
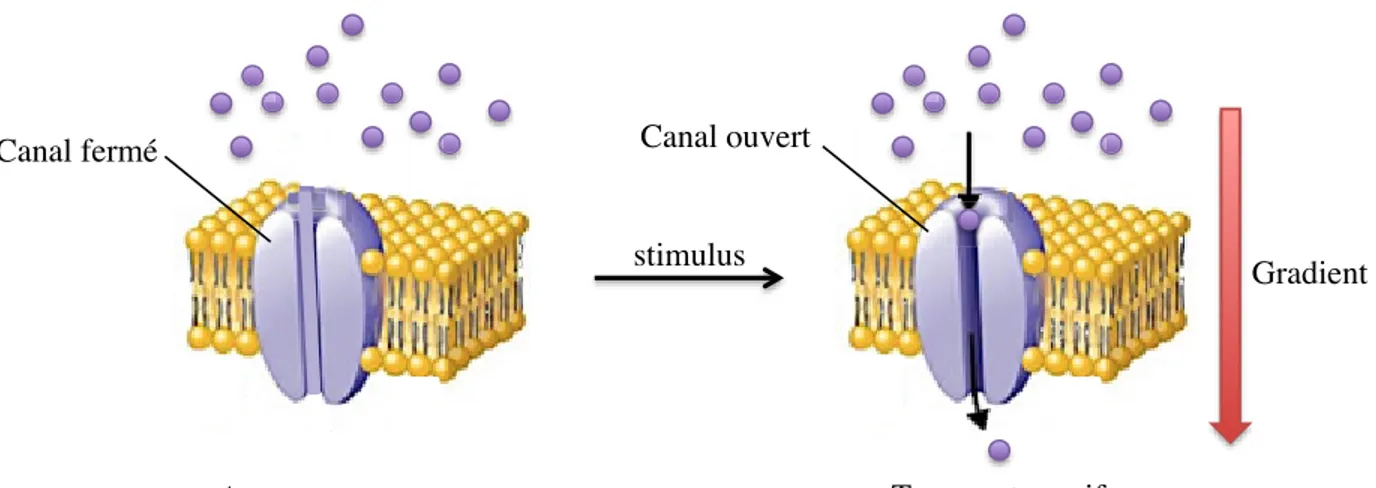
En règle général, les pores sont fermés et ils s’ouvrent à la suite d’un stimulus approprié à la sensibilité du canal (Figure 1.6). Un canal peut être voltage-dépendant (sensible au voltage de la membrane), mécanosensibles (sensible aux changements mécaniques et thermiques) ou ligand-dépendant (sensible à la fixation de ligands, comme l’ATP, la lumière sur une partie réceptrice, tels que les récepteurs 7TM)24. À l’inverse des transporteurs, une fois ouvertes, les protéines-canal ne subissent aucun changement de conformation pour permettre le passage transmembranaire des molécules. C’est d’ailleurs pourquoi le transport qui s’effectue via un canal est plus rapide que celui qui s’effectue via un transporteur21.
Figure 1.6 Protéine-canal fermée (à gauche) et ouverte (à droite) permettant le transport membranaire passif d’espèces moléculaires et ioniques25
1.1.3 Les canaux ioniques
Les canaux ioniques constituent une classe de protéines-canal qui suscite beaucoup d’intérêt en chimie biomoléculaire. Ce sont eux qui transportent spécifiquement les espèces ioniques à travers la membrane cellulaire. La force motrice qui régit ce transport ionique est
21 Gadsby, D. C. Nat. Rev. Mol. Cell Biol. 2009, 10, 344–352.
24 Kraichely, R. E.; Farrugia, G. Neurogastroenterol. Motil. 2007, 19, 245–252. 25 Midlands Technical College. Prokaryotes Internal Structures. Consulté le 30 nov. 2015 :
http://classes.midlandstech.edu/carterp/courses/bio225/chap04/lecture5.htm
Gradient
Transport passif
Aucun transport
Canal fermé Canal ouvert
le gradient électrochimique, c’est-à-dire une combinaison du gradient de concentration et du gradient électrique du milieu26.
La création du gradient électrochimique se produit grâce aux pompes lorsque les canaux ioniques sont fermés ou en période réfractaire, permettant ainsi l’accumulation des différents ions d’un côté de la cellule. En réponse à un stimulus, les canaux s’ouvrent et permettent aux espèces ioniques de circuler pour traverser la membrane, ce qui a pour effet de dissiper le gradient et de générer un courant électrochimique (mouvement de charges)21. Ces courants électrochimiques sont impliqués dans une foule de phénomènes cellulaires sous forme de potentiel d’action.
Potentiel d’action
Les cellules excitables (musculaires, nerveuses et sensorielles) utilisent les canaux ioniques pour convertir des messages mécaniques, thermiques ou chimiques en signaux électrochimiques qui prennent la forme d’un potentiel d’action10. Prenons, par exemple, un potentiel d’action qui se propage dans un neurone (Figure 1.7). Le potentiel membranaire au repos d’un neurone est d’environs -70 millivolts (mV) avec une majorité d’ions sodium (Na+) à l’extérieur et d’ions potassium (K+) à l’intérieur (1). En réponse à un stimulus, une brûlure par exemple, les canaux sodiques thermosensibles s’ouvrent et laissent entrer les ions Na+ dans la cellule, ce qui dépolarise la membrane. Si le stimulus est suffisant, la dépolarisation sera assez intense pour augmenter le potentiel membranaire au-dessus du seuil critique (environs -50 mV) (2). Lorsque ce seuil membranaire est atteint, ce sont les canaux sodiques voltage-dépendants qui s’ouvrent pour faire entrer les ions Na+ (3). Une fois ouverts, ils ne se referment que lorsque le potentiel membranaire atteint +30 mV. Ce nouveau potentiel atteint, ce sont désormais les canaux potassiques voltage-dépendants qui s’ouvrent. Cela permet aux ions K+ de s’échapper de la cellule et de repolariser la membrane (4) pour éventuellement ramener le potentiel membranaire local au repos (1).
10 Alberts, B.; Johnson, A.; Lewis, J.; Raff, M.; Roberts, K.; Walter, P. Molecular Biology of the Cell, 4th ed, Garland Science : New
York ; 2002.
21 Gadsby, D. C. Nat. Rev. Mol. Cell Biol. 2009, 10, 344–352.
Toutefois, avant de revenir au repos, les canaux sodiques tombent dans une période réfractaire (5) qui les inactive pour une courte période empêchant la formation d’un nouveau potentiel d’action27.
Figure 1.7 Étapes décrivant la formation d’un potentiel d’action nerveux
Cette variation du potentiel membranaire est ce qu’on appelle un potentiel d’action et se propage tout au long de la membrane de la cellule concernée. Dépendamment de la cellule impliquée, la propagation du potentiel d’action engendrera une réponse physiologique différente. Si l’on maintient l’exemple d’une cellule nerveuse, on peut s’attendre à l’exécution d’un réflexe, d’un mouvement volontaire, d’une activité cognitive, d’une sensation, d’une émotion ou même de la régulation d’un autre système (cardiaque, urinaire, immunitaire, respiratoire et endocrinien). De ce fait, lorsqu’un canal ionique est déficient, d’importantes physiopathologies (canalopathies) peuvent survenir.
27 Karp, G. The Structure and Function of Plasma Membrane. Dans Cell and Molecular Biology : Concepts and Experiments, John Wiley
& Sons, 2009, p 161. Potentiel au repos (-70 mV) +30 –50 –70 Potentiel membranaire (mV) Temps 1
Stimulus, ouverture des canaux Na+ spécifiques, dépolarisation jusqu’au seuil critique (-50 mV)
2
Ouverture des canaux Na+ sensibles au voltage et dépolarisation
3
Fermeture des canaux Na+, ouverture des canaux K+ sensibles au voltage et repolarisation
4
Hyperpolarisation, fermeture des canaux K+, relaxation des canaux Na+ (période réfractaire)
Canalopathies
La plupart des canalopathies sont dues à la mutation des gènes qui codent soit pour une protéine canal, soit pour une sous-unité protéique qui participe à la formation d’un canal. Devenues défectueuses, ces protéines ne sont plus capables de transporter correctement les espèces ioniques, ce qui nuit à la propagation des potentiels d’action et engendre de graves conséquences pour l’hôte. Le tableau 1.1 liste quelques exemples de canalopathies et mentionne le canal déficient ainsi que les symptômes observés28.
Tableau 1.1 Quelques canalopathies, leur canal mutant et leurs symptômes
Canalopathies mutant Canal Symptômes
Myotonie congénitale ClC-1 (Cl-) Contractions prolongées des muscles squelettiques
Syndrome de Dravet Nav1.1 (Na+) Crises d’épilepsie déclenchées par des températures élevées ou de la fièvre
Syndrome de
Brugada Nav1.5 (Na+) Arythmies cardiaques, mort subite
Ostéoporose ClC-7 (Cl-) Épaississement des plateaux vertébraux
Hypoglycémie
hyperinsulinémique Kir6.2 (K+) Tremblements, anxiété, nervosité, faim, migraine, etc...
Syndrome de Bartter Kir1.1 (K+) Soif intense, nausées, crampe musculaire
1.2 Les peptides cytotoxiques naturels et leurs modes d’action
L’importance physiologique des protéines-canal sur la régulation des différentes fonctions d’un organisme a été soulignée à la section précédente. Leurs propriétés essentielles en font des sujets d’étude très intéressants. Toutefois, en raison de leur complexité moléculaire qui les rend difficiles à isoler, à purifier, à manipuler et à analyser, on doit avoir recours à des modèles pour démystifier certaines de leurs relations structure-activité.
Parmi les modèles qu’on peut utiliser, on compte notamment les peptides cytotoxiques. Ceux-ci exercent des fonctions similaires aux protéines-canal, mais l’effet qui en résulte est différent. De la même façon que les protéines-canal, les peptides cytotoxiques s’incorporent dans les membranes cellulaires et forment un pore qui permet aux ions de traverser la membrane selon le gradient électrochimique. Cependant, à la différence des protéines-canal qui s’activent et s’inactivent au besoin, le canal ionique formé par un peptide cytotoxique ne s’ajuste pas de la sorte. Bien souvent, ce dernier demeure actif en tout temps, dissipant ainsi le gradient électrochimique usuel de la cellule, qui devient dysfonctionnelle et provoque son apoptose.
On peut diviser la famille des peptides cytotoxiques en quatre classes de molécules : (1) les venins (d’abeilles, de fourmis, de scorpions et d’araignées); (2) les sécrétions antimicrobiennes (des peaux de carpes et de grenouilles et de cellules immunitaires); (3) les peptides autocytotoxiques, qui s’attaquent à l’organisme même qui les a produits causant ainsi des maladies (comme l’Alzheimer et la maladie de la vache folle); et (4) les peptides synthétiques qui seront abordés à la prochaine section29.
Tel que discuté précédemment, plusieurs exemples tirés de la littérature utilisent ces modèles pour établir des relations structure-activité qui peuvent ensuite être transposées
aux protéines-canal30. De plus, lorsque les caractérisations sont exhaustives, des modes d’action peuvent être proposés afin d’expliquer l’influence de la structure sur la formation, la sensibilité et la sélectivité des protéines-canal. À ce propos, les peptides cytotoxiques modèles les plus connus de la littérature ainsi que leur mode d’action membranaire seront détaillés dans les sous-sections ci-dessous.
1.2.1 Gramicidine A31
En 1939, la gramicidine A fait son entrée dans le milieu hospitalier en tant que premier antibiotique utilisé à des fins cliniques32. À l’origine, ce peptide composé de 15 acides aminés est une sécrétion antimicrobienne retrouvée dans les spores de la bactérie Bacillus brevis33.
La séquence primaire du peptide est composée d’une partie hydrophobe (valines, leucines, alanines, glycines) et d’une petite portion hydrophile (tryptophanes) dont l’extrémité N-terminale est protégée par un groupement formyle et l’extrémité C-N-terminale par un groupement éthanolamine (Figure 1.8).
Figure 1.8 Structure primaire du peptide antibiotique gramicidine A
30 Woolley, G. A.; Wallace, B. A. J. Membrane Biol. 1992, 129, 109–136.
31 Kelkar, D. A.; Chattopadhyay, A. Biochim. Biophys. Acta (Biomembranes) 2007, 1768, 2011–2025. 32 Van Epps, H. L. J. Exp. Med. 2006, 203, 259.
33 Hotchkiss, R. D.; Dubos, R. J. J. Biol. Chem. 1940, 132, 791–792.
H NH O H N N H H N N H H N N H H N N H H N O O O O O O O O NH O NH O NH O H N N H O H N O NH N H O HNH N O OH
Mode d’action
L’alternance d’acides aminés de configuration L et D dans la séquence primaire confère à la gramicidine A une grande sensibilité à son environnement. En effet, en considérant la forme linéaire (non repliée) de la gramicidine A, on peut remarquer que ses chaînes latérales projettent toutes dans la même direction (hors du plan, Figure 1.8). Ceci a pour effet de diviser le peptide en deux parties, l’une regroupant les chaînes latérales et l’autre regroupant les carbonyles. Cet agencement particulier fait en sorte que le repliement de la gramicidine A est grandement influencé par le milieu dans lequel elle se trouve.
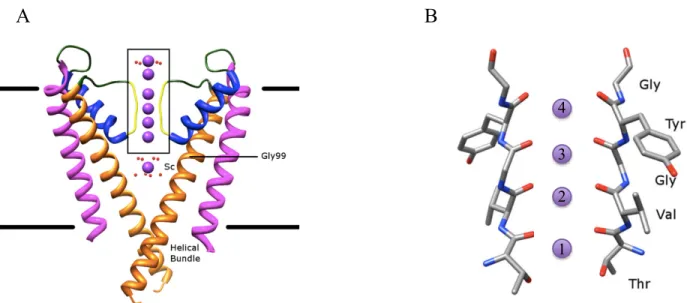
En présence de solvants organiques, elle adopte une conformation connue pour être inactive. Celle-ci résulte de l’entrelacement de deux brins linéaires de gramicidine A pour n’exposer que leurs carbonyles et leurs tryptophanes au milieu. Par contre, en présence de membranes, le peptide adopte une conformation active en hélice-β (ou hélice πLD) qui correspond en fait une large hélice dont le pas est de 6,3 résidus par tour34. Le terme β réfère aux liens hydrogènes (N-H…….O=C) qui rappelle ceux des feuillets-β, dû au fait que les liaisons N-H pointent alternativement vers le haut et le bas de l’hélice35.
Dans cette conformation en hélice-β, les chaînes latérales pointent vers l’extérieur de l’hélice, tandis que le squelette peptidique, plus polaire, pointe vers l’intérieur36. Ainsi, les chaînes latérales polaires (tryptophanes) demeurent en surface, près des têtes polaires hydrophiles, alors que les chaînes latérales apolaires (valines, leucines, alanines, glycines) se retrouvent au centre de la membrane près de ses chaînes hydrophobes. Elle n’est donc pas assez longue pour traverser la membrane et former un pore (Figure 1.9A). Une deuxième conformation inactive existe aussi pour la gramicidine A, celle où deux brins de gramicidine A s’associent en un dimère entrelacé37. Le pore membranaire se forme plutôt lorsque deux unités peptidiques se rencontrent et dimérisent grâce aux interactions propices
34 Urry, D. W.; Goodall, M. C.; Glickson, J. D.; Mayers, D. F. Proc. Nat. Acad. Sci. 1971, 68, 1907–1911. 35 Voet, D.; Voet, J. G. Biochemistry, 3rd ed, Wiley : New York; 2004.
36 Urry, D. W. Proc. Nat. Acad. Sci. 1971, 68, 672–676. 37 Bouchard, M.; Auger, M. Biophys. J. 1993, 65, 2484-2492
des extrémités N-terminales (Figure 1.9B). Le canal ionique est donc un pore transitoire de 26 Å résultant de la dimérisation de la gramicidine A38.
Figure 1.9 Conformation de gramicidine A sous sa forme (A) inactive et (B) active39
Les carbonyles du squelette peptidique qui pointent vers l’intérieur du pore, sont à l’origine de la sélectivité de la gramicidine A envers les cations, car ils peuvent aisément effectuer leur coordination.La taille du pore est de 4 Å, ce qui explique à la fois sa sélectivité pour les cations monovalents40 et son blocage par les plus gros cations41, tel que le Ca2+. La gramicidine A est donc un excellent antibiotique qui fonctionne en permettant le passage transmembranaire des cations monovalents, ce qui dissipe le gradient électrochimique usuel des cellules bactériennes42.
1.2.2 Magainine II
Les peptides antimicrobiens classés dans la famille des magainines ont été découverts en 1987 par le groupe de Zasloff de manière totalement imprévisible43. En effet, afin de mener des études sur l’expression de l’ARN chez les eucaryotes le groupe devait récupérer des ovaires de grenouilles Africaines de l’espèce Xenopus laevis. Pour ce faire, une incision était pratiquée sur l’abdomen de celles-ci, puis la plaie était ensuite refermée à l’aide de
38 Wallace, B. A.; Ravikumar, K. Science 1988, 241, 182–187.
39 Lundbaeck, J. A.; Collingwood, A. S.; Ingolfsson, H. I.; Kappor, R.; Andersen, O. S. J. R. Soc. Interface 2010, 7, 373–395. 40 A) Myers, V. B.; Haydon, D. A. 1972, 274, 313–322.; B) Finkelstein, A.; Andersen, O. S. J. Membrane. Biol. 1981, 59, 155–171. 41 Bamberg, E.; Läuger, P. J. Membrane Biol. 1977, 35, 351–375.
42 Mueller, P.; Rudin, D. O. Biochem. Biophys. Res. Commun. 1967, 26, 398–404. 43 Zasloff, M. Proc. Nat. Acad. Sci. 1987, 84, 5449–5453.
A B
points de suture. De façon surprenante, aucune des grenouilles n’avait développé d’infection, et ce malgré le fait que ni le matériel utilisé pour pratiquer l’incision ni l’endroit où elles étaient relâchées n’étaient stériles. Ce détail a frappé Zasloff qui avait dès lors suggéré que la peau de la grenouille devait naturellement sécréter un antibiotique, en l’occurrence les peptides antimicrobiens magainine I, magainine II et PGLa.
La magainine II est un peptide composé de 23 acides aminés qui possède les propriétés d’un canal ionique sélectif aux cations44. Lorsque le pH du milieu est similaire à celui des conditions physiologiques, le peptide possède six résidus chargés positivement (+1) et deux résidus chargés négativement (-1), ce qui lui confère une charge globale de +4 (Figure 1.10). C’est cette charge positive qui lui permet de s’attaquer aux membranes bactériennes, dont la composante majoritaire est un phosphoglycérolipide possédant une tête de phosphatidylglycérole chargée négativement45.
Figure 1.10 Structure primaire du peptide antimicrobien magainine II Mode d’action
En l’absence de membranes cellulaires, la magainine II a une conformation aléatoire, alors qu’en leur présence, le peptide s’adsorbe à la surface en raison des interactions électrostatiques favorables entre les têtes polaires à caractère négatif de la membrane et les
44 Cruciani, R. A.; Barker, J. L.; Durell, S. R.; Raghunathan, G.; Guy, H. R.; Zasloff, M.; Stanley, E. F. Eur. J. Pharmacol. 1992, 226,
287–296.
45 Riske, K. A.; Nascimento, O. R.; Peric, M.; Bales, B. L.; Lamy-Freund, M. T. Biochim. Biophys. Acta 1999, 1418, 133–146.
H3N O N H O H N ON H NH3 O H N ON H O H N NH HN O N H OH O H N O HN NH3 O N H NH3 O NH O H N ON H NH3 O H N ON H O H N ON H O H N O -O O N H O H N S O N H O NH2 O H N OH O O