HAL Id: dumas-01882666
https://dumas.ccsd.cnrs.fr/dumas-01882666
Submitted on 27 Sep 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Transfert hospitalier du radiomarquage au Gallium-68
d’un marqueur de l’angiogenèse
Antoine Pierrot
To cite this version:
Antoine Pierrot. Transfert hospitalier du radiomarquage au Gallium-68 d’un marqueur de l’angiogenèse. Sciences pharmaceutiques. 2016. �dumas-01882666�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteur
UNIVERSITÉ GRENOBLE ALPES FACULTÉ DE PHARMACIE DE GRENOBLE
Année : 2016 N°
Transfert hospitalier du radiomarquage au
Gallium-68 d’un marqueur de l’angiogenèse
MEMOIRE DE DIPLOME D’ETUDES SPECIALISEES DE PHARMACIE HOSPITALIERE PRATIQUE ET RECHERCHE
Conformément aux dispositions du décret N° 90-810 du 10 septembre 1990, tient lieu de
THÈSE
PRESENTÉE POUR L’OBTENTION DU TITRE DE DOCTEUR EN PHARMACIE DIPLOME D’ÉTAT
Antoine PIERROT
Mémoire soutenu publiquement à la faculté de Pharmacie de Grenoble
Le : 28/09/2016
DEVANT LE JURY COMPOSÉ DE
Président du jury :
M. Michel SEVE, Professeur des Universités
Membres :
Mme. Marie-Dominique DESRUET, Docteur en Pharmacie (Directeur de thèse)
Mme. Catherine GHEZZI, Professeur des Universités
Mme. Atekka CHABANSE, Docteur en Pharmacie
M. Julien LEENHARDT, Docteur en Pharmacie
La Faculté de Pharmacie de Grenoble n’entend donner aucune approbation ni improbation aux opinions émises dans les thèses ; ces opinions sont considérées comme propres à leurs auteurs.
REMERCIEMENTS
A ma directrice de thèse,
Madame le Docteur Marie-Dominique DESRUET,
Je vous remercie très sincèrement pour ces deux semestres passés dans votre service. J’ai beaucoup appris en travaillant à vos côtés. Merci pour vos conseils et votre patience tout au long de cette année. Votre expériences, votre disponibilité et votre dynamisme m’ont
beaucoup apporté tant sur le plan professionnel que personnel. Un immense merci également pour m’avoir donné la chance de travailler sur ce projet
passionnant.
Au président et aux membres du jury,
Monsieur le Professeur Michel SEVE,
Je vous remercie de me faire l’honneur de présider le jury de cette thèse. Avec toute ma considération.
Madame le Professeur Catherine GHEZZI,
Je vous remercie d’avoir accepté de participer à ce jury. Un immense merci également pour m’avoir ouvert les portes de votre unité de recherche pour que je puisse découvrir le monde passionnant de la recherche.
Madame le Docteur Atekka CHABANSE,
Je vous remercie pour votre disponibilité et pour me faire l’honneur de juger ce travail. Avec toute ma reconnaissance.
Monsieur le Docteur Julien LEENHARDT,
Un immense merci pour avoir accepté de juger ce travail. Merci pour ta disponibilité et pour ton aide tout au long de ces deux semestres. Cela a été un vrai plaisir de travailler avec toi.
A toutes les personnes qui m’ayant aidé dans ce projet,
A toute l’équipe de la Radiopharmacie,
Un grand merci à Olive, Martine, Emilie et Hélène pour votre accueil, votre gentillesse et tout le soutien que vous m’avez apporté pendant un an. J’ai beaucoup apprécié de travailler avec vous.
A toute l’équipe du service de médecine nucléaire,
Merci pour votre accueil et à votre disponibilité pour répondre à mes questions. Merci à vous d’avoir pris de votre temps pour m’expliquer comment marchait un bon service de médecine nucléaire.
A tout le personnel de l’unité de recherche INSERM 1039,
Là encore, un grand merci pour votre aide et votre disponibilité. Merci de m’avoir fait découvrir votre unité de recherche. Un merci spécial à Sandrine, Mitra et Alexis pour vos précieux conseils.
A tout le personnel des différents services dans lesquels je suis passé,
La Pharmacie du CH Alpes-Isère,
Les services d’Hépato-Gastroentérologie et de Maladies Infectieuses du CHU de Grenoble, de Stérilisation du CHU de Grenoble,
le CH de Chambéry,
Je tiens à remercier tout particulièrement l’ensemble du personnel de la pharmacie des HUG : un immense merci au Professeur Bonnabry pour m’avoir accueilli au sein de son service. Ce semestre passé dans votre service a été une des meilleures expériences de mon internat. Une dédicace spéciale au personnel du service de production et notamment Ludivine, Laurent et Salim pour votre gentillesse et pour m’avoir appris beaucoup de chose durant ce semestre. Un grand merci également à toute l’équipe des préparateurs pour l’accueil (et la fête de départ !) que vous m’avez réservé.
A tous mes amis,
Aux copains de la fac,
Merci à Charles, Manu, Marc, Thibaut, Bub’, Coco, Polo, Flo, Po, … pour tous ces moments à jouer aux cartes, à raconter n’importe quoi et surtout à bien s’éclater.
Aux copains de l’ABEP,
A Beubeu, Bob, Reda, Fomp, Mecton, Mectonne, Anne… A tous ces bons moments passés ensemble autour d’un babyfoot, d’un verre ou à bord de la FTT. A tous les amis rencontrés lors de nos pérégrinations en France : une dédicace particulière à
Anne-So, Jon, Allison, Babass, Lucas, Pradou et à tous les potes de la DBN (la vraie). Et aux copains venus d’ailleurs : Sonia, Tim, Agata, Vikky, …
A toutes ces belles rencontres de l’internat,
Merci à tous les Quesch’ du coin, Thibaut, GVG et Tom pour m’avoir appris ce qu’était entre autre une vache, un anaconda, un gendarme, un plomb et de la boulette.
Merci à tous les autres copains pour ces bons moments passés ensemble : Flore-Anne, Bastien, Sophie, Sabine, Virginie, Aude, Pluch’, Camille, DJ Galletos, Vincent, Nico, Bast’, Michou, Marine, Parmy, Fastoche, Camille, Nemz, VTH …
A tous les chefs que j’ai côtoyé et avec qui j’ai pu travailler pendant mon internat : Sébastien, Prudence, Charles, Caroline, Bruno, Julien, David, Aurélie, …
A ma famille et mes proches,
A mes parents,
Pour leur amour, leur soutien sans faille et leurs encouragements tout au long de mon parcours.
Pour tout ce que vous m’avez transmis et pour toute l’énergie que vous y avez mise. Sans vous je ne serai jamais arrivé jusqu’ici.
A ma sœur,
Pour son aide précieuse et tous ces moments partagés ensemble. Pour toutes les histoires à rebondissements qu’il faut réussir à suivre chez toi.
A toute ma famille,
Et notamment Martin et Etienne, pour me faire décompresser à chaque fois que je vous croise.
A tous mes proches,
A Marion,
Qui me supporte au quotidien, ce qui est déjà une belle performance.
Pour tes encouragements et ton soutien pendant la rédaction de ce travail. Merci pour ta bonne humeur et pour tout ce que tu m’apportes
1
TABLE DES MATIERES
LISTE DES FIGURES ... 5
LISTE DES TABLEAUX ... 7
ABREVIATIONS ... 9 GLOSSAIRE ... 12 INTRODUCTION ... 14 I. Le Gallium-68 ... 17 A. Propriétés chimiques ... 17 B. Propriétés physiques ... 18
C. Intérêts du Gallium-68 en TEP ... 19
1. Les moyens de production du Germanium-68 ... 20
2. Les moyens de production du Gallium-68 ... 22
3. Les générateurs actuels ... 23
II. Le radiomarquage avec du Gallium-68 ... 25
A. Types de marquage ... 25
1. Formation du complexe puis fixation au vecteur ... 25
2. Fixation du vecteur au chélateur puis radiomarquage ... 25
B. La chélation du Gallium-68 ... 26
1. Rappels de complexation ... 26
2. Exemples de chélatants ... 27
I. Les pathologies cancéreuses ... 31
A. Définition ... 31
B. Epidémiologie ... 31
C. Les cancers métastatiques ... 33
2
A. L’angiogenèse physiologique ... 34
B. Angiogenèse tumorale ... 37
C. Implication de la MEC dans l’angiogenèse ... 38
III. Les intégrines ... 39
A. Description ... 39
B. Mécanismes d’action ... 43
C. Implication des intégrines dans les processus physiologiques ... 45
IV. Intégrines et cancer ... 45
A. Mécanismes ... 45
B. L’intégrine αvβ3 ... 48
C. Thérapies anti intégrines αvβ3 ... 49
1. Traitement curatif ... 50
2. Marqueur de l’angiogenèse ... 51
Chapitre 3 : Les essais cliniques et le dossier du médicament expérimental ... 57
I. Les essais cliniques ... 57
A. Description ... 57
1. Structure d’un essai clinique ... 57
2. Législation des essais cliniques ... 60
B. Quelle réglementation pour un essai clinique avec médicament radiopharmaceutique ? ... 61
1. Quel statut pour le médicament radiopharmaceutique expérimental ? ... 62
2. Exigences d’un médicament radiopharmaceutique ... 62
II. Exigences d’un médicament expérimental : le DME ... 64
A. Legislation ... 64
B. Le contenu du DME ... 65
1. 1ère partie : données relatives à la qualité pharmaceutique, chimique et biologique ... 65
2. 2ème partie : Données pharmacologiques et toxicologiques non cliniques ... 68
3
I. Présentation du projet ... 77
A. Validation préclinique en tant qu’outils diagnostic ... 77
B. Validation préclinique en tant qu’agent thérapeutique ... 78
II. Partenariat public-privé ... 79
III. Rôle de la Radiopharmacie dans le projet ... 80
I. Matériel ... 81
A. Matières premières ... 81
B. Matériel de contrôle ... 82
1. Chromatographie liquide haute performance (CLHP) ... 82
2. Radiochromatographe ... 82
3. Spectromètre gamma ... 82
II. Méthode ... 82
A. Description du procédé de fabrication ... 82
B. Contrôles des étapes critiques et des produits intermédiaires ... 83
C. Contrôles sur le produit fini ... 84
I. Résultats ... 85
II. Discussion ... 87
A. Matières premières ... 87
1. Choix des matières premières ... 87
2. Contrôle des matières premières ... 89
B. Radiomarquage ... 90
C. Contrôle qualité du produit fini ... 91
D. Validation de la méthode de la CLHP ... 96
E. Tests biologiques in vitro et in vivo ... 97
CONCLUSION ... 99
ANNEXE 1... 110
4 ANNEXE 3... 112 ANNEXE 4... 113 ANNEXE 5... 114 ANNEXE 6... 115 ANNEXE 7... 116
5
LISTE DES FIGURES
Figure 1: Equation de désintégration du 67Ga ... 18
Figure 2: Equation de désintégration du 68Ga ... 18
Figure 3: Colonne à élution de Gallium-68 par EDTA d'après Yano et al ((12) ... 23
Figure 4: Incidence mondiale des dix principaux cancers chez un individu masculin ... 32
Figure 5: Incidence mondiale des dix principaux cancers chez un individu féminin ... 32
Figure 6 : Les différentes étapes de l’angiogenèse (35) ... 35
Figure 7: L’angiogenèse tumorale (35) ... 37
Figure 8: Différence entre un réseau vasculaire normal et tumoral (d'après Pelletier (12)) ... 38
Figure 9: Représentation schématique d’un récepteur de la famille des intégrines (41) ... 40
Figure 10: Représentation des différentes familles des intégrines (d’après Barczyk et al (13)) ... 41
Figure 11: Représentation d'une intégrine avec ses différents domaines (d’après Campbell et al (18)) ... 42
Figure 12: Représentation du positionnement des ions métalliques sur le domaine β-1 de l’intégrine (d’après Campbell et al (18)). ... 42
Figure 13: Exemples de facteurs interagissant avec les intégrines (d’après Legate et al (19)) ... 43
Figure 14: Exemples de messagers intracellulaires activés par les intégrines via le mécanisme de signalisation outside-in (d'après Hynes (20)) ... 44
Figure 15: Relations entre les intégrines et voies de prolifération cellulaire (d'après Guo et al(22)) .. 46
Figure 16: Structure du Cilengitide ... 50
Figure 17: Représentation du Raft-RGD (L = ligand) ... 56
Figure 18: Chronologie des différentes phases des essais cliniques (d’après BD4Cancer) ... 59
Figure 19: Représentation par scintigraphie du corps entier de la fixation du cRGD, du RAFT-RGD et du RAFT-RAD marqués au 99mTc sur les cellules tumorales exprimant l’intégrine α vβ3. (B16F0 : cellules de mélanome ; TS/A-pc : cellules de carcinome mammaire) ... 78
Figure 20: Effets du Raft-RGD marqué à 90Y sur le volume tumoral et sur la survie des souris exprimant l’intégrine αvβ3. (TVDT : Temps de doublement du volume tumoral) (D’après Bozon-petitprin et al (53)) ... 79
6
Figure 21: Evaluation de la stabilité du médicament radiopharmaceutique sur 2 heures ... 86 Figure 22: Fixation cellulaire du 68Ga-DOTA-Raft-RGD sur les cellules U87-MG ... 97
7
LISTE DES TABLEAUX
Tableau 1: Principales caractéristiques des isotopes du Gallium (d’après Bartholomä et al(59)) ... 19
Tableau 2: Comparaison de la dosimétrie de quelques examens réalisés actuellement en TEMP et TEP avec les mêmes examens réalisés avec du 68Ga. (d’après (61)) ... 20
Tableau 3: Principales réactions nucléaires décrites pour la synthèse du Germanium-68 (d’après l’IAEA) ... 21
Tableau 4: Caractéristiques des principaux centres produisant du Germanium-68 (8) ... 22
Tableau 5: Principales caractéristiques des générateurs commercialisés (A noter que la Pharmacopée Européenne recommande au maximum 0,001% de relargage de 68Ge dans l'éluat de 68Ga) ... 24
Tableau 6: Caractéristiques de chélatants acycliques du Gallium-68 ... 28
Tableau 7: Caractéristiques de chélatants acycliques du Gallium-68 ... 30
Tableau 8: Facteurs anti-angiogéniques (d'après Gratton (11)) ... 35
Tableau 9: Facteurs pro-angiogéniques (d'après Gratton (11)) ... 36
Tableau 10: Types d’intégrines exprimées par cellules (d’après Barczyk et al (13)) ... 39
Tableau 11: Exemples d'intégrines liant des molécules de la matrice extracellulaire (d'après Koistinen et al)(17) ... 41
Tableau 12: Expression des intégrines associées aux organes atteints de cancer (d’après Desgrossellier et al(23) et Koistinen et al (17)) ... 47
Tableau 13: Caractéristiques structurales et de synthèse de différentes molécules ciblées contre l'intégrine αvβ3 radiomarquées ... 54
Tableau 14: Eléments à renseigner pour la partie "substance active" du DME (87) ... 66
Tableau 15: Eléments à renseigner pour la partie "produit fini" du DME (87) ... 67
Tableau 16: Tests à effectuer en préclinique pour les substances administrées en microdoses (88) .. 71
Tableau 17: Catégories de niveau de bénéfice et de risque correspondant pour des adultes en bonne santé âgés de moins de 50 ans (d’après le CIPR 103). (a : à maintenir à des doses inférieures au seuil déterministe) ... 73
Tableau 18: Résultats de l'étude de stabilité réalisée après le radiomarquage du Raft-RGD au Gallium-68 ... 86
8
Tableau 19: Résumé des résultats obtenus lors des radiomarquages ; spécifications du traceur utilisé en pré-clinique ... 96
9
ABREVIATIONS
AAA: Advanced Accelerator ApplicationsADN: Acide DesoxyRibonucléique
AMM: Autorisation de Mise sur le Marché
ANSM : Agence Nationale de sécurité du Médicament et des produits de santé ARN : Acide RiboNucléique
ARS : Agence Régionale de Santé ASN : Agence de Sureté Nucléaire
ATC : Agent Transmissible Conventionnel ATNC : Agent Transmissible Non Conventionnel BPC : Bonnes Pratiques Cliniques
BPF : Bonnes Pratiques de Fabrication BPL : Bonnes Pratiques de Laboratoire BPP : Bonnes Pratiques de Préparation
CCPPRB : Comité Consultatif de Protection des Personnes dans la Recherche Biomédicale
CE : Cellule Endothéliale
CIC : Centre d’Investigation Clinique
CIOMS: Council for International Organizations of Medical Sciences
CIPR : Commission internationale de protection radiologique
CLHP : Chromatographie Liquide à Haute pression CML : Cellule Musculaire Lisse
CPP : Comité de Protection des Personnes CSP : Code de la Santé Publique
10
EANM: European Agency of Nuclear Medicine EC : Essai Clinique
EMA : European Medicines Agency
ESST: Encéphalopathies Subaiguës Spongiformes Transmissibles FGF: Fibroblast Growth Factor
GMP: Good Manufacturing Practices HCl: Acide Chlorhydrique
HGF: Hepatocyte Growth Factor
IARC: International Agency for Research on Cancer ICH: International Conference on Harmonisation IL: Interleukine
IM : Intra Musculaire
INSERM : Institut National de la Santé et de la Recherche Médicale IRSN : Institut de Radioprotection et de Sureté Nucléaire
IUPAC: International Union of Pure and Applied Chemistry IV : Intra Veineux
keV : kilo électron volt
MABEL: Minimal Anticipated Biological Effect Level MCP-1: Monocyte Chimoattractant Protein 1 MEC: Matrice Extra Cellulaire
MeV : mega électron volt
MIRD: Committee on Medical Internal Radiation Dose MMP: Metallo Proteinase
MRPE : Médicament Radiopharmaceutique Expérimental NOAEL: No Observable Adverse Effect Level
11
OMS : Organisation Mondiale de la Santé PDGF: Platelet-derived growth factor PEG: Polyethylene Glycol
PIGF: Placental Growth Factor PUI : Pharmacie à Usage Intérieur RBM : Recherche Bio Médicale SC : Sous Cutanée
siRNA : Small Interferring RiboNucleic TCR : T Cell Receptor
TEP : Tomoscintigraphie par Emission de Positons TEMP : Tomographie par Emission Mono-Photonique TFA: Acide Trifluoroacétique
TGF: Transforming Growth Factor TNF: Tumor Necrosis Factor
VEGF: Vascular Endothelial Growth Factor
VEGFR: Vascular Endothelial Growth Factor Receptor 68Ga: Gallium-68 68Ge: Germanium-68 111In: Indium-111 177Lu: Lutetium-177 99mTc: Technetium-99 métastable 90Y : Yttrium-90
12
GLOSSAIRE
Activité radioactive : Nombre des désintégrations par unité de temps d’une source
radioactive.
Activité spécifique : L'activité spécifique est la quantité de radioactivité par unité de masse
d'une molécule contenant le radio-isotope.
Activité volumique : L’activité volumique est la quantité de radioactivité d’une solution
rapportée au volume total.
Dose absorbée : Energie déposée par les rayonnements dans un échantillon de matière
(unité : le Gray (Gy)).
Dose effective : Dose biologique utilisée en radioprotection, qui sert à évaluer l'exposition
d'une personne individuelle aux rayonnements (unité : le millisievert (mSv)).
Dose létale 50 : Dose responsable de 50% de décès dans un échantillon donné.
Gallium-68 : Elément radioactif qui se désexcite en Zinc-68 par émission de positons ou bien
par capture électronique.
Générateur de radionucléide : Système contenant un radionucléide parent déterminé,
servant à la production d'un radionucléide de filiation obtenu par élution ou par toute autre méthode et utilisé dans un médicament radiopharmaceutique.
Médicaments radiopharmaceutiques : Tout médicament qui, lorsqu'il est prêt à l'emploi,
contient un ou plusieurs isotopes radioactifs, dénommés radionucléides, incorporés à des fins médicales.
Pureté chimique : Rapport, exprimé en pourcentage, de la masse de matière présente sous
la forme chimique indiquée, à la masse totale de matière contenue dans la source, exception faite des excipients et solvants éventuels.
Pureté radiochimique : Rapport, exprimé en pourcentage, de la radioactivité du
radionucléide considéré, qui se trouve présent dans la source sous la forme chimique indiquée, à la radioactivité totale de ce même radionucléide présent dans la source.
Pureté radionucléidique : Rapport, exprimé en pourcentage, de la radioactivité du
radionucléide considéré à la radioactivité totale de la source.
13
Radioactivité: Propriété qu’ont certains noyaux d’atomes à se désintégrer de manière
naturelle et spontanée, pour donner un autre élément.
Radiolyse : Ensemble des transformations chimiques provoquées dans la matière par
l’absorption de l’énergie d’un rayonnement ionisant.
Radionucléide : Elément radioactif du tableau périodique des éléments.
Radiomarquage : Correspond au fait de marquer un vecteur non radioactif par un
radionucléide.
Radiopharmacie : Domaine de la pharmacie relatif aux médicaments radiopharmaceutiques,
générateurs, trousses, précurseurs et, par extension, locaux de la pharmacie à usage intérieur, implantés dans un service de médecine nucléaire,affectés à la préparation et au contrôle de ces produits, ainsi qu’à leur livraison et leur stockage.
Rayonnements ionisants : Forme d’énergie libérée par les atomes qui se propage par le biais
d’ondes électromagnétiques (rayons gamma ou X) ou de particules (neutrons, particules bêta ou alpha).
RGD : Selon la classification IUPAC des acides aminés : R = Arginine, G = Glycine et D = Acide
aspartique.
Technétium 99 métastable : Elément radioactif qui se désexcite en Technétium 99 par
émission d’un photon gamma de 141 keV.
Trousse radiopharmaceutique : Préparation qui doit être reconstituée ou combinée avec
14
INTRODUCTION
Les maladies cancéreuses constituent un groupe de pathologies complexes. Selon l’OMS, l’incidence de ces maladies est en constante augmentation ces dernières années à cause du vieillissement et de l’augmentation de la population mondiale. Les pathologies cancéreuses sont responsables d’un grand nombre de décès dans le monde chaque année, à cause de leur taux de mortalité élevé.
Un des processus impliqués dans l’agressivité des cancers est sa capacité à se disséminer dans plusieurs localisations de l’organisme et à y proliférer. Afin de favoriser son développement et l’envahissement d’autres tissus, la tumeur est capable de créer un véritable réseau vasculaire chargé de l’alimenter en diverses substances nutritives ; c’est l’angiogenèse tumorale. De nombreuses recherches ont été menées sur ce phénomène clé dans l’agressivité des cancers et il a été démontré qu’il faisait intervenir de nombreux composants de la matrice extracellulaire et cellulaire. Parmi ces composants, l’intégrine αvβ3
a été identifiée comme étant une protéine indispensable au bon déroulement du processus d’angiogenèse tumorale. Il s’agit d’un récepteur membranaire exprimé en très fortes quantités dans de nombreux cancers tels que les glioblastomes et les mélanomes. A ce titre, l’intégrine αvβ3 constitue un marqueur intéressant dans le traitement et le diagnostic de
cancers agressifs et métastatiques.
L’équipe de l’Institut National de la Santé et de la Recherche Médicale (INSERM) 1039 de l’Université de Grenoble a pour mission de développer l’imagerie moléculaire afin d’améliorer la prise en charge des patients. Elle est spécialisée dans le développement de médicaments radiopharmaceutiques. Actuellement, cette équipe travaille sur la qualification et la validation d’un marqueur spécifique de l’intégrine αvβ3, le Raft-RGD. Cette molécule a
été couplée avec plusieurs radionucléides (tels que le Technétium-99 métastable et l’Yttrium-90) et testée dans le cadre du diagnostic et du traitement de tumeurs exprimant cette intégrine. Les résultats obtenus sont encourageants et incitent à poursuivre la recherche sur cette molécule.
Le Gallium-68 est un émetteur de positons qui profite d’un vif intérêt depuis quelques années dans l’imagerie par Tomographie par Emission de Positons (TEP). La qualité et la précision des images réalisées en TEP ont été démontrées dans le passé et l’utilisation du 68 dans cette technique est en plein essor. La demi-vie et l’accessibilité du Gallium-68 en font une alternative intéressante au Fluor-18. Plusieurs industries pharmaceutiques ont fabriqué récemment des générateurs de Gallium-68, rendant sont utilisation possible pour de nombreux centres de recherche.
15
Le projet CLARA est un projet mixte impliquant plusieurs participants : l’équipe INSERM 1039, le service de médecine nucléaire, la radiopharmacie du CHU de Grenoble et l’entreprise industrielle Advanced Accelerator Applications (AAA). L’objectif de ce projet est de développer un médicament radiopharmaceutique permettant de faire de l’imagerie diagnostique dans le cadre des tumeurs exprimant l’intégrine αvβ3. Le radionucléide choisi
pour être greffé au Raft-RGD est le Gallium-68. Le coupler au Raft-RGD permettrait d’obtenir des images de bonne qualité dans la visualisation des tumeurs ciblées. Dans un premier temps, AAA est chargé de mettre au point le protocole du marquage du Raft-RGD par le Gallium-68. La radiopharmacie du CHU de Grenoble doit ensuite transférer et valider cette technique de marquage à l’échelle hospitalière. Une fois cette étape effectuée, l’unité INSERM 1039 réalisera les études précliniques concernant le Raft-RGD radiomarqué.
La Radiopharmacie du CHU de Grenoble a été sollicité dans le cadre de ce projet afin de réaliser la mise au point et la validation du radiomarquage à l’échelle hospitalière ainsi que pour la rédaction du dossier du médicament expérimental (DME). L’objectif du présent travail est donc d’identifier la marche à suivre ainsi que les différents tests à effectuer pour réaliser la production d’un médicament de qualité pharmaceutique dans le cadre du dépôt du DME à l’Agence Nationale de la Santé et du Médicament (ANSM).
Dans un premier temps, nous étudierons les propriétés du Gallium-68 qui permettent de comprendre les conditions nécessaires pour réaliser un radiomarquage avec cet élément. Nous aborderons également son intérêt dans la TEP. Ensuite nous nous intéresserons au contexte dans lequel le développement du Raft-RGD se situe, ainsi que son intérêt dans la prise en charge des pathologies cancéreuses agressives et métastatiques. Par la suite, nous détaillerons la structure d’un essai clinique ainsi que son encadrement réglementaire et législatif. Nous identifierons également les exigences du médicament expérimental à travers la composition du DME. Enfin, après avoir présenté le projet CLARA, nous détaillerons les résultats obtenus dans le cadre du radiomarquage du Raft-RGD marqué au Gallium-68 à l’échelle hospitalière ainsi que dans la rédaction du DME.
16
17
Chapitre 1 : La chimie du Gallium
I.
Le
Gallium-68
A.
Propriétés chimiques
Le Gallium (Ga) a été découvert en 1874 par un chimiste français, Lecoq de Boisbaudran. Il appartient à la famille des éléments de post-transition comme l’Indium et le Thallium (groupe 13 de la classification périodique des éléments ; métaux pauvres) qui sont d’autres éléments utilisés en médecine nucléaire.
Le Gallium a un degré d’oxydation de +III en solution aqueuse, caractéristique des éléments du groupe 13. Le Gallium est un acide fort de Lewis (pKa = 2,6). A pH acide (pH<3), le Gallium se présente sous forme stable et soluble : Ga3+. Sous cette forme, il va se complexer avec
des atomes donneurs d’électrons tels que l’oxygène, l’azote ou le soufre, présents dans les groupements hydroxyles, thiolates ou amines notamment (1,2). La solubilité et la disponibilité du Gallium en solution aqueuse dépend du pH de la solution. En effet, à pH supérieur à 3, l’eau agit comme un ligand faible et le Gallium s’associe avec des groupements hydroxydes comme décrit ci-après :
Ga3+ + OH- [Ga(OH)]2+ + OH- [Ga(OH)
2]+ + OH- [Ga(OH)3] + OH- [Ga(OH)4]
-Les espèces formées ([Ga(OH)]2+, [Ga(OH)
2]+, [Ga(OH)3]) sont alors insolubles et le Gallium
n’est plus disponible pour une réaction de complexation. A pH basique (supérieur à 7), le Gallium forme avec les ions hydroxydes l’ion Gallate [Ga(OH)4]- qui est soluble. Néanmoins
le Gallium reste indisponible pour toute réaction de complexation.
Le Gallium est donc une espèce chimique amphotère dont la forme d’intérêt demeure sa forme oxydée (Ga3+), présente en solution aqueuse uniquement à pH inférieur à 2,6 et qui
18
B.
Propriétés physiques
Le Gallium possède 31 isotopes connus, ainsi que trois isomères nucléaires. Les deux principaux radio-isotopes de cet élément décrits en médecine sont le 67Ga et le 68Ga.
L’intérêt pour ces radioéléments remonte aux années 1960(3) mais les contraintes et les difficultés de leur production et de leur utilisation n’ont pas permis le développement de ces isotopes.
Le 67Ga se désintègre en Zinc-67 par capture électronique et émet des rayonnements gamma
(figure 16). Sa période radioactive est de 78,1 heures. L’énergie moyenne des photons émis est de 93 keV. Ses propriétés le rendent intéressant dans le domaine de l’imagerie médicale où, lorsqu’il est utilisé sous forme de citrate, il est utilisé pour détecter les tumeurs primaires et les métastases ainsi que les sites inflammatoires(1,4,5) en TEMP (Tomographie d’Emission Monophotonique). Cependant, son utilisation n’a jamais vraiment été généralisée du fait de l’existence de marqueurs radioactifs plus intéressants en TEMP comme le Technétium-99 métastable, dont la demi-vie n’est que de 6 heures, réduisant ainsi la durée d’exposition des patients à l’élément radioactif.
67Ga* + e- 67Zn + γ Figure 1: Equation de désintégration du 67Ga
Le 68Ga se désintègre principalement par émission d’un positon (88%) ou par capture
électronique (11%) (figure 2). Sa période radioactive est de 67,71 minutes. L’énergie moyenne de la particule beta émise est de 1899 keV, ce qui est bien supérieur à l’énergie émise par la particule beta du Fluor-18 (634 keV). L’énergie des rayonnements gamma est de 511 keV (photon d’annihilation) mais le 68Ga émet également d’autres rayonnements
gamma dont l’énergie peut aller jusqu’à 1,87 MeV (0,15%)(6).
68Ga* 68Zn + e+ + ν
68Ga* + e- 68Zn + γ Figure 2: Equation de désintégration du 68Ga
CE
19 Isotopes du
Gallium Type d’examen Demi-vie
Energie des rayonnements β (MeV) Energie des rayonnements γ (MeV) 67Ga TEMP 78,1 heures 0,093 (35,7%) 0,185 (19,7%) 0,30 (16%) 68Ga TEP 67,71 minutes 1,899 (88%) 0,822 (1%) 0,511 (176%) 1,08 (3,5%) 1,87 (0,15%)
Tableau 1: Principales caractéristiques des isotopes du Gallium (d’après Bartholomä et al(59))
C.
Intérêts du Gallium-68 en TEP
Comme dit plus haut, le 68Ga est un émetteur béta plus, il produit donc deux photons
d’annihilation lorsque la particule beta émise entre en collision avec un électron. Ces propriétés font du 68Ga un excellent marqueur : sa courte demi-vie permet de limiter
l’exposition du patient au traceur radioactif et l’émission de 2 photons d’annihilation permet une détection spécifique avec une caméra TEP.
Le 68Ga peut donc être utilisé en TEP dont la sensibilité, la précision et la résolution sont
améliorées et permettent d’obtenir des images de meilleure qualité que la TEMP (7). De plus la TEP permet une quantification de la radioactivité locale tandis que la TEMP ne le permet pas. Par ailleurs, les temps de réalisation des examens sont globalement plus courts et les doses reçues par les patients sont plus faibles (tableau 2). Enfin, l’énorme avantage du Gallium est sa disponibilité sous forme de générateur comme le Technétium : il est donc accessible directement dans le service (il n’y a plus de dépendance envers un cyclotron et plus d’aléas de production) et pour des coûts relativement faibles comparé à un autre marqueur de TEP, le Fluor-18.
20
Traceur Camera Durée de l’examen Dose effective (mSv)
111
In-DTPA-Octreotide TEMP 24 à 48 h 10,8
18F-DésoxyGlucose TEP 60 à 120 min 5,6
68Ga-DOTATOC TEP 30 à 60 min 2,3
99mTc-BPAMD TEMP 2 à 6 h 6
99mTc-MDP TEMP 2 à 6 h 3 - 4
68Ga-BPAMD TEP 3 à 4 h 3 – 4
Tableau 2: Comparaison de la dosimétrie de quelques examens réalisés actuellement en TEMP et TEP avec les mêmes examens réalisés avec du 68Ga. (d’après (61))
1. Les moyens de production du Germanium-68
Le Gallium-68 est l’élément fils du Germanium-68 (68Ge), lequel se désintègre via un
phénomène de capture électronique. Le 68Ge est obtenu grâce à un cyclotron. Plusieurs
techniques de synthèse du 68Ge ont été étudiées et décrites au cours de ces dernières
années, chacune présentant ses avantages et ses inconvénients. La première étape pour obtenir le 68Ge est de réaliser une réaction nucléaire : le cyclotron va permettre de
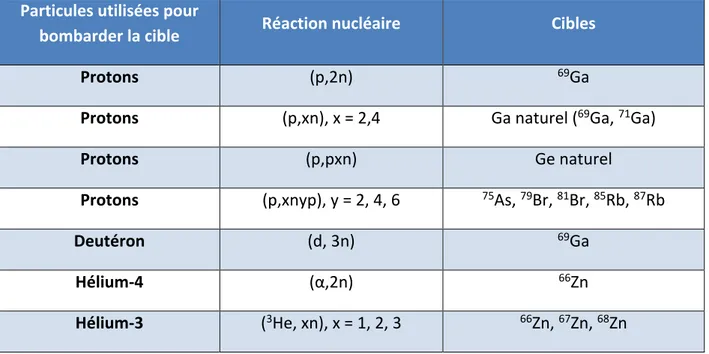
bombarder une cible avec des particules. Plusieurs types de particules et de cibles ont été associés et testés afin de déterminer le couple permettant le d’obtenir le meilleur rendement de production(8). Le tableau 3 représente quelques-uns des couples les plus utilisés pour la production de 68Ge.
21 Particules utilisées pour
bombarder la cible Réaction nucléaire Cibles
Protons (p,2n) 69Ga
Protons (p,xn), x = 2,4 Ga naturel (69Ga, 71Ga)
Protons (p,pxn) Ge naturel
Protons (p,xnyp), y = 2, 4, 6 75As, 79Br, 81Br, 85Rb, 87Rb
Deutéron (d, 3n) 69Ga
Hélium-4 (α,2n) 66Zn
Hélium-3 (3He, xn), x = 1, 2, 3 66Zn, 67Zn, 68Zn Tableau 3: Principales réactions nucléaires décrites pour la synthèse du Germanium-68 (d’après l’IAEA)
La deuxième étape du processus consiste à isoler le 68Ge des autres éléments « parasites »
qui ont été créés pendant la synthèse. Cette étape de purification est généralement réalisée par réaction chimique impliquant différentes techniques comme la distillation, la chromatographie par échange d’ions ou encore une extraction liquide-liquide. La pureté de l’élément obtenu est ensuite contrôlée avant de libérer le 68Ge.
Les contraintes de synthèse du 68Ge sont relativement importantes et seulement quelques
centres dans le monde ont les capacités de réaliser cette synthèse. Le tableau 4 présente les caractéristiques de ces cyclotrons.
22
Tableau 4: Caractéristiques des principaux centres produisant du Germanium-68 (8)
2. Les moyens de production du Gallium-68
Une fois le 68Ger synthétisé et isolé, il est possible de fabriquer un générateur afin de réaliser
des élutions de 68Ga comme on le ferait pour du 99mTc, ce qui en fait un avantage très
intéressant par rapport au Fluor-18, autre marqueur de TEP très largement utilisé dans le domaine de la médecine nucléaire. On s’affranchit donc de la nécessité et de la dépendance d’un cyclotron aux alentours du site d’utilisation. Plusieurs types de générateurs ont été décrits depuis les débuts de ce radio-isotope dans les années 1960 (9).
Le premier générateur de 68Ge/68Ga a été décrit par Gleason en 1960 (10) : sa technique
consiste en une extraction liquide-liquide du 68Ga et il obtenait ainsi un rendement de 70 à
80%. Par ailleurs, il était possible d’éluer le générateur toutes les trois à quatre heures. L’inconvénient majeur de cette technique est que de nombreux contaminants et impuretés étaient synthétisés et recueillis en même temps que le 68Ga (11). Par la suite, les chercheurs
ont mis au point d’autres techniques pour améliorer le rendement d’élution : c’est ainsi que les premières méthodes d’extraction solide-liquide ont été décrites. Yano et Anger ont utilisé une colonne d’alumine pour fixer le 68Ge puis le 68Ga est élué en faisant passer une solution
23
d’EDTA sur la colonne (12). Ils décrivent alors des rendements excellents et une faible concentration d’impuretés. La figure 3 représente schématiquement leur générateur.
Figure 3: Colonne à élution de Gallium-68 par EDTA d'après Yano et al ((12)
Le problème principal de ces méthodes d’élution est que le 68Ga qui est récupéré se
présente sous la forme d’un complexe inerte et souvent des impuretés ou des contaminants tels que le Zinc ou le Fer sont élués en même temps que le Gallium. Il nécessite donc d’autres traitements chimiques par la suite pour pouvoir être associé à une molécule d’intérêt. L’intérêt principal de ces traitements, appelés également purification, est d’augmenter le rendement de l’élution en obtenant par exemple une plus grande activité volumique (13). L’objectif est donc de trouver un moyen d’éluer le 68Ga sélectivement sous
sa forme ionisée (Ga3+). De nouvelles colonnes organiques(14–16) et inorganiques (17–19)
ont vu le jour suite à ces recherches.
3. Les générateurs actuels
Les générateurs de 68Ga actuellement commercialisés utilisent quasi exclusivement des
techniques d’extraction solide – liquide. L’intérêt médical pour le 68Ga ayant été relancé ces
dernières années, la course à la fabrication du générateur 68Ge/68Ga le plus performant bat
son plein. Les techniques d’extraction ont été optimisées afin d’obtenir un rendement maximal ; à ce jour de nombreuses techniques de purification de l’éluat ont été décrites comme l’élution fractionnée, la résine échangeuse de cations ou la résine échangeuse
24
d’anions (19–21). Plusieurs laboratoires pharmaceutiques commercialisent des générateurs de 68Ge/68Ga. Chacun de ces générateurs ont des caractéristiques différentes et donc des
techniques d’élution différentes. Le générateur commercialisé pour ITG (Isotope Technology Garching) est le seul à proposer une colonne organique, à base de gallate de dodécyle (C19H30O5) (22), tandis que les autres laboratoires proposent des colonnes inorganiques, à
base d’oxyde d’étain (SnO2) ou de titane (TiO2).
L’avantage principal de la colonne organique est qu’on ne récupère pas de contaminants métalliques lors de l’élution du générateur. D’un point de vue pratique, il est recommandé d’éluer ces générateurs au moins 1 fois par jour afin de conserver un rendement optimal. Par ailleurs, il est possible d’éluer plusieurs fois le générateur par jour à condition de laisser 4 heures d’intervalle entre deux élutions. A noter que les éluats des générateurs d’IDB et de Cyclotron & Co nécessitent des étapes de purification alors que les générateurs proposés par ITG, EZAG et IRE ELIT donnent des éluats de très bonne qualité sans étape de purification. Le tableau 5 résume les caractéristiques des générateurs disponibles sur le marché actuellement.
Laboratoire Cyclotron
and co.
Eckert &
Ziegler I.D.B ITG – iThemba
IRE ELIT et Raytest Colonne TiO2 TiO2 SnO2
Gallate de dodecyle Secret industriel Eluant HCl 0,1M HCl 0,1M HCl 0,6M HCl 0,05M HCl 0,1M Volume d’élution (mL) 5 5 5 2,5 à 4 1,1 Rendement (%) 60 – 70 > 75 > 80 > 80 70 – 75 Impuretés en 68Ge (%) < 0,005 < 0.001 ≈ 0,002 < 0,001 < 0,001
Purification Oui Non Oui Non Non
Délai recommandé entre 2 élutions
4 heures 4 heures 4 heures 4 heures 4 heures
Statut / AMM en
France GMP GMP GMP
Tableau 5: Principales caractéristiques des générateurs commercialisés (A noter que la Pharmacopée Européenne recommande au maximum 0,001% de relargage de 68Ge dans l'éluat de 68Ga)
25
II. Le radiomarquage avec du Gallium-68
A.
Types de marquage
Le radiomarquage d’une molécule consiste à fixer sur cette molécule un élément radioactif. Cette incorporation peut se faire par liaison covalente ou par la formation d’un complexe. Comme expliqué par Ahmadi (23), le processus de marquage des petits peptides est compliqué. D’une part, la fixation d’un radioélément directement sur une molécule est difficile car cette dernière ne contient pas toujours des atomes ou groupements nécessaires au marquage avec le radioélément. D’autre part, le site de fixation est incertain, le résultat de la réaction de marquage est aléatoire et donc non adapté à un marquage de qualité et répétable.
C’est pourquoi de nombreux chimistes s’orientent vers un procédé de radiomarquage faisant intervenir un chélateur bifonctionnel pour réaliser un complexe avec le radionucléide. Un chélateur est capable de se lier de façon covalente à la molécule d’intérêt (une molécule vectrice par exemple) mais aussi de fixer le radioélément de manière durable. Ce procédé de fabrication permet d’obtenir un complexe stable, de garder la fonctionnalité du vecteur et d’obtenir un rendement de marquage élevé.
1. Formation du complexe puis fixation au vecteur
Une des possibilités pour réaliser le radiomarquage est de fixer dans un premier temps le radionucléide à son chélateur bifonctionnel puis de greffer cet ensemble à la molécule vectrice. Les étapes de marquage et de conjugaison sont donc séparées selon un processus bien défini. Cependant, cette technique est peu applicable pour le radiomarquage de radionucléides utilisés en imagerie médicale : leur demi-vie est généralement trop courte pour être utilisé après l’étape de conjugaison.
2. Fixation du vecteur au chélateur puis radiomarquage
Une autre façon pour réaliser un radiomarquage est d’associer le chélatant bifonctionnel à la molécule vectrice dans un premier temps, puis de fixer le radionucléide à cet ensemble dans un second temps. Il s’agit de la méthode la plus utilisée dans le marquage de médicaments radiopharmaceutiques. Cette technique est plus rapide et permet de réaliser des marquages de qualité et avec un bon rendement.
26
B.
La chélation du Gallium-68
La demi-vie du Gallium-68 étant faible (67,7 min), il est préférable de réaliser la conjugaison du chélatant avec le vecteur préalablement au radiomarquage.
Comme décrit plus haut, le Gallium est un acide fort et son état d’oxydation est de +III. Cette dernière caractéristique permet au Gallium de se coordonner avec des atomes et des groupements riches en électrons (oxygène, azote, …). Son nombre maximal de coordination est de 6 (2). Plusieurs types de chélateurs ont été décrits (24) mais les principaux utilisés pour complexer le Gallium appartiennent aux groupes des tetradentates et des hexadentates. Plus un chélatant forme des liaisons avec l’atome métallique, plus le complexe est stable.
Un chélateur, pour être un bon candidat au marquage d’un radioélément à visée médicale doit posséder certaines caractéristiques importantes (25) :
- Conjugaison facile et simple pour se fixer à différents vecteurs
- Chimie simple, permettant un processus de fabrication dans des conditions simples (température ambiante, durée de réaction courte,…)
- Inertie vis-à-vis de son environnement afin de pouvoir être utilisé in vivo. En effet, autant que possible il ne doit pas provoquer d’effets indésirables ;
- l’interaction entre le radionucléide et le chélatant doit être forte afin d’éviter tout phénomène de démetallation (constante de stabilité élevée, de préférence supérieure à celle de la transferrine qui est le compétiteur majeur retrouvé in vivo); - son utilisation doit être simple et facilement productible pour pouvoir être utilisé à
grande échelle.
1. Rappels de complexation
Stabilité des complexes : Plusieurs paramètres entrent en jeu et influent sur la stabilité d’un complexe formé par un cation métallique et son ligand. Tout d’abord la capacité du métal à former un complexe stable avec un ligand donné (notée β). La tendance du ligand, qui est considéré comme un donneur d’électrons, à la protonation intervient également (notée pKa). Enfin, l’hydrolyse des cations métalliques, qui conduit à la formation de colloïdes inertes (formation d’hydroxydes métalliques) dans un milieu aqueux, est un phénomène à prendre en compte.
Grâce à ces différents paramètres, il est possible de définir le pM, grandeur qui représente la quantité de métal résiduel après la réaction de complexation.
27
On note pM = - log[M] Où [M] est la concentration en métal en solution. Plus le pM a une valeur élevée, plus le ligand a de l’affinité avec le cation métallique.
Inertie cinétique : Il s’agit de la rapidité avec laquelle se forme ou se décompose le complexe formé par le ligand et le métal. Dans l’idéal et pour un complexe utilisé in vivo, on recherche un complexe dont la cinétique de formation est rapide et la cinétique de décomplexation est faible. Mais de telles molécules sont souvent rares et on est obligé d’obtenir un compromis entre les cinétiques de complexation et de décomplexation. Afin d’augmenter la vitesse de la réaction de complexation, le chauffage du milieu de réaction est souvent réalisé, lorsque le ligand n’est pas endommagé par la chaleur.
2. Exemples de chélatants
Un des faits importants à prendre en compte pour la complexation du Gallium-68 et son utilisation in vivo est sa forte similarité avec le Fer, d’un point de vue chimique. Le comportement in vivo du Gallium-68 est donc semblable à celui du Fer. Ce dernier est transporté par la transferrine essentiellement au niveau hépatique (26). Cette protéine a tendance à retirer le Gallium de son ligand si le complexe est de faible affinité, ce qui explique la fixation hépatique du Gallium. La transferrine constitue donc une sorte de « référent » lors des tests des chélatants du Gallium-68 (pM = 21,3 et log β= 20,3).
a) Les chélatants acycliques
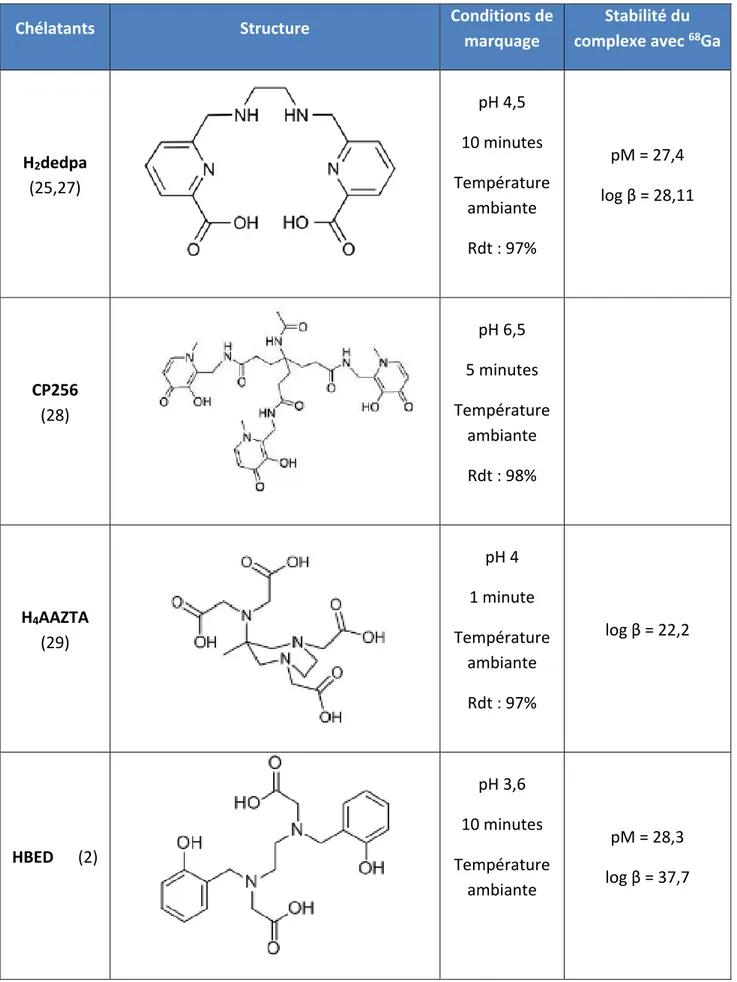
Les chélatants acycliques du Gallium-68 sont des composés dont l’interêt est récent et représentent des alternatives aux composés cycliques qui sont plus anciens. De nombreuses molécules intéresssantes ont été étudiées et sont pour la majorité des agents utilisés pour complexer le Fer. Ils ont globalement une cinétique de complexation plus élevée que les chélatants cycliques : un grand nombre des marquages réalisés avec ces molécules peuvent se faire à température ambiante, plutôt rapidement et avec un bon rendement (tableau 6). Parmi les plus décrits, on peut nommer l’H2dedpa (acide 6,6’-(éthane-1,2diylbis(azanediyl))bis(methylène)dipicolinique) qui possède de bonnes caractéristiques au niveau des paramètres de marquage mais dont la clairance in vivo semble lente (25). Le CP256 est un composé de la famille des 3-hydroxy-4-pyridinone (HPO) et possède pour principal défaut son pH requis pour le marquage, qui trop basique pour le Gallium. Le H4AAZTA (acide N, N’, N’’, N’’(6-amino-6-methylperhydro-1,4-diazepine)-tétra acétique)
montre aussi des bonnes qualités surtout au niveau de ses conditions d’utilisation simples. Enfin, le HBED (acide N,N’-bis[hydroxy-5-(carboxyethyl)benzyl]ethylènediamine-N,N’-diacétique) est considéré actuellement comme le gold standard des chélatants acycliques. Ce dérivé de l’EDTA possède une très grande affinité pour le Gallium-68 et forme des complexes très stables avec ce métal.
28
Chélatants Structure Conditions de
marquage Stabilité du complexe avec 68Ga H2dedpa (25,27) pH 4,5 10 minutes Température ambiante Rdt : 97% pM = 27,4 log β = 28,11 CP256 (28) pH 6,5 5 minutes Température ambiante Rdt : 98% H4AAZTA (29) pH 4 1 minute Température ambiante Rdt : 97% log β = 22,2 HBED (2) pH 3,6 10 minutes Température ambiante pM = 28,3 log β = 37,7
29
b) Les chélatants cycliques
Les chélatants cycliques sont les premières molécules décrites dans la complexation du Gallium-68. Ce sont principalement des dérivés du cyclène et du TACN (1,4,7 – triazacyclononane). Le métal complexé se retrouve capté au sein d’une sorte de « cage » formée par la molécule. Il est possible d’augmenter le nombre d’interactions avec le radionucléide en ajoutant des groupements donneurs d’électrons sur les chaines latérales des chélatants, ce qui permet d’améliorer la stabilité du complexe. Les chélatants cycliques présentent une bonne inertie de complexation et on n’aperçoit que peu de phénomènes de démétallation in vivo, d’où leur utilisation importante.
Le DOTA (Acide 1, 4, 7, 10-tétraazacyclododecane-N, N’, N’’, N’’’-tétraacétique) est l’une des premières molécules utilisées et sert de référence actuellement dans le marquage du Gallium-68. Malgré une affinité moins forte que la transferrine, sa cinétique de complexation avantageuse permet son utilisation in vivo. Il nécessite par ailleurs d’être chauffé pour réaliser le marquage, ce qui limite son utilisation aux molécules thermoresistantes. Quelques dérivés du DOTA ont été synthétisés pour augmenter la denticité du DOTA et permettre un marquage à température ambiante comme le C-DOTA ou le DOTAGA.
Le NOTA (Acide 1, 4, 7, 10-triaazacyclododecane-N, N’, N’’- triacétique) est un chélatant permettant une réaction de marquage rapide, efficace et sans chauffer le milieu réactionnel. Le complexe est très stable, de géométrie adaptée au 68Ga (plus que le DOTA).
Quelques dérivés du NOTA ont été synthétisés pour permettre le marquage de peptides comme le C-NOTA, NODAGA, le NODASA et le NODAPA.
Les dérivés du TRAP ont été synthétisés à partir de la structure du NOTA. Les complexes formés sont très stables. La réaction de marquage peut s’effectuer dans des conditions simples, sans chauffer et à un pH acide, ce qui est très intéressant pour un marquage au Gallium-68.
30
Chélatants Structure Conditions de
marquage Stabilité du complexe avec 68Ga DOTA (27,30) pH 4,0 30 minutes 85°C Rdt : 95% pM = 18,5 log β = 26,1 NOTA (2,31) pH 3,5 10 minutes Température ambiante Rdt : 95% pM = 27,9 log β = 31 Dérivés TRAP (32) pH 3,3 5 minutes 30°C Rdt : 95% log β = 26,2
Tableau 7: Caractéristiques de chélatants acycliques du Gallium-68
De nombreux agents complexant le Gallium ont été décrits ces dernières années. Il semblerait que la tendance aille vers le développement de chélatants acycliques car leurs utilisations et leurs conditions de marquage sont plus faciles à mettre en œuvre. Cependant le DOTA et les dérivés du TRAP constituent des molécules intéressantes et sont utilisés fréquemment dans le cadre d’essais cliniques.
31
Chapitre 2 : Les intégrines et l’angiogenèse
I.
Les pathologies cancéreuses
A.
Définition
Le cancer fait partie d’un grand groupe de maladies pouvant toucher n’importe quelle partie de l’organisme. On parle aussi de tumeurs malignes ou de néoplasmes. L’un des traits caractéristiques du cancer est la prolifération rapide de cellules anormales qui, au-delà de leur délimitation habituelle, peuvent envahir des parties adjacentes de l’organisme, puis se disséminer dans d’autres organes.
Selon l’OMS, « le cancer apparaît à partir d’une seule cellule et la transformation d’une cellule normale en cellule tumorale est un processus passant par plusieurs étapes. Il y a classiquement une évolution vers une lésion précancéreuse puis vers une tumeur maligne. Ces modifications proviennent des interactions entre les facteurs génétiques, propres à un individu et des agents extérieurs classés comme agents cancérigène physiques, chimiques ou biologiques. »
B.
Epidémiologie
Selon l’OMS, les pathologies cancéreuses représentent environ 14 millions de nouveaux cas en 2012, et environ 8 millions de décès, ce qui en fait une des causes majeures de décès dans le monde, derrières les cardiopathies ischémiques et les infections des voies respiratoires (33). « Les projections fondées sur les estimations de GLOBOCAN 2012 anticipent une augmentation substantielle de 19,3 millions de nouveaux cas de cancer par an d'ici à 2025 en raison de la croissance démographique et du vieillissement de la population mondiale » d’après l’IARC (34).
Chez les hommes, les 5 types de cancer les plus couramment diagnostiqués en 2012 étaient le cancer du poumon, de la prostate, du côlon et du rectum, de l’estomac et du foie. Chez les femmes, les 5 types de cancer les plus couramment diagnostiqués en 2012 étaient le cancer du sein, du côlon et du rectum, du col de l’utérus et de l’estomac (figures 4 et 5).
32
Figure 4: Incidence mondiale des dix principaux cancers chez un individu masculin
Figure 5: Incidence mondiale des dix principaux cancers chez un individu féminin
Plus de 60% des nouveaux cas de cancer surviennent dans les pays en voie de développement : Afrique, Asie, Amérique centrale et Amérique latine. Ces régions représentent 70% des décès par cancer dans le monde. L’OMS estime que le nombre de cas de cancer devrait atteindre 22 millions de cas par an au cours des deux prochaines décennies.
Toujours d’après l’OMS, environ 30% des décès par cancer sont dus aux cinq principaux facteurs de risque comportementaux et alimentaires: un indice élevé de masse corporelle, une faible consommation de fruits et légumes, le manque d’exercice physique, le tabagisme et la consommation d’alcool. Par ailleurs, l’âge est un autre
33
facteur important dans l’apparition du cancer. On observe en effet une augmentation spectaculaire de l’incidence des cancers avec l’âge.
Par ces faits, on peut dire que les pathologies cancéreuses représentent un enjeu de santé publique majeur, à cause de l’augmentation de leur incidence ainsi que de leur taux de mortalité important.
C.
Les cancers métastatiques
Une des caractéristiques du cancer est sa capacité à se propager dans l’organisme pour se développer dans différents sites. Le cancer qui se développe dans une autre partie du corps est appelé cancer métastatique et ses sites secondaires de développement sont nommés métastases. Le cancer métastatique peut se développer plusieurs années après le diagnostic initial du cancer primitif. Parfois, le cancer a déjà fait des métastases lorsqu’il est diagnostiqué.
La propagation du cancer repose sur des nombreux facteurs comme le type de cancer, son degré d’évolution (grade), sa taille ou encore l’emplacement du site primitif.
Le cancer peut se propager n’importe où dans le corps. Mais certains cancers ont tendance à se loger dans un endroit préférentiel. Par exemple, le cancer du sein et le cancer de la prostate se disséminent souvent dans le tissu osseux. Pour se déplacer vers un autre site, les cellules cancéreuses ont recours à 3 grands mécanismes :
- L’invasion : les cellules cancéreuses envahissent le tissu adjacent et se développent au détriment de celui-ci en s’accaparant les nutriments environnants.
- La dissémination par le système lymphatique : les cellules cancéreuses se détachent du « noyau de cellules» primitif et se déplacent via les vaisseaux lymphatiques. - La dissémination par le système sanguin : même principe que la dissémination
lymphatique sauf que les cellules cancéreuses utilisent le réseau sanguin pour se propager dans une autre partie du corps.
Normalement les cellules cancéreuses sont identifiées par le système immunitaire et détruites mais il arrive, dans le cas des cancers métastatiques, qu’elles survivent et qu’elles s’établissent dans une ou plusieurs localisations différentes de l’organisme. Suite à leur implantation, les cellules cancéreuses développent différents moyens pour subvenir à leurs besoins et proliférer : l’une des stratégies observées chez les tumeurs consiste à créer ses propres vaisseaux sanguins pour favoriser son approvisionnement en nutriments.
34
II. Angiogénèse
L’angiogenèse est un processus physiologique permettant la création, la croissance et à l’extension de l’arbre vasculaire préexistant pour former un nouveau réseau capillaire. Ce processus physiologique fait intervenir de nombreux protagonistes : cellules endothéliales (CE), péricytes, cellules musculaires lisses, divers composants de la matrice extracellulaire (MEC) ainsi que de nombreux facteurs régulateurs.
A.
L’angiogenèse physiologique
Au cours de la vie, l’angiogenèse se manifeste principalement durant l’embryogenèse et dans le cadre du développement des organes, l’angiogenèse permet d’augmenter l’apport d’oxygène, de nutriments et de divers messagers comme les facteurs de croissance aux différents tissus. A l’âge adulte, ce phénomène s’estompe et n’est observé que dans certains cas comme l’hypoxie, la cicatrisation, le développement musculaire ou la placentation. Il se peut que l’angiogenèse se manifeste dans des cas pathologiques tels que la croissance tumorale, l’inflammation et l’athérosclérose auxquels cas la stratégie thérapeutique consiste à limiter ce processus afin de guérir la maladie.
L’angiogenèse est un processus qui se déroule en plusieurs étapes (figure 6). Suite à l’action d’un stimulus tel que l’hypoxie on observe :
- dans un premier temps, la perméabilité vasculaire augmente et on constate une vasodilatation dans le vaisseau à partir duquel sera créé un nouveau vaisseau.
- Puis la paroi vasculaire se déstabilise et se dégrade pour créer un espace sur lequel sera branché le nouveau vaisseau.
- La MEC est dégradée par divers enzymes dont les MMP (Métalloprotéinases), ce qui favorise ensuite
- La prolifération et la migration des cellules endothéliales à travers la MEC
- On assiste ensuite à la formation d’un tube endothélial et à la lumière du nouveau vaisseau
- Puis, la construction de la nouvelle membrane basale peut avoir lieu grâce au recrutement des péricytes et des cellules musculaires lisses qui permettent la stabilisation du complexe. La MEC est également reconstituée autour des vaisseaux. - Lorsque l’émission de stimuli et de facteurs de croissance cesse, les CE retournent à
35
Figure 6 : Les différentes étapes de l’angiogenèse (35)
Tout au long du processus conduisant à la formation de nouveaux vaisseaux, on observe l’action de nombreux messagers et régulateurs, qui interviennent à des moments précis du processus (tableaux 8 et 9). Sans la présence de toutes ces substances, l’angiogenèse ne pourrait pas se faire correctement. La régulation de l’angiogenèse est finement orchestrée par ces multiples régulateurs, promoteurs ou inhibiteurs de ce phénomène afin de favoriser ou d’inhiber telle ou telle étape du processus.
Nom du facteur Effet du facteur
VEGFR-1, VEGFR-1 soluble et NRP-1 soluble Réquisitionne le VEGF, VEGF-B et PIGF Angiopoïétine-2 Antagoniste de Ang1 : induit la régression des
vaisseaux en absence d’un signal angiogénique
Thrombospodine-1 (TSP-1)
Protéine de matrice extracellulaire; inhibe la migration, la croissance, l’adhésion et la survie des cellules endothéliales; la protéine similaire TSP-2 inhibe aussi l’angiogenèse
Meth-1, Meth-2
Inhibiteurs contenant des domaines montrant des similitudes avec les métalloprotéinases, les thrombospondines et les disintégrines
Angiostatine et Related plasminogen kringles
Fragments protéolytiques du plasminogène; inhibent la migration et la survie des cellules endothéliales
Endostatine Fragment du collagène de type XVIII, inhibe la migration et la survie des cellules endothéliales Tableau 8: Facteurs anti-angiogéniques (d'après Gratton (11))
36
Nom du facteur Effet du facteur
Famille du VEGF
Stimulent l’angiogenèse, la vasculogenèse, la perméabilité vasculaire et l’adhésion des leucocytes.
PIGF : Rôle dans l’angiogenèse pathologique
VEGFR-2 Récepteur induisant signalement angiogenique
Angiopoïétine-1 Stabilise les vaisseaux en resserrant l’interaction endothéliale-muscle lisse
PDGF-BB et ses récepteurs Recrute les cellules du muscle lisse et péricytes TGF-β1, endogline et les récepteurs du TGF-β Stabilise les vaisseaux en stimulant la production
de matrice extracellulaire
FGF, HGF, MCP-1 Stimulent l’angiogenèse (FGF, HGF) et l’artériogenèse (FGF, MCP-1)
Intégrines αvβ3, αvβ5, α5β1
Récepteurs pour les macromolécules et métalloprotéinases de matrice (MMP2)
VE-cadhérine, PECAM (CD31)
Molécules de la jonction endothéliale
essentielles à la survie des cellules endothéliales. Des anticorps peuvent bloquer l’angiogenèse tumorale
Activateur du plasminogène, métalloprotéinases de matrice extracellulaire
Protéinases impliquées dans la migration cellulaire et le remodelage de la matrice; libèrent le FGF et le VEGF de la matrice; activent le TGF-β1; génèrent l’angiostatine
Inhibiteur de l'activateur du plasminogène (PAI-1)
Stabilise les nouveaux vaisseaux en prévenant la dissolution de la matrice;
mauvais pronostic de cancer Synthéase du monoxyde d’azote,
cyclooxygénase
Le monoxyde d’azote et les prostaglandines stimulent l’angiogenèse et la vasodilatation. Des inhibiteurs de Cox2 inhibent l’angiogenèse tumorale
Autres activateurs
Interleukine 8, leptine …
AC133 (récepteur orphelin impliqué dans la différentiation des angioblastes).
Chimiokines (rôle pléitropique dans l’angiogenèse).
Tableau 9: Facteurs pro-angiogéniques (d'après Gratton (11))
Un déséquilibre de cette balance entre les facteurs pro- et anti-angiogéniques va entrainer la prolifération anarchique des vaisseaux ou à l’inverse entrainer une ischémie tissulaire.
37
B.
Angiogenèse tumorale
Dans le cas des pathologies cancéreuses le phénomène d’angiogenèse est détourné par la tumeur afin de l’alimenter en nutriments. En effet, en proliférant, la tumeur ne dispose plus d’assez de ressources dans son environnement proche et doit trouver un moyen pour s’approvisionner. Les cellules cancéreuses vont alors secréter des facteurs pro-angiogéniques, dans le but de construire un nouveau réseau vasculaire les approvisionnant, afin qu’elles puissent continuer à se développer (figure 7). Le rapport entre les facteurs pro-angiogéniques et anti-pro-angiogéniques tourne en faveur de la synthèse de nouveaux vaisseaux : c’est ce qu’on appelle le switch angiogénique.
Figure 7: L’angiogenèse tumorale (35)
L’angiogenèse tumorale se différencie de l’angiogenèse physiologique par la sécrétion anarchique de facteurs pro- et anti-angiogéniques. Il a été constaté que les vaisseaux sanguins tumoraux sont de moins bonne qualité et efficacité que des vaisseaux sains.