GENEVIÈVE CORMIER
LES NIVEAUX D’EXPRESSION PULMONAIRE ET
PLACENTAIRE DE LA 17-ΒETA
HYDROXYSTÉROÏDE DÉSHYDROGÉNASE DE
TYPE 2 EN RELATION AVEC LES NIVEAUX
D’ESTRADIOL MATERNELS ET FŒTAUX DANS LE
MODÈLE MURIN AU JOUR DE GESTATION 17.5
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l’Université Laval dans le cadre du programme de maîtrise en physiologie-endocrinologie
pour l’obtention du grade de Maître ès Sciences (M.Sc.)
DÉPARTEMENT D’OBSTÉTRIQUE ET DE GYNÉCOLOGIE FACULTÉ DE MÉDECINE
UNIVERSITÉ LAVAL QUÉBEC
2013
Résumé
L’estradiol (E2) accélère la maturation pulmonaire et la 17β-hydroxystéroïde
déshydrogénase de type 2 (17ßHSD2) inactive les estrogènes et les androgènes. L’expression de la 17ßHSD2 fluctue et culmine dans le poumon fœtal murin au jour gestationnel 17,5. Les fluctuations de la 17ßHSD2 pulmonaire pourraient être associées aux niveaux de E2 fœtal. La 17ßHSD2 placentaire pourrait alors réguler E2 fœtal et maternel.
Cette étude établit s’il existe une corrélation entre E2 fœtal et la 17βHSD2 pulmonaire et
compare les ratios (E2 foetal/ E2 maternel)avec l’expression de la 17βHSD2 placentaire. E2
fut dosé par spectrométrie de masse et l’ARNm de la 17βHSD2 fut mesuré par QPCR. Aucune corrélation entre E2 fœtal et la 17ßHSD2 pulmonaire n’existe. Les ratios de E2 ne
corrèlent pas avec la 17ßHSD2 placentaire. Ces résultats suggèrent un contrôle local de la 17ßHSD2 dans les poumons fœtaux tandis que les ratios E2 pourraient être régulés par la
Résumé anglais
Estradiol (E2) exerts a positive effect on fetal lung maturation. The 17 beta-hydroxysteroid
dehydrogenase type 2 (17ßHSD2) inactivates estrogens and androgens. 17ßHSD2 also presents a peak and an inter-litter variation of expression at gestational day 17.5 in the murine fetal lung. The variability of the pulmonary 17ßHSD2 mRNA levels could be explained by variations in fetal E2 levels. The placental 17ßHSD2 could regulate fetal and
maternal E2. This study determined if a correlation exists between fetal E2 levels and
pulmonary 17βHSD2 mRNA levels. A comparison was also made between E2 ratios (fetal /
maternal) and the placental 17βHSD2 mRNA levels. E2 was measured by gas
chromatography-mass spectrometry and 17βHSD2 was determined by quantitative PCR. There is no correlation between levels of fetal E2 and pulmonary 17ßHSD2 mRNA. Ratios
of E2 levels do not correlate with placental 17ßHSD2 mRNA. These results suggest a local
control of 17ßHSD2 mRNA levels in fetal lungs. Ratios of E2 could be regulated by the
Remerciements
J’adresse des remerciements particuliers…
À mon directeur de recherche, le Dr Yves Tremblay qui m’a permis de faire mon entrée dans la recherche biomédicale et qui m’a toujours encouragé à développer mon potentiel scientifique;
À mon co-directeur, le Dr Pierre Provost qui a changé positivement mon regard sur la science et qui m’a soutenu et conseillé grandement avant chacune de mes présentations orales;
Aux étudiants qui ont fait parti de notre laboratoire et ceux du CRBR et du centre de recherche du CHUL avec qui j’ai eu la chance de développer des amitiés; Un merci tout particulier s’adresse à Marc Simard et Éric Boucher qui ont grandement contribué à mon apprentissage théorique et pratique, et sans qui mon séjour au centre de recherche n’aurait pu être le même;
À mes parents, Patrice et Colette Cormier; à ma sœur Constance Cormier. Sans votre amour et votre appui, je ne serais pas la personne que je suis aujourd’hui;
À mes grands-parents et ma tante Roberte Leblanc qui a été en quelque sorte mon ange gardien;
À Belco Barque-Barry avec qui j’ai partagé ma vie pendant plusieurs années et qui m’a beaucoup soutenu moralement.
Table des matières
Résumé ... iii
Résumé anglais ... iv
Remerciements ... v
Table des matières ... vi
Liste des tableaux ... viii
Liste des figures ... ix
Liste des abréviations ... x
CHAPITRE I INTRODUCTION ... 1
1. Introduction générale ... 2
1.1. Le placenta ... 4
1.1.1. Aspects fonctionnels, structuraux et développementaux du placenta murin ... 4
1.1.2. Développement placentaire ... 6
1.1.3. Comparaisons entre les placentas murin et humain ... 8
1.1.4. Stéroïdogénèse placentaire ... 9
1.2. Profil stéroïdien en circulation maternelle et fœtale chez les rongeurs ... 15
1.2.1. Stéroïdes circulants maternels ... 15
1.2.2. Stéroïdes circulants fœtaux ... 17
1.3. Le poumon ... 19
1.3.1. Développement pulmonaire ... 19
1.3.2. Implication des hormones stéroïdiennes dans le développement pulmonaire ... 23
1.4. La régulation des estrogènes par la famille des 17ß-hydroxystéroïdes déshydrogénases ... 27 1.4.1. 17ßHSD1 ... 27 1.4.2. 17ßHSD2 ... 28 1.4.3. 17ßHSD4 ... 30 1.4.4. 17ßHSD6 et 17ßHSD9 ... 30 1.4.5. 17ßHSD7 ... 30 1.4.6. 17ßHSD8 ... 31 1.4.7. 17ßHSD10 ... 31 1.4.8. 17ßHSD11 ... 31 1.4.9. 17ßHSD12 ... 31 1.4.10. 17ßHSD14 ... 31 CHAPTIRE II DESCRIPTION DU PROJET DE RECHERCHE ... 33
2.1. Contexte théorique ... 34
2.2. Hypothèses de travail ... 34
CHAPITRE III
MÉTHODES EXPÉRIMENTALES ... 37
3.1. Justification du modèle murin ... 38
3.2. Animalerie et récoltes des échantillons ... 38
3.3. Préparation du sérum à partir de sang complet murin ... 39
3.4. Chromatographie en phase gazeuse couplée à la spectrométrie de masse ... 39
3.5. Extraction d’ARN et synthèse d’ADN complémentaire ... 39
3.6. PCR en temps réel ... 41
3.7. Normalisation ... 41
3.8. Analyses statistiques ... 42
CHAPITRE IV RÉSULTATS ... 43
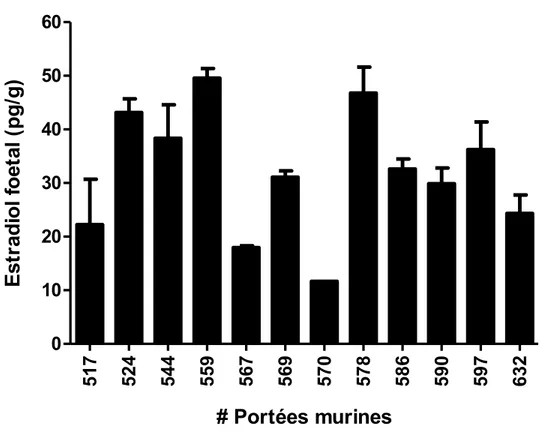
4.1. Niveaux d’estradiol fœtal et niveaux d’expression de la 17ßHSD2 pulmonaire ... 44
4.1.1. Niveaux d’estradiol fœtal ... 44
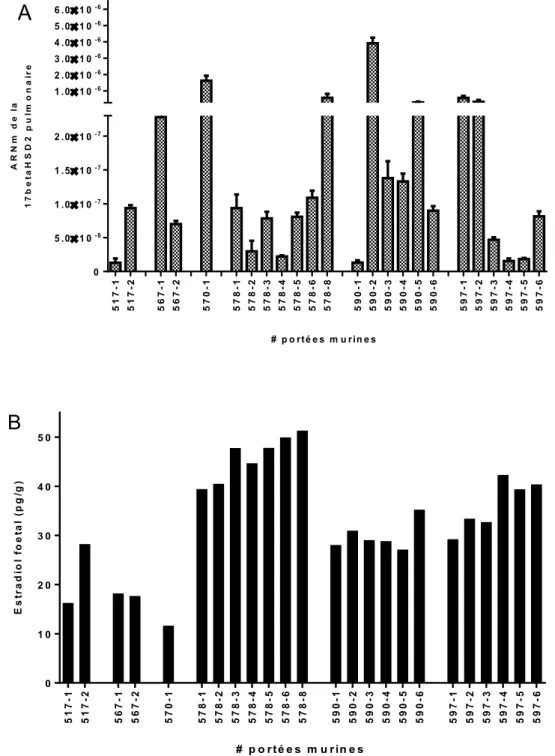
4.1.2 Relation entre les niveaux d’estradiol fœtal et le niveau d’expression de la 17ßHSD2 pulmonaire ... 49
4.2. Relation entre les niveaux d’estradiolfœtal, d’estradiol circulantmaternel et les niveaux d’expression de la 17βHSD2 placentaire ... 51
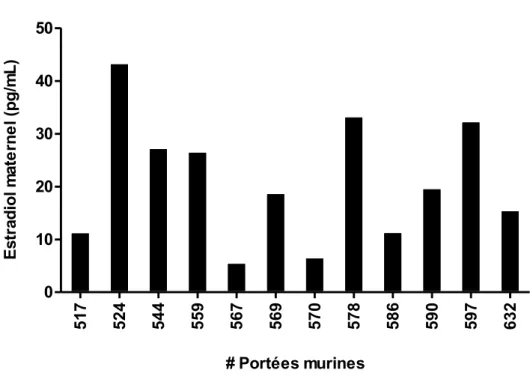
4.2.1. Niveaux d’estradiol circulant maternel et les niveaux d’estradiol fœtal ... 51
4.2.2. Ratios des niveaux d’estradiol circulant maternel et d’estradiol fœtal en relation avec les niveaux d’expression de la 17ßHSD2 placentaire ... 53
4.3. Dosages des autres substrats de la 17ßHSD2 placentaire ... 54
4.3.1. Testostérone ... 54
4.3.2. Progestérone ... 55
4.3.3. 17ßHSD2 placentaire en relation avec les autres substrats ... 56
4.4. Les niveaux relatifs d’expression des gènes de la 17ßHSD2 pulmonaire fœtal et placentaire ... 58
CHAPITRE V DISCUSSION ... 59
5.1. Niveaux d’estradiol fœtaux et niveaux d’expression relative du gène de la 17βHSD2 pulmonaire ... 60
5.2. Niveaux d’estradiol circulant maternel et d’estradiol fœtal en relation avec les niveaux relatifs d’expression de la 17ßHSD2 placentaire ... 61
5.3. Autres points de discussion... 62
CHAPITRE VI CONCLUSION ... 63
CHAPITRE VII PERSPECTIVES ... 67
Liste des tableaux
Tableau 1. Phases du développement pulmonaire humain et murin ... 20 Tableau 2. 17ßHSDs impliquées dans la régulation des estrogènes. ... 32 Tableau 3. Estradiol : Niveau maternel dans le sérum et niveau fœtal dans le tissu ... 52
Liste des figures
Figure 1. Structure générale du placenta murin. ... 6 Figure 2. Développement placentaire murin.. ... 8 Figure 3. Représentation simplifiée des réactions stéroïdogéniques menant à la formation de la progestérone et des estrogènes. ... 13 Figure 4. Profil des stéroïdes maternels circulants dans le plasma chez le modèle
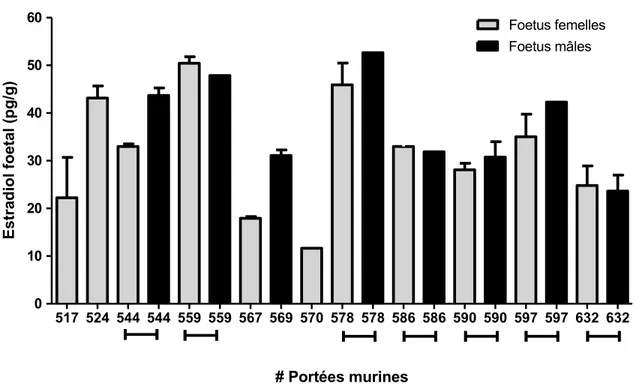
murin……….17 Figure 5.A. Niveaux d’estradiol fœtal au jour de gestation 17,5. ... 45 Figure 5.B. Moyennes des niveaux fœtaux d’estradiol à l’intérieur de chacune des portées murines au JG 17,5………45 Figure 5.C. Moyennes des niveaux d’estradiol fœtal chez les mâles et les femelles dans chacune des portées murines au JG 17,5………..46 Figure 6. Relation entre les niveaux d’expression de la 17ßHSD2 pulmonaire fœtale (A) et
les niveaux d’estradiol fœtal au JG 17,5 (B).. ... 50 Figure 7. Niveaux circulants d’estradiol maternel au JG 17,5... 51 Figure 8. Ratios des niveaux d’estradiol fœtal et maternel en relation avec la 17ßHSD2
placentaire au JG 17,5.. ... 53 Figure 9. Niveaux de testostérone maternelle et fœtale au JG 17,5. ... 54 Figure 10. Niveaux de progestérone maternelle et fœtale au JG 17,5. ... 55 Figure 11. Ratios des niveaux de progestérone maternelle et fœtale en relation avec la
17ßHSD2 placentaire au JG 17,5. ... 56 Figure 12. Ratios des niveaux de testostérone maternelle et fœtal en relation avec la
17ßHSD2 placentaire au JG 17,5. ... 57 Figure 13. Niveaux d’expression de la 17ßHSD2 pulmonaire fœtale et placentaire chez le
Liste des abréviations
5-diol : 5-androstènediolΔ4 : androstènedione
17ßHSD : 17 beta hydroxystétroïde déshydrogénase ADN : acide désoxyribonucléique
AR : récepteur des androgènes ARN : acide ribonucléique
ARNm : acide ribonucléique messager DHEA : déhydroépiandrostérone
DHEAS : déhydroépiandrostérone-sulfate DHT : dihydrotestostérone
D.O. : densité optique E1 : estrone
E2 : estradiol
E3 : estriol
EtOH : éthanol
GC/MS : chromatographie en phase gazeuse couplée à la spectrométrie de masse JG: jour gestationnel
MCI : Masse cellulaire interne
PCR : réaction en chaîne par polymérase
QPCR : réaction de polymérase en chaîne quantitative PN : post-natal
PTII : pneumocyte de type II T : testostérone
CHAPITRE I
INTRODUCTION
1. Introduction générale
Ce mémoire est en étroite relation avec la prématurité et ses conséquences sur le développement pulmonaire. En cas de naissance prématurée, l’immaturité pulmonaire peut mener à la détresse respiratoire du nouveau-né, causée principalement par une déficience en surfactant. Plusieurs études ont démontré que les hormones stéroïdiennes sont impliquées dans la régulation de la production de surfactant. En effet, la présence d’androgènes chez les fœtus mâles pendant le dernier tiers de la grossesse entraîne un ralentissement dans sa production, menant à un retard de maturation pulmonaire. Les estrogènes et les glucocorticoïdes exercent également une influence sur la production de surfactant, mais de manière positive.
Tout au long de la gestation, chez les rongeurs, les quantités plasmatiques d’estradiol (E2)
et de progestérone (P) augmentent graduellement suivant des courbes similaires. Bien que les concentrations de ces deux hormones soient différentes, leur ratio (P/E2) demeure
constant tout au long de la seconde moitié de la gestation pour atteindre un maximum au jour de gestation (JG) 17,5. La 17β-hydroxystéroïde déshydrogénase de type 2 (17ßHSD2), qui a la capacité d’inactiver les androgènes et les estrogènes, présente également un pic d’expression au JG 17,5 dans le poumon fœtal. De plus, une grande variation inter-portée est aussi observée dans son expression à ce JG.
Mes travaux de maîtrise ont donc porté sur la relation existant entre la variabilité de l’expression de la 17ßHSD2 pulmonaire et les niveaux de E2 fœtaux dans le modèle murin
Balb/c au JG 17,5. À cet effet, les niveaux de E2 circulant fœtaux ont été mesurés et
comparés non seulement avec la 17ßHSD2 pulmonaire mais aussi avec les niveaux d’E2
circulant maternels. D’autre part, des analyses ont été effectuées afin de déterminer si les niveaux 17ßHSD2 placentaire pouvaient expliquer la variabilité dans les niveaux d’E2
fœtaux, démontrant possiblement un mécanisme de régulation entre les niveaux d’E2
circulant fœtaux et maternels.
Les premières parties de ce mémoire présenteront le contexte général de mon étude. Le chapitre I, l’introduction, abordera divers aspects du placenta murin dont ses fonctions, sa structure, son développement, son endocrinologie, sa stéroïdogenèse et fera état des similitudes entre le placenta murin et humain. Il y aura une description du profil stéroïdien
dans la circulation maternelle et fœtale tandis que la section suivante présentera le développement pulmonaire et l’implication des hormones stéroïdiennes. La dernière section du chapitre I s’orientera vers la famille des 17ßHSDs qui ont les estrogènes comme substrats. Ensuite, s’enchaîneront les chapitres II, III, IV, V, VI et VII qui couvriront la description du projet, les méthodes expérimentales utilisées, les résultats, la discussion, la conclusion et finalement, les perspectives.
1.1. Le placenta
1.1.1. Aspects fonctionnels, structuraux et développementaux du placenta
murin
1.1.1.1 Fonctions générales du placenta
Le placenta est un organe de transition formant une interface entre la circulation maternelle et fœtale, nécessaire à la survie et la croissance du fœtus. Il permet les échanges gazeux, métaboliques et nutritionnels ainsi que l’élimination des déchets fœtaux. L’unité fœto-placentaire maternelle exerce également un rôle endocrinien par la production d’hormones altérant la physiologie maternelle au cours de la grossesse et formant, en plus de sa barrière physique, une protection immunitaire envers le fœtus. Le mécanisme par lequel le fœtus serait protégé du système immunitaire de la mère n’a pas encore été complètement élucidé. En effet, des études ont démontré que les souris femelles rejettent les organes provenant de donneurs allogéniques ou semi-allogéniques mâles. Pourtant les fœtus conçus par ces mêmes donneurs ne sont pas rejetés (Georgiades, Ferguson-Smith et al. 2002).
1.1.1.2. Structure générale du placenta
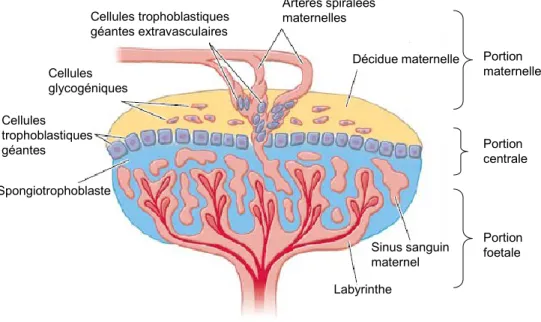
Les placentas humain et murin matures sont composés de trois parties majeures : 1) la couche maternelle externe incluant les cellules de la décidue de l’utérus et la vascularisation maternelle qui permet l’échange sanguin avec le site d’implantation; 2) une région centrale dite « jonctionnelle » reliant le placenta fœtal à l’utérus contenant les trophoblastes, qui envahissent le mur utérin et les vaisseaux maternels; 3) la couche interne, composée de plusieurs ramifications de villosités impliquées dans l’échange de nutriments (Watson and Cross 2005). Un schéma général des structures placentaires murines est disponible à la figure 1.
Les trophoblastes représentent le type cellulaire le plus important du placenta. Ceux-ci fournissent la structure principale et les composants nécessaires permettant au système sanguin maternel et fœtal d’entrer en contact. Les trophoblastes peuvent également accumuler le glycogène. Chez la souris, l’accumulation du glycogène est effectuée par les spongiotrophoblastes et survient vers la mi-gestation (Cross 2006).
Les villosités, qui constituent la troisième portion, baignent dans le sang maternel et sont elles-mêmes composées d’une partie externe constituée de couches de cellules épithéliales dérivées de la lignée des trophoblastes et d’une surface interne renfermant des cellules stromales et des vaisseaux sanguins (Watson and Cross 2005).
L’arrangement des villosités placentaires facilite la classification des structures placentaires. Inversement au modèle porcin où les villosités apparaissent diffuses (placenta diffus), elles sont fortement regroupées, chez l’humain et la souris, en une structure circulaire appelée cotylédon. Quant aux rongeurs, ils ont un seul cotylédon appelé placenta discoïdale. Toutefois, l’être humain, malgré la forme discoïde de son placenta, possède plusieurs cotylédons qui sont consolidés ensembles (Rossant and Cross 2001).
La structure de la couche trophoblastique, recouvrant les villosités et le type de cellules maternelles qui s’y rattachent, varie également entre les espèces. Chez les rongeurs et les primates, l’endomètre est érodé afin de permettre un contact direct entre le sang maternel et la surface des trophoblastes. Ce type de placenta renferme des villosités qui sont délimitées par un syncytium flottant dans le sang maternel : c’est un placenta hémo-chorial. Trois couches de cellules trophoblastiques sont retrouvées chez les rongeurs : deux couches de cellules syncytiales et une couche de cellules ayant une fonction inconnue (Cross 2006). Cependant, les humains ont une seule couche de cellules syncytiales et une couche sous-jacente de cellules souches trophoblastiques (Rossant and Cross 2001; Cross 2006).
Labyrinthe Décidue maternelle Sinus sanguin maternel Spongiotrophoblaste Cellules trophoblastiques géantes Cellules glycogéniques Artères spiralées maternelles Cellules trophoblastiques géantes extravasculaires Portion maternelle Portion centrale Portion foetale
Figure 1. Structure générale du placenta murin. Tiré de : (Watson and Cross 2005).
1.1.2. Développement placentaire
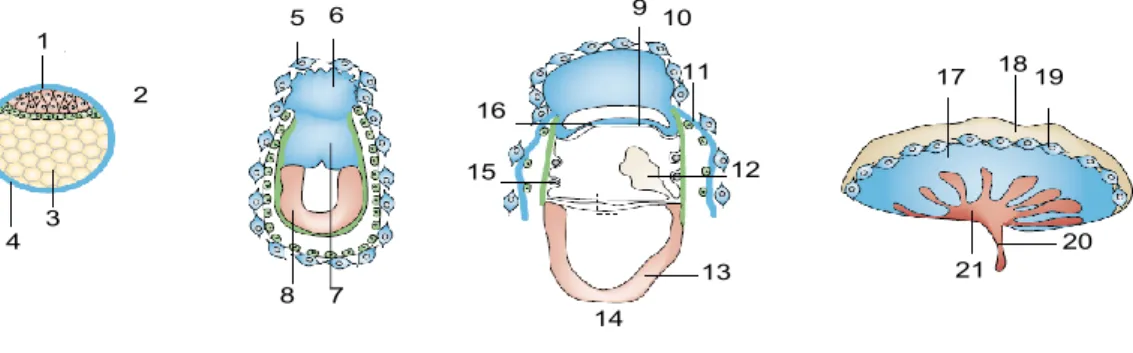
Malgré les différences architecturales entre les placentas humain et murin, les structures et mécanismes moléculaires découlant du développement sont semblables. Cette section s’attardera sur le développement placentaire murin. Il dérive de deux types tissulaires majeurs : le trophectoderme et l’allantoïde. La lignée cellulaire trophoblastique provient du trophectoderme au stade du blastocyste, alors que les composants stromaux et vasculaires dérivent de l’allantoïde. Chez la souris, au JG 3.5, deux lignées cellulaires distinctes sont formées : la lignée trophectodermique qui pompe les fluides vers l’intérieur formant ainsi la cavité du blastocoèle et la masse cellulaire interne (MCI) qui réside d’un côté de la cavité (voir figure 2). Près du moment de l’implantation, au JG 4.5, les cellules du trophectoderme adjacentes à la MCI prolifèreront et donneront lieu à l’ectoderme extra-embryonnaire et au cornet ectoplacentaire. Les cellules du trophectoderme éloignées de la MCI cesseront leur
division tout en continuant l’endoréduplication de leur ADN. Ce dernier processus mènera à la formation de cellules trophoblastiques géantes, analogues aux cellules cytotrophoblastiques extravilleuses de l’humain (Watson and Cross 2005). À mesure que le développement se poursuit, l’ectoderme extra-embryonnaire s’agrandira et formera un épithélium chorionique bordé d’une mince couche de cellules mésothéliales. Près du JG 8.5, l’allantoïde surgira du mésoderme à l’extrémité postérieure de l’embryon et entrera en contact avec le chorion menant à ce qu’on appelle la fusion chorioallantoïde. Par la suite, des plis se formeront dans le chorion suivi d’une expansion des vaisseaux sanguins fœtaux-placentaire engendrant les composants fœtaux du réseau vasculaire fœtaux-placentaire. Les trophoblastes et les vaisseaux sanguins fœtaux associés à ce réseau vasculaire subiront une vaste ramification de villosités formant le labyrinthe. Ce dernier sera composé de plusieurs couches de cellules trophoblastiques provenant à l’origine du chorion.
Au cours du développement, le labyrinthe est structuralement supporté par les spongiotrophoblastes. Ces cellules non-syncitiales forment une couche entre le labyrinthe et la couche externe de cellules géantes. Quelques études ont suggéré que les spongiotrophoblastes proviendraient du cornet ectoplacentaire (Rossant and Cross 2001). Le sang de la mère passe par les spongiotrophoblastes via de larges sinus artériels centraux dans lesquelles les cellules endothéliales maternelles sont érodées et remplacées par les cellules trophoblastiques. Éventuellement, le sang de la mère passera par de petits espaces tortueux du labyrinthe baignant directement dans les villosités trophoblastiques fœtales. Ces villosités assureront l’efficacité des échanges maternels entre deux systèmes sanguins. Deux artères et une veine ombilicales viendront créer un lien entre la vascularisation fœtale du placenta et le fœtus en développement.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 1819 20 21
Figure 2. Développement placentaire murin. Tiré de : (Rossant and Cross 2001).
1) trophectoderme polaire; 2) masse cellulaire interne; 3) blastocoèle; 4) trophectoderme; 5) celllules trophoblastiques géantes; 6) cornet ecto-placentaire; 7) ectoderme extra-embryonnaire; 8) épiblaste; 9) mésothélium; 10) cellules trophoblastiques géantes; 11) sac vitellin pariétale; 12) allantoïde; 13) embryon; 14) amnion; 15) sac vitellin viscéral; 16) ectoderme chorionique; 17) spongiotrophoblastes; 18) décidu maternelle; 19) cellules trophoblastiques géantes; 20) cordon ombilical; 21) labyrinthe.
1.1.3. Comparaisons entre les placentas murin et humain
Cette section énumère quelques similarités entre le placenta humain et murin. Tout d’abord, la couche supérieure du placenta murin mature est composée de cellules trophoblastiques géantes impliquées dans l’implantation et l’invasion de l’utérus. Chez l’être humain, les cytotrophoblastes extravilleux invasifs exercent un rôle semblable (Rossant and Cross 2001; Cross 2006). La polyploïdie des cellules, causée par l’endoréduplication des cellules trophoblastiques géantes, est l’une des caractéristiques les plus importantes chez la souris. Chez les humains, le noyau des cellules cytotrophoblastiques extravilleuses devient également polyploïde (Rossant and Cross 2001). La couche centrale des placentas murin et humain est constituée d’un arrangement dense de cellules trophoblastiques. Chez les primates, cette portion porte le nom de colonnes cytotrophoblastiques et chez la souris, il
s’agit des spongiotrophoblastes. La fonction principale des spongiotrophoblastes est de supporter les villosités sous-jacentes. Ils peuvent également sécréter des hormones polypeptides et garder en réserve les précurseurs des trophoblastes invasifs (Cross 2006). Le labyrinthe murin et les villosités chorioniques du placenta humain ont des fonctions analogues. Chez les deux espèces, les villosités placentaires sont recouvertes de syncytiotrophoblastes multinucléés (deux couches chez les rongeurs) qui sont en contact direct avec le sang maternel (Cross 2006). Les villosités contiennent également des cellules souches trophoblastiques, des cellules stromales et des vaisseaux sanguins (Rossant and Cross 2001; Cross, Anson-Cartwright et al. 2002; Cross 2006).
1.1.4. Stéroïdogénèse placentaire
Le placenta est classiquement considéré comme étant le lieu de synthèse de nombreuses hormones stéroïdiennes et polypeptides. L’établissement et le soutien du développement embryonnaire nécessitent la présence de progestérone et d’estrogènes. La présente section portera, premièrement, sur la description de ces deux hormones ainsi que sur leur régulation et production afin de pouvoir, par la suite, situer l’importance de la 17ßHSD2 dans la stéroïdogenèse placentaire.
1.1.4.1 Hormones stéroïdiennes produites et/ou régulées par le placenta
Les hormones stéroïdiennes correspondent aux hormones qui dérivent d’un noyau stérol découlant du cholestérol. Parmi celles-ci, on retrouve : les vitamines liposolubles du groupe D, les corticostéroïdes sous-divisés en minéralocorticoïdes et en glucocorticoïdes, la progestérone et les stéroïdes sexuels incluant les estrogènes et les androgènes. Dans cette partie de chapitre, seuls les estrogènes et la progestérone seront traités. L’accent sera mis sur les estrogènes puisqu’ils sont le point central de mon projet de maîtrise.
1.1.4.1. a) Estrogènes
Le placenta murin mature a la capacité de synthétiser les estrogènes à partir de la prégnenologne ou de la progestérone, hormones provenant du cholestérol, en raison de la présence de l’enzyme 17α-hydroxylase/17-20 lyase. Trois types d’estrogènes sont principalement produits et régulés par le placenta : l’estrone (E1), l’estradiol (E2) et l’estriol
(E3). E1 est la moins abondante des trois et peut servir de précurseur pour la formation de
E2, la plus biologiquement active des trois. La liaison de E2 avec le récepteur des
estrogènes est 10 fois plus forte que pour E1 et 100 fois plus forte que pour E3. Il a été
rapporté que la concentration de E3, hormone n’ayant pas ou très peu d’effet biologique,
augmente dans la salive et le sérum au cours des 4 à 6 dernières semaines de grossesse. Un niveau élevé de E3 salivaire au cours d’une grossesse peut être un indicateur de naissance
prématurée (Goodwin 1999).
Les estrogènes sont associés à plusieurs modifications physiologiques. Notamment, ils influent sur les changements de la circulation sanguine survenant au cours de la grossesse. L’augmentation du volume sanguin est reliée à la présence du fœtus et a pour objectif de fournir le liquide nécessaire à son développement. Pour ce faire, les estrogènes stimulent le système rénine-angiotensine qui amène une augmentation de la production de l’aldostérone et une réabsorption aqueuse aboutissant à l’accroissement du volume sanguin maternel (Longo 1983). Également, ils sont essentiels au développement et au fonctionnement utérin. En effet, ils sont responsables de la synthèse et la régulation des protéines contractiles de l’utérus (Fu, Moberg et al. 1996). Ils augmentent la concentration des récepteurs à l’ocytocine de même que les récepteurs aux agents α-adrénergiques, ces derniers modulant les canaux calciques membranaires. Les estrogènes exercent également un rôle critique dans la communication intracellulaire. Ils augmentent la synthèse de la protéine connexine 43, la formation des jonctions communicantes du myomètre et la stimulation de prostaglandines menant ainsi à la coordination et contraction utérine.
Plusieurs autres effets sont connus chez l’humain, notamment sur le développement des glandes mammaires (Albrecht and Pepe 1990; Colomb, Berthon et al. 1991), la relaxation des ligaments pelviens, l’augmentation de la captation de LDL-cholestérol et la stimulation de l’enzyme P450scc essentiel à la synthèse de prégnénolone et de progestérone par le placenta, l’augmentation des protéines liantes par le foie de même que celles des prolactines maternelles et déciduales (Albrecht and Pepe 1990). En fin de gestation, E2 est
également impliqué dans la maturation du poumon (Ballard 1989) et de la peau (Hanley, Rassner et al. 1996) ainsi que dans l’activation de l’axe hypothalamo-hypophyso-surrénalien (Pepe, Burch et al. 2001). L’influence de E2 envers la maturation pulmonaire
sera abordée au deuxième chapitre de ce mémoire. De plus, des études ont démontré qu’une privation de l’apport placentaire en E2 et P pourrait contribuer à l’ostéoporose chez les
enfants prématurés (James, Congdon et al. 1986) et que E2 pourrait promouvoir la
formation des synapses influençant conséquemment le développement du réseau neural (Matsumoto 1991).
Les récepteurs ERα et ERß ont été caractérisés chez l’humain (Mosselman, Polman et al. 1996). La signalisation cellulaire des estrogènes est médiée via ces deux récepteurs appartenant à la famille des récepteurs nucléaires des facteurs de transcription. Cette superfamille inclue les récepteurs des hormones stéroïdiennes et thyroïdiennes, de l’acide rétinoïque, de la vitamine D et de certains récepteurs orphelins (Carson-Jurica, Schrader et al. 1990).
1.1.4.1 b) Progestérone
Le principal rôle de la progestérone au cours de la grossesse est de maintenir l’utérus dans un état de quiescence et le col utérin en contraction (Bokstrom and Norstrom 1995). La progestérone est aussi reconnue pour avoir des effets opposés à ceux des estrogènes. Par exemple, in vitro, la progestérone inhibe la contractilité des cellules du myomètre ainsi que la formation des jonctions gap (Garfield, Saade et al. 1998). De plus, dans le contexte de la grossesse, cette hormone stéroïdienne exerce une régulation négative sur la production des prostaglandines, le développement des canaux calciques et le récepteur de l’ocytocine (Garfield, Saade et al. 1998).
En début de grossesse, chez la femme, la progestérone est produite par le corps jaune de l’ovaire. C’est à la fin du premier trimestre que le placenta prendra la relève pour devenir le principal lieu de synthèse de la progestérone et ce, jusqu’à la fin de la gestation; la contribution de l’ovaire étant minime. À noter que chez les rongeurs, la progestérone provient du corps jaune, et donc de l’ovaire, tout au long de la gestation.
Il est connu que la diminution de la progestérone initie le début du travail chez certaines espèces ayant une gestation lutéale dépendante, comme chez les rongeurs (Waddell and Bruce 1989). Cependant, chez l’humain, aucune variation significative n’est observée dans les niveaux sériques de progestérone, avant et pendant le travail. Il est possible que le ratio
E2/P soit régulé localement par les tissus cibles ou encore que le nombre de récepteurs de la
progestérone soit diminué (Padayachi, Pegoraro et al. 1990). Toutefois, il a été démontré que le blocage des récepteurs à la progestérone par l’antagoniste RU486 cause une élévation de l’activité utérine qui pourrait mener à l’induction du travail (Avrech, Golan et al. 1991).
1.1.4.2. Voies stéroïdogéniques menant à la formation des estrogènes
Cette section offre une description de la stéroïdogenèse placentaire afin de situer la 17ßHSD2 et de présenter son implication dans le métabolisme de E2. Un schéma simplifié
des réactions stéroïdogéniques menant à la formation des estrogènes et de la progestérone est présenté à la figure 3.
PREG 17-OH PREG CHOLESTÉROL
5-ANDROSTÈNEDIOL
PROG 17-OH PROG
P450c17 TESTO ANDROSTÈNEDIONE E1 E2 P450aromatase DHEA-S sulfatase P450scc DHEA P450c17 17ßHSDs 3β-HSD
Figure 3. Représentation simplifiée des réactions stéroïdogéniques menant à la formation de la progestérone et des estrogènes.
DHEA : déhydroépiandrostérone; DHEA-S : déhydroépiandrostérone-sulfate; E1 : estrone; E2 : estradiol; 3ß-HSD : 3ß-hydroxystéroïde déshydrogénase; 17ßHSD :
17ß-hydroxystéroïde déshydrogénase; 17-OH PREG : 17-hydroxyprégnénolone; 17-OH PROG : 17-hydroxyprogestérone; PREG : prégnénolone; PROG : progestérone; TESTO : testostérone.
Chez la souris, bien que ce soit le corps jaune de l’ovaire qui soit directement impliqué dans la synthèse de la P et de E2, le placenta a tout de même un rôle non négligeable à
jouer. La conversion du cholestérol en prégnénolone représente l’étape initiale et limitante de la synthèse de toutes les hormones stéroïdiennes. Pour ce faire, le cholestérol doit être transporté à la membrane la plus interne de la mitochondrie au site de la P450 side chain
cleavage (P450scc). Le transport du cholestérol vers les crêtes mitochondriales est facilité
par la protéine Steroidogenic Acute Regulatory (StAR). Suite à l’action de la P450scc sur le cholestérol, la prégnénolone subira des modifications supplémentaires.
La biosynthèse des hormones actives nécessite la conversion de la prégnénolone en progestérone par la 3ß-hydroxystéroïde déshydrogenase/isomérase (3ßHSD) localisée dans
le réticulum endoplasmique (RE) des cellules. Deux autres étapes sont requises dans le RE afin de mener à la synthèse des androgènes et des estrogènes à partir de la progestérone. En effet, la 17α-hydroxylase/17-20 lyase (P450c17) peut convertir la progestérone en androgènes aromatisables, et par l’intermédiaire de la P450arom, la testostérone peut être convertie en E2 (Ben-Zimra, Koler et al. 2002). Le cytochrome P450 aromatase peut
également convertir l’androstènedione (Δ4
)
en E1 et le 16-hydroxyandrostènedione en E3(Nebert, Nelson et al. 1991). Quant aux enzymes 17ßHSDs, ils catalysent les dernières étapes menant à l’activation et l’inactivation de E2. Au niveau placentaire, la 17ßHSD1
catalyse la conversion de E1 en E2, alors que la 17ßHSD2 catalyse la réaction opposée.
Bonenfant et ses collègues (Bonenfant, Blomquist et al. 2000) utilisèrent l’hybridation in
situ et identifièrent les cellules endothéliales du villi des artérioles comme le site primaire
d’expression de la 17ßHSD2 placentaire. Leurs résultats suggèrent un rôle régulateur de ces cellules par le contrôle des niveaux de progestérone, androgènes et estrogènes lors de la grossesse. La section 1.4 offrira une description des membres de la famille des 17ßHSDs impliquées dans l’activation et l’inactivation des estrogènes.
1.1.4.3. Principales distinctions entre la stéroïdogenèse placentaire murine et humaine
Chez l’humain, le placenta prend la relève des fonctions stéroïdogéniques du corps jaune dès la fin du premier trimestre. Par conséquent, une ovariectomie à ce moment n’affecterait pas la synthèse des estrogènes (Ben-Zimra, Koler et al. 2002). Fait important, le placenta humain n’exprime pas la P450c17. Par conséquent, la synthèse d’estrogènes ne peut s’effectuer à partir du cholestérol, de la prégnénolone ou de la progestérone (voir figure 3) (Albrecht and Pepe 1990). Étant donné qu’il n’y a pas de continuité entre la voie de biosynthèse de la progestérone et celles des estrogènes et androgènes, le placenta a besoin du précurseur déhydroépiandrostérone-sulfate (DHEA-S) en provenance des surrénales maternelles et fœtales pour la synthèse de stéroïdes sexuels biologiquement actifs. Il est à noter que chez l’humain, le gène StAR n’est pas exprimé dans le placenta. Il est possible que sa fonction soit remplacée par une autre protéine, dont MLN64 (Ben-Zimra, Koler et al. 2002). La production de novo de la progestérone est assurée par les syncytiotrophoblastes (Ben-Zimra, Koler et al. 2002). Ces cellules expriment la P450 aromatase requise pour la synthèse des estrogènes.
Chez les rongeurs, la stéroïdogenèse de l’ovaire est requise tout au long de la gestation. En effet, au cours de la gestation murine, P et E2 sont principalement produits par l’ovaire. Il
est donc évident de constater qu’une ovariectomie effectuée à n’importe quel stade du développement fœtal mettrait fin à la gestation. Ce n’est que lorsque le placenta est mature qu’il peut convertir la progestérone en androgène via l’expression de la P450c17. Toutefois, la progestérone doit provenir du corps jaune et être, ensuite, acheminée vers le placenta pour sa conversion en androgène. Ultérieurement, ces androgènes seront dirigés vers l’ovaire et serviront de substrats pour la formation d’estrogènes subséquents (Ben-Zimra, Koler et al. 2002). Il est à noter que le complexe enzymatique de l’aromatase, qui catalyse entre autre la conversion de T en E2, a été localisé dans les cellules de la granulosa chez la
souris (Ishimura, Yoshinaga-Hirabayashi et al. 1989). Néanmoins, des études effectuées par Salomon et Sherman ont démontré que les cellules trophoblastiques géantes du placenta murin étaient capables de synthétiser P à partir de cholestérol (Salomon and Sherman 1975).
1.2. Profil stéroïdien en circulation maternelle et fœtale chez les
rongeurs
Ce sous-chapitre présente une description du patron de sécrétion maternelle et fœtale de E2,
la progestérone et T lors de la gestation chez les rongeurs.
1.2.1. Stéroïdes circulants maternels
En début de gestation, chez la souris, l’ovaire est la principale source d’androgènes servant de substrat pour l’aromatisation en estrogènes. La gestation progressant, l’ovaire maintient son activité aromatique mais perd son habileté à convertir la P en androstènedione. Dès la mi-gestation, le placenta devient le site principal de substrat androgénique pour l’aromatisation en E2.
En 1979, Barkley et ses collègues (Barkley, Geschwind et al. 1979) ont mené une étude sur quatre différentes lignées murines, les Balb/c ne faisant pas partie de leurs modèles. Leurs recherches ont permis d’établir un patron de sécrétion maternelle de E2, P et T dans le
démontré que le niveau de E2, entre le début et la mi-gestation, était relativement stable
dans toutes les lignées à l’étude. Cependant, dès la mi-gestation, une augmentation graduelle était présente et ce, jusqu’au JG 17. Quant aux niveaux circulant de testostérone, une augmentation a été observée au moment où la régulation de la fonction lutéale est assumée par le conceptus (entre le JG 8 et 10). Durant cette période de transition, souvent associée avec la perte d’embryons chez plusieurs mammifères, T et l’androstènedione sont produits par l’ovaire et le placenta. Une seconde augmentation d’androgènes est présente en fin de gestation, aboutissant à un pic au JG 17. Il est à noter que les androgènes servent de substrats pour la synthèse des estrogènes qui soutiennent la production de P par l’ovaire via un mécanisme d’intracrinologie (Barkley, Geschwind et al. 1979). Les niveaux circulants de P augmentent au cours des premiers jours de la gestation et manifestent une faible fluctuation entre les JG 5 et 9. En général, la concentration plasmatique augmente jusqu’en fin de gestation et diminue de façon marquée à partir du JG 18 et ce, jusqu’au moment de la parturition. Le patron de sécrétion de la P est similaire à E2 c’est-à-dire qu’il augmente à
partir de la mi-gestation et diminue peu avant la parturition. Chez l’humain, un rapport 1 :10 en faveur de la progestérone est conservé tout au long de la grossesse (Tulchinsky, Hobel et al. 1972). En général, des niveaux élevés d’hormones stéroïdiennes, plus particulièrement d’androgènes et d’estrogènes, sont associés avec des performances reproductives élevées. Également, il a été démontré, chez les souris ayant de petites portées, que la survie embryonnaire pouvait être améliorée si de la progestérone était administrée tôt en gestation.
P ro g es té ro n e (ng /m l) Jours de gestation E st ra d io l (p g /m l) T es to st ér o n e (p g /m l) Jours de gestation Jours de gestation
Figure 4. Profil des stéroïdes maternels circulant dans le plasma chez le modèle murin. Tiré de (Barkley, Geschwind et al. 1979).
Les souris proviennent du croisement de 4 lignées pures (C57BL/6J, AKR/J, C3H/J, DBA/2J).P : parturition; C : lignée contrôle ; CN : lignée avec petites portées; S1 : lignée avec grandes portées; G : lignée avec recouvrement rapide de la perte de poids après le sevrage.
1.2.2. Stéroïdes circulants fœtaux
Chez les rongeurs, il est connu que la majeure partie de E2 qui se retrouve dans le plasma
fœtal et maternel est non-conjugué (de Lauzon, Uhrich et al. 1974). Selon une étude menée par Habert et ses collègues, les niveaux circulants de E2 fœtaux chez les ratsne sont pas
différents entre les sexes, c’est-à-dire constants entre les JG 17 et 20, augmentant au JG 21 et toujours plus élevés qu’au niveau maternel (Habert and Picon 1984). Les niveaux de E2
plus élevés, observés chez les fœtus, pourraient être expliqués par des concentrations accrues de protéines de liaison plasmatiques. Boucher et ses collègues (Boucher, Provost et al. 2010) ont mesuré les niveaux de E2 se retrouvant dans les poumons fœtaux ainsi que les
pattes postérieures sans peau chez la Balb/C entre le jour 16.5 et le jour postnatal (PN) 30. Les pattes postérieures excluant la peau ont servis de tissu de référence. Leurs résultats sont semblables à ceux qui ont été publiés sur le rat par Habert (Habert and Picon 1984) et sur la souris par Barkley (Barkley, Geschwind et al. 1979). Également, une différence sexuelle a été observée dans les niveaux de T et d’androstènedione alors que ce n’était pas le cas pour E2.
Chez le rat, les niveaux de T sont au moins quatre fois plus élevés chez les fœtus mâles (niveau maximal au JG 18) que chez les femelles, dont les niveaux se rapprochent plus de ceux maternels (Habert and Picon 1984). Baum et ses collègues ont démontré que le niveau d’androgènes, contenu dans les fœtus rats mâles (extraits totaux) et femelles, était significativement plus élevé aux JG 18 et 19 (Baum, Woutersen et al. 1991). Ces résultats concordent avec ceux de Weisz et Ward effectués en 1980 (Weisz and Ward 1980) avec une différence entre les sexes observée à ces mêmes jours. Fait intéressant, chez la souris, plusieurs études rapportent des différences dans les niveaux de T en fonction du positionnement relatif des foetus et du sexe fœtal. Effectivement, il a été démontré que le niveau de T contenue chez les fœtus femelles situés près des mâles, dans l’utérus, était plus élevé comparativement à ceux n’ayant que des voisins féminins au JG 17 (vom Saal and Bronson 1980).
1.3. Le poumon
1.3.1. Développement pulmonaire
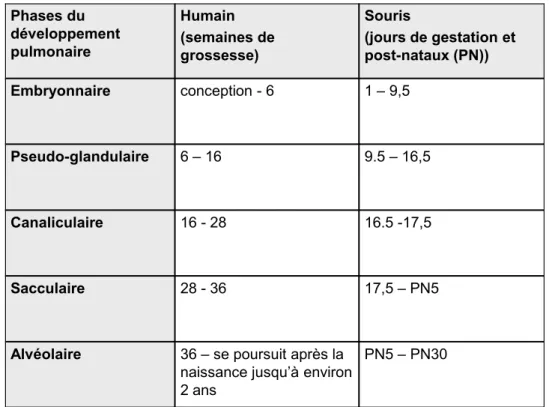
Le développement pulmonaire est un long processus. Chez l’humain, il débute environ 4 semaines après la conception et peut s’étendre jusqu’à l’âge de deux ans (Laudy and Wladimiroff 2000). Chez la souris, il débute entre le 1ière et la 9ième semaine de gestation et peut s’étendre jusqu’à 30 jours après la naissance (Warburton, Schwarz et al. 2000). Ce processus a été subdivisé en cinq différents stades qui se chevauchent tout au long de sa durée: embryonnaire, pseudo-glandulaire, canaliculaire, sacculaire et alvéolaire/microvasculaire. Le tableau 1 situe les stades du développement pulmonaire humain et murin dans le temps. L’initiation et la progression de ces stades sont sous le contrôle de plusieurs éléments tels que des facteurs de transcription et de croissance, des molécules de la matrice extracellulaire, des intégrines et des molécules d’adhésion intercellulaire. Les hormones stéroïdiennes telles que les glucocorticoïdes, les estrogènes et les androgènes exercent également une influence sur la maturation pulmonaire. Le poumon humain est constitué de 3 lobes droits et 2 lobes gauches, alors que chez la souris, on retrouve 1 seul lobe gauche et 4 lobes droits.
Tableau 1. Phases du développement pulmonaire humain et murin Phases du développement pulmonaire Humain (semaines de grossesse) Souris (jours de gestation et post-nataux (PN)) Embryonnaire conception - 6 1 – 9,5 Pseudo-glandulaire 6 – 16 9.5 – 16,5 Canaliculaire 16 - 28 16.5 -17,5 Sacculaire 28 - 36 17,5 – PN5
Alvéolaire 36 – se poursuit après la
naissance jusqu’à environ 2 ans
PN5 – PN30
(Laudy and Wladimiroff 2000; Warburton, Schwarz et al. 2000)
1.3.1.1. Stades du développement pulmonaire fœtal
Stade embryonnaire
Chez l’humain, ce stade se situe entre le début de la conception et la 6ième semaine de grossesse (Laudy and Wladimiroff 2000) et chez la souris, entre le début de la gestation et le JG 9,5 (Warburton, Schwarz et al. 2000). Le développement pulmonaire est entamé par la formation du sillon laryngotrachéal. En l’espace de quelques jours, un bourgeon se forme à sa partie distale et mène à l’ébauche pulmonaire. Ce dernier se fractionnera de manière dichotomique et, ensuite, surviendront les divisions subséquentes et asymétriques des bourgeons endodermiques à l’origine des bronches secondaires (ou lobaires). La formation de ces bourgeons et leurs nombres respectent donc les mêmes proportions que les lobes pulmonaires autant chez l’humain que la souris. La segmentation des différents lobes pulmonaires formés marque la fin du stade embryonnaire (Laudy and Wladimiroff 2000).
Stade pseudo-glandulaire
Il s’opère entre la 6ième et la 16ième semaine de grossesse chez l’humain (Laudy and Wladimiroff 2000) et, entre les JG 9.5 et 16.5 chez la souris (Warburton, Schwarz et al. 2000). À ce stade, la totalité des voies conductrices de l’air, jusqu’aux bronchioles terminales, seront mises en place. En premier lieu, la principale voie de conduction est revêtue d’un épithélium à cellules prismatiques, précurseurs des cellules épithéliales ciliées et des cellules sécrétrices. Au cours des dernières semaines de cette période, l’épithélium, situé au niveau des bronches pulmonaires, se différencie en cellules ciliées et en cellules gobelets ou caliciformes. Le cartilage et le muscle lisse se retrouveront dans la paroi des bronches et la différenciation pulmonaire se poursuivra de manière centrifuge (Laudy and Wladimiroff 2000). À la fin de ce stade, les précurseurs des pneumocytes sont détectables au niveau de l’épithélium.
Stade canaliculaire
Chez l’humain, le stade canaliculaire se situe entre la 16ième et la 28ième semaine de grossesse (Laudy and Wladimiroff 2000), alors que chez la souris c’est entre les JG 16,5 et 17,5 (Warburton, Schwarz et al. 2000). Au début de la phase canaliculaire, le patron des ramifications des voies aériennes est complet et le poumon est vascularisé. Le tissu interstitiel diminue, la croissance des capillaires augmente et les cellules pneumocytes de type I, spécialisées dans les échanges gazeux, se différencient en cellules pneumocytes de type II qui sont responsables de la production de surfactant (Laudy and Wladimiroff 2000). C’est au cours de ce stade que débute la sécrétion du surfactant pulmonaire par les PTII, parallèlement à l’accroissement de la surface des voies aériennes (Delacourt, Jarreau et al. 2003).
Stade sacculaire
Chez l’humain, ce stade se situe entre la 28ième et la 36ième semaine de grossesse (Laudy and Wladimiroff 2000), alors que chez la souris, c’est entre les JG 17,5 et PN 5 (Warburton, Schwarz et al. 2000). Cette phase est caractérisée par un changement dans l’apparence du poumon. Il y a une diminution marquée du tissu interstitiel et un amincissement net des murs de l’espace aérien. Survient également la formation des alvéoles pulmonaires, des
saccules terminales et des septa constituant les conduits alvéolaires et les sacs alvéolaires. Il est à noter que la formation des septa débute dans la phase sacculaire mais qu’elle ait surtout lieu dans la phase alvéolaire. Ensuite, une croissance extensive du poumon a lieu jusqu’à l’âge adulte. Notons, que c’est entre la 32ième et la 36ième semaine de grossesse, chez l’humain, que les PTII sont complètement matures. Au moment de la naissance, à la fin du stade sacculaire, toutes les générations de l’arbre respiratoire conducteur et parenchymateux sont formées (Laudy and Wladimiroff 2000).
Stade alvéolaire/microvasculaire
Chez l’humain, ce stade se situe entre la 36ième semaine de grossesse et continue après la naissance (Laudy and Wladimiroff 2000). Chez la souris, c’est entre le 5ième et le 30ième jour suivant la naissance (Warburton, Schwarz et al. 2000). Ce stade n’est complété qu’à la 8ième année de vie chez l’humain mais présente une augmentation prononcée du nombre d’alvéoles dès les 2 premières années de vie. Un amincissement de la barrière hémato-gazeuse, une augmentation de la production de surfactant et des embranchements progressifs des voies respiratoires ont lieu à ce stade. Il est à noter que l’alvéolarisation est accompagnée de la progression microvasculaire et que ces deux processus sont étroitement liés.
1.3.1.2. Surfactant pulmonaire : composition et fonction
Le surfactant est un mélange complexe de lipides, majoritairement de phospholipides, et de protéines (Ballard 1989). Le dipalmitoylphosphatydilcholine (DPPC) représente la majeure partie des phospholipides. Les protéines constituant le mélange peuvent être classées en deux différents groupes : 1) les protéines hydrophiles, SP-A et SP-D et; 2) les protéines hydrophobes, SP-B et SP-C (Parmigiani, Solari et al. 2005). Ce dernier groupe accroît considérablement le taux de propagation des phospholipides tensio-actifs. Il a été démontré que SP-B était nécessaire à la survie de l’individu (Klein, Thompson et al. 1998). En effet, une insuffisance respiratoire est observée chez les souris déficientes en SP-B. De même, chez l’humain, une telle défaillance peut mener au syndrome de détresse respiratoire chez les nouveau-nés. Les protéines SP-A et SP-D, à défaut d’être importantes dans la formation
du surfactant, sont plutôt reconnues pour leurs propriétés immunologiques. SP-A est la protéine du surfactant la plus abondante (Bolt, van Weissenbruch et al. 2001).
Le surfactant, élément indispensable à la respiration, est nécessaire afin de réduire la tension de surface à l’interface air-liquide des alvéoles et d’éviter le collapsus pulmonaire à la fin de l’expiration. Sa production se fait par la maturation des cellules épithéliales de type II (PTII) qui demande une communication cellule-cellule avec les fibroblastes et fait intervenir des facteurs paracrines. Une fois, les cellules matures, les fibroblastes et les facteurs paracrines deviennent inutiles. Il a été démontré que les glucocorticoïdes (Roberts and Dalziel 2006) et les estrogènes (Adamson, Bakowska et al. 1990) accéléraient la montée de la production de surfactant alors que les androgènes (Hanley, Rassner et al. 1996) ralentissaient ce processus. Chez la souris, la montée du surfactant se fait au JG 17,5 (Nielsen 1985), tandis que chez l’humain c’est plutôt entre la 24ième et la 35ième semaine de grossesse (Mendelson and Boggaram 1990). Une carence en surfactant peut mener à un syndrome de détresse respiratoire (SDR).
1.3.2. Implication des hormones stéroïdiennes dans le développement
pulmonaire
Cette section présentera l’impact qu’ont les différentes hormones stéroïdiennes sur le développement pulmonaire. Il est à noter que les glucocorticoïdes (Roberts and Dalziel 2006) et les estrogènes (Adamson, Bakowska et al. 1990) ont un effet positif sur la production de surfactant à l’inverse des androgènes (Hanley, Rassner et al. 1996).
1.3.2.1. Androgènes
Une différence sexuelle en surfactant est présente lors du développement pulmonaire fœtal. En effet, la production de surfactant est devancée chez les femelles comparativement aux mâles (Torday and Nielsen 1987) ce qui justifie l’incidence du SDR en faveur des mâles (1,7 :1) (Farrell and Avery 1975). Cette différence sexuelle, survenant lors d’une courte période de temps en fin de gestation, pourrait être attribuée aux niveaux élevés d’androgènes chez les mâles (Nielsen, Zinman et al. 1982). Ils réduisent la production du surfactant en ralentissant la sécrétion des facteurs de maturation épithéliaux par les
fibroblastes (Torday 1985). Ce processus serait médié par la liaison des androgènes à leur récepteur, présent dans les poumons fœtaux (Sultan, Migeon et al. 1980) (Nielsen 1985). Les androgènes modulent la maturation du poumon. Effectivement, l’utilisation exogène des androgènes dans les explants de poumons humains et les modèles animaux a révélé qu’ils diminuaient la production de lipides lors de la montée du surfactant. De plus, le ratio phosphatidylcholine/sphingomyéline du liquide amniotique, indicateur de la maturité pulmonaire, est augmenté chez les souris Tfm (souris qui ne possèdent pas de récepteur aux androgènes (AR) fonctionnel) ce qui montre que les effets des androgènes sur la maturation pulmonaire auraient lieu par un mécanisme dépendant de AR (Nielsen 1985). Il est à noter que les souris mâles qui portent le gène Tfm ont des niveaux de surfactant augmentés comparativement aux femelles et ce, pour un temps de gestation similaire (Nielsen 1985). D’un autre côté, l’administration de flutamide augmenterait la production des phospholipides du surfactant chez les fœtus mâles (Torday 1990). D’autres études ont également démontré que les androgènes pouvaient inhiber, in vitro, l’effet stimulateur des corticoïdes sur la synthèse de surfactant (Torday 1985). Chez la souris, plusieurs gènes exprimés dans le poumon sont impliqués dans le métabolisme des androgènes et sont plus spécifiquement régulés au JG 17.5 en parallèle avec l’émergence des cellules PTII matures (Provost, Simard et al. 2004).
1.3.2.2. Glucocorticoïdes
Au cours du troisième trimestre de la grossesse, le taux de cortisol dans le liquide amniotique augmente parallèlement avec la sécrétion du surfactant (Saizou, Sachs et al. 2005). Les corticoïdes sont également élevés dans le sang du cordon, à la naissance, en réponse au travail et au stress de l’accouchement. Leurs principaux effets sur le poumon fœtal sont : la différenciation des cellules mésenchymateuses, l’augmentation du nombre d’alvéoles, l’amélioration des fonctions respiratoires, l’élimination du liquide intra-pulmonaire à la naissance et l’induction de la synthèse des composants du surfactant par les PTII, pour ne nommer que ceux-ci (Saizou, Sachs et al. 2005). Les corticoïdes agissent suite à la liaison avec leur récepteur et peuvent également avoir un effet de maturation sur d’autres tissus tels que le foie, l’intestin, la peau, le rein, le cerveau et le système
cardio-La connaissance du rôle des corticoïdes endogènes a permis de mettre en place un traitement exogène anténatal favorisant la maturation pulmonaire. Les bénéfices de la corticothérapie anténatale, offerte aux mères en risque d’accoucher prématurément, ont été démontrés pour la première fois vers la fin des années 1960 par Liggins et Howie (Liggins 1968; Liggins 1969; Liggins and Howie 1972). Leurs études ont démontré que l’administration de betaméthasone ou dexaméthasone aux femmes, en risque d’accoucher prématurément, diminuait significativement l’incidence du syndrome de détresse respiratoire du nouveau-né et par conséquent le taux de mortalité (Liggins and Howie 1972).
L’utilisation de glucocorticoïdes synthétiques est plus avantageuse en raison de la durée d’action plus longue et l’affinité pour le récepteur supérieure. De plus, l’activité anti-inflammatoire est davantage prononcée et les propriétés minéralocorticoïdes sont diminuées ou nulles comparativement aux glucocorticoïdes naturels. La betaméthasone est priorisée puisque les risques de problèmes neurologiques sont moins élevés (Sweet, Bevilacqua et al. 2007).
Plusieurs interrogations demeurent concernant l’utilisation des glucocorticoïdes en tant que traitement anténatal. Les effets de l’utilisation de doses multiples (Sweet, Bevilacqua et al. 2007), le meilleur moment pour son administration (Wapner 2004) et les effets sur la morphologie pulmonaire (Valencia, Beharry et al. 2003; Sweet, Huggett et al. 2008) en sont quelques exemples. Notons également que certains fœtus ne répondent pas à la thérapie anténatale actuelle.
1.3.2.3. Estrogènes
De multiples études ont démontré que les estrogènes avaient un effet positif sur le développement pulmonaire (Beyer, Kuppers et al. 2003) (Khosla, Smith et al. 1981; Thuresson-Klein, Moawad et al. 1985). Ces derniers exercent la plupart de leurs effets via les récepteurs ERα et ERß. Ces deux récepteurs sont présents dans le poumon, ERß étant plus abondant (Couse, Lindzey et al. 1997). Il a été prouvé qu’il y avait une augmentation de l’ARNm de ERα, ERß et du récepteur à la progestérone (PR) dans le poumon fœtal murin alors qu’en postnatal et chez l’adulte surviendrait plutôt une diminution significative
(Beyer, Kuppers et al. 2003). Chez la souris adulte, le nombre d’alvéoles serait plus élevé chez les femelles que chez les mâles, ceci étant causé par l’effet des estrogènes par l’intermédiaire du récepteur ERß (Patrone, Cassel et al. 2003). Massaro et ses collègues suggèrent qu’une délétion génétique des récepteurs ERα ou ERß chez les souris diminuerait le nombre d’alvéoles en plus d’augmenter leur grosseur, ce changement étant plus prononcé chez les femelles que chez les mâles (Massaro and Massaro 2006). Également, il a été suggéré que l’altération dans la production de surfactant et dans la structure alvéolaire survenant chez les souris déficientes en ERß serait médié par PDGF-A (platelet-derived
growth factor A) et GM-CFS (granulocyte/macrophage colony-stimulating factor)
(Patrone, Cassel et al. 2003). En fait, PDGF-A et GM-CFS constituent d’importants facteurs impliqués dans la formation et la production de surfactant, contrôlés au niveau transcriptionnel par ERß.
Les effets stimulateurs et les inhibiteurs des estrogènes sur le poumon ont été étudiés dans quelques systèmes. Chez les souris adultes, une ovariectomie résulterait en la perte d’alvéoles en l’espace de 3 semaines. L’injection d’estrogènes, chez ces animaux, induirait la régénération des alvéoles (Massaro and Massaro 2004). Des études effectuées par Trotter et ses collègues (Trotter, Ebsen et al. 2006), ont établi que les antagonistes, à P et E2,
entraînaient une diminution de l’alvéolarisation dès la mi-gestation chez les fœtus porcins. Aussi, il a été constaté que l’injection d’estrogènes, à des lapines ou des rates gestantes, stimulait la synthèse du surfactant chez les fœtus (Khosla, Brehier et al. 1983; Thuresson-Klein, Moawad et al. 1985). Plus précisément, les estrogènes stimuleraient la synthèse de phospholipides (Gross, Wilson et al. 1979) et la formation de corps lamellaires (Thuresson-Klein, Moawad et al. 1985).
1.3.2.4. Progestérone
Peu d’études décrivent la progestérone (P) comme ayant un effet sur le développement pulmonaire à elle seule. Jusqu’à présent, les recherches démontrent surtout les effets combinés de P et E2. Par exemple, Trotter et ses collègues (Trotter, Kipp et al. 2009) ont
étudié l’implication d’une diminution prénatale de E2 et P dans la régulation de l’expression
au développement embryonnaire du poumon et qu’il est régulé par E2 et P. Leurs résultats
ont témoigné une augmentation significative de l’ARNm de VEGF dans les fibroblastes et les PTII, suite à un traitement combinant E2 et P. Également, un accroissement significatif
de l’ARNm de SP-B et SP-C surviendrait dans les PTII.
1.4. La régulation des estrogènes par la famille des
17ß-hydroxystéroïdes déshydrogénases
Les 17ß-hydroxystéroïdes déshydrogénases sont impliquées dans la formation et l’inactivation des stéroïdes sexuels actifs comme la testostérone (T), E2 et la
dihydrotestostérone (DHT). L’activation des stéroïdes sexuels se fait via la réduction des 17-kétostéroïdes et l’inactivation via l’oxydation des 17ß-hydroxystéroïdes (Peltoketo, Luu-The et al. 1999). C’est sous la forme 17ß-hydroxystéroïde que les estrogènes et les androgènes possèdent la plus grande affinité pour leur récepteur. Certaines 17ßHSDs possèdent également des activités 3αHSD et 20αHSD. Toutes ces réactions dépendent des cofacteurs NADPH ou NADH dans le cas de la réduction, ainsi que du NADP+ ou NAD+ dans le cas de l’oxydation (Persson, Kallberg et al. 2003).
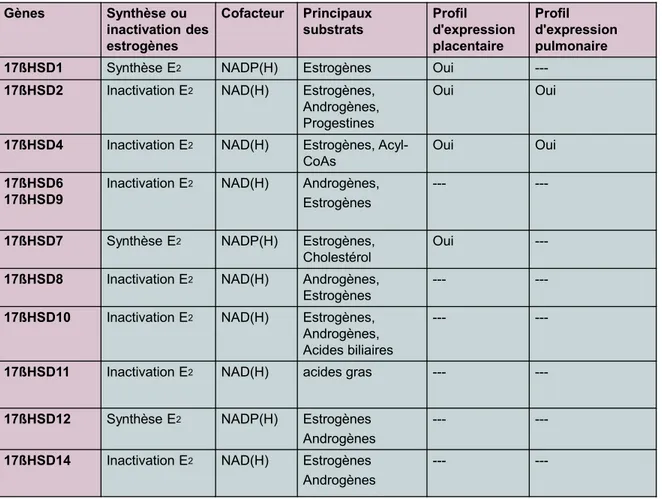
Les informations contenues dans ce sous-chapitre décrivent des propriétés générales des 17ßHSDs et ciblent surtout la régulation des estrogènes. Une attention particulière sera portée sur la 17ßHSD2 puisqu’elle fait partie intégrante de mon projet d’étude. Voir le Tableau 2 pour un résumé de l’implication des 17ßHSDs dans la régulation des estrogènes.
1.4.1. 17ßHSD1
La 17ßHSD1 a été la première enzyme à être clonée et caractérisée (Peltoketo, Isomaa et al. 1988; Luu The, Labrie et al. 1989). La forme humaine est cytosolique et sa principale fonction est de catalyser la réduction de E1 en E2. Elle est retrouvée dans les tissus
stéroïdogéniques tels que l’ovaire, le placenta et le sein (Moeller and Adamski 2006). La 17ßHSD1 humaine a été localisée au niveau des cellules de la granulosa (Sawetawan, Milewich et al. 1994) et des syncytiotrophoblastes (Bonenfant, Provost et al. 2000). Chez les rongeurs, c’est une enzyme membranaire impliquée dans la réduction des androgènes, androstènedione (Δ4) en T et des estrogènes, E1 en E2 (Peltoketo, Isomaa et al. 1988). Il est
à noter que les estrogènes forment des complexes plus stables avec cette enzyme comparativement aux androgènes
1.4.2. 17ßHSD2
La 17ßHSD2 est une enzyme microsomale, ayant une distribution tissulaire large, qui a été clonée chez l’humain, la souris et le rat. Elle se retrouve dans plusieurs tissus adultes et fœtaux tels que le placenta, l’utérus, le foie ainsi que les voies urinaires et gastriques (Peltoketo, Luu-The et al. 1999). Dans le placenta humain, le type 2 a été détecté dans les cellules endothéliales formant les vaisseaux sanguins des villosités (Bonenfant, Blomquist et al. 2000; Drolet, Simard et al. 2007). Chez le modèle murin, la 17ßHSD2 serait plus abondante dans le placenta à terme comparativement à celui en début gestation (Mustonen, Poutanen et al. 1997). Cette enzyme est entre autre retrouvée dans le poumon fœtal (Provost, Simard et al. 2004; Plante, Simard et al. 2009) (Simard, Plante et al.; Boucher, Provost et al. 2009). Chez l’humain et la souris, elle inactive E2, T et 5α-DHT en E1, Δ4 et
5α-androstanedione (5α-dione), respectivement. Notons que la 17ßHSD2 a une activité déshydrogénase, présente en cellules intactes, ayant des affinités semblables pour les androgènes et les estrogènes. Le cofacteur utilisé est le NADH. La 17ßHSD2 possède également une activité 20αHSD, lui permettant la transformation de la 20α-dihydroprogestérone en progestérone (Wu, Einstein et al. 1993). Le gène murin est localisé sur le chromosome 8 et occupe la position 16q24,1-2. Il possède 5 exons et une longueur de 57 kb. L’ARNm a une longueur de 1342 pb et un cadre ouvert de lecture de 1146 pb. L’ARNm encode une protéine active de 381 acides aminés ayant un poids moléculaire de 41.8 KDa. La protéine est associée avec le réticulum endoplasmique (Labrie, Luu-The et al. 2000).
1.4.2.1. 17ßHSD2 placentaire
Les niveaux sanguins de E2 augmentent continuellement tout au long de la grossesse chez
l’humain (Tulchinsky, Hobel et al. 1972). Plusieurs publications ont témoigné de l’effet néfaste d’une quantité excessive d’estrogène sur le fœtus en développement et plus tard à l’âge adulte, comme par exemple : un retard du développement fœtal, un cancer du sein ou des testicules et même la mort (Bartholomeusz, Bruce et al. 1999) (Braun, Ahlbom et al.
1995; Giusti, Iwamoto et al. 1995). Par contre, il est connu que E2 est nécessaire en fin de
gestation, au développement de plusieurs systèmes tels que la peau (Hanley, Rassner et al. 1996) et les poumons (Adamson, Bakowska et al. 1990). Le besoin fœtal en E2 semble donc
varier selon le stade de développement. Quelques études ont suggéré un mécanisme de régulation faisant intervenir la 17ßHSD2 placentaire qui pourrait expliquer les différences de concentration de E2 entrant dans la circulation fœtal en début et fin de gestation
(Tremblay and Provost 2003) (Mustonen, Isomaa et al. 1998; Drolet, Simard et al. 2007). D’un autre côté, il est également connu que les concentrations de E1 se dirigeant vers le
fœtus via la veine du cordon ombilical sont en continuelle augmentation tout au long de la grossesse (Gurpide, Marks et al. 1982). La 17ßHSD2 située dans les parois des vaisseaux du système veineux pourrait agir à titre de mécanisme de protection du fœtus contre les concentrations excessives de E2 en fin de gestation. Notons que c’est par le système
veineux ombilical que le fœtus reçoit l’oxygène. Également, en fin de gestation, dans le placenta, la 17ßHSD2 est exclusivement exprimée par les cellules endothéliales et préférentiellement au niveau des artères. Ces travaux suggèrent l’existence d’un mécanisme permettant au fœtus de recevoir la quantité de E2 nécessaire via la circulation veineuse en
fin de grossesse et limitant ce passage aux stades précoces, prévenant ainsi des effets indésirables sur le développement fœtal.
1.4.2.2. 17ßHSD2 pulmonaire
La 17ßHSD2 pulmonaire a principalement été détectée dans les fibroblastes entre les JG 15,5 et 18,5 (Provost, Blomquist et al. 2002) ainsi que dans les cellules épithéliales des conduits respiratoires entre les JG 15,5 et 17,5 (Plante, Simard et al. 2009). De plus, le gène de la 17ßHSD2 présente un pic d’expression aux JG 17,5 chez les fœtus mâles et femelles, corrélant avec l’émergence des cellules PTII (Provost, Simard et al. 2004). Comme mentionné précédemment, la 17ßHSD2 est, entre autre, impliquée dans l’inactivation de T en Δ4. La T est connue pour avoir un effet négatif sur la maturation pulmonaire et pourrait également retarder la production de facteurs paracrines menant à un retard dans la production de surfactant. Hypothétiquement, et par l’inactivation de la testostérone, la 17ßHSD2 pourrait permettre la sécrétion de ces facteurs par les fibroblastes et favoriser la
production de surfactant par les PTII contribuant ainsi à la maturation pulmonaire foetale. La 17ßHSD2 pulmonaire peut également inactiver E2 en E1.
1.4.3. 17ßHSD4
La 17ßHSD4 catalyse l’oxydation de E2 en E1, in vitro. L’expression de cette enzyme ne
serait pas seulement limitée aux tissues stéroïdogéniques. Elle est exprimée ubiquitairement dans l’organisme (Adamski, Carstensen et al. 1996) à des niveaux plus élevés dans le foie et dans les peroxysomes des cellules (Markus, Husen et al. 1995). Dans le poumon, elle se retrouve majoritairement dans l’épithélium bronchique (Peltoketo, Luu-The et al. 1999).
1.4.4. 17ßHSD6 et 17ßHSD9
Chez l’humain, la 17ßHSD6 est une enzyme membranaire exprimée dans la prostate et le foie. Elle utilise le NADH comme cofacteur et présente une activité déshydrogénase. Les androgènes sont les substrats principaux mais elle démontre tout de même une affinité plus faible pour les estrogènes. La 17ßHSD6 a 65% d’homologie avec le rétinol déshydrogénase de type 1 chez le rat (Peltoketo, Luu-The et al. 1999).
L’enzyme 17ßHSD9 est pour la souris ce qu’est la 17ßHSD6 pour l’humain. Elle participe à l’inactivation de E2 en utilisant le NADH comme cofacteur (Su, Lin et al. 1999). Elle a
également la capacité de métaboliser le rétinol et le 3α-hydroxystéroïde (Napoli 2001).
1.4.5. 17ßHSD7
La 17ßHSD7 a d’abord été clonée comme étant une protéine associée au récepteur de la prolactine (PRAP) (Duan, Linzer et al. 1996). Chez l’humain, le type 7 se retrouve en quantité plus élevée dans le placenta et dans l’ovaire. Son expression a également été détectée dans le foie et le cerveau humain (Krazeisen, Breitling et al. 1999). Chez le rat et la souris, la 17ßHSD7 est exprimée plus fortement dans l’ovaire lors de la deuxième moitié de la gestation. Cette enzyme est associée à la réduction de E1 en E2 impliquant le cofacteur