Impacts de la déficience maternelle modérée en fer
sur le développement des fonctions auditives
et
le métabolisme des acides gras et eicosanoïdes
de la progéniture
Thèse
Jean-Luc Jougleux
Doctorat en nutrition
Philosophiae doctor (Ph. D.)
Québec, Canada
RÉSUMÉ
Cette étude a pour objectif de déterminer les impacts de la l’anémie ferriprive (AF) modérée durant la gestation et la lactation, sur les fonctions neurophysiologiques des voies auditives, ainsi que sur les fonctions métaboliques de la progéniture du cochon d’Inde (Cavia porcellus). Elle s’articule selon 2 volets d’études distincts (protocoles 1 et 2), basés tant sur la composition en fer des diètes, que sur la nature des acides gras (AG) qui les composent. Ainsi, les diètes du 1er protocole sont soit suffisantes en fer (SF : 144 mg / Kg), soit déficientes en ce dernier
(DF : 11,7 mg / Kg), mais toutes deux exemptes d’AG polyinsaturés à longue chaîne (AGPI-LC) et présentant un ratio n-6:n-3 de 59:1. Dans le 2ème protocole, les diètes sont également SF (146 mg / Kg) ou DF (12,7 mg / Kg),
mais intègrent des AGPI-LC et présentent un ratio n-6:n-3 de 11:1, afin de mimer un profil d’AG proche de celui de la diète nord-américaine. La terminologie « +AGPI » (SF+AGPI et DF+AGPI) reflétera cette diète.
Les mères cobayes ont reçu leur alimentation respective durant les périodes d’habituation, reproduction, gestation et jusqu’au jour post-natal (JPN) 9. Les nouveau-nés ont été sevrés au JPN9 avec leur diète contrôle respective. Les potentiels évoqués auditifs du tronc cérébral (PEATC) et les prélèvements de tissus ont eu lieu au JPN24, moment où le statut hématologique des cobayes était restauré.
Les PEATC des fratries DF ont présenté de profondes altérations auditives périphériques, caractérisées par une perte d’audition de type neurosensorielle (affectant particulièrement les basses fréquences), associée à un retard dans la vélocité de conduction du nerf auditif et à une sur-stimulation neurale (hyperacousie, chez les femelles uniquement). Parallèlement, l’expression cérébrale de la Δ6-désaturase, et les niveaux de cyclo-oxygénase II (COX II) et de prostaglandines (PG) étaient inchangés par rapport aux fratries SF. Au niveau central (Encephalum), une incorporation importante d’AG (essentiellement sous forme d’AGPI n-6) était caractérisée au sein des phospholipides (PL) des fratries DF. Chez ces derniers, une élévation marquée des AG totaux, saturés, monoinsaturés et AGPI n-6 plasmatiques était parallèlement caractérisée.
Au sein du 2ème protocole, les fratries DF+AGPI et SF+AGPI ne présentaient pas de différence dans les temps de
transmission périphérique (nerf auditif) et plus centrale (tronc cérébral), ainsi qu’au niveau de la synchronisation neurale. Malgré une similarité avec les fratries SF+AGPI dans l’acuité auditive, une forte proportion de perte d’audition neurosensorielle s’illustrait parmi le groupe DF+AGPI. Au sein de ce dernier, l’ARNm encéphalique de la Δ6-désaturase présentait une tendance à la diminution et seule la concentration en PGE2 était significativement
réduite. Parallèlement, les AG des différents PL du cerveau apparaissaient faiblement affectés, alors que les concentrations érythrocytaires en AG totaux, AGS, AGPI-LC n-3 (dont l’ADH) étaient réduites. Les AG hépatiques ne subissaient aucun changement.
En dépit de la réplétion en fer, ces études révèlent que la magnitude des effets de la DF gestationnelle sur les altérations neurophysiologiques et biochimiques chez la progéniture est étroitement liée au métabolisme lipidique. Les variations dans le profil en AGPI-LC des diètes DF peuvent induire des altérations particulièrement marquées
ABSTRACT
This research aims to determine the impacts of a moderate iron deficiency anæmia (IDA) during gestation and lactation on neurophysiological functions of the auditory pathways, as well as metabolic functions of the offspring in the guinea pig (Cavia porcellus). This thesis consists of 2 distinct studies (protocols 1 and 2), based on both the content of iron and the nature of the fatty acids (FA) in the diets. Thus, the diets of the 1st protocol are iron
sufficient (IS: 144 mg / kg) or iron deficient (IDA: 11.7 mg / kg), but both are devoid of long chain polyunsaturated fatty acids (LC-PUFA) and have a ratio of n-6:n-3 equivalent to 59:1. In the 2nd protocol, diets are also IS
(146 mg / kg) or IDA (12.7 mg / kg), but contain LC-PUFA and have a n-6:n-3 ratio of 11:1, in order to mimic a FA profile close from the one of the Northern-American diet. The « +PUFA » terminology (SF+PUFA and IDA+PUFA) will reflect this diet.
Guinea pig dams received their respective diet during the periods of habituation, reproduction, gestation and until postnatal day (PNd) 9. Offspring were weaned at post-natal day (PNd) 9 with their respective control diet. Auditory brainstem response (ABR) and tissue samples took place at PNd24, a time point indicating when the hæmatologicalstatus of guinea pigs was restored.
The ABR from IDA siblings showed profound peripheral auditory impairments, characterized by a sensorineural hearing loss type (particularly affecting the low frequencies), associated with a delay in the conduction velocity of the auditory nerve and increased neural stimulation (hyperacusis, in females only). Furthermore, brain expression of the Δ6-desaturase, and cyclooxygenase II (COX II) and prostaglandins (PG) levels were unchanged compared with siblings IS. At the central level (Encephalum), a significant FA incorporation (mainly in the form of n-6 PUFA) was characterized in phospholipids (PL) from IDA siblings. In the latter, a marked plasma elevation of total, saturated, monounsaturated FA and n-6 PUFA was characterized in parallel.
In the second protocol, siblings IDA+PUFA and SF+PUFA showed no difference in peripheral (auditory nerve) and central (brainstem) transmission times, and in the neural synchronization. Despite a similarity with IS+PUFA siblings’ auditory acuity, a large proportion of sensorineural hearing loss was noted in the IDA+PUFA group. Within the latter, the brain Δ6-desaturase mRNA showed a trend to be decreased and only the PGE2
concentration was significantly reduced. Furthermore, FA from different brain PL appeared weakly affected,
whereas concentrations of total FA, saturated FA (SFA), n-3 LC-PUFA (including docosahexænoic acid, DHA) in erythrocytes were reduced. Liver FA underwent no change.
Despite iron repletion, these studies show that the magnitude in the impact of a gestational IDA on neurophysiological and biochemical alterations of offspring is closely related to their lipid metabolism. Changes in the offspring’s LC-PUFA profile following the gestational IDA diets may induce alterations particularly marked in their peripheral sensory organs. The mechanisms involved and their impact at the central level remain to be
TABLE des MATIÈRES
RÉSUMÉ ... iii
ABSTRACT ... v
TABLE des MATIÈRES... vii
Liste des tableaux ... xv
Liste des figures ... xix
Liste des abréviations et des sigles ... xxiii
Dédicaces ... xxix
Épigraphe ... xxxi
Remerciements ... xxxiii
Avant-propos ... xxxv
Chapitre 1. Introduction... 1
Chapitre 2. Anatomophysiologie de l’appareil auditif et principes des PEATC ... 7
2.1.Le son ... 7
2.2.Anatomie fonctionnelle ... 8
2.3.Transduction sensorielle mécano-électrique ... 10
2.4.Voies auditives primaires ... 12
2.5.Neurophysiologie des Potentiels Évoqués Auditifs du Tronc Cérébral (PEATC) ... 14
2.6.Instrumentation ... 19
2.7.Facteurs influençant les PEATC ... 20
Chapitre 3. Revue de la littérature ... 21
3.1.Épidémiologie et facteurs de risque liés à la déficience en fer ... 21
3.1.1. Définitions de la déficience en fer et de l’anémie... 21
3.1.2. Épidémiologie et prévalence ... 21
3.1.3. Étiologie et facteurs de risque ... 23
3.2.Métabolisme du fer ... 23
3.2.1. Rôles généraux du fer ... 25
3.2.2. Sources 26 3.2.3. Captation et absorption entérocytaires ... 27
3.2.3.1. Captation et transfert ... 27
3.2.3.2. Internalisation ... 28
3.2.4. Déstockage ... 28
3.2.5. Transport ... 28
3.3.Biodisponibilité du fer et états physiologiques spécifiques ... 30
3.3.1. Biodisponibilité ... 30
3.3.2. États physiologiques spécifiques ... 32
3.4.Métabolisme fœto-maternel ... 33
3.5.Cerveau, fonctions neurologiques du fer et audition ... 34
3.5.1. Homéostasie cérébrale du fer et conséquences de la déficience ... 34
3.5.2. Myélinisation et transmission cérébrale (PEATC) ... 38
3.5.2.1. Déficience en fer postnatale ... 39
3.5.2.2. Déficience en fer prénatale ... 40
3.5.3. Neurotransmetteurs ... 43
3.5.3.1. Notions générales ... 43
3.5.3.2. Neurotransmetteurs et déficience en fer ... 44
3.5.3.3. Neurotransmetteurs et système auditif (PEATC) ... 46
3.5.4. Seuils auditifs (PEATC) ... 47
3.5.5. Amplitudes (PEATC) ... 48
3.6.Fonctions du fer sur les métabolismes des eicosanoïdes et des lipides ... 48
3.6.1. Métabolisme des eicosanoïdes ... 49
3.6.1.1. Notions générales ... 49
3.6.1.2. Eicosanoïdes et déficience en fer ... 50
3.6.2. Métabolisme des lipides ... 51
3.6.2.1. Notions générales ... 51
3.6.2.2. Lipides et déficience en fer ... 52
3.7.Autre considération nutritionnelle : les acides gras essentiels ... 54
3.7.1. Généralités ... 55
3.7.2. Métabolisme fœto-placentaire ... 56
3.7.3. Allaitement ... 57
3.7.4. Fonction cérébrale et incidence des AGE ... 57
3.7.5. Effets des altérations en AGE alimentaires et PEATC ... 58
3.8.Justifications du modèle animal ... 60
3.9.Problématique ... 62
Chapitre 4. Hypothèses et objectifs de recherche ... 63
4.1.Hypothèses de recherche... 63
4.1.1. Protocole 1 : (1er volet d’étude) ... 63
4.1.2. Protocole 2 : (2ème volet d’étude) ... 64
4.2.Objectifs généraux ... 64
4.2.1. Protocole 1 : (1er volet d’étude) ... 64
4.2.2. Protocole 2 : (2ème volet d’étude) ... 65
4.3.Objectifs spécifiques ... 65
4.3.1. Protocole 1 : (1er volet d’étude) ... 65
Transition 1 ... 67
Chapitre 5. Mild iron deficiency anæmia during pregnancy and lactation in guinea pigs causes abnormal auditory function in the offspring ... 69
5.1.Résumé... 71
5.2.Abstract ... 73
5.3.Introduction ... 75
5.4.Materials and methods ... 76
5.4.1. Animals and diet ... 76
5.4.2. ABR procedure ... 77
5.4.2.1. ABR threshold (auditory acuity) ... 77
5.4.2.2. ABR Latency-Intensity (L-I) curves ... 77
5.4.3. Blood and tissue samples ... 78
5.4.4. Statistical analyses ... 78
5.5.Results ... 79
5.5.1. Maternal and offspring outcomes ... 79
5.5.2. Sibling weights ... 79
5.5.3. Hematological data ... 79
5.5.4. Auditory brainstem responses ... 80
5.5.4.1. Thresholds (auditory acuity)... 80
5.5.4.2. ABR Latency-Intensity curves ... 80
5.5.5. Corporal temperature ... 80 5.6.Discussion ... 80 5.7.Conclusion ... 83 References ... 90 Supplemental methods ... 94 Erratum ... 95 Transition 2 ... 97
Chapitre 6. Mild iron deficiency anæmia during pregnancy and lactation in guinea pigs alters amplitudes and auditory nerve velocity, but not brainstem transmission times in the offspring’s auditory brainstem response ... 99
6.1.Résumé... 101
6.2.Abstract ... 103
6.3.Introduction ... 107
6.4.Materials and methods ... 108
6.4.2.1. ABR recording ... 109
6.4.2.2. ABR Latencies (Neural Transmission Times) ... 110
6.4.2.3. PIII-NIII amplitudes. ... 110
6.4.2.4. Amplitude-intensity profiles. ... 111
6.4.3. Blood and tissue samples ... 111
6.4.4. Statistical analysis ... 111 6.5.Results ... 112 6.5.1. Hæmatological data ... 112 6.5.2. Sibling weights ... 113 6.5.3. ABR ... 113 6.5.3.1. Peak latencies ... 113
6.5.3.2. Interpeak Latencies (IPL) ... 114
6.5.3.3. PIII-NIII ABR amplitudes ... 114
6.5.3.4. Amplitude-Intensity (A-I) profiles ... 114
6.5.4. Corporal temperature ... 115
6.6.Discussion ... 115
6.7.Conclusion ... 118
References ... 128
Transition 3 ... 137
Chapitre 7. Dietary LC-PUFA in iron deficient anæmic pregnant and lactating guinea pigs induce minor defects in the offsprings’ auditory brainstem responses ... 139
7.1.Résumé ... 141
7.2.Abstract ... 143
7.3.Introduction ... 147
7.4.Materials and methods ... 148
7.4.1. Animals and Diet ... 148
7.4.2. ABR procedure ... 149
7.4.2.1. ABR recording ... 149
7.4.2.2. ABR threshold (auditory acuity) ... 150
7.4.2.3. ABR latency-intensity curves ... 150
7.4.2.4. ABR latencies (neural transmission times) ... 150
7.4.2.5. PIII-NIII amplitudes (neural synchrony) ... 151
7.4.2.6. Amplitude-Intensity profiles ... 151
7.4.3. Blood and tissue samples ... 151
7.4.4. Brain homogenization and fatty acid quantification ... 152
7.4.5. Statistical analysis ... 152
7.5.Results ... 153
7.5.1. Maternal and birthing outcomes ... 153
7.5.2. Siblings’ weight ... 153
7.5.3. Hæmatological data ... 153
7.5.4.1. Thresholds (auditory acuity)... 154
7.5.4.2. ABR L-I curves ... 154
7.5.4.3. Absolute peak latencies ... 155
7.5.4.4. Interpeak latencies ... 155
7.5.4.5. PIII-NIII ABR amplitudes (neural synchrony) ... 155
7.5.4.6. Amplitude-Intensity profiles ... 156
7.5.5. Corporal temperature ... 156
7.5.6. Brain fatty acid composition ... 156
7.6.Discussion ... 157 7.7.Conclusion ... 160 Supplemental data 1 ... 182 Supplemental data 2 ... 183 References ... 184 Transition 4 ... 195
Chapitre 8. Influence of a prenatal/early postnatal exposure to a mild iron deficient anæmic diet,with or without LC-PUFA,on fatty acid and eicosanoid metabolisms of guinea pigs during early development. ... 197
8.1.Résumé... 199
8.2.Abstract ... 201
8.3.Introduction ... 205
8.4.Materials and methods ... 207
8.4.1. Animals and Diet... 207
8.4.2. Blood and Tissues Samples ... 208
8.4.3. Homogenization ... 208
8.4.4. Δ6-desaturase (FADS2) ... 208
8.4.4.1. RNA extraction and cDNA synthesis ... 208
8.4.1.2. Gene identification ... 209
8.4.1.3. qPCR ... 209
8.4.5. Western blot and Prostaglandins ... 210
8.4.6. Separation of phospholipid classes and FA quantification ... 210
8.4.7. Statistical analysis ... 211
8.5.Results ... 211
8.5.1. Maternal and birth outcomes ... 211
8.5.2. Siblings’ weight ... 212
8.5.3. Hæmatological data ... 212
8.5.4. Cerebral Δ6-desaturase expression (FADS2) ... 213
8.5.5. Cerebral COX II and Prostaglandins ... 213
8.5.6. Brain phospholipids and fatty acid composition ... 214
8.5.7. Plasma fatty acid composition ... 214
8.6.Discussion ... 216
8.7.Conclusion ... 219
References ... 239
Chapitre 9. Discussion ... 249
9.1.Résumé et discussion relative aux résultats obtenus ... 249
9.1.1. Étude neurophysiologique et anémie ferriprive (absence d’AGPI-LC et ratio n-6:n-3 = 59:1) ... 252
9.1.1.1. Acuité auditive (seuils auditifs) ... 252
9.1.1.2. Vélocité de conduction (temps de latences absolues et temps de transmission du tronc cérébral) ... 254
9.1.1.3. Recrutement et synchronisation neurales (amplitudes) ... 255
9.1.2. Étude neurophysiologique et anémie ferriprive (présence d’AGPI-LC et ratio n-6:n-3 = 11:1) ... 256
9.1.2.1. Acuité auditive (seuils auditifs) ... 257
9.1.2.2. Vélocité de conduction (temps de latences absolues et temps de transmission du tronc cérébral) ... 258
9.1.2.3. Recrutement et synchronisation neurales (amplitudes) ... 259
9.1.3. Étude biochimique et anémie ferriprive (absence d’AGPI-LC et ratio n-6:n-3 = 59:1) ... 260
9.1.3.1. AG cérébraux totaux ... 260
9.1.3.2. AG des phospholipides cérébraux et expression de la Δ6-désaturase ... 261
9.1.3.3. AG totaux hépatiques et plasmatiques ... 261
9.1.3.4. AG totaux érythrocytaires ... 263
9.1.3.5. COX II et prostaglandines ... 263
9.1.4. Étude biochimique et anémie ferriprive (présence d’AGPI-LC et ratio n-6:n-3 = 11:1) ... 263
9.1.4.1. AG cérébraux totaux ... 264
9.1.4.2. AG des phospholipides cérébraux et expression de la Δ6-désaturase ... 264
9.1.4.3. AG totaux hépatiques ... 265
9.1.4.4. AG totaux érythrocytaires et plasmatiques ... 265
9.1.4.5. COX II et prostaglandines ... 266
9.2.Limites des études ... 267
9.3.Perspectives futures ... 270
Chapitre 10. Conclusion ... 273
Liste des tableaux
Chapitre 3. Revue de la littérature
Tableau 1 : différents stades progressifs de la déficience en fer chez une femme adulte. ... 22 Tableau 2 : liste des facteurs de risque de la déficience en fer. ... 24 Tableau 3 : sites et mécanismes mis en jeu dans le métabolisme du fer ... 36
Chapitre 5. Publication 1
Table 1. Maternal and birth outcomes for IS and IDA guinea pig dams and pups ... 85
Chapitre 6. Publication 2
Table 1. ABR I-IV (at 80 dB) and I-III (at 100 and 80 dB) inter-peak latency (IPL) outcomes as
functions of diet group and tone pips of various frequencies ... 120
Table 2. Detailed statistical outcomes of repeated measures ANOVA Group Sex Intensity, for Amplitude-Intensity (A-I) profiles ... 121
Suppl. Table 1. Siblings’ data matrix used for ANOVA calculations, including the Sex as a
significant variable ... 125
Suppl. Table 2. Siblings’ data matrix used for ANOVA calculations, excluding the Sex as a
significant variable ... 125
Chapitre 7. Publication 3
Table 1. Maternal and birth outcomes for the IS+PUFA and IDA+PUFA guinea pig dams and
pups ... 162
Table 2. ABR I-IV (at 80 dB) and I-III (at 100 and 80 dB) inter-peak latency (IPL) outcomes, as
functions of Groups and Tone Pips of various Frequencies. ... 163
Table 3. Fatty acid composition (% of total brain FA) of the Encephalum (Cerebrum,
Cerebellum and brainstem) of guinea pigs born from IS+PUFA and IDA+PUFA dams ... 164
Suppl. Table 1. Composition of IS+PUFA and IDA+PUFA guinea pig diets (g/kg of diet) ... 171 Suppl. Table 2. Fatty acid composition of IS+PUFA and IDA+PUFA guinea pig diets (% of FA
Suppl. Table 3. Composition of IS and IDA guinea pig diets (g/kg of diet) ... 173 Suppl. Table 4. Fatty acid composition of IS and IDA guinea pig diets (% of FA ± SEM) ... 174 Suppl. Table 5. Detailed statistical outcomes of repeated measures ANOVA Group Sex
Intensity, for A-I profiles ... 175
Suppl. Table 6. Brains’ weight (g) and fatty acid (FA) composition (µg/g brain) of the
Encephalum (Cerebrum, Cerebellum and brainstem) of guinea pigs born from IS+PUFA and IDA+PUFA dams ... 176
Suppl. Table 7. Brains’ weight (g) and fatty acid (FA) composition (µg/g brain) of the
Encephalum (Cerebrum, Cerebellum and brainstem) of guinea pigs born from IS and IDA dams ... 177
Suppl. Table 8. Fatty acid (FA) composition (% of total brain FA) of the Encephalum
(Cerebrum, Cerebellum and brainstem) of guinea pigs born from IS and IDA dams... 178
Chapitre 8. Manuscrit 4
Table 1. Nutritional composition of guinea pig diets (g/kg of diet) in Experiment 1 (IS vs IDA)
and Experiment 2 (IS+PUFA vs IDA+PUFA)... 223
Table 2. Fatty acid composition of guinea pig diets in Experiment 1 and 2 ... 224 Table 3. Maternal and birth outcomes for the Experiments 1 and 2 guinea pig dams and pups .... 225 Table 4. FA proportion (%) of the Encephalum (Cerebrum, Cerebellum and brainstem) PC, PE,
PI and PS of IS and IDA sibling in Experiment 1 ... 226
Table 5. FA proportion (%) of the Encephalum PC, PE, PI and PS of IS+PUFA and IDA+PUFA
sibling in Experiment 2 ... 227
Table 6. Total FA proportion (%) of the plasma, RBC and liver of IS and IDA guinea pig sibling,
in Experiment 1 ... 228
Table 7. Total fatty acid proportion (%) of the plasma, RBC and liver of IS+PUFA and
IDA+PUFA guinea pig sibling, in Experiment 2 ... 229
Suppl. Table 1. Fatty acid composition (µg/g brain) of the Encephalum (Cerebrum,
Cerebellum and brainstem) PC, PE, PI and PS of IS and IDA guinea pigs sibling in Experiment 1. ... 234
Suppl. Table 2. Fatty acid composition (µg/g brain) of the Encephalum (Cerebrum,
Cerebellum and brainstem) PC, PE, PI and PS of IS+PUFA and IDA+PUFA guinea pigs sibling in Experiment 2. ... 235
Suppl. Table 3. Fatty acid composition of the plasma, RBC (µg/ml) and liver (µg/g) of IS
Liste des figures
Chapitres 1, 2 et 3. Introduction, neurophysiologie de l’appareil auditif et revue de la littérature
Figure 1 : voie biochimique de la conversion des acides gras essentiels ... 4 Figure 2 : schématisation du principe de fréquence ... 7 Figure 3 : vue d'une cochlée de rat par microscopie électronique à balayage. La capsule
osseuse, la strie vasculaire et la membrane tectorielle ont été ôtées, permettant de visualiser les 3 spires (enroulements) de la membrane basilaire soutenant l’organe de Corti ... 9
Figure 4 : coupe transversale de la cochlée (A), représentant le canal cochléaire, les rampes
vestibulaire et tympanique, ainsi que les ganglions cochléaires et le nerf auditif. La coupe transversale d’un enroulement de la cochlée (B) permet d’identifier le
canal cochléaire riche en endolymphe, délimité par la lame réticulaire recouvrant l’organe de Corti, par la membrane de Reissner et par le mur latéral.. ... 9
Figure 5 : microscopie électronique à balayage des cellules ciliées (A) internes et externes à la
surface de l’organe de Corti. Coupe transversale d’un enroulement de cochlée (B) de cobaye montrant l’organe de Corti détaché de sa membrane tectorielle, la membrane de Reissner, ainsi que le mur latéral. ... 10
Figure 6 : schématisation du codage des fréquences de la membrane basilaire (organisation
tonotopique)... 11
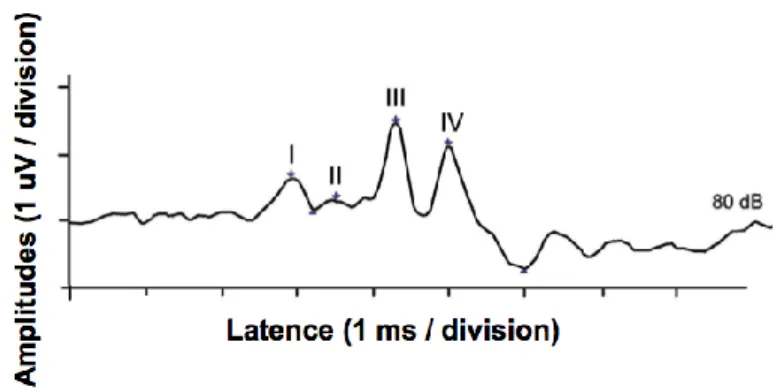
Figure 7 : représentation des voies auditives primaires. ... 13 Figure 8 : tracé de PEATC, à l’intensité de 80 dB, identifiant les 4 noyaux relais (nuclei) le long
des voies auditives. ... 16
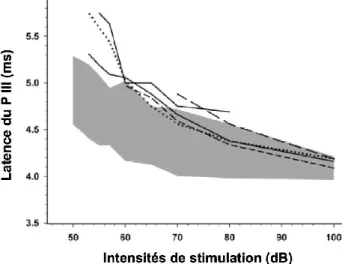
Figure 9 : exemple de profils individuels des latences du Pic III en fonction des intensités
(profils L-I), caractéristiques d’une perte neurosensorielle, chez 5 animaux. ... 17
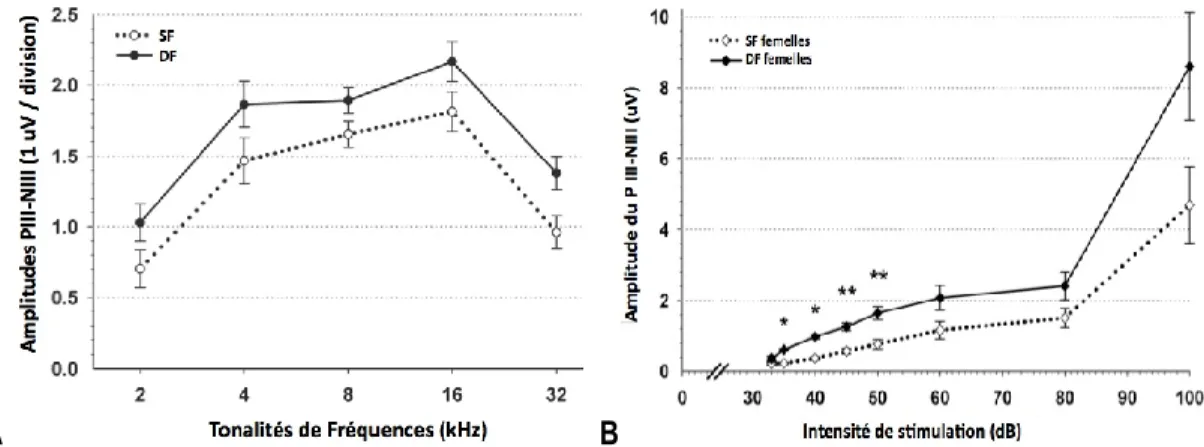
Figure 10 : exemple d’analyse des amplitudes du pic III en fonction des fréquences (A). En (B),
analyse d’amplitude en fonction des intensités, définie sur une fréquence spécifique . ... 18
Figure 11 : montage de l’instrumentation de mesures des PEATC à l’intérieur de la chambre
insonorisée (A). En (B), vue rapprochée du positionnement de l’embout auditif et des microélectrodes, au niveau des mastoïdes et du vertex du cobaye. ... 19
Figure 12 : atome de fer dans son anneau porphyrique (hème de l’hémoglobine). ... 25 Figure 13 : mécanismes mis en jeu lors de l’absorption, du déstockage et du transport du fer
Chapitre 5. Publication 1
Figure 1 : ABR traces in response to 2 kHz tone pips of descending intensities from a
representative IS pup (A) and from an IDA guinea pig pup (B) with an elevated threshold. ... 86
Figure 2 : Hct of guinea pigs fed an ISD or IDD during gestation and lactation. ... 87 Figure 3 : ABR thresholds in IS and IDA guinea pigs in response to varying tone pip
frequencies. ... 88
Figure 4 : PIII latency-intensity curves of offspring, at 32 kHz tone pip frequency. ... 89
Chapitre 6. Publication 2
Figure 1 : ABR Peak I latency of IS and IDA guinea pigs at 100 dB (A) and 80 dB (B),
as functions of group and tone pip frequency. ... 122
Figure 2 : ABR PIII-NIII amplitudes of IDA and IS guinea pigs in response to various tone
pips frequencies, at 100 dB (A) and 80 dB (B). ... 123
Figure 3 : Simple main effect decompositions of ABR amplitude-intensity (A-I) curves of IS
and IDA male (A) and female (B) guinea pigs in response to 4 kHz tone pips frequency. ... 124
Suppl. Figure 1 : ABR absolute peak II (A,B), peak III (C,D) and peak IV (E) latencies of IS
and IDA guinea pigs at 100 dB (A,C) and 80 dB (B,D,E), as functions of diet group and various tone pip frequencies. ... 126
Suppl. Figure 2 : A-I profiles of IS and IDA guinea pigs at 32 kHz (A,B), 16 kHz (C,D), 8 kHz
(E,F) and 2 kHz (G,H), as functions of diet group and sex (A,C,E,G: males and B,D,F,H: females). ... 127
Chapitre 7. Publication 3
Figure 1 : Dams’ Hct as function of Groups during gestation and lactation. ... 165 Figure 2 : ABR thresholds (dB) as functions of guinea pigs’ Groups, in response to various
Tone Pip Frequencies (kHz). ... 166
Figure 3 : PIII L-I curves of IS+PUFA (A,C) and IDA+PUFA (B,D) guinea pigs, in response to
various intensities (dB), at 4 kHz (A,B) and 2 kHz (C,D) tone pip frequencies. The shaded region is the normal range derived from the IS+PUFA group’s data... 167
Figure 4 : ABR peak II latencies, as functions of Group, Sex, and Tone Pip Frequency,
Figure 5 : ABR PIII-NIII amplitude (μV), as functions of Group, in response to various tone pip
frequencies (kHz), at 100 dB (A) and 80 dB (B). ... 169
Figure 6 : Simple main effect decompositions of ABR amplitude-intensity (A-I) curves of
IS+PUFA and IDA+PUFA male (A) and female (B) guinea pigs in response to the 4 kHz tone pips frequency. . ... 170
Suppl. Figure 1 : PIII L-I curves of IS+PUFA (A,C,E) and IDA+PUFA (B,D,F) guinea pigs,
in response to various intensities (dB), at 32 kHz (A,B), 16 kHz (C,D) and 8 kHz (E,F) tone pip frequencies. The shaded region is the normal range derived from the IS+PUFA group’s data……… 179
Suppl. Figure 2 : ABR absolute Peak I (A,B), Peak III (C,D) and Peak IV (E) latencies, as
functions of Group, Sex, and various Tone Pip Frequencies, at 100 dB (A,C) and 80 dB (B,D,E). ... 180
Suppl. Figure 3 : A-I profiles of IS+PUFA and IDA+PUFA guinea pigs’ siblings at 32 kHz
(A,B), 16 kHz (C,D), 8 kHz (E,F) and 2 kHz (G,H), as functions of Group and Sex (A,C,E,G: males and B,D,F,H: females). ... 181
Chapitre 8. Manuscrit 4
Figure 1 : Dams’ Hct as function of Groups during gestation and lactation in Experiment 1 (A)
and Experiment 2 (B) ... 230
Figure 2 : Brain FADS2 transcript expression levels in IS vs IDA pups (A) and IS+PUFA vs
IDA+PUFA pups (B). FADS2 transcripts (mRNA) levels are expressed as 2-∆∆Ct
mean ratio. ... 231
Figure 3 : Brain COX II protein levels in IS and IDA siblings (A) and IS+PUFA and IDA+PUFA
siblings (B). COX II protein (72 kDa) levels are expressed as integrated density values (IDV), normalized on ß-actin (42 kDa). Representative immunoblot of the cerebral COX II protein (72 kDa), normalized on ß-actin (42 kDa), in IS vs IDA pups (C, wells 1-4 and 5-8, respectively) and IS+PUFA vs IDA+PUFA pups (D, wells 1-4 and 5-8, respectively). ... 232
Figure 4 : Brain prostaglandins E (PGE2) and F (PGF2a) concentrations in IS and IDA siblings
Liste des abréviations et des sigles
Abréviations françaisesA
AA acide arachidonique C20:4 (n-6)
AAD acide adrénique C22:4 (n-6)
ADHGL acide di-homo-γ-linolénique C20:3 (n-6)
Aα-LN acide α-linolénique C18:3 (n-3)
ADH acide docosahexænoïque C22:6 (n-3)
ADN acide désoxyribonucléique
ADP adénosine diphosphate
ADP acide docosapentænoïque C22:5 (n-6)
ADT acide docosatetrænoïque C22:4 (n-6)
AE acide eicosanoïque C20:1 (n-9)
AED acide eicosadiénoïques C20:2 (n-6)
AEP acide eicosapentænoïque C20:5 (n-3)
AET apport énergétique total
AG acide gras
AGE acide gras essentiel
AGL acide γ-linolénique C18:3 (n-6)
AGMI acide gras monoinsaturé AGPI acide gras polyinsaturé
AGPI-LC acide gras polyinsaturé à longue chaîne AGS acide gras saturé
A-I amplitude-intensité
AL acide linoléique C18:2 (n-6)
ALC acide lignocérique C24:0
AMT apport nutritionnel tolérable
AN acide nervonique C24:1 (n-9)
ANR apports nutritionnels recommandés ANREF apports nutritionnels de référence
AO acide oléique C18:0
Apo-Tf apo-transferrine
AS apport suffisant
C
CCE cellules ciliées externes CCI cellules ciliées internes CGM corps grenouillé médian
CI colliculus inférieur
COS complexe olivaire supérieur
COX cyclo-oxygénase COX I cyclo-oxygénase I COX II cyclo-oxygénase II Cyt cytochrome
D
DA dopamineE
EOAPD émission oto-acoustique par produits de distorsion
F
F ferritine Fc ferritine du cordonH
Hb hémoglobine Hct hématocriteI
INSERM institut national de la santé et de la recherche médicale IRM imagerie par résonance magnétique
IRMfc imagerie par résonance magnétique fonctionnelle des connectivités
J
JPN jour post natal
L
LL lemnisque latéral
L-I latence-intensité
M
MPE malnutrition protéino-énergétique
N
NC noyau cochléaire
NE norépinephrine
O
ON oxyde nitrique
ONS oxyde nitrique synthétase
P
P pic
PC phosphatidylcholine
PE phosphatidyléthanolamine
PEA potentiels évoqués auditifs
PEATC potentiels évoqués auditifs du tronc cérébral
PL phospholipide PG prostaglandine PGE2 prostaglandine E2 PGF2α prostaglandine F2α PI phosphatidylinositol PS phosphatidylsérine
R
rDA récepteur de la dopamine rD2 récepteur D2 de la dopamine
rTf récepteur de la transferrine RXR récepteur X des rétinoïdes
S
SER sérotonine SF suffisant(e) en ferT
Tf transferrine T3 triiodothyronine T4 thyroxineSigles et symboles chimiques Symboles alphabétiques grecs
dADP désoxyadénosine diphosphate α alpha
Fe2+ fer ferreux β bêta
Fe3+ fer ferrique ∆ delta
K+ potassium γ gamma
Na+ sodium μ micro
Ω ohm
Locutions latines et leurs abréviations
Cf. confer se référer à
continuum continuité
de facto de fait, dans les faits
e.g. exempli gratia par exemple
et al. et alii et les autres (et collaborateurs)
etc et cætera et le reste, et toutes les autres (choses)
i.e. id est c’est à dire
in fine au final, enfin, à la fin, en dernier
in situ sur le lieu même
nucleus (pl., nuclei) noyau (pl., noyaux)
per se en soi
post hoc à la suite de
via par la route, au travers de
vs versus en direction de, par rapport à
Unités de mesures C celsius dB décibel Da Dalton g gramme Hz hertz k kilo L litre M molaire m milli
ppm particule par million
s seconde
V volts
% pourcentage
Abréviations anglaises et leur traduction et abréviation françaises (lorsqu’existantes)
A
AA arachidonic acid acide arachidonique AA
ABR auditory brainstem response potentiels évoqués auditifs du tronc cérébral PEATC ANOVA analysis of variance analyse de variance
ANCOVA analysis of covariance analyse de covariance
B
BTT brainstem transmission time temps de transmission du tronc cérébral TTTC
C
CHL conductive hearing loss perte d’audition de conduction
CNS central nervous system système nerveux central SNC
COX cyclo-oxygenase cyclo-oxygénase COX
COX I cyclo-oxygenase I cyclo-oxygénase I COX I
COX II cyclo-oxygenase II cyclo-oxygénase II COX II
D
Dcytb duodenal cytochrome b cytochrome b du duodénum Dcytb DMT1 divalent metal transporter 1 transporteur de métal divalent 1 TMD 1 DHA docosahexænoic acid acide docosahexænoique ADH DNMT1 DNA methyltransferase 1 méthyltransférase 1
DOI digital object identifier identificateur numérique de l’objet DPOAE distortion product otoacoustic emission
émission oto-acoustique par produits de distorsion EOAPD
E
EDTA ethylene diamine tetraacetic acid acide éthylène diamine tétra-acétique AEDTA
EFA essential fatty acid acide gras essentiel AGE
EPA eicosapentænoic acid acide eicosapentænoique AEP
Epub electronic publication publication électronique
F
FA fatty acid acide gras AG
FABP fatty acid binding protein protéine de liaison d’acide gras FADS2 fatty acid desaturase 2 désaturase d’acide gras 2
G
Gd gestationnal day jour gestationnel JG
GdbD gestational day before delivery jour gestationnel avant la délivrance JGaD
H
Hb hemoglobin hémoglobine Hb
Hct hematocrit hématocrite Hct
HCP 1 heme carrier protein 1 protéine transporteuse de l’hème 1 HDAC1 histone deacetylase 1 déacétylase d’histone 1
HO 1 heme oxygenase oxygénase de l’hème 1 OH 1
I
ID Iron deficiency (deficient) déficience (déficient) en fer DF
IDA Iron deficiency anæmia anæmie ferriprive AF
IDD iron deficient diet diète déficiente en fer DDF
IHC inner hair cell cellules ciliées internes CCI IPL inter-peak latency latence inter-pic
IREG1 iron-regulated protein 1 protéine régulatrice du fer 1
IS iron sufficient suffisant en fer SF
ISD iron sufficient diet diète suffisante en fer DSF
L
LIP labil intracellular pool réservoir intracellulaire labile
LA linoleic acid acide linoléique AL
LC long chain chaîne longue CL
L-I latency-intensity latence-intensié
M
MANOVA multivariate ANOVA analyse de variance multivariée MANCOVA multivariate ANCOVA analyse de covariance multivariée Mbp myelin basic protein protéine de base de la myéline MeCP2 methyl-CpG binding protein 2 protéine 2 liant le site CpG-méthylé
MUFA monounsaturated FA AG monoinsaturé AGMI
N
NO nitric oxyde oxyde nitrique ON
NOS nitric oxyde synthetase oxyde nitrique synthétase ONS
O
OHC outer hair cell cellule ciliée externe CCE
P
P peak pic P
peSPL peak-equivalent sound pressure level équivalent de pic de niveau de pression acoustique
PG prostaglandin prostaglandine PG
PGE2 prostaglandin E2 prostaglandine E2 PGE2
PGF2α prostaglandin F2α prostaglandine F2α PGF2α
PL phospholipid phospholipide PL
PNd postnatal day jour postnatal JPN
PUFA polyunsaturated fatty acid acide gras polyinsaturé AGPI
PIII-NIII peak III-nadir III pic III-nadir III PIII-NIII
S
SD standard deviation écart type ET
SEM standard error of mean erreur standard de la moyenne ESM
SFA saturated FA AG saturé AGS
SNHL sensorineural hearing loss perte d’audition neurosensorielle
SOC superior olivary complex complexe olivaire supérieur COS
W
Dédicaces
À mes parents, à ma famille,
Épigraphe
Stude, non ut plus aliquid scias, sed ut mellus.
« Étudiez, non pour en savoir davantage, mais pour mieux savoir »
Sénèque
(an 4 av. à 1 ap. J.-C – 65 ap. J.-C)
Lettres à Lucilius (Epistulae morales ad Lucilium) Livre XIV, lettre LXXXIX, 23.
Remerciements
Soyons reconnaissants aux personnes qui nous donnent du bonheur ; elles sont les charmants jardiniers par qui nos âmes sont fleuries. (Les Plaisirs et les Jours)
Marcel Proust
1896
Cette thèse conclut plusieurs années de travaux et je tiens, en ces quelques lignes, à exprimer ma gratitude envers ceux qui, de près ou de loin, y ont contribué.
Mes premiers remerciements vont naturellement à France Rioux, ma directrice de recherche, pour la confiance qu’elle m’a accordée dans le cadre de ce projet, ainsi que pour ses conseils judicieux, ses encouragements et son soutien, tout au long de ces années. Je la remercie également de m’avoir donné l’opportunité de participer et assister à un congrès international et m’avoir permis d’exercer une activité de recherche parallèle à l’université d’Ottawa.
Merci à Hélène Jacques, ma directrice de thèse, pour ses conseils avisés dans la conduite de ces années de travaux, de communications, ainsi que pour son encadrement et ses conseils.
Je tiens également à adresser ma gratitude à Marc Surette, mon co-directeur de recherche et titulaire de la chaire de recherche du Canada sur le métabolisme cellulaire des lipides, pour m’avoir accueilli dans son laboratoire et m’avoir enseigné et guidé, tant par ses conseils théoriques, que pratiques, en dépit de ses nombreuses charges de travail. Un merci chaleureux aussi aux membres du laboratoire qui m’ont tant appris et su me prodiguer leur bon enseignement technique.
J’exprime également mes plus vifs remerciements aux membres du jury qui m’ont fait l’honneur d’arbitrer les derniers moments de ces études doctorales.
Merci à Sylvain Fiset pour ses conseils avisés et sa clairvoyance dans les longs dédales et méandres statistiques auxquels il a fallu faire face lors du traitement des données. Son regard critique, juste et avisé qu’il a su porter sur mes analyses et publications m’ont été précieux.
J’adresse toute ma reconnaissance à Michael Church, de l’Université Wayne State, pour son
enseignement de la technique des potentiels évoqués auditifs et ses précieux conseils. Ses compétences, sa précision, sa rigueur et son regard scientifique ont été riches d’enseignements et
resteront à mes yeux des références.
Je ne saurais oublier de remercier les organismes subventionnaires de ce projet de recherche et de mes études doctorales, soit respectivement, les Instituts de Recherche en Santé du Canada (I.R.S.C.) et le Fonds Québécois de la Recherche sur la Nature et les Technologies (F.Q.R.N.T.) et au Fonds Jean-Paul-Houle.
Puis il y a les autres, dont le nom n’apparaît pas dans cette page mais auxquels je pense et qui, de près ou de loin (bien souvent très/trop loin), m’ont apporté leur réconfort, leur soutien, leur contribution et leur amour ... merci.
Avant-propos
Cette thèse est structurée et présentée sous forme de « thèse par articles ». Elle intègre 4 publications (2 acceptées, 1 soumise et 1 en voie de soumission), pour lesquelles je suis l’auteur principal. Ce projet est dirigé par l’investigatrice principale, la Dre France Rioux, Ph.D. (Dpt des Sciences de la Nutrition, U. d’Ottawa), et est co-dirigé par les Dr(e)s Marc Surette, Ph.D. (Dpt de Chimie et Biochimie, U. de Moncton) et Hélène Jacques, Ph.D. (Dpt des Sciences des Aliments et Nutrition, U. Laval). Le Dr Sylvain Fiset, Ph.D. (Dpt d’Administration et Sciences Humaines, U. de Moncton) a supervisé les analyses statistiques. Le Dr Michael Church (Dpt of Obstetrics and Gynecology, Wayne State U., USA) m’a formé à la technique des potentiels évoqués auditifs du tronc cérébral (PEATC), ainsi qu’à l’analyse des tracés issus des enregistrements. L’ensemble des coauteurs a été impliqué dans la conception expérimentale du projet, ainsi que dans l’analyse des données, les révisions et éditions des manuscrits.
À titre personnel, j’ai administré et conduit l’élevage, ainsi que l’ensemble des soins aux animaux et ai mis en place les procédures normalisées de fonctionnement (PNF), relatives aux suivis vétérinaires. Par ailleurs, j’ai supervisé 2 étudiants du 1er cycle. Mes contributions comprennent également
l’administration des tests relatifs aux potentiels évoqués auditifs du tronc cérébral, les dissections et les prélèvements de tissus, les analyses biochimiques de ces derniers, la compilation de l’ensemble des données recueillies, les analyses statistiques, la rédaction des manuscrits, ainsi que de cette thèse. Les manuscrits acceptés, soumis et/ou en voie de soumission sont les suivants :
- Influence of a prenatal/early postnatal exposure to a mild iron deficient anæmic diet, with or without LC-PUFA, on fatty acid and eicosanoid metabolisms of guinea pigs during early development. (en voie de soumission).
- Dietary LC-PUFA in iron deficient anæmic pregnant and lactating guinea pigs induce minor defects in the offsprings’ auditory brainstem responses. Nutr Neurosci. 2014 [Epub 19 Aug 2014]. Doi: 10.1179/1476830514Y.0000000140.
- Mild iron deficiency anæmia during pregnancy and lactation in guinea pigs alters amplitudes and auditory nerve velocity, but not brainstem transmission times in the offspring’s auditory brainstem response. Nutr Neurosci. 2014;17(1):37-47.
[Epub 26 Nov 2013]. Doi: 10.1179/1476830513Y.0000000067.
- Mild maternal iron deficiency anemia during pregnancy and lactation in guinea pigs causes abnormal auditory function in the offspring. J Nutr 2011;141:1390-5.
Doi: 10.3945/jn.110.135715.
Ces travaux de recherche ont été présentés dans le cadre d’un mini-symposium et ont fait l’objet d’un résumé, tous deux arbitrés :
- Postnatal impairments of auditory acuity and neural transmission times induced by maternal iron deficiency. Federation of American Society for Experimental Biology (FASEB), Anaheim convention center (April 2010), Anaheim, CA.
Chapitre 1. Introduction
La déficience en fer (DF) est une préoccupation de santé majeure, considérée comme étant le plus commun et répandu des troubles alimentaires à l’échelle mondiale (1), avec 1 à 2 milliards de personnes affectées (2). C’est, par ailleurs, un problème de santé particulièrement important et prévalent pour les femmes enceintes, considérant la hausse de la demande alimentaire en réponse au développement fœtal. La vulnérabilité à la déficience en fer varie donc grandement selon les différents stades d’évolution des individus. Cette variation est due aux changements des capacités de stockage en fer, aux niveaux des apports alimentaires, et aux besoins relatifs à la croissance et aux pertes en fer. Les groupes les plus à risque de présenter une déficience en ce minéral sont les enfants en forte période de croissance (âgés de 6 mois, jusqu’à 5 ans) (3), les femmes en âge de procréer (4) et plus particulièrement les femmes enceintes. C’est à ce stade critique, de fort anabolisme tant maternel que fœtal, que la requête en fer s’avère essentielle ; le développement placentaire et ombilical, l’entretien et augmentation de la masse érythrocytaire, la synthèse embryologique, la lactation induisent autant de besoins qu’il convient de combler. Malheureusement, les régimes alimentaires de beaucoup de femmes enceintes ne répondent pas à cette augmentation des exigences en fer, avec pour conséquence, un risque élevé de développer une déficience en fer.
Bien que l’étiologie de cette dernière soit multiple, l’Organisation Mondiale de la Santé estime que 50 % de l’ensemble des cas d'anémies liées à la grossesse sont le résultat d'une déficience en fer, principalement d’origine alimentaire (5). On retrouve des valeurs proportionnelles, voire supérieures, dans les pays émergeants (6), mais de manière plus surprenante encore, 18 % des femmes enceintes dans les pays industrialisés sont diagnostiquées déficientes en fer (7). L'anémie ferriprive (qui résulte de la détérioration progressive et avancée du statut en fer, altérant ultimement le niveau d’hémoglobine) liée à la grossesse n'est donc pas seulement un problème associé au statut économique de pays pauvres.
La déficience en fer maternelle a des conséquences néonatales majeures pour la santé et le développement du fœtus et du nourrisson. Elle est associée à un risque accru de naissances prématurées, de bébés de faibles poids de naissance et de mortalités infantiles (7). Par ailleurs, à long terme, entre 25 % et 85 % des prématurés de faible poids de naissance (≤ 1500 g) ont une carence en
Par ailleurs, la déficience en fer associée à la petite enfance est également une préoccupation clinique importante. Parmi la population pédiatrique globale des États-Unis, 9 % des enfants de 1-2 ans et de 3 % des enfants de 3-5 ans sont déficients en fer (9). Dans des travaux antérieurs sur un échantillon d'enfants canadiens (9 mois), issus de classes moyennes à supérieures, 2,7 % souffraient d'anémie ferriprive et 27 % avaient une hémoglobine basse (10).
La déficience en fer fœtale ou infantile est également un problème majeur dû aux rôles et implications majeurs du fer dans le développement cérébral. Les effets cliniques de la déficience sévère durant l’enfance sont bien documentés ; ceux associés à une déficience plus modérée semblent moins bien définis. Durant le développement, la déficience en fer est également associée à des altérations comportementales à long terme (11), des déficits cognitifs, moteurs et du langage, et ceci, malgré une thérapie subséquente en fer (12). Cependant, l'impact de la déficience en fer (notamment lorsqu’elle est modérée) au cours de la période prénatale sur le développement du système nerveux central de l'enfant est moins bien compris. Les fonctions neurophysiologiques et biochimiques du cerveau de l'enfant en réponse à cette déficience maternelle n'ont pas été extensivement étudiées et sont d'intérêt évident.
Ainsi, pour mieux évaluer les impacts neurophysiologiques de l’anémie ferriprive gestationnelle sur la descendance, la technique clinique d’étude des réponses du tronc cérébral à des stimulations auditives (en anglais : ABR, auditory brainstem responses ou PEATC : potentiels évoqués auditifs du tronc cérébral) a été utilisée et a permis d’évaluer la maturation du cerveau et l’une de ses fonctions sensorielles, la fonction auditive. Cette technique non-invasive est basée sur les potentiels sensoriels évoqués extraits de l'électroencéphalogramme. Les PEATC fournissent ainsi une mesure objective du temps de transmission neural le long de la partie périphérique du tronc cérébral et de la voie auditive (13). Il est également utilisé pour évaluer la maturation du cerveau après la naissance (14), et permet de détecter et de différencier les altérations auditives périphériques et centrales (15-19). En tant que tels, les PEATC (tant chez des enfants, que chez des progénitures de modèles animaux) peuvent aider à déterminer si une déficience nutritionnelle maternelle a des effets nocifs sur la maturation du cerveau des nourrissons, l'intégrité neurale et la fonction auditive (20,21).
De fait, plusieurs études ont examiné l’impact de la déficience en fer durant la période postnatale chez les humains et des modèles animaux, en utilisant cette technique d’investigation. Chez l'homme, une augmentation des temps de latence neuronale (20-22) et des amplitudes réduites (23) ont été rapportées, alors qu'aucun symptôme neurologique n’a été constaté dans d'autres études (24,25). Les conclusions de ces deux dernières pourraient montrer quelques résultats confondants, au vu de
données imprécises concernant l’âge des sujets, mais aussi la sédation qui leur a été attribuée et/ou l’absence d’information relative au contrôle de la température corporelle. Sur de jeunes rongeurs en développement, nourris avec une diète déficiente en fer, une équipe de chercheurs a décrit des altérations de l'acuité auditive et des dommages cellulaires (26), ainsi qu’une perte auditive neurosensorielle (27), tandis qu'une autre équipe n'a signalé aucun effet associé à la déficience en fer postnatale (28). Néanmoins, il y a de fortes raisons de penser que les fonctions des neurones sont lésées par cette déficience. Le fer est en effet impliqué dans la synthèse des neurotransmetteurs tels que la sérotonine, la dopamine et l'acide γ-amino butyrique (29-32) ; ces derniers étant impliqués dans la transmission synaptique de la cochlée (oreille interne) (33) et les noyaux auditifs du tronc cérébral (34). Enfin, chez les rongeurs, la déficience en fer durant l’initiation du développement (période prénatale) semble résulter en une diminution de la myélinisation cérébrale et en une modification de sa composition dans le tronc cérébral (35,36), ainsi que dans d'autres régions du cerveau (29,37-43). Une déficience en fer induit par ailleurs une réduction de la teneur en protéines cérébrales (29-31,42,44), réduit la prolifération des cellules précurseurs des cellules gliales et perturbe la production d'oligodendrocytes (44). Il semble établi que la DF postnatale et bien souvent sévère est impliquée dans de nombreux processus altératifs de la neurophysiologie auditive, mais les études relatives à la déficience en fer prénatale (gestationnelle) et modérée restent éparses et parfois contradictoires quant aux PEATC. Il n’est pas sans rappeler l’importance de l’audition durant le développement et qu’une perte en cette dernière, si elle n’est pas diagnostiquée précocement, représente un réel handicap d’apprentissage chez l’enfant. Par ailleurs, une acuité auditive altérée à un jeune âge peut se répercuter à un âge avancé (phénomène de presbyacousie : une perte d’audition de type neurosensorielle, reliée à l’âge (16)). Enfin, la perception auditive et son traitement par le cerveau sont sujets à de très rapides phénomènes de coordination d’une oreille à l’autre et permettent la géolocalisation de l’individu dans l’espace. En effet, l’oreille humaine est capable de détecter des sources sonores avec une précision de l’ordre de 2°, ce qui représente un délai de perception inter-aural de 11 μs ! De fait, une incoordination dans le traitement des informations des voies auditives peut mettre en péril l’individu, notamment face à des mesures d’évitements quotidiens.
En outre, durant le développement, la déficience en fer pourrait également avoir des incidences sur le métabolisme lipidique et ses dérivés. En effet, au stade fœtal, l'absorption du fer par le cerveau est maximale et directement impliquée dans le processus de production de myéline du cerveau par les oligodendrocytes (45-47). Par ailleurs, la déficience en fer maternelle peut altérer le métabolisme des acides gras et des eicosanoïdes cérébraux de la progéniture (48), altérations qui semblent s’avérer durables (49), induisant possiblement une détérioration des fonctions du système nerveux central.
impliquant la ∆-6-désaturase (Cf. Figure 1) dans le métabolisme des acides α-linolénique (C18:3 n-3) et linoléique (C18:2 n-6). Ces 2 acides gras essentiels chez l’homme, entrent en compétition avec l’enzyme ∆6-désaturase dont l’activité de conversion en acides gras à longue chaîne et plus insaturés (AA, acide arachidonique; AEP, acide eϊcosapentaenoïque; ADH, acide docosahexaenoïque) semblerait altérée chez le rat DF (54,55). Chez ce dernier, des études ont révélé des modifications cérébrales (54) et hématologiques (55,56) du profil des acides gras (élévation des acides gras essentiels initiaux, au détriment des produits de désaturation ultérieurs) suggérant une diminution de l’activité de l’enzyme ∆6-désaturase.
Figure 1 : voie biochimique de la conversion des acides gras essentiels
Chez le cochon d’Inde, il a été démontré qu’une déficience en fer modérée au cours du développement modifie également le profil en acides gras du cerveau (non pas d’un point de vue quantitatif, mais qualitatif), ainsi que le métabolisme des eicosanoïdes (48) ; effets qui semblent persister jusqu’à l’âge adulte (49). Durant le développement fœtal et jusqu’à une semaine postnatale chez le rat, l’activité enzymatique de la ∆6-désaturase est particulièrement accrue au niveau cérébral, puis diminue progressivement au profit de l’activité hépatique (51,52). Par ailleurs, des études cliniques semblent également démontrer chez des adultes déficients en fer, une diminution apparente des capacités de désaturation de cette enzyme dépendante du fer comme cofacteur (57). Chez de jeunes enfants déficients en fer, de fortes diminutions en acides gras polyinsaturés totaux (AEP, ADP et ADH) étaient caractérisées au niveau érythrocytaire ; la fraction phosphatidyléthanolamine présentait quant à elle,
une diminution du pourcentage d’acide α-linolénique, EPA et DHA. La réplétion en fer ayant normalisé ces données (58). L’hypothèse a donc été émise que la déficience en fer pourrait affecter indirectement le métabolisme lipidique tel qu’observé dans les études susvisées, via une modification de l’expression de l’enzyme et/ou de son activité (56). Actuellement, aucune étude n’est venue faire la lumière sur ce point.
La présence de ces acides gras polyinsaturés à longue chaîne (AGPI-LC), définis comme ayant une chaîne carbonée supérieure ou égale à 20 carbones (59,60) durant le stade fœtal est, par ailleurs, primordiale au développement cérébral. L’ADH est un composant majeur des membranes
phospholipidiques des photorécepteurs rétiniens et corps cellulaires de la substance grise (61). Les AGPI-LC sont hautement incorporés par le cerveau durant la croissance fœtale pour la synthèse
membranaire des phospholipides, dont la fluidité est augmentée par la présence d’ADH (62). AA et ADH sont également impliqués dans la neurogenèse, la plasticité synaptique et le maintien de la maturité neuronale au travers de leurs associations avec des récepteurs nucléaires (63,64). Les AGPI sont également impliqués dans la neurotransmission (65) et la fonction immunitaire (66).
De plus, les AA, ADH et AEP sont les précurseurs des eïcosanoïdes (leukotriènes, prostaglandines et thromboxanes), considérés agir comme des « hormones » paracrines et autocrines, impliqués dans de multiples fonctions biologiques. Les prostaglandines (PG) notamment, qui sont les principaux dérivés de l’AA, semblent jouer un rôle important dans le cerveau en développement. Elles participent aux ajustements du flux sanguin (67) et peuvent réguler l’expression de l’enzyme Oxyde Nitrique Synthétase (ONS) (68). L’ONS se retrouve dans différentes localisations de l’organisme. Au niveau endothélial, la synthèse d’oxyde nitrique (ON) induit la vasodilatation. D’un point de vue neural, l’ON aurait une activité de neurotransmetteur (participation à la recapture et au relargage de ces derniers) et participerait à la plasticité synaptique (68).
La concentration des PG (particulièrement PGE2) est élevée en période péri-natale dans le sang et le
cerveau (68) ; leurs récepteurs sont retrouvés dans les astrocytes et cellules oligodendrogliales impliquées dans le processus de myélinisation ; il a été suggéré que les prostanoïdes interviendraient dans la régulation et la différenciation des oligodendrocytes (69). Ces « pseudo-hormones » que sont les prostaglandines sont synthétisées par un complexe enzymatique à partir de l’AA : la prostaglandine synthétase. Elle est constituée d’une isoenzyme Cyclo-Oxygénase (COX) et d’une peroxydase, requérant un atome de fer. L’isoenzyme COX I est constitutive de l’organisme et se retrouve dans la majorité des cellules; elle est faiblement exprimée chez le nouveau-né, à l’inverse du stade adulte. La COX II, quant à elle, est fortement exprimée au niveau cérébral, en période périnatale (69,70) ; une
Enfin, puisque la majorité des études ont reproduit des déficiences sévères, et considérant qu’encore 18 % des femmes enceintes sont diagnostiquées avec une déficience en fer modérée dans les pays industrialisés, l’induction d’une déficience gestationnelle en fer légère à modérée permet de refléter davantage les processus de gestation et de développement actuellement rencontrés chez l’humain. De fait, deux objectifs généraux ont été instaurés pour cette étude, par l’entremise de 2 protocoles : le 1er étant d’évaluer, chez la progéniture issue de la femelle cochon d’Inde gestante, les effets
néfastes et délétères induits par une déficience en fer modérée durant la grossesse et la lactation, en analysant des données tant neurophysiologiques, que biochimiques. Par ailleurs, considérant que la
diète utilisée pour ce 1er volet d’étude était particulièrement riche en AGPI de la famille n-6
(ratio n-6:n-3 = 59:1) et dépourvue d’AGPI-LC, un 2ème volet d’étude a été instauré en utilisant une diète
également déficiente en fer, mais au profil modifié en acides gras (semblable au profil nord-américain), composée notamment d’AA, EPA, DHA et ayant un ratio n-6:n-3 de 11:1. Notre objectif s’est alors orienté vers la réplication potentielle ou non des résultats obtenus lors de notre 1er protocole.
Cette thèse s’articulera autour de plusieurs chapitres, le 1er étant la présente introduction.
Le 2ème expliquera les principes de fonctionnement de l’appareil auditif nécessaires à la compréhension
des mesures réalisées au moyen des potentiels évoqués auditifs du tronc cérébral (PEATC), dans le contexte de la déficience en fer maternelle. Un 3ème chapitre décrira une revue non exhaustive de la
littérature en rapport avec la déficience en fer, les PEATC et la biochimie. Un 4ème chapitre définira
précisément les hypothèses et objectifs relatifs au présent projet. Les chapitres 5, 6, 7 et 8 intégreront respectivement les articles publiés et en voie de soumission. Une discussion générale synthétisera l’ensemble des résultats et apportera un regard critique sur les forces et faiblesses du présent protocole de recherche. Elle sera complétée par les retombées potentielles qu’un tel projet pourrait avoir, ainsi que par les perspectives de recherche. Enfin, une conclusion viendra clore cette thèse.
Chapitre 2. Anatomophysiologie de l’appareil
auditif et principes des PEATC
Une explication générale des principes de fonctionnement de l’appareil auditif est nécessaire, afin de faciliter l’interprétation de la littérature reliée à la déficience en fer et aux mesures des PEATC.
2.1. Le son
Un signal acoustique consiste en une onde de pression (vibration) qui se propage dans un milieu ; ce dernier peut être gazeux (l’air ambiant), solide, ou encore liquide (comme c’est le cas au sein des différentes rampes de l’oreille interne) (71,72). L’énergie développée par la source émettrice de vibrations (i.e., de sons) est transmise dans l’air à une vitesse de 343 m/s (1500 m/s dans l’eau et 3500 m/s dans l’os) (72).
La fréquence sonore correspond au nombre de phases de compressions et de phases de détentes de l’air qui atteindront l’oreille en 1 sec (Cf. Figure 2). Un cycle sonore correspond à la distance entre ces 2 phases ; la fréquence sonore (Hertz, Hz) résulte de l’accumulation plus ou moins importante du nombre de cycles par sec. Dans l’exemple ci-dessous, la fréquence présentée correspond à un son pur de 2 Hz, soit 2 cycles par sec (71-73). C’est cette fréquence qui détermine la tonalité d’un son, soit haute (i.e., son aigu), soit basse (i.e., son grave). À titre d’exemple, le système auditif humain a la capacité de percevoir des fréquences allant de 20 Hz à 20 000 Hz.
Figure 2 : schématisation du principe de fréquence
2.2. Anatomie fonctionnelle
Le système auditif périphérique, l’oreille, comprend 3 éléments chez l’ensemble des mammifères :
- l’oreille externe ... composée du pavillon, du conduit auditif et du tympan. Son rôle est de canaliser les sons vers l’oreille moyenne. Une perte sonore de 6 dB est estimée au niveau du tympan.
- l’oreille moyenne ... relie mécaniquement le tympan à une autre membrane (la fenêtre ovale), via les osselets (le marteau : malleus ; l’enclume : incus et l’étrier : stapes), permettant une amplification sonore estimée à 20 dB, et facilitant également le transfert de l’onde acoustique du milieu aérien, vers le milieu aqueux de l’oreille interne.
- l’oreille interne ... correspond à la zone de transfert de l’onde physique (son) en une activité électrique (potentiel), phénomène encore appelé transduction. Il prend naissance au sein d’un enroulement osseux spiralé, nommée cochlée (du grec, kokhlías, « coquillage en spirale »). C’est l’organe sensoriel par excellence de l’oreille. (Cf. Figure 3) Parallèlement, l’oreille interne intègre un second organe sensoriel, le vestibule, dont le rôle est axé sur l’équilibration et ne revêt donc pas l’intérêt d‘être développé davantage ici.
Au sein de l’oreille interne, la cochlée est composée de 3 canaux enroulés en spirale : (Cf. Figure 4AB)
- le canal cochléaire, rempli d’endolymphe, riche en K+ [150 mM]; faiblement concentrée en Na+ [1 mM]
- la rampe vestibulaire (remplie de périlymphe) - la rampe tympanique (remplie de périlymphe)
Les rampes tympaniques et vestibulaires communiquent entre-elles dans la zone apicale de la cochlée par un orifice appelé hélicotrème. À l’inverse de l’endolymphe, la composition ionique de la périlymphe a une faible concentration en K+ [7 mM] et est riche en Na+ [140 mM]. Ces écarts de concentrations
ioniques permettent à l’endolymphe d’avoir un potentiel électrique plus positif (± 80 mV) que celui de la périlymphe : on parle de potentiel cochléaire, élément important de la transduction auditive (72).
Figure 3 : vue d’une cochlée de rat par microscopie électronique à balayage. La capsule osseuse, la strie vasculaire et la membrane tectorielle ont été ôtées, permettant de visualiser les 3 spires (enroulements) de la membrane basilaire soutenant l’organe de Corti (échelle : 2 mm). La zone encadrée correspond à la microscopie électronique à balayage de la Figure 5A, sur laquelle il est possible de distinguer les cellules ciliées. Images réalisées par M. Lenoir, extraites de "Voyage au Centre de l'Audition" www.cochlea.eu, par R. Pujol et al. NeurOreille, Montpellier (reprographie accordée avec l’aimable autorisation du Professeur R. Pujol, INSERM).
A
B
Figure 4 : coupe transversale de la cochlée (A), représentant le canal cochléaire (1), les rampes vestibulaire (2) et tympanique (3), ainsi que les ganglions cochléaires (4) et le nerf auditif (5). La coupe transversale d’un enroulement de la cochlée (B) permet d’identifier le canal cochléaire riche en endolymphe (vert), délimité par la lame réticulaire recouvrant l’organe de Corti (1), par la membrane de Reissner (2) et par le mur latéral (3). Schémas extraits de "Voyage au Centre de l'Audition" www.cochlea.eu, par R. Pujol et al. NeurOreille, Montpellier (reprographies accordées avec l’aimable autorisation du Professeur R. Pujol, INSERM).
2.3. Transduction sensorielle mécano-électrique
La transduction sensorielle mécano-électrique correspond à l’étape de codage des informations du milieu extérieur par des récepteurs sensoriels, soit l’interface entre une multitude de paramètres physiques et/ou chimiques et l’influx nerveux. Elle est assurée par les cellules sensorielles ciliées (Cf. Figure 5A) de l’organe de Corti (Cf. Figure 5B), au niveau de la cochlée. On distingue 2 types cellulaires :
- les cellules ciliées externes (CCE), cellules « mécano-électriques » permettant l’amplification du signal vibratoire,
- les cellules ciliées internes (CCI), cellules sensorielles, responsables de la transduction.
A
B
Figure 5 : microscopie électronique à balayage des cellules ciliées (A) internes (CCI, rangée du haut) et externes (CCE, 3 rangées du bas) à la surface de l’organe de Corti (échelle : 15 µm). Coupe transversale d’un enroulement de cochlée (B) de cobaye (échelle : 50 µm) montrant l’organe de Corti (1) détaché de sa membrane tectorielle, la membrane de Reissner (2), ainsi que le mur latéral (3). Images réalisées par M. Lenoir, extraites de "Voyage au Centre de l'Audition" www.cochlea.eu, par R. Pujol et al. NeurOreille, Montpellier (reprographies accordées avec l’aimable autorisation du Professeur R. Pujol, INSERM).
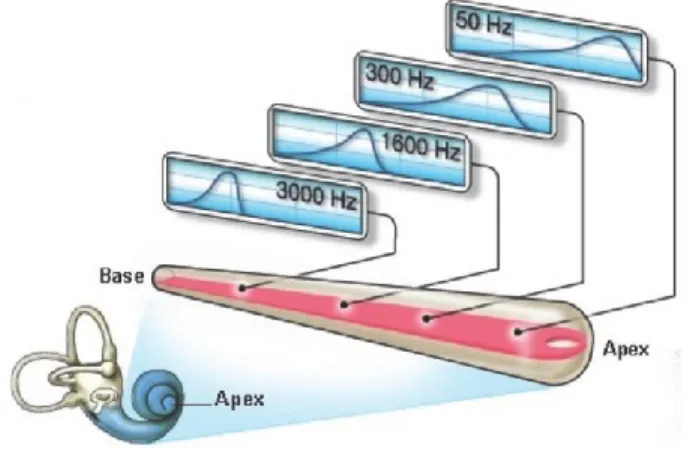
Ces dernières sont le siège de l’influx nerveux, qu’elles transmettent aux neurones cochléaires qui, à leur tour, le transmettent au cerveau, via le nerf auditif (nerf VIII) et des relais neuronaux. Au dessus des cellules ciliées se situe la membrane tectorielle. Lorsque le son est transmis aux liquides de l’oreille interne, la pression induite exerce une déformation de la membrane située sous l’organe de Corti (membrane basilaire), en un point qui est spécifique à une fréquence définie. Ainsi, différentes zones de la cochlée pourront traiter une large gamme de fréquences : on parle dès lors d’organisation tonotopique (Cf. Figure 6) de la cochlée (71-73). Les hautes fréquences seront traitées au niveau de la partie basale (entrée ou 1er enroulement) de la cochlée, alors que la zone apicale (dernier enroulement)
sera le siège du traitement des basses fréquences. Cette tonotopie se retrouve par ailleurs projetée au sein des différents relais nerveux retrouvés le long de l’ensemble des voies auditives que nous aborderons ultérieurement (i.e., Noyaux Cochléaires, Complexe Olivaire Supérieur, Lemnisque Latéral, Colliculus inférieur).