Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées
Centre d'études biologiques de Chizé - CEBC (Diplôme National - Arrêté du 7 août 2006)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Biologie de l?environnement, des populations, écologie
Présentée par :
Hélène Deraison
Effet de la diversité fonctionnelle de communautés
d'insectes herbivores sur la diversité et le fonctionnement
d'un écosystème prairial
Directeur(s) de Thèse : Isabelle Badenhausser, Nicolas Gross Soutenue le 16 décembre 2014 devant le jury Jury :Président Didier Bouchon Professeur, EBI, Université de Poitiers
Rapporteur David Bohan Directeur de recherches INRA, Dijon
Rapporteur Marco Moretti Directeur de recherches, Swiss Federal Research Institute WSL
Rapporteur Hervé Jactel Directeur de recherche INRA, Bordeaux
Membre Isabelle Badenhausser Ingénieur de recherche INRA-CEB, Chizé
Membre Nicolas Gross Chargé de recherche INRA-CEB, Chizé
Membre Richard Michalet Professeur, Université de Bordeaux
Membre Sébastien Ibanez Maître de conférences, Université de Savoie
Pour citer cette thèse :
Hélène Deraison. Effet de la diversité fonctionnelle de communautés d'insectes herbivores sur la diversité et le fonctionnement d'un écosystème prairial [En ligne]. Thèse Biologie de l?environnement, des populations, écologie. Poitiers : Université de Poitiers, 2014. Disponible sur Internet <http://theses.univ-poitiers.fr>
THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS Faculté des sciences fondamentales et appliquées
(Diplôme National – Arrêté du 7 aout 2006)
Ecole doctorale : Sciences pour l’environnement Gay Lussac
Secteur de recherche : Biologie de l’environnement, des populations, écologie
Présentée par :
Hélène DERAISON
Effet de la diversité fonctionnelle de communautés
d’insectes herbivores sur la
diversité
et le fonctionnement d’un écosystème prairial
Directrice de thèse : Isabelle Badenhausser Co-Directeur de thèse : Nicolas Gross
Effectuée au Centre D’études Biologiques de Chizé - Equipe AGRIPOP
Soutenue le 16 décembre 2014 devant la commission d’examen :
David BOHAN, Directeur de recherches, INRA de Dijon Rapporteur Hervé JACTEL, Directeur de recherches, INRA de Bordeaux Rapporteur Marco MORETTI, Directeur de recherches, Swiss Federal Research Institute WSL Rapporteur Didier BOUCHON, Professeur, Université de Poitiers Examinateur Sébastien IBANEZ, Maitre de conférences, Université de Savoie Examinateur Richard MICHALET, Professeur, Université de Bordeaux 1 Examinateur Isabelle BADENHAUSSER, Ingénieur de recherches, INRA-CEB Chizé Directrice Nicolas GROSS, Chargé de recherches, INRA-CEB Chizé Co-Directeur
Cette thèse a été conduite au Centre d’Etudes Biologiques de Chizé (Unité Mixte de Recherche 7372 du Centre National de la Recherche Scientifique et de l’Université de La Rochelle), dans l’équipe Agripop, grâce au soutien financier de la Région Poitou-Charentes, et de l’Institut National de la Recherche Agronomique. Cette thèse a été effectuée dans l’Ecole Doctorale Gay Lussac - Sciences pour l'environnement, et l’Université de Poitiers (département Sciences Fondamentales et Appliquées).
5
REMERCIEMENTS
Je tiens tout d’abord à remercier les membres de mon jury de thèse : David Bohan, Hervé Jactel, Marco Moretti, Didier Bouchon, Sébastien Ibanez et Richard Michalet, pour le temps que vous m’avez accordé afin d’examiner mon travail.
Merci aux membres de mon comité de thèse : Christophe Scherber, Nicolas Loeuille, Juliette Bloor, Pierre Liancourt et Cyrille Violle pour l’intérêt que vous avez porté à mon travail, et pour votre aide précieuse afin de cadrer mon sujet de thèse. Les échanges que nous avons eus autour de la manip criquets furent enrichissants. Un remerciement particulier à Christoph Scherber, Nicolas Loeuille et Pierre Liancourt pour la relecture de mon premier article.
Je tiens tout particulièrement à remercier mes directeurs de thèse Isabelle Badenhausser et Nicolas Gross. Merci à Nicolas pour ton aide et ta patience ; pour l’énergie positive transmise au quotidien, et pour ton encadrement qui a été stimulant et encourageant. Merci à Isabelle : ta rigueur, ta précision, et ton expérience m’ont inspirée, notamment dans l’initiation au monde des criquets que tu connais tant. Merci à tous les deux pour votre disponibilité, votre aide sur le terrain et pour votre investissement dans le bon déroulement de cette thèse.
Merci à Vincent Bretagnolle de m’avoir accueillie en stage de M2 au CEBC et de m’avoir initiée au monde la recherche. Merci également pour l’opportunité que tu m’as donnée en me permettant de rester au CEBC après mon stage. J’ai ainsi pu découvrir le « terrain », si prépondérant dans le déroulement d’une thèse. Sans ton investissement, ce doctorat n’aurait pu avoir lieu.
Merci à Patrick Ducan, Bertrand Gauffre, Sylvie Houte, et David Pinaud pour les échanges intéressants et constructifs durant les séminaires.
Merci à Luca Börger pour tes conseils, ton positivisme et de m’avoir apporté tes connaissances en statistiques.
Merci à Philippe Barre, Corinne Melun, Catherine Leveque et Nathalie Moynet pour votre accueil à L’INRA de Lusignan. Votre aide dans la réalisation et l’explication des protocoles de mesures de carbone et d’azote foliaires fût déterminante. Merci tout simplement pour votre gentillesse et votre investissement.
Merci aussi à Fernando Maestre de m’avoir accueillie pendant quelques semaines au sein de son laboratoire afin de réaliser les protocoles d’analyse de sol de la manip criquets. Merci pour ces échanges qui donneront de belles perspectives à cette manip. Un grand merci à Vicky, Dani, Bea et Enrique pour votre incroyable gentillesse et votre accueil si chaleureux. Merci pour votre aide et votre investissement dans la réalisation des nombreux protocoles que j’ai eus à faire en peu de temps. Une pensée particulière pour Vicky et Dario avec qui j’ai visité Madrid. Merci également aux thésards du labo pour votre bonne humeur pendant ces quelques semaines et pour cette soirée « Madrid by night ».
Sans oublier toutes les personnes qui ont participé au bon déroulement de la manip criquets : Merci à Valérie Bost de nous avoir fourni la prairie expérimentale.
Un grand merci à Louis pour ton aide et ton investissement notamment lors de la première année d’expérimentation alors que je découvrais l’ampleur de la tâche qui m’attendait. Merci aussi d’avoir veillé au bon déroulement de la manip en deuxième année alors que je devais me concentrer sur la rédaction de mon premier article.
Merci à Marilyn et Nadine pour votre savoir-faire technique et votre expérience qui n’ont pas de prix. Un merci particulier à Marilyn pour les prélèvements de criquets et pour ton aide dans leur identification. Merci à Nadine pour ton aide dans les mesures de traits de plantes.
6
Merci à Edo pour les comptages et les pesées de criquets et pour les broyages d’échantillons et de feuilles de plantes.
Merci à Gaëtane pour ton aide précieuse dans la manip criquets. Merci aussi pour ces passages en « coups de vent » dans le bureau, toujours réconfortants. C’était également un plaisir et une fierté d’encadrer ton stage de M2.
Merci aussi à Edouard, Yannick, Nicolas S., Adrien et Vincent C. pour votre aide dans l’installation et la désinstallation des cages de la manip.
Merci aux membres de l’atelier : Simon, Christian et Patrice pour vos nombreux coups de main, et pour la fabrication du matériel terrain, souvent dans l’urgence !
Un immense merci à vous tous d’avoir accepté de vous « plier en quatre » et de passer de longues journées en pleine chaleur ou sous la pluie à compter et prélever les criquets, à passer l’aspirateur et mettre du scotch dans les cages ou encore à prélever de la biomasse... Sans vous cette manip n’aurait jamais fonctionné aussi bien !
Merci à Orianne pour ton amitié depuis le M2. Merci pour ton positivisme et ton énergie encourageants. C’est toujours un plaisir de se remémorer la vie Chizéenne que j’ai découverte à tes côtés, la vie en communauté, le terrain et les rencontres que nous avons faites. Avec toi, c’est toujours des fous rires garantis accompagnés parfois d’un peu de mélancolie. Merci aussi pour ton aide pendant ces quelques soirées d’été à photographier des feuilles de plantes pour les mesures de traits. Quelle efficacité ce soir-là, on aurait fait un bon binôme sur le terrain !!!
Un grand merci à Ronan, mon collègue de bureau et ami ! Merci pour ton soutien, pour toutes ces conversations enrichissantes que nous avons eues pendant trois ans. Je n’oublierai pas les Chansons Du Jour que nous avons partagées pendant un an, qui égayaient notre quotidien et qui vont faire un bel album souvenir ! Les longs échanges sur nos analyses de données ont constitué un partage d’expérience motivant. Ne t’inquiète pas, je ne te tiendrai pas rigueur de nos différences de point du vue sur la maroquinerie !
Un grand merci à Titi. Merci pour ta bonne humeur et ton dynamisme. Merci pour toutes les soirées barbecue passées chez toi, les parties enflammées de Mölkky et pour les ballades du dimanche après-midi. Merci aussi pour tous ces très bons gâteaux. Un jour, je t’inscrirai au concours du Meilleur Pâtissier, c’est promis ! En te rencontrant, j’ai trouvé un excellent ami.
Merci à Gaël pour ces quelques temps de covoiturage qui nous ont permis de nous connaître. Merci pour ton honnêteté et ta franchise qui permettent de prendre du recul, chose précieuse quand on est thésard ! Tu m’as apporté un regard neuf sur la vie d’un doctorant.
Merci à Carine ma deuxième collègue de bureau. C’est toujours appréciable de pouvoir échanger avec simplicité sur des sujets sympas qui nous sortent du quotidien d’un thésard !
Merci à l’équipe administrative : Annie, Delphine, Evelyse et Martine. Sans oublier André et Arnaud pour l’équipe informatique.
Merci à Mina, d’avoir évité que notre petit bureau ne devienne un champ de bataille !
Merci à Sabrina Biais et Sylvie Pérez membres de l’université et de l’école doctorale de Poitiers pour votre aide dans les démarches administratives.
Merci également aux thésards, postdocs, contractuels et stagiaires de Chizé pour votre bonne humeur et la bonne ambiance que vous instaurez au labo : Adriana, Alexis, Aurélie, Carine, Cécile B., Damien, Elsa, Fabrice, Gaël, Gaëtane, Kevin, Laura, Licia, Paul D., Paul M., Pierrick, Ronan, Stefaniya, Vincent D. Merci également à tous les anciens stagiaires et thésards qui ont animé la vie Chizéenne.
7 Merci à Nat’, Anne, Pauline et Quentin que j’ai rencontrés à l’Université de Rennes 1 et avec qui j’ai esquissé mon parcours dans la recherche. Malgré la distance, il est toujours agréable de vous retrouver pour se remémorer les souvenirs de la Fac.
Merci à Ti pour ta présence et ton soutien dans les moments difficiles. Ton amitié de longue date a toujours été précieuse pour moi. Maintenant que la vie nous a rapprochées géographiquement, j’espère que nous partagerons plus de moments ensemble.
Un grand merci au Madjik. Merci à tous pour cette belle amitié qui fait la force et la cohésion de ce groupe depuis tant d’années ! Merci pour votre soutien et tous vos encouragements. J’espère maintenant rattraper tous ces moments manqués, et être présente à vos côtés pour les prochaines retrouvailles.
Merci à Renée et à Tri pour votre gentillesse et vos petites attentions chaleureuses.
Merci également à mes Parents, Aurélie, François et Margue pour votre soutien depuis toujours. Merci de m’avoir donné les moyens et la volonté d’aller jusqu’au bout de tout ce que j’ai pu entreprendre.
Enfin un grand merci à Mathieu. Merci pour ta patience, tu as toujours été présent pour moi ces huit dernières années. Merci pour ta confiance et ton soutien sans faille dans tous les choix que j’ai pu faire. Merci de me pousser à croire en moi !
9
RESUME
La biodiversité est un paramètre déterminant du fonctionnement des écosystèmes. Un effet généralement positif de la diversité en plantes a été observé dans plusieurs études pionnières. Cependant, il y a un besoin urgent de mieux comprendre le rôle de la biodiversité au sein des écosystèmes, notamment en intégrant différentes composantes importantes de la diversité telles que la diversité fonctionnelle entre et au sein de niveaux trophiques contrastés.
Nous avons testé l’effet de la diversité spécifique et fonctionnelle de communautés d’herbivores généralistes (criquets, Acrididea) sur le fonctionnement d’un écosystème prairial. Nous avons créé des communautés expérimentales de criquets au sein desquelles les diversités spécifique et fonctionnelle ont été manipulées de manière indépendante.
Cette expérimentation a permis d’identifier les traits fonctionnels d’effet déterminant l’intensité des interactions trophiques entre les communautés de plantes et de criquets. Nous montrons également que les mécanismes contrôlant l’impact des communautés de criquets sur la biomasse végétale dépendent de leur identité et de leur diversité fonctionnelles. Ainsi, une plus forte diversité des traits mandibulaires au sein d’une communauté augmente la taille des niches alimentaires et l’impact total observé sur l’écosystème. Enfin, la réponse de l’écosystème face aux herbivores dépend directement de l’intensité de la pression d’herbivorie, de la diversité fonctionnelle en plantes et des changements de composition fonctionnelle au sein des communautés végétales.
Cette étude contribue au développement des approches basées sur l’utilisation des traits au sein des interactions trophiques afin de relier l’effet de la biodiversité entre et au sein de multiples niveaux trophiques sur le fonctionnement des écosystèmes.
Mots-clefs : expérimentation de biodiversité, interactions plantes-insectes herbivores, communautés de criquets, diversité fonctionnelle, traits fonctionnels, traits mandibulaires, niche alimentaire
10
ABSTRACT
Biodiversity is a major determinant of ecosystem functioning. Pioneer biodiversity experiments have shown a general positive relationship between plant diversity and ecosystem functioning. However there is now a growing need to integrate the functional diversity within multi-trophic levels to improve our ability to scale biodiversity changes into future ecosystem functioning.
We experimentally tested how the functional identity and diversity of generalist insect herbivore communities impact the functioning of a grassland ecosystem. We experimentally and independently manipulated the functional identity and diversity of grasshopper communities.
We identified grasshopper functional effect traits determining the intensity of trophic interactions between plant and grasshopper communities. We demonstrated that the mechanisms driving grasshopper community impact on plant biomass depend on their functional identity and diversity. Thus a higher functional diversity of grasshopper mandibular traits increases the size of the feeding niche within communities and the total impact on ecosystem. Finally, ecosystem response to herbivores depends directly on the intensity of herbivory pressure, plant functional diversity and on the changes of plant functional structure within plant communities.
Our study contributes to the development of the trait-based approach in the study of trophic interactions to link biodiversity between and within trophic levels on ecosystem functioning.
Key words: biodiversity experiment, plant insect herbivore interactions, grasshopper communities, functional diversity, functional traits, mandibular traits, feeding niche
11
SOMMAIRE
R
EMERCIEMENTS
--- 5
R
ESUME
--- 9
A
BSTRACT
--- 10
S
OMMAIRE
--- 11
I
NTRODUCTION GENERALE
--- 15
1 - Régulation de l’impact des insectes herbivores sur la biomasse des producteurs primaires .. 17
2 - Mécanismes d’interactions trophiques entre plantes et insectes herbivores ... 22
2.1. Le compromis défense-croissance des plantes... 22
2.2. Les traits de tolérance des plantes ... 23
2.3. Les traits de qualité nutritionnelle des plantes et leurs effets sur les insectes herbivores.. 23
2.4. Les traits de défense des plantes et leurs effets sur les insectes herbivores ... 25
2.5. Les syndromes de traits de plantes impliqués dans les relations plantes-insectes herbivores ... 27
3 - Utilisation de l’approche fonctionnelle pour établir l’effet des communautés d’insectes herbivores sur le fonctionnement des écosystèmes... 29
3.1. Les traits fonctionnels ... 29
3.2. Le cadre conceptuel des traits de réponse et des traits d’effet ... 30
4 - Rôle de la diversité spécifique et fonctionnelle sur le fonctionnement des écosystèmes ... 34
4.1. L’apport des expérimentations sur la biodiversité ... 34
4.2. La controverse des expérimentations de biodiversité ... 35
4.3. Les mécanismes reliant diversité et fonctionnement des écosystèmes ... 37
4.4. Mesures de la diversité fonctionnelle ... 38
4.5. Les expérimentations de biodiversité au sein des réseaux trophiques ... 40
5 - Problématique et objectifs de la thèse ... 42
M
ETHODES
--- 45
1 - Protocole expérimental ... 47
2 - Présentation de la zone d’étude ... 49
3 - Le choix de la prairie expérimentale ... 50
4 - Le choix des six espèces de criquets ... 51
5 - Mesures des traits fonctionnels ... 54
5.1. Les traits fonctionnels des plantes ... 54
5.2. Les traits fonctionnels des criquets ... 57
6 - Le design experimental ... 60
6.1. Description générale du design ... 60
6.2. Les modalités de traitements ... 60
6.3. Déroulement de l’expérimentation ... 61
12
C
HAPITRE
1
–
TRAITS D
’
EFFET DES ESPECES DE CRIQUETS SUR LA BIOMASSE
VEGETALE
--- 65
1 - Summary ... 68
2 - Introduction ... 69
3 - Material and methods ... 71
3.1. Study site and grasshopper species selection... 71
3.2. The grasshopper experiment ... 71
3.2.1. Field site selection ... 71
3.2.2. Experimental design ... 72
3.2.3. Herbivore impact ... 72
3.3. Grasshopper trait measurements ... 73
3.4. Plant functional traits ... 74
3.5. Data analyses ... 74
3.5.1. Correlation between grasshopper traits... 74
3.5.2. Grasshopper impact on plant biomass and direct relationship with traits ... 75
3.5.3. Grasshopper feeding niche ... 76
3.5.4. Direct or mediated effect of grasshopper traits on plant community biomass... 77
4 - Results ... 78
4.1. Linking herbivore effect traits to their impact on plant community biomass ... 78
4.2. Linking plant traits to grasshopper feeding niche ... 79
4.3. Linking grasshopper traits to feeding niche ... 83
4.4. Direct and mediated effect of grasshopper traits on plant biomass ... 83
5 - Discussion ... 84
6 - Conclusion ... 87
7 - Supporting information ... 89
C
HAPITRE
2
–
E
FFETS DE LA DIVERSITE SPECIFIQUE ET FONCTIONNELLE DE
COMMUNAUTES DE CRIQUETS SUR LA BIOMASSE VEGETALE
--- 103
1 - Summary ... 106
2 - Introduction ... 107
3 - Material and methods ... 109
3.1. Grasshopper experiment ... 109
3.1.1. Field site selection ... 109
3.1.2. Grasshopper experiment ... 109
3.1.3. Grasshopper impact ... 110
3.2. Grasshopper & plant trait measurements ... 111
3.2.1. Grasshopper traits ... 111
3.2.2. Plant traits ... 112
3.3. Grasshopper feeding preferences ... 113
3.4. Grasshopper Survival ... 114
3.5. Data analysis ... 114
3.5.1. Grasshopper community impact on plant biomass ... 114
3.5.2. Grasshopper traits and feeding niche ... 115
3.5.3. Intra and interspecific interactions between grasshoppers ... 116
4 - Results ... 116
4.1. Grasshopper community impact on plant biomass ... 116
4.2. Relationship between grasshopper traits and their feeding niche ... 121
4.3. Intra and interspecific interactions between grasshoppers ... 123
13
6 - Conclusion ... 127
7 - Supporting information ... 129
C
HAPITRE
3
–
E
FFETS DE LA DIVERSITE FONCTIONNELLE DE COMMUNAUTES DE
CRIQUETS SUR LE FONCTIONNEMENT D
’
UN ECOSYSTEME PRAIRIAL
--- 135
1 - Summary ... 138
2 - Introduction ... 139
3 - Material and methods ... 144
3.1. The grasshopper experiment ... 144
3.1.1. Field site selection ... 144
3.1.2. Grasshopper species selection ... 144
3.1.3. The experimental design ... 145
3.1.4. Monitoring of the experiment ... 145
3.1.5. Plant trait measurement ... 146
3.2. Data calculation ... 147
3.2.1. Grasshopper community traits ... 147
3.2.2. Grasshopper community impact on plant biomass ... 148
3.2.3. Plant community response to grasshopper communities ... 148
3.3. Data analyses ... 149
3.3.1. Plant community responses to grasshopper communities ... 149
3.3.2. Effect of grasshopper communities on plant primary production ... 150
3.3.3. Direct and indirect links between grasshopper functional diversity and primary production ... 151
4 - Results ... 151
4.1. Plant community responses to grasshopper communities ... 151
4.2. Effect of grasshopper communities on plant primary production... 156
4.3. Direct and indirect links between grasshopper traits and plant primary production ... 158
5 - Discussion ... 159
6 - Conclusion ... 163
7 - Supporting information ... 164
D
ISCUSSION ET PERSPECTIVES
--- 169
1 - Traits fonctionnels et relations plantes-insectes herbivores ... 174
1.1. La force des incisives : un trait clef déterminant l’intensité des interactions plantes-insectes herbivores ... 174
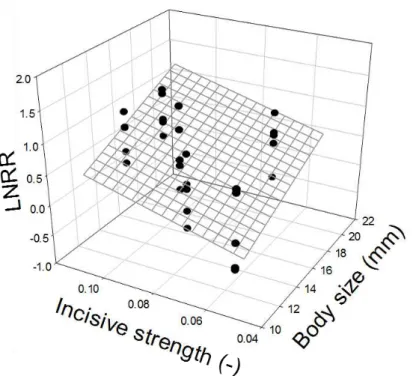
1.2. L’effet marginal de la taille corporelle des criquets sur la consommation de biomasse végétale ... 175
1.3. La relation entre les traits mandibulaires et la niche alimentaire est-elle généralisable à d’autres taxa ? ... 176
2 - Les relations plantes insectes herbivores à l’échelle des communautés ... 178
2.1. Les patrons d’abondance des communautés de criquets en systèmes semi-naturels ... 179
2.2. Les relations fonctionnelles non trophiques entre les plantes et les criquets ... 180
2.3. L’absence de prédateurs dans l’expérimentation ... 182
3 - L’effet des relations trophiques sur le fonctionnement des écosystèmes ... 184
3.1. Vers une approche multifonctionnelle des expérimentations de biodiversité ... 185
3.2. Données en cours d’analyse ... 188
4 - Conclusion ... 188
15
17
1 - Régulation de l’impact des insectes herbivores sur la biomasse des
producteurs primaires
Les insectes représentent une part importante de la biodiversité des écosystèmes terrestres. Avec plus d’un million d’espèces décrites, la diversité des insectes dépasse celle des autres animaux et des plantes (Stork 1988). En tant que pollinisateurs, prédateurs, parasites, détritivores, ingénieurs du sol ou encore herbivores (Weisser & Siemann 2008), les insectes sont des éléments majeurs du fonctionnement des écosystèmes. Les insectes herbivores ou phytophages sont définis comme des organismes se nourrissant de végétaux (Rochat, Desouhant & Menu 2013). On distingue par exemple les rhizophages, consommateurs de racines ou d’autres organes sous terrains ; les foreurs de tiges et xylophages, creusant des galeries, vivant à l’intérieur de la tige d’une plante ou du tronc d’un arbre et pouvant altérer la circulation de l’eau dans la plante ; les piqueurs-suceurs de sève, modifiant la quantité et la distribution des assimilas dans la plante ; les floricoles, s’alimentant des pièces florales (étamines, ovaires, nectar) ; les frugivores et séminivores, consommant des fruits et des graines et jouant ainsi sur la fonction de reproduction de la plante ; et enfin les phyllophages défoliateurs, qui consomment les feuilles réduisant ainsi la surface photosynthétique (Figure 1).
Figure 1. Classification des insectes herbivores selon l’organe végétal consommé. Ce schéma représente une des
18
L’action des insectes herbivores produit des changements de certains processus physiologiques de la plante qui se traduisent ou non par une destruction directe de sa biomasse, des réductions de sa croissance, de sa reproduction ou de sa survie (Crawley 1989; Huntly 1991). L’herbivorie peut également influencer les interactions entre espèces végétales en altérant leur capacité de compétition, et en les rendant plus vulnérables aux attaques des pathogènes. Elle peut également modifier la réponse des plantes à des stress abiotiques comme la sécheresse (Badenhausser et al. 1994). Dans certains cas, ces perturbations peuvent entrainer une baisse de la productivité des milieux notamment en cas de pullulation lors desquelles les insectes peuvent atteindre de très fortes densités.
“Despite a myriad of herbivores in terrestrial ecosystem the world is green”(Schädler et al. 2003a) Malgré l’impact que les insectes herbivores ont sur les végétaux, le monde est toujours vert. Cela implique qu’il existe des mécanismes de régulation des interactions trophiques entre plantes et herbivores allant de l’échelle de la plante à celle de l’écosystème tout entier. En effet, les dégâts engendrés par les insectes herbivores ne se traduisent pas nécessairement par une baisse de croissance ou de production à l’échelle de la plante entière. Les plantes peuvent tolérer une défoliation ou le détournement d’une part de leurs nutriments, jusqu’à un certain seuil avant que cela ne conduise à une altération de leur croissance ou de leur production (de Mazancourt, Loreau & Dieckmann 2001). Elles peuvent également répondre par un phénomène de surcompensation en réinvestissant les ressources vers les zones en croissance ou productrices. C’est le cas par exemple des graminées en milieu prairial dont la fauche ou la consommation de feuillage peut stimuler leur croissance et leur production de biomasse (Belovsky & Slade 2000). A l’échelle de la communauté, la mort ou l’altération de la croissance d’une certaine proportion de plantes peut conduire à une diminution de la compétition. Celle-ci peut se traduire par une augmentation de la croissance des plantes survivantes conduisant ainsi à l’absence d’effet des insectes herbivores sur la production du couvert, voire à une surcompensation (Pedigo, Hutchins & Higley 1986). A l’échelle des systèmes, l’herbivorie peut également engendrer des boucles de rétroaction positives en stimulant par exemple la décomposition de la litière (Chapman et al. 2003) le cycle de l’azote et la fertilité des sols (Belovsky & Slade 2000). Ces facteurs vont contribuer à augmenter la croissance végétale.
Dans les communautés végétales semi-naturelles, en opposition avec les plantes cultivées en grandes cultures, l’effet des insectes herbivores sur le fonctionnement des écosystèmes de pays tempérés a souvent été considéré comme négligeable par rapport aux autres herbivores (Polis & Strong 1996). Différentes raisons ont été évoquées pour expliquer ce faible impact. Tout d’abord des études réalisées en milieu prairial ont montré que la biomasse des insectes serait équivalente à moins de 2% de la biomasse des autres animaux aériens ou du sol, et à 0.2% de la biomasse végétale (Zlotin & Khodashova 1980). La faible abondance des insectes dans les milieux semi-naturels expliquerait leur
19 faible impact sur les producteurs primaires. De plus, en ne consommant qu’une faible partie de la matière végétale, estimée autour de 10% (Curry 1994), l’effet des insectes herbivores sur la productivité serait négligeable comparativement aux grands mammifères capables de consommer jusqu’à 90% de la biomasse d’une prairie (Detling 1988). En 1960, Hairston et al. ont proposé d’expliquer ce faible impact sur la consommation de biomasse par un fort contrôle des prédateurs sur les populations d’insectes. Ce contrôle dit « descendant » ou « top-down » est à l’origine de la théorie du « monde vert » qui stipule que les populations d’insectes herbivores sont limitées par l’action des ennemis naturels, c'est à dire les prédateurs, les parasites, les pathogènes et les parasitoïdes évitant que les producteurs primaires ne soient totalement consommés et permettant ainsi de maintenir un « monde vert ». Dans une moindre mesure, les auteurs font également référence à un contrôle ascendant ou « bottom-up » selon lequel les populations d’insectes herbivores sont également régulées par le niveau trophique inférieur, c'est à dire par les producteurs primaires eux-mêmes.
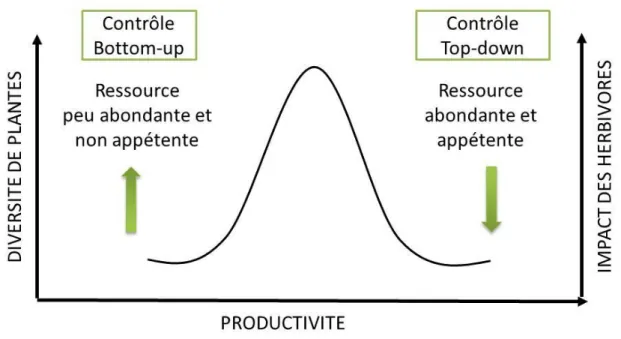
La régulation des insectes herbivores par les communautés de plantes dépend des conditions abiotiques du milieu c'est-à-dire de l’ensemble des conditions physico-chimiques dans un écosystème donné (nutriments, eau, lumière, température, etc…). La théorie de L'Hypothèse d'Exploitation des Écosystèmes propose que les mécanismes de régulation des herbivores évoluent d‘un contrôle « bottom-up » à un contrôle « top-down » lorsque la productivité du milieu augmente (Oksanen et al. 1981; Oksanen & Oksanen 2000) (Figure 2). Dans les milieux peu fertiles, les communautés de plantes sont majoritairement dominées par des espèces à croissance lente produisant peu de biomasse et à faible concentration en azote foliaire (Grime 1977, 1997). Ces espèces sont également constituées de traits de défense face à l’herbivorie limitant l’accessibilité et la digestibilité de la ressource (Coley 1983, 1988; Ritchie 2000). Ainsi, dans les milieux peu fertiles, la ressource peu abondante et de faible qualité nutritionnelle limite les communautés d’herbivores (contrôle « bottom-up »). Une récente étude portant sur une expérimentation de biodiversité et manipulant la diversité spécifique des plantes a confirmé le contrôle « bottom-up » de la biomasse végétale sur la diversité et la densité d’arthropodes (Borer, Seabloom & Tilman 2012). A l’inverse, dans les milieux fertiles, les communautés de plantes sont caractérisées par des espèces à fort taux de croissance produisant ainsi plus de biomasse, et par des espèces à fort taux d’azote foliaire les rendant appétentes et de bonne qualité nutritionnelle pour les herbivores (Coley 1983; Fraser & Grime 1997, 1999). Ces milieux productifs peuvent alors accueillir un plus grand nombre d’insectes herbivores mais également un cortège de prédateurs diversifiés permettant une régulation efficace des populations d’insectes herbivores.
20
Figure 2. Relation entre la productivité des milieux et les mécanismes de contrôle des herbivores (Oksanen et al. 1981). Dans les milieux peu fertiles les herbivores sont contrôlés par la quantité et la qualité de la ressource et à l’inverse dans les milieux fertiles les herbivores sont contrôlés par les prédateurs. Ce schéma fait également appel aux théories expliquant la coexistence des espèces végétales le long de gradient de productivité (Grime 1977). Cette théorie oppose les espèces végétales tolérantes aux stress dans les milieux peu fertiles aux espèces compétitrices dans les milieux fertiles. La diversité devient maximale pour une productivité intermédiaire, le milieu n’étant pas assez stressé pour exclure les espèces compétitrices mais suffisant pour limiter leur capacité de compétition envers les espèces tolérantes au stress et permettant ainsi la coexistence de ces deux types de stratégies.
La diversité végétale apparait également comme un facteur pouvant limiter l’impact des insectes herbivores sur les communautés végétales. Une augmentation de la diversité spécifique sur une surface donnée implique souvent une baisse du nombre d’individus par espèce. L'hypothèse de la concentration de ressources (Root 1973) prévoit une réduction de l'aptitude des insectes herbivores, notamment les espèces spécialistes, à découvrir et utiliser efficacement leur plante hôte dans les milieux de cultures diversifiées. Initialement, cette théorie a été utilisée dans les milieux agricoles afin de comprendre la forte densité observée d’insectes ravageurs dans les parcelles cultivées. En effet, il a été constaté que des espèces d’herbivores spécialistes avaient plus de chance d’être présentes lorsque leur plante hôte se trouve en grande quantité (Otway, Hector & Lawton 2005). Une autre hypothèse a été avancée concernant cette relation entre la diversité végétale et la régulation des insectes herbivores. La diversité en plantes influence positivement la richesse et l’abondance des insectes mais également celles de leurs prédateurs (Siemann et al. 1998; Schaffers et al. 2008). Ainsi, selon l’hypothèse des ennemis naturels (Root 1973), dans les milieux riches en espèces végétales, les prédateurs peuvent être favorisés par une plus grande diversité et quantité de proies mais également par une plus grande diversité d’habitats (Langellotto & Denno 2004; Haddad et al. 2009; Scherber et al. 2010a). Une étude a montré le long d’un gradient de richesse spécifique qu’une augmentation de la diversité de plantes implique une augmentation de la diversité d’insectes herbivores généralistes mais que cette
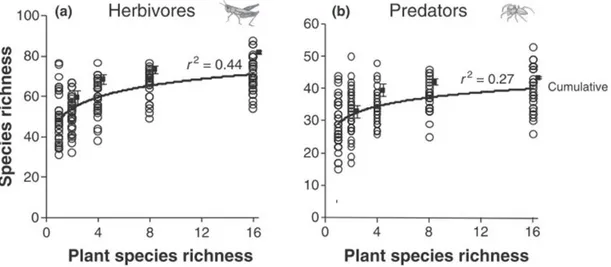
21 augmentation de diversité végétale est également reliée à une augmentation de la diversité de leurs prédateurs (Haddad et al. 2009) (Figure 3).
Figure 3. Effet de la richesse spécifique des plantes sur la richesse des insectes herbivores (les criquets) et de leurs prédateurs (les araignées) (Haddad et al. 2009).
Ainsi, la régulation de l’impact des insectes herbivores sur la production primaire repose sur différents processus complexes qui sont liés aux interactions directes et indirectes entre les plantes et les insectes. Ces interactions peuvent être caractérisées et étudiées par l’identification des traits qui les synthétisent tant chez les plantes que chez les insectes.
22
2 - Mécanismes d’interactions trophiques entre plantes et insectes
herbivores
2.1. Le compromis défense-croissance des plantes
A l’échelle spécifique, la réponse des plantes face à l’herbivorie résulterait d’un compromis évolutif, ou « trade-off », entre l’allocation des ressources à la croissance ou à la défense face aux herbivores (Figure 4) (« growth-response trade-off ») (Oksanen et al. 1981; Coley 1988; Fine et al. 2006). Ce modèle prédit que l’investissement dans les moyens de défense augmente lorsque le taux de croissance diminue, et que ce compromis est modulé par la quantité de ressources disponibles pour les plantes. Dans les milieux riches en ressources, les plantes présentent un taux de croissance élevé leur permettant de tolérer une défoliation et de synthétiser de nouveau les tissus consommés. Ces espèces peuvent être caractérisées par des traits de tolérance en relation avec le taux de croissance. A l’inverse, dans les milieux pauvres en ressources, les plantes présentent un taux de croissance faible et investissent davantage dans les défenses. Cela permet d’éviter ou de limiter la perte des tissus en agissant sur l’accessibilité à la ressource via la mise en place de défenses physiques (présence d’épines, forte quantité de fibres dans les feuilles) ou sur la performance des insectes herbivores par exemple via la sécrétion de composés chimiques toxiques. Ce compromis se réfère également à un mécanisme clef permettant d’expliquer la coexistence des espèces végétales le long d’un gradient de productivité (Grime 1977 ; Wright et al. 2004). Il oppose les espèces selon leurs capacités compétitrices. Les espèces à fort taux de croissance sont des espèces présentant une bonne capacité compétitrice et qui dominent les milieux productifs. A l’inverse, les espèces à faible taux de croissance investissant dans les défenses face aux herbivores, présentent de moins bonnes capacités de compétition et dominent les milieux peu productifs. Ainsi, il serait possible de quantifier ce « trade-off » en caractérisant les plantes avec des traits reflétant d’une part leur tolérance à l’herbivorie et d’autre part leur investissement dans les défenses vis-à-vis des herbivores et ce en relation avec les traits des herbivores qui les consomment.
23
Figure 4. Schéma conceptuel illustrant le compromis entre croissance et défense le long d’un gradient de
productivité.
2.2. Les traits de tolérance des plantes
Chez les insectes herbivores défoliateurs, les traits de tolérance des plantes se réfèrent à la capacité des plantes à supporter une défoliation sans que cela n’impacte ni leur survie ni leur reproduction (Strauss & Agrawal 1999). Dans les milieux fertiles, le taux de croissance des plantes apparait comme étant un bon indicateur reflétant la tolérance des plantes à l’herbivorie. Les plantes caractérisées par un taux de croissance élevé sont capables de reconstituer plus rapidement les tissus consommés du fait de leur capacité à absorber efficacement les nutriments disponibles dans le sol (Coley, Bryant & Chapin 1985; Herms & Mattson 1992; Grime 1997; Westoby 1999). Le taux de croissance a été corrélé à d’autres traits pouvant également être considérés comme des indicateurs de la tolérance des plantes à l’herbivorie. Les espèces qui sont capables de croitre rapidement sont aussi caractérisées par un fort taux photosynthétique, un fort taux d’absorption des nutriments tels que l’azote et donc par une forte concentration en azote foliaire. Ces espèces présentent également une forte surface spécifique foliaire (specific leaf area, SLA) qui correspond à la surface de feuille réalisée par gramme de matière sèche (Westoby et al. 2002).
2.3. Les traits de qualité nutritionnelle des plantes et leurs effets sur les insectes
herbivores
Le compromis entre croissance et défense prédit que les traits liés à l’appétence des plantes en termes de qualité nutritionnelle peuvent être de bons indicateurs de l’intensité d’herbivorie. Dans les
24
milieux pauvres en ressources, l’impact des herbivores est régulé par le faible taux de croissance des plantes et par la faible quantité d’azote foliaire, les rendant moins appétentes et de moins bonne qualité nutritionnelle (Grime 1977, 1997; Coley 1983). Dans ce contexte, les besoins nutritionnels des insectes herbivores ainsi que la composition chimique des plantes permet d’établir des liens forts entre les niveaux trophiques. Ces liens sont à la base de la théorie de la stœchiométrie (Sterner & Elser 2002; Brown et al. 2004) qui associe la proportion relative des différents éléments chimiques au sein des organismes végétaux et animaux avec la force de leurs interactions. Chez les insectes herbivores, leur performance et le taux d’ingestion de la ressource sont dépendants de l’équilibre, ou des ratios, entre leurs besoins alimentaires et le contenu de la ressource en différents éléments chimiques (Behmer 2009). Bien que l’azote (N) ou le phosphore (P) soient des éléments limitants dans de nombreux écosystèmes, ils sont pourtant des constituants majeurs des protéines, des glucides, des lipides et des acides nucléiques nécessaires au bon fonctionnement du métabolisme des organismes. L’azote, représenté essentiellement par les protéines, est considéré comme un composé alimentaire clé pour la performance des insectes herbivores (Mattson 1980). Il a par exemple été montré chez une espèce de criquet Ageneotettix deorum (Acrididae) qu’une alimentation composée de feuilles à faible quantité d’azote pouvait diminuer le taux de reproduction et la masse corporelle des individus de cette espèce (Joern & Behmer 1997). De ce fait, les plantes caractérisées par un fort taux d’azote foliaire sont qualifiées de bonne qualité nutritionnelle pour les insectes herbivores (Coley et al. 1985; Grime 1997; Westoby 1999; Cingolani, Posse & Collantes 2005). Elles sont plus appétentes et plus attractives à l’inverse des plantes caractérisées par la présence de composés carbonés complexes pouvant diminuer la digestibilité des feuilles (Coley 1988).
Bien que le compromis entre croissance et défense prédise une sélectivité alimentaire préférentielle envers les plantes riches en azote, les insectes herbivores, notamment les généralistes, ne se focalisent pas nécessairement sur un optimum en termes de quantité d’azote foliaire. Ils peuvent présenter des choix alimentaires plus complexes. Les insectes herbivores, en plus du carbone et de l’azote, ont besoin de consommer d’autres éléments afin d’assurer leur survie, leur développement et leur reproduction (Corio-Costet & Mondy 2013). Une étude récente a analysé la relation entre la structure des populations de criquets et celle des plantes en fonction de la quantité foliaire de 12 éléments nutritifs. Les auteurs montrent que l’azote et le phosphore jouent un rôle prépondérant pour expliquer la densité des populations de criquets au sein de parcelles de prairie, mais ils mettent également en avant l’importance d’autres éléments nutritifs moins étudiés dans la littérature tels que le magnésium ou le sodium pour expliquer la répartition de différentes guildes de criquets (spécialistes ou généralistes) (Joern, Provin & Behmer 2012). Certains insectes herbivores peuvent également montrer des préférences alimentaires envers des plantes moins appétentes caractérisées par un faible taux d’azote foliaire (Schädler et al. 2003b; Cease et al. 2012). Cease et al. (2012) ont montré que l’espèce de criquet Oedaleus asiaticus (Acrididae) préférait consommer des espèces végétales ayant une faible
25 teneur en azote foliaire et un ratio protéine/glucide déséquilibré en faveur des glucides et du carbone. De la même manière, Schädler et al. (2003a) ont montré que l’effet de deux herbivores invertébrés généralistes, Deroceras reticulatum (Agriolimacidae) et Acheta domesticus (Gryllidae), sur la composition spécifique de plantes n’était pas lié à l’appétence des tissus foliaires, indiquant que ces espèces n’ont pas préférentiellement consommé les plantes les plus riches en azote. Les espèces généralistes, face à une ressource de moins bonne qualité, ont développé des mécanismes de régulation et de compensation afin d’ajuster leur prise alimentaire et de satisfaire leurs besoins nutritionnels, notamment les ratios protéines/glucides. Par exemple, il a été montré que l’espèce Locusta migratoria (Acrididae), face à différentes qualités de ressources, est capable de maintenir un ratio protéine/glucides de 1:1 (Simpson & Raubenheimer 2001). La compensation de cette ressource variée et diluée entraine souvent une augmentation de la quantité de ressource ingérée afin d‘atteindre la quantité d’éléments adéquat (Berner, Blanckenhorn & Körner 2005; Behmer 2009). Elle peut aussi passer par des mécanismes plus complexes de reconnaissance des plantes en lien avec leur composition chimique et aussi par des mécanismes d‘apprentissage (Behmer 2009). Ainsi, la qualité nutritionnelle des plantes mais aussi les besoins métaboliques des herbivores peuvent directement impacter la quantité de nourriture ingérée par les insectes et permettent de comprendre la complexité dans interactions trophiques plantes-insectes herbivores (Hillebrand et al. 2009).
Chez les insectes herbivores, la taille ou la masse corporelle sont des déterminants majeurs de nombreuses fonctions, ainsi que de la performance des organismes (Whitman 2008; Chown & Gaston 2010). Ce trait, facilement mesurable, correspond à un proxy de différentes fonctions, plus difficilement mesurables, telles que le taux métabolique, la thermorégulation, les capacités de dispersion et de locomotion, la fécondité, le succès reproducteur, la compétitivité ou encore la prédation (Woodward et al. 2005a). Chez les insectes, les espèces plus grosses sont majoritairement caractérisées par un métabolisme total plus important, c'est-à-dire avec des besoins énergétiques plus grands (Whitman 2008). Ce trait morphologique serait alors lié à la quantité de ressources consommées par les herbivores afin de satisfaire leurs besoins métaboliques. Mais il serait également relié à leurs besoins stœchiométriques. En effet, on peut s’attendre à ce que les herbivores de grande taille consomment une ressource riche en azote pour combler leurs besoins nutritionnels indiquant un lien entre le taux métabolique et les besoins stœchiométriques chez les herbivores (Jeyasingh 2007; Hillebrand et al. 2009).
2.4. Les traits de défense des plantes et leurs effets sur les insectes herbivores
Les plantes ont développé un large éventail de traits de défense pour réguler l’impact des herbivores et la perte des tissus (Herms & Mattson 1992; Moles et al. 2013). Ces défenses ont été regroupées en deux catégories : les défenses dites induites si elles sont mobilisées suite à l’attaque d’un herbivore, et les défenses dites constitutives si elles sont présentes en permanence dans
26
l’organisme de la plante indépendamment des herbivores (Agrawal, Gorski & Tallamy 1999). Deux catégories de traits se distinguent de manière orthogonale aux défenses induites et constitutives. Les traits de défense utilisés par les plantes peuvent être soit chimiques soit physiques. Les défenses chimiques sont extrêmement variées et sont représentées par les métabolites secondaires. Ces métabolites appartiennent à trois grandes catégories qui sont les terpénoïdes, les alcaloïdes et les composés phénoliques (Croteau, Kutchan & Lewis 2000). Elles sont généralement plus néfastes pour les insectes généralistes puisque les spécialistes, au cours de l’évolution ont développé des mécanismes d’adaptation face à ces défenses (Ali & Agrawal 2012). Il a été montré qu’avoir un régime mixte peut dans ce cas présenter un avantage pour les espèces généralistes. En effet, en plus d’améliorer leur survie et leur reproduction (Unsicker et al. 2008), un régime alimentaire varié permettrait aux herbivores généralistes de consommer en plus faible quantité les toxines synthétisées par les plantes (hypothèse de la dilution des toxines) (Behmer, Simpson & Raubenheimer 2002; Marsh et al. 2006). Les espèces généralistes seraient ainsi capables de réguler les défenses des plantes par des mécanismes de détoxication.
Les traits de défense peuvent aussi être liés à des caractéristiques physiques qui peuvent aller de la présence d’épines, de trichomes pouvant libérer des substances irritantes ou du poison mais également de la cire rendant les feuilles lisses et glissantes et difficilement ingérables pour les herbivores (Hanley et al. 2007). Une autre caractéristique physique pouvant influencer l’impact des herbivores est la dureté des feuilles (Peeters, Sanson & Read 2007; Clissold et al. 2009; Santos et al. 2012). Elle est fortement corrélée avec la quantité de fibres dans les feuilles (Coley 1983). Les traits de structure foliaire tels que la dureté ou la teneur en matière sèche des feuilles (leaf dry matter content, LDMC) sont souvent considérés comme des proxy de l’appétence et de la qualité des plantes et de la résistance des feuilles face à l’herbivorie (Elger & Willby 2003). Par exemple, il a été montré chez le criquet australien Chortoicetes terminifera (Acrididae), en manipulant les propriétés biomécaniques de sa plante hôte, qu’une augmentation de la dureté des feuilles provoquait une baisse de son taux de croissance et de sa période de développement (Clissold et al. 2009). Cette baisse de la performance a été associée à une diminution du taux d’apports des nutriments nécessaires au bon développement de cette espèce et à une diminution de l’efficacité de l’assimilation des nutriments dans l’organisme. Ces propriétés biomécaniques peuvent également être reliées à l’énergie nécessaire que doit déployer l’herbivore pour fracturer la feuille et forment ainsi une barrière face à l’herbivorie (Santamaría & Rodríguez-Gironés 2007) diminuant l’accessibilité et la consommation de la ressource par l’herbivore.
Chez les insectes herbivores, plus particulièrement chez les criquets, la forme des mandibules a été proposée comme un trait permettant de distinguer les espèces selon leur régime alimentaire et selon les caractéristiques physiques des plantes (Gangwere 1966; Patterson 1983; ElEla, ElSayed & Nakamura 2010). En 1944, Isely a proposé une catégorisation du régime alimentaire des criquets selon la morphologie de leurs mandibules : les graminivores se nourrissant exclusivement de graminées, les
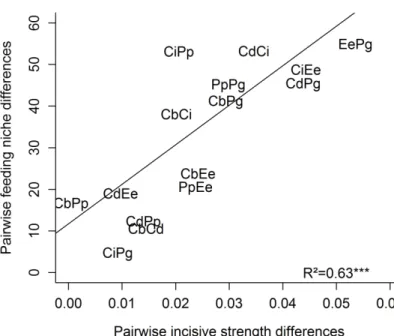
27 forbivores consommant des plantes herbacées non graminéennes et les espèces présentant un régime alimentaire mixte entre les graminivores et les forbivores. Cette étude mettait déjà en avant à partir de traits catégoriels que la morphologie des mandibules pouvait être reliée au régime alimentaire des criquets et permettait de prédire leur sélectivité alimentaire. La force des mandibules a, par la suite, été considérée comme reflétant la capacité des insectes herbivores à couper et mâcher des plantes à feuilles coriaces (Clissold 2007), sous l’hypothèse que les espèces avec de fortes mandibules sont capables de consommer une plus grande gamme de plantes que les espèces qui ont des mandibules plus faibles. Il existerait ainsi un seuil, c'est-à-dire une valeur à partir de laquelle les insectes ne sont plus capables de couper et mâcher la ressource (Seath 1977; Lucas 2004). Plus récemment des traits quantitatifs ont été utilisés afin de décrire la morphologie des mandibules chez 26 espèces d’orthoptères présentes dans des prairies alpines (Ibanez et al. 2013a). Les mandibules des orthoptères sont de type broyeur et sont composées d’une partie distale incisive à fonction coupante et d’une partie proximale molaire à fonction broyeuse (Calatayud & Le Ru 2013). En analysant les liens mécanistiques entre des traits mandibulaires (force des incisives, force des molaires), des traits biomécaniques (dureté, teneur en matière sèche des feuilles) et des traits chimiques (ratio C/N) chez 24 espèces de plantes, les auteurs ont mis en évidence une relation forte entre la force des incisives et la dureté des feuilles confirmant que les mandibules sont reliées à la niche alimentaire des criquets. Cependant, les résultats ne confirment pas l’hypothèse de l’effet seuil dans la mesure où les orthoptères possédant une faible force mandibulaire ont été capables de consommer des feuilles coriaces. Inversement, les criquets possédant une forte force des incisives n’ont pas consommé toutes les plantes mises à leur disposition mais ont majoritairement choisi des plantes à feuilles coriaces. Les mandibules apparaissent donc comme un trait clef qui intègre plusieurs facettes des interactions plantes-insectes herbivores et qui reflète davantage une complémentarité des niches alimentaires qu’un trait de barrière à l’accessibilité alimentaire.
2.5. Les syndromes de traits de plantes impliqués dans les relations
plantes-insectes herbivores
Les défenses développées par les plantes face aux herbivores apparaissent extrêmement variées et posent la question d’une vision unidimensionnelle des relations plantes-herbivores comme pourrait le suggérer le compromis entre croissance et défense. Les corrélations ou syndromes de traits permettraient à partir de la mesure d’un seul ou d’un petit nombre de traits de capturer l’ensemble de la stratégie de défense au sein des plantes. Récemment, une étude portant sur 261 espèces de plantes et 75 sites à travers le globe a tenté d’identifier des corrélations entre 4 traits de défense chimique et 6 trais de défense physique (Moles et al. 2013). Bien que les auteurs aient observé des corrélations par paire de traits, les résultats de cette étude n’ont pas permis d’identifier à cette échelle des syndromes de traits sur l’ensemble des traits considérés. Les auteurs supposent que la pression de sélection
28
exercée par les herbivores agit à une échelle plus locale et est dépendante des conditions abiotiques ainsi que de l’identité spécifique des espèces incluses au sein des interactions plantes herbivores.
A des échelles moins larges en revanche, des corrélations entre un plus petit nombre de traits ont été identifiées comme importantes pour prédire la sélectivité alimentaire des herbivores et l’intensité des interactions trophiques. Par exemple plusieurs études ont montré une corrélation négative entre les traits de défense induite tels que la dureté des feuilles, et les traits reliés à la qualité nutritionnelle des plantes tels que le ratio carbone/azote foliaire conformément au compromis entre croissance et défense. Ces traits peuvent influencer la sélectivité et la préférence alimentaire chez les insectes herbivores généralistes (Perez-Harguindeguy et al. 2003; Santos et al. 2012; Ibanez et al. 2013a). Une autre étude réalisée à partir de 51 espèces végétales et 42 traits de plantes a comparé les dommages causés par quatre groupes d’insectes herbivores, distingués selon leur mode de consommation des plantes. Cette étude montre une corrélation positive entre la concentration en lignine et en azote foliaire qui déterminent en retour l’intensité d’herbivorie : les herbivores consomment davantage les feuilles riches en azote foliaire (Loranger et al. 2012). De la même manière, la teneur en matière sèche des feuilles peut être positivement corrélée à la quantité de phénols (lignine et tanin) qui sont des traits limitant l’accessibilité des herbivores à leur ressource (Elger & Willby 2003).
En consommant préférentiellement les plantes appétentes compétitrices, les insectes herbivores peuvent également modifier la composition des communautés végétales. C’est ce qu’ont montré récemment Heard & Sax (2013) par une expérimentation d’exclusion des herbivores. Ces auteurs observent que les herbivores modifient les interactions compétitives entre plantes et altèrent les patrons d’abondance au sein des communautés de plantes conformément aux prédictions du compromis entre croissance et défense.
Ces études mettent en avant que les traits des plantes ou des insectes herbivores établissent des liens mécanistes permettant de comprendre et de prédire leurs interactions. Chez les plantes ces traits sont nombreux et variés. Ils se référent à des propriétés physiologiques, physiques ou chimiques et sont corrélés le long du gradient opposant les plantes à forte croissance des plantes investissant dans la défense contre les herbivores. Chez les insectes, les traits reliés à l’effet de l’herbivorie sur les plantes reflètent leurs besoins stœchiométriques ainsi que leurs préférences alimentaires qui peuvent, par exemple, pour les insectes généralistes, être reflétés par les traits biomécaniques de leurs mandibules.
29
3 - Utilisation de l’approche fonctionnelle pour établir l’effet des
communautés d’insectes herbivores sur le fonctionnement des
écosystèmes
3.1. Les traits fonctionnels
Les traits fonctionnels sont des caractéristiques morphologiques, physiologiques ou phénologiques quantifiées à l’échelle d’un individu lui permettant de subsister dans son environnement (Lavorel et al. 1997; Violle et al. 2007). Depuis 20 ans, les approches utilisant les traits fonctionnels se sont multipliées en écologie des communautés ainsi qu’en écologie fonctionnelle, notamment sur le modèle plantes, pour comprendre les liens entre les plantes et leur environnement (Wright et al. 2004), les mécanismes d’assemblages des communautés (Keddy 1992; Weiher, Clarke & Keddy 1998; Cornwell & Ackerly 2009) et le fonctionnement des écosystèmes (Lavorel & Garnier 2002; de Bello et al. 2010). Parce qu’ils représentent une fonction pour les plantes mais aussi leurs réponses aux facteurs simples de l’environnement, les traits peuvent être utilisés comme des variables de substitution ou comme un proxy de la niche des espèces (Suding, Goldberg & Hartman 2003; Ackerly & Cornwell 2007; Gross, Suding & Lavorel 2007a; Violle et al. 2007). Ainsi, une des hypothèses fondamentales des approches fonctionnelles est de dire que des espèces ayant des traits similaires vont répondre de la même manière à leur environnement (Suding et al. 2003; Ackerly 2004; McGill et al. 2006).
La niche écologique se réfère à l’ensemble des conditions biotiques et abiotiques assurant la survie et l’ensemble des fonctions de chaque espèce (Hutchinson 1957). Cette définition fait appel à deux concepts : la niche Grinnellienne (Grinnell 1917) qui correspond aux réponses d’une espèce à son environnement, et la niche Eltonienne (Elton 1927) qui regroupe les effets d’une espèce sur son environnement. Ainsi, ces deux concepts distinguent les besoins écologiques d’une espèce reflétés par ses traits de réponse ainsi que ses fonctions caractérisées par ses traits d’effet et par son impact sur son environnement immédiat. Par exemple, chez les plantes, les traits foliaires comme la concentration en azote, la teneur en matière sèche, ou la surface spécifique foliaire définissent un compromis fondamental entre capacité d’acquisition et d’utilisation des ressources (Díaz et al. 2004; Wright et al. 2004). A partir des traits foliaires, deux stratégies écologiques (Sensu Lavorel et al. 1997) peuvent être définies. Ces stratégies opposent des espèces exploitatrices à forte acquisition et faible conservation des ressources qui dominent les milieux productifs, à des espèces conservatrices à forte capacité de conservation des nutriments accumulés dans leurs tissus et qui dominent les milieux pauvres en ressources (Díaz et al. 2004; Wright et al. 2004) (Figure 4). Les traits reflètent alors l’adaptation des espèces aux facteurs abiotiques du milieu. Le long de gradients de fertilité des sols tels que les gradients post culturaux, un remplacement d’espèces exploitatrices par des espèces conservatrices va fortement influencer le fonctionnement de l’écosystème en diminuant la productivité primaire, la décomposition des litières et ralentir le cycle de l’azote (Garnier et al. 2004; Vile, Shipley & Garnier 2006).
30
L’utilisation de ces traits a été proposée comme un moyen de simplifier la complexité apparente du vivant et de pouvoir généraliser/comparer les résultats expérimentaux entre études et entre échelles (écologie comparative) (Lavorel & Garnier 2002; McGill et al. 2006; Shipley, Vile & Garnier 2006; Lavorel et al. 2007). Etant mesurés à l’échelle individuelle, les traits peuvent ensuite être moyennés à l’échelle des communautés et pondérés par l’abondance de chaque espèce permettant de caractériser la structure fonctionnelle de ces communautés (Violle et al. 2007). L’hypothèse du « mass ratio » (Grime 1998) propose que les espèces dominantes des communautés influencent le plus les fonctions écosystémiques car elles représentent la plus grande part de la biomasse des communautés. Les traits permettent ainsi de transférer la réponse des espèces à celle des communautés face aux changements environnementaux, d’intégrer les mécanismes d’assemblage au sein de ces communautés et de prédire leur effet retour sur le fonctionnement des écosystèmes. C’est sur ces deux propriétés des traits que repose le cadre conceptuel des traits de réponse et des traits d’effet.
3.2. Le cadre conceptuel des traits de réponse et des traits d’effet
Fondé sur les propriétés des traits fonctionnels, un cadre conceptuel permettant d’analyser à l’échelle des communautés la réponse des espèces aux gradients écologiques ou changements environnementaux et leurs effets sur le fonctionnement des écosystèmes a été développé (le response-effect framework Lavorel & Garnier 2002; Suding & Goldstein 2008). Une hypothèse centrale de ce cadre, appelée l’hypothèse du « Holy Grail », permettrait d’établir, à partir des mêmes traits, un lien direct entre les processus liés à l'assemblage ou la dynamique des communautés et le fonctionnement des écosystèmes (Figure 5). Elle permettrait également de simplifier l’étude des écosystèmes et de faire le lien entre les changements environnementaux et le fonctionnement des écosystèmes en utilisant des variables continues, quantifiables et comparables entre systèmes d’études en s’affranchissant de l’identité taxonomique des espèces (McGill et al. 2006).
31
Figure 5. Schéma du cadre conceptuel reliant les traits de réponse aux changements environnementaux et les
traits d’effet sur le fonctionnement des écosystèmes. Extrait de Lavorel & Garnier 2002.
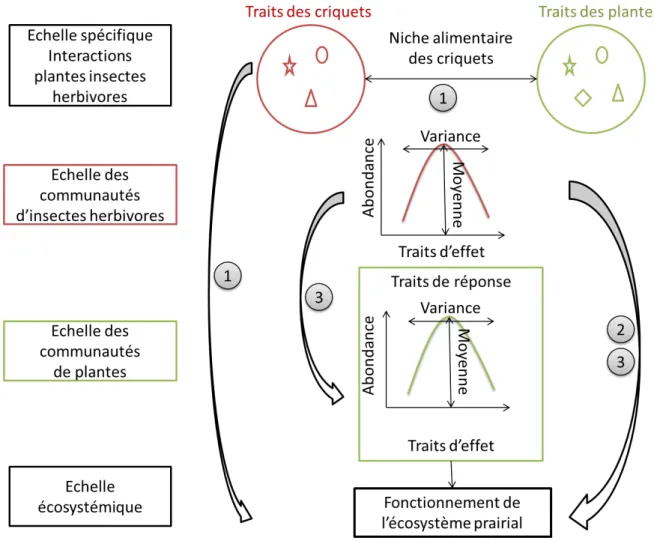
Le cadre des traits de réponse et des traits d’effet a été majoritairement utilisé chez les plantes en mettant en évidence un lien fort entre les traits de réponse des plantes liés à la disponibilité de la ressource tels que la surface spécifique foliaire, la concentration en azote foliaire ou la hauteur végétative, et leur effet sur le fonctionnement de l’écosystème tel que la productivité (Lavorel et al. 2007; Gross et al. 2008; Pakeman 2011; Laliberté & Tylianakis 2012). Récemment, il a été proposé d’adapter le cadre des traits de réponse et des traits d’effet à l’étude des interactions trophiques. En effet, les processus écosystémiques reposent en partie sur les interactions entre les plantes et les niveaux trophiques supérieurs (de Bello et al. 2010; Cardinale et al. 2012; Mulder et al. 2012) tels que le maintien de la fertilité des sols (Schmitz 2008), la productivité (Moretti et al. 2013), ou la pollinisation (Kremen et al. 2007). Actuellement, il existe une réelle nécessité d’élargir les études portant sur les liens entre biodiversité et fonctionnement des écosystèmes aux interactions trophiques afin d’avoir une vision plus intégrative de la complexité des systèmes (Cardinale et al. 2006, 2012; Hillebrand & Matthiessen 2009; Reiss et al. 2009; Lavorel et al. 2013). A l’échelle des communautés, les traits qui permettent de prédire la réponse d’un niveau trophique supérieur aux changements environnementaux et de prédire comment cette réponse se transfère au niveau trophique inférieur et au fonctionnement des écosystèmes permettraient d’importantes avancées dans l’étude des relations biodiversité-fonctionnement des écosystèmes (Figure 6).
32
Figure 6. Schéma du cadre conceptuel des traits de réponse et des traits d’effet adapté à l’étude des interactions
trophiques. Adapté de Lavorel et al. 2013.
Bien que ce cadre soit peu utilisé pour l’étude des interactions trophiques, il a été montré qu’il existe des liens entre les traits de réponse des plantes aux facteurs abiotiques et leurs traits d’effet sur d’autres niveaux trophiques, qui en retour influencent les processus écosystémiques. Par exemple, l’analyse corrélative des interactions entre les traits des plantes et les paramètres fonctionnels des organismes microbiens du sol a mis en évidence que les traits reliés à la réponse des plantes à la disponibilité de la ressource et au compromis entre exploitation et conservation de la ressource chez les plantes (Wright et al. 2004), peuvent également influencer l’activité des microorganismes du sol ainsi que la production de biomasse et la rétention du carbone et de l’azote dans le sol (Grigulis et al. 2013).
Quelques études ont, à partir d’analyses corrélatives, identifié des relations à l’échelle des communautés entre les traits des insectes herbivores et les traits des plantes le long de gradients environnementaux (van der Plas, Anderson & Olff 2012; Frenette-Dussault, Shipley & Hingrat 2013). Ces études montrent que l’influence des facteurs abiotiques sur la structure fonctionnelle des communautés de plantes peut en retour influencer celle des communautés d’insectes herbivores. Par exemple, van der Plas et al. (2012) ont montré le long d’un gradient de perturbation que les patrons de variations des traits au sein de communautés de criquets étaient influencés par la structure des communautés de plantes (contrôle « botttom-up »). Les communautés à forte hauteur végétative favorisent les communautés de criquets de grande taille corporelle et les communautés à forte surface