© Sophie Castonguay-Paradis, 2020
Influence des apports alimentaires sur les médiateurs
plasmatiques de l’endocannabinoïdome
Mémoire
Sophie Castonguay-Paradis
Maîtrise en nutrition - avec mémoire
Maître ès sciences (M. Sc.)
Influence des apports alimentaires sur les
médiateurs plasmatiques de l’endocannabinoïdome
Mémoire
Sophie Castonguay-Paradis
Sous la direction de :
Résumé
Les endocannabinoïdes et leurs congénères, aussi appelés les médiateurs de l’endocannabinoïdome, sont des molécules signalétiques dérivées d’acides gras ayant de nombreux rôles métaboliques, notamment dans le métabolisme énergétique et la prise alimentaire. Ces molécules sont produites dans plusieurs tissus, incluant le cerveau, l’intestin et le tissu adipeux, mais se retrouvent également dans la circulation sanguine. Le mécanisme par lequel les médiateurs de l’endocannabinoïdome se retrouvent en circulation n’est pas encore bien décrit dans la littérature de même que l’impact métabolique de leur présence sur les différents tissus. Notre objectif est donc d’établir la relation entre la composition corporelle, les habitudes alimentaires et les niveaux des médiateurs circulants de l’endocannabinoïdome chez l’humain. Nous avons observé de fortes corrélations entre les mesures de composition corporelle et anthropométriques avec les médiateurs de l’endocannabinoïdome, bien que la direction de la relation ne puisse être établie pour le moment. De plus, notre étude a démontré peu d’associations entre la consommation des différents macronutriments et les médiateurs de l’endocannabinoïdome plasmatique alors que la consommation de certains acides gras était, quant à elle, associée aux médiateurs correspondants, surtout en ce qui concerne la consommation des acides gras oméga-3. Ainsi, ces résultats suggèrent qu’il serait possible de moduler les médiateurs de l’endocannabinoïdome plasmatique avec l’alimentation, particulièrement par la composition en acides gras de la diète, alors que, malgré le lien clair avec la composition corporelle, la direction de la relation reste à éclaircir.
Abstract
Endocannabinoids and their congeners, also known as endocannabinoidome mediators, are signalling molecules derived from fatty acids with many metabolic roles, including energy metabolism and the regulation of food intake. These molecules are biosynthesized in several tissues, including the brain and intestine, but are also found in circulation. The mechanism by which endocannabinoidome mediators appear in circulation and their metabolic impact on different tissues is not yet well described in the literature. The aim of the study was to establish the interrelation between body composition, dietary habits and circulating endocannabinoidome mediator levels in humans. We have observed strong correlations between parameters of body composition, anthropometric measures and endocannabinoidome mediators, although the direction of the relationship cannot be established. We did not observe strong associations between the consumption of macronutrients and circulating endocannabinoidome mediator levels. We could however observe interesting associations between plasma mediators and habitual intake of their corresponding fatty acid precursors, associations that could be validated in an intervention study. These results suggest that it would be possible to modulate plasma endocannabinoidome mediators with diet, particularly by modulating fatty acid composition. Altogether, these findings are suggestive of associations between plasma endocannabinoidome mediator profiles, body composition and dietary composition but warrant more investigation in order to clarify their relationship.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vi
Liste des tableaux ... vii
Liste des abréviations, sigles, acronymes ... viii
Avant-propos ... ix
Introduction ... 1
1. Système endocannabinoïde et endocannabinoïdome ... 1
2. Rôles physiologiques des médiateurs de l’endocannabinoïdome ... 4
2.1. Métabolisme énergétique et prise alimentaire ... 4
2.2. Obésité ... 7
2.3. Complications reliées à l’obésité et santé métabolique ... 7
3. Facteurs influençant les niveaux plasmatiques des médiateurs de l’endocannabinoïdome ... 11
3.1. Composition corporelle et mesures anthropométriques ... 11
3.2. Apports alimentaires ... 14
3.3. Axe microbiome-endocannabinoïdome ... 21
3.4. Santé mentale, comportements alimentaires et activité physique ... 22
Mise en contexte, objectifs et hypothèses ... 23
Chapitre 1: Dietary fatty acid intake determine circulating endocannabinoidome
signaling beyond the effect of body fat ... 25
Résumé ... 26
Abstract ... 28
Introduction ... 29
Materials and methods ... 31
Results ... 34 Discussion ... 37 Conclusion ... 41 Acknowledgements ... 42 References ... 43 Tables ... 49 Figures... 53 Conclusion ... 57 Bibliographie ... 61
Liste des figures
Introduction
Figure 1. Structure moléculaire des endocannabinoïdes. ... 2 Chapitre 1
Figure 1. Hierarchical clustering based on principal component analysis (PCA)
of circulating eCBome mediators ... 54 Figure 2. Plasma eCBome mediator levels stratified by tertiles of usual fatty acid
intakes ... 55 Figure 3. Circulating eCBome mediator levels before (PRE) and after (POST) a
Liste des tableaux
Introduction
Tableau 1. Synthèse des médiateurs de l’endocannabinoïdome et leurs acides gras
précurseurs. ... 3 Tableau 2. Synthèse des études sur les associations entre les médiateurs de
l’endocannabinoïdome et la composition corporelle chez l’humain. ... 13 Tableau 3. Synthèse des études sur les associations entre les médiateurs de
l’endocannabinoïdome et la supplémentation en acides gras oméga-3. ... 19 Tableau 4. Synthèse des études sur les associations entre les médiateurs de
l’endocannabinoïdome et les apports alimentaires chez l’humain. ... 20
Chapitre 1
Table 1. Anthropometric and metabolic characteristics of the subjects of the
cross-sectional cohort. ... 50 Table 2. Circulating NAE and 2-MAG in the entire cohort and in a subset of 116
men and women matched for age and BMI. ... 51 Table 3. Pearson correlation coefficients between circulating NAE and 2-MAG
and body composition and fat distribution. ... 52 Table 4. Pearson correlation coefficients between circulating NAE and 2-MAG
and dietary composition adjusted for adiposity measures. ... 53
Supplementary Table 1. Dietary composition of the Control and the
Liste des abréviations, sigles, acronymes
2-AG : 2-arachidonoyl-glycérol 2-DHG : 2-docosahexaénoyl-glycérol 2-DPG : 2-docosapentaénoyl-glycérol 2-EPG : 2-eicosapenaénoyl-glycérol 2-LG : 2-linoléoyl-glycérol 2-MAG : 2-monoacyl-glycérols 2-OG : 2-oléoyl-glycérol 2-PG : 2-palmitoyl-glycérol AEA : N-arachidonoyl-éthanolamine CB1 : récepteur cannabinoïde 1 CB2 : récepteur cannabinoïde 2 9-THC : delta-9-tétrahydrocannabinol DHEA : N-docosahexaénoyl-éthanolamine EPEA : N-eicosapentaénoyl-éthanolamine FAAH : fatty acid amide hydrolase 1 GPR55 : G protein-coupled receptor 55 GPR110 : G protein-coupled receptor 110 GPR119 : G protein-coupled receptor 119 IMC : indice de masse corporelleLEA : N-linoléoyl-éthanolamine LPS : lipopolysaccharides NAE : N-acyl-éthanolamines OEA : N-oleoyl-éthanolamine PEA : N-palmitoyl-éthanolamine
PPAR : peroxisome proliferator-activated receptor alpha PPAR : peroxisome proliferator-activated receptor gamma TRPV1 : transient receptor potential vanilloid 1
Avant-propos
Mon mémoire présentera les différentes étapes du projet eMECA sur lequel j’ai concentré mes efforts durant les deux dernières années. Ce projet s’est intéressé à connaître les différents paramètres influençant les niveaux des médiateurs de l’endocannabinoïdome plasmatique. J’ai eu la chance de débuter mon parcours au 2e cycle au tout début du projet eMECA où, concrètement, mon rôle a été de collaborer au recrutement des participants et de prendre en charge les différentes visites au centre de recherche. Mon implication dans le projet s’est poursuivie par l’analyse quantitative des résultats. Ces derniers seront soumis prochainement dans une publication intitulée : «Dietary fatty acid intake determine circulating endocannabinoidome signaling beyond the effect of body fat». J’ai rédigé comme première auteure le manuscrit inclus dans ce mémoire, mais la contribution des co-auteurs à la version finale est indéniable.
La réalisation du projet eMECA a été possible grâce à la Chaire d’excellence en recherche du Canada sur l’axe microbiome-endocannabinoïdome dans la santé métabolique (CERC-MEND) et tout particulièrement, par l’apport scientifique considérable, voir essentiel, du titulaire, le professeur Vincenzo Di Marzo. Il s’agit d’une grande opportunité d’avoir pu travailler entourer des personnes aussi compétentes et passionnées qui composent la Chaire et ce, autant les professeurs, professionnels de recherche que les étudiants.
Également, j’aimerais sincèrement remercier mon directeur de recherche, Dr Alain Veilleux, pour m’avoir offert sa confiance pour travailler dans son équipe et de m’avoir si bien dirigée durant toutes les étapes de ma maîtrise. Son positivisme, même dans mes moments de doute, m’a toujours encouragée, alors que sa passion pour la recherche et sa curiosité ont été très inspirantes. J’aimerais aussi remercier les professionnels de recherche impliqués tout au long de mon parcours, Julie, Sébastien et Nadine pour leur aide, le partage de leurs connaissances et surtout, leur précieux temps. Mes collègues étudiants de l’équipe Veilleux m’ont aussi grandement soutenue, mais surtout, ils sont tous devenus des amis inestimables pour moi. Bénédicte, Florent, Frédéric et Gabrielle, je suis choyée de pouvoir vous compter dans ma
vie et merci pour tous les bons moments…scientifiques ou pas! Aussi, mes amies «INAFiennes», vous rendez mes journées tellement agréables et votre bonne humeur est contagieuse. Quel plaisir de travailler en votre compagnie!
Merci à mes précieuses amies de m’avoir encouragée chacune à votre façon pendant ces deux dernières années, sur le plan professionnel bien sûr, mais encore plus sur le plan personnel. Vous êtes mon équilibre!
Un petit mot pour mon frère qui est toujours partant pour une activité sportive …et une petite blague à mon sujet, deux choses qui me permettent de décrocher à 100%.
Finalement, j’aimerais remercier mes parents qui m’ont supportée dans mes projets de toutes les façons possibles et imaginables. Merci pour vos conseils, vos encouragements et votre compréhension. Vous m’avez permis de persévérer durant tout mon parcours universitaire et vous faites assurément partie du succès de cet accomplissement qu’est l’achèvement de ma maîtrise.
Introduction
1.
Système endocannabinoïde et endocannabinoïdome
L’intérêt scientifique précédant la découverte des endocannabinoïdes a d’abord été porté sur la principale composante psychoactive dans la plante de Cannabis Sativa, soit le delta-9-tétrahydrocannabinol (9-THC). Cette molécule possède une affinité pour certains
récepteurs présents dans de nombreux tissus de l’organisme : le récepteur cannabinoïde 1 (CB1) et le récepteur cannabinoïde 2 (CB2). Les récepteurs CB1 sont les
récepteurs couplés aux protéines G les plus présents dans le cerveau et sont responsables notamment des effets antiémétique et orexigène associés à la molécule 9-THC (1). Suite à
l’identification des récepteurs cannabinoïdes, les chercheurs se sont intéressés à connaître les molécules endogènes qui partageaient également une affinité pour ces derniers, d’où la découverte des endocannabinoïdes. Les endocannabinoïdes sont des molécules signalétiques dérivées des acides gras contenus dans les phospholipides membranaires ou dans les triglycérides sanguins qui possèdent de nombreux rôles métaboliques. Ces molécules sont le
N-arachidonoyl-éthanolamine (AEA) et le 2-arachidonoyl-glycérol (2-AG), dérivées de
l’acide arachidonique, et possèdent, respectivement, un groupement éthanolamine ou glycérol (voir figure 1). Les endocannabinoïdes sont produits par de nombreux tissus, notamment le cerveau, le tissu adipeux, l’intestin, mais aussi par certaines bactéries qui composent le microbiote intestinal (2–4). Ces molécules ont une action locale, étant donné la biosynthèse des endocannabinoïdes et la présence des récepteurs dans de nombreux tissus, mais leur action pourrait aussi être systémique, car ces dernières sont également présentes dans la circulation sanguine. Parmi les nombreux rôles de ces molécules, on compte notamment le contrôle de la prise alimentaire, leur implication dans le métabolisme énergétique, la réponse immunitaire ainsi que le bien-être psychologique (1,3). Les deux endocannabinoïdes, AEA et 2-AG, font partie du système endocannabinoïde qui comprend, en plus de ces deux molécules, les récepteurs CB1 et CB2 ainsi que les enzymes de
biosynthèse, dont la NAPE-PLD (N-acyl-phosphatidylethanolamine-hydrolyzing
phospholipase D), DGL (sn-1-specific diacylglycerol lipase-alpha) et DGL, et les
enzymes de dégradation, dont la FAAH (fatty acid amide hydrolase 1) et MAGL (monoacylglycerol lipase). Par contre, au fil des dernières années, de nombreuses molécules
chimiquement semblables, c’est-à-dire dérivées de différents acides gras et possédant un groupement éthanolamine ou glycérol, ont été identifiées et partagent également certains récepteurs et/ou enzymes avec les endocannabinoïdes (5). On peut diviser celles-ci en deux grandes familles, soit celles dérivées des éthanolamines, les N-acyl-éthanolamines (NAE) et celles dérivées du glycérol, les 2-monoacyl-glycérols (2-MAG) (voir tableau 1). Bien que partageant certaines voies métaboliques avec les endocannabinoïdes, les molécules des deux familles possèdent aussi leurs propres récepteurs et enzymes. Ainsi, pour mieux représenter les nouvelles composantes associées au système endocannabinoïde, le terme «endocannabinoïdome» est maintenant utilisé. Cette nouvelle appellation englobe les endocannabinoïdes ainsi que toutes les molécules congénères, leurs récepteurs et leurs enzymes de biosynthèse et de dégradation (5,6). En plus de la famille des NAE et 2-MAG, l’endocannabinoïdome inclut d’autres molécules dérivées d’acides gras, notamment les
N-acyl-dopamines, N-acyl-sérotonines et N-acyl-taurines qui partagent aussi certains
récepteurs et enzymes avec les deux familles. On peut donc voir l'endocannabinoïdome comme une extension considérable du système endocannabinoïde où les interactions sont nombreuses et très complexes (5). Malgré les nombreux médiateurs lipidiques présents dans l'endocannabinoïdome, les plus étudiés demeurent majoritairement l'AEA et le 2-AG, quoique l’impact de leur présence dans le plasma sur les différents tissus et la santé métabolique demeure inconnu. Cependant, la présence des endocannabinoïdes dans les différents tissus et l’activation locale des récepteurs démontrent clairement des actions nombreuses, complexes et voir même, selon la molécule ou le récepteur impliqué, des actions opposées sur l’organisme.
Figure 1. Structure moléculaire des endocannabinoïdes.
N-arachidonoyl-éthanolamine (AEA)
(AEA)
Tableau 1. Synthèse des médiateurs de l’endocannabinoïdome et leurs acides gras précurseurs. *
Médiateurs de
l’endocannabinoïdome Acides gras précurseurs
Structure chimique
N-acyl-éthanolamines (NAE) N-arachidonoyl-éthanolamine
(AEA ou anandamide) Acide arachidonique
C20:4 (oméga-6)
N-palmitoyl-éthanolamine
(PEA) Acide palmitique C16:0
N-oléoyl-éthanolamine
(OEA) Acide oléique C18:1
N-linoléoyl-éthanolamine
(LEA) Acide linoléique
C18:2 (oméga-6)
N-eicosapentaénoyl-éthanolamine
(EPEA) Acide eicosapentaénoïque (EPA)
C20:5 (oméga-3)
N-docosapentaénoyl-éthanolamine
(DPEA) Acide docosapentaénoïque (DPA)
C22:5 (oméga-3)
N-docosahexaénoyl-éthanolamine
(DHEA) Acide docosahexaénoïque (DHA)
C22:6 (oméga-3) 2-monoacyl-glycérols (2-MAG)
2-arachidonoyl-glycérol
(2-AG) Acide arachidonique C20:4
2-palmitoyl-glycérol
(2-PG) Acide palmitique C16:0
2-oléoyl-glycérol
(2-OG) Acide oléique C 18:1
2-linoléoyl-glycérol
(2-LG) Acide linoléique
C18:2 (oméga-6) 2-eicosapentaénoyl-glycérol
(2-EPG) Acide eicosapentaénoïque (EPA)
C20:5 (oméga-3) 2-docosapentaénoyl-glycérol
(2-DPG) Acide docosapentaénoïque (DPA)
C22:5 (oméga-3) 2-docosahexaénoyl-glycérol
(2-DHG) Acide docosahexaénoïque (DHA)
C22:6 (oméga-3)
2.
Rôles
physiologiques
des
médiateurs
de
l’endocannabinoïdome
2.1. Métabolisme énergétique et prise alimentaire
Bien qu’il soit établi que les médiateurs de l’endocannabinoïdome ont un rôle ubiquitaire dans l’organisme, ils possèdent des fonctions bien définies dans le métabolisme énergétique et la prise alimentaire.
Le récepteur CB1 est le plus impliqué dans ce rôle métabolique. La liaison des
endocannabinoïdes sur ce récepteur au niveau du système nerveux central provoque une augmentation de la prise alimentaire, mais agit également en supprimant les signaux anorexigènes (1,7). Les régions du cerveau étant impliqué sont notamment l’hypothalamus, où le système endocannabinoïde est stimulé par le jeûne et inhibé par la présence de leptine, une hormone anorexigène (1). L’activation du système endocannabinoïde contribue à l’amélioration du signal de l’orexine (un neurotransmetteur qui stimule l’appétit) ainsi qu’à l’augmentation de l’appétit suite à une privation de nourriture. Les récepteurs CB1, quoique
présents en majeure partie dans le système nerveux central, sont aussi retrouvés dans de nombreux autres organes en périphérie, notamment au niveau du tractus gastro-intestinal et plus précisément, dans le duodénum. La présence des récepteurs CB1 dans ce tissu
contribuerait également à inhiber les signaux de satiété à la suite d’un jeûne (1). Non seulement le jeûne contribue à stimuler le système endocannabinoïde, mais la prise alimentaire d’aliments palatables, c’est-à-dire des aliments qui procurent une sensation agréable lorsque consommés (souvent des aliments riches en gras et en sucre), peut également avoir cet effet. Effectivement, au niveau du système mésolimbique, la consommation de tels aliments vient créer une synergie entre le système endocannabinoïde, le système des opioïdes et le signal dopaminergique, toutes des actions impliquées dans la sensation de bien-être et de faim hédonique. Toutes ces actions ainsi combinées favorisent la prise alimentaire. Par ailleurs, il est intéressant de constater que la stimulation des récepteurs CB1 au niveau du cerveau peut elle aussi contribuer à la consommation d’aliments
palatables. En effet, autant l’administration orale de 9-THC (ligand exogène des
souris augmente la préférence pour ce type d’aliment (8). De surcroît, on observe que l’administration d’un médicament agoniste inverse des récepteurs CB1, le rimonabant,
diminue le désir pour les aliments qui contiennent une grande quantité de sucre et de gras (9). Ces observations suggèrent que la consommation d’aliments palatables, en plus d’apporter un apport énergétique élevé, contribue à entretenir le goût pour ce type d’aliment. Ainsi, l’un des facteurs endogènes à la stimulation de la prise alimentaire par le système endocannabinoïde pourrait être l’alimentation elle-même.
Considérant que les récepteurs CB1 possèdent une action bien précise sur la prise alimentaire
et l’adiposité, il s’agit d’une cible thérapeutique intéressante pour les compagnies pharmaceutiques pour s’attaquer au problème de l’obésité. Un médicament fut commercialisé sous le nom de rimonabant en 2005 agissant comme agoniste inverse aux récepteurs CB1 avec comme indication thérapeutique de diminuer la prise alimentaire chez
des sujets obèses (9). Plus spécifiquement, l’efficacité du médicament a été notamment documentée dans la «RIO-Europe study», qui a suivi une cohorte de plus de 1500 personnes présentant un IMC >30 kg/m2 sur une période d’un an (9). Alors que tous les participants ont
été soumis à une intervention de diminution de la prise alimentaire, le groupe contrôle a perdu en moyenne 1,8 kg comparativement à une perte de poids significativement plus élevée pour les groupes soumis à deux doses distinctes de rimonabant, soit respectivement une perte de 3,4 kg et 6,6 kg. De plus, la diminution du poids s’est accompagnée de plusieurs améliorations sur les paramètres de santé métabolique pour le groupe traité avec une plus haute dose de rimonabant, comme la circonférence de taille, les triglycérides, la glycémie à jeun et le cholestérol HDL. Après un an, ces améliorations ont d’ailleurs mené à une prévalence moins élevée du syndrome métabolique chez le groupe rimonabant à plus haute dose comparativement au groupe placebo. Les changements observés dans la perte de poids et plusieurs paramètres métaboliques ont été maintenus après 2 ans d’intervention (10). Ces résultats furent très encourageants et démontrent bien les effets contributoires du système endocannabinoïde sur la perte de poids, en plus d’apporter des effets positifs sur divers paramètres de la santé métabolique. Malgré ces résultats prometteurs, la mise en marché du rimonabant a aussi permis de démontrer des effets secondaires importants sur la santé mentale des participants, c’est-à-dire un taux de dépression, d’anxiété et d’idées suicidaires
plus élevé, ce qui a mené rapidement au retrait clinique de celui-ci (11,12). On peut tirer de cette expérience que, malgré un impact positif sur l’obésité et ses complications, il est maintenant clair que l’implication du système endocannabinoïde va bien au-delà du métabolisme énergétique, mais agit également de façon importante sur le bien-être psychologique (13). De plus, l’expérience avec le rimonabant aura aussi permis de constater la complexité et la difficulté à agir sur les différentes composantes du système endocannabinoïde étant donné son implication dans de nombreuses activités métaboliques. Suite à l’échec obtenu avec une thérapie pharmacologique, on peut se demander si des facteurs externes moins drastiques que la médication pourraient être la clé pour moduler l’action des endocannabinoïdes et leurs congénères.
Bien que l’activation du récepteur CB1 est connue pour favoriser la prise alimentaire, l’action
d’autres molécules et récepteurs de l’endocannabinoïdome pourrait, contrairement aux récepteurs CB1, augmenter l’effet de la satiété. En effet, chez la souris, une étude a démontré
que l’augmentation d’AEA, PEA, OEA et 2-AG dans l’intestin provoquée par une diminution de la FAAH, soit l’une des enzymes de dégradation des NAE, entraine une diminution de la motilité intestinale (14). Cet effet engendre un ralentissement de la progression du bol alimentaire dans le tractus gastro-intestinal, ce qui contribue au prolongement de l’effet de satiété. Une autre étude s’est intéressée spécifiquement à la molécule d’OEA et son impact sur la vidange gastrique chez la souris (15). Elle démontre que l’administration orale d’OEA peut diminuer de façon significative la vidange gastrique, ce qui contribue également à prolonger l’effet de satiété après un repas. Quoique préliminaires, ces résultats suggèrent que l’action de certaines molécules et récepteurs présents dans le tractus gastro-intestinal pourrait avoir des effets qui contribuent à augmenter la satiété. Ces résultats s’expliquent notamment par le fait que l’OEA ne possède pas d’affinité pour les récepteurs CB1, qui sont les récepteurs
les plus impliqués dans la prise alimentaire, mais plutôt pour les récepteurs PPAR, GPR119 et TRPV1. Ainsi, on constate que la réponse métabolique des endocannabinoïdes et leurs congénères dépendent du récepteur impliqué d’où la difficulté à prédire l’action isolée d’une seule molécule.
2.2. Obésité
L’endocannabinoïdome, bien que possédant un rôle dans la modulation de la prise alimentaire, est aussi impliqué dans les mécanismes physiologiques reliés à l’adiposité corporelle. La synergie de ces deux rôles sur le système nerveux central et le tissu adipeux est très certainement un facteur contributoire à l’obésité. D’ailleurs, l’activation de CB1 dans
le système nerveux central favorise l’accumulation des graisses, en augmentant la lipogenèse, diminuant la lipolyse et la thermogénèse dans le tissu adipeux brun (16). Le tissu adipeux peut non seulement synthétiser des médiateurs de l’endocannabinoïdome, mais possède également des récepteurs CB1 qui lui permettent d’être un organe cible pour ces
molécules (17,18). Ainsi, de façon concomitante à l’activation des récepteurs CB1 dans le
système nerveux central, on observe également une action locale dans la cellule adipeuse par l’activation de ces mêmes récepteurs, notamment une diminution de l’oxydation lipidique dans la mitochondrie, une diminution de la thermogénèse dans le tissu adipeux brun et une augmentation de l’entrée du glucose dans la cellule, soit un précurseur de la synthèse des triglycérides et des acides gras (16). L’activation du récepteur PPAR retrouvé dans les cellules adipeuses et possédant une affinité pour l’AEA contribue également à l’adiposité (18). Dans le tissu adipeux, l’activation de ce récepteur participe à la différentiation des adipocytes ainsi qu’à la mise en réserve des graisses. Ainsi, la liaison sur le récepteur CB1 et PPAR favorise la lipogenèse et la mise en réserve de tissus adipeux par
une activation locale et périphérique, contribuant ainsi de façon synergique à l’obésité.
2.3. Complications reliées à l’obésité et santé métabolique
L’implication de l’endocannabinoïdome dans le métabolisme du glucose et lipidique pourrait aussi être contributoire aux complications observées en présence d’obésité (16,17,19,20). D’une part, on observe chez les patients atteints de diabète de type II des niveaux plus élevés d’endocannabinoïdes plasmatiques et de leurs congénères, soit le 2-AG, l’AEA, OEA, PEA et LEA, que leur homologue non-diabétique présentant une adiposité comparable (20). De plus, on remarque que, indépendamment de l’IMC, les différents marqueurs de résistance à l’insuline sont corrélés de façon positive avec l’expression de CB1 dans le tissu adipeux (21).
d’un état de résistance à l’insuline, notamment dans le tissu adipeux, mais également dans le muscle, le foie, le pancréas et l’intestin. Ainsi, une augmentation synergique des récepteurs et des médiateurs plasmatiques de l’endocannabinoïdome suggère une altération de l’endocannabinoïdome en présence de résistance à l’insuline. Alors que l’activation des récepteurs CB1 est associée à une diminution de la sensibilité à l’insuline, la présence des
récepteurs GPR119, majoritairement exprimé dans les cellules bêta du pancréas et dans les cellules entéroendocrines, est quant à elle impliquée dans l’augmentation de la sensibilité à l’insuline (22). Ces récepteurs, contrairement aux récepteurs cannabinoïdes, ont une affinité pour les molécules de l’endocannabinoïdome dérivées d’acide oléique et linoléique, soit respectivement l’OEA, 2-OG et LEA, 2-LG (5). La liaison de ces molécules aux récepteurs GPR119 stimule la production d’insuline par le pancréas, de même que la libération des incrétines par l’intestin, soit le GLP-1 (glucagon-like peptide-1) et le GIP (glucose-dependent insulinotropic peptide) (22). Les analogues au GLP-1 sont actuellement utilisés en contexte clinique comme traitement du diabète de type II pour abaisser la glycémie et le poids corporel. Considérant que l’activation des récepteurs GPR119 agit de façon synergique sur deux composantes importantes impliquées dans le diabète de type II, l’implication de ce récepteur dans le métabolisme du glucose est claire et amène un intérêt comme cible thérapeutique pour le traitement de cette maladie.
L’endocannabinoïdome serait aussi impliqué dans d’autres complications métaboliques qu’on associe à l’obésité. Une étude utilisant un modèle murin a permis de démontrer que l’utilisation de deux perfusions, soit des agonistes ou des antagonistes aux récepteurs CB1,
engendrait des impacts opposés sur les niveaux plasmatiques des lipopolysaccharides (LPS), soit des molécules pro-inflammatoires (4). Selon les auteurs, lors de l’activation des récepteurs CB1, on observe une augmentation de la perméabilité intestinale qui permet le
passage des LPS de la lumière intestinale vers la circulation. Cet effet contribue ainsi à l’inflammation systémique. L’augmentation en circulation des LPS participe aussi à l’augmentation de la lipogenèse au niveau du tissu adipeux, notamment par l’activation locale du système endocannabinoïde. D’ailleurs, une différence significative entre les enzymes de biosynthèse et de dégradation des principaux endocannabinoïdes a été observée entre les souris minces comparativement à leurs homologues obèses. L’expression des gènes de
NAPE-PLD, soit la principale enzyme impliquée dans la biosynthèse de l’AEA, était significativement plus élevée chez les individus obèses, alors que l’expression de la FAAH, principale enzyme de dégradation, était significativement plus basse. De façon concomitante, l’expression du récepteur CB1 ainsi que les concentrations d’AEA était aussi augmentée dans
le tissu adipeux chez les souris obèses. Ces évidences suggèrent une altération du système endocannabinoïde dans le tissu adipeux en condition d’obésité contribuant à l’inflammation systémique. Le récepteur CB2, majoritairement exprimé dans les cellules du système
immunitaire, est lui aussi impliqué dans l’inflammation, mais plus précisément comme anti-inflammatoire et dans la diminution de la douleur (5,23,24). D’ailleurs, il se trouve souvent surexprimé en condition pathologique, tel qu’en condition inflammatoire. Bien qu’il semble être une cible thérapeutique intéressante dans la modulation de ces conditions, l’efficacité clinique des antagonistes aux récepteurs CB2 reste à prouver (25). Son rôle sur l’immunité
est aussi non-négligeable puisque l’immunosuppression est l’un des effets secondaires importants à considérer, bien qu’il pourrait être souhaitable dans certaines conditions (26). L’inflammation et la modulation de la douleur sont aussi contrôlées par la liaison des médiateurs de l’endocannabinoïdome sur le récepteur TRPV1, exprimé principalement dans les cellules du système nerveux central (5). Son activation contribue à l’augmentation de la perception de la douleur, mais augmente également l’inflammation neurogène par la libération de médiateurs inflammatoires (27). Alors que les récepteurs CB1 et CB2 lient
uniquement les endocannabinoïdes, ce récepteur possède une affinité pour de nombreuses molécules de la famille des NAE principalement, mais également pour le 2-OG et 2-LG. On peut donc observer que de nombreux médiateurs sont impliqués dans la modulation de l’inflammation et que la réponse inflammatoire obtenue est tributaire aux récepteurs impliqués.
D’autres récepteurs associés à l’endocannabinoïdome, soit le GPR55 et GPR110, sont deux récepteurs couplés aux protéines G qui ont longtemps été définis comme des récepteurs orphelins et demeurent, encore à ce jour, des ligands controversés des endocannabinoïdes (28,29). Bien que leurs rôles sont encore incertains, on attribue au GPR55 des rôles opposés aux récepteurs cannabinoïdes, CB1 et CB2, puisqu’il favoriserait la
au glucose (5). Il aurait également une activité stimulante des voies métaboliques associées à la douleur. Le récepteur GPR110 aurait une affinité pour le DHEA, dérivé de l’acide gras oméga-3 DHA, acide gras auquel on attribuerait des impacts positifs sur la fonction cognitive. En effet, les souris qui ont subi une délétion pour le gène associé aux récepteurs GPR110 présentaient des lacunes dans la reconnaissance de certains objets et en termes de mémoire spatiale (30). Bien que ces résultats soient encore préliminaires, le récepteur GPR110 pourrait expliquer le mécanisme qui relie le DHA avec le développement et la fonction cérébrale.
Il est maintenant clair que l’endocannabinoïdome a un impact sur plusieurs fonctions biologiques chez l’humain, bien que la relation avec les niveaux circulants soit encore incertaine. Les niveaux plasmatiques des endocannabinoïdes chez l’humain démontrent plusieurs associations avec différents paramètres métaboliques. On observe notamment une corrélation positive entre le 2-AG et les triglycérides sanguins ainsi que les acides gras libres plasmatiques, mais des corrélations négatives avec la sensibilité à l’insuline et le HDL cholestérol (31). Cependant, aucune association n’a été observée avec l’AEA. Ces observations viennent d’ailleurs appuyer l’amélioration de ces mêmes paramètres métaboliques qui avait été remarquée suite à l’administration du rimonabant, agoniste inverse des récepteurs CB1 (9). Cependant, dans ce cas, la perte de poids importante induite par le
médicament est difficile à dissocier de l’amélioration de ces paramètres par le système endocannabinoïde. La relation entre la présence des médiateurs de l’endocannabinoïdome présent dans la circulation et la santé métabolique est encore peu documentée de même que les différentes composantes qui influencent leur présence en circulation, ce qui en fait une lacune importante dans la compréhension de ce système.
3.
Facteurs influençant les niveaux plasmatiques des médiateurs
de l’endocannabinoïdome
3.1. Composition corporelle et mesures anthropométriques
La composition corporelle et surtout, les mesures anthropométriques sont associées dans quelques études avec les niveaux d’endocannabinoïdes circulants. En effet, des corrélations positives entre le 2-AG plasmatique et plusieurs paramètres, soit l’indice de masse corporelle (IMC), la circonférence de taille, l’adiposité totale et viscérale ont été démontrés (31–33). D’ailleurs, dans l’étude de Côté et coll., bien que des corrélations positives ont été trouvées entre le 2-AG et l’IMC ainsi que la circonférence de taille, aucune corrélation n’a été observée avec les molécules de la famille des NAE, soit l’AEA, le PEA et l’OEA (32). Cette étude a d’ailleurs été l’une des seules à inclure d’autres molécules que les endocannabinoïdes, AEA et 2-AG, à leurs analyses ainsi qu’à s’intéresser à l’adiposité viscérale et sous-cutanée. On observe que l’adiposité viscérale corrèle positivement avec le 2-AG, mais de façon négative avec l’AEA. Aucune relation n’a cependant été observée entre les deux endocannabinoïdes et la quantité de graisse sous-cutanée. Cela suggère que la localisation de la masse adipeuse pourrait être importante dans la relation avec les niveaux d’endocannabinoïdes circulants. Fanelli et coll. propose une seconde étude qui s’intéresse également à la famille des NAE, soit l’AEA, PEA et OEA, où on observait une concentration plasmatique plus élevée de ces molécules chez un groupe d’hommes obèses comparativement à un groupe d’hommes de poids normal ou en surpoids (34). Ces observations ne sont donc pas en congruence avec les résultats obtenus par Côté et coll. pour les mêmes médiateurs (32). L’étude d’Engeli et coll. appuie cependant les résultats obtenus par Fanelli et coll. puisque leur étude a démontré que les niveaux d’AEA étaient plus élevés dans un groupe de sujets obèses comparativement au groupe de sujets de poids normal (35). Il s’agit cependant de la seule étude n’ayant pas démontré de lien entre l’IMC et la concentration de 2-AG plasmatique. Il est intéressant de constater que le degré d’obésité influence aussi les niveaux d’endocannabinoïdes plasmatiques puisque des concentrations plasmatiques plus élevées d’AEA et de 2-AG ont été observé suivant le degré d’obésité, soit entre les sujets obèses classe I (30 ≤ IMC < 35), obèses classe II (35 ≤ IMC < 40) et obèses classe III (IMC ≥ 40) (36). On peut ainsi conclure qu’une majorité d’études ont rapporté des
associations positives entre plusieurs paramètres de composition corporelle, surtout l’IMC, et les niveaux des deux endocannabinoïdes, soit l’AEA et le 2-AG (33,34,37–39).
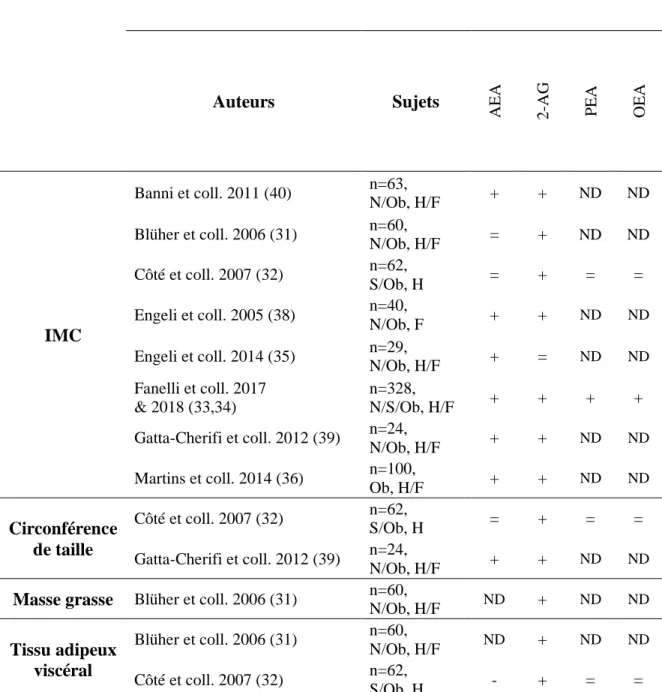
Le tableau 2 présente une synthèse des différentes études s’étant intéressées à la relation entre les endocannabinoïdes et leurs congénères avec les mesures de composition corporelle et/ou anthropométriques. On remarque que les études ont surtout porté leur attention sur les principaux endocannabinoïdes, AEA et 2-AG, ce qui limite l’application de ces résultats aux différentes molécules qui composent l’ensemble des médiateurs de l’endocannabinoïdome. De plus, comme présentée dans le tableau 2, la mesure anthropométrique la plus utilisée est l’IMC. Il est important de souligner que cette mesure demeure plutôt limitée puisqu’elle ne permet pas de tenir compte de la composition corporelle ou de la localisation des graisses, des informations très importantes lorsqu’on s’intéresse à la santé métabolique. D’ailleurs, la circonférence de taille, soit une mesure facilement accessible dans un contexte clinique, n’a été que très peu étudiée dans les différentes études présentées. Cette mesure a l’avantage d’être positivement corrélée à la masse grasse et à l’accumulation de tissus adipeux au niveau abdominal et donc, avec la santé métabolique (41,42). De plus, le lien entre les endocannabinoïdes et leurs congénères avec la masse adipeuse ou le tissu adipeux viscéral demeure très peu appuyé par la littérature. Une seule étude s’est intéressée à la relation entre les endocannabinoïdes et la masse grasse où une relation positive a été obtenue uniquement avec le 2-AG (31). Le tissu adipeux viscéral a été corrélé positivement avec le 2-AG, mais négativement avec l’AEA (31,32). Considérant la synthèse des études présentées dans le tableau 2, on peut clairement observer que la littérature est insuffisante présentement pour, d’une part, bien considérer les nombreuses molécules qui composent l’endocannabinoïdome et d’autre part, associer ces molécules à des paramètres de composition corporelle autre que l’IMC.
Tableau 2. Synthèse des études sur les associations entre les médiateurs de l’endocannabinoïdome et la composition corporelle chez l’humain.
Médiateurs de l’endocannabinoïdome Auteurs Sujets A EA 2-A G P EA O EA IMC Banni et coll. 2011 (40) n=63, N/Ob, H/F + + ND ND Blüher et coll. 2006 (31) n=60, N/Ob, H/F = + ND ND Côté et coll. 2007 (32) n=62, S/Ob, H = + = = Engeli et coll. 2005 (38) n=40, N/Ob, F + + ND ND Engeli et coll. 2014 (35) n=29, N/Ob, H/F + = ND ND Fanelli et coll. 2017 & 2018 (33,34) n=328, N/S/Ob, H/F + + + + Gatta-Cherifi et coll. 2012 (39) n=24, N/Ob, H/F + + ND ND Martins et coll. 2014 (36) n=100, Ob, H/F + + ND ND Circonférence de taille Côté et coll. 2007 (32) n=62, S/Ob, H = + = = Gatta-Cherifi et coll. 2012 (39) n=24, N/Ob, H/F + + ND ND
Masse grasse Blüher et coll. 2006 (31) n=60,
N/Ob, H/F ND + ND ND Tissu adipeux viscéral Blüher et coll. 2006 (31) n=60, N/Ob, H/F ND + ND ND Côté et coll. 2007 (32) n=62, S/Ob, H - + = = + : corrélations positives ou valeurs significativement plus élevées dans le groupe surpoids et/ou obèse comparativement au groupe poids normal, - : corrélations négatives, = : aucune corrélation, ND: données non disponibles. N: sujets de poids normal (IMC ≥ 18,5 < 25 kg/m2), S: sujets en
La présence des médiateurs de l’endocannabinoïdome dans la circulation sanguine n’est pas encore expliquée par une ou des sources précises. Une hypothèse intéressante serait que le tissu adipeux pourrait contribuer à l’augmentation des médiateurs de l’endocannabinoïdome dans le plasma. Cela pourrait donc expliquer une possible augmentation plasmatique de certains endocannabinoïdes et leurs congénères avec l’augmentation de l’adiposité (7). Comme discuté précédemment, une autre hypothèse serait que la présence des médiateurs de
l’endocannabinoïdome en circulation pourrait être un stimulant de la lipogenèse lors de la liaison sur les récepteurs CB1 (16). Cette explication aurait pu contribuer à l’efficacité
marquée sur la perte de poids du rimonabant, agoniste inverse des récepteurs CB1 (9,10).
L’inhibition de ces récepteurs au niveau du tissu adipeux aurait pu contribuer à diminuer la lipogenèse localement, contribuant ainsi à la perte de poids supplémentaire observée lors de la prise du médicament comparativement au groupe contrôle (17).
On peut ainsi conclure que les mécanismes qui associent les médiateurs de l’endocannabinoïdome et l’adiposité ne sont pas encore bien expliqués et demeurent hypothétiques. De plus, les études actuelles chez l’humain mettent clairement en relation les médiateurs de l’endocannabinoïdome et l’IMC, mais les études sur les autres paramètres de composition corporelle demeurent peu nombreuses.
3.2. Apports alimentaires
La présence d’acides gras dans la structure chimique des endocannabinoïdes et de leurs congénères nous permet d’émettre l’hypothèse que la composition de la diète, notamment en lipides ou en acides gras, pourrait jouer un rôle dans la biosynthèse de ces molécules. Dans l’étude d’Argueta et coll. effectuée chez la souris, il a été observé qu’une diète obésogène de type «western», c’est-à-dire élevé en gras et en sucrose, augmente les niveaux des endocannabinoïdes circulants (43). On observe également des signes d’hyperphagie chez les souris soumises à la diète que les auteurs attribuent à l’élévation des endocannabinoïdes. En effet, comme discuté précédemment, les endocannabinoïdes sont connus pour augmenter la consommation d’aliments palatables ce qui aurait pu contribuer au gain de poids observé (8,9). Ces résultats suggèrent que certains types de diètes entraineraient une
augmentation des endocannabinoïdes plasmatique et pourraient, simultanément, stimuler l’appétit. Cependant, la consommation d’une diète obésogène, telle que présentée dans cette étude, rend difficile à dissocier les effets de la diète elle-même de l’effet du gain de poids sur les niveaux d’endocannabinoïdes. Ainsi, bien que la prise de poids associé aurait pu contribuer à modifier les niveaux plasmatiques des endocannabinoïdes, la qualité globale de l'alimentation ou alors certaines composantes de la diète, comme les lipides ou les sucres, pourraient aussi être des facteurs contributoires.
D’ailleurs, on pourrait se demander si ce n’est pas l’apport élevé en lipides de la diète de type «western» qui aurait pu être en partie responsable de l’augmentation des endocannabinoïdes dans l’étude d’Argueta et al (43). Une étude dans une cohorte humaine constituée de deux groupes, soit des sujets de poids normal ou obèse, s’est intéressée à comparer l’effet d’une diète riche en lipides (>40% des kilocalories provenant des lipides) à une diète faible en lipides (20% des kilocalories provenant des lipides) sur les niveaux d’endocannabinoïdes plasmatiques (35). Chaque participant devait suivre chacune des deux diètes sur une période de 2 semaines selon un ordre aléatoire. Les résultats de l’étude ont démontré qu’il n’y avait pas de changement des niveaux des deux endocannabinoïdes, soit l’AEA et le 2-AG, selon le type de diète consommée. Il est important de mentionner que les participants n’ont pas eu de changement de poids corporel ou de leurs mesures anthropométriques durant l’intervention alimentaire. Cette étude comporte une limite importante puisque les participants ne recevaient pas leurs repas durant l’étude, mais devaient plutôt suivre un livre de recettes – adapté à la diète riche ou faible en lipides - et cuisiner eux-mêmes. Malgré un suivi à l’aide de journaux alimentaires, la composition en acides gras de leur alimentation n’était pas mesurée de façon directe. Les sujets étaient donc libres de choisir leurs aliments ce qui a pu entraîner des apports en certains acides gras très différents d’un participant à l’autre, et ce, malgré un apport en lipides similaire. Malheureusement, bien qu’il s’agisse de la seule étude sur le sujet, la validité de celle-ci demeure questionnable.
Bien que nous ne sommes pas en mesure d’affirmer que la composition en lipides de la diète influence les niveaux circulants d’endocannabinoïdes, la composition en acides gras pourrait cependant être un facteur contributoire. L’étude menée par Jones et coll. s’est intéressé au
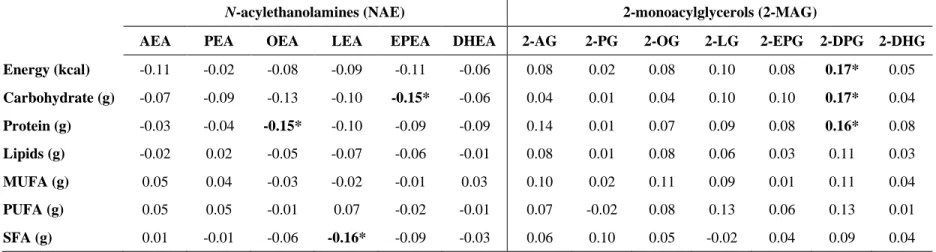
lien entre l’apport en acides gras alimentaire et les médiateurs de la famille des NAE en comparant trois diètes (44). La composition spécifique en acides gras de chaque diète était obtenue à l’aide d’un mélange d’huile qu’on peut décrire comme suit : 1) diète contrôle (>60% acide linoléique), 2) HOCO (~70% acide oléique) et 3) FXCO (55% acide alpha-linolénique). La diète contrôle est celle qui a engendré des concentrations plasmatiques plus élevées d’acide linoléique comparativement aux deux autres diètes alors que la diète HOCO et FXCO ont entrainé respectivement une plus grande concentration plasmatique d’acide oléique et alpha-linolénique. Cette augmentation des acides gras s’est effectuée en concomitance avec une augmentation de la concentration plasmatique de l’OEA, dérivé de l’acide oléique, après la diète HOCO, alors que la concentration d’ALEA, dérivé de l’acide alpha-linolénique, était significativement plus élevée suite à la diète FXCO. Les autres médiateurs de l’endocannabinoïdome mesurés, soit l’AEA, PEA, LEA et DHEA, n’ont pas été modifiés de façon significative avec les différentes diètes. Cette étude démontre que les concentrations des médiateurs de l’endocannabinoïdome peuvent varier en fonction de l’apport en acides gras précurseurs dans la diète, ce qui expliquerait pourquoi uniquement les niveaux circulants d’OEA et d’ALEA ont été modifiés contrairement aux autres médiateurs de la famille des NAE.
Une étude comparable a été menée par Pu et coll. pour évaluer l’impact de cinq diètes à différentes teneurs en acides gras sur les NAE (45). Des résultats similaires à l’étude de Jones et coll. ont été observés puisqu’une augmentation de l’apport en acides gras précurseurs dans la diète a été associée à une augmentation des médiateurs de l’endocannabinoïdome associés. Ainsi, les diètes riches en acide oléique, linoléique, alpha-linolénique et DHA ont respectivement entraîné des niveaux plus élevés d’OEA, LEA, ALEA et DHEA. Uniquement l’AEA a démontré des niveaux plus élevés suite à la diète riche en acide oléique, bien que cet acide gras ne soit pas son précurseur, alors que les niveaux de PEA n’ont pas été modifiés. Globalement, les études de Jones et coll. et Pu et coll. ont démontré qu’une augmentation de l’apport en acides gras précurseurs provenant de la diète influence les niveaux plasmatiques des médiateurs associés de la famille des NAE.
D’autres études se sont intéressées aux acides gras, mais plus spécifiquement à l’apport en acides gras oméga-3 sous forme de supplément. Suite à une supplémentation de 2 semaines en oméga-3 DHA/EPA dans un ratio 8:1, les résultats d’une étude chez la souris ont démontré une augmentation de certains médiateurs de l’endocannabinoïdome étant dérivés d’acides gras oméga-3, soit une augmentation significative de DHEA et de 2-EPG dans le plasma (46). Par contre, cette augmentation a aussi été accompagnée d’une diminution de certains médiateurs dérivés d’acides gras oméga-6 et oméga-9, soit le 2-AG, le 2-OG et l’OEA. Aucune modification n’a été observée pour l’AEA, le PEA, le 2-PG et le 2-DHG. Cela suggère qu’une supplémentation en acides gras oméga-3 pourrait moduler positivement certains médiateurs de l’endocannabinoïdome dérivés d’acides gras oméga-3 au profit de certains médiateurs dérivés d’acides gras oméga-6 et oméga-9.
L’impact d’une supplémentation en oméga-3 sur les niveaux plasmatiques d'AEA et 2-AG a aussi été étudié chez l’humain par Banni et coll. chez des sujets présentant divers statuts pondéraux (37). Après une supplémentation de quatre semaines d'huile de krill avec un ratio EPA/DHA de 2:1, on remarque une diminution significative chez les sujets obèses des niveaux de 2-AG, mais sans impact sur les niveaux d'AEA. De plus, les concentrations de 2-AG plasmatique dans ce groupe sont aussi corrélées positivement avec le ratio oméga-6/oméga-3 des phospholipides plasmatiques. Cela suggère que les niveaux de 2-AG pourraient être influencés par le métabolisme des acides gras impliquant l'équilibre entre les acides gras oméga-6/oméga-3 chez les obèses.
Une étude comparable à celle de Banni et coll. a été réalisée, mais cette fois-ci sur une période beaucoup plus longue de 24 semaines (47). Ainsi, une supplémentation en acides gras oméga-3 EPA/DHA dans un ratio 2:1 entraine une diminution des NAE, soit l’AEA, PEA et l’OEA, après la supplémentation, alors que les valeurs de 2-AG n’était pas différentes. Ces résultats ne correspondent pas à ceux obtenus par Banni et coll. où le 2-AG étaient diminué avec la supplémentation alors que les valeurs d’AEA n’étaient pas affectées (37). Il est important de mentionner que les deux études chez l’humain n’indiquaient aucun changement de poids durant l’étude. Une synthèse des trois études portant sur la supplémentation en
acides gras oméga-3 se retrouve dans le tableau 3 et permet de bien visualiser les résultats discordants entre les études sur le sujet.
Il est intéressant de constater que les habitudes de vie de façon plus globale peuvent aussi avoir un impact sur les niveaux circulants d’endocannabinoïdes. Une étude d’intervention menée sur une période d’un an proposait une amélioration des habitudes alimentaires et une augmentation de la pratique d’activité physique chez un groupe d’hommes présentant une obésité abdominale (48). Une perte de poids significative, une diminution du tour de taille et du tissu adipeux viscéral a été observée accompagnée d’une diminution de l’AEA plasmatique (-7.1%), mais surtout du 2-AG (-62.3%). Seulement les concentrations plasmatiques de 2-AG étaient corrélées avec les changements positifs induits par la modification des habitudes de vie, soit les changements sur le tissu adipeux viscéral, le taux de triglycérides sanguin et de HDL-cholestérol. Considérant que la composition corporelle et les mesures anthropométriques pourraient être associées aux niveaux plasmatiques des différents endocannabinoïdes, on constate maintenant que la perte de poids induite par des modifications des habitudes de vie serait associée à une réduction des niveaux d’endocannabinoïdes circulants. Encore une fois, il est très ardu de dissocier l’impact de la perte de poids comparativement à l’impact de l’amélioration des habitudes alimentaires sur les niveaux des médiateurs de l’endocannabinoïdome. On pourrait cependant invoquer l’hypothèse d’un impact synergique de ces deux composantes.
Tableau 3. Synthèse des études sur les associations entre les médiateurs de l’endocannabinoïdome et la supplémentation en acides gras oméga-3.
Auteurs Modèle
Supplémentation Impact sur les niveaux plasmatiques des médiateurs de l’endocannabinoïdome Durée Type Wood et coll. 2010 (46) Souris, n=10 2 semaines Huile de poisson, ratio DHA/EPA 8:1 ↑ DHEA, 2-EPG ↓ 2-AG, 2-OG, OEA
= AEA, PEA, 2-PG, 2-DHG Banni et coll. 2011 (40) Hommes et femmes, 3 groupes d’IMC, n=21 4 semaines Huile de krill, ratio EPA/DHA 2:1
↓ 2-AG (obèses seulement) = AEA Berge et coll. 2013 (47) Hommes en santé, IMC 30-35 kg/m2, n=11 24 semaines Poudre de krill, ratio EPA/DHA 2:1
↓ AEA, PEA, OEA = 2-AG
Tableau 4. Synthèse des études sur les associations entre les médiateurs de l’endocannabinoïdome et les apports alimentaires chez l’humain.
Auteurs Sujets Devis Intervention nutritionnelle
Impact sur les niveaux plasmatiques des médiateurs de l’endocannabinoïdome Engeli et coll. 2014 (35) Adultes poids normal et obèse n=29 Intervention, Randomisé, chassé-croisé Diète isocalorique faible en lipides (20% des kilocalories) ou élevé en lipides (>40% des kilocalories) pour une période de 2 semaines. =AEA =2-AG Jones et coll. 2014 (44) Adultes, Poids normal et obèse, n=36 Intervention, Randomisé, chassé-croisé Modification de l’apport en acides gras (3 diètes , chacune 29 jours): • Contrôle (>60% LA) • HOCO (~70% AO) • FXCO (55% ALA) HOCO : ↑OEA FXCO : ↑ALEA =AEA, PEA, LEA,
DHEA Pu et coll. 2016 (45) Adultes avec obésité viscérale, n=130 Intervention, Randomisé, chassé-croisé Modification de l’apport en acide gras (5 diètes, chacune 30 jours) : • Canola (60% AO, 20% AL, 10% ALA) • CanolaOleic (72% AO, 15% AL, 2% ALA) • CornSaff (18% AO, 69% AL) • FlaxSaff (18% AO, 38% AL, 32% ALA) • CanolaDHA (63% AO, 13% AL, 6% DHA) CanolaOleic: ↑AEA CanolaOleic: ↑OEA CornSaff : ↑LEA FlaxSaff: ↑ALEA CanolaDHA: ↑DHEA = PEA Di Marzo et coll. 2009 (48) Hommes avec obésité viscérale, n=49 Intervention, non contrôlée Modification des habitudes de vie (alimentation et activité physique) accompagnée d’une perte de poids sur une période d’un an.
↓ AEA (-7.1%) ↓ 2-AG (-62.3%)
De façon générale, on observe que les études avec des cohortes humaines s’intéressant à la relation entre l’alimentation et les niveaux des médiateurs de l’endocannabinoïdome plasmatiques sont très peu nombreuses. Les participants inclus dans les études présentent, dans la plupart des cas, un paramètre de dysfonction métabolique, que ce soit une obésité abdominale ou certains paramètres biochimiques altérés. De plus, l’intérêt est souvent limité aux deux endocannabinoïdes, l’AEA et le 2-AG. On observe que les médiateurs de l’endocannabinoïdome pourraient être modulés par des apports importants en certains acides gras, soit par la supplémentation ou l’ajout d’huile à une diète, mais, considérant ces aspects, on peut se demander si l’alimentation usuelle, à elle seule, dans la population générale serait suffisante pour moduler les niveaux des médiateurs de l’endocannabinoïdome plasmatique.
3.3. Axe microbiome-endocannabinoïdome
Un des mécanismes intermédiaires par lequel les médiateurs de l’endocannabinoïdome pourraient être modulés par l’alimentation est le lien des deux composantes avec le microbiote intestinal. D’une part, la composition de celui-ci peut influencer l'endocannabinoïdome de l’hôte puisque certains des médiateurs sont produits par des bactéries présentes dans l’intestin (3,4). D’autre part, plusieurs études démontrent clairement que tous les macronutriments, selon le type, la provenance ou la quantité ont une influence sur la composition du microbiote intestinal (49–51). Le type de diète, «western» (représentative de la diète nord-américaine) ou méditerranéenne, pourrait aussi avoir une influence sur la quantité de certaines bactéries (49). Il est donc bien établi que notre alimentation modifie directement la composition et la diversité du microbiote intestinal. Il est également démontré que celui-ci peut être modulé en présence de diverses altérations métaboliques, telles qu’en présence d’obésité, d’inflammation ou en condition de résistance à l’insuline (52). Parallèlement, plusieurs altérations du système endocannabinoïde ont été documentées en présence d’obésité et de dysfonctions métaboliques telle que la résistance à l’insuline (3,20). Il devient de plus en plus clair que le microbiome intestinal et l’endocannabinoïdome régulent des fonctions similaires et ont des relations comparables avec l’obésité et ses comorbidités. Cette accumulation d’évidences supporte l’existence d’une relation entre ces deux paramètres, nommée l’axe microbiome-endocannabinoïdome
où l’influence des habitudes alimentaires sur la relation entre ces deux systèmes demeure méconnue.
3.4. Santé mentale, comportements alimentaires et activité physique
Outre l’alimentation, la composition corporelle et la composition du microbiome, il est intéressant de constater que de nombreux autres facteurs pourraient potentiellement influencer les niveaux des médiateurs de l’endocannabinoïdome plasmatique. Une revue de littérature s’est intéressée à ce sujet, en ciblant notamment la santé mentale comme facteur contributoire (7). Le niveau de stress et d’anxiété pourrait contribuer à l’augmentation des niveaux circulants des médiateurs de l’endocannabinoïdome. D’ailleurs, le fait que l’endocannabinoïdome soit impliqué dans la sensation agréable que procure la consommation de certains aliments a permis de constater que chez les sujets aux prises avec des troubles de comportements alimentaire, on observe une altération des niveaux d’endocannabinoïdes plasmatiques comparativement à des sujets sains (53). L’activité physique est aussi une autre composante qui pourrait influencer les médiateurs de l’endocannabinoïdome. Nous connaissons l’implication de ceux-ci dans le métabolisme énergétique et la prise alimentaire. Une des hypothèses émises est que l’augmentation de la dépense énergétique causée par une activité physique pourrait se refléter dans une augmentation des endocannabinoïdes circulants dans le but de favoriser la réplétion des réserves énergétiques (7). Différentes réponses sur le système endocannabinoïde serait observées selon le type d’exercice effectué (cardiovasculaire vs musculaire) et que cette modification des médiateurs de l’endocannabinoïdome plasmatique pourrait aussi impliquer le microbiote intestinal (54). Bien que l’étude des différents paramètres évoqués précédemment ne fasse pas partie intégrante des objectifs de mon projet de maîtrise, il est tout de même intéressant de constater que de nombreuses composantes semblent influencer les niveaux des médiateurs de l’endocannabinoïdome plasmatique. D’ailleurs, bien que mon projet se soit concentré sur l’association entre les apports alimentaires et la composition corporelle sur les médiateurs de l’endocannabinoïdome, les futures analyses des données du projet permettront de vérifier l’implication du microbiote intestinal ainsi que les autres paramètres qui pourraient influencer les niveaux plasmatiques.
Mise en contexte, objectifs et hypothèses
Mon projet de maîtrise s'inscrit dans le cadre du projet «Environment and Microbiota – EndoCannabinoidome Axis (eMECA)», soit une étude observationnelle transversale visant à mettre en lien les habitudes alimentaires, le microbiome intestinal et les médiateurs de l’endocannabinoïdome plasmatique. Ce projet de recherche a été mis en place suite à la création de la Chaire d'excellence en recherche du Canada sur l’axe microbiome-endocannabinoïdome dans la santé métabolique (CERC-MEND) dont le titulaire est le professeur Vincenzo Di Marzo.
L'objectif principal du projet est d'établir la relation entre les habitudes alimentaires et les paramètres de l’axe microbiome- endocannabinoïdome dont notamment la composition et la diversité du microbiome intestinal, le profil des médiateurs de l’endocannabinoïdome circulant, le tout en relation avec la santé métabolique. Plus spécifiquement, mon projet de maîtrise s'est intéressé aux composantes qui pourraient influencer les niveaux des médiateurs de l’endocannabinoïdome plasmatique, soit les apports alimentaires et la composition corporelle.
Le premier objectif spécifique du projet est d'identifier la relation entre les apports alimentaires avec les niveaux plasmatiques des médiateurs de l'endocannabinoïdome. L'hypothèse est que la composition de la diète en macronutriment et le type d’acides gras consommé influenceront les niveaux plasmatiques des médiateurs de l'endocannabinoïdome.
Le deuxième objectif spécifique est d'établir la relation entre la composition corporelle et les niveaux des médiateurs de l'endocannabinoïdome. Notre hypothèse est que la plupart des médiateurs seront associés positivement aux différents paramètres d'adiposité, soit la masse grasse, le tissu adipeux viscéral, l’indice de masse corporelle et la circonférence de taille.
Approche méthodologique
Ainsi, pour répondre à ces objectifs, une cohorte d’environ 200 participants adultes a été constituée. La cohorte couvre un large éventail d’âge, de composition corporelle et inclut des participants en santé considérant les paramètres biochimiques et données médicales obtenues. Les individus avec un diagnostic de maladie inflammatoire de l’intestin, ceux ayant consommés des antibiotiques au cours des trois derniers mois, présentant une modification de leur poids corporel de plus de 5 kg dans les trois derniers mois, ayant une consommation élevée d'alcool (>15 consommations/semaine pour les hommes ou >10 consommations/semaine pour les femmes) ou les femmes enceintes ou allaitantes ont été exclus de l’étude.
La collecte de données s’est effectuée par la complétion de trois rappels alimentaires de 24h web (R24W) autoadministrés et validés permettant de mesurer les apports et habitudes alimentaires des participants (55–57). Parmi les différentes mesures effectuées, on compte une prise de sang à jeun, des mesures anthropométriques (taille, poids, tour de taille et tour de hanche) et une évaluation de la composition corporelle à l’aide d’un appareil à absorptiométrie biphotonique à rayons X (DXA) (58).
Pour répondre à l’un des objectifs du projet qui était d’associer les composantes de la diète aux différents médiateurs de l’endocannabinoïdome, le projet transversal eMECA a bénéficié des données d’une cohorte longitudinale, soit l’étude clinique META. Une cohorte de 21 participants âgés entre 20 et 34 ans et ayant un IMC de poids normal (18,8 – 25 kg/m2) a été
constituée. Cette étude nous a permis de mesurer les niveaux circulants des médiateurs de l’endocannabinoïdome plasmatique par une prise de sang effectuée avant et après la consommation de 48h d’une diète méditerranéenne, soit une diète riche en acides gras mono et polyinsaturés (principalement en acides gras oméga-3).
Chapitre 1: Dietary fatty acid intake determine
circulating
endocannabinoidome
Résumé
L'endocannabinoïdome (eCBome) englobe plusieurs médiateurs dérivés d'acides gras qui sont fortement impliqués dans le métabolisme énergétique et l'apport alimentaire, contribuant à l'obésité et à ses complications. La composition corporelle et les habitudes alimentaires ont été proposées dans la littérature comme des contributeurs importants des niveaux circulants des médiateurs de l’eCBome. Objectif: Notre objectif est d'établir la relation entre la composition corporelle, les habitudes alimentaires et les niveaux des médiateurs circulants de l’eCBome chez l'humain. Méthode: Les médiateurs plasmatiques de l’eCBome (c'est-à-dire les N-acyl-éthanolamines [NAE] et les 2-monoacyl-glycérols [2-MAG]) ont été évalués par HPLC-MS / MS dans une étude transversale (n=195) et dans une étude longitudinale impliquant la consommation de 2 jours d’une diète riche en acides gras mono-insaturés et oméga-3 polyinsaturés (n = 21). Résultats: Les niveaux plasmatiques de tous les médiateurs de l’eCBome, à l'exception du N-oléoyl-éthanolamine (OEA), étaient corrélés avec la masse grasse corporelle (0,22 <r <0,47, p <0,01) et le tissu adipeux viscéral (0,18 <r <0,55, p <0,01). Il est intéressant de constater que les niveaux de NAE étaient élevés chez les sujets obèses quelle que soit la distribution des graisses corporelles, tandis que les niveaux des 2-MAG n'était élevé que chez les sujets présentant une obésité viscérale (p <0,001). La composition en macronutriments de la diète n'était pas associée à un profil d’eCBome spécifique, mais les apports en acides gras sont associés aux niveaux plasmatiques de plusieurs médiateurs de l’eCBome. Indépendamment de la composition corporelle et de la distribution des graisses, des apports alimentaires plus élevés d'acide arachidonique, d'acide linoléique, d'EPA et de DHA étaient associés aux niveaux circulants de la plupart de leurs NAE correspondants (AEA, EPEA et DHEA) et 2-MAG (2-AG, 2- LG, 2-EPG et 2-DHG, p <0,01). Une intervention alimentaire sur une courte période avec des apports élevés d'acide oléique, d'EPA et de DHA chez des individus en bonne santé induit une augmentation rapide des niveaux circulants des NAE correspondants (c’est-à-dire OEA, EPEA et DHEA) et 2-MAG (2-OG, 2-EPG et 2-DHG, p <0,01). Conclusion: Les apports habituels ainsi qu’un changement à court terme en acides gras mono-insaturés et polyinsaturés modifient le profil des médiateurs de l’eCBome circulants, indépendamment des mesures d'adiposité, et mettent ainsi en évidence l'importance de ces variables dans la détermination du profil des médiateurs eCBome chez l’humain.
Dietary fatty acid intake determine circulating endocannabinoidome signaling beyond the effect of body fat
Sophie Castonguay-Paradis1,3,6, Sébastien Lacroix1,6, Gabrielle Rochefort1,3,6, Lydiane
Parent3,6, Julie Perron1,6,Cyril Martin2,6, Benoît Lamarche1,3, Nicolas Flamand2,4,6,
Vincenzo Di Marzo1,2,3,4,5,6, Alain Veilleux1,3,6
1. Institut sur la nutrition et les aliments fonctionnels (INAF), Québec, Canada;
2. Centre de recherche de l’Institut universitaire de cardiologie et de pneumologie de Québec (IUCPQ), Québec, Canada;
3. École de nutrition, Faculté des sciences de l’agriculture et de l’alimentation (FSAA), Université Laval, Québec, Canada;
4. Département de médecine, Faculté de Médecine, Université Laval, Québec, Canada; 5. Joint International Unit on Chemical and Biomolecular Research on the Microbiome and its Impact on Metabolic Health and Nutrition (UMI-MicroMeNu),
6. Canada Research Excellence Chair in the Microbiome-Endocannabinoidome mediators Axis in Metabolic Health (CERC-MEND)
Corresponding author: Alain Veilleux, PhD
Institut sur la nutrition et les aliments fonctionnels (INAF) , Université Laval 2440, boulevard Hochelaga, Québec, Québec (Canada), G1V 0A6
Email: alain.veilleux@fsaa.ulaval.ca Telephone : 418.656.2131 p.405108