Étude du comportement des particules virales aérosolisées
dans un bâtiment agricole ventilé mécaniquement
Mémoire
Martyne Audet
Maitrise en microbiologie
Maitre ès sciences (M. Sc.)
Québec, Canada
© Martyne Audet, 2016
Étude du comportement des particules virales aérosolisées
dans un bâtiment agricole ventilé mécaniquement
Mémoire
Martyne Audet
Sous la direction de :
iii
Résumé
Le contrôle des agents pathogènes viraux en agriculture constitue une préoccupation majeure pour les producteurs, tant pour l’impact économique négatif que les épidémies infligent que pour la santé des travailleurs et des animaux d’élevage. Les mesures de biosécurité renforcée restent à ce jour inefficaces à enrayer la dissémination des virus, ceux-ci pouvant être propagés par l’air. Il est connu que l’air intérieur des bâtiments d’élevage confiné contient une importante concentration de bioaérosols variés ayant le potentiel d’être dispersés aux sites voisins par les systèmes de ventilation. En conséquence, il s’avère urgent de développer des méthodes pour faciliter la détection précoce des virus dans l’air des bâtiments qui soient efficaces, simples, écologiques et sécuritaires pour les animaux. Une collaboration avec un groupe d’ingénieurs agricoles fut établie afin d’élaborer un outil visant l’amélioration des stratégies d’échantillonnage de l’air dans les bâtiments mécaniquement ventilés. Brièvement, il fut suggéré que la co-nébulisation d’une solution fluorescente (NSF/ANSI 60) et d’un bactériophage modèle pourrait démontrer la faisabilité de l’identification d’une zone stratégique dans l’espace intérieur pour l’échantillonnage des agents pathogènes viraux aérosolisés. La détermination d’une telle zone pourrait favoriser leur détection précoce et la prévention de leur propagation au sein du cheptel. Le comportement des aérosols viraux fut également étudié in vitro en présence de poussières standardisées pour tenter de déterminer si le contenu particulaire de l’air influence la taille des particules virales et si une taille préférentielle peut leur être attribuée. Ces informations supplémentaires pourraient éclairer la prise de décisions, faciliter la planification de systèmes de filtration pour les aérosols viraux et influencer le développement de méthodes de capture alternatives.
iv
Abstract
Dissemination of viral pathogens via airborne particles is a known phenomenon. In agriculture, indoor air of livestock confinement buildings contains a high concentration of bioaerosols that may be dispersed to neighbouring sites through ventilation systems. Control of pathogenic viruses remains to this day a major concern for the health of agricultural workers and animals, as well as for the significant negative economic impact that epidemics inflict on the industries. The development of methods for virus detection in the air of agricultural buildings that are simple, reliable, ecologically sound, and without risk for animal health is urgent. We collaborated with a group of agricultural engineers to tackle this problem. A 55 m3 mechanically ventilated experimental confinement building was used to improve air sampling strategies by assessing the spatial concentration variations of an artificially nebulized virus and a fluorescent marker. We have ascertained that it is feasible to determine the most probable areas where viral particles are more likely to stay in suspension and be detected, simply by nebulizing a fluorescent solution of varying particles sizes. In the near future, molecular diagnostic tests will be available to the agricultural industry. Simply nebulizing a fluorescent solution could lead to the determination of the most suitable areas to use these molecular devices. Viral aerosols behaviour was also studied in vitro in conjunction with standardized dusts to determine if the nature of the particles in the air influenced viral particles size and if a preferential particle size could be observed. This additional information could provide insights to help decision making towards filtration systems and influence the development of alternative methods for viral aerosols capture.
v
Table des matières
Résumé ... iii
Abstract ... iv
Liste des tableaux ... viii
Liste des figures ... ix
Liste des abréviations ... x
Remerciements ... xii
1. Introduction ... 1
1.1. Aérovirologie ... 2
1.2. Virus ... 2
1.3. Virus aérosolisés dans l’agriculture animale... 3
1.4. Impacts économiques des infections virales sur l’industrie porcine ... 4
1.5. Stratégies en développement ... 5
1.5.1. Capture ... 5
1.5.2. Détection précoce ... 6
1.6. Utilisation d’un bactériophage modèle et d’un marqueur fluorescent ... 7
2. Chapitre I ... 10
Détermination de la localisation spatiale la plus probable des aérosols viraux dans un bâtiment agricole mécaniquement ventilé à l’aide d’un bactériophage modèle et d’un marqueur fluorescent... 10
2.1.1. Prémices ... 10
2.1.2. Précision sur la taille des particules ... 11
2.1.3. Hypothèses et objectif ... 11 2.2. Matériel et méthodes ... 12 2.2.1. Démarche expérimentale ... 12 2.2.2. Bâtiment expérimental ... 13 2.2.3. Tests de fumée ... 15 2.2.3.1. Observation à l’aveugle ... 15 2.2.4. Échantillonnage de l’air ... 16 2.2.4.1. Échantillonneur ... 16 2.2.4.2. Pompe ... 16 2.2.4.3. Filtres ... 17 2.2.5. Nébulisation ... 17 2.2.5.1. Nébuliseur ... 17 2.2.5.2. Solution fluorescente ... 18
vi
2.2.5.3. Bactériophages phi6 ... 18
2.2.5.4. Concentrations optimales pour la co-nébulisation ... 19
2.2.6. Tailles des particules ... 21
2.2.7. Traitement des échantillons ... 22
2.2.7.1. Prétraitement des filtres ... 22
2.2.8. Analyse par biologie moléculaire ... 22
2.2.8.1. Extraction ... 22
2.2.8.2. Transcription inverse (RT) ... 23
2.2.8.3. PCR quantitative (qPCR) ... 23
2.2.8.4. Seuil de détection ... 25
2.2.9. Analyse en microscopie en fluorescence... 25
2.3. Résultats ... 27
2.3.1. Positionnement des équipements d’échantillonnage ... 27
2.3.2. Conditions environnementales ... 28
2.3.3. Hiver 2013 ... 28
2.3.4. Été 2013 ... 29
2.3.5. Effet de la hauteur des échantillonneurs... 32
2.3.6. Effets de la composition du liquide nébulisé sur la taille des particules ... 33
2.3.7. Hiver 2014 ... 34
2.4. Discussion ... 35
2.4.1. Bâtiment agricole expérimental, conditions environnementales et phi6 ... 35
2.4.2. Filtres de nitrocellulose et fluorescence ... 35
2.4.3. L’absence de génome et l’inconsistance de la fluorescence sont indissociables ... 36
2.5. Conclusion ... 37
3. Chapitre II ... 39
Étude du comportement des aérosols viraux artificiellement aérosolisés en présence de poussières standardisées et détermination d’une possible taille préférentielle... 39
3.1.1. Prémices ... 39
3.1.2. « Electrical Low Pressure Impactor » (ELPI+) ... 40
3.1.3. Hypothèses et objectifs ... 40
3.2. Matériel et méthodes ... 41
3.2.1. Démarche expérimentale ... 41
3.2.2. Chambre d’aérosolisation ... 42
vii 3.2.2.2. Instruments de mesure ... 42 3.2.3. Disperseur de poussières ... 42 3.2.3.1. Poussières standardisées ... 42 3.2.4. Nébulisation ... 43 3.2.4.1. Nébuliseur ... 43 3.2.4.2. Solution de nébulisation ... 43 3.2.5. Échantillonnage de l’air ... 44 3.2.5.1. Substrats d’aluminium ... 45
3.2.6. Traitement des échantillons ... 46
3.3. Résultats des expériences préliminaires ... 47
3.3.1. Graisse «Apiezon-L» ... 47
3.3.2. Canaux de courants négatifs ... 49
3.3.2.1. Tampon de phage, liquide fluorescent, lysat de phage ou poussières ... 49
3.3.3. Tailles de particules virales après 18 heures ... 50
3.4. Conclusions ... 52
4. Conclusions générales et perspectives ... 53
Annexes ... 54
Annexe A : Protocole d’amplification du bactériophage phi6 ... 54
Annexe B : Protocole de purification du bactériophage phi6 ... 55
Annexe C : Conditions environnementales lors des essais. ... 56
Annexe D : Série d’expériences « Génome Survie » ... 57
viii
Liste des tableaux
Tableau I. Liste de virus agricoles d’intérêt. ... 8 Tableau II. Correspondance entre les fractions de l’ELPI+ et les tailles des particules ... 46 Tableau III. Valeurs des mesures de température et d’humidité relative de l’air. ... 56
ix
Liste des figures
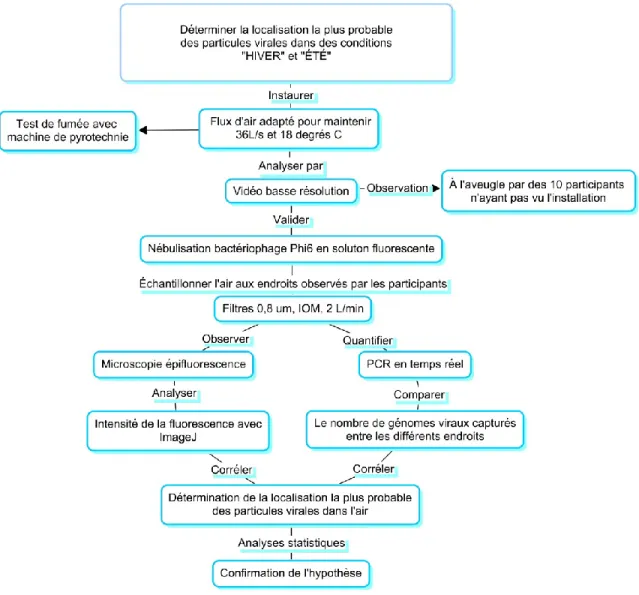
Figure 1. Schéma des étapes de la démarche expérimentale. ... 12
Figure 2. Bâtiment agricole expérimental attribué par l’IRDA. ... 14
Figure 3. Tunnel à vent. ... 20
Figure 4. Chambre environnementale rotative ... 21
Figure 5. Positionnement des équipements d’échantillonnage dans le BAE ... 27
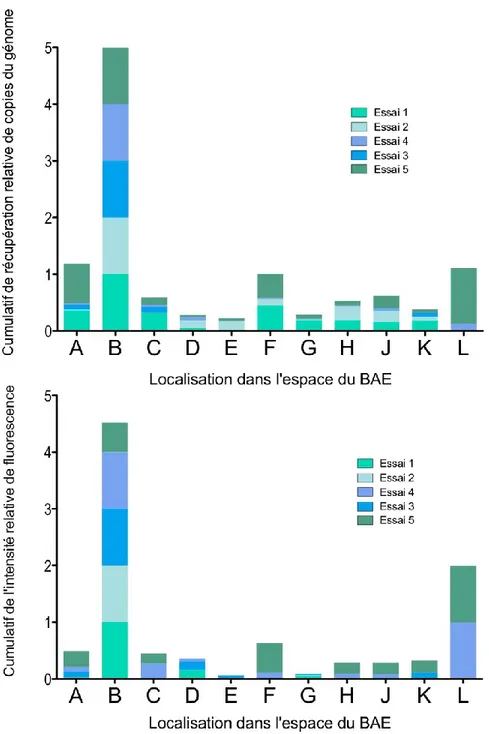
Figure 6. Hiver 2013. Variations de l’intensité relative de fluorescence en fonction de la localisation dans l’espace du BAE. ... 29
Figure 7. Été 2013. ... 30
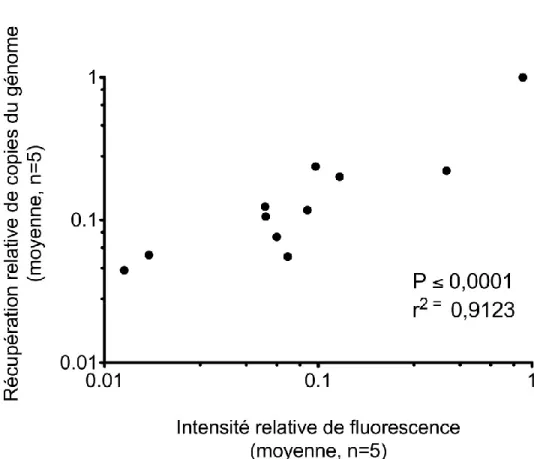
Figure 8. Corrélation des moyennes de l’intensité relative des signaux des deux méthodes pour l’été 2013. ... 31
Figure 9. Effets de la hauteur des échantillonneurs. ... 32
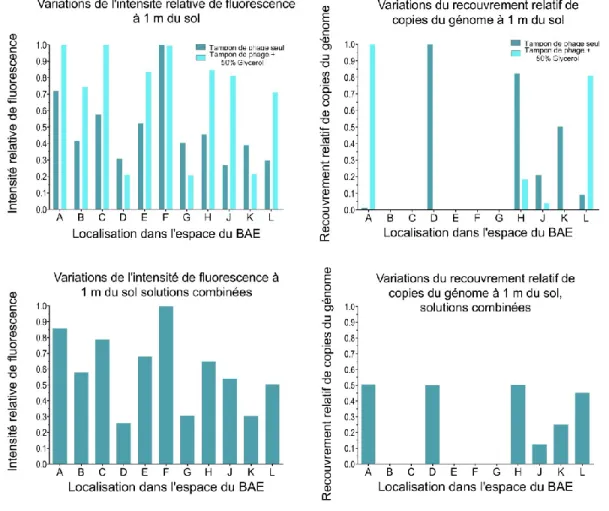
Figure 10. Effets de la composition du liquide nébulisé sur la distribution des tailles de particules. ... 33
Figure 11. Hiver 2014... 34
Figure 12. Localisation de la zone la plus stratégique pour la détection des particules virales dans l’air ... 38
Figure 13. Schéma des étapes de la démarche expérimentale proposée. ... 41
Figure 14. Schéma du ELPI + de Dekati Ltd ... 45
Figure 15. Effet de la graisse Apiezon-L sur la réaction qPCR. ... 48
Figure 16. Comparaison du rendement de récupération entre la graisse et le glycérol. ... 48
Figure 17. Variations de la taille et des concentrations des aérosols viraux après 18 heures ... 51
x
Liste des abréviations
ADN : acide désoxyribonucléique
ANSI : «American National Standards Institute» APC : «Airborne Particulate Counter»
APS : «Aerosol Particle Sizer» ARD : «Arizona Road Dust» ARN : acide ribonucléique
ASAE : «American Society of Agricultural Engineers» BAE : bâtiment agricole expérimental
BHV : «Bovine Herpes Virus»
BRSV : «Bovine Respiratory Syncytial Virus»
CDPQ : Centre de développement du porc du Québec
CRIUCPQ : Centre de recherche de l’Institut universitaire de cardiologie et de pneumologie de Québec da : diamètre aérodynamique
ds : «double stranded» ou double brins ELPI : «Electrical Low Pressure Impactor» EPI : «Electrostatic Particle Ionizer» FAM : «Fluorescein amidite» fluorophore
FMDV : «Foot-and-Mouth Disease Virus» ou fièvre aphteuse HPAI : «Highly Pathogenic Avian Influenza»
IOM : échantillonneur personnel de particules de l’«Institute of Occupational Medicine» IR : intensité relative
IRDA : Institut de recherche et développement en agroenvironnement LC50 : «Lethal Concentration 50» ou Concentration létale médiane
M : million
NDV : «Newcastle Disease Virus»
NSF60 : «National Safety Foundation Standard 60: Drinking Water Treatment Chemicals»
P : «p-value»
PC : polycarbonate
PCR : «Polymerase Chain Reaction», réaction en chaine par polymérase PCV-2 : «Porcine Circovirus type 2»
PEDv : «Porcine Epidemic Diarrhea virus» PIV-3 : «Parainfluenza Virus type 3»
ppb : «parts per billion» ou parties par milliard PRC : «Porcine Respiratory Coronavirus»
PRRSv : «Porcine Respiratory and Reproductive Syndrome Virus» psig : «pound per square inch gage»
qPCR : réaction en chaine par polymérase en temps réel (ou quantitative) RR : recouvrement relatif
RT : «Reverse Transcription» ou transcription inverse SIV : «Swine Influenza Virus»
ss : «single strand» ou simple brin ufp : unités formant des plages
UV : ultraviolets
vDEP : virus de la diarrhée épidémique porcine
vSRRP : virus du syndrome respiratoire et reproducteur porcin phi6 : bactériophage phi6
xi
Je dédie cet ouvrage à mes enfants, Maude-Laure et Émile,
à mon beau-fils Jonah, à mes nièces Justine, Laura-Jeanne,
Marilou et Anne-Sophie, ainsi qu’à mon neveu Félix.
Puissent-ils être séduits par la poursuite de la connaissance,
quête dont je me suis nourrie pendant les huit années
d’études qui m’ont menée jusqu’à ces pages.
Qu’ils soient heureux et apprécient le monde pour ce qu’il a
été avant eux, pour ce qu’il est avec eux et pour ce qu’il
deviendra après eux, dans ce qu’il présente de plus
grandiose, mais par-dessus tout, dans ce qu’il préserve dans
l’infiniment petit.
xii
Remerciements
Je souhaite remercier ma directrice de recherche, Caroline Duchaine, pour la confiance qu’elle m’a accordée. Sa passion contagieuse, sa fine intuition et sa pertinence scientifique continueront de me guider à jamais.
Je remercie du fond du cœur les professionnelles de recherche Valérie Létourneau et Nathalie Turgeon pour la patience dont elles ont fait preuve à l’égard de mes idées souvent farfelues. Merci à Marc Veillette pour son soutien technique et son sens de l’humour attachant.
Je désire remercier Sylvain Moineau et son équipe pour leur présence et leur générosité, plus particulièrement à Denise Tremblay et Geneviève Rousseau pour leur précieuse aide technique.
Je remercie Stéphane Godbout pour ses bonnes intentions, de même que les membres de l’équipe technique de l’IRDA à Deschambault, notamment Cédric Morin, Christian Gauthier et Michel Côté.
Je tiens à exprimer ma gratitude envers Vanessa Dion-Dupont pour sa curiosité scientifique, sa présence rassurante et sa méticulosité. Je remercie également les membres de l’équipe Duchaine qui m’ont gracieusement offerts un coup de main sur le terrain, notamment Laetitia Bonifait, Phillipa Perrot, Kevin Michel, Nicolas Groulx, Rémi Charlebois et Éric Jubinville.
Je souhaite remercier Amanda Toperoff pour l’exécution de figures tridimensionnelles qui ont favorisé la transmission de mes idées.
Pour terminer, je suis infiniment reconnaissante envers les membres de ma famille pour leur support et plus particulièrement envers mes enfants, Maude-Laure et Émile, pour n’avoir jamais contesté ma décision de retourner aux études, en dépit des contraintes qu’elle a pu leur infliger.
1
1. Introduction
Un aérosol, dans sa forme la plus simple, est défini comme un système à deux phases dans lequel une particule solide ou liquide est en suspension dans un gaz (Hinds 1999). Les aérosols sont généralement stables pour au moins quelques secondes et peuvent l’être jusqu’à plusieurs années. La taille des particules se situe entre 0,002 et 100 µm, voire 200 µm (Burge 1987; Hinds 1999). Cependant, selon les études publiées, à l’intérieur des bâtiments agricoles, les aérosols sont généralement composés de poussières ayant un diamètre aérodynamique (da) variant entre 2,2 et 15 µm (Donham et al. 1986; Jones et al. 1984).
Un bioaérosol, quant à lui, est une particule dérivant d’une source biologique qui est aérosolisée et qui varie selon la source, le mécanisme de dispersion et les conditions environnementales (Pillai and Ricke 2002; Tang 2009). En 1994, le «National Institute of Health» (NIH) américain définissait les bioaérosols dans son journal de la médecine du travail comme suit : «Les bioaérosols sont des particules, des grosses molécules ou des
composés volatils aérosolisés qui peuvent être vivants ou être libérés par un organisme vivant. Les bactéries, les moisissures et les virus sont des bioaérosols reconnus, mais les insectes, les oiseaux et les mammifères produisent des effluents –tels que des fèces, des squames et de la salive- qui constituent également des bioaérosols.» (Rose 1994). Une fois aérosolisés, les bioaérosols se comportent comme toute autre particule
dans l’air. Ils ne peuvent toutefois être considérés comme de simples molécules chimiques, car leur potentielle activité biologique ne peut être ni négligée, ni assumée (Verreault et al. 2008). Les bioaérosols peuvent être pathogènes ou servir de véhicule à la dissémination de pathogènes (Pillai and Ricke 2002). La littérature est faste sur les infections, notamment les infections respiratoires, pouvant être causées par des bioaérosols infectieux par contact, une fois la particule sédimentée, ou par inhalation (Tang et al. 2006). Dans le contexte des bâtiments agricoles, des concentrations importantes de bioaérosols, composés de mélanges complexes de bactéries mortes et vivantes, de leurs produits, d’allergènes divers et de virus, peuvent être responsables de graves problèmes de santé chez les travailleurs et les animaux (Bonlokke et al. 2009; Cormier et al. 1997; Cormier et al. 2000; Corzo et al. 2014; Duchaine et al. 2000; Larsson et al. 1994; Thorne et al. 1992).
2
1.1. Aérovirologie
De façon générale, l’étude des aérosols s’intéresse au comportement des particules dans l’air ainsi qu’aux méthodes d’échantillonnage, aux systèmes de filtration et à la pollution de l’atmosphère. L’aérobiologie, pour sa part, se caractérise comme une science intégrative et multidisciplinaire qui réunit des expertises en biologie, en microbiologie, en physique, en génétique, en biologie moléculaire ainsi qu’en plusieurs disciplines d’ingénierie. Elle se préoccupe, en autres choses, des mécanismes d’aérosolisation d’agents biologiques tels que la toux ou la respiration des animaux, la desquamation d’un porteur ou le vent. La discipline de l’aérovirologie ajoute à l’aérobiologie la composante de la ‘virologie’ en s’intéressant au comportement des particules virales lors de l’aérosolisation et une fois aérosolisées, de même qu’à leur résistance aux stress environnementaux (Cutler et al. 2012; Gustin et al. 2013; McDevitt et al. 2012). Le terme «aérovirologie» fut concocté par l’équipe du professeur Caroline Duchaine et utilisé pour la première fois dans la littérature scientifique en 2008 (Verreault et al. 2008). Grâce aux développements relativement récents des technologies de la biologie moléculaire, l’aérovirologie devient un champ d’études aux applications médicales et industrielles tangibles et pousse la science vers le développement de nouvelles méthodes d’évaluation de la qualité de l’air (Lowen et al. 2007; Verreault et al. 2010; Verreault et al. 2011). La détection des particules virales dans l’air dépend de trois principaux facteurs : leur concentration, l’efficacité de la méthode d’échantillonnage et la sensibilité de la méthode de détection (Hermann et al. 2006). L’équipe de la Professeure Caroline Duchaine s’est efforcée, tout au long de la dernière décennie, de configurer et optimiser des méthodes efficaces pour contrôler ces éléments essentiels.
1.2. Virus
Les virus sont des parasites intracellulaires obligatoires. Ce sont des entités de différentes tailles et formes, composées d’acides nucléiques, soit d’ADN ou d’ARN, contenus dans une capside protéique parfois enveloppée d’une membrane lipidique (M. Flint et al. 2009). Pour se multiplier, un virus doit infecter une cellule hôte, compatible et apte, et utiliser sa machinerie cellulaire pour la synthèse de ses protéines et la réplication de son génome. Le génome viral contient toutes les informations nécessaires à la complétion du cycle de multiplication qui se déroule généralement selon des étapes bien précises, soit l’adsorption, ou l’attachement du virus à une cellule, l’entrée génome viral, la réplication du génome, la synthèse des protéines virales, l’assemblage et le relâchement des virions. Les nouveaux virus produits peuvent ensuite être largués dans l’environnement suite à la lyse cellulaire, par bourgeonnement ou être dispersés avec leur hôte (Dillon 2011; Geden et al. 2008). Les virus se propagent d’un organisme à un autre selon divers modes de transmission et pénètrent leur organisme hôte par différentes portes d’entrée. En ce qui concerne les virus eucaryotes, comme ceux qui infectent les animaux agricoles, les voies de transmission sont généralement le contact direct
3
entre un animal infecté et un animal susceptible ou par contact indirect par transfert mécanique comme, par exemple, la voie des airs (S. J. Flint, V.R. Racaniello et al 2009).
Les virus peuvent être aérosolisés sur ou dans des particules qui sont composées de matières organiques et inorganiques, de protéines et de sels dont les concentrations sont variables (Verreault et al. 2008). Le degré de succès de ces virus à être transmis par la voie des airs est influencé par la nature structurale du virus, de même que par des facteurs environnementaux variés qui affectent l’intégrité du virion dans le bioaérosol par lequel il est transporté d’une cellule susceptible à une autre (Tang 2009). Les conditions environnementales généralement reconnues pour influencer l’intégrité des virions aérosolisés sont la température ambiante, l’humidité relative de l’air, les radiations et la composition de la particule (Tang 2009; Verreault et al. 2015). De plus, la distance que les particules pourront parcourir dans l’air sera directement proportionnelle à leur taille (Hinds 1999).
Le processus d’aérosolisation de même que la nature des autres particules en suspension peuvent également interférer avec la propagation du virus. Dans le contexte de l’élevage agricole, les virus peuvent être relâchés dans l’air par la respiration, la toux, les éternuements et par l’aérosolisation secondaire due aux mouvements des animaux (Verreault et al. 2008). Ils peuvent également pénétrer l’environnement intérieur d’un bâtiment par le système de ventilation lorsque les particules sont transportées d’une ferme à l’autre ou par un insecte, de même que lors de contact avec une surface contaminée ou un animal porteur lors du transport du bétail (Alonso et al. 2014; Corzo et al. 2013; Thakur et al. 2015).
1.3. Virus aérosolisés dans l’agriculture animale
Dès 1955, la communauté vétérinaire canadienne louangeait la situation enviable de l’industrie agricole au pays, mais était déjà en mesure de prévoir que les nouvelles méthodes d’élevage et d’importation menaçaient de favoriser la propagation de maladies contagieuses (Wells 1955). À cet effet, entre 1976 et 2013, le nombre de fermes d’exploitation porcine au Canada est passé de 63 602 à 7 125, soit une diminution de 89% (Canadian Pork 2015). Toutefois, le nombre de porcs produits entre 1984 et 2014 a presque doublé, passant de 15 à 27 millions (M) de têtes (Canadian Pork 2015). Bien que la taille des bâtiments confinés ait pu être adaptée et que les systèmes de ventilation et d’élevage se soient sophistiqués avec les avancements technologiques, la proximité des animaux est la conséquence directe du développement de l’industrie porcine. Ce rapprochement augmente la concentration des contaminants dans l’air et favorise leur dispersion (Godbout et al. 2009; Letourneau et al. 2010; Verreault et al. 2010). Les particules virales étant soumises aux mêmes lois que tout autre contaminant, leur propagation a favorisé les épisodes épidémiques au Canada, tout comme ailleurs sur le globe.
4
L’hypothèse suggérant que le «Foot-and-Mouth Disease Virus» (FMDV) responsable de la fièvre aphteuse pouvait être transmis par la voie des airs par-dessus les mers sur de très longues distances fut supportée dès 1982 (Gloster et al. 1982) alors que la propagation du virus par les aérosols excrétés des animaux put être démontrée en 1967 (Sellers and Parker 1969). Aujourd’hui, les infections causées par le virus du syndrome respiratoire et reproducteur porcin (vSRRP), par le virus de la diarrhée porcine épidémique (vDEP), par le circovirus porcin de type 2 (PCV-2 ), par l’influenza porcin (SIV) ou par le virus herpétique bovin (BHV) ne sont que quelques exemples de virus naturellement aérosolisés et transmissibles par la voie des airs, même si celle-ci peut ne pas être leur voie de transmission privilégiée (Alexandersen et al. 2002; Corn et al. 2009; S. Dee et al. 2009; S. Dee et al. 2010; Pitkin et al. 2009b; Torremorell et al. 1997). Il fut également établi plus récemment que la souche d’influenza aviaire hautement pathogénique (HPAI) H5N1 est transmissible lorsqu’aérosolisée entre les poulets sur une très courte distance (Fournie et al. 2012; Spekreijse et al. 2011). Quant aux distances qui peuvent être parcourues par des particules virales infectieuses, le virus DEP fut détecté à plus de 20 km en aval d’un cheptel infecté (Alonso et al. 2014).
1.4. Impacts économiques des infections virales sur l’industrie porcine
Les maladies virales affectent le bien-être des animaux, leur longévité et leur capacité de reproduction. Toutefois, ce sont les impacts économiques négatifs infligés par les épidémies virales sur les industries agricoles qui font réagir les producteurs à l’échelle du globe. À titre d’exemple, un mémoire publié par la Faculté de médecine vétérinaire de l’Université de Montréal estimait en 2007 que les infections causées par le virus du syndrome respiratoire et reproducteur porcin (vSRRP) sont responsables de pertes économiques annuelles de l’ordre de 150M de dollars au Canada (Sirois 2007) et jusqu’à 169M selon les plus récentes études (Morin 2014). Cette maladie est présentement considérée comme la plus couteuse pour les éleveurs de porcs (Létourneau 2015). De plus, les répercussions économiques du SRRP qui avaient été évaluées à 560M de dollars aux États-Unis en 2005 ont été révisées à la hausse à plus de 664M 6 ans plus tard (Holtkamp et al. 2011). Plus récemment, le vDEP mettait en péril plus de 10% du bétail américain en 2014, une industrie qui produit plus de 23 milliards de livres (1010 kg) de porc annuellement pour un montant total de 97 milliards de dollars (Mole 2013; USDA 2015).
Bien qu’il soit déraisonnable d’attribuer ces fléaux économiques à la seule influence des bioaérosols viraux, il convient de mentionner que malgré les mesures de biosécurité renforcées lors du transport des animaux et aux accès des sites d’élevages, les infections virales continuent d’éclore au Canada et partout dans le monde, et ce, en dépit des recherches épidémiologiques, algorithmes et simulations complexes ou des tentatives d’élaboration de vaccins efficaces (Bowman et al. 2015; Desrosiers 2011; Fahrion et al. 2014; Lowe et al. 2014). En effet, comment se fait-il que les récents développements reliés aux systèmes de génétique inverse
5
n’aient pu réussir à produire des thérapies virales efficaces, tels que des vaccins (Stobart and Moore 2014). Brièvement, la façon dont les vaccins protègent des infections virales implique la production d’anticorps neutralisants qui peuvent être inefficaces pour les virus qui évoluent rapidement ou qui sont génétiquement très diversifiés, tels que les virus à ARN (Robinson et al. 2015). Comme il en sera question un peu plus loin, un grand nombre de virus porcins appartiennent à cette catégorie.
1.5. Stratégies en développement
S’il semble évident que des brèches perdurent dans l’implantation, la compliance ou l’application efficace de mesures de biosécurité qui favorisent le contrôle des épidémies virales dans l’agriculture porcine, cette constatation ne fait que renforcer la pertinence d’élaborer des stratégies qui puissent seconder ces mesures de prévention de premières lignes avec des méthodes d’appoint simples et applicables à l’échelle d’un bâtiment agricole. Les méthodes d’appoint qui peuvent être appliquées par les producteurs sont reliées à la capture des virus aérosolisés avant leur pénétration dans l’environnement intérieur par le système de ventilation et à la détection précoce des virus dans le bâtiment de confinement. Des méthodes intégratives, faisant appel à ces deux principes, tel que le bioconfinement en quarantaine avant l’introduction de nouvelles truies dans une maternité, ont également été tentées (Dufour 2013).
1.5.1. Capture
Les bioaérosols retrouvés dans les bâtiments d’élevages confinés sont composés de microorganismes et leurs métabolites, de protéines animales, de poussières provenant de la nourriture, des excréments et du sol (Letourneau et al. 2010). Ces bioaérosols peuvent être transportés d’un bâtiment agricole à un autre, d’une ferme à une autre, ou être réacheminés à l’intérieur du bâtiment par le système de ventilation (Pitkin et al. 2009a). Les systèmes de ventilation munis de filtres adaptés qui furent récemment développés se sont montrés relativement efficaces pour contrôler la pénétration des particules virales (Pitkin et al. 2009a; Spronk et al. 2010). Par exemple, les risques d’introduction d’une nouvelle souche du virus SRRP ont pu être réduits de 80% dans les bâtiments situés dans une région de production porcine à haute densité, lorsque le système de filtration était ajouté à de bonnes pratiques de biosécurité, démontrant du même coup la prévalence de la transmission de ce virus par la voie des airs (Alonso et al. 2013a). Néanmoins, l’immobilisation financière requise par les producteurs pour se procurer ces systèmes de filtration peut avoir des périodes d’amortissement sur l’investissement de plusieurs années, sans nécessairement garantir leur succès (Alonso et al. 2013b). En effet, bien que l’approvisionnement en air frais de ces bâtiments soit filtré, des entrées d’air parasite, non filtrées, peuvent pénétrer l’environnement intérieur d’un bâtiment par des infiltrations, les portes et autres orifices lorsque ce bâtiment est ventilé par les systèmes en pression négative (CDPQ 2012). De l’air non filtré peut également pénétrer dans le bâtiment par un phénomène de retour d’air (back-drafting) lorsque les ventilateurs sont éteints, ce qui consiste en un réel risque de contamination dans les régions où la
6
production porcine est dense (Alonso et al. 2012; CDPQ 2012). La filtration de l’air comporte d’autres problématiques. Plus le pouvoir de filtration des filtres est élevé, tel que celui des filtres HEPA reconnus pour être les plus efficaces, plus ils sont restrictifs au passage de l’air et requièrent de l’énergie pour alimenter le bâtiment en air frais, augmentant les coûts d’exploitation et la période nécessaire à l’amortissement de l’investissement (S. A. Dee et al. 2006).
D’autres méthodes novatrices telles des filtres antimicrobiens ou l’Electrostatic particle ionization (EPI) ont suscité l’intérêt des acteurs de l’industrie il y a quelques années sans toutefois réussir à enrayer les épidémies (S. Dee et al. 2010). L’EPI est un système d’ionisation des particules en suspension qui génère des ions négatifs et les émet dans l’air. Les murs, les plafonds et les équipements qui sont dans le bâtiment servent ensuite de surfaces d’impaction qui attirent les poussières chargées, diminuant ainsi la concentration de poussières dans l’air et, par extension, des contaminants agglutinés avec elles. Un récent projet pilote conduit par de Centre de développement du porc du Québec (CDPQ), en collaboration avec le laboratoire de Caroline Duchaine du Centre de recherche de l’Institut universitaire de cardiologie et de pneumologie de Québec (CRIUCPQ), a d’ailleurs démontré que les filtres antimicrobiens, lorsqu’additionnés à l’EPI, peuvent réduire la concentration de poussières de 64% et des bactéries totales de 83%. Les particules de plus petite taille (autour de 0,3 µm) ont un taux de réduction de concentration plus faible (54%) (Dufour 2013). Néanmoins, le projet qui avait comme mission le contrôle des aérosols transporteurs du SRRP n’a pu faire la démonstration directe de l’efficacité du concept pour les virus.
1.5.2. Détection précoce
Les avancées technologiques des dernières décennies ont permis de développer des méthodes de détection rapide d’une panoplie de contaminants atmosphériques et d’agents infectieux. On a pu simuler l’atmosphère martienne afin de développer un détecteur de biomolécules dans l’espace (Fajardo-Cavazos et al. 2010) et un dispositif multiplex peut maintenant faire la détection simultanée de 26 agents pathogènes tropicaux (Tan et al. 2014). Toutefois, les producteurs agricoles, aux prises avec des contaminants pouvant compromettre le rendement de leurs entreprises, ne peuvent toujours pas jouir de méthodes de détection précoces ciblant les virus qui dévastent leur production. Aux États-Unis, il fut récemment démontré par biologie moléculaire qu’une vaste diversité de variants sauvages, et d’autres provenant de vaccins, du virus SRRP était présente dans l’air dans les régions de production porcine à haute densité (Alonso et al. 2014; Brito et al. 2014; Corzo et al. 2013). Si ces recherches ont pu démontrer la présence de génomes viraux dans l’air, il devrait être concevable de pouvoir adapter ces méthodes moléculaires complexes aux applications des exploitants agricoles.
7
Ainsi, dans un avenir rapproché, des dispositifs automatisés de détection moléculaire rapide et spécifique pour les virus porcins pourraient être commercialisés. Lorsque ces dispositifs seront disponibles, il deviendra alors indispensable de déterminer la localisation la plus probable des aérosols viraux dans l’espace du bâtiment d’élevage. Les travaux présentés dans le présent ouvrage ont été dirigés dans cette optique.
1.6. Utilisation d’un bactériophage modèle et d’un marqueur fluorescent
Les bactériophages ont joué un rôle clé dans différents types de recherche. Les bactériophages (ou phages) sont des entités virales comme celles décrites précédemment, mais ont la particularité d’infecter exclusivement les bactéries. Une application particulièrement importante des phages est leur utilisation comme modèles ou substituts viraux, notamment lors d’études impliquant des virus pathogènes. Ainsi, dans ces systèmes, ils sont utilisés en remplacement de virus eucaryotes dont la dissémination dans l’environnement pourrait comporter un risque. Comme ils ne posent aucune menace sérieuse pour la santé animale, ils peuvent être disséminés et employés pour des études comportementales dans l’espace. De plus, les phages ont l’avantage d’être relativement faciles à cultiver, d’être peu couteux et d’être généralement faciles à détecter. Cependant, afin de permettre une corrélation adéquate dans un contexte d’aérosolisation, de transport et de détection, il semble important de sélectionner le substitut viral en fonction de similitudes physiques avec les virus d’intérêt (Turgeon et al. 2014). Puisque plusieurs virus d’animaux sont enveloppés, et sont constitués d’un génome à ARN, il nous semble nécessaire d’avoir recours à un substitut viral pourvu d’une enveloppe et ayant un génome à ARN. Le bactériophage virulent phi6, qui infecte la bactérie
Pseudomonas syringae, possède les caractéristiques désirées et est bien caractérisé (Gendron et al. 2010).
Appartenant à la famille des Cystoviridae, son génome est composé de trois segments linéaires d’ARN double brins; un long (L), un moyen (M) et un court (S). Le virion est composé de trois couches concentriques et son diamètre total est approximativement de 86 nm (Poranen et al. 2005). Dans la présente étude, le phage phi6 sera utilisé comme substitut pour les virus enveloppés retrouvés en milieu agricole tels SRRP, SIV, HPAI, PRCV, BCV, BHV-1, BRSV, PIV-3 ainsi que le plus récent DEP (Alonso et al. 2015; Bourgueil et al. 1992; Brockmeier et al. 2008; Saif 2010; Valarcher et al. 2006). Le tableau I présente les caractéristiques physiques de ces virus.
8 Tableau I. Liste de virus agricoles d’intérêt.
phi6
SRRP
PED
SIV
HPAI
PRCV/
BCV
PCV-2
NDV
FMDV
BPIV-3
Nom complet Bactério- phage phi6 Syndrome respiratoire reproducteur porcin « Porcine Epidemic Diarrhea » «Swine Influenza Virus» «Highly Pathogenic Avian Influenza» «Porcine Respiratory Coronavirus»/ «Bovine Coronavirus» «Porcine Circovirus Type II» «Newcastle Disease Virus» « Foot-and-Mouth Disease Virus» «Bovine Para influenza Virus Type III»
Famille Cystoviridae Arteviridae Coronaviridae Orthomyxo
viridae Orthomyxo viridae Coronaviridae Circoviridae
Paramyxo
viridae Picorna viridae Paramyxo viridae
Hôte
Pseudomonas
syringae porc porc
porc humain poulet parfois canard, dindon, caille, humain porc
bovins porc poulet
bovins
porc bovins
Taille
du virion 80 nm 58 nm 150 nm 120 nm 80- 120 nm 80- 160 nm 80- 17 nm 150 nm 27-30 nm 400 nm 200- Génome ARN ds (+) ss ARN (+) ss ARN (-) ss ARN
ARN
(-) ss (+) ss ARN ADN ss (-) ss ARN (+) ss ARN (-) ss ARN
Segments 3 non non 8 8 non non non non non
Enveloppe oui oui oui oui oui oui non oui non oui
Référence (Ellis and
9
Le développement d’une méthode de détection spécifique pour les virus aérosolisés dans les bâtiments agricoles est complexe et continue de poser des défis importants, particulièrement parce que ces bioaérosols existent dans un système dynamique et ponctuel dans le temps et dans l’espace, et que les variables environnementales influencent leur comportement, tant en regard de l’infectivité que du temps de résidence (Verreault et al. 2015). Les variables environnementales peuvent également affecter leur tendance à s’agglutiner à d’autres particules et leur capacité de détection (Alonso et al. 2015). Les méthodes de microscopie et de biologie moléculaire, de même que les méthodes utilisant des marqueurs chimiques sont les mieux adaptées pour étudier ces processus dynamiques dans le temps et l’espace (Nazaroff 2014). L’utilisation de molécules fluorescentes offre l’avantage d’une résolution dans le temps et l’espace, mais manque toutefois de spécificité. Il est légitime de penser qu’à défaut de spécificité, il soit possible de localiser la zone dans l’espace d’un bâtiment où le temps de résidence des particules virales sera le plus long, augmentant ainsi les probabilités de détecter des virus aérosolisés. Conséquemment, cette zone pourrait constituer le positionnement d’un dispositif moléculaire de surveillance en continu.
Ainsi, le présent ouvrage décrit les travaux de recherche effectués entre mai 2012 et aout 2014. Il est séparé en deux principaux volets, soit les chapitres I et II. Le premier chapitre présente les travaux directement dirigés sur l’amélioration des stratégies d’échantillonnage de l’air dans les bâtiments d’élevage confiné dans le but de faciliter la détection précoce des contaminants viraux. Le second chapitre rapporte les travaux de laboratoire qui furent effectués pour la mise au point d’un échantillonneur à haute performance. Ces travaux visaient à étudier le comportement des aérosols viraux en présence de poussières standardisées et à tenter de déterminer si une taille préférentielle pouvait leur être attribuée.
10
2. Chapitre I
Détermination de la localisation spatiale la plus probable des
aérosols viraux dans un bâtiment agricole mécaniquement ventilé à
l’aide d’un bactériophage modèle et d’un marqueur fluorescent
2.1.1. Prémices
Dans le but de déterminer la localisation la plus probable des aérosols viraux dans les bâtiments d’élevage confiné, les composantes nécessaires au développement de la stratégie ont fait l’objet de considérations pratiques et économiques, dont certaines ont été adaptées ou changées au cours de la progression des recherches. Toutefois, toutes ces composantes ont été choisies sur la base de prémices définies lors de l’élaboration préliminaire du projet. Les prémices qui furent posées sont les suivantes : 1) La dispersion des particules aérosolisées dans l’espace n’est pas homogène dans le temps et obéit à la résultante ponctuelle des forces physiques qui s’appliquent sur elles. 2) Il est entendu que le patron de dispersion, le temps de résidence et la localisation spatio-temporelle des bioaérosols dans un bâtiment sont « bâtiment-dépendants » et « particules-bâtiment-dépendants ». Ces propriétés sont influencées par les paramètres environnementaux tels que les dimensions du bâtiment, les matériaux de construction, les flux d’air indésirables et les flux d’air connus, la température ambiante, la pression atmosphérique, l’humidité relative, les obstacles (murs, raccords, poutres, meubles…), les radiations et les mouvements des personnes et animaux qui s’y trouvent. Ces facteurs s’ajoutent et interfèrent avec les propriétés inhérentes aux particules aérosolisées, telles que la charge, la taille et la composition chimique et biochimique. 3) Bien que la modélisation mathématique des particules dans l’air soit possible, elle implique généralement une « sursimplification » du phénomène de dispersion dans l’air qui ne tient pas compte du nombre élevé de variables dans l’environnement intérieur des bâtiments. Les modèles de dispersion des particules atmosphériques, par exemple en préparation d’une réponse face à des attaques biochimiques ou d’accidents nucléaires, ou par les opérations de production animale, tendent à intégrer les modèles de dispersion et de transport traditionnels (gaussiens, lagrangiens, eulériens) à la dynamique des fluides computationnelle, et ajoutent les données connues des conditions météorologiques et du terrain à évaluer (Dungan 2010; Garten 2003). Toutefois, en ce qui a trait à la dispersion des particules dans l’environnement intérieur des bâtiments, ces modèles mathématiques sont à ce jour inapplicables. À notre connaissance, tous les auteurs s’entendent et admettent la difficulté impliquée par l’environnement intérieur à cause de leurs géométries complexes.
11
2.1.2. Précision sur la taille des particules
La taille des particules est probablement la propriété la plus déterminante de son comportement dans l’air. Comme la plupart des particules ne sont pas sphériques, le concept de diamètre aérodynamique est connu et reconnu comme l’équivalent du diamètre d’une particule sphérique ayant la même vélocité terminale qu’une particule de densité standard, comme l’eau (1g/cm3). Cette notion est très utile pour caractériser les particules de taille micrométrique. Pour les particules nanométriques, les concepts d’équivalents de mobilité sont plus adaptés, car ces particules sont généralement moins assujetties à l’inertie. Les équivalences de diamètre de masse, de volume et de surface sont utilisées pour décrire les tailles des particules nanométriques (Kulkarni 2011). Dans la présente étude, tout comme dans celle présentée au chapitre II, le diamètre d’équivalent de masse est utilisé pour caractériser la taille des particules. Cette équivalence correspond au diamètre d’une particule sphérique ayant la même masse que la particule en question.
2.1.3. Hypothèses et objectif
Sur la base des prémices énoncées, nous avons posé les hypothèses suivantes : 1) L’utilisation de traceurs adéquats peut permettre de faire une évaluation des déplacements d’air dans l’espace d’un bâtiment. Ces déplacements peuvent être corrélés avec la dissémination des aérosols dans le temps et l’espace. 2) La zone dans l’espace où se situe une plus grande concentration de traceurs correspond à la zone où la concentration de particules virales aérosolisées sera la plus élevée. 3) Cette zone constitue l’endroit privilégié pour effectuer l’échantillonnage de l’air dans le but de détecter les particules virales aérosolisées.
Ainsi, l’objectif central du présent projet de recherche est de démontrer que l’utilisation seule d’un traceur adéquat, notamment d’un traceur fluorescent, peut permettre de déterminer la localisation la plus probable des aérosols viraux dans un bâtiment agricole mécaniquement ventilé. Cet objectif sera poursuivi en procédant à la co-nébulisation d’une solution fluorescente et d’une suspension de bactériophages dans le système de ventilation d’un bâtiment agricole expérimental. Nous tenterons d’établir une corrélation directe entre le signal détecté en microscopie à fluorescence et le nombre de génomes retrouvé en PCR quantitative. Pour ce faire, une collaboration spéciale fut établie avec l’Institut de recherche de développement en agroenvironnement (IRDA) 1 notamment pour l’utilisation d’un bâtiment agricole expérimental de même que pour leur expertise relativement à la détermination de certains paramètres
1 L’Institut de recherche et de développement en agroenvironnement est une corporation de recherche à but non lucratif qui a pour
mission de réaliser des activités de recherche, de développement et de transfert en agroenvironnement visant à favoriser l’innovation en agriculture, dans une perspective de développement durable. Chaque année, l’IRDA travaille sur une centaine de projets de recherche en collaboration avec de nombreux partenaires du milieu agricole et du domaine de la recherche.
12
physiques concernant les débits de ventilation et les degrés de température. Il fut conjointement décidé avec l’IRDA que les méthodes utilisées devaient impérativement être simples, fiables, économiques, écologiques et sans risque pour les travailleurs ni pour les animaux.
2.2.
Matériel et méthodes
2.2.1. Démarche expérimentale
La succession des étapes choisies pour permettre de déterminer la localisation la plus probable des particules virales dans un bâtiment agricole expérimental (BAE) mécaniquement ventilé est présentée dans la figure 1. Les détails relatifs aux composantes de la démarche expérimentale sont ensuite présentés en ordre d’apparition.
13
2.2.2. Bâtiment expérimental
Le BAE qui fut attribué par l’IRDA était une pièce de 55 m3 située à l’arrière gauche du bâtiment expérimental de production animale DC-0102, localisé au 120-A, chemin du Roy à Deschambault-Grondines, Québec. Il s’agissait d’une pièce ventilée par un ventilateur d’extraction qui instaure une pression négative, comme dans la majorité des bâtiments agricoles porcins. La figure 2 présente une schématisation de l’espace. Afin de faciliter la visualisation, le schéma ne fait pas mention de l’ameublement qui est resté sur place tout au long des séances d’expérimentation.
Un système de chauffage de l’air était installé dans une antichambre (A) où l’air était conditionné à la température désirée avant de pénétrer dans la pièce. Le ventilateur (B) extrayait l’air vicié vers l’extérieur par le conduit. Comme les limites inférieures et supérieures de températures sont relativement permissives pour les élevages porcins, tant en période de chauffage qu’en période de climatisation, et que durant la période d’engraissement, les températures de consigne varient de 15 à 21 °C, nous avons ciblé une température idéale de 18 °C pour toutes les expériences de terrain (Zhang 1994). La surface exploitable de la pièce correspondait à 11,18 m2 (3,43 m X (5.26m – 2,0 m)). Comme les recommandations de surface de plancher requises changent avec le poids des animaux, la moyenne de 0,63 m2 par animal fut utilisée, ce qui permit d’établir le nombre d’animaux qui pourraient être élevés simultanément dans l’espace à 18 °C (Hahn 1993). Selon les standards de l’American Society of Agricultural Engineers (ASAE), un apport d’air frais minimum de 2 L/s est nécessaire en période de chauffage pour chaque animal, fixant ainsi le débit d’air minimum pour toutes les expériences à 36 L/s.
L’ouverture de l’entrée d’air (C) fut arbitrairement fixée statique à 7,60 cm pour toutes les expériences. Le débit de l’air conditionné dans l’antichambre qui pénètre dans la pièce était donc contrôlé par un panneau fixé devant le conduit du ventilateur (B), plus l’ouverture était grande, plus la vitesse de l’air dans le conduit augmentait, plus le débit de l’air était élevé. Cette ouverture était ajustée avant chacune des expériences afin d’obtenir le débit d’air désiré de 36 L/s. Pour ce faire, la vitesse de l’air était systématiquement vérifiée dans le conduit par un trou perforé dans la paroi (D), à une distance de 3,5 m de l’entrée d’air dans l’antichambre, à l’aide d’un anémomètre portatif à fil chaud (TSI instruments). L’instrument permettait une résolution de lecture de 0,01 m.s-1 avec une précision de 0,015 m.s-1. La formule utilisée pour calculer la vitesse d’air appropriée fut la suivante : 𝑣 = 𝑄
ℎ 𝑙 , où v = vitesse de l’air en m.s-1, Q = le débit de l’air en
m3.s-1, h = la hauteur du conduit en m et l = la largeur en m. Compte tenu de la taille du conduit rectangulaire (0,254 m X 0,610 m), et le débit de l’air désiré de 36 L.s-1 (0,036 m3.s-1), la vitesse de l’air nécessaire dans le conduit était de 0,23 m.s-1.
14
La température de l’air et le taux d’humidité relative ont été mesurés en continu à l’aide d’une sonde suspendue au centre de la pièce, reliée à un système d’enregistrement des données (LoggerNet 4.1,
Campbell Instruments). Les mesures étaient enregistrées toutes les 10 minutes. L’humidité relative n’était
toutefois pas contrôlée.
Figure 2. Bâtiment agricole expérimental attribué par l’IRDA. A) Antichambre où l’air frais était préalablement conditionné afin d’atteindre la température appropriée. B) Ventilateur extracteur d’air par lequel sort l’air vicié. L’ouverture de ce conduit contrôle le débit de l’apport en air frais. C) Entrée d’air conditionné. L’ouverture de ce conduit fut arbitrairement fixée à 7,60 cm. D) Endroit approximatif où un trou dans la paroi inférieure du conduit permettait de vérifier la vitesse de l’air à l’aide d’un anémomètre à fil chaud. Les flèches turquoise représentent schématiquement les déplacements d’air. Les triangles rouges numérotés représentent les endroits où les caméras vidéo étaient placées. Une porte, une rampe et une plateforme étaient présentes dans la pièce, mais ne sont pas représentées par souci de clarté (Illustration A. Toperoff).
A
B
C
D
1 2 3 4 515
2.2.3. Tests de fumée
Dans le but d’observer les déplacements d’air à l’intérieur du BAE, et de pouvoir positionner les équipements d’échantillonnage judicieusement, des tests de fumée furent exécutés. Il s’agissait de faire pénétrer un brouillard de fumée de combustion provenant d’une machine de pyrotechnie à l’intérieur du conduit d’entrée d’air, puis de mettre en marche le ventilateur afin d’observer s’il y avait des endroits dans l’espace où les particules étaient moins bien dispersées.
Des lanières de plastique noires d’un mètre de largeur furent installées sur les murs du BAE afin d’augmenter le contraste visuel avec la fumée. Cinq caméras vidéo à basse résolution ont été installées dans le BAE aux endroits schématisés par les triangles rouges numérotés sur la figure 1. L’enregistrement dura 15 minutes et 3 essais ont été effectués. Les fichiers vidéo ont été numérotés selon leur caméra respective et disposés dans trois dossiers séparés soit Essais 1, Essai 2 et Essai 3.
2.2.3.1. Observation à l’aveugle
Les trois dossiers de 5 fichiers vidéo nommés Cam 1 à Cam 5 ont été présentés à 10 participants afin qu’ils puissent tenter de déterminer si à leurs yeux, il y avait un endroit dans l’espace où de la fumée résiduelle était présente plus longtemps. Un schéma de localisation tel que celui de la figure 1 leur fut présenté. Les instructions suivantes leur ont été fournies.
1. Prendre connaissance du schéma de positionnement des caméras qui vous est fourni et sur lequel vous encerclerez la région d’intérêt pour chacun des trois (3) essais. Ceci vous permettra de localiser les angles d’observation et d’avoir une approximation des dimensions.
2. Pour chaque essai, ouvrir les fichiers Cam 1-5 simultanément à l’aide de QuickTime Player ou tout autre lecteur qui vous permette d’ouvrir plusieurs fenêtres vidéo en même temps.
3. Placer les fenêtres sur votre écran de façon à pouvoir les observer en simultané. 4. Commencer le visionnement.
5. Observer le mouvement de la fumée qui pénètre dans l’espace puis sa disparition dans le système de ventilation.
6. Tenter de déterminer, pour chaque essai, quelle région vous semble contenir une concentration plus importante de fumée stagnante.
7. Encercler la région sur la feuille d’observation qui vous est fournie. Vous pouvez encercler jusqu’à deux (2) régions par essai.
Les feuilles furent recueillies et les résultats comptabilisés. Les zones qui furent observées ont été nommées par les lettres A – L, la zone I correspondant à l’entrée d’air dans le BAE. Le positionnement des équipements d’échantillonnage s’est effectué en fonction des réponses obtenues.
16
2.2.4. Échantillonnage de l’air
Pour chacun des essais effectués dans le BAE, un échantillonnage a été effectué avant chacune des nébulisations afin de déterminer le niveau basal de phages présents dans l’air. Comme aucune analyse en microscopie à fluorescence ne fut exécutée sur ces échantillons, l’échantillonnage de l’air était effectué pendant 60 minutes. Pour chacun des échantillonnages suivant une nébulisation, le temps de fonctionnement des pompes était de 120 minutes.
2.2.4.1. Échantillonneur
L’échantillonneur choisi fut le «IOM sampler» développé par l’Institute of Occupational Medicine (IOM) d’Édinbourg en Écosse. Cet échantillonneur a été développé pour la collection des poussières inhalables. Il se distingue de par sa simplicité et son adaptabilité. Le modèle utilisé est constitué d’une structure légère de polymère rigide moulée en plusieurs pièces, dont certaines peuvent être stérilisées à basse température dans l’autoclave. Dans le compartiment « cassette » autoclavable s’insère un filtre de 25 mm de diamètre. Sur le dessus de la cassette se trouve une ouverture circulaire de 15 mm de diamètre pour l’entrée de l’échantillon d’air. La cassette s’insère à son tour dans la structure moulée. Un tube court et flexible d’une dizaine de centimètres connecte l’échantillonneur par son raccord cannelé à une pompe. Pour toutes les expériences, les cassettes ont été stérilisées à l’autoclave et les structures des échantillonneurs ont été nettoyées par trempage dans une solution de Virox 5 (1 :16) pendant 15 minutes puis rincée par trempage à l’eau claire pendant 1 heure minimum. Les structures ont été séchées à l’air puis rangées jusqu’à utilisation.
2.2.4.2. Pompe
Cet échantillonneur a été utilisé avec une pompe à haut débit GilAir-5 (Sensidyne) calibrée à 2 L/minute. Avant chaque session d’expériences, les pompes ont été calibrées précisément au laboratoire, la veille du départ, avec un débitmètre primaire à piston DryCal DC-1 (BIOS International Corporation). Au début de chaque expérience, la calibration des pompes a été vérifiée à l’aide d’un rotamètre (Gilmont Instruments) et les ajustements ont été exécutés au besoin. Les pompes ont été installées aux endroits prescrits et l’échantillonnage du niveau basal (60 minutes) a été exécuté. Les pompes ont été mises hors fonction pendant les nébulisations, à l’exception de la pompe qui était installée directement devant l’entrée d’air dans le BAE. Cet échantillon a servi de contrôle positif d’exécution à chacune des nébulisations afin de s’assurer que les aérosols étaient bien distribués à l’intérieur du BAE. L’échantillonnage de l’air, suite aux nébulisations, a été exécuté pendant 120 minutes.
17
2.2.4.3. Filtres
L’utilisation d’une méthode d’analyse en microscopie à fluorescence, dans le but de quantifier d‘un échantillon à l’autre les variations d’intensité de signal, requiert l’utilisation d’un substrat compatible avec la technique. Le choix des filtres s’est arrêté sur un filtre de nitrocellulose, un mélange biologiquement inerte d’acétate de cellulose et de nitrate de cellulose, avec une porosité de 0,8 µm (MF-AABG0250, Millipore). Ces filtres hydrophiles et versatiles ont la particularité d’être disponibles en noir et d’être quadrillés, ce qui permet de s’assurer que les observations microscopiques soient effectuées toujours dans la même région du filtre, évitant ainsi les variations dues à un biais induit par le choix du champ d’observation dans l’oculaire. Pour chacune des expériences, les filtres ont directement été posés dans les cassettes stériles à l’aide d’une pince stérile dans des conditions aseptiques et ont ensuite été recouverte du couvercle stérile de la cassette. Elles ont été transportées sur le site expérimental dans des contenants propres. Pour chacune des expériences, une cassette supplémentaire a été préparée afin de servir de blanc de terrain.
2.2.5. Nébulisation
Étant donné le volume important de l’espace dans le BAE, le mode de génération de bioaérosols qui fut choisi est la nébulisation. Cette méthode permet la dissémination contrôlée d’une grande concentration de bioaérosols viraux provenant d’une solution dans un temps relativement court. Les caractéristiques des particules virales générées dépendent de la composition de la solution, des spécificités du nébuliseur et de la vélocité du flux d’air qui y pénètre. Le temps de nébulisation appliqué dans le BAE fut déterminé arbitrairement à 20 minutes puisqu’après ce temps, un brouillard de particules était visible. Ensuite, une autre période de 20 minutes était allouée afin de permettre aux aérosols de bien se mélanger dans l’air et de donner le temps au système de ventilation de déplacer l’air.
2.2.5.1.
Nébuliseur
Le nébuliseur utilisé fut le Collison 24 jets (BGI Inc). Un volume de 45 ml de solution fut utilisé pour chacune des nébulisations effectuées dans le BAE. Le nébuliseur était directement installé dans l’entrée d’air conditionné dans l’antichambre (figure 1, A). L’air était poussé par un compresseur à une pression de 40 psig (Campbell-Hausfeld 200 PSI). Le système de ventilation était en fonction aux conditions mentionnées plus haut.
18
2.2.5.2. Solution fluorescente
La solution fluorescente choisie fut une solution de rhodamine WT, un colorant traceur utilisé pour les applications servant à déterminer les volumes, les débits et les directions d’écoulement et de transport dans les systèmes d’eau potable. Ce traceur est certifié conforme à l’utilisation dans l’eau selon le standard NSF60 du « National Safety Foundation » américain. Plus précisément, le colorant traceur est un composé organique hétérocyclique dérivé de la famille des xanthènes comme certains fluorophores utilisés dans les applications de biotechnologie. Le produit commercial choisi fut le « Bright Dyes » (Kingcote Chemicals) qui a un seuil de détection visuel en fluorescence sous les 4 ng par litre de solution (autour de 10 ppb), à une longueur d’onde d’absorbance de 550 nm et d’émission à 588 nm. De plus, les données écotoxicologiques ont confirmé une concentration létale médiane (LC50) >320 mg/L pour les truites arc-en-ciel pendant 96 heures, de 170 mg/L pour les daphnies pendant 96 heures et qu’aucun problème développemental n’était à craindre pour les larves d’huitres jusqu’à 100 mg/L (Marking 1969).
Afin de s’assurer que le signal du traceur n’était pas dégradé trop rapidement par la lumière pour l’ application, une expérience fut effectuée afin d’évaluer la stabilité du signal fluorescent lors de l’exposition prolongée à la lumière ambiante. Les instructions du fabricant indiquaient un rendement maximal de détection de 100 µl : 200 L. Comme nous n’avions pas prévu l’utilisation d’une concentration aussi faible, une solution de 20 µl : 300 ml, soit 133X au-dessus de ce seuil hypothétique de détection, fut préparée et laissée sur une paillasse dans les conditions normales de laboratoire, avec une fenêtre pourvoyant une luminosité d’automne et un éclairage à tubes fluorescents en fonction 10 heures par jour. Le flasque était couvert d’une pellicule plastique pour limiter l’évaporation. Dix µl de la solution furent déposés sur le carreau central d’un filtre noir (MF-AABG0250, Millipore) au moment de la préparation. Cette opération fut répétée 12 jours plus tard. Les filtres furent observés en microscopie à fluorescence (Nikon Eclipse E600,
Software PCI) immédiatement suite au dépôt des aliquotes sur le filtre. Les résultats ont pu corroborer les
affirmations du fabricant, car seule une perte de 43% du signal fut observée dans ces conditions.
2.2.5.3. Bactériophages phi6
Pour les expériences préliminaires de même que pour les essais dans le BAE, le bactériophage phi6 fut amplifié à des titres variant de 10E9 à 10E13 unités formant des plages (ufp) par ml de suspension, selon que les amplifications aient été purifiées ou non. Les protocoles d’amplification et de purification détaillés peuvent être consultés aux annexes A et B. Les suspensions de phages ont été conservées à 4°C jusqu’à leur utilisation et les titres ont été vérifiés tous les 3 mois. Des lysats de phages aux titres de 10E10 ont été utilisés pour les expériences d’hiver et d’été 2013. Une suspension de phages purifiés à une concentration diluée à 10E10 fut utilisée pour les essais d’hiver 2014.
19
2.2.5.4. Concentrations optimales pour la co-nébulisation
Lors des essais préliminaires, il était primordial de déterminer quelle devait être la concentration appropriée de solution de traceur en fonction des possibles interactions chimiques entre les filtres et la molécule fluorescente ou son solvant, car des réactions indésirables pouvaient potentiellement altérer le signal en fluorescence ou influencer les procédés de détection en biologie moléculaire. En d’autres termes, il était nécessaire d’utiliser une quantité de traceur qui soit suffisamment importante pour assurer l’obtention d’un signal fiable en fluorescence lors de l’analyse microscopie, tout en évitant la surcharge (saturation) de molécules fluorescentes qui empêcherait l’observation des variations d’intensité. De plus, il était impératif de déterminer si les molécules fluorescentes ou leur solvant avaient un effet inhibiteur sur le procédé de détection en biologie moléculaire. Il en allait de même pour la concentration finale de bactériophages contenue dans la solution à nébuliser, à savoir qu’une concentration trop faible ne permettrait pas la quantification avec les méthodes de biologie moléculaire prévues, et qu’une concentration trop élevée ne permettrait pas de quantifier les variations de concentrations entre les échantillons.
Ainsi, la mise au point fine des concentrations fut exécutée en laboratoire à l’aide d’une chambre environnementale dénommée tunnel à vent. Un tunnel à vent est une chambre d’aérosolisation dynamique dans laquelle les aérosols qui y sont générés sont en mouvement (figure 3). Ce dispositif, lorsqu’associé aux instruments de mesure adéquats, permet l’étude du comportement des particules qui y sont aérosolisées. À titre d’exemple, le suivi des concentrations et de la taille des aérosols dans le temps peut être effectué suite à un processus d’aérosolisation, de même que l’évaluation du rendement de récupération d’une méthode.
La solution de nébulisation de base était une solution tampon, nommée « tampon de phage », composée de 20 mM Tris, 100 mM NaCl, 10 mM MgSO4. Les conditions utilisées dans le tunnel étaient : vitesse du vent = 1,25 m/s; 40 psig dans le nébuliseur; concentration de particules aérosolisées = 2,5 < 5,3 mg/m3; échantillonnage = 1 minute. Suite à l’analyse des échantillons en microscopie à fluorescence et en biologie moléculaire (méthodes décrites dans les sections suivantes), il fut déterminé qu’une concentration de 50X (50 fois le seuil de détection proposé par le fabricant du traceur), soit 25 µl de traceur : 1L de tampon de phage 1X et une concentration de 10E8 ufp de bactériophages phi6 par volume nébulisé, permettait une détection optimale des deux signaux lorsqu’ils étaient conébulisés. Cette formulation fut utilisée pour les essais d’hiver et d’été 2013. Elle fut changée pour les essais d’hiver 2014.
20
D’autres expériences d’optimisation ont suivi, notamment pour vérifier si les interactions moléculaires impliquées dans le processus de co-nébulisation interféraient avec le taux de récupération des bactériophages dans le procédé de quantification en PCR quantitative. Aucune interférence ne fut observée. L’ajout de poussières standardisées « Arizona Road Dust » (Powder Technology Inc), dans le système a démontré que les virus étaient plus facilement détectables lorsque la poussière était présente, suggérant qu’un plus grand nombre de virus se retrouvait sur les particules. Toutefois, l’absence de moyens mécanisés pour distribuer la poussière dans un espace tel que le BAE n’a pas permis son utilisation pour les expériences sur le terrain. Ces expériences ont toutefois permis d’élaborer d’autres pistes de recherche. Le chapitre II du présent document fut inspiré par ces travaux d’optimisation.
Figure 3. Tunnel à vent. 1) Un ventilateur extracteur (ici non connecté au tunnel) tire l’air à vitesse variable. 2) L’air entre par une trappe munie d’un filtre HEPA dans la paroi supérieure de la chambre d’aérosolisation. 3) L’air provenant d’un système intégré à l’immeuble est délivré à pression variable par un tube flexible connecté au nébuliseur installé dans la chambre 4. 4) Chambre d’aérosolisation. 5) Dans les parois du tunnel, des sondes variées, telles qu’un anémomètre et un psychromètre, sont installée de même que des ports d’échantillonnage. 6) Un APS (Aerodynamic Parlicle Sizer, TSI) est utilisé pour étudier les concentrations et les tailles des particules. 7) L’APS et les sondes sont connectés à des ordinateurs portables qui permettent le suivi de l’expérience en temps réel et l’enregistrement des données.