HAL Id: tel-01088716
https://tel.archives-ouvertes.fr/tel-01088716
Submitted on 28 Nov 2014HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
l’oxygénation musculaire et cérébrale lors de l’exercice
d’intensité modérée et élevée
Houssem Zorgati
To cite this version:
Houssem Zorgati. Effet de la cadence de pédalage sur les paramètres de l’oxygénation musculaire et cérébrale lors de l’exercice d’intensité modérée et élevée. Autre [qbio.OT]. Université Paris Sud -Paris XI, 2014. Français. �NNT : 2014PA113005�. �tel-01088716�
UNIVERSITÉ PARIS-SUD
ÉCOLE DOCTORALE 456 :
SCIENCES DU SPORT, DE LA MOTRICITÉ ET DU MOUVEMENT HUMAIN Laboratoire : Complexité, Innovation et Activités Motrices et Sportives
THÈSE DE DOCTORAT
SCIENCES DU SPORT ET DU MOUVEMENT HUMAIN
par
Houssem ZORGATI
Effet de la cadence de pédalage sur les paramètres de
l’oxygénation musculaire et cérébrale lors de l’exercice
d’intensité modérée et élevée
Date de soutenance : 03/10/2014 Composition du jury :
Directeur de thèse : Fabrice PRIEUR MCU HDR (Université d’Orléans) Rapporteurs : Laurent BOSQUET Professeur (Université de Poitiers)
Henri BENOIT Professeur (Université de Grenoble 1) Examinateurs : Katia COLLOMP Professeur (Université d’Orléans)
Patrick MUCCI Professeur (Université de Lille 2) Thomas RUPP MCU (Université de Savoie) Membre invité : Virgile AMIOT Médecin du sport (CHR d’Orléans)
« La vie, c’est comme une bicyclette, il faut avancer pour ne pas perdre l’équilibre.» Albert EINSTEIN Mais… «Tout en choisissant sa propre cadence !» Sans oublier que… « Seul le rythme provoque le court-circuit poétique et transmue le cuivre en or, la parole en verbe.» Léopold Sédar SENGHOR, Éthiopiques, Postface, 1956.
Dédicaces
Je dédicace ce présent mémoire à mon père, à ma mère,
à ma sœur et à mon frère, qui m’ont toujours
soutenu pour finir ce travail.
Merci à vous pour tout le soutien, les sacrifices et l’affection
dont vous avez fait preuve
à mon égard.
Puisse cette offrande, ma plus importante réalisation, vous témoigne
toute ma gratitude, mon profond amour
et ma reconnaissance éternelle.
Mais aussi je souhaite dédier ce manuscrit à mon cher Directeur et à Katia
pour leurs soutiens continus.
A tous ceux qui me sont
chers,…
Remerciements
Ce travail n’aurait jamais vu le jour sans l’aide et le soutien de nombreuses personnes, que je tiens à remercier tout particulièrement.
A Monsieur Fabrice PRIEUR,
qui m’a encadré pendant quatre ans et pour qui j’ai le plus profond respect. Outre vos nombreuses compétences, qui m’ont permis de développer un savoir scientifique, je souhaite vous remercier plus particulièrement pour votre disponibilité, votre sens de la pédagogie, votre patience et vos qualités humaines.
A Mesdames et Messieurs les membres du Jury,
qui me font un grand honneur d’accepter de juger ce travail
A Katia COLLOMP,
pour tout ce que vous avez fait pour moi… Merci pour votre intérêt et votre disponibilité
A l’UFR STAPS d’Orléans,
et notamment, Marc LEVEQUE,Jean-Paul ELIZONDO, Jacques LARUE, Hugues PORTIER, Philippe REBOT, Nancy REBOT, Hérvé GARRIGUES, Alexandre GUIMARD, Nathalie RIETH, Christelle JAFFRE, Arnaud LACAILLE,Aimen KHACHAREM,Jean-Baptiste DUEZ, Jean-Louis LABONNE,
je tiens à vous remercier chaleureusement
A Monsieur le Professeur Patrick MUCCI, Jan BOONE et Olivier BUTTELLI,
pour leur collaboration précieuse
Au Docteur Virgile AMIOT,
pour m’avoir accueilli dans son service et permis de réaliser mes recherches dans de bonnes conditions
Aux membres duservice d’Exploration Fonctionnelle et Respiratoire du CHR d’Orléans
pour leur contribution au déroulement des protocoles expérimentaux
A nos chers sujets,
aux étudiants de l’UFR STAPS d’Orléans et aux triathlètes qui ont contribué à la réalisation de ce travail
A mes amis,
et notamment, Jamel, Yousef, Acho, Nizar, Mary, Amine, Akram, Nader, Helmi, Maxime, Christophe, Douha, Cécile, Martial,
pour votre soutien…
A Sylvain et Sophie,
pour votre aide…
A Evelyne,
avec qui j’ai arrêté de compter le nombre d’heure de correction d’anglais…Merci pour ton aide et ton soutien !
A ma famille,mes parents, ma sœur et à mon frère,
pour leurs soutiens infaillibles !
Je tiens à remercier aussi ceux et celles qui ont contribué de prés ou de loin à l’élaboration de ce travail.
Résumé
Au laboratoire comme sur le terrain, le choix de la cadence lors de l’exercice de pédalage est un élément important dans la réalisation d’un exercice. De nombreux travaux ont porté sur l’effet de la cadence de pédalage sur différents aspects tels que la performance, les paramètres cardiorespiratoires, la participation du métabolisme « anaérobie » et le recrutement musculaire. Cependant, très peu de travaux ont étudié l’effet de la cadence de pédalage sur la disponibilité et l’utilisation d’O2 au niveau musculaire et cérébral. L’objectif principal de cette
thèse était de comprendre les effets de la cadence de pédalage sur la disponibilité en O2 ainsi
que l’utilisation d’O2 au niveau musculaire et cérébral. Le but de nos trois plans
expérimentaux était d’étudier d’une part l’effet de la cadence de pédalage sur l’hétérogénéité de la déoxygénation musculaire lors de l’exercice modéré et d’autre part l’effet de la cadence sur l’oxygénation musculaire et cérébrale et sur la performance lors de l’exercice intense chez des sujets non entraînés ainsi que chez des sujets entraînés à l’endurance.
Ce travail nous a permis de montrer que, lors de l’exercice d’intensité modérée, O2 de
l’organisme entier et l’hétérogénéité de la déoxygénation musculaire étaient plus élevées à cadence élevée qu’à cadence faible, bien que la déoxygénation n’était pas modifiée par la cadence de pédalage chez les sujets non entraînés à l’endurance. D’autre part, lors de l’exercice intense mené jusqu’à l’épuisement, la performance était améliorée à 40 rpm par rapport à 100 rpm chez les sujets non entraînés tandis qu’aucune différence significative n’était observée entre les deux cadences chez les triathlètes. De plus, l’extraction d’O2 au
niveau du vastus lateralis était dépendante de la cadence de pédalage chez les sujets non entraînés mais ne l’était pas chez les sujets entraînés à l’endurance. Enfin, nous avons observé un effet de la cadence de pédalage sur l’oxygénation cérébrale et en particulier une possible élévation de la disponibilité en O2 au niveau cérébral à faible cadence de pédalage chez les
deux populations. Pour conclure, ce travail nous a permis de mettre en évidence des différences liées à l’aptitude aérobie des sujets et à l’intensité de l’exercice dans les réponses de l’oxygénation cérébrale et musculaire et de la performance lors d’exercices effectués à différentes cadences.
Mots clés : cadence de pédalage, oxygénation musculaire, oxygénation cérébrale,
spectroscopie dans le proche infrarouge (NIRS), performance, exercice d’intensité modérée, exercice temps limite, épuisement, entraînement en endurance.
Abstract
Choosing the pedalling cadence during the cycling exercise, in the laboratory as well as on the field, is a crucial element in fulfilling an exercise. Many studies have examined the effect of pedal cadence on various aspects such as performance, cardiorespiratory parameters, the participation of the “anaerobic” metabolism and muscle recruitment. However, few studies have investigated the effect of pedal cadence on the O2 availability and its utilization in the
muscle as well as in the brain. This is why the main objective of this thesis was to understand this subject which is underdeveloped. The aim of our three experimental procedures was on one hand to study the effect of pedal cadence on the heterogeneity of the muscle’s deoxygenation during moderate exercise. On the other hand, to study the effects of pedal cadence on muscle and cerebral oxygenation and also on the performance during heavy exercise in untrained subjects, as well as in endurance-trained subjects.
This work allows us to show that at moderate-intensity exercise, whole body O2 and the
heterogeneity of muscle deoxygenation were higher at high cadence than at a lower one, even if the deoxygenation was not altered by the pedalling cadence in non-endurance-trained subjects. On the other hand, during intense exercise performed until exhaustion, the performance improved at 40 rpm than at 100 rpm in untrained subjects, while no significant difference was observed between the two cadences among triathletes. In addition, the O2
extraction in the vastus lateralis depended on the pedal cadence in untrained subjects and the opposite in endurance-trained subjects. Finally, we observed an effect of pedal cadence on cerebral oxygenation and in particular a possible rise in the availability of O2 in the brain on a
lower cadence in both population levels. In conclusion, this work has allowed us to highlight the differences in the aerobic fitness of the subjects and in the intensity of the exercise in brain and muscle oxygenation responses and performance during exercises performed at different cadences.
Keywords: pedal cadence, muscle oxygenation, cerebral oxygenation, near infrared
spectroscopy (NIRS), performance, moderate-intensity exercise, exercise until exhaustion, fatigue, endurance training.
Table des matières
Dédicaces ... 3
Remerciements ... 4
Résumé ... 6
Abstract ... 7
Table des matières ... 8
Index des figures et tableaux ... 12
Liste des abréviations et symboles ... 15
Introduction ... 17
Partie 1 : REVUE DE LITTERATURE ... 20
I.
Oxygène et limitation de l’exercice ... 21
1. Les étapes du transport d’O2 ... 21
2. Apport et utilisation d’O2 au niveau musculaire à l’exercice ... 22
2.1. Apport musculaire d’O2 ... 22
2.1.1. Débit sanguin musculaire à l’exercice ... 23
2.2. Utilisation musculaire d’O2 ... 25
3. Apport et utilisation d’O2 au niveau cérébral ... 26
3.1. Apport cérébral d’O2 ... 26
3.1.1. Débit sanguin cérébral à l’exercice ... 27
3.2. Utilisation cérébrale d’O2 à l’exercice ... 30
4. Apport et utilisation musculaire et cérébrale d’O2 et limitation de l’exercice ... 31
4.1. Limitation du transport d’O2 ... 31
4.2. Limitation de l’exercice et oxygénation cérébrale et musculaire ... 33
4.2.1. Limitation de l’exercice et oxygénation cérébrale ... 34
4.2.2. Limitation de l’exercice et oxygénation musculaire ... 35
II.
La cadence de pédalage ... 37
1. Effet de la cadence de pédalage sur la performance ... 37
1.1. Lors d’un exercice incrémental ... 38
1.2. Lors d’un exercice à charge constante ... 39
1.2.2. Exercice d’intensité élevée ... 40
2. Effet de la cadence de pédalage sur la participation du métabolisme « anaérobie » ... 41
3. Effet de la cadence de pédalage sur les paramètres cardiorespiratoires ... 42
3.1. La consommation d’oxygène ... 42
3.2. La ventilation... 46
3.3. La fréquence cardiaque ... 47
4. Effet de la cadence de pédalage sur le recrutement musculaire ... 48
5. Effet de la cadence de pédalage sur le débit sanguin ... 50
5.1. Au niveau musculaire ... 50
5.2. Au niveau cérébral ... 54
6. Effet de la cadence de pédalage sur l’oxygénation tissulaire ... 55
6.1. Au niveau musculaire ... 55
6.2. Au niveau cérébral ... 56
III.
La spectroscopie dans le proche infrarouge ... 58
1. La technique NIRS ... 58
1.1. Principe théorique ... 58
1.2. Loi de Beer-Lambert modifiée ... 61
2. Les principales applications de la NIRS ... 64
2.1. Au niveau musculaire ... 64
2.1.1. Lors d’un exercice incrémental ... 65
2.1.2. Lors d’un exercice à charge constante ... 67
2.1.2.1. Exercice d’intensité modérée ... 67
2.1.2.2. Exercice d’intensité élevée ... 70
2.2. Au niveau cérébral ... 72
2.2.1. Lors d’un exercice incrémental ... 72
2.2.2. Lors d’un exercice à charge constante ... 74
2.2.2.1. Exercice d’intensité modérée ... 74
2.2.2.2. Exercice d’intensité élevée ... 76
3. Les avantages de la NIRS ... 77
4. Les limites de NIRS ... 78
IV.
Conclusion cadre théorique et problématique ... 81
1. Contexte ... 81
2. Objectif principal ... 83
Partie 2 : CONTRIBUTION PERSONNELLE ... 85
I.
Méthodologie générale ... 86
1. Sujets ... 86
2. Protocole ... 87
2.1. Test incrémental jusqu’à épuisement (études 1, 2 et 3) ... 87
2.2. Exercice modéré à charge constante (étude 1) ... 88
2.3. Exercice intense à charge constante (études 2 et 3) ... 88
3. Variables mesurées ... 89
3.1. Echanges gazeux ... 89
3.1.1. Détermination du premier seuil ventilatoire (étude 1) ... 89
3.2. Fréquence cardiaque ... 90
3.3. Oxygénation musculaire et cérébrale ... 90
3.3.1. Etude 1 ... 90
3.3.1.1. Détermination de la vasodilatation induite par l’exercice ... 92
3.3.1.2. Hétérogénéité de la déoxygénation musculaire ... 93
3.3.2. Etude 2 et 3 ... 93
3.4. Performance (études 2 et 3) ... 96
3.5. Concertation sanguine de lactate (études 2 et 3) ... 96
3.6. Perception de la pénibilité de l’effort... 96
3.7. Statistiques ... 97
3.7.1. Etude 1 ... 97
3.7.2. Etude 2 et 3 ... 97
II.
Contribution expérimentale ... 98
1. Etude 1 : effet de la cadence de pédalage sur l’hétérogénéité de la déoxygénation musculaire lors de l’exercice modéré. ... 98
1.1. Contexte et objectifs ... 98
1.2. Résultats ... 100
1.2.1. Réponses cardiorespiratoires ... 100
1.2.2. Paramètres de l’oxygénation musculaire ... 101
1.2.2.1. HHb, tHb et Δmax-mintHb au niveau musculaire ... 101
1.2.2.2. Hétérogénéité de la déoxygénation musculaire ... 102
2. Etude 2 : effet de la cadence de pédalage sur l’oxygénation cérébrale et musculaire au cours de l’exercice de pédalage intense mené jusqu’à épuisement chez des sujets sains ... 103
2.1. Contexte et objectifs ... 103
2.2.1. Réponses cardiorespiratoires ... 105
2.2.2. Paramètres de l’oxygénation musculaire ... 106
2.2.3. Les paramètres de l’oxygénation cérébrale ... 108
2.2.4. La performance ... 108
2.2.5. Lactate et RPE ... 109
3. Etude 3 : oxygénation cérébrale et musculaire au cours de l’exercice intense mené à cadence faible et à cadence élevée chez les triathlètes ... 110
3.1. Contexte et objectifs ... 110
3.2. Résultats ... 112
3.2.1. Réponses cardiorespiratoires (Figure 41) ... 112
3.2.2. Paramètres de l’oxygénation musculaire (Figure 42a) ... 114
3.2.3. Paramètres de l’oxygénation cérébrale (Figure 42b) ... 116
3.2.4. Performance... 116
3.2.5. Pression artérielle, [La]sg et RPE (Tableau 5) ... 116
III.
Synthèse ... 119
1. Discussion de l’étude 1 ... 119
1.1. Hétérogénéité de HHb... 119
1.2. HHb, tHb et Δmax-mintHb musculaire ... 120
1.3. Intensité de l’exercice et réponses cardiorespiratoires ... 122
2. Discussion des études 2 et 3 ... 123
2.1. Performance ... 123
2.2. Oxygénation musculaire ... 125
2.3. Oxygénation cérébrale ... 128
2.4. Réponses métaboliques et cardiorespiratoires ... 129
3. Discussion générale ... 131
4. Limites et orientations futures ... 134
5. Perspectives et conclusion ... 136
Références bibliographiques ... 138
Travaux ... 156
Index des figures et tableaux
Figure 1 : principales étapes du transport d’O2 (structures et fonctions) ... 22
Figure 2 : évolution du débit sanguin musculaire mesuré au niveau de l’artère fémorale lors d’un exercice d’extension du genou à des différentes puissances ... 23 Figure 3 : interaction des mécanismes locaux (vasodilatation) et centraux (vasoconstriction)
de régulation de la vasomotricité musculaire... 24 Figure 4 : facteurs de régulation du débit sanguin cérébral pendant l’exercice ... 27 Figure 5 : débit sanguin cérébral au repos et pendant l’exercice sous-maximal et maximal ... 28 Figure 6 : changements du débit sanguin pendant l’exercice ... 29 Figure 7 : l’extraction et la consommation cérébrale d’O2 au repos et pendant l’exercice
sous-maximal et sous-maximal ... 31 Figure 8 : sensibilité de O2max à chacun des composants du système de transport d’O2... 32
Figure 9 : schéma hypothétique reliant le transport d’O2 et ses effets sur la fatigue et la
performance lors de l’exercice. ... 33 Figure 10 : temps jusqu’à épuisement à 60, 80, 100 et 120 rpm au cours de l’exercice
incrémental ... 39 Figure 11 : relations O2 -cadence (○) et RPE-cadence (●) lors d’exercice effectués à 40, 60,
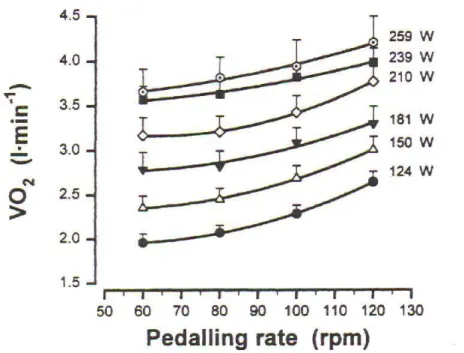
80, 100 et 120 rpm à une puissance externe de 150 W ... 43 Figure 12 : relation O2-cadence de pédalage lors d’exercice effectués à 60, 80, 100 et 120
rpm à différentes puissances externes ... 44 Figure 13 : relation E-cadence de pédalage lors d’exercices effectués à 50, 125, 200 et 275 et 350 W. ... 47 Figure 14 : relation FC-cadence de pédalage lors d’exercice effectué à 50, 125, 200 et 275 et
350 W ... 48 Figure 15 : modèle schématique de la composition et de la relation puissance-cadence d’un
muscle entier composé de proportions égales des fibres musculaire type I et Type II ... 50 Figure 16 : réponse du débit sanguin musculaire pendant l’exercice incrémental d’extension
du genou jusqu’à épuisement effectué à 40, 60 et 80 cpm ... 52 Figure 17 : évolution de O2 et [HHb] pendant l’exercice progressif (à gauche) et à 20 W
(BSL), au seuil lactique (LT) et à O2peak (à droite) à 60 et 100 rpm. ... 56
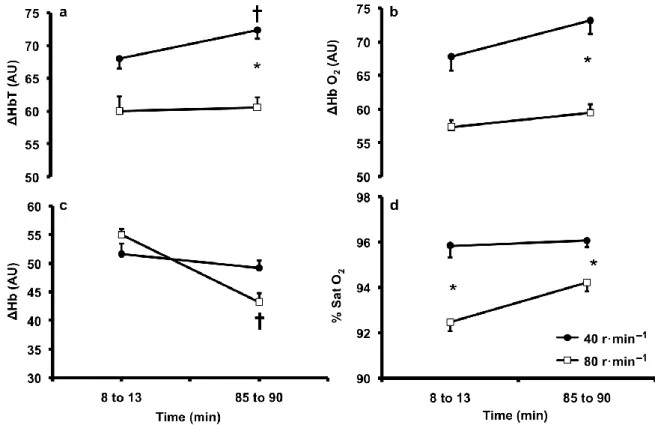
Figure 18 : ∆tHb(a), ∆O2Hb(b), ∆Hb (c) et SatO2 (d) au niveau du cortex frontal pendant 90
minutes de pédalage à 40 et 80 rpm ... 57 Figure 19 : spectres d’absorption de la lumière de O2Hb et HHb dans la « fenêtre optique » du
proche infrarouge ... 59 Figure 20 : la NIRS en mode réflexion... 60
Figure 21 : modèle de «la cuvette», qui constitue la base de la loi de Beer-Lambert ... 61
Figure 22 : modèle illustrant les concepts de l’absorption de photons, la diffusion vers l’avant et vers l’arrière et la longueur du trajet optique ... 63
Figure 23 : paramètres NIRS au niveau du vastus lateralis au cours d’un exercice incrémental ... 66
Figure 24 : changements au cours de temps des paramètres NIRS durant un exercice de pédalage progressif maximal ... 67
Figure 25 : réponses typiques de Δ[tHb] et Δ[Oxy] à l’exercice de pédalage ... 68
Figure 26 : changements des paramètres NIRS du muscle vastus lateralis pendant 90 minutes de pédalage à 40 et 80 rpm ... 69
Figure 27 : adaptation des paramètres NIRS au niveau du muscle vastus lateralis en réponse à une variation de la puissance de travail de 20 W à 80% du « seuil lactique » ... 70
Figure 28 : changements de l’oxygénation du vastus lateralis au cours l’exercice intense ... 71
Figure 29 : paramètres NIRS au niveau du cortex préfrontal au cours d’un exercice incrémental ... 73
Figure 30 : changements au cours du temps des paramètres NIRS au niveau cérébral lors d’un exercice maximal progressif de pédalage ... 73
Figure 31 : changements des paramètres NIRS au niveau cérébral pendant 10 minutes de repos, 10 minutes de pédalage à 30% de O2max, 10 minutes à 60% de O2max et 10 minutes de récupération ... 75
Figure 32 : oxygénation cérébrale déterminée par NIRS au repos, au cours de l’exercice sous-maximal et sous-maximal et pendant la récupération ... 76
Tableau 1 : caractéristiques de la population étudiée ... 86
Figure 33 : optode NIRS placée au niveau du vastus lateralis pour l’étude 1... 91
Figure 34 : détermination de ∆max-mintHb (étude 1) ... 93
Figure 35 : optode NIRS utilisée pour les études 2 et 3 ... 94
Figure 36 : détermination de la position de l’optode au niveau du cortex préfrontal (étude 1 et 2)... 95
Tableau 2 : réponses cardiorespiratoires lors de l’exercice à 40 et 100 rpm ... 100
Figure 37 : HHb (A) et tHb (B) à la deuxième, quatrième et sixième minute lors de l’exercice à 40 et 100 rpm. ... 101
Figure 38 : dispersion relative de la déoxygénation musculaire (HHb RD) à 100 et 40 rpm. 102 Tableau 3 : paramètres cardiorespiratoires et oxygénation musculaire et cérébrale à l’épuisement au cours de l’exercice à 100 rpm et au temps correspondant à 40 rpm ... 105
Figure 39 : paramètres cardiorespiratoires à 40 et 100 rpm en fonction du temps ... 106
Figure 40 : ΔHHb, ΔO2Hb et ΔtHb au niveau musculaire (a) et cérébral (b) à 40 et 100 rpm en fonction du temps. ... 107
Tableau 4 : performance, [La]sg et RPE pendant les exercices à 40 et 100 rpm ... 108
Figure 41 : paramètres cardiorespiratoires à 40 et 100 rpm en fonction du temps ... 113 Figure 42 : ΔHHb, ΔO2Hb et ΔtHb au niveau musculaire (A) et cérébral (B) à 40 et 100 rpm
en fonction du temps ... 115 Tableau 5 : performance, [La]sg, RPE et pression artérielle systémique au cours des
Liste des abréviations et symboles
ANOVA : analysis of variance (analyse de variance)
bpm : battements par minutes Ca2+ : ions calcium
CaO2 : contenu artériel en oxygène
CLC : cadence librement choisie
CMRO2 : cerebral metabolic rate of oxygen
(taux métabolique cérébral d’oxygène) CO2 : gaz carbonique ou dioxyde de
carbone
cpm : contractions par minutes
CvO2 : contenu veineux en oxygène (sang
veineux mêlé)
DPF : differential pathlength factor (facteur correcteur de trajet différentiel) EMG : électromyographie
FC : fréquence cardiaque
FCmax : fréquence cardiaque maximale
FR : fréquence respiratoire H+ : ions hydrogène Hb : hémoglobine [Hb] : concentration sanguine en hémoglobine HHb : désoxyhémoglobine ou hémoglobine réduite HHb RD : dispersion relative de désoxyhémoglobine ΔHHb : variation de désoxyhémoglobine Δ[HHb] : variation de concentration en désoxyhémoglobine Hz : Hertz
[La]sg : concertation sanguine de lactate
MANOVA : multiple analysis of variance (analyse de variance multivariée)
MAOD : déficit maximale accumulé d’oxygène
Mb : myoglobine min : minute mm : millimètres
mmHg : millimètre de mercure
MLSS : maximal lactate steady state (état stable de lactate maximal)
NIRS : near infrared spectroscopy
(spectroscopie dans le proche infrarouge) nm : nanomètre
NO : nitric oxide (monoxyde d’azote) O2 : dioxygène
O2Hb : oxyhémoglobine ou hémoglobine
oxygénée
ΔO2Hb : variation d’oxyhémoglobine
∆[O2Hb] : variation de concentration en
oxyhémoglobine
PaCO2 : pression artérielle en dioxyde de
carbone
PaO2 : pression artérielle en oxygène
PETCO2 : pression en dioxyde de carbone
de fin d’expiration
PMA : puissance maximale aérobie PO2 : pression partielle en oxygène
c : débit cardiaque
M : débit sanguin musculaire
O2C : apport cérébral d’oxygène
O2M : apport musculaire d’oxygène
RER : rapport des échanges respiratoires rpm : rotations par minutes (révolutions par minutes)
s : seconde
SaO2 : saturation artérielle d’hémoglobine
en oxygène
SD : standard deviation (écart-type) SEM : standard error of the mean (écarts types de la moyenne)
SV1 : premier seuil ventilatoire SV2 : second seuil ventilatoire SvO2 : saturation en oxygène du sang
veineux
tHb : hémoglobine totale
ΔtHb : variation de l’hémoglobine totale ∆[tHb] : variation de concentration en hémoglobine totale
U.A : unités arbitraires
VES : volume d’éjection systolique
CO2 : débit expiré en dioxyde de carbone
E : débit ventilatoire
O2 : consommation d’oxygène
O2C : consommation cérébrale d’oxygène
O2M : consommation musculaire
d’oxygène
O2max : consommation maximale
d’oxygène
O2peak : pic de consommation d’oxygène
W : Watt
max : puissance maximale
Introduction
Dans un objectif d’optimisation de la performance, le cycliste doit choisir selon les exigences de la situation entre minimiser la dépense énergétique et la fatigue ou maximiser la distance parcourue, la puissance développée et la vitesse de déplacement. Puisque la puissance correspond au produit de la force par la vitesse, l’optimisation de la performance génère un compromis entre la force appliquée sur la pédale et la fréquence de pédalage. De nombreuses études se sont intéressées à l’identification des facteurs contribuant à modifier les réponses adaptatives de l’athlète au cours d’un exercice de pédalage. Parmi ces facteurs, la cadence de pédalage est un paramètre souvent étudié dans la littérature (Chavarren et Calbet, 1999 ; Dickinson, 1929 ; Foss et Hallen, 2005 ; Jacobs et al., 2013). La plupart des études ont montré que la cadence de pédalage influence les réponses à l’exercice de l’athlète aussi bien au niveau métabolique qu’au niveau biomécanique ou du recrutement des fibres musculaires. Cependant, peu d’études se sont intéressées à l’effet de la cadence de pédalage sur l’oxygénation musculaire et cérébrale.
Pour réaliser un exercice, M et Céréb doivent satisfaire la demande d’O2. Le mode de
contraction, l’intensité de l’exercice et la fréquence des contractions ont des effets directs sur M (Bellemare et al., 1983 ; Buchler et al., 1985 ; Lutjemeier et al., 2005 ; Walloe et Wesche,
1988). Des résultats contradictoires ont été observés concernant l’élévation de la fréquence de contraction musculaire lors d’exercices d’extension du genou ou de flexion plantaire. Il convient de noter que la masse musculaire mise en jeu lors des exercices utilisés dans ces études était relativement faible et les réponses lors d’exercices mobilisant une plus grande masse musculaire pourraient être différentes (Boushel et Saltin, 2013). D’autre part, l’approvisionnement sanguin au niveau cérébral pourrait être affecté par la cadence de pédalage en raison d’une modification de la relation entre la pression artérielle et la circulation cérébrale due à un changement de la sympathoexcitation (Ogoh et al., 2008), ou en permettant une redistribution du sang entre la circulation systémique et la circulation cérébrale (Ogoh et al., 2005).
Un changement de cadence de pédalage pourrait modifier l’oxygénation musculaire et cérébrale puisque le niveau d’oxygénation dans ces territoires dépend de l’apport et de l’utilisation d’O2 à leur niveau. D’autre part, des travaux se sont intéressés à l’effet de la
cadence de pédalage sur l’oxygénation musculaire en utilisant la spectroscopie dans le proche infrarouge (NIRS). Ces études mettent en évidence un niveau similaire d’extraction d’O2
indépendamment de la cadence de pédalage (Ferreira et al., 2006 ; Kounalakis et Geladas, 2012). À notre connaissance, une seule étude a suivi les variations de l’oxygénation cérébrale induites par un changement de cadence de pédalage (Kounalakis et Geladas, 2012). Ce travail a montré que l’oxygénation cérébrale durant un exercice prolongé d’intensité modérée était réduite à 80 rpm en comparaison de 40 rpm. Toutefois, le profil de l’oxygénation musculaire et/ou cérébrale pourrait être différent lors de l’exercice intense mené jusqu’à l’épuisement. De plus, l’influence de la cadence de pédalage sur les réponses de l’oxygénation musculaire et cérébrale n’a, à notre connaissance, pas été explorée lors d’un exercice d’intensité élevée durant lequel la disponibilité en O2 pourrait jouer un rôle central sur la performance.
D’autre part, ces études antérieures qui ont évalué l’effet de la cadence de pédalage sur l’oxygénation musculaire et/ou cérébrale ont été réalisées chez des sujets non entraînés (Ferreira et al., 2006 ; Kounalakis et Geladas, 2012). Des adaptations à l’entraînement peuvent entraîner un changement de l’équilibre entre l’apport et l’utilisation d’O2. En effet, la
densité capillaire, le nombre et la taille des mitochondries dans le muscle squelettique augmentaient en réponse à l’entraînement aérobie (Holloszy, 2008 ; Laughlin et Roseguini, 2008). De plus, il a été suggéré que le débit sanguin cérébral est amélioré avec l’aptitude aérobie (Ainslie et al., 2008) pouvant ainsi conduire à une amélioration de l’oxygénation cérébrale. Par conséquent, la réponse à un changement de cadence de pédalage pourrait être spécifique chez des sujets entraînés à l’endurance.
Pour finir, un changement de la cadence de pédalage peut modifier le recrutement musculaire. Pour une même puissance externe, un recrutement supplémentaire de fibres musculaires à contraction rapide a été observé à une haute fréquence de contraction (Sargeant, 2007). La conséquence de ces modifications pourrait être un changement de O2M dans
certaines régions du muscle actif. Par ailleurs, il a été montré que la perfusion musculaire est hétérogène au cours de l’exercice (Kalliokoski et al., 2001 ; Laaksonen et al., 2003 ; Mizuno
et al., 2003) et que la déoxygénation musculaire est hétérogène au sein d’un même muscle
lors de l’exercice de pédalage (Kime et al., 2005 ; Koga et al., 2007 ; Koga et al., 2011 ; Prieur et al., 2010). Toutefois, à notre connaissance, aucune étude n’a examiné l’effet de la cadence de pédalage sur l’hétérogénéité de l’oxygénation musculaire.
Dans ce contexte, il nous apparait important d’approfondir les connaissances sur les effets de la cadence de pédalage sur les réponses musculaires et cérébrales à l’exercice. Dans ce travail nous avons tout d’abord testé l’effet de la cadence de pédalage sur l’hétérogénéité de la déoxygénation musculaire lors d’un exercice de pédalage à charge constante effectué dans le domaine d’intensité modérée à 40 et 100 rpm chez des sujets non entraînés. Ensuite, afin de prendre en compte l’effet de l’intensité de l’exercice, nous avons utilisé la même méthodologie mais lors d’un exercice intense. De plus, l’objectif était de dresser le profil de l’oxygénation musculaire et cérébrale lors de l’exercice intense mené jusqu’à l’épuisement afin de mieux comprendre l’implication de l’oxygénation musculaire et cérébrale dans l’épuisement. Enfin, ce travail nous a permis de comparer la réponse de l’oxygénation musculaire et cérébrale suite à un changement de la cadence chez deux populations différentes (non entraînés vs. triathlètes) dans le but de mettre en évidence un potentiel effet de l’entraînement aérobie.
Nous avons choisi de décomposer ce manuscrit en deux parties elles-mêmes divisées en sous parties. La première partie comprend tout d’abord une revue non exhaustive de l’utilisation d’O2 au niveau musculaire et cérébral et son rôle dans les limitations de
l’exercice. Cette première partie décrit ensuite les effets de la cadence de pédalage puis la technique NIRS, son utilisation et ses limites. Cet état de lieu des connaissances actuelles est suivi du « rationnel scientifique » de la thèse. La deuxième partie illustre notre contribution personnelle pour laquelle nous présentons la méthodologie générale et les principaux résultats obtenus lors de trois études expérimentales. Cette partie est suivie d’une synthèse comprenant une discussion de nos résultats, une discussion générale, les limites et les orientations futures et une conclusion. Enfin, nous terminons cette thèse par les annexes comprenant les différentes publications.
Partie 1
I. Oxygène et limitation de l’exercice
Afin de tenter de mieux comprendre le rôle du transport systémique d’O2 sur la
performance musculaire et le développement de la fatigue à la fois au niveau central et périphérique, nous allons présenter dans cette partie les étapes du transport d’O2, l’apport et
l’utilisation d’O2 au niveau musculaire et cérébral à l’exercice et enfin la limitation de
l’exercice liée à cet apport et à cette utilisation d’O2.
1. Les étapes du transport d’O
2Les principales structures impliquées dans le transport d’O2,ainsi que leurs fonctions,
sont bien connues (Wagner, 2008) (Figure 1). La première étape dans le transport d’O2 est la
ventilation, qui représente le processus au cours duquel l’air inspiré est transporté dans les alvéoles pulmonaires par convection. Grace à la ventilation, PO2 alvéolaire est maintenue à
environ 100 mmHg au niveau de la mer. La deuxième étape du transport d’O2 est la diffusion
passive d’O2 à partir de gaz alvéolaire vers le sang capillaire pulmonaire. La troisième étape
est le transport d’O2 par le sang à partir des capillaires aux veines pulmonaires puis au cœur
gauche et enfin à la microvascularisation des divers tissus de l’organisme. La quatrième et dernière étape est le déchargement d’O2 de l’Hb dans les microvaisseaux des tissus puis la
diffusion passive jusqu’aux aux mitochondries où l’O2 est utilisé afin de produire de l’ATP
Figure 1 : principales étapes du transport d’O2 (structures et fonctions). Les étapes sont reliées en série de telle sorte que le débit maximal d’O2 dépend de la fonction intégrée de
toutes les étapes (Wagner, 2008).
2. Apport et utilisation d’O
2au niveau musculaire à l’exercice
La détermination du principal facteur limitant O2max est toujours en débat (Prieur et
Benoît, 2011 ; Saltin et Calbet, 2006 ; Wagner, 2006). La quantification des multiples étapes de transport d’O2 et de son utilisation par le muscle est importante pour la détermination des
limites de O2M pour diverses formes d’exercice.
2.1. Apport musculaire d’O
2L’apport d’O2 aux muscles est le produit de M par CaO2. M dépend en partie du
débit cardiaque lui-même produit de FC et de VES. CaO2 est dépendant de [Hb] et PaO2,
SaO2 étant liée à PaO2 par la courbe de dissociation de l’oxyhémoglobine :
CaO2 = 1,39 × [Hb] × SaO2 + 0,003 × PaO2
Avec 1,39 (mlO2.g Hb-1), le pouvoir oxyphorique de l’Hb ; [Hb] (g.l-1 sang), la
concentration sanguine en hémoglobine ; SaO2 (%), la saturation artérielle d’hémoglobine en
2.1.1.
Débit sanguin musculaire à l’exercice
Pour exécuter un exercice pendant quelques minutes, M doit répondre à la demande
métabolique. Lors de l’exercice, M s’élève grâce à l’accroissement du débit cardiaque et à
l’augmentation de la perfusion sanguine du muscle. La perfusion musculaire augmente avec l’intensité de l’exercice (Figure 2) et la perfusion musculaire maximale peut être 50 à 100 fois plus élevée qu’au repos (Saltin et al., 1998).
Figure 2 : évolution du débit sanguin musculaire mesuré au niveau de l’artère fémorale lors d’un exercice d’extension du genou à des différentes puissances (Saltin et al., 1998).
La perfusion musculaire est le résultat des interactions entre des mécanismes centraux et locaux de contrôle de la vasomotricité, mais aussi des effets mécaniques de la contraction musculaire (Saltin et al., 1998) (Figure 3). Toutefois, les facteurs locaux de contrôle
vasculaire seraient la principale cause de l’hypérémie fonctionnelle induite par l’exercice (Delp et Laughlin, 1998). Ces facteurs locaux sont des substances vasodilatatrices (NO et métabolites du muscle : adénosine, H+, lactate, CO2).
Figure 3 : interaction des mécanismes locaux (vasodilatation) et centraux
(vasoconstriction) de régulation de la vasomotricité musculaire (Thomas et Segal, 2004).
L’augmentation de la perfusion musculaire accroît la fourniture d’O2 au muscle à un
niveau compatible avec la demande d’O2. L’hyperémie fonctionnelle permet de
« coordonner » la circulation du sang. L’hétérogénéité de la perfusion sanguine diminue dans le muscle squelettique au cours de l’exercice (Kalliokoski et al., 2001 ; Mizuno et al., 2003), ce qui permet sans doute d’améliorer la distribution des globules rouges au sein du muscle actif. La réponse vasodilatatrice maximale au niveau de la jambe a pu être mesurée pendant l’exercice grâce à l’injection de substances vasodilatatrices dans la circulation artérielle. Ainsi, l’injection continue d’adénosine dans l’artère fémorale chez des sujets en bonne santé augmente le débit sanguin de la jambe (mesurée par échographie Doppler) à des valeurs pic de ~ 6-8 l.min-1 lors d’un exercice d’extension du genou (Radegran et Calbet, 2001). Au cours
de l’exercice de pédalage, le débit sanguin dans une seul jambe atteignait ~ 8 l.min-1
à intensité maximale (Calbet et al., 2007 ; Calbet et al., 2006 ; Knight et al., 1993 ; Lundby et
al., 2006 ; Richardson et al., 1995 ; Schaffartzik et al., 1993). Ce débit sanguin atteignait
même 12,5 l.min-1 chez des athlètes présentant un débit cardiaque maximal plus élevé (Gonzalez-Alonso et Calbet, 2003). D’après Kime et al. (Kime et al., 2009), le volume sanguin au niveau du muscle actif (évalué par les variations de la concentration en Hb par la NIRS) diminue pendant la première minute de l’exercice à cause de facteurs mécaniques liés à la contraction musculaire. Ensuite, pour des exercices d’intensités inférieures à 60 % de max, le volume sanguin augmente avec le temps en raison de la vasodilatation et de
l’augmentation du recrutement artériolaire et capillaire. Cependant, pour des intensités d’exercice plus élevées, l’approvisionnement en O2 aux muscles peut être limité par des effets
mécaniques dus à l’augmentation de la pression intramusculaire (Sadamoto et al., 1983 ; Saltin et al., 1998). Cela pourrait expliquer le déséquilibre entre l’apport et la demande d’O2
se produisant lors de l’exercice intense qui peut conduire à la déoxygénation des tissus musculaires.
2.2. Utilisation musculaire d’O
2La phosphorylation oxydative a lieu dans les mitochondries où les molécules d’O2 sont
utilisées en tant qu’accepteur final d’électrons. Ce système de transfert d’énergie exige donc un transport d’O2 de l’air atmosphérique aux mitochondries où l’O2 sera consommé. Le
processus d’apport d’O2 jusqu’aux capillaires musculaires comporte de multiples facteurs
(ventilation pulmonaire, oxygénation du sang artériel, [Hb], c, M et sa distribution
spatiale…). Une fois l’O2 présent au niveau des capillaires musculaires, sa diffusion
jusqu’aux mitochondries est déterminée par la surface d’échange entre le sang et les cellules musculaires et le gradient de PO2 entre les capillaires et les mitochondries. Son utilisation au
niveau mitochondrial est quant à elle déterminée par la densité mitochondriale, l’activité enzymatique oxydative et l’approvisionnement en substrats métaboliques. O2M peut donc
être influencée par de nombreux facteurs impliqués dans le transport d’O2 jusqu’aux
La capacité oxydative des mitochondries des muscles squelettiques a été estimée comme étant au moins deux fois plus élevée que celle utilisée au cours de l’exercice du corps entier (Saltin, 1985). De plus, l’entraînement aérobie induit une augmentation importante de la densité des enzymes mitochondriales. Cependant, ces adaptations n’entraînent que des faibles améliorations de O2max. Tout cela suggère que la capacité d’utilisation d’O2 n’est pas
un facteur limitant important de O2max (Saltin et al., 1977).
3. Apport et utilisation d’O
2au niveau cérébral
L’apport et l’utilisation d’O2 au niveau cérébral sont d’une importance capitale. Au
repos, le cerveau peut consommer 20% de l’O2 de l’organisme malgré le fait que sa masse ne
représente qu’environ 2% de la masse corporelle totale (Bruder et al., 2011). Le glucose est la principale source d’énergie du cerveau. Toutefois, l’oxydation du lactate pourrait participer de manière non négligeable à la production d’énergie du cerveau (Bouzier-Sore et al., 2003). En effet, au cours de l’exercice, le lactate peut contribuer entre 20 et 25 % au métabolisme énergétique cérébral (van Hall et al., 2009). De plus, le métabolisme cérébral anaérobie pourrait être utilisé dans le cas d’une réduction de l’apport d’O2 afin de maintenir
l’homéostasie. Cependant, la plus grande partie du métabolisme cérébral est aérobie et nécessite donc la présence d’O2 (Zauner et al., 2002).
3.1. Apport cérébral d’O
2L’évaluation du métabolisme cérébral est basée sur la détermination de Céréb et de la
concentration des substrats métaboliques et énergétiques disponibles au niveau cérébral. En effet, O2C dépend de Céréb et de la différence artério-veineuse du contenu en O2. Au cours
de l’exercice physique, Céréb augmente pour fournir suffisamment d’O2 au cerveau (Seifert et
Secher, 2011), et la régulation de Céréb apparaît cruciale pour le maintien de l’homéostasie
3.1.1.
Débit sanguin cérébral à l’exercice
Le cerveau humain reçoit environ 750 ml.min-1 de sang au repos, ce qui représente environ 15% du débit cardiaque total (Lassen, 1959). Céréb joue un rôle important dans
l’apport sanguin au cerveau et le maintien d’un Céréb constant est essentiel pour l’organisme.
Contrairement à d’autres organes, Céréb est peu dépendant des variations de la pression de la
perfusion cérébrale ou de la pression artérielle grâce à l’autorégulation cérébrale dynamique (Atkins et al., 2010). L’autorégulation cérébrale est le mécanisme par lequel le cerveau est capable de maintenir Céréb constant lors de variations de pression artérielle. En effet, la
pression artérielle peut varier durant des périodes de stress physiologique, notamment l’exercice physique. Ces changements doivent être compensés par une variation de la résistance vasculaire cérébrale via l’autorégulation cérébrale. La modulation de Céréb est un
effort coordonné, comprenant de nombreux systèmes différents. Les principaux facteurs de régulation de Céréb pendant l’exercice ont été décrits dans des revues récentes (Querido et
Sheel, 2007 ; Seifert et Secher, 2011 ; Willie et al., 2014) (Figure 4).
Figure 4 : facteurs de régulation du débit sanguin cérébral pendant l’exercice. CBF,
débit sanguin cérébral ; les flèches en gras représentent des facteurs qui sont censés être les principaux contributeurs (Querido et Sheel, 2007).
La plupart des études portant sur l’effet de l’exercice sur Céréb ont montré, en utilisant
l’échographie Doppler transcrânienne, une augmentation soudaine de Céréb en réponse à
l’exercice (Imray et al., 2005 ; Jorgensen et al., 1992 ; Linkis et al., 1995 ; Nybo et Nielsen, 2001 ; Pott et al., 1997). Toutefois, d’autres travaux n’ont pas mis en évidence de changement (Scheinberg et al., 1954) ou bien ont montré une diminution de Céréb pendant l’exercice
(Globus et al., 1983). L’augmentation de Céréb est liée à l’intensité de l’exercice. En effet,
Céréb augmentait avec l’intensité jusqu’à des intensités correspondant à environ 60% de
O2max, ensuite Céréb diminuait progressivement pour atteindre les valeurs égales ou
inferieures aux valeurs de repos à des intensités plus élevées (Figure 5) (Hellstrom et al., 1996 ; Moraine et al., 1993 ; Seifert et Secher, 2011). L’augmentation de Céréb a été attribuée à
l’augmentation de l’activité neuronale et du métabolisme cérébrale liée à l’intensité de l’exercice. De plus, la modalité d’exercice et la masse musculaire mise en jeu pourrait modifier la réponse de Céréb à l’exercice (Ide et al., 1998 ; Jorgensen et al., 1992). La baisse
de la vitesse de Céréb à des intensités d’exercice élevées a été généralement attribuée à la
diminution de PaCO2 induite par l’hyperventilation induite par l’exercice (Linkis et al., 1995 ;
Moraine et al., 1993).
Figure 5 : débit sanguin cérébral au repos et pendant l’exercice sous-maximal et maximal. Moyenne ± SEM (données regroupant 23 études) ; CBF, débit sanguin cérébral ;
Kety/schmidt, CBF dérivé de la méthode Kety-Schmidt (barres noires) ; TCD, CBF mesuré par Doppler transcrânien à partir de changements de la vitesse moyenne du sang au niveau de
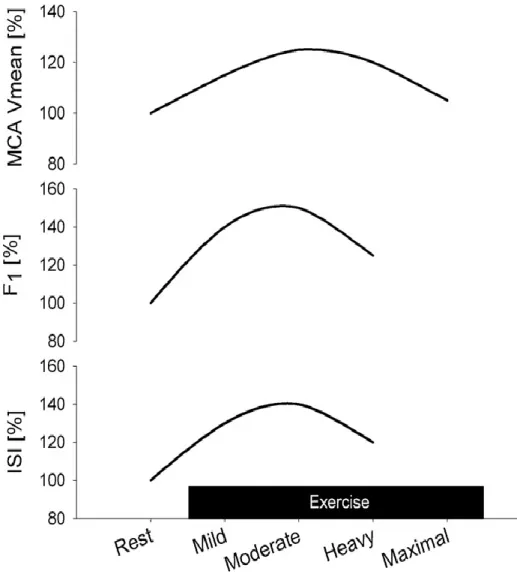
Dans une récente revue, Seifert et Secher (Seifert et Secher, 2011) ont conclu que le débit sanguin cérébral régional, le débit sanguin de la matière grise et de l’artère cérébrale moyenne augmentaient au cours de l’exercice d’intensité faible à modérée, mais diminuaient autour des valeurs de repos au cours de l’exercice d’intense maximale lorsque PaCO2
diminuait en raison de l’hyperventilation induite par l’exercice (Figure 6).
Figure 6 : changements du débit sanguin pendant l’exercice. ISI, indice initial de pente
(représentant à la fois le débit sanguin cortical et de la substance blanche déterminé par le
133
Xe) ; F1, débit du compartiment rapide (représentant le débit sanguin de la matière grise) ; MCA Vmean, vitesse moyenne du sang au niveau de l’artère cérébrale moyenne (données
3.2. Utilisation cérébrale d’O
2à l’exercice
Lorsqu’elle était évaluée par la technique Kety-Schmidt, la consommation cérébrale d’O2 (CMRO2, pour « cerebral metabolic rate for oxygen ») restait stable lors de l’exercice
(Madsen et al., 1993 ; Seifert et Secher, 2011). Toutefois, en utilisant Céréb déterminé par
Doppler transcrânien à partir de changements de la vitesse moyenne du sang au niveau de l’artère cérébrale moyenne, CMRO2 dépendait non seulement de l’intensité du travail, mais
aussi de la masse musculaire impliquée dans l’exercice. En effet, au cours d’un exercice mobilisant une faible masse musculaire de type « handgrip » (Seifert et al., 2010) ou lors d’un exercice de pédalage d’intensité faible (Rasmussen et al., 2010), CMRO2 restait stable.
Cependant, CMRO2 augmentait lors de l’exercice d’intensité modérée et, lors de l’exercice
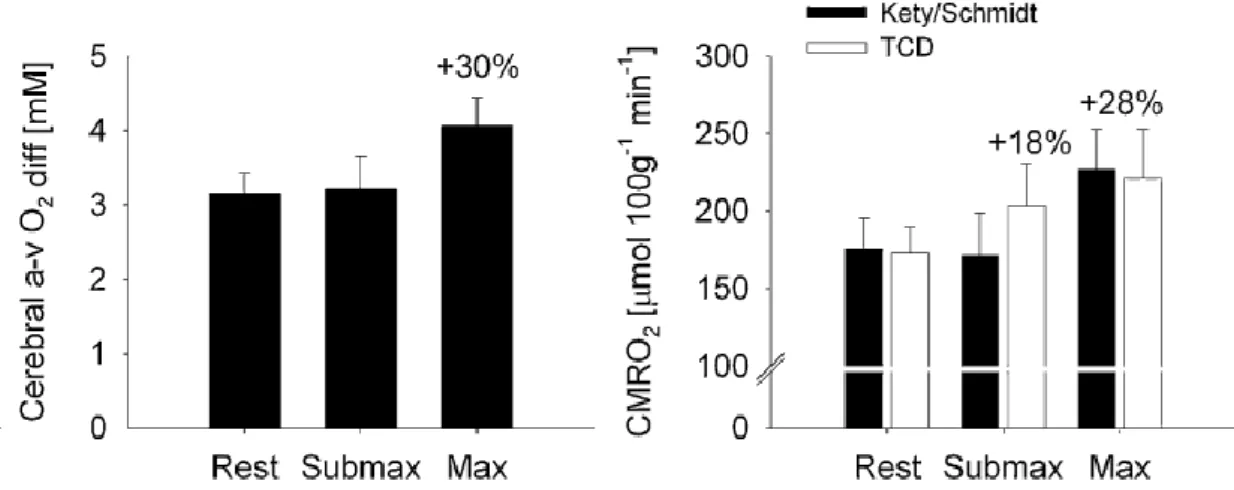
maximal, l’augmentation atteignait environ 30% (Figure 7) (Gonzalez-Alonso et al., 2004 ; Seifert et al., 2009 ; Seifert et Secher, 2011). L’élévation de CMRO2 lors de l’exercice
d’intensité modérée pourrait être expliquée par l’augmentation de Céréb (voir section
précédente). Puisque Céréb retrouve les valeurs de repos lors de l’exercice maximal,
l’augmentation de CMRO2 pendant l’exercice maximal serait due à l’augmentation de la
différence artério-veineuse du contenu en O2 au niveau cérébral (Figure 7). En effet, SvO2 au
niveau de la veine jugulaire interne diminuait d’environ 20% indépendamment de SaO2 qui
restait stable (Seifert et al., 2009 ; Seifert et Secher, 2011).
Au cours de l’exercice intense, une perfusion cérébrale limitée pourrait compromettre CMRO2 (Nybo et Rasmussen, 2007). Toutefois, la réduction de Céréb pourrait être
compensée par l’extraction accrue d’O2 au niveau cérébral de telle sorte que CMRO2 soit
maintenue ou même augmentée (Nybo et al., 2002). Par ailleurs, l’oxygénation du lobe frontal, évaluée par la NIRS, ainsi que PO2 mitochondriale au niveau cérébral augmentaient
pendant l’exercice d’intensité faible à modérée, mais diminuaient au cours de l’exercice maximal (Seifert et Secher, 2011).
Figure 7 : l’extraction et la consommation cérébrale d’O2 au repos et pendant l’exercice
sous-maximal et maximal. Moyenne ± SEM (données regroupant 23 études) ; cerebral a-v
O2, différence artério-veineuse du contenu en O2 au niveau cérébral ; CMRO2, débit de
consommation cérébrale d’O2 ; Kety/schmidt, Céréb dérivé de la méthode Kety-Schmidt
(barres noires) ; TCD, Céréb évaluée avec le Doppler transcrânien à partir de changements de
la vitesse moyenne du sang au niveau de l’artère cérébrale moyenne (barres blanches) (Seifert et Secher, 2011).
4. Apport et utilisation musculaire et cérébrale d’O
2et limitation de
l’exercice
4.1. Limitation du transport d’O
2Etant donné que les quatre étapes du transport d’O2 (ventilation, diffusion pulmonaire,
perfusion et diffusion tissulaire) sont reliées en série les unes aux autres, elles fonctionnent comme un système intégré. Cela implique que chaque étape a le potentiel d’affecter le « comportement quantitatif » de l’ensemble du système de transport d’O2 (Wagner, 1996). Par
conséquent, il n’y aurait pas de facteur limitant unique pour le transport maximal d’O2. De
plus, « l’amélioration » d’une ou plusieurs étapes a relativement peu d’effet sur le débit global d’O2, cependant, une réduction de la fonction d’une étape présente un potentiel considérable
Figure 8 : sensibilité de O2max à chacun des composants du système de transport d’O2. Cette courbe représente la valeur de O2max atteinte en fonction d’un changement (en % par
rapport à la normale) de chacune des étapes du transport d’O2. La valeur maximale de cette
O2max théorique étant atteinte lorsque la capacité mitochondriale maximale de consommation
d’O2 est atteinte (= 4 l.min-1) (Wagner, 2008).
Les changements dans le transport systémique d’O2 affectent la performance
musculaire et la vitesse de développement de la fatigue à la fois au niveau central et périphérique. Une baisse de l’apport d’O2 accélère l’apparition de la fatigue, alors qu’une
augmentation de l’apport d’O2 améliore la tolérance à l’exercice. Toutefois, les mécanismes
par lesquels les changements dans le transport d’O2 limitent l’exercice sont complexes
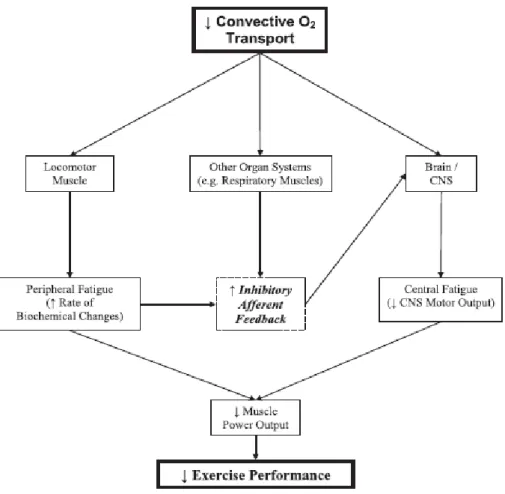
(Amann et Calbet, 2008). Ces auteurs ont conclu que le développement de la fatigue serait lié à l’accumulation de sous-produits métaboliques due à la réduction de l’apport d’O2 au niveau
périphérique (c'est-à-dire au niveau musculaire). Toutefois, ils ont suggéré que la fatigue pourrait avoir une origine centrale liée à un effet direct de l’apport d’O2 au niveau cérébral ou
Figure 9 : schéma hypothétique reliant le transport d’O2 et ses effets sur la fatigue et la
performance lors de l’exercice (Amann et Calbet, 2008).
4.2. Limitation de l’exercice et oxygénation cérébrale et musculaire
La fatigue (ou l’épuisement) est un phénomène complexe impliquant des facteurs limitant la capacité à maintenir la contraction musculaire ou un niveau donné de production de force (Vollestad et al., 1988). Bien que la décision de mettre fin à l’exercice soit prise par le cerveau (Kayser, 2003), il est évident que la fatigue périphérique, décrite comme une perturbation de la capacité de génération de force d’un muscle, contribue au développement de la fatigue globale (Fitts, 1994). Si la fatigue centrale se réfère à tous les processus impliqués dans l’activation des motoneurones qui peuvent être modulés au niveau de la moelle et/ou au niveau supraspinal (Gandevia, 2001), le système nerveux central semble être fortement influencé par les événements qui se déroulent dans les muscles pendant l’effort (Amann et al., 2008).
Lors de l’exercice maximal mobilisant une grande masse musculaire, le débit cardiaque devient un facteur limitant (Mortensen et al., 2008) et pourrait affecter non seulement la circulation sanguine et l’oxygénation des muscles actifs, mais aussi la perfusion et l’oxygénation cérébrale (Seifert et al., 2009).
4.2.1.
Limitation de l’exercice et oxygénation cérébrale
Lors de l’exercice aérobie d’intensité élevée, l’oxygénation cérébrale réduite résulte de l’apport d’O2 insuffisant au cerveau (Rasmussen et al., 2007). Cette baisse de l’apport d’O2 au
niveau cérébral serait due à la baisse de la PaCO2 induite par l’hyperventilation (Hellstrom et
al., 1996) et pourrait être impliquée dans la limitation de l’exercice.
L’oxygénation cérébrale a été mesurée en utilisant la NIRS au niveau du cortex préfrontal ou des aires corticales motrices à différentes intensités d’exercice (Bhambhani et
al., 2007 ; Gonzalez-Alonso et al., 2004 ; Ide et al., 1999 ; Nielsen et al., 1999 ; Oussaidene et al., 2013 ; Rupp et Perrey, 2008 ; Shibuya et al., 2004 ; Subudhi et al., 2007). La plupart des
études ont montré une diminution significative de l’oxygénation cérébrale à l’approche de l’épuisement. Ces auteurs ont conclu que la diminution de l’activation corticale a eu lieu en concomitance avec une déficience de la fonction musculaire et contribue progressivement à la fatigue centrale avant l’épuisement (Sogaard et al., 2006). De plus, certains auteurs ont suggéré que l’oxygénation cérébrale était plus susceptible de contribuer à limitation de l’exercice que l’oxygénation musculaire (Nielsen et al., 1999). Par ailleurs, bien que Rooks et al. (Rooks et al., 2010) aient suggéré que l’entraînement pourrait influencer l’oxygénation cérébrale pendant l’exercice, les mêmes conclusions sur le lien entre oxygénation cérébrale et fatigue ont été tirées chez les sujets entraînés à l’endurance (Nielsen et al., 1999) et chez les sujets non entraînés (Oussaidene et al., 2013).
peak (Subudhi et al., 2008) et le temps de maintien (temps auquel l’épuisement
survenait) (Amann et al., 2007 ; Kayser et al., 1994) en hypoxie ont été rapidement améliorées par l’administration d’O2 juste avant l’apparition de la fatigue. Ces auteurs ont
conclu que cette amélioration serait due à une augmentation de l’apport d’O2 au cerveau car
ces changements sont trop rapides pour inverser l’accumulation ou l’épuisement des métabolites associés à la fatigue musculaire. D’autre part, l’hyperoxie modérée décale le seuil de diminution de l’oxygénation cérébrale lors de l’exercice progressif sans avoir d’effet sur le profil de l’oxygénation musculaire, ce décalage étant lié à l’augmentation de performance en hyperoxie (Oussaidene et al., 2013). Ces résultats soutiennent l’hypothèse d’un rôle de l’oxygénation cérébrale comme un mécanisme impliqué dans la limitation de la performance. Toutefois, l’augmentation de Céréb sans élévation concomitante de M (par la respiration de
CO2) n’améliore pas la performance lors de l’exercice progressif maximal, suggérant que
l’apport d’O2 au niveau cérébral ne serait pas le principal facteur limitant de l’exercice
(Subudhi et al., 2011).
4.2.2.
Limitation de l’exercice et oxygénation musculaire
La fatigue musculaire est définie comme une perte transitoire de la capacité du muscle à générer de la force. Cette fatigue musculaire se développait lors des contractions suffisamment intenses et/ou prolongées (Enoka et Duchateau, 2008 ; Gandevia, 2001). Un facteur important en rapport avec les mécanismes de la fatigue musculaire pendant l’exercice est la capacité d’apport et d’utilisation d’O2 au niveau musculaire. En d’autres termes, O2M
insuffisant et/ou O2M insuffisante peuvent influencer la capacité des muscles à résister à la
fatigue (Hogan et al., 1994 ; Katayama et al., 2007).
Lors de l’exercice impliquant une grande masse musculaire, plusieurs études ont montré que l’oxygénation musculaire diminuait progressivement avec l’augmentation de l’intensité ou la durée de l’exercice, atteignant un minimum ou un plateau vers la fin de l’exercice incrémental (> 90% de peak) (Boone et al., 2010 ; Ferreira et al., 2007 ; Legrand
et al., 2007 ; Racinais et al., 2014 ; Subudhi et al., 2007) ou vers la troisième minute
d’exercice lors de l’exercice à charge constante d’intensité élevée (> 80% de peak)
(Keramidas et al., 2011 ; Turner et al., 2013). Bien que ce plateau a été interprété comme une preuve de l’extraction maximale d’O2 (Esaki et al., 2005 ; Shibuya et al., 2004 ; Wilson et al.,
rôle important dans l’épuisement. En effet, les sujets ont pu continuer l’exercice à des intensités plus élevées après l’apparition du plateau de l’oxygénation musculaire, et par conséquent, l’hypothèse d’une implication de l’oxygénation cérébrale demeure plausible (voir section précédente).
Toutefois, aucune désaturation du tissu cérébral n’a été observée au cours de l’exercice d’extension de genou qui implique de fait une petite masse musculaire (Gomes et al., 2013 ; Matsuura et al., 2011 ; Pereira et al., 2007). Dans le même temps, O2Hb et tHb étaient
compromis au niveau musculaire (Gomes et al., 2013 ; Matsuura et al., 2011). Ces résultats suggèrent que la fatigue des membres inférieurs serait d’origine périphérique et s’expliquerait en partie par la réduction de la disponibilité d’O2 au niveau musculaire due à une réduction de
O2M (Place et al., 2009). D’autre part, le développement de la fatigue musculaire lors de
contractions isométriques intermittentes de flexion du coude à 60% de la contraction maximale volontaire était accompagné d’une augmentation de tHb et O2Hb au niveau cérébral
et d’une stabilisation de tHb et O2Hb au niveau musculaire (Bhambhani et al., 2014). Ces
auteurs ont suggéré que la fatigue musculaire à cette intensité d’exercice est due en partie à la réduction de la disponibilité d’O2 au niveau périphérique plutôt qu’à une diminution de
l’activation neuronale centrale.
Il semble donc que le rôle de l’oxygénation musculaire dans la limitation de l’exercice serait limité à l’exercice très local mobilisant une petite masse musculaire et que la disponibilité et l’utilisation d’O2 au niveau musculaire, lors de l’exercice mobilisant une
grande masse musculaire, ne serait pas impliqué dans la limitation de l’exercice. Toutefois, ces conclusions sont à prendre avec précaution. En effet, le rôle de la fatigue périphérique dans la limitation de l’exercice mobilisant une petite masse musculaire a été mise en doute (Neyroud et al., 2012). De plus, une implication de la disponibilité et de l’utilisation musculaire d’O2 dans la limitation de l’exercice du corps entier est loin d’être écarté (Subudhi
II. La cadence de pédalage
Dans un objectif d’optimisation de la performance qui génère un compromis entre la force appliquée sur la pédale et la cadence de pédalage, des nombreuses études se sont intéressées à l’identification des facteurs contribuant à modifier les réponses adaptatives de l’athlète au cours d’un exercice de cyclisme. La cadence de pédalage est l’un des paramètres de la performance sportive souvent étudié dans la littérature (Chavarren et Calbet, 1999 ; Coast et Welch, 1985 ; Ferreira et al., 2006 ; Gaesser et Brooks, 1975 ; Gotshall et al., 1996 ; Kounalakis et Geladas, 2012 ; Sacchetti et al., 2010 ; Zoladz et al., 2002). La majorité de ces études ont montré que la cadence de pédalage influence les réponses à l’exercice aussi bien au niveau métabolique qu’au niveau de la performance ou du recrutement musculaire. Dans cette partie nous allons présenter les effets de la cadence de pédalage sur ces paramètres.
1.
Effet de la cadence de pédalage sur la performance
L’augmentation de la cadence de pédalage a été souvent associée à un développement plus rapide de la fatigue se traduisant par une baisse de la tolérance à l’exercice et donc une baisse de la performance. Ces observations ont été généralement attribuées en grande partie à une baisse de l’efficacité à des cadences élevées, qui serait due à une augmentation du travail interne (Coast et Welch, 1985 ; Gaesser et Brooks, 1975 ; Nesi et al., 2004 ; Nielsen et al., 2004 ; Tokui et Hirakoba, 2008). Une récente étude a montré que l’augmentation de la fatigue associée à l’augmentation de la cadence de pédalage est liée à la fréquence de la contraction musculaire plutôt qu’à la vitesse de la pédale (Tomas et al., 2010). En effet, selon ces auteurs, le temps disponible pour l’excitation du muscle et la cinétique de relaxation est un contributeur majeur à la fatigue suggérant que les changements dans la libération du calcium et le pompage du calcium par le reticulum sarcoplasmique sont les mécanismes impliqués dans la survenue de la fatigue.
L’effet de la cadence de pédalage sur la performance est lié à la modalité et à l’intensité de l’exercice. En effet, la nature de l’exercice (progressif ou à charge constante)
peut influencer les effets de la cadence de pédalage sur la performance. Cela est dû sans doute à l’intensité et à ses variations. En effet, le recrutement musculaire varie avec l’intensité de l’exercice (donc au cours d’un exercice progressif) et au cours du temps lors d’un exercice suffisamment intense due aux différences de l’amplitude de la composante lente de O2.
D’autre part, le recrutement musculaire varie entre les muscles impliqués dans le pédalage mais aussi au sein des mêmes muscles avec la cadence de pédalage.
1.1.
Lors d’un exercice incrémental
Une relation parabolique entre la performance et la cadence de pédalage a été observée chez des cyclistes, la meilleure performance se produisant pour une cadence de 80 rpm. En effet, lors de l’exercice incrémental, O2max et max étaient significativement supérieures à 80
rpm comparativement à 40, 60, 100 et 120 rpm (Coast et Welch, 1985). Dans le même contexte, Foss et Hallen (Foss et Hallen, 2004) ont comparé la performance chez des cyclistes professionnels lors d’un exercice incrémental réalisé à différentes cadences et mené jusqu’à l’épuisement (durée 4-7 minutes). L’exercice commençait à une puissance individuelle légèrement supérieure à la puissance correspondant à leur MLSS (300-350 W), ensuite la puissance était augmentée de 25 W toutes les trente secondes jusqu’à une puissance pour laquelle les sujets estimaient leur épuisement imminent (1,5-2 minutes). Dès lors, la puissance (425-525 W) a été maintenu constante jusqu’à l’épuisement. Ces auteurs ont observé que la performance de tous les sujets était supérieure à 80 rpm et que le temps de maintien était plus court de 14, 8 et 25% à 60, 100 et 120 rpm, respectivement (Figure 10).
Figure 10 : temps jusqu’à épuisement à 60, 80, 100 et 120 rpm au cours de l’exercice incrémental. Moyenne ± SD (n = 6) ; la puissance était la même pour toutes les cadences,
mais différente entre les sujets ; *, P < 0,05, différence significative entre les cadences (Foss et Hallen, 2004).
Toutefois, chez des sujets non entraînés à l’endurance, la cadence de pédalage n’a pas modifié peak lors d’un exercice incrémental même si, dans le même temps, O2peak était
supérieure à 100 rpm comparativement à 60 rpm (Ferreira et al., 2006).
1.2.
Lors d’un exercice à charge constante
1.2.1.
Exercice d’intensité modérée
Étrangement, l’effet de la cadence de pédalage sur la performance a rarement été étudié au cours de l’exercice prolongé (> 10 minutes). Chez les cyclistes professionnels, la meilleure performance était obtenue pour la cadence la plus efficace (80 rpm) lors d’exercices



![Figure 17 : évolution de O 2 et [HHb] pendant l’exercice progressif (à gauche) et à 20 W (BSL), au seuil lactique (LT) et à O 2peak (à droite) à 60 et 100 rpm](https://thumb-eu.123doks.com/thumbv2/123doknet/15050736.694906/57.892.192.754.109.547/figure-évolution-exercice-progressif-gauche-seuil-lactique-droite.webp)