HAL Id: tel-02967468
https://hal-unc.archives-ouvertes.fr/tel-02967468
Submitted on 15 Oct 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Étude phytochimique et pharmacologique de plantes de
Nouvelle-Calédonie à potentialités anti-dengue
Paul Coulerie
To cite this version:
Paul Coulerie. Étude phytochimique et pharmacologique de plantes de Nouvelle-Calédonie à potential-ités anti-dengue. Chimie thérapeutique. Université de la Nouvelle-Calédonie, 2012. Français. �NNT : 2012NCAL0038�. �tel-02967468�
UNIVERSITÉ DE LA NOUVELLE-CALÉDONIE
ÉCOLE DOCTORALE DU PACIFIQUE, ED 469
Thèse présentée pour l’obtention du grade de
DOCTEUR EN CHIMIE DES SUBSTANCES NATURELLES
par
M. Paul COULERIE
Étude phytochimique et pharmacologique
de plantes de Nouvelle-Calédonie à
potentialités anti-dengue
Soutenue le 25 avril 2012 devant un jury composé de :
Madame G. Dijoux-Franca
Professeur, Faculté de pharmacie,
Université Lyon 1
Rapporteur
Madame P. Raharivelomanana
Professeur, Université de la Polynésie
Française
Rapporteur
Madame M. Dupont-Rouzeyrol
Docteur, Institut Pasteur de
Nouvelle-Calédonie
Examinateur
Monsieur Y. Asakawa
Professeur, Faculty of pharmaceutical
sciences, Tokushima, Japon
Examinateur
Monsieur B. Figadère
Docteur, Faculté de pharmacie,
Université Paris-Sud XI
Examinateur
Monsieur M. Nour
Professeur, Université de la
Nouvelle-Calédonie
Examinateur
Monsieur E. Hnawia
Docteur, Université de la
Nouvelle-Calédonie
Examinateur
Monsieur N. Lebouvier
Docteur, Université de la
Nouvelle-Calédonie
Examinateur
Résumé
La flore de Nouvelle-Calédonie, de part sa richesse et son originalité, est une source potentielle de nouveaux médicaments. En portant une attention particulière aux plantes de la médecine traditionnelle, 48 plantes ont été récoltées et 91 extraits bruts testés pour différentes activités biologiques. 10 plantes nous ont fourni des extraits inhibant la croissance de microorganismes pathogènes de l’homme et 15 plantes sont à l’origine d’extraits cytotoxiques. Ces plantes pourraient respectivement renfermer de nouveaux antibiotiques et anticancéreux. 17 plantes présentent de fortes potentialités pour la recherche de composés antiviraux, actifs contre le virus de la dengue.
Le virus de la dengue (DV), contre lequel il n’existe aucun traitement aujourd’hui, touche plus de 50 millions de personnes chaque année. Afin de trouver des inhibiteurs de ce virus nous avons ciblé la protéine DV-NS5, une enzyme essentielle à la réplication et spécifique du DV. Le fractionnement bioguidé des extraits actifs de trois plantes (Myrtopsis corymbosa Guill., Dacrydium balansae Brongn. & Gris., et Carpolepis laurifolia J.W. Dawson) nous a alors permis d’isoler divers composés appartenant aux familles des alcaloïdes, coumarines, flavonoïdes, stérols et terpènes. Parmi ceux-ci, les flavonoïdes sont les plus puissants inhibiteurs de la DV-NS5 : Certains biflavonoïdes, tels que la podocarpusflavone A (40), ont ainsi montré une concentration inhibant 50% de l’activité de la polymérase virale (CI50)
inférieure à 1 µM, sans montrer de cytotoxicité. L’activité de ces composés devra désormais être évaluée contre des cellules infectées par le virus de la dengue.
Remerciements
Ce travail a été réalisé au Laboratoire Insulaire du Vivant et de l’Environnement de l’Université de la Nouvelle-Calédonie (LIVE-UNC), sous la direction de M. Nour et la codirection d’E. Hnawia que je remercie de m’avoir accepté dans leur équipe et permis de réaliser cette thèse. Je remercie également le gouvernement de la Nouvelle-Calédonie pour m’avoir accordé une bourse de recherche pour effectuer ces travaux.
Je tiens à remercier chacun des membres du jury, Madame G. Dijoux-Franca, Madame P. Raharivelomanana, Madame M. Dupont-Rouzeyrol, Monsieur Y. Asakawa et Monsieur B. Figadère de me faire bénéficier de leur expertise en acceptant de juger ce travail et de consacrer du temps à l’examen de ce manuscrit.
Je remercie aussi l’ensemble de l’équipe du LIVE et particulièrement A. Hamir son directeur, B. Fogliani, N Lebouvier et S. Mengant. Le laboratoire de chimie des substances naturelles du LIVE étant hébergé dans les locaux du centre IRD de Nouméa, notre travail a bénéficié de nombreuses collaborations. A ce titre je tiens à remercier tout le personnel de l’IRD et notamment V. Guillemard, A. Vidault et C. Poullain pour toute l’aide technique fournie. Merci aussi aux thésards du LIVE et de l’IRD de Nouméa pour les bons et mauvais moments sincèrement partagés.
Les études phytochimiques ont été réalisées en partie au sein du laboratoire BioCIS de la faculté de pharmacie de l’université Paris-Sud. Je remercie B. Figadère de
m’avoir accueilli à deux reprises au sein de son laboratoire. Je remercie très chaleureusement K. Leblanc, A. Berton, A. Maciuk, B. Akagah, A. Lormier, mais aussi ceux du 4ème et notamment B. Seon-Meniel, P. Champi, E. Poupon, G. Lewin, F. Roblot,
C. Fourneau, et toute l’équipe des thésards parisiens. Je remercie aussi J-C Jullian, C. Troufflard et E. Morvant du service RMN, et A. Solgadi du SAMM.
L’évaluation biologique contre la dengue est le fruit d’une collaboration active avec le laboratoire AFMB de l’Université Aix-Marseille. Pour cela je remercie C. Eydoux, J-C. Guillemot et B. Cannard.
La mise en plaque des extraits pour la préparation du criblage biologique, ainsi que les tests de cytotoxicité ont été réalisés à l’ICSN de Gif sur Yvette. Je remercie pour cela, F. Guéritte, M. Litaudon et V. Dumontet.
Les plantes récoltées en Nouvelle-Calédonie ont été sélectionnées pour la plupart sur des critères ethnopharmacologiques. Ce travail n’aurait pas été possible sans la collaboration de P. Cabalion, que je remercie pour avoir partagé une partie de son savoir avec moi. Je souhaite aussi remercier tout le personnel de l’herbier du centre IRD de Nouméa d’avoir accepté de conserver un échantillon de référence des plantes récoltées pour nos travaux. Je remercie également J. Munzinger pour toute l’aide apportée en matière de botanique.
Je remercie ma famille et mes proches pour leur soutien pendant ces trois années. Et, à toutes celles et ceux que j’ai malencontreusement oubliés, j’adresse mes plus plates excuses et vous remercie également.
Table des matières
Résumé ... .
Remerciements ... 1
Table des matières ... 3
Liste des figures ... 11
Liste des tableaux... 15
Liste des abréviations ... 17
Introduction générale ... 21
Première partie : Généralités & contexte de l’étude ... 20
1.
Le virus de la dengue (DV) ... 25
1.1.
Vecteurs de la maladie... 26
1.2.
Symptomatologie et pathogénèse ... 27
1.2.1.
Symptômes classiques de la dengue... 27
1.2.2.
Formes graves de la dengue ... 28
1.2.3.
Nouvelle classification des symptômes ... 30
1.3.
Epidémiologie ... 31
1.4.
Notions de virologie et d’enzymologie appliquées au DV ... 34
1.4.1.
Réplication du DV dans les cellules de l’hôte ... 34
1.4.2.
NS3 et NS5 : deux enzymes clés dans la réplication de l’ARN du DV ... 37
2.
Stratégies de lutte contre le DV ... 40
2.1.
Moyens disponibles ... 40
2.2.
Nouvelle stratégie de lutte anti-vectorielle ... 40
2.3.
Recherche d’un vaccin ... 42
2.4.
Recherche d’antiviraux ... 44
3.
La nature comme source de nouveaux composés bioactifs ... 48
3.1.
Naissance, apogée, déclin et renaissance de la pharmacognosie ... 49
3.1.1.
La « pré-histoire » de la pharmacognosie ... 49
3.1.2.
Les grandes étapes de l’histoire de la pharmacognosie ... 51
3.1.3.
Quel avenir pour la pharmacognosie ? ... 52
3.2.
Spécificités des composés bioactifs d’origine naturelle ... 53
3.3.
Le choix des plantes pour la recherche de composés bioactifs ... 54
3.4.
Le criblage aléatoire ... 55
3.5.
La chimiotaxonomie ... 56
3.6.
L’ethnopharmacologie ... 57
3.6.1.
Historique ... 58
3.6.2.
Difficultés d’interprétation des informations de la médecine traditionnelle .. 59
3.6.3.
Enjeux modernes de l’ethnopharmacologie... 60
3.7.
Valorisation et sauvegarde de la biodiversité ... 61
4.
La Nouvelle-Calédonie : notre terrain d’étude ... 63
4.1.
Situation géographique de la Nouvelle-Calédonie ... 63
4.2.
Biotopes et biodiversités calédoniens... 66
4.2.1.
La forêt sèche ... 66
4.2.2.
La forêt humide ... 68
4.2.3.
Le maquis minier ... 69
4.2.4.
Le littoral Calédonien ... 69
Seconde partie : Sélection des plantes & criblage des extraits bruts ... 72
Introduction ... 73
1.
Sélection des plantes... 73
1.1.
Sélection des plantes fébrifuges de la médecine traditionnelle ... 74
1.1.1.
Concepts traditionnels et modernes de la médecine ... 74
1.1.2.
Sélection des plantes fébrifuges ... 76
1.2.
Sélection des plantes sur des critères chimiotaxonomiques ... 77
2.
Récolte des espèces sélectionnées ... 79
3.
Préparation des extraits bruts ... 83
4.
Criblage biologique des extraits bruts ... 83
4.1.
Evaluation des potentialités antidengue ... 84
4.2.
Evaluation de l’activité antibiotique contre quatre microorganismes ... 86
4.3.
Evaluation de la cytotoxicité contre deux souches cellulaires humaines ... 88
4.4.
Criblage phytochimique des plantes d’intérêt ... 91
Conclusions et discussion ... 95
Troisième partie : Alcaloïdes & coumarines de Myrtopsis corymbosa ... 102
Introduction ... 103
1.
Notions de botanique du genre Myrtopsis ... 103
1.1.
La famille des Rutaceae ... 104
1.2.
Le Genre Myrtopsis ... 105
2.
Chimiotaxonomie des Rutaceae ... 106
2.1.
Huile essentielle ... 106
2.2.
Alcaloïdes, flavonoïdes, coumarines et limonoïdes ... 107
2.3.
Travaux précédent sur le genre Myrtopsis ... 108
3.
Comparaison de la composition chimique et de l’activité biologique de trois Myrtopsis
spp. 110
3.1.
Criblage phytochimique ... 110
3.2.
Tests biologiques préliminaires ... 111
3.3.
La famille des coumarines responsable de l’activité ... 113
4.
Fractionnement bioguidé de l’extrait DCM des écorces de M. corymbosa ... 115
5.
Isolement et évaluation biologique des coumarines majoritaires de M. corymbosa .. 116
5.1.
Composition de l’extrait DCM ... 116
5.2.
Détermination structurale du composé 23 ... 120
5.3.
Détermination structurale des composés 24 et 25 ... 122
5.4.
Une coumarine non isolée ... 124
5.5.
Activité des coumarines isolées contre la DV-NS5 RdRp ... 125
6.
Isolement et évaluation biologique des alcaloïdes majoritaires de M. corymbosa .... 126
6.1.
Détermination structurale du composé 26 ... 127
6.2.
Détermination structurale du composé 27 ... 128
6.3.
Détermination structurale du composé 28 ... 129
6.4.
Activité des alcaloïdes isolés contre la DV-NS5 RdRp ... 131
7.
Comparaison de la composition en alcaloïdes des feuilles et des écorces de M.
corymbosa ... 132
Conclusion ... 133
Quatrième partie : Biflavonoïdes des Dacrydium spp. ... 135
Introduction ... 136
1.
Notions de botanique du genre Dacrydium ... 137
2.
Chimiotaxonomie ... 139
2.1.
Huile essentielle ... 139
2.2.
Diterpènes oxygénés... 141
2.3.
Etude des flavonoïdes ... 142
3.
Isolement des principes actifs de D. balansae ... 143
3.1.
Fractionnement bioguidé de l’extrait des feuilles de D. balansae ... 143
3.3.
Fractionnement de la partie ACN ... 144
3.4.
Fractionnement de la partie hexanique ... 145
4.
Analyse structurale des biflavonoïdes 39, 40 et 41 ... 145
4.1.
Détermination structurale du composé 39 ... 147
4.2.
Détermination structurale des composés 40 et 41 ... 148
5.
Analyse structurale des phénols 42 et 43 ... 152
5.1.
Analyse des spectres UV et MS ... 152
5.2.
Détermination structurale du composé 42 ... 152
5.3.
Détermination structurale du composé 43 ... 153
6.
Analyse structurale des stérols 44, 45 et 46 ... 156
6.1.
Analyse des spectres UV et MS ... 156
6.2.
Détermination structurale du composé 44 ... 157
6.3.
Détermination structurale du composé 45 ... 158
6.4.
Détermination structurale du composé 46 ... 158
7.
Activité biologique des composés isolés ... 161
7.1.
Potentialités antivirales ... 161
7.1.1.
Activité contre la DV-NS5 ... 161
7.1.2.
Activité contre d’autres polymérases virales ... 161
7.1.3.
Inhibition de l’activité de la DV-NS5 dans deux réplicons ... 163
7.2.
Cytotoxicité ... 164
8.
Etude des biflavonoïdes des feuilles de D. araucarioides ... 166
8.1.
Détermination structurale des biflavones isolées de D. araucarioides ... 167
9.
Etude des relations structure-activité des biflavonoïdes contre la DV-NS5 RdRp .... 171
9.1.
Comparaison de l’activité biologique de quatre biflavonoïdes simples ... 172
9.2.
Modulation de l’activité contre la DV-NS5 RdRp par les groupements méthyls sur
l’amentoflavone ... 173
9.3.
Etude SAR de dérivés de l’apigénine sur la DV-NS5 RdRp ... 174
Conclusion et discussion ... 180
Cinquième partie : Flavonoïdes de Carpolepis laurifolia ... 182
Introduction ... 183
1.
Description botanique ... 183
2.
Chimiotaxonomie ... 186
2.1.
Huile essentielle ... 186
2.2.
Flavonoïdes ... 187
3.
Rappel des résultats préliminaires ... 189
3.1.
Activités biologiques des feuilles de C. laurifolia ... 189
3.2.
Les flavonoïdes révélés par le criblage phytochimique ... 190
4.
Fractionnement bioguidé d’un extrait des feuilles de C. laurifolia ... 190
4.1.
Extrait total des flavonoïdes ... 190
4.2.
Séparation liquide/liquide de l’extrait méthanolique ... 191
4.3.
Fractionnement bioguidé de B.2 ... 191
5.
Analyse structurale des principes actifs de C. laurifolia ... 193
5.1.
Détermination structurale des composés 65 et 77 ... 194
5.2.
Analyse structurale des composés 78 et 79 ... 195
5.2.1.
Détermination structurale du composé 78 ... 196
5.2.2.
Détermination structurale du composé 79 ... 198
5.3.
Détermination structurale du composé 80 ... 200
5.4.
Détermination structurale du composé 81 ... 203
6.
Activité biologique des flavonoïdes contre la DV-NS5 ... 206
6.1.
Potentiel antidengue des composés isolés de C. laurifolia ... 206
6.1.1.
Inhibition de la DV-NS5 par deux flavonoïdes non glycosylées (65 et 82) . 206
6.1.2.
Inhibition de la DV-NS5 par trois flavonols glycosylés (77, 78 et 79) ... 207
6.2.
Autres flavonols glycosylés testés contre la DV-NS5 RdRp ... 209
Conclusion et Discussion ... 210
Partie expérimentale ... 212
1.
Récoltes des plantes sélectionnées ... 213
2.
Préparation des extraits bruts ... 217
3.
Tests biologiques ... 218
3.1.
Test enzymatique contre la DV-NS5... 218
3.1.1.
Production et purification de l’enzyme ... 218
3.1.2.
Mesure de l’activité d’inhibition de la DV2 NS5 ... 219
3.1.3.
Test contre un réplicon ... 222
3.2.
Inhibition de l’ARN polymérase d’autres virus ... 223
3.3.
Mesure de cytotoxicité ... 223
3.3.1.
Evaluation de la cytotoxicité contre les cellules KB et MRC5 ... 223
3.3.2.
Evaluation de la cytotoxicité contre les cellules COS et BHK ... 225
3.4.
Tests antibiotiques ... 225
4.
Chimie analytique ... 227
4.1.
Criblage phytochimique ... 227
4.2.
Recherche des principes actifs ... 229
4.2.1.
Préparation des extraits... 229
4.2.2.
Extraction totale des coumarines ... 229
4.2.3.
Extraction totale des alcaloïdes ... 230
4.2.4.
Extraction totale des flavonoïdes ... 230
4.3.
Fractionnement bioguidé ... 231
4.3.1.
Matériel utilisé ... 231
4.3.2.
Méthodes employées ... 233
5.1.
Matériel utilisé ... 234
5.1.1.
Chromatographie ... 234
5.1.2.
Méthodes employées ... 235
5.2.
Spectrométrie et spectroscopie ... 235
5.2.1.
Spectrométrie de masse à haute résolution (HRMS) ... 235
5.2.2.
Résonnance magnétique nucléaire (RMN) ... 236
6.
Composés commerciaux et hémi-synthétiques ... 236
6.1.
Composés commerciaux ... 237
6.2.
Composés hémi-synthétiques... 237
Conclusion générale ... 238
Bibliographie ... 245
Liste des figures
Figure 1. Arbre phylogénétique des Flavivirus d’après la séquence codant pour la protéine
NS5 de ces virus ... 25
Figure 2. Nouvelle classification proposée par l’OMS des symptômes de la dengue ... 30
Figure 3. Nombre de cas de dengue recensés par l’OMS depuis 1955. ... 32
Figure 4. Population mondiale exposée au DV selon les estimations de l’OMS en 2010 ... 32
Figure 5. Cycle de réplication du DV dans la cellule hôte ... 35
Figure 6. Structure 3D de la DV-NS5-RdRp ... 38
Figure 7. Principaux composés antiviraux non-nucléosidiques décrits contre le DV. ... 47
Figure 8. A : Extrait du Papyrus de Ebers. B : la mandragore dans une reproduction du
manuscrit de Dioscoride datée VII
èmesiècle. ... 50
Figure 9. Portrait de F.W.A. Serturner (1783-1841) à gauche et de F.A. Kékulé (1829-1896) à
droite. ... 52
Figure 10. Structure chimique de la vinblastine (5) et de la vincristine (6) isolées à partir de
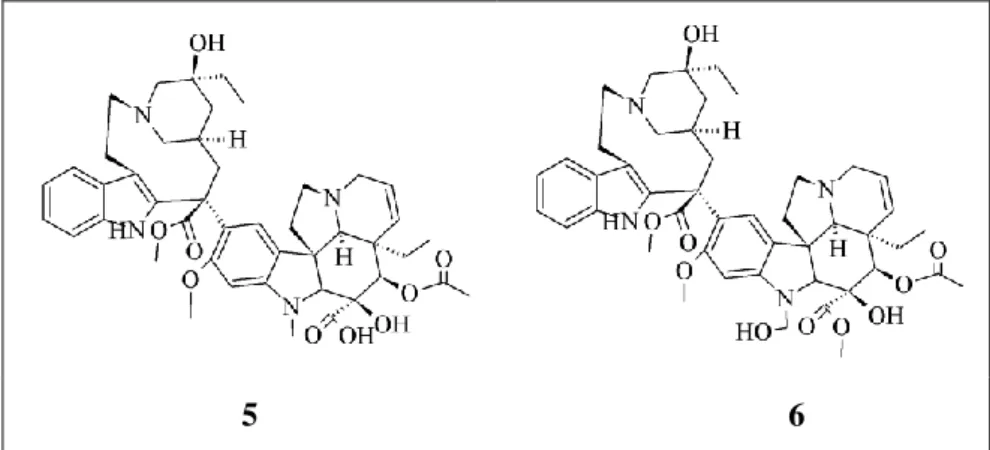
Catharanthus roseus. ... 55
Figure 11. Situation géographique de la Nouvelle-Calédonie... 64
Figure 12. Exemples de plantes hyper-accumulatrices de nickel : Pycnandra acuminata (arbre
à sève bleue) à gauche et Psychotria douarrei, à droite ... 65
Figure 13. Variété des écosystèmes calédoniens. ... 67
Figure 14. Photo du maquis minier dégradé par les mines et les incendies dans la région de la
coulée. ... 71
Figure 15. Carte de la Nouvelle-Calédonie représentant les différents biotopes et les lieux de
récolte des différentes plantes criblées au cours de cette étude ... 82
Figure 16. Exemples de diterpénoïdes isolés à partir de E. agalocha. ... 100
Figure 17. Photographies des différentes espèces de Myrtopsis récoltées pour notre étude. . 105
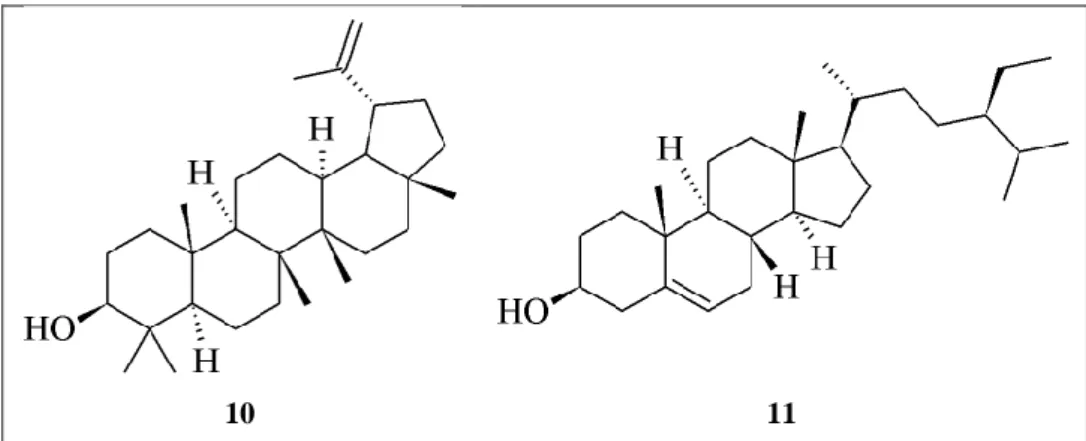
Figure 18. Stérol et triterpène décrits dans le genre Myrtopsis. ... 108
Figure 19. Coumarines décrites dans le genre Myrtopsis... 109
Figure 20. Alcaloïdes décrits dans le genre Myrtopsis.. ... 110
Figure 21. Schéma du fractionnement bioguidé de l’extrait DCM de l’écorce de M.
corymbosa... 115
Figure 22. Chromatogramme HPLC-UV/MS de l’extrait DCM des écorces de M. corymbosa à
330 nm. ... 117
Figure 23. Spectre UV des coumarines identifiées dans l’extrait DCM de M. corymbosa (A)
comparé au spectre UV de la 5,7-dihydroxycoumarine et de la 6,7-dihydroxycoumarine
analysées par Goodwin & Pollock (B). ... 118
Figure 24. Spectres de masse des coumarines majoritaires de l’extrait DCM de M. corymbosa.
... 119
Figure 25. Stabilisation de la 7-hydroxy-8-diméthylallylcoumarine ([M+H]
+=231) sous la
forme 3’,4’-dihydroséséline. ... 120
Figure 26. Schéma récapitulatif des données RMN et MS utilisés pour la détermination
structurale de la ramosine (23). ... 122
Figure 27. Hypothèse concernant la structure d’une quatrième coumarine observée par
HPLC-UV/MS dans l’extrait DCM de M. corymbosa. ... 124
Figure 28. Chromatogramme HPLC-UV/MS de l’extrait alcaloïdique total des feuilles de M.
corymbosa à 254 nm. ... 126
Figure 29. Spectre UV des alcaloïdes identifiés dans les feuilles de M. corymbosa. ... 127
Figure 30. Chromatogramme HPLC-UV/MS de l’extrait alcaloïdique des écorces de M.
corymbosa. ... 132
Figure 31. Schéma de deux alcaloïdes supposés présents dans M. corymbosa : la myrtopsine
(21) et la N-méthylflindersine (29). ... 133
Figure 32. Pourcentage d’inhibition de la DV-NS5 RdRp par les extraits bruts des feuilles et
des écorces de D. araucarioides (Cou 11) et de D. balansae (Cou 14) à 50, 10 and 1 µg/mL.
... 136
Figure 33. Photographies des quatre Dacrydium rencontrés en Nouvelle-Calédonie. ... 138
Figure 34. Structure des terpènes majoritaires dans l’huile essentielle des quatres Dacrydium
calédoniens. ... 140
Figure 35. Exemples de diterpènes oxydés présents chez les Podocarpaceae. ... 142
Figure 36. Séparation liquide-liquide de l’extrait MeOH des feuilles de D. balansae ... 143
Figure 37. Structure générale des composés de la famille des flavones. ... 146
Figure 38. Structure de l’amentoflavone et données RMN obtenues par l’analyse du composé
39
... 147
Figure 39. Structure de la podocarpusflavone A (40) et de l’isoginkgétine (41). ... 149
Figure 40. Structure de la trans-3,5,4’-triméthoxystilbène (42) et de la
cis-3,5,4’-triméthoxystilbène (43). ... 154
Figure 41.Structure du stérol (47). ... 157
Figure 42. Structure de la 6-hydroxystigmast-4-èn-3-one (44), de la
3-hydroxystigmast-5-èn-7-one (45) et du β-Sitostérol (46). ... 159
Figure 43. Structure des dérivés de l’amentoflavone isolés de D. balansae et D. araucarioides
... 168
Figure 44. Structure de l’hinokiflavone (50) et de la robustaflavone (54). ... 168
Figure 45. Concentration inhibant 50% de l’activité de la DV2-NS5 RdRp (µM) de quatre
biapigénines distinguées par la liaison entre les deux monomères. ... 172
Figure 46. Concentration inhibant 50% de l’activité de la DV2-NS5 RdRp (µM) de 8 dérivés
de l’amentoflavone.. ... 174
Figure 47. Pourcentage d’inhibition de la DV-NS5 RdRp par l’apigénine (57) et quatre
dérivés méthylés de l’apigénine ainsi que six flavonoïdes structurellement proches. ... 175
Figure 48. Comparaison de la composition en biflavonoïdes des feuilles de D. araucarioides
(A), D. balansae (B), D. guillauminii (C) et D. lycopodioides (D). ... 177
Figure 49. Structure de la 7,4’,7’’,4’’’-tetramethoxyamentoflavone (68). ... 178
Figure 50. Schéma floral d’une plante à hypanthium et détail de la fleur de C. laurifolia var.
laurifolia. ... 184
Figure 51. Photos des deux variétés de C. laurifolia : var. laurifolia à gauche et var.
demonstrans à droite. ... 185
Figure 52. Exemples de flavonoïdes isolés de M. excelsa. ... 187
Figure 53. Génine des anthocyanines isolés dans les Metrosideros spp. ... 188
Figure 54. Pourcentage d’inhibition de la DV-NS5 RdRp par les extraits des feuilles et des
écorces de C. laurifolia à 50, 10 et 1 µg/mL. ... 189
Figure 55. Schéma du fractionnement bioguidé effectué sur l’extrait FB.2. ... 192
Figure 56. Analyse HPLC-UVMS de la partie B.2 de l’extrait méthanolique des feuilles de C.
laurifolia. ... 194
Figure 57. Schéma de la quercétine (65) et de l’hyperoside (77). ... 195
Figure 58. Spectres UV des composés 78 (λmax= 257, 350) et 79 (λmax= 257, 355). ... 196
Figure 59. Spectres MS des composés 78 et 79. ... 196
Figure 60. Schéma de la structure de l’avicularine (78) et de la quercitrine (79). ... 197
Figure 61. Spectre UV du composé 80. ... 200
Figure 62. Schéma de la 6-C-méthyl-7-O-méthylapigénine (80) montrant les données issues
des analyses RMN... 201
Figure 63. Attribution des signaux observés sur le spectre RMN
1H pour le composé 81 aux
différents protons de l’acide bétulinique par l’analyse des spectres RMN 1D et 2D. ... 204
Figure 64. Schéma de la quercétine (65) et de la 6-méthyl-7-méthoxyapigénine (80) et
pourcentage d’inhibition de la DV-NS5 RdRp de ces composés à 10 µg/mL. ... 206
Figure 65. Schéma de l’hyperoside (77), de l’avicularine (78) et de la quercitrine (79) et
pourcentage d’inhibition de la DV-NS5 RdRp de ces composés à 10 µg/mL. ... 207
Figure 66. Schéma de l’acide bétulinique (81) et pourcentage d’inhibition de la DV-NS5
RdRp de ces composés à 10 µg/mL. ... 208
Figure 67. Structures et inhibition de la DV-NS5 RdRp (%) à 10 µM des dérivés
commerciaux de la quercétine ... 209
Figure 68. Evaporation sous pression réduite et filtration sur gel de polyamide. ... 217
Figure 69. Schéma réactionnel de la méthylation de l’apigénine et de l’amentoflavone. ... 237
Liste des tableaux
Tableau 1. Principales cibles et antiviraux proposés contre la dengue. ... 45
Tableau 2. Pourcentage d’inhibition de la DV2-NS5 RdRp pour les extraits bruts considérés
comme « hits » à 50, 10 et 1 µg/mL. ... 85
Tableau 3. Extraits des différents organes des plantes présentant une activité antimicrobienne
in vitro. ... 87
Tableau 4. Extraits cytotoxiques contre les cellules KB et/ou MRC5. ... 90
Tableau 5. Résultats du criblage phytochimique mené sur les poudres des plantes ayant
montré un fort potentiel antiviral, antimicrobien ou anticancéreu. ... 92
Tableau 6. Analyse statistique des résultats du criblage biologique. ... 96
Tableau 7. Résultats du criblage phytochimique mené sur les trois espèces de Myrtopsis
récoltées. ... 111
Tableau 8. Pourcentage d’inhibition de la DENV-NS5 RdRp à 10 µg/mL par les extraits
AcOEt obtenus à partir de trois espèces de Myrtopsis. ... 112
Tableau 9. Pourcentage d’inhibition de la DV-NS5 RdRp par différents extraits des feuilles et
des écorces de M. corymbosa (Cou 39) à 10 µg/mL. ... 114
Tableau 10. Données RMN obtenues pour les composés 23, 24 et 25 ... 123
Tableau 11. Résultats d’inhibition de la DV2-NS5 RdRp obtenus avec les trois coumarines
isolées à partir des écorces des M. corymbosa. ... 125
Tableau 12. Données RMN
1H et
13C obtenues pour les composés 26, 27 et 28. ... 130
Tableau 13. Pourcentage d’inhibition de la DV2-NS5 RdRp mesuré avec les trois alcaloïdes
isolés à partir des feuilles de M. corymbosa, à 50, 10 et 1 µM. ... 131
Tableau 14. Données HRMS et masse molaire des flavonoïdes (39, 40 et 41) isolés à partir
des feuillest de D. balansae. ... 146
Tableau 15. Données RMN
1H et
13C obtenues pour les biflavonoïdes 39, 40 et 41. ... 151
Tableau 16. Données HRMS et masse molaire des stilbenoïdes (42 et 43) isolés à partir des
feuilles de D. balansae. ... 152
Tableau 17. Données RMN
1H et
13C obtenues pour les composés 42 et 43. ... 155
Tableau 18. Données de spectrométrie de masse (MS) obtenues par l’analyse des composés
44
, 45 et 46. ... 156
Tableau 19. Données RMN
1H et
13C obtenues pour les composés 44, 45 et 46 ... 160
Tableau 20. Activité inhibitrice des composes isolés des feuilles de D. balansae contre la
DV-NS5 et contre d’autre DV-NS5 issus de trios autres Flaviviridæ. ... 163
Tableau 21. Concentration létale pour 50 % (CL
50) des cellules COS et BHK des composés
isolés de D. balansae. ... 164
Tableau 22. Données HRMS et masse molaire des flavonoïdes isolées à partir des feuilles de
D. araucarioides. ... 167
Tableau 23. Données RMN
1H et
13C obtenues pour les dérivés de l’amentoflavone 48, 49, 51,
52
et 53 et pour la perméthylamentoflavone 55. ... 169
Tableau 24. Données RMN
1H et
13C obtenus par l’analyse de l’hinokiflavone (50) et de la
robustaflavone (54). ... 170
Tableau 25. Comparaison des biflavonoïdes dans les quatre espèces de Dacrydium de
Nouvelle-Calédonie. ... 178
Tableau 26. Données RMN
1H et
13C obtenus par l’analyse de la
7,4’,7’’,4’’’-tetramethoxyamentoflavone (68) d. ... 179
Tableau 27. Pourcentage d’inhibition de la DV-NS5 RdRp par les extraits à l’éther de pétrole
(A), au méthanol à 80% (B) et de la partie AcOEt (B.2) à 10, 1 et 0,1 µg/mL. ... 191
Tableau 28. Données RMN
1H et
13C obtenues pour les composés 77 et 78 et 79. ... 199
Tableau 29. Données RMN
1H et
13C obtenues pour le composé 80. ... 202
Tableau 30. Données RMN
1H et
13C obtenues avec le composé 81. ... 205
Tableau 31. Liste et localisation des espèces végétales récoltées pour notre étude. ... 213
Tableau 32. Caractéristiques de différentes souches microbiennes ciblées. ... 226
Tableau 33. Mise en évidence de différents métabolites secondaires d’intérêt
pharmacologique dans les plantes bioactives. ... 228
Tableau 34. Systèmes d’élutions utilisés pour le fractionnement bioguidé des extraits de
plantes sélectionnés. ... 233
Tableau 35. Systèmes d’élutions utilisés pour la réalisation des analyses HPLC-UV/MS des
extraits de plantes sélectionnés. ... 235
Liste des
abréviations
AA : Acide AminéAcOEt : Acétate d’éthyle ACN : Acétonitrile
AFMB : Laboratoire d’étude de
l’Architecture et Fonctionnement des Macromolécules Biologiques
APCI : Ionisation Chimique à Pression Atmosphérique
ARN : Acide Ribo-Nucléique ARNss : ARN simple brin ARNds: ARN double brin ASP: Asparagine
BHK-DV : Réplicon du virus de la dengue dans des cellules BHK
CDCl3 : Chloroforme deutéré
CH : Cyclohexane
CI50 : Concentration Inhibant 50% de
l’activité biologique d’une cible CL50 : Concentration entraînant la mort de
50% de cellules
CCM : Chromatographie sur Couche Mince CNRS : Centre National pour la Recherche
Scientifique
COS-DV : Réplicon du Virus de la Dengue dans des cellules COS
COS-DV EGFP : COS-DV possédant une protéine de fluorescence
COSY : Corrélation spectroscopique 1H-1H
CPS : Communauté du Pacifique Sud DCM : Dichlorométhane
DCS : Syndrome de Choc de la Dengue DH : Dengue hémorragique
DMSO : Diméthylsulfoxide
DMSO-d6 : Diméthylsulfoxide deutéré
DV : Virus de la Dengue
DV-NS5 : Protéine Non-Structurale 5 du DV DV-NS5 RdRp : Domaine ARN polymérase
ARN dépendant de la DV-NS5 DMEM : milieu de culture de Dulbecco
modifié
EIP : Période d’Incubation Extrinsèque Ec : Ecorces
ESI : Ionisation par électrospray Fe : Feuilles Fl : Fleurs Fr : Fruits GTP : Guanosine triphosphate [3H]-GTP : GTP tritié HE : Huile essentielle HEX : Hexane HCl : Acide chloridrique HIS : Histidine
HPLC : Chromatographie Liquide à Haute Performance
HRMS : Spectrométrie de Masse à Haute Résolution
HSQC : Corrélation hétéronucléaire directe HMBC:Corrélation hétéronucléaire à longue
distance
IPNC : Institut Pasteur de Nouvelle-Calédonie
IRD : Institut pour la Recherche et le Développement
JEV : Virus de l’encéphalite Japonaise LIV : Forme atténuée d’un Virus MeOH : Méthanol
MeOD : Méthanol deutéré MH : Mueller-Hinton
Poly(rC) : homopolymère nucléotidique de cytosine MS : Spectrométrie de Masse MSn : Spectrométrie de Masse à n dimensions MTase : Méthyl-Transférase NC : Nouvelle-Calédonie NP : Produit Naturel NTP : Nucléotides
OMS : Organisation Mondiale de la Santé PA : Partie Aérienne
RE : Réticulum endoplasmique
RMN : Résonnance Magnétique Nucléaire Rt : Temps de Rétention
SAMM : Service d’Analyse des Médicaments et Métabolites SAR : Relations Structure/Activité SDS : Sodium dodécylsulfate
TBEV : Virus de l’encéphalite à tique TRP : Tryptophane
UV : Ultra Violet
WNV : Virus du Nil occidental YFV : Virus de la fièvre jaune
Introduction
générale
20
Depuis la nuit des temps l’homme utilise la nature comme source de nourriture et de médicaments. A cet effet, les plantes ont été privilégiées par toutes les civilisations du monde pour développer une pharmacopée traditionnelle en réponse aux maladies qui les touchaient. Depuis les deux derniers siècles environ, l’essor industriel des pays occidentaux a donné naissance à la chimie de synthèse et à la chimie combinatoire qui ont aujourd’hui supplanté la nature pour fournir des médicaments à l’industrie pharmaceutique. Cependant, l’étude des composés d’origine naturelle est toujours porteuse de beaucoup d’espérance pour la recherche de nouveaux médicaments. En effet, depuis quelques décennies, les qualités intrinsèques des produits naturels sont mises en avant (biodisponibilité, biodégradabilité, etc.). La nature produit une grande variété de structures chimiques. Les composés naturels sont souvent, grâce au travail de l’évolution, adaptés à des cibles biologiques spécifiques. Comme nous le verrons, les composés d’origine naturelle se distinguent par de nombreux points des composés de synthèse. Pourtant, le réveil des consciences vis-à-vis de la nature se heurte au développement industriel qui menace un peu plus chaque jour la biodiversité. Le développement industriel et la mondialisation, en bousculant leurs coutumes, déstabilisent aussi de nombreuses sociétés traditionnelles. La rapidité de ces bouleversements engendre une perte importante des savoirs traditionnels. S’appuyant sur la richesse floristique extraordinaire de la Nouvelle-Calédonie et sur les connaissances empiriques des kanaks concernant les plantes médicinales, les recherches entreprises ici participent à leur valorisation et à leur protection. 48 plantes, dont 30 utilisées en médecine traditionnelles ont été récoltées pour notre étude dans les provinces Nord et Sud de la Nouvelle-Calédonie. 91 extraits bruts, préparés à partir des différents organes de ces plantes, ont ensuite été testés contre différentes cibles biologiques pour évaluer leur potentiel antiviral, antibiotique et anticancéreux. Comme nous le verrons, les plantes sélectionnées sur des critères ethnopharmacologiques sont plus souvent21
actives et moins cytotoxiques que les plantes sélectionnées sur des critères chimiotaxonomiques. De plus, l’activité biologique mesurée est en lien direct avec leur utilisation traditionnelle.Notre travail de criblage visait dans un second temps à sélectionner des plantes à fort potentiel antidengue. La dengue est une maladie virale affectant toutes les régions tropicales et subtropicales de la planète et contre laquelle il n’existe aucun vaccin ni aucune thérapie spécifique disponible. Afin de proposer des candidats médicaments contre la dengue, nos travaux ont porté sur la recherche d’inhibiteurs de la réplication du virus de la dengue (DV) dans les cellules humaines en ciblant l’ARN polymérase du virus (la DV-NS5 RdRp). Cette enzyme est absolument essentielle à la réplication de l’ARN viral, spécifique du DV et bien conservée dans les quatre sérotypes du virus. Ce type d’enzyme est par ailleurs absent dans les cellules humaines ce qui limite les possibles effets secondaires d’un médicament élaboré selon ce protocole. Pour toutes ces raisons, la DV-NS5 RdRp est considérée comme une des cibles de choix pour la recherche de nouveaux antiviraux contre le DV. La stratégie mise en place ici a déjà montré de bons résultats par le passé en permettant l’identification d’inhibiteurs des virus tels que le HIV, HBV et HCV1,2
.
Nous nous sommes alors intéressés aux extraits non cytotoxiques ayant démontré une forte inhibition de la DV-NS5 RdRp. Un fractionnement bioguidé fut mené sur trois plantes endémiques de Nouvelle-Calédonie : Myrtopsis corymbosa, une Rutaceae du maquis minier, Dacrydium balansae, une Podocarpaceae récoltée dans la chaîne centrale et Carpolepis laurifolia, une Myrtaceae récoltée en forêt humide. Ces recherches nous ont amené à purifier 29 composés appartenant à diverses familles chimiques : alcaloïdes, coumarines, flavonoïdes, stilbènes, stérols et
22
triterpènes. Les premiers résultats obtenus avec certains composés, notamment des flavonoïdes glycosylés, un triterpène mais surtout avec les biflavonoïdes sont, comme nous le verrons, très encourageants pour le développement d’une thérapie antivirale spécifique du DV.Première partie :
Généralités &
"La variété très riche des ressources biologiques et les interactions entre ces ressources ne sont point un luxe, bien au contraire, elles sont essentielles pour la croissance et le développement des sociétés humaines et pour l’existence même de la vie sur Terre. La diversité biologique est le socle, le soubassement de nos ressources alimentaires et c’est la source de médecine dont dépend la santé"
Hamdallah Zedan, Secrétaire exécutif de la Convention sur la Diversité Biologique, lors de son discours d’ouverture de la conférence internationale "Biodiversité, Science et Gouvernance", à Paris, en Janvier 2005.
25
1. Le virus de la dengue (DV)
Le virus de la dengue (DV) est responsable d’une fièvre virale ancienne : les premières mentions de cette maladie apparaissent dans la littérature médicale occidentale dès la fin du XVIIIème siècle. Aujourd’hui répandu dans toutes les régions
tropicales et sub-tropicales du globe, le DV est responsable d’une maladie dont la sévérité dépend de plusieurs facteurs liés à l’hôte et au virus comme nous le verrons plus loin.
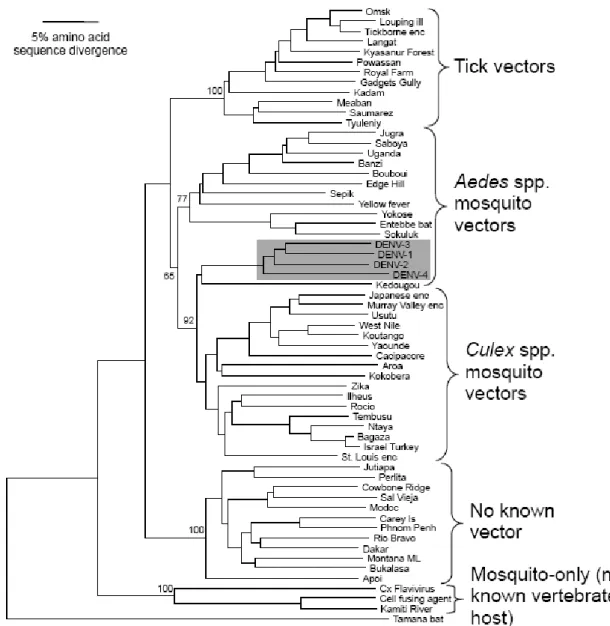
Figure 1. Arbre phylogénétique des Flavivirus d’après la séquence codant pour la protéine NS5 de ces virus3
26
Causant le plus souvent une fièvre légère à forte, parfois même un état asymptomatique, le DV peut toutefois être beaucoup plus virulent, voire mortel. Le DV fait partie de la famille des Flaviviridæ et appartient plus précisément au genre des Flavivirus.Le genre Flavivirus, dont la phylogénie est présentée dans la figure 1, comprend plus de 70 virus dont plus de 40 sont connus pour être pathogènes de l’homme : les virus du Nil occidental (WNV), de l’encéphalite Japonaise (JEV), de l’encéphalite à tique (TBEV) et de la fièvre jaune (YFV) sont parmi les plus tristement célèbres de par les pathologies humaines dont ils sont responsables4,5. Le nom du
genre et de la famille provient du grec « flavus » qui signifie jaune, en référence à la jaunisse provoquée par le virus de la fièvre jaune (YFV). L’étude des Flaviviridæ a marqué l’histoire de la virologie, notamment car le YFV fut le premier virus isolé6. Le
DV fut pour sa part, isolé pour la première fois en 1944 par un médecin et chercheur américain, Albert Bruce Sabin7, à partir de prélèvements effectués sur des patients
de Nouvelle-Guinée.
1.1.
Vecteurs de la maladie
Qualifié d’arbovirus, le DV est transmis à l’homme par les moustiques du genre Aedes. Ae. aegyptii est reconnu comme le vecteur principal de la maladie bien que d’autres espèces, tel que Ae. albopictus, véhiculent également la maladie8.
L’infection de la femelle moustique se produit au cours d’un repas sanguin sur un individu en phase virémique, par la consommation de sang contaminé. Après avoir passé les barrières digestives de l’insecte, soit approximativement six jours après son ingestion, le DV apparaît dans différents tissus et organes, tels que les tissus adipeux, les ovarioles, les hémocytes, le système nerveux, les ganglions thoraciques
27
et abdominaux9. Quatre jours plus tard environ, le virus apparait dans les glandessalivaires du moustique. Ce dernier devient alors « infectant » et peut transmettre le DV lors d’un nouveau repas sanguin. La période d’incubation extrinsèque (EIP) désigne le temps qui sépare l'infection du vecteur par un repas sanguin et l'infection de ses glandes salivaires ; elle dure en moyenne une dizaine de jours dans le cas du DV. Seules les femelles moustiques dont l’âge est supérieur à l’EIP seront en réalité capables de transmettre le DV à l’homme10. La transmission verticale du virus,
capacité des femelles moustiques infectées à transmettre le virus à leur descendance, a également été observée chez ces moustiques11,12,13. D’après les
études menées, le moustique ne manifeste aucun symptôme particulier lié à l’infection par le virus et ne serait donc pas affecté par le DV.
1.2.
Symptomatologie et pathogénèse
Il existe quatre sérotypes du DV (DV-1 à DV-4) caractérisés par la présence d’antigènes spécifiques. Les quatre sérotypes du DV possèdent la même morphologie, un génome très proche avec près de 70% d’homologie14 et sont
responsables des mêmes symptômes. L’infection par l’un des quatre sérotypes du DV induit pour le patient une immunité spécifique prolongée mais pas d’immunité croisée entre les sérotypes. Cela signifie qu’une personne peut être atteinte par la maladie plusieurs fois dans sa vie en étant infectée par plusieurs sérotypes15.
1.2.1. Symptômes classiques de la dengue
28
jours en moyenne, les symptômes débutent par une fièvre supérieure à 39°C qui durera entre 2 et 7 jours. Le début brutal de l’infection s’accompagne de céphalées frontales et rétro-orbitaires importantes, de myalgies (courbatures), d’arthralgies (douleurs articulaires) d’une asthénie générale (fatigue physique) et fréquemment de vomissements. Certains patients présentent des éruptions de type morbilliformes (macules érythémateuses punctiformes, non confluentes) épargnant le plus souvent le visage et les extrémités16. D’autres symptômes plus rares sont également associésà l’infection par le DV16,17: myosites (inflammations musculaires), myélite
(inflammation de la moelle épinière), encéphalomyélite aigue ou encéphalite post-infectieuse (inflammation démyelisante du système nerveux central). Il faut aussi noter que l’infection par le virus de la dengue peut entraîner de graves complications chez les femmes enceintes (avortement, accouchement prématuré et complications hémorragiques de l’accouchement) et que la possibilité d’une transmission verticale de la mère au nouveau né pouvant entraîner son décès a été constatée15.
1.2.2. Formes graves de la dengue
La dengue peut évoluer vers des symptômes plus graves appelés dengue hémorragique (DH) et syndrome de choc (DCS), qui sont les principales causes de décès liés au DV18. DH et DSC sont le plus fréquemment observés chez les enfants
de moins de 15 ans, mais de manière générale résulteraient de la conjonction de plusieurs facteurs liés à l’hôte et au virus. Une seconde infection par un sérotype différent, notamment dans le cas d’une infection primaire par le DV-1 ou DV-319, et
surtout si les deux infections successives sont proches dans le temps, augmenterait la possibilité d’apparition des symptômes aggravés de la maladie. D’après les
29
études épidémiologiques, le DV-2 est aussi associé plus fréquemment aux formes sévères de la dengue20. Ainsi, la première infection par le DV est le plus souventasymptomatique alors que les infections suivantes seront souvent plus graves21.
Etant avéré que plusieurs sérotypes peuvent cohabiter dans des régions où le DV est endémique22, les cas de DH et de DSC soulèvent de réelles inquiétudes. L’âge
comme nous l’avons dit mais aussi l’origine ethnique de l’hôte auraient également une influence sur l’évolution de la maladie, ce qui laisse supposer une prédisposition génétique de certains individus à ces complications. D’après certaines études épidémiologiques, les populations d’origine africaine présenteraient ainsi moins de risque de développer la DH ou le DCS que les populations caucasiennes23.
DH et DCS évoluent en général en deux temps : après une amélioration transitoire, des signes hémorragiques liés à l’augmentation de la perméabilité vasculaire apparaissent (purpura en nappe, saignements digestifs, le plus souvent une hématémèse et des épistaxis). Parfois le syndrome hémorragique est accompagné d’un état de choc en relation avec une altération de la perméabilité capillaire entraînant l’apparition de défaillances circulatoires (pouls rapide et faible, hypotension). La gravité des cas de dengue hémorragique (DH) est classée en grade de 1 à 4. L’augmentation de l’aire de répartition du vecteur et du DV pourrait induire, dans l’avenir, une augmentation des syndromes aggravés et du taux de mortalité de la maladie24. Des observations récentes tendent aussi à montrer que les
symptômes liés à l’infection par le virus de la dengue sont en train d’évoluer vers des complications neurologiques (encéphalopathies, encéphalites, congestions cérébrales) de plus en plus fréquentes. Ces symptômes neurologiques peuvent être imputés aux effets neurotrophiques du virus et aux effets systémiques liés à l’infection25.
30
1.2.3. Nouvelle classification des symptômes
La distinction entre les cas de dengue classique et de dengue hémorragique est remise en question par des études de l’OMS publiées en 2009, qui introduisent une classification plus simple, en distinguant les cas de dengue plus ou moins alarmants des cas sévères de la maladie (voire la figure 2).
Figure 2. Nouvelle classification proposée par l’OMS des symptômes de la dengue26
La nouvelle classification semble plus précise et mieux adaptée à la reconnaissance des cas sévères lors d’épidémies. Elle serait aussi plus efficace pour la classification rétrospective des cas de dengue, réalisée pour les études épidémiologiques et qui permettent notamment d’élaborer des modèles prédictifs de l’évolution des épidémies dans le monde27.
Cette classification, plus simple, permet de palier aux problèmes rencontrés avec le système classique (chevauchement des formes classiques et
31
hémorragiques, difficulté d’obtenir les renseignements permettant de conclure à une DH, etc.) et porte moins l’attention sur l’hémorragie (observés aussi dans certains cas de dengue classique) du fait que les cas sévères sont plutôt liés à l’augmentation de la perméabilité vasculaire, déclenchant alors une fuite plasmatique.1.3.
Epidémiologie
Le foyer de développement et de propagation du DV se situe en Asie du Sud-Est. Au cours du XVIIIème et XIXème siècles, des moustiques infectés par le DV auraient
profité du développement de la marine à voile pour se répandre progressivement dans toutes les régions tropicales du globe. Les épidémies de dengue restaient alors peu fréquentes, apparaissant tous les 10 à 40 ans. Cette dynamique fut dans un second temps modifiée, notamment en Asie du Sud-Est, au cours de la seconde guerre mondiale. Les perturbations écologiques et démographiques pendant cette période ont induit une forte augmentation de l’aire de répartition et de la densité de population de moustiques, notamment Ae. aegypti 28,29. A la fin de la guerre, le DV est
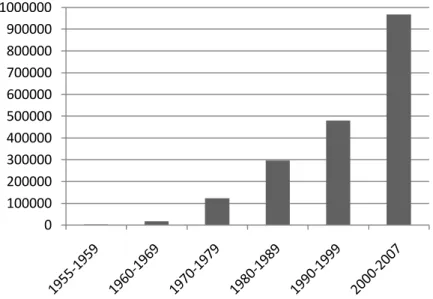
devenu endémique dans la plupart des pays d’Asie du Sud-Est et des épidémies de dengue hémorragique y sont apparues quelques années plus tard. L’urbanisation et le développement des moyens de transport modernes ont depuis fortement accéléré la circulation du virus dans le monde qui voit le nombre et l’importance des épidémies de dengue, et l’incidence des cas de DH et de DCS augmenter de manière exponentielle24,30. Comme le montre la figure 3, le nombre de cas de
32
Figure 3. Nombre de cas de dengue recensés par l’OMS depuis 195526.L’augmentation des épidémies s’accompagne d’un accroissement des taux de modifications génétiques du virus et par voie de conséquences d’une augmentation des probabilités de voir apparaître de nouvelles souches plus virulentes ou ayant un potentiel épidémique plus important.
Figure 4. Population mondiale exposée au DV selon les estimations de l’OMS en 2010
0 100000 200000 300000 400000 500000 600000 700000 800000 900000 1000000
33
En ce début de XXIème siècle, le DV est considéré comme l’arboviruspathogène de l’homme le plus répandu sur la planète. La dengue touche entre 50 et 100 millions de personnes chaque année selon les estimations de l’OMS. 2/5ème de la
population mondiale est exposée au virus qui est désormais endémique dans plus de 100 pays et des cas de DH sont décrits dans plus de 60 d’entre eux (figure 4). La morbidité des épidémies de dengue est en général assez faible : inferieure à 1% dans certaines régions, elle peut en revanche dépasser 20% dans des pays où l’accès au soin est insuffisant24,32. La maladie a également un impact
socio-économique considérable dans les pays touchés par des épidémies récurrentes33,34.
La situation est particulièrement préoccupante en Asie du Sud-est et dans le Pacifique Ouest35. Ae. aegyptii se rencontre désormais dans la plupart des îles du
Pacifique jusque là préservées du fait de leur isolement géographique. Le DV est devenu par voie de conséquence, endémique dans ces îles, où la dengue se manifeste périodiquement par des épidémies. La Nouvelle-Calédonie n’est pas épargnée par ce fléau.
Depuis 1883, date du premier document officiel notifiant en Nouvelle-Calédonie une maladie infectieuse correspondant vraisemblablement à la dengue, les épidémies se sont succédées selon une périodicité irrégulière suivies ou non de périodes d’endémisation et conduisant à l’introduction progressive des 4 sérotypes viraux. En 2002-2003, puis en 2008-2009, la Nouvelle-Calédonie est touchée par deux épidémies de dengue de large ampleur, la dernière touchant près de 7 300 personnes d’après les chiffres de l’IPNC (Institut Pasteur de Nouvelle-Calédonie). Enfin, la persistance du sérotype DV-1 pendant plus de 2 ans, avec des cas diagnostiqués même en saison fraîche, suggère qu’une situation
endémo-34
épidémique est en train de s’installer sur le territoire.1.4.
Notions de virologie et d’enzymologie appliquées au DV
Les Flavivirus présentent tous la même organisation structurale et génomique : le génome encapsulé est composé d’un ARN simple brin positif d’environ 11Kb 5, protégé de la dégradation par une coiffe de type 1 (7MeGpppA2’OMe)
en son extrémité 5’ 36 et par une queue poly(rA) à l’extrémité 3’ 37. Ne codant que
pour 10 protéines (E, C, prM, NS1, NS2A/B, NS3, NS4A/B, NS5), le génome des Flavivirus ne leur permet pas d’assumer leur réplication de façon autonome et ces organismes sont pour cela, dépendants de la machinerie cellulaire de leur hôte38.
1.4.1. Réplication du DV dans les cellules de l’hôte
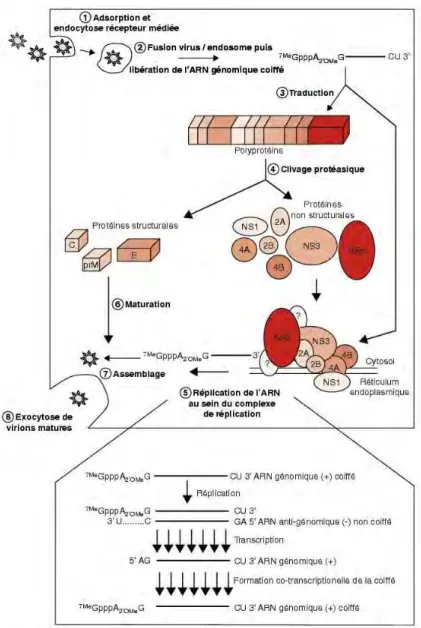
Le DV pénètre dans les cellules par endocytose, via une interaction de la protéine E avec des récepteurs membranaires, et se retrouvent alors dans des endosomes cellulaires. Il s’agit de l’étape 1 dans le schéma de la réplication du DV proposé dans la figure 5. L’acidité de ces endosomes induit des changements conformationnels majeurs des glycoprotéines (E), entraînant la fusion du virus avec la membrane de l’endosome et la libération de l’ARN viral dans le cytoplasme39
,40. Il s’agit de la seconde phase dans le schéma de la figure 5. Ainsi, lorsque le virus arrive dans le sang, suite à la piqure d’un moustique infecté, la protéine E reconnait le récepteur Fc des monocytes et fusionne avec eux. Un premier cycle de réplication et d’amplification a lieu au sein de ces monocytes, induisant l’arrivée des macrophages qui reconnaissent les anticorps liés à l’intrusion d’un virus. Cependant, au lieu d’être détruit par les macrophages qui l’engloutissent, le DV peut encore une fois se répliquer. Et c’est par le biais des macrophages que le DV se transporte dans
35
l’organisme, pouvant pénétrer dans d’autres cellules au sein desquelles il peut traduire et répliquer son génome.Figure 5. Cycle de réplication du DV dans la cellule hôte41
Le génome du DV se compose d’un seul brin d’ARN qui ne présente qu’un seul cadre ouvert de lecture et sera pour cela, transcrit en une unique polyprotéine (phase n°3 dans le schéma de la figure 5). La polyprotéine est alors clivée (phase n°4) par des protéases de l’hôte (protéases de type furine et autres protéases de l’appareil de Golgi) et par la sérine-protéase virale NS3-pro (partie N-terminale de la
36
protéine NS3) en collaboration avec NS2B, cofacteur de l’enzyme42, pour donner les3 protéines structurales qui formeront le virion (C, prM et E) et 7 protéines non-structurales (NS1, NS2A/B, NS3, NS4A/B, NS5) impliquées dans la réplication de l’ARN, l’assemblage des virions, et la modulation des réponses cellulaires de l’hôte43.
Suite à la traduction, les protéines NS sont assemblées en un complexe de réplication. Ces enzymes coordonnent leur(s) fonction(s), synthase, ARN-capping, hélicase, protéase, lors de la réplication de l’ARN viral44. A partir de l’ARN
génomique (ARN+), ce complexe enzymatique va effectuer la synthèse d’ARN
-(phase n°5) servant à son tour de matrice pour la synthèse de nouveaux brins d’ARN+ qui serviront pour la synthèse de la polyprotéine virale (la traduction
correspond à la phase n°6), à la synthèse une matrice ARN(amplification), ou seront encapsulés pour former de nouvelles particules virales45.
La réplication du DV, dite de novo car elle ne nécessite pas l’intervention d’une amorce, débute par l’extrémité 3’ de l’ARN44. Cette réplication se produit sur les
membranes de structures cellulaires de l’hôte induites par le virus lui-même38. Les
particules virales, encore non-infectieuses sont alors assemblées dans le réticulum endoplasmique (RE) de l’hôte (phase n°7 de la figue 5), où l’ARN viral complexé à la protéine C est empaqueté dans une bicouche lipidique issue du RE avec des hétérodimères de prM et E46
,47. La maturation du virion a lieu au cours de son transport dans l’appareil de Golgi dans lequel prM est clivée pour donner M48,49. La
particule virale est alors libérée dans le milieu extracellulaire par exocytose (phase n°8). Ce mécanisme de réplication, commun à tous les Flavivirus, nous permet de comprendre les mécanismes d’action des antiviraux. Il nous permet également d’élaborer une stratégie de recherche de composés antidengue en ciblant spécifiquement une phase de la réplication virale.
37
1.4.2. NS3 et NS5 : deux enzymes clés dans la réplication de l’ARN du DV
Lors de ce cycle de réplication cellulaire du DV, deux des sept protéines NS jouent un rôle central dans la réplication de l’ARN50 : NS3 et NS5 possèdent en effet
la plupart, si ce n’est toutes les compétences catalytiques pour la réplication de l’ARN viral et la synthèse de la coiffe42.
La NS3 est une enzyme à domaines multiples : la partie N-term (NS3-pro)
intervient comme nous l’avons dit plus haut dans la maturation des protéines virales au cours de l’infection. La partie C-terminale de la NS3 possède quant à elle les fonctions d’hélicase et d’ARN-triphosphatase51. Ces fonctions
interviennent respectivement dans la synthèse de l’ARN et de la coiffe. Rappelons que la coiffe joue pour le virus un rôle équivalent à celles rencontrées dans les cellules eucaryotes : c’est un élément capital qui protège l’ARN de la dégradation par des exonucléases, et intervient dans l’adressage de l’ARN synthétisé.
La NS5 présente quant à elle deux domaines distincts. La partie N-terminale
de la protéine agit comme une méthyl-transférase (MTase), impliquée notamment dans la synthèse de la coiffe en 5’ de l’ARN génomique52,53,54,55. La
partie C-terminale de NS5 agit comme ARN polymérase ARN dépendante (RdRp) et prend en charge la réplication du génome viral à proprement parlé56,57,58,59,60. Certaines études tendent à montrer que le domaine MTase de
la NS5 n’influence pas significativement l’activité polymérase de l’enzyme44 et
bien que cette hypothèse ne soit pas unanimement partagée61, il est possible
38
1.4.3. Structure et fonctionnement de la DV-NS5 RdRp
La NS5, schématisée dans la figure 6, est la plus grosse enzyme du DV et des Flavivirus en général. Elle se compose de 900 acides aminés (AA). Cette enzyme spécifique du DV est de plus très conservée dans les quatre sérotypes du virus62.
Figure 6. Structure 3D de la DV-NS5-RdRp (code PDB : 2J7U) réalisée à l’aide du logiciel Swiss-Pdb viewer. Les sous-domaines doigts, pouce et paume sont indiqués respectivement en rouge, orange et jaune. La boucle d’initiation, qui ferme en partie le tunnel de sortie de l’ARN, est indiquée en gris. La position du site actif, à l’intersection des tunnels d’entrée de l’ARN simple brin (ss), des nucléotides (NTPs) et de sortie de l’ARN double brin (ds) est indiquée par un cercle en pointillés et les chaines latérales de deux acides aminés ASP533 et ASP663 essentiels du sites actif, sont indiqués en gris.
Le domaine RdRp de la DV-NS5 débute à partir de la méthionine 273 et comprend donc 628 AA. D’après les études menées par cristallographie61, la DV-NS5
RdRp adopte une conformation dans l’espace caractéristique de ce type d’enzyme, rappelant celle d’une main droite. Trois sous-domaines y sont distingués et sont respectivement appelés les doigts, la paume et le pouce. Trois tunnels traversent l’enzyme et servent d’une part, à l’accès aux NTPs et à l’ARNss (matrice de la réplication) et d’autre part, à la sortie de l’ARNds (fruit de la réplication). Le site actif de l’enzyme se trouve au croisement de ces trois tunnels et correspond à deux
ARN ss NTPs
39
asparagines ASP533 et ASP566. La séquence des acides aminés entre 320 et 405 est une séquence très conservée chez tous les Flavivirus. Cette séquence est appelée NLS, pour « nuclear localization sequence ». Essentielle au bon fonctionnement de l’enzyme, la NLS serait reconnue spécifiquement par la NS3 lors de la constitution du complexe de réplication. Indépendamment de cela, et bien que la réplication soit effectuée dans le cytoplasme de la cellule hôte, cette séquence pourrait interagir dans une phase ultérieure, avec des transporteurs nucléaires de la cellule hôte et permettre ainsi à la NS5 de pénétrer dans le noyau de la cellule hôte dans un but encore inconnu63,64. Une boucle est également caractéristique de lastructure de DV-NS5 RdRp : située sur « le pouce », entre les résidus 792 et 801 et pointant vers le site catalytique de la « paume ». Cette boucle, en particulier grâce aux résidus TRP795 et HIS798, agit comme une plateforme d’initiation pour les premières étapes de la synthèse de l’ARN. La pénétration de l’ARNss à répliquer et des premiers NTPs dans la DV-NS5 seraient alors guidés vers le site actif de l’enzyme par la boucle d’initiation. Il semble que la protéine adopte alors une conformation rigide et fermée autour de la partie 3’ de l’ARN à répliquer (formant ainsi le complexe d’initiation), induite selon certains auteurs par le GTP65. Il est
d’ailleurs important de noter que le GTP est présent comme second nucléotide chez tous les flavivirus, ce qui souligne son importance probable dans ce processus d’initiation44. La DV-NS5 s’ouvre ensuite en une conformation plus souple pour la
40
2. Stratégies de lutte contre le DV
2.1.
Moyens disponibles
Il n’existe à l’heure actuelle ni vaccin ni traitement antiviral contre le DV15,67et
l’épandage d’insecticides pour contrôler les populations de moustiques dans les zones infectées, est souvent le seul moyen de lutte utilisé pour contenir les épidémies de dengue. Cette méthode a fourni de bon résultats dans un premier temps : en Asie par exemple68 mais surtout en Amérique du Sud où le vecteur de la
dengue était considéré comme éradiqué dans les années 197069,70. Mais l’épandage
d’insecticide est une méthode onéreuse ayant un impact environnemental non-négligeable et l’on a vu resurgir les moustiques et les maladies qu’ils véhiculent dès que les épandages se sont arrêtés69,70. L’utilisation d’insecticides (deltaméthrine,
fénitrothion, malathion, etc.) dans les zones urbaines qu’affectionne particulièrement Ae. aegypti, soulève aussi des inquiétudes pour la santé humaine67. L’exposition
répétée aux insecticides engendre qui plus est, l’apparition de phénomènes de résistance chez les moustiques limitant aussi leur application71. L’épandage
d’insecticides dans les zones touchées par le virus s’est donc montré impuissant face à l’augmentation de l’incidence de la maladie dans le monde, encourageant la recherche de nouvelles solutions de lutte72.
2.2.
Nouvelle stratégie de lutte anti-vectorielle
Depuis quelques années, une nouvelle stratégie de lutte contre le DV a vu le jour suite à l’observation en laboratoire de l’inhibition de la réplication du virus chez



![Figure 25. Stabilisation de la 7-hydroxy-8-diméthylallylcoumarine ([M+H] + =231) sous la forme 3’,4’-dihydroséséline](https://thumb-eu.123doks.com/thumbv2/123doknet/14669708.741427/125.892.122.795.431.601/figure-stabilisation-hydroxy-diméthylallylcoumarine-forme-dihydroséséline.webp)