HAL Id: tel-02933337
https://tel.archives-ouvertes.fr/tel-02933337
Submitted on 8 Sep 2020
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Analyses des dysfonctions neuronales d’un modèle murin
de Paraplégie Spastique Héréditaire
Baptiste Wilmet
To cite this version:
Baptiste Wilmet. Analyses des dysfonctions neuronales d’un modèle murin de Paraplégie Spastique Héréditaire. Neurosciences [q-bio.NC]. Université Paris sciences et lettres, 2019. Français. �NNT : 2019PSLEP045�. �tel-02933337�
Préparée à l’École Pratique des Hautes Études
Analyses des dysfonctions neuronales d’un modèle
murin de Paraplégie Spastique Héréditaire
Soutenue par
Baptiste WILMET
Le 21/11/2019
École doctorale n° 472
École doctorale de l’École
Pratique des Hautes Études
Spécialité
Systèmes intégrés,
environnement et
biodiversité
Composition du jury : Stéphane, CHARPIERPU, Sorbonne université Président
Jamilé, HAZAN
DR, IBPS Rapporteur
Lionel, DAHAN
AP, TMBI Rapporteur
Alexandre, MOUROT
CR1, INSERM Examinateur
Morwena, LATOUCHE
MCU, EPHE Co-encadrant
Giovanni STEVANIN
Remerciements
Je tiens tout d’abord à remercier l’EPHE et PSL pour m’avoir permis de réaliser cette thèse. Merci à Mme Jamilé Hazan et Mr Lionel Dahan d’avoir acceptés d’êtres les rapporteurs de ce travail. Merci à Mr Stéphane Charpier et à Mr Alexandre Mourot pour avoir accepté de faire partie du jury de cette thèse.
Je te remercie infiniment, Morwena pour ton encadrement, ton soutien, ta bonne humeur, ta motivation indéfectible et, surtout, ton humanité. Ces qualités te serviront toute ta vie et j’espère que tu sauras rester tel que tu es :D . J’ai beaucoup appris sous ton aile, rien ne saurait remplacer les 4 années qu’on a passées ensemble et que je garderais pour toujours en mémoire. C’est grâce à toi que j’ai découvert la méthode scientifique, l’univers de la Recherche, avec ses avantages et ses inconvénients. Tu as su développer mon esprit critique au-delà de ce que j’aurais cru possible. Je doute pouvoir retrouver une autre cheffe comme toi un jour… C’est très rare des êtres comme toi ; aussi, ne changes rien.
Je remercie de tout cœur Delphine Roussel, qu’aurais-je fait sans toi ? Pas grand-chose à mon avis, pour ne pas dire rien. C’est avec toi que j’ai découvert l’électrophysiologie et la chirurgie (mon grand amour). Tu étais là alors que je n’étais encore qu’un gosse qui découvrait le milieu professionnel. Tu étais là quand j’ai obtenus mes premiers résultats, mes premières étoiles (dans les yeux ou dans les graphes), mes premières larmes, eu mes premiers déboires, mes premières craintes et mes premières joies. Travailler avec toi a été plus qu’un plaisir, c’était un honneur. Je remercie grandement Charlotte Deleuze et Carine Dalle, pour leur aide technique (entre autre ;)). J’ai beaucoup appris grâce à vous, et ça a toujours été un plaisir de venir discuter avec vous à la plateforme CELYS-E-PHYS que j’ai longtemps considéré comme ma deuxième maison. J’ai passé de très agréables moments en votre compagnie et espère vous revoir régulièrement !
Je remercie Giovanni pour son soutien, tes passages dans le bureau, souvent rapides mais toujours remarquables par les rires qui en découlent et m’ont beaucoup aidés. Je suis heureux de pouvoir te compter parmi mes amis indéfectibles.
Julie… Ma (pas si) petite Julie… Les mots me manquent pour te dire à quel point tu as été importante pour ma santé mentale ces 4 dernières années. Certes on a frôlé l’internement pour folie aggravée plusieurs fois, mais je préfère ça à la dépression (ou à la surpression). Je me souviens encore de notre première rencontre, à nous regarder en chiens de faïence (C’est qui celle-là là ?!? Qu’est ce qu’elle fout sur MON bureau ? ;) ) ; Qui eut cru que ça déboucherait sur une telle amitié ? C’est simple, au laboratoire, il y avait les journées « avec Julie », et les journées « sans Julie ». Tes qualités, tant humaines que professionnelles, t’emmèneront loin. Ne lâches rien et tu pourras devenir une très grande cherch(i)euse. Même si je sais qu’on se reverra souvent, J’ai les larmes aux yeux en écrivant ce paragraphe que je ne peux m’empêcher d’imaginer comme un au revoir… Changes rien, gardes la pêche !
Je te remercie Pupuche, le petit hibou qui a pris son envol (avec panache). J’aurais aimé être plus présent pour toi, tu mérites le meilleur dans ta vie. Tu peux être fier de ce que tu es, et de ce que tu as accomplis. J’adore toutes nos conversations, tous nos délires et je chéris notre amitié que j’espère mériter et conserver le plus longtemps possible !
Je te remercie Elena Banchi, ma nouvelle voisine ;). Oh ! Petite Pipette ! Tu es à la fois si drôle et si professionnelle, un cador pour une équipe de recherche ! J’aime ton franc parler, ta force de caractère et ton humour irremplaçable. J’ai l’impression de me répéter, mais ne changes rien ! Ma petite maman… Cette thèse est pour toi. Pour tout ce qu’on a traversé, pour tout ce que tu as fait pour nous, tous tes sacrifices. Pour tous ceux qui ne croyaient pas en nous… Malgré mes humeurs, malgré mes fautes et mes défauts, tu m’as toujours soutenue et supporté. La vie n’a pas toujours été rose, mais aujourd’hui elle est déjà un peu plus belle. Que puis-je dire d’autre qui ne paraisse trop obvious ? Rien de tout cela n’aurait été possible sans toi, sans ton aide, sans ta présence rassurante dans ma vie. Je t’aime
Cyrille… Evidemment, Cyrille… Je te dois tant. Tu as été comme un père pour moi. Jamais je ne pourrais te rendre tout ce que tu m’as donné. Il n’existe pas de mots capables de t’exprimer ma gratitude. Je laisse donc libre cours à mon clavier. Merci pour tout, pour ton aide, ton soutien, ta présence. Tu as toujours eu raison sur tout, je me suis mordu les doigts à chaque fois que j’ai voulu dévier de tes directives (que veux-tu, poussin est une tête brûlée). Je pense à tous ces gamins qui seraient perdus sans toi. Merci pour tout (déjà dit…). Tu es un homme au grand cœur, toujours prêt
peut s’appuyer et sans qui tant de gens s’effondreraient… Te rencontrer a été une des plus belles choses qui me soient arrivé et j’espère te garder parmi mes amis pendant longtemps encore… Ma douce, je voudrais éviter de m’épancher en sentiments, mais ça ne va pas être facile. Merci de ton soutien, merci d’avoir supporté ma tête de mort tout ce temps. S’il y a bien une personne qui m’a permis de tenir le coup, c’est toi. Ton sourire, ton enthousiasme, ta bonne humeur, ta gentillesse, autant d’éléments qui font de toi quelqu’un d’unique, de solaire… Tu m’as fait découvrir tant de choses que je m’étais cru interdites à jamais… Merci est un mot si faible pour t’exprimer ce que je ressens, dommage qu’il n’existe pas d’autres mots plus forts…
Je remercie les potes, sans qui la vie ne vaudrait pas la peine d’être vécue ! Geoffroy, le meilleur, bon courage pour ta thèse et la suite, amuses toi bien en Argentine. J’espère que tu ne partiras pas trop loin ensuite, nos soirées me manqueraient énormément. Romain, mon rochou, navré de n’avoir pas pu t’accorder autant de temps que ce que j’aurais voulu, tu restes dans mon cœur quoiqu’il arrive et je n’oublierais jamais nos années lycée. Arnaud, ce grand con au cœur non moins grand, c’est grâce à toi que j’ai découvert une bonne partie des « vrais » plaisirs de la vie ;), carpe diem ! Aleks, sans qui la vie n’aurait pas été pareille. Tu n’imagines pas à quel point tu as pu m’influencer, on ne se voit pas souvent mais à chacune de nos retrouvailles c’est comme si à peine 2 heures s’étaient écoulées depuis la dernière fois. C’est là que tu reconnais un frère. Marianne, le soleil de ma vie, encore bravo pour ta réussite en neuropsy. Tu es si pétillante, si humaine et drôle, Je te souhaite tout le meilleur de ce que la vie peut t’offrir car tu le mérites. A bientôt en Belgique ;). François, mon ami, personne ne saurait mériter plus de reconnaissance que toi. Tu m’as apporté tant de belles choses ! Sans toi pour me maintenir dans le droit chemin, j’aurais certainement bien mal fini… Je pourrais louer tes innombrables qualités pendant des heures, je pourrais en écrire toute une thèse, tiens ! Te remercier vis-à-vis de ton soutien ces dernières années me parait bien futile, comparé à ce que je te dois depuis ces 20 hivers que nous nous connaissons. A chaque difficulté, tu réponds présent. A chaque fois que la vie me faisait ployer, tu me relevais… Merci Un grand merci à tous les autres, de l’équipe AD-GS ou non : Liriopé pour ton calme et ta présence reposante, Ashraf, pour ta gentillesse et le plaisir que me procurent nos discussion, Max, Typhaine, Claire, pour ta gentillesse, ton ouverture d’esprit et nos discussions toujours prenantes, Fred, Raph, Thomas, Ruiyi, Charles, Mélissa, les AJITES. Un grand merci à l’équipe de la Tête Ailleurs, QG officiel de l’ICM, sans qui de (trop ?) nombreuses soirées auraient été bien moins intéressantes.
Table des matières
REMERCIEMENTS ... 1
TABLE DES MATIERES ... 4
ABREVIATIONS. ... 6
INTRODUCTION ... 7
I. AXE CORTICO-SPINAL ET MALADIES ASSOCIEES. ... 9
L’axe cortico-spinal ... 9
1) Historique et généralités ... 9
2) Organisation et fonction du cortex moteur humain et murin. ... 13
3) Physiologie du cortex moteur. ... 16
a) Les neurones pyramidaux ... 16
b) Les interneurones et la relation neurone-interneurones... 17
4) Organisation et fonction de la moelle épinière et des voies motrices ... 20
Les maladies du Motoneurone ... 26
1) La dégénérescence du neurone moteur : ... 28
a) La Paraplégie Spastique Héréditaire (PSH) ... 28
Epidémiologie et symptômes ... 28
Diagnostic et traitements des PSH ... 34
Voies cellulaires impliquées ... 35
b) Le cas de la PSH de type 11 (SPG11) ... 36
Epidémiologie ... 36
La protéine Spatacsine ... 39
Le modèle d’étude Spg11 -/- ... 40
2) Atteinte des deux motoneurones : la Sclérose Latérale Amyotrophique ... 44
a) Epidémiologie et symptômes ... 44
b) Diagnostic et traitements. ... 44
c) Gènes en cause et voies cellulaires impliquées ... 46
II. HIPPOCAMPE ET LES ATTEINTES COGNITIVES. ... 53
Structure, projections et fonction de l’hippocampe ... 53
La plasticité synaptique ... 56
L’hippocampe dans les maladies neurodégénératives. ... 60
III. OBJECTIFS ET HYPOTHESES. ... 62
MATERIEL ET METHODES ... 64
I. APPROBATION ETHIQUE ET PRODUCTION DU MODELE ANIMAL. ... 64
II. CHIRURGIE EXPERIMENTALE. ... 64
III. ELECTROENCEPHALOGRAMME. ... 65
IV. ADMINISTRATION DES DROGUES. ... 66
V. DEFINITION DES DECHARGES POINTES ONDES. ... 66
VI. PATCH CLAMP SUR CULTURE DE NEURONES. ... 67
Culture de neurones corticaux embryonnaires ... 67
Enregistrements intracellulaires ... 67
VII. MULTIPLE ELECTRODE ARRAY. ... 68
X. STATISTIQUES. ... 71
RESULTATS ... 72
I. PERTE DE LA PLASTICITE SYNAPTIQUE DANS L’HIPPOCAMPE DES SOURIS SPG11-/-. ... 72
Résultats obtenus... 72
II. ARTICLE:LOSS OF SPATACSIN IN A MOUSE MODEL OF HEREDITARY SPASTIC PARAPLEGIA LEADS TO ABNORMAL ELECTROPHYSIOLOGICAL ACTIVITY ORIGINATING IN THE MOTOR CORTEX THAT RESEMBLE ABSENCE EPILEPSY. ... 75
Résumé ... 75
DISCUSSION/PERSPECTIVES. ... 77
I. LES MODELES ANIMAUX D’ETUDES DES MALADIES DU MOTONEURONE : INTERETS ET COMPARAISON ... 78
Les modèles d’études de la PSH-SPG11 ... 80
Les autres modèles de maladies neurodégénératives présentant des altérations electrophysiologiques.. 82
II. L’EXTINCTION DE LA SPATACSINE PROVOQUE L’APPARITION D’OSCILLATIONS ANORMALES DANS LE CORTEX MOTEUR DES SOURIS SPG11-/-. ... 84
La PSH-SPG11 et l’Epilepsie d’Absence. ... 84
1) Epidémiologie et symptômes de l’Epilepsie d’Absence ... 85
2) Traitements ... 87
3) Physiopathologie et modèles animaux. ... 87
Hypothèses et perspectives sur les mécanismes d’apparition des DPO dans le modèle Spg11-/- ... 92
L’excitabilité neuronale et l’homéostasie calcique. ... 99
III. PERTE DE LA PLASTICITE SYNAPTIQUE DANS L’HIPPOCAMPE DES SOURIS SPG11-/-. ... 102
Mécanismes de la plasticité synaptique hippocampique. ... 102
1) Le Potentiel Post tétanique. ... 102
2) La Potentialisation à long terme ... 103
3) La Facilitation à court terme ... 105
4) La Dépression à long terme. ... 106
La plasticité synaptique, synaptogénèse et homéostasie calcique. ... 108
CONCLUSION ET INTERETS. ...111
Abréviations.
Liste des abréviations les plus couramment utilisées (traduction en anglais le cas échéant)
ADHSP Autosomal Dominant Hereditary Spastic Paraplegia
AE Epilepsie d'Absence (Absence Epilepsy)
AMP Amyotrophie Musculaire Primaire
ARHSP Autosomal Recessive Hereditary Spastic Paraplegia
CA1, 2, 3 Corne d'Amon 1, 2, 3
CC Corps calleux (Corpus Callosum)
CE Cortex Entorhinal
CS (SC) Collatérales de Schaffer (Schaffer's Collaterals)
CST Axe corticospinal (Corticospinal Tract)
DFT (FTD) Démence Fronto-temporal (FrontoTemporal Dementia)
DPO (SWD) Décharge Pointe Onde (Spike and Wave Discharges)
Ecog Electrocorticogramme
EEG Electroencéphalogramme
ETX Ethosuximide
FF Fast Fatigable Motorneuron
FFR Fast Fatigue-Resistant Motorneuron
FFT Fast Fourier Transformation
FM (MF) Fibres Moussues (Mossy Fibers)
FP (PP) Fibres Perforantes (Perforante Pathway)
GAERS Genetic Absence Epielepsy Rat from Strasbourg
GD (DG) Gyrus denté (Dentage Gyrus)
HFS Stimulation Haute Fréquence (High frequency Stimulation)
I/O Input/Output
IN Interneurone
iPSC Cellules Souches Pluripotentes induites (induced Pluripotente Stem Cells)
IRM (MRI) Imagerie par Résonance Magnétique (Magnetic Resonnance Imaging)
KO Knock-Out
LTP Potentialisation à Long-terme (Long Term Potentiation)
M1 Cortex Moteur Primaire
MA (AD) Maladie d'Alzheimer (Alzheimer's Disease)
MH (HD) Maladie de Huntington (Huntington's Disease)
MN Motoneurone (Motorneuron)
MNC= UMN (CMN) Motoneurone Cortical = Motoneurone Supérieur (Upper Motorneuron = Cortical Motorneuron)
MNS= LMN (SMN) Motoneurone spinal = Motoneurone Inférieur (Lower Motorneuron = Spinal motorneuron)
MP (PD) Maladie de Parkinson (Parkinson's Disease)
NPC Neural Precursor Cells
PA (AP) Potentiel d'Action (Action Potential)
PEM Potentiel Evoqué Moteur
PMC Cortex Prémoteur
PPR Paired Pulse Ratio
PPSE (EPSP) Potentiel synaptic excitateur (Excitatory Post-Synaptic Potential)
PPSI (IPSP) Potentiel synaptic Inhibiteur (Inhibitory Post-synaptic Potential)
PSH-SPGx (HSP-SPGx) Paraplégie Spastique Héréditaire liée au gène SPGx (Hereditary Spastic Paraplegia linked to SPGx gene
PV Parvalbumine
RE Réticulum Endoplasmique
S1 Cortex Somatosensoriel Primaire
SICI Inhibition Intracorticale à court interval (short interval intracortical inhibition)
SLA (ALS) Sclérose Latérale Amyotrophique (Amyotrophic Lateral Sclerosis)
SOCE Store Operated Calcium Entry
Spg11 WT Spg11 Wild-type
Spg11-/- Spg11 Knock-out
SST Somatostatine
Introduction
Durant ce travail de thèse, je me suis intéressé aux réseaux neuronaux responsables de la motricité et de la mémorisation que sont l’axe cortico-spinal et l’hippocampe dans un contexte de maladie neurodégénérative humaine, plus précisément, une maladie du motoneurone. Ces dernières décennies ont vu la démocratisation de nombreuses techniques permettant l’étude de paramètres électrophysiologiques tels que la plasticité synaptique (la capacité des synapses à se renforcer ou s’affaiblir dans la durée, en réponse à une augmentation ou à une diminution de leur activité) ou l’excitabilité neuronale (la capacité d’un neurone à émettre un potentiel d'action à la suite d'une excitation supraliminaire). Nos connaissances sur les corrélats biologiques de ces paramètres s’accroissent et il est possible de lier de nombreux symptômes d’une pathologie neurologique à une altération d’au moins un paramètre électrophysiologique.
J’ai donc travaillé sur une maladie neurodégénérative affectant le motoneurone : la Paraplégie Spastique Héréditaire de type 11 (HSP-SPG11), une maladie de l’axe cortico-spinale avec atteintes motrices et cognitives entre autres symptômes, provoquée par la perte de fonction du gène SPG11 codant pour la protéine Spatacsine. Plus précisément ce travail est basé sur un modèle murin knock-out (Spg11-/-) de cette pathologie, modèle généré précédemment par notre laboratoire qui a déjà fait l’objet de plusieurs publications scientifiques. J’ai tenté de comprendre quels paramètres électrophysiologiques pouvaient se retrouver altérés dans notre modèle, avant, pendant, ou après l’apparition des premières pertes neuronales. A terme, une meilleure connaissance des étapes précoces de la pathologie devrait permettre de proposer de nouvelles perspectives dans l’étude de la physiopathologie de la Paraplégie Spastique Héréditaire ainsi que pour les autres maladies du motoneurone.
Cette thèse a porté à la fois sur une exploration électroencéphalographique longitudinale de différentes régions cérébrales (résultats principaux) et sur une étude ponctuelle des paramètres de la plasticité synaptique hippocampique du modèle murin Spg11-/-. Grâce ces méthodes, j’ai pu mettre en évidence l’apparition d’évènements anormaux sous forme de décharges pointes ondes (DPO) localisés dans le cortex moteur primaire, dont l’apparition précède la dégénérescence neuronale, parallèle aux symptômes moteurs et répondant à l’injection de drogues pro et anti épilepsie de type absences. Au niveau hippocampique, nos résultats dévoilent une modification de
plusieurs paramètres pré et post-synaptiques de la plasticité synaptique qui sont en accord avec les phénotypes cognitifs observés chez la souris Spg11-/-.
J’ai séparé l’introduction de cette thèse en deux parties. La première consistera à expliquer ce qu’est l’axe cortico-spinal au niveau anatomique et physiologique, j’y décrirai aussi les interactions entre motoneurones et interneurones au sein du cortex moteur. S’ensuivra la description des maladies du motoneurone telles que la PSH-SPG11 d’un point de vue clinique, génétique et physiopathologique. Dans une seconde partie, je vous décrirai l’anatomie et la physiologie de l’hippocampe, centre principal de la mémoire avec l’accent mis sur les processus de la plasticité hippocampique. Enfin je traiterai de quelques maladies affectant cette plasticité hippocampique dont le parallèle m’a semblé pertinent.
I. Axe cortico-spinal et maladies associées.
L’axe cortico-spinal
1) Historique et généralités
L’axe cortico-spinal (CST) est un ensemble de fibres nerveuses multisynaptiques descendantes et ascendantes assurant les fonctions motrices, mais aussi sensorielles, des mammifères. Il est décrit pour la première fois par Thomas Willis en 1664 dans son essai « cerebri anatome » dans lequel il résume les différentes observations qu’il a pu faire après dissection de cadavres humains (Figures 1 et 2). Cette description sera étoffée par François Pourfour du Petit en 1710 qui fut le premier à soupçonner l’existence de la décussation des fibres motrices- c’est-à-dire l’inversion de la latéralité des fibres au niveau du tronc cérébral - puis par Ludwig Türck en 1851 qui la décrira véritablement. Grâce aux avancées en méthodologie clinique et en électrophysiologie, Jean-Martin Charcot complètera leurs observations dans « Lectures on the
Localisation of Cerebral and Spinal Diseases » en 1883 et en profitera pour décrire une des maladies du motoneurone les plus répandues : la Sclérose Latérale Amyotrophique –aussi nommée « Maladie de Charcot ». (Figure 1).
Les progrès technologiques aidant, la description et la caractérisation fonctionnelle de ce système complexe de la motricité s’étoffe encore quotidiennement de nos jours. Les premières études telles que celles citées plus haut s’appuient majoritairement sur l’analyse de tissus post-mortem. Au milieu du 20ème siècle, différentes méthodes apparaissent telles que la stimulation électrique crânienne utilisée par le neurochirurgien W. G. Penfield. Sur patients éveillés mais
Figure 1: Iconographie non exhaustive de quelques fondateurs de la neurophysiologie moderne. En haut à gauche : gravure de Thomas Willis. En bas à gauche : photographie de Ludwig Türck. En bas à droite : photographie de Jean-Martin Charcot
anesthésiés localement, il est le premier avec H.H Jasper à proposer une carte fonctionnelle des cortex moteur et sensoriels (qu’ils appellent alors « l’homoncule moteur » et « homoncule sensoriel »). Il a fallu attendre l’invention et la généralisation de méthodes non invasives pour obtenir une carte anatomique et fonctionnelle précise des fibres motrices chez l’être humain vivant (O. Al Masri & al. ; 2011)1. Parmi celles-ci, on peut citer deux techniques principales :1) la stimulation transcranienne magnétique dont le principe a été décrit pour la première fois en 1896 par Arsène d’Arsonval mais la première utilisation réussie en recherche à la fin du 20ème siècle pour
l’étude de l’axe corticospinal (AT Barker & al. ; 1985)2 et 2) l’Imagerie par Résonance Magnétique
fonctionnelle dans les années 1990 et plus précisément la méthode d’imagerie du tenseur de diffusion (Figure 3 3). Aujourd’hui, l’axe cortico-spinal humain est bien caractérisé
anatomiquement et fonctionnellement et je vais résumer dans les pages suivantes l’état des connaissances que nous avons sur ce système chez l’humain et son homologue murin.
Figure 2: Gravure représentant le cerveau et le tronc cérébral. Tirée de « Cerebri Anatome » de T. Willis, 1664
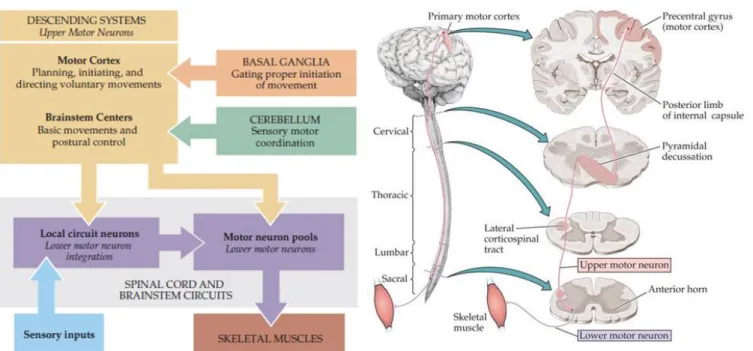
On peut subdiviser le système moteur (Figure 4) en plusieurs sous-systèmes :
1) Le cortex moteur et le tronc cérébral qui réunissent les neurones moteurs (ou Primaires ou Corticaux) (MNS) et sont les centres d’initiation, de planification des gestes volontaires et du maintien de la posture respectivement. Plus précisément, le cortex moteur est responsable de la séquence spatiotemporelle des mouvements complexes volontaires, tandis que le tronc cérébral gère le tonus musculaire ainsi que l’orientation des yeux et de la tête en réponse aux stimuli sensoriels. Ces deux régions agissent en contactant directement ou via un interneurone (IN) les motoneurones secondaires situés dans la moelle épinière.
2) Les ganglions de la base et le cervelet qui assurent respectivement une bonne initiation et une bonne coordination des mouvements. Les ganglions de la base suppriment les mouvements involontaires tandis que le cervelet compare en temps réel la séquence de mouvements voulue avec le mouvement effectif et assure la correction des erreurs. Il est ainsi responsable d’une partie de l’apprentissage moteur. Ces deux régions agissent en modulant l’activité des neurones moteurs.
3) La circuiterie spinale composée d’interneurones et de motoneurones inférieurs (ou secondaires ou spinaux) (MNS) qui reçoivent l’information nerveuse de la part du cortex et contactent les muscles à contracter suivant la planification imposée par le cortex moteur. 4) Les muscles posturaux ou squelettiques qui se contractent en réponse à une stimulation par
des motoneurones inférieurs. Les fibres musculaires sont disposées en fuseaux (Figure 12).
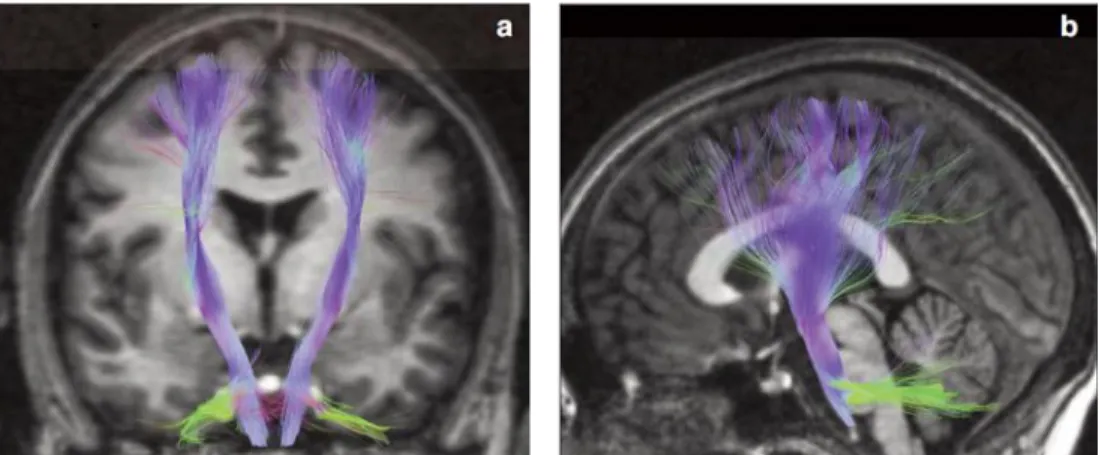
Figure 3: Partie cérébrale de l’axe corticospinal humain, visualisé par Imagerie à Résonance Magnétique en tenseur de diffusion, suivant une coupe coronale (Gauche) ou sagittale (Droite). Tirée de D. Fortin & al. ; 2015
Il existe des neurones sensitifs dont les projections contactent l’intérieur de ces fuseaux (ils sont alors dits intrafusaux), ils sont chargés d’informer la circuiterie spinale de l’état de contraction du muscle.
L’interaction de ces différents sous-systèmes permet une régulation fine des mouvements. Pour la suite, nous nous concentrerons sur les circuiteries effectrices de la motricité situés dans le cortex moteur et la moelle épinière.
Figure 4: Représentation schématique des éléments impliquées dans la motricité (à Gauche, tirée de Neuroscience 3rd edition, 2014). Représentation de l’axe corticospinal, du cortex Moteur aux muscles (à Droite).
2) Organisation et fonction du cortex moteur humain et murin.
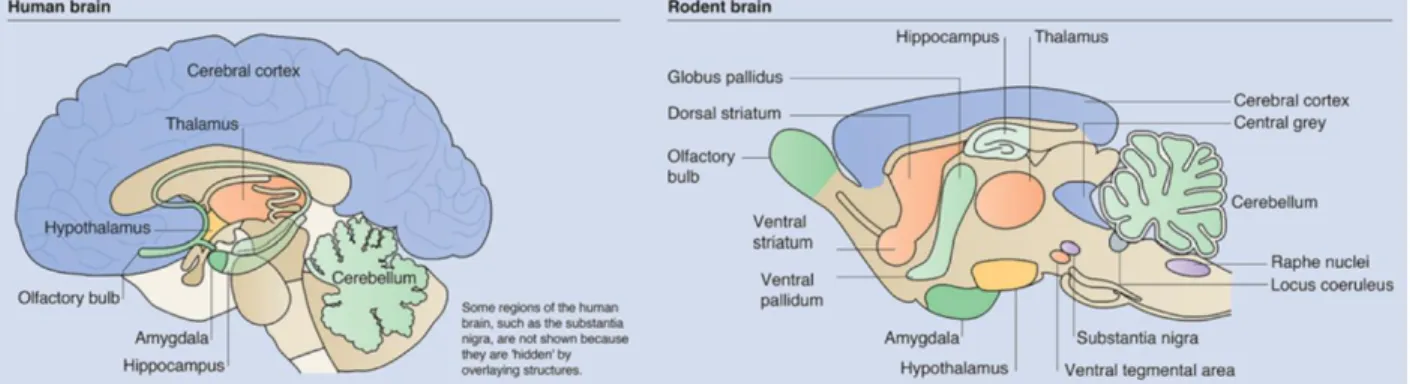
Le terme cortex cérébral provient du latin « cortex » qui signifie enveloppe ou écorce, il s’agit d’une région qui, comme son nom l’indique, est située en périphérie du cerveau et encercle les régions internes telles que l’hippocampe, le striatum et le thalamus (Figure 5). Il comprend la majeure partie de la substance grise cérébrale, concentrant les corps cellulaires des neurones dans des couches appelées couches corticales que l’on numérote de I à VI (Figure 7). Chez l’humain adulte, on estime que le cortex est constitué de plus de 27.109 neurones et possède 400*106 synapses/mm3 de cortex (Mountcastle, 1997)4. Les régions corticales assurent de très nombreuses fonctions, de l’intégration d’informations sensorielles aux fonctions cognitives les plus complexes en passant par la motricité.
Figure 5: Schéma comparant l’organisation générale du cerveau humain et murin en coupe sagittale. Tirée de B. Ellenbroek, J. Youn, 2016.
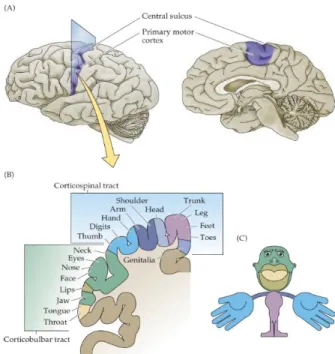
Le cortex moteur est fonctionnellement régionalisé par une somatotopie précise (Figure 6). La partie la plus dorsale contrôle les membres et le tronc via la voie cortico-spinale (réseau de fibres nerveuses partant du cortex moteur aux muscles des membres en passant par le tronc cérébral et la moelle épinière) que je décris plus en détail dans les paragraphes suivants. La partie plus pariétale du cortex innerve les muscles faciaux via la voie cortico-bulbaire, (Voie qui suit la voie cortico-spinale mais ne passant pas par la moelle épinière : son contact avec le motoneurone secondaire se fait dans la Medulla Oblongata (Moelle allongée ou bulbe rachidien) qui ne sera pas traitée ici. Le cortex moteur est lui aussi formé de couches aux fonctions distinctes à la différence que la couche 4 est inexistante et que la couche 5 est subdivisée en 5A et 5B, présentant des fonctions et projections différentes. Ces dernières concentrent avec la couche 6 la majorité des corps cellulaires des neurones pyramidaux qui représentent la plus grosse source d’efférences du cortex. Ces mêmes neurones vont présenter des caractéristiques en termes
Figure 6: Schéma représentant la somatotopie du Cortex Moteur Primaire. En bas à gauche : coupe coronale représentant les deux voies corticospinales et corticobulbaires et les régions du corps associées. En bas à droite : Représentation des parties du corps humain en fonction de la capacité de contrôle motrice médiée par le cortex. Tirée de Neuroscience 3rd Edition.
de projections, de paramètres électrophysiologiques et de machinerie cellulaire différentes suivant leur localisation dans les différentes couches corticales. Notamment, les couches 2 et 3 contactent d’autres régions corticales -on parle de projection cortico-corticale- soit ipsilatérales (couche 2) comme par exemple du cortex prémoteur au cortex moteur secondaire, soit contralatérales (couche 3) via le corps calleux, un réseau de fibres assurant la connexion entre les deux hémisphères cérébraux. C’est dans la couche 5 que se concentrent les efférences vers le tronc cérébral et la moelle épinière (appelées cortico-spinales) et dans la couche 6 celles vers le thalamus (cortico-thalamiques). De plus, les neurones de ces différentes couches expriment des marqueurs protéiques différents ce qui permet de les distinguer par marquage immunologique. Au niveau local, il existe des interneurones inhibiteurs (ou GABAergiques) qui forment des synapses sur les dendrites et corps cellulaires des neurones pyramidaux, y sécrétant de l’acide γ-aminobutyrique (GABA), un neurotransmetteur inhibiteur.
L’axe cortico-spinal remplit deux fonctions principales liées aux deux systèmes de fibres nerveuses qui la composent : l’une ascendante des membres et organes internes vers le cerveau qui assure majoritairement une fonction sensorielle ; l’autre descendante qui assure principalement une fonction motrice (en contactant les muscles) Au cours de l’évolution, chez les mammifères, l’axe corticospinal s’est très largement conservé bien que des différences inter-espèces soient observées. Notamment, le point commun principal entre les différentes espèces est que la grande majorité des faisceaux corticospinaux tirent leur origine des cellules pyramidales de la couche 5 du cortex moteur primaire (M1) et du cortex somatosensoriel (S1) (Nudo & Masterton, 19905,6) (Figure 7). Chez les rongeurs, on peut y ajouter certains corps neuronaux des cortex cingulaires, pariétaux, préfrontaux et visuels (Akintunde & Buxton ; 19827, Tennant & al. ; 20118, Kamiyama & al. ;20159). Chez l’humain, les études d’IRM/DTI ont permis d’établir que si la majorité du CST
Figure 8: Schéma comparant l’organisation des fibres de l’axe corticospinal au niveau cervical chez l’humain et le rongeur. Adaptée de Q. Welniarz & al. ; 2016. CST= Corticospinal Tract
tire son origine de M1 et S1, une portion non négligeable (25%) provient de l’aire motrice supplémentaire (SMA) (Seo & Jang ; 201310) et du cortex prémoteur (PMC) (7%). La trajectoire
des axones vers la moelle épinière est conservée à travers le taxon des mammifères jusqu’à la medulla caudale (à la jonction entre le tronc cérébral et la moelle épinière). Certaines exceptions et différences inter-espèces sont décrites plus en détail dans la revue de Q. Welniarz & al. ; 201711.
3) Physiologie du cortex moteur.
a) Les neurones pyramidaux
L’organisation stratifiée du cortex implique la formation d’un dipôle électrique (extracellulaire) via les Neurones pyramidaux (neurones moteurs ou cellules de Betz dans le cas du cortex moteur). Ce dipôle est généré par la différence de charges électriques entre les dendrites apicales et le soma des cellules pyramidales et nous permet de mesurer l’activité électrique corticale globale via la technique de l’électroencéphalographie (EEG). Cette différence de charges est générée par les afférences excitatrices et inhibitrices reçues de la part des autres neurones et interneurones sur le corps cellulaire ou les dendrites apicales du neurone pyramidal. De plus, la répartition des neurones, parallèles au scalp, permet à une électrode de surface de capter cette différence de charges (on parle de dipôle radial). Ainsi, si des afférences excitatrices s’activent au niveau des dendrites apicales, la charge électrique extérieure globale y sera plus négative qu’au niveau du soma et l’électrode captera un signal plus négatif (Figure 9). Le cerveau humain présente
Figure 9: Schéma du dipôle cortical radial. Seules les cellules pyramidales sont représentées ici. Par convention, un courant positif est représenté vers le bas et inversement.
mais parallèles (on parle alors de dipôle tangentiel) et participent moins au signal EEG que les neurones perpendiculaires ; dit autrement, l’activité de ces cellules est difficile à isoler par une électrode de surface. Le modèle murin présente plusieurs « avantages » par rapport à l’être humain : il n’y a pas de sillons donc pas de dipôle tangentiel, et il est possible d’implanter les électrodes directement à la surface corticale ou dans des régions sous-corticales.
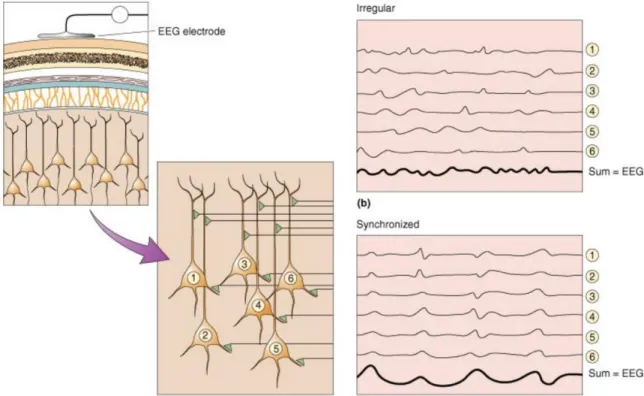
L’EEG est donc une technique d’électrophysiologie extracellulaire. Le signal observé résulte de la sommation spatiale et temporelle de tous les Potentiels Post Synaptiques Excitateurs (PPSE) et Potentiel Post Synaptiques Inhibiteurs (PPSI) (Figure 10). Pour qu’un signal soit visible à l’EEG, il faut donc une synchronisation des neurones étudiés. Différentes formes de synchronisations visibles à l’EEG existent : des non pathologiques comme les rythmes d’éveil et sommeil ou des pathologiques telles que les paroxysmes épileptiques.
b) Les interneurones et la relation neurone-interneurones.
Figure 10: Schéma explicative du signal EEG : chaque neurone numéroté de 1 à 6 peut avoir une activité irrégulière (panneau en haut à droite) ou synchronisé avec les neurones alentours (panneau en bas à droite).
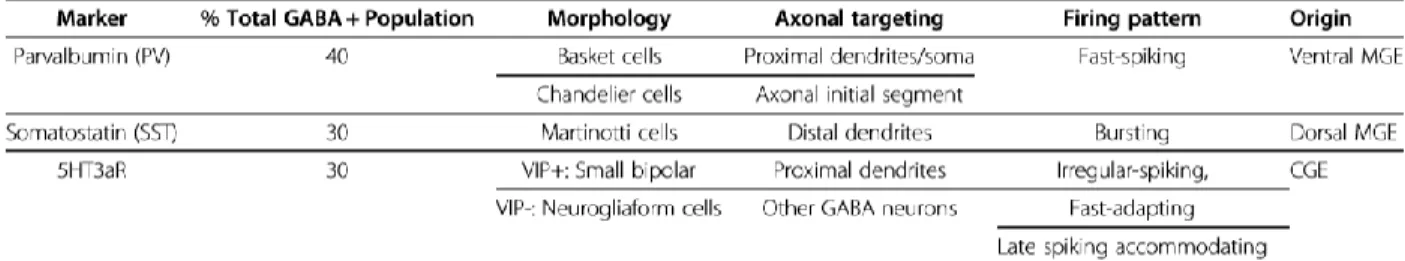
Les interneurones (IN) sont des neurones de plus petite taille que les neurones pyramidaux. Ils ont pour rôle de réguler l’activité neuronale locale. Il s’agit d’un groupe très hétérogène en termes d’origine embryonnaire, de morphologie, de marqueurs protéiques et de propriétés biochimiques et physiques (voir tableau 1 et C. Kelsom, W. Lu, 201312). Les dernières études transcriptomiques suggèrent qu’il peut exister jusqu’à 50 types d’IN ; ce chiffre variant cependant suivant les techniques et méthodes d’analyses utilisées et les régions cérébrales étudiées (B. Tasic & al. ; 201713, A. Zeisel & al. ; 201514). Ils sont classiquement divisés en trois types principaux : les Interneurones Parvalbumine (PV), Somatostatine (SST), et sérotoninergiques (5HT3aR).
Le développement des Interneurones Gabaergiques corticaux à partir des progéniteurs neuronaux (NPC) se fait dans les éminences ganglionnaires (Figure 11, K.T. Sultan & al. ; 201315).
Si le processus de différentiation et de migration n’est pas encore totalement compris, des motifs spatiaux et temporels d’expression de facteurs de transcription sont proposés (C. Kelsom, W. Lu, 2013). Notamment, concernant les interneurones Parvalbumine et Somatostatine, 2 cascades de régulation génétique sont retenues : la première concerne des facteurs de transcription de la famille des DLX et la deuxième implique le facteur de transcription Nkx2.1. Les cascades de réactions qui en découlent vont donc
Table 1: Proportion et diversité des interneurones GABAergiques. Tiré de C. Kelsom, W. Lu, 2013. MGE= Medial Ganglionic Eminence. CGE= Caudal Ganglionic Eminence
Figure 11: Schéma représentant les zones de neurogénèse des Interneurones Gabaergiques principaux et leurs voies transcriptionelles principales. MGE= Medial Ganglionnic Eminence. LGE= Lateral Ganglionnic Eminence. CGE= Caudal Ganglionnic Eminence. PoA= Tiré de K.T.
réguler la différentiation et la migration des futurs interneurones (L. Lim & al. ; 2018). Comme pour les neurones, les interneurones sont générés en surplus, et ceux qui ne reçoivent pas suffisamment d’afférences excitatrices de la part des neurones (notamment pyramidaux) -signe d’une mauvaise intégration dans le réseau neuronal- enclenchent l’apoptose. Il y a donc une relation très étroite entre les neurones pyramidaux et les interneurones Gabaergiques, présente dès les dernières étapes de la neurogénèse développementale et maintenue à l’âge adulte. Ainsi, des altérations de cette relation ou dans la neurogénèse, migration ou intégration des interneurones Gabaergiques peuvent mener à tout un spectre de maladies neurodeveloppementales telles que des épilepsies (R.S. Sloviter & al. ; 198716, I. Cohen & al. ; 200217), la schizophrénie ou l’autisme (A.M. Katsarou & al. ; 201718, D.A. Lewis & al. ; 200519, E. Rossignol, 201120).
4) Organisation et fonction de la moelle épinière et des voies motrices
Figure 11: Schéma des voies pyramidales directes (gauche) ou indirectes (droite) et localisation de leurs projections respectives. En bas : représentation des cibles musculaires des projections suivant leur localisation dans la moelle épinière. Les muscles les plus distaux sont innervés par les motoneurones spinaux
En partant des différentes régions corticales, les axones se regroupent en faisceau jusqu’à la médulla caudale où une majorité d’entre eux subissent la décussation pyramidale : ils changent de latéralité gauche/droite et de ventrale à dorsale. La proportion de fibres subissant cette décussation peut varier d’une espèce à l’autre : entre 80-95% chez les rongeurs, 75-90% chez l’humain (Joosten & al; 199221, Jang 201422). L’avantage évolutif expliquant ce phénomène
conservé chez les mammifères est encore sujet à débat, mais certaines informations ont permis d’émettre une hypothèse qui a aujourd’hui les faveurs de la communauté scientifique. Cette décussation ne concerne que les fibres innervant les muscles des membres innervés par la voie cortico-spinale mais pas les muscles faciaux qui sont innervés par la voie cortico-bulbaire. De plus, les régions corticales impliquées dans la réception et l’intégration des informations sensorielles telles que l’ouïe sont situées à l’interface entre l’organe sensoriel d’un côté donné et les régions corticales motrices innervant le côté opposé. Ainsi il est communément admis qu’il s’agirait de permettre une communication plus rapide entre ces régions corticales, en découlant de meilleurs réflexes de fuite du côté opposé à celui d’où l’animal perçoit la menace (S. Vulliemoz & al. ; 200523). Les axones moteurs, une fois la décussation subie, sont régionalisés au sein de la moelle épinière en fonction de la cible de leur projection. Les corps cellulaires des neurones spinaux constituent la substance grise et sont localisés au centre de la moelle. La substance blanche localisée en périphérie (à l’inverse du cerveau) concentre les axones majoritairement myélinisés pour assurer une conduction nerveuse plus rapide le long du corps. S’il existe quelques variabilités inter espèces, les axones gérant le tonus postural se situent au centre de la corne ventrale de la moelle épinière, suivant une voie dite « indirecte » ou réticulospinale tandis que les axones ciblant les membres inférieurs et postérieurs sont plus latéraux et suivent une voie dite « directe » (Figure 11).
Figure 12: Schéma d’un fuseau musculaire avec les efférences de l’α motoneurone et γ motoneurone innervant respectivement les fibres extrafusales et les pôles contractiles, les afférences du neurone sensoriel Ia sur les fibres intrafusales. Tiré de Neuroscience 3rd Edition
NB : En plus de ces voies, il existe chez l’humain d’autres voies descendantes, régulant les mouvements involontaires et réflexes, qui ne seront pas traitées ici car moins touchées par la neurodégénérescence pour les syndromes spastiques des membres inférieurs: les voies vestibulospinale, la voie rubrospinale (provient du noyau rouge et innerve les membres supérieurs) et tectospinale (ou colliculospinale, innervant la tête et le cou).
Aussi, plus le corps cellulaire du motoneurone spinal est proche de l’extrémité caudale de l’axe rostro-caudal, plus l’axone du neurone moteur est long, certains pouvant atteindre un mètre un long chez l’humain. Les extrémités des axones des neurones moteurs forment des synapses excitatrices (ou glutamatergiques car sécrétant du glutamate) avec les dendrites et corps cellulaires des motoneurones spinaux. Comme dans le cortex, il existe une circuiterie d’interneurones modulant localement l’activité des neurones spinaux et sensoriels via des synapses inhibitrices.
On peut classer les motoneurones spinaux en plusieurs catégories suivant la fibre
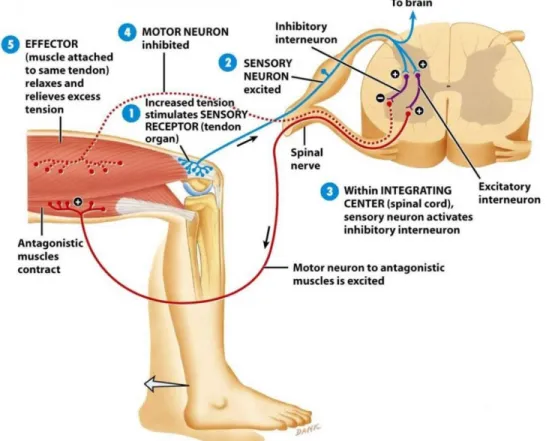
extrafusales qui sont responsables de la contraction musculaire à proprement parler ; les motoneurones qui innervent les extrémités (ou pôles contractiles) des fibres musculaires intrafusales, provoquant leur contraction. Les fibres musculaires intrafusales sont des fibres internes arrangées parallèlement aux fibres extrafusales (Figure 12). Elles agissent comme des récepteurs informant la moelle épinière de l’état de contraction de la fibre musculaire. Il existe aussi des fibres efférentes sensitives (Neurone sensoriel Ia, Figure 12 et 13) qui sont les plus gros axones des nerfs périphériques. Lors de l’étirement du muscle, il y a déformation des fibres intrafusales, qui vont activer des canaux ioniques des fibres afférentes sensorielles, provoquant la création d’un potentiel d’action le long de l’axone sensoriel jusqu’à la moelle épinière. Là, le neurone sensoriel possède des connections directes excitatrices avec l’α motoneurone homonyme (innervant le même muscle) et des connections indirectes et inhibitrices (via un interneurone GABAergique) avec l’α motoneurone antagoniste (innervant le muscle antagoniste) permettant une action parallèle sur le muscle homonyme et le muscle antagoniste. C’est ce qu’on appelle « l’innervation réciproque » et permet la contraction rapide car réflexe d’un muscle conjointement à l’étirement de son muscle antagoniste. On peut citer par exemple le réflexe d’étirement (Figure 13 et P.J. Delwaide & al. ; 198824). La plupart des neurones sensoriels contactent l’α motoneurone indirectement, via un interneurone excitateur ou inhibiteur.
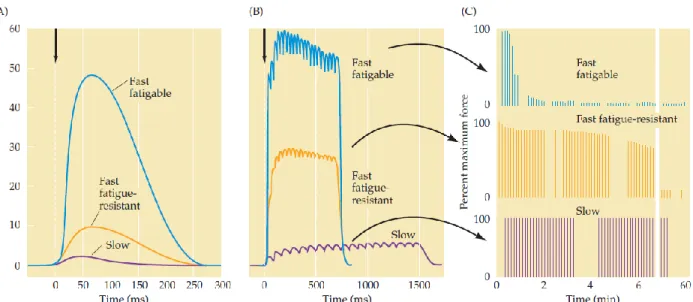
Une unité motrice est composée du corps cellulaire et prolongements du α motoneurone secondaire ainsi que de toutes fibres musculaires innervées par ce même motoneurone. On peut classer les différentes unités motrices en fonction de la taille et des capacités contractiles des fibres étudiées (voir Figures 14 et 15). Ces deux paramètres suffisent pour définir la fonction d’une unité motrice. Il existe :
_ Les unités motrices lentes (ou slow motor units, S-type), innervées par de « petits » motoneurones. Il s’agit principalement de petits muscles à la contraction faible et lente mais pouvant résister à de longues contractions sans fatiguer, ceci grâce à une forte concentration en myoglobine, en mitochondries, et en capillaires sanguins. Ce sont les plus recrutées pour maintenir la posture du corps par exemple. _ Les unités motrices rapides et fatigables (ou Fast fatigable Units, ou FFs type), à l’opposé des Slow units, sont recrutables très rapidement, mènent à une forte contraction de grosses fibres musculaires mais rapidement fatigable. Il s’agit de fibres recrutées principalement lors d’efforts physique intenses et importants tels que la course ou le saut.
_Les unités motrice rapides et résistantes à la fatigue (ou Fast-Fatigue-resistant units), de taille et de capacité contractile intermédiaire. Leur stimulation provoque une tension moins forte que les unités FFs mais bien plus résistantes à la fatigue (voir Figures 14 et 15)
Figure 14: Graphique schématique représentant les types et % de motoneurones secondaires recrutés en fonction de la force nécessaire pour exécuter l’action commandée par le cortex. Tiré de Neuroscience 3rd Edition
La répartition et l’innervation de ces unités motrices dépendent de leur rôle et taille. Par exemple, dans le soleus (ou muscle soléaire) -un muscle de petite taille situé à l’arrière de la jambe, près du talon, constitué majoritairement d’unités motrices de type S- qui possède majoritairement un rôle de maintien postural, un motoneurone innerve en moyenne 180 fibres musculaires. A l’inverse, dans le gastrocnemius (ou gastrocnémien)- un muscle de plus grande taille agissant de concert avec le soleus (on les appelle triceps sural) et devant assurer des mouvements plus soudains et nécessitant plus de force- est composé de petites et de grande unités motrices, un motoneurone peut innerver jusqu’à 2000 fibres musculaires.
Figure 15 : Force de recrutement et fatigabilité des différents types d’unités motrices (un seul motoneurone stimulé). A : Comparaison de la tension musculaire en réponse à un potentiel d’action unique. B : Idem queA avec une stimulation répétée. C : Stimulation répétée à une intensité évoquant la réponse maximale de l’unité motrice. Notez la différence de force recrutée dans les trois unités motrices et la vitesse de fatigue musculaire. Tiré de Neuroscience 3rd Edition et Burke & al.; 1974
Les maladies du Motoneurone
L’axe cortico-spinal et toutes les régions cérébrales avec lesquelles il interagit plus ou moins directement forment un système complexe dont de nombreux éléments peuvent être altérés à plusieurs niveaux : de la bonne propagation de l’influx nerveux le long des axones corticospinaux (impliquant des éléments pré et post-synaptiques) au métabolisme neuronal an passant par l’interaction avec les cellules gliales et interneurones ainsi que l’excitabilité intrinsèque des neurones moteurs et spinaux. Différentes maladies peuvent survenir lors de l’altération d’un ou plusieurs des éléments constituants l’axe corticospinal. Les plus connues sont la Sclérose Latérale Amyotrophique (SLA ou ALS) et les Paraplégies Spastiques Héréditaires (PSH ou HSP).
Figure 16 : Liste non exhaustive de la répartition des gènes dont des mutations mènent à une maladie du neurone moteur (upper motorneurone) ou spinal (lower motorneurone) ou les deux. Notez le chevauchement génétique de nombreuses pathologies telles que SPG11 pour les PSH complexes et la SLA ou BICD2 dans les HSP pures, complexes ou l’Atrophie musculaire spinale (SMA). Tirée de C. Tesson & al.; 2015
On appelle Maladies du Motoneurone toutes les maladies neurodégénératives dont les symptômes principaux sont signes de dégénérescence d’un/des deux motoneurones (Figure 16 et C. Tesson & al.; 201525). Suivant le pattern spatiotemporel de dégénérescence des motoneurones,
les symptômes observés peuvent varier d’une forme pathologique à l’autre et dépend aussi de l’atteinte d’autres types neuronaux dans les formes complexes. La variabilité des symptômes observés est aussi due à des causes environnementales et à une très forte variabilité des causes génétiques de ces maladies. De plus, il est observé un fort continuum génétique et symptomatique entre les différentes maladies du motoneurone (voir Figure 16). Par exemple des mutations sur BICD2 (codant pour une protéine impliquée dans le système de transport moléculaire médié par la Dynéine en assurant le rôle d’adaptateur à de nombreux complexes) mènent principalement à une Amyotrophie spinale (SMA) mais peuvent aussi provoquer certaines formes pures ou complexes de PSH (Oates & al. ; 201326, Neveling & al. ; 201327). des mutations sur le gène SPG18 (codant pour la protéine Erlin2 impliquée dans la dégradation de macromolécules médiée par le réticulum endoplasmique) affectant le neurone moteur peuvent causer aussi bien des formes de PSH que des Scléroses latérales primaires (AM Alazami & al. ; 201128, A. Al-Saif & al. ; 201229). Certains symptômes peuvent aider à distinguer quel motoneurone est affecté : notamment le signe de babinski (Table 2, Figure 17) et l’augmentation du tonus musculaire et hypereflexie sont des signes reflétant une atteinte du neurone moteur tandis que l’apparition de fasciculations, l’hyporeflexie, la perte de tonus musculaire et l’atrophie musculaire sont des signes attestant d’atteintes du motoneurone inférieur (table 2).
Table 2: Symptômes typiques d’atteintes du motoneurone inférieur ou supérieur. Tirée de Neuroscience, 3rd edition.
1) La dégénérescence du neurone moteur :
a) La Paraplégie Spastique Héréditaire (PSH)
Epidémiologie et symptômes
La paraplégie Spastique Héréditaire est la deuxième maladie du motoneurone la plus fréquente après la Sclérose Latérale Amyotrophique (SLA). Il s’agit d’une maladie d’origine génétique à transmission autosomique dominante, récessive ou liée à l’X ou encore mitochondriale (L. Parodi et al., 201730). Elle est présente sur tous les continents et sa prévalence globale est de 1,8/100000 personnes avec cependant une forte variabilité suivant l’aire géographique (Ruano & al.; 201431). Elle peut par exemple monter jusqu’à 7,4/100000 habitants en Norvège avec
principalement des formes dominantes (AK. Erichsen & al. ; 200932) ou à 5,7/100000 habitants en
Tunisie avec une majorité de formes récessives (A. Boukhris & al. ; 200933). Ses causes génétiques
sont très variables : des mutations sur plus de 80 loci et 70 gènes causant cette pathologie ont été découvertes à ce jour (C. Blackstone 201834). Le symptôme commun à toutes ses formes de la
maladie est une rigidité spastique progressive et symétrique des membres inférieurs provoquée par
Figure 17: Le signe de Babinski: le médecin stimule la voute plantaire du patient du talon vers les orteils. Le réflexe normal est, chez le nouveau né jusqu’à 6 mois environ, une extension dorsale des orteils (B) puis ce réflexe disparait pour être remplacé par un réflexe de flexion des orteils (A). Il s’agit d’un symptôme pathognomique d’une atteinte du faisceau pyramidal. Tirée de Neuroscience 3rd Edition
la dégénérescence du neurone moteur et menant à terme à une paralysie dite contractile. Cette spasticité est liée à des activités motrices réflexes normalement modulées par la voie cortico-spinale. D’un point de vue histologique, il y a dégénérescence de l’axone corticospinal projeté par le neurone moteur, menant à un isolement fonctionnel de la circuiterie spinale (voir figures 4 et 13). Les mécanismes de cette dégénérescence peuvent varier d’une forme de PSH à l’autre, mais il s’agirait d’un phénomène de « dying back » (Deluca & al. ; 2004). Au niveau neuronal, dans la majorité des formes de PSH, il n’y a pas de dégénérescence du neurone moteur. Dans certaines formes de la pathologie cependant, des études histologiques de tissus post-mortem de patients ont révélés que cette dégénérescence axonale pouvait être accompagnée ou suivie de la mort de neurones dans diverses régions cérébrales. Par exemple, il y a une forte perte neuronale dans le thalamus, le cortex frontal et la moelle épinière des patients SPG11. Cependant, il est difficile de tirer des conclusions générales sur la dégénérescence neuronale dans les PSH à cause du faible nombre de tissus post mortem de patients PSH ; de plus, parmi ces tissus, beaucoup proviennent de patients atteints de PSH sans précision de la forme de PSH. Enfin, certaines formes de la PSH réduisent l’espérance de vie au contraire d’autres, et/ou peuvent être associées à des comorbidités (formes complexes), il peut donc y avoir aussi un biais lors d’études histologiques par la confusion entre des altérations dues à l’âge, aux comorbidités et/ou à la PSH en elle-même.
La spasticité est souvent couplée à une augmentation du reflexe ostéo-tendineux et on observe la présence du signe de Babinski (voir Figure 17). Des études sur tissu post-mortem de patients PSH ont montré que les axones longs, dont la cible se situe dans la moelle lombaire, sont plus sensibles et dégénèrent en premier par rapport aux axones dont les cibles sont plus proximales (Deluca & al. ; 200435). Une faiblesse musculaire des mêmes membres est souvent observée, bien que
secondaire par rapport à l’hypertonie. De plus, les patients peuvent développer des pertes sensitives distales à différents degrés. Chaque forme de la pathologie présente des caractéristiques qui lui sont propres en termes d’âge de début, progression, symptômes, régions cérébrales atteintes, voies cellulaires impliquées. On peut cependant diviser ces formes en deux groupes :
_ Les formes pures (70-80% des cas) se caractérisant par des atteintes exclusivement motrices : hypertonie musculaire, Trouble sphinctériens et urinaires, tremblements et paralysie progressive. Dans ces formes la transmission est souvent autosomique dominante. Le gène le plus fréquemment muté est le gène SPG4 (40% des cas à transmission autosomique dominante, voir Figure 18) codant pour la Spastine. La PSH-SPG4 est parfois associée à des troubles cognitifs. Parmi les 60% restants, 10% des cas sont expliqués par des mutations dans le gène ATL1 (PSH-SPG3A) codant pour l’Atlastine-1. Le gène REEP1 (PSH-SPG31) est incriminé dans 4,5 à 10% des PSH pures. Enfin, des allèles pathologiques du gène KIF5A (PSH-SPG10) ont été observés dans 2,5% des cas. De plus, dans les formes pures, il est rare d’observer des atrophies cérébrales visibles à l’IRM.
_ Les formes complexes dans lesquelles les patients présentent en plus des troubles moteurs des formes pures, des atteintes cognitives et extraneurologiques : épilepsie, syndrome parkinsonien, ataxie, neuropathie, atteinte rétinienne… Ces formes présentent souvent une transmission autosomique récessive et le gène le plus fréquemment impliqué est le gène SPG11 (ou KIAA1840) (21% des cas à transmission autosomique récessive, voir Figure 18) (Ruano & al. ; 201431, C Tesson & al. ; 201536, G. Stevanin & al. ; 2007 et 200837,38) codant pour la Spatacsine. Les formes SPG5 et SPG7 comptent chacune pour 7% de ce groupe. De plus les patients peuvent développer
Figure18: Proportions des différents gènes impliqués dans l’apparition de formes autosomique dominantes (a) ou récessive (b). Tirée de C. Tesson & al.; 2015
des atteintes visibles à l’IRM telles qu’une atrophie du corps calleux, trait fréquent dans la forme SPG11.
Bases anatomiques et physiologiques de la spasticité et du signe de Babinski
La spasticité se caractérise par une augmentation de la résistance musculaire lors des mouvements causée par un réflexe d’étirement hyper réactif, une augmentation du tonus musculaire et l’apparition de contractions/relaxations involontaires lors de l’étirement du muscle (Burke & al. ; 197239). Cette augmentation de la résistance est transitoire lors d’un mouvement et disparait à la fin de la contraction musculaire, provoquant un phénomène appelé familièrement « le phénomène du couteau de poche » (clasp-knife phenomenon) car comme un couteau dépliable, la résistance lors d’un mouvement finit par disparaitre brutalement à la fin du dit-mouvement (Figure 19).
D’une manière générale, plusieurs mécanismes ne s’excluant pas l’un l’autre peuvent expliquer l’apparition de la spasticité. L’un d’origine spinale, l’autre supraspinale. Pour chacune de ces origines, il existe des mécanismes impliquant une perte d’inhibition et/ou un gain d’excitation (Figure 20).
Figure 19: Phénomène du couteau de poche : la spasticité se caractérise par une résistance musculaire au mouvement forcé qui se termine par un « effondrement » de cette résistance, phénomène caractéristique des sécurités sur les couteaux dépliables.
Pour les mécanismes spinaux d’excitation, il a été proposé que des modifications des propriétés membranaires des motoneurones α impacteraient leur excitabilité (J.C. Rekling & al. ; 200040, C.J Heckmann & al. ; 200341, C.H. Heckmann & al. ; 200542 ). Plus précisément, il pourrait
s’agir de courants entrants persistants (Persistent inward currents ou PICs) Ca2+ et/ou Na+. Si cette
hypothèse mécanistique a été émise entre autres chez le chat (D. Burke & al. ; 197243), on ne sait pas si elle est transposable à l’humain. Une deuxième hypothèse à retenir expliquant l’existence du signe de Babinski concerne une augmentation de la sensibilité des réflexes cutanés. Les neurones de la corne dorsale peuvent former des efférences longues distance ascendantes (rôle proprioceptif) ou de courte distance vers les motoneurones. Une lésion des fibres descendantes réticulospinales additionnée d’une perte d’inhibition locale par les interneurones GABAergiques peuvent perturber l’excitabilité des neurones sensitifs qui peuvent percevoir comme nocif un stimulus non nocif. A l’inverse, la surexcitation des interneurones propriospinaux (interneurones spinaux impactant différents segments de la moelle épinière impliqués dans l’intégration motrice et sensitive) peut mener à l’apparition de réflexes nociceptifs inappropriés (tels que le signe de Babinski).
En plus des mécanismes spinaux d’excitation, il peut y avoir des perturbations de l’inhibition spinale. Ces mécanismes ont la faveur de la communauté scientifique dans certaines pathologies. Notamment, une réduction de l’inhibition présynaptique de l’afférence du neurone sensitif Ia (voir Figure 20) peut entrainer une surexcitation secondaire du motoneurone α. Il s’agit là du mécanisme privilégié pour expliquer la spasticité chez des patients atteints de Sclérose en Plaques (J. Nielsen & al. ; 199544,45). De plus, Les voies motrices descendantes contactent
l’interneurone Ia ; ainsi, des dommages dans ces voies peuvent perturber l’activation de cet interneurone et ainsi diminuer l’inhibition spinale par ce mécanisme (appelé l’inhibition disynaptique réciproque médiée par l’interneurone Ia). Les autres mécanismes présentés dans la Figure 20 tels que l’inhibition récurrente par les cellules de Renshaw (un type d’interneurone
inhibiteur différent des interneurones Ia et Ib et permettant l’autoinhibition du motoneurone α) semblent ne pas être affectés chez la plupart des patients spastiques.
Les mécanismes supraspinaux (c’est-à-dire impliquant des régions cérébrales et donc les fibres motrices descendantes) sont particulièrement pertinents lorsqu’on étudie les maladies du neurone moteur telles que les PSH. La spasticité provoquée par ces mécanismes semble mettre en
jeu une perte d’inhibition exercée par le cortex sur la voie corticospinale et/ou sur le noyau vestibulaire (ou noyau de Deiters) et la formation réticulaire, impliqués dans les voies vestibulospinales et réticulospinales respectivement. Des lésions dans le cortex moteur seul ne suffisent pas à développer la spasticité, il faut que les dommages affectent aussi le cortex prémoteur et/ou les aires motrices supplémentaires. Les régions corticales de la motricité exercent un effet inhibiteur sur le tonus musculaire via la voie corticoréticulaire (et donc les fibres réticulospinales), on peut donc imaginer l’impact de lésions dans cette voie sur le développement de la spasticité. Pour ce qui concerne la voie vestibulospinale, on sait que ses fibres contactent en majorité des interneurones spinaux (mais aussi certains motoneurones spinaux) dans le but de maintenir un
Figure 20: Voies spinales pouvant être affectées lors du développement d'une spasticité. α : motoneurone alpha ;γ : motoneurone gamma. Tiré de A. Mukherjee & A. Chakravarty, 2010
certain tonus des muscles posturaux. Cependant, il semblerait que cette voie soit moins impliquée dans le développement de la spasticité que la voie réticulospinale (W. Fries & al. ; 199346)
Ainsi, de nombreux mécanismes peuvent mener à la spasticité et aux troubles des réflexes. Cependant, chez les patients atteints de PSH, la spasticité des membres inférieurs proviendrait de la perte d’inhibition des arcs réflexes spinaux médiée par les afférences corticales, elle-même causée par la dégénérescence (ou la déafférentation) du neurone moteur.
Diagnostic et traitements des PSH
Le chevauchement des symptômes et causes génétiques dans les différentes formes de maladies du motoneurone a imposé l’utilisation de puissants outils diagnostiques, tant cliniques que biologiques, et de proposer une nouvelle nosographie à ces maladies. Pour pouvoir conclure à une forme ou une autre de la PSH, il faut que le patient présente un syndrome pyramidal (associé ou non d’autres éléments caractéristiques de certaines formes) non inexplicable par d’autres causes telles que des anomalies structurales (tumeur, compression..) ou infections (HTLV1, SIDA…) ou d’autres pathologies chevauchantes comme une leucodystrophie ou une sclérose en plaque (nécessité de réaliser des IRM…).. De plus, vérifier l’historique clinique de la famille du patient peut beaucoup aider à discriminer certaines formes, surtout pour les maladies neurodégénératives héréditaires. Des biomarqueurs structurels existent pour certaines d’entre elles tels que l’atrophie du corps calleux dans certaines formes complexes de la pathologie, ou fonctionnels tels que l’étude du Potentiel Evoqué Moteur (PEM) et l’utilisation de techniques d’électrophysiologies (Geevasinga N & al. ; 201545). Enfin, le séquençage de l’ADN au niveau des gènes potentiellement
mutés dans telle ou telle pathologie, s’il révèle la présence d’allèles potentiellement pathogènes, permettra de confirmer le diagnostic.
Jusqu’à maintenant, seuls des traitements symptomatiques sont proposés aux patients : Injection de toxine botulique ou prise de myorelaxants tels que le baclofène pour traiter la spasticité par exemple (Synofzik and Schüle, 201747). La kinésithérapie et les exergames (jeux video pilotés par les mouvements du corps) permettent aussi de ralentir la progression de la pathologie.
Voies cellulaires impliquées
Dans sa revue de 2018, C. Blackstone48 résume les différentes voies cellulaires les plus souvent
atteintes dans cette pathologie (voir Figure 21). Parmi les voies les plus affectées, on notera : _ La fonction et l’intégrité des voies endolysosomales, une des voies les plus souvent impliquées, notamment avec la spatacsine (SPG11) et la spastizine (SPG15) que je décris plus en détail dans la partie dédiée. Cela concerne aussi la Spastine (SPG4), au contact entre le Réticulum Endoplasmique (RE) et les endosomes et dont l’absence est responsable de dysfonctions lysosomales (R Allison & al. ; 201749).
_ La fonctionnalité du transport axonal, très sensible à la longueur de l’axone avec KIF5A et KIF1A, qui codent pour des protéines de la famille des Kinésines ou encore la Spastine (SPG4) qui est impliquée dans les processus dynamiques de formations/déformations des microtubules et du RE via des interactions avec REEP1, Atlastine1 et reticulon 1 (J.C. Lindsey & al. ; 200050, 49Evans et al. 200651, Mannan et al. 200652, Sanderson et al. 200653, Park et al. 201054)
Figure 21: Répartition des différents gènes impliqués dans la pathogénèse des PSH en fonction des fonctions biologiques de leur protéines respectives. ER : Réticulum Endoplasmique Tiré de C. Blackstone, 2018
_ Le métabolisme lipidique avec CYP2U1 (SPG56) (CM. Durand & al. ; 201855, Citterio A &
al. ;201456, C. Tesson & al. ; 201257) étudiée dans notre laboratoire et CYP7B1 (SPG5) impliquées
dans le métabolisme des acides gras à longue chaine et du cholestérol respectivement.
_ Les fonctions mitochondriales car la transmission nerveuse est un processus particulièrement couteux en énergie. On citera la Paraplégine (SPG7) une ATPase mitochondriale dont la dysfonction provoque une des formes le plus courantes de PSH complexe ainsi que quelques formes pures avec atrophie cérébelleuse (Cesnekova J & al. ; 201858, Coarelli G & al. ; 201959) . _ Le façonnage des différents compartiments intracellulaires avec l’Atlastine 1 (SPG3A), une GTPase impliquée dans le traffic entre le RE et l’appareil de Golgi, ainsi que la signalisation médiée par BMP et deuxième cause la plus courante de PSH pure (A. Abel & al. ; 200460, Zhu P-P & al. ; 200661 et 201462).
b) Le cas de la PSH de type 11 (SPG11)
Epidémiologie
La paraplégie spastique de type 11 tire son origine de mutations sur le gène SPG11 (Figure 22) situé sur le chromosome 15q13-15 ; il s’agit d’une forme très particulière de la PSH. Elle représente 6,7 % des formes familiales de la PSH et 20% des formes à transmission autosomique récessive. Il s’agit d’une forme très sévère, à progression lente, fatale entre 30 et 40 ans après le
Figure 22: Répartition et nature des différentes mutations responsables de PSH-SPG11 recensées sur le gène SPG11. Notez la surabondance de mutations dans l’exon 32 Adaptée de G. Stevanin & al. ; 2008
décennie (De Bot & al. ; 201363). La
particularité première de cette pathologie est la dégénérescence des deux motoneurones et non seulement du premier. De plus, les patients développent en grande majorité des formes complexes de la PSH, mais aussi un syndromes parkinsoniens (M. Anheim & al.; 200964, A. Guidubaldi & al. ;201165), une ataxie (G. Stevanin & al. ; 200866), un déclin cognitif et retard mental (G. Stevanin & al. ; 200737 & 200866), des épilepsies (Al-Yahyaee & al. ; 200667), des dysphagies et des pertes visuelles (De Souza & al. ;2017), des neuropathies sensorielles (KN. Karle & al. ; 201368), une forme de sclérose latérales amyotrophiques juvéniles (Orlacchio & al.; 201069) et des symptômes proches de la sclérose en plaques (M. Mukai & al. ; 201870). On appelle d’ailleurs ALS5 la forme de SLA juvénile médiée par SPG11. A ce jour, il est difficile d’expliquer pourquoi certains patients vont développer une PSH tandis que d’autres vont développer une SLA juvénile par la seule génétique, il est possible que l’environnement ou des gènes facilitateurs puissent influer sur la pathologie développée. Si des mutations sur le gène SPG11 peuvent mener à des formes juvéniles de Parkinsonisme, des chercheurs ont évalué l’intégrité du système dopaminergique chez les patients SPG11 et ont révélé une dégénérescence de la substance noire ainsi qu’une baisse de la densité du transporteur de la dopamine. Certains patients SPG11 présentent une amélioration significative de leur état grâce à la L-DOPA (E. Kara & al. ;201671), au contraire d’autres (I. Faber & al. ; 201872). A l’IRM, on peut observer une atrophie du corps calleux chez les patients SPG11 (voir Figure 23). Cette atrophie est considérée comme un symptôme développemental de la HSP-SPG11 car elle serait due à l’incapacité des projections corticofugales à trouver leur cible (J.K. Fink, 201370). On parle alors d’agénésie (ou hypoplasie) du corps calleux. Toutefois, chez certains patients, l’atteinte de cette structure est tardive, voire même n’apparait jamais. Au niveau histologique, des pertes neuronales ont été observées dans le CNS de nombreux patients SPG11, notamment le thalamus, le cortex frontal (neurones pyramidaux ou cellules de Betz) et la moelle épinière. A ce sujet, la PSH-SPG11 est
Figure 23: Image IRM en coupe sagittale d’un cas contrôle (gauche) et d’un patient atteint de PSH- SPG11 avec Atrophie du corps calleux (droite, flèche blanche). Tirée de F. Franco da Graça & al. ; 2019