THESE
En vue de l’obtention du
DOCTORAT DE L’UNIVERSITE DE TOULOUSE
Délivré par l’Université Paul SabatierDiscipline ou spécialité : Pathologie et Nutrition
Présentée et soutenue par Séverine BRUNET
Le 28 Novembre 2008
Titre :
Analyse des mécanismes d’action antiparasitaire de plantes riches en substances polyphénoliques sur les nématodes du tube digestifs des ruminants.
JURY
Mme Isabelle FOURASTE- Professeur Emérite de l'Université de Toulouse Mme Irene MUELLER-HARVEY - Directeur de Recherche à l'Université de Reading
M Michel NICOLE - Directeur de Recherche au centre IRD de Montpellier M Stig Milan THAMSBORG - Professeur de l'Université de Copenhagen
M Hervé HOSTE - Directeur de Recherche à l'INRA Toulouse
Ecole doctorale : Sciences Ecologiques, Vétérinaires, Agronomiques et Bioingéneries (ED 458) Unité de recherche : UMR 1225 INRA/DGER Interactions Hôte-Agent Pathogène
Cette thèse est dédiée à mes parents, Isabelle et Marc Brunet,
à ma sœur Linda et à mon frère Thomas.
Cette thèse représente l’aboutissement du soutien et des
encouragements qu’ils m’ont prodigués tout au long de ma scolarité.
REMERCIEMENTS
Je remercie le Dr. Hervé Hoste de l’équipe ‘Interaction tanins-nématodes digestifs’ de l’UMR 1225 INRA/DGER ‘Interaction Hôte-Agent Pathogène’, pour avoir dirigé mes travaux de recherche. Je lui suis extrêmement reconnaissante pour ses conseils judicieux, ses (nombreuses) corrections de mes manuscrits sans lesquelles je n’aurais pas à ce jour 4 articles publiés, et pour m’avoir permise de présenter nos résultats lors du congrès international de la WAAVP en Août 2007. Je tiens à le remercier pour sa disponibilité, son enthousiasme, sa bienveillance et la confiance qu’il m’a témoignée dés le premier jour.
Je souhaite remercier le Pr. Stig Milan Thamsborg de la ‘Royal Veterinary and Agricultural University of Denmark’ et le Dr. Michel Nicole de l’UMR ‘Résistance des plantes aux bio-agresseurs’ du centre IRD de Montpellier d’avoir accepté d’être rapporteurs de mon travail de thèse.
J’adresse mes plus sincères remerciements au Pr. Isabelle Fouraste de la Faculté des Sciences Pharmaceutiques de Toulouse et au Dr. Irene Mueller-Harvey de l’‘University of Reading’ (Angleterre) qui ont bien voulues faire partie de mon comité et de mon jury de thèse. Je les remercie pour leur intérêt pour mon travail et pour m’avoir fait bénéficier de leurs conseils et de leur avis éclairé.
Cette étude a pû être réalisée grâce à l’appui et à la collaboration de nombreuses personnes, tant en France qu’à l’étranger. Je tiens donc également à remercier :
Les membres de l’équipe ‘Interaction tanins-nématodes digestifs’, Fotini Manolaraki, Angélique Serre et Marie-Emmanuelle Sanchez pour leur amitié et les formidables journées (et soirées) passées ensemble, et Eric Pardot pour sa bonne humeur.
Le Pr. Michel Franc et le personnel du département de Parasitologie de l’Ecole Nationale Vétérinaire de Toulouse pour m’avoir accompagnée au quotidien pendant ces trois années.
Le Pr. François Schelcher et le personnel de l’UMR 1225 INRA/DGER ‘Interactions Hôte-Agent Pathogène’ pour leur sympathie et les services rendus.
Les animaliers de l’Ecole Nationale Vétérinaire de Toulouse, Jean-Marc Delmas et Corrine Fabreguette, pour les soins quotidiens aux chèvres.
Isabelle Fourquaud et le personnel du ‘Centre de Microscopie Electronique Appliquée à la Biologie’ de l’Université Paul Sabatier pour m’avoir initiée à la microscopie électronique à transmission et pour la préparation de mes nombreux échantillons (Article 5). J’exprime ici ma plus grande gratitude à Isabelle pour sa sympathie et la persévérance dont elle a fait preuve pendant ces trois années de collaboration.
L’équipe de l’UMR 152 IRD/UPS ‘Pharmacochimie des substances naturelles et pharamacophores redox’ pour m’avoir toujours accueillie dans leur laboratoire avec amitié et pour leur aide précieuse lors des extractions et des dosages.
Le Dr. Jocelyne Aufrère et le personnel du centre INRA de Theix pour leur collaboration et leur aide salvatrice lors de la réalisation du protocole in vivo avec les moutons canulés (Article 2).
Le Dr. Sylvie Hounzangbe-Adote de l’Université d’Abomey-Calavi (Benin), pour les bons moments partagés pendant son séjour en France.
Le Dr. Felipe Torres-Acosta, le Dr. Carlos Sandoval-Castro, le Dr. Armando Aguilar-Caballero et le personnel de la ‘Facultad de Medicina Veterinaria y Zootecnica de Mérida’ (Mexique), pour m’avoir si aimablement accueillie dans leur école et pour leur prévenance à mon égard. Je tiens à remercier particulièrement Cintli Martinez-Ortiz de Montellano, Nadia Ojeda-Robertos, Lorèna Canul-Ku et Miguel Alonzo-Diaz, dont l’enthousiasme et les nombreux efforts ont rendu possible la réalisation du protocole in vivo de l’Article 1. Je leur adresse ici un ‘Muchas Gracias’ pour leur précieuse amitié et pour les merveilleux moments passés au Mexique en leur compagnie.
Le Dr. Dieter Treutter, le Pr. Walter Feucht, le Dr. Michael Neum ller, les étudiants et le personnel du ‘Center of Life and Food Science’ de la ‘Technische Universität München’ (Allemagne) pour leur aimable accueil, leur bonne humeur et leurs judicieux conseils lors de l’adaptation des méthodes histochimiques aux larves (Article 6). Je tiens à remercier tout particulièrement Ionelas Regos pour sa gentillesse naturelle et son amitié. En bref, je leur dis ‘Thausend Dank’ pour les semaines passées ensemble !
Le Dr. Irene Mueller-Harvey et le personnel du ‘Department of Agriculture’ de l’‘Universitiy of Reading’ (Angleterre) pour m’avoir permise d’effectuer mes analyses biochimiques et pour leur intérêt pour mon travail. J’adresse ici un ‘Thank you very
much’ à Marina Dobreva, Elisabetta Stringano et An Gea pour la bonne ambiance de travail et pour leur amitié.
Le Pr. Frank Jackson du ‘Moredum Research Institute’ (Ecosse) pour ses précieux conseils lors de la mise en place du protocole ‘In vitro Direct Challenge’ au sein de notre laboratoire, ainsi que pour ses corrections du manuscrit de l’Article 4.
Je tiens à remercier tout particulièrement ma famille. A mes parents, je leur exprime ici un ‘immense merci’ pour leur amour, leur générosité, leur soutien inconditionnel et leur confiance en moi. Je remercie aussi très chaleureusement ma sœur Linda et son compagnon Gaël, et mon frère Thomas pour leur affection, leur foi en mon travail et leurs encouragements qui m’ont été si précieux au cours de ces trois dernières années.
Je remercie aussi tous mes amis et tous mes proches qui, chacun à sa manière, de prés ou de loin, m’ont soutenue durant mes années scolaires et universitaires.
Enfin, notre travail de thèse a été réalisé grâce au soutien financier de :
Le Ministère de l’Enseignement Supérieur et de la Recherche et l’école doctorale SEVAB, par l’attribution d’une allocation ministérielle de recherche ;
L’Union Européenne, par le projet Marie-Currie ‘Healthy Hay’ (Projet MRTN_CT-2006-035805) ;
La région Midi-Pyrénnées (Contrat 030321196) ;
Le programme ECOS Nord France-CONACYT-ANNUIES, Mexico (Projet M03-A03), par le financement du voyage et du séjour au Mexique en 2006 ;
L’Université Paul Sabatier de Toulouse, par l’octroi d’une bourse de voyage à l’étranger (Bourse ATUPS);
La Société Française de Parasitologie et le Comité des Sciences Biologiques, par l’attribution d’une bourse de voyage pour le congrés en Belgique.
LISTE DES PUBLICATIONS
Les différents travaux de recherche menés au cours de cette thèse ont fait l’objet des publications suivantes :
Articles intégrés dans la thèse :
Brunet, S. and Hoste, H. (2006). Monomers of condensed tannins affect the
larval exsheathment of parasitic nematode of ruminants. Journal of Agricultural and Food Chemistry 54, 7481-7487.
Brunet, S., Aufrere, J., El Babili, F., Fouraste, I. and Hoste, H. (2007). The
kinetics of exsheathment of infective nematode larvae is disturbed in presence of tannin-rich plant (Sainfoin) both in vitro and in vivo. Parasitology 135, 1-10.
Brunet, S., Jackson, F. and Hoste, H. (2008). Effects of sainfoin (Onobrychis viciifolia) extract and monomers of condensed tannins on the association of abomasal nematode larvae with fundic explants. International Journal for Parasitology 38, 783-790.
Brunet, S., Martinez-Ortiz de Montellano, C., Torres-Acosta, J.F.J,
Sandoval-Castro, C.A., Aguilar-Caballero, A.J., Capetillo-Leal, C. and Hoste, H. (2008). Effect of
the consumption of Lysiloma latisiliquum on the larval establishment of
gastrointestinal nematodes in goats. Veterinary Parasitology 157, 81-88. Autres articles :
Hoste, H., Torres-Acosta, J.F.J., Alonso-Diaz, M.A., Brunet, S. and Houzangbe-Adote, S. (2008). Identification and validation of bioactive plants for the control of gastrointestinal nematodes in small ruminants. Tropical Biomedecine 25, 56-72.
Alonso-Diaz, M.A., Torres-Acosta, J.F.J., Sandoval-Castro, C.A., Capetillo-Leal, C., Brunet, S. and Hoste, H. (2008). Effects of four tropical tanniniferous plant extracts on the inhibition of larval migration and the exsheathment process of Trichostrongylus colubriformis infective stage. Veterinary Parasitology 153, 187-192.
TABLE DES MATIERES
REMERCIEMENTS ... 1
LISTE DES PUBLICATIONS ... 6
TABLE DES MATIERES ... 7
INTRODUCTION ... 11
LISTE DES ABREVIATIONS... 12
CONTEXTE BIBLIOGRAPHIQUE ... 13
1. Les nématodes gastro-intestinaux des ruminants ... 14
1.1 Généralités sur les nématodes gastro-intestinaux ... 14
1.1.1 Cycle biologique ... 15
1.1.2 Biologie des larves infestantes ... 17
1.2 Epidémiologie descriptive des strongyloses gastro-intestinales ... 19
1.2.1 Conditions d’infestation des animaux ... 19
1.2.2 Fluctuations des infestations ... 19
1.3 Epidémiologie analytique des strongyloses gastro-intestinales ... 20
1.3.1 Importance de la source de contamination ... 20
1.3.2 Facteurs liés au contact entre l’hôte et les larves infestantes ... 21
1.3.3 Facteurs liés à l’hôte ... 22
1.4 Conséquences des strongyloses gastro-intestinales chez les ruminants ... 26
1.4.1 Impact sur la production ... 26
1.4.2 Tableau clinique des strongyloses gastro-intestinales ... 27
1.4.3 Mécanismes physiopathologiques ... 27
2. Les anthelminthiques de synthèse et leurs limites ... 30
2.1 Classification des anthelminthiques de synthèse ... 30
2.1.1 Les benzimidazoles et les pro-benzimidazoles ... 31
2.1.2 Les imidazothiazoles et les tétrahydropyrimidines ... 32
2.2 Limites d’utilisation des anthelminthiques de synthèse ... 33
2.2.1 Ecotoxicité des anthelminthiques ... 33
2.2.2 Restrictions d’emploi des anthelminthiques ... 33
2.2.3 Résistance des nématodes gastro-intestinaux aux anthelminthiques ... 34
2.3 Prévenir l’apparition des résistances aux anthelminthiques ... 38
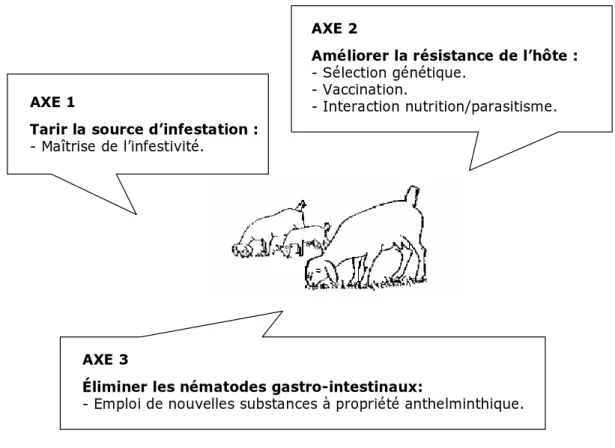
3. Les méthodes alternatives aux anthelminthiques de synthèse ... 41
3.1 Tarir la source de contamination des animaux ... 42
3.1.1 La rotation des parcelles ... 42
3.1.2 Les méthodes de dilution ... 42
3.1.3 La décontamination active des pâturages ... 43
3.2 Améliorer la résistance de l’hôte ... 44
3.2.1 La sélection d’animaux génétiquement résistants ... 44
3.2.2 La vaccination ... 45
3.2.3 L’amélioration de la ration de l’hôte ... 46
3.3 Eliminer les nématodes gastro-intestinaux ... 48
3.3.1 L’utilisation de l’oxyde de cuivre ... 48
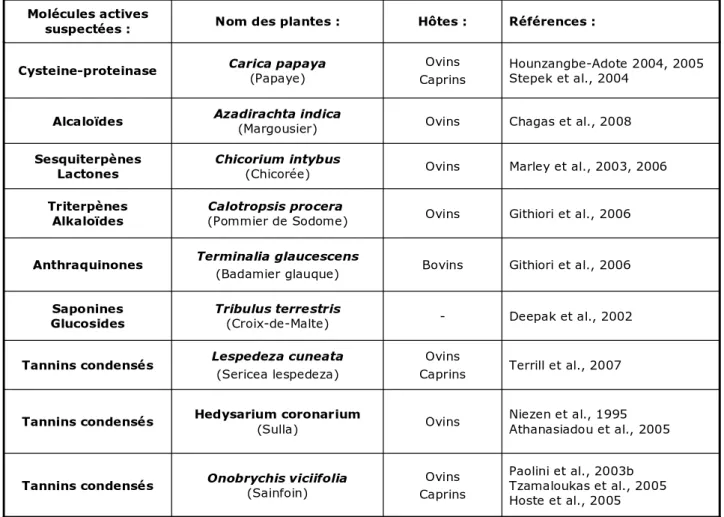
3.3.2 L’exploitation de plantes à propriétés anthelminthiques ... 49
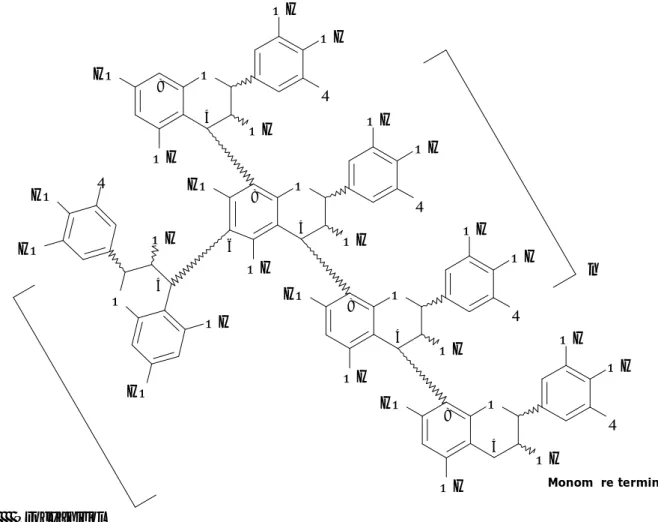
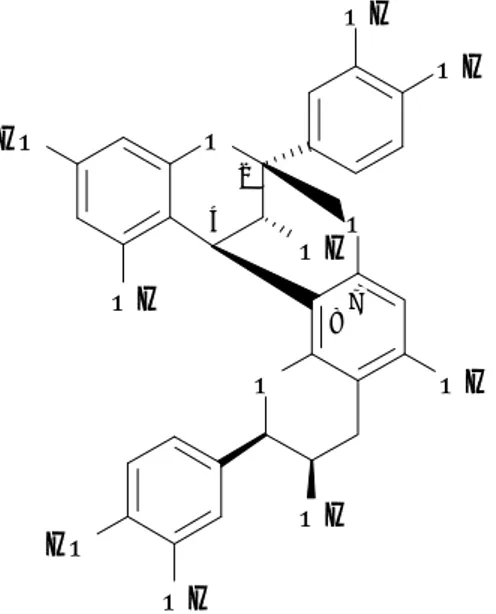
4. Les tannins ... 52
4.1 Généralités et définition ... 52
4.2 Propriétés des tannins ... 52
4.2.1 Les propriétés physico-chimiques des tannins ... 52
4.2.2 Les propriétés biologiques des tannins ... 54
4.3 Classification biochimique des tannins ... 55
4.3.1 Les tannins hydrolysables ... 56
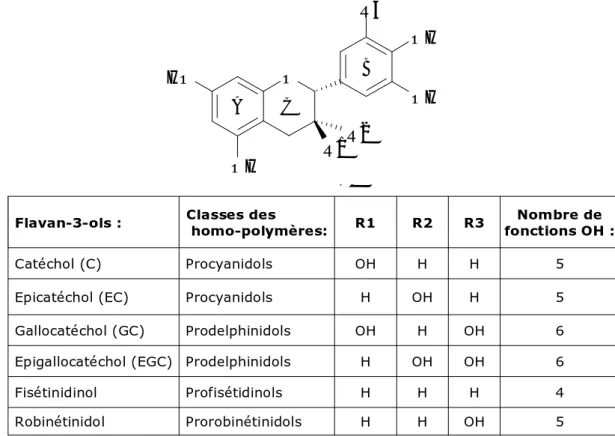
4.3.2 Les tannins condensés ... 57
4.4 Analyses biochimiques des tannins ... 62
4.4.1 Dosages des tannins totaux ... 62
4.4.2 Dosages spécifiques et analyses des tannins hydrolysables ... 63
4.4.3 Dosages spécifiques et analyses des tannins condensés ... 63
4.5 Plantes à tannins ... 65
4.6 Rôle des tannins dans les plantes ... 65
4.8 Facteurs de variation de la teneur en tannins ... 67
4.8.1 L’espèce végétale et la variété ... 67
4.8.2 La partie végétale ... 67
4.8.3 Le stade végétal ... 67
4.8.4 Les conditions environnementales ... 68
5. Les effets des tannins chez les ruminants non-parasités ... 69
5.1 Effets des tannins hydrolysables ... 69
5.2 Effets des tannins condensés ... 70
5.2.1 Effets bénéfiques des tannins condensés ... 71
5.2.2 Effets néfastes des tannins condensés ... 75
5.2.3 Palier aux effets néfastes des tannins condensés ... 77
6. Les effets des tannins condensés sur les nématodes gastro-intestinaux 81 6.1 Etudes in vitro... 81
6.1.1 Extraits totaux de plantes riches en tannins ... 83
6.1.2 Extraits de plantes traités avec un inhibiteur de tannins ... 85
6.1.3 Tannins condensés purifiés ... 85
6.1.4 Monomères des tannins condensés ... 86
6.2 Etudes in vivo ... 87
6.2.1 Etudes en condition d’infestations expérimentales ... 87
6.2.2 Etudes en condition d’infestations naturelles ... 91
6.3 Variabilité des effets des tannins condensés ... 94
6.3.1 Facteurs liés à l’hôte ... 94
6.3.2 Facteurs liés aux nématodes gastro-intestinaux ... 95
6.3.3 Facteurs liés aux sources de tannins condensés exploitées... 96
6.4 Modes d’action des tannins condensés ... 99
6.4.1 Effet indirect des tannins condensés ... 99
6.4.2 Effet direct des tannins condensés ... 100
ETUDE PERSONNELLE ... 102
LES OBJECTIFS ... 103
ARTICLE 1 : Effets de la consommation d’une plante riche en tannins (Lysiloma
latisiliquum) sur l’installation larvaire des nématodes gastro-intestinaux chez les chèvres. 104
PARTIE II : Etude des modifications fonctionnelles ... 115
ARTICLE 2 : La cinétique du dégainement des larves infestantes des nématodes gastro-intestinaux est perturbée in vitro et in vivo en présence d’un extrait de plante riche en tannins (sainfoin). ... 115
ARTICLE 3 : Les monomères des tannins condensés affectent le dégainement des larves des nématodes parasites des ruminants. ... 128
ARTICLE 4 : Effets d’un extrait de sainfoin (Onobrychis viciifolia) et des monomères de tannins condensés sur la pénétration des larves de nématodes abomasaux dans des explants fundiques. 138 PARTIE III : Etude des modifications structurelles ... 149
ARTICLE 5 : Modifications ultra-structurales des larves infestantes de nématodes parasites des ruminants après contact avec un extrait de sainfoin (Onobrychis viciifolia). ... 149
PARTIE IV : Etude des interactions ... 175
ARTICLE 6 : La gaine des larves infestantes des nématodes parasites est la cible des flavonoïdes du sainfoin. ... 175
SYNTHESE ET DISCUSSION GENERALE ... 197
CONCLUSIONS ET PERSPECTIVES ... 213
INTRODUCTION
La compréhension des mécanismes d’action des tannins condensés (TCs) sur les nématodes gastro-intestinaux (GIs) représente un véritable défi scientifique. Dans le contexte actuel de la propagation des résistances aux principaux anthelminthiques (AHs) de synthèse dans les populations parasitaires, elle a également des conséquences agronomiques et économiques non négligeables. En effet, une meilleure compréhension des mécanismes d’action des TCs et des facteurs de variation permettrait à l’avenir de promouvoir une utilisation plus pertinente des plantes bioactives riches en TCs pour la maîtrise du parasitisme GI chez les ruminants.
Notre travail de thèse a principalement concerné l’étude et la caractérisation des effets des TCs sur les larves infestantes (L3s) des nématodes GIs des petits ruminants.
Dans la première partie de ce mémoire, nous présenterons le contexte bibliographique de ce travail de recherche. Nous y exposerons successivement les caractéristiques de l’infestation des petits ruminants par les nématodes GIs, les AHs de synthèse actuellement employés pour contrôler les infestations et les limites actuelles à leur utilisation ainsi que les solutions de luttes alternatives envisagées. Enfin, nous détaillerons les caractéristiques des tannins, et particulièrement des TCs, et leurs effets sur le parasitisme GI décrits lors d’études menées en conditions in vitro et in vivo.
La deuxième partie de cette thèse, correspondant à notre étude personnelle, sera consacrée à la confirmation de l’effet inhibiteur des TCs sur l’installation des L3s chez les chèvres, à la détermination de l’effet des TCs sur les fonctions et sur l’ultra-structure des L3s, et enfin, à l’étude préliminaire des interactions entre les TCs et les L3s.
Enfin, nous terminerons ce travail par une discussion de nos résultats, suivie par les perspectives envisagées.
LISTE DES ABREVIATIONS
AH Anthelminthique C Catéchol (catechin) Da(s) Daltons DMACA -Diméthylaminocinnamaldéhyde EC Epicatéchol (epicatechin)EGC Epigallocatéchol (epigallocatechin)
g Gramme
GC Gallocatéchol (gallocatechin)
GI(s) Gastro-intestinal(aux)
HCl Acide chlorhydrique
HPLC Chromatographie en phase liquide à haute performance
Kg Kilogramme
L3s Larves de stade 3
MET Microscopie électronique à transmission
MS Matière sèche
OPG Œufs par gramme
PC Procyanidol (procyanidin)
PD Prodelphinidol (prodelphinidin)
PEG Polyéthylène glycol
PM Poids moléculaire
PRP(s) Protéine(s) riche(s) en proline
PVPP Polyvinyl polypyrrolidone
RMN Résonnance magnétique nucléaire
TCs Tannins condensés
THs Tannins hydrolysables
1. Les nématodes gastro-intestinaux des ruminants
1.1 Généralités sur les nématodes gastro-intestinaux
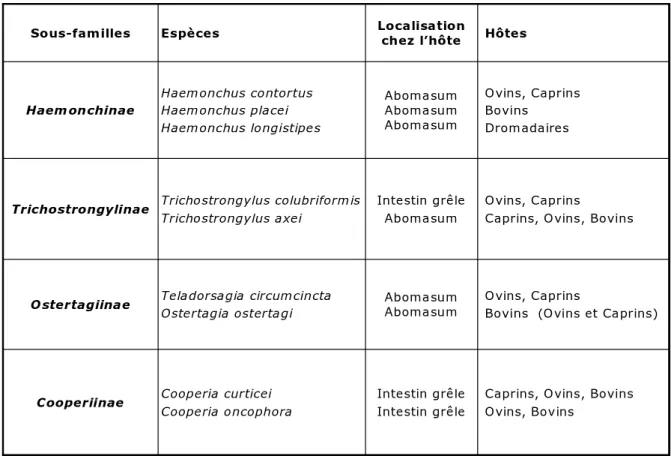
Chez les ruminants, les nématodes parasites du tractus digestif les plus prévalents, communément appelés strongles gastro-intestinaux (GIs) ou strongles digestifs en médecine vétérinaire, appartiennent à l’ordre des Strongylidea et à deux familles distinctes : les Trichostrongyloidea (principaux genres : Teladorsagia, Cooperia, Trichostrongylus et Haemonchus) et les Strongyloidea (genre : Oesophagostomum) (Euzéby, 1963; Urquhart et al., 1996; Hoste et al., 1999) (Tableau 1).
Tableau 1. Principales espèces de trichostrongles gastro-intestinaux des ruminants et leur localisation dans le tube digestif.
Caprins, Ovins, Bovins Ovins, Bovins Intestin grêle Intestin grêle Cooperia curticei Cooperia oncophora Cooperiinae Ovins, Caprins
Bovins (Ovins et Caprins) Abomasum Abomasum Teladorsagia circumcincta Ostertagia ostertagi Ostertagiinae Ovins, Caprins
Caprins, Ovins, Bovins Intestin grêle Abomasum Trichostrongylus colubriformis Trichostrongylus axei Trichostrongylinae Ovins, Caprins Bovins Dromadaires Abomasum Abomasum Abomasum Haemonchus contortus Haemonchus placei Haemonchus longistipes Haemonchinae Hôtes Localisation chez l’hôte Espèces Sous-familles
Les strongyloses GIs sont souvent dues à plusieurs espèces parasites dans les divers organes du tube digestif.
Les nématodes GIs ont une distribution mondiale avec des prédominances d’espèces variables selon les grandes zones climatiques.
En zones tempérées, les trichostrongles les plus fréquemment retrouvés dans les élevages de petits ruminants exploitant le pâturage sont Telardorsagia circumcincta (espèce abomasale) et Trichostrongylus colubriformis (espèce intestinale) (Chartier et Reche, 1992; Gasnier et al., 1997; Etter et al., 2000a; O’connor et al., 2006). Haemonchus contortus, une autre espèce de l’abomasum, est moins fréquent dans les élevages des zones tempérées.
En zones tropicales et sub-tropicales, H.contortus est très largement réparti et très pathogène (Urquhart et al., 1996; Chartier et al., 2000c; O’connor et al., 2006). T. colubriformis est également retrouvés dans les élevages des régions tropicales (Chartier et al., 2000c).
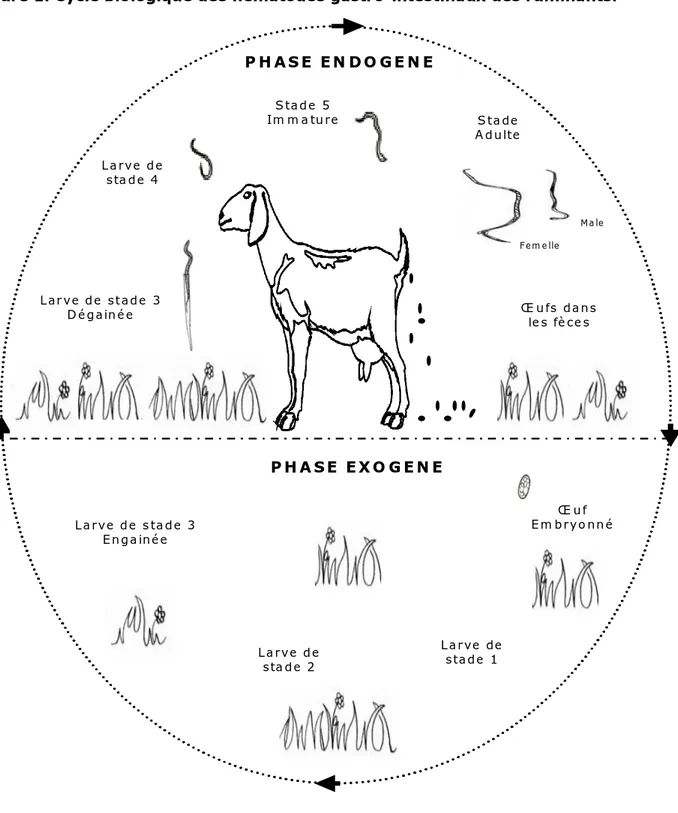
1.1.1 Cycle biologique
Le cycle biologique des nématodes GIs des ruminants est monoxène (un seul hôte). Il comprend deux phases : une phase libre dans le milieu extérieur (également appelée phase exogène) et une phase parasitaire chez l’hôte (ou phase endogène) (Urquhart et al., 1996; Jacquiet, 1997; Chartier et al., 2000c) (Figure 1).
La phase libre
La phase exogène du cycle des nématodes GIs débute avec l’élimination des œufs pondus par les vers femelles dans les fèces de l’hôte. Les œufs sont ainsi répandus sur le sol (prairies). Lorsque les conditions environnementales sont favorables (température minimale de 10°C et taux d’humidité de 60%), les œufs s’embryonnent et éclosent, libérant des larves de stade 1 (L1s) (Euzéby, 1963; Smith et Sherman, 1994; Urquhart et al., 1996). Après l’éclosion, les L1s évoluent au travers de deux mues pour devenir des larves infestantes (L3s).
Les stades intermédiaires L1 et L2 sont peu résistants dans le milieu extérieur contrairement aux œufs et aux L3s. En fonction des conditions environnementales, les L3s peuvent survivre sur un pâturage plusieurs mois en zones tempérées grâce à leurs réserves lipidiques, alors qu’en zones tropicales ou sub-tropicales, la survie des L3s est de l’ordre de quelques semaines (Urquhart et al., 1996; O’connor et al., 2006).
Figure 1. Cycle biologique des nématodes gastro-intestinaux des ruminants. L a rv e d e sta d e 4 L a rv e d e sta d e 2 L arve de stad e 1 S ta de A d ulte S tad e 5 Im m a tu re L ar v e d e st ad e 3 D é g ain é e Œ u f E m b ry o nn é L a rv e d e s ta d e 3 E n g a in é e Œ u fs dans le s fè ce s F em e lle P H A S E E N D O G E N E P H A S E E X O G E N E M a le La phase parasitaire
La phase parasitaire commence par l’ingestion des L3s par l’hôte lors du pâturage. Dans le tube digestif, les L3s se libèrent d’abord de leur gaine, ce qui marque la transition entre la vie libre et la vie parasitaire (Rogers et Sommerville, 1968; Sommerville et Rogers, 1987; Hertzberg et al., 2002). Les L3s dégainées pénètrent ensuite dans la muqueuse digestive où elles muent en larves 4 (L4s). Les L4s muent une dernière fois pour donner le stade 5, également appelé stade
pré-adulte ou juvénile. Le passage au stade pré-adulte correspond à l’acquisition de la maturité sexuelle. Après fécondation, les femelles pondent des œufs excrétés dans les matières fécales de l’hôte (Euzéby, 1963).
En hiver ou durant une longue période sèche, il est fréquent que les L4s s’enkystent dans la muqueuse digestive retardant ainsi leur développement (phénomène d’hypobiose larvaire) et reprennent leur évolution au printemps ou à la saison des pluies suivante (Euzéby, 1963; Smith et Sherman, 1994; Chartier et al., 2000c).
La chronologie du développement des stades parasites des nématodes GIs diffère en fonction de l’espèce, de l’importance de l’infestation et de l’hôte (résistance). Le temps écoulé entre l’ingestion des L3s par l’hôte et la première ponte d’œuf par les vers est appelée la période prépatente. En l’absence d’hypobiose larvaire, la période prépatente dure généralement de 2 à 3 semaines pour la plupart des espèces parasites chez les ovins et les caprins, alors qu’elle dure jusqu’à 5 semaines pour certaines espèces chez les bovins, telles que Oesophagostomum radiatum (Urquhart et al., 1996).
1.1.2 Biologie des larves infestantes
Sur le pâturage, les L3s des nématodes GIs possèdent une gaine (exuvie), vestige de la cuticule de la L2. Grâce à la présence de cette gaine, les L3s sont très résistantes aux conditions extérieures (O’connor et al., 2006). La durée de la survie des L3s dépend de l’espèce, des conditions climatiques et de leur localisation dans le milieu. Pour Haemonchus contortus, les L3s subsistent de 10 à 15 semaines au printemps et seulement 3 à 4 semaines pendant un été chaud et sec. Les mousses et les matières fécales offrent des conditions optimales de survie pour les L3s en créant des micro-climats favorables (Rogers et Sommerville, 1963; O’connor et al., 2006).
Le stade 3 est également très résistant aux agents chimiques et aux agents biologiques. Néanmoins, elles sont naturellement en concurrence vitale avec d’autres organismes, tels que les bactéries et certains champignons (Paraud, 2006).
Les L3s sont très mobiles. Elles se déplacent horizontalement et verticalement sur l’herbe suivant un hygrotropisme positif (recherche d’humidité), un phototropisme négatif (fuite d’une trop forte lumière) et selon un géotropisme négatif (élévation au dessus du sol) (Euzéby, 1963; Rogers et Sommerville, 1963). Cette mobilité les rend plus accessibles à l’ingestion et augmente leur chance de parasiter les ruminants.
incapables de se nourrir et épuisent leurs réserves par ces mouvements (Rogers et Sommerville, 1963; O’connor et al., 2006).
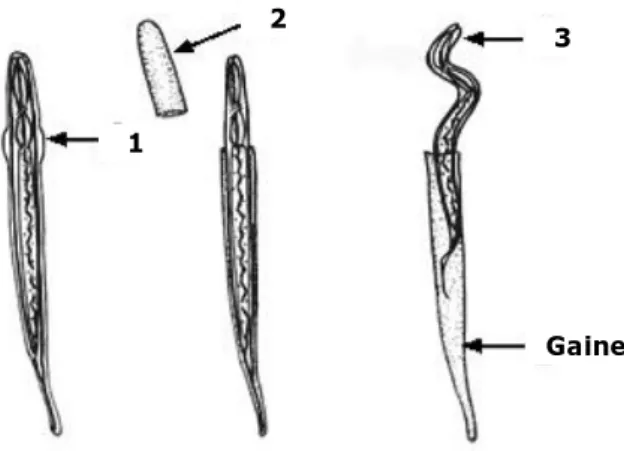
L’infestation de l’hôte par les L3s débute par le dégainement, c'est-à-dire la perte active de la gaine. Ce phénomène s’opère dans la portion du tube digestif qui précède le segment où s'établissent les adultes (Hertzberg et al., 2002). Ainsi, les L3s des espèces abomasales se dégainent dans le rumen alors que les espèces intestinales se dégainent dans l’abomasum (Rogers et Sommerville, 1963; Rahman et Collins, 1990a). Le dégainement a été décrit comme un processus restreint dans le temps (Dakkak et al., 1981; Hertzberg et al., 2002; De Rosa et al., 2005). Par exemple, des études ont montré que la majorité des larves d’H.contortus sont dégainées 60 à 80 minutes après leur ingestion par l’hôte (Dakkak et al., 1981; Hertzberg et al., 2002).
Le dégainement est un phénomène actif en réponse à certains stimuli tels l’exposition à un environnement riche en dioxyde de carbone, la valeur de pH (neutre pour H.contortus et acide pour Trichostrongylus colubriformis) ou la variation de température lors de l’ingestion (Rogers et Sommerville, 1963 et 1968). Ces stimuli induisent la sécrétion par des cellules glandulaires de la L3 et l’excrétion par des pores excréteurs d’un fluide riche en protéases et acétylcholinestérases (Rogers, 1982; Mallet et Lesage, 1987). Le dégainement s’opère ensuite en 3 étapes successives : 1) la formation d’un anneau indenté dans la partie antérieure de la gaine ; 2) la digestion et la séparation de la coiffe du reste de la gaine ; 3) la sortie de la L3 (Rogers et Sommerville, 1963; Gamble et al., 1989) (Figure 2).
Figure 2. Les étapes du dégainement des larves infestantes des trichostrongles gastro-intestinaux des ruminants.
3 2
Gaine 1
1.2 Epidémiologie descriptive des strongyloses gastro-intestinales
1.2.1 Conditions d’infestation des animaux
Les infestations des ruminants par les nématodes GIs dépendent de la conduite des animaux au pâturage puisque la phase de vie libre de ces strongles ne peut se dérouler que sur la prairie et que les ruminants s’infestent par les L3s présentes sur l’herbe (Chartier et al., 1992). Les animaux élevés à l’intérieur, sans contact avec des animaux ayant pâturé, et recevant du foin ou de l’ensilage, ne sont normalement pas infestés par des L3s (Chartier et al., 1992). Néanmoins, la distribution de fourrage frais contaminé peut être source potentielle d’infestation.
La notion d’infestivité correspond à la quantité de L3s présentes sur une parcelle. L’infestivité dépend du nombre d’œufs déposés, de leur vitesse de développement et de la survie des L3s. L’intensité de l’infestation de l’hôte dépend du nombre de L3s ingérées mais aussi des caractéristiques de l’hôte (réceptivité).
1.2.2 Fluctuations des infestations
Les infestations par les nématodes GIs montrent des fluctuations saisonnières qui sont dues aux variations de contamination de la prairie par les animaux parasités mais également, aux variations saisonnières qui influent sur le développement des œufs en L3s et sur la survie des L3s sur la prairie (O’connor et al., 2006).
En zones tempérées, les pics d’infestation ont été décrits essentiellement au printemps (mai à juillet) et en automne (octobre à décembre) (Hoste et al., 1999; Chartier et Hoste, 2004; Paolini, 2004). Une étude réalisée dans des élevages caprins français a montré un parasitisme constant tout le long de l’année avec un pic d’excrétion fécal en automne (Etter et al., 2000a). En zones tropicales, deux pics d’infestations existent : le premier après la reprise des pluies et le second après une longue période de saison sèche (Euzéby, 1963; Chartier et al., 2000c).
Les conditions climatiques rencontrées à ces périodes, telles un fort taux d’humidité et des températures propices, favorisent l’éclosion des œufs et le développement des L3s. Au contraire, les œufs embryonnés n’évoluent pas lors d’hivers froids ou d’étés très chauds et secs (Coyne et Smith, 1992).
1.3 Epidémiologie analytique des strongyloses gastro-intestinales
Les niveaux d’infestation des ruminants par les nématodes GIs dépendent de plusieurs facteurs liés au pâturage, aux risques de contact entre l’hôte et les L3s infestantes et à l’hôte.
1.3.1 Importance de la source de contamination
Comme mentionné, la fluctuation saisonnière du parasitisme GI des animaux est étroitement associée aux facteurs climatiques influant sur le développement des œufs en L3s et sur la survie des L3s (Rogers et Sommerville, 1963).
Par ailleurs, le niveau de contamination des prairies dépend aussi de facteurs liés à l’espèce de nématodes GIs (niveau d’excrétion d’œufs, développement et survie des L3s) et de l’intensité d’exploitation des prairies.
Niveau d’excrétion d’œufs :
La contamination des prairies est d’autant plus importante que l’excrétion des œufs de nématode par l’hôte l’est. Or, les espèces de trichostrongles digestifs n’ont pas la même prolificité (Chartier et al., 2000c). Les femelles d’H.contortus sont très prolifiques (5 000 à 10 000 œufs par femelle et par jour) par rapport à celles de T.colubriformis et de T.circumcincta (quelques centaines d’œufs par femelle et par jour).
Développement des œufs :
Des conditions optimales de température et d’humidité (temps chaud et humide) permettent le développement accéléré des œufs sur la prairie (O’connor et al., 2006). L’humidité et l’oxygénation induisent l’éclosion des œufs et la température influe sur la vitesse de développement en L3s (Rossanigo et Gruner, 1994). En fonction des espèces de nématodes GIs, la température optimale est comprise entre 23 et 28°C et le pourcentage d’humidité optimal entre 60 et 70%. De plus, les œufs de T.colubriformis semblent plus résistants au froid que ceux d’H.contortus (Smith et Sherman, 1994; O’connor et al., 2006).
Survie des L3s sur les prairies :
Comme pour l’éclosion des œufs, la survie des L3s sur la prairie est directement liée aux conditions de température et d’humidité (Smith et Sherman, 1994; Jacquiet, 1997; Etter et al., 2000a; O’connor et al., 2006). En fonction des espèces de nématode, cette survie varie de quelques semaines en zones tropicales à 12 mois en zones tempérées (Chartier et al., 2000c).
Le gel ou la dessiccation accélèrent la mort des L3s. Néanmoins, l’enfouissement de certaines L3s dans le sol leur permet de survivre malgré des températures très basses (Smith et Sherman, 1994). Ces formes ‘trans-hivernantes’ contribueront à la réinfestation des animaux au printemps suivant (Smith et Sherman, 1994; Etter et al., 2000a).
Niveau de chargement des prairies :
La contamination des prairies est étroitement liée au niveau de chargement et au temps d’exploitation des parcelles (Smith et Sherman, 1994; Etter et al., 2000a; Hoste et al., 2001a). Cependant, la relation entre le chargement des prairies et les infestations ne semble pas linéaire (Thamsborg et al., 1999).
1.3.2 Facteurs liés au contact entre l’hôte et les larves infestantes
Les contacts entre l’hôte et les L3s sont à l’origine de l’infestation des animaux. Ils dépendent du comportement des L3s et de celui des hôtes.
Mobilité des L3s :
Les L3s des nématodes GIs sont très mobiles en phase liquide. Elles se déplacent sur l’herbe suivant un phototropisme négatif et un hygrotropisme positif (Rogers et Sommerville, 1963). Les deux moments favorables aux infestations sont alors l’aube et le crépuscule, lorsque l’ensoleillement est réduit et quand la rosée recouvre l’herbe (Smith et Sherman, 1994).
Comportement de l’hôte :
Deux principaux modes de comportements ont été décrits chez les ruminants qui contribue à réduire l’ingestion de L3s de nématodes GIs.
Des différences de préférence alimentaire entre les espèces de ruminants influencent le niveau d’infestation. En effet, pour des raisons liées au comportement des L3s, les risques d’infestation sont réduits lors de l’exploitation d’arbustes ou de buissons. A l’inverse, la consommation d’herbe est propice au contact avec les L3s. Ce constat expliquerait en partie que, sur parcours ou environnement pastoral, les chèvres (comportement de cueilleur) soient généralement moins infestées que les moutons (comportement de brouteur) (Vercruysse, 1983; Smith et Sherman, 1994; Hoste et Chartier, 1998; Hoste et al., 2001b).
Par ailleurs, même les animaux décrits comme des brouteurs, tels les ovins, des comportements acquis existent. L’évitement des zones riches en matières fécales semble un comportement très marqué chez les animaux parasités, qui conduit à de moindres infestations (Hutchings et al., 2003).
1.3.3 Facteurs liés à l’hôte
Résistance et résilience
La résistance est définie comme l'aptitude de l’hôte à mettre en place et maintenir des réponses qui modifient la biologie des vers en limitant leur installation, développement ou reproduction, ou en provoquant l’élimination de populations établies (Douch et al., 1996; Hoste et al., 2006). Elle semble indissociable de la réponse immunitaire.
La résilience est l'aptitude de l’hôte à supporter les effets pathologiques du parasitisme GI et à maintenir une production malgré les infestations (Bisset et al., 1994; Douch et al., 1996; Woolaston et Baker, 1996; Baker et al., 1998; Hoste et al., 2006). La résilience est définie comme la capacité d’un hôte parasité à surpasser les effets du parasitisme GI (Hoste et al., 2006).
Mécanismes de l’immunité
Deux types de réponses immunitaires (innée ou acquise) ont été évoqués pour expliquer la résistance de l’hôte aux infestations par les nématodes GIs
La réponse innée correspond à l’aptitude de l’hôte à réguler les populations de vers par des mécanismes non-spécifiques tels que des particularités physiologiques (mouvements péristaltiques, pH gastrique, sécrétion de mucus) et une grande
réactivité inflammatoire (phagocytose, système du complément, sécrétion de cytokines) (Lacroux, 2006).
La réponse acquise fait suite à des infestations préalables. C’est une réponse plus tardive mais plus spécifique du nématode GI concerné. Chez les ovins et les caprins, cette réponse immunitaire serait associée au rôle des lymphocytes T de type TH2– CD4+ qui produisent des interleukines de type IL-4, IL-13, IL-5 et IL-9 (Karanu et al., 1997) et des lymphocytes B (Pérez et al., 2001; Pérez et al., 2008). Une mastocytose tissulaire, des taux élevés de globules leucocytes, une éosinophilie sanguine et tissulaire et une production accrue d’anticorps (majoritairement de type Ig1, IgA et IgE) ont également été décrits lors d’infestations par les trichostrongles GIs (Rahman et Collins, 1990b; Balic et al., 2000; Pérez et al., 2003; Lacroux, 2006).
Facteurs de variation de la résistance
Age et Expérience vis-à-vis des infestations :
De manière générale, les jeunes animaux sont les plus sensibles et réceptifs aux infestations. Néanmoins, le facteur ‘Age’ serait plus discriminant chez les ovins et les bovins que chez les caprins (Urquhart et al., 1996). Ces différences de réceptivité selon l’âge seraient surtout liées à l’acquisition d’une immunité à la suite des infestations répétées (Smith et Sherman, 1994; Urquhart et al., 1996; Hoste et al., 1999; Chartier et al., 2000c).
Espèce animale :
L’espèce de l’hôte module la réceptivité aux nématodes GIs. De manière générale, à la suite d’infestations répétées par les trichostrongles GIs, la réponse immunitaire observée est moins efficace chez les caprins que chez les ovins et les bovins (Smith et Sherman, 1994; Hoste et al., 1999).
Race et lignée :
Des différences inter-races et inter-lignées (intra-races) de résistance aux nématodes GIs ont été largement décrites chez les ovins (Gruner et al., 1994; Lahlou Kassi et al., 1994; Gauly et Erhardt, 2001; Bishop et Morris, 2007). Des différences de niveaux d’infestation entre races et lignées de chèvres ont également été mises en évidence (Patterson et al., 1996b; Patterson et al., 1996a; Hoste et al., 2001b;
caprins sont contradictoires et l’origine des différences reste mal définie. Hoste et al. (2001b) ont suggéré qu’à côté de la réponse immunitaire, le comportement alimentaire serait une composante importante à prendre en considération chez les caprins.
Alimentation :
Le parasitisme GI peut être perçu comme une maladie nutritionnelle (Cf. Chapitre 1.4) car il induit une baisse d’appétit, des perturbations de la physiologie du tube digestif ainsi qu’une réorientation du métabolisme de l’hôte (Urquhart et al., 1996; Fox, 1997; Hoste et al., 2005b).
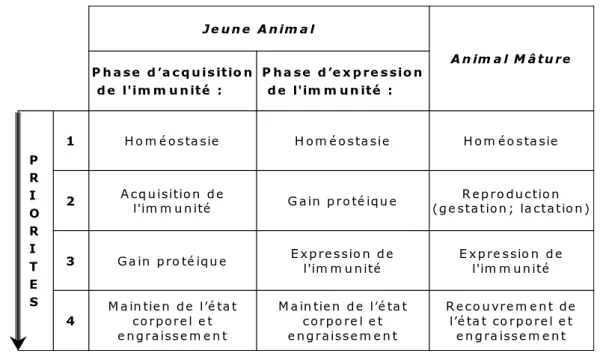
En raison même de l’importance de ces conséquences nutritionnelles, il est logique que la qualité ou la quantité de la ration offerte à l’hôte pour couvrir ses besoins soient considérées comme des facteurs majeurs influant sur sa capacité de réponse aux infestations. Coop and Kyriazakis (1999) ont décrit les priorités métaboliques des animaux (Tableau 2).
Tableau 2. Les priorités métaboliques chez les animaux parasités selon Coop et Kyriazakis (1999 et 2001). P R I O R I T E S P h a s e d ’e x p re s sio n d e l'im m u n ité : P h as e d ’a c q u is itio n d e l'im m u n ité : H o m éo s ta sie H o m é o s ta sie H o m é o s ta sie 1 R ep ro du c tio n (g e station ; la ctatio n ) G ain p ro té iqu e A c q u isition d e l'im m u n ité 2 E x p re ssio n d e l'im m u n ité E x p res sio n d e l'im m u n ité G a in p ro té iqu e 3 R ec o u vre m e n t de l’é ta t co rp o rel e t e n g ra iss e m e n t M a in tien d e l’é ta t c orpo re l e t e n g raiss e m e n t M a in tien d e l’é ta t co rporel e t e n g raiss e m e n t 4 A n im a l M âtu re Je u n e A n im a l
Pour tous les animaux, la première priorité métabolique est le maintien de l’homéostasie, c'est-à-dire le maintien des protéines constitutives de l’organisme. L’ordre des priorités métaboliques suivantes varie en fonction de l’âge et du statut
parasitaire de l’animal. A l’inverse, les conséquences d’un déficit alimentaire seraient différentes chez les jeunes animaux en phase d’acquisition ou d’expression de l’immunité, et chez les animaux adultes. Lors d’infestations par les nématodes GIs, la conséquence d’une malnutrition se traduirait surtout par un retard de croissance chez les jeunes en phase d’acquisition de l’immunité, et par une moindre capacité de l’hôte à contrôler le parasitisme chez les jeunes ou les adultes en phase d’expression de l’immunité.
Ce modèle permet d’expliquer comment des corrections ajustées des déséquilibres par apport de facteurs nutritionnels limitants (supplémentation en énergie ou en protéines) conduisent à moduler les conséquences du parasitisme et de la résistance de l’hôte. De même, le modèle explique pourquoi plusieurs facteurs physiologiques, modifiant les besoins de l’hôte et leur couverture par la ration, influencent la réceptivité et la résilience de l’hôte au parasitisme GI.
Statut physiologique :
Chez les brebis ou les chèvres en gestation, des augmentations d’excrétion fécale d’œufs (OPG) de nématodes ont été couramment observées autour de la mise bas, le phénomène étant décrit comme le ‘periparturient rise’ (Rahman et Collins, 1992; Smith et Sherman, 1994; Hoste et al., 1999; Bishop et Stear, 2001).
Ces pics d’excrétion seraient dus à un relâchement du système immunitaire des femelles en fin de gestation et en début de lactation, lié à des déficits nutritionnels (surtout protéique) provoqués par les changements métaboliques chez ces femelles et par l’augmentation de leurs besoins (Rahman et Collins, 1992; Hoste et al., 1999; Etter et al., 2000a; Coop et Kyriazakis, 2001).
Effet de la parité :
Quelques études ont montré des niveaux d’OPG différents en fonction de la parité chez les ovins (Haile et al., 2007) et les caprins (Morris et al., 1997; Hoste et al., 1999). Néanmoins, Etter et al. (2000a) n’ont pas observé de différences d’OPG entre les primipares et les multipares.
L’effet de la parité serait étroitement liée à l’âge et au premier contact avec les nématodes car, en pratique, les jeunes femelles ne sortent pas ou peu avant leur première mise-bas et, ainsi, ne sont pas en contact avec les L3s.
Niveau de production :
Une réceptivité accrue au parasitisme GI et des conséquences pathologiques plus sévères ont été décrites à plusieurs reprises chez les animaux présentant les meilleurs niveaux de production (Chartier et Hoste, 1994; Hoste et al., 1999; Etter et al., 2000a; Veneziano et al., 2007). Chez ces animaux les plus performants, ces niveaux d’infestation plus élevés seraient dus à une plus forte consommation d’herbe lors du pâturage conduisant à une infestation plus importante. Toutefois, comme pour le ‘periparturient rise’, l’hypothèse de déséquilibres alimentaires exacerbés, liés à des besoins nutritionnels plus élevés, a également été envisagée et en partie démontrée par des expériences de supplémentation ajustées (Etter et al., 2000b).
1.4 Conséquences des strongyloses gastro-intestinales chez les ruminants
Chez les ruminants, les conséquences des strongyloses GIs diffèrent selon le niveau d’infestation de l’hôte. En général, les strongyloses digestives évoluent sous forme chronique, d’expression subclinique, entrainant des déficits de productions chroniques. Néanmoins, lors de fortes infestations, le parasitisme GI peut entraîner d’abord l’apparition de signes cliniques voire la mort chez les animaux les plus sensibles.
Les conséquences dépendent, d’une part, de facteurs liés à l’hôte tels que l’espèce, l’âge ou la malnutrition comme précédemment évoqués, et d’autre part, de facteurs liés aux nématodes, tels que le nombre de vers, la nature ou le nombre d’espèces présentes dans les divers organes digestifs. Toutefois, le niveau d’infestation reste le facteur le plus important.
1.4.1 Impact sur la production
Chez les ruminants, en terme économique, les strongyloses GIs sont reconnues, à l’échelle mondiale, comme une des premières pathologies en raison des pertes de production majeures qu’elles entrainent. En élevage, la présence des vers influence à la fois la quantité et la qualité des productions.
De multiples études ont montré que le parasitisme GI est responsable de retard de croissance des jeunes animaux (Urquhart et al., 1996) que ce soit chez les agneaux (Kyriazakis et al., 1996) ou les chevreaux (Torres-Acosta, 1999) qui se
traduisent par des réductions de poids de carcasse à l’abattage. De même, des modifications de la qualité des carcasses ou de la viande (taux de gras réduit; rétention d’eau) ont été décrites à la suite d’infestations par les nématodes GIs (Sykes et Coop, 1976 et 1977).
Chez les femelles laitières, les infestations par les trichostrongles digestifs ont été régulièrement associées à des baisses de production de lait (Hoste et Chartier, 1993; Chartier et Hoste, 1994; Veneziano et al., 2007) et, de manière plus rare, à des modifications de la composition du lait (Chartier et Hoste, 1994), observées principalement chez les plus fortes productrices.
Enfin, de multiples exemples en Australie et en Nouvelle-Zélande ont illustré les baisses de production et les altérations de la qualité de la laine (plus fine et plus cassante), observées chez les animaux parasités (Knox et al., 2006).
1.4.2 Tableau clinique des strongyloses gastro-intestinales
L’évolution des strongyloses digestives est généralement chronique. L’état des animaux évolue peu à peu et peut conduire à la mort. Auparavant, des symptômes généraux apparaissent tels une baisse d’appétit, un amaigrissement progressif, une asthénie ou des signes de malnutrition (Urquhart et al., 1996). Les signes de gastro-entérites accompagnées de diarrhées aiguës sont également très fréquents (Rahman et Collins, 1990b).
De plus, des symptômes plus spécifiques peuvent aussi être constatés en fonction des nématodes en cause (Urquhart et al., 1996; Brugère-Picoux, 2004). Ainsi, dans le cas d’infestation par des nématodes hématophages, tels que H.contortus, des signes d’anémie et des œdèmes peuvent apparaître (Rahman et Collins, 1990b; Smith et Sherman, 1994; Urquhart et al., 1996; Jacquiet, 1997). En effet, il a été estimé qu’un mouton parasité par 5000 H.contortus perdait l’équivalent de 250mL de sang par jour (Urquhart et al., 1996).
1.4.3 Mécanismes physiopathologiques
Les baisses de production et les symptômes observés chez les animaux parasités s’expliquent par des perturbations de la physiologie digestive. Les principaux processus pathologiques impliqués ont été largement décrits. A l’inverse, les mécanismes pathogéniques à la base de ces perturbations restent mal identifiés.
Effets sur la physiologie digestive
Diminution de l’ingestion :
Les infestations par les nématodes GIs s’accompagnent généralement d’une baisse d’appétit. Dans le cas d’infestation massive, cette perte d’appétit peut aller jusqu’à une anorexie quasi totale (Urquhart et al., 1996; Hoste et al., 1997; Kahn et Diaz-Hernandez, 2000; Knox et al., 2006).
Mal-digestion et malabsorption :
Les nématodes présents dans les différents organes du tube digestif causent des lésions au niveau des épithéliums. Au niveau de l’abomasum, la présence des vers est associée à des modifications des glandes gastriques et à une réduction de la densité de cellules différenciées, en particulier les cellules à HCl. Dans l’intestin, une abrasion des villosités et une altération sévère des entérocytes sont les principales lésions décrites (Hoste et al., 1997).
Ces modifications structurales ont d’importantes répercussions fonctionnelles, en particulier des conséquences sur la digestion des aliments et l’absorption des nutriments dans les différents organes digestifs. Le parasitisme GI induit une augmentation du pH gastrique entrainant une moindre efficacité de la pepsine et une profonde déplétion des activités enzymatiques intestinales. De plus, il est également à l’origine d’une l’altération de la perméabilité des épithéliums (Hoste et al., 1997). Enfin, des perturbations du péristaltisme réduisant le temps de contact du chyme avec les muqueuses ont aussi été signalées (Hoste et al., 1997).
La conjonction de ces phénomènes affectant les structures et les fonctions digestives est à l’origine d’une mal-digestion des aliments et d’une malabsorption des nutriments (Rahman et Collins, 1991; Hoste et al., 1997; Coop et Kyriazakis, 2001; Knox et al., 2006).
Modification et réorientation des métabolismes :
Les effets du parasitisme GI sur l’appétit et la digestion sont amplifiés par une réorientation des métabolismes (Hoste et al., 1997).
Le résultat global des réductions d’ingestion et d’absorption est une diminution des apports nutritionnels. En parallèle, la présence des vers augmente les besoins nutritionnels de l’hôte pour maintenir l’homéostasie sanguine et l’intégrité des épithéliums digestifs et développer une réponse immunitaire (Fox, 1997; Kahn et Diaz-Hernandez, 2000; Coop et Kyriazakis, 2001; Kyriazakis et Houdijk, 2006). Il en
résulte une réquisition des nutriments, en particulier les protéines, vers les sites endommagés par les vers au détriment des sites habituels de synthèse (mamelle, follicule pileux, muscle), ce qui accroît les pertes de production. Une forte perturbation du métabolisme protéique découle alors du parasitisme par les nématodes GIs (Fox, 1997; Hoste et al., 1997; Hoste et al., 2005b).
De même, Knox et al. (2006) ont suggéré que les métabolismes du phosphore, du calcium et du fer sont modifiés par la présence des vers.
Les mécanismes pathogéniques
Les perturbations pathophysiologiques résultent d’une part d’effets mécaniques et d’autre part, d’effets liés aux produits d’excrétion-sécrétion des nématodes GIs.
Les effets mécaniques :
Les lésions des muqueuses digestives sont dues en partie à un effet mécanique des nématodes lors de la fixation des nématodes aux épithéliums, les vers pouvant dissocier ou endommager les tissus digestifs de l’hôte à l’aide de structures anatomiques spécialisées (Hoste et al., 1997). Certaines espèces des Strongylidae (Chabertia ovina par exemple) présentent une capsule buccale développée équipée de dents qui leur permettraient de se fixer aux épithéliums digestifs (Euzéby, 1963; Urquhart et al., 1996). Chez les Trichostrongyloidae, la capsule buccale est réduite et seule l’espèce hématophage Haemonchus contortus présente une néoformation dentale. Toutefois, pour les espèces intestinales, telles Trichostronsgylus spp., un effet abrasif de la cuticule du vers sur les cellules absorbantes a été suggéré (Durette-Desset, 1985; Hoste et al., 1997).
Effets des produits d’excrétion-sécrétion :
La majorité des nématodes GIs libèrent dans leur environnement des produits d’excrétion-sécrétion (E/S) de nature biochimique variée, en particulier des protéines dont certaines présentent une activité enzymatique (protéase, acétylcholinestérases) (Rogers, 1982; Mallet et Lesage, 1987; Hoste et al., 1997). Le rôle de ces produits E/S reste mal connu, mais leur intervention dans l’installation des L3s, le développement, la nutrition et la reproduction des vers chez l’hôte est largement suspecté. Certaines des molécules libérées sont ainsi toxiques pour les cellules de l’hôte et contribueraient à la genèse des perturbations pathophysiologiques (Euzéby, 1963; Hoste et al., 1997).
2. Les anthelminthiques de synthèse et leurs limites
La maîtrise des strongyloses GIs des ruminants repose traditionnellement sur l’administration répétée de molécules anthelminthiques (AHs) de synthèse. Un AH idéal peut être défini comme un traitement multivalent, non-toxique et rapidement éliminé par l’hôte, facile d’administration et d’un coût raisonnable. Pendant de nombreuses années, les AHs de synthèse se sont avérés efficaces. Cependant, l’utilisation de ces molécules rencontre désormais de plus en plus de limites.
2.1 Classification des anthelminthiques de synthèse
Les AHs de synthèse peuvent être classés en différentes familles selon leur mode d’action. En médecine vétérinaire, trois grandes familles d’AHs à large spectre sont utilisées chez les ruminants : les benzimidazoles et les pro-benzimidazoles, les imidazothiazoles et les lactones macrocycliques (Tableau 3).
Les benzimidazoles et les pro-benzimidazoles sont efficaces contre les strongles GIs et respiratoires. Certaines molécules présentent également une activité douvicide. Les imidazothiazoles et les tétrahydropyrimidines sont actifs contres les vers GIs et pulmonaires. Les lactones macrocycliques sont également appelées endectocides car elles sont actives à la fois contre les nématodes GIs et certains ectoparasites (acariens ou insectes) (Smith et Sherman, 1994; Urquhart et al., 1996; Beugnet et al., 1997; Bengone-Ndong et Alvinerie, 2004).
Enfin, certaines molécules AHs à spectre étroit, tel que le closantel dirigé contre H.contortus, sont également utilisées en médecine vétérinaire.
Tableau 3. Principales molécules actives contre les strongles des petits ruminants. Canaux ioniques SGI / SR Insectes Acariens Doramectine Eprinomectine Ivermectine Moxidectine Lactones macrocycliques Récepteurs à l’acétylcholine SGI / SR Lévamisole Pyrantel Morantel Imidazothiazoles et Tétrahydropyrimidines -Tubuline SGI / SR SGI / SR SGI / SR SGI SGI SGI / SR /douve Oxfendazole Fébantel Fenbendazole Thiabendazole Mébendazole Nétobimin Benzimidazoles et Pro-benzimidazoles Cibles suspectées chez les vers : Spectre d’activité : Structure chimique de base: Représentants : Familles : Lévamisole Ivermectine Thiabendazole
Légende : SGI: strongles gastro-intestinaux; SR : strongles respiratoires. N S N O O O CH3 CH3 CH3 O O O H CH3 OH O C H3 CH3 O C H3 O O CH3 O C H3 O H O CH3 N N H S N
2.1.1 Les benzimidazoles et les pro-benzimidazoles
Cette famille regroupe de nombreux représentants qui présentent une structure chimique commune (Tableau 3).
Ces molécules sont administrées par voie orale uniquement. Ils sont commercialisés sous forme de solution, de bolus ou incorporés dans des blocs de compléments minéralo-vitaminiques (Smith et Sherman, 1994).
Les benzimidazoles agissent directement sur les vers alors que les pro-benzimidazoles sont administrés à l’animal sous forme de prodrogues converties en molécules actives par des réactions enzymatiques, qui se déroulent en général dans le foie (Lanusse et Prichard, 1993).
Les représentants de cette famille ont un mode d’action commun : ils se fixent spécifiquement aux molécules de -tubuline des vers (Samsom-Himmelsjerna, 2007a). Par cette fixation, ils empêchent la synthèse et la polymérisation des microtubules dans les cellules tégumentaires et intestinales des nématodes, sans
altérer le réseau de microtubules de l’hôte. Ils perturbent ainsi des fonctions essentielles telles le maintien de la morphologie cellulaire, le mouvement des organites et la mitose, ce qui conduit à la mort du vers.
2.1.2 Les imidazothiazoles et les tétrahydropyrimidines
Bien que les représentants des imidazothiazoles (lévamisole) et des tétrahydropyrimidines (pyrantel, morantel) aient des structures chimiques différentes, ils ont le même mode d’action. Pour cette raison, ils sont classés dans une même famille (Tableau 3).
Ces AHs se fixent sur les récepteurs nicotiniques à acétylcholine des nématodes GIs (Samsom-Himmelsjerna, 2007a). Ils miment l’action de l’acétylcholine. Cette fixation induit un changement de la perméabilité membranaire post-synaptique provoquant une contraction musculaire, une paralysie spastique et finalement, la mort des vers.
2.1.3 Les lactones macrocycliques
Les lactones macrocycliques représentent la classe d’AHs la plus récente. Cette classe est homogène en raison du mode d’action unique et spécifique (Bengone-Ndong et Alvinerie, 2004). Cette famille regroupe les avermectines (ivermectine, doramectine, eprinomectine) et les mylbémycines (moxidectine) (Tableau 3) (Beugnet et al., 1997). Ces molécules ont une structure chimique complexe comprenant de nombreux hétérocycles lactones.
Bien que leur mode d’action reste mal élucidé, il semble que les lactones macrocycliques se fixent aux canaux ioniques glutamate-dépendant de la membrane des cellules neuromusculaires des nématodes et des arthropodes (Samsom-Himmelsjerna, 2007a). Cette fixation provoquerait l’ouverture de ces canaux et une augmentation de la perméabilité aux ions chlorures (Urquhart et al., 1996; Beugnet et al., 1997; Bengone-Ndong et Alvinerie, 2004). Ceci entraînerait une inhibition du contrôle nerveux des muscles du pharynx, de l’utérus et des muscles du corps du vers, conduisant à la mort du vers par paralysie.
2.2 Limites d’utilisation des anthelminthiques de synthèse
L’utilisation des AHs de synthèse pour la maîtrise des strongyloses GIs rencontre désormais plusieurs limites, liées notamment à la présence de résidus dans l’environnement ou dans les produits de consommation. Surtout, le développement de résistances aux AHs de synthèse dans les populations de nématodes GIs est devenu un phénomène mondial et de plus en plus préoccupant, en particulier chez les petits ruminants.
2.2.1 Ecotoxicité des anthelminthiques
Les AHs de synthèse sont généralement métabolisés dans le tractus digestif de l’animal ou par le foie après absorption (Mc Kellar, 1997). La majorité des molécules AHs sont ainsi retrouvées dans les matières fécales, en quantité plus ou moins importante, sous la forme active ou de métabolites. Depuis une vingtaines d’années, des études se sont intéressées à l’activité de ces AHs ou de leurs métabolites sur le fonctionnement de l’écosystème de la prairie et sur leurs possibles conséquences pour certains composants biotiques (Mc Kellar, 1997; Williams, 1997; Jensen et al., 2003; Erzen et al., 2005).
Aucune toxicité n’a été décrite, à ce jour, pour les métabolites fécaux des benzimidazoles et du lévamisole. A l’inverse, certaines lactones macrocycliques présenteraient une toxicité pour des insectes coprophages (Wardhaugh et Rodriguez-Menendez, 1988; Mc Kellar, 1997). Cette écotoxicité potentielle s’explique par le spectre d’action (incluant les insectes) des endectocides. Toutefois, cette écotoxicité est surtout liée à certains modes d’administration (sous de forme de bolus) entrainant une persistance des molécules et des résidus dans les matières fécales.
2.2.2 Restrictions d’emploi des anthelminthiques
En raison de l’inquiétude des consommateurs vis-à-vis de la présence de résidus chimiques dans les produits d’origine animale, des règles d’utilisation des AHs de synthèse ont été instaurées, qui contribuent à limiter leur usage dans certaines productions. Ces restrictions sont particulièrement fortes chez les espèces laitières et dans les modes de production répondant aux critères de l’‘Agriculture Biologique’.
Durant la lactation :
Durant la lactation, le nombre d’AHs utilisables est limité. Les restrictions d’utilisation ont été mises en place parce que certains AHs ou leurs métabolites sont éliminés par le lait ou à cause de l’absence d’études sur cette élimination. Ces restrictions entraînent des délais d’attente pour la consommation du lait (de l’ordre de quelques traites) voire une interdiction totale d’emploi de certaines molécules chez les femelles en lactation (Chartier et Hoste, 1997). Ainsi, chez les ovins et caprins laitiers, seuls le fébantel, l’oxfendazole et le fenbendazole (benzimidazoles) sont employés lors de la lactation en raison d’une autorisation de mise sur le marché avec des délais d’attente nuls.
En mode de production ‘Agriculture Biologique’ :
L’intérêt des consommateurs européens pour des produits de consommation issue d’une agriculture limitant les intrants chimiques a conduit au développement croissant de l’‘Agriculture Biologique’.
En élevage biologique, l’éleveur doit respecter un cahier des charges définissant les modalités de production des animaux (Cc-Repab-F, 2000; Decante et Sans, 2001). L’accès maximal des animaux au pâturage est notamment préconisé et les traitements thérapeutiques sont strictement réglementés (Thamsborg et al., 1999). L’usage curatif des AHs est ainsi limitée à deux traitements par an chez les petits ruminants (Cc-Repab-F).
2.2.3 Résistance des nématodes gastro-intestinaux aux anthelminthiques
Définition de la résistance aux anthelminthiques
Une population de nématodes GIs résistante aux AHs est définie comme une population ayant génétiquement acquis la capacité de résister à des concentrations d’AHs habituellement létales pour des individus de cette espèce (Prichard et al., 1980; Sanger et Gill, 1999). La résistance reposant sur un déterminisme génétique, ce caractère se transmet de façon héréditaire (Coles, 2002; Wolstenholme et al., 2004).
Il s’agit d’un phénomène évolutif (Jackson, 1993; Waller, 2006). Les parasites devenus résistants par mutation génétique sont au début peu nombreux, mais leur développement et leur abondance sont favorisés par une pression de sélection, due à l’emploi répété d’anthelminthiques.
Situation de la résistance aux anthelminthiques
Familles d’anthelminthiques concernées :
Les premières résistances décrites concernaient les benzimidazoles. Aujourd’hui, toutes les classes d’AHs de synthèse sont concernées (Gopal et al., 1999; Wolstenholme et al., 2004; Artho et al., 2007).
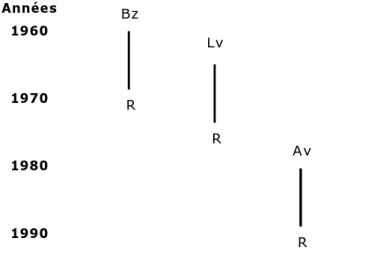
De manière générale, les premiers cas de résistance aux AHs apparaissent environ 10 ans après la mise sur le marché (Kaplan, 2004; Waller, 2006)(Figure 3).
De plus, des cas de résistances multiples ont été détectés dès les années 1980s en Australie, en Afrique du Sud et en Nouvelle Zélande (Pomroy et al., 1992; Urquhart et al., 1996; Kaplan, 2004; Besier, 2007), en Asie du Sud-est (Chandrawathani et al., 1999) et récemment en Europe (Yue et al., 2003).
Figure 3. Années de la mise sur le marché et de l'apparition de résistance pour les molécules anthelminthiques, selon Waller (2006).
Années 1960 1970 1980 1990 Bz Légende:
Bz, benzimidazole; Lv, lévamisol; Av, avermectine. R, 1er cas de résistance.
Lv
Av R
R
R
Distribution géographique mondiale :
Les premiers cas de populations de nématodes GIs résistantes aux AHs ont été signalés dans les années 1960s dans l’hémisphère sud, mais à l’heure actuelle, ce phénomène est devenu mondial (Waller, 1997; Jackson et Coop, 2000; Bartley et al., 2003; Kaplan, 2004; Wolstenholme et al., 2004; Pomroy, 2006; Waller, 2006; Besier, 2007).
En effet, des cas de résistances aux AHs ont été décrits en :
- Afrique (Van Wyk et al., 1999; Bakunzi, 2003);
- Australie (Woolaston et Baker, 1996) ; - Nouvelle-Zélande (Gopal et al., 1999) ;
- Asie du Sud (Chandrawathani et al., 1999) ;
- Europe (Jackson, 1993; Coles et al., 1994; Maingi et al., 1996;
Requejo-Fernandez et al., 1997; Chartier et al., 2001) ;
- Amérique du Nord (Terrill et al., 2001; Mortensen et al., 2003) ;
- Amérique du Sud (Echevarria et Trindade, 1989; Echevarria et al., 1996).
Espèces animales en cause :
Les cas de résistance aux AHs ont été majoritairement décrits chez les petits ruminants. De plus, il semble que la prévalence des résistances soit plus importante chez les caprins que chez les ovins (Chandrawathani et al., 1999). Pendant longtemps, les cas de résistance ont été absents chez les bovins, mais ils sont de plus en plus fréquemment signalés (Waller, 1997; Coles, 2002; Kaplan, 2004; Wolstenholme et al., 2004).
Espèces parasites concernées :
Des résistances aux AHs ont désormais été mentionnées pour toutes les espèces de nématodes GIs des petits ruminants, principalement pour H. contortus, Trichostrongylus spp. et Teladorsagia spp. (Gopal et al., 1999; Kaplan, 2004; Wolstenholme et al., 2004; Besier, 2007). Chez les bovins, les cas de résistance décrits concernent surtout Cooperia spp. (Waller, 1997; Suarez et Cristel, 2007).
Mécanismes des résistances aux anthelminthiques
Selon Wolstenholme et al. (2004), la résistance aux AHs peut être due à 3 phénomènes : 1) la modification de la molécule cible, 2) le changement des voies métaboliques qui conduirait à l’inactivation ou à l’élimination accélérée des molécules AHs, 3) l’amplification du nombre des cibles afin de diluer l’activité des molécules AHs dans l’organisme du parasite. La résistance initiale chez certains vers de la population serait préacquise à la suite d’une (ou de) modification(s) génétique(s) par mutation.
Les mécanismes de résistance semblent être spécifiques de chaque famille de molécules AHs (Samsom-Himmelsjerna, 2007b). Le mécanisme de résistance aux
benzimidazoles a été le plus largement étudié. Il serait du à une mutation du gène codant la -tubuline (Sanger et Gill, 1999; Wolstenholme et al., 2004; Samsom-Himmelsjerna, 2007b). Pour le lévamisole, la résistance serait associée à une modification des récepteurs nicotiniques (Sanger et Gill, 1999; Samsom-Himmelsjerna, 2007b). Pour les lactones macrocycliques, la résistance seraît un phénomène plus complexe car reposerant sur des mécanismes de mutation des gènes impliqués dans la réponse cellulaire au GABA ou de surexpression de la glycoprotéine P impliquée dans la détoxification cellulaire (Gill et Lacey, 1998; Sanger et Gill, 1999; Wolstenholme et al., 2004; Samsom-Himmelsjerna, 2007b). Ce dernier mécanisme est aussi suggéré pour expliquer les cas de résistances multiples.
Facteurs favorisant l’apparition des résistances
Tout renforcement de la pression de sélection associé à l’emploi de AHs favorise l’apparition de résistances (Wolstenholme et al., 2004). En effet, à la suite de traitements, les nématodes GIs porteurs d’allèles ‘résistants’, notamment les homozygotes, survivent contrairement à leurs congénères, sensibles. En conséquence, la proportion de nématodes porteurs d’allèles ‘résistants’ augmente dans la population. Les vers résistants peuvent ensuite se reproduire et propager les allèles de résistance.
Différents facteurs, dépendant des nématodes (intrinsèques) ou liés à l’activité humaine (extrinsèques), peuvent accélérer l’apparition et à la propagation des allèles de résistance au sein d’une population de vers.
Facteurs intrinsèques :
Certains éléments de la dynamique des populations des nématodes digestifs favorisent la propagation des résistances aux AHs. La durée du cycle biologique, c'est-à-dire le temps séparant deux générations, est un facteur important. Plus cette durée est courte, plus la diffusion du caractère résistant sera rapide (Sanger et Gill, 1999; Paolini, 2004; Wolstenholme et al., 2004).
De même, la prolificité des espèces parasites est un facteur majeur de transmission et de propagation de la résistance (Silvestre et al., 2002; Wolstenholme et al., 2004), la résistance se propageant d’autant plus rapidement que l’espèce concernée est prolifique. Ceci explique notamment le nombre important de cas de résistance décrits chez H.contortus.
Facteurs extrinsèques :
Certaines interventions de l’homme (facteurs opérationnels) sont également impliquées dans le développement des résistances aux AHs (Coles et Roush, 1992; Smith et Sherman, 1994; Coles, 2002; Silvestre et al., 2002; Wolstenholme et al., 2004) :
~ L’introduction d’animaux parasités par une souche résistante dans un troupeau.
~ Le sous-dosage. En exposant les vers à des doses non-létales, il conduit à une sélection élevée des individus résistants par l’élimination des vers les plus sensibles (les homozygotes ‘sensible/sensible’) tout en conservant les vers résistants (les homozygotes ‘résistant/résistant’ et les hétérozygotes)(Barnes et al., 1995). En conséquence, la fréquence des allèles ‘résistants’ dans la population de nématodes en est encore accrue.
~ Une fréquence élevée des traitements et l’usage répété de la même classe d’AHs.
~ L’absence de refuge. La notion de refuge est déterminée par la proportion de nématodes demeurant sensibles aux AHs dans une population totale (Jackson, 1993; Coles, 2002). La population totale de nématodes GIs comprend les vers abrités chez les hôtes mais également les L3s présentes sur le pâturage. Ainsi, l’application du principe de refuge repose sur le maintien d’une proportion importante de nématodes sensibles soit sur la prairie (parcelles contaminées par une souche sensible), soit chez des animaux non-traités au sein du troupeau restant principalement infestés par une souche sensible et non-soumise à pression de sélection (Wolstenholme et al., 2004).
2.3 Prévenir l’apparition des résistances aux anthelminthiques
Afin de préserver l’efficacité des traitements AHs et de ralentir l’apparition et la diffusion des résistances, il est devenu nécessaire d’utiliser ces molécules de façon plus raisonnée, à partir de la compréhension des facteurs extrinsèques favorisant le développement des résistances (Hoste et al., 2002c; Waller, 2004).
La prévention des résistances repose sur des solutions prenant le contre pieds des erreurs de conduites identifiées comme propices à la diffusion des résistances.