Contrôle de la respiration chez la préparation du tronc
cérébral isolé du poisson rouge (Carassius auratus; Linnaeus)
Mémoire
Éric côté
Maîtrise en neurobiologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Éric Côté, 2013
III
Résumé
Nous avons mené une étude à deux volets sur la préparation du tronc cérébral isolé du poisson rouge (Carassius auratus; Linnaeus). Le premier volet porte sur la chémosensibilité centrale du poisson rouge. Nos résultats nous révèlent qu’une diminution de la PO2 dans le superfusat engendre une augmentation de la fréquence des décharges
respiratoires tandis qu’une diminution du pH du superfusat, suite à l’augmentation de sa PCO2, n’influence pas le rythme respiratoire. Le deuxième volet porte sur l’importance
relative de l’inhibition réciproque chlore-dépendante dans la rythmogenèse respiratoire. Ici, nos résultats nous indique que la perturbation de ce mécanisme via 1) la superfusion du tronc cérébral isolé avec un superfusat sans ion chlorure aboli le rythme respiratoire, 2) l’activation des récepteurs GABAergiques avec du GABA exogène diminue la fréquence des décharges respiratoires et 3) l’inactivation simultanée des récepteurs GABAergiques et glycinergiques à l’aide d’antagonistes augmente la fréquence et l’amplitude des décharges respiratoires.
V
Abstract
We conducted a two-part in vitro study on the isolated brainstem preparation of the goldfish (Carassius auratus; Linnaeus). In the first part, we investigated the central chemosensibility of the goldfish. Our results indicate that decreasing the PO2 of the
superfusate increases the frequency of the fictive respiratory bursts. However, decreasing the pH of the superfusate by increasing its PCO2 had no effect on the respiratory rhythm. In
the second part, we investigated the relative importance of GABA- or glycine-mediated Cl- -dependent reciprocal inhibition for respiratory rhythmogenesis by disrupting this mechanism with three different treatments. Here, our results indicate that 1) bathing the brainstem in a Cl--free superfusate abolishes the respiratory rhythm, 2) activating GABA receptors with exogenous GABA decreases the frequency of the fictive respiratory bursts and 3) simultaneously inactivating GABA receptors and glycine receptors with antagonists increases both the frequency and the amplitude of the fictive respiratory bursts.
VI
Rien n'a de sens en biologie, si ce n'est à la lumière de l'évolution T. Dobzhansky (1973)
VII
Table des matières
Résumé ... III Abstract ... V Liste des abréviations ... IX Liste des figures ... XI Avant-propos ... XIII
CHAPITRE I ... 1
INTRODUCTION ... 1
1. La respiration chez les vertébrés ... 3
1.1 Généralités sur la respiration ... 3
1.2 Mécanique respiratoire ... 3
1.2.1 Respiration aquatique ... 3
1.2.2 Respiration bimodale ... 5
1.2.3 Respiration aérienne ... 8
1.2.4 Évolution de la mécanique respiratoire ... 10
1.3 Étude de la neurobiologie respiratoire chez les vertébrés ... 11
2. Préparation in vitro du tronc cérébral isolé ... 13
2.1 Historique de la préparation ... 13
2.2 Description de la préparation ... 15
3. Contrôle neural de la respiration ... 17
3.1 Localisation des neurones respiratoires ... 17
3.1.1 Découverte du « nœud vital » de la respiration chez les mammifères ... 17
3.1.2 Distribution des neurones respiratoires chez les mammifères ... 19
3.1.3 Distribution des neurones respiratoires chez les ectothermes ... 22
3.2 Régulation du rythme respiratoire ... 25
3.2.1 Chémosensibilité périphérique et centrale à l’oxygène ... 25
3.2.2 Chémosensibilité périphérique et centrale au dioxyde de carbone ... 28
3.3 Mécanismes neuronaux sous-jacents à la génération du rythme respiratoire ... 30
3.3.1 Théorie du réseau ... 30
3.3.2 Théorie des neurones autorythmiques ... 32
3.3.3 Théories du modèle hybride et du groupe autorythmique ... 34
3.3.4 Identification des mécanismes ... 35
4. Projet de maitrise ... 37
4.1 Objectifs du projet ... 37
4.2 Hypothèses de recherche ... 38
CHAPITRE II ... 41
CONTROL OF BREATHING IN THE IN VITRO BRAINSTEM PREPARATION FROM GOLDFISH (CARASSIUS AURATUS; LINNAEUS) ... 41
1. Abstract ... 43
VIII
3. Materials and methods ... 49
3.1 Animals ... 49
3.2 In vitro brainstem preparations ... 49
3.3 Electrophysiological recordings ... 50
3.4 Experimental protocol ... 50
3.4.1 Series I: Effects of hypoxia on fictive respiratory activity ... 51
3.4.2 Series II: Effects of hypercapnia on fictive respiratory activity ... 51
3.4.3 Series III: Effects of a chloride-free medium on fictive respiratory activity .. 52
3.4.4 Series IV: Effects of GABA receptors activation on fictive respiratory activity ... 53
3.4.5 Series V: Effects of simultaneous GABAA/glycine receptors inactivation on fictive respiratory activity ... 53
3.5 Data and statistical analysis ... 54
4. Results ... 57
4.1 Bursting pattern under baseline conditions ... 57
4.2 Series I: Effects of hypoxia on fictive respiratory activity ... 58
4.3 Series II: Effects of hypercapnia on fictive respiratory activity ... 58
4.4 Series III: Effects of a chloride-free medium on fictive respiratory activity ... 58
4.5 Series IV: Effects of GABA receptors activation on fictive respiratory activity .. 59
4.6 Series V: Effects of simultaneous GABAa/glycine receptors inactivation on fictive respiratory activity ... 59
5. Discussion ... 65
5.1 Critique of methods ... 65
5.1.1 Is the motor output respiratory related? ... 65
5.1.2 Why does this preparation produce many motor patterns? ... 66
5.2 Central O2 chemosensitivity ... 67
5.3 Central CO2 chemosensitivity ... 68
5.4 Neural mechanisms underlying respiratory rhythm generation ... 68
6. Conclusions ... 73
7. Acknowledgements ... 73
CHAPITRE III ... 75
CONCLUSION ... 75
1. Critique de la méthodologie ... 77
1.1 Pertinence de l’utilisation de la préparation in vitro du tronc cérébral isolé comme modèle expérimental ... 77
1.2 Évaluation de la préparation in vitro du tronc cérébral isolé du poisson rouge .... 82
1.3 Améliorations possibles de la méthodologie et recommandations ... 83
2. Accomplissements du projet de maîtrise ... 87
2.1 Atteinte des objectifs ... 87
2.2 Retour sur les hypothèses de recherche ... 88
3. Perspectives d’avenir ... 89
IX
Liste des abréviations
ºC degré(s) Celsius
5-HT sérotonine
AFF acide flufénamique
Ag argent
AgCl chlorure d’argent
C1 1ère vertèbre cervicale (atlas) C2 2e vertèbre cervicale (axis)
Ca2+ ion calcium
CB complexe Bötzinger
Cd2+ ion cadmium
Cl- ion chlorure
CN nerf crânien (suivi du numéro du nerf en chiffres romains)
CNS système nerveux central
CO2 dioxyde de carbone
CPB complexe pré-Bötzinger
CSF liquide céphalo-rachidien artificiel
Em potentiel membranaire
GABA acide gamma-aminobutyrique
GRD groupe respiratoire dorsal GRP groupe respiratoire pontin GRpF groupe respiratoire parafacial GRpT groupe respiratoire paratrijumeau GRV groupe respiratoire ventral GRVc groupe respiratoire ventral caudal GRVr groupe respiratoire ventral rostral
H+ ion hydronium
HEPES acide N-2-hydroxyéthylpipérazine-N-2-éthanesulfonique
Hz hertz
X
INaP courant sodium persistant
K+ ion potassium MRVL moelle rostro-ventrolatérale MS-222 méthane-sulfonate de tricaïne mV millivolt(s) N2 azote nA noyau ambigu Na+ ion sodium nF noyau facial
NICS neurones inspiratoires cervicaux supérieurs
nKF noyau Kölliker-Fuse
nMF noyau moteur facial
nMG noyau moteur glossopharyngien
nMV noyau moteur vague nPL noyau parabrachial latéral nPM noyau parabrachial médian
nT noyau trijumeau
nTS noyau du tractus solitaire
O2 oxygène
PCO2 pression partielle du dioxyde de carbone
pH potentiel hydrogène
PIPES acide pipérazine-bis(éthane-2-sulfonique)-1,4 PO2 pression partielle de l’oxygène
PPSEs potentiels postsynaptiques excitateurs
SD déviation standard
Tris tris(hydroxyméthyl)aminométhane
Il est à noter que certaines abréviations, notamment toutes celles apparaissant au chapitre II de ce mémoire, proviennent de termes anglais. Afin d’éviter l’utilisation d’un trop grand nombre d’abréviations différentes, j’ai préféré conserver uniquement l’abréviation anglaise d’un mot ou groupe de mots apparaissant dans les deux langues. Par exemple, l’abréviation CSF peut désigner « liquide céphalo-rachidien artificiel » ou « artificial cerebrospinal fluid », selon le contexte.
XI
Liste des figures
Figure 1.1 : Diagramme schématique illustrant les pompes buccale et operculaire
retrouvées chez la plupart des poissons osseux.
Figure 1.2 : Diagrammes schématiques illustrant le fonctionnement de la pompe buccale
des actinoptérygiens et des sarcoptérygiens lors de la respiration aérienne.
Figure 1.3 : Diagrammes schématiques illustrant le fonctionnement de la pompe à
aspiration des crocodiliens et des mammifères.
Figure 1.4 : Dendrogramme résumant les différentes phases actives et passives des cycles
ventilatoires buccaux et pulmonaires associés à la respiration aquatique et pulmonaire chez divers groupes de vertébrés.
Figure 1.5 : Diagramme du cerveau d’un poisson rouge (Cyprinus carassius).
Figure 1.6 : Comparaison entre la périodicité des changements de potentiel électrique et
la périodicité des mouvements respiratoires.
Figure 1.7 : Schéma du montage de la préparation in vitro du tronc cérébral isolé.
Figure 1.8 : Représentation schématique de la localisation des principaux groupes de
neurones respiratoires dans le tronc cérébral et la moelle épinière des mammifères.
Figure 1.9 : Diagramme schématique illustrant la distribution des chémorécepteurs
sensibles à l’O2 chez différents groupes de vertébrés.
Figure 2.1 : Schematic representation of the isolated brainstem preparation from
goldfish.
Figure 2.2 : Bursting patterns recorded from cranial nerve VII of isolated brainstems of
goldfish.
Figure 2.3 : Effects of hypoxia on the fictive breathing recorded from in vitro brainstem
preparations.
Figure 2.4 : Effects of hypercapnia on the fictive breathing recorded from in vitro
brainstem preparations.
Figure 2.5 : Effects of a Cl--free CSF on fictive respiratory activity.
Figure 2.6 : Effects of GABA on fictive respiratory activity.
Figure 2.7 : Effects of simultaneous inactivation of GABAA and glycine receptors on fictive respiratory activity.
XIII
Avant-propos
Le second chapitre de ce mémoire contient un article soumis pour publication au Journal of Experimental Biology en date du 21 janvier 2013. Cet article fait état de quatre auteurs : moi-même, Éric Côté, étudiant à la maîtrise en neurobiologie, Stéphanie Fournier, professionnelle de recherche, Jean-Philippe Rousseau, stagiaire inscrit au baccalauréat en biologie, et Richard Kinkead, mon directeur de recherche. Je suis le premier auteur de cet article, car j’ai contribué à l’élaboration du projet, j’ai effectué la majorité des manipulations et de l’analyse des données, j’ai conçu la majorité des figures et j’ai rédigé l’essentiel du manuscrit. Stéphanie a contribué à l’élaboration du projet et a effectué plusieurs manipulations. Stéphanie et Jean-Philippe ont participé à l’analyse des données et à la réalisation de certaines figures. Le Dr Kinkead nous a guidés dans l’élaboration du protocole et a fait la correction du manuscrit. Il a également apporté quelques modifications au texte ainsi qu’à certaines figures.
Bien évidemment, rien de tout cela n’aurait été possible sans que le Dr Kinkead ne m’ait accueilli au sein de son laboratoire en tout premier lieu, ce pourquoi je tiens à le remercier du fond du cœur. Je ne sais pas si j’aurais pu mener ce projet à terme sans sa grande disponibilité, sa flexibilité, sa patience, sa compréhension, son écoute attentive à mes questionnements et son aide précieuse. J’aimerais également remercier mes collègues de laboratoire qui ont contribué, de près ou de loin, à la réalisation de ce mémoire : Stéphanie Fournier, pour le soutien technique qu’elle m’a apporté au niveau des manipulations et pour son apport au développement des protocoles expérimentaux, Jean-Philippe Rousseau, pour avoir participé à la correction du manuscrit suite à un premier refus des évaluateurs, Sébastien Labonté-Fournier et Frédéric Dumont, pour les conseils judicieux qu’ils m’ont offerts tout au long de ma formation, Sylvie Viger et Mélanie Pelletier, pour avoir pris grand soin de mes poissons rouges, et Roumiana Gulemetova, pour m’avoir aidé à me retrouver dans le dédale que constituent les couloirs souterrains de l’hôpital Saint-François d’Assise. Il ne faut pas oublier les membres du comité d’évaluation de mon mémoire, les Drs Pierre Guertin, Richard Kinkead et Vincent Joseph, pour leurs commentaires constructifs.
XIV
Pour conclure, j’aimerais remercier mes parents, qui m’ont encouragé tout au long de ce cheminement dont l’aboutissement repose maintenant sous vos yeux. Malgré les doutes, les angoisses et les embûches qui se sont dressés, par moments, sur le chemin de ma formation, je savais que je pouvais compter sur eux pour me soutenir. C’est avec une grande fierté et un sentiment d’accomplissement tout aussi grand que je vous présente mon mémoire effectué dans le cadre du programme de maîtrise en neurobiologie de l’Université Laval.
CHAPITRE I
3
1.
La respiration chez les vertébrés
1.1 Généralités sur la respiration
Afin de maintenir leur homéostasie, les organismes vivants doivent constamment échanger diverses substances avec leur environnement. Par exemple, les organismes pratiquant la respiration aérobie métabolisent l’O2 provenant du milieu ambiant, l’eau ou l’air, et y excrète du CO2. La diffusion passive de ces deux gaz respiratoires est suffisante pour répondre aux besoins des organismes qui possèdent un grand rapport surface/volume, tel que les bactéries, les levures, les plantes et les insectes. Or, les organismes plus complexes, possédant un rapport surface externe/volume plus réduit et un taux métabolique élevé, comme les mammifères et les oiseaux, doivent favoriser activement les échanges gazeux avec leur environnement en renouvelant continuellement, par ventilation, le milieu immédiat à des surfaces spécialisées dans l’échange des gaz respiratoires. Chez les vertébrés, cette ventilation s’effectue à l’aide d’une pompe activée par des muscles respiratoires. À ce processus s’ajoute la circulation sanguine qui, dans le cas des vertébrés, est générée par un une autre pompe, le cœur, et qui assure l’acheminement des gaz respiratoire entre les surfaces d’échange avec l’environnement et l’ensemble des tissus vivants de l’organisme (Feldman et McCrimmon 2003). Bien que le fonctionnement et la physionomie du système ventilatoire et des surfaces d’échange des gaz respiratoires diffèrent en fonction de l’organisme, il est possible de mettre en évidence certaines généralités que partagent les vertébrés en fonction de leur milieu respiratoire (Dejours 1989, Milsom 2008).
1.2 Mécanique respiratoire
1.2.1 Respiration aquatique
Il existe une hypothèse selon laquelle les chordés primitifs étaient les premiers vertébrés chez qui la convection active de leur milieu contribuait à l’échange gazeux. Chez ces animaux, les mouvements respiratoires étaient dérivés de l’alimentation par filtration durant laquelle l’eau de l’environnement était aspirée dans la cavité buccale pour ensuite être éjectée à travers les fentes pharyngiennes contenant les branchies primordiales. Dès lors, ces animaux durent compter sur des contractions rythmiques, mais pas nécessairement continues, de la musculature buccale afin d’assurer une circulation unidirectionnelle
4
adéquate de l’eau à la surface de leurs branchies (Milsom, Chatburn et al. 2004, Kinkead 2009). Malgré la présence de nombreuses variations interspécifiques, c’est ce type de pompe buccale qui constitue la principale source de ventilation chez l’ensemble des vertébrés contemporains pratiquant la respiration aquatique (Milsom 2008).
Chez les lamproies adultes, les muscles branchiaux, innervés par les nerfs crâniens trijumeaux (V), glossopharyngiens (IX) et vagues (X) (Rovainen et Schieber 1975, Kinkead 2009), entourent le panier branchial constitué de cartilages élastiques et contenant les sacs branchiaux. La contraction synchronisée des muscles branchiaux comprime le panier branchial, ce qui provoque l’exhalation, c’est-à-dire la sortie de l’eau contenue dans le panier branchial par les fentes branchiales pharyngiennes. Par la suite, la relaxation des muscles branchiaux permet au panier branchial de reprendre sa forme initiale de manière passive grâce à ses propriétés élastiques, ce qui fait pénétrer de l’eau fraîche dans le panier branchial : on parle alors d’inhalation. La ventilation est souvent bidirectionnelle chez les lamproies adultes, l’eau circulant de l’extérieur à l’intérieur à travers les fentes pharyngiennes branchiales (Johansen et Strahan 1963, Milsom 2008).
Chez les lamproies larvaires ainsi que les myxines, le mouvement de l’eau associé à la ventilation est unidirectionnel (Homma 1975, Rovainen et Schieber 1975, Kinkead 2009), car, à l’inverse de chez les lamproies adultes, les valves au-dessus des fentes branchiales sont fermées pendant l’inhalation, ce qui oblige l’eau à pénétrer par la bouche de l’animal (Johansen et Strahan 1963, Milsom 2008). Le cycle respiratoire des lamproies larvaires et des myxines s’effectue en trois étapes successives débutant par 1) la contraction des muscles du velum; cette étape est suivie de près par 2) la compression du panier branchial propulsant l’eau à travers le pharynx et vers les branchies pour favoriser l’irrigation. Le cycle se termine par 3) la relaxation de ces deux ensembles de muscles et le recouvrement passif de la forme initiale du panier branchial (Homma 1975, Rovainen et Schieber 1975, Kinkead 2009). La participation continue du velum à la ventilation est un élément exclusif aux lamproies larvaires et aux myxines (Rovainen et Schieber 1975, Kinkead 2009).
La ventilation est également unidirectionnelle chez tous les autres vertébrés contemporains pratiquant la respiration aquatique : l’eau entre par la bouche, les spiracles ou les narines, dépendamment de l’espèce, et ressort par les fentes branchiales. Or, à l’inverse des
5 lamproies larvaires et des myxines, l’inhalation est désormais une phase active de la
ventilation buccale. De plus, même si la pompe buccale constitue toujours le principal moteur de la ventilation, ces animaux sont dotés d’une seconde pompe provoquant la dilatation et la contraction de la cavité parabranchiale ou operculaire, comme l’illustre la figure 1.1 (Shelton 1970, Milsom 2008).
Figure 1.1 : Diagramme schématique illustrant les pompes buccale et operculaire retrouvées chez la plupart des poissons osseux. À cause d’une légère différence de pression entre la cavité buccale et la cavité operculaire, l’écoulement unidirectionnel de l’eau entre les branchies s’effectue de manière quasi continue. Ce mécanisme de base alimente la ventilation branchiale chez tous les poissons primitifs et à mâchoires modernes (Coolidge, Hedrick et al. 2007). Figure modifiée à partir de Coolidge, Hedrick et al. (2007). 1.2.2 Respiration bimodale
Bien que l’on sache peu de chose sur l’origine de la respiration aérienne chez les vertébrés (Wilson, Harris et al. 2000), on peut supposer qu’elle est associée à une prédisposition comportementale à nager à la surface de l’eau (Milsom 2008). L’exploitation efficace du milieu aérien, beaucoup plus riche en oxygène que l’eau, a certainement dû nécessiter des changements physiologiques significatifs (Dejours 1989, Kinkead 2009). Cependant, dans une perspective purement mécanique, les modifications requises étaient relativement modestes et impliquaient principalement des améliorations au niveau de la régulation du débit d’air (Gans, De Jongh et al. 1969, Milsom, Chatburn et al. 2004, Kinkead 2009) grâce à un contrôle accrue de la fermeture et de l’ouverture de la bouche, des spiracles ou des narines, ainsi que des opercules et de la glotte (ou d’une structure analogue) (Milsom 2008).
6
On retrouve des poissons « primitifs » pratiquant la respiration aérienne chez les sarcoptérygiens (les ancêtres des tétrapodes) et les actinoptérygiens (Wilson, Harris et al. 2000). En 2008, au moins 47 espèces issues de 24 genres de poissons osseux, les ostéichthyens, étaient reconnues pour respirer de l’air à l’aide de leur poumon ou de leur vessie natatoire. Comme pour la respiration aquatique, c’est la pompe buccale qui produit les mouvements d’air associés à la respiration aérienne chez ces poissons (Milsom 2008). Une analyse comparative du fonctionnement des pompes buccales des actinoptérygiens et des sarcoptérygiens lors de la respiration aérienne a révélé des différences fondamentales au niveau de la mécanique permettant la ventilation du poumon (ou d’un organe analogue) entre ces deux clades. Chez la grande majorité des actinoptérygiens étudiés jusqu’à ce jour, le transfert de l’air entre l’atmosphère, la cavité buccale et le poumon s’effectue de la manière suivante : Premièrement, alors que le poisson approche la surface de l’eau, sa bouche reste fermée pendant que l’air contenu dans le poumon se déplace vers la cavité buccale en expansion. Deuxièmement, la cavité buccale se compresse et force l’air exhalé à quitter cette dernière par la bouche ou par les valves operculaires. Troisièmement, une seconde expansion de la cavité buccale permet à l’air frais de l’atmosphère d’y pénétrer. Quatrièmement, la cavité buccale se compresse une deuxième fois et force l’air à gagner l’intérieur du poumon (Brainerd 1994). On observe également une pause respiratoire suite à l’inspiration, lorsque le poumon est rempli d’air (Brainerd 1994, Milsom 2008). Parce qu’il se produit deux expansions ainsi que deux compressions de la cavité buccale, c’est-à-dire deux cycles complets de la pompe buccale, à l’intérieur d’un cycle de ventilation pulmonaire, Brainerd nomma ce patron respiratoire la ventilation par la pompe buccale en « quatre-coups ». Contrairement aux actinoptérygiens, les sarcoptérygiens utilisent un patron respiratoire en « deux-coups » durant lequel l’inspiration et l’expiration se produisent à l’intérieur du même cycle d’expansion-compression buccale. Premièrement, la bouche ou les narines s’ouvrent et la cavité buccale se dilate pour aspirer l’air frais. Au même moment, l’air contenu dans les poumons est exhalé et gagne la cavité buccale en expansion (il n’y a pas de barrière entre la cavité buccale et le poumon). En second, la bouche ou les narines se referment et la cavité buccale se compresse, ce qui force un mélange d’air frais et d’air exhalé à pénétrer à l’intérieur des poumons. Ainsi, la cavité buccale se dilate et se compresse qu’une seule fois pour renouveler l’air à l’intérieur du
7 poumon lors de la respiration en « deux-coups » (Brainerd 1994). Dans un cas comme dans
l’autre, c’est l’état des différentes valves (fermées ou ouvertes) qui dicte quel mode de respiration (aquatique ou aérienne) la pompe buccale est disposée à mettre en marche; pendant la respiration aquatique, la glotte, ou une structure analogue, reste fermée, empêchant ainsi l’eau d’accéder au poumon. À l’inverse, pendant la respiration aérienne, la glotte est maintenue ouverte alors que les opercules, normalement ouverts pendant l’exhalation d’eau et fermés lors de l’inhalation d’eau, demeurent fermés pendant la déflation et l’inflation du poumon (Milsom 2008). La différence entre le fonctionnement de la pompe buccale des actinoptérygiens et celle des sarcoptérygiens est représentée à la figure 1.2.
Étant membres de la classe des sarcoptérygiens, la déflation et l’inflation du poumon s’effectuent toutes les deux à l’intérieur d’un seul cycle de la pompe buccale chez les dipneustes ainsi que la plupart des grenouilles et des crapauds. Cependant, pour ces espèces, les deux phases du cycle buccal, soit l’expansion et la compression buccale, participent à l’inflation du poumon : l’expansion buccale rempli la cavité buccale d’air alors que la compression buccales force cet air à pénétrer dans le poumon. La déflation du poumon se produit de manière passive durant une pause entre l’expansion et la compression buccale (Vitalis et Shelton 1990, Milsom 2008), excepté pour plusieurs espèces d’amphibiens chez lesquelles la contraction de muscles axiaux contribue activement à l’expiration (Brainerd 1999, Brainerd et Owerkowicz 2006, Milsom 2008). Encore une fois, c’est l’état des différentes valves qui détermine si un cycle de la pompe buccale produira un cycle de respiration aquatique (chez les dipneustes et les larves d’anoures; une oscillation buccale chez les anoures adultes), la déflation du poumon ou l’inflation du poumon (Milsom 2008).
8
Figure 1.2 : Diagrammes schématiques illustrant le fonctionnement de la pompe buccale des actinoptérygiens et des sarcoptérygiens lors de la respiration aérienne. (A) Respiration aérienne en « quatre-coups ». La pompe buccale des actinoptérygiens effectue deux expansions et deux compressions de la cavité buccale pour accomplir un cycle de ventilation pulmonaire. L’inspiration est suivie d’une pause respiratoire. (B) Respiration aérienne en « deux-coups ». Chez les sarcoptérygiens, la pompe buccale complète un cycle de ventilation pulmonaire avec seulement une expansion et une compression de la cavité buccale. Figure modifiée à partir de Coolidge, Hedrick et al. (2007).
1.2.3 Respiration aérienne
Bien que la pompe buccale soit conservée chez la plupart des vertébrés (Brainerd et Owerkowicz 2006, Kinkead 2009), la ventilation est principalement assurée par une pompe à aspiration chez les reptiles, les oiseaux et les mammifères. Le fonctionnement de cette pompe à aspiration repose sur l’activation de différents groupes musculaires, ces derniers n’étant pas forcément les mêmes d’une espèce à l’autre. Parmi ceux-ci, on retrouve les muscles de la paroi thoracique, le diaphragmatus (crocodiliens), les membres postérieurs (tortues) et le diaphragme (mammifères) (Milsom, Chatburn et al. 2004, Klein et Owerkowicz 2006, Kinkead 2009). Ces muscles sont innervés par des nerfs spinaux, mais les animaux dotés d’une pompe à aspiration recrute toujours les motoneurones trijumeaux (V), vagues (X) et hypoglosses (XII) pour favoriser la ventilation, bien que leur rôle principal soit désormais réduit à celui d’assurer l’ouverture des voies respiratoires supérieures (Milsom, Chatburn et al. 2004, Greer et Funk 2005, Kinkead 2009). Tandis que la déflation et l’inflation pulmonaires sont des processus actifs chez les reptiles et les oiseaux, on observe, chez les mammifères, une diminution de la nécessité d’une déflation
9 active des poumons (Milsom 2008). Alors que la contraction du diaphragme et des muscles
intercostaux externes induit l’inflation pulmonaire, la déflation des poumons se produit souvent de manière passive, particulièrement au repos, par le retour des poumons et de la cage thoracique à leurs positions d’équilibre (Feldman et Del Negro 2006). C’est seulement en conditions de demande respiratoire élevée que la déflation pulmonaire est assistée par la contraction de muscles axiaux (Milsom 2008).
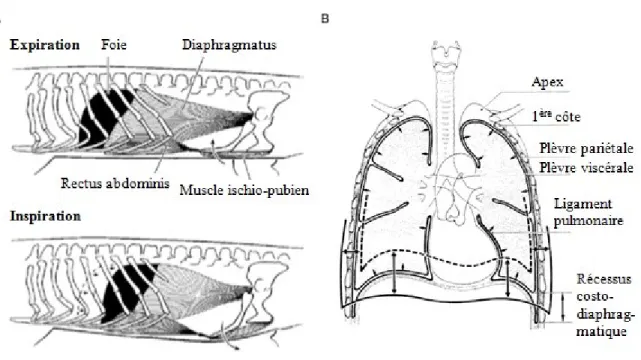
Figure 1.3 : Diagrammes schématiques illustrant le fonctionnement de la pompe à aspiration des crocodiliens et des mammifères. (A) Section sagittale de la cavité thoraco-abdominale d’Alligator
mississippiensis. Chez les crocodiliens, la cavité thoraco-abdominale primitive est divisée par le foie en une
cavité thoracique antérieure et une cavité abdominale postérieure. La surface rostrale du foie est fermement attachée aux poumons par du tissu conjonctif. La contraction du diaphragmatus provoque la rétraction du foie et l’expansion de la cavité thoracique, ce qui induit une entrée d’air dans les poumons en raison d’une diminution de la pression thoracique. Le mouvement de va-et-vient qu’effectue le foie à l’intérieur de la cavité thoraco-abdominale lors de la respiration n’est pas sans rappeler celui d’un piston glissant à l’intérieur d’un cylindre, ce qui a valu le nom de pompage par piston hépatique à ce mécanisme ventilatoire. La rotation des côtes et la rotation des plaques pubiennes contribuent également à la ventilation pulmonaire chez les crocodiliens (Carrier et Farmer 2000, Brainerd et Owerkowicz 2006). Figure modifiée à partir de Carrier et Farmer (2000). (B) Section frontale de la cavité thoracique humaine. Chez les mammifères, le diaphragme sépare le thorax de l’abdomen. Chez la plupart des mammifères, le diaphragme à la forme d’une feuille plate, mais le fait qu’il repose sur la surface rostrale du foie lui donne, au repos, une forme de dôme. La contraction des fibres musculaire réduit la courbure de ce dôme, ce qui provoque l’expansion de la cavité thoracique et l’aspiration de l’air dans les poumons. La rotation des côtes est relativement faible chez les mammifères lors de la respiration et la principale fonction respiratoire de la cage thoracique est de prévenir l’effondrement du mur thoracique lorsque le diaphragme diminue la pression thoracique en se contractant (Brainerd et Owerkowicz 2006). Sur la figure, les flèches simples indiquent la force rétractile des poumons alors que les flèches doubles représentent le déplacement de la base et de la périphérie des poumons entre une inspiration (ligne pleine) et une expiration (ligne pointillée) profondes. Figure modifiée à partir de Weibel (1984). Expiration
Inspiration Foie Diaphragmatus
10
1.2.4 Évolution de la mécanique respiratoire
En récapitulatif, la transition entre la respiration aquatique et la respiration aérienne chez les vertébrés est caractérisée par le remplacement d’une pompe buccale à pression positive par une pompe thoraco-abdominale à aspiration (pression négative) comme principal « moteur » de la ventilation. La première est animée par des muscles branchiomériques et hypobranchiaux associés aux cavités buccale et pharyngienne. Ces muscles sont innervés par des nerfs crâniens, plus spécifiquement les nerfs trijumeaux (V), faciaux (VII) et hypoglosses (XII). La dernière est essentiellement animée par des muscles axiaux associés au thorax et à l'abdomen. Ces muscles sont innervés par des nerfs spinaux recevant leur excitation principalement de neurones prémoteurs situés dans la colonne respiratoire médullaire ventrale (Milsom 2008, Milsom 2010a). Comme il a été mentionné précédemment, un mécanisme intermédiaire entre la pompe buccale des poissons et des amphibiens et la pompe à aspiration des reptiles, des oiseaux et des mammifères a été découvert, plutôt récemment, chez plusieurs amphibiens. Chez ces espèces, l’expiration active de l’air s’exécute grâce à la contraction de muscles axiaux alors que l’inspiration active de l’air est assurée par la pompe buccale (Brainerd 1999, Brainerd et Owerkowicz 2006, Milsom 2008). Un dendrogramme résumant les différentes phases actives et passives des cycles ventilatoires buccaux et pulmonaires associés à la respiration aquatique et pulmonaire chez divers groupes de vertébrés est illustré à la figure 1.4.
11
Figure 1.4 : Dendrogramme résumant les différentes phases actives et passives des cycles ventilatoires buccaux et pulmonaires associés à la respiration aquatique et pulmonaire chez divers groupes de vertébrés. (BC= compression buccale, BE = expansion buccale, LD = déflation pulmonaire, LI = inflation pulmonaire). Figure modifiée à partir de Milsom (2008).
1.3 Étude de la neurobiologie respiratoire chez les vertébrés
Malgré la réorganisation significative du système respiratoire au cours de l’évolution, la totalité des évidences recueillies jusqu’à maintenant suggèrent que les groupes de neurones à l’origine du rythme respiratoire soient demeurés au niveau du tronc cérébral chez l’ensemble des vertébrés (Milsom, Chatburn et al. 2004, Greer et Funk 2005, Kinkead 2009). Cela nous illustre à quel point la genèse du rythme respiratoire au niveau du système nerveux central (CNS) est une fonction phylogénétiquement ancienne qui fut fortement conservée au cours de l’évolution (Hedrick 2001, Hedrick 2005, Vasilakos, Wilson et al. 2005, Kinkead 2009). Cela n’a rien de bien étonnant, particulièrement lorsque l’on considère le rôle vital joué par la génération du rythme respiratoire dans le maintien de l’homéostasie (Kinkead 2009) : chez l’humain, par exemple, le contrôle de la ventilation doit perdurer de la naissance jusqu’à la mort sans interruptions de plus que quelques minutes. Heureusement, le système neural responsable du maintien du rythme respiratoire
12
est reconnu pour sa robustesse. En effet, les mouvements ventilatoires sont souvent les derniers mouvements importants à disparaître suite à une dépression généralisée des fonctions supérieures. Conséquemment, il est possible de tirer profit de la robustesse du système respiratoire pour en étudier les mécanismes neuronaux sous-jacents chez des animaux expérimentaux anesthésiés ou décérébrés qui continuent de respirer. Il est même possible d’enregistrer in vitro la poursuite de l’activité des neurones respiratoires d’une tranche de tissu nerveux isolée à partir du tronc cérébral d’un rongeur d’âge néonatal ou fœtal avancé, à condition que cette dernière ait été prélevée au niveau approprié du tronc cérébral (Feldman et McCrimmon 2003). La prochaine section porte sur la préparation du tronc cérébral isolé in vitro, un modèle expérimental qui fait également usage de la robustesse du système respiratoire et dont je me suis servi, dans le cadre de mon projet de recherche, pour étudier les mécanismes sous-jacents à la genèse du rythme respiratoire ainsi que la chémosensibilité à l’O2 et au CO2 du CNS chez le poisson rouge (voir chapitre II).
13
2.
Préparation in vitro du tronc cérébral isolé
2.1 Historique de la préparation
Adrian et Buytendijk (1931) furent les premiers à enregistrer des changements de potentiel électrique lents et rythmiques à partir de troncs cérébraux de poissons rouges isolés in vitro (Cyprinus carassius). À l’origine, le choix de cette préparation reposait sur le désir d’éliminer les sources périphériques de variation électrique, comme le cœur et les muscles squelettiques, afin de s’assurer que les changements enregistrés étaient bel et bien d’origine centrale. La procédure décrite dans cette étude débute par la décapitation du poisson et la destruction du prosencéphale par écrasement de la partie antérieure du crâne. Par la suite, le tronc cérébral est délicatement exposé par dissection et les racines des nerfs crâniens sont coupées, permettant la transposition de ce dernier vers une lame de verre humidifiée avec une solution saline : le fluide de Ringer. Une fois isolée, la préparation, représentée par le diagramme de la figure 1.5, inclue la partie supérieure de la moelle épinière, une paire de lobes vagaux, disposés de part et d’autre de la ligne médiane, le cervelet, formant une protrusion arrondie centrée sur la ligne médiane, et le mésencéphale avec sa paire de lobes optiques (Adrian et Buytendijk 1931).
Figure 1.5 : Diagramme du cerveau d’un poisson rouge (Cyprinus carassius). La préparation comporte le tronc cérébral, les hémisphères cérébraux (section ombragée) ayant été détruits. Figure modifiée à partir d’Adrian et Buytendijk (1931). Lobes vagaux Lobes optiques Cervelet Prosencéphale
14
À l’aide d’une paire d’électrodes non-polarisables (Ag, AgCl), chacune d’entre elles se terminant par un mince filet humide, Adrian et Buytendijk parvinrent à enregistrer une succession d’ondes lentes dont le cycle avait une durée de 1 à 3 secondes. Cela leur indiqua que le tronc cérébral était non seulement capable de produire une activité rythmique en absence d’afférence périphérique, mais qu’il y avait de fortes chances que celle-ci soit reliée à la respiration, car, comme l’illustre la figure 1.6 (tirée de l’étude en question), la fréquence de ces ondes était similaire à la fréquence à laquelle se produisent les mouvements respiratoires chez un poisson rouge intact. De plus, les deux chercheurs constatèrent que les nerfs moteurs impliqués dans la génération des mouvements respiratoires prennent racines dans le tronc cérébral chez le poisson rouge (Adrian et Buytendijk 1931), ce qui vint apporter une preuve supplémentaire appuyant l’hypothèse selon laquelle le tronc cérébral contient les circuits critiques à la rythmogenèse respiratoire (Feldman et McCrimmon 2003).
Figure 1.6 : Comparaison entre la périodicité des changements de potentiel électrique et la périodicité des mouvements respiratoires. Tracé du haut : enregistrement oscillographique du potentiel électrique brut du tronc cérébral isolé in vitro d’un poisson rouge. Tracé du bas : mouvements branchiaux d’un poisson rouge intact. Figure modifiée à partir d’Adrian et Buytendijk (1931).
Depuis les travaux pionniers d’Adrian et Buytendijk (1931), la préparation in vitro du tronc cérébral isolé fut raffinée et appliquée chez différents groupes de vertébrés incluant les lamproies (Bongianni, Mutolo et al. 2006, Mutolo, Cinelli et al. 2011), les poissons (Duchcherer, Kottick et al. 2010), les amphibiens (Galante, Kubin et al. 1996, Liao, Kubin et al. 1996, Broch, Morales et al. 2002, Fournier, Allard et al. 2007, Fournier et Kinkead 2008) et les tortues (Johnson, Wilkerson et al. 2002, Bartman, Wilkerson et al. 2010), ce
Changement de potentiel
Respiration
1 sec
15 qui permît d’accroître substantiellement notre compréhension du contrôle neural de
l’activité respiratoire. Toutefois, c’est sans doute l’adaptation de cette technique chez les mammifères réalisée par Suzue (1984), s’inspirant de la préparation in vitro de la moelle épinière isolée chez le rat nouveau-né introduite par Otsuka et Konishi (1974), qui la rendît le plus populaire et qui permît, dans les années qui suivirent, de faire un grand nombre de découvertes majeures en neurobiologie respiratoire (Suzue 1984, Smatresk 1990, Richter et Spyer 2001, Hedrick 2005, Kinkead 2009, Johnson, Turner et al. 2012). Ironiquement, c’est au sujet des poissons, groupe auquel appartient la première espèce chez qui la préparation in vitro du tronc cérébral isolé fut appliquée, que la littérature portant sur les mécanismes sous-jacents à la rythmogenèse respiratoire est la plus limitée. En effet, depuis Adrian et Buytendijk (1931), seulement deux autres études sur les poissons ont utilisé une préparation in vitro du tronc cérébral isolé : l’une porte sur l’organisation spatiale des neurones responsables de la génération du rythme respiratoire chez le poisson rouge (Carassius auratus) (Duchcherer, Kottick et al. 2010) alors que l’autre examine la chémosensibilité centrale au CO2/H+ du lépisosté osseux (Lepisosteus osseus) (Wilson, Harris et al. 2000). C’est d’ailleurs cette iniquité au niveau des connaissances acquises sur les différents groupes de vertébrés dans le domaine de la neurobiologie respiratoire qui m’a motivé à réaliser, dans le cadre de ma maîtrise en neurobiologie, une étude sur le contrôle de la respiration chez la préparation du tronc cérébral isolé du poisson rouge. Cette étude est présentée au chapitre II de ce document.
2.2 Description de la préparation
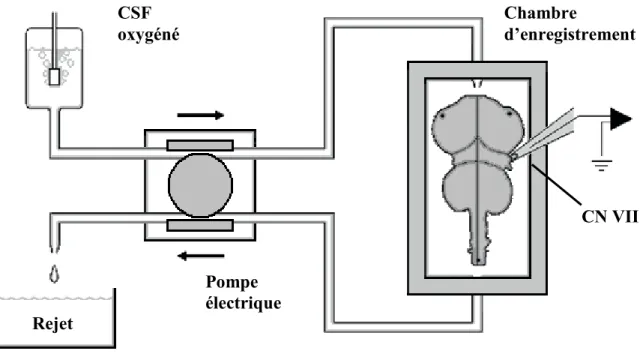
De nos jours, la préparation in vitro du tronc cérébral isolé est typiquement placée à l’intérieur d’une chambre d’enregistrement où circule un liquide céphalo-rachidien artificiel (CSF) hyperoxygéné, maintenu à température constante, servant à approvisionner le tissu nerveux en glucose et en O2 par diffusion. Les décharges motrices spontanées associées à la respiration sont normalement enregistrées à partir des racines ventrales d’un ou plusieurs nerfs spinaux situées au niveau de la moelle épinière cervicale et thoracique ou à partir des racines d’un ou plusieurs nerfs crâniens, dépendamment de l’espèce étudiée (Johnson, Turner et al. 2012). La figure 1.7 représente le schéma d’un montage typique associé à la
16
préparation in vitro du tronc cérébral isolé. Il s’agit également du montage qui fut utilisé lors de l’étude présentée au chapitre II.
Figure 1.7 : Schéma du montage de la préparation in vitro du tronc cérébral isolé. Dans le cas de l’étude présentée au chapitre II, une pompe électrique a été utilisée pour faire circuler le liquide céphalo-rachidien artificiel (CSF) oxygéné, mais il est possible de modifier le montage afin que le CSF puisse s’écouler simplement sous l'influence de la gravité. La vue de dessus du tronc cérébral isolé d’un poisson rouge, entièrement submergé par le CSF en circulation dans la chambre d’enregistrement, est représentée à droite. L’enregistrement des décharges motrices spontanées associées à la respiration a été effectué à partir des racines du nerf crânien VII (CN VII) à l’aide d’une électrode à succion. Figure modifiée à partir de Duchcherer et al. (2010). Chambre d’enregistrement Pompe électrique CSF oxygéné Rejet CN VII
17
3.
Contrôle neural de la respiration
3.1 Localisation des neurones respiratoires
3.1.1 Découverte du « nœud vital » de la respiration chez les mammifères
L’identification des neurones responsables du contrôle de la respiration est une étape primordiale à la compréhension des mécanismes cellulaires et synaptiques sous-jacents à la génération et à la régulation du rythme respiratoire. Bien que l’implication du tronc cérébral dans la respiration soit connue depuis plus de 200 ans, la localisation précise de ces neurones vint beaucoup plus tard et elle nécessita le développement de préparations in vitro de plus en plus sophistiquées. Au début des années 1800, Le Gallois (1813), désirant déterminer quelles structures étaient nécessaires à la respiration, utilisa une approche consistant à faire l’extraction de transsections du tronc cérébral et à en vérifier l’effet sur le rythme respiratoire. De cette manière, il parvint à localiser certains sites critiques dans la partie rostrale de la moelle ventrolatérale, près de la sortie du nerf vague (Le Gallois 1813, Feldman et McCrimmon 2003). Pierre Flourens, physiologiste français et contemporain de Le Gallois, baptisa « nœud vital » le centre de la respiration qu’il situa à l’intérieur du bulbe rachidien (Flourens 1858, Ramirez 2011). Après avoir examiné les projections afférentes et efférentes des nerfs associés à la respiration, Ramon y Cajal (1909) détailla davantage l’emplacement hypothétique de ces sites critiques entrevus par Le Gallois et Flourens. Ainsi, il mit en évidence l’importance de trois noyaux du tronc cérébral pour la rythmogenèse respiratoire : le noyau du tractus solitaire (nTS) et les noyaux commissuraux, cibles primaires des afférences pulmonaires, ainsi que le noyau ambigu (nA), contenant les neurones moteurs crâniens innervant les muscles des voies respiratoires supérieures (Ramon y Cajal 1909, Feldman et McCrimmon 2003). Des études lésionnelles subséquentes suggérèrent que des régions distinctes du cerveau contribuent à différentes formes de respiration (Lumsden 1923, Ramirez 2011). Ensuite vint la contribution d’Adrian et Buytendijk (1931) dont il a déjà été question plus tôt. Grâce à la préparation in vitro du tronc cérébral isolé, ces derniers apportèrent des preuves physiologiques appuyant la présence des circuits critiques de la respiration au sein du tronc cérébral (Adrian et Buytendijk 1931, Feldman et McCrimmon 2003). Gesell et ses collègues (1936) allèrent plus loin encore en enregistrant, à partir de neurones médullaires individuels, un patron d’activité en phase avec le rythme respiratoire (Gesell, Bricker et al. 1936, Feldman et
18
McCrimmon 2003). Plus tard, le raffinement de la préparation in vitro du tronc cérébral isolé par Suzue (1984) permît de reprendre la démarche initié par Legallois (1813) près de deux siècles auparavant, mais celle-ci bénéficia dès lors de la plus grande précision et reproductibilité des techniques contemporaines. De la sorte, Smith et al. (1991) parvinrent à isoler une petite région ventro-médullaire et bilatérale, nommée le complexe pré-Bötzinger (CPB), essentielle à l’expression du rythme respiratoire, en retirant de minces (50-75 µm) sections de l’extrémité rostrale ou caudale de la préparation en bloc tout en enregistrant l’activité respiratoire à partir de nerfs spinaux ou crâniens (Smith, Ellenberger et al. 1991, Feldman et McCrimmon 2003). Ils découvrirent, d’une part, que la destruction du CPB chez les rats néonataux induit l’abolition de l’activité respiratoire et que, d’autre part, l’activité respiratoire était maintenue à l’intérieur d’une mince coupe transversale du tronc cérébral contenant cette région (Smith, Ellenberger et al. 1991, Ramirez 2011). Ce ne fut qu’une question de temps avant que Johnson et al. (2001) démontrèrent qu’un simple « îlot » de tissu nerveux incluant le CPB, isolé par dissection à partir d’une telle coupe, pouvait générer un rythme relié à la respiration (Johnson, Koshiya et al. 2001, Feldman et McCrimmon 2003). Toutes ces découvertes suggérèrent que le CPB est à la fois nécessaire et suffisant pour générer le rythme respiratoire, du moins en conditions in vitro (Feldman et McCrimmon 2003). L’utilisation d’outils moléculaires et pharmacologiques modernes apporta un support accru à la notion selon laquelle le CPB serait le centre de la respiration, le fameux « nœud vital » de Flourens (Gray, Janczewski et al. 2001, McKay, Janczewski et al. 2005, Tan, Janczewski et al. 2008, Ramirez 2011), et de nouvelles données semblent indiquer que ce dernier joue un rôle essentiel dans la génération de toutes les formes de respirations (Bouvier, Thoby-Brisson et al. 2010, Gray, Hayes et al. 2010, Ramirez 2011). Toutefois, il est important de noter que le CPB n’est pas la seule région impliquée dans la formation du rythme respiratoire. En effet, un grand nombre de régions différentes participent à la respiration, telles que le néocortex, le cervelet, le pont et la moelle épinière. On a qu’à penser à la vocation, qui nécessite une orchestration corticale et sous-corticale complexe du contrôle respiratoire, ou encore aux émotions, comme la panique, qui altèrent considérablement la respiration (Ramirez 2011). De plus, comme il est expliqué plus loin, le rythme respiratoire est hautement régulé par l’activité de divers récepteurs, dont des
19 chémorécepteurs capables de discerner différents niveaux d’O2 et de CO2/pH dans le sang
ou dans l’eau (ou les deux), dépendamment de l’espèce (Milsom 2010a).
3.1.2 Distribution des neurones respiratoires chez les mammifères
C’est chez les mammifères que notre connaissance de la distribution des neurones respiratoires est la plus complète et avancée. Ainsi, j’aborde ce sujet en premier, car il est plus aisé de décrire la distribution des neurones respiratoires des ectothermes en faisant des parallèles avec celle des mammifères, que l’on comprend mieux. Chez ces derniers, les neurones respiratoires sont concentrés à l’intérieur de trois régions bilatéralement symétriques se situant dans le pont et la moelle épinière, mais ils n’y sont pas restreints (Bianchi, Denavit-Saubie et al. 1995, Rekling et Feldman 1998, Feldman et McCrimmon 2003). Ces neurones sont impliqués dans la génération du rythme respiratoire, le traitement des afférences et l’élaboration de la commande prémotrice (Duffin 2004). L’amas de neurones formant le CPB, décrit précédemment, ne constitue qu’une partie limitée d’une plus longue colonne de neurones respiratoires centrée en position ventrale par rapport au nA et s’étendant de l’extrémité caudale du noyau facial (nF) jusqu’à la moelle épinière cervicale rostrale. Selon la nomenclature actuelle, cette colonne respiratoire ventrolatérale est normalement divisée en trois sections. La section la plus rostrale, le complexe Bötzinger (CB), contient un grand nombre de neurones expiratoires bulbospinaux et propriobulbaires (Feldman et McCrimmon 2003). Le CB se situe dans une région nommée la moelle rostro-ventrolatérale (MRVL). Celle-ci contient une variété de types de neurones, y compris des motoneurones crâniens et un groupe majeur de neurones expiratoires inhibiteurs (Ezure, Tanaka et al. 2003, Duffin 2004). On y retrouve également le groupe respiratoire parafacial (GRpF), soupçonnée de jouer un rôle important dans la génération du rythme respiratoire en interagissant avec le CPB (Onimaru et Homma 2003, Duffin 2004, Milsom 2010a), ce dernier étant situé en position immédiatement caudale au CB (Rekling et Feldman 1998, Feldman et McCrimmon 2003, Duffin 2004). Il a été suggéré que le CPB est le site dominant de la génération du rythme respiratoire et que son rôle est d’induire l’activité inspiratoire alors que le GRpF, contenant un réseau de neurones pré-inspiratoire, induit l’activité expiratoire (Mellen, Janczewski et al. 2003, Feldman et Del Negro 2006, Milsom 2010a).
20
La section la plus caudale, le groupe respiratoire ventral (GRV), s’étend jusqu’à la moelle épinière et elle contient la majorité des neurones prémoteurs innervant les motoneurones inspiratoires et expiratoires dans la moelle épinière. Or, le GRV est lui-même subdivisé en deux sous-sections : le GRV rostral (GRVr) et le GRV caudal (GRVc). Le GRVr contient essentiellement des neurones prémoteurs inspiratoires innervant les motoneurones inspiratoires spinaux, incluant les motoneurones phréniques innervant le diaphragme, et les motoneurones intercostaux externes. Pour sa part, le GRVc contient surtout des neurones expiratoires et innerve des motoneurones expiratoires dont les axones se retrouvent principalement dans les nerfs intercostaux internes (Feldman et McCrimmon 2003). Une région intermédiaire, située au niveau de l’obex, contient à la fois des neurones inspiratoires et des neurones expiratoires. On y retrouve également des motoneurones crâniens du nA (Núñez-Abades, Pásaro et al. 1992, Duffin 2004). En position caudale au GRV, on retrouve les neurones inspiratoires cervicaux supérieurs (NICS) formant une colonne bilatérale s’étalant de l’atlas (C1) à l’axis (C2). L’importance fonctionnelle des NICS est encore mal comprise (Nonaka et Miller 1991, Lipski, Duffin et al. 1993, Yuan, Chandler et al. 2000).
Le groupe respiratoire dorsal (GRD), un autre groupe de neurones respiratoires médullaires, est centré dans la région ventrolatérale du noyau du tractus solitaire. Les neurones respiratoires du GRD sont étroitement associés aux fibres afférentes primaires rattachées aux poumons et aux voies respiratoires et parcourant les nerfs crâniens IX (glossopharyngien) et X (vague) (Feldman et McCrimmon 2003). Chez le rat, le rôle de ces neurones en est un de traitement des afférences et de relais (Hilaire, Monteau et al. 1990, Duffin 2004) alors que, chez le chat, ce groupe contient également des neurones prémoteurs innervant des motoneurones dans la moelle épinière (Duffin et Lipski 1987, Duffin 2004). De plus, quelques neurones respiratoires sont dispersés à l’intérieur de la formation réticulée : cette dernière forme une bande étendue en position dorsomédiane par rapport au nA. En raison de leur forte dispersion, ces neurones sont particulièrement difficiles à étudier et on sait très peu de chose sur leurs fonctions (Feldman et McCrimmon 2003).
Finalement, on retrouve des neurones respiratoires concentrés dans la portion dorsolatérale rostrale du pont. L’association de ces neurones avec les noyaux parabrachiaux médians
21 (nPM) et latéraux (nPL), ainsi qu’avec les noyaux Kölliker-Fuse (nKF), forme un
regroupement appelé le groupe respiratoire pontin (GRP) (Feldman et McCrimmon 2003). Celui-ci serait impliqué dans la régulation réflexe, le modelage des patrons d’activité respiratoire (Richter et Spyer 2001) et la respiration eupnéique chez les mammifères (Smith, Abdala et al. 2007, Milsom 2010a). Selon certains, ce groupe serait homologue au site paratrijumeau où est générée l’activité rythmique associée à la ventilation de la pompe buccale chez les lamproies et les poissons (voir plus bas) (Milsom 2010a). À titre de résumé, la localisation des différentes composantes du réseau respiratoire est représentée schématiquement à la figure 1.8.
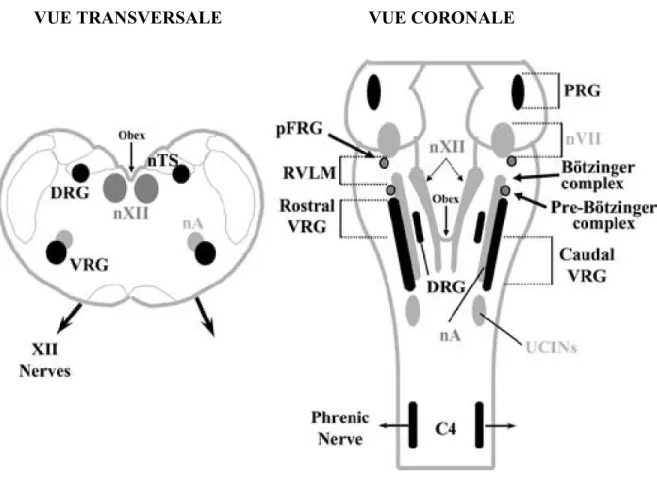
Figure 1.8 : Représentation schématique de la localisation des principaux groupes de neurones respiratoires dans le tronc cérébral et la moelle épinière des mammifères. La section transversale, à gauche, se situe approximativement au niveau de l’obex de la vue coronale, à droite. Abréviations : nA, noyau ambigu; nVII, noyau facial; nXII, noyau hypoglosse; nTS, noyau du tractus solitaire; DRG, groupe respiratoire dorsal; PRG, groupe respiratoire pontin; RVLM, moelle ventrolatérale rostrale; pFRG, groupe respiratoire parafacial; VRG, groupe respiratoire ventral; UCINs, neurones inspiratoires cervicaux supérieurs;
C4, segment correspondant de la moelle épinière. Figure modifiée à partir de Duffin (2004).
VUE CORONALE VUE TRANSVERSALE
22
3.1.3 Distribution des neurones respiratoires chez les ectothermes
Comme il a été mentionné précédemment, la rythmogenèse respiratoire est une fonction phylogénétiquement ancienne et fortement conservée chez les vertébrés (Hedrick 2001, Hedrick 2005, Vasilakos, Wilson et al. 2005, Kinkead 2009). Cela ne signifie pas pour autant qu'il n'existe pas certaines distinctions au niveau de l'organisation du réseau neuronal responsable de la rythmogenèse respiratoire entre les différents groupes de vertébrés. Par exemple, chez les lamproies adultes, de multiples enregistrements électrophysiologiques in vitro et in situ ont mis en évidence l’existence de deux rythmes respiratoires distincts : un rythme «·rapide·», correspondant à la principale commande motrice produisant le mouvement de l’eau à travers les fentes branchiales, et un rythme «·lent·», associé à de fortes contractions de la musculature entourant le panier branchial soupçonnées de servir à déloger des particules s’étant accumulées sur les branchies (Rovainen 1979, Kinkead 2009). Plusieurs évidences supportent l’hypothèse selon laquelle chacun de ces deux rythmes seraient générés par une différente paire d’oscillateurs centraux distribués bilatéralement. Le rythme «·rapide·» seraient généré dans la partie rostrale du rhombencéphale, plus précisément dans une région rostrolatérale au noyau trijumeau (nT) (Martel, Guimond et al. 2007, Milsom 2010a) nommée le groupe respiratoire paratrijumeau (GRpT) (Mutolo, Bongianni et al. 2007, Kinkead 2009), alors que le rythme «·lent·» serait produit dans une région du bulbe rachidien contenant les noyaux moteurs facial (nMF), glossopharyngien (nMG) et vague (nMV) (Kawasaki 1984, Rovainen 1996, Martel, Guimond et al. 2007, Kinkead 2009, Milsom 2010a). Bien qu’elle soit encore mal comprise, il a été démontré qu’il existe une interaction substantielle entre ces deux générateurs de rythme et que ces derniers sont modulés par des afférences sensorielles en provenance des branchies (Martel, Guimond et al. 2007, Kinkead 2009). Cela n’est pas sans rappeler les interactions entre le CPB et le GRpF des mammifères (Onimaru et Homma 2003, Duffin 2004, Milsom 2010a).
Pour ce qui est des poissons, on sait très peu de chose sur la localisation et la physiologie des circuits rythmogéniques chez cette classe de vertébrés (Kinkead 2009). Les quelques rares études consacrées à ce sujet suggèrent que le réseau respiratoire serait distribué de manière diffuse à l’intérieur du tronc cérébral, du moins chez certaines espèces (Shelton 1961, Duchcherer, Kottick et al. 2010). Ceci contraste fortement avec les réseaux nucléés
23 que l’on retrouve chez les amphibiens (Vasilakos, Kimura et al. 2006) et les mammifères
(Rekling et Feldman 1998). En effet, l'existence de «·nœuds vitaux·» essentiels à la rythmogenèse respiratoire, à l’instar du CPB chez les mammifères, reste encore à être démontrée chez les poissons. (Shelton 1961, Duchcherer, Kottick et al. 2010). Or, il serait prématuré de tirer une quelconque conclusion à ce sujet avant qu’un plus grand nombre d’études sur la neurologie respiratoire des poissons aient été effectuées. Wilson et al. (2000) ont démontré que la préparation in vitro du tronc cérébral isolé d’un lépisosté osseux (Lepisosteus osseus), un actinoptérygien pratiquant une forme primitive de respiration bimodale, produit deux patrons de décharges motrices distincts, l’un pouvant être associé à la respiration branchiale et, l’autre, à la respiration pulmonaire. Quoique limitées, ces données suggèrent que l'apparition du premier générateur de rythme respiratoire associé à la respiration aérienne date d'avant la divergence des sarcoptérygiens et des actinoptérygiens (Wilson, Harris et al. 2000, Kinkead 2009). Cependant, on ignore toujours si les neurones produisant le rythme branchial sont différents de ceux produisant le rythme pulmonaire (Kinkead 2009).
En revanche, chez les amphibiens, on sait que les circuits générant le rythme de haute fréquence et de faible amplitude associé à la ventilation branchiale (chez les têtards) ou buccale (chez les adultes) et le rythme de basse fréquence et de haute amplitude associé à la respiration pulmonaire sont fonctionnellement distincts (Galante, Kubin et al. 1996, Kinkead 2009). Une étude développementale a démontré que, chez les têtards pré-métamorphiques, les circuits générant le rythme respiratoire pulmonaire semblent être situés dans une région légèrement caudale au nerf vague alors que, après la maturation, les sites dominants de la génération du rythme respiratoire pulmonaire semblent être relocalisés dans une région plus rostrale du tronc cérébral, située entre les nerfs crâniens V et X (Torgerson, Gdovin et al. 2001b, Kinkead 2009). Ces résultats s’accordent avec ceux d’une autre étude, effectuée sur des grenouilles adultes, suggérant que la génération du rythme respiratoire pulmonaire prend naissance dans une région située entre les nerfs crâniens VIII et IX (McLean, Perry et al. 1995, Wilson, Vasilakos et al. 2002, Kinkead 2009), à proximité du nMF, du nMG et du nMV (Wilson, Vasilakos et al. 2002, Milsom 2010a). Pour sa part, le réseau responsable de la génération du rythme respiratoire branchial semble occuper une position plus rostrale, au niveau du nerf crânien X (Wilson, Vasilakos
24
et al. 2002, Kinkead 2009). Il existe un nombre important de similarités entre le générateur du rythme respiratoire pulmonaire de la grenouille et le CPB du rat : 1) ces deux circuits ne semblent pas dépendre de l’inhibition postsynaptique pour générer une activité rythmique pouvant être associée à la ventilation des poumons (Galante, Kubin et al. 1996, Shao et Feldman 1997, Wilson, Vasilakos et al. 2002), 2) ils sont tous deux situés dans la moelle ventrolatérale, entre les nMF et les nMG (Wilson, Vasilakos et al. 2002) et 3) chacun de ces sites semblent chémosensible au CO2-H+ (Torgerson, Gdovin et al. 2001a, Wilson, Vasilakos et al. 2002). Ainsi, il y a de fortes chances que ces deux circuits soient homologues (Vasilakos, Wilson et al. 2005, Kinkead 2009). Il existe également des similarités intéressantes entre les rythmes respiratoires buccal et pulmonaire des amphibiens et les deux rythmes respiratoires retrouvés chez les lamproies. Par exemple, la fréquence du rythme respiratoire buccal des amphibiens se situe entre 30 et 60 respirations/minute (Wilson, Vasilakos et al. 2002), ce qui est comparable à la fréquence du rythme respiratoire «·rapide·» des lamproies (Martel, Guimond et al. 2007), alors que les décharges pulmonaires se produisent en moyenne une fois par minute chez les amphibiens (Wilson, Vasilakos et al. 2002), une période semblable à celle du rythme «·lent·» des lamproies (Martel, Guimond et al. 2007). De plus, les décharges pulmonaires peuvent survenir seules ou en groupe (Wilson, Vasilakos et al. 2002) comme celles du rythme «·lent·» des lamproies (Martel, Guimond et al. 2007). Toutefois, les décharges buccales et pulmonaires de la grenouille sont approximativement de la même durée alors que, chez les lamproies, les décharges du rythme «·rapide·» sont beaucoup plus courtes que celles associées au rythme «·lent·» (Martel, Guimond et al. 2007).
Certaines évidences suggèrent que tous les sites majeurs mentionnés ci-dessus (le GRpT, le GRpF et le CPB) sont capables, sous les conditions appropriées, de générer un rythme indépendant chez toutes les espèces (St. John et Bledsoe 1985, Smith, Ellenberger et al. 1991, Onimaru et Homma 2003, Milsom 2010a). Cela implique que l’évolution du système de contrôle de la respiration est caractérisée par un déplacement caudal des sites prédominants où s’effectue la génération du rythme respiratoire à l’intérieur du tronc cérébral (Milsom 2010a).
25
3.2 Régulation du rythme respiratoire
La capacité du tronc cérébral de générer des décharges motrices rythmiques associées à la respiration en absence de signaux afférents semble être répandue chez tous les vertébrés. Cependant, le maintien de l’O2 et du CO2 sanguin à des niveaux adéquats nécessite que le système de contrôle de la respiration puisse répondre à diverses exigences environnementales et métaboliques en régulant le rythme respiratoire (Smatresk 1990). Cette régulation du rythme respiratoire s’effectue, entre autres, par la présence de chémorécepteurs : des variations de PO2, de PCO2 et de pH dans l’environnement immédiat
des chémorécepteurs, qu’il soit externe ou interne, altèrent l’activité de ces derniers, ce qui occasionne des changements réflexes au niveau de la ventilation qui permettront d’assurer l’homéostasie (Feldman et McCrimmon 2003).
3.2.1 Chémosensibilité périphérique et centrale à l’oxygène
Chez les vertébrés, on observe une réduction de la distribution des chémorécepteurs périphériques sensibles à l’O2 au cours de l’évolution : alors que les poissons et les amphibiens possèdent de multiples sites chémosensibles à l’O2 situés à plusieurs endroits, les mammifères et les oiseaux sont dotés d’un unique site récepteur dominant. À titre d’exemple, on retrouve, chez les poissons, des chémorécepteurs associés aux quatre arcs branchiaux ainsi qu’à la cavité orobranchiale capables de détecter différents niveaux d’O2 aussi bien dans le sang que dans l’eau. À l’inverse, chez les mammifères, l’ensemble des chémorécepteurs périphériques sensibles à l’O2 se retrouvent exclusivement au niveau des corps carotidiens (Gilmour 2001, Perry et Gilmour 2002, Milsom et Burleson 2007, Milsom 2010a) et aortiques, ces derniers étant souvent considérés comme accessoires par rapport aux premiers (Piskuric et Nurse 2012, Piskuric et Nurse 2013). Par conséquent, chez les mammifères, le champ de détection des chémorécepteurs sensibles à l’O2 est limité au sang artériel. Deux évènements pourraient expliquer cette tendance. Le premier est la transition d’une respiration aquatique ou bimodale vers une respiration strictement aérienne (Milsom 2010a). En effet, considérant l’occurrence fréquente de l’hypoxie dans les environnements aquatiques (Smatresk 1990), la capacité de détecter des changements de PO2 à de multiples endroits, incluant l’environnement extérieur, présente certainement un
avantage pour les vertébrés pratiquant la respiration aquatique (Milsom 2010a). L’air étant beaucoup plus riche en O2 que l’eau (Dejours 1989), on peut raisonnablement spéculer que