Faculté de génie
Département de génie électrique et de génie informatique
Développement de la nanostructuration de
germanium par gravure électrochimique pour
des applications en tant qu’anode sur puce
pour batterie lithium-ion
Thèse de doctorat
Spécialité : génie électrique
Arthur DUPUY
Sherbrooke (Québec) Canada
Pr. Richard Arès
DirecteurPr. Abderraouf Boucherif
CodirecteurPr. Lionel Roué
ÉvaluateurPr. Julien Sylvestre
ÉvaluateurPr. Jocelyn Veilleux
ÉvaluateurLe stockage d’énergie représente actuellement un des domaines les plus étudiés au monde. Issue d’années de recherche, la batterie lithium-ion s’est imposée comme le système de stockage par excellence, que cela soit pour les voitures, les ordinateurs ou même pour les technologies autonomes et connectées participant à l’Internet des objets (Internet of
Things en anglais, IoT). Le germanium, candidat intéressant pour les matériaux anodiques,
possède une capacité 4 fois supérieure au graphite (1600 mAh g−1) et présente, malgré une
capacité 2.6 fois inférieur, une meilleure mobilité électronique ainsi qu’une meilleure dif-fusion d’ion lithium que le silicium. Afin de minimiser l’impact de l’expansion volumique lors de lithiation, il est nécessaire de nanostructurer le matériau. La méthode la plus trans-posable et déjà mature pour l’obtention de silicium poreux est la gravure électrochimique, et plus précisément la porosification électrochimique. Cependant, le germanium subit un véritable verrou technologique via cette technique, dû notamment à un manque de possi-bilités dans les morphologies pouvant être obtenues. De plus, une dissolution continue du matériau concurrençant le mécanisme de porosification a également lieu. Dans le cadre de cette thèse, une architecture unique d’anode sur puce à base de germanium mésoporeux et graphène est développée, permettant d’atteindre 1000 cycles avec une capacité surfacique
de 1 mAh cm−2 pour un taux de décharge de C/5 mais également 4000 cycles avec une
capacité de 0.083 mAh cm−2 à des temps de décharge de l’ordre de la minute. De même,
la porosification électrochimique du germanium a été approfondie pour développer des structures anisotropes à porosité fermée et ouverte, présentant des performances record une fois en anode sur puce. Plus précisément, il a été observé pour ces structures une
effi-cacité coulombique de premier cycle de 98.3% pour une tenue de 398 cycles à 1 mAh cm−2
avec un taux de décharge 2C. L’utilisation de procédés simples et peu coûteux tels que la gravure électrochimique, la gravure chimique et la croissance de graphène par CVD s’est révélée très efficace et innovante permettant d’augmenter significativement le temps de vie du matériau anodique et d’accéder à des applications versatiles dans le stockage d’énergie. Ainsi l’architecture d’anode développée sur germanium permettra une intégration facilitée dans l’industrie. Plus particulièrement, une telle architecture pourrait répondre à la de-mande croissante des objets connectés autonomes en participant aux développements des technologies répondant aux besoins du marché de l’IoT, soit les micro-batteries, batteries solides ou encore les systèmes sur puce.
Mots-clés :Germanium mésoporeux, Électrochimie de semi-conducteur, Graphène, Anode
Development of germanium nanostructuration by electrochemical etching as on-chip anode for lithium-ion battery application
Energy storage is currently one of the most studied areas in the world. Based on years of research, lithium-ion batteries have established themselves as the main used storage system, whether for cars, computers or even for autonomous and connected technologies participating in the Internet of Things (IoT). Germanium, an interesting candidate for
an-odic materials, has a capacity 4 times greater than graphite (1600 mAh g−1) and, despite a
2.6 times lower capacity, has better electronic mobility as well as better diffusion of lithium ion than silicon. In order to minimize the impact of volumic expansion during lithiation, it is necessary to nanostructure the material. The most scalable and mature method on silicon being electrochemical etching. However, germanium is undergoing a real techno-logical barrier via this technique, due to a lack of possibilities in the morphologies that can be obtained. In addition, a continuous dissolution of the material competing with the porosification mechanism also takes place. As part of this thesis, an unique on-chip anode architecture based on graphene-coated mesoporous germanium is developed, making it
possible to reach 1000 cycles with a surface capacity of 1 mAh cm−2 for a discharge rate
of C/5 but also 4000 cycles with a capacity of 0.083 mAh cm−2 at one-minute discharge
time. Likewise, the electrochemical etching of germanium has been deepened to develop anisotropic structures with closed and open porosity, exhibiting record performances once used as on-chip anode. More precisely, it was observed for these structures an initial
coulombic efficiency of 98.3% with life cycle of 398 at mAh cm−2 with a discharge rate of
2C. The use of simple and inexpensive processes such as electrochemical etching, chemical etching and growth of graphene by CVD has proved to be very efficient and innovative allowing to significantly increase the lifetime of the anodic material and to access to versa-tile applications in energy storage. Thus, the anode architecture developed on germanium will allow easier integration into industry. More particularly, such an architecture could meet the growing demand for autonomous connected objects by participating in the de-velopment of technologies meeting the needs of the IoT market, such as micro-batteries, solid-state batteries or on-chip storage systems.
Keywords: Mesoporous germanium, Semiconductor electrochemistry, Graphene, On-chip
Tout d’abord, je remercie sincèrement mes directeurs de thèse, Pr. Richard Arès et Pr. Abderraouf Boucherif, pour leur encadrement tout au long de mon doctorat. Richard, ton esprit scientifique accéré, ta jovialité de tous les jours et ta disponibilité ont été d’une grande aide pendant ce doctorat. Abderraouf, ta soif d’entreprendre, tes discussions pas-sionnées et ta vision scientifique ont et seront toujours un modèle pour l’éternel étudiant que je suis.
J’exprime mes remerciements aux Pr. Lionel Roué, Pr. Jocelyn Veilleux et Pr. Julien Sylvestre d’avoir accepté de faire partie de mon jury de thèse et pour les corrections per-tinentes, qui m’ont aidé à améliorer le manuscrit final.
De nombreuses personnes ont aussi collaboré à ces travaux, et je tiens à les remercier. Dr. Aude Roland pour sa collaboration active tout au long de ce projet. Dr. Mohammad Reza Aziziyan, pour l’aide et les conseils apportés au fur et à mesure de la thèse. Dr. Denis Machon pour son soutien et ses corrections. Pr. Gessie Brisard pour m’avoir permis de manipuler en département de chimie et Valerie Charbonneau qui m’a aidé à approfondir mes connaissances dans les batteries. Leurs aides m’ont été précieuse.
Je veux exprimer également mes remerciements aux doctorants et post-doctorants du groupe de recherche : Stéphanie Sauze, Alex Brice Poungoué Mbeunmi, Mohamed El-Gahouchi, Alexandre Heintz, Sofiane Abdelouhab, ainsi que tous les autres, les nouveaux, qui d’une façon ou d’une autre m’ont aidé pendant cette thèse. De même, je souhaite remercier l’ensemble des ingénieurs, techniciens et professionnels de recherche des plate-formes du 3IT, LNN et LCSM. Merci en particulier à René Labrecque, Caroline Roy, Hubert Pelletier, Guillaume Bertrand, Daniel Blackburn, Étienne Grondin, Etienne Pa-radis et Pierre Langlois. Également, j’aimerai remercier Dr. Lionel Santinacci, qui m’a motivé dans ma poursuite de carrière scientifique et avec qui j’ai eu le plaisir de conver-ser lors de conférences. Merci aussi aux Dr. Olivier Marconot et Dr. Guillaume Gommé pour leurs conseils avisés quant à l’écriture du manuscrit. Petite mention spéciale pour ma tante Marie-Stéphane qui a dû corriger entièrement l’orthographe et la grammaire de cette thèse.
Et finalement un gros merci à ma famille, qui par leur soutien constant dans les différentes étapes de ma vie, ont fait de moi ce que je suis aujourd’hui. Je dédie plus particulièrement cette thèse à mes parents, qui ont su m’insuffler amour et inspiration depuis toujours. Ma réussite est leur réussite.
Merci aussi à toi, Laura, qui a su malgré les moments difficiles me soutenir et m’accom-pagner depuis toutes ces années.
Enfin, parce qu’il y a celle que l’on hérite, mais également celle que l’on choisit, j’aimerai remercier mes deux autres familles, celle des amis depuis toujours, celle de Compiègne, qui malgré l’éloignement et les différences, est et restera présente. Puis celle de Sherbrooke, qui a rendu cette aventure québécoise si unique, si parfaite. Encore une fois merci.
Ce travail a été financé par différents organismes qui sont le CRSNG, FQRNT, CQMF et Innovéé.
1 Introduction 1
2 État de l’art 5
2.1 Les systèmes de stockage . . . 5
2.2 L’Internet des objets et micro-batteries . . . 6
2.3 Batteries électrochimiques . . . 10
2.3.1 Généralités . . . 10
2.3.2 Fonctionnement d’une batterie lithium-ion . . . 11
(a) Les électrodes . . . 12
(b) L’électrolyte . . . 17
(c) Le séparateur . . . 17
2.3.3 Caractérisation d’une batterie . . . 18
(a) Potentiel en circuit ouvert . . . 18
(b) Voltamétrie cyclique . . . 19
(c) Analyse galvanostatique . . . 19
(d) Spectroscopie d’impédance électrochimique . . . 21
2.3.4 Matériaux actifs anodiques . . . 22
(a) Limitations . . . 23
(b) Stratégie de réduction . . . 25
2.3.5 Électrode sur puce . . . 33
2.3.6 Réflexion et contribution . . . 36
2.4 Gravure par voie électrochimique . . . 37
2.4.1 Rappels théoriques . . . 38
(a) Électrochimie . . . 38
(b) Physique de semi-conducteurs . . . 43
(c) Électrochimie de semi-conducteurs . . . 44
2.4.2 Porosification électrochimique du silicium . . . 48 xi
2.4.3 Porosification électrochimique du germanium . . . 51
(a) Régime de gravure . . . 51
(b) Propriétés et applications . . . 60
(c) Défis et objectifs . . . 61
2.5 Croissance de graphène . . . 61
3 Article : Intégration monolithique de germanium mésoporeux en tant qu’anode sur puce à haute performance 65 3.1 Avant-propos . . . 65
3.2 Abstract . . . 67
3.3 Introduction . . . 68
3.4 Material and methods . . . 70
3.4.1 Electrochemical Etching . . . 70
3.4.2 Graphene coating growth . . . 70
3.4.3 Fabrication of a CR2032 cell . . . 71
3.4.4 Characterization . . . 71
3.5 Results and discussion . . . 72
3.5.1 Structural characterization . . . 72
3.5.2 Electrochemical characterization . . . 74
(a) Cyclic voltammetry . . . 74
(b) Electrochemical impedance spectroscopy . . . 75
(c) Galvanostatic measurements . . . 77 3.5.3 Post-mortem characterizations . . . 84 3.6 Conclusions . . . 86 3.7 Author statement . . . 86 3.8 Acknowledgements . . . 87 3.9 Supplementary material . . . 87
3.9.1 Image treatment with ImageJ software . . . 87
3.9.2 FTIR characterization of the mpGe sample . . . 88
3.9.4 Potential curve as a function of capacity and discharge time . . . . 89
3.9.5 Calculation of theoretical capacity and the associated discharge current 90 3.9.6 Calculating mass percentage of the quantity of graphene coating relative to the quantity of porous germanium . . . 92
3.9.7 Voltage-capacity curve during the high power density cycling . . . . 93
4 Article : Nanostructures anisotropes de germanium mésoporeux par gra-vure électrochimique bipolaire rapide 95 4.1 Abstract . . . 97
4.2 Introduction . . . 97
4.3 Experimental . . . 99
4.3.1 Electrochemical etching process . . . 99
4.3.2 Chemical etching process . . . 100
4.3.3 Characterization . . . 100
4.3.4 Preparation of electrodes and coin cell fabrication . . . 101
4.4 Results and discussion . . . 101
4.4.1 Synthesis of porous germanium with tubular morphology . . . 101
(a) Influence of etching current density . . . 101
(b) Influence of total time of porosification . . . 105
(c) Influence of passivation time and etching current density . 108 4.4.2 Fabrication of columnar porous germanium . . . 115
4.4.3 Integration of T-PGe and C-PGe as on-chip anode . . . 117
4.5 Conclusion . . . 120
4.6 Author statement . . . 121
4.7 Acknowledgment . . . 121
4.8 Supplementary material . . . 122
4.8.1 Cross-section SEM views of tubular samples with different total time of porosification . . . 122
4.8.2 Linear fitting of porosity values measured during the total time of porosification study . . . 123
4.8.3 Valence dissolution calculation as a function of total time of porosi-fication . . . 123
4.8.4 Evolution of the reactive surface area at the pore tips as a function
of total time of porosification . . . 125
4.8.5 Cross section SEM view of chemically etched T-PGe samples . . . . 126
4.8.6 Pore size distribution by ImageJ, for T-PGe and C-PGe samples . . 127
4.8.7 Cyclic voltammetry of T-PGe and C-PGe on-chip anodes at various rates . . . 128
4.8.8 Charge-discharge plot of bulk Ge used as on-chip anode . . . 129
5 Conclusion générale 131 A Étude physico-chimique de nanocomposite à base de semi-conducteur et de graphène 135 A.1 Avant-propos . . . 135
A.2 Abstract . . . 137
A.3 Introduction . . . 137
A.4 Fabrication . . . 137
A.4.1 Electrochemical etching . . . 138
A.4.2 Chemical Vapor Infiltration . . . 138
A.5 Characterization . . . 139
A.5.1 Chemical stability . . . 139
A.5.2 Physical properties . . . 140
A.6 Application as on-chip anode for Lithium-ion batteries . . . 140
A.7 Conclusion . . . 141
A.8 Author statement . . . 141
A.9 Aknowledgement . . . 141
2.1 Différents moyens de stockage en fonction de la quantité d’énergie stockée
et du temps de décharge (adapté de [20]) . . . 6
2.2 Représentation graphique du nombre de systèmes participant à l’IoT ces 30 dernières années (adapté de [21]) . . . 7 2.3 Évolution du marché des micro-batteries de 2018 à 2025 pour l’Amérique
du nord, l’Europe, l’Asie-Pacifique et le reste du monde (adapté de [24]) . 8
2.4 Sommaire des technologies d’alimentation pour systèmes IoT : avantages et inconvénients (adapté de [25]) . . . 9 2.5 Diagramme de Ragone montrant la puissance spécifique vs l’énergie
spéci-fique pour différents systèmes de stockage (adapté de [26]) . . . 11
2.6 Illustration d’une batterie lithium-ion en charge, composée d’oxyde de
li-thium métallique et de germanium . . . 12
2.7 Étape de fabrication d’électrode à base de poudre. (1) Mélange des compo-sants, (2) étalement de l’encre sur collecteur de courant, (3) recuit thermique et (4) découpe des électrodes . . . 14 2.8 Capacité spécifique d’une cellule complète en fonction de la capacité
spéci-fique de l’anode, et considérant que la cathode est du LiCoO2 (adapté de
[38]) . . . 16 2.9 Sommaire des anodes métalliques et leurs caractéristiques en batterie
lithium-ion. Référence pour Li [39], Si [4], Ge [40], Sn [41], Al [42]et C [43] . . . 17 2.10 Courbe OCV obtenue pour la demi-cellule à base de silicium mésoporeux
en poudre . . . 18 2.11 Courbe de voltamétrie cyclique obtenue pour la demi-cellule à base de
sili-cium mésoporeux en poudre . . . 19 2.12 Courbe potentiel-capacité du 1er cycle, obtenue pour la demi-cellule à base
de silicium mésoporeux en poudre . . . 20 2.13 Diagramme de cycle de vie et d’efficacité coulombique, obtenu pour la
demi-cellule à base de silicium mésoporeux en poudre . . . 21
2.14 Exemple de courbes EIS pouvant être obtenues sur une batterie lithium-ion,
(a) diagramme de Nyquist,(b) et (c) diagrammes de Bode . . . 22
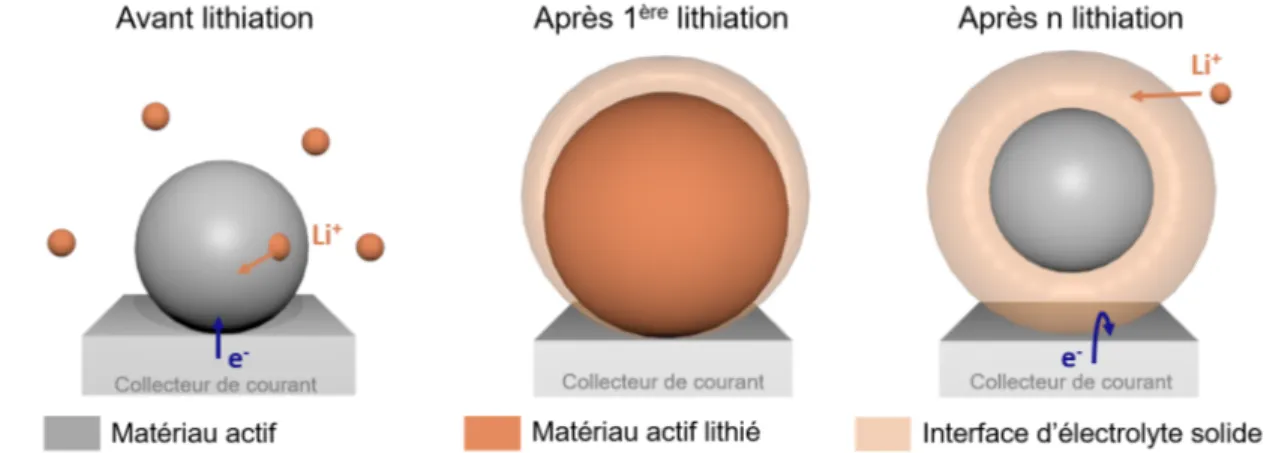
2.15 Illustration du phénomène d’expansion volumique pour une particule . . . 23
2.16 Illustration du phénomène d’interphase d’électrolyte solide pour une particule 24 xv
2.17 Illustration des changements volumiques pouvant apparaître lors du cyclage électrochimique de Si [40] . . . 26 2.18 (a) Illustration de la supercapacité à base de silicium poreux recouvert de
graphène, (b) Voltamétrie cyclique, (c) courbes I-V et (d) diagramme de
Ragone des anodes sur puce de silicium poreux avec et sans graphène [90] 34
2.19 (a) Illustration des trois régimes de lithiation sur silicium poreux recouvert de carbone : supercapacité, batterie à haute puissance et intercalation pro-fonde (b) Diagramme de Ragone des anodes sur puces pour les différents régimes de lithiation et (c) Extrapolation de l’énergie totale pouvant être
stockée en fonction du temps des vies de chacun des régimes étudiés [91] . 35
2.20 Représentation d’un possible arrangement d’anode sur puce en batterie "solid-state"(adapté de [92]) . . . 37 2.21 Illustration d’un système électrochimique lors de la porosification (ou
oxy-dation) de germanium . . . 39 2.22 Illustration du transfert de charge à l’interface électrolyte/électrode. La
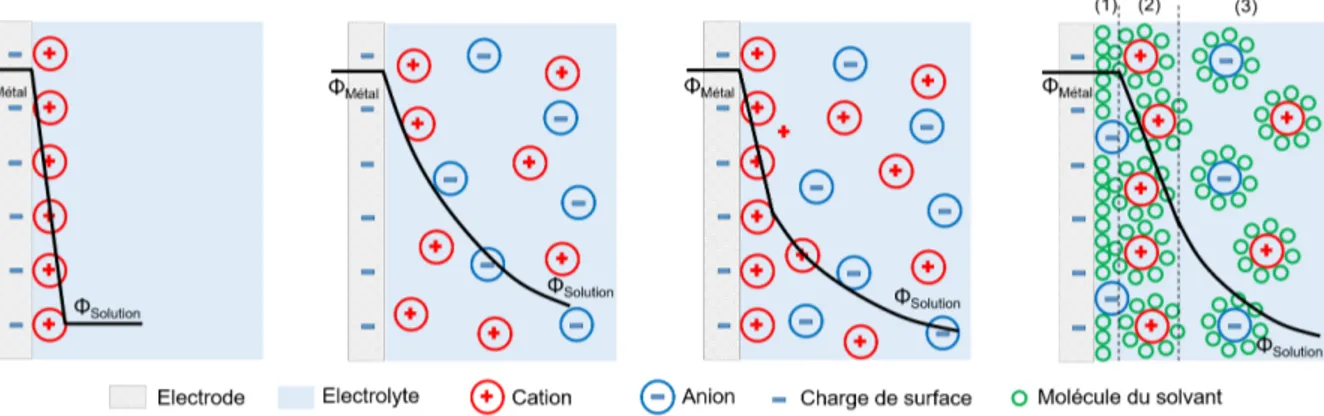
longueur des flèches est proportionnelle à la quantité de charges qui traverse la double couche électrique dans chaque direction par unité de surface et par unité de temps. [93] . . . 41 2.23 Représentation schématique des modèles de double couche électrochimique
(de gauche à droite) Helmholtz, Gouy-Chapman, Stern et BDM, avec (1) couche interne d’Helmholtz, (2) couche externe d’Helmholtz et (3) couche diffuse de Gouy-Chapman. . . 43 2.24 Schéma théorique établi selon la théorie des bandes d’énergie indiquant la
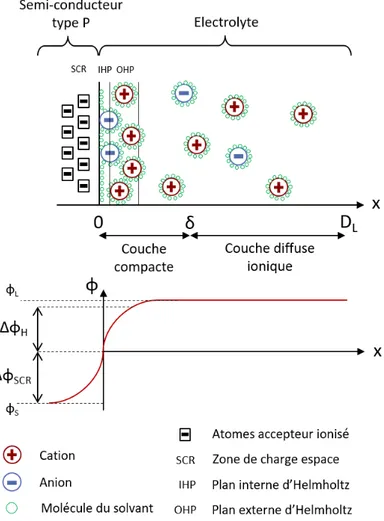
position respective de la bande de valence et de la bande d’énergie pour un métal, un semi-conducteur et un isolant . . . 44 2.25 Représentation de (en haut) la double couche électrochimique et (en bas)
la répartition du potentiel, à l’interface semi-conducteur et électrolyte . . . 45
2.26 Diagramme de bande d’une interface semi-conducteur de type p/électrolyte (a) avant mise en contact et (b) à l’équilibre . . . 46
2.27 Simulation des courants traversant le semi-conducteur . . . 48
2.28 Illustration du mécanisme de porosification de Si [104] . . . 49
2.29 Courbes I-V de silicium type p en contact avec de l’HF. (En haut) La ligne solide représente la réponse sans illumination et celle en pointillé avec illumination [8]. (En bas) Zoom sur la zone rouge de la première image. Les équations divalentes et tétravalentes présentes sont respectivement liées aux
régimes de porosification et d’électropolissage (adapté de [6]) . . . 50
2.30 Illustration du modèle de formation des pores secondaires selon la surtension [9] . . . 52
2.31 Profil de gravure par courant pulsé bipolaire sans initiation (à gauche) [10] et avec initiation (à droite) [11] . . . 53 2.32 Images SEM en vue de côté des 6 morphologies possibles de Ge mésoporeux
par CBEE [13] . . . 55 2.33 a) Images SEM en vue de côté et illustration de germanium mésoporeux
composé des 3 morphologies spongieuse (en bleu), en arête de poisson (en rouge) et ramifiée (en vert), b) réaction électrochimique à la surface du Ge pour le pulse anodique et cathodique, et c) illustration de la nucléation et
la croissance des pores en fonction du degré de passivation [14] . . . 57
2.34 Illustration des différences entre les régimes de gravure CBEE et FBEE selon (a) le profil galvanostatique, (b) les observations SEM en section et (c) les variations du taux de gravure et de la porosité en fonction de la densité de courant de gravure [15] . . . 59 2.35 Formes allotropiques de carbone constituées de structure graphène :
fulle-rène (en vert), nanotube de carbone (en mauve) et graphite (en bleu) [118] 62
2.36 Schéma étape par étape de la croissance de graphène par CVD(adapté de [123]). (1) Activation thermique, (2) Diffusion gazeuse des réactifs (du flux principal vers la couche barrière), (3) Adsorption des réactifs en surface, (4) Dissolution et diffusion dans le substrat, (5) Activation thermique milieu-surface, croissance du film, (6) Désorption, (7) Diffusion au travers de la couche barrière et retour dans le flux principal et (8) Convection forcée (extraction des gaz) . . . 63 3.1 Comparison between the conventional and on-chip anode synthesis
me-thods. The solid-line (top) window, related to the on-chip method, shows
the sole step to obtain a porous-based on-chip anode. . . 71
3.2 Cross-sectional SEM image at x15K and x100K magnification for (a)(c) mpGe and (b)(d) GPGNC samples, respectively. (e)(f) Raman spectra of
mpGe and GPGNC samples. . . 73
3.3 Cyclic voltammetry curves at 1 mV s-1 potential rate for mpGe and GPGNC anodes. . . 74
3.4 (a) Nyquist plots at the frequency range of 105 Hz to 10−2 Hz with an
amplitude of 5 mV, (b) Bode representation of the impedance and (c) Bode
representation of phase angle for mpGe and GPGNC anodes. . . 76
3.5 (a)(b) Charge-discharge plot with Coulombic efficiency for, respectively, mpGe and GPGNC electrodes. (c)(d) Voltage-capacity profiles at 2C rate for, respectively, mpGe and GPGNC electrodes. (e) Schematic illustration of the lithiation/delithiation processes with a mesoporous on-chip electrode, with and without graphene. . . 78
3.6 For mpGe and GPGNC samples at 2C discharge rate, (a) Cumulated irre-versible capacity plot vs. cycle number and (b) discharge voltage cut-off vs. cycle number. . . 81 3.7 (a) Charge-discharge plot with Coulombic efficiency (b) Voltage-capacity
profile for GPGNC anode at C/5 discharge rate. . . 83
3.8 Charge-discharge profile for GPGNC anode at high discharge rate, to high-light high power density application (5 mA cm−2). . . . 84
3.9 Post-mortem observation of mpGe sample after 335. (a) Cross-sectional SEM view of mpGe at x50K magnification, (b) top SEM view of mpGe at x100K magnification. . . 85 3.10 An example of imaging treatment using 3D Object Counter” plugin of
Ima-geJ for mpGe sample. The red surface is corresponding to the crystallite surface after threshold adjusting level. The two pictures at the bottom
re-present with colors the different surface participating to the treatment. . . 88
3.11 Absorbance spectrum of mpGe sample by FTIR spectroscopy. . . 89
3.12 Pore size distribution of mpGe sample using ImageJ. . . 90
3.13 Galvanostatic curve of GPGNC on-chip anode at 2 mA cm−2 without
ca-pacity limitation. . . 91 3.14 Illustration of the geometries in the case of a 3-layer graphene coating on
porous germanium crystallite . . . 93 3.15 Typical voltage-capacity curve of GPGNC electrode during the high rate
cycling at 5 mA cm−2 . . . . 94
4.1 Schematic illustration of the two processes, electrochemical and chemical etching, used to synthesize T-PGe and C-PGe . . . 100 4.2 Cross-section SEM view of porous germanium with sponge-like and/or
tu-bular morphologies, etched during 120 min with an etching current density
of a) 15 mA cm−2, b) 20 mA cm−2 c) 25 mA cm−2 and d) 30 mA cm−2. All
SEM images were taken with a x15k magnification, except for the Figure 4.2 (d) taken with a x20k magnification . . . 101 4.3 Evolution of a) porous layer thickness with morphologies representation as a
function of the etching current density, b) the number of mole of germanium reacting during porosification, for sponge-like, tubular and both morphologies103 4.4 a) Cross-sectional SEM view at 150K magnification for a total etching time
from 30 min to 360 min. Evolution of b) pore thickness and wafer dissolu-tion, c) porosity, and d) crystallite size and pore size as a function of total time of porosification. e) Schematic illustration of tubular porous morpho-logy evolving through the germanium wafer. . . 105
4.5 a) Cross-section view SEM images at 50K magnification for various current densities and passivation pulse durations and evolution of b) porosity, c) pore thickness, d) crystallite size and e) pore size as a function of etching current density with a passivation pulse duration of 0.1 s (◻), 0.15 s (◯) and 0.2 s (△) . . . 109 4.6 Evolution of a) pore density, b) vertical growth rate and c) lateral growth
rate in function of etching current density with a passivation pulse duration of 0.1 s (◻), 0.15 s (◯) and 0.2 s (△) . . . 111 4.7 Schematic illustration of the porous layer evolution for etching current
den-sity of 10, 15 and 20 mA cm−2 and passivation pulse time of 0.10, 0.15 and
0.20 s . . . 113 4.8 Cross-section SEM view of optimized tubular porous morphology at x12k
magnification and the evolution of porosity as a function of porous layer thickness . . . 114 4.9 Cross section SEM view of a) T-PGe, b) T-PGe etched after 1 s dipping
time in 5 times diluted solution, c) T-PGe etched after 5 s dipping time in 5 times diluted solution and d) C-PGe synthesized in 3 times diluted etching solution with 1 s dipping time. Evolution of e) porosity, f) pore thickness, g) crystallite and h) pore size, as a function of dipping time, for the etching solutions diluted 3 and 5 times . . . 116 4.10 Cyclic voltammetry of T-PGe and C-PGe on-chip anodes at potential rate
of (a) 0.1 V s−1 and (b) 0.001 V s−1, to highlight pseudo-capacitance and
deep-intercalation applications, respectively . . . 118 4.11 Charge-discharge plot for (a)(b) pseudo-capacitance application (high
di-scharge rate) and (c)(d) for deep-intercalation application (with coulombic efficiency at 2C discharge rate) of T-PGe and C-PGe samples used as on-chip anodes . . . 119 4.12 Cross-section SEM views of tubular samples with different total time of
porosification at lower magnification . . . 122 4.13 Linear fit of porosity values in function of total time of porosification . . . 123 4.14 Value of dissolution valence for porous layer formation and wafer dissolution
as a function of total time of porosification . . . 125 4.15 Evolution of the reactive surface area at the pore tips as a function of total
time of porosification . . . 126 4.16 Cross section SEM view of chemically etched T-PGe samples for different
diluted solution and various dipping time . . . 127 4.17 Imaging treatment by ImageJ of (a) T-PGe and (b) C-PGe samples to
4.18 Cyclic voltammetry of T-PGe and C-PGe on-chip anodes, at (a) 10, (b) 1, (c) 0.1 and (d) 0.001 V s−1 potential rates . . . 129
4.19 Charge-discharge plot with coulombic efficiency of bulk Ge used as on-chip anode . . . 130 A.1 Schematic view of the process to synthesize GPNC . . . 138 A.2 Cross-section SEM view of a) PGe and b) PSi and c) Raman spectra of
D-band and G-band for GPSNC and GPGNC samples . . . 139
A.3 a) Voltage profiles of GPGNC between 0.8 and 3 V vs Li+/Li and b)
2.1 Équivalence des C-rate avec les temps et courant de décharge pour un ma-tériau actif d’électrode de germanium de 1 mg et une capacité spécifique de 1600 mAh g−1 . . . . 13
2.2 Liste d’anodes nanostructurées à base de silicium et leurs performances en batterie . . . 28 2.3 Liste d’anodes nanostructurées à base de germanium et leurs performances
en batterie . . . 29 2.4 Liste d’anodes nanostructurées à base de composite silicium/carbone et
leurs performances en batterie . . . 31 2.5 Liste d’anodes nanostructurées à base de composite germanium/carbone et
leurs performances en batterie . . . 33 3.1 Cycling performance summary obtained for mpGe and GPGNC on-chip
anode at 2C rate . . . 79 3.2 Values of discharge current and time for related C-rate used with mpGe
and GPGNC anodes . . . 92 A.1 Chemical resistance of non-graphenized and graphenized porous Si and Ge
semiconductors. Three symbols are used to describe the materials dissolu-tion : ”C” resistant and ”X” etching or morphological variadissolu-tion . . . 139 A.2 Physical properties of non-graphenized and graphenized porous Si and Ge
semiconductors . . . 140
Acronyme Définition en français
CBEE Gravure électrochimique bipolaire conventionnelle
CE Efficacité coulombique
CLO Orientation selon les lignes du courant
CO Orientation selon le cristal
CV Voltamétrie cyclique
CVD Dépôt en phase vapeur
CVI Infiltration en phase vapeur
EIS Spectroscopie d’impédance électrochimique
FBEE Gravure électrochimique bipolaire rapide
GEIS Spectroscopie d’impédance électrochimique galvanostatique
GPNC Nanocomposite poreux recouvert de graphène
GPGNC Nanocomposite de germanium poreux et graphène
GPSNC Nanocomposite de silicium poreux et graphène
IoT Internet des objets
LIB Batterie lithium-ion
PEIS Spectroscopie d’impédance électrochimique potentiostatique
PSi Silicium poreux
PGe Germanium poreux
mpGe Germanium mésoporeux
T-PGe Germanium poreux tubulaire
C-PGe Germanium poreux colonnaire
SEI Interphase d’électrolyte solide
SCR Zone de charge espace
SEM Microscopie électronique à balayage
Introduction
Stocker l’énergie électrique de façon viable et durable représente pour l’humanité un vé-ritable défi technologique. Les meilleurs candidats pour les particuliers sont actuellement les batteries lithium-ion, mises au point en 1980 par Murphy et al. [1] et Lazzari et al. [2]. Leur intérêt réside dans l’utilisation du lithium, qui se trouve être l’élément le plus électronégatif avec la plus faible masse, facilitant grandement l’architecture des systèmes de stockage pour d’importantes densités d’énergie. Cependant, avec une demande crois-sante d’énergie et de puissance pour des systèmes de plus en plus élaborés (car de plus en plus consommateurs : téléphonie, véhicule, capteur), il est nécessaire de revoir chaque composant de ces batteries pour les améliorer. Plus précisément, avec l’émergence des technologies connectées et autonomes, l’Internet de objets (Internet of Things en anglais, IoT), ces composants doivent d’être miniaturisés, allégés, résistants à leur environnement, possédant d’importantes densités d’énergie et de puissance, d’avoir une empreinte envi-ronnementale faible et d’être facilement intégrables aux techniques de fabrication de l’in-dustrie. Ces objectifs peuvent être atteints si les problématiques matériaux de la batterie sont résolues. Notamment, il en existe une majeure quant à la durabilité des électrodes et leur capacité de stockage, lors des processus de lithiation/délithiation au cours des cycles charge/décharge [3]. Actuellement, le graphite est majoritairement utilisé de par son faible coût et sa tenue de vie relativement grande (200 cycles) mais souffre d’une faible capacité
spécifique (372 mAh g−1) [3, 4]. Dans le cas du graphite, cathode et anode limitent la
capacité de la batterie comme sa durée de vie. Mais dans le cas où l’anode possède une capacité bien supérieure à celle de la cathode, seule sa durée de vie est limitante. Il est alors plus facile de venir modifier l’anode pour en augmenter les performances.
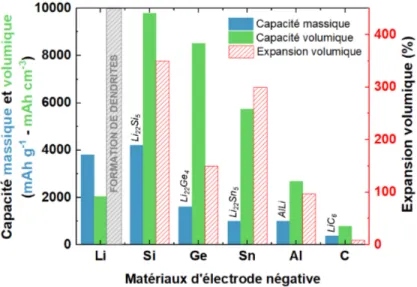
C’est le cas avec les semi-conducteurs du groupe IV, qui ces dernières années, connurent un intérêt grandissant. Plus particulièrement, le silicium (Si) et le germanium (Ge), qui peuvent respectivement stocker 11 et 4 fois plus de capacité pour un gramme d’électrode que le graphite. Néanmoins, l’utilisation de ces deux matériaux, qui forment un alliage avec le lithium lors de la lithiation, provoque l’apparition de deux phénomènes indési-rables. Le premier, appelé expansion volumique, intervient lors du processus de lithiation et augmente drastiquement le volume initial du matériau utilisé en électrode. Dues aux contraintes mécaniques que cela engendre, des fissures peuvent apparaître et se développer jusqu’à la pulvérisation complète du matériau anodique interrompant alors le contact
trique de ce dernier et le collecteur de courant. Le second, appelé Interphase d’Électrolyte Solide (Solid Electrolyte Interphase en anglais, SEI), apparaît quand le semi-conducteur est en contact avec l’électrolyte et est équivalent à un film de passivation se formant à sa surface, consommant le lithium présent dans le système. Ces deux phénomènes indésirables sont les principales sources des chutes de capacités précoce et sont observés lors des cycles de charge/décharge de la batterie. Au fil des années, il a été démontré que la nanostruc-turation de ces semi-conducteurs pouvait réduire les contraintes induites par l’expansion volumique en créant au sein du matériau des espaces vacants. En parallèle, fonctionna-liser la surface de l’électrode permet de réduire la formation de SEI et donc diminuer la consommation irréversiblede lithium qui est directement reliée à la capacité irréversible du système [5]. La nanostructuration du silicium est une méthode mature et pleinement explorée ces dernières années, que ce soit par des synthèses chimiques, électrochimiques ou même plasmas [6, 7, 8]. Dans le cas du germanium, la nanostructuration reste un vé-ritable défi. Plus particulièrement, celle par voie électrochimique est encore incomprise et ne recense actuellement que quelques études [9, 10, 11, 12, 13, 14, 15]. Cela dit, bien que plus onéreux (car 6 fois plus cher que du silicium), le germanium présente de plus intéressantes propriétés que le silicium une fois utilisé en anode dans les batteries. Non seulement la mobilité des électrons et trous s’y trouve plus grande(400 fois celle du silicium [16]), mais également le coefficient de diffusion des ions lithium au sein du matériau (10 000 fois supérieur à celle du silicium [16]). De plus, le Ge subit une expansion volumique plus faible que le Si (150% contre 350%) et est un meilleur catalyseur pour la croissance d’espèce carbonée [17, 18]. Enfin, il a été montré que les anodes à base de Ge poreux ont une grande tenue en température, entre -20 et 60°C [19], ce qui fait du germanium un candidat des plus intéressants pour les anodes en batterie lithium-ion.
La présente thèse consiste ainsi à développer la porosification électrochimique du ger-manium, en démontrant l’émergence de nouvelles morphologies et en prouvant leur per-formance en batterie. Une nouvelle architecture d’anode sera également mise en avant, appelée « on-chip », qui consiste à conserver la partie nanostructurée sur son substrat, permettant (i) la diminution des étapes de synthèse du matériau anodique et (ii) d’obtenir un contact électrique parfait entre le collecteur de courant et le matériau actif (ici la couche de Ge poreux). Les objectifs seront de démontrer dans un premier temps la faisabilité et l’intérêt des structures de Ge poreux, ainsi que du nanocomposite à base de Ge poreux et graphène sur puce. Dans un second temps, l’influence de différentes morphologies poreuses sur les performances de batteries sera étudiée. La contribution originale de ce document réside dans l’étude de germanium nanostructuré par des voies facilement industrialisables et appliquées en architecture d’anode sur puce, diminuant le nombre d’étapes de synthèse
et pouvant s’intégrer directement en ligne de production.
La démarche scientifique proposée se base sur l’élaboration d’un matériau anodique nano-composite sur puce, axée sur trois aspects : (i) la nanostructuration du Ge par anodisation électrochimique, (ii) la fonctionnalisation de surface par du graphène via un dépôt chimique en phase vapeur (Chemical Vapor Deposition en anglais, CVD) et (iii) l’utilisation de l’ar-chitecture sur puce, permettant l’application de taux de décharge rapide et la suppression des composants d’électrode ne participant pas au processus de lithiation. L’adoption et la démonstration de cette approche contribuent non seulement à faciliter l’utilisation de matériaux nanostructurés à haute performance dans les batteries lithium-ion, mais aussi à améliorer les performances d’anode à base de Ge utilisée dans les batteries. De plus, la démonstration de cette approche sur puce pourra ouvrir la voie à l’intégration d’anodes directement sur gaufre en ligne de production.
Ce document est constitué de cinq chapitres. L’introduction s’attache à souligner l’intérêt à développer le nanocomposite à base de Ge mésoporeux et graphène pour minimiser les phénomènes à l’origine des chutes de capacité dans les batteries et à démontrer l’intérêt de l’architecture sur puce. Le CHAPITRE 2 offre une revue de l’état de l’art relative aux différentes technologies de stockage d’énergie existant actuellement, en mettant l’accent sur les batteries lithium-ion et les défis qui leurs sont associés. Des rappels théoriques sur l’électrochimie de semi-conducteur seront également proposés, en développant particulière-ment les récents travaux sur l’anodisation de germanium. En dernière partie, les stratégies employées pour synthétiser du graphène, mono et multicouches seront expliquées. Les mé-thodes d’intégration les plus prometteuses sont également identifiées dans ce chapitre. Le CHAPITRE 3 présente un article publié dans le journal Material Today Communication, y résumant le développement de nanocomposites de Ge poreux et graphène et ses per-formances en tant qu’anode sur puce. Il est montré expérimentalement que des régimes à faible comme à fort taux de décharge peuvent être utilisés, faisant du nanocomposite une anode pouvant assumer de grandes densités d’énergie comme de grandes densités de puissance. Les bénéfices de l’utilisation de graphène sont également démontrés par l’ob-tention de plus longs cycles de vie, allant jusqu’à 1000 cycles pour une capacité surfacique
de 1 mAh cm−2, correspondant théoriquement à une capacité spécifique de 1428 mAh g−1
pour des temps de décharge de 5 heures. Enfin le CHAPITRE 4 présente un article publié dans le journal Electrochimica Acta résumant le développement de la porosification de Ge et plus particulièrement l’émergence de morphologies anisotropes par gravure électrochi-mique bipolaire rapide. Plus précisément, une morphologie poreuse colonnaire, obtenue par une étape de gravure chimique appliquée sur une structure poreuse tubulaire, présente
des performances électrochimiques en tant qu’anode sur puce intéressantes, en particulier pour des applications en pseudo-capacitance.
État de l’art
Le présent chapitre, ayant pour objectif d’introduire le sujet de recherche et d’effectuer un état de l’art bibliographique concis et précis, est construit selon deux axes. Le pre-mier concerne les technologies de stockage d’énergie, et plus particulièrement les batteries lithium-ion. Il sera abordé dans cette partie le principe de fonctionnement de la batterie, les méthodes de caractérisation, les phénomènes indésirables à l’origine de la chute de capa-cité ainsi que les solutions existantes et envisagées pour réduire ces phénomènes. Le second axe concerne la méthode de nanostructuration utilisée lors de ce projet de recherche, qui est la gravure électrochimique. Plusieurs rappels théoriques concernant l’électrochimie et la physique des semi-conducteurs seront faits, ainsi qu’une revue de littérature exhaustive sur la porosification du germanium.
2.1
Les systèmes de stockage
Les technologies de stockage d’énergie électrique peuvent être classées en différentes ca-tégories, selon le mécanisme de stockage utilisé. La Figure 2.1 recense une partie de ces technologies, classées selon l’énergie qu’elles peuvent stocker et le temps de décharge. On trouve ainsi le stockage d’énergie mécanique (volants d’inertie, pompage hydraulique), le stockage et la conversion d’énergie chimique (piles à combustible), le stockage d’énergie thermique et thermochimique (centrales solaires thermiques), le stockage d’énergie élec-trique (condensateurs) et enfin le stockage d’énergie électrochimique (super-condensateurs, pseudo-condensateurs et batteries). Toutes ces technologies diffèrent également par leur puissance, c’est-à-dire la quantité d’énergie qu’elles peuvent fournir en fonction du temps qu’elles mettent à la délivrer (appelée temps de décharge). Ainsi dans une même catégorie, deux technologies distinctes peuvent avoir des puissances différentes. Par exemple pour le stockage d’énergie mécanique, les volants d’inertie stockent peu d’énergie (< 10 kWh) mais leur temps de décharge est de l’ordre de la minute, ce qui représente une puissance d’environ 625 kW. À l’inverse le pompage hydraulique peut stocker une grande quantité d’énergie (> 100 000 kWh) mais aura des temps de décharge de l’ordre de l’heure, soit une puissance de 1 MW. De par ces caractéristiques, chaque catégorie de stockage a son application dédiée. Pour les particuliers, ce sont les systèmes de stockage d’énergie élec-trique, chimique et électrochimique qui sont le plus utilisés et qui connaissent ces dernières années un intérêt grandissant.
Figure 2.1 Différents moyens de stockage en fonction de la quantité d’énergie stockée et du temps de décharge (adapté de [20])
2.2
L’Internet des objets et micro-batteries
Avec la miniaturisation des technologies, la recherche de systèmes énergétiquement auto-nomes et l’émergence du « tout connecté », un nouveau marché de niche est apparu, appelé Internet des Objets (Internet of Things en anglais, IoT). Ce marché a pour objectif de dé-velopper des systèmes d’analyse et de mesure, miniaturisés et interconnectés, permettant de rassembler de nouvelles masses de données sur le réseau internet et donc de nouvelles connaissances. Actuellement soutenues et développées par des géants du web et industriels tels qu’Intel, IBM, Google ou encore Bouygues, les applications d’une telle technologie sont nombreuses et en constante croissance. Comme le montre la Figure 2.2 ci-dessous, le nombre de systèmes participant à l’IoT augmente de façon quasi-exponentielle, et est estimé au nombre de 50 milliards pour l’année 2020.
Que ce soit dans le transport, l’environnement, le marketing ou encore l’automobile, il existe un véritable besoin de mesurer et analyser la majeur partie des données récoltées. Cependant comme toutes les nouvelles technologies, l’IoT amène un certain nombre de défis :
– Sur un plan éthique d’abord vis-à-vis de la surveillance du consommateur,
– Sur un plan environnemental aussi au vu de la production importante de systèmes électroniques (25 milliards d’unités attendues pour 2020),
Figure 2.2 Représentation graphique du nombre de systèmes participant à l’IoT ces 30 dernières années (adapté de [21])
Concernant le dernier point sur l’autonomie énergétique, deux axes de recherche sont ac-tuellement en cours. Le premier est basé sur la récupération d’énergie et notamment le développement de technologies photovoltaïques [22] et thermoélectriques [23], tandis que le second est tourné vers les systèmes de stockage d’énergie adaptés aux demandes de l’IoT. Plus précisément, il est important de développer un système de stockage miniaturisé et performant, avec une empreinte écologique diminuée. De plus, le coût, la masse et surtout le volume du système de stockage étant prépondérants sur la technologie complète, ces contraintes doivent être également prises en compte. Un système de stockage miniaturisé est appelé « micro-batterie », dont la taille est de l’ordre du mm. Son fonctionnement est équivalent à une batterie classique, cependant la limitation en volume et en masse des matériaux délivrant et stockant l’énergie nécessite de repenser le design et le fonctionne-ment du système. Une micro-batterie, tout comme une batterie classique, est constituée de deux électrodes et un électrolyte. Comme ce dernier est souvent de nature solide pour les micro-batteries il fait à la fois office de milieux de transport pour les ions et de séparateur. Afin de gagner en densité de puissance et d’énergie, les micro-batteries sont pensées afin de maximiser la surface spécifique et minimiser la longueur de diffusion des charges. Ainsi, les micro-batteries possèdent un design qu’il leur est propre, en 3D, qui peut être divisé en 4 catégories : Piliers interdigités, en tranchée, concentrique et apériodique.
Avec l’augmentation de la demande IoT, le marché des micro-batteries évolue, augmentant de 42% entre 2018 et 2020 (soit de 110 à 156 millions de $USD). Comme montré dans la Figure 2.3, les prévisions de marché pour les micro-batteries suivent l’évolution de l’IoT,
avec un marché atteignant les 631 millions $USD d’ici 2025.
Actuellement, les différentes technologies existantes pour les micro-batteries sous soumises à certains verrous technologiques. Le Tableau 2.4 ci-dessous les résume en précisant leurs avantages et inconvénients respectifs.
Figure 2.3 Évolution du marché des micro-batteries de 2018 à 2025 pour l’Amé-rique du nord, l’Europe, l’Asie-Pacifique et le reste du monde (adapté de [24])
Comme résumé dans ce tableau 2.4, ce sont les technologies de batterie rechargeable ainsi que les super-condensateurs qui peuvent être utilisées à court terme. Cependant, dans un objectif d’intégration et de facilité, les batteries tout-solide (possédant un électrolyte solide) ou « imprimables »(issues d’une impression 3D) représentent les candidats in-téressants au long terme pour le stockage d’énergie IoT. C’est dans cette optique que le domaine du stockage «micro» s’est développé, avec notamment le développement de super-condensateurs et batteries à base de lithium, sodium, à électrolyte liquide et solide et aux architectures 1D, 2D et 3D.
Figure 2.4 Sommaire des technologies d’alimentation pour systèmes IoT : avan-tages et inconvénients (adapté de [25])
°
Les systèmes électrochimiques et électriques sont particulièrement étudiés pour les appli-cations IoT. La Figure 2.5 illustre par un diagramme de Ragone la puissance spécifique (représentant la puissance maximale rapportée à la masse du système) et l’énergie spé-cifique (représentant l’énergie maximale délivrée normalisée par la masse) de chacun de ces systèmes ainsi que l’objectif visé par la recherche et l’industrie. Les condensateurs représentent la première et la plus simple forme d’un dispositif de stockage d’énergie. Il en existe deux sortes, électrolytique et diélectrique, dont les capacités respectives sont de l’ordre du milliFarad (mF) et du microFarad (µF). Les super-condensateurs (également appelés condensateurs électrochimiques ou ultra-condensateurs) se composent de deux électrodes séparées par un séparateur perméable aux ions (comme le carton, la céramique, le verre, le plastique ou le papier) et un électrolyte qui relie ioniquement les deux
élec-trodes. Dans un super-condensateur, la charge est stockée soit par séparation de la charge à l’interface électrode/électrolyte (connue sous le nom de capacité électrochimique à double couche) ou par transfert de charge faradique via des réactions redox (connues sous le nom de pseudo-capacitance). Les batteries sont une autre classe de dispositifs de stockage d’énergie. Les batteries sont constituées de deux électrodes séparées par un électrolyte, tout comme les super-condensateurs. Cependant, les batteries ne stockent pas réellement d’énergie électrique. Les batteries sont des dispositifs qui stockent de l’énergie sous forme chimique à l’intérieur des matériaux actifs des électrodes. Plus précisément, c’est via les réactions d’oxydo-réduction ou l’intercalation des ions dans la structure de l’électrode qui convertira l’énergie chimique en énergie électrique et inversement. Les batteries lithium-ion fonctionnent sur ce principe, avec l’utilisation du lithium qui vient s’intercaler ou former des liaisons avec l’électrode. C’est notamment ce dernier système qui intéresse la présente thèse et qui sera explicité dans la prochaine partie. Parallèlement aux deux domaines de recherche les plus populaires axés sur les batteries et les super-condensateurs, ces dernières années, certains matériaux d’électrodes de type super-condensateurs ont été couplés à des matériaux de type batterie pour produire des systèmes de stockage d’énergie hybrides. Dans les dispositifs de stockage d’énergie hybrides, deux électrodes avec des comporte-ments de stockage de charge différents, par exemple un capacitif (super-condensateur) et un faradique (batterie), sont combinées ; la première sert de source d’alimentation tandis que la seconde sert de source d’énergie. Le comportement d’un système hybride ressemble à celui d’une batterie rechargeable avec une puissance et/ou une durée de vie plus éle-vée, ou d’un super-condensateur avec une énergie plus élevée. Une telle intégration offre des possibilités de progrès dans le domaine du stockage d’énergie et les performances de ces systèmes se situent généralement entre celles d’un super-condensateur et celles d’une batterie.
2.3
Batteries électrochimiques
2.3.1
Généralités
Les batteries électrochimiques sont l’un des dispositifs de stockage d’énergie qui conver-tissent l’énergie chimique stockée dans les électrodes directement en énergie électrique par des réactions d’oxydo-réduction ou des réactions de transfert de charge. Il existe deux types fondamentaux de batteries : (i) les batteries primaires, communément appelées batteries non rechargeables, et (ii) les batteries secondaires, appelées batteries rechargeables [27]. Dans cette classification, d’autres sous-genres sont également utilisés pour mieux classer les batteries en fonction de structures ou de conceptions particulières [26]. On y retrouve ainsi les batteries stationnaires et à flux, à base de dissolution et d’intercalation, fermées
Figure 2.5 Diagramme de Ragone montrant la puissance spécifique vs l’énergie spécifique pour différents systèmes de stockage (adapté de [26])
ou ouvertes, aqueuses et non aqueuses, à électrolyte solide (sec) et à électrolyte liquide (humide) et enfin les piles acides ou alcalines. Les batteries lithium-ion sont majoritaire-ment à électrolyte liquide, bien que dernièremajoritaire-ment un intérêt particulier apparaît pour les électrolytes solides.
2.3.2
Fonctionnement d’une batterie lithium-ion
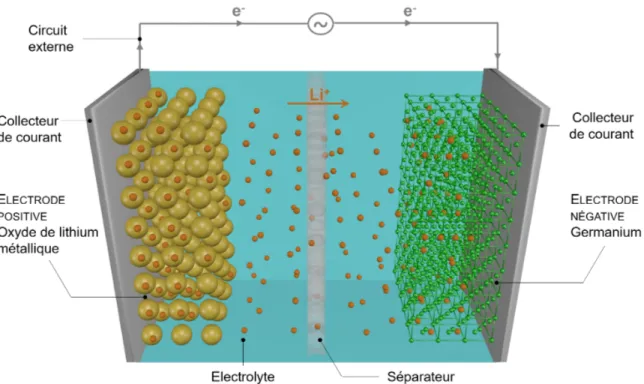
La batterie Li-ion (Lithium-ion battery en anglais, LIB) est actuellement le système de stockage le plus utilisé. Le lithium est apparu comme élément de stockage idéal, de par son faible rayon atomique, sa faible masse et sa forte électronégativité qui lui permet d’être très réactif. Généralement les LIBs, en tant que batteries de pointe, sont basées sur l’intercalation et l’extraction des ions Li dans les électrodes. La Figure 2.6 illustre les différents composants d’une telle batterie. On y distingue :
– Une électrode positive – Une électrode négative – Un électrolyte
– Un séparateur – Un circuit externe
Figure 2.6 Illustration d’une batterie lithium-ion en charge, composée d’oxyde de lithium métallique et de germanium
(a) Les électrodes
Les électrodes sont des composants actifs du système de stockage d’énergie et sont utilisées pour charger les matériaux actifs. Elles permettent aux électrons de passer d’une demi-cellule à l’autre, via un circuit externe. Par convention, l’électrode négative est appelée anode, tandis que l’électrode positive est appelée cathode. Une telle notation est une adap-tation des batteries primaires qui ne peuvent être déchargées qu’une fois, pour lesquelles l’anode est toujours l’électrode négative et donc le lieu de l’oxydation et la cathode la positive, soit le lieu de la réduction. Les équations d’oxydo-réduction associées au lithium avec un métal M pour l’oxydation et la réduction sont respectivement :
M Lix→ M + x.Li++ x.e− (2.1)
et
M + x.Li++ x.e−→ MLix (2.2)
Une cellule secondaire, par exemple dans une batterie rechargeable, est une cellule dans laquelle les réactions chimiques sont réversibles. Lorsqu’une cellule secondaire est en cours de charge, l’anode devient la borne positive et la cathode la borne négative. C’est-à-dire qu’à l’inverse de la décharge, une réduction a lieu sur la borne positive et une oxydation
sur la borne négative. Ce sont donc les désignations anode/cathode qui changent si la cellule se charge/se décharge. En d’autres termes, pendant le processus de charge, le pôle négatif de la cellule est la cathode. Pendant le processus de décharge, la situation s’inverse et le pôle négatif de la cellule est donc l’anode. Lorsqu’une batterie Li-ion est en charge, le matériau actif de l’électrode positive abandonne certains de ses ions lithium, qui migrent à travers l’électrolyte vers l’électrode négative, stockant ainsi l’énergie. Les processus in-verses se produisent lorsque la batterie se décharge. Le potentiel chimique du lithium dans les deux électrodes entraîne la diffusion des ions Li+ hors de l’électrode négative, générant à la fois un flux d’ions Li+ de l’électrode négative vers l’électrode positive à travers l’élec-trolyte mais également un flux d’électrons, toujours de l’électrode négative vers l’électrode positive, à travers le circuit externe.
L’énergie fournie par une batterie dépend de la capacité de stockage de charge (libéra-tion et absorp(libéra-tion de lithium) des matériaux actifs d’électrode et des réac(libéra-tions d’oxydo-réduction qui se produisent au niveau des deux électrodes. Cette capacité, appelée capacité spécifique, peut se calculer théoriquement et expérimentalement par les deux équations suivantes : Ctheo= x.F Mma (2.3) Cexp= I.t mma (2.4)
avec x le nombre d’électrons échangés, F la constante de Faraday (96485 C mol−1), M
mala
masse molaire du matériau actif d’électrode, I le courant appliqué, t le temps de décharge
et mma la masse du matériau actif d’électrode.
Dépendamment du courant appliqué aux électrodes, il est possible de charger/décharger plus ou moins rapidement l’énergie contenue de la batterie, équivalent à la capacité spé-cifique du matériau actif utilisé. Un terme est utilisé pour quantifier ce courant, que l’on appelle « C-rate », et qui s’exprime xC (courant appliqué pour décharger la capacité spé-cifique en 1/x heure). Si on considère une électrode possédant en matériau actif 1 mg de
germanium (dont la capacité spécifique théorique est de 1600 mAh g−1), les équivalences
entre C-rate, temps de décharge t et courant de décharge I seront :
Tableau 2.1 Équivalence des C-rate avec les temps et courant de décharge pour un matériau actif d’électrode de germanium de 1 mg et une capacité spécifique
de 1600 mAh g−1
C-rate C/40 C/20 C/10 C/5 1C 2C 5C 10C
t (h) 40 20 10 5 1 0.5 0.2 0.1
Cependant, le système électrochimique pouvant être soumis à des phénomènes de cinétique limitants tels que le transport de masse ou le transfert de charge, appliquer un C-rate trop élevé peut ne pas laisser le temps aux ions lithium de s’intercaler dans l’électrode. Une valeur inférieure de capacité est alors observée.
Le matériau actif doit également être conçu pour permettre l’intercalation et la désinterca-lation des espèces réactives dans tout le matériau. De façon générale, les matériaux actifs sont réduits en poudre puis mélangés avec un liant polymère (PVdF, NMP, SCMS, PAA, PI, CMC) et un agent conducteur (noir de carbone, noir d’acétylène). Le mélange alors obtenu est étalé sur un collecteur de courant (Cu ou Al) comme le montre la Figure 2.7. Les collecteurs de courant sont utilisés pour permettre une recombinaison efficace entre électrons et ions, permettant le stockage/déstockage de lithium dans l’électrode. Cepen-dant, le développement de matériaux actifs d’électrodes hautement conducteurs, tels que des nanotubes de carbone interconnectés, du graphène ou des carbures métalliques 2D à conductivité métallique, peut éliminer le besoin de collecteurs de courant [28]. Il sera éga-lement vu dans cette thèse que l’utilisation de germanium fortement dopé, nanostructuré sur son substrat, permet d’éliminer le collecteur de courant.
Figure 2.7 Étape de fabrication d’électrode à base de poudre. (1) Mélange des composants, (2) étalement de l’encre sur collecteur de courant, (3) recuit thermique et (4) découpe des électrodes
(a).i. L’électrode positive
Un certain nombre de revues intéressantes, traitant des progrès sur la synthèse de ma-tériaux actifs pour électrode positive de batteries, ont été publiées [29, 30, 31]. Le pôle
positif des LIBs est généralement constitué de LiMO2 (M=Co, Ni, Mn) [32], LiMn2O4
notamment mis en avant les principales limitations de chacune de ces cathodes. Ainsi il
apparaît que la synthèse de LiCoO2 a un coût élevé et que sa diminution de capacité
pen-dant un cyclage profond est importante. Concernant LiNiO2, une instabilité thermique
qui réduit facilement le Ni3+ à haute température a été remarquée. LiMnO2 souffre de
faibles performances de cyclage en raison de la conversion de sa structure en couches en structure spinelle lors du processus de délithiation. Enfin, concernant les composés LiM P O4, leur principale faiblesse est leur mauvaise conductivité électrique et ionique et
donc leur faible densité de puissance. Pour contourner ces limitations, les phases pures des matériaux actifs des électrodes sont parfois dopées avec d’autres éléments pour améliorer leurs performances de stockage d’énergie [35].
Également, diverses stratégies ont été adoptées afin de minimiser les limitations de chaque matériau. L’une des approches les plus efficaces consiste à nanostructurer le matériau actif des électrodes à la fois permettant d’augmenter sa surface d’échange (ou spécifique), de stimuler le transfert de charge et de réduire les voies de diffusion des ions Li. Cependant, bien que cette méthode puisse être bénéfique aussi bien du point de vue cinétique que mécanique, elle offre aussi des désavantages qui demandent de la coupler avec d’autres stratégies.
(a).ii. L’électrode négative
Le choix du matériau actif d’électrode négative est presque limité aux matériaux à base de carbone [36] ainsi qu’aux matériaux d’anode de conversion, d’intercalation et d’alliage [37]. Actuellement le graphite est le matériau principalement utilisé en tant qu’anode dans les LIBs. Ses avantages résident dans son faible coût et une conductivité électrique moyenne.
Cependant, sa faible capacité spécifique de 372 mAh g−1, correspondant à la formation
de LiC6, est devenue limitante ces dernières années avec les récents développements faits
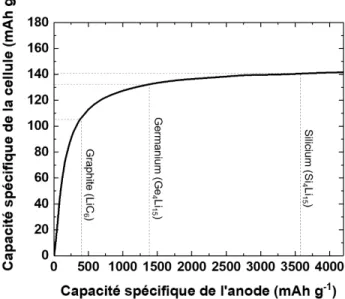
sur la cathode. A titre d’exemple, la Figure 2.8 ci-dessous montre l’influence du matériau anodique sur la capacité spécifique de la batterie complète (ou cellule complète) dans la
cas d’une électrode positive de LiCoO2. Dans cette disposition, l’utilisation d’une
élec-trode négative à base de graphite permet d’avoir une capacité spécifique de cellule de 105
mAh g−1, tandis qu’une électrode à base de germanium ou de silicium permet d’obtenir
Figure 2.8 Capacité spécifique d’une cellule complète en fonction de la capacité
spécifique de l’anode, et considérant que la cathode est du LiCoO2 (adapté de
[38])
D’autres matériaux sont devenus des candidats intéressants, comme recensés dans la Fi-gure 2.9. Le lithium métallique peut être utilisé en anode avec les matériaux cathodiques explicités précédemment. Cependant, il est également possible de l’utiliser en cathode pour l’étude électrochimique de matériaux anodiques. Dans un cas comme dans l’autre on parle de demi-cellule, permettant d’étudier une seule électrode telle qu’utilisée pour les études matériaux. Ce système de demi-cellule sera l’unique dispositif utilisé pendant cette thèse. Les demi-cellules offrent une quantité quasi-infinie de lithium à stocker, cependant elle souffre de la formation de dendrites pouvant créer un court-circuit et entraîner l’échauf-fement du dispositif. Les demi-cellules sont de par ce fait, peu appliquée à la production industrielle, bien que ces dernières années de nouvelles batteries Li-LFP tout solide ont été développé à l’échelle industriel. Les semi-conducteurs de groupe IV, Si et Ge sont apparus comme d’intéressants candidats, de par non seulement leur grande capacité théorique, mais également la facilité avec laquelle il est possible de venir les structurer. L’aluminium (Al) et l’étain (Sn) sont également de bons candidats possédant une capacité théorique supérieure au graphite mais inférieure au semi-conducteur. Néanmoins ces matériaux offrent moins de flexibilité dans leurs propriétés que les semi-conducteurs de groupe IV. Les problèmes liés aux matériaux actifs anodiques, en particulier lors de l’utilisation de silicium et de germanium, ainsi que les méthodes existantes pour pallier ces problèmes, sont approfondis en partie 2.3.4.
Figure 2.9 Sommaire des anodes métalliques et leurs caractéristiques en bat-terie lithium-ion. Référence pour Li [39], Si [4], Ge [40], Sn [41], Al [42]et C [43]
(b) L’électrolyte
L’électrolyte est un liquide, un gel ou une substance solide chimiquement stable qui assure la conduction des ions dans la cellule. On peut distinguer [44] :
– Les électrolytes inertes qui n’interviennent absolument pas dans les réactions d’oxydo-réduction,
– Les électrolytes oxydo-réducteurs capables de subir des réactions de transfert de charge faradiques,
– Les électrolytes d’additifs d’oxydo-réduction dans lesquels des espèces actives sont incluses pour permettre des réactions de transfert de charge aux interfaces électro-de/électrolyte.
L’électrolyte dans les batteries lithium-ion est souvent synthétisé à base de sel (LiBF4,
LiP F6, LiAsF6, LiCIO4, LiT F SI) et de solvants organiques (EC, PC, DEC, DMC,
DMM). Pour garder les électrodes électriquement neutres, les électrons se déplacent à travers un circuit externe et se dirigent vers l’électrode positive. Ainsi, le flux d’ions à travers l’électrolyte et le mouvement des électrons via le circuit externe sont des processus interconnectés et si l’un s’arrête, l’autre aussi.
(c) Le séparateur
Un séparateur est une membrane électriquement isolante mais ioniquement conductrice, placée entre les bornes positive et négative de la cellule. Le séparateur empêche
l’auto-décharge instantanée et le court-circuit électrique entre les deux électrodes, tout en per-mettant le transport des ions.
2.3.3
Caractérisation d’une batterie
Différents types de caractérisation permettent de remonter aux performances des batteries. Il sera introduit ici les caractérisations d’une demi-cellule dont l’anode (de masse active de 2.6 mg) est composée de 56% de silicium mésoporeux en poudre, 30% de carbone amorphe et 14% de polymère styrène-butadiène. Le taux de cyclage est de C/50, soit un courant de décharge de 0.149 mA appliqué pendant 50 h. Seuls les spectres d’impédance électrochi-mique sont issus de simulation, les caractérisations expérimentales n’ayant pas pu donner des données adéquates.
(a) Potentiel en circuit ouvert
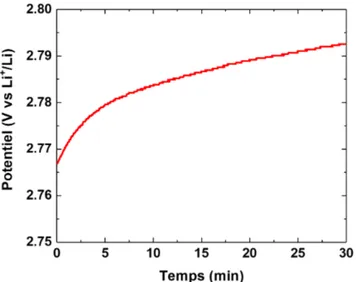
Le potentiel en circuit ouvert (Open Circuit Voltage en anglais, OCV) consiste à observer l’évolution de la tension du système sans qu’aucun courant ne le traverse. Elle permet notamment de déterminer le potentiel d’équilibre électrochimique du système qui atteint une valeur limite ou fluctue autour de cette valeur au bout d’un certain temps. La Figure 2.10 correspond à l’OCV obtenue sur une demi-cellule Li métal/silicium mésoporeux. Un potentiel en circuit ouvert de 2.79 V est observé après 30 min d’expérience. Cependant ce potentiel n’étant pas encore stable, un temps plus long est nécessaire d’appliquer pour permettre d’atteindre l’équilibre électrochimique de notre système.
Figure 2.10 Courbe OCV obtenue pour la demi-cellule à base de silicium mé-soporeux en poudre
(b) Voltamétrie cyclique
Le voltamétrie cyclique (Cyclic Voltammetry en anglais, CV) consiste à balayer le système électrochimique en potentiel et à observer l’évolution du courant. Cette caractérisation renseigne sur les processus d’oxydo-réduction, les réactions de transfert d’électrons ainsi que les processus d’adsorption. Il est également possible de calculer la quantité de charges de réaction, la capacité de la double couche et indirectement la surface spécifique. La Figure 2.11 est un exemple de courbe CV obtenue sur une demi-cellule à base de poudre de silicium mésoporeux. Les pics d’oxydation/réduction (charge/décharge) apparaissent
à des potentiels respectifs de 0.52 et 0.12 V vs Li+/Li. Seul le premier cycle présente un
potentiel de lithiation plus élevé, associé notamment à la formation d’interface d’électrolyte solide.
Figure 2.11 Courbe de voltamétrie cyclique obtenue pour la demi-cellule à base de silicium mésoporeux en poudre
(c) Analyse galvanostatique
L’analyse galvanostatique (ou chronopotentiométrique) consiste à observer l’évolution du potentiel en fonction du temps, pour un courant constant imposé. Notamment utilisé pour cycler les batteries, il est possible par cette technique d’obtenir des courbes de potentiel-capacité, de cycle de vie et d’efficacité coulombique ou encore des études de «C-rate».
(c).i. Potentiel-Capacité
Une des principales caractérisations électrochimiques obtenues lors du cyclage de la bat-terie est celle du potentiel-capacité, obtenue à courant constant. Elle permet de suivre l’évolution du potentiel au fur et à mesure de la charge ou décharge. Elle permet ainsi
de déterminer les potentiels de lithiation/délithiation du matériau actif étudié, ainsi que les capacités réversibles et irréversibles. Également, il est possible de déterminer par cette méthode le potentiel «cut-off», tension minimale pouvant être obtenue en décharge et
amorçant la charge une fois atteinte (correspond à 0.05 V vs Li+/Li pour le silicium). La
Figure 2.12 présente la courbe potentiel-capacité du 1er cycle de la demi-cellule à base de silicium mésoporeux en poudre. Les potentiels de lithiation/délithiation sont
respective-ment 0.22 et 0.48 V vs Li+/Li et la capacité irréversible de premier cycle d’environ 1100
mAh g−1. Plus ces potentiels sont bas, plus la tension nominale d’une batterie complète
utilisant ce matériau est importante. Ainsi, il est plus intéressant d’utiliser des matériaux
anodiques dont les potentiels charges/décharges se rapprochent de 0 V vs Li+/Li. Il est
également possible d’observer l’amorphisation ou la formation de phases intermédiaires du matériau anodique sous lithiation par le changement de pente de la courbe. Ainsi, la zone entre 0.78 et 0.25 V vs Li+/Li présente une pente différente du plateau de lithiation,
caractéristique de la modification du matériau (en général on parle d’amorphisation). Au vu de la différence du potentiel de litiation avec celui attendu théoriquement, il est possible que l’oxyde de silicium présent en surface soit également lithier pendant ce processus.
Figure 2.12 Courbe potentiel-capacité du 1er cycle, obtenue pour la demi-cellule à base de silicium mésoporeux en poudre
(c).ii. Cycle de vie et efficacité coulombique
Une représentation alternative au potentiel-capacité présentée précédemment est celle du cycle de vie et de l’efficacité coulombique (Coulombic efficiency en anglais, CE). La Figure 2.13 correspond aux courbes de cycle de vie et d’efficacité coulombique obtenues avec la
demi-cellule à base de silicium mésoporeux avec un taux de décharge de C/50. Comme il peut être observé, le cycle 1 présente les mêmes valeurs de capacité de charge et dé-charge que celles montrées en Figure 2.12. L’efficacité coulombique permet de déterminer le rendement de la batterie en pourcentage, par le ratio de la capacité de charge sur la capacité de décharge. Cette efficacité est un indicateur précis pour connaître l’état de la batterie, ainsi que les capacités irréversibles de chaque cycle. Dans ce cas, une efficacité coulombique de premier cycle de 72% est observée, puis de 95% pour le deuxième cycle. La valeur inférieure obtenue au premier cycle est caractéristique de la formation d’électrolyte d’interface solide, majoritaire lors de ce cycle, augmentant significativement la capacité irréversible. Une diminution de capacité est observée dès le 3ème cycle pour cette batterie. L’analyse C-rate est une caractérisation consistant à appliquer différents taux de décharge à la suite et d’observer la rétention de capacité, c’est-à-dire la possibilité avec laquelle une capacité peut revenir à sa valeur initiale malgré l’application de différents courants. Le résultat final apparaît dans un diagramme équivalent à celui présenté en Figure 2.13.
Figure 2.13 Diagramme de cycle de vie et d’efficacité coulombique, obtenu pour la demi-cellule à base de silicium mésoporeux en poudre
(d) Spectroscopie d’impédance électrochimique
La spectroscopie d’impédance électrochimique (Electrochemical Impedance Spectroscopy en anglais, EIS) consiste à appliquer une perturbation sinusoïdale à potentiel fixe (ou courant fixe) de faible amplitude (5 mV) et sur une plage de fréquence définie (de 1 MHz à 0.01 Hz est la plus utilisée), puis à observer la réaction en courant (ou en potentiel). Par cette technique, les impédances réelles et imaginaires du système sont observées via un diagramme de Nyquist. De même, la valeur absolue de l’impédance et la phase de cette
![Figure 2.2 Représentation graphique du nombre de systèmes participant à l’IoT ces 30 dernières années (adapté de [21])](https://thumb-eu.123doks.com/thumbv2/123doknet/2923163.76648/33.918.268.657.122.401/figure-représentation-graphique-systèmes-participant-dernières-années-adapté.webp)
![Figure 2.17 Illustration des changements volumiques pouvant apparaître lors du cyclage électrochimique de Si [40]](https://thumb-eu.123doks.com/thumbv2/123doknet/2923163.76648/52.918.234.656.180.598/figure-illustration-changements-volumiques-pouvant-apparaître-cyclage-électrochimique.webp)
![Figure 2.29 Courbes I-V de silicium type p en contact avec de l’HF. (En haut) La ligne solide représente la réponse sans illumination et celle en pointillé avec illumination [8]](https://thumb-eu.123doks.com/thumbv2/123doknet/2923163.76648/76.918.251.637.210.853/figure-courbes-silicium-représente-réponse-illumination-pointillé-illumination.webp)