HAL Id: hal-02816502
https://hal.inrae.fr/hal-02816502
Submitted on 6 Jun 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Caractérisation moléculaire de la cinétique
d’acclimatation des peupliers (Populus tremula x alba) à
des flexions multiples
Wassim Lakhal
To cite this version:
Wassim Lakhal. Caractérisation moléculaire de la cinétique d’acclimatation des peupliers (Populus tremula x alba) à des flexions multiples. [Stage] France. Université Blaise Pascal (Clermont Ferrand 2) (UBP), FRA.; France. Institut d’Enseignement Supérieur et de Recherche en Alimentation, Santé Animale, Sciences Agronomiques et de l’Environnement (VetAgro Sup), FRA. 2010, 26 p. + annexe. �hal-02816502�
MASTER II Biologie et Environnement
SPECIALITÉ : GEPV
RAPPORT DE STAGE PRESENTE PAR:
LAKHAL Wassim
SUJET:CARACTERISATION MOLECULAIRE DE LA
CINETIQUE D’ACCLIMATATION DES PEUPLIERS (Populus
tremula x alba) A DES FLEXIONS MULTIPLES
Responsable du Stage:
Nathalie LEBLANC-FOURNIER
Résumé
Durant leur développement, les plantes sont soumises à des stimulations mécaniques répétées et fluctuantes causées par le vent. Pour croître dans cet environnement mécanique fluctuant, les plantes doivent s’acclimater. Pour comprendre ce mécanisme d’acclimatation au niveau moléculaire, l’expression de plusieurs gènes mécanosensibles a été étudiée en appliquant différents régimes de flexions à des tiges de peuplier. Des analyses de Q-PCR ont montré que la cinétique d’expression du gène mécanosensible PtaZFP2 n’est pas modifiée après une ou deux flexions. Par contre, après la deuxième flexion, le niveau d’expression de ce gène est atténué par rapport à celui observé après une seule flexion suggérant une désensibilisation des plantes aux flexions successives. Ce mécanisme est rapide puisque un délai de 3h entre deux flexions successives est suffisant pour atténuer les réponses des peupliers. De plus, nos résultats montrent que des gènes de la voie des jasmonates sont impliqués dans la réponse de peuplier aux flexions. Enfin, l’utilisation de peupliers transgéniques surexprimant PtaZFP2 suggère un rôle potentiel de ce facteur de transcription dans la régulation de ces gènes ainsi que des gènes mécanosensibles ACS6, TCH2 et TCH4.
Mots clefs : Flexions répétées, Désensibilisation, Jasmonates, PtaZFP2, TCH4
Abstract
During their development, plants are subjected to repeated and fluctuating mechanical stimulations caused by the wind. For their survival in such environment, plants have to be acclimated. To understand the molecular processes involved in the acclimation, the expression of several mecanosensitive genes was studied after applying different bending treatments on poplar stem. Q-PCR analyses showed that no differences were observed on time-course expression of the mechanosensitive PtaZFP2 gene after one or two bendings. However, after the second bending, PtaZFP2 mRNAs level was much lower than after a single bending, suggesting that plants have been desensitized to successive bendings. This desensitization process is rapid since a 3h-time interval is sufficient to alter plant responsiveness. Our results also showed that the genes of the jasmonates pathway are involved during poplar responses to bendings. Besides, the analysis of transgenic poplar over-expressing PtaZFP2 suggested a role of this putative transcription factor in the regulation of these genes and the mecanosensitive genes ACS6, TCH2 and TCH4
Remerciements
C’est avec un grand plaisir que je veux remercier, au terme de ce travail, tous ceux qui ont contribué de prés ou de loin à son élaboration.
Je tiens à remercier spécialement Mme Nathalie LEBLANC-FOURNIER, mon encadrant durant ce stage, pour ses conseils très intéressants et son aide précieuse pour la réalisation de ce travail. C’est grâce à elle que j’ai fait mon premier grand pas dans la recherche. En effet, j’ai vraiment la chance qu’elle soit mon encadrant car, à côté de ses qualités humaines exceptionnelles, ses qualités professionnelles en tant que chercheur que ce soit au niveau pratique (manipulations) ou théorique m’ont permis d’apprendre la méthodologie globale de la recherche.
Je remercie également Mr Jean Louis JULIEN, le directeur du laboratoire d’accueil et le responsable du master pour son humour et pour son soutien continu. Je remercie aussi, Jérome, Christelle, Laurent et Nicole pour leur collaboration, Hosam pour sa gentillesse, Sylvaine pour sa bonté, Eric pour sa compagnie et tous mes collègues en master, David et Delphine ainsi que toute l’équipe du PIAF sans oublier Norbert pour ses services informatiques indispensables.
LISTE DES ABBREVIATIONS
ADN : Acide désoxyribonucléique ADNc : ADN complémentaire ADNg : ADN génomique ARN : Acide ribonucléique ARNm: ARN messager ARN tx : ARN totaux
C2H2-ZFP: Cysteine2/Histidine2 Zinc Finger Protein CIV: Culture in vitro
CPMCW : Cytosqueleton – Plasma Membrane – Cell Wall CTAB : Cetyltrimethylammonium bromide
DEPC : Diéthyl pyrocarbonate dNTP : Désoxyribonucléotide DTT : Dithiothréitol
EDTA : Ethylenediamine tetraacetic acid JA: Acide jasmonique
Jas: Jasmonates
LiCl: Chlorure de Lithium MeJa: Methyl ester jasmonate Ms: Murashige et Skoog NaCl: Chlorure de Sodium Pb: Paire de base
PCR : Polymerase chain reaction Pta: Populus tremula L. X alba L. PVP : Polyvinylpyrrolidone Q-PCR : PCR quantitative relative RT-PCR : Reverse transcription PCR
Taq polymérase : Thermophyllus aquaticus DNA polymerase enzyme Tm : Température de fusion spécifique
SOMMAIRE
Introduction
Bibliographie
1- REPONSES PHYSIOLOGIQUES ET MOLECULAIRES DES PLANTES AUX STIMULATIONS MECANIQUES
1 1.1- Impacts physiologiques et agronomiques des stimulations mécaniques
externes sur le développement et la croissance des plantes
1 1.2- Etude quantitative de l’effet d’une flexion sur les premières étapes de la
mécanoperception
2 1.2.1- Variable mécanique perçue par les plantes au cours d’une flexion 3 1.2.2- Acteurs moléculaires de la réponse aux sollicitations mécaniques 3 1.3- Acclimatation des plantes à des sollicitations mécaniques répétées 5 2- IMPLICATION DES JASMONATES DANS L’ACCLIMATATION
AUX STRESS MECANIQUES
7 2.1- Voie de biosynthèse et de régulation de la biosynthèse des jasmonates 7 2.2- Impact des jasmonates dans les réponses aux sollicitations mécaniques 8
Matériel et méthodes
1- Matériel végétal et conditions de culture 10
2- Les flexions 11
3- Extraction d’ARN et synthèse d’ADNc 11
4- PCR quantitative relative (Real-time quantitative RT-PCR) 12
Résultats
1- Cinétique d’acclimatation de l’expression de PtaZFP2 14
1.1- Comparaison de la cinétique d’expression de PtaZFP2 après une flexion et deux flexions
14 1.2- Etude de l’expression de PtaZFP2 après la deuxième flexion en fonction du délai entre les deux flexions successives
14 2- Implication des jasmonates dans la réponse et l’acclimatation aux flexions chez
le peuplier
15 2.1- Cinétique d’expression des gènes de biosynthèse et de régulation
des jasmonates après une flexion
15 2.2- Etude de l’expression des gènes de biosynthèse et de régulation des
jasmonates après des flexions répétées chez le peuplier
16 2.2.1- Comparaison de la cinétique de l’expression des gènes de
biosynthèse et de régulation des jasmonates après une ou deux flexions
16 2.2.2- Etude de l’expression des gènes de biosynthèse et de régulation des jasmonates en fonction du délai entre les deux flexions
17
3- Etude de l’acclimatation à des flexions répétées à travers des plantes transgéniques de peuplier surexprimant le gène PtaZFP2
17 3.1- Est-ce que PtaZFP2 régule l’expression des gènes de la voie de des
jasmonates?
17 3.2- Etude de l’expression des gènes mécanosensibles à travers les plantes
transgéniques
Discussion
1- Analyse moléculaire des réponses des plantes aux flexions multiples chez le peuplier
21 2- Implication des jasmonates dans la réponse et la désensibilisation aux
flexions chez le peuplier
23 3- Etude du rôle de PtaZFP2 dans les réponses moléculaires induites au cours de la flexion d’une tige chez le peuplier.
INTRODUCTION
La capacité de percevoir et de répondre aux stimulations externes est importante pour les organismes vivants. Parmi ces stimulations environnementales détectées par les organismes, on cite la lumière, la température et les signaux considérés comme physiques et/ou mécaniques tels que le vent qui résulte des gradients de pression dans l’atmosphère (Telewski, 2006). Or, les plantes terrestres sont des organismes non mobiles. Elles doivent changer de comportement pour accroître leur compétitivité suivant les fluctuations de leur environnement local (Gang et al., 2007, Chehab et al., 2009). Elles ont donc développé une forte plasticité développementale, c'est-à-dire la capacité d’un génotype à produire différents phénotypes en fonction de son environnement grâce à des mécanismes très sensibles, à travers lesquels elles peuvent percevoir et répondre aux différents stimuli (Chehab et al., 2009 ; Madlung et Comai, 2004).
Les perturbations mécaniques sont parmi les nombreux stimuli environnementaux auxquels la plante doit répondre (Chehab et al., 2009). Ces stimuli mécaniques sont connus aujourd’hui sous le nom des stimuli thigmomorphogénétiques (Telewski, 2006) dont le vent constitue une variable environnementale qui influence remarquablement la croissance et le développement des plantes (Knight et al., 1992). Les réponses morphologiques résultantes du vent se caractérisent essentiellement par une diminution de la croissance en hauteur, une augmentation de la croissance en diamètre de la tige et une réallocation de la biomasse vers les racines (Telewski et Pruyn, 1998, Coutand et al., 2008). Cette réponse pourrait être une partie d’une stratégie générale d’acclimatation par laquelle la croissance de la plante est redirectionnée pour diminuer l’exposition au stress (Martin et al., 2010). Ceci amène à se demander comment les plantes répondent à des sollicitations mécaniques successives et récurrentes. Si le syndrome de la thigmomorphogenèse est développé à chaque fois que les plantes sont stimulées mécaniquement, l’investissement de ces dernières dans la réponse à ces perturbations peut avoir des effets nocifs sur la taille des plantes et sur leur reproduction (Cipollini et al., 1999). Or, les mécanismes permettant aux plantes de s’acclimater à des régimes de sollicitations mécaniques variées et récurrentes, que ce soit au niveau écophysiologique ou au niveau moléculaire, sont très peu connus. La compréhension des mécanismes par lesquels les végétaux perçoivent cette stimulation et transmettent les signaux vers la machinerie cellulaire pour activer ces réponses d’acclimatation est alors très importante (Gang et al., 2007).
Chez le peuplier (Populus tremula L. X alba L.), une étude réalisée par Martin et al. (2010) a porté sur la cinétique d’acclimatation des jeunes peupliers à plusieurs flexions de tige en suivant la croissance en diamètre et l’expression de différents gènes mécanosensibles (PtaZFP2, PtaTCH2, PtaTCH4 et PtaACS6). Les jeunes arbres ont été soumis à plusieurs flexions séparées de 24 heures durant plusieurs jours (Martin et al., 2010). Cette faible fréquence de flexions mime plutôt des ‘coups’ de vent d’une journée à l’autre. Les résultats ont montré que, dès la deuxième flexion, les réponses moléculaires ont été atténuées par rapport à la première flexion. Par ailleurs, suite à une première flexion, une période de plusieurs jours de désensibilisation des plantes à la flexion a été démontrée (Martin et al., 2009). L’objectif de ce projet de recherche est de mieux caractériser, au niveau moléculaire, la mise en place de ce phénomène de désensibilisation en : (i) réduisant le délai entre deux flexions et (ii) réalisant une cinétique plus fine de l’expression de certains gènes mécanosensibles après deux flexions.
Par ailleurs, des données bibliographiques récentes suggèrent, d’une part, l’implication des jasmonates (JAs) dans les réponses thigmomorphogénétiques chez les plantes suite à des stimulations mécaniques (Chehab et al., 2009) et d’autre part leur implication dans l’acclimatation à d’autres stress biotiques ou abiotiques comme la blessure (Pauwels et al., 2008 ; Galis et al., 2009). Or le gène mécanosensible PtaZFP2 est également régulé par un stress de type blessure (Martin et al., 2009). De plus, un gène homologue à PtaZFP2 est impliqué dans la répression du gène LOX codant pout la lipoxigénase, première enzyme de la voie de biosynthèse des jasmonates (Pauwels et al., 2008). Afin de tester le rôle des jasmonates dans la réponse à une flexion chez le peuplier, l’expression des gènes de la voie de biosynthèse des jasmonates sera analysée par Q-PCR sur des peupliers sauvages suite à une flexion ou à des flexions multiples, ainsi que dans des plantes transgéniques de peuplier surexprimant PtaZFP2.
Figure 1 : Illustration de la thigmomorphogenèse : au centre de l'image, les plantes de luzerne ont poussé à travers deux grilles qui réduisent l'amplitude de leurs mouvements ; celles-ci poussent beaucoup plus haut que les plantes voisines libres d'osciller sous le vent (photo : Moulia & Combes (2004))
1- REPONSES PHYSIOLOGIQUES ET MOLECULAIRES DES PLANTES AUX STIMULATIONS MECANIQUES
Les études récentes convergent pour démontrer l’importance des sollicitations mécaniques dans la régulation de la morphogenèse des plantes (Ingber D.E., 2005). Ces stimulations peuvent être d’origine interne, comme la perception du gravitropisme ou dues aux autocontraintes de croissance, ou externe comme le vent, la neige, le poids des fruits (Telewski, 2006). Comme le montre la figure 1, elles peuvent présenter un impact agronomique important (Moulia et Combes, 2004). Le vent, étant une stimulation mécanique naturelle omniprésente et fluctuante dans l’environnement (Telewski, 1995), nous nous sommes plus particulièrement intéressés à cette contrainte externe.
1.1- Impacts physiologiques et agronomiques des stimulations mécaniques externes sur le développement et la croissance des plantes
Les réponses morphologiques résultantes des stimulations mécaniques et plus précisément de la flexion, se caractérisent essentiellement par des modifications des dimensions de la tige (Telewski et Pruyn, 1998). En effet, ces stimulations externes engendrent une diminution de de la croissance longitudinale des tiges et une activation de la croissance en diamètre chez Prunus avium (Coutand et al., 2008), Ulmus americana (Telewski et Pruyn, 1998), Lycopersicon esculentum (Coutand et Moulia, 2000), et Juglans regia (Leblanc-Fournier et al., 2008). Dans la plupart des études, les stimulations sont appliquées sur une partie de la tige ayant terminé sa croissance longitudinale. L’arrêt de croissance longitudinale peut être expliqué par le fait qu’un signal rapide a été transmis du point de la flexion vers la zone de croissance au niveau du méristème apical (Telewski, 2006). L’augmentation de croissance radiale semble être due à une activité cambiale accrue puisqu’une augmentation de la production du xylème a été observée au niveau du point de la flexion (Telewski et Pruyn, 1998). Chez le peuplier, suite à une flexion de la tige, la première réponse est un arrêt de la croissance en diamètre observé 2 h après la sollicitation et qui dure 4h (Coutand, Martin et al., 2009). Ensuite, la croissance en diamètre augmente jusqu’à atteindre une valeur maximale 2 à 3 jours après la flexion en fonction des plantes. Puis, le taux de croissance revient au niveau de base observé avant la flexion. En ce qui concerne la croissance en diamètre, ce contrôle mécanosensible de la réponse est local et limité à la partie fléchie de la tige (Coutand C. et al., 2009). Les effets des stimulations mécaniques sur les dimensions de la tige peuvent être quantitativement importants. En effet, chez Prunus avium, des flexions effectuées 8 fois par
de 80% et une augmentation de la croissance radiale de la tige de 30 % (Coutand C. et al., 2008).
Les stimulations mécaniques peuvent également avoir un impact sur le type d’enracinement (Coutand C. et al., 2008 ; Goodman et Ennos, 1998). Ainsi, Goodman et Ennos (1998) ont montré que chez le maïs (Zea mays) et le tournesol (Helianthus annuus), les racines latérales perpendiculaires au plan de la flexion sont moins développées que les racines situées dans la même direction de ce plan. De plus, une étude récente a montré que des plantes de chêne (Quercus robur L.) soumises au vent ont produit deux fois plus de racines que des plantes témoins et que ces racines sont plus longues et ceci sans que le volume total des racines latérales soit différent entre les traités et les témoins (Tamasi et al., 2005). D’autre part, bien que les stimuli mécaniques n’affectent pas la biomasse totale de l’arbre, ils modifient l’allocation et la répartition de cette biomasse entre la partie aérienne et le système racinaire (Coutand C. et al., 2008).
Or, la protection des plantes contre le vent par diverses techniques, comme le tuteurage par exemple, réduit les stimulations mécaniques perçues par l’arbre. Ces techniques, étant largement utilisées dans les plantations forestières et agro-forestières, les plantes protégées peuvent souffrir d’un pauvre et faible développement des racines et des rapports instables entre la hauteur de la tige et son diamètre. Ainsi, il a été démontré que l’allocation de la biomasse peut être modifiée d’une telle manière que ces arbres ne pourront plus supporter leur propre poids et risquent d’être cassés ou arrachés suite à un stress mécanique fort et brusque. Ceci montre que la perception des stimulations mécaniques induites par le mouvement est une manière pour les plantes d’ajuster la répartition de leur biomasse (Coutand C. et al., 2008).
En conclusion, les réponses thigmomorphogénétiques pourraient être considérées comme une acclimatation au vent améliorant la survie des végétaux en : (i) réduisant leur prise au vent grâce à la diminution de la croissance longitudinale, (ii) en augmentant la rigidité de leurs tiges avec un diamètre plus grand et (iii) en favorisant la croissance racinaire leur permettant d’avoir un meilleur ancrage au sol.
1.2- Etude quantitative de l’effet d’une flexion sur les premières étapes de la mécanoperception
Concernant l’effet des perturbations mécaniques sur la croissance des végétaux, divers efforts ont été faits pour comprendre la physiologie des premières étapes de la mécanoperception
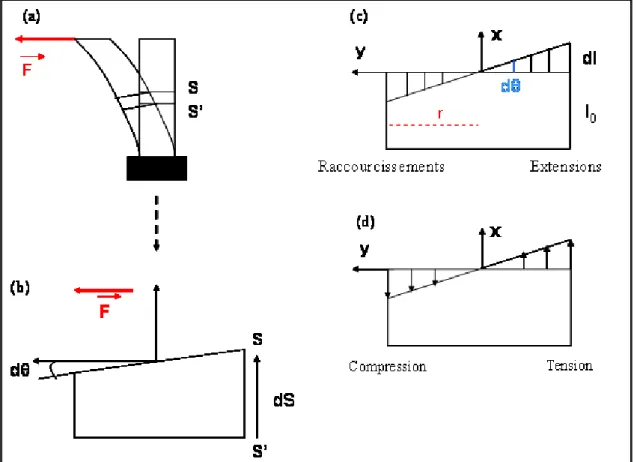
Figure 2 : Analyse mécanique de la flexion d’une poutre.
L’effet de l’application de sollicitation de force F est présentée au niveau global (a) puis au niveau d’une tranche infinitésimale (b). Distribution des déformations longitudinales (c) et des contraintes normales (d) sur une section droite au cours d’une flexion.
Pour mieux comprendre ces premières étapes de la mécanoperception, plusieurs paramètres sont nécessaires : (i) déterminer quelle est la variable physique perçue et la quantifier, (ii) décrypter les acteurs moléculaires impliqués dans les voies de signalisation. 1.2.1- Variable mécanique perçue par les plantes au cours d’une flexion
Comme la montre la figure 2, quand on applique une flexion d’une force F, deux variables physiques peuvent être perçues. La première correspond aux contraintes (Force par unité de surface) correspondant à des tensions ou à des compressions. La deuxième correspond aux déformations subies par la tige (modification des dimensions) correspondant aux extensions ou raccourcissements (Martin, 2009).
Afin de déterminer quelle est la variable mécanique perçue, une étude biomécanique de l’effet d’une flexion contrôlée sur la croissance longitudinale de la tige de tomate a été réalisée par Coutand et collaborateurs (2000). Les auteurs ont mis en évidence une corrélation forte entre la réponse de croissance et la somme des déformations longitudinales subies par la tige. Aucune corrélation n’a pu être observée entre la force ou les contraintes et la réponse de croissance. Plus récemment, ces résultats ont été confirmés sur le peuplier en étudiant une réponse plus locale telle que la croissance en diamètre (Coutand et al., 2009). L’intensité de la croissance en diamètre dépend de l’intensité des déformations subies par la tige et non pas de l’intensité des contraintes appliquées. Ces études suggèrent fortement que la variable perçue par les cellules au cours d’une flexion est la déformation, c'est-à-dire les modifications de dimension des cellules.
Ces résultats sont essentiels pour mieux comprendre les mécanismes moléculaires sous-jacents puisqu’ils nous permettent désormais de quantifier l’intensité du stimulus mécanique appliqué à la tige.
1.2.2- Acteurs moléculaires de la réponse aux sollicitations mécaniques
Les premiers acteurs moléculaires impliqués dans la réponse des végétaux aux stimulations mécaniques correspondent aux gènes TCH chez Arabidopsis et sont régulés en réponse à divers stimuli environnementaux (Braam et al., 1997). Ces gènes TCH1, TCH2, TCH3 codent pour des calmodulines, protéines impliquées dans la fixation du calcium, et sont induits 10 à 30 minutes après l’application d’un stress mécanique (vent, pluie, toucher) chez Arabidopsis (Braam et al., 1997). Chez le peuplier, une flexion de la tige induit également une activation rapide (dès 5 min) et transitoire de l’expression de PtaTCH2 (Martin et al., 2009).
Or, en utilisant des plants transgéniques de Nicotiana plumbaginifolia surexprimant l’aequorine, Knight et al. (1992) ont montré que le vent provoque une augmentation rapide, transitoire et dose-dépendante du calcium cytosolique. Ces résultats suggèrent que le calcium peut jouer un rôle dans la voie de transduction du signal mécanique chez les plantes (Chehab et al., 2009).
Le gène TCH4, qui code une XET (xyloglucanes endotransglycosylases/hydrolases), protéine impliquée dans des modifications de la paroi, est également induit très précocement par une sollicitation mécanique (Xu et al., 1995).
Mis à part les gènes TCH, plusieurs gènes impliqués dans la voie de biosynthèse de l’éthylène sont régulés suite à une stimulation mécanique. Ainsi, le gène ACS codant pour l’ACC synthase est un gène précoce de réponse à des stress mécaniques . Les ARNm de l’ACC synthase s’accumulent dès 10 min après la flexion des feuilles de Vigna radiata (Botella et al., 1995). Chez le peuplier, les transcrits de PtaACS s’accumulent 10 min après la flexion de la tige et leur quantité atteint un pic après 30 min (Martin et al., 2009).
Parmi les nombreux facteurs de transcription identifiés chez les plantes, des centaines d’entre eux sont impliqués dans la réponse aux stress environnementaux (Gang et al., 2007). Une approche de transcriptomique réalisée chez Arabidopsis montre que 20 % des gènes régulés au cours des premières étapes de la mécanoperception correspondent à des facteurs de transcription (Lee et al., 2005). Chez les plantes ligneuses, un gène mécanosensible nommé JrZFP2 a été identifié chez le noyer (Juglans regia) (Leblanc-Fournier et al., 2008). L’homologue de ce gène a été isolé chez le peuplier (Populus tremula X alba) et a été nommé PtaZFP2. Ces deux gènes codent pour des facteurs de transcription à doigts de zinc de type Cys2/His2 (C2H2-ZFP). Chez le peuplier, il a été démontré que le gène PtaZFP2 s’exprime à partir de 5 min après une seule flexion et atteint son niveau maximal d’expression 30 min plus tard et retourne à un niveau de base 1 h après la stimulation (Martin et al., 2009). Après une flexion de la tige, ZFP2 est uniquement exprimé dans les tissus mécaniquement stimulés (Leblanc-Fournier et al., 2008 ; Martin et al., 2009).
De plus, l’expression de PtaZFP2 a été étudiée après avoir appliqué différentes sommes de déformations. L’abondance relative des transcrits de PtaZFP2 après une seule flexion étant positivement corrélée avec la somme des déformations de la tige (Coutand et al., 2009), ce gène mécanosensible parait intéressant comme marqueur précoce de la mécanoperception. Cependant, aucun lien entre ces différents acteurs moléculaires de la mécanoperception n’a pu être établi.
Figure 3 : Atténuation de l’expression de PtaZFP2 dès la deuxième flexion chez le peuplier (Martin et al.,
2010). L’abondance des transcrits de ce gène a été mesurée par PCR quantitative relative. 1B, 2B, 3B, 4B et 5B représentent le nombre des flexions (B) appliquées à la tige séparées de 1 jour (1d) que chaque plante a subies. Pour chaque condition, les ARNs ont été extraits de la portion fléchie de la tige 30 min après la dernière flexion. Les barres d’erreur représentent l’écartype de la quantité relative des transcrits pour chaque traitement pour 4 répétitions indépendantes de cette expérience. Les valeurs notées par des lettres différentes sont significativement différentes (test de Newman-Keuls P < 0.05).
Figure 4 : Durée de la désensibilisation de l’expression de PtaZFP2 suite à une flexion (Martin et al., 2010).
L’abondance des transcrits de ce gène a été mesurée par PCR quantitative relative. Certaines plantes n’ont subi aucune flexion (C) ou une seule flexion de la tige (1B). Les autres plantes ont subi deux flexions (2B) séparées de 1 jour (1d), 3 jours (2d), 5 jours (5d), 7 jours (7d) ou 10 jours (10d). Pour chaque condition, les ARNs ont été extraits de la portion fléchie de la tige 30 min après la dernière flexion Les barres d’erreur représentent l’écartype de la quantité relative des transcrits pour chaque traitement pour 4 répétitions indépendantes de cette expérience. Les valeurs notées par des lettres différentes sont significativement différentes (test de Newman-Keuls P < 0.05).
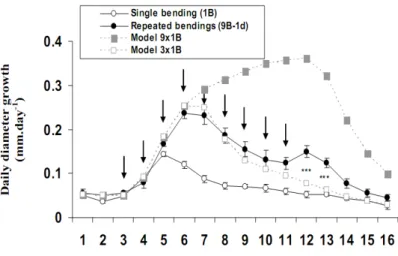
Figure 5 : Comparaison de l’effet d’une seule flexion ou des flexions répétées sur la croissance journalière en diamètre (Martin et al., 2010).
Les valeurs de croissance journalière en diamètre ont été obtenues après 1 ou 9 flexions transitoires séparées de 24 h. Les flèches indiquent les jours durant lesquels la flexion de la tige a été appliquée. Les cercles ouvertes et fermées sont les moyennes de 10 ou 6 enregistrements indépendants, respectivement, après une seule flexion ou des flexions répétées chaque jour. Sous l’hypothèse que les effets de chaque flexion successive sont additifs, 2 modèles théoriques sont proposés : modèle 9x1B (carrés pleins) et modèle 3x1B (carrés vides). Ces modèles ont été obtenus en utilisant la croissance en diamètre mesurée en enregistrant 1B et en ajoutant 9 fois (9x1B) ou 3 fois (3x1B) l’effet d’une seule flexion. Dans le modèle 3x1B, on a considéré que les flexions après la troisième flexion n’avaient plus d’effets. Les triples astérisques (***) représentent les différences significatives entre les valeurs expérimentales du traitement 9B1d et le modèle 3x1B à 0.01.
1.3- Acclimatation des plantes à des sollicitations mécaniques répétées
Les plantes peuvent rester debout pendant une période très longue, pas seulement parce qu’elles ont des structures rigides et génétiquement optimisées, mais aussi parce qu’elles possèdent un contrôle actif de leur posture et de leur équilibre ainsi qu’une acclimatation à long terme aux pressions environnementales dominantes via une croissance contrôlée mécaniquement (Moulia et al., 2006). Dans la nature, les plantes sont soumises à des sollicitations mécaniques fluctuantes et récurrentes. Ainsi, le vent peut engendrer plusieurs flexions par seconde chez les végétaux. Si les réponses thigmomorphogénétiques se développent chaque fois que les plantes rencontrent un stress mécanique, leur investissement dans la résistance à ces perturbations mécaniques peut avoir des effets préjudiciables sur leur taille (Telewski, 1995).
Or, la capacité des plantes à croitre malgré cet environnement mécanique fluctuant suggère l’existence d’un processus d’acclimatation aux sollicitations mécaniques multiples (Moulia et al., 2006). Chez Ulmus americana L., après 3 semaines de traitement, aucune différence de la croissance en diamètre n’est observée entre les plantes ayant subi une faible dose de stimulations mécaniques (5 flexions par jour) ou une forte dose (80 flexions par jour) (Telewski et Pruyn, 1998) suggérant l’existence d’un mécanisme d’acclimatation. Toutefois, dans cette étude, les réponses ayant été analysées au bout de trois semaines de flexions, ces résultats ne permettent pas de comprendre finement les mécanismes mis en jeu. Ainsi, afin de mieux les comprendre, il est intéressant d’analyser la capacité de réponse des plantes au fur et à mesure des flexions successives.
Dans ce but, Martin et al. (2010) ont étudié la cinétique de la réponse des plantes de peuplier à des flexions successives en suivant à la fois la croissance en diamètre et les niveaux d’expression de 4 gènes mécanosensibles précoces et marqueurs de la mécanoperception (PtaZFP2, PtaTCH2, PtaTCH4 et PtaACS6).
Comme le montre la figure 3, le niveau d’induction des gènes mécanosensibles étudiés, notamment PtaZFP2, est plus faible après la deuxième flexion appliquée 24 heures après la première. Ceci suggère que, après avoir subi une première flexion, les plantes sont en partie désensibilisées vis à vis des flexions suivantes. Par ailleurs, suite à une première flexion, une période de plusieurs jours de désensibilisation des plantes à la flexion a été démontrée (fig.4). En ce qui concerne la croissance en diamètre, les flexions répétées chaque jour n’ont plus d’effets additifs sur la croissance en diamètre à partir de 3 flexions (fig.5) ce qui montre également une désensibilisation des plantes au cours des flexions successives.
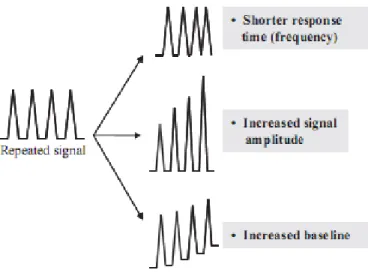
Figure 6 : Différents cas de réponse aux stress répétés (Galis et al., 2009)
Figure 7 : Accumulation de JA après des sollicitations répétées (Stork et al., 2009).
Les patrons d’accumulation de JA observés (triangles et lignes continues) diffèrent de celles prédites de l’addition des sollicitations uniques répétées (x et lignes discontinues). Les flèches indiquent la fréquence des sollicitation (1 / h).
Ces mécanismes permettant aux plantes de s’acclimater à des stress abiotiques répétés ont déjà été mis en évidence en réponse à des stress comme le froid et les attaques des pathogènes. Dans ce cadre, les études ont montré que une exposition préalable à un stress donné rend la plante plus résistante aux expositions futures à ce même stress (Bruce et al., 2007) et ce phénomène a été défini comme le processus d’endurcissement. Comme l’illustre la figure 6, si la plante est plus résistante, plusieurs types de réponses peuvent être observées: soit la réponse est plus rapide avec une cinétique plus courte, soit l’amplitude de la réponse est plus forte, soit les acteurs impliqués dans la réponse ne sont pas revenus à leur niveau de base suite à la première sollicitation. Plusieurs hypothèses ont été émises pour expliquer ce phénomène d’endurcissement : soit certains métabolites clefs de signalisation ou des facteurs de transcription sont maintenus à un niveau sous la forme inactive suite à la première sollicitation, soit des modifications épigénétiques peuvent aussi jouer un rôle dans le cas de réponse à long terme de l’expression des gènes (Bruce et al., 2007).
L’intervalle du temps qui s’écoule entre l’événement d’endurcissement et la réexposition au stress est d’un intérêt considérable. Un nombre de scientifiques ont montré que ces processus d’endurcissement peuvent persister, au moins, plusieurs jours (Bruce et al., 2007). Quelques études récentes ont étudié l’effet des sollicitations répétées (piqure d’insectes ou chimique) sur la défense des plantes (Stork et al., 2009). Ainsi, chez Nicotiana attenuata, lorsqu’on soumet des feuilles à des stimulations répétées (par une attaque d’insecte), avec une fréquence d’une sollicitation par heure, les niveaux de JA observés ne correspondent pas aux niveaux prédits. (fig.7) (Stork et al., 2009). Ce résultat est très semblable à celui obtenu par Martin et al. (2010) qui a mis en évidence une désensibilisation de la réponse de peuplier, au niveau de l’expression de PtaZFP2, après une première stimulation mécanique. Or, des résultats précédents ont montré que chez le peuplier, le gène PtaZFP2 est régulé par la blessure (Martin et al., 2009). On peut donc se demander s’il existe des mécanismes communs entre la réponse des plantes aux sollicitations mécaniques et aux attaques des insectes herbivores.
Ainsi des questions restent à résoudre : Est-ce que le faible niveau d’expression de PtaZFP2 observé 30 min après la deuxième flexion (Martin et al. 2010) est réellement dû à un phénomène de désensibilisation ou à une cinétique de réponse plus rapide à la deuxième flexion ? Qu’elle est donc la cinétique de l’expression de PtaZFP2 après la deuxième flexion ? Quel est le délai entre deux flexions pour que ce phénomène de désensibilisation se mette en place ? L’objectif de ce projet de recherche sera d’étudier ces questions au niveau
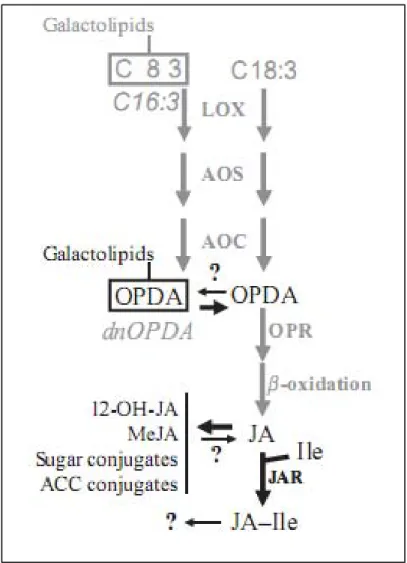
Figure 8 : Schéma de la voie de biosynthèse des jasmonates (Galis et al., 2009).
De plus, nous nous sommes intéressés à l’implication des jasmonates dans l’acclimatation au stress mécanique.
2- IMPLICATION DES JASMONATES DANS L’ACCLIMATATION AUX STRESS MECANIQUES
Les voies de signalisation impliquant l’acide jasmonique jouent un rôle central dans l’intégration et la coordination de la majorité de réponses de plantes aux stress (Bruce et al., 2007). Les jasmonates (JAs) ont des rôles dans le développement (croissance, partition de carbone, sénescence, reproduction…) et dans la régulation de la réponse aux stress (Browse et Howe, 2008). Les attaques des pathogènes et la blessure causée par les insectes herbivores induisent leur biosynthèse et donc, après leur perception par les cellules des plantes, ces dernières activent divers mécanismes de défense par l’intermédiaire de la reprogrammation de l’expression des gènes (Pauwels et al., 2008).
2.1- Voie de biosynthèse et de régulation de la biosynthèse des jasmonates
La biosynthèse de l’acide jasmonique débute quand les lipases libèrent l’acide linolénique (C18:3) des membranes plastidiales (fig.8) (Galis et al., 2009). La lipoxygénase (LOX), étant responsable de la production des précurseurs des jasmonates à partir des acides gras polyinsaturés libres (Chehab et al., 2009), catalyse la première étape dans la biosynthèse de l’acide jasmonique (Galis et al., 2009). A l’aide des enzymes allène oxyde synthase (AOS) et allène oxyde cyclase (AOC), les enzymes LOX transforment C18:3 en oxo-phytodienoic acid (OPDA). L’OPDA est transformé en JA (acide jasmonique) à l’aide d’OPDA réductase (OPR) et d’une série de β-oxydations dans les peroxysomes (Galis et al., 2009). Le JA est sujet à de plusieurs transformations enzymatiques pour générer une série de dérivés qui diffèrent dans leur activité biologique (Browse et Howe, 2008). L’OPDA estérifié et le dn-OPDA (dinor-dn-OPDA) sont créés probablement au niveau de la voie des galactolipides. Les ligases JAR occupent la place finale dans l’activation de JA : la formation du conjugué jasmonyl-isoleucine (JA-Ile) (Galis et al., 2009). D’autres modifications de JA incluent la conjugaison en sucres, en ACC (amino-cyclopropane carboxylic acid) et en MeJA (methyl jasmonate) (Galis et al., 2009) qui est l’un des composés organiques volatiles impliqués dans la défense par signalisation aérienne (Kessler et al., 2006).
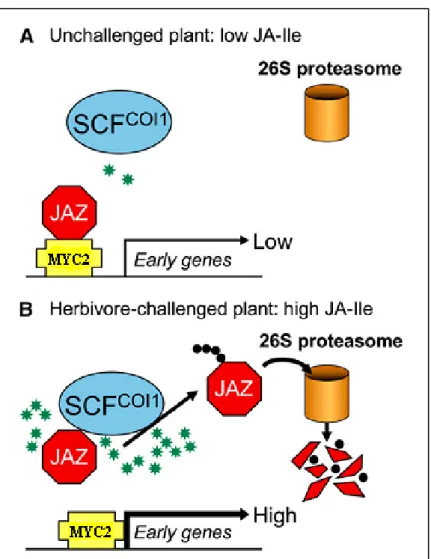
Figure 9 : Modèle de signalisation de JA en réponse à une attaque herbivore (Browse et Howe, 2008).
(A) Un faible niveau intracellulaire de JA-Ile (étoiles vertes) favorise l’accumulation des protéines JAZ qui répriment l’activité de MYC2 qui régule positivement les gènes de réponses aux jasmonates. (B) La blessure du tissu causée par les insectes herbivores induit une accumulation rapide de JA actif qui déclenche une ubiquitination de JAZ via le complexe SCFCOI1 ce qui entraine sa dégradation via le protéasome 26S. Cette élimination des protéines JAZ induit l’activité de MYC2 et donc l’expression des gènes de réponse précoces.
JA-Ile est fortement active à promouvoir l’interaction entre la CORONATINE INSENSITIVE (COI1), une protéine de type F-box impliquée dans la voie de protéolyse par le protéasome via l’ubiquitine et JAZ (jasmonate ZIM-domain) d’une manière dose-dépendante. Ainsi, en présence de JA-Ile, COI1 se fixe aux protéines JAZ induisant leur dégradation spécifique par le protéasome 26S (Thines et al., 2007), libérant ainsi MYC2 (un facteur de transcription de type bHLHzip) (fig.9). Or MYC2 agit comme activateur et répresseur de l’expression de divers gènes de réponse au JA (Lorenzo et al., 2004). Par ailleurs, les transcrits de JAZ s’accumulent d’une façon dépendante à MYC2. En effet, les gènes JAZ, inductibles par les jasmonates, sont constitutivement surexprimés chez des plantes non traitées surexprimant MYC2 et moins exprimés chez des mutants myc2 traités. Ceci montre que MYC2, bien qu’il soit réprimé par JAZ, effectue un rétrocontrôle positif sur JAZ (Chini et al., 2007) et régule négativement sa propre expression (Dombrecht et al., 2007).
De plus, Chini et al. (2007) a montré que l’activation des réponses aux jasmonates est régulée par un mécanisme de type rétrocontrôle négatif impliquant les protéines MYC2 et JAZ. Ceci pourrait donner une explication au pic de JA obtenu et suivi, ensuite, par une période de désensibilisation des cellules aux jasmonates (fig.7). En effet, l’hormone, en se fixant à son récepteur induit une dégradation des protéines JAZ via le protéasome libérant ainsi MYC2 et permettant l’activation de la transcription des jasmonates. Par la suite, puisque les gènes JAZ sont des cibles de MYC2, leur expression rapide induite par ce facteur de transcription contribue à l’auto-répression de MYC2 (Chini et al., 2007). Ainsi, dans notre projet de recherche, l’étude de l’expression des deux gènes MYC2 et JAZ, après divers traitements, sera très intéressante.
2.2- Impact des jasmonates dans les réponses aux sollicitations mécaniques
Les jasmonates (JAs) sont impliquées dans les réponses thigmomorphogénétiques chez les plantes suite à des stimulations mécaniques. Tretner et al. (2008) ont montré que la stimulation mécanique (par le toucher) des plants de Medicago truncatula engendre la production transitoire d’un fort niveau de jasmonates dans les racines et les tiges. Ces plants sont devenus plus riches en chlorophylle avec des racines plus courtes et une biomasse plus importante. De plus, les racines mécaniquement perturbées ont montré une plus faible élongation couplée avec une augmentation du JA. Ces modifications thigmomorphogénétiques représentent un phénotype similaire à celui observé chez des mutants cev1 d’Arabidopsis qui produisent constitutivement des niveaux élevés de jasmonates
Ainsi, suite aux stimulations mécaniques, les jasmonates peuvent jouer un rôle dans la voie de transduction relative à la thigmomorphogenèse (Chehab et al., 2009).
Par ailleurs, chez Arabidopsis, un nombre de facteurs de transcription de type C2H2 sont induits par le MeJA. Ces protéines à doigt de zinc de type C2H2 : ZAT10 et AZF2, qui contiennent un domaine de répression (ERF-associated amphiphilic) et qui fonctionnent comme des répresseurs transcriptionnels (et qui sont homologues de PtaZFP2), peuvent se fixer sur le promoteur de LOX3, codant la première enzyme de la voie de biosynthèse des jasmonates (Pauwels et al., 2008). De plus, la stimulation par le toucher, le vent ou la blessure cause une augmentation dose dépendante de la quantité de transcrits de la lipoxigénase (LOX) chez des plants de blé (Triticum aestivum L.). Cette réponse a été transitoire et a eu lieu après 1 heure de traitement (Mauch et al., 1997).
Concernant le gène AOC, il possède aussi un rôle crucial dans la synthèse de jasmonates en catalysant une étape régulatrice dans cette voie (Tretner et al., 2008). Pour OPR, Pauwels et al. ont montré que les OPDA réductases OPR2 et OPR3 sont régulés positivement et rapidement suite à un traitement avec le MeJA chez Arabidopsis. Chez le maïs aussi, le niveau de transcrits d’OPR1/2, OPR5 et OPR8 a augmenté après exposition au cis-3-hexenyl acétate qui induit des réponses de type ‘endurcissement’ chez cette espèce (Galis et al., 2009). De plus, la production systémique de JA-Ile induite par la blessure nécessite OPR3 et a été montré comme étant largement dépendante de l’activité de JAR1 vu que la conjugaison de JA en JA-Ile nécessite cette enzyme (Koo et al., 2009). Ainsi, les gènes AOC, OPR et JAR seront intéressants à étudier.
Tous ces résultats nous ont donc amené à étudier l’expression des gènes de biosynthèse de JAs en réponse à des stimulations mécaniques dans le but de mieux comprendre le phénomène d’acclimatation des plantes au stress mécanique.
Afin d’étudier l’implication des jasmonates dans la réponse aux sollicitations mécaniques, nous avons ciblé des gènes clefs de la voie de biosynthèse et de régulation des jasmonates et qui sont : LOX3, AOC, OPR, JAR, JAZ et MYC2.
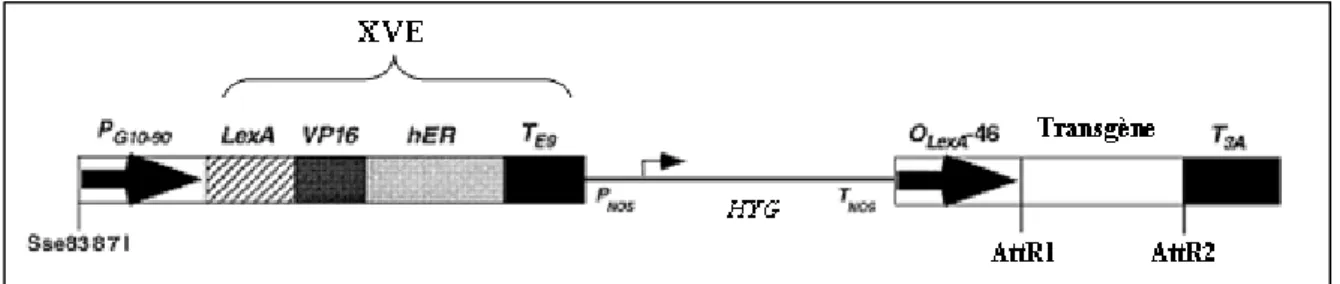
Figure 10: Schéma de la cassette de surexpression du vecteur PMDC7 (d’après Zuo et al., 2000)
Le promoteur constitutif G10-90 contrôle l’expression de la protéine de fusion XVE. Cette protéine est formée du domaine de liaison à l’ADN de LexA, du domaine d’activation de la transcription de VP16, de la région régulatrice du récepteur humain d’œstrogènes hER et d’une séquence polyA TE9. La cassette de surexpression comprend également une séquence PNOS correspondant au promoteur de la nopaline synthase, un gène de résistance à l’hygromycine (HYG) et une séquence TNOS poly adénylée. Le transgène est entouré des sites AttR1 et AttR2 permettant la recombinaison homologue à l’aide du système GATEWAY, précédé d’un promoteur OLexA-46 et suivi d’une séquence T3A poly-adénylée. XVE est activé en présence de β-œstradiol ce qui active le promoteur en amont du transgène.
1- Matériel végétal et conditions de culture
Des peupliers hybrides (Populus tremula x Populus alba, clone INRA 717-1B4) ont été obtenus par une micropropagation in vitro dans un milieu de Murashige et Skoog (Murashige and Skoog, 1962). Lorsque leurs tiges ont atteint une hauteur de 4 cm environ, les vitro-plants ont été acclimatés progressivement dans une solution nutritive (Morizet et Mingeau, 1976). Ensuite, les jeunes peupliers ont été mis dans une chambre de croissance à environnement contrôlé : 16 h de lumière (40 µmol m-2 s-1) à 24°C (jour) et 8 h d’obscurité à 20°C (nuit), l’humidité relative est de 70 + 10%. Les expériences ont été faites sur ces plantes environ 3 mois après la micropropagation soit avec une hauteur de 35 + 4 cm et 20 entre-nœuds environ.
Des plantes de peuplier transgéniques surexprimant PtaZFP2 ont été utilisées dans les expériences d’expression de gènes. Dans ces plantes, le transgène est sous contrôle d’un promoteur inductible par une hormone animale, le β-œstradiol (Zuo et al., 2000). Cette construction a été choisie afin d’éviter les problèmes de létalité causés par la surexpression de certains transgènes lors de la régénération des jeunes plantes et de pouvoir contrôler de manière précise le niveau et la durée d’expression du gène introduit (Martin, 2009). De plus, chez Arabidopsis, Sakamoto et al. (2004) ont montré la difficulté d’obtention des transformants surexprimant AZF2 et STZ (protéines à deux doigts de zinc de type (C2H2-ZFP) comme PtaZFP2) sous le contrôle d’un promoteur constitutif 35S. Le vecteur utilisé pour ces transformations est PMDC7 (Curtis et Grossniklaus, 2003). Ce vecteur comprend un promoteur constitutif PG10-90 qui induit l’expression d’un facteur de transcription chimérique
XVE qui est activé en présence de β-œstradiol (fig.10). Une fois activé, ce dernier agit sur un promoteur inductible OLexA-46 contrôlant l’expression du gène d’intérêt. Le niveau
d’expression de PtaZFP2 dans les plantes transgéniques dépend de la dose d’hormone introduite dans le milieu de culture (Zuo et al., 2000). La transformation génétique du peuplier a été effectuée selon le protocole de Leplé et al. (1992). Parmi les 7 lignées transgéniques obtenues, deux lignées (A30 et A39), surexprimant fortement PtaZFP2 ont été utilisées (Martin, 2009). Elles ont servi pour les diverses expériences afin de s’assurer que le phénotype observé soit résultant de la surexpression du transgène et pas en relation avec le site d’insertion de ce dernier dans le génome.
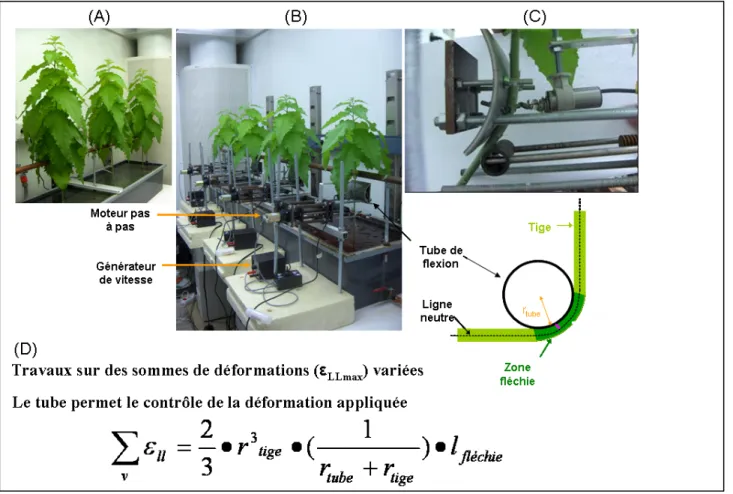
Figure 11 : Système de flexion de tiges
(A) Les peupliers sont en culture hydroponique et les plantes sont fixées sur un support métallique. (B) Les flexions ont été faites automatiquement à l’aide des tubes fixés sur des moteurs liés à une partie commande. (C) La flexion consiste à l’enroulement de la partie basse de la tige sur le tube de flexion pendant quelques secondes. C’est la zone fléchie (vert foncé) qui sera utilisée pour les analyses moléculaires. (D) A l’aide de la formule des sommes des déformations, on peut contrôler la déformation appliquée en changeant le diamètre de tube de flexion.
2- Les flexions
Les expériences de flexion ont été effectuées dans la chambre de croissance sous les mêmes conditions environnementales de culture. Les plantes ont été placées verticalement et ont été fixées à une barrde métallique horizontale à l’aide d’un anneau de serrage (fig.11 A). Les tiges ont été entourées avec de la mousse avant de serrer les anneaux pour éviter les blessures des tiges. Avant la fixation des plantes, les feuilles basales situées au dessous de l’anneau de serrage ont été enlevées pour éviter les stimulations mécaniques non contrôlées sur les feuilles et pour faciliter l’application des flexions et les mesures de croissance. Après l’installation et l’effeuillage, les plantes ont été laissées quatre jours sans réaliser aucun traitement ou stress pour (i) éviter les interactions entre les effets incontrôlés des stimulations mécaniques durant l’installation et les effets des flexions contrôlées et pour (ii) les laisser atteindre leur capacité maximale de perception et de réponse aux premières flexions contrôlées de la tige.
Les stimulations mécaniques ont été appliquées aux peupliers par le fait de fléchir la partie basale de la tige contre un tube en plastique pour obtenir une flexion homogène et contrôlée (fig.11 C), comme il est détaillé dans Coutand et al. (2009). Pour chaque plante, le niveau de stimulation mécanique a été quantifié en calculant la déformation qui résulte de la flexion et ceci à l’aide du calcul de la ’’somme des déformations’’ (fig.11 D) (Coutand and Moulia, 2000 ; Coutand et al., 2009). Dans notre cas, on a choisi des diamètres des tubes permettant d’avoir une somme de déformations proche de 3 mm3 et dans chaque expérience on a veillé à ce que la somme des déformations soit le plus homogène possible pour toutes les plantes.
Dans les expériences d’expression des gènes, la partie fléchie de la tige (3 cm de longueur), qui a été préalablement marquée par un feutre, a été collectée à différents temps après la flexion et elle a été rapidement congelée dans l’azote liquide et conservée à -80°C. 3- Extraction d’ARN et synthèse d’ADNc
Le matériel végétal utilisé a été broyé dans de l’azote liquide. Les ARNs totaux ont été extraits à partir d’environ 150 mg de tiges fléchies en utilisant le tampon d’extraction CTAB décrit par Chang et al. (1993). Ils ont été ensuite traités avec RNase-free RQ1 DNase (Promega, Charbonnières-les-Bains, France). Les ARNs ont été quantifiés par spectrophotométrie et vérifiés par électrophorèse sur gel d’agarose. Pour la synthèse d’ADNc, 1 µg d’ARNs totaux a été utilisé dans une reverse transcription utilisant de l’oligodT et le « Superscript™ III First-Strand Synthesis System » (Invitrogen, Cergy Pontoise, France) selon
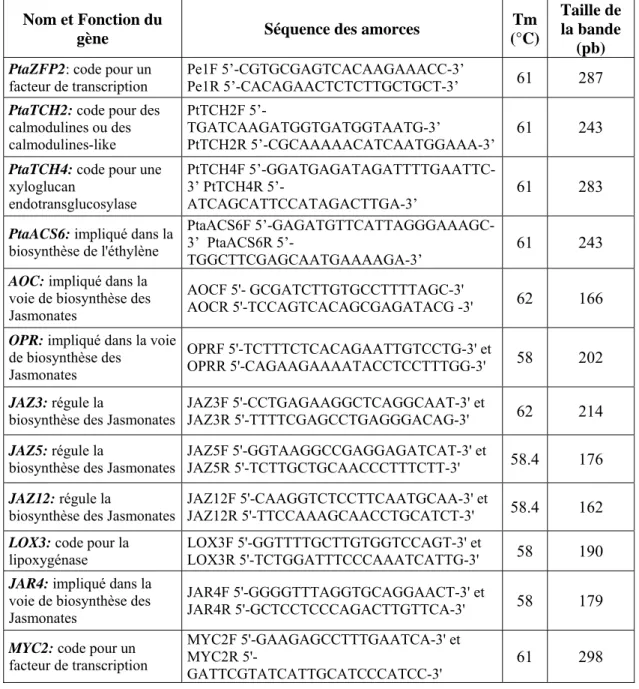
Tableau 1: Séquences et Tm des couples d’amorces permettant l’amplification de séquences des gènes étudiés
Nom et Fonction du
gène Séquence des amorces
Tm (°C)
Taille de la bande
(pb)
PtaZFP2: code pour un
facteur de transcription
Pe1F 5’-CGTGCGAGTCACAAGAAACC-3’
Pe1R 5’-CACAGAACTCTCTTGCTGCT-3’ 61 287
PtaTCH2: code pour des
calmodulines ou des calmodulines-like
PtTCH2F
5’-TGATCAAGATGGTGATGGTAATG-3’
PtTCH2R 5’-CGCAAAAACATCAATGGAAA-3’ 61 243
PtaTCH4: code pour une
xyloglucan
endotransglucosylase
PtTCH4F GGATGAGATAGATTTTGAATTC-3’ PtTCH4R
5’-ATCAGCATTCCATAGACTTGA-3’ 61 283
PtaACS6: impliqué dans la
biosynthèse de l'éthylène
PtaACS6F GAGATGTTCATTAGGGAAAGC-3’ PtaACS6R
5’-TGGCTTCGAGCAATGAAAAGA-3’ 61 243
AOC: impliqué dans la
voie de biosynthèse des Jasmonates
AOCF 5'- GCGATCTTGTGCCTTTTAGC-3'
AOCR 5'-TCCAGTCACAGCGAGATACG -3' 62 166
OPR: impliqué dans la voie
de biosynthèse des Jasmonates
OPRF 5'-TCTTTCTCACAGAATTGTCCTG-3' et
OPRR 5'-CAGAAGAAAATACCTCCTTTGG-3' 58 202
JAZ3: régule la
biosynthèse des Jasmonates JAZ3F 5'-CCTGAGAAGGCTCAGGCAAT-3' et JAZ3R 5'-TTTTCGAGCCTGAGGGACAG-3' 62 214
JAZ5: régule la
biosynthèse des Jasmonates JAZ5F 5'-GGTAAGGCCGAGGAGATCAT-3' et JAZ5R 5'-TCTTGCTGCAACCCTTTCTT-3' 58.4 176
JAZ12: régule la
biosynthèse des Jasmonates JAZ12F 5'-CAAGGTCTCCTTCAATGCAA-3' et JAZ12R 5'-TTCCAAAGCAACCTGCATCT-3' 58.4 162
LOX3: code pour la
lipoxygénase LOX3F 5'-GGTTTTGCTTGTGGTCCAGT-3' et LOX3R 5'-TCTGGATTTCCCAAATCATTG-3' 58 190
JAR4: impliqué dans la
voie de biosynthèse des Jasmonates
JAR4F 5'-GGGGTTTAGGTGCAGGAACT-3' et
JAR4R 5'-GCTCCTCCCAGACTTGTTCA-3' 58 179
MYC2: code pour un
facteur de transcription
MYC2F 5'-GAAGAGCCTTTGAATCA-3' et MYC2R
4- PCR quantitative relative (Real-time quantitative RT-PCR)
Les amplifications en PCR quantitative relative en temps réel ont été réalisées en utilisant un thermocycleur iCycler IQ (Bio-Rad, Marnes-la-Coquette, France) et SYBR green comme un colorant fluorescent (selon le protocole du kit MESA GREEN qPCR MAsterMix Plus for SYBR® (Eurogentec)). Chaque réaction PCR (25 µl), contient : de l’ADNc obtenu par une reverse transcription (4 µl de dilution 1 :20 d’ADNc), MasterMix (-1 X), amorces (0.2 µM pour chacune).
Après une étape de chauffage à 95°C durant 3 min, les conditions de chaque cycle PCR (40 cycles au total) consistent en : une étape de dénaturation (95°C durant 10 s), une phase d’hybridation ou ‘‘annealing’’ (58°C ou 58,4°C ou 61°C ou 62°C, selon la Tm du couple d’amorces, durant 15 s) et une étape d’élongation (72°C durant 15 s).
Les couples d’amorces utilisés pour amplifier les différents gènes, leurs Tm ainsi que la taille des bandes amplifiées sont présentés dans le tableau 1. Le facteur d’élongation EF-1α a été utilisé comme gène de référence puisque son expression n’est pas modifiée en réponse aux stimulations mécaniques (Martin et al., 2009). Les transcrits de EF-1α ont été amplifiés en utilisant les amorces EF1F 5’-GACAACTAGGTACTACTGCACTGTC-3’ et EF1R 5’-TTGGTGGACCTCTCGATCATG-3’. Les amorces ont été choisies en utilisant le logiciel PRIMER3 sur des séquences nucléotidiques prédites de peuplier (cultivars autres que Pta) des gènes cibles dont les protéines ont été déjà identifiées chez Arabidopsis thaliana. Pour s’assurer de la spécificité des amorces, tous les produits PCR correspondant à ces gènes ont été vérifiés par séquençage (Société GATC Biotech, Marseille, France). Un blast (base de données NCBI) a été réalisé sur chaque séquence dans le but de s’assurer que les fragments d’ADN amplifiés correspondent spécifiquement aux séquences souhaitées.
L’abondance quantitative relative (Qr) des transcrits de PtaZFP2, PtaTCH2, PtaTCH4, PtaACS6, AOC, OPR, JAZ3, JAZ5, JAZ12, LOX3, JAR4 et MYC2 a été calculée par comparaison avec l’expression d’EF-1α en utilisant le modèle mathématique de la méthode delta-delta (Mc Maugh & Lyon, 2003).
Ici, xg est le gène étudié, EF-1α est le gène de référence, C est le nombre de cycles PCR pour atteindre la détection de seui. La spécificité d’amplification a été confirmée par la détermination des courbes de fusion pour les produits PCR. Les amplifications PCR en temps réel ont été faites selon, au moins, deux répétitions indépendantes et pour chaque répétition, on a utilisé des triplicats d’échantillons.
Les tests statistiques ont été réalisés à l’aide du logiciel ‘’STATGRAPHICS Centurion’’. Concernant la mesure d’expression des gènes, les valeurs de l’abondance quantitative relative (Qr) ont été transformées en Logarithme népérien (Ln) pour mieux garantir la normalité des données. Cette dernière a été vérifiée avant chaque test à l’aide de graphique de normalité. Afin de s’assurer de l’homoscédasticité des données (égalité des variances), le test de Bartlett à été utilisé. Le niveau de signification statistique global a été déterminé par une analyse de la variance à un facteur (ANOVA) à l’aide du test non paramétrique de Kurskal et Wallis car il est plus adapté au cas où il existe des valeurs extrêmes. Les différents groupes statistiques ont été obtenus avec un test de Newman-Keuls.
PtaZFP2
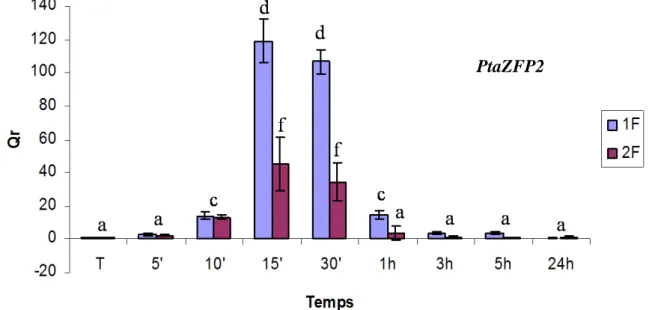
Figure 12 : Cinétique d’accumulation des transcrits de PtaZFP2 dans les tiges de peuplier après une flexion et deux flexions.
La quantité relative des transcrits (Qr) de PtaZFP2 a été mesurée par PCR quantitative en temps réel. Pour chaque plante, les ARNs ont été extraits à partir de la portion de tige fléchie (3 cm de longueur) prélevée 5 min, 10 min, 15 min, 30 min, 1h, 3h, 5h et 24h après la première flexion (1F) ou après la deuxième flexion (2F). Pour les plantes fléchies 2 fois, l’intervalle entre les deux flexions est de 24h. Des plantes non fléchies ont été utilisées comme témoins (T). Les barres d’erreur représentent l’écartype de la quantité relative des transcrits pour chaque temps de la cinétique pour 2 répétitions indépendantes de cette expérience. Les valeurs notées par des lettres différentes sont significativement différentes (test de Newman-Keuls P < 0.05).
Figure 13 : Expression de PtaZFP2 après la deuxième flexion en fonction du délai entre les deux flexions.
La quantité relative des transcrits (Qr) de PtaZFP2 a été obtenue par PCR quantitative en temps réel. Pour chaque plante,les ARNs ont été extraits à partir de la portion de tige fléchie (3 cm de longueur) prélevée 30 min après la deuxième flexion et de la première flexion (1F). La deuxième flexion a été réalisée 3, 6, 12, 18 ou 24 heures après la première flexion. Les histogrammes colorés en vert foncé (1F) et en vert clair (24 h) proviennent d’une expérience indépendante (fig.12) dans laquelle la somme des déformations appliquée sur les tiges de peupliers est très proche de celle de cette expérience. Des plantes non fléchies ont été utilisées comme témoins (T). Les barres d’erreur représentent l’écartype de la quantité relative des transcrits mesurée sur 2 plantes pour chaque point. Les valeurs notées par des lettres différentes sont significativement différentes (test de Newman-Keuls P < 0.05).
1- Cinétique d’acclimatation de l’expression de PtaZFP2
1.1- Comparaison de la cinétique d’expression de PtaZFP2 après une flexion et deux flexions
Pour mieux caractériser le phénomène de désensibilisation observé lors de la réponse des peupliers suite à une deuxième flexion, la cinétique d’accumulation des transcrits de PtaZFP2, gène utilisé comme marqueur de la mécanoperception, a été étudiée en réponse à une et à deux flexions. Les flexions de la tige ont été contrôlées de manière à appliquer la même somme de déformations à chacune des plantes. Suite à une flexion, l’expression de ce facteur de transcription est induite 10 min après la sollicitation. Le maximum est atteint entre 15 et 30 min après la flexion, puis le niveau de transcrits retourne à son niveau de base 3 heures après la sollicitation (fig.12). De même, après une deuxième flexion effectuée 24 heures après la première, l’expression de PtaZFP2 est induite 10 min après la deuxième sollicitation. Le maximum d’accumulation des ARNs est atteint entre 15 et 30 min après la deuxième sollicitation et le niveau de base est atteint après 3 heures (fig.12). Cependant, le niveau d’accumulation des transcrits est beaucoup plus faible que celui atteint suite à une seule flexion. Ainsi, 15 min après la première flexion, la quantité d’ARNm de PtaZFP2 est 120 fois plus importante que chez le témoin. Lorsqu’on applique une deuxième flexion 24h00 après la première, la quantité d’ARN PtaZFP2 est seulement 40 fois plus importante que chez le témoin au même point de la cinétique (fig.12). Ces résultats montrent que la cinétique d’expression de PtaZFP2 est identique après 1 flexion ou deux flexions. Toutefois, le plus faible niveau d’accumulation des ARNs de ce gène mécanosensible après la deuxième flexion suggère une atténuation de la réponse des peupliers.
1.2- Etude de l’expression de PtaZFP2 après la deuxième flexion en fonction du délai entre les deux flexions successives
Bien que la désensibilisation des peupliers à des flexions répétées ait été mise en évidence lorsque les deux flexions sont séparées de 24 heures (Martin et al., 2010), il est intéressant d’étudier le temps nécessaire entre deux flexions pour que ce phénomène se mette en place. Dans ce but, le niveau d’expression du gène mécanosensible PtaZFP2 a été étudié en diminuant l’intervalle de temps séparant les deux sollicitations successives. Pour chaque plante, la portion de tige fléchie a été prélevée 30 min après la deuxième flexion. Comme dans l’expérience précédente, les flexions ont été contrôlées de manière à appliquer la même somme de déformations à chacune des plantes.
Figure 14 : Cinétique d’expression des gènes de biosynthèse et de régulation des jasmonates après une flexion de la tige chez le peuplier.
La quantité relative des transcrits (Qr) des gènes de biosynthèse (LOX3, AOC, OPR et JAR4) (A) et de régulation (JAZ5, JAZ3, JAZ12 et MYC2) (B) des jasmonates a été étudiée par PCR quantitative en temps réel. Pour chaque plante, les ARNs ont été extraits à partir de la portion de tige fléchie (3 cm de longueur) prélevée 5 min, 10 min, 15 min, 30 min, 1h, 3h, 5h et 24h après la flexion. Des plantes non fléchies ont été utilisées comme témoins (T). Les barres d’erreur représentent l’écartype de la quantité relative des transcrits pour chaque temps de la cinétique pour 2 répétitions indépendantes de cette expérience. Les valeurs notées par des astérisques (*) sont significativement différentes du témoin (test de Newman-Keuls P < 0.05).
Comme le montre la figure 13, pour tous les intervalles de temps testés (3, 6, 12, 18 et 24 heures), aucune différence des quantités relatives des transcrits de PtaZFP2 n’est observée. Par contre, si on compare le niveau d’expression de ce gène après la deuxième flexion (quel que soit le délai entre les deux flexions) avec celui obtenu après une seule flexion, on constate que le niveau d’accumulation des transcrits est plus faible (fig.13). Ces résultats suggèrent qu’un délai de 3h entre deux flexions successives est suffisant pour atténuer les réponses des peupliers à la deuxième flexion.
2- Implication des jasmonates dans la réponse et l’acclimatation aux flexions chez le peuplier
2.1- Cinétique d’expression des gènes de biosynthèse et de régulation des jasmonates après une flexion
Afin de tester si la voie de signalisation des jasmonates est impliquée dans la réponse aux sollicitations mécaniques chez le peuplier, la cinétique d’expression des gènes de biosynthèse et de régulation des jasmonates suite à la flexion a été analysée en utilisant les mêmes plantes que celles décrites dans le paragraphe précédent (&1.1). Dans ce but, des alignements de séquence ont été réalisés entre les protéines identifiées chez Arabidopsis thaliana et la banque de données de Populus trichocarpa. Des amorces ont été dessinées dans les régions conservées de ces différentes protéines. Pour chaque couple d’amorce, le fragment d’ADN amplifié par Q-PCR a été séquencé pour confirmer sa spécificité. Comme le montre la figure 14 A., le niveau de transcrits des gènes étudiés de cette voie de biosynthèse (LOX3, AOC, OPR et JAR4) est modifié après une flexion. En effet, la quantité d’ARNs LOX3 est 8 fois supérieure à celle observée chez le témoin 30 min et 1 heure après la flexion. L’expression de LOX3 revient au niveau de base au bout de 3 heures. En ce qui concerne JAR4, son expression est induite plus tardivement (3 heures après la flexion) et diminue après 24 heures. De manière surprenante, deux pics d’accumulation d’ARNs sont observés pour les gènes AOC et OPR au cours de la cinétique. Pour ces deux gènes, un premier pic de faible intensité est observé dès 5 min après la sollicitation et le taux de transcrit revient au niveau de base au bout de 15 min. Puis, un deuxième pic d’expression de forte intensité du gène AOC est détecté 3 heures après la flexion, puis la quantité de transcrits diminue jusqu’à atteindre le niveau de base après 24 heures. Dans le cas du gène OPR, un deuxième pic d’expression de faible intensité et très transitoire est également observé 3 heures après la flexion (fig.14 A).
Figure 15 : Comparaison des cinétiques d’expression des gènes de biosynthèse et de régulation des jasmonates après une flexion ou deux flexions de la tige chez le peuplier.
La quantité relative des transcrits (Qr) de certains gènes de biosynthèse (LOX3 (A), AOC (C), OPR (D) et JAR4 (B)) et de régulation (JAZ5 (E) et MYC2 (F)) des jasmonates a été étudiée par PCR quantitative en temps réel. Pour chaque plante, la fraction fléchie de la tige (3 cm de longueur) a été prélevée 5 min, 10 min, 15 min, 30 min, 1h, 3h, 5h et 24h après la première flexion (1F) et la deuxième flexion (2F). L’intervalle entre deux flexions est de 24h. Des plantes non fléchies ont été utilisées comme témoins (T). Les barres d’erreur représentent l’écartype de la quantité relative des transcrits pour chaque temps de la cinétique pour 2 répétitions indépendantes de cette expérience. Les valeurs notées par des lettres différentes sont significativement différentes (test de Newman-Keuls P < 0.05).
Ces résultats montrent que l’ensemble des gènes impliqués dans la voie de biosynthèse des jasmonates sont régulés suite à une sollicitation mécanique. Toutefois, les gènes AOC et OPR sont régulés plus précocement par un stress de type flexion que les gènes LOX3 et JAR4.
Concernant les gènes impliqués dans la régulation de la voie de biosynthèse des jasmonates, l’expression de JAZ3 et JAZ12 n’est pas régulée par la flexion alors que celle de JAZ5 est fortement induite dès 30 min après la flexion (fig.14 B). Ces résultats suggèrent que les deux isoformes JAZ3 et JAZ12 de la famille multigénique des gènes JAZ, ne semblent pas être impliqués dans la réponse à la flexion chez Populus tremula X alba. Au contraire, l’isoforme JAZ5, décrit comme un régulateur négatif de cette voie, est fortement régulé par ce type de sollicitation.
Comme le montre la figure 14 B, l’expression du facteur de transcription MYC2, régulateur positif de cette voie de signalisation, est induite après 15 min (un peu avant celle de JAZ5), atteint un maximum à 30 min et diminue au bout de 3 heures. Ces données indiquent que l’ensemble des gènes de la voie de signalisation des jasmonates pourraient être régulés par le stress mécanique chez le peuplier.
2.2- Etude de l’expression des gènes de biosynthèse et de régulation des jasmonates après des flexions répétées chez le peuplier
2.2.1- Comparaison de la cinétique de l’expression des gènes de biosynthèse et de régulation des jasmonates après une ou deux flexions
Afin d’étudier l’impact des flexions répétées sur l’expression des gènes de biosynthèse et de régulation des jasmonates, la cinétique d’accumulation des transcrits de LOX3, JAR4, AOC, OPR, JAZ5 et MYC2 dans la tige après une flexion a été comparée à celle après deux flexions. Dans cette expérience, la deuxième flexion est réalisée 24h00 après la première flexion. Pour tous ces gènes, la cinétique d’induction n’est pas modifiée mais le niveau d’expression est plus faible après la deuxième flexion en comparaison avec la première flexion (fig.15). Pour le gène LOX3 (fig.15 A), cette diminution du taux de transcrits est très forte et pour certains points de la cinétique, la quantité de transcrits est plus faible que celle observée chez le témoin n’ayant pas subi de sollicitation mécanique. Ces résultats pourraient suggérer une répression de l’expression de LOX3.