Faculté de Médecine et de Pharmacie, Rabat
Faculté des Sciences Semlalia, Marrakech Faculté de Médecine et de Pharmacie, Rabat
Ecole Normale Supérieure, Rabat Faculté des Sciences, Rabat
Faculté de Médecine et de Pharmacie, Rabat Faculté de Médecine et de Pharmacie, Rabat Faculté de Médecine et de Pharmacie, Rabat
Président Directeur de thèse Rapporteur Rapporteur Rapporteur Examinateur Examinateur Invité Pr. ZELLOU Amina
Soutenue le : 09/01/2020, devant la commission d’examen :
Pr. CHERRAH Yahia Pr. ALAOUI Katim Pr. ES-SAFI Nour Eddine Pr. KAHOUADJI Azzedine Pr. KHATTABI Naima Pr. OULAD BOUYAHYA IDRISSI Mohammed Pr. NEJJARI Rachid
UNIVERSITE MOHAMMED V, RABAT FACULTE DE MEDECINE ET DE PHARMACIE
CENTRE D’ETUDES DOCTORALES DES SCIENCES DE LA VIE ET DE LA SANTE N° de thèse : 24/19 CSVS
Thèse de Doctorat
Présentée parMeryem EL JEMLI
Spécialité : Sciences du Médicament Laboratoire : Pharmacologie et Toxicologie
Contribution à l’étude ethnobotanique, toxicologique, pharmacologique et
phytochimique de quatre Cupressacées marocaines : Juniperus thurifera L.,
Juniperus oxycedrus L., Juniperus phoenicea L. et Tetraclinis articulata L.
ANNEE 20192
A ALLAH LE TOUT PUISSANT
À mes chers parents
Aucun mot ne pourra exprimer la profondeur de mes sentiments, mon respect,
ma considération, ma reconnaissance et mon amour éternel
À mes sœurs adorées Yousra et Safae
Merci de m‘avoir supporté et soutenu. Sans votre aide, votre implication et vos
encouragements, ce travail n‘aurait jamais vu le jour
À mon cher fiancé Iliass
Merci pour tout
À la mémoire de mes grands-parents
À la grande famille El Jemli
À la grande famille Khattabi
À la grande famille Feddol
À tous mes amis et tous ceux qui me sont chers et à tous ceux que
ma réussite leur tient à cœur
3
REMERCIEMENTS
Le présent travail n’aurait pas pu avoir lieu sans la contribution de nombreuses personnes. Je tiens à exprimer ma profonde gratitude en remerciant tous ceux qui m’ont aidée pour mener à bien ce travail.
Mes profondes gratitudes vont tout d’abord à Monsieur le Professeur Taoufik Jamal, Directeur de notre centre d’école doctorale ‘’Sciences de la Vie et de la Santé’’ au sein de la Faculté de Médecine et de Pharmacie, pour l’immense intérêt et les efforts qu’il déploie pour l’épanouissement de la recherche scientifique au sein de notre établissement.
J’exprime mes remerciements les plus sincères à Madame le Professeur Alaoui Katim, pour m’avoir chaleureusement accueillie au sein de son équipe de recherche. Sous sa direction, j’ai grandement appris et acquis une solide expertise dans le domaine de la pharmacologie. Je lui suis également très econnaissante de m’avoir laissé autant de liberté et de responsabilités au sein de son laboratoire.
Mes remerciements vont également à Monsieur le Professeur Cherrah Yahia, Directeur du Laboratoire de Pharmacologie et Toxicologie de la Faculté de Médecine et de Pharmacie de Rabat, de m’avoir accueillie au sein de son Laboratoire. Je tiens à lui exprimer toute ma gratitude d’avoir accepté de présider le jury de ma soutenance de thèse malgré ses multiples obligations. Qu’il veuille bien trouver ici l’expression de mon profond respect.
Je tiens à exprimer ma très grande considération et ma vive reconnaissance à Madame le Professeur Khattabi Naima de la Faculté des Sciences Semlalia, Marrakech, pour m’avoir bien accueillie dans le Laboratoire de Biotechnologie et Physiologie Végétales, Faculté des Sciences Semlalia et d’avoir accepté de faire partie de mon jury de thèse en qualité de rapporteur.
J’exprime ma reconnaissance à Monsieur Es-safi Nour Eddine, Professeur à l’Ecole Normale Supérieure, Université Mohammed V de Rabat ainsi qu’à Monsieur Kahouadji Azzedine, Professeur à la Faculté des Sciences, Université Mohammed V de Rabat qui ont fait l’honneur d’examiner ce travail en qualité de rapporteurs. Qu’ils trouvent ici l’expression de ma haute considération.
J’adresse également mes remerciements à Monsieur Oulad Bouyahya Idrissi Mohammed, Professeur au Laboratoire de Chimie Analytique et Bromatologie, Faculté de Médecine et de Pharmacie de Rabat, qui a toujours manifesté une grande disponibilité pour me faire bénéficier
4
de ses connaissances en matière de chimie analytique ainsi que pour sa participation au jury de cette thèse.
Mes remerciements vont aussi à Monsieur Nejjari Rachid, Professeur au Laboratoire de Pharmacognosie, Faculté de Médecine et de Pharmacie de Rabat, pour avoir accepté de faire partie du jury. Je tiens à lui exprimer toute ma gratitude pour son aide et son orientation dans l’élaboration de ce projet ainsi que pour ses judicieux conseils lors de mon séjour au Laboratoire de Pharmacognosie.
Madame le Professeur Zellou Amina, Merci infiniment pour votre grande disponibilité, pour votre soutien, pour vos nombreux conseils et pour avoir accepté de participer au jury à titre d’invité.
Mes remerciements vont également à Monsieur le Professeur Moutaj Redouane, chef de service de parasitologie de l’Hôpital Militaire Avicenne de Marrakech, de m’avoir accueillie au sein du Laboratoire de mycologie et parasitologie à la Faculté de Médecine et de Pharmacie de Marrakech, pour la réalisation des tests antifongiques. Je tiens à lui exprimer toute ma gratitude pour ses judicieux conseils et son aide pour accomplir la partie parasitologie de mon projet de thèse.
Mes remerciements vont à Monsieur le Doyen de la Faculté de Médecine et de Pharmacie de Marrakech, le Professeur Bouskraoui Mohammed, d’avoir accepté ma demande pour effectuer mon stage au sein du Laboratoire de Parasitologie, Faculté de Médecine et de Pharmacie de Marrakech.
J’adresse également mes remerciements à Madame Lachqer Khadija, Professeur au Laboratoire de Biotechnologie et Physiologie Végétale, Faculté des Sciences Semlalia, Université Cadi Ayyad, Marrakech, Maroc. Merci pour l’énorme contribution que vous m’avez apportée afin de mener à bien ce projet. Soyez assurée de mon profond respect et de ma vive reconnaissance.
Mes vifs remerciements s’adressent à Monsieur le Professeur Wahbi Said, Directeur du Laboratoire de Biotechnologie et Physiologie Végétale, Faculté des Sciences Semlalia, Université Cadi Ayyad, Marrakech, d’avoir accepté ma demande de stage au sein de son laboratoire.
Mes sincères et profonds remerciements vont au Professeur M. Ezzat Shahira, département de Pharmacognosie, Faculté de Pharmacie, Université du Caire, Égypte, au Professeur Eman Mostafa Sherien, Département de Pharmacognosie, Faculté de Pharmacie, Université des sciences et des arts modernes, Égypte et au Professeur Ali Radwan Rasha, département de Biochimie et de Biotechnologie, Faculté de Pharmacie et de Technologie Pharmaceutique,
5
Université Heliopolis, Égypte, pour avoir contribué à l’élucidation structurale et l’évaluation pharmacologique des composés isolés.
Mes vifs remerciements s’adressent à Monsieur El Hassani Abdelmounaim, ingénieur en chef des eaux et forets, pour son aide dans le choix, l’identification et la collecte des espèces végétales étudiées dans ce travail.
Un grand merci à Monsieur Fennane Mohamed, Professeur à l’institut scientifique, Université Mohammed V de Rabat pour son aide dans l’identification des espèces végétales étudiées dans ce travail.
Merci également à Madame Foukara Zakia, Laboratoire de Parasitologie, Faculté de Médecine et de Pharmacie de Marrakech, auprès de laquelle j’ai trouvé un soutien fort et inconditionnel pour mener à bien la partie parasitologie de ce travail. Je la remercie vivement pour sa confiance, ses conseils et de l'amitié dont elle m'a honoré. Qu’elle trouve ici l’expression de ma profonde reconnaissance.
Toute ma gratitude à mon collègue Kharbach Mourad, membre du Laboratoire de Pharmacologie et Toxicologie de la Faculté de Médecine et de Pharmacie de Rabat, et du Département de chimie analytique et de technologie pharmaceutique, Université libre de Bruxelles, Belgique, pour la réalisation des tests HPLC/SM.
Un très grand merci à tous les Herboristes et les Villageois qui ont accepté de participer à ce travail.
Mes vifs remerciements s’adressent à Madame Yaiche Latifa et Madame Aouri Hayat, pour leurs soutiens, leurs encouragements et les conversations amicales entretenues avec eux.
Toute ma reconnaissance à Monsieur le Professeur Bousliman Yassir et Madame le Professeur Ait El Cadi Mina que j'ai eu l'honneur et le plaisir de côtoyer au cours des travaux pratiques de toxicologie dédiés aux étudiants pharmaciens de la Faculté de Médecine et de Pharmacie de Rabat. Merci chers Professeurs de m’avoir fait profiter de vos riches expériences en recherches toxicologiques et pour l’environnement de travail convivial et chaleureux que vous créez au cours de chaque séance de travaux pratiques.
Mes remerciements vont aussi au Personnel de l’Animalerie Centrale de la Faculté de Médecine et de Pharmacie de Rabat, pour leur disponibilité et leurs précieux conseils lors des expérimentations animales.
Mes vifs remerciements vont à tous les professeurs et le personnel du Laboratoire de Pharmacologie et Toxicologie, le Laboratoire de Chimie Analytique et Bromatologie, et le
6
Laboratoire de Chimie Thérapeutique de la Faculté de Médecine et de Pharmacie de Rabat, notamment le Professeur Benzeid Hanane, le Professeur Faouzi Moulay El Abbes et le Professeur Ramli Youssef pour leurs conseils qui m’ont été d’une grande utilité pour la réalisation de mon travail.
Je remercie également Madame Harrat Khadija secrétaire du centre d’école doctorale ‘’Sciences de la Vie et de la Santé’’, Faculté de Médecine et de Pharmacie, pour sa disponibilité, sa gentillesse et son aide dans toutes mes démarches administratives.
Un vif merci à tous les amis, les collègues et les stagiaires que j’ai côtoyés à la Faculté de Médecine et de Pharmacie de Rabat et à la Faculté des Sciences Semlalia de Marrakech, particulièrement Zakhour Rajaa, Guerrab Walid, Salhi Najoua, Doukkali Zouhra, Terence Nguema Ongone, Bahadi Hind, El Bairi Khalid, Bouidida El Houcine, Mzabri Hanan, Balliout Hajar, Aghraz Abdallah, M’sou Soufiane, El-gourrami Otman, Drioua Soufiane, ZaouiYounes, Sayah Karima, El Hassani Hamza, Chabib Amine, Chabib Ousama, Chemlal Laila. Merci pour tous les innombrables moments forts que nous avons vécus ensemble. Sans votre serviabilité, vos encouragements et la bonne ambiance que vous créaient, mes années de thèse auraient eu une toute autre saveur.
Je ne saurais oublier mon meilleur ami Marmouzi Ilias. Vous m’avez beaucoup aidée par votre grande expérience et vos larges connaissances. Merci pour l’énorme contribution que vous m’avez apportée afin de mener à bien ce projet et pour tous les bons moments que nous avons partagés ensemble durant la réalisation de nos manipes.
Le plus ENORME, INEFFABLE merci s’adresse à mes Parents qui m’ont toujours aidée et soutenue dans mes choix, et qui ont été présents chaque fois que cela été nécessaire. Merci Maman, Merci Papa, Merci ma Sœur Yousra, Merci ma Sœur Safae. C’est avec vous que j’ai partagé mes joies, mes peines, vous m’avez soutenue grâce à votre présence, à votre sourire, à votre amitié. Je vous dédie ce travail en témoignage de ma profonde reconnaissance pour toute la patience et les sacrifices que vous avez consentis pour moi et dont je vous serai à jamais redevable. Merci pour tout ce que vous avez fait pour moi.
7
FICHE PRESENTATIVE DE LA THESE
Doctorante : Meryem EL JEMLI
Formation Doctorale : Sciences de la Vie et de la Santé, branche Sciences du Médicament
Intitulé du travail : Contribution à l‘étude ethnobotanique, toxicologique, pharmacologique et phytochimique de quatre Cupressacées marocaines : Juniperus thurifera, Juniperus oxycedrus, Juniperus phoenicea et Tetraclinis articulata.
Encadrante :
- Nom et prénom : Pr. Katim ALAOUI
- Laboratoire et institution : Laboratoire de Pharmacologie et Toxicologie (Equipe de Recherche de Pharmacodynamie ERP), Faculté de Médecine et de Pharmacie, Université Mohammed V, Rabat.
Lieux de réalisation des travaux :
- Laboratoire de Pharmacologie et Toxicologie, Equipe de Recherche de de Toxicité et Pharmacodynamie des Plantes Aromatiques et Médicinales ERTP.PAM Pharmacodynamie ERP, Faculté de Médecine et de Pharmacie, Université Mohammed V, Rabat.
- Laboratoire de Biotechnologie et physiologie végétales, Département de Biologie, Faculté des Sciences Semlalia, Université Cadi Ayyad, Marrakech, Maroc.
- Laboratoire de Pharmacognosie, Faculté de Médecine et de Pharmacie, Université Mohammed V, Rabat.
- Laboratoire de Mycologie-Parasitologie, Faculté de Médecine et de Pharmacie, Université Cadi Ayyad, Marrakech, Maroc.
- Département de Pharmacognosie, Faculté de Pharmacie, Université du Caire, Égypte. - Département de Pharmacognosie, Faculté de Pharmacie, Université des sciences et des arts modernes, Égypte.
- Département de Biochimie et de Biotechnologie, Faculté de Pharmacie et de Technologie Pharmaceutique, Université Heliopolis, Égypte.
- Département de chimie analytique et de technologie pharmaceutique, Université libre de Bruxelles, Belgique.
8
PRINCIPALES PUBLICATIONS ET COMMUNICATIONS EN
RAPPORT AVEC LE SUJET
Publications (Annexe)
1. El Jemli, M., Khattabi, N., Lachqer, K., Touati, D., El Jemli, Y., Marmouzi, I., Wakrim, EM., Cherrah Y., Alaoui K., (2018) ‗‘Antifungal and Insecticidal Properties of Juniperus thurifera Leaves. Natural Product Communications. Vol. 13, No 0 (1 – 3).
2. El Jemli, M., Kamal, R., Marmouzi, I., Doukkali, Z., Bouidida, E., Touati, D., Nejjari, R., El Guessabi, L., Cherrah, Y., Alaoui, K. (2017). Chemical composition, acute toxicity, antioxidant and anti-inflammatory activities of Moroccan Tetraclinis articulata L. Journal of Traditional and Complementary Medicine. Vol. 7, No 3 (281-287).
3. El Jemli, M., Kamal, R., Marmouzi, I., Zerrouki, A., Cherrah, Y., Alaoui, K., (2016). Radical-Scavenging Activity and Ferric Reducing Ability of Juniperus thurifera (L.), J. oxycedrus (L.), J. phoenicea (L.) and Tetraclinis articulata (L.). Advances in Pharmacological Sciences. Vol 2016.
4. El Jemli, M., Marmouzi, I., Kharbach M., El Jemli, Y., Sayah, Wakrim, E.M., Cherrah, Y., Alaoui, K. Quantification of polyphenols and evaluation of toxicity and pharmacological effects of aqueous extracts of J. thurifera, J. phoenicea and J. oxycedrus (soumis à ‗Journal of Ethnopharmacology‘)
Communications dans des congrès internationaux
- El Jemli M., Marmouzi I., Kharbach M., El Jemli Y., Sayah K., Wakrim E., El-Guourrami O., Bahadi H., Cherrah Y., Alaoui K. ‘‘Quantification of polyphenols and evaluation of
toxicity, anti-inflammatory and analgesic effects of aqueous extracts of J. thurifera, J. phoenicea and J. oxycedrus‘‘ VIIème Congrès International de Biotechnologie et
Valorisation des Bio-Ressources, 20- 23 Mars 2019, Tunisie.
- El Jemli M., Moutaj R., Marmouzi I., El Jemli Y., Wakrim E., Khattabi N., M., Cherrah Y., Alaoui K. ‘‘Innocuité et effet dermo-protecteur (anti-candidose/antioxidant/anti-tyrosinase) des extraits de Tetraclinis articulata‘‘ Neuvième Edition du Prix SRPO, "De la Recherche et des Sciences Pharmaceutiques", 26-27 Octobre 2018, Oujda.
9
- El Jemli, M., Kharbach, M., El Jemli, Y., Cherrah, Y., Alaoui, K.‘‘Anti-Aging and anti-Oxidant Properties of essential oil from Juniperus thurifera, an endemic, threatened medicinal plant in Morocco‘‘ 2ème congrès International des Sciences Pharmaceutiques (CISPHARM 2017), 17-18 Février 2017, FST Beni Mellal.
- El Jemli M., Marmouzi I., Kharbach, M., Sayah, K., Doukkali, Z., Wakrim, E., Cherrah, Y., Alaoui, K. ‘‘HPLC-MS of water extracts from leaves of three Juniperus taxa used in Moroccan traditional medicine and their anti-inflammatory and analgesic activities‘‘ 2ème congrès International des Sciences Pharmaceutiques (CISPHARM 2017), 17-18 Février 2017, FST Beni Mellal.
- El Jemli M., Marmouzi I., Doukkali, Z., Bouidida, E., Touati, D., Nejjari, R., El Guessabi, L., Cherrah, Y., Alaoui, K. ‘‘Chemical composition acute toxicity and biological activity of Moroccan Tetraclinis articulata L.‘‘ Substances Naturelles : Stress et métabolisme cellulaires, 15-16 Novembre 2016, Settat.
- El Jemli M., Khattabi, N., Lachqer, Kh., Cherrah, Y., Alaoui, K.‘‘Chemical composition, antifungal and antioxidant activities of essential oil from Moroccan Tetraclinis articulata (L.)‘‘ Substances Naturelles et Développement Durable, 19-21 Mai 2016, Rabat.
- El Jemli M., Khattabi N., Lachqer Kh., Cherrah, Y., Alaoui, K. ‘‘Chemical composition, antifungal and antioxidant activities of essential oil from Moroccan Juniperus oxycedrus (L.)‘‘ CIALGUE, 29 Mars-02 Avril 2016, Marrakech.
- El Jemli M., Kamal, R., Doukkali, Z., Bahadi, H., Bouidida, E., Touati, D., Nejjari, R., El Guessabi, L., Cherrah, Y., Alaoui, K. ‘‘Chemical composition, toxicity, antioxidant and anti-inflammatory activities of essential oil from Moroccan Juniperus phoenicea (L.)‘‘ CISPHARM congress, 25-26 Février 2016, Beni Mellal.
- El Jemli M., Kamal, R., Bounihi, A., Touati, D., Nejjari, R., El Guessabi, L., Cherrah, Y., Alaoui, K.‘‘Chemical composition and biological properties of Tetraclinis articulata (L.) essential oil and water extract‘‘ Congrès international sur les plantes aromatique et médicinales, 26-28 Novembre 2015, Fes.
- El Jemli M., Kamal, R., Bahadi, H., Touati, D., Nejjari, R., El Guessabi, L., Cherrah, Y., Alaoui, K. ‘‘Chemical composition antioxidant and anti-inflammatory activities of essential oil of Juniperus thurifera (L.)‘‘ Health & Ion Channel Signaling Mecanisms, 25-26, Novembre 2015, Mohammedia.
10
- El Jemli, M., Bounihi, A., Touati, D., Taoufiq, J., Nejjari, R., El Guessabi, L., Cherrah, Y., Alaoui, K. ‘‘Profil phytochimique, activité antioxydante et anti-inflammatoire des huiles essentielles et des extraits aqueux de quatre espèces marocaines de la famille des Cupressaceae‘‘ Best practices in biodiversity conservation and local livelihoods in Morocco, 27-30 May 2015, Imlil.
Communications dans des congrès nationaux
- El Jemli, M., Marmouzi, I., Kharbachn M., El jemli, Y., Sayah, K., Cherrah, Y., Alaoui, K. ‘‘Toxicity, anti-inflammatory effects of J. thuifera, J. phoenicea and J. oxycedrus extracts‘‘ 9èmes Journées Scientifiques du CEDoc-SVS, Faculté de médecine et de pharmacie, 15-20 Avril 2018, Rabat.
- El Jemli, M., Khattabi, N., Lachqer, Kh., Touati, D., El Jemli, Y., Wakrim, E., Marmouzi, I., Cherrah, Y., Alaoui, K. ‗‘Potential use of Juniperus thurifera essential oil against stored-product insects, phytopathogenic fungi and oxidative deterioration in food‘‘ 8èmes Journées Scientifiques du CEDoc-SVS, Faculté de médecine et de pharmacie, 27-31 Mars 2018, Rabat. - El Jemli, M., Khattabi, N., Lachqer, Kh., Doukkali, Z., Bahadi, H., Cherrah, Y., Alaoui, K.‘‘Antifungal and antioxidant activities of essential oil from Moroccan Tetraclinis articulata (L.)‘‘ 7éme journées scientifiques du Cedoc SVS, Faculté de médecine et de pharmacie, 16-19 Mars 2016, Rabat.
- El Jemli, M., Khattabi, N., Touati, D., Taoufiq, J., El Guessabi, L., Cherrah, Y., Alaoui, K. ‘‘Evaluation de l‘activité antioxydante et antifongique des huiles essentielles et des extraits aqueux des quatre Cupressaceae marocaine : Juniperus thurifera, Juniperus oxycedrus, Juniperus phoenicea et Tetraclinis articulata‘‘ 6éme journées scientifiques du Cedoc SVS, Faculté de médecine et de pharmacie, 04-07 Mars 2015, Rabat.
- El Jemli, M., Bahadi, H., Doukkali, Z., Touati, D., Nejjari, R., El Guessabi, L., Cherrah, Y., Alaoui, K. ‘‘Chemical composition antioxidant and anti-inflammatory activities of essential oil of Juniperus oxycedrus (L)‘‘ 3ème Edition de la journée Internationale de Biotechnologie Médicale, Faculté de médecine et de pharmacie, 17-Decembre 2015, Rabat.
11 Prix
1er Prix de la meilleure communication ‗‘9èmes Journées Scientifiques du CEDoc-SVS, Faculté de médecine et de pharmacie, 15-20 Avril 2019, Rabat‘‘.
2ème Prix de la meilleure communication ‗‘ 9èmes Edition du Prix SRPO, 26-27 Octobre 2018, Oujda‘‘.
Prix public du concours « Ma thèse en 180 secondes », Edition 2018.
1er Prix de la meilleure communication ‗‘8èmes Journées Scientifiques du CEDoc-SVS, Faculté de médecine et de pharmacie, 27-31 Mars 2018, Rabat‘‘.
12
RESUME
Contribution à l’étude ethnobotanique, toxicologique, pharmacologique et phytochimique de quatre Cupressacées marocaines : Juniperus thurifera L., Juniperus
oxycedrus L., Juniperus phoenicea L. et Tetraclinis articulata L. El Jemli Meryem
Le présent travail s‘inscrit dans le cadre de la valorisation des extraits aqueux (EA), des huiles essentielles (HE) et des goudrons végétaux (GV) de Juniperus thurifera (JT), J. oxycedrus (JO), J. phoenicea (JP) et Tetraclinis articulata (TA) à travers l‘évaluation de leurs innocuités, la confirmation potentielle de leurs réputations médicinales et l‘identification des composés chimiques susceptibles d‘être responsables de leurs propriétés.
L‘étude de la toxicité aiguë nous a permis de montrer que les GV de JT, JO, JP et TA sont dépourvus de toute toxicité systémique à la dose de 2g/kg par voie cutanée. De même, les EA et les HE sont dénués de tout effet toxique par voie orale à la dose limite (5g/kg). En conséquence, les GV, EA et HE de JT, JO, JP et TA peuvent être considérées comme non toxiques tandis qu‘une étude de toxicité chronique serait à envisager dans le cadre d‘un éventuel développement des extraits.
Les résultats des tests pharmacologiques ont montré que les GV, EA et HE de l‘ensemble des espèces étudiées pressentent une capacité anti-candidose relativement modérée, un effet antioxydant notoire et un pouvoir anti-inflammatoire significatif. Les potentialités thérapeutiques seraient nettement liées à la richesse des différents extraits testés en composés phénoliques et terpéniques révélés par les identifications et dosages phytochimiques réalisés. Sur la base des résultats ainsi obtenus, l‘EA de JT a été retenu pour faire l‘objet d‘un fractionnement bioguidé. La fraction buthanolique, présentant les propriétés antioxydantes et dermo-protectrices les plus importantes, a permis l‘isolement de quatre molécules dont l‘activité cytotoxique a été évaluée sur différentes lignées tumorales et a révélé que la quercetine et le kaempférol sont les composés les plus actifs vis-à-vis de la lignée cellulaire humaine du cancer du sein (MCF7). Les CI50 étant comprisses entre 5.54 et 40.69μg/ml, en
analogie avec celle de l‘Etoposide (10.90μg/ml), ouvrant un champ potentiel anti-tumoral significatif pour l‘EA de JT.
Mots-clés : JT, JO, JP, TA, enquête ethnopharmacologique, toxicité aiguë, screening pharmacologique, criblage phytochimique, fractionnement bioguidé.
13
ABSTRACT
Contribution to the ethnobotanical, toxicological, pharmacological and phytochemical studies of four Moroccan Cupressaceae: Juniperus thurifera L., Juniperus oxycedrus L.,
Juniperus phoenicea L. and Tetraclinis articulata L. El Jemli Meryem
The main objective of the present work is the valorization of aqueous extract (EA), essential oil (HE) and vegetable tar (GV) of Juniperus thurifera (JT), J. oxycedrus (JO), J. phoenicea (JP) and Tetraclinis articulata (TA) by the evaluation of their safety, the confirmation of their potential activities and by the identification of the chemical compounds that could be responsible for their medicinal properties.
The study of the dermal acute toxicity shows that the DL50 (lethal doses of 50% of animals) of
JT, JO, JP, and TA tars are greater than 2g/kg. Also, the oral acute toxicity investigations of aqueous extracts and essential oils of the four studied species show that all plant extracts are non-toxic, since a dose of 5 g/kg did not induce toxic symptoms or deaths. However, chronic toxicity studies should be considered for the evaluation of their chronic uses.
The evaluation of the various activities showed that GV, EA and HE of JT, JO, JP, and TA have an interesting anti-inflammatory activity, high antioxidant properties, and interesting fungistatic effects. The therapeutic effects could be attributed to the richness of plant extracts in phenolic and terpenic compounds identified by the phytochemical analysis.
Thus, based on the obtained results during the pharmacological and phytochemical screening, the EA of JT was selected for a bio guided fractionation.
The buthanolic fraction, representing the most important antioxidant and dermo-protective properties, allowed the isolation of four molecules which were then tested for their cytotoxic activity against different tumor lines. Quercetine and kaempférol are the most active compounds against breast cancer cell line (MCF7) with inhibitory concentrations 50 less than 6µg/ml. These results suggest the potential antitumor properties of JT EA.
Key words: JT, JO, JP, TA, ethnopharmacological investigation, acute toxicity, pharmacological screening, phytochemical screening, bioguided fractionation.
14
صخلم
ةصاخلا ةيئايمكلا و ةيئاوذلا صئاصخلا و ةيمسلا ، ةيذيلقتلا ةيبطلا تلاامعتسلاا ةسارد يف ةمهاسم
لا نم فانصأ ةعبرأب
ةيمتنملا تاتابن
ةلئاعل
Cupressaceae
:
Juniperus thurifera
و
ميرم يلمجلاJuniperus oxycedrus
و
Juniperus phoenicea
و
Tetraclinis articulata
ذُح سس لاا ِزْ دبحبا ًٍٍزحسبطا ًف تحٔشط ( تٍئبًنا ثبصهخخسًنا EA ( تٍسبسلأا ثٌٕزنأ ، ) HE ٔ ، ) ًحببُنا ٌاشطمنا (GV) خخسًنا ٍي تصه (JP) J. phoenicea, (JO) J. oxycedrus, (JT) Juniperus thurifera ٔ Tetraclinis (TA) articulata ،ىْسشض ىٍٍمح للاخ ٍي تٍبطنا ىٓحبياذخخسإ ٍي ذكأخنأ ٌأ مًخحٌ ًخنا تٍئبًٍٍكنا ثببكشًنا ذٌذححٔ ىٓصإخ ٍع تنٔؤسي ٌٕكح . أ سبٓظئب ةدبحنا تًٍسنا تساسد بُن جحًس ٌ GV صهخخسًنا ٍي JT ٔ JO ٔ JP ٔ TA ًنبخ ، تعشضب تًٍس يأ ٍي 2 ىص ٌئف ، مزًنببٔ .ذهضنا كٌشط ٍع ىضك / EA ٔ HE تعشضب ىفنا كٌشط ٍع وبس شٍرأح يأ ٍي ٕهخح 5 ،ًنبخنببٔ .ىضك / ىص سببخعا ٍكًٌ GV ٔ EA ٔ HE ٍي تصهخخسًنا JT ٔ JO ٔ JP ٔ TA ًسنا تساسد ًغبٌُ بًٍُب تيبس شٍغ ًف تُيزًنا تٍ .ثبصهخخسًهن مًخحي سٕطح قبٍس ٌأ تٍئأذنا ثاسببخخلاا شئبخَ ثشٓظأ ٍي مك GV ٔ EA ٔ HE تصهخخسًنا ٍي JT ٔ JO ٔ JP ٔ TA تنذخعي ةسذل بٓن ذض بًٍبسَ ا ثبٌشطفن تٍصلاعنا ثبَبكيلإا ظبحشح .ثبببٓخنلان ةدبضي ةشٍبك ةٕلٔ ظٕحهي ةذسكلأن دبضي شٍرأحٔ ، ىُغب فهخخي نا بْسببخخا ىح ًخنا ثبصهخخسً ب ثببكشً لٍُٕفٍنٕبنا بُٓع جفشك ًخنا ٍٍبشٍخنأ دبحبلأا تٍئبًٍٍكنا جٌشصأ ًخنا . ا سبسأ ىهع بٍٓهع لٕصحنا ىح ًخنا شئبخُن سبٍخخا ىح ، EA صهخخسًنا ٍي JT عٕضخهن خسا مصا ٍي ّصٕي لزعن خ ساش تٍصٕنٍٕبنا ّصئبصخ ٍع تنٔؤسًنا تٍئبًٍٍكنا ثببكشًنا . بل لزع ىنإ لَٕبحٕبنا صهخخسًن ّصًٕنا ًئبًٍٍكٕخٍفنا ذحبنا د تٍَبطشسنا بٌلاخهن بٓخحفبكي تٍَبكيا تساسد كنر ذعب جًح ،ثبئٌزص تعبسا ٌا بٍٓهع مصحًنا شئبخُنا جٍُب ذل ٔ quercetine ٔ kaempférol بطبشَ شخكلاا بًْ ذض يذزنا ٌبطشس بٌلاخ . (MCF7) ظٍهسح ىنإ كنازك تساسذنا جحًس ىهع ءٕضنا ثبصهخخسي صئبصخ EA ةسبضنا ثبًٌزَلاا ضعب ٍي ذهضنا تٌبًح صئبصخ ىنإ تفبضلإبب ةذسكلأن ةدبضًنا . حاتفملا تاملكلا JT : ، JO ، JP ، TA ، جحبنا نا ًَاذًٍ ، ًئبًٍٍكنا صحفنا ، ًئأذنا صحفنا ، ةدبحنا تًٍسنا ، ذحبنا ّصًٕنا ًئبًٍٍكٕخٍفنا .15
SOMMAIRE
REMERCIEMENTS ... 3
FICHE PRESENTATIVE DE LA THESE ... 7
PRINCIPALES PUBLICATIONS ET COMMUNICATIONS EN RAPPORT AVEC LE SUJET ... 8
RESUME ... 12
ABSTRACT ... 13
LISTE DES ABREVIATIONS ... 19
LISTE DES TABLEAUX ... 20
LISTE DES FIGURES ... 21
INTRODUCTION GENERALE ... 23
PREMIERE PARTIE ... 27
Sélection et récolte du matériel végétal ... 27
Chapitre 1(I) : Sélection du matériel végétal ... 28
1 Généralités sur les critères de sélection du matériel végétal ... 28
1.1 Endémisme ... 28
1.2 Ethnopharmacologie ... 28
1.3 Aspects chimiotaxonomiques ... 29
1.4 Travaux scientifiques antérieurs ... 29
2 Présentation des plantes étudiées... 30
2.1 Familles des Cupressaceae ... 30
2.2 Juniperus thurifera ... 33
2.2.1 Description botanique ... 33
2.2.2 Répartition géographique ... 34
2.2.3 Utilisation en médecine traditionnelle ... 34
2.2.4 Investigations scientifiques antérieurs ... 35
2.3 Juniperus phoenicea ... 36
2.3.1 Description botanique ... 36
2.3.2 Répartition géographique ... 37
2.3.3 Utilisation en médecine traditionnelle ... 38
2.3.4 Investigations scientifiques antérieurs ... 39
2.4 Juniperus oxycedrus ... 41
2.4.1 Description botanique ... 41
2.4.2 Répartition géographique ... 42
2.4.3 Utilisation en médecine traditionnelle ... 42
2.4.4 Investigations scientifiques antérieurs ... 45
2.5 Tetraclinis articulata ... 46
2.5.1 Description botanique ... 46
2.5.2 Répartition géographique ... 47
2.5.3 Utilisation en médecine traditionnelle ... 48
2.5.4 Investigations scientifiques antérieures ... 49
Chapitre 2(I): Récolte du matériel végétal ... 53
1 Introduction ... 53
2 Matériel et méthodes ... 53
2.1 Récolte du matériel végétal ... 53
2.2 Identification ... 54
2.3 Séchage ... 55
16
3.1 Identification ... 55
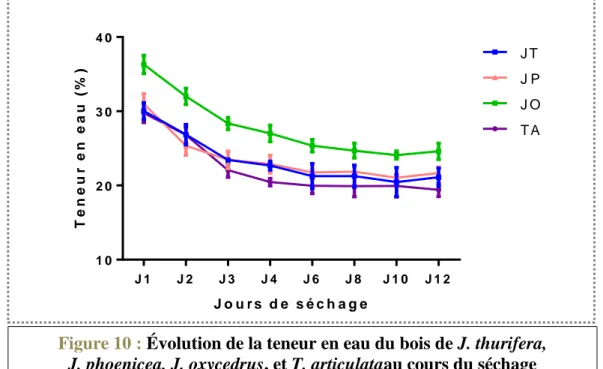
3.2 Etude de la cinétique de séchage ... 55
4 Conclusion ... 58
DEUXIEME PARTIE ... 59
Valorisation des données de la pharmacopée traditionnelle ... 59
Chapitre 1(II) : Enquête ethnopharmacologique des plantes sélectionnées ... 60
1 Introduction ... 60
2 Matériel et méthodes ... 60
2.1 Zone d'étude ... 60
2.2 Enquête ethnopharmacologique ... 61
2.3 Analyse des données ... 62
2.3.1 Valeur d‘usage (VU) ... 63
2.3.2 Fréquence de citation (FC) ... 63
2.3.3 Fréquence relative de citation (FRC) ... 63
3 Résultats et discussion ... 63
3.1 Données sociodémographiques ... 63
3.2 Répartition selon la connaissance ... 65
3.3 Répartition selon la valeur d‘usage ... 66
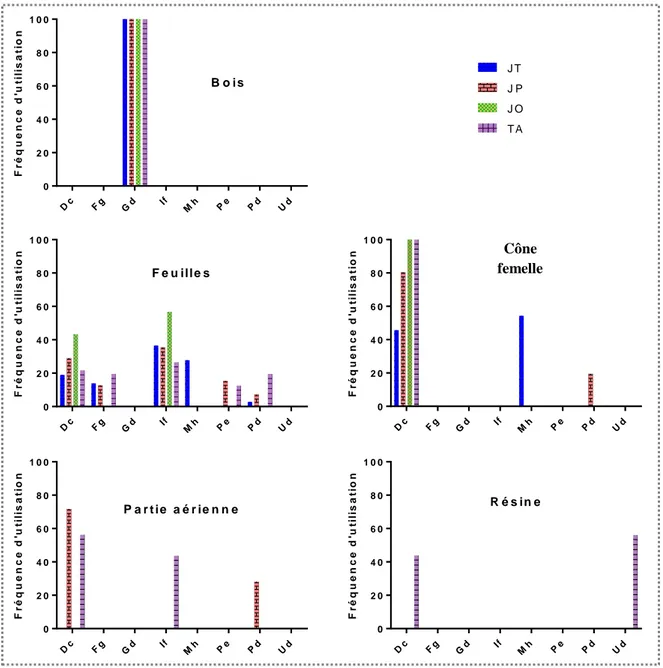
3.4 Parties de plantes utilisées comme agents thérapeutiques ... 66
3.5 Mode de préparation ... 69
3.6 Mode d'administration ... 73
3.7 Répartition selon les maladies traitées ... 75
4 Conclusion ... 77
Chapitre 2(II) : Critères de sélection et préparation des extraits ... 78
1 Introduction ... 78
2 Matériel et méthodes ... 79
2.1 Préparation des goudrons ... 79
2.2 Préparation des huiles essentielles ... 80
2.3 Extrait aqueux ... 81
3 Résultats et discussion ... 81
3.1 Caractérisations organoleptiques des extraits obtenus ... 81
3.2 Rendements en extraits ... 83
4 Conclusion ... 84
Chapitre 3(II) : Étude de la toxicité aiguë des extraits deJ. thurifera, J. phoenicea, J. oxycedrus et T. articulata ... 85
1 Introduction ... 85
2 Matériel et méthodes ... 86
2.1 Animaux ... 86
2.2 Toxicité aiguë orale des huiles essentielles et des extraits aqueux ... 86
2.3 Toxicité cutanée aiguë des goudrons ... 87
3 Résultats et discussion ... 89
3.1 Toxicité aiguë orale des extraits aqueux et des huiles essentielles ... 89
3.2 Toxicité aiguë cutanée des goudrons ... 93
4 Conclusion ... 98
Chapitre 4(II) : Etude de l’activité anticandidosique des extraits de J. thurifera, J. phoenicea, J. oxycedrus et T. articulata ... 99
1 Introduction ... 99
2 Matériel et méthodes ... 100
2.1 Diffusion en milieu solide ... 100
2.2 Dilution en milieu liquide ... 102
3 Résultats et discussion ... 104
17
Chapitre 5(II) : Etude de l’activité anti-inflammatoire des extraits de J. thurifera,
J. phoenicea, J. oxycedrus et T. articulata ... 111
1 Introduction ... 111
2 Matériel et méthodes ... 111
2.1 Effet anti-inflammatoire in vitro : Activité anti-élastase... 111
2.2 Effet anti-inflammatoire in vivo : Induction de l‘œdème chez le rat par la carragéenine ... 112
3 Resultats et discussion ... 113
3.1 Activité anti-élastase ... 113
3.2 Test de la carragéenine ... 114
4 Conclusion ... 119
Chapitre 6(II) : Etude de l’activité antioxydante des extraits de J. thurifera, J. phoenicea, J. oxycedrus et T. articulata ... 120
1 Introduction ... 120
2 Matériel et méthodes ... 120
2.1 DPPH ... 120
2.2 ABTS ... 121
2.3 Pouvoir réducteur du Fer, FRAP ... 121
3 Résultats et discussion ... 122
4 Conclusion ... 125
Chapitre 7(II) : Composition chimique des extraits de J. thurifera, J. phoenicea, J. oxycedrus et T. articulata ... 126
1 Introduction ... 126
2 Matériel et Méthodes ... 126
2.1 Criblage phytochimique ... 126
2.1.1 Recherche des anthocyanes ... 126
2.1.2 Recherche des saponines ... 126
2.1.3 Recherche des flavonoïdes ... 126
2.1.4 Recherche des tanins ... 127
2.1.5 Recherche des alcaloïdes ... 127
2.1.6 Recherche des terpènes ... 127
2.2 Dosage spectroscopique des composées phénoliques ... 127
2.2.1 Dosage des polyphénols totaux ... 127
2.2.2 Dosage des flavonoïdes ... 127
2.2.3 Dosage des tanins condensés ... 128
2.3 Analyses chromatographiques couplées à la spectrométrie de masse ... 128
2.3.1 Chromatographie liquide à haute performance couplée à une spectrométrie de masse (CLHP/SM) ... 128
2.3.2 Chromatographie en phase gazeuse couplée à la spectrométrie de masse (CPG/SM) ... 129
3 Résultats et Discussion ... 129
3.1 Criblage phytochimique ... 129
3.2 Dosage spectroscopique des composées phénoliques ... 131
3.3 Identification et quantification par chromatographie liquide à haute performance couplée à spectroscopie de masse (CLHP/SM) ... 133
3.4 Chromatographie en phase gazeuse couplée à la spectrométrie de masse (CPG/SM) ... 137
4 Conclusion ... 140
TROISIEME PARTIE ... 141
Fractionnement bioguidé de l’extrait aqueux de J. thurifera ... 141
1 Introduction ... 142
18
2.1 Fractionnement liquide-liquide ... 142
2.1.1 Préparation des fractions ... 142
2.1.2 Tests biologiques in vitro ... 143
2.1.3 Analyse phytochimique ... 144
2.2 Fractionnement par colonne de l‘extrait butanolique de J. thurifera ... 144
2.2.1 Préparation des sous-fractions ... 144
2.2.2 Identification des composés 1, 2, 3 et 4 ... 144
2.2.3 Tests biologiques in vitro des composés 1, 2, 3 et 4 ... 145
2.2.3.1 Evaluation de l‘activité antiradicalaire ... 145
2.2.3.2 Evaluation de l‘activité anticancéreuse ... 145
3 Résultats et discussion ... 146
3.1 Fractionnement liquide-liquide de l‘extrait aqueux de J. thurifera... 146
3.1.1 Rendement des fractions ... 146
3.1.2 Tests biologiques in vitro ... 146
3.1.2.1 Activité antioxydante ... 146 3.1.2.2 Activité dermo-protectrice ... 147 3.1.2.2.1 Effet anti-élastase ... 147 3.1.2.2.2 Effet anti-tyrosinase ... 148 3.1.3 Analyses phytochimiques ... 149 3.1.3.1 Criblage phytochimique ... 149
3.1.3.2 Dosages des composées phénoliques ... 149
3.2 Fractionnement par colonne de l‘extrait butanolique de J. thurifera ... 151
3.2.1 Caractérisation des composés isolés ... 151
3.2.2 Evaluation de l‘activité antioxydante des composés isolés ... 152
3.2.3 Evaluation de l‘activité anticancéreuse ... 153
4 Conclusion ... 154
CONCLUSION GENERALE ET PERSPECTIVES ... 155
REFERENCES BIBLIOGRAPHIQUES ... 159
19
LISTE DES ABREVIATIONS
ABTS : 2,2'-azino-bis 3-éthylbenz-thiazoline-6-sulfoniqueAUG (%) : Pourcentage d‘augmentation du volume de la patte BHA : Butylhydroxyanisol
BHT : Butylhydroxytoluène
CI50 : Concentration inhibitrice de 50 %
CLHP : Chromatographie liquide haute performance CMF : Concentrations minimale fongicide
CMI : Concentration minimale inhibitrice COX-1 : Cyclooxygénase-1
CPG : Chromatographe en phase gazeuse
DL50 : Dose létale de 50 % des animaux d‘expérience
DME : Dose maximale sans effet toxique DMSO-d6 : Diméthysulfoxyde hexadeutéré DO : Densité optique DPPH : 1,1-diphenyl-2-picrylhydrazyle EA : Extrait aqueux FA : Fraction aqueuse FB : Fraction butanolique FC : Fréquence de citation FD : Fraction dichlorométhane FE : Fraction acétate d‘éthyle FH : Fraction hexan ique FM : Fraction méthanolique
FMPR : Faculté de Médecine et de Pharmacie de Rabat FMPM : Faculté de Médecine et de Pharmacie de Marrakech FRAP : Ferric Reducing Antioxydant Power
FRC : Fréquence relative de citation
FSSM : Faculté des Sciences Semlalia, Marrakech GV : Goudron végétal
HaCaT : Kératinocytes humaines non tumorigènes HE : Huile essentielle
Huh 7 : Lignée cellulairede carcinome hépatocellulaire INH(%) : Pourcentage d‘inhibition de l‘œdème JO : Juniperus oxycedrus
JP : Juniperus phoenicea JT : Juniperus thurifera LPS : Lipopolysaccharides VU : Valeur d'usage
MCF7 : Lignée cellulaire du cancer du sein MeOH : Méthanol
NO : Oxyde nitrique
NRU : Neutralreduptake test
OCDE : Organisation de coopération et de développement économiques RMN : Spectrométrie de résonance magnétique nucléaire
SM: Spectromètrie de masse TA : Tetraclinis articulata 12-LOX : 12-lipoxygénase
20
LISTE DES TABLEAUX
Tableau 1 : Position systématique des Cupressaceae ... 31
Tableau 2 : Principales utilisations médicinales de J. thurifera ... 35
Tableau 3 : Principales activités biologiques de J. thurifera ... 36
Tableau 4 : Principales utilisations médicinales de J. phoenicea ... 39
Tableau 5 : Principales activités biologiques de J. phoenicea ... 40
Tableau 6 : Principales utilisations médicinales de J. oxycedrus ... 43
Tableau 7 : Principales activités biologiques de J. oxycedrus ... 45
Tableau 8 : Principales utilisations médicinales de T. articulata ... 48
Tableau 9 : Principales activités biologiques de T. articulata ... 51
Tableau 10: Coordonnées géographiques des site de collecte des espèces étudiées ... 54
Tableau 11 : Spécimens déposés dans l‘herbier de l‘institut scientifique ... 55
Tableau 12 : Données démographiques des informateurs ... 64
Tableau 13 : « Indications » de J. thurifera, J. phoenicea, J. oxycedrus et T. articulata en médecine traditionnelle marocaine ... 71
Tableau 14 : Propriétés organoleptiques des extraits aqueux, des huiles essentielles et des goudrons de J. thurifera, J. phoenicea, J. oxycedrus et T. articulata ... 82
Tableau 15 : Signes de toxicité aiguë (%) observés chez la souris (n=3), les 4 premières heures qui suivent l‘administration orale des (EA) et des (HE) de J. thurifera, J. oxycedrus, J. phoenicea et T. articulata ... 89
Tableau 16 : Concentration minimale inhibitrice (CMI) et fongicide (CMF) des extraits de J. thurifera, J. phoenicea, J. oxycedrus et T. articulata ... 106
Tableau 17: Pourcentage d'inhibition de l'inflammation des extraits de J. thurifera (JT), J. phoenicea (JP), J. oxycedrus (JO) et T. articulata (TA) ... 117
Tableau 18 : CI50 (μg/ml) des extraits aqueux (EA), des huiles essentielles (HE) et des goudrons (GV) de J. thurifera, J. phoenicea, J. oxycedrus et T. articulata et des antioxydants synthétiques utilisés ... 122
Tableau 19: Résultats du screening phytochimique ... 130
Tableau 20 : Teneur en flavonoïdes et en acides phénoliques des extraits aqueux de ... JT, JP, JO et TA (mg/kg) ... 134
Tableau 21 : Composés majoritaires des huiles essentielles de J. thurifera, J. phoenicea, J. oxycedrus et T. articulata (%) ... 138
Tableau 22 : Rendement des différentes fractions préparées (%) ... 146
Tableau 23: CI50 (μg/ml) des fractions de J. thurifera ... 147
Tableau 24: Résultats du screening phytochimique ... 149
Tableau 25: Caractéristiques phytochimiques des composés isolés ... 151
Tableau 26 : Activité antiradicalaire des composés isolés à partir de J. thurifera ... 152
21
LISTE DES FIGURES
Figure 1 : Arbre phylogénétique décrivant la relation entre les Cupressaceae et les 6 autres
familles de conifères ... 30
Figure 2 : Classification sub-familiale de la famille des Cupressaceae ... 31
Figure 3 : Phylogénie de la sous-famille des Cupressoideae ... 32
Figure 4 : Juniperus thurifera: Arbre ; Feuilles ; Cônes mâles et Cônes femelles ... 33
Figure 5 : Juniperus phoenicea: Arbre ; Feuilles ; Cônes mâles et Cônes femelles ... 15
Figure 6 : Juniperus oxycedrus : Arbre ; Feuilles ; Cônes mâles et Cônes femelles ... 20
Figure 7 : Tetraclinis articulata: Arbre ; Feuilles ; Cônes mâles et Cônes femelles ... 47
Figure 8 : Site de collecte des espèces étudiées ... 53
Figure 9 : Évolution de la teneur en eau des feuilles de J. thurifera, J. phoenicea, J. oxycedrus, et T. articulata au cours du séchage ... 57
Figure 10 : Évolution de la teneur en eau du bois de J. thurifera, J. phoenicea, J. oxycedrus, et T. articulataau cours du séchage ... 58
Figure 11: Préfectures de réalisation des investigations ethnopharmacologiques ... 61
Figure 12 : Fiche enquête ethnobotanique des intervenants ... 62
Figure 13 : Répartition des enquêtés selon la connaissance de J. thurifera (JT), J. phoenicea (JP), J. oxycedrus (JO) et T. articulata (TA)... 65
Figure 14 : Valeurs d'usage de J. thurifera (JT), J. phoenicea (JP), J. oxycedrus (JO) et T. articulata (TA) en médecine traditionnelle marocaine ... 66
Figure 15 : Fréquence d‘utilisation de chaque partie pour chacune des espèces : J. thurifera (JT), J. phoenicea (JP), J. oxycedrus (JO) et T. articulata (TA) ... 67
Figure 16 : Valeurs d'usage des parties utilisées comme agents « thérapeutiques »... 67
Figure 17 : Mode de préparation pour chaque partie de J. thurifera, J. phoenicea, J. oxycedrus et T. articulata ... 70
Figure 18 : Mode de préparation pour chacune des parties des 4 plantes J. thurifera, J. phoenicea, J. oxycedrus et T. articulata ... 74
Figure 19 : Répartition des différentes utilisations thérapeutiques de J. thurifera, J. phoenicea, J. oxycedrus et T. articulata ... 76
Figure 20 : Procédé d‘extraction du goudron ... 80
Figure 21 : Procédé d‘extraction des huiles essentielles ... 80
Figure 22 : Procédé d‘obtention des extraits aqueux ... 81
Figure 23 : Rendements en extraits aqueux (EA), en huiles essentielles (HE) et en goudron végétal (GV) de J. thurifera, J. phoenicea, J. oxycedrus et T. articulata ... 83
Figure 24 : Protocole expérimental de l‘évaluation de la toxicitécutanée aiguë des goudrons ... 88
Figure 25 : Evolution du poids corporel moyen des souris traitées oralement par l‘extrait aqueux (EA) de JT, JP, JO et TA ... 91
Figure 26 : Evolution du poids corporel moyen des souris traitées oralement par l‘huile essentielle (HE) de JT, JP, JO et TA ... 92
22
Figure 27: Comparaison de la zone traitée entre les rats males (n=3) du groupe témoin négatif (T(-)) et les rats males traité par le goudron de JT, JP, JO et TA ... 94
Figure 28: Comparaison de la zone traitée entre les rats femelles (n=3) du groupe témoin négatif (T(-)) et les rats femelles traité par le goudron de JT, JP, JO et TA ... 95
Figure 29 : Evolution du poids corporel moyen des rats traitées par l‘application cutanée des goudrons (GV) de JT, JP, JO et TA ... 96 Figure 7 : Schématisation des Principe d‘évaluation d‘activité antifongique des huiles par la méthode diffusion en milieu solide ... 100 Figure 30 : Protocole expérimental de l‘évaluation de l‘effet anti-candidosique en milieu solide ... 101 Figure 31 : Protocole expérimental de l‘évaluation de l‘effet anti-candidosique en milieu liquide ... 103 Figure 32 : Diamètres des zones d‘inhibition de C. albicanset C. krusei après 48 h
d'incubation. ... 104 Figure 33 : Variation des diamètres des zones d'inhibition des extraits testés en milieu solide vis-à-vis de C. albicans et C. krusei ... 105 Figure 34 : Nombre de Candida après 48h d‘incubation en utilisant la cellule de Malassez. ... 107 Figure 35 : Variation des taux d‘inhibition des extraits testés en milieu liquidevis-à-vis de C. albicans et C. krusei ... 108 Figure 36 : CI50 (μg/mL) des extraits aqueux (EA), des huiles essentielles (HE) et des
goudrons (GV) de TA, JT, JP et JO et de la quercetine vis à vis de l‘élastase ... 114 Figure 37 : Evolution de l‘inflammation (œdème plantaire) en fonction du temps chez les différents groupes de rats traités respectivement par les GV de (JT, JP, JO et TA) ... 115 Figure 38 : Evolution de l‘inflammation (œdème plantaire) en fonction du temps chez les différents groupes de rats traités respectivement par les EA de (JT, JP, JO et TA) ... 115 Figure 39: Evolution de l‘inflammation (œdème plantaire) en fonction du temps chez les différents groupes de rats traités respectivement par les HE de (JT, JP, JO et TA) ... 116 Figure 40 : Teneurs en composés phénoliques des extraits aqueux et des goudrons de JT, JP, JO et TA ... 131 Figure 41 : Teneurs en flavonoides des AE et des GV de JT, JP, JO et TA ... 132 Figure 42 : Teneurs en tanins des extraits aqueux et des goudrons de JT, JP, JO et TA ... 132 Figure 43 : Profil chromatographique des extraits aqueux de JT, JP, JO et TA ... 135 Figure 44 : Profil chromatographique des huiles esssentielles de JT, JP, JO et TA ... 138 Figure 45 : Extraction et fractionnement de l‘extrait aqueux des feuilles de J. thurifera ... 143 Figure 46 : CI50 (μg/mL) des fractions de J. thurifera et de la quercetine ...
vis à vis de l‘élastase ... 147 Figure 47 : CI50 (μg/mL) des fractions de J. thurifera et de la quercetine vis à vis de la
tyrosinase ... 148 Figure 48 : Teneurs en composés phénoliques des fractions de J. thurifera ... 150 Figure 49 : Teneurs en flavonoïdes des fractions de J. thurifera ... 150 Figure 50 : Teneurs en tanins des fractions de J. thurifera ... 150
Introduction générale
24
Les plantes médicinales ont toujours eu une place importante dans l'arsenal thérapeutique de l'humanité et sont depuis toujours une source essentielle de médicaments. Aujourd‘hui encore une majorité de la population mondiale, plus particulièrement dans les pays en voie de développement, a recours à la médecine traditionnelle en se référant uniquement aux drogues végétales pour leurs soins de base.
De l‘Aspirine©
au Taxol©, l‘industrie pharmaceutique moderne s‘appuie encore largement sur la diversité des principes actifs végétaux pour trouver de nouvelles molécules aux propriétés pharmaceutiques inédites. Le monde végétal dont l‘investigation phytochimique et pharmacologique est loin d‘être achevée, est un véritable réservoir de principes actifs, de structures chimiques aussi différentes que complexes, qui viendront sans aucun doute élargir l‘arsenal thérapeutique de l‘humanité.
Par sa position géographique particulière et ses conditions climatiques favorables, le Maroc dispose d‘une grande diversité floristique à laquelle s‘ajoute une tradition séculaire d‘utilisation traditionnelle des plantes médicinales. Par ailleurs, si la flore marocaine est en grande partie connue d‘un point de vue botanique, il existe peu de données pharmacologiques et phytochimiques s‘y rapportant. L‘intérêt médicinal de cette biodiversité non encore étudiée constitue un enjeu scientifique et industriel très important et la contribution à sa valorisation revêt un intérêt particulier.
Les Cupressacées sont parmi les principaux arbustes du cortège floristique des forêts du Haut Atlas Marocain, qui rendent d‘inestimables services aux populations autochtones, surtout dans les situations d‘urgence et pour de nombreuses affections chroniques (Bellakhdar, 2006). Ces plantes possèdent des vertus thérapeutiques démontrées par l‘expérience et qui méritent d‘être validées scientifiquement afin de confirmer leurs indications dans la médecine traditionnelle et d‘isoler les principes actifs susceptibles d‘être responsable de leurs propriétés thérapeutiques. De plus, il est impératif de vérifier leur innocuité par des tests de toxicité in vivo.
Conscient de ce fait, l‘Equipe de Recherche de Toxicité et Pharmacodynamie des Plantes Aromatiques et Médicinales ERTP.PAM relevant du Laboratoire de Pharmacologie et de Toxicologie de la Faculté de médecine et de Pharmacie de Rabat poursuit, depuis quelques années, un vaste programme de recherche ayant pour objet la valorisation des plantes
Introduction générale
25
Sayah et al., 2017). La valorisation de ces ressources naturelles peut se faire notamment par la vérification de leurs toxicités (Alnamer et al., 2011; Bouidida et al., 2004; Zaoui et al., 2002), la validation de leur effet thérapeutique (El Cadi et al., 2012; Khabbal et al., 2006; Nguemfo et al., 2009) et/ou l‘identification des substances susceptibles d‘être responsable de leurs propriétés médicinales (Marmouzi et al., 2017).
Ainsi, l‘objectif de cette étude est la valorisation de quatre espèces marocaines de la famille des Cupressacées : Juniperus thurifera, Juniperus oxycedrus, Juniperus phoenicea et Tetraclinis articulata, par la réalisation de tests toxicologiques et pharmacologiques, ainsi que des analyses phytochimiques permettant l‘identification et le dosage des composés chimiques susceptibles d‘être responsable des propriétés thérapeutiques de chaque extrait. Ces espèces ont été sélectionnées en fonction, d‘une part, de leur caractère endémique et/ou de leur vulnérabilité, et d‘autre part, de leurs métabolites secondaires attendus en raison de considérations chimiotaxonomiques. En effet, ces espèces appartiennent à la famille des Cupressacées connue pour sa richesse en terpènes et en polyphénols essentiellement en lignanes et flavonoïdes (Abul’saeva & Pashinina, 1981; Iida et al., 2007; Nakanishi et al.,
2002). Ces composés sont doués de propriétés pharmacologiques diverses : anti-inflammatoire, antioxydante, cytotoxique, antifongique et antibactérienne (Cai et al.,
2004; Schinella et al., 2002).
Ce travail est divisé en trois parties :
Nous proposons dans une première partie, une synthèse bibliographique pour situer le contexte du travail. Cette section décrit les différents critères, de l‘utilisation en médecine traditionnelle au criblage biologique et/ou phytochimique, qui ont conduit et orienté la sélection des espèces végétales à étudier. L‘état des connaissances bibliographiques, botaniques, ethnopharmacologiques et phytochimiques sur les quatre plantes sélectionnées sera également présenté ;
La deuxième section est consacrée à la valorisation des données de la pharmacopée traditionnelle. Dans une première partie (Chapitre 1(II)), nous proposons une enquête
ethnopharmacologique, afin d‘inventorier les principales utilisations de J. thurifera, J. oxycedrus, J. phoenicea et T. articulata dans la médecine traditionnelle marocaine. Les
résultats de cette enquête serviront de base pour justifier le choix des méthodes d‘extractions (Chapitre 2(II)) tests toxicologiques (Chapitre 3(II)) et pharmacologiques (Chapitre 4(II)-6(II))
Introduction générale
26
que nous utiliserons pour confirmer ou d‘infirmer les données de la pharmacopée traditionnelle recensées. Le dernier chapitre de cette partie relate les résultats des tests phytochimiques utilisés pour identifier les composés majoritaires et secondaires susceptibles d‘être responsables des propriétés thérapeutiques de chacune des espèces étudiées.
La dernière partie du travail sera consacrée aux résultats de l‘étude phytochimique bioguidée des feuilles de J. thurifera et nous détaillerons les étapes de fractionnement, de purification et d‘identification des composés isolés. Une présentation des résultats biologiques obtenus in vitro y sera également détaillée.
Nous terminerons par une conclusion générale et les perspectives issues de ce travail de recherche.
PREMIERE PARTIE
PARTIE I
28
Chapitre 1
(I): Sélection du matériel végétal
1 Généralités sur les critères de sélection du matériel végétalLe choix du matériel végétal constitue une étape cruciale pour le chercheur. Ainsi, le succès du travail entrepris dépend en grande partie du soin avec lequel le choix des plantes à étudier est effectué. Dans cette optique, un certain nombre de critères ont été pris en compte pour sélectionner les espèces qui ont fait l‘objet de cette étude. Toutefois, quel que soit le critère choisi pour sélectionner les espèces potentiellement actives, il est impératif de protéger et de conserver notre patrimoine végétal qui peut toujours offrir un nouvel espoir pour la découverte de nouvelles substances médicinales.
1.1 Endémisme
L‘emplacement géographique privilégié du Maroc, au carrefour entre l‘Afrique et l‘Europe et entre la Méditerranée et l‘Océan Atlantique, lui confère une gamme remarquable de bioclimats très variés allant de l‘humide et du subhumide au saharien. Cette diversité géographique et climatique a façonné une mosaïque de végétation, riche et diversifiée, avec plus de 7 000 espèces végétales dont 4500 espèces de plantes vasculaires réparties en 920 genres et 130 familles (Fennane, 2004). Neuf cent cinquante et une espèces sont endémiques, 463 rares, 1284 très rares et 36 vulnérables (Benabid, 2000). L‘endémisme, la rareté et ou la vulnérabilité des espèces végétales peuvent constituer les principaux critères de sélection, la distribution géographique restreinte d‘une espèce augmentant la probabilité d‘obtenir de nouvelles substances.
1.2 Ethnopharmacologie
Il s‘agit d‘une démarche interdisciplinaire qui s‘intéresse aux savoirs des populations concernant la préparation et l‘utilisation de remèdes traditionnels. Elle profite de plusieurs siècles d‘observations et la transmission des savoirs empiriques accumulés est essentiellement basée sur la tradition orale d‘une génération à l‘autre. L‘ethnopharmacologie peut ainsi permettre la découverte de nouvelles molécules actives pour l‘industrie pharmaceutique. De nombreux principes actifs employés à l‘heure actuelle dans notre médecine moderne sont issus des connaissances thérapeutiques traditionnelles, soit des antalgiques (morphine, aspirine), des anticancéreux (vincristine, vinblastine, taxol), des psychotropes (réserpine,
PARTIE I Chapitre 1(I) : Sélection du matériel végétal
29
mescaline), des antipaludéens (quinine, artémisinine) ou encore des toniques et des stimulants cardiaques (digitaline, quinidine) (Farnsworth et al., 1985).
La découverte de ces principes actifs repose sur la constatation de l‘efficacité de certaines espèces végétales dans les différentes pharmacopées traditionnelles (arabo-musulmanes, chinoises, européennes ou indiennes), mais aussi et surtout à partir des observations réalisées sur l‘utilisation traditionnelles des plantes médicinales (Gurib-Fakim, 2006).
1.3 Aspects chimiotaxonomiques
Les espèces végétales de la même famille ou appartenant à des familles voisines sont susceptibles de synthétiser les mêmes substances chimiques. La chimiotaxonomie, ou la classification des plantes en fonction de leurs métabolites secondaires complète ainsi la classification botanique basée sur des critères morphologiques et moléculaires (Grayer et al., 1999). Si des substances à grand potentiel thérapeutique sont produites par une espèce, il y aura de fortes chances que les mêmes substances chimiques soient synthétisées par des espèces appartenant au même genre ou à la même famille. C‘est le cas du paclitaxel (Taxol®), anti-tumoral initialement extrait de l‘écorce de l'if du Pacifique (Taxus brevifolia) mais avec des rendements très faible et une structure chimique trop complexe pour permettre sa synthèse (Wani et al., 1971).L‘investigation phytochimique des aiguilles de Taxus baccata a conduit à l‘extraction de la 10-désacéthylbaccatine III, avec un rendement plus important et qui, par hémi-synthèse, peut servir à l‘obtention du taxol ainsi que d‘autres substances telles que le taxotère qui s‘est révélé deux fois plus actif que le taxol (Bissery et al., 1991).
1.4 Travaux scientifiques antérieurs
Dans l‘optique de découvrir de nouvelles substances et/ou de nouvelles voies d‘application thérapeutiques ou cosmétiques, le chercheur devra toujours, avant d‘entreprendre son travail sur une espèce végétale, établir un état des lieux sur les travaux scientifiques antérieurs (études ethnobotaniques, ethnopharmacologiques, pharmacologiques, phytochimiques ...). Le scientifique pourra également investir une espèce déjà étudiée en suivant de nouvelles pistes (organes, méthodes d‘extraction, cible biologique différente ...).
PARTIE I Chapitre 1(I) : Sélection du matériel végétal
30
2 Présentation des plantes étudiées
Sur la base des critères de sélection cités ci-dessus, notre choix s‘est porté sur quatre espèces marocaines soit Juniperus thurifera, J. phoenicea, J. oxycedrus et Tetraclinis articulata. Les quatre plantes appartiennent à la famille des Cupressacées connue par ses essences méditerranéennes et caractérisées par de multiples utilisations en médecine traditionnelle.
2.1 Familles des Cupressaceae
La famille des Cupressaceae est une vaste et importante famille du monde végétal, classée dans le sous embranchement des Gymnospermes, ordre des Coniférales (Adams, 2000; 2011)
(Tableau 1). C‘est la plus grande famille des conifères en termes degenres, et la troisième en terme d'espèces (Earle, 2015; Farjon, 2010), (Figure 1). Elle regroupe vingt-neuf genres et plus de 130 espèces (Adams et al., 2009; Christenhusz et al., 2011; Farjon, 2005; Gadek et al., 2000; Little et al., 2004).
Pinaceae Podocarpaceae Sciadopityaceae Taxaceae Cephalotaxaceae Cupressaceae Araucariaceae 11 19 1 3 3 29 3 250 156 1 12 20 130 41
Nombre de genres Nombre d’espèces
Figure 1 : Arbre phylogénétique décrivant la relation entre les Cupressaceae et les 6 autres familles de conifères (Adams et al., 2009; Farjon 2005; Gadek et al. 2000; Little et al. 2004)
PARTIE I Chapitre 1(I) : Sélection du matériel végétal
31
Tableau 1 : Position systématique des Cupressaceae
Embranchement Spermaphytes
Sous Embranchement Gymnospermes
Classe Conifères
Ordre Coniférales
Sous ordre Taxales
Famille Cupressacées
Selon les caractéristiques génétiques et morphologiques de chaque espèce, la famille des Cupressaceae est divisée en sept sous-familles (Figure 2), soit les Cunninghamioideae, Taiwanioideae, Athrotaxidoideae, Sequoioideae, Taxodioideae, Callitroideae et Cupressoideae (Gadek et al., 2000; Pittermann et al., 2012).
Cunninghamioideae Taiwanioideae Sequoioideae Taxodioideae Callitroideae Cupressoideae Athrotaxidoideae 1 1 3 3 10 10 1 Nombre de genres C u pressac eae
Figure 2 : Classification sub-familiale de la famille des Cupressaceae (Gadek et al., 2000) Sous-familles
PARTIE I Chapitre 1(I) : Sélection du matériel végétal
32
Au sein de la sous-famille des Cupressoideae, le genre Juniperus occupe une place importante
(Figure 3), avec environ 60 espèces caractérisées par leur rusticité et leur dynamisme (Adams, 1998). Quatre espèces, de répartition fort inégale, se rencontrent au Maroc où l‘on
peut aisément distinguer les espèces à feuilles écailleuses réduites (J. thurifera et J. phoenicea) et les espèces à feuilles étalées-piquantes (J. communis et J. oxycedrus)
(Benabid, 2000).
Le genre Tetraclinis n'est constitué dans l‘Afrique du Nord que d'une seule espèce, T. articulata. C‘est une essence endémique de la Méditerranée occidentale. Ses principaux
peuplements sont essentiellement localisés au Maroc (565.7980ha), en Algérie (environ 60.000) et en Tunisie (près de 30.000) (Rikli, 1943; Quézel, 1980).
Au Maroc, J. thurifera, J. phoenicea, J. oxycedrus et T. articulata occupent une place importante dans la flore du pays et représentent des espèces pionnières et peu exigeantes de point de vue écologique. Elles se trouvent depuis le bord de mer jusqu‘aux sommets des Atlas.
Ce sont des arbres ou arbrisseaux très exploités pour leur bois ou leur feuillage et ce, pour des fins industrielles ou médicinales (Bellakhdar, 1997). Leur rusticité leur permet de résister aux agressions humaines intenses dont ils sont l‘objet car dans de nombreuses régions, ils représentent le seul élément arboré ou arbustif susceptible d‘être exploité (Bellakhdar, 1997).
Cupressoideae