ÉVELINE PLAMONDON
THERMORÉSISTANCE CHEZ MYCOBACTERIUM
AVIUM SSP. PARATUBERCULOSIS DANS LES
PRODUITS DE LA VIANDE
Mémoire présentée
à la Faculté des études supérieures de l’Université Laval dans le cadre du programme de Maîtrise en Science animale
pour l’obtention du grade de Maître ès Sciences (M.Sc.)
DÉPARTEMENT DES SCIENCES ANIMALES
FACULTÉ DES SCIENCES DE L’AGRICULTURE ET DE L’ALIMENTATION UNIVERSITÉ LAVAL
QUÉBEC
2009
Résumé
Mycobacterium avium ssp. paratuberculosis (Map) est responsable de la maladie de Johne
chez les ruminants en particulier chez le bovin. Les scientifiques ont émis l’hypothèse que Map pourrait être l'agent étiologique de la maladie de Crohn chez l'humain, ce qui a soulevé des inquiétudes en santé publique. Map est particulièrement résistant à la chaleur dans le lait, mais l'état des connaissances est pratiquement limité dans les matrices de viande. Les valeurs D (temps de réduction décimal) et z (sensibilité à la température) ont été déterminées dans du boeuf haché préparé aseptiquement à partir du muscle semi
membranosus pour Map, Escherichia coli et Enterococcus faecalis. L'objectif de ce travail
est de déterminer l'effet de divers traitements thermiques sur la cinétique de destruction de Map dans la viande afin d'évaluer si les procédés thermiques industriels (la pasteurisation, cuisson) sont adéquats pour contrôler la Map dans les produits de viande.
Avant-propos
La maladie et la perte de ma mère durant ma maîtrise m’ont profondément atteinte. Cependant, une femme a sue me convaincre de ne pas me laisser abattre et qu’un jour tout finira par bien aller. C’est ainsi que je tiens fortement à remercier ma directrice de recherche, Madame Linda Saucier, pour m’avoir donné cette chance incomparable de poursuivre mes études supérieures. Avec tous les hauts et le bas que j’ai dû traverser durant ma maîtrise, elle a su, comme une amie, être à mes cotés afin de me soutenir. Enfin avec elle, j’ai su ce qu’était un vrai microbiologiste. De plus, elle m’a donné la chance de cultiver cette passion pour la recherche appliquée en microbiologie alimentaire. Ses nombreuses discussions et son appui m’ont permis de devenir plus confiante, responsable et autonome. Maintenant, surpasser mes craintes et mes peines me semble soudainement plus simple.
Je remercie le Département de biochimie et de microbiologie de l’Université Laval, en particulier M. Luc Trudel, pour son aide. De plus, j’aimerais aussi remercier la Prof. Mme Lucy Mutharia, Mme Mélinda Raymond (University of Guelph) pour nous avoir fourni des souches mycobactériennes et de nombreux conseils pour l’élaboration de ce projet. Toute ma gratitude va à Mme Francine Giguère (Mme Tranquilité) et M. Serge Daigle pour leur présence et soutient durant ce projet. Ce projet n’aurait pas pu être possible sans le soutien financier du Fonds québécois de la recherche sur la nature et les technologies (FQRNT) du Gouvernement du Québec. Je tiens aussi à remercier l’Association scientifique canadienne de la viande (ASCV) et Newly Weds Foods pour m’avoir choisie comme récipiendaire de la bourse commémorative Percy Gitelman en 2007.
Enfin, j’exprime toute ma reconnaissance à ma famille, à toi mon père Denis, à toi ma sœur Geneviève. Ginette, maman, je sais que tu seras toujours fière de moi quoique j’entreprenne. Sans oublier mon conjoint, Christopher, car sans lui, je n’aurais pas pu terminer, Je te remercie de ton appui et de ta présence. Un gros merci à ma meilleure amie Sophie. Ton sourire m’a éclairé durant mes périodes les plus sombres J’apprécie votre soutien. La confiance que vous avez su me démontrer a permis à cette belle aventure de parvenir à terme.
Je dédie ce mémoire à tous ceux et celles que j’aime
Table des matières
Résumé...i
Avant-propos ... ii
Table des matières ...iv
Liste des tableaux... vii
Liste des figures ... viii
Introduction...11 Revue de littérature...14 1. Les mycobactéries...14 2. Historique...15 3. La paratuberculose...17 3.1 La maladie...17 3.2 La prévalence...18 3.2.1 Aux États-Unis...19 3.2.2 Au Canada...20
3.3 Le potentiel zoonotique de Map et la maladie de Crohn ...21
4. Caractéristiques physiologiques ...23
4.1 Paroi cellulaire ...24
4.2 Croissance et dissémination...28
4.2.1 Croissance in vitro ...28
4.2.2 Dépendance à la mycobactine...30
4.2.3 Survie dans l’environnement ...33
4.2.4 Croissance in vivo dans les macrophages ...37
5. Identification et diagnostic...42
5.1 Les méthodes de diagnostic ...42
5.1.1 La mise en évidence de la bactérie à partir d’un échantillon de selles, méthode directe...42
5.1.1.1 Microscopie et histopathologie...42
5.1.1.2 La culture in vitro ...43
5.1.1.3 Réaction en chaîne de la polymérase (PCR)...44
5.1.2 La détection d’anticorps par diverses techniques, méthode indirecte ...45
5.1.2.1 La fixation du complément (TFC) ...45
5.1.2.2 ELISA ...46
5.1.2.3 Immunodiffusion sur gel d’agarose (IDGA) ...46
6. La résistance thermique ...47
6.1 Traitements thermiques...47
6.1.1 La stérilisation...47
6.1.2 La pasteurisation ...48
6.1.3. Cuisson ohmique...49
6.2 Efficacité des traitements thermiques ...49
6.2.1 Cinétique de la résistance thermique et ses paramètres...49
6.2.1.1 Valeur n...50
6.2.1.2 Valeur D...50
6.2.1.3 Temps de destruction thermique (TDT) ...53
6.2.1.4 Valeur z...57
6.2.1.5 Valeur pasteurisatrice P ...59
6.2.1.5.1 Valeur pasteurisatrice minimale Pm et partielle Pp...59
6.2.1.6 La valeur létale F ...60
6.3 Facteurs influençant la résistance thermique ...62
6.3.1 La résistance intrinsèque...62
6.3.2 Facteurs environnementaux durant la croissance microbienne ...63
6.3.2.1 L’âge de la culture ...63
6.3.2.2 Température de croissance...63
6.3.2.3 Nature du milieu de croissance des bactéries ...64
6.3.3 Facteurs environnementaux durant le procédé thermique ...64
6.3.3.1 Nature du milieu de croissance lors de la réparation des lésions et des blessures cellulaires. ...64
6.3.3.2 Nature du milieu testé lors du traitement thermique...65
6.4 Les méthodes expérimentales pour mesurer la résistance thermique ...66
6.4.1 Méthode du TDT en tube...66
6.4.2 Méthode du TDT en conserve ...67
6.4.3 Méthode en flacon ...68
6.4.4 Méthode des capillaires ...68
6.4.5 Méthode des sacs stériles de type Whirl-pak™...69
7. Résistance thermique de Map ...70
7.1 Le lait ...70 7.2 Le fromage...72 7.3 Le colostrum ...73 7.4 Le boeuf ...73 Hypothèse et buts...75 Matériel et Méthode...76
Souches bactériennes et conditions de culture et d’entreposage ...76
Préparation des suspensions bactériennes pour les traitements ...77
Préparation des échantillons de viande...78
Composition de la viande ...79
Traitements thermiques...81
Analyse microbiologique...82
Détermination du temps de montée en température ...82
Détermination des valeurs D et z...83
Analyse statistique ...83
Résultats...84
Effet des différents traitements thermiques sur les dénombrements cellulaires...84
Traitements thermiques en milieu liquide par la méthode des capillaires...85
Traitement thermique dans la viande...90
Effet de la température...93
Effet de la souche...95
Comparaison entre les valeurs D et z en milieu liquide et dans la viande...96
Effet de l’inoculum ...98
Discussion...103
1. Traitements thermiques en milieu liquide par la méthode des capillaires...103
1.2 Effet significatif du milieu...104
1.3 Effet significatif de la souche ...110
2. Traitement thermique dans la viande...111
2.1 Effet significatif de la température ...111
2.2 Effet significatif de la souche ...112
2.3 Effet du milieu utilisé pour la préparation de l’inoculum...119
2.4 Différence significative entre viande et capillaire ...120
Conclusion ...122 Bibliographie ...125 ANNEXE A ...160 ANNEXE B ...162 ANNEXE C ...164 ANNEXE D ...167 ANNEXE E...176 ANNEXE F...178 ANNEXE G ...188
Liste des tableaux
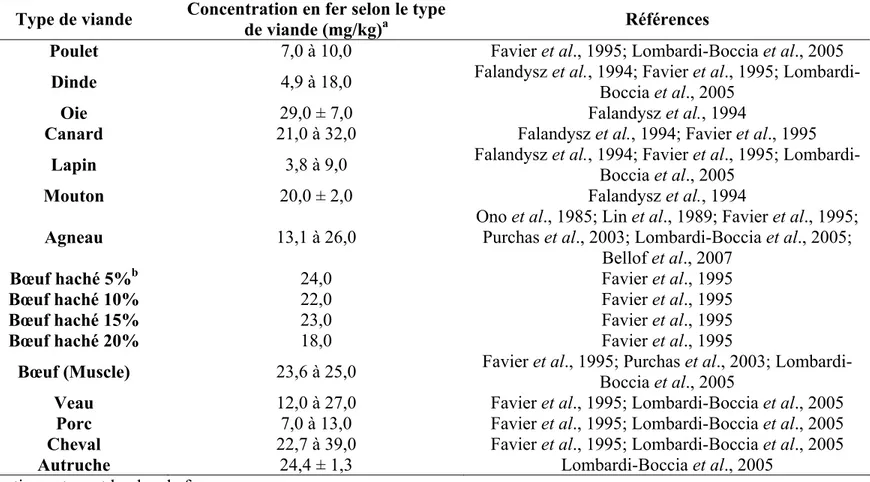
Tableau 1. Concentrations en fer selon le type de viande. ...34 Tableau 2. Résistance thermique (valeur D) des microorganismes cibles selon le milieu
liquide. ...87 Tableau 3. Effet du milieu sur les valeurs D pour E. coli et E. faecalis selon la température.
...87 Tableau 4. Les différentes valeurs P entre E. coli et E. faecalis pour les valeurs D obtenues
selon le milieu et la température étudiée. ...89 Tableau 5. Résistance thermique des microorganismes cibles dans le bœuf haché maigre. 92 Tableau 6. Effet de la température sur les valeurs D pour les souches de E. coli ATCC
25922, E. faecalis ATCC 7080, Map ATCC 19698 et Map gN27 lorsque testé dans la viande hachée préparée aseptiquement...94 Tableau 7. Effet du microorganisme sur les valeurs D pour une température donnée. ...95 Tableau 8. Effet du milieu sur les valeurs D obtenues par la méthode des capillaires et dans
la viande pour E. coli et E. faecalis à une température donnée. ...97 Tableau 9. Effet du milieu de préparation de l’inoculum sur les valeurs D selon la
température pour E. coli et E. faecalis...99 Tableau 10. Thermorésistance de E. coli en milieu liquide selon la littérature...106 Tableau 11. Thermorésistance d’Enterococcus ssp. en milieu liquide selon la littérature. 107 Tableau 12. Types de pasteurisation des carcasses utilisées en industrie...119 Tableau C1. Réduction logarithmique de la charge microbienne selon le milieu et la
température pour E. coli...165 Tableau C2. Réduction logarithmique de la charge microbienne selon le milieu et la
température pour E. faecalis. ...166 Tableau C3. Réduction logarithmique de la charge microbienne selon le microorganisme
étudié, le milieu et la température pour Map. ...166 Tableau E1. Composition de la viande en pourcentage de protéines, de gras et d’humidité
Liste des figures
Figure 1. Structure du mycolyl-arabinogalactane (image réalisée par E. Plamondon). ...25
Figure 2. Paroi cellulaire des mycobactéries (image réalisée, par E. Plamondon)...26
Figure 3. (A) Destruction des microorganismes en fonction du temps démontrant un écart par rapport à une cinétique de premier ordre. (B) Exemple de courbe de survie où la concentration microbienne des survivants en logarithme base 10 est en fonction du temps; équation de régression où la pente (m) = -1/D, exemple d’une cinétique de premier ordre...51
Figure 4. Modèles de courbes de survie convexes. ...54
Figure 5. Modèle de courbe de survie concave, biphasique...55
Figure 6. Modèles de courbes de survie sigmoïdales. ...56
Figure 7. Exemples de courbes de survie à différentes températures...57
Figure 8. Courbe de destruction thermique du logarithme en base 10 de la valeur D en fonction de la température où la pente (m) de l’équation de régression est égaleà -1/z (z = -1/m). ...58
Figure 9. Méthode pour déterminer la résistance thermique dans la viande avec la méthode des sacs stériles de type Whirl-pak™ (Photo gracieuseté M. Marcotte). ...70
Figure 10. Procédures pour obtenir de la viande préparée aseptiquement. ...79
Figure 11. Valeurs z évaluées par la méthode des capillaires pour E. coli ATCC 25922 et E. faecalis ATCC 7080. Pour un même milieu, les résultats ayant une lettre minuscule identique signifient qu’il n’y a pas de différence significative. Les lettres en majuscule sont utilisées pour un microorganisme spécifique, c’est-à-dire pour E. coli (A) et E. faecalis (WXYZ). ...89
Figure 12. Interaction entre le milieu et le microorganisme dans les capillaires à 55 °C (A); à 60°C (B) pour les valeurs D (P = 0,01 et 0,02, respectivement). ...100
Figure 13. Interaction entre le milieu et le microorganisme à 65°C pour la valeur D dans les capillaires (A; P = 0,02); dans la viande (B; P = 0,003). Pour un même milieu, les résultats ayant une lettre minuscule identique signifient qu’il n’y a pas de différence significative. Les lettres en majuscule sont utilisées pour un microorganisme spécifique, c’est-à-dire AB pour E. coli et X pour E. faecalis. ...101
Figure 14. Interaction entre le milieu et le microorganisme pour la valeur z évaluée dans les capillaires. Pour un même milieu, les résultats ayant une lettre minuscule identique signifient qu’il n’y a pas de différence significative. Les lettres en majuscule sont utilisées pour un microorganisme spécifique, c’est-à-dire AB pour E. coli et YZ pour E. faecalis,...102
Figure 15. Courbe de destruction thermique présentant le logarithme de la valeur D (sec) en fonction de la température (°C) dans la viande pour Map ATCC 19698, Map gN27, ▲ E. faecalis ATCC 7080 et ● E. coli ATCC 25922...112
Figure B16. Courbe de croissance de Map ATCC 19698; densité optique (600 nm) en fonction du temps (jours) à une concentration d’inoculum de 1% cultivé dans un bouillon de 7H9 Middlebrook enrichie ADC. ...163
Figure B17. Courbe de croissance de E. faecalis ATCC 7080; Log de la population microbienne en fonction du temps (h) à une concentration d’inoculum de 1% cultivé dans un bouillon BHI...163
Figure D18. Valeurs D pour E. coli ATCC 25922 et E. faecalis ATCC 7080 en fonction de la température de traitement à A) 50˚C, B) 55˚C, C) 60˚C, D) 65˚C et E) 70˚C. ...168 Figure D19. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de
E. coli ATCC 25922 en fonction du temps (sec) de traitement thermique dans
BHI/BHI effectué à une température de A) 50°C, B) 55°C, C) 60°C, D) 65°C et E) 70°C. ...169 Figure D20. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de
E. faecalis ATCC 7080 en fonction du temps (sec) de traitement thermique dans
BHI/BHI effectué à une température de A) 55°C, B) 60°C, C) 65°C et D) 70°C...170 Figure D21. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de
E. coli ATCC 25922 en fonction du temps (sec) de traitement thermique dans
ME2/ME10 effectué à une température de A) 50°C, B) 55°C, C) 60°C et D) 65°C..171 Figure D22. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de
E. faecalis ATCC 7080 en fonction du temps (sec) de traitement thermique dans
ME2/ME10 effectué à une température de A) 55°C, B) 60°C, C) 65°C et D) 70°C..172 Figure D23. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de
E. coli ATCC 25922 en fonction du temps (sec) de traitement thermique dans
BHI/ME10 effectué à une température de A) 50°C, B) 55°C, C) 60°C et D) 65°C...173 Figure D24. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de
E. faecalis ATCC 7080 en fonction du temps (sec) de traitement thermique dans
BHI/ME10 effectué à une température de A) 55°C, B) 60°C, C) 65°C et D) 70°C...174 Figure D25. Courbe de destruction thermique présentant les log10 de la valeur D (sec) en
fonction de la température (° C) pour E. coli ATCC 25922 et E. faecalis ATCC
7080 dans A) BHI/BHI, B) ME2/ME10 et (C) BHI/ME10...175 Figure F26. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de
E. coli ATCC 25922 en fonction du temps (sec) de traitement thermique dans
BHI/Viande effectué à une température de A) 50°C, B) 55°C, C) 60°C et D) 65°C. 179 Figure F27. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de
E. coli ATCC 25922 en fonction du temps (sec) de traitement thermique dans
ME2/Viande effectué à une température de A) 55°C, B) 60°C et C) 65°C...180 Figure F28. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de
E. faecalis ATCC 7080 en fonction du temps (sec) de traitement thermique dans
BHI/Viande effectué à une température de A) 55°C, B) 60°C, C) 65°C et D) 70°C. 181 Figure F29. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de
E. faecalis ATCC 7080 en fonction du temps (sec) de traitement thermique dans
ME2/Viande effectué à une température de A) 55°C, B) 60°C, C) 65°C et D) 70°C. ...182 Figure F30. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de Map
ATCC 19698 en fonction du temps (sec) de traitement thermique dans 7H9/Viande effectué à une température de A) 55°C, B) 60°C, C) 65°C et D) 70°C...183 Figure F31. Courbe de survie présentant les dénombrements cellulaires (log10 ufc/ml) de Map
gN27 en fonction du temps (sec) de traitement thermique dans 7H9/Viande effectué à une température de A) 55°C, B) 60°C, C) 65°C et D) 70°C. ...184 Figure F32. Courbes de destruction thermique présentant les log10 de la valeur D (sec) en
fonction de la température (°C) pour A) E. coli ATCC 25922 BHI/Viande; B) E. coli ATCC 25922 ME2/Viande; C) E. faecalis ATCC 7080 BHI/Viande; D) E. faecalis
ATCC 7080 ME2/Viande; E); Map ATCC 19698 7H9/Viande et F); Map gN27
7H9/Viande...185 Figure F33. Valeurs D dans la viande pour E. coli ATCC 25922, E. faecalis ATCC 7080 et
des deux souches de Map en fonction de la température du traitement à A) 50˚C, B) 55˚C, C) 60˚C, D) 65˚C et E) 70˚C...186 Figure F34. Histogramme des valeurs z pour E. coli ATCC 25922, E. faecalis ATCC 7080 et
des deux souches de Map dans la viande en fonction du milieu de préparation de l’inoculum...187
Introduction
La paratuberculose est une infection bactérienne causée par Mycobacterium avium ssp.
paratuberculosis (Map). Cette maladie est fatale, chronique, progressive, dégénérative et
incurable affectant principalement l’intestin des ruminants. Cette maladie touche principalement les cheptels laitiers et de boucherie. Cependant, une grande variété de ruminant comme les moutons, les chèvres, les cerfs communs, les antilopes et les bisons sont également touchés. La maladie se caractérise par une perte de poids et des diarrhées intermittentes et persistantes (Collins et Manning, 2001). Dans un élevage, le nombre d’animaux malades et symptomatiques ne reflètent pas le nombre réel d’animaux infectés puisqu’une fraction du troupeau peut être asymptomatique et sécrète la bactérie via leurs fèces. Plusieurs scientifiques ont avancé l’hypothèse que Map pourrait être également l’agent étiologique de la maladie de Crohn chez l’humain. La question à savoir si la paratuberculose pouvait être transmise à l’homme a donc été soulevée. De plus, la séquence d’insertion IS900, qui est une caractéristique de son génome (Green et al., 1989), aurait été identifiée à partir de biopsies de muqueuse intestinale chez certains patients atteints de la maladie de Crohn (Sechi et al., 2005). Cette découverte a engendré une vague d’inquiétudes en santé publique puisque le bœuf et le lait font partie de notre alimentation (Sartor, 2005). De fait, il serait inquiétant de voir les bovins identifiés comme réservoir de cette mycobactérie et de la maladie. L’industrie bovine ne peut se permettre une autre crise comme celle de l’encéphalite spongiforme bovine (ESB), d’où la nécéssité d’être proactif. Les interventions ainsi que les traitements appliqués aux aliments doivent être en mesure de contrôler Map advenant une contamination accidentelle. Ce projet de maîtrise décrit ici vise à évaluer l’efficacité des traitements thermiques utilisés dans la transformation des produits carnés pour contrôler Map.
Map est un organisme avec certaines particuliarités. Il est fastidieux de le faire et peut prendre entre 4 et 16 semaines d’incubation avant que des colonies ne soient visibles sur un milieu de culture gélosé et ceci est dépendant du stress subi. De plus, il requiert de la mycobactine pour sa culture in vitro afin d’assurer sa croissance et ses besoins en fer puisqu’il ne synthétise pas ce sidérophore. Deux autres microorganismes à croissance plus
rapide, Escherichia coli et Enterococcus faecalis, ont aussi été testés, non seulement dans la viande mais aussi dans un bouillon de culture à des fins des fins de comparaison. E. coli est utilisé comme indicateur du niveau d’hygiène des carcasses tel que décrit dans le Manuel des méthodes de l’hygiène des viandes de l’Agence canadienne d’inspection des aliments (ACIA, 2008) et les Lignes directrices pour l'interprétation des résultats analytiques en microbiologie alimentaire du Ministère de l'agriculture, des pêcheries et de l'alimentation du Québec (MAPAQ, 2007). Les entérocoques sont reconnus pour être responsables de toxi-infections et de l’altération des aliments (Franz et al., 1999). E.
faecalis ainsi que E. faecium sont souvent impliqués dans la détérioration des aliments
(Gordon, 1991). Par ailleurs, ils sont également utilisés comme indicateur de contaminations fécales (Franz et al., 1999). Certaines études effectuées dans les abattoirs, ont révélé que les entérocoques, comme E. faecalis, étaient prédominantes sur la viande crue comme le bœuf, le porc ou le poulet (Stiles et al. 1978; Turtura and Lorenzelli, 1994; Franz et al., 1999). De plus, les entérocoques peuvent aussi contaminer les viandes transformées (Franz et al., 1999). E. faecalis, connue pour être particulièrement résistant à la chaleur, est aussi responsable notamment, de gastroentérites qui sont associées à la consommation d’aliments contaminés (Franz et al., 1999). Le contrôle efficace de la contamination des viandes par les entérocoques pourrait devenir plus important dans le futur puisque l’identification de ces bactéries en tant que microbes pathogènes opportunistes humains est de plus en plus courante et répendue. La résistance thermique de ces deux microorganismes en milieu liquide a été déterminée par la méthode élaborée par Splitsoesser et al. (1996). Ce dernier utilise des capillaires scellés remplis de la culture bactérienne. Ces capillaires sont chauffés, refroidis, décontaminés à l’alcool éthylique (70%) puis aseptiquement cassés dans un diluant afin de libérer leur contenu et d’effectuer le dénombrement sur gélose. Des essais préliminaires ont été réalisés en laboratoire et le premier bouillon utilisé est standard et est fréquemment utilisé en laboratoire, il s’agit du bouillon d’infusion cœur - cervelle (Brain Heat Infusion; BHI). Afin d’obtenir un bouillon de culture ressemblant à la composition de la viande, plusieurs essais ont été effectués avec de l’extrait de viande (meat extract; ME) constitué de tissus animaux (bœuf) ne contenant ni graisse et tendon réhydraté à différentes concentrations. Le bouillon reconstitué à 2% d’azote total supporte la croissance des deux bactéries; la croissance était considérablement
ralentie à des concentrations supérieures à 2%. Un bouillon reconstitué à 10% d’azote et dont le pH a été ajusté avec de l’acide lactique au pH de la viande fraîche soit 5,6 a été utilisé pour l’évaluation de la résistance thermique. Dix pourcent est la reconstitution maximale du milieu pour qu’il n’y ait pas de floculation après autoclavage (Dubuc, communication personnelle).
Cette recherche vise donc à déterminer si les traitements thermiques couramment utilisés dans le domaine de la viande sont suffisants afin de contrôler Mycobacterium avium ssp.
paratuberculosis advenant une contamination accidentelle de la viande tout comme cela a
déjà été établi dans le cas du contôle de Clostridium botulinum, qui est l’indicateur de la stérilisation pour les traitements thermiques dans la préparation des conserves (Prescott et
al., 1995). Puisque le bœuf haché commercial possède une flore indigène pouvant faire
compétition avec Map pour les nutriments, de la viande bovine préparée aseptiquement a été utilisée pour ne pas nuire à la croissance de Map qui pousse très lentement. La résistance thermique a été déterminée en calculant les valeurs D et z en milieux liquides et dans de la viande hachée.
Revue de littérature
1. Les mycobactéries
Selon Bergey et al. (1984), les mycobactéries sont classées dans la famille des
Mycobacteriaceae qui ne comporte qu’un seul genre, Mycobacterium. Les mycobactéries
forment un groupe hétérogène de bacilles ubiquitaires saprophytes à croissance lente ou rapide. Mycobacterium smegmatis est l’une des mycobactéries à croissance rapide. Cette dernière peut donner des colonies visibles en moins de sept jours sur les milieux de croissance gélosés tel que Midllebrook et Herold (Stahl et Urbance, 1990; Brown-Elliott et Wallace, 2002). À l’opposé, les bactéries à croissance lente prennent au-delà de sept jours avant que leur croissance ne soit visible. Mycobacterium bovis, agent étiologique de la tuberculose chez plusieurs mammifères, est l’une de ces mycobactéries à croissance lente (Tsukamura, 1983; Collins et De Lisle, 1985). De par sa complexité, la paroi des mycobactéries se distingue de celle des autres bactéries (Gram négatif et positif) par sa complexité. La caractéristique principale des parois est le fort contenu lipidique constitué majoritairement d’acides mycoliques (Prescott et al., 1995). Il est aussi intéressant d’ajouter que le polysorbate 80 (Tween 80; monoléate de sorbitane polyoxyéthylène ou polysorbate) peut être hydrolysé par certaines mycobactéries à croissance lente. Cette hydrolyse permet de différencier les espèces et sous espèces de mycobactéries, particulièrement les groupes à croissance lente tel que le groupe II (scotochromogène) et le groupe III (non photochromogène). Le complexe M. avium intracellulaire (dont Map fait parti), M. xenopi et M. scofulaceum répondent négativement à ce test, contrairement à M.
kansasii. Les lipases produites par certaines mycobactéries scindent ce composé en acide
oléique et en polyéthylène sorbitol ce qui résulte en un changement de couleur du milieu en rouge (MacFaddin, 1985; Koneman et al., 1997; de la Maza, 2004). Le milieu contient du rouge neutre qui se lie au Tween 80. Lorsque le pH est neutre ce colorant a une teinte ambrée en raison de la rotation optique de la lumière transmise (de la Maza, 2004). Le changement de couleur ne serait pas dû au pH puisque le tampon du milieu neutralise
l’acide oléique. Le changement de rotation optique du colorant en serait vraisemblablement la cause du changement de couleur (MacFaddin, 1985).
Finalement, ces petits bacilles sont la cause de plusieurs maladies humaines dont les plus connues sont, sans aucun doute, la tuberculose et la lèpre causées respectivement par
M. tuberculosis et M. leprae (Stahl et Urbance, 1990; Prescott et al., 1995). Cependant,
depuis quelques années, on porte un intérêt particulier à M. avium ssp. paratuberculosis, agent pathogène responsable de la paratuberculose chez une grande variété de ruminants, mais qui touche principalement le bovin laitier et de boucherie. Sa croissance lente, son diagnostic difficile ainsi que sa présence chez le bovin entraîne une vague d’inquiétudes en ce qui concerne son impact économique (Zurbrick et Czuprynski, 1987) et la santé publique. L’hypothèse selon laquelle ce microorganisme serait aussi la cause de la maladie de Crohn chez l’homme date de 1913 (Sechi et al., 2001; Gill, 2005). Depuis quelques années, plusieurs auteurs d’articles scientifiques prônent avec plus d’insistance cette hypothèse (Chiodini et al., 1984b; Thompson, 1994; Mishina et al., 1996; Chamberlin et
al., 2001; El-Zaatari et al., 2001; Sartor, 2005; Jones et al., 2006). La section 3.3 de ce
chapitre présente plus en détail le rationnel derrière cette hypothèse.
2. Historique
C’est depuis 1826 que les signes cliniques de la paratuberculose ont été identifiés. Cependant, à cette époque, personne n’était encore en mesure, à cette époque, de caractériser et d’identifier l’agent étiologique de cette maladie. Il a fallu attendre jusqu’à la fin de ce siècle, vers 1895, pour que cette maladie, qui touche principalement les ruminants, soit reconnue comme une maladie infectieuse causée par M. avium ssp. paratuberculosis. Dans la région d’Oldenbourg en Allemagne, au cours de l’année 1894, un fermier acquiert une nouvelle vache pour son troupeau. Le 23 octobre de la même année, il s’aperçoit rapidement que sa nouvelle vache a une perte de productivité. En plus de constater ce problème, elle perd du poids et souffre de diarrhées passagères. Sa mort sera constatée au printemps suivant par le vétérinaire local, le docteur Herr Frederick Harmes. Ce dernier
croyait que l’animal souffrait de la tuberculose bovine intestinale causée par M. bovis. Suite à la nécropsie, les intestins, l’estomac ainsi que l’épiploon1 sont expédiés à l’unité vétérinaire de pathologie de Dresde. Ce sont les docteurs H. A. Johne et L. Frothingham, un Américain de passage, qui examineront le tube digestif de cette vache et décriront, en 1895, cette toute nouvelle mycobactérie (Collins et Manning, 2001).
Étrangement, en examinant le tube digestif de l’animal, les deux docteurs remarquent que la muqueuse intestinale est plus épaisse que la normale, la paroi de l’intestin est perforée et ils découvrent un nombre élevé de leucocytes et de cellules géantes2. Ils remarquent de plus, que des cellules acido-résistantes abondent dans les tissus infectés. C’est à ce moment qu’ils ont pu faire le lien entre l’entérite bovine et la présence du microorganisme. Ils observent une similitude dans la pathologie de la maladie avec celle de la tuberculose bovine intestinale causée par M. bovis. De plus, la maladie s’apparente à la tuberculose et s’avère être causée par une bactérie semblable à M. avium. C’est en 1906 que Bernhard Bang fait une distinction entre la tuberculose et cette nouvelle entérite. Il propose alors le nom de Pseudotuberculous enteritis (Cocito et al., 1994; Baumgartner et Lorenz Khol, 2006). En 1907, John McFadden propose le nom de maladie de Johne (yo-nee; Pattison, 1988). Au cours des années 1912, Twort a pu isoler pour la toute première fois le microorganisme (Cocito et al., 1994). Ce dernier lui a donné le nom de Mycobacterium
enteritis chronicae pseudotuberulosae bovis johne (Collins et Manning, 2001). Mieux
connu sous le nom du bacille de Johne, il a été nommé pendant plusieurs années
Mycobacterium johnei ou enteridis (Institue of Food Science & Technology; IFST, 1998).
Il faudra attendre plus d’une dizaine d’année, vers 1923, pour que le nom de paratuberculose soit retrouvé dans la littérature (Ayele et al., 2001).
1 Le Nouveau Petit Robert (Robert, 1994) : « Se réfère au repli du péritoine qui relie entre eux les organes
abdominaux ».
2 Les cellules géantes se réfèrent à la fusion des macrophages aussi appelées cellules géantes polynuclées de
3. La paratuberculose
3.1 La maladie
La paratuberculose aussi connue sous le nom de maladie de Johne, est une entérite chronique, fatale, progressive, dégénérative et incurable affectant principalement l’intestin des ruminants tels que le mouton, la chèvre, le cerf commun, l’antilope et le bison (Collins, 1997; Sung et Collins, 1998; Sung et Collins 2000; Stabel, 2000; Manning et Collins, 2001; Collins et Manning, 2001; Grant et al. 2001; Gao et al., 2002; Englund et al. 2002; Whittington et al., 2004). Rappelons que les cheptels laitiers et de boucherie sont actuellement les plus touchés par cette maladie.
Ce sont habituellement les veaux qui sont les plus susceptibles de contracter la maladie dû à leur système immunitaire encore peu développé (Cocito et al., 1994; Ayele et al., 2001; Englund, 2002). La transmission se fait via les voix utérines, ou encore lors de l’ingestion de matières fécales, de lait ou de colostrum contaminés par Map (Chiodini et al., 1984a cité par Stabel, 2000; Englund, 2002; Collins, 2003c). L’infection débute généralement dans la partie terminale du petit intestin, l’iléum (Ayele et al., 2001; Collins, 2003b,c; Coussens et
al., 2005; Baumgartner et Khol, 2006). De par sa structure, cet organe, fait de replis
nommés Plaques de Peyer, concentre un bon nombre de nodules lymphoïdes. À cet endroit, Map traverse la muqueuse pour pénétrer le système lymphatique grâce aux cellules spécialisées M du système immunitaire qui adhèrent sélectivement aux bactéries lors d’une infection (Momotani et al., 1988 cité par Koets et al., 2001; Janeway et al., 2003; Sigurðardóttir et al., 2005). Map utilise ces cellules afin de pénétrer la muqueuse de l’iléum où elle peut être phagocytée (absorbée) par les macrophages (Baumgartner et Khol, 2006). Par un processus encore mal compris, Map réussit à survivre et à se répliquer dans les macrophages tout en étant protégé contre le système humoral de l’hôte (Collins, 2003a). Après une incubation prolongée, entre un et 10 ans, les symptômes cliniques s’installent (Collins, 2003b). Les lésions et l’épaississement des parois intestinales causées par Map et l’initialisation du processus immunitaire commencent à nuire aux processus normaux d’absorption des protéines et des nutriments dans l’intestin (Cocito et al., 1994; Leboeuf, 2001; Koets et al., 2001; Englund, 2002).
3.2 La prévalence
Il est très difficile de déterminer la prévalence réelle de ce microorganisme, car le nombre d’études d’épidémiologiques est encore restreint jusqu’à ce jour. Cette maladie est répandue sur tous les continents (Collins, 2003c). Sa prévalence serait plus importante dans les pâturages des bovins laitiers que ceux des bovins de boucherie (European Commision, 2000; Grant et al., 2001). Il est difficile de déterminer la prévalence ou l’incidence de cette maladie au niveau mondial. L’apparition des symptômes cliniques peut prendre plusieurs mois, et même des années. La plupart des animaux sont asymptomatiques sur une longue période. La Suisse et quelques états d’Australie sont les seules régions du globe où les troupeaux sont exempts de la maladie. Leur système de dépistage fiable ainsi que les nombreuses analyses effectuées expliquent ce succès dans le contrôle de la maladie (Collins, 2003a). Le pourcentage des troupeaux contaminés par ce microorganisme en Europe s’étend de 7 à 55% (Manning et Collins, 2001). En Espagne, suite à une enquête bactériologique réalisée durant l’abattage, 1% des individus étaient porteurs de la maladie. Au Pays Basque, 67% des troupeaux analysés par la la technique d’immuno-absorption enzymatique (ELISA) étaient contaminés par Map. D’autres études démontrent aussi la présence de Map en Belgique et aux Pays-Bas. En Belgique, 17,4 % des troupeaux (présente au moins un animal malade dans le troupeau) et 1,2% des animaux (moyenne du nombre d’animaux malades par troupeau) sont contaminés alors qu’aux Pays-Bas, la prévalence est de 54,8% pour les troupeaux et de 2,5% pour les animaux (European Commission, 2000). Une étude faite sur 16 000 vaches provenant de 378 troupeaux aux Pays-Bas a démontré qu’un très petit nombre de vaches laitières (2,7 à 6,9%) et un grand nombre de troupeaux (31 à 71%) étaient positifs (Muskens et al., 2000). Au Danemark, 900 troupeaux laitiers ont été examinés et 70 % de ces troupeaux se sont avérés positifs (au moins une vache était détectée positive; Nielsen et al., 2000). Il y a une dizaine d’années la prévalence en Norvège et en Suède était nulle alors qu’elle atteignait 12,0 % aux États-Unis (Nielsen et al., 2000). Probablement liée à l’importance de la production, la maladie de Johne est plus commune dans les cheptels laitiers que pour les autres ruminants (Collins, 2003c). Cependant, la susceptibilité de nouveaux hôtes semble augmenter (Collins, 2003b).
Notamment, une étude en Écosse a démontré que le lapin ainsi que ses prédateurs peuvent être porteurs de la maladie (Beard et al., 2001).
3.2.1 Aux États-Unis
Aux États-Unis, entre 1983 et 1984, dans 32 états, on estimait à 2,9 % la prévalence de Map dans les cheptels laitiers et à 0,8 % chez le cheptel de boucherie (Merkal et al., 1987). De plus, Stabel (2000) mentionne qu’en 1987 la prévalence dans les troupeaux s’évaluait à 1,6 %. Une étude supplémentaire, démontre qu’en 1987, 8,6 % du bétail de boucherie et 17,1 % du bétail laitier en Floride étaient positifs aux tests de détection par la technique ELISA pour Map (Braun et al., 1990). En 1954, dans les troupeaux aux Missouri, 74 % des troupeaux laitiers et 40% des troupeaux de boucherie étaient positifs à l’ELISA (Thorne et Hardin, 1997). D’autres enquêtes ont démontré que la prévalence de Map en Pennsylvanie, au Wisconsin et en Californie dans les bovins laitiers est respectivement de 7,2, 10,8 et 3.1 % (Stabel, 2000). Également, dans une étude réalisée par Collins et al. (1994), la prévalence au Wisconsin se traduisait ainsi, 4,79% (4 990 animaux) des bovins étaient détectés positifs avec un test ELISA et 34% (158 troupeaux) des troupeaux laitiers. Malgré ces études, on a considéré que le niveau de la prévalence aux É.-U. était bas. En effet, dans une autre étude, 7,9% des 380 troupeaux provenant de 21 états différents étaient considérés comme positifs par un test d’ELISA (Dargatz et al., 2001). De plus, il a été démontré que la prévalence de l’infection de Map touche moins de 22 % des fermes (Mitchell et al., 2008; Wells et Wagner, 2000). Les troupeaux infectés par Map entraînent des pertes économiques considérables. Chiodini et al. (1984b; cité par Losinger, 2005), estime l’impact de la maladie de Johne sur la production laitière à une perte annuelle de 54$ (É.-U.) millions. Au début des années 90, les pertes occasionnées par Map se chiffraient à plus de 9$ (É.-U) millions par année en Floride (Braun et al., 1990). Il est aussi indiqué dans une étude de Losinger (2005) qu’en 1996 plus de 200$ US millions avaient été perdus dû à cette maladie. De plus, les pertes en lait peuvent atteindre jusqu’à 700 kg par vache soit 22 à 27$ US par vache ce qui équivaut à 200 à 250$ US millions annuellement (Ott et al., 1999).
3.2.2 Au Canada
Au Québec, même si les vétérinaires sont bien au courant de l’importance de cette maladie, la prévalence exacte jusqu’à aujourd’hui n’est pas très bien établie. La Fédération des producteurs de bovins du Québec mentionne que plus de 75 % des producteurs ne connaissent pas cette maladie (Coté, 2003). Cependant, une étude faite entre 2001 et 2002, sur des bovins de boucherie a permis d’identifier la paratuberculose dans 15,7 % des troupeaux et 0,7% des animaux (Coté, 2003).
Des études de séroprévalence (tests de dépistage grâce aux anticorps) ont été réalisées dans quelques provinces canadiennes (Lebœuf, 2001). Dans l’Est du Canada ainsi qu’au Maine, basé sur l’échantillonnage aléatoire du bétail abattu, un test de la réaction de polymérisation en chaîne (PCR) confirmait à 16,1 % la présence de Map dans les troupeaux (McKenna et
al., 2004). En Ontario, on estime qu’il y a jusqu’à 30 % des troupeaux qui sont infectés. Au
Nouveau-Brunswick, en Nouvelle-Écosse et à l’Ile du Prince-Édouard, 2,6% des vaches laitières sont porteuses de la mycobactérie. De plus, le niveau d’infection dans les troupeaux de ces provinces monte à 16,7 % (au moins deux vaches par troupeau sont malades; Vanleeuwen et al., 2001). Au Manitoba, sur les 1204 vaches laitières et 1425 vaches de boucherie, 4,5% et 1,7% ont été dépistées séropositives pour Map, respectivement (VanLeeuwen et al., 2006). En Alberta, en 2005, jusqu’à 58,0 % des troupeaux étaient infectés. Dans la même province, une étude a été menée afin de déterminer la séroprévalence (détection par ELISA) de Map sur 100 troupeaux constitués de vaches et de leurs veaux. Cette étude a permis de mettre en évidence que 7,9 % des troupeaux étaient considérés comme infectés (Scott et al., 2007). Dans cette étude, on considère un troupeau infecté lorsque deux animaux ou plus par groupe de trente animaux testés sont trouvés séropositifs ici par ELISA). Plus de 15% des troupeaux de boucherie ont été diagnostiqués pour la paratuberculose en Saskatchewan (NcNab et al., 1991; Leboeuf, 2001; Waldner et al., 2002; Sorensen, 2003 Hendrick et al., 2005). Il a été rapporté qu’environ 1,3% à 7,5% des cheptels laitiers canadiens et entre 9,8% et 40,0% des troupeaux (boucherie et laitiers ensemble) étaient infectés par Map selon la province (Tiwari et al., 2006). Dans une étude, le coût moyen annuel a été estimé à 2 472$ par
troupeau infecté ayant une taille moyenne de 50 animaux. De plus, la séroprévalence a été évaluée à 7% (Chi et al., 2002).
3.3 Le potentiel zoonotique de Map et la maladie de Crohn
Il n’est pas encore certain que la paratuberculose soit une zoonose. Cependant, due à la forte similitude histopathologique de cette maladie avec celle de la maladie de Crohn, certains scientifiques ont avancé l’hypothèse que Map serait l’agent étiologique de cette maladie (Sartor, 2005; Chamberlin et Naser 2006). Depuis près d’un siècle que cette possibilité a été étudiée (Dalziel, 1913 cité par Jeyanathan et al., 2006; Sechi et al., 2001; Gill, 2005). Cette hypothèse est d’autant plus inquiétante puisque la séquence d’insertion3 IS900 a été détectée dans des tissus intestinaux de certains patients atteints de cette maladie (Sartor, 2005). Des données supportant ce fait proviennent de l’étude d’Autschbach et
al. (2005). Cette recherche portait sur la détection de IS900 chez des patients atteints
(n=100) et non atteints (groupe contrôle; n = 100) de la maladie de Crohn et atteints de colites ulcéreuses (n=100). La prévalence de Map dans les tissus chirurgicalement excisés a été déterminée en utilisant la technique PCR afin de détecter IS900. Les résultats démontrent que IS900 se retrouve dans 52% des tissus provenant des patients atteints de la maladie de Crohn comparativement à 2% pour ceux atteints de colites ulcéreuses et 5% des patients du groupe contrôle (Autschbach et al., 2005). Toutefois, la possibilité que la présence de Map soit plutôt liée à une infection secondaire reste entière.
Les nombreuses études relatant la présence de Map dans la chaîne alimentaire contribuent à augmenter l’inquiétude en santé publique (Sator, 2005; Shanahan et O’Mahony, 2005). Dans les pays où Map est endémique, les cours d’eau servant à l’usage domestique peuvent être contaminés (Le Dantec et al., 2002; Pickup et al., 2005). Entre août 2002 et août 2003, 40 des 70 échantillons provenant de la rivière Tywi (Royaume Uni) étaient positifs quant à la détection de IS900 par PCR (Pickup et al., 2006). De plus, en Irlande, Map a aussi été
3 Une séquence d’insertion est un élément génétique petit et mobile. Cette séquence contient uniquement les
gènes utiles à son insertion. Souvent retrouvée en plusieurs copies dans la structure des gènes, elle cause souvent des mutations polaires (Green et al., 1989).
détecté dans des eaux pour usages domestiques (Whan et al., 2005). Il n’est pas étonnant de constater que Map peut se retrouver dans le lait puisque les vaches malades peuvent l’excréter dans le lait sans pour le moins créer une infection comme la mammite (Raizman
et al., 2004; Sator, 2005). De plus, plusieurs études viennent démonter la capacité de Map à
résister aux techniques de pasteurisation (Grant et al., 1999; Lund et al., 2002; Grant et al., 2005; Feller et al., 2007). En dépit de la mobilité des séquences d’insertion, cette IS900 a été fréquemment utilisée pour détecter la présence de Map. Toutefois, elle a également été détectée chez Mycobacterium cookii (Englund et al., 2002). Depuis cette découverte, d’autres éléments génétiques ont donc été utilisés pour détecter Map. ISMav2 est une séquence d’insertion se retrouvant en trois copies dans le génome de Map. Il semble qu’elle n’est pas été retrouvé chez d’autres mycobactéries (Strommenger et al., 2001). F57 est un fragment de 620 bp se retrouvant en une seule copie dans le génome de Map. Sa fonction n’a pas encore été établie (Poupart et al., 1993; Tasara et Stephan, 2005). La séquence d’insertion ISMap02 se retrouve en six copies. Même si sa fonction n’est pas connue, elle pourait constituer une solution alternative dans le diagnostic de Map, car elle procurerait une plus grande sensibilité et spécificité dans les tests de détection (Stabel et Bannantine, 2005). Cependant, il existe plus de 21 séquences codantes pouvant servir à la détection de Map, le locus 255 et le fragment p34 en sont d’autres exemples (Bannantine et al., 2002; Möbius et al., 2008).
En contrepartie, d’autres éléments ne supportent pas de l’hypothèse que Map serait l’agent étiologique de la maladie de Crohn puisque que Map ne soit pas toujours détecté par les méthodes de coloration standard de Ziehl-Neelsen (Greenstein, 2003). Hulten et al. (2000) ont pu mettre en évidence, grâce à une méthode d’hybridation in situ, que Map pouvait perdre sa paroi cellulaire tout en conservant son intégrité. Ceci a aussi été observé chez
M. tuberculosis. Chez cet organisme, la perte de la paroi permettrait de survivre aux
lysozymes, aux lysosomes des macrophages ou encore aux antibiotiques. Sa surface étant modifiée, il est moins immunogène et peut ainsi contourner la réponse immunitaire de l’hôte (Chandrasekhar et Ratnam, 1992). Bien que le lien reste à établir et que les opinions divergent, il en reste pas moins que le risque potentiel de sa présence chez l’humain est réel.
4. Caractéristiques physiologiques
Ce petit bacille (0.5 par 1.5 microns) d'aspect similaire à E. coli, s’apparente génétiquement à Mycobacterium avium (plus de 97,0 % d’homologie au niveau du génome; Harris et Barletta, 2001; Bannantine et al., 2003; Collin, 2003a). Le séquençage des ARN ribosomaux (ARNr) est souvent utilisé afin d’évaluer la relation entre différents genres et espèces microbiennes. Ces séquences sont hautement conservées dans l’évolution et le nombre de gènes d’ARNr sont moins nombreux que dans les autres bactéries. Une analyse des séquences d’ARNr 16S a démontré que M. paratuberculosis est identique génétiquement à M. avium (≥ 99,9%; Cocito et al., 1994; Bannantine et al., 2003). Map a également en commun quelques antigènes avec M. avium comparé aux autres mycobactéries (M. bovis ou M. tuberculosis). L’antigène GroES, une protéine associée au choc thermique (Hsp), en est un exemple. En 1999, une équipe de la Division of Infectious
Diseases and International Health à Durham aux États-Unis, a cloné et séquencé cet
antigène chez Map et M. avium. La séquence en acide aminé et la région codante de cette protéine étaient identiques chez les deux bactéries (Cobb et Fronthingham, 1999; Harris et Barletta, 2001). Également, une dizaine d’années avant cette expérience, Camphausen et al. (1988) ont essayé de déterminer si certains antigènes de M. avium se trouvaient aussi chez Map. Certaines lignées de Map possèdent des glycopeptidolipides (antigène) identiques au sérovar 8 de M. avium. Longtemps les chercheurs ont pensé que Map était un taxon homogène, mais il semble qu’il serait plus un variant ou une sous espèce de M. avium avec des antigènes défectifs (Thorel et al., 1990). Même si Map et M. avium sont pratiquement identiques génétiquement, leurs caractéristiques phénotypiques sont pourtant différentes. Map pousse beaucoup plus lentement. En culture in vitro pour sa croissance, Map requiert un sidérophore (transporteur chimique du fer), la mycobactine, ce qui n’est pas nécessaire pour M. avium (Collin, 2003c). Finalement, le nom de M. paratuberculosis et sa classification taxonomique sont encore débattus (Thorel et al., 1990). L’Association Internationale pour la paratuberculose supporte le reclassement de Map comme une sous-espèce de M. avium et c’est pour cette raison que la majorité de la littérature qui couvre ce
sujet utilise la dénomination M. avium ssp. paratuberculosis (Thorel, 1990; Collins, 1997; Collins, 2003a).
Map est un agent infectieux, pathogène et opportuniste. Selon l’Agence de santé publique du Canada, la majorité des mycobactéries devraient être classées parmi les pathogènes de niveau de bioconfinement de type II (Santé Canada, 2001a). Cette bactérie prend difficilement la coloration de Gram, mais on la considère comme une Gram positif (Cocito
et al., 1994; Collins, 1997; Euzéby, 1998). C’est une bactérie qui n’a pas de flagelle donc
elle n’est pas motile. Elle est asporulée et ne possède pas de capsule. Tel que mentionné ci-haut, elle a des besoins nutritifs particuliers, dont le besoin en mycobactine, c’est un microorganisme aérobe stricte. Puis enfin, le test de catalase thermostable à 68°C est positif (Euzéby, 1998). Finalement, sa température de croissance optimale est 39°C, cependant ses températures de croissance minimales et maximales se situent entre 25°C et 45°C. Étant une bactérie acido-résistante, Map pousse plus facilement à un pH près de 5.5. Coïncidence particulière, c’est précisément un pH voisin de celui de la viande de boeuf. Il est aussi possible d’inhiber la croissance de Map en présence de 5% et plus de chlorure de sodium (IFST, 1998). Précisons que les produits de viande transformés contiennent rarement plus de 2% de sel sinon le produit goûte trop ou très salé (Leblanc, 2005).
4.1 Paroi cellulaire
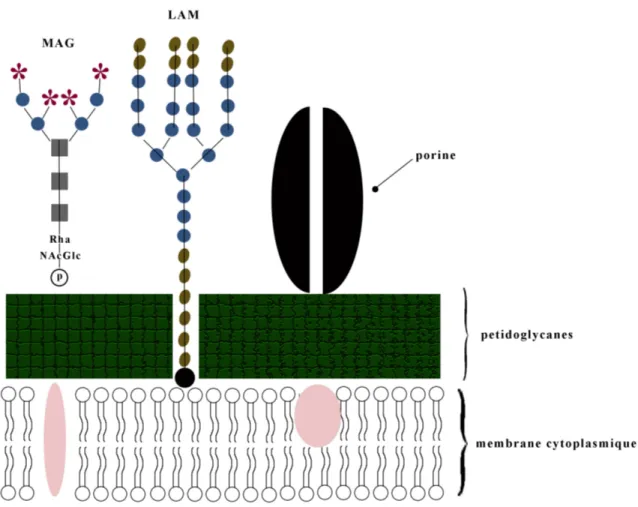
La paroi cellulaire des mycobactéries est extrêmement complexe. Tout comme les bactéries à Gram positif, Map possède une membrane cytoplasmique constituée d’une double couche de phospholipides et d’une paroi cellulaire importante contenant des peptidoglycanes (PG; Prescott et al., 1995). Le principal polymère, qui est aussi un antigène de surface, attaché à ces PG est le mycolyl-arabinogalactane (mAG; Figure 1). Ce polysaccharide neutre est attaché de façon covalente à l’acide muramique des PG (Sussman, 2002; Barton 2005). Cette molécule complexe est constituée d’une chaîne linéaire de galactose et possède des embranchements composés d’arabinose. Des liaisons esters viennent créer un lien entre les molécules d’arabinose et d’acide mycolique. Cet acide est un acide gras complexe à
longues chaînes carbonées qui possède un groupe hydroxyle sur le carbone et une chaîne aliphatique attachée au carbone (Prescott et al., 1995).
Figure 1. Structure du mycolyl-arabinogalactane (image E. Plamondon).
Chez les mycobactéries, les acides mycoliques constituent une barrière hydrophobe autour de la bactérie, prévenant l'action décolorante des acides et des alcools (Euzéby, 1998). Une vue générale de la paroi cellulaire des mycobactéries est illustrée à la Figure 2. Il existe un autre polymère dans la paroi cellulaire, le lipo-arabinomananne (LAM). Ce sont des polymères d’arabinose ayant comme chaîne centrale des polymères de mannose (Barton, 2005). Ils sont bien ancrés dans la membrane cytoplasmique par leur partie lipidique. Leur partie polysaccharidique gagne la surface cellulaire en traversant la paroi cellulaire. Ces molécules amphiphiles joueraient un rôle dans la cohésion de la paroi (Euzéby, 1998). La paroi cellulaire est aussi constituée d’autres molécules comme des lipopolysaccharides (LPS), des glycopeptidolipides (GPL), des sulfolipides et des porines. Les mycosides sont des GLP dont la structure antigénique permet, pour certaines espèces, de décrire le
sérovar . De plus, la paroi est parfois si épaisse en mycosides, chez certaines souches, quelle forme une pseudocapsule (Euzéby, 1998).
Figure 2. Paroi cellulaire des mycobactéries (image E. Plamondon).
La paroi cellulaire des mycobactéries est très hydrophobe. Les cellules ont tendance à
adhérer entre elles pour former des agrégats de même qu’une couche ou pellicule de cellules à la surface du milieu (MacFaddin, 1985; Barton 2005). Pour éviter la formation d’agrégats, du Tween 80 ou du Tyloxapol peuvent être ajoutés au milieu pour aider les bactéries à se développer en suspension (Van Boxtel et al., 1990; Barton, 2005). Le Tween 80 est un agent émulsifiant et surfactant. Sa propriété amphiphile lui permet de stabiliser les mélanges instables d’huile et d’eau. Dans ce cas-ci, l’agent se place à l’interface bactérie/milieu et permet d’abaisser la tension superficielle de surface. Un film est alors
4 Sérovar: À l'intérieur d'une même espèce de microorganismes, subdivision établie en fonction de leurs
formé à cette interface qui s’oppose à la coalescence des bactéries entre elles. Son but principal est d’empêcher les cellules de former des agrégats. L’agent se place à l’interface bactérie/milieu et permet d’abaisser la tension superficielle de surface. Un film est alors formé à cette interface qui s’oppose à la coalescence des bactéries entre elles. Les bactéries ont également un meilleur contact avec le milieu, ce qui leur permet de croître plus aisément grâce à un approvisionnement suffisant en nutriments tout en prévenant la surcharge des nutriments autour de la cellule (Ratledge, 1977). Le détergent peut augmenter la solubilité de certaines composantes mycobactériales tel que les lipides. Une fois les lipides dissous, la perméabilité de la membrane cellulaire est augmentée, ce qui facilite le transport des substrats à l’intérieur de la cellule (Van Boxtel et al., 1990). Chez Map, le Tween 80 a la propriété d’altérer sa morphologie. En absence de Tween sur un agar de Middlebrook 7H11, les colonies sont irrégulières et granuleuses. Cependant, en présence de > 0,01% (v/v) de Tween 80, les colonies sont voûtée et lisses. De plus, mentionnons que les colonies rugueuses sont plus susceptibles d’être virulentes. L’apparition de polypeptidolipides polaires a été observée sur les cellules lisses mais absentes sur les rugueuses. Ceci suggère que le Tween puisse aussi influencer la structure chimique aussi bien que la structure antigénique de Map (Van Boxtel et al., 1990).
Map, comme les autres sous espèces de M. avium, est capable de pénétrer les macrophages
par la phagocytose et d’y survivre. C’est pourquoi Map fait partie du complexe M. avium intracellulaire (MAC). Ainsi, la classification des mycobactéries atypiques ou non tuberculeuse (comme M. avium) de Runyon la situe dans le groupe III, une mycobactérie non photochromogène (Kerr et Barrett, 1994). Ce qui veut dire que la colonie n’a pas développé de pigmentation après une incubation à la lumière ou à l’obscurité (Euzéby, 1998). En plus de regrouper les mycobactéries atypiques, cette classification permet de les caractériser selon la pigmentation qu’elles produisent, mais aussi selon le taux de croissance5 (Koneman et al., 1997).
5 Classification de Runyon : classement des mycobactéries dites atypiques (qui ne cause pas la tuberculose)
r 1997). selon la pigmentation produite et leur taux de croissance; Groupe I: photochromogènes (pigment produit pa la lumière); Groupe II: Scotochromogènes (pigment produit par la noirceur); Groupe III: Non
4.2 Croissance et dissémination
4.2.1 Croissance in vitro
Le principal problème rencontré lors de la culture in vitro de Map est l’absence de croissance sur les milieux de culture standard pour les mycobactéries (Francis et al., 1953; Ayele et al., 2001). En plus de devoir pousser sur des milieux complexes, Map requiert un facteur de croissance, la mycobactine ferrique (Merkal et Curran, 1974; Merkal et McCullough, 1982; Lambrecht et Collins, 1992; Lambrecht et Collins, 1993; Rodriguez et Smith, 2003). Il existe un grand éventail de milieux liquides et solides, avec une variété de suppléments, qui sont utilisés afin de mettre en évidence et de permettre la croissance de Map (de Juan et al., 2006). L’une des catégories de milieux est celle élaborée entre 1954 et 1968 par Middlebrook et al. (Middlebrook et Cohn, 1958; Vestal et al., 1965; Cohn et al., 1968). Ce sont des milieux non-sélectifs synthétiques. Par exemple, le milieu liquide 7H9 Middlebrook est principalement utilisé pour la culture des souches mycobactériales (Map et les autres; Sparks, 1998). Les deux autres milieux fréquemment utilisés sont le 7H10 et 7H11 Middlebrook. Le 7H11 diffère légèrement du 7H10 par l’ajout d’extraits pancréatiques de caséine. Il est d’ailleurs recommandé pour les souches de mycobactéries qui ont tendnace à coître fastidieusement tel Map. Ces deux milieux solides sont utilisés pour la culture et l’isolement des mycobactéries (Map et les autres). Comparativement au 7H9, qui ne contient pas d’agar, le 7H10 et 7H11 contiennent également du vert de Malachite qui est un agent inhibiteur des microorganismes contaminants, comme les moisissures et les bactéries sporulantes (Neumann et al., 1997; Sparks, 1998). Ces trois milieux contiennent tous un grand nombre de sels nécessaires à la croissance. Par exemple, le citrate de sodium, lorsqu’il est converti en acide citrique, permet de maintenir la concentration des cations inorganiques dans le milieu. De plus, il est recommandé d’ajouter du glycérol et un supplément d’acide oléique-albumine-dextrose-catalase (OADC). En premier lieu, le glycérol et le dextrose sont une excellente source de carbone et d’énergie. Deuxièmement, l’albumine fixe les acides gras libres du milieu. Ces derniers peuvent être toxiques pour Mycobacterium ssp. lorsque leur concentration est trop élevée (Lynn et al., 1979). De plus, la catalase détruit les radiaux libres du milieu tel que les peroxydes. Le
chlorure de sodium maintient l’équilibre osmotique. Finalement, l’acide oléique est un acide gras à longue chaîne qui joue un rôle essentiel dans le métabolisme des mycobactéries (Sparks, 1998). Il a été démontré que cet acide gras permet un meilleur emmagasinage des lipides extracellulaires dans les vacuoles des mycobactéries, ce qui procure un source supplémentaire de carbone et d’énergie (Schaefer et Lewis, 1965).
Map peut être identifié sur des milieux gélosés à base de jaune d’œufcomme le Herrold et le Löwenstein-Jensen (Ayele et al., 2001; Nielsen et al., 2004). Les phospholipides du jaune d’œuf, en plus d’être une source de vitamines et de fer, neutralisent le pouvoir bactéricide des désinfectants (benzalkonium ou hexadécyl-piridinium) utilisés nécessairement lors de la préparation des échantillons de matières fécales (Douart et al., 2002; Carbonnelle et al., 2003; Harris et al., 2005). Les échantillons ou les cultures de mycobactéries doivent subir une décontamination pour retirer les autres bactéries ou moisissures indésirables pouvant faire compétition pour les nutriments. Les principaux décontaminants utilisés sont le benzalkonium, l’hexadécyl-piridinium ou encore le NaOH (Ramon et al., 1991; Kalis et al., 1999; Donaghy et al., 2003). Le milieu solide Löwenstein-Jensen peut être utilisé pour la sélection, la différenciation et l’enrichissement des mycobactéries. Tout comme le milieu Herrold, il est à base de jaune d’œuf. Il contient aussi de l’amidon de pomme de terre, des sels minéraux, du glycérol et du vert de Malachite (Sparks, 1998; Carbonnelle et al., 2003). La solidité du milieu provient de la coagulation de l’albumine contenue dans le jaune d’œuf. Ce milieu est particulièrement employé dans les pays européens. Le Löwenstein-Jensen est recommandé pour la culture de Map provenant de fèces des ruminants tels que les caprins et les bovins (Nielsen et al., 2004; de Juan et al., 2006). Le milieu Herrold est celui le plus utilisé en Amérique du Nord puisqu’il soutient bien sa croissance (Nielsen et al., 2004). Ce milieu gélosé est sélectif et permet la différenciation de Map. Le milieu contient de l’extrait pancréatique de caséine qui fourni les acides aminés et l’azote nécessaire. De l’extrait de boeuf est aussi présent comme source seconde d’azote, de vitamines et minéraux. Des plus, l’ajout de pyruvate de sodium comme source d’énergie aide aussi à la réparation des cellules endommagées lors de différents stress (chaleur, acidité, etc.; McDonald et al., 1983, Bacon et al., 2003). Comme mentionné plus haut, le jaune d’œuf et le glycérol sont des sources d’énergie et de carbone. L’un des inconvénients d’utiliser ces deux milieux est leur opacité ce qui rend plus
difficile la détection des premières colonies (Organisation Mondiale de la Santé Animale; OIE, 2005). Ce sont des milieux utilisés pour la détection en laboratoire médical et non pour l’isolation de Map provenant d’échantillons environnementaux (de Juan et al., 2006). Comme mentionné plus haut, Map est une mycobactérie à croissance lente. Son temps de
4.2.2 Dépendance à la mycobactine
génération peut dépasser 20 heures (Lambrecht et al, 1988; Coetsier et al., 1998; Rowe et Grant, 2006). Ce n’est qu’après plusieurs semaines d’incubation, minimum quatre voir même jusqu’à seize semaines, que la multiplication de Map se visualise par l’apparition de petites colonies (ressemblant à un chou-fleur), blanches le plus souvent (Douart et al., 2002; Donaghy et al., 2003; Stabel et al., 2004; Grant, 2005). Tout comme les autres mycobactéries, son grand pourcentage en lipide (60%) contenu dans sa paroi cellulaire, lui confère des propriétés tinctoriales particulières; ce sont des cellules acido-alcoolo-résistantes. La coloration de Ziehl-Neelsen permet d’identifier cette propriété. Dû à la présence importante de lipides dans la paroi, les colorants usuels ne se fixent pas à la cellule (Carbonnelle et al., 2003). La méthode de coloration consiste à chauffer la bactérie avec un mélange de fuchsine6 basique et de phénol. Ainsi, la chaleur et le phénol permettent la pénétration de la fuchsine à l’intérieur de la cellule qui dénature les protéines et altère la membrane cellulaire. Les lavages à l’aide de solutions alcoolo-acides ne décolorent pas ou pratiquement pas les cellules acido-alcoolo-résitantes et restent rouges (Prescott et al., 1995). La paroi riche en lipides donne un avantage de survie aux mycobactéries. Cependant, le prix à payer est la perméabilité des nutriments, ce qui pourrait expliquer en partie sa croissance lente (Domingue et Woody, 1997; Rowe et Grant, 2006). De plus, le passage des petits nutriments hydrophiles au travers de la membrane lipidique ce fait au moyen des porines. Pour des raisons encore mal comprises, l’efficacité de ces porines est 1000 fois moins fonctionnelle que celle des bactéries à Gram négatif (Engelhardt et al., 2002; Faller et al., 2004).
6 Le Grand Dictionnaire : «Colorant dérivé du toluène, utilisé en bactériologie pour colorer le bacille de Koch
(Ziehl) et en association avec la résorcine, en histologie, pour colorer électivement les fibres élastiques (Weigert)» (Office québécois de la langue française, 2007).
Le fer est tout aussi important pour les mycobactéries que pour les autres procaryotes. Sa mitation dans le milieu déclenche une réponse visant à optimiser son absorption. En revanche, les environnements riches en fer incitent les mycobactéries à induire la synthèse
des bactéries acido-résistantes. Map est un organisme auxotrophe pour la mycobactine, c’est-à-dire qu’il est incapable de synthétiser sa propre mycobactine (Lambrecht et Collins, 1992; Harris et Barletta, 2001). Par conséquent, ce composé est ajouté au milieu de culture li
de molécules de stockage du fer. Ce mécanisme procure une protection contre des dommages oxydatifs du fer. Chez les mycobactéries, la prise, le transport et le stockage du fer sont accomplis par le régulateur fer-dépendant, IdeR. IdeR est une protéine essentielle pour la plupart des mycobactéries dont M. tuberculosis. Elle fonctionne comme répresseur des gènes dans l’absorption du fer, mais agit également comme un activateur des gènes de stockage du fer et régulateur de la réponse oxydative. En présence d’oxygène et au pH physiologique, le fer a tendance à former des complexes ferriques insolubles. Pour remédier à ce problème, les mycobactéries sécrètent des chélateurs possédant une haute affinité pour le fer, les sidérophores. Ces molécules sont des métabolites biochimiques extracellulaires solubles dans l’eau fixant le fer III. Ils transportent et rendent le fer plus facilement disponible pour les bactéries (Pelmont, 1993). En condition limitante en fer, les mycobactéries produisent deux types de sidérophores, la mycobactine et l’exochéline. La mycobactine se retrouve chez la plupart des mycobactéries pathogènes sous forme de carboxymycobactine, dont l’acide salicylique est le précurseur. L’exochéline, par contre, est une molécule peptidique qui se retrouve chez les saprophytes. Il n’est pas encore très clair pourquoi les mycobactéries ont besoin, à la fois, de ces deux sidérophores. La mycobactine serait attachée à la paroi cellulaire (Lambrecht et Colins, 1993) et l’exochéline ou la carboxymycobactine serait excrétée dans l’environnement. L’association de la mycobactine avec la cellule pourrait lui permettre de servir de molécule retenant le fer provisoirement pour empêcher l'afflux soudain du fer si ce minéral devenait disponible après une période de pénurie. Les mycobactéries pathogènes, grâce à ce processus, peuvent survivre longtemps dans le corps humain et rendre l’hôte malade. Toutefois, ce mécanisme d’adaptation reste encore peu connu (Rodriguez et Smith, 2003).
pour permettre la culture de Map en laboratoire (Lambrecht et Collins, 1992). Croyant que l’absence de croissance de ce microorganisme était due à un manque dans le milieu, Twort et Ingram, au début du XXe siècle, complétaient leurs milieux avec divers extraits des tissus normaux de bétail, sans pour le moins observer de croissance supplémentaire. Ils en conclurent que cette absence est probablement due à l’absence d’un facteur essentiel et que ce facteur doit se trouver probablement dans un bacille tuberculeux. En ajoutant du bacille de Koch sec et inactif au milieu, il y avait de nouveau la croissance de Map (Twort et Ingram, 1913 cité par Francis et al., 1953).
Il a été démontré que certaines lignées de Map et de M. avium peuvent perdre leur dépendance à la mycobactine (Merkal et Curran, 1974; Matthews et al., 1977; Barclay et Ratledge, 1983; Barclay et al., 1985; Lambrecht et Collins 1992). Ceci coïncide, généralement, avec la production de mycobactine suite à plusieurs sous cultures (Merkal et Curran, 1974; Barclay et Ratledge, 1983). Ceci suggère que cette incapacité à produire la mycobactine serait davantage un processus phénotypique plutôt que la perte systématique d’information génétique via un plasmide par exemple (Barclay et al., 1985). De plus, lorsque les cellules sont en présence d’éthanol, la mycobactine associée à la paroi se dissocie et la dépendance reprend (Lambrecht et Collins, 1992). Cependant, Map n’est pas la seule mycobactérie dépendante de la mycobactine. Une analyse taxonomique de ces mycobactéries a révélé qu’il s’agissait, pour la plupart, des sous-espèces de M. avium (Matthews et al., 1977; McIntyre et Stanford, 1986; Camphausen et al., 1988). Certains facteurs peuvent influencer la dépendance à la mycobactine. La concentration minimale pour la croissance a été établie et se situe environ à 0,006 µM. Pour un optimum de croissance, la concentration doit être de 1,2 µM (1 µg/ml). Si le milieu est riche en fer, la croissance de Map est restaurée (Merkal et McCullough, 1982). En effet, selon les travaux de Lambrecht et Collins (1992) dans un milieu liquide Middlebrook 7H12 Bactec exempt de mycobactine, mais ayant une concentration de fer (citrate d’ammonium ferrique) ≤ 100 µM (5,6 gfer/litre) à un pH de 5,0 la croissance est possible (temps de génération plus d’environ 6,9 jours). Toutefois, à pH 6,8, la croissance est possible seulement lorsqu’il y a une concentration en fer de ≥ 100 µM (5,6 gfer/litre) ce qui correspond à un taux de génération de moins de 3,5 jours (Lambrecht et Collins, 1992). La dépendance à la
des montrent que Map est persistante dans la nature. Les études portant sur la survie de ce microorganisme dans l’environnement sont bien documentées et ne datent pas ap ont débuté avec les travaux de Lovell et al. (1944) où des fèces contaminées avec Map ont été placées dans diverses conditions naturelles mycobactine est une caractéristique importante de Map. On peut donc se demander si Map peut être en mesure de croître dans des aliments riches en fer comme la viande puisque certains types de viandes comme le bœuf, le cheval et l’agneau contiennent une quantité non négligeable de fer. Le Tableau 1 présente la concentration en fer dans différents types de viandes.
4.2.3 Survie dans l’environnement
Plusieurs étu
d’hier. Les études sur la survie de M
telles que le froid, la sécheresse, la pluie, les changements de température et la lumière du soleil. Ces derniers ont pu démontrer que Map peut survivre dans les fèces de 152 à 246 jours dépendamment des conditions (Lovell et al., 1944 cité par Manning et Collins, 2001). D’ailleurs, certaines études ont démontré que Map pouvait aussi survivre dans l’eau. En effet, Map peut survivre entre 6 à 18 mois dans l’eau provenant soit du robinet ou d’étangs (Lovell et al., 1944 et Larsen et al., 1956 cités par Whittington et al., 2005). Une étude réalisée sur une période de deux ans et demi (912 jours), a révélé que Map peut persister jusqu’à 841 jours dans un microcosme se voulant reproduire l’eau des lacs du Royaume-Uni (Pickup et al., 2005). De plus, 192 échantillons d’eau potable non traitée ont été prélevés sur une période d’un an en Ireland du Nord. Dans 8% des échantillons, Map a pu croître sur des milieux gélosés Herrold (Whan et al., 2005). Lorsque de l’eau et des sédiments de barrage sont mélangés dans des cuves de 250 litres et sont placés soit dans un endroit ombragé ou partiellement ombragé, la survie de Map atteint 48 semaines à l’ombre comparé à 36 semaines pour les cuves partiellement ombragées (Whittington et al., 2005).