THÈSE
Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées
Institut de chimie des milieux et matériaux de Poitiers - IC2MP (Diplôme National - Arrêté du 7 août 2006)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Chimie théorique, physique, analytique
Présentée par : Anna Zalineeva
Influence d'une modification par des éléments du groupe p de catalyseurs de palladium nanostructurés sur l'oxydation
électrocatalytique du glycérol
Directeur(s) de Thèse :
Christophe Coutanceau, Stève Baranton Soutenue le 28 août 2014 devant le jury Jury :
Président François Jérôme Directeur de recherche CNRS, Université de Poitiers Rapporteur Pascal Brault Directeur de recherche CNRS, Université d'Orléans Rapporteur Marian Chatenet Professeur des Universités, INP de Grenoble Membre Christophe Coutanceau Professeur des Universités, Université de Poitiers
Membre Stève Baranton Maître de conférences, Université de Poitiers Membre Gregory Jerkiewicz Professor, Queen's University, Canada
Membre Claude Lamy Professeur honoraire, Université de Montpellier 2
Pour citer cette thèse :
Anna Zalineeva. Influence d'une modification par des éléments du groupe p de catalyseurs de palladium
nanostructurés sur l'oxydation électrocatalytique du glycérol [En ligne]. Thèse Chimie théorique, physique,
THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS (Faculté de Sciences Fondamentales et Appliquées)
(Diplôme National – Arrêté du 7 août 2006)
Ecole Doctorale : Sciences pour l’Environnement Gay Lussac
Secteur de Recherche : Chimie Théorique, Physique, Analytique Présentée par :
Anna ZALINEEVA
Influence d’une modification par des éléments du groupe p de
catalyseurs de palladium nanostructurés sur l’oxydation
électrocatalytique du glycérol
Directeur de Thèse : Christophe COUTANCEAU Codirecteur de Thèse : Stève BARANTON
Soutenu le 28 aout 2014 devant la Commission d’Examen
JURY
Pascal BRAULT, Directeur de Recherche CNRS Rapporteur GREMI, UMR CNRS-Université d’Orléans n° 7344
Marian CHATENET, Professeur Rapporteur
LEPMI-Phelma, UMR CNRS-Grenoble INP n°5279
Gregory JERKIEWICZ, Professeur Examinateur
Department of Chemistry, Queen's University
Claude LAMY, Professeur honoraire Examinateur
IEM, UMR CNRS-Université Montpellier 2 n° 5635
François JERÔME, Directeur de Recherche CNRS Examinateur IC2MP, UMR CNRS-Université de Poitiers n°7285
Stève BARANTON, Maître de conférences Examinateur
IC2MP, UMR CNRS-Université de Poitiers n°7285
Christophe COUTANCEAU, Professeur Examinateur
Remerciements
En premier lieu, je souhaite remercier très sincèrement l’ensemble des membres du jury, qui m’ont fait l’honneur d’évaluer ce travail : M. Pascal Brault (Directeur de
Recherche au CNRS, GREMI, Université d’Orléans) et M. Marian Chatenet (Professeur des Universités, LEPMI, Université de Grenoble) en qualité de rapporteurs de la thèse, M. Gregory Jerkiewicz (Professeur, Queen’s University, Kingston, Canada), M. Claude Lamy (Professeur des Universités, IEMM, Université de Montpellier 2), M. François Jérôme (Directeur de Recherche CNRS, IC2MP, Université de Poitiers), M. Stève Baranton (Maître de Conférences, IC2MP, Université de Poitiers) et M. Christophe Coutanceau (Professeur des Universités, IC2MP, Université de Poitiers).
C’est un très grand privilège pour moi d’avoir M. Claude Lamy, Professeur honoraire à l’IEMM et fondateur du laboratoire d’électrocatalyse de l’université de Poitiers, comme examinateur de mon travail de thèse.
En particulier, je suis très reconnaissante à M. Gregory Jerkiewicz pour la collaboration fructueuse sur la partie de nanoparticules à forme et le long déplacement
qu’il a dû effectuer pour assister à la soutenance.
Ma sincère gratitude va à mes directeurs de thèse, M. Christophe Coutanceau et M. Stève Baranton. C’est avec Stève et Christophe que je me suis lancée en
électrochimie. C’est aussi grâce à Stève et Christophe que j’ai appris nombre de techniques de caractérisation électrochimique des matériaux dont j’ai rapidement eu
besoin. Merci pour votre patience et soutien.
Je ne saurais continuer sans remercier la Direction de la Région Poitou-Charentes pour le financement de cette thèse. Je voudrais aussi remercier M. Boniface Kokoh et Mme. Sabrina Biais de l’école doctorale Gay Lussac pour leur soutien au cours de cette thèse.
Un grand merci à Monsieur Teko Napporn pour ses conseils, l’encouragement et les discussions scientifiques.
Je tiens également à remercier M. Plamen Atanassov de m’avoir accepté pour un stage de 9 mois au sein de son laboratoire à l’Université de Nouveau-Mexique. De cette collaboration productive émane toute la partie D de ma thèse et une publication
significative! Merci à tous mes collègues russes et américains, Alexey, Kateryna, Monica, Ulises.
Enfin, j’aimerais adresser un grand merci à tous mes collègues « thésards », en particulier à Jiwei Ma et Patrick Urchaga et à tous les membres de mon ancienne équipe «Électrocatalyse», ainsi que les techniciens et les verriers, Claude pour les cellules électrochimiques artisanales, Stéphane pour les images MET de haute qualité dans un court délai…
Résumé
Les stocks de glycérol à travers le monde augmentent : étant une matière première secondaire, ce produit chimique doit être valorisé. La co-production d’énergie
électrique ou d’hydrogène et de produits chimiques à valeur ajoutée à partir du glycérol peut être réalisée dans des réacteurs électrochimiques. L’oxydation de glycérol est une
réaction complexe qui peut conduire à un grand nombre de produits chimiques et
d’intermédiaires utiles pour l’industrie. Le développement de catalyseurs spécifiques pour orienter les chemins réactionnels de l’électro-oxydation du glycérol vers les
produits désirés est donc un objectif très important.
Des nanoparticules non supportées de palladium à distribution de taille et de forme contrôlées ont été synthétisées par une voie colloïdale et caractérisées par
microscopie électronique et des méthodes électrochimiques afin d’obtenir une
corrélation entre la structure de surface et la réponse électrochimique. Ces électrolyseurs
modèles ont été modifiés par dépôt d’adatomes de bismuth. Puis leur activité et leur
sélectivité vis-à-vis de l’électro-oxydation du glycérol ont été respectivement évaluées par voltammétrie cyclique et spectroscopie infrarouge in situ. Des matériaux plus
proches d’applications industrielles à base de palladium et d’éléments du groupe p (Bi, Sn) ont aussi été par la suite synthétisés et évalués vis-à-vis de l’électrooxydation du glycérol.
Les résultats obtenus montrent clairement l’influence de la composition, de
l’orientation de surface et de la nature de catalyseur sur l’activité et la sélectivité dans la réaction de l’électrooxydation du glycérol.
Abstract: Modification of nanostructured palladium catalysts by p-elements and their influence on electro-oxidation of glycerol.
The worldwide glycerol stocks are increasing; this chemical could be used as a secondary primary raw material. Electric energy or hydrogen and added-value-chemical cogeneration can be performed in electrochemical reactors. Glycerol oxidation is made up of complex pathway reactions that can produce a large number of useful products and valuable fine intermediates. The development of specific catalysts for electro oxidation of glycerol to obtain desired products is a very important goal.
Unsupported palladium nanoparticles with controlled size and shape distribution were synthesized by a colloidal method and characterized by electron microscopy and electrochemical methods to obtain a correlation between the surface structure and the electrochemical response. These model electrocatalysts have been modified by adatoms of bismuth. And their activity and selectivity towards the electro-oxidation of glycerol were respectively evaluated by cyclic voltammetry and in situ infrared spectroscopy. Other materials for industrial applications based on palladium and p elements (Bi, Sn) were also synthesized and evaluated towards the electro-oxidation of glycerol.
The results clearly show the influence of the composition, surface orientation and the nature of the catalyst on activity and selectivity in the reaction of electro-oxidation of glycerol.
1 Sommaire Introduction ... 4 A. Partie bibliographique ... 7 I. Le glycérol ... 7 1. Production ... 7 2. Valorisation du glycérol ... 9
3. Produits d’oxydation du glycérol ... 10
4. Conversion électrochimique du glycérol ... 12
II. Les catalyseurs ... 19
1. Electrooxydation du glycérol sur les catalyseurs monométalliques ... 20
a. Le platine ... 20
b. L’or ... 22
c. Le palladium ... 23
2. Electrooxydation du glycérol sur les catalyseurs bimétalliques ... 25
III. Conclusion et objectifs ... 27
B. Partie expérimentale... 29
I. Nettoyage de la verrerie ... 29
II. Méthodes de synthèses ... 30
1. Méthode colloïdale ... 30
a. Synthèse des nanosphères ... 33
b. Synthèse des nanocubes ... 33
c. Synthèse des nanooctaèdres ... 34
2. Méthode du support sacrificiel... 34
a. Synthèse des catalyseurs PdxBi1-x ... 35
b. Synthèse des catalyseurs PdxSn1-x ... 36
III. Méthodes de caractérisation électrochimiques ... 36
1. Voltammétrie cyclique ... 36
a. Cellule électrochimique ... 37
b. Préparation de l’électrode de travail en or ... 38
2
2. Chronoampérommétrie ... 41
3. Spectroscopie infrarouge in situ... 41
IV. Méthodes de caractérisation physicochimique ... 43
1. Microscopie ... 43
a. Microscopie électronique à transmission (MET) ... 44
b. Microscopie électronique à balayage (MEB) ... 45
2. Porosimétrie à l’azote ... 46
3. Spectroscopie photoélectronique de rayons X (XPS) ... 46
4. Spectroscopie d’absorption atomique (SAA) ... 47
C. Résultats : nanoparticules de palladium non supportées à distributions de tailles et de formes contrôlées ... 48
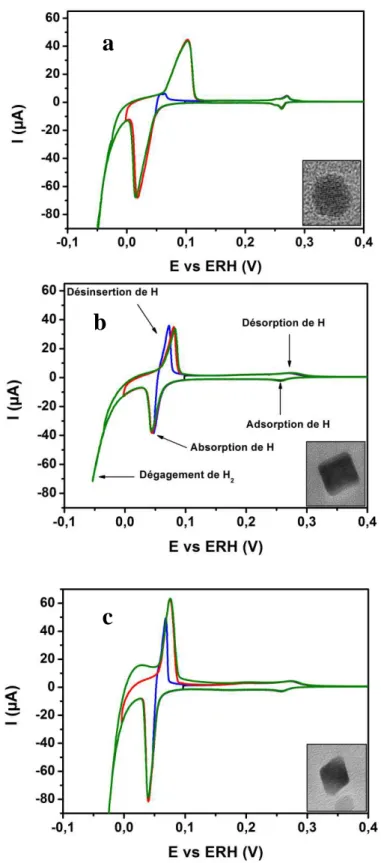
I. Caractérisation par microscopie électronique à transmission des nanoparticules de palladium préparées par méthode colloïdale ... 48
1. Nanoparticules sans orientation préférentielle (nanosphères) ... 49
2. Nanoparticules d’orientation préférentielle (100) ... 50
3. Nanoparticules d’orientation préférentielle (111) ... 51
4. Conclusion ... 53
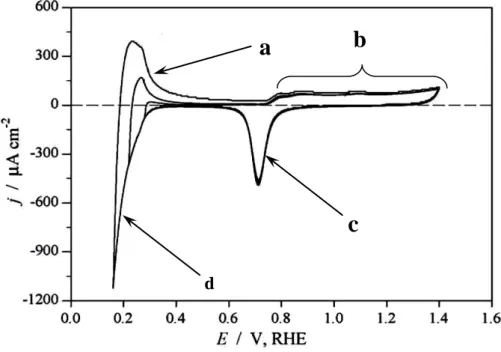
II. Caractérisation électrochimique en milieu acide ... 53
1. Comparaison du comportement électrochimique du palladium massif et du palladium nanostructuré ... 54
2. Séparation des processus dans la zone hydrogène en milieu acide ... 57
3. Détermination de la charge d’adsorption/désorption d’hydrogène en sous potentiel ... 62
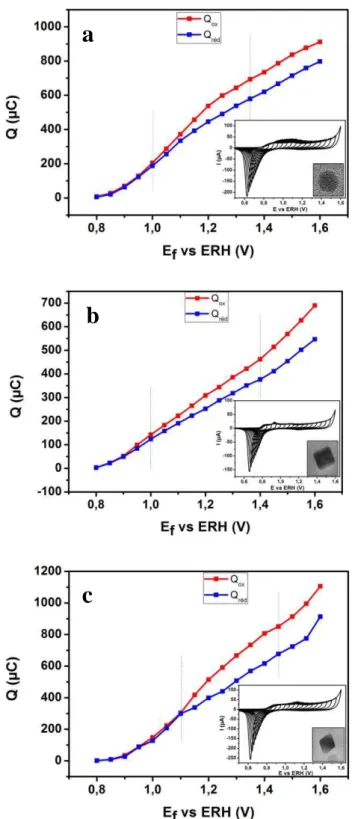
4. Effet de la limite supérieure de potentiel sur la stabilité du palladium en milieu acide ... 65
5 Conclusion ... 69
III. Voltammétrie cyclique en milieu alcalin ... 71
1. Etude en milieu support des nanoparticules de palladium ... 71
2. Modification de surface par le bismuth ... 73
IV. Electrooxydation du glycérol en milieu alcalin ... 79
3
2. Electrooxydation du glycérol sur les nanoparticules de palladium modifiée par
adsorption spontanée de bismuth ... 82
V. Etude infrarouge in situ ... 88
1. Nanoparticules de palladium pur ... 88
2. Nanoparticules de palladium modifiées par le bismuth ... 96
VI. Conclusion ... 103
D. Résultats : nanoparticules auto-supportées à base de palladium modifié par des éléments du groupe p ... 107
I. Catalyseurs auto-supportés PdxBi1-x ... 107
1. Caractérisation physicochimique ... 107
2. Caractérisation électrochimique ... 111
3. Electrooxydation du glycérol sur les catalyseurs PdxBi1-x auto-supportés .... 113
4. Etude infrarouge in situde l’oxydation du glycérol sur les catalyseurs PdxBi1-x autosupportés ... 118
5. Conclusion sur l’activité/sélectivité de PdxBi1-x ... 122
II. Catalyseurs auto-supportés PdxSn1-x ... 125
1. Caractérisation physicochimique ... 126
2. Caractérisation électrochimique des catalyseurs PdxSn1-x ... 130
3. Electrooxydation du glycérol sur les catalyseurs auto-supportés PdxSn1-x .... 131
4. Etude infrarouge in situde l’oxydation du glycérol sur le catalyseur PdSn autosupporté ... 133
5. Conclusion sur l’activité/sélectivité de PdSn vis-à-vis de l’oxydation du glycérol ... 135
III. Evaluation de l’activité des catalyseurs PdxBi1-x et PdxSn1-x vis-à-vis de l’oxydation autres alcools ... 137
E. Conclusion générale et perspectives ... 144
Références ... 151
4
Introduction
Chaque année la demande énergétique de la société augmente de façon impressionnante, alors que les ressources fossiles sont limitées. L’épuisement des réserves pétrolières, mais également les problèmes environnementaux engendrés par
l’exploitation du carbone fossile (émission de gaz à effet de serre) ont suscité un intérêt
croissant pour les matières premières renouvelables issues de la biomasse.
Dans le domaine de l’énergie, la biomasse représente l’ensemble des matières organiques d’origine végétale, animale ou fongique pouvant devenir une source d’énergie par combustion ou méthanisation. La valorisation de la biomasse est un sujet d’actualité de par son intérêt économique. En effet, les composés issus de la biomasse
ont souvent une faible valeur ajoutée et leur conversion par les méthodes chimiques permet d’obtenir des produits à haute valeur ajoutée. Dans ce contexte, l’équipe « Catalyse et milieux non-conventionnels » de l’Institut de Chimie des Milieux et Matériaux de Poitiers (IC2MP, UMR CNRS-Université de Poitiers 7285) est très fortement impliquée dans le développement de la chimie verte ou durable. Elle
développe d’ailleurs des recherches dans les thématiques suivantes: dépollution,
énergie, valorisation de la biomasse pour la chimie fine ou de spécialité. Pour cela, elle entend développer des éco-procédés innovants s’appuyant sur la catalyse hétérogène et
l’activation non thermique des réactions chimiques. La conversion électrocatalytique de
la biomasse, notamment de polyols, au sein de réacteurs électrochimiques fait bien évidemment partie des priorités de recherche.
Le glycérol et bien d’autres molécules encore, peuvent être extraits de la biomasse. Le glycérol est une molécule produite aujourd’hui en grandes quantités de différentes façons: productions de biocarburants (bioéthanol et biogazole1,2) et d’acides gras. Le bioéthanol est principalement produit et consommé au Brésil et en Amérique du Nord alors que l’Europe est un leader mondial dans la production de biogazole. Les biocarburants sont actuellement plus chers que les combustibles traditionnels. La production européenne de biogazole s’élève actuellement à plus de 9 millions de tonnes
5
par an, la quantité annuelle actuelle de glycérine provenant de la production de biogazole s’élève à environ 2,4 millions de tonnes et continuera à augmenter proportionnellement dans le monde entier. En effet, pour 9 kg de biogazole produits, environ 1 kg de glycérol brut est formé comme sous-produit3. L'augmentation de la production de biogazole en Europe conduira à une augmentation des stocks de glycérol brut. Une utilisation du glycérol brut ou sa conversion pour obtenir des produits spécifiques pourrait conduire à la réduction du coût de production du biogazole et à
l’augmentation de sa rentabilité sans nécessité de soutien financier par les états ou la
commission européenne. Dans ce cas, le glycérol apparaîtrait comme une matière première secondaire plutôt que comme un déchet de l’industrie des agro-carburants. En particulier, il a été démontré que tous les produits d’oxydation du glycérol, sans rupture de la liaison carbone-carbone, étaient des produits chimiques valorisables,4,5 quelle que soit la positon de la fonction alcool oxydée.
La conversion du glycérol en composés oxygénés à haute valeur ajoutée peut être effectuée dans des réacteurs électrochimiques (électrolyseurs ou piles à combustible). Ces procédés de synthèse montrent de nombreux avantages, parmi lesquels: les réactions sont effectuées dans des milieux aqueux à basse température et à pression atmosphérique, l’activité et la sélectivité de la réaction peuvent être contrôlées par le potentiel d’électrode, la valeur du pH de l’électrolyte, la concentration du glycérol, ainsi que par la formulation des catalyseurs1,6-9.
La majorité des électrocatalyseurs anodiques développés pour l’oxydation de molécules organiques est à base du platine10,11. Le platine est en effet reconnu pour être le matériau le plus actif et le plus stable en milieu acide pour ce type de réaction. En même temps, il est aussi connu que les cinétiques des réactions anodiques et cathodiques sont plus élevées en milieux alcalins qu’en milieux acides12,13. De plus, la stabilité des métaux non-nobles ou moins nobles que le platine est accrue en milieu alcalin. C’est pourquoi, dans les piles à combustible alcalines, des matériaux catalytiques alternatifs au platine peuvent être utilisés dans les deux électrodes, la cathode14,15 et l’anode16,17. Des catalyseurs nanostructurés à base de palladium pur ou
6
d’alliages de palladium avec des métaux de transition ou des éléments du groupe p ont en effet déjà montré de fortes activités et des stabilités accrues en milieu alcalin, et peuvent être considérés comme des substituts possibles du platine, intéressants d’un
point de vue économique pour l’oxydation des alcools18-21
.
Les travaux de thèse décrits dans ce manuscrit visent à présenter une recherche pertinente et de nouveaux résultats concernant des matériaux catalytiques pour la
valorisation de déchets issus de la biomasse, en l’occurrence le glycérol.
Le procédé dans lequel s’inscrivent les développements issus de cette thèse
s’oriente vers les réacteurs électrochimiques. Le matériau catalytique de base sera le
palladium, qui possède en milieu alcalin des caractéristiques catalytiques intéressantes pour les réactions envisagées et qui de plus présente une disponibilité sur la planète plus importante que celle du platine et un coût trois à quatre fois inférieurs. Les réactions
d’oxydation électrocatalytiques d’alcools étant des réactions de surface, il est dans un
premier temps très important de caractériser ces surfaces de palladium et de déterminer leur activité et leur sélectivité. Ainsi, le comportement électrochimique du palladium nanostructuré sera étudié dans un premier temps sur des nanoparticules modèles de palladium, à distributions de taille et de formes contrôlées, puis, dans un second temps, des matériaux catalytiques réels, c’est-à-dire dont la production peut aisément être industrialisée en termes de changement d’échelle de production, feront eux aussi l’objet d’une étude détaillée. Ces matériaux à structure hiérarchiquement contrôlée à base de palladium seront étudiés pour l’électrooxydation de différents alcools d’intérêt énergétique (méthanol, éthanol, isopropanol et glycérol), avec une attention toute particulière pour le glycérol. Pour chaque type de catalyseurs, les effets sur l’activité et la sélectivité vis-à-vis de la réaction d’électrooxydation du glycérol de la modification de la surface de palladium par ajout d’atomes d’un élément du groupe p seront examinés par des méthodes électrochimiques et des méthodes de spectroscopie infrarouge in situ.
7
A. Partie bibliographique
I.
Le glycérol
1. Production
Le glycérol (propane-1,2,3-triol) ou glycérine est un composé organique naturel de formule semi-développée: CH2OH-CHOH-CH2OH. Il est intéressant de par son
caractère renouvelable et son abondance. Le glycérol est un produit non toxique, non dangereux, non volatile, biodégradable et recyclable.
Le glycérol peut être obtenu par synthèse à partir du propylène et par fermentation à partir des sucres. Industriellement, le glycérol est produit à partir des huiles végétales lors de la formation d’acide gras, de savon ou de biogazole (100 kg de glycérol sont produits pour 1 tonne de savon22 ou de biogazole23) selon le schéma réactionnel présenté sur la Figure 1.
En principe, toutes les huiles peuvent être utilisées, ainsi que les graisses animales3,24, cependant, certaines huiles sont privilégiées. Ainsi, en France, les producteurs utilisent le plus souvent de l'huile de colza, tandis qu'aux États-Unis, les fabricants préfèrent le soja et dans une moindre mesure le canola. Les États-Unis sont par ailleurs les plus grands producteurs de soja devant le Brésil. Le glycérol produit industriellement possède généralement une pureté de l’ordre de 75-90%; l’eau et des sels résiduels (provenant des catalyseurs) sont les principaux contaminants du glycérol25,26. Pour des études de l’oxydation électrocatalytique du glycérol, la pureté de ce dernier était ≥99% (GC).
Dans le cas de l’industrie des biogazoles, le glycérol est le résidu non valorisé des réactions de transestérification utilisées dans les procédés de production des esters méthyliques d’huile végétales (EMHV) ajouté à raison de 5% au gazole.
8
Figure 1. Production industrielle conduisant au glycérol comme sous-produit.
Les objectifs en termes d’utilisation de biogazole sont très ambitieux: en 2003, l’Union Européenne a adopté la directive 2003/30/EC pour la promotion de l’utilisation
de biocarburants pour les transports1. Cette directive "biocarburants" pressait les états membres d’établir des objectifs précis pour imposer une proportion minimum de biocarburants sur le marché. Cet objectif a été placé à 2 % en 2005 et à 5,75 % en 2010. Puis, en 2007, la commission européenne a proposé un paquet “integrated energy and
climate change” supporté par le parlement européen, qui a été finalement adopté par les
chefs d’états de l’Union européenne au cours du conseil européen du 8-9 mars 2007, où il a été visé un minimum de 10% de biocarburants dans les essences et gazoles à
l’horizon 20202
. Les mêmes objectifs ont été édictés aux USA par le DOE.
De nos jours, le marché global des biocarburants consiste approximativement en 85% de bioéthanol et 15% de biogazole. Le bioéthanol est principalement produit et consommé au Brésil et en Amérique du nord. D’un autre côté, l’Europe est le leader
1
http://ec.europa.eu/energy/res/legislation/doc/biofuels/en_final.pdf
2
9
mondial dans la production du biogazole et ce carburant représente environ 3/4 du marché européen des biocarburants. Cependant, les biocarburants sont toujours plus chers que les carburants traditionnels, et en conséquence les états membres de l’union
européenne ont eu la permission d’appliquer une exemption totale ou partielle de taxe
sur les biocarburants. De plus, en rappelant que pour 9 kg de biogazole produit environ 1 kg de glycérol brut est formé, l’augmentation de la production de biogazole en Europe conduira à l’augmentation des stocks de glycérine. Par conséquent, l’utilisation effective ou la conversion du glycérol en produits pour la chimie fine et/ou de spécialité pourrait conduire à une réduction des coûts de production du biogazole.
2. Valorisation du glycérol
La valorisation du glycérol est généralement effectuée par des réactions de la chimie organique. Ces réactions sont effectuées soit par catalyse hétérogène27,28 ou homogène, soit à l'aide de biocatalyseur4. Des produits intéressants ont ainsi été obtenus à partir du glycérol: des monoglycérides, des polyglycérols, des esters de polyglycérols
(utilisés comme émulsifiants dans l’industrie agroalimentaire mais également comme
agents tensioactifs non ioniques en cosmétiques), des éthers éthyliques du glycérol (additifs de la coupe gazole), d’autres éthers (provenant de la réaction de télomérisation avec le butadiène), le carbonate de glycérol (intermédiaire dans la formation de polyéthers aliphatiques, solvants «verts»), le propane-1,3-diol, le glycéraldéhyde,
l’acide glycérique, l’acroléine, des aminoacides (surfactants cationiques), le glycidol
(intermédiaire de synthèse), des esters carbamiques soufrés ou non (à effet antifongique) utilisables pour les espèces végétales cultivées pour la production de biocarburants, de nouveaux analogues nucléosidiques à activité antivirale, etc. Cependant, l’utilisation du glycérol en chimie organique est relativement difficile à cause de la présence de trois groupes hydroxyles dont les pKa sont similaires (14,32 et 14,68)29,30 conduisant à la formation parasite dedifférents produits. De plus, la viscosité importante du glycérol pose des problèmes de transfert dematière, et enfin, le fort caractère hydrophile de la molécule de glycérol rend difficile son interaction avec la plupart des composés organiques.
10
D’un autre côté, les produits d’oxydation du glycérol sans rupture de la liaison
C-C sont des intermédiaires utiles pour la chimie fine ou des produits à valeur ajoutée, mais malheureusement ils n’ont pas encore vraiment eu d’applications industrielles à grande échelle en raison du coût et de la dangerosité des processus de production actuels4,31-35. Les réactions d'oxydation du glycérol sont principalement réalisées en présence d’oxydants puissants en quantité stœchiométrique (permanganate de potassium, acide nitrique ou encore acide chromique). Ces voies de synthèse ont aussi le défaut de ne pas être sélectives et entraînent la formation de nombreux sous-produits indésirables31,36 provenant de la rupture des liaisons carbone-carbone. Des procédés enzymatiques ou microbiens ont aussi été utilisés et ont aidé à améliorer la sélectivité de
la réaction d’oxydation du glycérol, notamment vers le dihydroxyacétone, mais le
procédé reste couteux du fait de la très lente cinétique de réaction et de la difficulté à séparer les produits de réaction du milieu de culture.
3. Produits d’oxydation du glycérol
Le glycérol possède une grande réactivité chimique grâce à la présence des trois groupements hydroxyles: chacun des atomes de carbone portant une fonction alcool est potentiellement activé et peut subir des réactions d’oxydation. Les chemins réactionnels les plus importants pour la conversion du glycérol par oxydation sont présentés sur le Figure 2. Ce schéma réactionnel montre deux voies principales de réaction. La première consiste en l’oxydation d’un atome de carbone portant un groupement «alcool primaire» (voie de gauche), alors que la seconde consiste en l’oxydation du carbone portant un groupement «alcool secondaire» (voie droite).
En pratique, toutes les espèces oxygénées obtenues par oxydation sélective du glycérol sont commercialement utilisables37. Par exemple, le 1,3-dihydroxyacétone (DHA) est un des produits chimiques importants de l’oxydation du glycérol d’un point de vue économique car il est utilisé dans de nombreuses industries, en particulier en cosmétique comme agent bronzant38 et sert aussi de syntone élémentaire versatile pour la synthèse organique et pour de nombreux composés de chimie fine39,40 qui trouveront
11
peut être obtenu par la conversion microbienne du glycérol41 mais le procédé
d’extraction de DHA est complexe et couteux ce qui limite son développement à l’échelle industrielle31,36
. L’acide glycérique, l’acide tartronique et l’acide mésoxalique sont principalement convertis en polymères ou émulsifiants biodégradables4. Mais ces produits pourraient également servir comme agents complexant les métaux lourds pour
le contrôle de la pollution de l’eau31
, ainsi que pour la synthèse de composés biocompatibles utilisés dans l’industrie des détergents ou comme additifs alimentaires.
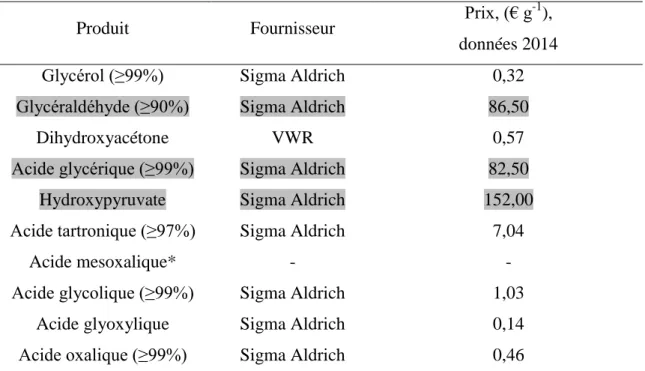
En fait, comme l’indique le Tableau 1 dans lequel les prix des divers composés sont
indiqués par unité de masse, les produits d’oxydation du glycérol possèdent tous une valeur plus élevée que celle de glycérol, parfois dans un rapport 500 (dans le cas de
l’hydroxypyruvate).
Les couts relatifs des différents produits formés par oxydation du glycérol en milieu alcalin sont présentés dans le Tableau 1.
Produit Fournisseur Prix, (€ g
-1
), données 2014
Glycérol (≥99%) Sigma Aldrich 0,32
Glycéraldéhyde (≥90%) Sigma Aldrich 86,50
Dihydroxyacétone VWR 0,57
Acide glycérique (≥99%) Sigma Aldrich 82,50
Hydroxypyruvate Sigma Aldrich 152,00
Acide tartronique (≥97%) Sigma Aldrich 7,04
Acide mesoxalique* - -
Acide glycolique (≥99%) Sigma Aldrich 1,03
Acide glyoxylique Sigma Aldrich 0,14
Acide oxalique (≥99%) Sigma Aldrich 0,46
Tableau 1 Produits d’oxydation du glycérol en milieu alcalin et leurs couts relatifs.
* A noter que le coût de mésoxalate n’est pas renseigné par les fournisseurs commerciaux et dépend de la quantité commandée.
12
Figure 2 Produits principaux de l’oxydation du glycérol4. 4. Conversion électrochimique du glycérol
La conversion électrochimique du glycérol peut être réalisée en milieu acide ou en milieu alcalin. Le choix du milieu sera principalement orienté par le coût de matériau nécessaire pour le fonctionnement du système.
Les piles à combustible et les électrolyseurs avec une membrane conductrice de protons fonctionnent généralement avec des électrodes à base de métaux nobles (le platine, le palladium, le ruthénium, les oxydes d'iridium, etc.). Le platine, en effet, reste encore un catalyseur irremplaçable en milieu acide et sert de référence en milieu alcalin42,43 pour certaines réactions électrochimiques comme, par exemple, la réduction
de l’eau et l’oxydation des alcools. En milieu acide, ce métal est le seul capable d’initier
13
alcools procédant de la rupture des liaisons C-H8,9,44. De plus, peu de métaux sont stables en milieux acide; même le palladium qui fait partie de la famille du platine et est souvent considéré comme un métal noble, ne possède pas une stabilité suffisante en milieu acide et subit des phonèmes de corrosion et de dissolution pour des potentiels
d’électrodes relativement faibles.
En milieu alcalin, en revanche, des métaux moins nobles que le platine, et aussi moins onéreux et plus disponibles, peuvent être utilisés comme matériaux catalytiques pour activer non seulement les réactions d’oxydation d’alcools à l’anode des réacteurs électrochimiques, mais aussi les réactions de réduction de l’oxygène et de l’eau à la cathode des réacteurs électrochimiques. Un autre avantage du milieu alcalin sur le milieu acide se situe au niveau des produits de réaction. En effet en milieu acide la rupture de la liaison carbone-carbone est plus aisée et favorise la formation des composés à un ou deux atomes de carbone (acide formique, acide oxalique, acide
glycolique) qui possèdent une valeur ajoutée plus faible que les produits d’oxydation à
trois atomes de carbone formés préférentiellement en milieu alcalin. En milieu alcalin la dissociation du glycérol lors de son adsorption (la rupture de la liaison C-C) est limitée et le glycéraldéhyde et/ou le dihydroxyacétone deviennent les intermédiaires/produits de réaction majoritaires9.
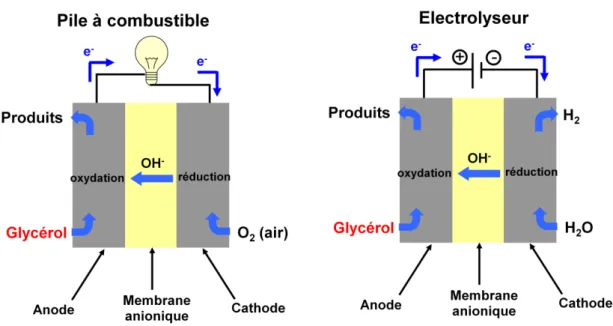
Les réacteurs électrochimiques peuvent se présenter sous deux configurations différentes: la configuration «pile à combustible» et la configuration «électrolyseur». La Figure 3 présente les schémas de principe de ces deux configurations de réacteurs électrochimiques dans le cas de l’oxydation complète du glycérol en carbonate en milieu alcalin. La configuration «pile à combustible» permet d’obtenir simultanément des produits chimiques à haute valeur ajoutée (dans le cas de l’oxydation contrôlée et
ménagée du glycérol à l’anode) et de l’énergie électrique par la réaction d’oxydation
directe du glycérol à l’anode couplée à la réaction de réduction de l’oxygène à la cathode. Dans le cas de la configuration «électrolyseur», des produits chimiques à haute valeur ajoutée sont obtenus en même temps que des molécules d’hydrogène par oxydation directe du glycérol à l’anode et la réduction de l’eau à la cathode.
14
Figure 3 Principe de fonctionnement: d’une pile à combustible à glycérol en milieu alcalin et d’un
électrolyseur.
De nos jours, la production massive d’hydrogène est principalement réalisée à
partir de composés fossiles par reformage d’hydrocarbures. Bien que ce procédé soit
actuellement le moins onéreux, il ne peut pas être considéré comme un procédé de la chimie durable et de plus, l’hydrogène produit contient une quantité significative de
monoxyde de carbone (CO) qui n’autorise pas son utilisation directe au sein des piles à
combustible à basse température. Pour ce faire, il est nécessaire de purifier l’hydrogène
par l’intermédiaire de réactions de types « water gas shift », oxydation préférentielle,
etc., énergivores qui compliquent le procédé et augmentent le coût de production de
l’hydrogène. L’électrolyse de l’eau est un autre moyen de produire de l’hydrogène
propre. Dans ce cas, il est intéressant de comparer d’un point de vue thermodynamique la production électrochimique d’hydrogène par électrolyse de l’eau et par l’électrolyse du glycérol. Les valeurs thermodynamiques pour l’électrolyse de l’eau et du glycérol sont présentées ci-dessous.
H2O → 1/2 O2 + 2 H+ + 2 e− (1) ΔΗ0
r = 286 kJ.mol-1 ΔG0r = 237 kJ.mol-1
15
ΔΗ0
r = 3ΔΗ0f (CO2)gaz - 3ΔΗ0f (H2O)liq - ΔΗ0f (Glycérol)liq = 3(-393,5) + 3285,8 +
665,9 = 342,8 kJ.mol-1 , ΔG0r = 3 (-394,4) + 3237,2 + 475,5 = 3,9 kJ.mol-1
Les valeurs d’enthalpie de réaction montrent la nécessité d’un apport d’énergie
extérieure, fournie par un courant électrique. La tension théorique minimale standard U0 pour activer la réaction peut être calculée à partir de ΔG0r : U0 = ΔG0r/nF, avec n le nombre d’électrons impliqués dans la réaction et F la constante de Faraday. Ainsi dans le cas de l’électrolyse de l’eau, une tension minimale de 1,23 V (n=2)5
doit être appliquée dans les conditions standards contre 0,003 V (n=14) dans le cas du glycérol. Toutefois, il faut ajouter à ces valeurs théoriques, une surtension nécessaire pour obtenir une cinétique suffisante. Les données thermodynamiques montrent, donc, que
l’utilisation d’alcools, et notamment du glycérol45
à l’anode d’un électrolyseur pourrait être énergétiquement plus intéressante que l’oxydation de l’eau pour la production d'hydrogène. L’énergie stockée dans l’hydrogène peut ensuite être récupéré grâce à une pile à combustible H2/O246.
Les piles à combustible ont un grand potentiel en tant que source d’alimentation pour les appareils électroniques portables. Bien que l’hydrogène soit un combustible qui
permet d’atteindre un rendement électrique supérieur, sa production et sa purification
restent encore problématiques46-48. En effet, bien que l’hydrogène soit l’élément chimique le plus abondant dans l’univers, il n’existe pas (ou de manière anecdotique) sous la forme de molécules de dihydrogène sur la planète; il est en effet quasiment exclusivement combiné soit avec du carbone (les hydrocarbures) soit avec de l’oxygène
(l’eau). L’utilisation de combustibles liquides, tels que des alcools et des polyols peut
alors être avantageuse49,50. Les nouvelles technologies de piles à combustible alcalines (AFC) sont en cours de développement. Cependant, il est plus intéressant d’un point de
vue énergétique d’utiliser l’hydrogène fournit par une cellule d’électrolyse dans laquelle un alcool est oxydé à l’anode plutôt que d’utiliser directement l’alcool comme
combustible dans la pile (Figure 4).
16
Figure 4 Comparaison des caractéristiques électriques E(j) représentatives d’une loi cinétique de
Butter–Volmer pour l’oxydation de l’hydrogène, du glycérol, de l’eau, la réduction de l’oxygène et de des protons pour une densité de courant de 1 A.cm-2.
Maintenant, la question peut être : quel est le meilleur alcool pour ce type de procédé? Le méthanol présente généralement une assez bonne réactivité pour son oxydation totale en CO2, produisant 6 moles d’électrons par mole de méthanol. Mais c’est un composé toxique qui de plus possède une forte affinité avec l’eau, ce qui peut
conduire à des risques pour la santé et l’environnement. De plus, le méthanol est principalement produit à partir de l’oxydation partielle du gaz naturel dans des procédés industriels. L’éthanol est moins toxique et plus attrayant parce qu’il peut être produit à partir de la fermentation du sucre issu des céréales ou de la betterave. Mais, en raison de la difficulté de la rupture de la liaison C-C à basse température, les principaux produits de réaction de l’oxydation de l’éthanol sont l’acétaldéhyde et l’acide acétique (en milieu acide) ou l’acétate (en milieu alcalin)51, ce qui conduit à un rendement faible en configuration pile à combustible (entre 17 et 33 % de l’énergie théorique) et à la production des composés à faible valeur ajoutée en configuration «électrolyseur». Accessoirement, l’acétaldéhyde est suspecté d’être toxique et cancérigène (fiche de
toxicité n°120 de l’INRS). 0,2 0,4 0,6 0,8 1,0 - 0,2 - 0,4 - 0,6 - 0,8 - 1,0 j / A cm-2 E vs ERH/V 0,4 0,8 1,2 1,6 2,0 O2H2O 1,23 H2H+ UFC(O2/H2) = 0,65 V H+H2 H2OO2 UEC =1,8 - 2,0V
UFC(O2/H2)/ Ualcool EC
Ualcool EC= 0,8V17
L’utilisation des polyols comme combustible peut être une alternative
intéressante. Une relativement bonne réactivité de l’éthylène glycol et du glycérol (6 mW.cm-2 et 10 mW.cm-2 respectivement) a été démontrée en milieu alcalin par Matsuoka52 dans une SAMFC équipée d’une électrode à base de PtRu. Demarconnay53 a obtenu une performance proche de 30 mW.cm-2 avec de l'éthylène glycol 2,0 M à température ambiante dans une SAMFC (Solid Alkaline Membrane Fuel Cell) munie d’ une anode Pt0,45Pd0,45Bi0,1/C contre 22 mW.cm-2 avec une anode Pt0,9Bi0,1/C dans les
même conditions expérimentales. Ilie a obtenu jusqu’à 25 mW.cm-2 dans une pile à combustible avec un catalyseur Pt/C pour la cathode et une électrode à base de Pt0,9Bi0,1/C comme anode17. La possibilité de cogénération de l’énergie et des produits
chimiques par l’oxydation électrochimique du glycérol a été mentionnée en 2010 par Simoes50. Plus tard, Zhang a étudié l’oxydation électrocatalytique du glycérol pour la cogénération d’électricité et de produits chimiques à haute valeur ajoutée sur un catalyseur classique de Pt/C à l’anode d’une pile à combustible à membrane conductrice
d’anions (AEMFC)54
. De plus, les polyols tels que l’éthylène glycol et le glycérol sont moins toxiques que le méthanol et présentent une densité d’énergie théorique relativement élevée (respectivement, 5,2 et 5,0 kWh.kg-1 pour l’éthylène glycol et le glycérol, contre 6,1 et 8,0 kWh.kg-1 pour le méthanol et l’éyhanol, respectivement49). Dans les polyols, chaque atome de carbone porte un groupement alcool et en conséquence leur oxydation partielle en oxalate et mesoxalate (selon les réactions 3 et 4), sans rupture de la liaison C-C et production de CO2, implique 8 et 10 électrons
échangés pour l’éthylène glycol et le glycérol, contre 10 et 14 électrons, respectivement,
pour l’oxydation complète en carbonate (réactions 5 et 6).
CH2OH–CH2OH + 10 OH−→ COO−–COO− + 8 H2O + 8e− (3)
CH2OH–CHOH–CH2OH + 12 OH−→ COO−–CO–COO− +10 H2O + 10 e− (4)
CH2OH–CH2OH + 14 OH−→ 2 CO32- + 10 H2O + 10 e− (5)
CH2OH–CHOH–CH2OH + 20 OH−→ 3 CO32- + 14 H2O + 14 e− (6) Cependant, l’éthylène glycol est un produit issu de l’industrie pétrochimique et provient principalement de l’oxydation partielle de l’éthylène, tandis que le glycérol,
18
comme il a été dit précédemment, est un sous-produit encore peu valorisé de l’industrie des agro-carburants. Il peut à ce titre être considéré comme une matière première secondaire issue de la biomasse.
Dans une pile à combustible (PEMFC = proton exchange membrane fuel cell) ou un électrolyseur (PEMEC = proton exchange membrane electrolysis cell) acide à alcool directe, les protons traversent la membrane conductrice protonique de l’anode où les alcools sont oxydés vers la cathode, pour participer à la réaction de réduction de
l’oxygène (mode PEMFC) ou être réduits en hydrogène moléculaire (mode PEMEC).
Au contraire, dans les piles à combustible (SAMFCs) et les électrolyseurs (SAMECs) à membrane alcaline solide, ce sont les ions hydroxyles qui traversent la membrane conductrice d’anions de la cathode où les réactions de réduction de l’oxygène ou de
l’eau se produisent selon les équations 7 ou 8, vers l’anode où le glycérol est oxydé
selon, par exemple, les équations 9 et 10 conduisant à la production de glycéraldéhyde et de glycérate. Réactions de réduction: 1/2 O2 + H2O + 2 e−→ 2 OH− (7) 2 H2O + 2 e−→ 2 OH− + H2 (8) Réactions d’oxydation: CH2OH–CHOH–CH2OH + 2 OH−→ CH2OH–CHOH–CHO + 2 H2O + 2 e− (9) CH2OH–CHOH–CH2OH + 5 OH− → CH2OH–CHOH–COO- + 4 H2O + 4 e− (10)
Ainsi, les réactions complètes dans le cas d’une SAMFCs produisant, par exemple, du glycéraldéhyde, du glycérate et du carbonate sont les suivantes:
CH2OH–CHOH–CH2OH + 1/2 O2 → CH2OH–CHOH–CHO + H2O (11)
CH2OH–CHOH–CH2OH + O2 + OH− → CH2OH–CHOH–COO- + 2 H2O (12)
CH2OH–CHOH–CH2OH + 7/2 O2 + 6 OH− → 3 CO32- + 7 H2O (13)
19
CH2OH–CHOH–CH2OH → CH2OH–CHOH–CHO + H2 (14)
CH2OH–CHOH–CH2OH + OH−→ CH2OH–CHOH–COO- + 2 H2 (15)
CH2OH–CHOH–CH2OH + 6 OH−→ 3 CO32- + 7 H2 (16) L’oxydation des polyols à l’anode d’une pile à combustible ou d’un
électrolyseur peut donc être réalisée relativement facilement, permettant la production
d’électricité pour l’alimentation directe d’appareils électroniques de faible puissance ou d’hydrogène propre pour alimenter une pile de plus forte puissance ou pour la chimie.
Cependant, pour rendre de tels systèmes intéressants pour d’éventuelles applications, les performances globales électriques des réacteurs électrochimiques doivent être améliorées. Cela permettrait non seulement de concevoir des générateurs électriques avec une puissance plus élevée, mais également d’augmenter le rendement en produits à haute valeur ajoutée (dont l’hydrogène). Il est nécessaire pour cela d’augmenter les vitesses de réaction (activité) et d’orienter les chemins réactionnels vers les produits désirés (sélectivité), c’est le rôle de l’électrocatalyse. Pour cela, le développement
d’électrocatalyseurs spécifiques aux réactions envisagées et aux milieux considérés doit
être effectué.
II.
Les catalyseurs
La nature, la structure et la composition des catalyseurs mono- et multi-métalliques ont des effets importants sur le chemin réactionnel d’électrooxydation du glycérol, et par conséquent sur leur activité (production d’énergie ou de dihydrogène) et sélectivité (en ce qui concerne les produits de réaction d’oxydation)50. En effet,
l’électrooxydation du glycérol peut se produire par l’intermédiaire de deux chemins
réactionnels selon que les fonctions « alcool » primaires ou la fonction « alcool » secondaire soient préférentiellement attaquées lors de la première étape du processus, et conduire à plusieurs types à produits selon les schémas réactionnels suivants:
20
Figure 5 Les schémas réactionnels de l’électrooxydation du glycérol.
Le platine est le matériau de référence pour l’électrooxydation des alcools en
milieu acide, comme en milieu basique. En milieu acide, ce métal est considéré comme le seul à pouvoir initier les premières étapes de l’adsorption des alcools, à savoir la rupture de la liaison C-H44. En milieu alcalin, d’autres métaux ont été proposés comme candidats pour l’oxydation électrocatalytique des alcools en général, et du glycérol en particulier: le palladium et l’or55. Le palladium, qui est moins noble que le platine,
gagne en stabilité en milieu alcalin. L’or est inactif en milieu acide pour l’oxydation des
alcools56,57 mais il le devient en milieu alcalin en raison de sa capacité à adsorber des espèces hydroxyles à sa surface à des potentiels relativement bas (0,4 V vs. ERH)56.
1. Electrooxydation du glycérol sur les catalyseurs monométalliques
a. Le platine
Les effets du potentiel d’électrode et du pH du milieu réactionnel sur l’oxydation
électrocatalytique du glycérol sur des électrodes de platine ont été étudiés dans les années 1990 par Roquet et al.9. Ces auteurs ont analysé les produits de réaction par chromatographie liquide pendant des expériences de chronoampérométrie à potentiels contrôlés. Ils trouvèrent en particulier que la sélectivité vers la production de glycéraldéhyde dépendait fortement du potentiel d’électrode et du pH de l’électrolyte.
Rupture de la iaison C-C : produits en C2 et C1 -2 e --2 e- -4 e --2 e --2 e --4 e --4 e -glyceraldéhyde glycérol dihydroxyacétone glycérate tartronate mésoxalate hydroxypyruvate
21
En milieu acide, l’oxydation dissociative du glycérol conduisait aux acides
formique, oxalique et glycolique lorsque le potentiel était fixé dans la zone de formation des oxydes de surface sur le platine. En revanche, lorsque le potentiel d’électrode était fixé avant le début de la formation des oxydes de surface sur le platine, la sélectivité vers la formation de glycéraldéhyde devenait très élevée.
En milieu alcalin, très peu de produits de dissociation, provenant de la rupture de la liaison C-C, ont été détectés, et ce indépendamment de la valeur du potentiel
appliquée à l’électrode. En revanche, la vitesse de conversion du glycérol était
sensiblement augmentée en comparaison avec le milieu acide.
De récentes études de l’oxydation du glycérol par spectroscopie infrarouge réalisées par Fernandes Gomes et Tremiliosi-Filho sur du platine polycrystallin indiquait que la sélectivité de la réaction ne semblait pas dépendre de la valeur du pH du milieu; les produits principaux de réaction étant les acides tartronique (tartronate en milieu alcalin), glycolique (glycolate), glyoxylique (glyoxylate), formique (formate) et le dioxyde de carbone (carbonate)58. Au contraire, sur la base de mesure par HPLC et nano balance électrochimique à crystal de quartz, Kwon et al. ont trouvé une dépendance du mécanisme avec le pH: du glycérate produit à partir de glycéraldéhyde adsorbé est le produit principal en milieu alcalin, tandis que lorsque le pH est diminué, le glycéraldéhyde devenait le produit principal de réaction59.
Enfin, l’effet de la structure cristalline des surfaces de platine sur l’électro
oxydation du glycérol a été étudié par Avramov-Ivic et al8. Ces auteurs n’ont pas observé de différences notables d’activité entre les monocristaux Pt(111), Pt(110) et Pt(100), bien que la surface Pt(111) semblait être la plus active. Ils ont en revanche montré que la cinétique de réaction était globalement plus élevée en milieu alcalin qu’en milieu acide et que l’adsorption et l’oxydation de glycérol avec rupture de la liaison C-C étaient limitées.
22
b. L’or
L'or est un matériau inactif en milieu acide pour l’électrooxydation des alcools56,57 mais il devient actif en milieu alcalin en raison de sa capacité d’adsorber à sa surface des espèces hydroxyle (OH) à relativement bas potentiels (environ 0,4 V vs. ERH)56. Il a été d’ailleurs récemment montré que l’or possédait une activité électrocatalytique élevée pour l’oxydation du glycérol en milieu alcalin59,60.
En 1984, Kahyaoglu et al. ont en effet observé que l’or était en effet actif pour la
réaction d’oxydation du glycérol seulement en milieu alcalin6
. Cette propriété a été récemment confirmée par Kwon et al.59. Pour de faibles concentrations en glycérol, le
mécanisme suivant a été proposé pour l’oxydation du glycérol en milieu alcalin:
M + Gly M-Glyads (17)
M + OH- M-OH + e- (18)
M-Glyads + M-OH produits (19)
M-Glyads + OH- produits + e- (20)
où M représenté un site métallique d’adsorption et Gly est une molécule de glycérol. Pour expliquer la différence de comportement catalytique entre le platine et l’or, les auteurs ont proposé que la réaction d’adsorption des ions hydroxyles fût l’étape limitante sur l’or, tandis que sur la platine l’étape limitante était la réaction d’adsorption du glycérol. Mais, quelques années plus tard, Adzic et Avramov-Ivic61 ont étudié
l’électrooxydation de l’éthylène glycol en milieu alcalin sur des monocristaux Au(111),
Au(110) et Au(100) et ont montré que l’adsorption des ions hydroxyles avec un
transfert partial d’électron pouvait être l’étape limitante pour l’adsorption d’alcool sur des surfaces d’or. La réaction suivante de transfert partiel d’électron a été proposée:
Au + OH-Auλ+- OHλ- + e- (21)
Cette réaction est sensible à la structure du catalyseur et l’adsorption d’espèces hydroxyles se produit à plus faibles potentiels sur une surface Au(110) que sur les
23
surfaces Au(100) et Au(111). Les auteurs ont vérifié que le déplacement du potentiel de début d’oxydation du glycérol suivait la même tendance que celui de l’adsorption des ions hydroxyles sur les surfaces respectives. Avramov-Ivic´ et al.7 ont plus tard confirmé l’adsorption d’ions hydroxyles avec un transfert partiel de charge comme étant
l’étape limitante sur une surface Au(100). De plus, les auteurs ont proposé que le
glycérol ne s’adsorbait pas sur une surface d’or avant la formation d’espèces Au-OHads
et que la première étape de la réaction d’oxydation du glycérol impliquait une
interaction entre l’atome d’hydrogène porté par le carbone secondaire de la molécule de
glycérol et une espèce Au-OHads.
Simoes et al. ont par ailleurs récemment montré, sur la base d’une étude par spectroscopie infrarouge in situ de l’oxydation du glycérol, la formation de
dihydroxyacétone et d’hydroxypyruvate sur des nanoparticules d’or qui implique l’oxydation de la fonction alcool secondaire en cétone50
. La formation de ces composés a été ensuite confirmée par analyse en chromatographie liquide après des expériences de chronoampérométrie à potentiels contrôlés.
Kwon et al. ont obtenu de l’acide glycérique comme produit primaire à bas potentiels; ce produit de réaction peut ensuite être oxydé à plus hauts potentiels (> 0,8 V) pour donner des acides glycolique et formique59. Zhang et al., quand à eux, ont analysé les produits de réaction à la sortie anodique d’une pile alcaline à membrane alimentée en glycérol et équipée d’une anode Au/C; ils ont trouvé que l’or favorisait la production de produits fortement oxydés, tels que les acides tartronique, mésoxalique et oxalique60. Dans leurs expériences, ils ont appliqué différentes tensions de cellule pendant 2 heures avec recirculation de la solution anodique, ce qui pouvait permettre la suroxydation d’espèces de type dihydroxyacétone et hydroxypyruvate en acide tartronique et mésoxalique.
c. Le palladium
Le palladium possède une activité catalytique très élevée pour plusieurs processus électrochimiques, tels que la réaction de dégagement d’hydrogène, la réaction
24
d’oxydation de l’hydrogène en milieu acide62
, la réduction de l’oxygène63 dans les milieux acides et alcalins, et l’oxydation de composés organiques simples5,19,63-73.
Les catalyseurs à base de palladium sont plus stables en milieu alcalin qu’en milieu acide. La réaction d’électrooxydation est dépendante de l’adsorption des groupements hydroxyle sur la surface. Ce fait est déterminant pour justifier l’écart
d’activité entre le palladium et le platine. La désorption de l’hydrogène de la surface du
palladium se produit à des potentiels plus élevés que sur le platine. A cause de cela, la surface métallique n’est pas accessible pour l’adsorption des ions hydroxyles. Ceci engendre un écart de potentiel entre la formation des espèces surfaciques PdOHads et
PtOHads ce qui conduit à une différence considérable pour le potentiel de début d’oxydation du glycérol entre le palladium et le platine.
Les avantages d’un catalyseur de palladium par rapport à celui de platine est son coût, deux à trois fois moins élevé (le coût de palladium est environ de 20 000 € / kg)13, ainsi que son abondance sur la terre (Pd est au moins 50 fois plus abondant que Pt)70.
Le comportement du palladium vis à vis de la réaction d’oxydation du glycérol a été étudié par Yildiz et Kadirgan1. Ils ont observés deux pics d’oxydation au cours de
la variation positive de potentiel. La première vague d’oxydation apparaissait juste après la désorption de l’hydrogène de la surface du palladium. A partir de résultats infrarouge
in situ, ils ont attribué une bande d’absorption à 1600 cm-1 à la formation de glycérate. Mais, dans le cas du glycérol, la symétrie de la molécule peut conduire à l’oxydation des deux groupements alcools primaires avec formation de glycérate et de tartronate;
leur distinction par infrarouge est loin d’être triviale. Plus récemment les performances
de catalyseurs Pd/MWCNT (Multi Walled Carbon Nanotubes) ont été évaluées au sein
d’une pile à combustion directe de glycérol9,19
. L’analyse par RMN du 13C des produits de réaction après 12 h d’opération à température ambiante à intensité contrôlée de 102 mA a conduit à la détection de glycérate, tartronate, glycolate, oxalate, formate et carbonate. La recirculation de la solution anodique à l’anode de la pile et le potentiel élevé de l’étude est certainement responsable de la large variété de produits formés et ne permet pas de proposer un mécanisme.
25
Cependant, il est apparu que le palladium pouvait casser la liaison C-C et que le carbone portant la fonction alcool secondaire ne s’était pas oxydé dans ces conditions. Simoes a observé par spectroscopie infrarouge in situ les mêmes bandes d’absorption
sur le palladium que sur le platine et a donc conclut que le même mécanisme était en jeu sur ces deux catalyseurs50. Dans les deux cas, une bande d’absorption à 1335 cm-1 attribuée à la formation de dihydroxyacétone (DHA) a été observée à bas potentiels. Ceci indiquait, donc, que le carbone portant la fonction alcool secondaire pouvait être oxydé. Pourtant, il n’observa pas de formation d’hydroxypyruvate, ni par infrarouge in situ, ni par analyse HPLC. Il a été proposé que le DHA produit à la surface des électrodes subissait une réaction d’isomérisation rapide vers le glycéraldéhyde qui pouvait être ensuite oxydé vers le glycérate et le tartronate.
2. Electrooxydation du glycérol sur les catalyseurs bimétalliques
Les catalyseurs bimétalliques à base de métaux nobles ont été extensivement étudiés au cours de ces dernières années74-79. Il a été montré que des alliages du platine avec des atomes de métaux moins nobles permettaient d’augmenter sensiblement
l’activité et la sélectivité du catalyseur vis-à-vis des réactions d’électrooxydation des
alcools51,80. Le comportement électrocatalytique d’un alliage Pd0,5Pt0,5/C a été évalué et
comparé à ceux de catalyseurs monométaliques Pt/C et Pd/C. Les caractérisations par méthodes électrochimiques pour la surface et de diffraction de rayon X ont indiqué que la structure cristalline des nanoparticules Pd0,5Pt0,5 correspondait à celle des
nanoparticules de Pt et que cet alliage a été formé par substitution des atomes de platine par des atomes de palladium. Le catalyseur bimétallique a affiché une activité plus élevée que les catalyseurs monométalliques, pour l’oxydation du glycérol5. Un tel effet synergique du palladium allié au platine a déjà été observé pour l’électrooxydation de
l’éthylène glycol en milieu alcalin en cellule électrochimique classique à trois
électrodes, ainsi que dans des piles à combustible53,81.
L’électrooxydation du glycérol a aussi été étudiée sur des alliages PdxAu1-x de
compositions atomiques différentes50. Le mécanisme de la réaction, ainsi que la sélectivité du matériau ont été comparés à ceux obtenus sur l’or et le palladium purs. Le
26
potentiel de début d’oxydation du glycérol sur PdxAu1- x /C est d’environ 0,5 V pour x >
0,5, le même que pour Au/C et Pd/C et environ 0,45 V pour x ≤ 0,5. L’activité des alliages PdxAu1-x est plus élevée et plus proche de celle du platine pur. Les activités les
plus élevée ont été obtenues pour des rapports atomiques Pd /Au 1:1 et 3:7; Toutefois, Simoes et al. ont montré que les surfaces de ces catalyseurs étaient riches en palladium, correspondant à 76 et 61 at% de palladium à la surface, respectivement82, au lieu des 50 % et 30 % donnés par analyse ICP-OES. L’amélioration de l’activité s’explique par le mécanisme bifonctionnel83, ainsi que par l’effet de ligand84. Les spectres infrarouge des intermédiaires de réaction sur les catalyseurs PdxAu1- x /C ont fait apparaître la même
bande d’absorption, à 1335 cm-1, que sur le catalyseur Pd/C, attribuée à la formation du dihydroxyacétone aux bas potentiels et la formation d’espèces issues de l’oxydation des groupes alcool primaire du glycérol à des potentiels plus élevés. L’apparition d’une bande d’absorption infrarouge à 1350 cm-1 attribuée à l’hydroxypyruvate n’avait quant à elle pas été détectée. En outre, une bande d’absorption à 1900 cm-1, attribuée à des espèces de CO adsorbé sur le palladium85 (qui est une preuve de la capacité du catalyseur de casser la liaison C-C ), n’était présente que pour des rapports atomiques de palladium: or supérieurs à 3:7. La présence de l’or sur la surface de catalyseur permettait la diminution de l’empoisonnement par le monoxyde de carbone adsorbé et
l’amélioration de l’activité du catalyseur.
Récemment, Simoes a montré que la modification du palladium par le nickel conduisait aussi à une augmentation de l’activité pour l’électrooxydation du glycérol,
laquelle s’approchait de celle du platine50
. Les mesures par spectroscopie infrarouge in situ ont démontré des changements importants du comportement de Pd/C après
l’addition des atomes de nickel. Il a ainsi été montré que le palladium favorisait l’oxydation du groupement alcool primaire (ce qui conduisait à des composés tels que
carboxylates et tartronates)50.
Simoes a obtenu des courbes de polarisation en milieu 0,1 M glycérol + 1 M NaOH sur des catalyseurs PdxBi1-x/C montrant une activité électrocatalytique pour l’oxydation du glycérol beaucoup plus élevée que celle du palladium seul et équivalente
27
à celle d’un catalyseur Pt/C, avec un déplacement du début de la vague d’oxydation de 0,6 V vs. RHE à 0,4 V vs. RHE. En revanche, la modification du platine par Bi
déplaçait le début d’oxydation de 0,2 V vers les bas potentiels (de 0,4 V vs ERH à 0,2 V
vs. ERH). Ces résultats remarquables d’augmentation de l’activité catalytique du platine et du palladium vis-à-vis de l’oxydation de petites molécules organiques induite par leur modification par des atomes des éléments du groupe p71,86-89, notamment, du bismuth53,90-92 a fait l’objet d’un intérêt croissant au cours des dernières décennies. L’étude du comportement électrochimique de surfaces du platine et du palladium modifiées par la présence d’atomes de bismuth a permis d’accroitre la compréhension de la nature de ces modifications et de la structure des matériaux93,94. Un métal étranger non noble permet aussi de limiter l’adsorption du CO sur la surface d’un métal noble, c'est-à-dire l’empoisonnement du catalyseur83,95.
Il a été observé que la présence de bismuth a une influence sur le mode
d’adsorption du glycérol (le début d’oxydation est décalé vers les bas potentiels) et que pour les potentiels plus élevés, l’oxydation du bismuth peut apporter des espèces hydroxyles pour compléter la réaction d’oxydation, assurant un pH élevé à la surface86
.
III.
Conclusion et objectifs
En milieu alcalin un catalyseur Pt/C est le plus actif vis-à-vis de l’oxydation du glycérol, présentant une surtension d’oxydation inférieure d’environ 0,2 V à celle obtenue avec les catalyseurs Pd/C et Au/C. Les inconvénients principaux de l’utilisation des catalyseurs à base de platine sont le coût de ce métal noble (actuellement plus de 40
000 €/kg) et les ressources mondiales limitées qui représente un frein pour le
développement durable. En raison du fait que le platine est un métal couteux et rare, le
palladium a été considéré comme l’élément de base des catalyseurs développés et
étudiés au cours de cette thèse de doctorat.
L’étude bibliographique a montré qu’il y avait des désaccords concernant les mécanismes d’oxydation du glycérol sur le palladium: certains auteurs ont montré que
28
seules les fonctions alcool primaire étaient oxydées sur le palladium tandis que d’autres ont montré la formation de dihydroxyacétone. Les réactions d’électrooxydation
d’alcools ont lieu à la surface des électrodes, et ces réactions d’oxydation d’alcools en
général, et du glycérol en particulier, sont sensibles à la structure des catalyseurs. Il
apparaissait donc important de vérifier dans un premier temps l’activité et la sélectivité
de nanoparticules de palladium présentant des structures de surfaces différentes
vis-à-vis de la réaction d’oxydation du palladium afin de tenter d’établir une corrélation
structure/comportement électrocatalytique.
Toujours en partant de l’étude bibliographique, il est apparu que la modification
des surfaces de palladium par le bismuth induisait de forte variation de l’activité et de la sélectivité du catalyseur vis-à-vis de la réaction d’électrooxydation du glycérol. La modification de la surface des nanoparticules de palladium à distributions de taille et de forme contrôlées par dépôt spontané et contrôlé de bismuth a été réalisée dans un second temps et les effets sur l’activité et la sélectivité ont été évalués.
Enfin, des matériaux catalytiques réels, c’est-à-dire dont la production peut aisément être industrialisée, à base de palladium modifié par des éléments du groupe p (bismuth et étain) ont aussi été étudiés.
Une attention particulière a été donnée aux caractérisations physicochimiques de tous les matériaux synthétisés. Cela a permis d’atteindre une bonne compréhension des
structures qui composent les surfaces catalytiques et de leur influence sur l’activité et la
29
B. Partie expérimentale
I.
Nettoyage de la verrerie
Pour réaliser une expérience électrochimique, il est d’une extrême importance
que tout le matériel en contact avec les électrodes et l’électrolyte soit très propre. La
présence de molécules organiques adsorbées sur la verrerie est indésirable: ces
molécules peuvent se solubiliser dans l’électrolyte et réagir avec le catalyseur au cours d’une expérience. Dans ce cas, soit la molécule reste irréversiblement adsorbée sur la
surface catalytique dans la zone de potentiel considérée, bloquant des sites actifs, soit
elle va réagir avec le catalyseur. S’il y a un transfert de charge, des pics de courant apparaîtront lors de l’enregistrement des courbes de polarisation. Le nettoyage du matériel de laboratoire est donc d’une importance extrême et ne doit pas être négligé
avant toute expérience d’électrochimie.
Généralement la verrerie est nettoyée à l’aide de solutions fortement oxydantes.
La procédure consiste à immerger la verrerie dans une solution acidifiée de permanganate de potassium (Sigma-Aldrich) pendant 24 h. Après avoir sorti la verrerie de la solution de permanganate, celle-ci est rincée avec une solution composée en
volume d’un quart de peroxyde d’hydrogène à 33% vol. (VWR), d’un quart d’acide sulfurique à 95% vol. (VWR) et d’un demi d’eau ultra pure. L’acide persulfurique
formé ainsi est un composé très dangereux, toutes les manipulations doivent s’effectuer avec les précautions spéciales. Finalement, le matériel est abondamment rincé à l’eau ultra pure.
Toute la verrerie utilisée lors de la synthèse des catalyseurs est nettoyée
préalablement à l’acétone, à l’éthanol et à l’eau ultra pure pour éliminer les traces de
tensioactif. Ensuite, cette verrerie est immergée dans une solution d’eau régale,
composée de deux volumes d’acide chlorhydrique 37% vol. (VWR) et d’un volume d’acide nitrique 68% vol. (VWR). Cette solution permet de solubiliser tous les résidus